KOMPLEXE BIOLOGIKA/BIOSIMILARS: KEIN AUSTAUSCH OHNE MEDIZINISCHEN GRUND
|
|
|
- Inken Michel
- vor 6 Jahren
- Abrufe
Transkript
1 PRESSEMITTEILUNG KOMPLEXE BIOLOGIKA/BIOSIMILARS: KEIN AUSTAUSCH OHNE MEDIZINISCHEN GRUND Ludwigshafen, 20. April 2016 Bei Patienten, die mit einem Biologikum behandelt werden, sollte kein Therapiewechsel aus nicht medizinischen Gründen erfolgen. Dies forderten AbbVie Experten in Anlehnung an die Positionen von Fachgesellschaften und Patientenorganisationen 1,2 im Rahmen des Pressetermins Fascination Biologics Qualitätsgesicherter Einsatz von Biologika. Heute und in Zukunft *. Nachahmerprodukte von Biologika, sogenannte Biosimilars, sind nie identisch mit dem Referenzprodukt, da sie auf Basis einer anderen Zelllinie und anderer Herstellungsprozesse produziert werden. 3 Unter dem Aspekt der Unterscheidbarkeit und Transparenz beleuchteten die Referenten die Implikationen der Unterschiede zwischen Original Biologika und Biosimilars für die Austauschbarkeit und Nachverfolgbarkeit bei unerwünschten Ereignissen. 4,5,6 Ein weiterer Schwerpunkt des Pressetermins behandelte das Thema Innovation: Trotz moderner Therapien gibt es Patienten, die nicht ausreichend auf die zur Verfügung stehenden Behandlungen ansprechen. 7 Damit die Versorgungssituation dieser Patienten auch in Zukunft verbessert werden kann, forscht AbbVie konsequent weiter an der Entwicklung innovativer Therapien. Biosimilars sind keine Generika. Biosimilars sind im Gegensatz zu Generika mit dem Originalprodukt niemals identisch. Dies liegt am grundsätzlich verschiedenen Herstellungsprozess von Biologika im Vergleich zu chemisch synthetisierten Wirkstoffen. 8 Medikamente mit kleinem Molekülgewicht können chemisch hergestellt werden und daher von Nachahmern exakt reproduziert werden. Anders ist das bei den zum Teil aus mehr als Atomen bestehenden komplexen Biologika, wie den monoklonalen Antikörpern und ihren Nachahmerprodukten, den Biosimilars: Für die Herstellung von Biologika benötigt man biologische Systeme, d.h. spezielle Zellen. Dadurch ist das Herstellungsverfahren und die Qualitätskontrolle produktbestimmend und wesentlich aufwendiger als bei chemisch synthetisierten Wirkstoffen, erklärte Dr. Björn Wolff, Head of Medical Immunology bei AbbVie Deutschland, im Rahmen des Fachpressetermins. Biosimilars sind ähnlich, aber nicht gleich Die verwendeten Zellen bzw. Zelllinien und das Wissen über den Herstellungsprozess sind proprietär und liegen dem Biosimilar Hersteller nicht vor. 9 Da diese jedoch maßgeblich für das Endprodukt sind, ist ein Biosimilar im Gegensatz zu einem Generikum per Definition nie identisch mit dem Original Biologikum. 3,4 Die Zulassung eines Biosimilars bedeutet demnach nicht, dass es ohne weiteres mit dem Referenzprodukt austauschbar ist. 4 Der Fragestellung, ob auch Original Biologika Biosimilars ihrer selbst sind, begegnete Dr. Stefanie Hauck, Leiterin New Biological Entities Process Development & Formulation Sciences: Bei unserem biologischen Originalprodukt ist die Zelllinie über den Herstellungszeitraum von 15 Jahren unverändert geblieben. Änderungen im Herstellungsprozess wurden lediglich bei der Anpassung des Produktionsmaßstabs aufgrund der Erweiterung der Indikationen vorgenommen. Es wurden neue Herstellungsstandorte etabliert und die Spezifikationsgrenzen für die analytische Untersuchung unseres Produktes enger gesetzt. Dies alles erfolgte gemäß den Vorgaben der European Medicines Agency. Auch der Verband der European Biopharmaceutical Enterprises betont in seinem Positionspapier: Ein Biologikum als ein Biosimilar seiner
2 selbst zu bezeichnen, wird den Unterschieden zwischen einer Änderung im Herstellungsprozess des Originalprodukts einerseits und der Biosimilarität andererseits nicht gerecht und birgt das Risiko, das Vertrauen in Biologika zu schwächen. 9 Extrapolation der Indikationen in der Diskussion Für die Zulassung von Biosimilars durch die europäische Zulassungsbehörde EMA müssen die Hersteller eine ausreichende Ähnlichkeit des Biosimilars mit dem Original Biologikum im Hinblick auf Qualität, biologische Aktivität, Sicherheit und Wirksamkeit nachweisen. 10 Im Vergleich zum Referenzprodukt durchläuft das Biosimilar dabei ein reduziertes Studienprogramm. 10 Die Ergebnisse in einer Indikation können dann unter bestimmten Voraussetzungen auf andere Indikationen, in denen das Referenzprodukt zugelassen ist, übertragen bzw. extrapoliert werden, ohne dass hierfür Studien durchgeführt werden müssen. 11 Allerdings ist bei erfolgter Extrapolation für den behandelnden Arzt in der Fachinformation nicht ersichtlich, bei welchen Indikationen die Zulassung auf Basis einer Extrapolation erfolgte und welche Studien mit den Biosimilars vorliegen. Denn derzeit beinhaltet die Fachinformation eines Nachahmerproduktes in diesen Fällen nur die zulassungsrelevanten Daten des Referenzproduktes. Doch insbesondere wenn die Indikationen unterschiedliche Dosierungen und Zielpopulationen beinhalten, können die Aussagen zu Sicherheit und Immunogenität nicht automatisch als ausreichend angesehen werden. 12 So fordert zum Beispiel der Verband Forschender Arzneimittelhersteller e.v. (vfa) die Ergänzung der Fachinformation von Biosimilars um eine Übersicht, die angibt, welche Anwendungsgebiete durch klinische Vergleichsstudien belegt sind und welche durch Extrapolation abgeleitet wurden. 13 Eindeutige Unterscheidbarkeit zur Erfassung von Sicherheit und Wirksamkeit Die zurzeit zugelassenen Biosimilars werden mit demselben Freinamen (International Nonproprietary Name/INN) bezeichnet wie das Referenzprodukt. Dadurch können sie nicht klar voneinander unterschieden werden, was aber essentiell ist, um mögliche Nebenwirkungen früh erfassen und klar zuordnen zu können. Deshalb fordern deutsche Fachgesellschaften und Patientenorganisationen eine eindeutig vom Referenzprodukt unterscheidbare Wirkstoffbezeichnung sowie ein engmaschiges Monitoring des Wirksamkeits und Sicherheitsprofils von Biosimilars auch nach Marktzulassung, teilte Stefanie Zervos, Head of Biotherapeutics Value bei AbbVie Deutschland, mit. Zudem sollte die Verschreibung von Biologika unter Verwendung des Produktnamens und der Chargennummer erfolgen. Für die genaue Bezeichnung der unterschiedlichen Biologika, einschließlich Biosimilars, schlug die Weltgesundheitsorganisation einen so genannten Biological Qualifier (BQ) vor. 14 Er besteht aus einem zufälligen, vierstelligen Code, der zusätzlich in Verbindung mit dem INN aufgeführt werden soll. 14 Die US amerikanische Zulassungsbehörde FDA hat diesen Vorschlag aufgegriffen und nun das erste Biosimilar eines monoklonalen Antikörpers mit einem unterscheidbaren Freinamen zugelassen. 15 Um die Sicherheit und Wirksamkeit von Biosimilars, genau wie bei Originalpräparaten, nach Marktzulassung zu untersuchen, ist deren Aufnahme in Register wichtig. Momentan sind noch zu wenige Patienten, die mit Biosimilars behandelt werden, in die bestehenden Biologika Register eingeschlossen. 16 Im Sinne der Transparenz und Patientensicherheit befürworten wir die Aufnahme in nationale Register gleichermaßen für alle Hersteller. Denn nur so kann die Evidenz zum Wirksamkeits und Sicherheitsprofil erweitert und Ärzten zur Verfügung gestellt werden, sagte Stefanie Zervos.
3 Kein Therapiewechsel aus nicht medizinischen Gründen Erkrankungen, die mit Biologika und insbesondere mit monoklonalen Antikörpern behandelt werden, sind oft chronisch, schwerwiegend und komplex. Der Verlauf der Krankheitsaktivität ist häufig nur schwer vorhersehbar. Für die Behandlung liegt die Entscheidung über die entsprechende Biologika Therapie beim Arzt, in Abstimmung mit dem Patienten unter Berücksichtigung seiner individuellen Situation. 17 In Bezug auf die Wahl des Präparates plädiert der vfa für die Wahrung der Therapiehoheit des Arztes und spricht sich gegen einen unkontrollierten Wechsel aus. 13 Ein Wechsel der Therapie aus nicht medizinischen Gründen, ob Original Biologika oder Biosimilar, sollte grundsätzlich vermieden werden, da dieser mit einer schlechteren Kontrolle der Krankheitsaktivität assoziiert sein kann. 18 Diese Ansicht teilen verschiedene Fachgesellschaften und Patientenorganisationen: So fordert die Deutsche Rheuma Liga in ihrer Stellungnahme zur Einführung von Biosimilars, dass Patienten nicht gezwungen werden sollten, aus Kostengründen ihre Medikation zu wechseln. 1 Und auch die Deutsche Gesellschaft für Rheumatologie (DGRh) lehnt einen unkontrollierten Wechsel zwischen Biologika aus Kostengründen ab. 2 Mehrfache Therapiewechsel zwischen Original Biologika und/oder Biosimilars könnten zudem das immunogene Potential steigern und Auswirkungen auf Wirksamkeit und Sicherheit haben. 19 Bislang mangelt es an umfangreichen klinischen Daten zu den Konsequenzen, die ein Switch aus nicht medizinischen Gründen nach sich ziehen könnte. Bisherige Studien berücksichtigen nur einen einmaligen Wechsel zwischen Original und Biosimilar, sagte Björn Wolff. Aussagekräftige Studien zur Austauschbarkeit fehlen und sollten mehrfache Wechsel zwischen Original Biologikum und Biosimilar beinhalten. 12,20 Weiterer Bedarf an medizinischer Forschung Trotz moderner Ansätze und wegweisender Erfolge in der Behandlung von chronischen Erkrankungen sind viele Patienten nicht ausreichend therapiert und benötigen neue Behandlungsmöglichkeiten. So zeigten beispielsweise 30 % der Patienten, die aufgrund einer rheumatoiden Arthritis mit einer Anti TNF α Therapie behandelt wurden, ein unzureichendes Ansprechen auf die Therapie. 7 Aus diesem Grund entwickelt AbbVie weiterhin innovative und zielgerichtete Therapien mit Biologika. Auch in anderen Bereichen und bei seltenen Erkrankungen gibt es Bedarf für neue Behandlungsmöglichkeiten. Um auch in Zukunft die Versorgungssituation dieser Patienten zu verbessern, investiert AbbVie etwa 80 % seiner Bruttowertschöpfung in Forschung und Entwicklung. 21 Allein im Jahr 2015 wurden 4,3 Milliarden US Dollar dafür eingesetzt. 22 In unserer Pipeline befinden sich derzeit die Biologika der nächsten Generation für die Bereiche Immunologie, Onkologie und Neurodegeneration mit innovativen Behandlungsansätzen, teilte Dr. Corinna Klein, Laborleiterin Neuroanatomie bei AbbVie Deutschland, mit. Bis 2020 werden etwa 20 neue Zulassungen erwartet, unter denen sich ca. 30 % Biologika befinden. 22 *Veranstaltung: Fachpressetermin Fascination Biologics Qualitätsgesicherter Einsatz von Biologika. Heute und in Zukunft. Am 20. April am Forschungsstandort von AbbVie Deutschland in Ludwigshafen
4 Über AbbVie AbbVie (NYSE:ABBV) ist ein globales, forschendes BioPharma Unternehmen. Mission von AbbVie ist es, mit seiner Expertise, seinem einzigartigen Innovationsansatz und seinen engagierten Mitarbeitern neuartige Therapien für einige der komplexesten und schwerwiegendsten Krankheiten der Welt zu entwickeln und bereitzustellen. Zusammen mit seiner hundertprozentigen Tochtergesellschaft Pharmacyclics beschäftigt AbbVie weltweit mehr als Mitarbeiter und vertreibt Medikamente in mehr als 170 Ländern. In Deutschland ist AbbVie an seinem Hauptsitz in Wiesbaden und seinem Forschungs und Produktionsstandort in Ludwigshafen vertreten. Insgesamt beschäftigt AbbVie Deutschland rund Mitarbeiter. Weitere Informationen zum Unternehmen finden Sie unter und Folgen auf Twitter oder besuchen Sie unsere Karriereseite auf Facebook. info.de umdenken.de mit ced.de care.de Kontakt AbbVie Deutschland GmbH & Co. KG Christine Blindzellner Communication Manager Immunology Wiesbaden T: E Mail: christine.blindzellner@abbvie.com Literatur 1 Positionierung der Deutschen Rheuma Liga Bundesverband e.v. zur Einführung von Biosimilars in Deutschland: liga.de/biosimilars/ 2 Lorenz HM et al. Einführung und Gebrauch von biosimilars in der Therapie entzündlich rheumatischer Erkrankungen. Stellungnahme der Deutschen Gesellschaft für Rheumatologie Z Rheumatol 2014, 73: vfa Broschüre Biopharmazeutika. Hightech im Dienst der Patienten. Stand Dezember Ventola CL et al. Biosimilars: part 2: potential concerns and challenges for p&t committees. P T Jun;38(6): Radtke MA et al. Biosimilars bei Psoriasis. Was können wir erwarten? J Dtsch Dermatol Ges Apr;12(4): Biosimilars Positionspapier der DCCV e.v., Februar Rubbert Roth and Finckh A. Treatment options in patients with rheumatoid arthritis failing initial TNF inhibitor therapy: a critical review. Arthritis Research & Therapy 2009, 11(Suppl 1):S1 8 Schiestl M et al, Acceptable changes in quality attributes of glycosylated biopharmaceuticals, Nature Biotechnology 29, Pages: Im Internet verfügbar unter: am 19. Mai 2014, zuletzt abgerufen am European Biopharmaceutical Enterprises (EBE): Biosimilarity and Comparability after Manufacturing changes: Can a biologic become a biosimilar of itself? European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP). Guideline on Similar Biological Medicinal Products Containing Biotechnology Derived Proteins as Active Substance: Non Clinical and Clinical Issues. EMEA/CHMP/BMWP/42832/2005.
5 11 EuropaBio. Guide to Biologic Medicines: A Focus on Biosimilar Medicines. 12 Declerck P, Mellstedt H, Danese S. Biosimilars terms of use. Current Medical Research and Opinion. Vol. 31, No. 12, 2015, vfa/vfa bio Positionspapier Biosimilars. Stand: World Health Organization: Biological Qualifier An INN Proposal (Juni 2015) 15 FDA approves Inflectra, a biosimilar to Remicade, Im Internet verfügbar unter: zuletzt abgerufen am Dr. Anja Strangfeld, Studienleiterin des RABBIT Registers am Deutschen Rheuma Forschungszentrum (DRFZ) Berlin im Rahmen der Veranstaltung EUROFORUM Jahrestagung: Biosimilare Antikörper in der Rheumatologie Chancen und Herausforderungen für das Gesundheitssystem, 24. November 2015, Berlin. 17 Smolen JS et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis Jan;75(1): Wolf D. et al., ECCO 2015, Abstract P Scott, BJ et al., Biosimilar Monoclonal Antibodies: A Canadian Regulatory Perspective on the Assessment of Clinically Relevant Differences and Indication Extrapolation. J Clin Pharmacol Mar;55 Suppl 3:S Dörner, T. & Kay, J. Nat. Rev. Rheumatol. 11, (2015); published online 18 August 2015; corrected online 25 August 2015; 21 AbbVie Unternehmensbroschüre, Im Internet verfügbar unter: zuletzt abgerufen am AbbVie Daten und Fakten zur Pipeline, Stand: Februar 2016, Im Internet verfügbar unter: zuletzt abgerufen am
Biosimilars ähnlich, aber nicht identisch!
 Biosimilars ähnlich, aber nicht identisch! München, 23. April 2007 Dr. Frank Mathias Geschäftsführer, AMGEN GmbH Deutschland Die Frage...... identisch - oder nur ähnlich? 2 Biotechnologisch hergestellte
Biosimilars ähnlich, aber nicht identisch! München, 23. April 2007 Dr. Frank Mathias Geschäftsführer, AMGEN GmbH Deutschland Die Frage...... identisch - oder nur ähnlich? 2 Biotechnologisch hergestellte
AbbVie Healthcare Monitor erhebt ab sofort öffentliche Meinung zu Gesundheitsund Versorgungsthemen
 PRESSEMITTEILUNG AbbVie Healthcare Monitor erhebt ab sofort öffentliche Meinung zu Gesundheitsund Versorgungsthemen 74 Prozent der Deutschen fühlen sich gut versorgt, 85 Prozent wünschen sich schnellere
PRESSEMITTEILUNG AbbVie Healthcare Monitor erhebt ab sofort öffentliche Meinung zu Gesundheitsund Versorgungsthemen 74 Prozent der Deutschen fühlen sich gut versorgt, 85 Prozent wünschen sich schnellere
Positionierung der Deutschen Rheuma-Liga Bundesverband e.v. zur Einführung von Biosimilars in Deutschland
 Positionierung der Deutschen Rheuma-Liga Bundesverband e.v. zur Einführung von Biosimilars in Deutschland Die Deutsche Rheuma-Liga sieht es als erstrebenswert an, dass sichere und effektive Therapien möglichst
Positionierung der Deutschen Rheuma-Liga Bundesverband e.v. zur Einführung von Biosimilars in Deutschland Die Deutsche Rheuma-Liga sieht es als erstrebenswert an, dass sichere und effektive Therapien möglichst
Apotheke vor Ort oder Versandhandel? AbbVie Healthcare Monitor erhebt Meinung der Bevölkerung
 PRESSEMITTEILUNG Apotheke vor Ort oder Versandhandel? AbbVie Healthcare Monitor erhebt Meinung der Bevölkerung 78 Prozent der Befragten kaufen Medikamente ausschließlich in der Apotheke vor Ort. Wohnortnähe
PRESSEMITTEILUNG Apotheke vor Ort oder Versandhandel? AbbVie Healthcare Monitor erhebt Meinung der Bevölkerung 78 Prozent der Befragten kaufen Medikamente ausschließlich in der Apotheke vor Ort. Wohnortnähe
Medikamentöse Therapie rheumatischer Erkrankungen
 Medikamentöse Therapie rheumatischer Erkrankungen Nichtsteroidale Antirheumatika/ Cox 2-Hemmer u. a. Diclofenac, Ibuprofen Celecoxib, Etoricoxib DMARDs/Basistherapeutika u. a. Hydroxychloroquin, Sulfasalazin,
Medikamentöse Therapie rheumatischer Erkrankungen Nichtsteroidale Antirheumatika/ Cox 2-Hemmer u. a. Diclofenac, Ibuprofen Celecoxib, Etoricoxib DMARDs/Basistherapeutika u. a. Hydroxychloroquin, Sulfasalazin,
Aktuelle Einblicke in die Kombinationstherapie von TNF-alpha-Blockern plus MTX
 Rheumatoide Arthritis Aktuelle Einblicke in die Kombinationstherapie von TNF-alpha-Blockern plus MTX Düsseldorf (19. September 2014) - Bei der Behandlung der rheumatoiden Arthritis ist Methotrexat (MTX)
Rheumatoide Arthritis Aktuelle Einblicke in die Kombinationstherapie von TNF-alpha-Blockern plus MTX Düsseldorf (19. September 2014) - Bei der Behandlung der rheumatoiden Arthritis ist Methotrexat (MTX)
Viele Medikamente nicht bei pädiatrischen Patienten zugelassen: Versorgungsdefizite bei Kindern und Ju
 Viele Medikamente nicht bei pädiatrischen Patienten zugelassen: Versorgungsdefizite bei Kindern und Ju Viele Medikamente nicht bei pädiatrischen Patienten zugelassen Versorgungsdefizite bei Kindern und
Viele Medikamente nicht bei pädiatrischen Patienten zugelassen: Versorgungsdefizite bei Kindern und Ju Viele Medikamente nicht bei pädiatrischen Patienten zugelassen Versorgungsdefizite bei Kindern und
ÖGHO Positionspapier zu BIOSIMILARS
 ÖGHO Positionspapier zu BIOSIMILARS Dieses Positionspapier stellt den Konsens einer Expertengruppe dar, die am 19. Juni 2009 in Wien auf Initiative der ÖGHO tagte. Die Expertengruppe umfasste folgende
ÖGHO Positionspapier zu BIOSIMILARS Dieses Positionspapier stellt den Konsens einer Expertengruppe dar, die am 19. Juni 2009 in Wien auf Initiative der ÖGHO tagte. Die Expertengruppe umfasste folgende
27. November 2012: Biosimilars: Ähnlich, aber eben doch nicht gleich
 Gladkova Svetlana Sarah Borowski / PIXELIO www.pixelio.de 27. November 2012: Biosimilars: Ähnlich, aber eben doch nicht gleich Dr. Sabine Sydow, Leiterin vfa bio Biotechnologie und Gentechnik eine Einführung
Gladkova Svetlana Sarah Borowski / PIXELIO www.pixelio.de 27. November 2012: Biosimilars: Ähnlich, aber eben doch nicht gleich Dr. Sabine Sydow, Leiterin vfa bio Biotechnologie und Gentechnik eine Einführung
Positionspapier Biosimilars von monoklonalen Antikörpern in der Medizinischen Onkologie
 Positionspapier Biosimilars von monoklonalen Antikörpern in der Medizinischen Onkologie 3. Mai 2017 Zusammenfassung Nach Patentablauf der ersten therapeutisch eingesetzten, monoklonalen Antikörper in der
Positionspapier Biosimilars von monoklonalen Antikörpern in der Medizinischen Onkologie 3. Mai 2017 Zusammenfassung Nach Patentablauf der ersten therapeutisch eingesetzten, monoklonalen Antikörper in der
Biologika trotz Nebenwirkungen sicher anwendbar
 Zielgenaue Medikamente gegen Rheuma Biologika trotz Nebenwirkungen sicher anwendbar Köln (23. September 2009) Biotechnologische Medikamente gegen Rheuma sogenannte Biologika lindern nicht nur die Krankheit
Zielgenaue Medikamente gegen Rheuma Biologika trotz Nebenwirkungen sicher anwendbar Köln (23. September 2009) Biotechnologische Medikamente gegen Rheuma sogenannte Biologika lindern nicht nur die Krankheit
Positionspapier zu Biosimilars. Zusammenfassung
 Positionspapier zu Biosimilars Zusammenfassung Biotechnologisch hergestellte Medikamente, auch Biologika genannt, nehmen einen wichtigen Platz in der Behandlung von Krankheiten wie Krebs, rheumatoider
Positionspapier zu Biosimilars Zusammenfassung Biotechnologisch hergestellte Medikamente, auch Biologika genannt, nehmen einen wichtigen Platz in der Behandlung von Krankheiten wie Krebs, rheumatoider
Novartis setzt bei Biopharmazeutika weiter auf Österreich
 Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Novartis setzt bei Biopharmazeutika weiter auf Österreich Novartis setzt bei Biopharmazeutika weiter auf Österreich
Published on Novartis Austria (https://www.novartis.at) Home > Printer-friendly PDF > Novartis setzt bei Biopharmazeutika weiter auf Österreich Novartis setzt bei Biopharmazeutika weiter auf Österreich
TVT-Therapie. Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio
 Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Präventio Bayer HealthCare Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Biosimilars - Die Sicht der Patienten Ulla Ohlms, Vorsitzende der Stiftung PATH Patients Tumorbank of Hope
 Biosimilars - Die Sicht der Patienten Ulla Ohlms, Vorsitzende der Stiftung PATH Patients Tumorbank of Hope Vfa-Tagung Ähnlich, aber eben doch nicht gleich Penzberg, 6. November 2013 März 2000, damals,
Biosimilars - Die Sicht der Patienten Ulla Ohlms, Vorsitzende der Stiftung PATH Patients Tumorbank of Hope Vfa-Tagung Ähnlich, aber eben doch nicht gleich Penzberg, 6. November 2013 März 2000, damals,
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose
 Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Merck beantragt Zulassung in den USA für Cladribin-Tabletten als mögliche orale Kurzzeitbehandlung der Multiplen Sklerose Darmstadt (30. September 2009) - Die Merck KGaA hat heute bekannt gegeben, dass
Biosimilars : Wachstumsfaktoren und Antikörper in der Onkologie
 Biosimilars : Wachstumsfaktoren und Antikörper in der Onkologie Dr. med. Ursula Kronawitter www.onkologie - traunstein.de onkologie traunstein @ t-online.de Anforderungen des Arztes an ein Biosimilar Im
Biosimilars : Wachstumsfaktoren und Antikörper in der Onkologie Dr. med. Ursula Kronawitter www.onkologie - traunstein.de onkologie traunstein @ t-online.de Anforderungen des Arztes an ein Biosimilar Im
Von Originalen, Generika und Biosimilars. Marion Matousek-Wild Co-Leiterin Spitalapotheke 25. Juni 2015
 Von Originalen, Generika und Biosimilars Marion Matousek-Wild Co-Leiterin Spitalapotheke 25. Juni 2015 Generikum vs. Biosimilar Chemisches Produkt Chemische Synthese Biologisches Produkt Komplexer, mehrstufiger
Von Originalen, Generika und Biosimilars Marion Matousek-Wild Co-Leiterin Spitalapotheke 25. Juni 2015 Generikum vs. Biosimilar Chemisches Produkt Chemische Synthese Biologisches Produkt Komplexer, mehrstufiger
Similar Biological Medicinal Products
 Similar Biological Medicinal Products Rechtliche Rahmenbedingungen in Europa 06.10.2004, Regensburg Biogenerika - Biosimilars 25.9.2002 Arzneimittel-Kopierer stürzen sich auf Gentechnik Die Biotech Industrie
Similar Biological Medicinal Products Rechtliche Rahmenbedingungen in Europa 06.10.2004, Regensburg Biogenerika - Biosimilars 25.9.2002 Arzneimittel-Kopierer stürzen sich auf Gentechnik Die Biotech Industrie
Begleiterkrankungen. erkennen vorbeugen behandeln. Chronisch-entzündliche Erkrankungen: Was Sie wissen sollten.
 Begleiterkrankungen erkennen vorbeugen behandeln Chronisch-entzündliche Erkrankungen: Was Sie wissen sollten www.abbvie-care.de Was sind Begleiterkrankungen? Es gibt eine Reihe von chronisch-entzündlichen
Begleiterkrankungen erkennen vorbeugen behandeln Chronisch-entzündliche Erkrankungen: Was Sie wissen sollten www.abbvie-care.de Was sind Begleiterkrankungen? Es gibt eine Reihe von chronisch-entzündlichen
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben?
 Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Haben Sie externe Hilfestellungen in Anspruch genommen? Wenn ja, bitte geben Sie an, welche Hilfestellung Sie in Anspruch genommen haben? 1.1 Angefragte Untersuchungs- und Behandlungsmethode (Kurzbezeichnung
Begleiterkrankungen. erkennen, vorbeugen und behandeln. Was Sie über chronisch-entzündliche Erkrankungen wissen sollten
 Begleiterkrankungen erkennen, vorbeugen und behandeln Was Sie über chronisch-entzündliche Erkrankungen wissen sollten Was sind Begleiterkrankungen? Es gibt eine Reihe von chronisch-entzündlichen Erkrankungen,
Begleiterkrankungen erkennen, vorbeugen und behandeln Was Sie über chronisch-entzündliche Erkrankungen wissen sollten Was sind Begleiterkrankungen? Es gibt eine Reihe von chronisch-entzündlichen Erkrankungen,
Biosimilars- Die Sicht der Patienten
 Ähnlich, aber eben doch nicht gleich - Biopharmazeutika: Der Unterschied liegt im Detail Biosimilars- Die Sicht der Patienten 27. November 2012 Ludwigshafen Renate Haidinger Medozinjournalistin 1.Vorsitzende
Ähnlich, aber eben doch nicht gleich - Biopharmazeutika: Der Unterschied liegt im Detail Biosimilars- Die Sicht der Patienten 27. November 2012 Ludwigshafen Renate Haidinger Medozinjournalistin 1.Vorsitzende
27. November 2012: Biopharmazeutika: Der Weg in die Zukunft
 Sarah Borowski / PIXELIO www.pixelio.de 27. November 2012: Biopharmazeutika: Der Weg in die Zukunft Dr. Karl-Heinz Grajer, Director Corporate Affairs Amgen GmbH und Mitglied im Vorstand von vfa bio Medizinische
Sarah Borowski / PIXELIO www.pixelio.de 27. November 2012: Biopharmazeutika: Der Weg in die Zukunft Dr. Karl-Heinz Grajer, Director Corporate Affairs Amgen GmbH und Mitglied im Vorstand von vfa bio Medizinische
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international
 Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Gesetzliche Grundlagen der Arzneimittelentwicklung national/ international Dr. med. Dirk Mentzer Referatsleiter Arzneimittelsicherheit Facharzt für Kinder- und Jugendmedizin Paul-Ehrlich-Institut Bundesinstitut
Perjeta für die neoadjuvante Therapie zugelassen
 HER2-positives Mammakarzinom Perjeta für die neoadjuvante Therapie zugelassen Grenzach-Wyhlen (31. Juli 2015) - Die Europäische Arzneimittel-Agentur (EMA) hat Perjeta (Pertuzumab) in Kombination mit Herceptin
HER2-positives Mammakarzinom Perjeta für die neoadjuvante Therapie zugelassen Grenzach-Wyhlen (31. Juli 2015) - Die Europäische Arzneimittel-Agentur (EMA) hat Perjeta (Pertuzumab) in Kombination mit Herceptin
Biosimilars in der Rheumatologie
 Biosimilars in der Rheumatologie T. Glück Kreisklinik Bad Reichenhall + Kreisklinik Berchtesgaden + Kreisklinik Freilassing + Kreisklinik Ruhpolding + Klinikum Traunstein + Biologicals und Biosimilars
Biosimilars in der Rheumatologie T. Glück Kreisklinik Bad Reichenhall + Kreisklinik Berchtesgaden + Kreisklinik Freilassing + Kreisklinik Ruhpolding + Klinikum Traunstein + Biologicals und Biosimilars
UNSER ANTRIEB: KREBS HEILEN
 UNSER ANTRIEB: KREBS HEILEN Unser Antrieb Bild: Gefärbte rasterelektronenmikroskopische Aufnahme (REM) einer Prostatakrebszelle. Wir sind Takeda Oncology, der Spezialbereich für Krebserkrankungen des Pharmaunternehmens
UNSER ANTRIEB: KREBS HEILEN Unser Antrieb Bild: Gefärbte rasterelektronenmikroskopische Aufnahme (REM) einer Prostatakrebszelle. Wir sind Takeda Oncology, der Spezialbereich für Krebserkrankungen des Pharmaunternehmens
Ausführliche vergleichende Daten zur Qualität sowie vergleichende nicht-klinische und klinische Daten
 vfa/vfa bio-positionspapier Biosimilars ZUSAMMENFASSUNG Biopharmazeutika werden mit Hilfe von Zellen hergestellt. Ihre Qualität wird anders als bei chemisch-synthetischen Arzneimitteln ganz wesentlich
vfa/vfa bio-positionspapier Biosimilars ZUSAMMENFASSUNG Biopharmazeutika werden mit Hilfe von Zellen hergestellt. Ihre Qualität wird anders als bei chemisch-synthetischen Arzneimitteln ganz wesentlich
AbbVie-Initiative RheuMotion bringt Bewegung in die Rheumatherapie
 DGRh 2017 AbbVie-Initiative RheuMotion bringt Bewegung in die Rheumatherapie - Regelmäßige, an die körperlichen Voraussetzungen angepasste Bewegung kann anti-entzündlich wirken und damit nachweislich positiven
DGRh 2017 AbbVie-Initiative RheuMotion bringt Bewegung in die Rheumatherapie - Regelmäßige, an die körperlichen Voraussetzungen angepasste Bewegung kann anti-entzündlich wirken und damit nachweislich positiven
Biosimilars Produkt und Entwicklungsprozess
 Dr. med. Guido Würth, Global Program Medical Director, Hexal AG XI. Expertengespräch der PPH plus GmbH & Co. KG Frankfurt am Main, 29. April 2016 Biosimilars Produkt und Entwicklungsprozess Deklaration
Dr. med. Guido Würth, Global Program Medical Director, Hexal AG XI. Expertengespräch der PPH plus GmbH & Co. KG Frankfurt am Main, 29. April 2016 Biosimilars Produkt und Entwicklungsprozess Deklaration
Chicago News: Aktuelles vom ACR 2011: B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß
 Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
Chicago News: Aktuelles vom ACR 2011 B-Zell-Therapie bei Rheumatoider Arthritis Medizin nach Maß Frankfurt am Main (22. November 2011) - Auf dem diesjährigen ACR-Kongress untermauerten gleich drei Studien
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM- RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Extrapolation von Indikationen
 Extrapolation von Indikationen BfArM im Dialog : Biosimilars Bonn, 27. Juni 2016 Dr. Martina Weise Überblick Konzept der Gesamtheit der Evidenz Lernen von Änderungen im Herstellungsprozess Überlegungen
Extrapolation von Indikationen BfArM im Dialog : Biosimilars Bonn, 27. Juni 2016 Dr. Martina Weise Überblick Konzept der Gesamtheit der Evidenz Lernen von Änderungen im Herstellungsprozess Überlegungen
mit symptomatischen Knochenmetastasen beim CRPC
 Innovation aus der Bayer Onkologie-Entwicklung: Xofigo Eine neue Therapieoption für Patienten mit s Innovation aus der Bayer Onkologie-Entwicklung Xofigo Eine neue Therapieoption für Patienten mit symptomatischen
Innovation aus der Bayer Onkologie-Entwicklung: Xofigo Eine neue Therapieoption für Patienten mit s Innovation aus der Bayer Onkologie-Entwicklung Xofigo Eine neue Therapieoption für Patienten mit symptomatischen
MENSCHEN. MÖGLICHKEITEN. LEIDENSCHAFT.
 MENSCHEN. MÖGLICHKEITEN. LEIDENSCHAFT. EIN FORSCHENDES BIOPHARMA-UNTERNEHMEN. www.abbvie.de @abbvie_de AbbVie Deutschland Kapitelheadline INHALT 06 AbbVie bedeutet 08 AbbVie forscht 10 AbbVie entdeckt
MENSCHEN. MÖGLICHKEITEN. LEIDENSCHAFT. EIN FORSCHENDES BIOPHARMA-UNTERNEHMEN. www.abbvie.de @abbvie_de AbbVie Deutschland Kapitelheadline INHALT 06 AbbVie bedeutet 08 AbbVie forscht 10 AbbVie entdeckt
Personalisierte Medizin
 Personalisierte Medizin Möglichkeiten und Grenzen Prof. Dr. Friedemann Horn Universität Leipzig, Institut für Klinische Immunologie, Molekulare Immunologie Fraunhofer Institut für Zelltherapie und Immunologie
Personalisierte Medizin Möglichkeiten und Grenzen Prof. Dr. Friedemann Horn Universität Leipzig, Institut für Klinische Immunologie, Molekulare Immunologie Fraunhofer Institut für Zelltherapie und Immunologie
HINTERGRUND-INFORMATION 2.7
 Biosimilars eine neue Generation von Arzneimitteln Biosimilars sind Nachfolgepräparate von Biopharmazeutika (Biologics), deren Patentschutz abgelaufen ist. Sie enthalten eine Wirksubstanz, die mit der
Biosimilars eine neue Generation von Arzneimitteln Biosimilars sind Nachfolgepräparate von Biopharmazeutika (Biologics), deren Patentschutz abgelaufen ist. Sie enthalten eine Wirksubstanz, die mit der
Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
 Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
10 Jahre Biosimilars in Europa: Vom wissenschaftlichen Konzept zum wissenschaftlich-erfahrungsbasierten. Ansatz
 BfArM im Dialog zu Biosimilars 10 Jahre Biosimilars in Europa: Vom wissenschaftlichen Konzept zum wissenschaftlich-erfahrungsbasierten Andrea Laslop Scientific Office AGES Medizinmarktaufsicht, Wien, Austria
BfArM im Dialog zu Biosimilars 10 Jahre Biosimilars in Europa: Vom wissenschaftlichen Konzept zum wissenschaftlich-erfahrungsbasierten Andrea Laslop Scientific Office AGES Medizinmarktaufsicht, Wien, Austria
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Daratumumab wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
1. Zusatznutzen des Arzneimittels im Verhältnis zur zweckmäßigen Vergleichstherapie
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Schwanger? GEHT DAS? Neun Antworten zum Thema Schwangerschaft bei entzündlichen Gelenkserkrankungen. RA, PsA und axspa
 Schwanger? GEHT DAS? Neun Antworten zum Thema Schwangerschaft bei entzündlichen Gelenkserkrankungen RA, PsA und axspa 9 Monate - 9 Antworten In der heutigen Zeit sind rheumatische Erkrankungen meist gut
Schwanger? GEHT DAS? Neun Antworten zum Thema Schwangerschaft bei entzündlichen Gelenkserkrankungen RA, PsA und axspa 9 Monate - 9 Antworten In der heutigen Zeit sind rheumatische Erkrankungen meist gut
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Neue Methotrexat-Fertigspritzen erleichtern Rheumapatienten die Selbstinjektion
 Weniger Volumen, mehr Funktionalität Neue Methotrexat-Fertigspritzen erleichtern Rheumapatienten die Selbstinjektion Holzkirchen (26. April 2013) Von MTX HEXAL stehen jetzt neue Fertigspritzen in der Konzentration
Weniger Volumen, mehr Funktionalität Neue Methotrexat-Fertigspritzen erleichtern Rheumapatienten die Selbstinjektion Holzkirchen (26. April 2013) Von MTX HEXAL stehen jetzt neue Fertigspritzen in der Konzentration
Biosimilars aus Sicht der Kostenträger - BfArM im Dialog
 Biosimilars aus Sicht der Kostenträger - BfArM im Dialog Bonn, 27. Juni 2016 Dr. Antje Haas GKV-Spitzenverband Abteilung Arznei- und Heilmittel Biologische Arzneimittel, ein problematischer Teilmarkt GKV-Umsatz
Biosimilars aus Sicht der Kostenträger - BfArM im Dialog Bonn, 27. Juni 2016 Dr. Antje Haas GKV-Spitzenverband Abteilung Arznei- und Heilmittel Biologische Arzneimittel, ein problematischer Teilmarkt GKV-Umsatz
TÜV SÜD Product Service GmbH Medical and Health Services Safely and successfully on the health market.
 TÜV SÜD Product Service GmbH Medical and Health Services Safely and successfully on the health market. TÜV SÜD Product Service GmbH Prof. Dr. Sabine Kloth 1 Arzneimittel/Medizinprodukt-Kombinationen: Die
TÜV SÜD Product Service GmbH Medical and Health Services Safely and successfully on the health market. TÜV SÜD Product Service GmbH Prof. Dr. Sabine Kloth 1 Arzneimittel/Medizinprodukt-Kombinationen: Die
Prevenar 13 für Erwachsene von 18 bis 49 Jahren
 Pneumokokken-Schutz jetzt für alle Altersgruppen Europäische Kommission erteilt Zulassung für Prevenar 13 für Erwachsene von 18 bis 49 Jahren Berlin (17. Juli 2013) - Pfizer hat für den 13-valenten Pneumokokken-Konjugatimpfstoff
Pneumokokken-Schutz jetzt für alle Altersgruppen Europäische Kommission erteilt Zulassung für Prevenar 13 für Erwachsene von 18 bis 49 Jahren Berlin (17. Juli 2013) - Pfizer hat für den 13-valenten Pneumokokken-Konjugatimpfstoff
DGRh Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung
 DGRh 2008 - Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung Berlin (26. September 2008) Patienten mit Ankylosierender Spondylitis (AS) profitieren auch
DGRh 2008 - Etanercept bei Ankylosierender Spondylitis: Sicher und wirksam in der klinischen Routineversorgung Berlin (26. September 2008) Patienten mit Ankylosierender Spondylitis (AS) profitieren auch
Innovationen für Patienten
 Roche Innovationen für Patienten Penzberg (3. Mai 2017) - Roche zielt darauf, mit innovativen Lösungen neue Therapiestandards für Patienten zu schaffen. Beispielhaft für solche Durchbrüche in der Behandlung
Roche Innovationen für Patienten Penzberg (3. Mai 2017) - Roche zielt darauf, mit innovativen Lösungen neue Therapiestandards für Patienten zu schaffen. Beispielhaft für solche Durchbrüche in der Behandlung
Wie ist die Evidenzlage in Biosimilarstudien? Gibt es trotzdem Unterschiede?
 Wie ist die Evidenzlage in Biosimilarstudien? Gibt es trotzdem Unterschiede? Satellitensymposium während des DGHO-Kongresses: Biosimilars 3.0: therapeutische monoklonale Antikörper in der Onkologie - Chancen,
Wie ist die Evidenzlage in Biosimilarstudien? Gibt es trotzdem Unterschiede? Satellitensymposium während des DGHO-Kongresses: Biosimilars 3.0: therapeutische monoklonale Antikörper in der Onkologie - Chancen,
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten
 Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
Frühe Nutzenbewertungen nach AMNOG: Einblicke in die aktuellen Verfahren und mögliche Auswirkungen für Ärzte und Patienten Arzneimittelmarktneuordnungsgesetz (AMNOG) 35a Bewertung des Nutzens von Arzneimitteln
BAnz AT B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V
Biosimilars: Die Sicht der Ärzte (am Beispiel von Trastuzumab)
 Biosimilars: Die Sicht der Ärzte (am Beispiel von Trastuzumab) Veranstaltung für Patientenselbsthilfegruppen, Roche Diagnostics GmbH, Penzberg, 06.11.2013 PD Dr. M. Thill Klinik für Gynäkologie und Geburtshilfe
Biosimilars: Die Sicht der Ärzte (am Beispiel von Trastuzumab) Veranstaltung für Patientenselbsthilfegruppen, Roche Diagnostics GmbH, Penzberg, 06.11.2013 PD Dr. M. Thill Klinik für Gynäkologie und Geburtshilfe
Bedeutung von MAO-B-Hemmern
 DGN-Kongress 2014: Rasagilin verlässlicher Therapiepartner im Krankheitsverlauf Individuelle Konzepte in der Parkinson-Therapie: Bedeutung von MAO-B-Hemmern München (17. September 2014) - Wie kann der
DGN-Kongress 2014: Rasagilin verlässlicher Therapiepartner im Krankheitsverlauf Individuelle Konzepte in der Parkinson-Therapie: Bedeutung von MAO-B-Hemmern München (17. September 2014) - Wie kann der
BfArM im Dialog: Biosimilars 27. Juni 2016
 BfArM im Dialog: Biosimilars 27. Juni 216 Apothekerin Dr. Antje Behring Abteilung Arzneimittel des G-BA Inhaltsverzeichnis Marktzugang Regulierung und Erstattung von Biosimilars in Deutschland Frühe Nutzenbewertung
BfArM im Dialog: Biosimilars 27. Juni 216 Apothekerin Dr. Antje Behring Abteilung Arzneimittel des G-BA Inhaltsverzeichnis Marktzugang Regulierung und Erstattung von Biosimilars in Deutschland Frühe Nutzenbewertung
BAnz AT B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Diabetes. Zulassungserweiterung: Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Mens
 Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
Zulassungserweiterung Levemir (Insulin detemir) als Add-on Therapie zu Victoza (Liraglutid) bei Menschen mit Typ 2 Diabetes Mainz (16. November 2011) Die Europäische Kommission hat die Zulassung des modernen
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT
 UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
UNSERE VERANTWORTUNG FÜR DIE PATIENTENSICHERHEIT Im Gleichgewicht bleiben Ein gesunder Körper ist im Gleichgewicht. Wenn wir krank sind, bemüht sich der Körper, diese Balance wiederherzustellen. Doch manchmal
Sexualhormon bei älteren Männern vorsichtig einsetzen
 Testosteron erhöht Muskelkraft aber auch Herz-Kreislaufrisiko Sexualhormon bei älteren Männern vorsichtig einsetzen Wiesbaden (11. August 2010) Nehmen ältere Männer das Sexualhormon Testosteron ein, stärkt
Testosteron erhöht Muskelkraft aber auch Herz-Kreislaufrisiko Sexualhormon bei älteren Männern vorsichtig einsetzen Wiesbaden (11. August 2010) Nehmen ältere Männer das Sexualhormon Testosteron ein, stärkt
BAnz AT B7. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland
 Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
Pneumologie Spiriva Respimat erhält Zulassung für die Asthma-Therapie in Deutschland - Trotz verfügbaren Therapieoptionen* hat fast jeder zweite Asthma-Patient weiterhin Symptome1,2,3 - Spiriva Respimat
Vertrag über ein strukturiertes Arzneimittel-Management von Biologika und Biosimilars (Biolike) in Hamburg nach 84 Abs.
 Vertrag über ein strukturiertes Arzneimittel-Management von Biologika und Biosimilars (Biolike) in Hamburg nach 84 Abs. 1 Satz 5 SGB V zwischen der Kassenärztlichen Vereinigung Hamburg Heidenkampsweg 99,
Vertrag über ein strukturiertes Arzneimittel-Management von Biologika und Biosimilars (Biolike) in Hamburg nach 84 Abs. 1 Satz 5 SGB V zwischen der Kassenärztlichen Vereinigung Hamburg Heidenkampsweg 99,
Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV
 Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV Von Dr. med. Markus Rupp, MSD SHARP & DOHME GMBH, Haar München (20. September 2008) Der World-Aids-Report
Integrase-Hemmung mit ISENTRESS : Eine neue Klasse antiretroviraler Wirkstoffe zur Behandlung von HIV Von Dr. med. Markus Rupp, MSD SHARP & DOHME GMBH, Haar München (20. September 2008) Der World-Aids-Report
BAnz AT B5. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson
 Boehringer Ingelheim erhält Marktzulassung von der Europäischen Kommission Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson Ingelheim (14. Oktober 2009) - Die Europäische Kommission hat
Boehringer Ingelheim erhält Marktzulassung von der Europäischen Kommission Jetzt einmal täglich: Sifrol Retardtablette bei Morbus Parkinson Ingelheim (14. Oktober 2009) - Die Europäische Kommission hat
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um die Wirkstoffkombination Netupitant/Palonosetron wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Neu zugelassen: JAK-Inhibitor Xeljanz bei Rheumatoider Arthritis
 Neu zugelassen: JAK-Inhibitor Xeljanz bei Rheumatoider Arthritis - Therapeutische Lücke schließen: To Therapeutische Lücke schließen: Tofacitinib ist langfristig gut wirksam Neu zugelassen: JAK-Inhibitor
Neu zugelassen: JAK-Inhibitor Xeljanz bei Rheumatoider Arthritis - Therapeutische Lücke schließen: To Therapeutische Lücke schließen: Tofacitinib ist langfristig gut wirksam Neu zugelassen: JAK-Inhibitor
Zulassung von Arzneimitteln. Klinische Untersuchungen. Katalin Müllner
 Zulassung von Arzneimitteln. Klinische Untersuchungen Katalin Müllner Arzneimittel In gesetzlicher Definition sind Arzneimittel Stoffe oder Zubereitungen aus Stoffen, die vom Hersteller, der sie in den
Zulassung von Arzneimitteln. Klinische Untersuchungen Katalin Müllner Arzneimittel In gesetzlicher Definition sind Arzneimittel Stoffe oder Zubereitungen aus Stoffen, die vom Hersteller, der sie in den
Antrag bei der Krankenkasse Zur Übernahme der Behandlungskosten - Off Label Therapie bei Uveitis - Patient:, geb. Datum:
 Antrag bei der Krankenkasse Zur Übernahme der Behandlungskosten - Off Label Therapie bei Uveitis - Patient:, geb. Datum: Augen-Diagnosen (bitte alle auflisten): Uveitis bekannt seit: Symptome durch die
Antrag bei der Krankenkasse Zur Übernahme der Behandlungskosten - Off Label Therapie bei Uveitis - Patient:, geb. Datum: Augen-Diagnosen (bitte alle auflisten): Uveitis bekannt seit: Symptome durch die
Funktion. Organisation und Leitung zusammen mit Dr. Ingo Arnold, Bremen Referent für die Rheumaliga
 Organisation bzw. Leitung von wissenschaftlichen Veranstaltungen seit 2004 Titel, Ort und Datum der Veranstaltung Bremer Qualitätszirkel Interdisziplinäre Rheumatologie, 4x/ Jahr seit 2005 Jährliche Vorträge
Organisation bzw. Leitung von wissenschaftlichen Veranstaltungen seit 2004 Titel, Ort und Datum der Veranstaltung Bremer Qualitätszirkel Interdisziplinäre Rheumatologie, 4x/ Jahr seit 2005 Jährliche Vorträge
1. Die Angaben zu Perampanel in der Fassung des Beschlusses vom 7. März 2013 (BAnz AT B4) werden aufgehoben.
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Auf dem Weg zu einem evidenzbasierten. auch in der Onkologie
 Auf dem Weg zu einem evidenzbasierten Gesundheitssystem auch in der Onkologie Reinhard Busse, Prof. Dr. med. MPH FFPH FG Management im Gesundheitswesen, Technische Universität Berlin (WHO Collaborating
Auf dem Weg zu einem evidenzbasierten Gesundheitssystem auch in der Onkologie Reinhard Busse, Prof. Dr. med. MPH FFPH FG Management im Gesundheitswesen, Technische Universität Berlin (WHO Collaborating
Europäische Verfahren
 Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Europäische Verfahren Zur Zeit existieren 3 verschieden Zulassungsverfahren in der EU: Verfahren der gegenseitigen Anerkennung (MRP) dezentrales Verfahren (DCP) zentrales Verfahren Alle Biotech Produkte
Herausforderungen in der individualisierten Therapie beim mcrc
 Erstlinientherapie des kolorektalen Karzinoms Herausforderungen in der individualisierten Therapie beim mcrc Berlin (2. Oktober 2010) Beim metastasierten kolorektalen Karzinom (mcrca) mit nicht-mutiertem
Erstlinientherapie des kolorektalen Karzinoms Herausforderungen in der individualisierten Therapie beim mcrc Berlin (2. Oktober 2010) Beim metastasierten kolorektalen Karzinom (mcrca) mit nicht-mutiertem
Umsetzung der Handlungsempfehlung Arzneimitteltherapiesicherheit im Krankenhaus Welchen Beitrag leistet closed-loop medication?
 Umsetzung der Handlungsempfehlung Arzneimitteltherapiesicherheit im Krankenhaus Welchen Beitrag leistet closed-loop medication? Dr. Juliane Eidenschink, Apothekerin Was ist Arzneimitteltherapiesicherheit?
Umsetzung der Handlungsempfehlung Arzneimitteltherapiesicherheit im Krankenhaus Welchen Beitrag leistet closed-loop medication? Dr. Juliane Eidenschink, Apothekerin Was ist Arzneimitteltherapiesicherheit?
Forschung & Entwicklung Arzneimittelforschung
 Forschung & Entwicklung Arzneimittelforschung 24 www.q-more.com q&more 01.16 Warum Biosimilars und nicht Biogenerika? Hohe Hürden für Nachahmerprodukte hochkomplexer Biopharmazeutika Prof. Dr. Theo Dingermann
Forschung & Entwicklung Arzneimittelforschung 24 www.q-more.com q&more 01.16 Warum Biosimilars und nicht Biogenerika? Hohe Hürden für Nachahmerprodukte hochkomplexer Biopharmazeutika Prof. Dr. Theo Dingermann
BAnz AT B1. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Biosimilars ähnlich aber nicht gleich
 DPhG Jahrestagung 2008 Bonn Biosimilars ähnlich aber nicht gleich Prof. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt/Main Zwei Standpunkte zu generischen Biologicals:
DPhG Jahrestagung 2008 Bonn Biosimilars ähnlich aber nicht gleich Prof. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt/Main Zwei Standpunkte zu generischen Biologicals:
Stelara ist ein Arzneimittel, das zur Behandlung der folgenden Erkrankungen angewendet wird:
 EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/636854/2016 EMEA/H/C/000958 Zusammenfassung des EPAR für die Öffentlichkeit Ustekinumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) d
 Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) der Firma Pfizer zur Behandlung der pulmonal-arteriellen Hypertonie (PAH) - Revatio ist die einzige PAH-Behandlung
Europäische Kommission erteilt Zulassung für neue intravenöse Formulierung von Revatio (Sildenafil) der Firma Pfizer zur Behandlung der pulmonal-arteriellen Hypertonie (PAH) - Revatio ist die einzige PAH-Behandlung
Sehr geehrte Patientin! Sehr geehrter Patient!
 Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Univ. Klinik f. Innere Medizin LKH Graz Klinische Abteilung für Rheumatologie und Immunologie Univ. Prof. Dr. W. Graninger Auenbruggerplatz 15, A-8036 Graz Tel 0 316-385-12645 PATIENTENAUFKLÄRUNG ZUR THERAPIE
Aktionstag Chronisch entzündliche Darmerkrankungen : Morbus Crohn-Patienten brauchen individuelle
 Aktionstag Chronisch entzündliche Darmerkrankungen Morbus Crohn-Patienten brauchen individuelle Therapie Berlin (19. Mai 2015) Deutet sich bei Morbus Crohn ein komplizierter Krankheitsverlauf an, sollten
Aktionstag Chronisch entzündliche Darmerkrankungen Morbus Crohn-Patienten brauchen individuelle Therapie Berlin (19. Mai 2015) Deutet sich bei Morbus Crohn ein komplizierter Krankheitsverlauf an, sollten
KLINISCHE STUDIEN KOMPAKT
 KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
KLINISCHE STUDIEN KOMPAKT VORWORT Vom Labor zum Medikament ist es ein langer Weg klinische Studien leisten einen wertvollen Beitrag zur Wirkstoffentwicklung. Doch was verbirgt sich hinter dem Begriff?
Immuntherapien in der Onkologie: Was lange währt, wird endlich gut?
 Immuntherapien in der Onkologie: Was lange währt, wird endlich gut? Dr.med. Isabel Marieluise Gruber, PhD 3. März 2016 Trendtage Gesundheit Luzern Krebs verursacht eine grosse Krankheitslast Vier von zehn
Immuntherapien in der Onkologie: Was lange währt, wird endlich gut? Dr.med. Isabel Marieluise Gruber, PhD 3. März 2016 Trendtage Gesundheit Luzern Krebs verursacht eine grosse Krankheitslast Vier von zehn
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
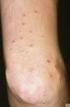 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Velcade (Bortezomib) auch in der Therapie niereninsuffizienter Myelompatienten effektiv und verträglich
 Aktuelle Pressemitteilung Velcade (Bortezomib) auch in der Therapie niereninsuffizienter Myelompatienten effektiv und verträglich (Neuss, 4. Dezember 2007) Neueste beim Internationalen Myelomworkshop auf
Aktuelle Pressemitteilung Velcade (Bortezomib) auch in der Therapie niereninsuffizienter Myelompatienten effektiv und verträglich (Neuss, 4. Dezember 2007) Neueste beim Internationalen Myelomworkshop auf
Grundsätze der Neuerungen bei der Zulassung von Arzneimitteln mit bekannten Wirkstoffen (BWS) ab 1. Januar 2014
 Swissmedic Regulatory News aus dem Bereich Zulassung Freitag, 8. November 2013, Stade de Suisse Bern Grundsätze der Neuerungen bei der Zulassung von Arzneimitteln mit bekannten Wirkstoffen (BWS) ab 1.
Swissmedic Regulatory News aus dem Bereich Zulassung Freitag, 8. November 2013, Stade de Suisse Bern Grundsätze der Neuerungen bei der Zulassung von Arzneimitteln mit bekannten Wirkstoffen (BWS) ab 1.
Sunitinib: Neue Chance für Patienten mit Nieren- oder Magen-Darm-Krebs Weitere Krebsarten in der klinischen Prüfung
 Sunitinib: Neue Chance für Patienten mit Nieren oder Magen Darm Krebs - Weitere Krebsarten in der kl Sunitinib: Neue Chance für Patienten mit Nieren- oder Magen-Darm-Krebs Weitere Krebsarten in der klinischen
Sunitinib: Neue Chance für Patienten mit Nieren oder Magen Darm Krebs - Weitere Krebsarten in der kl Sunitinib: Neue Chance für Patienten mit Nieren- oder Magen-Darm-Krebs Weitere Krebsarten in der klinischen
Auswahlrunde Name: Medizinstudium seit: In der Auswahlrunde 2014 wurden 5 Bewerber in das Programm aufgenommen.
 In der Auswahlrunde 2014 wurden 5 Bewerber in das Programm aufgenommen. Auswahlrunde 2014 In der Auswahlrunde 2014 wurden 5 Bewerber in das Programm aufgenommen. Jennifer Furkel WS 2011/2012 1 Christoph
In der Auswahlrunde 2014 wurden 5 Bewerber in das Programm aufgenommen. Auswahlrunde 2014 In der Auswahlrunde 2014 wurden 5 Bewerber in das Programm aufgenommen. Jennifer Furkel WS 2011/2012 1 Christoph
Stellungnahme der Bundesärztekammer
 Stellungnahme der Bundesärztekammer zur Änderung der Psychotherapie-Richtlinie: Indikation Schizophrenie (Anfrage des Gemeinsamen Bundesausschusses vom 17. April 2013) Berlin, 15.05.2013 Bundesärztekammer
Stellungnahme der Bundesärztekammer zur Änderung der Psychotherapie-Richtlinie: Indikation Schizophrenie (Anfrage des Gemeinsamen Bundesausschusses vom 17. April 2013) Berlin, 15.05.2013 Bundesärztekammer
Zulassung von Biosimilars
 Zulassung von Biosimilars Was ist zu beachten Dr. Brigitte Brake und Medizinprodukte Bonn Frnakfurt, 20. Juni 2007 Besonderheiten Biologika Herstellungsprozess Kultur lebender Organismen, genetische Stabilität,
Zulassung von Biosimilars Was ist zu beachten Dr. Brigitte Brake und Medizinprodukte Bonn Frnakfurt, 20. Juni 2007 Besonderheiten Biologika Herstellungsprozess Kultur lebender Organismen, genetische Stabilität,
Pharmaceuticals. Das Wichtigste zum Thema Generika. Sandoz legt Wert auf höchste Qualität, weltweite Präsenz und permanente Innovation.
 Pharmaceuticals Das Wichtigste zum Thema Generika Sandoz legt Wert auf höchste Qualität, weltweite Präsenz und permanente Innovation. 2 3 WAS SIND GENERIKA? Generika sind viel günstiger und dies bei gleicher
Pharmaceuticals Das Wichtigste zum Thema Generika Sandoz legt Wert auf höchste Qualität, weltweite Präsenz und permanente Innovation. 2 3 WAS SIND GENERIKA? Generika sind viel günstiger und dies bei gleicher
: Schulungsmaterial (Educational Material) für medizinisches Fachpersonal
 Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
Kadcyla : Schulungsmaterial (Educational Material) für medizinisches Fachpersonal EU Information für medizinisches Fachpersonal Januar 2017 Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
