Biosimilars Produkt und Entwicklungsprozess
|
|
|
- Rudolf Julian Mann
- vor 6 Jahren
- Abrufe
Transkript
1 Dr. med. Guido Würth, Global Program Medical Director, Hexal AG XI. Expertengespräch der PPH plus GmbH & Co. KG Frankfurt am Main, 29. April 2016 Biosimilars Produkt und Entwicklungsprozess
2 Deklaration möglicher Interessenkonflikte Der Vortragende ist Angestellter der Firma Hexal 2
3 Agenda Biologika Vergleich mit synthetischen Wirkstoffen Herstellung Biosimilars Wissenschaftliche und regulatorische (Entwicklungs)prinzipien Die Rolle der klinischen Entwicklung Erklärung Extrapolation 3
4 Biologika im Vergleich zu chemisch-synthetisch hergestellten Wirkstoffen Paracetamol Filgrastim (ein Wachstumsfaktor) Antikörper Synthetisch hergestelltes Molekül Einheitliche Substanz 151 Dalton Vielfältige Wirkmechanismen Protein (nicht glykosyliert) Hergestellt mit Bakterien Einheitliche Substanz 175 Aminosäuren Dalton Wirkt ausschließlich durch Rezeptorbindung Glykoprotein (glykosyliert) Hergestellt mit Säugetierzellen Einheitliche Aminosäuresequenz, variable Glykosylierung z.b. von Charge zu Charge Aminosäuren Da Rezeptorbindung, Effektor- 4 Funktionen
5 Biologika: Produktion durch lebende Organismen Zellbank Produktionszelllinie (z.b. E. coli, CHO) wird modifiziert, um das gewünschte Protein herstellen zu können Zellkultur In großen Bioreaktoren (Fermentation) Proteinreinigung Isolierung und mehrstufige Reinigung (z.b. Chromatographie) Formulierung und sterile Abfüllung Wirkstoff (drug substance) Fertigprodukt (drug product) Adapted from EGA Handbook on biosimilar medicines; available from CHO = Chinese hamster ovary 5
6 Was ist ein Biosimilar? 1 Biosimilar ist ein regulatorischer Begriff und bezeichnet ein biologisches Medikament, das die strengen EU-Zulassungsbedingungen des Biosimilar-Pfades erfüllt und in der EU zugelassen wurde Proposed Biosimilar ist ein Produkt, das entwickelt wird, um mit einem bereits zugelassenen biologischen Arzneimittel ( Referenzarzneimittel ) vergleichbar zu sein Wie alle biotechnologisch entwickelten Arzneimittel werden auch Biosimilars zentral von der Europäischen Arzneimittelagentur (EMA) zugelassen Arzt und Patient können erwarten, dass ein Biosimilar und sein Referenzarzneimittel für zugelassene Indikationen das gleiche Sicherheits- und Wirksamkeitsprofil haben Je nach Fall sind Biosimilars entweder für alle oder ausgewählte Indikationen des Referenzarzneimittels zugelassen 1 Definitionen sind entnommen dem Konsensinformationsblatt 2013 der Europäischen Kommission Was Sie über Biosimilars wissen sollten 6
7 Unterschiedliche Ansätze für Erstanbietervs. Biosimilarentwicklung Vergleich der Entwicklungsverfahren Erstanbieter Klinik PK/PD Präklinik Analytik Ziel: Erforschung des klinischen Effektes Biosimilar Klinik PK/PD Präklinik Analytik Ziel: Beweis der Vergleichbarkeit des Biosimilars zum Erstanbieter/ Bildung der Brücke zur klinischen Erfahrung des Erstanbieters Beide Verfahren gewährleisten dasselbe Nutzen-Risiko- Verhältnis in Bezug auf die Sicherheit und Wirksamkeit 7
8 Biosimilars werden systematisch auf Vergleichbarkeit mit dem Erstanbieter entwickelt Primärstruktur (Sequenz): Gesamtmasse Aminosäure-Sequenz Peptide Mapping Verunreinigungen und Nebenprodukte: saure/basische Varianten Glycation/Glykierung Peptide Mapping Deamidierung, Oxidation, Mutation Aggregatbildung Faltung: Kernspinresonanzspektroskopie Spektroskopie Fourier-Transformations-Infrarotspektrometer Glykosylierung Verfahren zur Bestimmung von Glykanen Sialinsäuren Biologische Aktivität: Bindungstests abhängig vom Produkt Kombinierte Analyse verschiedener Messmethoden Statistische Datenanalyseverfahren z.b. Multivarianzdatenanalyse, mathematische Algorithmen Prüfung der Ergebnisse auf Konsistenz Die Vergleichbarkeit muss in allen relevanten Qualitätsattributen gegeben sein 8
9 Alle Biologika unterliegen einer gewissen Variabilität a) Charge zu Charge Nicht-Identität ist ein natürliches Prinzip Keine zwei Chargen eines Biologikums sind völlig identisch Unproblematisch, solange Spezifikationen für Qualitätsattribute getroffen b) Nach Änderungen im Herstellungsverfahren Verfahren werden häufig geändert Führen manchmal auch zu größeren Unterschieden in einzelnen Qualitätsattributen Solche Änderungen sind streng reguliert und werden nur dann genehmigt, wenn negative Auswirkungen auf klinische Eigenschaften ausgeschlossen werden können Schneider CK. Ann Rheum Dis 2013;72(3):315 8 Wirksamkeit/Sicherheit demonstriert Variabilität eines Polysaccharides in einem kommerziellen mab ADCC Potency [% of reference] Pre-Shift Post- Shift Expiry Date Schiestl M, et al. Nat Biotechnol 2011;29(4):310 2 ADCC = Antikörperabhängige zellvermittelte Zytotoxizität 9
10 Erfahrung mit Änderungen in Herstellungsprozessen von Erstanbietern führte zum Biosimilarkonzept Erstanbieter ändern auch nach der Zulassung immer wieder den Herstellungsprozess (Abbildung: Stand 2013) Gründe für Änderungen Wechsel des Lieferanten für Zellkulturmedium Neue Reinigungsmethode Neuer Produktionsstandort Solche Änderungen sind heutzutage gut verstanden und behördlich streng reguliert (ICH Q5E) C Schneider, Ann Rheum Dis March 2013 Vol 72 No 3 Alle Markennamen sind Eigentum des jeweiligen Inhabers 10
11 Wie vergleichbar sind Biosimilar und Erstanbieter in der biochemischen Struktur? Aminosäuresequenz Primärstruktur Identisch Faltung Sekundäre/Tertiäre/ Quarternäre Struktur Gleich Glykosylierung und Nebenprodukte Identische Strukturen mit vergleichbaren Gehalten Unterschiede sind nur erlaubt, wenn sie keinen Einfluss auf Funktion und klinische Eigenschaften haben 11
12 Anforderungen an das klinische Studiendesign für Biosimilars Ziel: Prüfung auf Vergleichbarkeit Pharmakokinetik (PK-Studien oft in gesunden Freiwilligen) Wirkung und Sicherheit (konfirmatorische Studie in Patienten) Generell ist ein Äquivalenzdesign bevorzugt (zweiseitiger statistischer Test mit Vorfestlegung eines klinisch relevanten Konfidenzintervalls) Anforderungen Direkter Vergleich gegen Erstanbieter Konfirmatorische Studie: in möglichst sensitiver Indikation Zur Erfassung klinisch relevanter Unterschiede in Wirksamkeit und Sicherheit Endpunkte mit großem Unterschied zwischen Placebo und Verum Immunkompetente Studienpopulationen 12
13 Was bedeutet Extrapolation? 1 Wenn Biosimilarität für eine Indikation demonstriert wurde, ist die Extrapolation auf andere Indikationen des Referenzarzneimittels mit entsprechender wissenschaftlicher Begründung möglich. Für eine Zulassung von Biosimilars ist zunächst die Evidenz zu erbringen, dass Biosimilar und Referenzarzneimittel im Hinblick auf analytische, präklinische und klinische Eigenschaften vergleichbar sind. Klinisch reicht oft eine Studie in einer hochsensitiven Patientenpopulation, wenn wissenschaftlich begründet (z.b. wenn der Wirkmechanismus für alle Indikationen eines Biologikums derselbe ist, aber auch bei verschiedenen Wirkmechanismen kann eine wissenschaftliche Begründung ausreichend sein). Das Biosimilar kann dann von der EMA aufgrund der Extrapolation die Zulassung für alle Indikationen erhalten, in denen das Original zugelassen ist. 1 Definitionen sind entnommen aus EMA guideline on similar biological medicinal products 2014 und dem Konsensinformationsblatt 2013 der Europäischen Kommission Was Sie über Biosimilars wissen sollten 13
14 Extrapolation basiert auf der gesamten Datenlage (Englisch: Totality of the Evidence) Erstanbieter Biosimilar Strukturelle Attribute Biologische Funktionen Humane PK / PD Extrapolierte Indikation Sensitive Indikation S I M I L A R Connected to the Safety and reference S I M I L A R efficacy product and its established by findings on S I M I L A R clinical studies in safety and all approved efficacy by a Wissenschaftlich begründet indications robust similarity exercise S I M I L A R 14
15 Extrapolation erfolgt keinesfalls automatisch und nur aufgrund der klinischen Testung in einer Indikation Extrapolierte Indikation Extrapolierte Indikation Das ist nicht das Konzept! Getestete Indikation Extrapolierte Indikation Extrapolierte Indikation 15
16 Das Biosimilarkonzept funktioniert Seit 10 Jahren und eingesetzt über mehr als 400 Millionen Patiententage in der EU......mit Wirksamkeits- und Sicherheitsprofilen vergleichbar mit den Erstanbietern Sandoz data on file ARGUS 31 Oct
17 Zusammenfassung Biologika sind gut verstanden und charakterisierbar Biosimilars sind mit Erstanbietern vergleichbar Arzt und Patient können dieselben klinischen Eigenschaften erwarten Biosimilarität wird im analytischen Vergleich etabliert und in klinischen Studien bestätigt Extrapolation von Indikationen basiert auf detailierten wissenschaftlichen Begründungen Die Erfahrung zeigt: das Biosimilarkonzept funktioniert 17
18 Backup 18
19 Entwicklung von Biosimilars im Vergleich zu Generika und Erstanbieter Generika* Biosimilars* Erstanbieter* US$ 2 3m US$ m US$ 800m Entwicklungskosten 2 3 Jahre 7 8 Jahre 8 10 Jahre Entwicklungszeit ~ 500 > 800 Zahl an Patienten/Probanden * Industriedurchschnitt 19
20 Biosimilars werden systematisch auf Vergleichbarkeit mit dem Erstanbieter entwickelt 2. Optimierung des Herstellungsverfahrens Biologisch mögliche Variabilität Zelllinienentwicklung Klinik PK/PD 3. Prüfung der Biosimilarität Fertigproduktentwicklung Verfahrensentwicklung Entwicklung Zellkultivierung Präklinik Analytik Entwicklung Proteinreinigung Zielvariabilität Variabilität des Erstanbieters 1. Zieldefinition Charakterisierung der biologischen Funktionen Physikochemische Charakterisierung 20
21 Sandoz/Hexal ist der Pionier für Biosimilars Globaler Marktanteil 2013 Globaler Biosimilar Marktanteil 1, Prozent Marktprodukte Zugelassen: 2006 (EU und US) Zugelassen: 2007 (EU) Zugelassen 2009 (EU); 2015 (US) Pipeline Produkte in der späten klinischen Entwicklung Etanercept Adalimumab Rituximab Pegfilgrastim Weitere Produkte in der frühen Entwicklung 1 Inkludiert zugelassene Produkte in hoch-regulierten Märkten von Nordamerika, Europa und Asien 21
22 Patentabläufe 22
Forschung & Entwicklung Arzneimittelforschung
 Forschung & Entwicklung Arzneimittelforschung 24 www.q-more.com q&more 01.16 Warum Biosimilars und nicht Biogenerika? Hohe Hürden für Nachahmerprodukte hochkomplexer Biopharmazeutika Prof. Dr. Theo Dingermann
Forschung & Entwicklung Arzneimittelforschung 24 www.q-more.com q&more 01.16 Warum Biosimilars und nicht Biogenerika? Hohe Hürden für Nachahmerprodukte hochkomplexer Biopharmazeutika Prof. Dr. Theo Dingermann
Biosimilars - Die Sicht der Patienten Ulla Ohlms, Vorsitzende der Stiftung PATH Patients Tumorbank of Hope
 Biosimilars - Die Sicht der Patienten Ulla Ohlms, Vorsitzende der Stiftung PATH Patients Tumorbank of Hope Vfa-Tagung Ähnlich, aber eben doch nicht gleich Penzberg, 6. November 2013 März 2000, damals,
Biosimilars - Die Sicht der Patienten Ulla Ohlms, Vorsitzende der Stiftung PATH Patients Tumorbank of Hope Vfa-Tagung Ähnlich, aber eben doch nicht gleich Penzberg, 6. November 2013 März 2000, damals,
ein handbuch BIOSIMILARS
 1 BIOSIMILARS ein handbuch BIOSIMILARS BIOSIMILARS e i n h andbuch BIOSIMILARS 2. aktualisierte Auflage 4 INHALT VORWORT 5 Inhalt Vorwort 5 Einleitung 7 Zielgruppe 8 Überblick 9 Bedeutung der Biosimilars
1 BIOSIMILARS ein handbuch BIOSIMILARS BIOSIMILARS e i n h andbuch BIOSIMILARS 2. aktualisierte Auflage 4 INHALT VORWORT 5 Inhalt Vorwort 5 Einleitung 7 Zielgruppe 8 Überblick 9 Bedeutung der Biosimilars
KLINISCHE PRÜFUNG EINE EINFÜHRUNG. ATA Conference 2003 - Elke Vogt-Arendt
 KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
KLINISCHE PRÜFUNG EINE EINFÜHRUNG ATA Conference 2003 - Elke Vogt-Arendt Was ist eine klinische Prüfung? Überprüfung von Wirkung, Nebenwirkung, Dosierung usw. eines neuen Arzneimittels vor Markteinführung.
Extrapolation von Indikationen
 Extrapolation von Indikationen BfArM im Dialog : Biosimilars Bonn, 27. Juni 2016 Dr. Martina Weise Überblick Konzept der Gesamtheit der Evidenz Lernen von Änderungen im Herstellungsprozess Überlegungen
Extrapolation von Indikationen BfArM im Dialog : Biosimilars Bonn, 27. Juni 2016 Dr. Martina Weise Überblick Konzept der Gesamtheit der Evidenz Lernen von Änderungen im Herstellungsprozess Überlegungen
Klinische Entwicklung des Filgrastim-Biosimilars Ratiograstim
 Klinische Entwicklung des Filgrastim-Biosimilars Ratiograstim Prof. Dr. med. Andreas Engert Klinik I für Innere Medizin der Universität zu Köln Was ist Filgrastim (G-CSF)? G-CSF = Granulozyten-koloniestimulierender
Klinische Entwicklung des Filgrastim-Biosimilars Ratiograstim Prof. Dr. med. Andreas Engert Klinik I für Innere Medizin der Universität zu Köln Was ist Filgrastim (G-CSF)? G-CSF = Granulozyten-koloniestimulierender
Biosimilars aus Sicht der Kostenträger - BfArM im Dialog
 Biosimilars aus Sicht der Kostenträger - BfArM im Dialog Bonn, 27. Juni 2016 Dr. Antje Haas GKV-Spitzenverband Abteilung Arznei- und Heilmittel Biologische Arzneimittel, ein problematischer Teilmarkt GKV-Umsatz
Biosimilars aus Sicht der Kostenträger - BfArM im Dialog Bonn, 27. Juni 2016 Dr. Antje Haas GKV-Spitzenverband Abteilung Arznei- und Heilmittel Biologische Arzneimittel, ein problematischer Teilmarkt GKV-Umsatz
Rekombinante Wirkstoffe. Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.
 Rekombinante Wirkstoffe Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Praktische Definitionen Gentechnik Unmittelbare neukombination
Rekombinante Wirkstoffe Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt Dingermann@em.uni-frankfurt.de Praktische Definitionen Gentechnik Unmittelbare neukombination
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien
 Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Welt Lymphom Tag Seminar für Patienten und Angehörige 15. September 2007 Wien Ein Vortrag von Univ. Prof. Dr. Johannes Drach Medizinische Universität Wien Univ. Klinik für Innere Medizin I Klinische Abteilung
Als Krebspatient an einer Studie teilnehmen was sollte man wissen?
 Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Als Krebspatient an einer Studie teilnehmen was sollte man wissen? Krebsinformationsdienst, Heidelberg Dr. Susanne Weg-Remers Seite 2 Grundlage für evidenzbasiertes medizinisches Wissen sind klinische
Biosimilars ähnlich aber nicht gleich
 DPhG Jahrestagung 2008 Bonn Biosimilars ähnlich aber nicht gleich Prof. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt/Main Zwei Standpunkte zu generischen Biologicals:
DPhG Jahrestagung 2008 Bonn Biosimilars ähnlich aber nicht gleich Prof. Theo Dingermann Institut für Pharmazeutische Biologie Goethe-Universität Frankfurt/Main Zwei Standpunkte zu generischen Biologicals:
Zulassung von Arzneimitteln in Österreich und EU/EWR
 Zulassung von Arzneimitteln in Österreich und EU/EWR Dr. Gerhard Beck Institute Begutachtung & Analytik AGES Medizinmarkaufsicht UBA 3.12.2015 Österreichische Agentur für Gesundheit und Ernährungssicherheit
Zulassung von Arzneimitteln in Österreich und EU/EWR Dr. Gerhard Beck Institute Begutachtung & Analytik AGES Medizinmarkaufsicht UBA 3.12.2015 Österreichische Agentur für Gesundheit und Ernährungssicherheit
Prevenar 13 für Erwachsene von 18 bis 49 Jahren
 Pneumokokken-Schutz jetzt für alle Altersgruppen Europäische Kommission erteilt Zulassung für Prevenar 13 für Erwachsene von 18 bis 49 Jahren Berlin (17. Juli 2013) - Pfizer hat für den 13-valenten Pneumokokken-Konjugatimpfstoff
Pneumokokken-Schutz jetzt für alle Altersgruppen Europäische Kommission erteilt Zulassung für Prevenar 13 für Erwachsene von 18 bis 49 Jahren Berlin (17. Juli 2013) - Pfizer hat für den 13-valenten Pneumokokken-Konjugatimpfstoff
Erforderliche Schüsselkompetenzen für Biosimilars Hersteller
 Erforderliche Schüsselkompetenzen für Biosimilars Hersteller Dr. Hermann Allgaier Merckle Biotec GmbH BioGeneriX AG www.merckle-biotec.de www.biogenerix.com Hessisches Ministerium für Wirtschaft, InnovationsForum
Erforderliche Schüsselkompetenzen für Biosimilars Hersteller Dr. Hermann Allgaier Merckle Biotec GmbH BioGeneriX AG www.merckle-biotec.de www.biogenerix.com Hessisches Ministerium für Wirtschaft, InnovationsForum
Rekombinante Antikörper
 Frank Breitling und Stefan Dübel 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. Rekombinante Antikörper Technische
Frank Breitling und Stefan Dübel 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. Rekombinante Antikörper Technische
PHARMAZIE. Biosimilars. www.pharmuz.de. Gastherausgeber: Theo Dingermann. 41. Jahrgang 6 2012 ISSN 0048-3664 PHUZBI D 6544
 41. Jahrgang 6 2012 ISSN 0048-3664 PHUZBI D 6544 G2F-Menge der Originator-Produkt-Batches [%] 60 Klinik 50 PK/PD Änderung des Herstellungsprozesses 40 Präklinische Testung 30 Biologische 20 6 l 2012 10
41. Jahrgang 6 2012 ISSN 0048-3664 PHUZBI D 6544 G2F-Menge der Originator-Produkt-Batches [%] 60 Klinik 50 PK/PD Änderung des Herstellungsprozesses 40 Präklinische Testung 30 Biologische 20 6 l 2012 10
Zusätzliche Behandlungs möglichkeiten für Ihre Patienten
 Zusätzliche Behandlungs möglichkeiten für Ihre Patienten Über FoundationOne Bei dem validierten umfassenden Tumorprofil von FoundationOne wird die gesamte codierende Sequenz von 315 krebsassoziierten Genen
Zusätzliche Behandlungs möglichkeiten für Ihre Patienten Über FoundationOne Bei dem validierten umfassenden Tumorprofil von FoundationOne wird die gesamte codierende Sequenz von 315 krebsassoziierten Genen
Kinder mit seltenen Erkrankungen in klinischen Prüfungen-was gibt es aus ärztlicher Sicht zu beachten
 Kinder mit seltenen Erkrankungen in klinischen Prüfungen-was gibt es aus ärztlicher Sicht zu beachten Dr. med. Christina Lampe Zentrum für seltene Erkrankungen Helios Horst Schmidt Kliniken, (HSK) Wiesbaden,
Kinder mit seltenen Erkrankungen in klinischen Prüfungen-was gibt es aus ärztlicher Sicht zu beachten Dr. med. Christina Lampe Zentrum für seltene Erkrankungen Helios Horst Schmidt Kliniken, (HSK) Wiesbaden,
Wie funktioniert eine klinische Studie?
 Wie funktioniert eine klinische Studie? Bernhard Saller 3. Süddeutscher Hypophysen- und Nebennierentag München, 5. Mai 2007 Definitionen Ablauf klinischer Studien Klinische Arzneimittelprüfungen Zulassungsprozess
Wie funktioniert eine klinische Studie? Bernhard Saller 3. Süddeutscher Hypophysen- und Nebennierentag München, 5. Mai 2007 Definitionen Ablauf klinischer Studien Klinische Arzneimittelprüfungen Zulassungsprozess
Studienplan. Im einzelnen bedeuten
 1 Studienplan Im einzelnen bedeuten Stoffgebiet des Studiums der Pharmazie nach Anlage 1 [zu 2 (2)] der AAppO*): A B C D E F G H I K Allgemeine Chemie der Arzneistoffe, Hilfsstoffe und Schadstoffe Pharmazeutische
1 Studienplan Im einzelnen bedeuten Stoffgebiet des Studiums der Pharmazie nach Anlage 1 [zu 2 (2)] der AAppO*): A B C D E F G H I K Allgemeine Chemie der Arzneistoffe, Hilfsstoffe und Schadstoffe Pharmazeutische
IQWiG im Dialog 2015 Wie konfirmatorisch ist HTA? Zusammenfassung
 IQWiG im Dialog 2015 Wie konfirmatorisch ist HTA? Zusammenfassung Stefan Lange Stellvertretender Institutsleiter Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen Schluss mit lustig?? IQWiG
IQWiG im Dialog 2015 Wie konfirmatorisch ist HTA? Zusammenfassung Stefan Lange Stellvertretender Institutsleiter Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen Schluss mit lustig?? IQWiG
Specific regulatory requirements for. stem cell-based therapies. Dr. Jens Schletter, Cardion AG. Jens Schletter 19Feb03 1
 Specific regulatory requirements for stem cell-based therapies Dr. Jens Schletter, Cardion AG Jens Schletter 19Feb03 1 Spektrum möglicher Therapeutika: frühe Versuche Marcellus Empiricus De medicamentis
Specific regulatory requirements for stem cell-based therapies Dr. Jens Schletter, Cardion AG Jens Schletter 19Feb03 1 Spektrum möglicher Therapeutika: frühe Versuche Marcellus Empiricus De medicamentis
Regulatorischer Rahmen. Klassifizierung
 Regulatorischer Rahmen Erkenntnisgewinn zu Regenerations- und Reparaturprozessen des menschlichen Körpers führen zu neuen Arten innovativer und komplexer Produkte. Unter Regenerativer Medizin (kurz: RegMed)
Regulatorischer Rahmen Erkenntnisgewinn zu Regenerations- und Reparaturprozessen des menschlichen Körpers führen zu neuen Arten innovativer und komplexer Produkte. Unter Regenerativer Medizin (kurz: RegMed)
Biologics Center. We make Biologics happen!
 Biologics Center We make Biologics happen! Biologics gehören zu den wichtigsten Wachstumsmotoren der Pharmaindustrie. Sie liefern neuartige therapeutische Ansätze oder können bereits bestehende Ansätze
Biologics Center We make Biologics happen! Biologics gehören zu den wichtigsten Wachstumsmotoren der Pharmaindustrie. Sie liefern neuartige therapeutische Ansätze oder können bereits bestehende Ansätze
Änderungskontrolle. Anforderungen / Zitate aus den Rechtsvorschriften
 Änderungskontrolle Anforderungen / Zitate aus den Rechtsvorschriften Definition im Glossar zum Annex 15 (Qualifizierung und Validierung) des EU-GMP-Leitfadens: Die Änderungskontrolle ist ein formales System,
Änderungskontrolle Anforderungen / Zitate aus den Rechtsvorschriften Definition im Glossar zum Annex 15 (Qualifizierung und Validierung) des EU-GMP-Leitfadens: Die Änderungskontrolle ist ein formales System,
Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung
 Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn Gesundheit e.v. 10.
Beteiligung von Patienten an der Bewertung von Arzneimitteln bei der Zulassung und der Nutzen-Schaden- Bewertung U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte, Bonn Gesundheit e.v. 10.
Pflanzliche Inhaltsstoffe nutzbar machen: Der Weg von der Pflanze zum Nahrungsergänzungsmittel
 Pflanzliche Inhaltsstoffe nutzbar machen: Der Weg von der Pflanze zum Nahrungsergänzungsmittel Vital Solutions Swiss Haupstrasse 137 C Ch 8274 Tägerwilen Bbi - Breeding Botanicals International Haupstrasse
Pflanzliche Inhaltsstoffe nutzbar machen: Der Weg von der Pflanze zum Nahrungsergänzungsmittel Vital Solutions Swiss Haupstrasse 137 C Ch 8274 Tägerwilen Bbi - Breeding Botanicals International Haupstrasse
Zusammensetzung von Medikamenten Lehrerinformation
 02 / Medikamente Lehrerinformation 1/5 Arbeitsauftrag Ziel Sch lesen Text über die Wirkstoffe (LP trägt vor) Sch schreibt Schlüsselwörter an die WT Sch verfassen Kurztext zu den Wirkstoffarten Lösen der
02 / Medikamente Lehrerinformation 1/5 Arbeitsauftrag Ziel Sch lesen Text über die Wirkstoffe (LP trägt vor) Sch schreibt Schlüsselwörter an die WT Sch verfassen Kurztext zu den Wirkstoffarten Lösen der
AMTLICHE BEKANNTMACHUNG
 Nr. 6 vom 8. August 2007 AMTLICHE BEKANNTMACHUNG Hg.: Die Präsidentin der Referat Rechtsangelegenheiten in Studium und Lehre Änderung der Studienordnung für den Studiengang Pharmazie an der Vom 1. November
Nr. 6 vom 8. August 2007 AMTLICHE BEKANNTMACHUNG Hg.: Die Präsidentin der Referat Rechtsangelegenheiten in Studium und Lehre Änderung der Studienordnung für den Studiengang Pharmazie an der Vom 1. November
Die EU Clinical Trials Directive 2001/20 EC
 Die EU Clinical Trials Directive 2001/20 EC Konsequenzen für die chemischpharmazeutische Dokumentation von Klinischen Prüfpräparaten DGRA- Jahreskongress 2003 Dr. Susanne Keitel, BfArM Bonn, 22. Mai 2003
Die EU Clinical Trials Directive 2001/20 EC Konsequenzen für die chemischpharmazeutische Dokumentation von Klinischen Prüfpräparaten DGRA- Jahreskongress 2003 Dr. Susanne Keitel, BfArM Bonn, 22. Mai 2003
Translational Research Herausforderung für das Monitoring?
 Translational Research Herausforderung für das Monitoring? Karin Huber, M.Sc., Head of Monitoring CTC Nadine Bosbach, M.Sc., CRA Definition Translational Research Erste Zitate um 1993 Definitionen (T1,
Translational Research Herausforderung für das Monitoring? Karin Huber, M.Sc., Head of Monitoring CTC Nadine Bosbach, M.Sc., CRA Definition Translational Research Erste Zitate um 1993 Definitionen (T1,
Methylglyoxal in Manuka-Honig (Leptospermum scoparium):
 Methylglyoxal in Manuka-Honig (Leptospermum scoparium): Bildung, Wirkung, Konsequenzen DISSERTATION zur Erlangung des akademischen Grades Doctor rerum naturalium (Dr. rer. nat.) vorgelegt der Fakultät
Methylglyoxal in Manuka-Honig (Leptospermum scoparium): Bildung, Wirkung, Konsequenzen DISSERTATION zur Erlangung des akademischen Grades Doctor rerum naturalium (Dr. rer. nat.) vorgelegt der Fakultät
Hintergrundpapier der BIO Deutschland. zum Thema. Biosimilars
 Hintergrundpapier der BIO Deutschland zum Thema Biosimilars 06.03.2012 I. Einführung 1. Definition Biologische Arzneimittel ( Biologics ) werden unter Verwendung eines lebenden Systems oder Organismus
Hintergrundpapier der BIO Deutschland zum Thema Biosimilars 06.03.2012 I. Einführung 1. Definition Biologische Arzneimittel ( Biologics ) werden unter Verwendung eines lebenden Systems oder Organismus
Preise für innovative Arzneimittel Kommt das System an seine Grenzen?
 AOK-Forum live Potsdam, 28. April 2015 Preise für innovative Arzneimittel Kommt das System an seine Grenzen? Wolf-Dieter Ludwig Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); HELIOS Klinikum
AOK-Forum live Potsdam, 28. April 2015 Preise für innovative Arzneimittel Kommt das System an seine Grenzen? Wolf-Dieter Ludwig Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); HELIOS Klinikum
Aktuelles zu Neuartigen Therapien (ATMPs)
 Aktuelles zu Neuartigen Therapien (ATMPs) I. Reischl, PhD Institut Überwachung AGES/MEA Traisengasse 5, 1200 Wien Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Themen Klassifizierung
Aktuelles zu Neuartigen Therapien (ATMPs) I. Reischl, PhD Institut Überwachung AGES/MEA Traisengasse 5, 1200 Wien Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Themen Klassifizierung
Biotechnologische Herstellung von Chitosanen
 Für eine narbenfreie Wundheilung Biotechnologische Herstellung von Chitosanen Münster (7. April 2011) - Krabbenschalen liefern wertvolle Rohstoffe: sogenannte Chitosane. Diese Zuckerverbindungen können
Für eine narbenfreie Wundheilung Biotechnologische Herstellung von Chitosanen Münster (7. April 2011) - Krabbenschalen liefern wertvolle Rohstoffe: sogenannte Chitosane. Diese Zuckerverbindungen können
Wissen, worauf es ankommt
 Wissen, worauf es ankommt www.tuev-sued.de/akademie GmbH Westendstraße 160 80339 München Telefon: 089 5791 2389 E-Mail: akademie@tuev-sued.de Bleiben wir in Kontakt! AC46-Pharma-fly-210x297-w-15-07-03
Wissen, worauf es ankommt www.tuev-sued.de/akademie GmbH Westendstraße 160 80339 München Telefon: 089 5791 2389 E-Mail: akademie@tuev-sued.de Bleiben wir in Kontakt! AC46-Pharma-fly-210x297-w-15-07-03
Staat und privat? Session III Berlin, Prof. Dr. Helga Rübsamen-Schaeff
 Staat und privat? Session III Berlin, 7.7.2015 Prof. Dr. Helga Rübsamen-Schaeff Altestadt 2 40213 Düsseldorf Tel.: +49 0151 1176 1891 Fax: +49 202 317 63 1177 3 unterschiedliche Erfahrungen: Arbeiten im
Staat und privat? Session III Berlin, 7.7.2015 Prof. Dr. Helga Rübsamen-Schaeff Altestadt 2 40213 Düsseldorf Tel.: +49 0151 1176 1891 Fax: +49 202 317 63 1177 3 unterschiedliche Erfahrungen: Arbeiten im
Bezirksregierung Münster Dezernat 24 Domplatz Münster Fax: +49 (251)
 Bezirksregierungen Münster Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
Bezirksregierungen Münster Anzeige gemäß 67 Abs. 1 u. 2 AMG für die erlaubnisfreie Herstellung von Arzneimitteln durch Ärzte und zur Ausübung der Heilkunde bei Menschen befugten Personen gemäß 13 Abs.
PILLEN, PULVER, SALBEN PHARMAZIE UND PHARMAKOLOGIE Vom Kräutergarten zur Gentechnologie die Geschichte der Arzneimittel
 Arbeitsblätter mit Lösungen zur DVD 14064 PILLEN, PULVER, SALBEN PHARMAZIE UND PHARMAKOLOGIE Vom Kräutergarten zur Gentechnologie die Geschichte der Arzneimittel Arbeitsblätter mit Lösungen zur DVD 14064
Arbeitsblätter mit Lösungen zur DVD 14064 PILLEN, PULVER, SALBEN PHARMAZIE UND PHARMAKOLOGIE Vom Kräutergarten zur Gentechnologie die Geschichte der Arzneimittel Arbeitsblätter mit Lösungen zur DVD 14064
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs
 AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
AMNOG-Fachtagung des G-BA Besondere Therapiesituationen Bedingte Zulassung, Kinderarzneimittel und Orphan Drugs Martin Völkl, Director Market Access & Public Affairs, Celgene GmbH Warum forschen Pharmaunternehmen?
mglu5 Antagonisten zur Behandlung des Fragilen X Syndroms
 mglu5 Antagonisten zur Behandlung des Fragilen X Syndroms Georg Jaeschke, F. Hoffmann La Roche Fragiles X Syndrom mglur Theorie Martin-Bell Syndrom Fmr1 Gen identifiziert mglu5 MPEP FMRP hemmt Translation
mglu5 Antagonisten zur Behandlung des Fragilen X Syndroms Georg Jaeschke, F. Hoffmann La Roche Fragiles X Syndrom mglur Theorie Martin-Bell Syndrom Fmr1 Gen identifiziert mglu5 MPEP FMRP hemmt Translation
Die Ereignisse um Biotrial 2016
 Michael Wolzt michael.wolzt@meduniwien.ac.at Klinische Pharmakologie Medizinische Universität Wien Die Ereignisse um Biotrial 2016 Mar 2016 Disclaimer Diese Präsentation beruht auf öffentlich verfügbaren
Michael Wolzt michael.wolzt@meduniwien.ac.at Klinische Pharmakologie Medizinische Universität Wien Die Ereignisse um Biotrial 2016 Mar 2016 Disclaimer Diese Präsentation beruht auf öffentlich verfügbaren
Prof. Dr. Stephan Ludwig. Institut für Molekulare Virologie (IMV)
 Cystus052, ein polyphenolreicher Pflanzenextrakt wirkt gegen Grippeviren durch Blockierung des Viruseintritts in die Wirtszelle Prof. Dr. Stephan Ludwig Institut für Molekulare Virologie (IMV) Die Virusgrippe
Cystus052, ein polyphenolreicher Pflanzenextrakt wirkt gegen Grippeviren durch Blockierung des Viruseintritts in die Wirtszelle Prof. Dr. Stephan Ludwig Institut für Molekulare Virologie (IMV) Die Virusgrippe
Tapentadol weiterhin keine nachhaltige therapeutische Verbesserung belegt
 AG AMV Arbeitsgruppe Arzneimittelvereinbarung Gemeinsame Information der KVWL und der Verbände der Krankenkassen in Westfalen-Lippe Datum: Oktober 2014 Tapentadol weiterhin keine nachhaltige therapeutische
AG AMV Arbeitsgruppe Arzneimittelvereinbarung Gemeinsame Information der KVWL und der Verbände der Krankenkassen in Westfalen-Lippe Datum: Oktober 2014 Tapentadol weiterhin keine nachhaltige therapeutische
Projektskizze: Studie/ Auswertung/ Publikation
 Projektskizze: Studie/ Auswertung/ Publikation Name: PD Dr. Dr. Robert Bals, CAPNetz C11 Datum: 30. 8. 2007 Institution(en)/Autor(en): Klinikum der Universität Marburg Klinik für Innere Medizin mit Schwerpunkt
Projektskizze: Studie/ Auswertung/ Publikation Name: PD Dr. Dr. Robert Bals, CAPNetz C11 Datum: 30. 8. 2007 Institution(en)/Autor(en): Klinikum der Universität Marburg Klinik für Innere Medizin mit Schwerpunkt
Die antivirale Therapie der chronischen Hepatitis B: Identifikation neuer Resistenzmutationen und Optimierung der Verlaufskontrolle
 Angefertigt am Fachbereich 08 - Biologie und Chemie in Zusammenarbeit mit dem Institut für Medizinische Virologie am Fachbereich 11- Medizin der Justus-Liebig-Universität Gießen Die antivirale Therapie
Angefertigt am Fachbereich 08 - Biologie und Chemie in Zusammenarbeit mit dem Institut für Medizinische Virologie am Fachbereich 11- Medizin der Justus-Liebig-Universität Gießen Die antivirale Therapie
Europäische Rahmenverordnung (EG) Nr. 1935/2004. Gute Herstellungspraxis nach Verordnung (EG) Nr. 2023/2006
 Seite 1 von 5 TÜV Rheinland LGA Products - Information 05/2016 Inhalt und Umfang von Konformitätserklärungen Entsprechend des Artikel 16 der Verordnung (EG) Nr. 1935/2004 über Materialien und Gegenstände,
Seite 1 von 5 TÜV Rheinland LGA Products - Information 05/2016 Inhalt und Umfang von Konformitätserklärungen Entsprechend des Artikel 16 der Verordnung (EG) Nr. 1935/2004 über Materialien und Gegenstände,
Qualität von Publikationen randomisierter Nicht-Unterlegenheitsund Äquivalenzstudien
 Qualität von Publikationen randomisierter Nicht-Unterlegenheitsund Äquivalenzstudien, Nicole Burchardi, Michael Niestroj, Meinhard Kieser Nicht-Unterlegenheit und Äquivalenz Überlegenheit Test vs. Placebo
Qualität von Publikationen randomisierter Nicht-Unterlegenheitsund Äquivalenzstudien, Nicole Burchardi, Michael Niestroj, Meinhard Kieser Nicht-Unterlegenheit und Äquivalenz Überlegenheit Test vs. Placebo
Kontinuierliche Produktion - die Zukunft der Arzneimittelherstellung aus FDA-Sicht
 Kontinuierliche Produktion - die Zukunft der Arzneimittelherstellung aus FDA-Sicht von Dr. Sabine Paris Im September 2014 hat sich in Washington die GMP-Welt zur jährlichen gemeinsamen Konferenz von PDA
Kontinuierliche Produktion - die Zukunft der Arzneimittelherstellung aus FDA-Sicht von Dr. Sabine Paris Im September 2014 hat sich in Washington die GMP-Welt zur jährlichen gemeinsamen Konferenz von PDA
Basisstationen und Notwendigkeit epidemiologischer Untersuchungen
 Basisstationen und Notwendigkeit epidemiologischer Untersuchungen Dr. med. Bernhard Aufdereggen, Aertzinnen und Aerzte für Umweltschutz Meine Sicht ist geprägt durch: Meine Erfahrung als Arzt Meine Erfahrung
Basisstationen und Notwendigkeit epidemiologischer Untersuchungen Dr. med. Bernhard Aufdereggen, Aertzinnen und Aerzte für Umweltschutz Meine Sicht ist geprägt durch: Meine Erfahrung als Arzt Meine Erfahrung
Post-Market-Surveillance & PMCF Wann ist eine PMCF-Studie angezeigt? PD Dr. med. Ulrich Matern
 Post-Market-Surveillance & PMCF Wann ist eine PMCF-Studie angezeigt? PD Dr. med. Ulrich Matern Das Gesetz Clinical investigations shall be performed unless it is duly justified to rely on existing clinical
Post-Market-Surveillance & PMCF Wann ist eine PMCF-Studie angezeigt? PD Dr. med. Ulrich Matern Das Gesetz Clinical investigations shall be performed unless it is duly justified to rely on existing clinical
Bedeutung von Zellkulturen für f die industrielle Biotechnologie. Dr. Christine Rascher-Bang 06. Dezember 2011
 Bedeutung von Zellkulturen für f die industrielle Biotechnologie Der ABAS im Dialog mit der industriellen Biotechnologie Dr. Christine Rascher-Bang 06. Dezember 2011 Zellkulturen. sind in den letzten Jahrzehnten
Bedeutung von Zellkulturen für f die industrielle Biotechnologie Der ABAS im Dialog mit der industriellen Biotechnologie Dr. Christine Rascher-Bang 06. Dezember 2011 Zellkulturen. sind in den letzten Jahrzehnten
GMP-Konformität ausländischer Wirkstoffhersteller
 GMP-Konformität ausländischer Wirkstoffhersteller Michel Keller, Swissmedic März 2005: GMP-Konformität 1 Überblick Gesetzliche Anforderungen in der CH Infos zum GMP-Status ausländischer Hersteller Situation
GMP-Konformität ausländischer Wirkstoffhersteller Michel Keller, Swissmedic März 2005: GMP-Konformität 1 Überblick Gesetzliche Anforderungen in der CH Infos zum GMP-Status ausländischer Hersteller Situation
Institut für Medizinische Biometrie, Epidemiologie und Informatik WIE ENTSTEHT WISSEN? EVIDENZBASIERTE MEDIZIN
 WIE ENTSTEHT WISSEN? EVIDENZBASIERTE MEDIZIN 1 Gliederung Wieso EbM? Was ist EbM? Organisatorisches Wieso EbM? Frau Müller, 37y inflammatorisches MammaCa nach 1y: Progress wünscht sich Zellkernklärung
WIE ENTSTEHT WISSEN? EVIDENZBASIERTE MEDIZIN 1 Gliederung Wieso EbM? Was ist EbM? Organisatorisches Wieso EbM? Frau Müller, 37y inflammatorisches MammaCa nach 1y: Progress wünscht sich Zellkernklärung
MM Proteinmodelling. Michael Meyer. Vorlesung XVII
 Proteinmodelling Vorlesung XVII Proteinstrukturen Es besteht ein sehr großer Bedarf an Proteinstrukturen: Die Kenntnis der 3D-Struktur hat große Vorteile für das Design neuer Wirkstoffe. Experimentelle
Proteinmodelling Vorlesung XVII Proteinstrukturen Es besteht ein sehr großer Bedarf an Proteinstrukturen: Die Kenntnis der 3D-Struktur hat große Vorteile für das Design neuer Wirkstoffe. Experimentelle
Taschenatla s der Biotechnologie und Gentechni k
 Rolf D. Schmi d Taschenatla s der Biotechnologie und Gentechni k 2. Auflage Inhalt Sperialitate n Vitamine... 5 4 Vorwort... IX Nucleoside und Nucleotide... 56 Vorwort zur 2. Auflage... X Biotenside und
Rolf D. Schmi d Taschenatla s der Biotechnologie und Gentechni k 2. Auflage Inhalt Sperialitate n Vitamine... 5 4 Vorwort... IX Nucleoside und Nucleotide... 56 Vorwort zur 2. Auflage... X Biotenside und
Kombinationsprodukte, Anforderungen aus dem Medizinprodukterecht
 , Anforderungen aus dem Medizinprodukterecht Referent: Dipl. Ing. Michael Schrack Reutlingen, den 25.11.2011 Schrack & Partner; Ingenieure, Naturwissenschaftler Gerhard-Kindler-Straße 6, 72770 Reutlingen
, Anforderungen aus dem Medizinprodukterecht Referent: Dipl. Ing. Michael Schrack Reutlingen, den 25.11.2011 Schrack & Partner; Ingenieure, Naturwissenschaftler Gerhard-Kindler-Straße 6, 72770 Reutlingen
Dissertation zur Erlangung des Doktorgrades der Ernährungswissenschaften (Dr. troph.)
 Wissenschaftliche Substantiierung von gesundheitsbezogenen Angaben über Lebensmittel innerhalb der Europäischen Union Unter besonderer Berücksichtigung der EFSA-Gutachten zu gesundheitsbezogenen Angaben
Wissenschaftliche Substantiierung von gesundheitsbezogenen Angaben über Lebensmittel innerhalb der Europäischen Union Unter besonderer Berücksichtigung der EFSA-Gutachten zu gesundheitsbezogenen Angaben
Jahrestagung House of Pharma
 Jahrestagung House of Pharma Biosimilars Dr. Manja Epping Bild einfügen (Cover Small) zur Image Library Frankfurt, 18. September 2012 Inhalt 01 > Was sind Biosimilars? 02 > Was macht Biosimilars so besonders?
Jahrestagung House of Pharma Biosimilars Dr. Manja Epping Bild einfügen (Cover Small) zur Image Library Frankfurt, 18. September 2012 Inhalt 01 > Was sind Biosimilars? 02 > Was macht Biosimilars so besonders?
Pittfalls in der Autoimmundiagnostik. Initiiated and supported by
 Pittfalls in der Autoimmundiagnostik Fallen in der Autoimmundiagnostik Der Fluch des englischen Geistlichen Thomas Bayes Weniger ist oft mehr Fehlende Standardisierung von Tests Thomas Bayes 1702-1761,
Pittfalls in der Autoimmundiagnostik Fallen in der Autoimmundiagnostik Der Fluch des englischen Geistlichen Thomas Bayes Weniger ist oft mehr Fehlende Standardisierung von Tests Thomas Bayes 1702-1761,
GVP Module V Risk Management Systems
 GVP Module V Risk Management Systems Dr. Susanne Wolf Institut für Pharmakovigilanz AGES Gespräche Wien, 26.04.2012 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Guideline on good
GVP Module V Risk Management Systems Dr. Susanne Wolf Institut für Pharmakovigilanz AGES Gespräche Wien, 26.04.2012 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Guideline on good
Verfahrensweise zur Festlegung der Identität eines Biozid-Produktes im Zulassungsbescheid
 Verfahrensweise zur Festlegung der Identität eines Biozid-Produktes im Zulassungsbescheid Zur Zulassung eines Biozid-Produktes ist seine Identität festzulegen. Dazu sind vom Antragsteller ausführliche
Verfahrensweise zur Festlegung der Identität eines Biozid-Produktes im Zulassungsbescheid Zur Zulassung eines Biozid-Produktes ist seine Identität festzulegen. Dazu sind vom Antragsteller ausführliche
Hohlräume der Natur füllen.
 Hohlräume der Natur füllen. 1 Daten in Akten bei RTI Biologics, Inc. 2 Schoepf C. Allograft safety: the efficacy of the Tutoplast Process. Implants: International Magazine of Oral Implantology. 2006;1(7):
Hohlräume der Natur füllen. 1 Daten in Akten bei RTI Biologics, Inc. 2 Schoepf C. Allograft safety: the efficacy of the Tutoplast Process. Implants: International Magazine of Oral Implantology. 2006;1(7):
Which data and when?
 PRO-data for market access in Germany where and when? Frank-Ulrich Fricke PRO-data for market access in Germany where and when? AMNOG the German assessment Which data and when? Requirements to be met Seite
PRO-data for market access in Germany where and when? Frank-Ulrich Fricke PRO-data for market access in Germany where and when? AMNOG the German assessment Which data and when? Requirements to be met Seite
Streitgegenstand Biosimilars: rechtliche Aspekte und Produkthaftung Markus Ambrosius Rechtsanwalt bei Sträter Rechtsanwälte, Bonn
 Pressekonferenz der Korporativen Mitglieder der Deutschen Gesellschaft für Innere Medizin e. V. (DGIM) Biosimilars wenn das Gleiche nicht dasselbe ist Termin: Montag, 20. April 2015, 13.30 bis 14.00 Uhr
Pressekonferenz der Korporativen Mitglieder der Deutschen Gesellschaft für Innere Medizin e. V. (DGIM) Biosimilars wenn das Gleiche nicht dasselbe ist Termin: Montag, 20. April 2015, 13.30 bis 14.00 Uhr
Dr. Johannes Knollmeyer Direktor Gesundheitspolitik Sanofi-Aventis Deutschland GmbH
 Versorgungsforschungskongress 2015 Versorgungforschung und klinische Forschung: Synergien und Alleinstellungsmerkmale Perspektive der pharmazeutischen Industrie Dr. Johannes Knollmeyer Direktor Gesundheitspolitik
Versorgungsforschungskongress 2015 Versorgungforschung und klinische Forschung: Synergien und Alleinstellungsmerkmale Perspektive der pharmazeutischen Industrie Dr. Johannes Knollmeyer Direktor Gesundheitspolitik
Neue Medikamente bei der progredienten MS. Brigitte Wildemann, Neurologische Klinik Universitätsklinikum Heidelberg
 Neue Medikamente bei der progredienten MS Brigitte Wildemann, Neurologische Klinik Universitätsklinikum Heidelberg Progrediente MS Formen der progredienten MS SPMS PPMS sekundär chronisch >> primär chronisch
Neue Medikamente bei der progredienten MS Brigitte Wildemann, Neurologische Klinik Universitätsklinikum Heidelberg Progrediente MS Formen der progredienten MS SPMS PPMS sekundär chronisch >> primär chronisch
Eine Broschüre für interessierte Leser. Biosimilars. Chancen in der Therapie mit der neuen Generation von Arzneimitteln. Die mit dem Regenbogen
 Eine Broschüre für interessierte Leser Biosimilars Chancen in der Therapie mit der neuen Generation von Arzneimitteln Die mit dem Regenbogen 1 Inhalt Von der Brot-, Wein- und Bierherstellung zur Produktion
Eine Broschüre für interessierte Leser Biosimilars Chancen in der Therapie mit der neuen Generation von Arzneimitteln Die mit dem Regenbogen 1 Inhalt Von der Brot-, Wein- und Bierherstellung zur Produktion
POST MARKET CLINICAL FOLLOW UP
 POST MARKET CLINICAL FOLLOW UP (MEDDEV 2.12-2 May 2004) Dr. med. Christian Schübel 2007/47/EG Änderungen Klin. Bewertung Historie: CETF Report (2000) Qualität der klinischen Daten zu schlecht Zu wenige
POST MARKET CLINICAL FOLLOW UP (MEDDEV 2.12-2 May 2004) Dr. med. Christian Schübel 2007/47/EG Änderungen Klin. Bewertung Historie: CETF Report (2000) Qualität der klinischen Daten zu schlecht Zu wenige
Biosimilar- Arzneimittel wissen sollten. Was Sie über
 Europäische Kommission Was Sie über Biosimilar- Arzneimittel wissen sollten Prozess zur unternehmerischen Verantwortung auf dem Gebiet der Pharmazeutika Zugang zu Medikamenten in Europa Konsensinformationsdokument
Europäische Kommission Was Sie über Biosimilar- Arzneimittel wissen sollten Prozess zur unternehmerischen Verantwortung auf dem Gebiet der Pharmazeutika Zugang zu Medikamenten in Europa Konsensinformationsdokument
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen
 Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Sumatriptan Antrag auf Freistellung von der Verschreibungspflicht mit Beschränkungen Sachverständigen-Ausschuss für Verschreibungspflicht 62. Sitzung am 13.01.2009 im Bundesinstitut für Arzneimittel- und
Perspektiven mit Tarceva und Avastin
 Fortgeschrittenes NSCLC: Perspektiven mit Tarceva und Avastin Mannheim (20. März 2009) - Die Behandlung des fortgeschrittenen nicht-kleinzelligen Lungenkarzinoms (Non Small Cell Lung Cancer, NSCLC) mit
Fortgeschrittenes NSCLC: Perspektiven mit Tarceva und Avastin Mannheim (20. März 2009) - Die Behandlung des fortgeschrittenen nicht-kleinzelligen Lungenkarzinoms (Non Small Cell Lung Cancer, NSCLC) mit
Metalle und Reach - eine Zwischenbilanz Dortmund, 10. November 2014 Zulassungspflichten für Anhang XIV-Stoffe in Rezyklaten Dr.
 Metalle und Reach - eine Zwischenbilanz Dortmund, 10. November 2014 Zulassungspflichten für Anhang XIV-Stoffe in Rezyklaten Dr. Claus Haas Bundesstelle für Chemikalien Inhalt Zulassung - Vergleich Primärherstellung
Metalle und Reach - eine Zwischenbilanz Dortmund, 10. November 2014 Zulassungspflichten für Anhang XIV-Stoffe in Rezyklaten Dr. Claus Haas Bundesstelle für Chemikalien Inhalt Zulassung - Vergleich Primärherstellung
Orphan Drugs. Arzneimitteltherapie seltener Krankheiten
 Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
Orphan Drugs Arzneimitteltherapie seltener Krankheiten Seltene Krankheiten 30 Millionen Europäer, davon etwa 4 Millionen Deutsche, leiden an seltenen Krankheiten. Als selten gilt hier eine Krankheit, wenn
WILLKOMMEN im virtuellen Konferenzraum
 DLR-PT.de Folie 1 WILLKOMMEN im virtuellen Konferenzraum Klinische Studien mit hoher Relevanz für die Versorgung älterer und hochaltriger Patientinnen und Patienten Das Web-Seminar beginnt um 10:00 Uhr.
DLR-PT.de Folie 1 WILLKOMMEN im virtuellen Konferenzraum Klinische Studien mit hoher Relevanz für die Versorgung älterer und hochaltriger Patientinnen und Patienten Das Web-Seminar beginnt um 10:00 Uhr.
Einzelfallentscheide und Profiling.
 Modul 2, 26. September 2016 Webinar@Weblaw: DSGVO Bearbeitung von Personendaten, Einwilligungserklärung, Einzelfallentscheide. Nicolas Passadelis Einzelfallentscheide und Profiling. Inhaltsverzeichnis.
Modul 2, 26. September 2016 Webinar@Weblaw: DSGVO Bearbeitung von Personendaten, Einwilligungserklärung, Einzelfallentscheide. Nicolas Passadelis Einzelfallentscheide und Profiling. Inhaltsverzeichnis.
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie
 AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
AMNOG: Wenn Innovation aufs System trifft: Ist das AMNOG System fit für Innovation- Beispiel Onkologie Dr. Jutta Wendel-Schrief Direktor Market Access MSD SHARP & DOHME GMBH Was sind Innovationen? Neue
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU - Kombination mit Sulfonylharnstoff n
 Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Indikationserweiterungen für JANUVIA (Sitagliptin, MSD) in der EU Kombination mit Sulfonylharnstoff nun ebenfalls zugelassen Haar (März 2008) - Die europäische Arzneimittelbehörde EMEA hat JANUVIA für
Einstufung von Änderungen
 Einstufung von Änderungen Mag. Caroline Kleber AGES MEA, Wien AGES-Gespräch, 24. Juni 2014 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Aufbau und Zusammenhänge Variation Regulation
Einstufung von Änderungen Mag. Caroline Kleber AGES MEA, Wien AGES-Gespräch, 24. Juni 2014 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Aufbau und Zusammenhänge Variation Regulation
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen
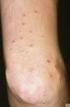 Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Ekzemschübe bei atopischer Dermatitis vermeiden Protopic Salbe jetzt zur proaktiven Therapie zugelassen München (1. Mai 2009) Die europäische Arzneimittelagentur EMEA hat mit Wirkung zum 1. Mai 2009 Protopic
Kostenexplosion im CH Gesundheitswesen: Bringen TEVA Generika die Lösung? Handelskammer Schweiz-Israel 30. Januar 2014
 Kostenexplosion im CH Gesundheitswesen: Bringen TEVA Generika die Lösung? Handelskammer Schweiz-Israel 30. Januar 2014 Andreas Bosshard General Manager Mepha/Teva Inhalt Generika: Definition, Entwicklung
Kostenexplosion im CH Gesundheitswesen: Bringen TEVA Generika die Lösung? Handelskammer Schweiz-Israel 30. Januar 2014 Andreas Bosshard General Manager Mepha/Teva Inhalt Generika: Definition, Entwicklung
Biologicals Innovationen der besonderen Art. Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie JWG-Universität Frankfurt.
 Biologicals Innovationen der besonderen Art Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie JWG-Universität Frankfurt Arzneimittel sind Stoffe oder Stoffgemische unterschiedlicher chemischer
Biologicals Innovationen der besonderen Art Prof. Dr. Theo Dingermann Institut für Pharmazeutische Biologie JWG-Universität Frankfurt Arzneimittel sind Stoffe oder Stoffgemische unterschiedlicher chemischer
17. März 2011 Deutsches Patent- und Markenamt. Dr. Christopher Brückner
 Definition des Erzeugnisses in Abhängigkeit von der pharmakologischen Wirkung Verhältnis zu Erwägungsgrund 14 der EG-Verordnung 1610/96 und Auswirkungen für die pharmazeutische Industrie 17. März 2011
Definition des Erzeugnisses in Abhängigkeit von der pharmakologischen Wirkung Verhältnis zu Erwägungsgrund 14 der EG-Verordnung 1610/96 und Auswirkungen für die pharmazeutische Industrie 17. März 2011
Neues in der Diagnose der Tuberkulose
 Neues in der Diagnose der Tuberkulose Klinische Diagnose Dr. med. Alexander Turk Zürcher Höhenklinik Wald alexander.turk@zhw.ch Tuberkulose in Homo erectus vor 500 000 Jahren? AMERICAN JOURNAL OF PHYSICAL
Neues in der Diagnose der Tuberkulose Klinische Diagnose Dr. med. Alexander Turk Zürcher Höhenklinik Wald alexander.turk@zhw.ch Tuberkulose in Homo erectus vor 500 000 Jahren? AMERICAN JOURNAL OF PHYSICAL
Gute Klinische Praxis : Prüfungsmaßstäbe für die Ethik-Kommission
 Gute Klinische Praxis : Prüfungsmaßstäbe für die Ethik-Kommission ass. iur. Jan Paus, LL.M. Rechtsreferent Ethik-Kommission der Ärztekammer Westfalen-Lippe und der Medizinischen Fakultät der WWU Münster
Gute Klinische Praxis : Prüfungsmaßstäbe für die Ethik-Kommission ass. iur. Jan Paus, LL.M. Rechtsreferent Ethik-Kommission der Ärztekammer Westfalen-Lippe und der Medizinischen Fakultät der WWU Münster
IMPACT. IMmunoglobulins Purified for Anti- Cancer Therapy
 IMPACT IMmunoglobulins Purified for Anti- Cancer Therapy Bis zu 3% der Blutspender besitzen Plasma mit starker zytotoxischer Wirkung gegen bestimmte Tumore. Die tumorspezifische, zytotoxische Wirkung basiert
IMPACT IMmunoglobulins Purified for Anti- Cancer Therapy Bis zu 3% der Blutspender besitzen Plasma mit starker zytotoxischer Wirkung gegen bestimmte Tumore. Die tumorspezifische, zytotoxische Wirkung basiert
Rekombinante Antikorperfragmente fur die. Zoonosediagnostik
 Rekombinante Antikorperfragmente fur die Zoonosediagnostik Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des Grades eines Doktors
Rekombinante Antikorperfragmente fur die Zoonosediagnostik Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des Grades eines Doktors
Forderungen der DGHO unter Berücksichtigung der Rolle von Ethik-Kommissionen und des Bundesamts für Strahlenschutz (BfS) bei Klinischen Studien
 Berlin, 17.6.2014: Pressekonferenz: Die neue EU-Verordnung zu klinischen Studien eine Chance für den Forschungsstandort Deutschland Forderungen der DGHO unter Berücksichtigung der Rolle von Ethik-Kommissionen
Berlin, 17.6.2014: Pressekonferenz: Die neue EU-Verordnung zu klinischen Studien eine Chance für den Forschungsstandort Deutschland Forderungen der DGHO unter Berücksichtigung der Rolle von Ethik-Kommissionen
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic )
 Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Calcineurininhibitoren zur topischen Anwendung: Pimecrolimus und Tacrolimus (Elidel, Douglan und Protopic ) Ergebnisse der europäischen Risiko- Bewertungs-Verfahren Anlass für die Risikobewertungsverfahren
Anmeldungsübersicht Jogustine
 Anmeldungsübersicht Jogustine 1. Semester Pharmazeutische Chemie - Vorlesungen: 09.126.000 Grundlagen zur allg. und anorganischen Chemie sowie zu anorganischen Arzneistoffen I (PD Dr. rer. Nat. Holger
Anmeldungsübersicht Jogustine 1. Semester Pharmazeutische Chemie - Vorlesungen: 09.126.000 Grundlagen zur allg. und anorganischen Chemie sowie zu anorganischen Arzneistoffen I (PD Dr. rer. Nat. Holger
WB 11 Aufgabe: Hypothesentest 1
 WB 11 Aufgabe: Hypothesentest 1 Ein Medikament, das das Überleben eines Patienten sichern soll, wird getestet. Stelle Null- und Alternativhypothese auf und beschreibe die Fehler 1. Art und 2. Art. Welcher
WB 11 Aufgabe: Hypothesentest 1 Ein Medikament, das das Überleben eines Patienten sichern soll, wird getestet. Stelle Null- und Alternativhypothese auf und beschreibe die Fehler 1. Art und 2. Art. Welcher
Ergebnisprotokoll 3. Treffen Swissmedic Arbeitsgruppe Patienten- und Konsumentenorganisationen
 Ergebnisprotokoll 3. Treffen Swissmedic Arbeitsgruppe Patienten- und Konsumentenorganisationen Traktandum Freitag, 21. November 2014, 14.15 bis 17:30 Uhr Swissmedic Hallerstrasse 7, 3000 Bern, Sitzungszimmer
Ergebnisprotokoll 3. Treffen Swissmedic Arbeitsgruppe Patienten- und Konsumentenorganisationen Traktandum Freitag, 21. November 2014, 14.15 bis 17:30 Uhr Swissmedic Hallerstrasse 7, 3000 Bern, Sitzungszimmer
GESUNDHEIT ANDERS BETRACHTET
 GESUNDHEIT ANDERS BETRACHTET GESUND WERDEN AUF ANDERE WEISE 2 Durchblutung Gewebereparatur Entzündung Schmerz Gesund zu sein ist für die meisten Menschen etwas ganz Selbstverständliches. Doch manchmal
GESUNDHEIT ANDERS BETRACHTET GESUND WERDEN AUF ANDERE WEISE 2 Durchblutung Gewebereparatur Entzündung Schmerz Gesund zu sein ist für die meisten Menschen etwas ganz Selbstverständliches. Doch manchmal
Globales Risikomanagement der Novartis
 Globales Risikomanagement der Novartis Dr. Urban Gruntz Leiter Novartis Konzernabteilung Risikomanagement BWL Konferenz (Schaffhausen), 9 September 2008 Übersicht Novartis weltweit im Überblick: Kennzahlen,
Globales Risikomanagement der Novartis Dr. Urban Gruntz Leiter Novartis Konzernabteilung Risikomanagement BWL Konferenz (Schaffhausen), 9 September 2008 Übersicht Novartis weltweit im Überblick: Kennzahlen,
Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom
 Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
Prof. Dr. Gerald Mickisch: Avastin First-Line - Überzeugendes Therapiekonzept bei fortgeschrittenem Ni Avastin First-Line Überzeugendes Therapiekonzept bei fortgeschrittenem Nierenzellkarzinom Von Prof.
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM
 KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
KURZFASSUNG DES PRÜFPROTOKOLLS 1839IL/0079 VOM 11.11.02 RANDOMISIERTE, OFFENE, NICHT-KOMPARATIVE PHASE II STUDIE ZUR BEURTEILUNG DER WIRKSAMKEIT UND VERTRÄGLICHKEIT VON ZWEI DOSIERUNGEN ZD1839 BEI PATIENTEN
Forschung und Entwicklung
 Forschung und Entwicklung Wir sind innerhalb der pharmazeutischen Industrie in Bezug auf Forschung und Entwicklung samt zugehörigen Investitionen führend. Die Entdeckung und Entwicklung eines neuen Wirkstoffs
Forschung und Entwicklung Wir sind innerhalb der pharmazeutischen Industrie in Bezug auf Forschung und Entwicklung samt zugehörigen Investitionen führend. Die Entdeckung und Entwicklung eines neuen Wirkstoffs
