PRAKTISCHE ÜBUNGEN IN GENETIK FÜR FORTGESCHRITTENE. Protokoll FÜR LEHRAMTSKANDIDATEN
|
|
|
- Daniela Gerber
- vor 7 Jahren
- Abrufe
Transkript
1 Universität zu Köln Institut für Genetik 8. April 2001 PRAKTISCHE ÜBUNGEN IN GENETIK FÜR FORTGESCHRITTENE FÜR LEHRAMTSKANDIDATEN WS 2000/2001 Protokoll Versuchsleiter: Dr. Fußwinkel Dr. Kisters-Woike Dr. Cramer Dr. Reiners
2 BAKTERIENGENETIK Übersicht der Versuche I. Isolierung von DNA aus Zwiebeln II. Restriktionsspaltung von Plasmid- und Lambda-DNA III. Ligation der Fragmente IV. Genetische Transformation V. Plasmidpräparation aus Übernachtkultur VI. Versuchstag EDV-Recherche Einleitung Da dieses Praktikum vor allem für Lehramtskandidaten angeboten wird, wurde besonderen Wert darauf gelegt, dass die durchgeführten Versuche in dieser oder ähnlicher Form auch im Schulunterricht angewendet werden können. Um dieses Ziel zu erreichen, mussten Versuche so abgewandelt werden, dass durch Verwendung alternativer Chemikalien eine Gefährdung von Schülern ausgeschlossen werden kann. Weiterhin mussten die Versuche so konzipiert sein, dass auch ungeübte Schüler, die mit den Techniken nicht vertraut sind, eine Möglichkeit haben, die erwarteten Ergebnisse zu erzielen. Als Grundlage für die durchgeführten Versuche diente im Wesentlichen die vorliegende Hausarbeit zur ersten Staatsprüfung für Lehrämter aus dem Jahr 1996 von Volkmar Menz (s. Literaturliste). Die Reihenfolge der Versuche wurde im Vergleich zu den Lehrer- und Schülermanualen der Hausarbeit leicht verändert: molekulare Klonierung in E. coli Restriktion der beiden DNAs Gelelektrophorese Ligation Transformation Plasmidpräparation Restriktion Gelelektrophorese
3 Versuch I: Isolierung von DNA aus Zwiebeln Einleitung Bei diesem Versuchsteil ging es darum, mit einem möglichst einfachen Versuch, DNA und RNA aus pflanzlichem Material zu isolieren. Wir verwendeten, der Versuchsanleitung entsprechend, Zwiebeln. Die Versuchsdurchführung ist jedoch auch mit anderen Früchten, z.b. Tomaten, möglich. Die mit dieser Methode isolierte DNA ist nicht sehr rein. Sinn des Versuches ist es auch vielmehr, Schülern mit sehr einfachen Mitteln und ohne aufwändige Vorbereitung einen genetischen Versuch anbieten zu können, in dem DNA eindrucksvoll isoliert, und somit greifbar gemacht wird. Material und Methoden Die Versuchsdurchführung erfolgte anhand des Skripts, S. 98/99. Um die Zellwände aufzubrechen, wurde eine Zwiebel grob zerschnitten und anschließend mit Hilfe von Zentrifugenröhrchen zerdrückt. Die Zwiebel wurde daraufhin in eine Lösung aus 3g Kochsalz, 3ml Spülmittel (Konzentrat) und 100ml Wasser gegeben. Nach 15 Minuten in einem 60 C warmen Wasserbad wurde das Gemisch in einem Eisbad abgekühlt. Die Erwärmung diente dazu, DNAsen zu denaturieren, die anschließende Abkühlung sollte eine zu starke Schädigung der DNA durch Hitze verhindern. Das Gemisch wurde geschüttelt und durch einen gewöhnlichen Kaffeefilter geschüttet, um die Zellwandbestandteile von den Übrigen Bestandteilen der Lösung zu trennen. Übrig waren darin jetzt außer DNA und RNA noch Proteine. Um diese abzubauen, wurde etwas Feinwaschmittel zugefügt, in dem Proteasen enthalten sind. Abschließend wurden auf 10ml der Lösung noch die gleiche Menge an eiskaltem Ethanol gegeben. Die DNA wurde ausgefällt. Da sie sich in Ethanol nicht löst, konnte sie vorsichtig mit einer Impföse oder einer Eppendorf-Pipette abgenommen und getrocknet werden. Die getrocknete DNA wurde durch Zugabe von TE-Puffer wieder gelöst und so zur Analyse durch die Gelelektrophorese vorbereitet. Drei verschiedene Ansätze mit unterschiedlichen der DNA-Lösung wurde in die Taschen des Gels gegeben:
4 Tabelle 1: Ansätze zur gelelektrophoretischen Untersuchung der isolierten Zwiebel-DNA Tasche 1 Tasche 2 Tasche 3 Zwiebel-DNA 1µl 3µl 5µl TBE-Puffer (10x) 1µl 1µl 1µl Blaumarker (10x) 1µl 1µl 1µl H 2 O 7µl 5µl 3µl Σ 10µl 10µl 10µl Die beladenen Gele liefen für etwa 2 Stunden bei 60V in der Gelkammer. Gegen Versuchsende wurde die Spannung auf etwa 100V erhöht, um den Ablauf zu beschleunigen. Um auf Ethidiumbromid verzichten zu können (Schulversuch), wurden die Gele mit Azurblau gefärbt. Die Färbung dauerte etwa 15 Minuten, danach wurden die Gele gründlich ausgewaschen. Ergebnis Auf dem Gel konnte man drei Laufbahnen erkennen. Bei keiner der Laufbahnen ließen sich jedoch klar abgegrenzte Banden erkennen, die Bandenmuster waren stark verschmiert. Alle drei Laufbahnen waren gleich lang. Die Färbung der Laufbahnen hatte eine Unterschiedliche Intensität: Bahn 1 war am schwächsten, Bahn 3 am intensivsten und die 2. Laufbahn lag in der Intensität zwischen den beiden anderen. Auswertung Das verschmierte Bandenmuster deutet darauf hin, dass wir hier keine spezifischen Fragmentlängen erhalten haben, wie dies z.b. bei der Restriktionsspaltung der Fall ist. Wir haben in diesem Experiment die DNA vielmehr in völlig unterschiedlich große Fragmente gespalten. Es liegt in unserer DNA-Lösung also ein Gemisch von sehr vielen unterschiedlichen DNA-Stücken vor. Weiterhin können wir aufgrund der verwendeten Methode davon ausgehen, dass die isolierte DNA nicht besonders rein ist, zumindest RNA- Fragmente, wahrscheinlich aber auch noch Proteine werden auch noch in der Lösung vorhanden sein, und zu dem verwaschenen Bandenmuster beitragen. Die abgestufte Intensität der Laufbahnen entspricht den Erwartungen, da ja die DNA-Lösung in unterschiedlichen Konzentrationen
5 zugegeben wurde. Somit ist auch der Beweis erbracht, dass mit der Elektrophorese auch wirklich DNA nachgewiesen wurde, denn diese war das einzige Reagens, das von uns in unterschiedlichen Konzentrationen zugefügt wurde (s. Tabelle 1). Versuch II: Restriktionsspaltung von Plasmid- und Lambda-DNA Einleitung In diesem Versuchsteil wurde DNA durch Restriktionsenzyme gespalten. Restriktionsenzyme sind Endonucleasen, die auch natürlich in Bakterien vorkommen. Sie haben dort die Aufgabe, evtl. eingedrungene Fremd-DNA zu erkennen und durch Spaltungen unschädlich zu machen. Dabei besitzt jedes Restriktionsenzym eine spezifische Erkennungssequenz auf der Fremd-DNA, an die es andocken kann, meist bestehen diese Erkennungsstellen aus Palindromen. Die bakterieneigene DNA wird von der Restriktion verschont obwohl auch diese solche Erkennungssequenzen beinhaltet. Diese sind jedoch durch spezielle Methylierungsmuster vor einem Andocken der Restriktionsenzyme geschützt. Restriktionsenzyme können entweder so schneiden, dass einer der Einzelstränge um einige Basen übersteht (sticky ends), oder so, dass beide Einzelstränge an der gleichen Position gespalten werden (blunt ends). Durch das gleiche Restriktionsenzym entstandene Enden neigen dazu, sich selbständig zusammenzulagern. Aufgrund dieser Eigenschaften sind Restriktionsenzyme aus der heutigen gentechnischen Arbeit nicht mehr wegzudenken. Material und Methoden Der Versuch wurde im wesentlichen anhand des Lehrermanuals (S. 58) durchgeführt. Das Plasmid pbluescript II KS wurde in vier verschiedenen Restriktionsansätzen geschnitten: 1. EcoRI / BamHI 2. XmnI 3. BamHI 4. XmnI / BamHI Zusätzlich wurde der Phage λ mit einer Kombination von EcoRI und BamHI geschnitten. Die Kombination dieser Restriktionsenzyme wurde deshalb gewählt, weil alle
6 drei in der gleichen Pufferlösung schneiden können. Zum Restriktionsversuch wurden 5 verschiedene Ansätze gemacht: Tabelle 2: Zusammensetzung der Ansätze für den Restriktionsversuch Ansatz 1 Ansatz 2 Ansatz 3 Ansatz 4 Ansatz 5 4µl pbluescript 10 µl λ-dna 1µl pbluescript 1µl pbluescript 2µl pbluescript 2µl TBE-Puffer 10x 2µl TBE-Puffer 10x 2µl TBE-Puffer 10x 2µl TBE-Puffer 10x 2µl TBE-Puffer 10x 12µl H 2 O 6µl H 2 O 16µl H 2 O 16µl H 2 O 4µl H 2 O 1µl EcoRI 1µl EcoRI 1µl XmnI 2µl BamHI 1µl XmnI 1µl BamHI 1µl BamHI µl BamHI Dabei betrug die Konzentration von λ und pbluescript 50ng/µl. Insgesamt befanden sich in den Ansätzen also folgende DNA-Mengen:!: 200ng, ": 500ng, #+$: 50ng, %: 100ng. Die 8 Geltaschen wurden daraufhin mit folgenden Ansätzen gefüllt (die Reihenfolge wurde geändert, da das verwendete Gel seitlich beschädigt war): Tabelle 3: Probenzusammensetzung des Restriktionsversuchs für die Gelelektrophorese Tasche 1 1 µl λ-dna (ungespalten) 2µl TBE-Puffer 10x 15µl H 2 O Tasche 2 1µl pbluescript (ungespalten) 2µl TBE-Puffer 10x 15µl H 2 O Tasche 3 5µl pbluescript EcoRI / BamHI 2µl TBE-Puffer 10x 11µl H 2 O
7 Tasche 4 10µl kb-leiter Tasche 5 5µl λ-dna (EcoRI / BamHI) 2µl TBE-Puffer 10x 11µl H 2 O Tasche 6 20µl pbluescript (BamHI) Tasche 7 20µl pbluescript (XmnI / BamHI) Tasche 8 20µl pbluescript (XmnI ) Die Gelelektrophorese lief 3 Stunden bei 60V. Anschließend wurde das Gel, wie schon bei Versuch 1, in einem Astralblaubad gefärbt. Später wurde das Gel entfärbt und unter Durchlicht beobachtet. Ergebnis Die Laufstrecken von Bahn $, der Marker-DNA, wurden als Eichkurve in eine Grafik eingetragen (s. Anhang 1), danach wurden aus den Laufstrecken der übrigen Banden die Größe der jeweiligen Fragmente ermittelt:
8 Tabelle 4: Beobachtete Banden und Größe der jeweiligen Fragmente Bahn 1, λ-dna ungespalten Bande 1: >12.000bp Bahn 2, pbluescript ungespalten Bande 1: ~1.650bp, schwach sichtbar Bahn 3, pbluescript EcoRI / BamHI Bande 1: ~3000bp Bahn 4, Marker-DNA (kb-ladder) 13 gut zu unterscheidende Banden von definierter Größe (s. Foto von Gel und DNA-Ladder im Anhang) Bahn 5, λ-dna EcoRI / BamHI mehrere kaum zu unterscheidende Banden, 3 davon etwas stärker, ~ bp Bahn 6, pbluescript BamHI Bande 1: ~3.000bp Bahn 7, pbluescript XmnI / BamHI Bande 1: ~2.000bp Bande 2: ~1.000bp Bahn 8, pbluescript XmnI Bande 1: bp Auswertung Bahn 1: Die ungespaltene λ-dna ergibt auf dem Gel eine Bande bei 1,75cm, die ensprechende DNA muss also über bp lang sein. Als Literaturwert ist für den Phagen λ eine DNA-Länge von bp angegeben. Die erhaltene Bande liegt also durchaus im erwarteten Bereich, eine genaue Bestimmung der Größe ist mit unserer Methode nicht möglich, da die verwendete Marker- DNA nur für Fragmentgrößen bis maximal bp geeignet ist. Bahn 2: Das ungespaltene Plasmid pb hat eine Größe von 2.961bp. Die ermittelte Größe von etwa 1.650bp stimmt damit nicht überein. Ursache hierfür
9 ist die superspiralisierte Form (Supercoil), die das Plasmid in seiner ungespaltenen Form annimmt. In dieser Form ist die Plasmid-DNA dichter gepackt und kann sich damit leichter durch die Strukturen des Agarosegels bewegen. Die DNA wandert damit weiter, also zu erwarten wäre. Bahn 3: Hier liegt die Bande dort, wo man sie eigentlich auf Bahn 2 bei der ungespaltenen pb-dna erwartet hätte (~3.000bp). Der Grund dafür ist, dass die DNA hier durch die Restriktionsspaltungen in einer linearen Form vorliegt. Obwohl mit zwei Enzymen geschnitten wurde, kann man nur eine Bande erkennen. Das liegt daran, dass beide Erkennungsstellen in der MCS des Plasmids liegen. Das ausgeschnittene Fragment ist damit so klein (22bp), dass es aus dem Gel herausläuft und nicht mehr bestimmt werden kann. Bahn 4: Das Bandenmuster, das wir für die Marker-DNA erhielten, entsprach jenem, das wir aus der Literatur kannten (s. Kopie im Anhang). Die Fragmentgrößen konnte man am Besten anhand der Lücken zwischen 1.000bp und 1.650bp bestimmen. Bahn 5: Aus der Restriktionskarte von λ (s. Anhang) kann man entnehmen, das jedes der verwendeten Enzyme jeweils 5 Erkennungsstellen auf der λ-dna besitzt. Es wären also 11 Fragmente zu erwarten. Tatsächlich ließ sich die genaue Zahl der Banden nicht genau feststellen. Das liegt zum einen an der verwendeten Färbemethode: Da wir mit Azurblau färbten, waren alle Banden grundsätzlich schwächer auszumachen, als das mit Ethidiumbromid der Fall gewesen wäre. Zum anderen liegt es auch an der Menge der Fragmente selber. In der Geltasche liegen nicht nur die 11 direkt durch die Restriktion entstandenen Fragmente vor, sondern auch Zusammenschlüsse von zufällig wieder zusammengelagerten Fragmenten. Durch die Vielzahl der möglichen Kombinationen können die einzelnen Banden so wenig DNA enthalten, dass es nicht mehr möglich ist, sie zu unterscheiden. Bahn 6 und 8: Da das Plasmid hier jeweils nur mit einem Restriktionsenzym gespaltet worden ist, kann man eine Linearisierung des pbluescript erwarten. Und tatsächlich sind hier jeweils Banden in der Größenordnung um 3.000bp vorhanden. Der Supercoil-Effekt aus Bahn 2 tritt hier also nicht mehr auf. Bahn 7: Wieder wurde eine Doppelspaltung mit 2 Enzymen durchgeführt, diesmal lagen die Schnittstellen allerdings weiter auseinander. BamHI schneidet bei 701bp, XmnI schneidet bei Position Ein Fragment muss demnach 1944bp lang sein, das zweite 1017bp. Auf unserem Gel lassen sich beide Fragmente nachweisen.
10 Versuch III: Ligation der Fragmente Einleitung DNA-Fragmente, die mit dem gleichen Restriktionsenzym geschnitten worden sind, können sich selbständig zusammenlagern. Im Experiment kann man so auch fremde DNA in andere einbauen. In diesem Versuch wollten wir Fragmente aus λ-dna in das Plasmid pbluescript einbauen. Eine Ligase sorgt dabei für die stabile Verknüpfung der DNA-Fragmente. Die vorangehende Restriktion von pbluescript erfolgt dabei immer mit zwei verschiedenen Enzymen in der MCS, da sich das Plasmid sonst zu leicht wieder zu einem Ring verbinden könnte. So aber haben beide Enden des Plasmids unterschiedliche Enden, die nur ein Anheften von DNA gleicher Endung erlauben. Material und Methoden Folgender Ligationsansatz wurde von uns erstellt: Tabelle 5: Ligationsansatz DNA-Ligation 5 µl Spaltung pbluescript 10µl Spaltung λ-dna 2µl Ligase-Puffer 10x 1µl H 2 O 2µl T4-Ligase Dieser Ligationsansatz wurde für einige Zeit ins Eisbad überführt. Ein Agarosegel wurde schließlich mit folgenden Ansätzen beladen: Tabelle 6: Probenzusammensetzung des Ligationsversuchs für die Gelelektrophorese Tasche 1 10µl Marker-DNA Tasche 2 5 µl λ-dna EcoRI / BamHI 2µl TBE-Puffer 10x 11µl H 2 O
11 Tasche 3 5 µl pb-dna EcoRI / BamHI 2µl TBE-Puffer 10x 11µl H 2 O Tasche 4 10 µl Ligationsansatz 2µl TBE-Puffer 10x 8µl H 2 O Zusammen mit der Praktikumsgruppe 2 wurde eine Gelplatte benutzt. Das Gel wurde für 1 Stunde bei 60V, danach für 30 Minuten bei 100V in die Elektrophoresekammer gesetzt. Anschließend wurde das Gel in einem 15minütigen Ethidiumbromid-Bad gefärbt und unter UV-Licht ausgewertet sowie fotografiert. Ergebnis Wieder wurde anhand der bekannten Fragmentgrößen der Marker-DNA eine Eichkurve erstellt (s. Anhang). Folgende Banden konnten auf unserem Gel beobachtet werden: Tabelle 7: Beobachtete Banden und Größen der jeweiligen Fragmente Bahn 1, Marker-DNA erwartetes Bandenmuster (s. Kopie im Anhang). Die Bahn ist zum Ende hin leicht seitlich aus dem Gel herausgelaufen. Daher sind die Größenmarker <300bp nicht mehr zu unterscheiden. Bahn 2, λ-dna verschiedene Banden zu erkennen, bp lang. Bahn 3, pb-dna Bande 1: 3000bp Bande 2: 2300bp Bande 3: 2000bp weiterhin noch eine Vielzahl von undeutlich zu erkennenden Banden <2000bp
12 Bahn 4, Ligationsansatz hier ist keine Bande zu erkennen, in unserer Gruppe ist beim Ansetzen des Ligationsansatzes ein Fehler unterlaufen. Alternativ haben wir zur Auswertung den Ligationsansatz der Gruppe 2 herangezogen, der auf dem gleichen Gel auf Bahn 8 mitgelaufen ist. Hier kann man keine klaren Banden erkennen, ein Schmierfilm zieht sich über das gesamte Spektrum, das auch die geschnittene λ-dna abdeckt. Auswertung Auch hier ist wieder wie beim Restriktionsversuch λ-dna aufgetragen worden, diesmal sind aber durch die andere Färbemethode mehr Banden sichtbar. Wie im Versuchsteil II besprochen, würde man bei einer Spaltung mit EcoRI und BamHI 11 Banden erwarten, die tatsächliche Zahl der Banden lässt sich zwar nicht genau ermitteln, liegt aber über diesem Wert. Es müssen also zusätzlich noch Fragmente anderer Länge entstanden sein. Das kann einmal durch spontanes Zusammenlagern von einzelnen Fragmenten geschehen. Es können aber auch zusätzliche Fragmente dadurch entstehen, dass die verwendeten Enzyme nicht nur genau an ihren spezifischen Bindungsstellen geschnitten haben, sondern auch an ähnlichen. Zu bedenken ist dabei auch, dass wir aus praktischen Gesichtspunkten den gleichen Puffer für alle Enzyme benutzt haben, was nicht der Optimalbedingung entspricht. Ansonsten entsprechen die Ergebnisse der pb und λ-spaltung dieser Gelelektrophorese denen aus Versuch II. Im Ligationsansatz lassen sich keine klaren Banden voneinander unterscheiden. Das kann als Beweis für eine erfolgreiche Ligation herangezogen werden. Die Anzahl der möglichen Kombinationen der λ-fragmente mit pbluescript ist so groß, dass das Ergebnis nur noch als Schmierfilm auf dem Gel beobachtet werden kann.
13 Versuch IV: Genetische Transformation Einleitung Unter einer Transformation im Allgemeinen versteht man das Übertragen von DNA auf einen anderen Organismus. In diesem Versuch wollten wir Plasmid- DNA mit einem eingebauten Stück λ-dna in E. coli Zellen einschleusen und in deren DNA einbauen. Mit diesem Verfahren lässt sich in der Praxis für ein bestimmtes Protein codierende DNA, z.b. für Insulin, in ein Bakterium einsetzen, um davon dieses Protein vermehrt produzieren zu lassen. Für eine erfolgreiche Transformation müssen die Bakterien zuerst vorbereitet werden. Durch eine Behandlung mit CaCl 2 werden die Zellen durchlässig für DNA. Nun kann Plasmid-DNA in das Bakterium eingebracht werden. Zur Kontrolle, ob eine Transformation gelungen ist, sowie zur Selektion der transformierten Bakterien dienen zwei Mechanismen: Das Plasmid pbluescript enthält einen Abschnitt, der für Ampicillin-Resistenz codiert. Damit ist es möglich, später die E. coli - Zellen zu isolieren, die das Plasmid eingebaut haben. Denn nur diese können auf einem Ampicillinhaltigen Nährboden überleben. Weiterhin enthält pbluescript in der Multiple Cloning Site (MCS) das LacZ-Gen, einen Sequenz, die für das Enzym β-galactosidase codiert. ohne β- Galactosidase ist eine Verstoffwechselung von Lactose nicht möglich. Nimmt man nun zur Transformation einen E.coli-Stamm mit defektem LacZ-Gen, so sind diese Bakterien zum Verarbeitung von Lactose auf das LacZ-Gen der eingebauten Plasmide angewiesen. Da nun in pbluescript die Schnittstellen für EcoRI und BamHI genau innerhalb des LacZ-Gens liegen, kann man später leicht kontrollieren, ob in dem betreffenden Plasmid ein Insert eingefügt ist: Ohne Insert bleibt das LacZ-Gen intakt, das transformierte Bakterium kann Lactose verstoffwechseln, mit Insert fehlt dem Bakterium diese Möglichkeit. Kontrollieren lässt sich dieser Sachverhalt durch Ausplattieren auf McConkey- Platten. Hier wird durch einen Farbumschlag angezeigt, ob das Bakterium Lactose verwerten kann, oder nicht.
14 Material und Methoden Die Versuchsdurchführung erfolgte weitestgehend anhand des Skripts (S. 75ff.). Die genaue Versuchsandordnung lässt sich auch dem Skript des entsprechenden Referatsthemas entnehmen (s. Anhang). Aus einer Übernachtkultur von E. coli-bakterien mit defektem LacZ-Gen wurden einige Kolonien abgenommen und in zwei verschiedene Reaktionsgefäße mit eisgekühltem CaCl 2 überführt. In eines der Reaktionsgefäße wurden daraufhin 50ng Plasmid-DNA gegeben. Beide Reaktionsgefäße wurden einem 90- sekündigen Hitzeschock in 42 C warmem Wasserbad unterzogen. Durch diesen Prozess sollen die Bakterien zu einer Oberflächenreinigung angeregt werden, bei der auch DNA in die Zellen aufgenommen wird. Wieder wurde auf Eis inkubiert, anschließend wurden jeweils 250µl LB-Medium zugefügt, um die Versorgung für die sich teilenden Bakterien und Plasmide zu gewährleisten. Nach weiteren 30 Minuten Inkubation im 37 C warmen Heizblock wurden die Lösungen auf verschiedene, zuvor vorbereitete Platten Ausplattiert. Je Platte wurden dabei 100µl ausplattiert. Für eine Übersicht über die Ausplattierungen s. Tabelle 8, wo auch die Ergebnisse verzeichnet sind. Die Platten wurden im Brutschrank bei 37 C inkubiert und am nächsten Praktikumstag ausgezählt. Ergebnis Nachfolgend eine tabellarische Übersicht über die Ausplattierungen und die Ergebnisse des Auszählens: Tabelle 8: Ausplattierung nach dem Transformationsversuch Platte A McConkey (=+Amp) Platte B McConkey Platte C LB +Amp 100µl +Plasmid 100µl (1:10) +Plasmid 100µl Plasmid sehr kleine Kolonien sehr kleine Kolonien sehr geringes Wachstum Platte D LB Amp Platte E LB +Amp Platte F LB Amp 100µl Plasmid 100µl +Plasmid 100µl +Plasmid Rasen sehr geringes Wachstum Rasen
15 Auswertung Die erwarteten Ergebnisse haben sich nicht eingestellt. Ein deutliches Kolonienwachstum war bei unserem Versuch nur bei den Platten D und F festzustellen. Bei diesen Platten war jedoch kein Ampicillin im Nährmedium enthalten, so dass hier auch Bakterien ohne entsprechende Resistenz wachsen können. der sehr schwache Bakterienrasen auf Platte E hätte auf eine Transformation hinweisen können, allerdings ist ein Rasen in der gleichen Ausprägung auch auf der Platte C zu sehen, hier wurden allerdings E. coli ohne Plasmid ausplattiert. Der schwache beobachtete Rasen wird also eher auf eine durch spontane Mutation hervorgerufene Ampicillin-Resistenz zurückzuführen sein. Wir gehen aufgrund unserer Ergebnisse davon aus, dass eine Transformation nicht stattgefunden hat. Versuch V: Plasmidpräparation aus Übernachtkultur Einleitung In diesem Versuchsteil ging es darum, Plasmide wieder aus Bakterienzellen zu isolieren und zu reinigen. Dabei wurden zwei verschiedene Methoden angewandt: Zum einen die Kochlyse, (Skript S.39ff.), bei der die Bakterienzelle durch EDTA, Triton-X-100 und Lysozym chemisch aufgebrochen wird und durch Aufkochen die Plasmid-DNA von der chromosomalen DNA getrennt wird. Zum anderen die alkalische Lyse, bei der der Schritt des Kochens durch eine Behandlung mit NaOH ersetzt wird. Ansonsten ist der Ablauf beider Methoden sehr ähnlich: Alle DNA wird denaturiert und versucht sich später wieder zu renaturieren, was aufgrund der geringen Größe und Komplexität in vollem Umfang nur bei der Plasmid-DNA der Fall ist. So kann man später Plasmid-DNA von chromosomaler DNA trennen. Material und Methoden 1. Plasmidpräparation mittels Kochlyse Bei diesem Prozess werden die Bakterien zunächst mit STET-Puffer behandelt, um die Bakterienzellen aufzubrechen. Dann wird der Ansatz gekocht und abzentrifugiert, um ein Denaturieren der DNA auszulösen. Im Gegensatz zur Plasmid-DNA kann sich die chromosomale DNA nicht mehr renaturieren und kann nach der Zentrifugation abgenommen werden. Schließlich wird die zurückgebliebene Plasmid-DNA noch mit Isopropanol gefällt und kann nach dem Trocknen in TE-Puffer resuspendiert werden.
16 Im Einzelnen erfolgte die Plasmidpräparation anhand des Skriptes (S.33f., S.39ff.) und anhand des Referat-Skriptes zum jeweiligen Thema (s. Anhang) 2. Plasmidpräparation mittels alkalischer Lyse Hierbei werden Mureinsacculus und Cytoplasmamembran durch Zugabe von SDS Zerstört. Die Aufgabe des Kochens bei Methode 1 übernimmt hier eine Zugabe von NaOH, nach der der ph auf 12 12,5 steigt. Alle DNA denaturiert daraufhin. Nach Zugabe von Eisessig und Kaliumacetat stellt sich der ph wieder auf 7 ein, die Plasmid-DNA kann renaturieren, die chromosomale DNA ist hierfür zu komplex. Auch hier wird die Plasmid-DNA schließlich mit Isopropanol zur Fällung gebracht und nach dem Trocknen in TE-Puffer resuspendiert. Die einzelnen Schritte wurden dem Skript (S.49ff.) sowie dem entsprechenden Referats-Skript entnommen (s. Anhang). Um das Ergebnis der Plasmidpräparationen sichtbar machen zu können, und um die eingesetzten Plasmide herauszuschneiden, führten wir Restriktionsspaltungen sowie eine anschließende Gelelektrophorese durch. Folgende Restriktionen wurden angesetzt: Tabelle 9: Restriktionsansätze bei der Plasmidpräparation Kochlyse alkalische Lyse Ansatz 1 Ansatz 2 Ansatz 3 Ansatz 4 10µl pb +Insert 10µl pb 10µl pb 10µl pb +Insert 2µl TBE-Puffer (10x) 2µl TBE-Puffer (10x) 2µl TBE-Puffer (10x) 2µl TBE-Puffer (10x) 6µl H 2 O 1µl EcoRI 1µl BamHI 6µl H 2 O 1µl EcoRI 1µl BamHI 6µl H 2 O 1µl EcoRI 1µl BamHI 6µl H 2 O 1µl EcoRI 1µl BamHI Die Restriktionsansätze wurden 1h20m bei 37 C inkubiert. Anschließend wurden folgende Proben für die Gelelektrophorese angesetzt. Diese lief eine Stunde bei 120V, später noch etwa 20 Minuten bei 140V. Wieder wurde das Gel 15 Minuten lang mit Ethidiumbromid angefärbt und unter UV-Bestrahlung ausgewertet.
17 Folgende Proben wurden für die Gelelektrophorese angesetzt: Tabelle 10: Ansätze für die Gelelektrophorese beim Versuchsteil Plasmidpräparation Tasche 1 Tasche 2 10µl Marker-DNA 10µl pb Insert (alkalische Lyse) 1µl Blaumarker Tasche 3 Tasche 4 20µl pb Insert (alkalische Lyse) EcoRI / 20µl pb Insert (Kochlyse) EcoRI / BamHI BamHI Tasche 5 Tasche 6 10µl pb +Insert (Kochlyse) ungespalten 20µl pb +Insert (Kochlyse) EcoRI / 1µl Blaumarker BamHI Tasche 7 Tasche 8 10µl pb +Insert (alkalische Lyse) 20µl pb +Insert (alkalische Lyse) EcoRI / ungespalten BamHI 1µl Marker Ergebnis In der folgenden Tabelle sind die Beobachtungen nach der Gelelektrophorese aufgetragen (s. Foto im Anhang) Tabelle 11: Beobachtete Banden und Größen der jeweiligen Fragmente Bahn 1, Marker-DNA erwartetes Bandenmuster (s. Kopie im Anhang). Beim Beladen ist das Gel etwas beschädigt worden, daher sind die Banden etwas verwaschen und besitzen in der Mitte eine deutliche Störung. Bahn 2, pbluescript Insert, alkalische Lyse Bande 1: >12.000bp verwischt Bande 2: ~2000 bp schwach Bahn 3, pbluescript Insert (alkalische Lyse) EcoRI / BamHI Bande 1: >12.000bp verwischt Bande 2: ~2000 bp
18 Bahn 4, pbluescript Insert (Kochlyse) EcoRI / BamHI Bande 1: >12.000bp ansonsten nur verschmierte Bahn zu erkennen Bahn 5, pbluescript +Insert (Kochlyse) Bande 1: >12.000bp (sehr schwach) Bahn 6, pbluescript +Insert (Kochlyse) EcoRI / BamHI Bande 1: >12.000bp (schwach) Bahn 7, pbluescript +Insert (alkalische Lyse) ungespalten Bande 1: >12.000bp (stark) Bande 2: ~2.600bp Bahn 8, pb +Insert (alkalische Lyse) EcoRI / BamHI Bande 1: >12.000bp (stark) Bande 2: ~2.600bp Auswertung Bahn 1: Das Bandenmuster, das wir für die Marker-DNA erhielten, entsprach jenem, das wir aus der Literatur kannten (s. Kopie im Anhang). Bahn 2: Beim ungespaltenen pbluescript ohne Insert würden wir eine Bande entweder bei 2961bp erwarten, oder, wenn das Plasmid als Supercoil vorliegt wie in Versuchsteil II, wieder eine Bande bei 1650bp. Statt dessen erhielten wir eine Bande bei etwa 2000bp. Möglicherweise ist diese Bande das Produkt einer unvollständigen Superspiralisierung. Die zusätzliche Bande oberhalb des Markers für bp tritt, wenn auch unterschiedlich stark, in allen Proben auf. Nur in Bahn 1 ist an dieser Stelle keine Bande zu erkennen, weshalb ein Fehler im Gel wahrscheinlich auszuschließen ist. Da das Plasmid selber aufgrund seiner viel geringeren Größe für die Bande nicht verantwortlich sein kann, vermute ich eine Verunreinigung unserer Proben. Anscheinend war die Plasmidpräparation nicht ausreichend sauber, wahrscheinlich waren in den Proben noch Bakterien-DNA enthalten. Bahn 3: Hier wäre zu erwarten, dass das Plasmid linear vorliegt und damit eine Bande bei knapp 3.000bp sichtbar wäre. Tatsächlich liegt die Bande aber an der gleichen Position wie schon bei Bahn 2. Hier liegt also das Plasmid entweder in der gleichen Form vor wie bei Bahn 2, oder die
19 Restriktionsspaltung hat nicht funktioniert. Bahn 4: Bis auf die schon weiter oben besprochene Bande bei >12.000bp haben wir hier keine deutlichen Banden unterscheiden können. Wir gehen daher davon aus, dass unsere Kochlyse misslungen ist. Bahn 5: Auch hier lässt sich aufgrund der wahrscheinlich misslungenen Kochlyse keine Bande nachweisen. Da das ungespaltene Plasmid 2961bp lang ist, in der ersten Restriktion aber 22bp entfernt wurden, wäre hier eine Fragmentgröße von 2939 zu erwarten gewesen. Dazu wäre noch die (unbekannte) Länge des λ-fragmentes gekommen. Bahn 6: Dieser Ansatz hätte Aufschluss geben müssen über die Größe des unbekannten Inserts. Wir haben hier 2 Banden erwartet: Die des Plasmids (2939bp) und die des Inserts. Leider konnten wir unsere Vermutungen aufgrund der misslungenen Kochlyse auch hier nicht überprüfen. Bahn 7: Die erwartete Bandenverteilung war wie bei dem entsprechenden Ansatz mit Kochlyse (Bahn 5). Hier haben wir nur eine Bande erhalten, und zwar bei ~2.600bp, die tatsächliche Größe des Plasmids müsste aber 2939bp betragen haben. Entweder das Plasmid lag in einer Form vor, die die Bewegung durch das Gel erleichterte, oder die Restriktion lief ungenau ab. So könnten Restriktionsenzyme auch an ähnlichen Stellen der DNA geschnitten haben, nicht nur exakt an ihren spezifischen Bindungsstellen. Eine weitere Erklärung wären Ungenauigkeiten in der Methode. Bahn 8: Auch hier waren die Erwartungen wie beim entsprechenden Ansatz aus Kochlyse (Bahn 6). Auch hier kann man wieder, wie in Bahn 7, eine Bande bei ~2600bp sehen. Da nur diese eine Bande zu sehen ist, war das ausgeschnittene Insert vermutlich so klein, dass es aus dem Gel heraus gelaufen ist.
20 Versuch VI: Versuchstag EDV-Recherche Schnittstellen von Lambda für EcoRI und BamHI EcoRI Fragmente von Lambda (48.502bp): nach Größe BamHI nach Schnittstellen Schnittstellen von puc18 (2686bp) mit EcoRI und BamHI: 426 BamHI 447 EcoRI Fragmente von puc18 bei Doppelspaltung: andere Plasmide von STRATAGENE: pbs-, pbluescript II SK -, PCR-Script Amp Restriktionskarten dazu s. Anhang
21 Verwendete Literatur: Menz, Volkmar: Genetische Transformation als Schülerexperiment der Sekundarstufe II: Ein Beispiel für die Erweiterung der genetischen Methodik. Hausarbeit zur 1. Staatsprüfung für Lehrämter 1996, Institut für Genetik, Universität zu Köln Knippers, Rolf: Molekulare Genetik. 7. Aufl., Thieme, Stuttgart, New York 1997 Primrose, S.B.: Biotechnologie. Spektrum Verlag 1990
Molekulare Klonierung Praktikum
 Molekulare Klonierung Praktikum 2013 Praktikumsaufgabe Ligation 1. Zusammensetzung des Ligationsreaktions-ansatzes : 1 l Vektor DNA 1 l Insert DNA 2 l 10X Ligase Puffer 15 l destillertes Wasser 1 l Ligase
Molekulare Klonierung Praktikum 2013 Praktikumsaufgabe Ligation 1. Zusammensetzung des Ligationsreaktions-ansatzes : 1 l Vektor DNA 1 l Insert DNA 2 l 10X Ligase Puffer 15 l destillertes Wasser 1 l Ligase
Gentechnologie: Klonierung und Transformation von DNA
 Grundpraktikum Genetik 8. Kurstag 16.06.2005 Gentechnologie: Klonierung und Transformation von DNA Lerninhalte: Transformation, natürliche Kompetenz, Transformationseffizienz, Vektor, Plasmid, Resistenzgen,
Grundpraktikum Genetik 8. Kurstag 16.06.2005 Gentechnologie: Klonierung und Transformation von DNA Lerninhalte: Transformation, natürliche Kompetenz, Transformationseffizienz, Vektor, Plasmid, Resistenzgen,
AUFGABENSAMMLUNG. Restriktionsenzyme. Füllen Sie den Lückentext aus. Gentechnik Schroedel, Braunschweig
 Restriktionsenzyme Füllen Sie den Lückentext aus. PCR 1a Mit dem folgenden Quiz können Sie Ihr Wissen zum Thema PCR überprüfen. Klicken Sie jeweils die richtige Antwort an. PCR 1b Mit dem folgenden Quiz
Restriktionsenzyme Füllen Sie den Lückentext aus. PCR 1a Mit dem folgenden Quiz können Sie Ihr Wissen zum Thema PCR überprüfen. Klicken Sie jeweils die richtige Antwort an. PCR 1b Mit dem folgenden Quiz
Zellbiologie und Physiologie Labormethoden der Biologie
 Zellbiologie und Physiologie Labormethoden der Biologie Molekularbiologie I Dr. Stefan Weinl > Molekularbiologie I Plasmidpräparation Transformation Restriktionsverdau Gel-Elektrophorese 1 > Experimenteller
Zellbiologie und Physiologie Labormethoden der Biologie Molekularbiologie I Dr. Stefan Weinl > Molekularbiologie I Plasmidpräparation Transformation Restriktionsverdau Gel-Elektrophorese 1 > Experimenteller
Restriktion und Gentechnik
 Restriktion und Gentechnik Einteilung 1.) Restriktion - Restriktionsenzyme - Southern Blotting 2.)Gentechnik - sticky ends - blunt ends Restriktion Grundwerkzeuge der Gentechnik - Restriktionsenzymanalyse
Restriktion und Gentechnik Einteilung 1.) Restriktion - Restriktionsenzyme - Southern Blotting 2.)Gentechnik - sticky ends - blunt ends Restriktion Grundwerkzeuge der Gentechnik - Restriktionsenzymanalyse
Zellbiologie und Physiologie Labormethoden der Biologie
 Zellbiologie und Physiologie Labormethoden der Biologie > Molekularbiologie I Plasmidpräparation Molekularbiologie I Transformation Gel-Elektrophorese Dr. Stefan Weinl > Plasmid-Isolierung aus E. coli
Zellbiologie und Physiologie Labormethoden der Biologie > Molekularbiologie I Plasmidpräparation Molekularbiologie I Transformation Gel-Elektrophorese Dr. Stefan Weinl > Plasmid-Isolierung aus E. coli
MODULE für den SCHULKOFFER GENTECHNIK
 MODULE für den SCHULKOFFER GENTECHNIK Modul 1 - DNA-Bastel-Set Zusammenbau eines Papiermodells in Form einer Doppelhelix sehr einfach, Unterstufe, ohne Koffer möglich Modul 2 - DNA-Isolierung aus Gemüse
MODULE für den SCHULKOFFER GENTECHNIK Modul 1 - DNA-Bastel-Set Zusammenbau eines Papiermodells in Form einer Doppelhelix sehr einfach, Unterstufe, ohne Koffer möglich Modul 2 - DNA-Isolierung aus Gemüse
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers
 Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein Transformation des Expressionsstammes
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein Transformation des Expressionsstammes
Protokoll Versuch 1: VDJ-Rekombination in humanen prä-b-zellen
 F2-Praktikum Genetik Protokoll Versuch 1: VDJ-Rekombination in humanen prä-b-zellen Gruppe 4 (Susanne Duncker, Kristin Hofmann) Einleitung Wir untersuchten in diesem Versuch die Effizienz der VDJ-Rekombination
F2-Praktikum Genetik Protokoll Versuch 1: VDJ-Rekombination in humanen prä-b-zellen Gruppe 4 (Susanne Duncker, Kristin Hofmann) Einleitung Wir untersuchten in diesem Versuch die Effizienz der VDJ-Rekombination
Protokoll Versuch A2 Expressionstests von D1D2 in verschiedenen E. coli-stämmen
 Protokoll Versuch A2 Expressionstests von D1D2 in verschiedenen E. coli-stämmen Gruppe 8 Susanne Duncker und Friedrich Hahn Einleitung und Aufgabenstellung In Versuch A1 stellten wir einen das Gen für
Protokoll Versuch A2 Expressionstests von D1D2 in verschiedenen E. coli-stämmen Gruppe 8 Susanne Duncker und Friedrich Hahn Einleitung und Aufgabenstellung In Versuch A1 stellten wir einen das Gen für
Molekulargenetische Experimente IV: Plasmidpräparation
 Molekulargenetische Experimente IV: Plasmidpräparation Plasmide sind kleine, ringförmige DNA-Moleküle in Bakterien, die in der Lage sind, sich selbst mit Hilfe von Enzymen zu replizieren. Gene, die auf
Molekulargenetische Experimente IV: Plasmidpräparation Plasmide sind kleine, ringförmige DNA-Moleküle in Bakterien, die in der Lage sind, sich selbst mit Hilfe von Enzymen zu replizieren. Gene, die auf
Gentechnologie: Isolierung und Charakterisierung von DNA
 Genetisches Grundpraktikum 9. Kurstag 23.06.2005 Gentechnologie: Isolierung und Charakterisierung von DNA Lerninhalte: Klonierung, Plasmid, Polylinker ( multiple cloning site ), Restriktionsendonuklease,
Genetisches Grundpraktikum 9. Kurstag 23.06.2005 Gentechnologie: Isolierung und Charakterisierung von DNA Lerninhalte: Klonierung, Plasmid, Polylinker ( multiple cloning site ), Restriktionsendonuklease,
Novartis Pharma AG Schullabor. Plasmid-DNA. Auf der Suche nach dem Antibiotikaresistenz Gen 2019 / 1
 Novartis Pharma AG Schullabor Plasmid-DNA Auf der Suche nach dem Antibiotikaresistenz Gen 019 / 1 Herausgeber Novartis Pharma AG, CH-00 Basel Kontaktadresse: Novartis Pharma AG Schullabor WKL-1..6A Postfach
Novartis Pharma AG Schullabor Plasmid-DNA Auf der Suche nach dem Antibiotikaresistenz Gen 019 / 1 Herausgeber Novartis Pharma AG, CH-00 Basel Kontaktadresse: Novartis Pharma AG Schullabor WKL-1..6A Postfach
Restriktion zweier Plasmide zur Erstellung einer physikalischen Karte, Grundlagen der DNA- Trennung und Analyse über Agarosegele
 Versuch 1: Restriktionsenzyme als molekulare Werkzeuge Versuchsinhalt Restriktion zweier Plasmide zur Erstellung einer physikalischen Karte, Grundlagen der DNA- Trennung und Analyse über Agarosegele Zwei
Versuch 1: Restriktionsenzyme als molekulare Werkzeuge Versuchsinhalt Restriktion zweier Plasmide zur Erstellung einer physikalischen Karte, Grundlagen der DNA- Trennung und Analyse über Agarosegele Zwei
5 NUKLEINSÄUREN. In diesem Versuch wird ein kommerzielles Plasmid (plitmus38, Firma: NEB, siehe Abbildung) eingesetzt.
 5 NUKLEINSÄUREN Nukleinsäuren sind Polynukleotide, wobei jedes Nukleotid sich aus einem Phosphat, einer Ribose (RNA) oder Desoxyribose (DNA) und einer Purin- oder Pyrimidin-Base zusammensetzt. Die einzelnen
5 NUKLEINSÄUREN Nukleinsäuren sind Polynukleotide, wobei jedes Nukleotid sich aus einem Phosphat, einer Ribose (RNA) oder Desoxyribose (DNA) und einer Purin- oder Pyrimidin-Base zusammensetzt. Die einzelnen
Grundideen der Gentechnik
 Grundideen der Gentechnik Die Gentechnik kombiniert Biotechnik und Züchtung. Wie in der Züchtung wird die Erbinformation eines Lebewesen verändert. Dabei nutzte man in den Anfängen der Gentechnik vor allem
Grundideen der Gentechnik Die Gentechnik kombiniert Biotechnik und Züchtung. Wie in der Züchtung wird die Erbinformation eines Lebewesen verändert. Dabei nutzte man in den Anfängen der Gentechnik vor allem
Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Monokotylen
 Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Monokotylen Vorbereitung auf diesen Praktikumsteil: Organisation - Für den Bioinformatik-Teil benötigen Sie pro Gruppe einen Laptop -
Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Monokotylen Vorbereitung auf diesen Praktikumsteil: Organisation - Für den Bioinformatik-Teil benötigen Sie pro Gruppe einen Laptop -
Quiz zum Praktikum Tierartendifferenzierung
 Quiz zum Praktikum Tierartendifferenzierung Frage 1: Aus welcher DNA wurden am Praktikumstag die Abschnitte für die Tierartenbestimmung untersucht? A. DNA aus dem Zellkern B. Mitochondriale DNA C. Plasmid-DNA
Quiz zum Praktikum Tierartendifferenzierung Frage 1: Aus welcher DNA wurden am Praktikumstag die Abschnitte für die Tierartenbestimmung untersucht? A. DNA aus dem Zellkern B. Mitochondriale DNA C. Plasmid-DNA
Versuch 8. Plasmid - Isolierung
 Versuch 8 Plasmid - Isolierung Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X C. Weindel & M. Schwarz Wird benotet?: Einleitung Ein Plasmid
Versuch 8 Plasmid - Isolierung Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X C. Weindel & M. Schwarz Wird benotet?: Einleitung Ein Plasmid
Versuchsprotokoll Klonierung eines amplifizierten PCR-Fragments. 0 Inhaltsverzeichnis
 0 Inhaltsverzeichnis 0 Inhaltsverzeichnis...- 1-1 Einleitung...- 2-2 Versuch...- 2-2.1 Versuchsteil 4.2.3.-4.2.4. (PCR und Gel der cdna)...- 2-2.1.1 Einleitung...- 2-2.1.2 Durchführung...- 2-2.1.3 Auswertung...-
0 Inhaltsverzeichnis 0 Inhaltsverzeichnis...- 1-1 Einleitung...- 2-2 Versuch...- 2-2.1 Versuchsteil 4.2.3.-4.2.4. (PCR und Gel der cdna)...- 2-2.1.1 Einleitung...- 2-2.1.2 Durchführung...- 2-2.1.3 Auswertung...-
Mikrobiologie Praktikum SS 2001 Montag, den Sarah Horsten Gruppe 3. Hinweise
 Montag, den 01.10.2002 Sarah Horsten Gruppe 3 Hinweise Dies sind Protokolle zum Praktikum Genetik und Molekularbiologie an dem ich im SS 2001 teilgenommen habe. Natürlich haben meine Protokolle keinen
Montag, den 01.10.2002 Sarah Horsten Gruppe 3 Hinweise Dies sind Protokolle zum Praktikum Genetik und Molekularbiologie an dem ich im SS 2001 teilgenommen habe. Natürlich haben meine Protokolle keinen
Plasmide, Vektoren und Klonierung
 Biologische Übungen IV, Kurstage 3, 4 Restriktionskartierung eines Plasmids, 27./28.05.2004 Protokollant: Bernhard Schnepf Gruppe A1: Dachs Sven Schnepf Bernhard Thumann Rauno Plasmide, Vektoren und Klonierung
Biologische Übungen IV, Kurstage 3, 4 Restriktionskartierung eines Plasmids, 27./28.05.2004 Protokollant: Bernhard Schnepf Gruppe A1: Dachs Sven Schnepf Bernhard Thumann Rauno Plasmide, Vektoren und Klonierung
Modifizierte Gene Editor Mutagenese
 Modifizierte Gene Editor Mutagenese zur gleichzeitigen Einführung mehrerer Punktmutationen DNA Template Präparation: 2 µg Plasmid DNA (bei 6 kb, sonst entsprechend mehr oder weniger) + 2 µl 2M NaOH, 2
Modifizierte Gene Editor Mutagenese zur gleichzeitigen Einführung mehrerer Punktmutationen DNA Template Präparation: 2 µg Plasmid DNA (bei 6 kb, sonst entsprechend mehr oder weniger) + 2 µl 2M NaOH, 2
Methodensammlung des LAG PCR-Nachweis von gentechnisch veränderten Organismen, die von pbr322 abgeleitete Sequenzen enthalten
 Methodensammlung des LAG PCR-Nachweis von gentechnisch veränderten Organismen, die von pbr322 abgeleitete Sequenzen enthalten erstellt vom Unterausschuß Methodenentwicklung des LAG 1. Zweck und Anwendungsbereich
Methodensammlung des LAG PCR-Nachweis von gentechnisch veränderten Organismen, die von pbr322 abgeleitete Sequenzen enthalten erstellt vom Unterausschuß Methodenentwicklung des LAG 1. Zweck und Anwendungsbereich
Fortbildung für Biologen an der Oranienschule
 Fortbildung für Biologen an der Oranienschule Am 28.01.08 fand die erste ganztägige schulinterne Lehrerfortbildung für Biologen an der Oranienschule unter der Leitung von Frau Dr. Wismar und Herrn Bender
Fortbildung für Biologen an der Oranienschule Am 28.01.08 fand die erste ganztägige schulinterne Lehrerfortbildung für Biologen an der Oranienschule unter der Leitung von Frau Dr. Wismar und Herrn Bender
Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS
 Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS Von: Andreas Tschammer, Fachhochschule Aalen-Hochschule f. Technik und Wirtschaft, Fachbereich Chemie, Schwerpunkt Molekulare Biotechnologie Material
Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS Von: Andreas Tschammer, Fachhochschule Aalen-Hochschule f. Technik und Wirtschaft, Fachbereich Chemie, Schwerpunkt Molekulare Biotechnologie Material
Plasmidpräparation aus Bakterien Inhalt
 Inhalt Einleitung... 2 Materialien... 4 Gewinnung der Bakterien... 6 Zerstörung der Bakterien... 7 Trennung von Plasmid-DNA und genomischer DNA... 8 Reinigung der Plasmid-DNA... 10 Elution der gereinigten
Inhalt Einleitung... 2 Materialien... 4 Gewinnung der Bakterien... 6 Zerstörung der Bakterien... 7 Trennung von Plasmid-DNA und genomischer DNA... 8 Reinigung der Plasmid-DNA... 10 Elution der gereinigten
Musterlösung- Übung 9
 Teil Molekularbiologie 1. Über Mutationen a) In welchem Teil eines Operons befinden sich Mutationen, welche die Menge eines Enzyms in einem Organismus beeinflussen? Solche Mutationen befinden sich im Operator.
Teil Molekularbiologie 1. Über Mutationen a) In welchem Teil eines Operons befinden sich Mutationen, welche die Menge eines Enzyms in einem Organismus beeinflussen? Solche Mutationen befinden sich im Operator.
Ein interessanter und arbeitsreicher Tag im livfe Biolab in Darmstadt
 Ein interessanter und arbeitsreicher Tag im livfe Biolab in Darmstadt Als einer der ersten Kurse überhaupt durfte der Biologieleistungskurs der Alfred-Delp-Schule unter Kursleitung von Sven Remdisch das
Ein interessanter und arbeitsreicher Tag im livfe Biolab in Darmstadt Als einer der ersten Kurse überhaupt durfte der Biologieleistungskurs der Alfred-Delp-Schule unter Kursleitung von Sven Remdisch das
1 µl BamHI H 2 O 21 µl H 2 O 30 µl Volumen 18 µl H 2 O 30 µl Inkubation 2h @ 37 C 2h @ 37 C
 F1-Praktikum Genetik Protokoll Versuch 2: Nachweis der Funktion von Promotor- und Enhancer-Sequenzen mittels Reportergen-Assay Gruppe 8, Manfred Depner & Susanne Duncker Einführung Um die Funktion von
F1-Praktikum Genetik Protokoll Versuch 2: Nachweis der Funktion von Promotor- und Enhancer-Sequenzen mittels Reportergen-Assay Gruppe 8, Manfred Depner & Susanne Duncker Einführung Um die Funktion von
Kurs 5 Grundpraktikum Genetik
 WS 2018/19 BSc Modul 8 Kurs 5 Grundpraktikum Genetik Klassische Experimente der Gentechnologie: DNA-Klonierung Pt. 2 Thomas Hankeln & Christiane Kraemer AG Molekulargenetik & Genomanalyse (iome) Biolumineszenz
WS 2018/19 BSc Modul 8 Kurs 5 Grundpraktikum Genetik Klassische Experimente der Gentechnologie: DNA-Klonierung Pt. 2 Thomas Hankeln & Christiane Kraemer AG Molekulargenetik & Genomanalyse (iome) Biolumineszenz
Kurstage 7 und 8: Klassische Experimente der Gentechnologie
 Kurstage 7 und 8: Klassische Experimente der Gentechnologie Liga;on von DNA (Tag 7) Transforma;on von Bakterien (Tag 7) Auswertung der Transforma;on (Tag 8) Isolierung und Analyse von rekombinanter Plasmid
Kurstage 7 und 8: Klassische Experimente der Gentechnologie Liga;on von DNA (Tag 7) Transforma;on von Bakterien (Tag 7) Auswertung der Transforma;on (Tag 8) Isolierung und Analyse von rekombinanter Plasmid
1-A: Schneiden des Plasmids pucd-lacz mit dem Restriktionsenzym Ban II
 Arbeitsblatt 1 Analyse von DNA 1-A: Schneiden des Plasmids pucd-lacz mit dem Restriktionsenzym Ban II Bevor Sie anfangen: Alle Reagenzien müssen vor Gebrauch vollständig aufgetaut sein und durchmischt
Arbeitsblatt 1 Analyse von DNA 1-A: Schneiden des Plasmids pucd-lacz mit dem Restriktionsenzym Ban II Bevor Sie anfangen: Alle Reagenzien müssen vor Gebrauch vollständig aufgetaut sein und durchmischt
Identifizierung positiver Klone aus einer λ-phagenbibliothek
 Identifizierung positiver Klone aus einer λ-phagenbibliothek Betreuer: Elke Muth-Köhne und Nora Cavara Beginn des Versuchs: 9.00 Uhr im Praktikumssaal NBCF 04 Nord 1. Theoretischer Hintergrund 1.1 Screening
Identifizierung positiver Klone aus einer λ-phagenbibliothek Betreuer: Elke Muth-Köhne und Nora Cavara Beginn des Versuchs: 9.00 Uhr im Praktikumssaal NBCF 04 Nord 1. Theoretischer Hintergrund 1.1 Screening
3 GFP green fluorescent protein
 SCHNUPPERKURS GENTECHNIK 1 ExploHeidelberg 2 Klonierung des Phagen Lambda 3 GFP green fluorescent protein 4 Gens in a bottle Vanessa Hecht 1 ExploHeidelberg Stiftung Jugend und Wissenschaft GmbH Technologiepark
SCHNUPPERKURS GENTECHNIK 1 ExploHeidelberg 2 Klonierung des Phagen Lambda 3 GFP green fluorescent protein 4 Gens in a bottle Vanessa Hecht 1 ExploHeidelberg Stiftung Jugend und Wissenschaft GmbH Technologiepark
Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Tulpen
 Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Tulpen Vorbereitung auf diesen Praktikumsteil: Organisation 2. Praktikumstag: - Für den Bioinformatik-Teil benötigen Sie am 2. Tag dieses
Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Tulpen Vorbereitung auf diesen Praktikumsteil: Organisation 2. Praktikumstag: - Für den Bioinformatik-Teil benötigen Sie am 2. Tag dieses
Plasmid Mini Kit. Artikel-Nr Präparationen Präparationen Präparationen
 1 Datenblatt Artikel-Nr. 55.4000.010 10 Präparationen 55.4000.050 50 Präparationen 55.4000.250 250 Präparationen Verbessertes Protokoll mit neuen Puffern! Sicherheitsanweisungen Bitte gehen Sie mit allen
1 Datenblatt Artikel-Nr. 55.4000.010 10 Präparationen 55.4000.050 50 Präparationen 55.4000.250 250 Präparationen Verbessertes Protokoll mit neuen Puffern! Sicherheitsanweisungen Bitte gehen Sie mit allen
Methodensammlung der Bund/Länder-Arbeitsgemeinschaft Gentechnik (LAG) Differenzierung von E.coli-Stämmen mit Hilfe der Pulsfeldgelelektrophorese
 Methodensammlung der Bund/Länder-Arbeitsgemeinschaft Gentechnik (LAG) Differenzierung von E.coli-Stämmen mit Hilfe der Pulsfeldgelelektrophorese Erstellt vom Unterausschuss Methodenentwicklung der LAG,
Methodensammlung der Bund/Länder-Arbeitsgemeinschaft Gentechnik (LAG) Differenzierung von E.coli-Stämmen mit Hilfe der Pulsfeldgelelektrophorese Erstellt vom Unterausschuss Methodenentwicklung der LAG,
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers
 Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein (1) Kolonie-PCR Polymerase
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein (1) Kolonie-PCR Polymerase
Seminarbericht Jugendakademie Mannheim
 Seminarbericht Jugendakademie Mannheim Stiftung Begabtenförderung der Stadt Mannheim Oberstufe 2014/2015 Seminarthema: Biotechnologisches Praktikum Ort: BASF Agrarzentrum Limburgerhof BASF Ludwigshafen
Seminarbericht Jugendakademie Mannheim Stiftung Begabtenförderung der Stadt Mannheim Oberstufe 2014/2015 Seminarthema: Biotechnologisches Praktikum Ort: BASF Agrarzentrum Limburgerhof BASF Ludwigshafen
Nukleinsäure II Restriktionsverdau Ligation Transformation. Dr. Sandra Scheiblhofer
 Nukleinsäure II Restriktionsverdau Ligation Transformation Dr. Sandra Scheiblhofer Nukleasen Enzyme, die Nukleinsäuren abbauen Phosphidoesterasen hydrolytische Spaltung der Bindung zwischen Nukleotiden
Nukleinsäure II Restriktionsverdau Ligation Transformation Dr. Sandra Scheiblhofer Nukleasen Enzyme, die Nukleinsäuren abbauen Phosphidoesterasen hydrolytische Spaltung der Bindung zwischen Nukleotiden
GEIM- TECHIMOLOGISCHE ARBEITSMETHODEN
 GEIM- TECHIMOLOGISCHE ARBEITSMETHODEN Ein Handbuch experimenteller Techniken und Verfahren Herausgegeben von Rudolf Hagemann Bearbeitet von Frank Baldauf, Jörn Belter, Sabine Brantl, Baimund Eck, Karsten
GEIM- TECHIMOLOGISCHE ARBEITSMETHODEN Ein Handbuch experimenteller Techniken und Verfahren Herausgegeben von Rudolf Hagemann Bearbeitet von Frank Baldauf, Jörn Belter, Sabine Brantl, Baimund Eck, Karsten
Isolierung von Plasmid-DNA aus einem Bakterienlysat mittels Ionenaustauschchromatographie an einer DEAE-Säule
 Versuch 2 Isolierung von Plasmid-DNA aus einem Bakterienlysat mittels Ionenaustauschchromatographie an einer DEAE-Säule Versuchsbeschreibung Die Isolierung hochreiner Nucleinsäuren ist eine der grundlegenden
Versuch 2 Isolierung von Plasmid-DNA aus einem Bakterienlysat mittels Ionenaustauschchromatographie an einer DEAE-Säule Versuchsbeschreibung Die Isolierung hochreiner Nucleinsäuren ist eine der grundlegenden
Inhaltsverzeichnis. Polymerase Chain Reaction Theoretischer Hintergrund - 2 -
 Inhaltsverzeichnis 1 Theoretischer Hintergrund - 2-1.1 Die Komponenten der PCR - 2-1.2 Das Verfahren der PCR - 3-1.3 Die Gelelektrophorese - 5-2 Material und Methoden - 6-3 Ergebnisse - 7-3.1 Ergebnisse
Inhaltsverzeichnis 1 Theoretischer Hintergrund - 2-1.1 Die Komponenten der PCR - 2-1.2 Das Verfahren der PCR - 3-1.3 Die Gelelektrophorese - 5-2 Material und Methoden - 6-3 Ergebnisse - 7-3.1 Ergebnisse
DNA Isolierung. Praktikum Dr. László Kredics
 Isolierung Praktikum Dr. László Kredics SZTE, Inst. für Med. Biol., Praktikum -Isolierung Zellaufschluss Isolierung genomischer Isolierung von Plasmid Konzentrationsbestimmung der -Lösungen Anhand Absorptionswert
Isolierung Praktikum Dr. László Kredics SZTE, Inst. für Med. Biol., Praktikum -Isolierung Zellaufschluss Isolierung genomischer Isolierung von Plasmid Konzentrationsbestimmung der -Lösungen Anhand Absorptionswert
1. Beschreiben Sie die Rolle der folgenden Proteine bei der DNA- Replikation in E. coli:
 1. Beschreiben Sie die Rolle der folgenden Proteine bei der DNA- Replikation in E. coli: Übung 7 - DnaA bindet an 13 bp DNA Sequenz (DnaA Box, 5 Wiederholungen bei E. coli) im oric ori wird in AT reicher
1. Beschreiben Sie die Rolle der folgenden Proteine bei der DNA- Replikation in E. coli: Übung 7 - DnaA bindet an 13 bp DNA Sequenz (DnaA Box, 5 Wiederholungen bei E. coli) im oric ori wird in AT reicher
1. EINLEITUNG Der eukaryontische Translationsinitiationsfaktor 5A (eif5a) Der Polyaminbiosyntheseinhibitor Agmatin...
 1. EINLEITUNG... 14 1.1 Lebenszyklus der Malaria Erreger Plasmodium falciparum und Plasmodium vivax... 16 1.2 Molekulares Targeting... 18 1.2.1 Die alternative Fettesäurebiosynthese II in Plasmodium falciparum...
1. EINLEITUNG... 14 1.1 Lebenszyklus der Malaria Erreger Plasmodium falciparum und Plasmodium vivax... 16 1.2 Molekulares Targeting... 18 1.2.1 Die alternative Fettesäurebiosynthese II in Plasmodium falciparum...
Versuchsanleitung: RFLP als Modell für einen DNA-Fingerprint
 RFLP als Modell für einen DNA-Fingerprint Teil 1: Restriktionsverdau 1.1: Thermoblock / Wasserbad auf 37 C vorheizen 1.2: Puffer Y+/Tango auftauen und auf Eis stellen 1.3: 4 Proben, RSA I und H 2 O demin.
RFLP als Modell für einen DNA-Fingerprint Teil 1: Restriktionsverdau 1.1: Thermoblock / Wasserbad auf 37 C vorheizen 1.2: Puffer Y+/Tango auftauen und auf Eis stellen 1.3: 4 Proben, RSA I und H 2 O demin.
Methoden der Gentechnik
 Methoden der Gentechnik *** DNA-Rekombination und Klonierung *** 1. Allgemeine Grundprinzipien 1.1. Wesen der Gentechnik 1.2. Allgemeine Ziele der Gentechnik 1.3. Molekulare Voraussetzungen 1.4. Wichtige
Methoden der Gentechnik *** DNA-Rekombination und Klonierung *** 1. Allgemeine Grundprinzipien 1.1. Wesen der Gentechnik 1.2. Allgemeine Ziele der Gentechnik 1.3. Molekulare Voraussetzungen 1.4. Wichtige
Praxisworkshop DNA Extraktion und DNA Färbung
 Praxisworkshop DNA Extraktion und DNA Färbung Marc Grahmann, Prof. Dr. Hans Peter Klein, PD Dr. Paul Dierkes Abteilung für Didaktik der Biowissenschaften, FB15, Johann Wolfgang Goethe-Universität Frankfurt
Praxisworkshop DNA Extraktion und DNA Färbung Marc Grahmann, Prof. Dr. Hans Peter Klein, PD Dr. Paul Dierkes Abteilung für Didaktik der Biowissenschaften, FB15, Johann Wolfgang Goethe-Universität Frankfurt
7 Prinzipien und Methoden der DNA-Klonierung
 7 Prinzipien und Methoden der DNA-Klonierung Das Klonieren von DNA-Molekülen seien es DNA-Fragmente, komplette Gene oder sogar das ganze Genom eines Organismus stellt im Grunde genommen den Kern gentechnischer
7 Prinzipien und Methoden der DNA-Klonierung Das Klonieren von DNA-Molekülen seien es DNA-Fragmente, komplette Gene oder sogar das ganze Genom eines Organismus stellt im Grunde genommen den Kern gentechnischer
Abbildungsverzeichnis. Tabellenverzeichnis. Abkürzungsverzeichnis. 1 Einleitung 1
 Inhaltsverzeichnis Inhaltsverzeichnis I Abbildungsverzeichnis VI Tabellenverzeichnis VIII Abkürzungsverzeichnis IX 1 Einleitung 1 1.1 Wasser, ein limitierender Faktor für die Landwirtschaft 1 1.2 Anpassungen
Inhaltsverzeichnis Inhaltsverzeichnis I Abbildungsverzeichnis VI Tabellenverzeichnis VIII Abkürzungsverzeichnis IX 1 Einleitung 1 1.1 Wasser, ein limitierender Faktor für die Landwirtschaft 1 1.2 Anpassungen
Biochemisches Praktikum 1 DNA-Analytik Praktischer Teil
 Biochemisches Praktikum 1 DNA-Analytik Praktischer Teil 2 Inhaltsverzeichnis Sicherheitshinweise DNA-Analytik 1 Arbeitshinweise DNA-Analytik 2 Gießen von Agarosegelen 3 Isolierung genomischer DNA 4 Isolierung
Biochemisches Praktikum 1 DNA-Analytik Praktischer Teil 2 Inhaltsverzeichnis Sicherheitshinweise DNA-Analytik 1 Arbeitshinweise DNA-Analytik 2 Gießen von Agarosegelen 3 Isolierung genomischer DNA 4 Isolierung
Grundlagen der Klonierung. Analytische Methoden der Biologie SS09 7 Klonierung und Gentechnik. Modul
 Restriktion und Ligation: Restriktion und Ligation: Grundlagen der Klonierung Modul 2303-021 1 Restriktion und Ligation Verknüpfung von Fragmenten unterschiedlicher DNA Herkunft Restriktion und Ligation
Restriktion und Ligation: Restriktion und Ligation: Grundlagen der Klonierung Modul 2303-021 1 Restriktion und Ligation Verknüpfung von Fragmenten unterschiedlicher DNA Herkunft Restriktion und Ligation
Anorganische Chemie. Versuch 16 Titration einer schwachen Säure gegen eine starke Base. Versuchsteil 16.1 Potentiometrische Titration
 Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Georg-August-Universität Göttingen Fakultät für Biologie und Psychologie Anorganische Chemie Versuch 16 Titration einer schwachen Säure gegen eine starke Base Versuchsteil 16.1 Potentiometrische Titration
Biochemie und. chemischer Mechanismus
 Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Biochemie und chemischer Mechanismus der Thiomethylierung von RNA Dorothea Maria
Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München Biochemie und chemischer Mechanismus der Thiomethylierung von RNA Dorothea Maria
Robin Martin. Elektrophorese. von Nucleinsäuren
 Robin Martin Elektrophorese von Nucleinsäuren Abkürzungen 11 Vorwort 13 Danksagung 15 I. Grundprinzipien und Methoden 1. Einleitung: Verschiedene Arten und Formen von Nucleinsäure 19 1.1 Überblick 19
Robin Martin Elektrophorese von Nucleinsäuren Abkürzungen 11 Vorwort 13 Danksagung 15 I. Grundprinzipien und Methoden 1. Einleitung: Verschiedene Arten und Formen von Nucleinsäure 19 1.1 Überblick 19
DNA Isolierung. Praktikum Dr. László Kredics
 Isolierung Praktikum Dr. László Kredics Aufgabe: Isolierung von Plasmid aus Bakterienzellen Plasmid : pbluescript Vektor, Gröβe: 2960 Bps 1. 1,5 ml Bakterienkultur in Eppendorf-Röhrchen pipettieren, 2
Isolierung Praktikum Dr. László Kredics Aufgabe: Isolierung von Plasmid aus Bakterienzellen Plasmid : pbluescript Vektor, Gröβe: 2960 Bps 1. 1,5 ml Bakterienkultur in Eppendorf-Röhrchen pipettieren, 2
Versuch 3. Elektrophorese
 Versuch 3 Elektrophorese Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@mustermann.de X X X Prof. Dr. Schäfer Wird benotet?: 1. Einleitung Ziel des ersten Versuches
Versuch 3 Elektrophorese Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@mustermann.de X X X Prof. Dr. Schäfer Wird benotet?: 1. Einleitung Ziel des ersten Versuches
2) Mischen Sie daraufhin das Ligationsprodukt zusammen. Dazu werden 50 µl Zellen und 2 µl Plasmid zusammengegeben
 Translation of lab protocols Transformation Protocol 1) Stellen Sie die kompetenten Zellen auf Eis 2) Mischen Sie daraufhin das Ligationsprodukt zusammen. Dazu werden 50 µl Zellen und 2 µl Plasmid zusammengegeben
Translation of lab protocols Transformation Protocol 1) Stellen Sie die kompetenten Zellen auf Eis 2) Mischen Sie daraufhin das Ligationsprodukt zusammen. Dazu werden 50 µl Zellen und 2 µl Plasmid zusammengegeben
Plasmidisolierung. Mit Plasmiden können Sie Gene in Organismen einschleusen und so deren Eigenschaften verändern.
 Plasmidisolierung Mit Plasmiden können Sie Gene in Organismen einschleusen und so deren Eigenschaften verändern. Was können Sie lernen? Sie lernen eine ringförmige DNA, ein Plasmid, zu isolieren. Mit diesem
Plasmidisolierung Mit Plasmiden können Sie Gene in Organismen einschleusen und so deren Eigenschaften verändern. Was können Sie lernen? Sie lernen eine ringförmige DNA, ein Plasmid, zu isolieren. Mit diesem
1 Einleitung... 13. 1.1 Staphylokokken... 13. 1.2 Koagulase-negative Staphylokokken... 13. 1.4 MSCRAMM-Proteine... 16. 1.5 LPXTG-Motive...
 Inhaltsverzeichnis 1 Einleitung... 13 1.1 Staphylokokken... 13 1.2 Koagulase-negative Staphylokokken... 13 1.3 Staphylococcus saprophyticus... 14 1.4 MSCRAMM-Proteine... 16 1.5 LPXTG-Motive... 16 1.6 Oberflächenassoziierte
Inhaltsverzeichnis 1 Einleitung... 13 1.1 Staphylokokken... 13 1.2 Koagulase-negative Staphylokokken... 13 1.3 Staphylococcus saprophyticus... 14 1.4 MSCRAMM-Proteine... 16 1.5 LPXTG-Motive... 16 1.6 Oberflächenassoziierte
Überproduktion der Taq DNA Polymerase mit rekombinanten E. coli Zellen
 Überproduktion der Taq DNA Polymerase mit rekombinanten E. coli Zellen Versuchsleiter: Bernhard Eikmanns Protokollführung: Karl Varadi Gruppe: 11 Durchführung: 11.11 15.11.2002 Protokoll testiert: WS02
Überproduktion der Taq DNA Polymerase mit rekombinanten E. coli Zellen Versuchsleiter: Bernhard Eikmanns Protokollführung: Karl Varadi Gruppe: 11 Durchführung: 11.11 15.11.2002 Protokoll testiert: WS02
Antibiotika sind oft Inhibitoren der Genexpression
 Antibiotika sind oft Inhibitoren der Genexpression Inhibitoren der Transkription: Rifampicin, Actinomycin α-amanitin Inhibitoren der Translation: Puromycin, Streptomycin, Tetracycline, Chloramphenicol
Antibiotika sind oft Inhibitoren der Genexpression Inhibitoren der Transkription: Rifampicin, Actinomycin α-amanitin Inhibitoren der Translation: Puromycin, Streptomycin, Tetracycline, Chloramphenicol
Facharbeit. Restriktionsverdau am Plasmid puc 18 mit verschiedenen Enzymen
 Bernhard Strigel Gymnasium Kollegstufe/ Jahrgang: 2007/ 2009 Memmingen Leistungskurs: Biologie Kollegiat: Stefanie Funk Facharbeit Restriktionsverdau am Plasmid puc 18 mit verschiedenen Enzymen Abgegeben
Bernhard Strigel Gymnasium Kollegstufe/ Jahrgang: 2007/ 2009 Memmingen Leistungskurs: Biologie Kollegiat: Stefanie Funk Facharbeit Restriktionsverdau am Plasmid puc 18 mit verschiedenen Enzymen Abgegeben
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016
 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 2 (06.06. 10.06.) DNA-Schäden, Mutationen und Reparatur 1.
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 2 (06.06. 10.06.) DNA-Schäden, Mutationen und Reparatur 1.
Gentechnologie für Einsteiger
 T. A. Brown Gentechnologie für Einsteiger 3. Auflage Aus dem Englischen übersetzt von Sebastian Vogel Spektrum Akademischer Verlag Heidelberg Berlin Vorwort Vorwort zur dritten englischen Auflage Vorwort
T. A. Brown Gentechnologie für Einsteiger 3. Auflage Aus dem Englischen übersetzt von Sebastian Vogel Spektrum Akademischer Verlag Heidelberg Berlin Vorwort Vorwort zur dritten englischen Auflage Vorwort
Biologische Übungen III Donnerstag, Kurs 2- Ames Test. Arbeitsgruppe D6: Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann
 Biologische Übungen III Donnerstag, 14.11.2003 Kurs 2- Ames Test Arbeitsgruppe D6: Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Protokoll: Einleitung Im heutigen Kurs haben wir den Ames Test
Biologische Übungen III Donnerstag, 14.11.2003 Kurs 2- Ames Test Arbeitsgruppe D6: Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Protokoll: Einleitung Im heutigen Kurs haben wir den Ames Test
Plasmid Mini Kit PLUS
 Datenblatt Artikel-Nr.: 55.4500.010 10 Präparationen 55.4500.050 50 Präparationen 55.4500.250 250 Präparationen Sicherheitsanweisungen Bitte gehen Sie mit allen Materialien und Reagenzien, die im Kit enthalten
Datenblatt Artikel-Nr.: 55.4500.010 10 Präparationen 55.4500.050 50 Präparationen 55.4500.250 250 Präparationen Sicherheitsanweisungen Bitte gehen Sie mit allen Materialien und Reagenzien, die im Kit enthalten
Hochdurchsatz Generierung und Analyse von Arabidopsis thaliana-proteinen
 MAX-PLANCK-INSTITUT FÜR MOLEKULARE GENETIK Hochdurchsatz Generierung und Analyse von Arabidopsis thaliana-proteinen Dissertation zur Erlangung der Doktorwürde des Fachbereichs Biologie, Chemie, Pharmazie
MAX-PLANCK-INSTITUT FÜR MOLEKULARE GENETIK Hochdurchsatz Generierung und Analyse von Arabidopsis thaliana-proteinen Dissertation zur Erlangung der Doktorwürde des Fachbereichs Biologie, Chemie, Pharmazie
1. Einleitung S. 1 1.1. Zelladhäsionsmoleküle S. 1 1.2. Die Immunglobulin-Superfamilie S. 2. 1.2.1. Das neurale Zelladhäsionsmolekül NCAM S.
 Inhaltsverzeichnis 1. Einleitung S. 1 1.1. Zelladhäsionsmoleküle S. 1 1.2. Die Immunglobulin-Superfamilie S. 2 1.2.1. Das neurale Zelladhäsionsmolekül NCAM S. 4 1.2.1.1. Molekulare Struktur von NCAM S.
Inhaltsverzeichnis 1. Einleitung S. 1 1.1. Zelladhäsionsmoleküle S. 1 1.2. Die Immunglobulin-Superfamilie S. 2 1.2.1. Das neurale Zelladhäsionsmolekül NCAM S. 4 1.2.1.1. Molekulare Struktur von NCAM S.
Vererbung. Die durch Fortpflanzung entstandene Nachkommenschaft gleicht den Elternorganismen weitgehend
 Vererbung Die durch Fortpflanzung entstandene Nachkommenschaft gleicht den Elternorganismen weitgehend Klassische Genetik Äußeres Erscheinungsbild: Phänotypus setzt sich aus einer Reihe von Merkmalen (Phänen))
Vererbung Die durch Fortpflanzung entstandene Nachkommenschaft gleicht den Elternorganismen weitgehend Klassische Genetik Äußeres Erscheinungsbild: Phänotypus setzt sich aus einer Reihe von Merkmalen (Phänen))
3 ERGEBNISSE 3.1 PLASMIDKONSTRUKTIONEN UND -PRÄPARATIONEN
 ERGEBNISSE Die Zielsetzung dieser Arbeit ist es, ein in-vitro-modell zur Bestimmung der Zyto- und Genotoxizität zu konstruieren. Zur Entwicklung des Genotoxizitätsmodells wurde der Vektor pnf-κb/neo unter
ERGEBNISSE Die Zielsetzung dieser Arbeit ist es, ein in-vitro-modell zur Bestimmung der Zyto- und Genotoxizität zu konstruieren. Zur Entwicklung des Genotoxizitätsmodells wurde der Vektor pnf-κb/neo unter
Versuchsanleitung. Inhaltsverzeichnis. Restriktionsenzyme. Von Magnus Mauer. VAD_Biologie_Restriktionsenzyme.doc
 Restriktionsenzyme Von Magnus Mauer Inhaltsverzeichnis II Zielsetzung. Seite 02 III Hintergrundinformationen Seite 02 IV Restriktionsenzyme in der Gentechnik (Kopiervorlage für Schüler).... Seite 06 IV
Restriktionsenzyme Von Magnus Mauer Inhaltsverzeichnis II Zielsetzung. Seite 02 III Hintergrundinformationen Seite 02 IV Restriktionsenzyme in der Gentechnik (Kopiervorlage für Schüler).... Seite 06 IV
Auf der Suche nach der Wundermedizin
 Auf der Suche nach der Wundermedizin Experimente im Schullabor 1 Herausgeber Novartis Pharma AG, CH-4002 Basel Autoren: Dr. Gesche Standke und Dr. Christiane Röckl Michel Zeichnungen: Fonds der Chemischen
Auf der Suche nach der Wundermedizin Experimente im Schullabor 1 Herausgeber Novartis Pharma AG, CH-4002 Basel Autoren: Dr. Gesche Standke und Dr. Christiane Röckl Michel Zeichnungen: Fonds der Chemischen
Genetik Praktikumsklausur SS2005
 Genetik Praktikumsklausur SS2005 1. Aufgabe: Der Genotyp AbaB wird geselbstet, dabei werden 256 Nachkommen gebildet. Davon erhalten 16 Pflanzen den Genotyp ABAB a) gekoppelt b) nicht gekoppelt c) teilweise
Genetik Praktikumsklausur SS2005 1. Aufgabe: Der Genotyp AbaB wird geselbstet, dabei werden 256 Nachkommen gebildet. Davon erhalten 16 Pflanzen den Genotyp ABAB a) gekoppelt b) nicht gekoppelt c) teilweise
Klonierung von S2P Rolle der M19-Zellen. POL-Seminar der Biochemie II 13.02.2007 Sebastian Gabriel
 Klonierung von S2P Rolle der M19-Zellen POL-Seminar der Biochemie II 13.02.2007 Sebastian Gabriel Inhalt 1. Was ist eine humane genomische DNA-Bank? 2. Unterschied zwischen cdna-bank und genomischer DNA-Bank?
Klonierung von S2P Rolle der M19-Zellen POL-Seminar der Biochemie II 13.02.2007 Sebastian Gabriel Inhalt 1. Was ist eine humane genomische DNA-Bank? 2. Unterschied zwischen cdna-bank und genomischer DNA-Bank?
Vorbereitung. 4) Durchführungshinweise: 4.1 Prinzip erklären: Ablauf mit Zeitplanung und Gerätschaften 4.2 Pipettieren üben mit Aqua dest.!
 Vorbereitung 1) am Vortag o.ä.: (wie Versuch 4) 1.1 Arbeitsblätter kopieren / bereitlegen. fertiges (Ergebnis-)Gel überprüfen Vorratslösungen überprüfen: Elektrophorese-Puffer, Aqua dest., Färbelösung
Vorbereitung 1) am Vortag o.ä.: (wie Versuch 4) 1.1 Arbeitsblätter kopieren / bereitlegen. fertiges (Ergebnis-)Gel überprüfen Vorratslösungen überprüfen: Elektrophorese-Puffer, Aqua dest., Färbelösung
1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen:
 Übung 10 1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen: a. Eine Mutation, die zur Expression eines Repressors führt, der nicht mehr an den Operator binden kann.
Übung 10 1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen: a. Eine Mutation, die zur Expression eines Repressors führt, der nicht mehr an den Operator binden kann.
Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005
 Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005 F1 Molekulare Zoologie Teil II: Expressionsanalyse Proteinexpressionsanalyse
Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005 F1 Molekulare Zoologie Teil II: Expressionsanalyse Proteinexpressionsanalyse
Protokoll Versuch A1 Klonierung des Tyro3-D1D2-Fragments mittels PCR
 Protokoll Versuch A1 Klonierung des Tyro3-D1D2-Fragments mittels PCR Gruppe 8 Susanne Duncker und Friedrich Hahn Einleitung und Aufgabenstellung Ziel dieses Versuchs ist es, das Gen für ein bestimmtes
Protokoll Versuch A1 Klonierung des Tyro3-D1D2-Fragments mittels PCR Gruppe 8 Susanne Duncker und Friedrich Hahn Einleitung und Aufgabenstellung Ziel dieses Versuchs ist es, das Gen für ein bestimmtes
6. Induktion der Galactosidase von Escherichia coli
 Johannes Gutenberg-Universität Mainz Institut für Mikrobiologie und Weinforschung FI-Übung: Identifizierung, Wachstum und Regulation (WS 2004/05) Sebastian Lux Datum: 19.1.2005 6. Induktion der Galactosidase
Johannes Gutenberg-Universität Mainz Institut für Mikrobiologie und Weinforschung FI-Übung: Identifizierung, Wachstum und Regulation (WS 2004/05) Sebastian Lux Datum: 19.1.2005 6. Induktion der Galactosidase
1. Grundoperationen der Gentechnik Schneiden von DNA
 1. Grundoperationen der Gentechnik Schneiden von DNA Eines der wichtigsten Werkzeuge der Gentechnik sind Restriktionsenzyme. Sie dienen sowohl dazu, die DNA aus dem Spenderorganismus in Bruchstücke zu
1. Grundoperationen der Gentechnik Schneiden von DNA Eines der wichtigsten Werkzeuge der Gentechnik sind Restriktionsenzyme. Sie dienen sowohl dazu, die DNA aus dem Spenderorganismus in Bruchstücke zu
Die Häufigkeit illegitimer Rekombination an den Grenzen homologer Rekombinationsbereiche in Acinetobacter baylyi
 Fortgeschrittenenpraktikum Genetik WS 2007/2008 Die Häufigkeit illegitimer Rekombination an den Grenzen homologer Rekombinationsbereiche in Acinetobacter baylyi Johann de Vries AG Neurogenetik Institut
Fortgeschrittenenpraktikum Genetik WS 2007/2008 Die Häufigkeit illegitimer Rekombination an den Grenzen homologer Rekombinationsbereiche in Acinetobacter baylyi Johann de Vries AG Neurogenetik Institut
TEV Protease, rekombinant (Kat.-Nr )
 GEBRAUCHSANLEITUNG TEV Protease, rekombinant (Kat.-Nr. 36403) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010 e-mail: info@serva.de -http://www.serva.de
GEBRAUCHSANLEITUNG TEV Protease, rekombinant (Kat.-Nr. 36403) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010 e-mail: info@serva.de -http://www.serva.de
1. Nennt Informationen, die ein Wissenschaftler für die Durchführung des farbig markierten Schrittes benötigt. 2. Nennt zusätzliche Probleme die bei
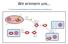 Wir erinnern uns 1. Nennt Informationen, die ein Wissenschaftler für die Durchführung des farbig markierten Schrittes benötigt. 2. Nennt zusätzliche Probleme die bei der Verwendung eines Gens aus einer
Wir erinnern uns 1. Nennt Informationen, die ein Wissenschaftler für die Durchführung des farbig markierten Schrittes benötigt. 2. Nennt zusätzliche Probleme die bei der Verwendung eines Gens aus einer
Synthese von cis- und trans-stilben
 28. April 2008 eifer Manuel raktikum in Organischer Chemie (OC 1) Frühjahrssemester 2008 529-0230-00L eifer Manuel Synthese von cis- und trans-stilben Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich
28. April 2008 eifer Manuel raktikum in Organischer Chemie (OC 1) Frühjahrssemester 2008 529-0230-00L eifer Manuel Synthese von cis- und trans-stilben Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich
GENSPIRALE- PRAKTIKUM 1
 GENSPIRALE- PRAKTIKUM 1 FRAGE- UND PROBLEMSTELLUNG In diesem Praktikum, das am Anfang von dreien Genspirale-Praktika steht, soll zuerst das gentechnische und sterile Arbeiten gelernt werden. Anschliessend
GENSPIRALE- PRAKTIKUM 1 FRAGE- UND PROBLEMSTELLUNG In diesem Praktikum, das am Anfang von dreien Genspirale-Praktika steht, soll zuerst das gentechnische und sterile Arbeiten gelernt werden. Anschliessend
3.5 Moderne Genetik - Vorgänge
 3.5 Moderne Genetik - Vorgänge Der genetische Code Jedes Gen besteht aus sogenannten Basentriplets. Das ist eine Sequenz von drei aufeinanderfolgenden Nukleinbasen, die für eine bestimmte Aminosäure stehen.
3.5 Moderne Genetik - Vorgänge Der genetische Code Jedes Gen besteht aus sogenannten Basentriplets. Das ist eine Sequenz von drei aufeinanderfolgenden Nukleinbasen, die für eine bestimmte Aminosäure stehen.
MOLEKULARBIOLOGISCHE METHODEN
 45 MOLEKULARBIOLOGISCHE METHODEN Die Technik der DNA-Rekombination, auch als Gentechnik bezeichnet, erlaubt die Isolierung von DNA-Abschnitten (genomische oder cdna), deren Sequenzbestimmung, Modifikation
45 MOLEKULARBIOLOGISCHE METHODEN Die Technik der DNA-Rekombination, auch als Gentechnik bezeichnet, erlaubt die Isolierung von DNA-Abschnitten (genomische oder cdna), deren Sequenzbestimmung, Modifikation
Abbildungs- und Tabellenverzeichnis Abkürzungsverzeichnis Genbezeichnung. 1. Einleitung 1
 Abbildungs- und Tabellenverzeichnis Abkürzungsverzeichnis Genbezeichnung VI VIII X 1. Einleitung 1 1.1 Das Plastom 1 1.2 Transkription in Chloroplasten 4 1.2.1 Die plastidäre Transkriptionsmaschinerie
Abbildungs- und Tabellenverzeichnis Abkürzungsverzeichnis Genbezeichnung VI VIII X 1. Einleitung 1 1.1 Das Plastom 1 1.2 Transkription in Chloroplasten 4 1.2.1 Die plastidäre Transkriptionsmaschinerie
Herstellung kompetenter Zellen und Überprüfung des Kompetenzerhaltes
 Bernhard-Strigel-Gymnasium Memmingen 1 Kollegstufe Jahrgang: 2006/2008 Leistungskurs: Biologie Kollegiat: Jana Krieger FACHARBEIT Herstellung kompetenter Zellen und Überprüfung des Kompetenzerhaltes Abgegeben
Bernhard-Strigel-Gymnasium Memmingen 1 Kollegstufe Jahrgang: 2006/2008 Leistungskurs: Biologie Kollegiat: Jana Krieger FACHARBEIT Herstellung kompetenter Zellen und Überprüfung des Kompetenzerhaltes Abgegeben
Induktion der β-galaktosidase von Escherichia coli
 Induktion der β-galaktosidase von Escherichia coli 1. Einleitung Das Bakterium Escherichia coli ist in der Lage verschiedene Substrate für seinen Stoffwechsel zu nutzen. Neben Glucose und Acetat kann es
Induktion der β-galaktosidase von Escherichia coli 1. Einleitung Das Bakterium Escherichia coli ist in der Lage verschiedene Substrate für seinen Stoffwechsel zu nutzen. Neben Glucose und Acetat kann es
Gentechnische Methoden
 Desmond S. T. Nicholl Gentechnische Methoden 2. Auflage Aus dem Englischen übersetzt von Renate FitzRoy und Kurt Beginnen Spektrum Akademischer Verlag Heidelberg Berlin Inhalt Vorwort XI 1. 1.1 1.2 1.3
Desmond S. T. Nicholl Gentechnische Methoden 2. Auflage Aus dem Englischen übersetzt von Renate FitzRoy und Kurt Beginnen Spektrum Akademischer Verlag Heidelberg Berlin Inhalt Vorwort XI 1. 1.1 1.2 1.3
1. Proteinnachweis mit Bradford-Farbreagenz
 1. Proteinnachweis mit Bradford-Farbreagenz 96-well-Platte Pipetten (10, 20 und 200 µl) Pipettenspitzen Proteinvorratslösung (1 mg/ml Albumin in destillierten Wasser) Destilliertes Wasser Bradford Farbreagenz
1. Proteinnachweis mit Bradford-Farbreagenz 96-well-Platte Pipetten (10, 20 und 200 µl) Pipettenspitzen Proteinvorratslösung (1 mg/ml Albumin in destillierten Wasser) Destilliertes Wasser Bradford Farbreagenz
Novartis Pharma AG Schullabor. Wundermedizin. Experimente im Schullabor
 Novartis Pharma AG Schullabor Wundermedizin Experimente im Schullabor 2017 Experiment A 1. Markieren Sie die bunten Röhrchen auf dem Deckel mit Ihrem Gruppenzeichen (zum Beispiel *, X, oder etc.) 2. Die
Novartis Pharma AG Schullabor Wundermedizin Experimente im Schullabor 2017 Experiment A 1. Markieren Sie die bunten Röhrchen auf dem Deckel mit Ihrem Gruppenzeichen (zum Beispiel *, X, oder etc.) 2. Die
Nukleinsäuren (Prof. Stradal)
 26.11. 30.11.2012 Nukleinsäuren (Prof. Stradal) 1 Laborbiologie: Biomoleküle Versuchswoche DNA Lernziele sind die Kenntnis: des molekularen Aufbaus und der wichtigsten Eigenschaften der Nukleinsäurebasen,
26.11. 30.11.2012 Nukleinsäuren (Prof. Stradal) 1 Laborbiologie: Biomoleküle Versuchswoche DNA Lernziele sind die Kenntnis: des molekularen Aufbaus und der wichtigsten Eigenschaften der Nukleinsäurebasen,
Prostaglandinstoffwechsel in Trypanosoma brucei: Klonierung und Charakterisierung der Prostaglandin F 2a Synthase und der PGD 2 induzierte Zelltod
 Prostaglandinstoffwechsel in Trypanosoma brucei: Klonierung und Charakterisierung der Prostaglandin F 2a Synthase und der PGD 2 induzierte Zelltod DISSERTATION der Fakultät für Chemie und Pharmazie der
Prostaglandinstoffwechsel in Trypanosoma brucei: Klonierung und Charakterisierung der Prostaglandin F 2a Synthase und der PGD 2 induzierte Zelltod DISSERTATION der Fakultät für Chemie und Pharmazie der
Akkreditierte Lehrerfortbildung im Fachgebiet Genetik
 Akkreditierte Lehrerfortbildung im Fachgebiet Genetik für die Sekundarstufen I und II Ein Schüler einer 13. Klasse belädt eine Geltasche mit seiner eigenen DNA-Probe. Fotos: M. Grüning / T. Goebel, Science
Akkreditierte Lehrerfortbildung im Fachgebiet Genetik für die Sekundarstufen I und II Ein Schüler einer 13. Klasse belädt eine Geltasche mit seiner eigenen DNA-Probe. Fotos: M. Grüning / T. Goebel, Science
PROTRANS Elektrophorese Equipment
 Elektrophorese Equipment Elektrophorese Einheit 4x25 REF 210 000 Mit dem Elektrophorese Equipment ist es auf schnelle und einfache Art möglich, bis zu 100 PCR Amplifikate oder DNA Fragmente in einem einzigen
Elektrophorese Equipment Elektrophorese Einheit 4x25 REF 210 000 Mit dem Elektrophorese Equipment ist es auf schnelle und einfache Art möglich, bis zu 100 PCR Amplifikate oder DNA Fragmente in einem einzigen
