Erforderliche Stoffdaten zur Auslegung Technischer Prozesse
|
|
|
- Reinhardt Meinhardt
- vor 6 Jahren
- Abrufe
Transkript
1 .0.99 Erforderliche Stoffdaten zur Auslegung Technischer Prozesse Reaktor Chem. Gleichgewicht ( g B o, h B o, c P o ) Reaktionskinetik Phasengleichgewicht Enthalpie Viskosität Stofftransport... Phasenscheider (Flash Drum) Phasengleichgewicht Sättigungsdampfdruck Verdampfungsenthalpie... Pumpe Viskosität Dichte Bedeutung Wärmetauscher Molwärme Verdampfungsenthalpie Wärmeleitfähigkeit Viskosität Phasengleichgewicht... Destillationskolonne Phasengleichgewicht Sättigungsdampfdruck Verdampfungsenthalpie Dichte Viskosität...
2 Beschaffung von Stoffdaten als f (T,P) Eperimentelle Daten (z.b. aus Tabellenwerken, Datenbanken, über Korrelationen) Anwendungen von Abschätzmethoden. Basierend auf empirischen, halbtheoretischen oder theoretischen Ansätzen a) z.b. Guldbergsche Regel T S /T kr =/3 Troutonsche Regel h V =90 T S [J/mol] b) ideales Gasgesetz c) Clausius-Clapeyron-Gleichung. Korrespondenzmethoden (generalisierte Zustandsgleichungen) a) Zweiparameter-Korrespondenzprinzip b) Dreiparameter-Korrespondenzprinzip 3. Gruppenbeitragsmethoden, basierend auf: a) den Beiträgen der Elemente b) den Beiträgen der Strukturgruppen c) wie b) und zusätzlich Beitrag der nächsten Nachbargruppen d) wie c) und zusätzlich Beiträge der übernächsten Nachbargruppen
3 Beziehungen zur Abschätzung verschiedener Reinstoffdaten (Joback, Reid) PvT 3
4 .0.99 Ausgewählte Gruppenparameter (Joback) PvT 4
5 .0.99 Abschätzmethode nach Joback, ausgewählte Gruppenbeiträge Bildung 5
6 Berechnung der Standardbildungsgrößen im idealen Gaszustand Beispiel: Ethanol bei 98.5 K (Joback-Methode) Standardbildungsenthalpie (kj/mol) Gibbsche Standardbildungsenthalpie (kj/mol) CH CH OH ARTIST Summe Literatur: kj/mol kj/mol 6
7 Verdampfungsenthalpie verschiedener Komponenten als Funktion der Temperatur Clausius Clapeyron Gl. : * V v ( ) h = h h = T v v v >> v V L V L L dp dt ( entfernt vom kritischen Punkt) V RT v s P s s RT dp d lnp hv = = R s P dt d T * auch für andere Phasenübergänge S Loder S V s 7
8 Inhalt der Vorlesung Grundlagen der Technischen Chemie Unterschied Labor - Technik a) größerer Maßstab b) Wirtschaftlichkeit Geschichte der industriellen Chemie Rohstoff und Energiesituation Grundbegriffe (Umsatz, Selektivität, Ausbeute) Produkte der chemischen Industrie Grundlagen Reaktionskinetik (homogen) Stofftransport Wärmetransport Thermodynamik a) Reaktionsenthalpie, chemisches Gleichgewicht b) Phasengleichgewicht c) Stoffdaten Aufstellung und Lösung von Bilanzgleichungen a) Reaktionstechnik (CSTR, PFR) b) *Grundoperationen (z.b. Rektifikation) Thermische Trennverfahren Rektifikation*, Etraktion, Absorption, Kristallisation, Adsorption, Membrantrennverfahren Herstellung der Grundchemikalien Erdöldestillation, Chemische Raffinerie Steamcracker (C4- und Aromatenaufarbeitung) Steamreforming Produktstammbäume Ausgewählte Chemische Prozesse Vinylchlorid Ethylenoid Kostenrechnung 8
9 .0.99 Auslegung z.b. einer Vinylacetat-Anlage C H 4 + CH 3 COOH + ½ O Auslegung, d.h. Festlegung der Größe der CH 3 COOCH=CH + H O Apparate (z.b. Reaktor, Trennkolonne) (eotherm) geschieht durch Lösung der Bilanzgleichungen (Mengen- und Enthalpiebilanz) eines mathematischen Modells des betrachteten Prozesses Bedeutung Nebenreaktionen, z.b.: C H O CO + H O (Acetaldehyd, Ethylacetat,.. ) 9
10 Mengenbilanz ( kontinuierliches Verfahren, Molbasis ) n o - n e + R = W R n : eintretender Strom o n : austretender Strom e n o n e R : Mengenänderung durch chemische Reaktion R = r V i R W W : Akkumulation W = dn / dt i Grenzfälle: stationärer Fall: W = 0 keine chemische Reaktion: R = 0 diskontinuierlich: n o = n e = 0 Anmerkung: alle Ströme / Mengen: [kmol/h] 0
11 Enthalpiebilanz ( kontinuierliches Verfahren, Molbasis ) H - H + Q + Q = Q o e T R W Q R H o: eintretender Enthalpiestrom H = n c (T - T*) o o P,o o H o H e H e: austretender Enthalpiestrom H e = n e c P,e (T e - T*) Q : Wärmestrom durch chemische Reaktion R Q = -r V h R i R R Q : ausgetauschter Wärmestrom T Q = k A T T w Q W: akkumulierter Wärmestrom Q = dq/dt W Q T QW Grenzfälle: stationärer Fall: Q W = 0 adiabatisch: Q T = 0 keine chemische Reaktion: Q R = 0 diskontinuierlich: H = H = 0 Anmerkungen: alle Enthalpie- / Wärmeströme: [kj/h] T* = Referenztemperatur o e
12 Idealer Rührkessel ( continuous stirred tank reactor (CSTR) ( totale Rückvermischung )) z.b. Reaktion. Ordnung: A B c A c A c Ao c Ao n V Ao o c Ao XAo n V Ae e c Ae c Ae XAe t V R c A f() c Ae c A f(t) r A f() Bilanzraum V R stationärer Fall Mengenbilanz: n - n + r V = 0 Ao Ae A R
13 Ideales Rohr ( plug flow reactor (PFR) (keine Rückvermischung)) pfr.cdr, z.b. Reaktion. Ordnung: A B n Ao Vo Bilanzraum dv R n A n A + dna c Ao X c X Ao Ae 0 L c Ao c Ae c A = 0 = L/ = L n V Ae e t Ae c A = f() c Ao c Ae c A r = f() A -r A = k cao L -r A = k cae c A() f(t) stationärer Fall Mengenbilanz für dv : R n A - (n A + dn A ) + radv R = 0 3
14 Berechnung der Raumzeit (des Reaktorvolumens) für gewünschten Umsatz bei isothermer Fahrweise * Umsatz X A Kontinuierlicher idealer Rührkessel (continuous stirred tank reactor) X A τ CSTR = k X A Kontinuierliches ideales Rohr (plug flow reactor) τ = PFR ln k X A X A = X A = X A = *Reaktion. Ordnung: A B Annahme: k = h - keine Dichteänderung 4
15 Temperaturverlauf Rohrreaktor bei eothermer Reaktion T hot spot = Q & & & & R > Q A Q R < Q A f (r,v,c Ao, h R,k W,k(T)) A B z.b.. r Α = k(t) c A Temper ratur Temperatur T T L steigende k(t) sinkende Konz. c A Reaktionsmedium T L dq & A = kw da T= kw π r dl T dq & = k(t) c dv ( h ) R A R R = k(t) c A π r dl ( h R ) T Kühlmittel (z.b. siedendes Wasser bei entsprechendem Druck) Länge L 6
16 .0.99 Schema einer Vinylacetat-Anlage (vereinfacht) C H 4 + CH 3 COOH + ½ O CH 3 COOCH=CH + H O (eotherm) Bedeutung Nebenreaktionen, z.b.: C H O CO + H O (Acetaldehyd, Ethylacetat,.. ) 7
17 .0.99 Allgemeines Schema eines Trennprozesses Trennhilfsmittel Feed Trennhilfsmittel Energie Stufe Trennprozess Rektifikation Kristallisation... Ströme unterschiedlicher Zusammensetzung Zusatzstoff Energie + Zusatzstoff Absorption Flüssig-Flüssig-Etraktion, Fest-Flüssig-Etraktion, Etraktion mit überkritischen Fluiden Adsorption Membrantrennverfahren Azeotrope und etraktive Rektifikation 8
18 Erreichbare Anreicherung in einer theoretischen Trennstufe für ein System mit Trennfaktor α =.5 y F V y L Welche Konzentrationen ergeben sich bei einer Feedmenge von kmol/h und einer Feedkonzentration von = 0.5 bei einem Dampfstrom von 0.5 kmol/h? α = + ( α ) = L + V y F z y = = (. 5 ) y = +. 5 (. 5 ) 0.5 = y = y = 0.66
19 Aufbau einer Rektifikationskolonne (Bodenkolonne) Kondensator Kühlmedium (oft Kühlwasser) evtl. Rücklauf L R Destillat D d.h. typische Rektifikationskolonne besteht aus: Zulauf (Feed) F evtl. mehreren Stufen Verdampfer Kondensator evtl. Stromführung: evtl. Gegenstrom zu unterscheiden: Verdampfer Ablauf B Verstärkungsteil Abtriebsteil Heizmedium (oft H O-Dampf) 5
20 Vorderansicht und Draufsicht eines Bodens einer Siebbodenkolonne Seitensansicht abhängig vom Durchmesser auch mehrflutige Böden Draufsicht 7
21 Typische Bodenkolonne Glockenböden Ventilböden Ziel: guter Stoffaustausch (turbulente Bedingungen, große Phasengrenzfläche Tunnelböden 8
22 Typische Packungskolonne a) Flüssigkeitsverteiler b) Flüssigkeitssammler* c) Packung wünschenswert: geringer Druckverlust P HETP gering möglichst hohe Flüssigkeits- und Dampfbelastung geringer Durchmesser d) Tragerost e) Mannloch f) Flüssigkeitswiederverteiler g) Niederhalterost *bei geringem Durchmesser Wandabweiser ausreichend 9
23 Verschiedene Füllkörper der Fa. Raschig 30
24 Schritte bei der Entwicklung geordneter Packungen Entwicklung bei der Fa. Sulzer ca. 955 (Ziel: D O-Gewinnung) zu unterscheiden: Blech- und Gewebepackung. Weiterhin: Typ X 30 Grad Neigung geringerer Druckverlust als Typ Y mit 45 Grad Neigung. jedoch schlechterer Stoffaustausch 3
25 Zu lösende Fragen bei der Auslegung kontinuierlicher Rektifikationskolonnen Art der Kolonne (Boden- bzw. Füllkörperkolonne) bei welchem Druck soll die Kolonne arbeiten (üblicherweise: Atmosphärendruck) Anzahl der benötigten theoretischen (praktischen) Stufen (bzw. Höhe) der Kolonne Festlegung der Destillatmenge Rücklaufverhältnis Feedströme wo welche Mengen thermischer Zustand flüssige (dampfförmige) Seitenströme? wo welche Mengen welche Energiemengen müssen zu- (Verdampfer) bzw. abgeführt (Kondensator) werden Durchmesser evtl. Zulauf (Feed) F evtl. Rücklauf L R evtl. evtl. Heizmedium (oft H O-Dampf) Kondensator Kühlmedium (oft Kühlwasser) Destillat D Verdampfer Ablauf B 3
26 Auslegung, d.h. Bestimmung der erforderlichen Trennstufen bzw. Höhe der Packung in Packungskolonnen A) Konzept der idealen Trennstufe (Gleichgewichtsstufenkonzept) bietet sich für Bodenkolonnen an benötigt werden: K i als f(,t,p), h L, h V B) Stoff- und Wärmeübergangsmodell (Konzept der Übertragungseinheit) bietet sich für Packungskolonnen an benötigt werden β Gi, β Li, a, α als f(,t,p) und hydrodynamischen Bedingungen, f(packung), h L, h V 33
27 Material- und Enthalpiebilanz für eine Gleichgewichtsstufe (MESH-Gleichungen) M L& V& y F& z (L& S & ) L i,j = j+ i,j+ + j i,j + j i,j j + j i,j (V& + S & )y = 0 V j j i,j Ei,j = yi,j Ki,ji,j = 0 = S, j i, j.0 = 0 K i, j = y i, j i, j S = y.0 = 0 y,j i,j H L& h V& h Fh & (L& S & )h L V L L j = j+ j+ + j j + j F,j j + j j (V& + S & )h + Q& = 0 V V j j j j N(n+3) Gleichungen und Unbekannte a Bedeutung Für n = 4 Komponenten und N = 45 Böden ergeben sich 495 Gleichungen 34
28 McCabe-Thiele-Verfahren Vernachlässigung der Enthalpiebilanz, unter der Annahme dass:.) h v = h v.) h E = 0 3.) Wärmeverlust = 0 Mengenbilanz im Verstärkungsteil: V & y j j =L& j+ j+ +D& D D, D Nach Umstellung: L& j+ D& yj = j+ + V& V& j j D Bei Vernachlässigung der Enthalpieeffekte gilt: L& = L & =L & =L& j+ j j- bzw. V& = V & = V & = V& j+ j j- v =L& Nach Einführung des Rücklaufverhältnisses und Substitution des Dampfstroms V & = L & + D& erhält man: D& yj Vj j+ L j+ y j = L& L & + D& j+ + D& L & + D& D 35
29 Bodenkolonne 36
30 McCabe-Thiele-Verfahren Nach Division durch die Destillatmenge ergibt sich: y j = L& L& D& D+D & & D& j+ + L& D& D& D+D & & D& D bzw.: y j v = j+ v+ + D v+ Für die sogenannte Verstärkungsgerade gilt: =0 = D y= y= D D (v+) Rücklaufverhältnis: v = L& D& 37
31 Beeinflussung der Ströme auf dem Zulaufboden durch die Zulaufbedingungen 38
32 McCabe-Thiele-Verfahren Mengenbilanz für den Abtriebsteil: bzw. & i + = L& i =L& i- =L& L & i + = V& i = V& i- = V& V yi Vi i + L i + L& y i= V& L& V& B& V i+ & Mit L & = V & + B & ergibt sich: B wird durch den thermischen Zustand des Feeds beeinflusst B, B = y = B B 39
33 Typische Kolonne Gesucht: L, V, L, V L/V L /V Steigung der Arbeitsgeraden B& = F& D& = 0 6 = 4 kmol / h L& = v D& = 3 6 = 8 kmol / h V& = L& + D& = = 4 kmol / h F=0 kmol/h (flüssig, gesättigt) D=6 kmol/h v=3 L& V& = = 4 & = & + & = + = & = & = & = 8 & =.67 4 ' L L q F kmol / h ' V V 4 kmol / h ' L V ' B 40
34 Bilanzgeraden in Abhängigkeit vom Rücklaufverhältnis Anzahl der benötigten theoretischen Stufen wird von v und q beeinflusst 4
35 Bestimmung von v min und N min im McCabe-Thiele Diagramm Unterkühlung wie verstärktes Rücklaufverhältnis 4
36 Bestimmung der minimalen Bodenzahl Grenzfälle denkbar: N min v = V min N th = v = bedeutet D& = 0 B& = 0 : 43
37 Abhängigkeit der Stufenzahl und Kosten vom Rücklaufverhältnis Anz zahl der Tren nnstufen N Kosten Gesamtkosten Investitionskosten Betriebskosten N min v min Rücklaufverhältnis v v min Rücklaufverhältnis v 44
38 McCabe-Thiele-Verfahren für das System Methanol-H O 45
39 Fenske-Gleichung zur Ermittlung der minimalen Stufenzahl N min Annahme: = α ij konstant S S P P y y / y / y γ γ = = = α. Stufe (Sumpf B): = α = y y y 46. Stufe: 3 = α = α = y y Für N min Stufen gilt: B N D min = α Durch Umstellung erhält man die Fenske-Gleichung: ( ) ( ) α = log / / log N B D min
40 Anzahl theoretischer Stufenzahl als f(trennfaktor, Produktreinheit) normale Rektifikation nicht mehr sinnvoll Propan-Propen-Splitter α. ( ) ca. 0 4 bei 99 % Reinheit ca. 0 8 bei % Reinheit von Kopf- und Sumpfprodukt 47
41 Material- und Enthalpiebilanz für eine Gleichgewichtsstufe (MESH-Gleichungen) M L& V& y F& z (L& S & ) L i,j = j+ i,j+ + j i,j + j i,j j + j i,j (V& + S & )y = 0 V j j i,j Ei,j = yi,j Ki,ji,j = 0 = S, j i, j.0 = 0 S = y.0 = 0 y,j i,j K H L& h V& h Fh & (L& S & )h L V L L j = j+ j+ + j j + j F,j j + j j V V j j j j i, j (V& + S & )h + Q& = 0 = y i, j i, j N(n+3) Gleichungen und Unbekannte a Bedeutung Für n = 4 Komponenten und N = 45 Böden ergeben sich 495 Gleichungen 48
42 Trennung des Systems Methanol () - Wasser () - Ethanol (3) - Isobutanol (4) DESW Bedeutung 49
43 Luftzerlegung: Feedzusammensetzung 50
44 Luftzerlegung und VLE des Systems O ()-N () ep. Daten PSRK N Temperatur [K] untere Kolonne P = 6.0 bar obere Kolonne O 80 K bar 9 K 95 K fast reines N?Ar Seitenkolonne Siedepunkte: N : 77.4 K O : 90. K P =.3 bar Feed: vorgereinigte Luft 5-6 bar 99 K 38% O Ar: 87.3 K, y 5
45 Linde-Verfahren zur Luftzerlegung (gesamtes Verfahren) 5
Erforderliche Stoffdaten zur Auslegung Technischer Prozesse
 .0.99 Erforderliche Stoffdaten zur Auslegung Technischer Prozesse Reaktor Chem. Gleichgewicht ( g B o, h B o, c P o ) Reaktionskinetik Phasengleichgewicht Enthalpie Viskosität Stofftransport... Phasenscheider
.0.99 Erforderliche Stoffdaten zur Auslegung Technischer Prozesse Reaktor Chem. Gleichgewicht ( g B o, h B o, c P o ) Reaktionskinetik Phasengleichgewicht Enthalpie Viskosität Stofftransport... Phasenscheider
Klausur Technische Chemie SS 2008 Prof. M. Schönhoff // PD Dr. C. Cramer-Kellers Klausur zur Vorlesung
 Klausur zur Vorlesung Technische Chemie: Reaktionstechnik 14.7.2008 10.00 Uhr bis 12.00 Uhr Name, Vorname Geburtsdatum Studiengang/Semester Matrikelnummer Hinweis: Alle Ansätze und Rechenwege sind mit
Klausur zur Vorlesung Technische Chemie: Reaktionstechnik 14.7.2008 10.00 Uhr bis 12.00 Uhr Name, Vorname Geburtsdatum Studiengang/Semester Matrikelnummer Hinweis: Alle Ansätze und Rechenwege sind mit
Was uns so antreibt: Alkohol & Benzin. Die Destillation. Destillation
 Was uns so antreibt: Alkohol & Benzin Die Autor: Sylvia Burghoff Fachbereich Bio- und Chemieingenieurwesen Prof. Andrzej Górak Lehrstuhl Thermische Verfahrenstechnik Definition Definition Das Verdampfen
Was uns so antreibt: Alkohol & Benzin Die Autor: Sylvia Burghoff Fachbereich Bio- und Chemieingenieurwesen Prof. Andrzej Górak Lehrstuhl Thermische Verfahrenstechnik Definition Definition Das Verdampfen
Einführung thermischen
 Einführung die thermischen Trennung von Gas-, Dampf- und Flüssigkeitsgemischen von Prof. Burkhard Lohrengel 2., Auflage Oldenbourg Verlag München Inhalt Vorwort zur 2. Auflage Vorwort XI XI 1 Grundlagen
Einführung die thermischen Trennung von Gas-, Dampf- und Flüssigkeitsgemischen von Prof. Burkhard Lohrengel 2., Auflage Oldenbourg Verlag München Inhalt Vorwort zur 2. Auflage Vorwort XI XI 1 Grundlagen
Thermische Trennverfahren I Destillation, Rektifikation Shell Eastern Petrochemicals Complex (SEPC), Pulau Bukom, Singapore
 Thermische Trennverfahren I Destillation, Rektifikation Shell Eastern Petrochemicals Complex (SEPC), Pulau Bukom, Singapore Universität Hamburg 133 Atmosphärenrektifikation Aufstellen einer 110 m hohe
Thermische Trennverfahren I Destillation, Rektifikation Shell Eastern Petrochemicals Complex (SEPC), Pulau Bukom, Singapore Universität Hamburg 133 Atmosphärenrektifikation Aufstellen einer 110 m hohe
Siedediagramm binärer Gemische und Rektifikation
 Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Versuch Nr. 14: Siedediagramm binärer Gemische und Rektifikation 1. Ziel des Versuchs Ziel des Versuches, ist es die Siedekurve eines Methanol-Wasser-Gemisches aufzunehmen. Im zweiten Versuchsteil soll
Lehrbuch Chemische Technologie
 C. Herbert Vogel Lehrbuch Chemische Technologie Grundlagen Verfahrenstechnischer Anlagen WILEY- VCH WILEY-VCH Verlag GmbH & Co. KGaA IX Inhaltsverzeichnis 1 Einführung 1 1.1 Das Ziel industrieller Forschung
C. Herbert Vogel Lehrbuch Chemische Technologie Grundlagen Verfahrenstechnischer Anlagen WILEY- VCH WILEY-VCH Verlag GmbH & Co. KGaA IX Inhaltsverzeichnis 1 Einführung 1 1.1 Das Ziel industrieller Forschung
in die thermischen Tren nverfahren
 Einfuhrung in die thermischen Tren nverfahren Trennung von Gas-, Dampf- und Flussigkeltsgemischen von Prof Dr.-Ing. Burkhard Lohrengel Oldenbourg Verlag Munchen Wien Inhalt Vorwort XI 1 1.1 1.2 1.3 2 2.1
Einfuhrung in die thermischen Tren nverfahren Trennung von Gas-, Dampf- und Flussigkeltsgemischen von Prof Dr.-Ing. Burkhard Lohrengel Oldenbourg Verlag Munchen Wien Inhalt Vorwort XI 1 1.1 1.2 1.3 2 2.1
Manfred Nitsche. Kolonnen-Fibel. Für die Praxis im chemischen Anlagenbau. Springer Vi eweg
 Manfred Nitsche KolonnenFibel Für die Praxis im chemischen Anlagenbau Springer Vi eweg 1 Planung von Destillations und Absorptionskolonnen 1 1.1 Planungshinweise 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung
Manfred Nitsche KolonnenFibel Für die Praxis im chemischen Anlagenbau Springer Vi eweg 1 Planung von Destillations und Absorptionskolonnen 1 1.1 Planungshinweise 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung
Teil 2: Beispiele aus der Verfahrenstechnik
 Teil 2: Beispiele aus der Verfahrenstechnik Seite 1 / Ausgabe: Januar 2006 Für diesen Teil sollte man nicht mehr als 5 Minuten verwenden. Er soll dazu dienen, den Schülern an Hand weniger, markanter Beispiele
Teil 2: Beispiele aus der Verfahrenstechnik Seite 1 / Ausgabe: Januar 2006 Für diesen Teil sollte man nicht mehr als 5 Minuten verwenden. Er soll dazu dienen, den Schülern an Hand weniger, markanter Beispiele
Praktikum Physikalische Chemie II (C-3) Versuch Nr. 12
 Praktikum Physikalische Chemie II (C-3) Versuch Nr. 12 Rektifikation: Bestimmung der theoretischen Trennstufenzahl einer Glockenbodenkolonne bei verschiedenen Rücklaufverhältnissen Grundlagen Die in der
Praktikum Physikalische Chemie II (C-3) Versuch Nr. 12 Rektifikation: Bestimmung der theoretischen Trennstufenzahl einer Glockenbodenkolonne bei verschiedenen Rücklaufverhältnissen Grundlagen Die in der
Thermische Verfahrenstechnik I. Prof. Dr.-Ing. B. Platzer Folie 1 University of Applied Sciences Kaiserslautern
 Thermische Verfahrenstechnik I Prof. Dr.-Ing. B. Platzer Folie 1 Gliederung 1. Einführung 2. Thermodynamische h Grundlagen 3. Thermische Trennverfahren / Apparative Gestaltung 3.1 Destillation/Rektifikation
Thermische Verfahrenstechnik I Prof. Dr.-Ing. B. Platzer Folie 1 Gliederung 1. Einführung 2. Thermodynamische h Grundlagen 3. Thermische Trennverfahren / Apparative Gestaltung 3.1 Destillation/Rektifikation
Einführung in die Rektifikation mit CHEMCAD
 - - Einführung in die Rektifikation mit CHEMCAD Inhaltsverzeichnis. Dampfdruck, Zustandsgleichung, Fugazitätskoeffizient 2. Phasengleichgewicht nach Raoult, Dalton, Aktivitätskoeffizient 3. Rektifikation
- - Einführung in die Rektifikation mit CHEMCAD Inhaltsverzeichnis. Dampfdruck, Zustandsgleichung, Fugazitätskoeffizient 2. Phasengleichgewicht nach Raoult, Dalton, Aktivitätskoeffizient 3. Rektifikation
REKTIFIKATION. 1. Voraussetzung. 2. Zielsetzung
 Universität Linz Rektifikation REKTIFIKATION 1. Voraussetzung 2. Zielsetzung Die Rektifikation, ein industriell angewendetes Verfahren der flüssig-flüssig Trennung, ist dem Gebiet der thermischen Verfahrenstechnik
Universität Linz Rektifikation REKTIFIKATION 1. Voraussetzung 2. Zielsetzung Die Rektifikation, ein industriell angewendetes Verfahren der flüssig-flüssig Trennung, ist dem Gebiet der thermischen Verfahrenstechnik
Inhaltsverzeichnis 1 Planung von Destillations- und Absorptionskolonnen
 Inhaltsverzeichnis 1 Planung von Destillations- und Absorptionskolonnen.................... 1 1.1 Planungshinweise................................................. 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung.....................
Inhaltsverzeichnis 1 Planung von Destillations- und Absorptionskolonnen.................... 1 1.1 Planungshinweise................................................. 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung.....................
Institut für Technische Chemie Technische Universität Clausthal. Technisch-chemisches Praktikum TCB. Versuch: Rektifikation
 Institut für Technische Chemie Technische Universität Clausthal Technisch-chemisches Praktikum TCB Versuch: Rektifikation Einleitung In einer Vielzahl von chemischen Produktionsanlagen besteht die Notwendigkeit,
Institut für Technische Chemie Technische Universität Clausthal Technisch-chemisches Praktikum TCB Versuch: Rektifikation Einleitung In einer Vielzahl von chemischen Produktionsanlagen besteht die Notwendigkeit,
Grundoperationen der Verfahrenstechnik. Berechnung idealer Reaktoren II
 Grundoperationen der Verfahrenstechnik 9. Übung, WS 2016/2017 Betreuer: Maik Tepper M.Sc., Maik.Tepper@avt.rwth-aachen.de Morten Logemann M.Sc., Morten.Logemann@avt.rwth-aachen.de Johannes Lohaus M.Sc.,
Grundoperationen der Verfahrenstechnik 9. Übung, WS 2016/2017 Betreuer: Maik Tepper M.Sc., Maik.Tepper@avt.rwth-aachen.de Morten Logemann M.Sc., Morten.Logemann@avt.rwth-aachen.de Johannes Lohaus M.Sc.,
Universität Stuttgart. Institut für Technische Chemie
 Universität Stuttgart Institut für Technische Chemie Technisch-Chemisches Grundpraktikum Versuch 1: Thermische Trennung von flüssigen Gemischen 2 / 1 1. Einleitung Die Bestimmung der Lage von Dampf-Flüssigkeits-Gleichgewichten
Universität Stuttgart Institut für Technische Chemie Technisch-Chemisches Grundpraktikum Versuch 1: Thermische Trennung von flüssigen Gemischen 2 / 1 1. Einleitung Die Bestimmung der Lage von Dampf-Flüssigkeits-Gleichgewichten
REKTIFIKATION. 1. Voraussetzung. 2. Zielsetzung
 Universität Linz Rektifikation REKTIFIKATION 1. Voraussetzung 2. Zielsetzung Die Rektifikation, ein industriell angewendetes Verfahren der flüssig-flüssig Trennung, ist dem Gebiet der thermischen Verfahrenstechnik
Universität Linz Rektifikation REKTIFIKATION 1. Voraussetzung 2. Zielsetzung Die Rektifikation, ein industriell angewendetes Verfahren der flüssig-flüssig Trennung, ist dem Gebiet der thermischen Verfahrenstechnik
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Phasengleichgewichte (VLE)
 Phasengleichgewichte (VLE) Gibbs sche Phasenregel Clausius-Claeyron-Gleichung Antoine-Gleichung Nichtideales Phasenverhalten Van der Waals-Gleichung Phasenverhalten von Gemischen (VLE) Raoult sches Gesetz
Phasengleichgewichte (VLE) Gibbs sche Phasenregel Clausius-Claeyron-Gleichung Antoine-Gleichung Nichtideales Phasenverhalten Van der Waals-Gleichung Phasenverhalten von Gemischen (VLE) Raoult sches Gesetz
ExergySim - Fließschemasimulation in einem frühen Entwicklungsstadium mit dem Fokus auf Exergiebilanzen P. Frenzel, R. Hillerbrand, A.
 ExergySim - Fließschemasimulation in einem frühen Entwicklungsstadium mit dem Fokus auf Exergiebilanzen P. Frenzel, R. Hillerbrand, A. Pfennig AVT Thermal Process Engineering, RWTH Aachen Department of
ExergySim - Fließschemasimulation in einem frühen Entwicklungsstadium mit dem Fokus auf Exergiebilanzen P. Frenzel, R. Hillerbrand, A. Pfennig AVT Thermal Process Engineering, RWTH Aachen Department of
Versuch 6: Rektifikation
 Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
Physikalisch-Chemisches Grundpraktikum Sommersemester 2004 Gruppe B9 Andreas Frintrup / Sven Wolff Versuch 6: Rektifikation Ziel: Die Effizienz zweier verschiedener Trennsäulen, einer fünfbödigen Glockenbodenkolonne
Die Innere Energie U
 Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Mischphasenthermodynamik Prüfung
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Kolonnenkonfiguration und y-x-diagramm für die Trennung des Systems Wasser (1)-Butanol-1 (2) bei kpa
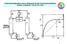 Kolonnenkonfiguration und y-x-diagramm für die Trennung des Systems Wasser (1)-Butanol-1 (2) bei 101.3 kpa 71 Azeotrope Zusammensetzung als Funktion des Druckes Tetrahydrofuran (1) + Wasser (2) azd(p).cdr
Kolonnenkonfiguration und y-x-diagramm für die Trennung des Systems Wasser (1)-Butanol-1 (2) bei 101.3 kpa 71 Azeotrope Zusammensetzung als Funktion des Druckes Tetrahydrofuran (1) + Wasser (2) azd(p).cdr
Inhalt 1 Grundlagen der Thermodynamik
 Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Thermodynamik 2 Klausur 14. September 2011
 Thermodynamik 2 Klausur 14. September 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Thermodynamik 2 Klausur 14. September 2011 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Karl Stephan Franz Mayinger. Thermodynamik. Grundlagen und technische Anwendungen. Zwölfte, neubearbeitete und erweiterte Auflage
 Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Aufgabe, Bedeutung und Definition der chemischen Reaktionstechnik... 1
 Kapitel 1 Aufgabe, Bedeutung und Definition der chemischen Reaktionstechnik... 1 1. Klassifizierung chemischer Reaktionen 2 2. Grundbegriffe der Reaktionstechnik 3 Kapitel 2 Stöchiometrie chemischer Reaktionen
Kapitel 1 Aufgabe, Bedeutung und Definition der chemischen Reaktionstechnik... 1 1. Klassifizierung chemischer Reaktionen 2 2. Grundbegriffe der Reaktionstechnik 3 Kapitel 2 Stöchiometrie chemischer Reaktionen
Destillation und Rektifikation: Vorlesung am : Zusammenfassung des zweiten Teils. Siedediagramm
 Destillation und Rektifikation: Vorlesung am 27.1.211: Zusammenfassung des zweiten eils llgemeine Bemerkung zu den Berechnungen und bleitungen der Formeln: Die Vorgänge werden in der Regel für ideale Zustände
Destillation und Rektifikation: Vorlesung am 27.1.211: Zusammenfassung des zweiten eils llgemeine Bemerkung zu den Berechnungen und bleitungen der Formeln: Die Vorgänge werden in der Regel für ideale Zustände
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse
 Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs der Technischen Chemie der Universität Oldenburg unter Leitung von Herrn Prof. Dr. J. Gmehling Ort: Universität
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs der Technischen Chemie der Universität Oldenburg unter Leitung von Herrn Prof. Dr. J. Gmehling Ort: Universität
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Die obere und untere Grenze der Schallgeschwindigkeitin WasserdampfjWasser Gel'nischen. unter Berücksichtigung der Kompressibilität des Wassers
 Januar 1969 KFK 717 Institut für Reaktorentwicklung Die obere und untere Grenze der Schallgeschwindigkeitin WasserdampfjWasser Gel'nischen. unter Berücksichtigung der Kompressibilität des Wassers H. Sameith
Januar 1969 KFK 717 Institut für Reaktorentwicklung Die obere und untere Grenze der Schallgeschwindigkeitin WasserdampfjWasser Gel'nischen. unter Berücksichtigung der Kompressibilität des Wassers H. Sameith
Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik
 Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
Thermodynamik 2 Klausur 23. Februar 2012
 Thermodynamik 2 Klausur 23. Februar 2012 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Thermodynamik 2 Klausur 23. Februar 2012 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Ein großer Teil der Schadstoffe in
 Reinigung von industriellen Abwässern (Auf-)Lösung eines hoch - siedenden Problems Sulzer-Equipment kann Schadstoffe in großen Abwasserflüssen kosteneffizient abspalten. Abhängig von der Lage des Siedepunktes
Reinigung von industriellen Abwässern (Auf-)Lösung eines hoch - siedenden Problems Sulzer-Equipment kann Schadstoffe in großen Abwasserflüssen kosteneffizient abspalten. Abhängig von der Lage des Siedepunktes
Rektifikation. Daniel Bomze W05 Paul Gauss W12 Paul Kautny W
 Daniel Bomze W05 Paul Gauss W12 Paul Kautny W20 10.11.2009 Inhaltsverzeichnis 1 Aufgabenstellung 3 1.1 Messung der Temperatur- und Konzentrationsänderungen......... 3 1.2 Wärmebilanz..................................
Daniel Bomze W05 Paul Gauss W12 Paul Kautny W20 10.11.2009 Inhaltsverzeichnis 1 Aufgabenstellung 3 1.1 Messung der Temperatur- und Konzentrationsänderungen......... 3 1.2 Wärmebilanz..................................
Fachlabor UTRM. Versuch: Kontinuierliche-Rektifikation SS 2016 RUHR-UNIVERSITÄT BOCHUM
 RUHR-UNIVERSITÄT BOCHUM Lehrstuhl für Fluidverfahrenstechnik Fachlabor UTRM Versuch: Kontinuierliche-Rektifikation SS 2016 Betreuung: Frau M.Sc. Iris Rieth Frau M.Sc. Carolin Stegehake Raum: IC 3/099 IC
RUHR-UNIVERSITÄT BOCHUM Lehrstuhl für Fluidverfahrenstechnik Fachlabor UTRM Versuch: Kontinuierliche-Rektifikation SS 2016 Betreuung: Frau M.Sc. Iris Rieth Frau M.Sc. Carolin Stegehake Raum: IC 3/099 IC
Shortcut Simulation. Abbildung 1: Flowsheet Shortcut Kolonne
 Problemstellung/ Zielsetzung: Shortcut Simulation Die Shortcut Simulation grenzt den optimalen Betriebsbereich einer Rektifikationskolonne für sich annähernd ideal verhaltende Gemische ein. Die Ergebnisse
Problemstellung/ Zielsetzung: Shortcut Simulation Die Shortcut Simulation grenzt den optimalen Betriebsbereich einer Rektifikationskolonne für sich annähernd ideal verhaltende Gemische ein. Die Ergebnisse
Josef Draxler Matthäus Siebenhofer. Verfahrenstechnik. in Beispielen. Problemstellungen, Lösungsansätze, Rechenwege.
 Josef Draxler Matthäus Siebenhofer Verfahrenstechnik in Beispielen Problemstellungen, Lösungsansätze, Rechenwege ^ Springer Vieweg Inhaltsverzeichnis VII INHALTSVERZEICHNIS 1. Einleitung 1 1.1. Konzentrationsmaße
Josef Draxler Matthäus Siebenhofer Verfahrenstechnik in Beispielen Problemstellungen, Lösungsansätze, Rechenwege ^ Springer Vieweg Inhaltsverzeichnis VII INHALTSVERZEICHNIS 1. Einleitung 1 1.1. Konzentrationsmaße
Auslegung von Wärmeübertragern und Stoffaustauschkolonnen
 Auslegung von Wärmeübertragern und Stoffaustauschkolonnen Lunch & Learn, Marl, 13.11.2013 Ralf Ziegler Agenda Übersicht über Bauformen von Wärmeübertragern Auslegungsprogramme bei Siemens EC Mitgliedschaft
Auslegung von Wärmeübertragern und Stoffaustauschkolonnen Lunch & Learn, Marl, 13.11.2013 Ralf Ziegler Agenda Übersicht über Bauformen von Wärmeübertragern Auslegungsprogramme bei Siemens EC Mitgliedschaft
Physikalische Chemie II
 Prof.Dr.M.Bredol / FB01 Physikalische Chemie II Modulprüfung PC-II (Klausur) 16.3.2016 Name, Vorname Aufgabe 1 2 3 4 5 Punkte maximal 20 20 20 18 22 Erreichte Punktzahl Matrikel-Nr. Gesamtpunktzahl Note
Prof.Dr.M.Bredol / FB01 Physikalische Chemie II Modulprüfung PC-II (Klausur) 16.3.2016 Name, Vorname Aufgabe 1 2 3 4 5 Punkte maximal 20 20 20 18 22 Erreichte Punktzahl Matrikel-Nr. Gesamtpunktzahl Note
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Vom Dampfdruck zur Destillationskolonne
 Vom Dampfdruck zur Destillationskolonne Teil 2: Prozesssimulation & Apparateauslegung Lunch & Learn Marl 03.07.2013 André Ohligschläger Cape Tools- EC verfügt über eine Integrierte Softwareumgebung: Effektiv
Vom Dampfdruck zur Destillationskolonne Teil 2: Prozesssimulation & Apparateauslegung Lunch & Learn Marl 03.07.2013 André Ohligschläger Cape Tools- EC verfügt über eine Integrierte Softwareumgebung: Effektiv
Anfahren, Betrieb und Bilanzierung mit einer Pilotrektikationsanlage in explosionsgeschützer Umgebung a
 Studiengang Chemie Prozess- und Verfahrenstechnik Praktikum FS11 Anfahren, Betrieb und Bilanzierung mit einer Pilotrektikationsanlage in explosionsgeschützer Umgebung a Fabian Deuber & Michael Edelmann
Studiengang Chemie Prozess- und Verfahrenstechnik Praktikum FS11 Anfahren, Betrieb und Bilanzierung mit einer Pilotrektikationsanlage in explosionsgeschützer Umgebung a Fabian Deuber & Michael Edelmann
Thermodynamik 1 Klausur 12. August 2013
 Thermodynamik 1 Klausur 12. August 2013 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Thermodynamik 1 Klausur 12. August 2013 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
Rektifikative Aufarbeitung von Lösungsmittelgemischen
 RUHR-UNIVERSITÄT BOCHUM Lehrstuhl für Fluidverfahrenstechnik Prof Dr-Ing M Grünewald Rektifikative Aufarbeitung von Lösungsmittelgemischen Rektifikation eines binären Gemisches in einer Labor-Batch-Rektifikationskolonne
RUHR-UNIVERSITÄT BOCHUM Lehrstuhl für Fluidverfahrenstechnik Prof Dr-Ing M Grünewald Rektifikative Aufarbeitung von Lösungsmittelgemischen Rektifikation eines binären Gemisches in einer Labor-Batch-Rektifikationskolonne
Institut für Technische Chemie und Polymerchemie (ITCP) Prof. Dr. O. Deutschmann. Prof. Dr. J.-D. Grunwaldt
 Institut für Technische Chemie und Polymerchemie (ITCP) Prof. Dr. O. Deutschmann Prof. Dr. J.-D. Grunwaldt Versuchsbeschreibung zum chemisch-technischen Grundpraktikum Glockenbodenkolonne KIT Die Forschungsuniversität
Institut für Technische Chemie und Polymerchemie (ITCP) Prof. Dr. O. Deutschmann Prof. Dr. J.-D. Grunwaldt Versuchsbeschreibung zum chemisch-technischen Grundpraktikum Glockenbodenkolonne KIT Die Forschungsuniversität
A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 3 Dampfdruckkurve einer leichtflüchtigen Flüssigkeit Aufgabe: Es ist die Dampfdruckkurve einer leicht flüchtigen Flüssigkeit zu ermitteln
Bernhard Härder. Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik W/ WESTAR.P WISSENSCHAFTEN. Skripte, Lehrbücher Band 2
 Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Liste der Formelzeichen. A. Thermodynamik der Gemische 1
 Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Dampfdruck der Mischung, x Molenbruch der leichter flüchtigen Komponente in der flüssigen Phase.
 0. Rektifikation 0. REKTIFIKATION. Aufgabe urch die Messung der Zusammensetzung des estillates bei verschiedenen Entnahmeraten soll die Trennleistung einer Rektifikationskolonne bestimmt werden. Um die
0. Rektifikation 0. REKTIFIKATION. Aufgabe urch die Messung der Zusammensetzung des estillates bei verschiedenen Entnahmeraten soll die Trennleistung einer Rektifikationskolonne bestimmt werden. Um die
Chemische Verfahrenstechnik
 FH Düsseldorf Maschinenbau und Verfahrenstechnik Chemische Verfahrenstechnik Teil 1 Einführung Chemische Verfahrenstechnik Gliederung Gliederung 1. Einführung 2. Verweilzeitverhalten von Reaktoren 3.
FH Düsseldorf Maschinenbau und Verfahrenstechnik Chemische Verfahrenstechnik Teil 1 Einführung Chemische Verfahrenstechnik Gliederung Gliederung 1. Einführung 2. Verweilzeitverhalten von Reaktoren 3.
Lehrveranstaltung: Chemische Prozesstechnik (CPT)
 Lehrveranstaltung: Chemische Prozesstechnik (CPT) Semester: Projektkurs: 1. Semester (Sommersemester) CEN Vorlesung: 3h ECTS: 5 Dozenten: Unterrichtssprache: Voraussetzungen: 2h Prof. Dr. A. König, Prof.
Lehrveranstaltung: Chemische Prozesstechnik (CPT) Semester: Projektkurs: 1. Semester (Sommersemester) CEN Vorlesung: 3h ECTS: 5 Dozenten: Unterrichtssprache: Voraussetzungen: 2h Prof. Dr. A. König, Prof.
Physikalische Chemie I
 M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
Thermodynamik 2 Klausur 19. September 2012
 Thermodynamik 2 Klausur 19. September 2012 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Thermodynamik 2 Klausur 19. September 2012 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 5 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind
Versuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten -
 1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Aufgabe 1 (60 Punkte, TTS & TTD1) Bitte alles LESBAR verfassen!!!
 Aufgabe (60 Punkte, TTS & TTD) Bitte alles LESBAR verfassen!!!. In welcher Weise ändern sich intensive und extensive Zustandsgrößen bei der Zerlegung eines Systems in Teilsysteme?. Welche Werte hat der
Aufgabe (60 Punkte, TTS & TTD) Bitte alles LESBAR verfassen!!!. In welcher Weise ändern sich intensive und extensive Zustandsgrößen bei der Zerlegung eines Systems in Teilsysteme?. Welche Werte hat der
Klausur Technische Chemie SS 2007 Prof. M. Schönhoff // PD Dr. C. Cramer-Kellers Klausur zur Vorlesung
 Klausur zur Vorlesung Technische Chemie: Reaktionstechnik 9.7.2007 9:00 Uhr bis 11.00 Uhr Name, Vorname Geburtsdatum Studiengang/Semester Matrikelnummer Hinweis: Alle Ansätze und Rechenwege sind mit Worten
Klausur zur Vorlesung Technische Chemie: Reaktionstechnik 9.7.2007 9:00 Uhr bis 11.00 Uhr Name, Vorname Geburtsdatum Studiengang/Semester Matrikelnummer Hinweis: Alle Ansätze und Rechenwege sind mit Worten
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse
 Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg Ort: Universität Oldenburg, Standort Oldenburg-Wechloy (Naturwissenschaften),
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg Ort: Universität Oldenburg, Standort Oldenburg-Wechloy (Naturwissenschaften),
endotherme Reaktionen
 Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Exotherme/endotherme endotherme Reaktionen Edukte - H Produkte Exotherme Reaktion Edukte Produkte + H Endotherme Reaktion 101 Das Massenwirkungsgesetz Das Massenwirkungsgesetz Gleichgewicht chemischer
Bekannter Stoff aus dem 1. Semester:
 Bekannter Stoff aus dem 1. Semester: Atombau! Arten der Teilchen! Elemente/Isotope! Kernchemie! Elektronenhülle/Quantenzahlen Chemische Bindung! Zustände der Materie! Ionenbindung! Atombindung! Metallbindung
Bekannter Stoff aus dem 1. Semester: Atombau! Arten der Teilchen! Elemente/Isotope! Kernchemie! Elektronenhülle/Quantenzahlen Chemische Bindung! Zustände der Materie! Ionenbindung! Atombindung! Metallbindung
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
14 Destillation Grundlagen Destillation
 72 4 Destillation 4 Destillation 4. Grundlagen Mit dem wichtigen rennverfahren der Destillation (die entscheidende Modifikation der Destillation stellt dabei die Rektifikation dar) lässt sich aus einem
72 4 Destillation 4 Destillation 4. Grundlagen Mit dem wichtigen rennverfahren der Destillation (die entscheidende Modifikation der Destillation stellt dabei die Rektifikation dar) lässt sich aus einem
Musterlösung zur Klausur Thermodynamik I Sommersemester 2014
 Musterlösung zur Klausur Thermodynamik I Sommersemester 04 . Aufgabe (04): Theoriefragen (0 Punkte) a) ( Punkt) Intensive Zustandsgrößen bleiben bei Teilung des Systems konstant. Extensive Zustandsgrößen
Musterlösung zur Klausur Thermodynamik I Sommersemester 04 . Aufgabe (04): Theoriefragen (0 Punkte) a) ( Punkt) Intensive Zustandsgrößen bleiben bei Teilung des Systems konstant. Extensive Zustandsgrößen
Thermodynamik. Springer. Peter Stephan Karlheinz Schaber Karl Stephan Franz Mayinger. Grundlagen und technische Anwendungen Band 1: Einstoffsysteme
 Peter Stephan Karlheinz Schaber Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Band 1: Einstoffsysteme 16., vollständig neu bearbeitete Auflage Mit 195 Abbildungen und
Peter Stephan Karlheinz Schaber Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Band 1: Einstoffsysteme 16., vollständig neu bearbeitete Auflage Mit 195 Abbildungen und
Hauptsätze der Thermodynamik
 Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Hauptsätze der Thermodynamik Dominik Pfennig, 31.10.2012 Inhalt 0. Hauptsatz Innere Energie 1. Hauptsatz Enthalpie Satz von Hess 2. Hauptsatz
Platzhalter für Bild, Bild auf Titelfolie hinter das Logo einsetzen Hauptsätze der Thermodynamik Dominik Pfennig, 31.10.2012 Inhalt 0. Hauptsatz Innere Energie 1. Hauptsatz Enthalpie Satz von Hess 2. Hauptsatz
Klausur zur Vorlesung Thermodynamik
 Institut für Thermodynamik 23. August 2013 Technische Universität Braunschweig Prof. Dr. Jürgen Köhler Klausur zur Vorlesung Thermodynamik Für alle Aufgaben gilt: Der Rechen- bzw. Gedankengang muss stets
Institut für Thermodynamik 23. August 2013 Technische Universität Braunschweig Prof. Dr. Jürgen Köhler Klausur zur Vorlesung Thermodynamik Für alle Aufgaben gilt: Der Rechen- bzw. Gedankengang muss stets
PC I Thermodynamik G. Jeschke FS Lösung zur Übung 12
 PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
Kontinuierliche Rektifikation
 Universität Karlsruhe Institut für Chemische Technik Prof. Dr. H. Bockhorn Versuchsbeschreibung zum Chemisch-Technischen Grundpraktikum Kontinuierliche Rektifikation 1 Literatur - Bockhardt/Güntzschel/Poetschukat
Universität Karlsruhe Institut für Chemische Technik Prof. Dr. H. Bockhorn Versuchsbeschreibung zum Chemisch-Technischen Grundpraktikum Kontinuierliche Rektifikation 1 Literatur - Bockhardt/Güntzschel/Poetschukat
Das Chemische Gleichgewicht
 Das Chemische Gleichgewicht a A + b B c C + d D r r r r Für r G = 0 gilt: Q = K r G G E D r G = dg dx
Das Chemische Gleichgewicht a A + b B c C + d D r r r r Für r G = 0 gilt: Q = K r G G E D r G = dg dx
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Achtung: Hausaufgabe
 Institut für Technische Chemie und Polymerchemie (ITCP) Prof. Dr. O. Deutschmann Prof. Dr. J.-D. Grunwaldt Versuchsbeschreibung zum chemisch-technischen Grundpraktikum Kontinuierliche Rektifikation Achtung:
Institut für Technische Chemie und Polymerchemie (ITCP) Prof. Dr. O. Deutschmann Prof. Dr. J.-D. Grunwaldt Versuchsbeschreibung zum chemisch-technischen Grundpraktikum Kontinuierliche Rektifikation Achtung:
Umwelt Engineering Reaktions- und Trenntechnik
 FRAUNHOFER-INSTITUT FÜR Chemische Technologie ICT Umwelt Engineering Reaktions- und Trenntechnik Umwelt Engineering Reaktions- und Trenntechnik Die Arbeitsbereiche der Reaktions- und Trenntechnik reichen
FRAUNHOFER-INSTITUT FÜR Chemische Technologie ICT Umwelt Engineering Reaktions- und Trenntechnik Umwelt Engineering Reaktions- und Trenntechnik Die Arbeitsbereiche der Reaktions- und Trenntechnik reichen
Thermodynamik. Springer Vieweg. Grundlagen und technische Anwendungen. Band 1: Einstoffsysteme. Schaber
 Schaber Peter Stephan Karlheinz Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Band 1: Einstoffsysteme 19., ergänzte Auflage Springer Vieweg Inhaltsverzeichnis Liste der
Schaber Peter Stephan Karlheinz Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Band 1: Einstoffsysteme 19., ergänzte Auflage Springer Vieweg Inhaltsverzeichnis Liste der
Endersch, Jonas 09./
 Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Endersch, Jonas 09./10.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.2: Destillation 1 Versuch 1.3: Destillation 2 Einleitung und Theorie: In diesen Versuchen
Unterscheide: Behältersieden (w 0 m/s) und Strömungssieden (w > 0 m/s)
 6 Sieden 1 Verdampfung von Flüssigkeiten Unterscheide: Behältersieden (w 0 m/s) und Strömungssieden (w > 0 m/s) Wärmeübergang beim Sieden hängt ab von - Heizflächenbeschaffenheit (Material, Rauhigkeit,
6 Sieden 1 Verdampfung von Flüssigkeiten Unterscheide: Behältersieden (w 0 m/s) und Strömungssieden (w > 0 m/s) Wärmeübergang beim Sieden hängt ab von - Heizflächenbeschaffenheit (Material, Rauhigkeit,
Wärmelehre Zustandsänderungen ideales Gases
 Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
Wärmelehre Zustandsänderungen ideales Gases p Gas-Gleichung 1.Hauptsatz p V = N k B T U Q W p 1 400 1 isobar 300 200 isochor isotherm 100 p 2 0 2 adiabatisch 0 1 2 3 4 5 V V 2 1 V Bemerkung: Mischung verschiedener
D r H Entropie-Änderungeng. D rs Arbeit, maximale (Nicht Volumen) D r G
 REP Was schon behandelt wurde: 1. Hauptsatz 2. Hauptsatz Enthalpie-Änderungen D r H Entropie-Änderungeng D rs Arbeit, maximale (Nicht Volumen) D r G REP D r G = D r H - TDD r S Gleichgewicht: D r G = 0
REP Was schon behandelt wurde: 1. Hauptsatz 2. Hauptsatz Enthalpie-Änderungen D r H Entropie-Änderungeng D rs Arbeit, maximale (Nicht Volumen) D r G REP D r G = D r H - TDD r S Gleichgewicht: D r G = 0
Praktikumsanleitung Trennung eines azeotropen Stoffgemisches in einer Rektifikationskolonne
 Institut für Verfahrenstechnik Lehrstuhl für Thermische Verfahrenstechnik Prof. Dr.-Ing. E. Tsotsas Praktikumsanleitung Trennung eines azeotropen Stoffgemisches in einer Rektifikationskolonne Für Studenten
Institut für Verfahrenstechnik Lehrstuhl für Thermische Verfahrenstechnik Prof. Dr.-Ing. E. Tsotsas Praktikumsanleitung Trennung eines azeotropen Stoffgemisches in einer Rektifikationskolonne Für Studenten
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Thermodynamik 1 Klausur 03. März Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als Hilfsmittel zugelassen.
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Thermodynamik 1 Klausur 03. März 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung:
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Thermodynamik 1 Klausur 03. März 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung:
Lösungen 10 (Kinetik)
 Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Beispielaufgaben IChO 2. Runde 2019 Grundlagen der Thermodynamik, Lösungen. = -0,900 kj/k (21,84 22,15) K / 13,16 g = 0,279 kj / 13,16 g
 Lösung Beispiel 1 Erhaltung der Energie a) ZnSO 4(s) ZnSO 4(aq): Lösungsenthalpie Lsg (ZnSO 4) = -0,900 kj/k (23,52 22,55) K / 1,565 g = -0,873 kj / 1,565 g mit (ZnSO 4) = 161,48 g/mol: Lsg (ZnSO 4) =
Lösung Beispiel 1 Erhaltung der Energie a) ZnSO 4(s) ZnSO 4(aq): Lösungsenthalpie Lsg (ZnSO 4) = -0,900 kj/k (23,52 22,55) K / 1,565 g = -0,873 kj / 1,565 g mit (ZnSO 4) = 161,48 g/mol: Lsg (ZnSO 4) =
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse
 Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg unter Leitung von Herrn Ort: Universität Oldenburg, Standort
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg unter Leitung von Herrn Ort: Universität Oldenburg, Standort
Formelsammlung. Experimentalphysik II. Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester Pascal Del Haye 27.
 Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Formelsammlung Experimentalphysik II Zur Vorlesung bei Prof. Dr. M. Wuttig, Sommersemester 2003 Pascal Del Haye www.delhaye.de 27. Juli 2003 Inhaltsverzeichnis Thermodynamik 3. Ideale Gasgleichung........................
Taschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister
 aschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister ISBN-: 3-446-458-9 ISBN-3: 978-3-446-458-9 Leseprobe Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-458-9
aschenbuch der Verfahrenstechnik Herausgegeben von Karl Schwister ISBN-: 3-446-458-9 ISBN-3: 978-3-446-458-9 Leseprobe Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-458-9
4. Freie Energie/Enthalpie & Gibbs Gleichungen
 4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
Protokoll Dampfdruck. Punkte: /10
 Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
Spezialfälle. BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz. bei V, n = konstant: p = const.
 Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
Spezialfälle BOYLE-MARIOTT`sches Gesetz p V = n R T bei T, n = konstant: p V = const. GAY-LUSSAC`sches Gesetz p V = n R T bei V, n = konstant: p = const. T Druck Druck V = const. Volumen T 2 T 1 Temperatur
