Die Rolle von Chromosom 8p-Deletionen und Verlust. der SFRP1-Expression beim Urothelkarzinom der. Harnblase
|
|
|
- Franziska Weiss
- vor 8 Jahren
- Abrufe
Transkript
1 Die Rolle von Chromosom 8p-Deletionen und Verlust der SFRP1-Expression beim Urothelkarzinom der Harnblase Der Naturwissenschaftlichen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg zur Erlangung des Doktorgrades Dr. rer.nat. vorgelegt von Anja Paola Rogler aus Nürnberg
2 Als Dissertation genehmigt von der Naturwissen- schaftlichen Fakultät der Friedrich-Alexander Universität Erlangen-Nürnberg Tag der mündlichen Prüfung: 19. Oktober 2012 Vorsitzender der Promotionskommission: Prof. Dr. Rainer Fink Erstberichterstatter: Prof. Dr. Johann-Helmut Brandstätter Zweitberichterstatter: Prof. Dr. Arndt Hartmann
3
4
5 Inhaltsverzeichnis INHALTSVERZEICHNIS 1 Einleitung Das Harnblasenkarzinom Der Wnt-Signalweg SFRP1 - secreted frizzled related protein Chromosomale Verluste auf 8p bei Krebs Single nucleotide polymorphisms (SNPs) in SFRP Ziele der Arbeit 29 2 Material und Methoden Material Patientenmaterial Zelllinien Bakterien-Stamm Chemikalien und Reagenzien Lösungen und Puffer Kommerzielle Reagenziensätze (Kits) Nukleinsäuren Proteine Geräte und Laborausstattung Softwares und Webtools Methoden Zellbiologische Methoden Auftauen und Einfrieren von Zellen Kultivieren und Splitten von adhärenten Zellen Zählen von Zellen mit der Neubauer-Zählkammer Transfektion von Nukleinsäuren Bestimmung der Viabilität mittels CellTiter Glo Assay Bestimmung der Proliferation mittels BrdU Assay Bestimmung der Migration mittels Wound Scratch Assay Bestimmung der Wnt-Aktivität mittels TOP flash/fop flash Assay Behandlung der Zellen mit 5-Aza, SAHA und Trichostatin Molekularbiologische Methoden Mikrodissektion von gefrorenen Gewebedünnschnitten Isolierung von Ribonukleinsäure (RNA) Isolierung von Desoxy-Ribonukleinsäure (DNA) Quantitäts- und Qualitätskontrolle von Nukleinsäuren Synthese von komplementärer DNA (cdna) Konventionelle Polymerase-Kettenreaktion (PCR) Bisulfitbehandlung und methylierungsspezifische PCR (MSP) Agarose-Gelelektrophorese Quantitative Real-Time PCR (qrt-pcr) RFLP-Analyse der SNPs 75
6 Inhaltsverzeichnis Amplifikation von Plasmiden mittels Transformation in E. coli Restriktionsenzymverdau von Plasmiden Mutations-Analyse mittels SNaPshot-Assay Sanger-Sequenzierung von DNA Vergleichende Genomische Hybridisierung (acgh) Proteinbiochemische Methoden Isolierung von Proteinen aus Zellen und Gewebe Protein-Konzentrationsbestimmung mittels BCA-Assay SDS-Polyacrylamid-Gelelektrophorese Westernblot Herstellung eines Tissue Micro Arrays (TMA) Anfertigung einer HE-Färbung Immunhistochemie (IHC) Immunfluoreszenz (IF) Statistische Methoden 94 3 Ergebnisse Untersuchung der SFRP1-Expression bei Blasenkrebs Funktionelle Charakterisierung der SFRP1-Expression in Harnblasenkarzinom-Zelllinien Screening der SFRP1-Expression in Harnblasenkarzinom- Zelllininen Analyse der Wnt-Zielgene in SFRP1-exprimierenden und SFRP1 defizienten RT112 und BFTC905 Zellen mittels qrt-pcr Analyse der Wnt-Zielgene in SFRP1-exprimierenden und SFRP1 defizienten RT112 und BFTC905 Zellen mittels Westernblot Wnt-Aktivität mittels TOP/FOP Assay Bestimmung der SFRP1-abhängigen Viabilität (Viability Assay) Bestimmung der SFRP1-abhängigen Proliferation (BrdU Assay) Untersuchung des SFRP1-abhängigen Migrationsverhaltens mit dem Wound Scratch Assay Prospektive Untersuchung der Bedeutung der SFRP1-Expression in papillären Blasentumoren SFRP1-Expression in fortgeschrittenen Blasentumoren rs3242 und rs SNP-Analysen in SFRP Genotypisierung von humanen Blasentumoren mittels RFLP und Sequenzierung Auswirkung des rs3242 SNP auf die SFRP1-mRNA-Sekundär- Struktur Expressionsanalyse von hsa-mir-603 und hsa-mir Überexpression von hsa-mir-603 in RT112, RT4 und J Deletionsmapping von Chromosom 8p mittels acgh Vergleichende genomische Hybridisierung 141
7 Inhaltsverzeichnis Cluster-Analyse Mutations-Analyse in FGFR3 und PIK3CA Untersuchung der MTUS1-Expression bei Blasenkrebs MTUS1-Expression in Harnblasenkarzinom-Zelllininen MTUS1-Expression in Tumorgewebe Funktionelle Untersuchung der MTUS1-Überexpression in RT Kontrolle des Transfektionserfolges mittels qrt-pcr Bestimmung der MTUS1-abhängigen Viabilität (Viability Assay) Bestimmung der MTUS1-abhängigen Proliferation (BrdU Assay) Untersuchung des MTUS1-abhängigen Migrationsverhaltens mit dem Wound Scratch Assay Immunhistochemische Untersuchung der MTUS1-Expression an zwei TMA-Studien TMA mit papillären Harnblasenkarzinomen TMA mit fortgeschrittenen Harnblasenkarzinomen Diskussion Zusammenfassung Literaturverzeichnis Abbildungsverzeichnis Publikationen, Kongressbeiträge und Fortbildungen Anhang Abkürzungsverzeichnis Hersteller-Angaben Schmelzkurven und Eichgeraden der Primeroptimierung und Primereffizienzbestimmung der qrt-pcr Karyogramme der 19 Tumoren der acgh Chromosomale Aberrationen der acgh zur Generierung von Pseudomarkern für die Cluster-Analyse Genotypen und Risikoallelverteilung beim rs3242 SNP in SFRP Genotypenverteilung beim rs SNP in SFRP Danksagung 229
8
9 Einleitung 1 Einleitung 1.1 Das Harnblasenkarzinom Definition, Epidemiologie, Ätiologie Der ableitende Harntrakt (siehe Abbildung 1-1) erstreckt sich vom Nierenbecken über den Urether (Harnleiter), die Harnblase bis hin zur proximalen Urethra (Harnröhre) und ist mit einem 5-7-schichtigen epithelialen Zellverbund, dem Urothel, ausgekleidet. Das Urothel fungiert als dehnbare, osmotische Barriere zwischen Urin und interstitieller Flüssigkeit, kann sich den verschiedenen Füllungszuständen anpassen und ist durch den ständigen Kontakt mit Urin häufig potenziellen Kanzerogenen ausgesetzt. Urothelkarzinome (UC urothelial carcinoma) sind maligne Veränderungen des Urothels und können im gesamten Harntrakt auftreten. In 90% der Fälle tritt das Urothelkarzinom jedoch in der Harnblase auf, in der zudem 90% des gesamten Urothels lokalisiert ist. Histologisch werden neben dem Urothelkarzinom, was in 90% der Blasenkrebspatienten präsent ist, noch andere, seltenere Entitäten unterschieden: in <10% der Fälle treten beispielsweise auch Plattenepithelkarzinome, sehr selten Adenokarzinome, neuroendokrine Tumore, maligne Melanome und mesenchymale Tumore in der Harnblase auf. Das Harnblasenkarzinom ist zudem eine oft multifokale (gleichzeitig an verschiedenen Stellen des Organs vorkommend), Alters- und Geschlechts-abhängige Erkrankung, die bevorzugt in höherem Lebensalter (mittleres Erkrankungsalter: Männer 72 Jahre; Frauen 74 Jahre) und bei Männern auftritt (Männer: 1/23, Frauen: 1/64) [1]. Mit bzw Neuerkrankungen im Jahre 2006 ist das Harnblasenkarzinom die viert-häufigste bzw. die siebt-häufigste maligne Erkrankung des Mannes bzw. der Frau in Deutschland. Im gleichen Jahr konnten (Männer) bzw (Frauen) Blasenkrebs-assoziierte Sterbefälle in Deutschland verzeichnet werden [1]. Europaweit wurden im Jahre Neuerkrankungen ( Männer und Frauen) und Harnblasenkarzinom-assoziierte Sterbefälle gemeldet, was das Harnblasenkarzinom damit zur 6.häufigsten malignen Tumorerkrankung in Europa macht [2]. 9
10 Einleitung A B Abbildung 1-1: Darstellung des Urogenitaltraktes des Mannes (A) und der Frau (B); der gesamte ableitenende Harntrakt, also Nierenbecken, Urether, Harnblase (Cystis) und Urethra sind vom Urothel ausgekleidet; zu 90% tritt das Urothelkarzinom aber in der Harnblase auf. Für das Harnblasenkarzinom werden viele verschiedene Ursachen diskutiert, wobei aber Rauchen mit Abstand den wichtigsten Risikofaktor darstellt. So konnte in einer kürzlich durchgeführten Studie von Boström et al gezeigt werden, dass 64% aller Blasenkrebspatienten Raucher, hingegen nur 36% Nicht-Raucher sind [3]. Auch andere Studien belegen, dass Raucher ein 2-6 mal so hohes Risiko haben an Blasenkrebs zu erkranken [4, 5], wie Nicht-Raucher und es wird angenommen, dass 66% (bei Männern) bzw. 30% (bei Frauen) aller Harnblasenkarzinome mit Tabakkonsum assoziiert sind [6, 7]. In einer groß angelegten Studie von Freedman et al (2011), die Männer und Frauen umfasste und deren Rauchverhalten und damit assoziierte Harnblasenkrebs-Erkrankungen von 1995 bis 2006 untersuchte, konnte bestätigt werden, dass Raucher und ehemalige Raucher ein signifikant höheres Erkrankungsrisiko haben (177,2 bzw. 119,8 pro ), als Nichtraucher (39,8 pro ) [8]. Neben dem Rauchen erhöht aber auch der berufsbedingte Kontakt zu bestimmten kanzerogenen Substanzen das Blasenkrebsrisiko. Der erste Zusammenhang wurde hierbei schon 1895 von Rehn beobachtet, als er von einem erhöhten Auftreten von Blasenkrebs bei Mitarbeitern der Anilin-Farbstoffindustrie berichtete [9]. Aromatische Amine, wie etwa Benzidin oder 2-Naphtylamin sind dabei die wichtigsten Noxen. Aber auch andere Industriezweige, wie etwa die Leder-, Papier-, Teppich-, Gummiund Metallindustrie, sowie Maler, Kraftfahrer, Mienen- und Zementarbeiter aber auch Frisöre haben ein höheres Erkrankungsrisiko, das sich aber auch immer nach der Dauer des Kontakts zu kanzerogenen Stoffen richtet [10, 11]. 10
11 Einleitung Weitere Ursachen der Blasenkrebsentstehung sind die Einnahme bestimmter Medikamente, wie Cyclophosphamid, Chlornaphazin oder der chronische Abusus von Analgetika, die Phenacetin enthalten [12, 13]. Chronische Infektionen mit dem Bilharzioseerreger Schistosoma haematobium, wie sie in bestimmten afrikanischen Ländern (z.b. Ägypten), im Mittleren Osten und in Süd-West Asien vorkommen, sowie andere Noxen, die zu chronische Zystitis führen, können zum plattenepithelialen Subtyp des Harnblasenkarzinoms führen [14, 15]. Symptome, Diagnose und Therapie In den meisten Fällen wird die Anwesenheit eines Harnblasenkarzinoms durch das Auftreten einer schmerzfreien, makroskopisch-sichtbaren Hämaturie während der Miktion angezeigt (bei 80% der Harnblasenkarzinome) [16, 17]. Begleitende Symptome, die auch von der Lage und Größe des Tumors abhängen, können Dysurie sowie häufigeres oder dringenderes Wasserlassen sein. Flanken-, Knochen-, Kopf- und suprapubische Schmerzen, sowie Gewichtsverlust, Müdigkeit und Anorexie können Zeichen einer bereits weiter fortgeschrittenen oder metastasierenden Erkrankung sein [18]. Goldstandard für die Detektion von Blasenkarzinomen ist die manuelle oder kamerabasierte Zystoskopie, die mit Hilfe eines flexiblen Zystoskops durch einen Urologen durchgeführt wird. Dabei wird sowohl die Weißlicht-basierte Zystoskopie, als auch die Fluoreszenz-Zystoskopie mittels 5 -Aminolävulinsäure (5-ALA) oder deren Ester (Hexvix ) angewendet. Diese Methode macht malignes Blasengewebe noch besser sichtbar und ist insbesondere für die Detektion von flachen Urothelveränderungen wie dem Carcinoma in situ besser geeignet als die Weißlicht-Blasenspiegelung [19]. Zusätzlich zur Zystoskopie wird unterstützend die Urin- bzw. Blasenspül-Zytologie hinzugezogen, um maligne Zellen zu identifizieren. Dabei werden die zellulären Bestandteile des Urins zytomorphologisch untersucht und so veränderte Zellen detektiert. Ausschlaggeben ist dabei zum Beispiel die Kerngröße der vorliegenden Zellen, das Vorhandensein von Chromatinkondensationen, die Anfärbbarkeit des Kerns, das Größenverhältnis zwischen Zytoplasma und Kern und die Anzahl von sichtbaren Mitosen [20]. Mit einer Spezifität von 98%, aber einer geringen Sensitivität 11
12 Einleitung von nur 30-40%, insbesondere bei gut differenzierten low-grade Tumoren, sollte die Zytologie nur in Kombination mit der Zystoskopie durchgeführt werden [21]. Alternativ zur Urin-Zytologie können heute auch Assays zur Detektion bestimmter molekularer Tumormarker durchgeführt werden [22]. Der UroVysion Test weist beispielsweise Veränderungen auf den Chromosomen 3, 7, 17 und 9p21 nach [23]. Dabei handelt es sich um genetische Aberrationen, die häufig beim Blasenkarzinom anzutreffen sind. Außerdem können bestimmte Tumorzell-spezifische Antigene oder Proteine wie das BTA-stat-BTA-TRAK [24], NMP22 [25], NMP52 oder bestimmte Cytokeratine, die in Blasenkrebszellen überexprimiert werden (wie 8, 18, 19, 20) detektiert werden. Auch PCR-basierte diagnostische Tests, wie Mikrosatelliten- Instabilität oder der TRAP (Telomerase)-Assay werden immer mehr in der Diagnostik eingesetzt [26, 27]. Allerdings sprechen hier die oft noch zu geringe Sensitivität und/oder Spezifität, das Fehlen von großen, validierenden Studien und der vergleichsweise hohe finanzielle Aufwand gegen eine breite Anwendung in der Routinediagnostik [28]. Zur Erstellung der Diagnose, die die Grundlage für die Auswahl der richtigen Thearpieform sowie die Abschätzung der Prognose des Patienten darstellt, bedient sich der Pathologe der sogenannte TNM-Klassifikation. Dabei handelt es sich um ein international gültiges Codesystem aus Buchstaben und Zahlen, das die anatomische Ausbreitung und Invasionstiefe des Primärtumors (Stadium bzw. staging, T=Tumor), sowie das Vorhandensein von Lymphknotenmetastasen (N=Node) oder Fernmetastasen (M=Metastasis) beschreibt (TNM) [29]. Bei papillären pta-tumoren und dem soliden Carcinoma in situ (ptis/cis) handelt es sich um nicht-invasive Tumoren, die nur das Urothel betreffen. Das flach wachsende Carcinoma in situ hat eine besondere Bedeutung bei der Diagnose und Prognosestellung, da es häufig mit einer malignen Progression assoziiert ist. pt1 Tumoren hingegen, dringen bereits in die Lamina propria, eine subepitheliale Bindegewebsschicht, vor und werden deshalb als frühes invasives Stadium bezeichnet. pt2 Tumoren dringen bereits in die umliegende Muskulatur vor, pt2a Tumoren bis in die innere Hälfte der Muskulatur, pt2b-tumoren bis in die äußere Hälfte. Beim pt3-tumor handelt es sich um ein invasives Stadium, das über die Mukelschicht hinaus bis in das umliegende Fettgewebe vordringt. pt4 Tumoren 12
13 Einleitung stellen den höchst möglichen Invasionsgrad dar und wachsen bis in benachbarte Organe ein (pt4a: Prostata, Gebärmutter, Scheide, pt4b: Becken- oder Bauchwand) (siehe Abbildung 1-2). Die Zusätze der N-Kategorie (N0 bis N3) richten sich nach der Anzahl und Lage der regionär befallenen Lymphknoten. M0 oder M1 bezeichnet die Abwesenheit bzw. das Vorhandensein von Fernmetastasen [ /ll_f_04.pdf]. Abbildung 1-2: Veranschaulichung der verschiedenen Tumorstadien beim Urothelkarzinom der Harnblase; bei pta und ptis handelt es sich um nicht-invasive Läsionen, bei allen anderen Stadien um invasivwachsende Tumoren; ab einem Stadium von pt2 wächst der Tumor muskelinvasiv. Zusätzlich zum Staging bestimmt der Pathologe das Grading (G) oder den Differenzierungsgrad des Tumors. Dabei handelt es sich um die Beschreibung der strukturellen Veränderungen des Tumorgewebes im Vergleich zu Normalgewebe. Das Grading liefert wichtige Informationen über die biologischen Eigenschaften und die Aggressivität des Tumors. Für das Grading von Harnblasenkarzinomen (siehe Abbildung 1-3) gibt es seit dem Jahre 2004 eine neue WHO-Klassifikation (low-grade und high-grade Tumoren) [30]. Das 3-stufige System von 1973 (G1, G2 und G3) [31] wurde aufgehoben und durch das 2-stufige System ersetzt. Bei lg (low-grade, früher G1 und teils G2)-Tumoren handelt es sich um malignes Gewebe, das aber noch ein geordnetes Erscheinungsbild aufweist; man spricht dabei auch von hochgradig- oder gut-differenzierten Tumoren. Im Vergleich dazu spricht man bei high-grade (hg, früher z.t. G2 und G3) Tumoren von geringgradig- oder schlecht-differenziertem, malignem Gewebe, dessen Architektur in hohem Maße von der des Normalgewebes 13
14 Einleitung abweicht. High-grade Tumoren sind mit einer höheren Progressionsrate und einer schlechteren Prognose assoziiert, als low-grade Tumoren und sie wachsen meist invasiv, erfordern oft eine aggressivere und zeitnahe Behandlung, da sonst schnell Metastasierung eintreten kann [32]. Zusätzlich zu lg und hg-tumoren wird im neuen WHO Grading auch die Entität des PUNLMP (papillary urothelial neoplasia with low malignant potential) eingeführt. Dabei handelt es sich um eine papilläre Veränderung mit geringem malignem Potential, die kein invasives Wachstum zeigt und ein niedriges Progressions- und Metastasierungsrisiko aufweist. Deshalb wird das PUNLMP auch nicht als Karzinom, sondern nur als Neoplasie bezeichnet [33]. Es gibt jedoch bereits Studien, die belegen, dass die dreistufige Grading-Einteilung der WHO 1973 in invasiven Tumoren besser für die Vorhersage der Progression geeignet ist, als das aktuelle zweistufige Tumor-Grading [34]. WHO 2004 PUNLMP low grade high grade WHO 1973 Grade G1 Grade G2 Grade G3 Abbildung 1-3: Gegenüberstellung des alten und neuen Grading-Systems der WHO; im System von 1973 wurden noch drei Differenzierungsgrade unterschieden, im aktuellen Grading-System werden die low-grade von den high-grade Tumoren abgegrenzt; das PUNLMP wurde als neue Entität eingeführt [35]. In 60-70% der Fälle des nicht-muskel-invasiven Harnblasenkarzinoms (<pt2) treten Rezidive, also wiederkehrende Tumoren auf und in 20-30% kommt es zur Progression zum muskel-invasiven Karzinom [36]. Die Dauer und Art der Behandlung hängt dabei meist vom individuellen Risikofaktor des Patienten ab, also von der Kombination aus Tumorstadium, histologischem Grading, Anzahl und Größe der Läsionen, dem Intervall der Tumor-Rekurrenz und der körperlichen Konstitution. Bei Niedrig-Risiko-Patienten treffen dabei die folgenden Parameter zu: pta, lg, 3 kleine (< 3cm) und papilläre Läsionen, das Nichtvorhandensein von CIS und ein großes Intervall zwischen einem Wiederauftreten der Erkrankung. Alle anderen Patienten werden der Hoch-Risiko-Gruppe zugeordnet [18]. Die Therapie erfolgt interdisziplinär und unterscheidet zwischen Niedrig- und Hoch-Risiko-Patienten. Als initiale Behandlung eines nicht-muskel-invasiven Tumors wird das Tumorareal einer transurothelialen Resektion (TUR) unterzogen. Bei verdächtigen Läsionen (z.b. pta 14
15 Einleitung hg oder pt1) sollte eine kurzfristige Wiederholung der TUR durchgeführt werden [37]. Zusätzlich kann die Anwendung eines lokalen Chemotherapeutikums (z.b. Mitomycin) circa sechs Stunden postoperativ zur Anwendung kommen [38]. Diese Methode senkt die Rezidivwahrscheinlichkeit signifikant (12% bei unifokalen, 20% bei multifokalen Tumoren). Bei nicht-muskel-invasiven, hoch-risiko Tumoren (z.b. pt1, hg) kommt meist auch die Anwendung einer stärkeren, lokalen Therapie zur Anwendung. Dabei handelt es sich um den abgeschwächten Stamm des Bakteriums Mycobakterium bovis, der auch als BCG (Bacillus Calmette-Guérin) bezeichnet wird [39]. Die Bakteriensuspension wird mittels Katheter in die Blase appliziert, wo sie dann die lokale Immunantwort, sowie bestimmte Zytokine aktiviert und somit einen Anti-Tumor-Effekt induziert. Auch bei wiederkehrenden Tumoren (Rezidiven), bei denen initial eine TUR durchgeführt wurde, wird BCG mit Erfolg eingesetzt. Die Überlebensrate bei nicht-muskel-invasiven Tumoren liegt bei 70-85%. Der Patient sollte durch eine 3-6-monatige Zystoskopie-Frequenz eventuelle Rekurrenzen, Persistenz oder Progression abklären lassen. Alle 1-2 Jahre sollte der Urogenital- Trakt auch mittels bildgebender Methoden (wie CT, MRT) visualisiert werden. Das empfohlene therapeutische Vorgehen bei Patienten mit muskelinvasiven Erkrankungen ist die radikale Zystektomie, die Entfernung der gesamten Harnblase mit zusätzlicher Entfernung regionaler Lymphknoten. Bei dieser Art der Therapie beträgt die progressionsfreie 5-Jahres-Überlebensrate 60-80%. In einigen Fällen geht der Operation eine neoadjuvante Chemotherapie, wie z.b. mit MVAC (Methotrexat, Vinblastin, Doxorubicin, Cisplatin) oder GC (Gemcitabin, Cisplatin) voraus, welche die Gesamt- Überlebenswahrscheinlichkeit nochmals erhöht [40]. Beim metastasierenden oder lokal fortgeschrittenen Blasenkarzinom hat die Chemotherapie grundsätzlich palliativen Charakter. Metastasen treten vorwiegend in Lymphknoten, Lunge, Knochen und Leber auf, das ZNS ist seltener betroffen. Patienten, die eine radikale Zystektomie ablehnen oder deren körperliche Konstitution eine solch schwerwiegende Operation nicht erlaubt, können auch mit Blasen-erhaltenden Therapien (z.b. kombinierte Radio-, Chemotherapie) behandelt werden. Das Harnblasenkarzinom ist bei zeitiger Erkennung zwar eine gut behandelbare, aber dennoch chronische und dadurch sehr kostenintensive Erkrankung, die immer eine lebenslange Nachsorge mit sich bringt. 15
16 Einleitung Histologie, Pathogenese und Molekulargenetik des Urothelkarzinoms Hinsichtlich der Histologie des Urothelkarzinoms werden zwei große Gruppen unterschieden: man grenzt die papillären Tumoren von den solide wachsenden Urothelkarzinomen ab. Zur ersten Gruppe gehören alle Tumoren, die ein papilläres Wachstumsmuster aufweisen, bzw. aus papillären Tumoren hervorgegangen sind. Diese sind das PUNLMP, das nicht-invasive und das invasive, papilläre Urothelkarzinom, das urotheliale Papillom und das invertierte Papillom, wobei das PUNLMP aufgrund der guten Prognose nicht als maligne Neoplasie bzw. Krebs bezeichnet wird. Beim Papillom bzw. invertierten Papillom handelt es sich um benigne urotheliale Läsionen ohne Progress und nur sehr seltenen mit Rezidiven. Die zweite Gruppe der soliden Karzinome (inklusive CIS) zeichnet sich durch ein flaches, nicht-invasives Wachstum mit großen, unregelmäßig begrenzten und hyperchromatischen Kernen aus. CIS-Tumoren treten zudem häufig zusammen mit papillären Tumoren auf und besitzen ein hohes malignes Potential. Bei den invasiven Karzinomen finden sich die verschiedensten histologischen Typen, wobei es sich bei der Mehrzahl der pt1-tumore noch um papilläre low-grade oder high-grade-tumoren handelt. Die hoch malignen pt2-pt4 Neoplasien hingegen, sind fast alle nicht-papillärer Natur mit schlechtem Differenzierungsgrad. Beispiele für nicht-papilläre invasive Urothelkarzinome sind Plattenepithelkarzinome, solche mit drüsiger oder trophoblasischer Differenzierung, die Nested-Variante, sowie mikrozystische, mikropapilläre, plasmozytoide, sarkomatoide oder undifferenzierte Subtypen [30]. Die papillären und soliden Urothelkarzinome unterscheiden sich nicht nur hinsichtlich ihrer Histologie und Invasionstiefe, sondern auch aufgrund ihres morphologischen und molekularpathologischen Entstehungsweges. Ausgehend vom normalen Urothel können zwei präneoplastischen Vorläuferläsionen entstehen: die Hyperplasie und die Dysplasie [41]. Bei der Hyperplasie handelt es sich um die Vorläuferläsion mit dem geringeren malignen Potential. Sie wird als verdickte Schleimhaut ohne zytologische Atypien definiert. Aus ihr entsteht die Mehrheit der nicht-invasiven papillären Urothelkarzinome (70-80% aller UC), die mit 70% Wahrscheinlichkeit rezidivieren und mit 15% einen Progress zum invasiven Tumor zeigen. 16
17 Einleitung Die Dysplasie ist eine intraurotheliale low-grade Neoplasie, die sich durch den Verlust der Zellpolarität, durch nukleäre und zytologische Atypien (z.b. unregelmäßige Zellkerngrenzen, veränderte Chromatinverteilung, wenige Mitosen, etc.) auszeichnet. Aus der Dysplasie entsteht das flache, nicht-invasive, aber biologisch sehr aggressive Carcinoma in situ (CIS), aus dem sich oftmals schnell ein muskel-invasives Karzinom entwickelt. Diesen beiden Hauptentstehungswegen des Urothelkarzinoms liegen auch unterschiedliche molekulare Alterationen zugrunde. Unabhängig von Grading oder Staging sind beide Entstehungswege durch initiierende Deletionen auf Chromosom 9p/q charakterisiert [42]. Diese Veränderungen finden sich sowohl in normalem Urothel von Tumorpatienten, als auch in den bereits beschriebenen Vorläuferläsionen und in mehr als 50% der Tumoren selbst. Dabei kommt es zu einer Inaktivierung von CDKN2A auf 9p21, was dazu führt, dass P14 und P16 nicht mehr funktionsfähig sind. Diese beiden Tumorsuppressorgene spielen eine wichtige Rolle in der Zellzykluskontrolle durch die Inhibition von Cyclin-abhängigen Kinasen [43]. Normalurothel Deletion Chromosom 9p/q FGFR3 Deletion Chromosom 9p/q TP53-Alteration Deletion Chromosom 9p/q Hyperplasie Hyperplasie + Dysplasie/CIS Dysplasie FGFR3 PIK3CA Cyclin D HRAS nicht-invasiver, papillärer low-grade Tumor?? FGFR3 Cyclin D HRAS?? nicht-invasiver, papillärer high-grade Tumor TP53-Alteration Carcinoma in situ Rezidiv Rezidiv?? Deletion Chromosom 8p Deletion Chromosom 11p Deletion Chromosom 13q Deletion Chromosom 14q TP53-Alteration Verlust von RB... Verlust von RB PTEN MYC, FHIT, chromosomale Deletionen und Amplifikationen... invasives Karzinom Metastasierung Abbildung 1-4: Darstellung der verschiedene molekularen Entstehungswege des Urothelkarzinoms der Harnblase: es werden zwei Hauptentstehungswege unterschieden: der hyperplastische/papilläre und der dysplastische/solide Entstehungsweg. Beiden Entstehungswegen liegen unterschiedliche genetische Alterationen zu Grunde [35]. 17
18 Einleitung Ein charakteristisches Merkmal des hyperplastischen Entstehungsweges ist das Auftreten von gain-of-function-mutationen in den klassischen Onkogenen FGFR3 (fibroblast growth factor receptor 3) und H-RAS (rat sarcoma), was zu einer konstitutiven Aktivierung des Rezeptor-Tyrosin-Kinase-Ras-MAPK-Signalweges führt, sowie die Überexpression von CCND1 (cyclin D1). Diese findet sich häufig in Hyperplasien, Papillomen, sowie nicht-invasiven, papillären low-grade-karzinomen (ca. 60%), jedoch nur selten bzw. gar nicht in Dysplasien, CIS und invasiven Karzinomen. Das Auftreten von FGFR3-Mutationen ist zudem mit einer guten Prognose assoziiert und nicht selten von einer zusätzlichen Mutation im PIK3CA-Gen (phosphoinositide-3-kinase, catalytic, alpha polypeptide) begleitet [44]. Sogar bei invasiven Tumoren kann bei Vorliegen einer FGFR3-Mutation eine verminderte Progression beobachtet werden. Der dysplastische Entstehungsweg weißt im Vergleich zum hyperplastischen eine viel größere genomische Instabilität auf und ist durch eine Aktivierung des EGFR/ERBB-Signalwegs gekennzeichnet. Häufige chromosomale Alterationen sind neben Chromosom 9 auch 13q (RB1), 17p (P53), 8p, 3p, 16q (CDH1), 11p (CDKN1C/P57), 7p (ERBB1/EGFR) und 8q (CMYC). Ein charakteristisches Merkmal beim CIS und bei invasiven Tumoren ist vor allem das Auftreten von loss-of-function- Mutationen in den Tumorsuppressorgenen P53, RB1 und PTEN [45]. Begleitend findet sich auch aberrante Expression von CDH1 (Zell-Zell-Kontakte), von Matrix- Metalloproteinasen (MMPs) und von angiogenese Faktoren, wie VEGF, die die Tumorprogression und Metastasierung fördern. Ein möglicher dritter Tumorentstehungsweg könnte über das gleichzeitige Auftreten von Dysplasien und Hyperplasien und durch die Überschneidung beider molekularer Pathogenesen zum nicht-invasiven papillären high-grade Tumor (pta, hg) führen. Dies konnte aber experimentell noch nicht bestätigt werden [35]. 18
19 Einleitung 1.2 Der Wnt-Signalweg Man unterscheidet den kanonischen (WNT/CTNNB1) von mehreren nichtkanonischen (z.b. WNT/Ca 2+, WNT/ROR oder WNT/planar cell polarity) Wnt- Signalwegen, wobei es sich beim kanonischen Signalweg um den am besten untersuchten und auch geläufigsten Wnt-Signalweg handelt [46]. Der WNT/CTNNB1- Signalweg soll deshalb auch im Folgenden genauer erläutert werden. Der kanonische Wnt-Signalweg ist ein molekularer, hoch-konservierter Signalweg der Zelle, der eine wichtige Rolle während der Embryonal- und Zellentwicklung, beim normalen Zellwachstum, bei der Zelldifferenzierung, sowie bei der Proliferation spielt. Er wurde zum ersten Mal bei der Fruchtfliege Drosophila melanogaster identifiziert. Bei flügellosen Fliegen konnte eine Mutation im sogenannten Wingless-Gen (Wg) nachgewiesen werden. Außerdem konnten 15 weitere Genloci (z.b. armadillo entspricht CTNNB1 in Vertebraten oder zeste white 3/shaggy entspricht GSK3ß in Vertebraten) identifiziert werden, die in mutiertem Zustand zu einer veränderten Anzahl an Körpersegmenten sowie zu veränderter Polarität im Larvenstadium führten [47]. Dem Wingless-Säugetier-Homologon, Int1, konnte ebenfalls eine wichtige Rolle in der Entwicklung zugeschrieben werden. Bei spontanen loss-of-function-mutationen in Int1 kommt es zum Beispiel zu einer fehlenden Ausbildung des Kleinhirns. Bei Überexpression von Int1 im Brustgewebe von Mäusen kommt es hingegen zur Ausbildung von Tumoren [48]. Damit konnte ein erster Zusammenhang zwischen dem Auftreten maligner Erkrankungen und dem Wnt-Signalweg hergestellt werden. Der Name Wnt entstand aus der Kombination von Wg und Int1. Als Wnt-Onkogene werden all jene Gene angesehen, die durch ihre (Über-) Expression zu einer verstärkten Aktivität des Wnt-Signalweges führen können (z.b. Wnt-Liganden, CTNNB1, TCF/LEF). Als Wnt-Tumorsuppressorgene bezeichnet man hingegen jene Gene, die durch ihren Expressionsverlust zu einer verstärkten Wnt- Aktivität führen können, da sie dann ihre Aufgabe als negative Regulatoren nicht mehr erfüllen können (z.b. SFRP1, DKK, WIF-1, APC, GSK-3ß). Das zentrale Signalmolekül des Wnt-Signalweges ist ß-Catenin (CTNNB1), welches das Wnt-Signal der Zelloberfläche in den Nukleus übermittelt und dort zu einer Veränderung der Transkription führt. In einem aktiven Wnt-Signalweg bindet der von 19
20 Einleitung umgebenden Zellen sezernierte Ligand WNT (es gibt derzeit 19 bekannte WNT- Liganden) an den Transmembran-Rezeptor Frizzled (FZD) und an die transmembrane Domäne LRP5/6 (low-density lipoprotein receptor-related protein 5/6). Diese werden im Anschluss durch die Casein-Kinase CK1γ und die Glycogen- Synthase-Kinase GSK3ß phosphoryliert, wodurch ein weiteres Signalmolekül, Dishevelled (DVL), zur Zytoplasmamembran rekrutiert wird, wo es mit FZD interagiert. Dadurch wird der im Zytoplasma befindliche CTNNB1-Destruktions- Komplex bestehend aus APC (adenomatous polyposis coli protein), AXIN und GSK3, inaktiviert, CTNNB1 im Zytoplasma stabilisiert und schließlich in den Kern transportiert. Dort bildet CTNNB1 zusammen mit dem Transkriptionsfaktor TCF/LEF (t-cell factor/lymphoid enhancer factor) einen Transkriptions-aktivierenden Komplex, der die Transkription der Zielgene des Wnt-Signalwegs initiiert [49]. Beispiele für Wnt-Zielgene sind CCND1, CMYC, AXIN2, BMP4, BIRC5 (=Survivin) oder CD44. Bei Abwesenheit eines Wnt-Liganden oder bei Anwesenheit eines Inhibitors (z.b. Dickkopf (DKK), Wnt-inhibitory factor 1 (WIF-1) oder secreted frizzled-related protein 1 (SFRP1) [50], wird CTNNB1 im Destruktions-Komplex zunächst phosphoryliert, und mittels E3 Ubiqutin-Ligase TrCP ubiquitiniert, was schließlich zum proteolytischen Abbau von CTNNB1 und somit zu verminderter Genexpression führt [51]. In Abbildung 1-5 sind der kanonische, sowie zwei nicht-kanonische Signalwege schematisch dargestellt. Verschiedenste Erkrankungen, wie beispielsweise Osteoarthritis [52], Lungenfibrose [53], Schizophrenie [54] aber auch die Entstehung von Krebs [55] sind mit einer aberranten Aktivierung des Wnt-Signalweges assoziiert. Erste Zusammenhänge von Krebs und dem Wnt-Signalweg konnten beim Kolonkarzinom hergestellt werden. Beim erbliche Syndrom der adenomatösen Polyposis coli ist das danach benannte APC-Gen mutiert, was schließlich dazu führt, dass CTNNB1 nicht abgebaut werden kann und somit der Wnt-Signalweg dauerhaft aktiv ist. So bilden sich bei betroffenen Patienten hunderte von zunächst benignen, adenomatösen Polypen im gesamten intestinalen Bereich, die aber mit einer Wahrscheinlichkeit von fast 100% maligne entarten können [56, 57]. 20
21 Einleitung Abbildung 1-5: Schematische Darstellung des kanonischen und zweier nicht-kanonischer Wnt-Signalwege; initialer Schritt einer Aktivierung ist die Bindung eines Wnt-Liganden an den Trans Membranen Rezeptor Frizzled; durch eine CTNNB1-abhängige (a) oder unabhängige Signalkaskade (b und c) wird die Transkription von Wntdownstream Zielgenen beeinflusst. Auch beim hepatozellulären Karzinom ist der Wnt-Signalweg involviert. Mit einer Frequenz von 25-30% treten beim Leberkrebs Punktmutationen im CTNNB1-Gen auf, welche dazu führen, dass das Protein nicht mehr phosphoryliert und somit nicht mehr im Proteasom abgebaut werden kann. Mit geringerer Frequenz treten auch Mutationen in AXIN1-Gen und die beim Kolonkarzinom bereits erwähnten APC- Mutationen auf. In einer Subgruppe von HCCs scheint aber auch eine Überexpression von WNT-1 eine große Rolle zu spielen. Die Blockade dieses Liganden führte zur Inaktivierung des Wnt-Signalwegs und zu verschiedenen anti- Tumor-Effekten, wie gesteigerter Apoptose und verminderter Blutgefäßbildung [58, 59]. Weitere Krebserkrankungen, bei denen eine Mutation im CTNNB1-Gen nachgewiesen wurde, sind unter anderem das Ovarialkarzinom, das anaplastische Schilddrüsenkarzinom, das Melanom der Haut und das Medulloblastom [60]. Ein klarer Zusammenhang zwischen dem Wnt-Signalweg und dem Auftreten des Urothelkarzinoms konnte bisher allerdings noch nicht hergestellt werden. Stöhr et al konnte in einer ersten Studie zeigen, dass beim Harnblasenkarzinom keine 21
22 Einleitung aktivierenden Mutationen im CTNNB1- oder APC-Gen vorliegen [61]. Thievessen et al postulierten daraufhin, dass eine konstitutive Aktivierung des Wnt-Signalweges unwahrscheinlich sei, was auch das Fehlen der bereits erwähnten Mutationen erklären könnte [62]. Diese und andere Studien untersuchten beispielsweise auch den Zusammenhang zwischen CDH1- bzw. JUP- (Plakoglobin) Expression und einer Wnt-Aktivierung. Eine Überexpression von CDH1 führte dabei zu keiner Inhibition von TCF-abhängigen Reportergenen, was dann aber einen aktiven Wnt-Signalweg voraussetzen würde. Die Plakoglobin-Überexpression führte hingegen zu keiner Aktivierung des Wnt-Signalweges, was wiederum die ersten Thesen stützt, dass der Wnt-Signalweg im UCC nicht aktiv ist [63]. Mehrere unabhängige Studien konnten dann aber einen Zusammenhang zwischen epigenetischer Herunterregulation verschiedener Wnt-Gene und dem Auftreten des Harnblasenkarzinoms herstellen. Hauptsächlich wurde dabei die methylierungsbedingte Inhibition der Wnt-Antagonisten (WIF-1, DKK und verschiedener SFRPs), sowie auch der WNT-Liganden selbst untersucht [64-66]. Im Urothelkarzinom konnte zudem auch eine höhere Methylierungsfrequenz von Wnt-Signalwegs-Antagonisten detektiert werden, als in normalem Urothel. Dies lässt darauf schließen, dass der Wnt-Signalweg im Karzinom weniger inhibiert wird, als in normaler Blasenschleimwand und es somit zu gesteigerter Proliferation und Progression kommen kann. Neben einer Promoterhypermethylierung in den Wnt-Inhibitoren, konnten auch Promotorhypermethylierungen in CTNNB1, sowie CDH1 und APC detektiert werden [67]. Neben dem Einfluss von epigenetischen Faktoren, die einen Einfluss auf eine aberrante Wnt-Expression haben können, wird auch eine Interaktion mit anderen Signalwegen diskutiert. Ahmad et al konnte erst kürzlich einen signifikanten Zusammenhang zwischen dem MAPK- und dem Wnt-Signalweg im Harnblasenkarzinom nachweisen. Dabei konnte nur in den Mäusen ein urothelialer Tumor innerhalb von 12 Monaten diagnostiziert werden, die eine Mutation in CTNNB1 und K-RAS trugen. Das Vorliegen von nur einer der beiden Mutationen genügte jedoch nicht, um einen Tumor innerhalb eines Jahres hervorzurufen [68]. Shin et al zeigten außerdem, dass die regenerative Proliferation von epithelialen Stammzellen in der Blase nach Reizung durch chemische Noxen oder Bakterieninfektionen durch ein negatives Feedback zwischen Shh- und Wnt- Signalweg zustande kommt [69]. Ein möglicher Crosstalk von Wnt-Signalweg und 22
23 Einleitung weiteren molekularen Signalwegen wird weitläufig diskutiert und untersucht, bedarf aber noch tiefgehenderer Analysen. 1.3 SFRP1 secreted frizzled related protein 1 SFRP1, secreted frizzled related protein 1 (auch bekannt als sfrp, FRP1, FRP-1, FrzA oder SARP2/secreted-apoptosis related protein 2) ist ein ca. 35 kda schweres, sezerniertes Glycoprotein der SFRP-Familie, die neben SFRP1 auch SFRP2-5 beinhaltet. SFRP1 enthält eine Cystein-reiche Domäne, die zu etwa 30-50% eine Sequenzhomologie zur Cystein-reichen Domäne des Frizzled-Rezeptors (FZD) aufweist. Aus diesem Grund kann SFRP1, genauso wie FZD, den Wnt-Liganden binden und somit als löslicher, extrazellulärer Antagonist des Wnt-Signalweges fungieren. Der Genlokus von SFRP1 liegt auf Chromosom 8p ( ) und besteht aus 47,5 Kilobasenpaaren (kbp), die in drei verschiedene Protein-kodierende Transkripte umgeschrieben werden können: SFRP1-001 bestehend aus 4488 bp und 314 Aminosäuren, SFRP1-002 bestehend aus 3873 Basenpaaren und 178 Aminosäuren oder SFRP1-003 bestehend aus 1437 Basenpaaren und ebenfalls 314 Aminosäuren im Protein (siehe Abbildung 1-6). Abbildung 1-6: Schematische Darstellung der drei verschiedenen Transkriptvarianten von SFRP1 [Ensembl] SFRP1 spielt eine wichtige Rolle in der Entwicklung und wird in vielen adulten Geweben, wie z.b. in Speicheldrüsen, der Haut, dem Uterus, der Retina, der Niere, der Brust und dem Herzen exprimiert. Doch auch bei der Entstehung und dem Verlauf von verschiedensten benignen und malignen Erkrankungen ist SFRP1 beteiligt. So konnte beispielsweise im uterinen Leiomyom, beim Glaukom und auch beim Lungenemphysem eine Überexpression 23
24 Einleitung von SFRP1 beobachtet werden. Beim Leiomyom konnte kein Zusammenhang mit Zellproliferation, aber mit antiapoptotischen Effekten vor allem bei hohen Östrogenkonzentrationen hergestellt werden [70]. Beim Lungenemphysem ging die Heraufregulierung mit einer progressiven Gewebezerstörung, beim Glaukom mit einem steigenden Augeninnendruck einher [71, 72]. Im Gegensatz zu benignen Erkrankungen, scheint SFRP1 bei Karzinomen verschiedenster Entitäten fast ausschließlich herunterreguliert zu sein. So konnten unter anderem beim Mamma-, kolorektalen-, ovarialen-, hepatozellulären-und beim Nierenzell-Karzinom gezeigt werden, dass die SFRP1-Expression vermindert oder verloren gegangen war. Als häufigster biologischer Mechanismus wurde hierbei die Promotermethylierung genannt. Dabei wird die Anlagerung der RNA-Polymerase an den SFRP1-Promotor durch das Vorhandensein von Methylgruppen an den Cytosinbasen der DNA, verhindert. So kommt es zu einer Verminderung oder Inhibition der Genexpression. Eine groß-angelegte Studie aus dem Jahre 2007 untersuchte die Expression von SFRP1 immunhistochemisch bei 3448 verschiedenen Tumoren aus 36 Organen (132 Tumorsubtypen) und 26 zugehörigen Normalgeweben [73]. Während in Tumorvorläuferläsionen von beispielsweise Niere, Endometrium, Nebenniere, etc. noch eine moderate bis starke SFRP1-Expression beobachtet wurde, konnte im entsprechenden malignen Tumor häufig ein Expressionverlust nachgewiesen werden. In neun Tumorentitäten (Niere, Magen, Dünndarm, Pankreas, Nebenniere, Parathyroidea, Gallenblase, Endometrium und Hoden) konnte der Expressionsverlust zum ersten Mal beschrieben werden. Beim Brustkrebs konnten Veeck et al eine 61%ige Hypermethylierung bei primären Mammatumoren mit einem schlechteren Gesamtüberleben korrelieren. Ugolini et al zeigten außerdem, dass 80% der invasiven Mamma-Tumoren am SFRP1-Promotor methyliert waren und dies in Zusammenhang mit der Anwesenheit von Hormonrezeptoren stand [74, 75]. Ähnliche Ergebnisse fanden sich auch beim Ovarkarzinom, bei dem ebenfalls die Promotermethylierung zur Inhibition des Wnt- Antagonisten und Tumorsuppressors SFRP1 führte [76]. Tanaka et al konnten beim Kolonkarzinom sogar eine 100%ige Hypermethylierung im SFRP1-Promotor nachweisen und zudem zeigen, dass SFRP1 der wichtigste Inhibitor des Wnt- Signalweges in MSI-H-Tumoren ist [77]. Auch andere Studien konnten eine Promotor-Hypermethylierung in SFRP1 im kolorektalen Karzinom nachweisen [78]. Allerdings spricht gegen eine Beteiligung des kanonischen Wnt-Signalweges, dass 24
25 Einleitung CTNNB1 in dieser Entität sowieso konstitutiv aktiv ist und eine veränderte SFRP1- Expression somit nicht ins Gewicht fällt. Caldwell et al postulierten dann, dass wohl veränderte nicht-kanonische Wnt-Signale zur SFRP1-bedingten Tumorprogression führen könnten [79]. Auch im Leberkrebs spricht hypermethyliertes SFRP1 für die Beteiligung des nicht-kanonischen Signalweges [80]. Für die Beteiligung des kanonischen Wnt-Signalweges spricht wiederum eine Studie von Gumz et al aus dem Jahre 2007, in der nach Reexpression von SFRP1 in einer klarzelligen Nierenkarzinomzelllinie neben vermindertem Wachstum auch eine verminderte Expression von kanonischen Wnt-Zielgenen, wie VEGF, VIM, HIG2, FN1, u.a. zu beobachten war [81]. Die Rolle von SFRP1 beim Harnblasenkarzinom wurde bisher in nur wenigen Studien untersucht. In einer 2004 publizierten Vorarbeit unserer eigenen Arbeitsgruppe konnten Stöhr et al als erste Gruppe einen Expressionsverlust von SFRP1 in 38% der Tumoren auf mrna-ebene und in 66% auf Proteinebene nachweisen. In 25% der Tumoren wurde ein LOH in SFRP1, in 29% ein methylierter Promoter gefunden [82]. Eine brasilianische Forschergruppe fand im Jahre 2005 eine Herunterregulation der mrna-expression von SFRP1 in 90% der Fälle. Die Promotormethylierung wurde als einer der Hauptmechanismen der Herunterregulation im Harnblasenkarzinom untersucht. Sechs verschiedene Studien fanden dabei eine SFRP1-Promotormethylierung zwischen 36,6 und 55,6% [67, 83-87]. Jedoch lagen den Studien oft verschiedene ethnische Gruppen, heterogene Methoden und auch unterschiedlich große Fallzahlen zu Grunde, sodass ein Vergleich schwierig ist. In der hier vorliegenden Arbeit soll der Zusammenhang zwischen der SFRP1- Expression und dem Risiko für das Harnblasenkarzinom weiter analysiert werden. 1.4 Chromosomale Verluste auf 8p bei Krebs Das Chromosom 8 besteht aus dem kurzen Chromosomenarm 8p und dem langen Arm 8q, die mit mehr als 145 Millionen Basenpaaren etwa 4,5 bis 5% der gesamten menschlichen DNA repräsentieren. Der Genkatalog von Chromosom 8 enthält 793 Genloci, die aus 614 bekannten Genen, 109 neuen CDS (coding sequences), 43 neuen Transkripten, 14 putativen und 13 Genfragmenten bestehen. Außerdem sind bereits mindestens 70 nicht-kodierende RNAs (mirnas), wie z.b. hsa-mir-30b/- 25
26 Einleitung 597/-124-1/-3674, bekannt, die ihren Genlokus auf Chromosom 8 haben (Stand , chromosome=8&start=&end=). Der kurze Arm 8p enthält 45.2 Millionen Basenpaare (1,5% des Genoms), deren 484 kodierende Gene vor allem eine wichtige Rolle bei der Entwicklung und der Signalübertragung des Nervensystems spielen [88]. In ihrem 2009 erschienen Review fassen Tabarés-Seisdedos und Rubenstein verschiedene molekulargenetische und entwicklungsbiologische Studien zusammen, die insgesamt 21 Gene auf 8p identifizierten, die gleichzeitig mit neuropsychiatrischen und neurodegenerativen Störungen, sowie malignen Erkrankungen einher gingen. Beispiele für diese Gene sind ADRA1A, DKK4, EGR3, FGFR1, LDL, NRG1 und eben auch SFRP1 [89]. Außerdem wurden dabei insgesamt 80 mit Krebs assoziierte Gene genannt. Chromosomale Alterationen sind ein häufiges Ereignis bei der Krebsentstehung. Dazu zählen neben Deletionen oder Insertionen einzelner Gene auch chromosomale Translokationen und Inversionen, sowie der Zugewinn oder Verlust großer Chromosomenabschnitten oder ganzer Chromosomen. Während manche Krebsarten ein nahezu diploides Genom mit wenigen Veränderungen der Chromosomenanzahl oder struktur aufweisen, gibt es auch andere maligne Erkrankungen, die durch aneuploide oder polyploide Chromosomensätze charakterisiert sind. Viele Karzinome zeigen im Verlauf ihrer Progression ausgehend von einem fast diploiden Chromosomensatz eine Entwicklung über einen fast-tetraploiden Chromosomensatz bis hin zu einem metastabilen pseudo-triploiden Zustand mit einer mittleren Chromosomenanzahl von 70, die der eines triploiden Chromosomensatzes entspricht. Chromosom 8p-Deletionen sind die häufigsten chromosomalen Alterationen in der Tumorgenese von humanen Tumoren. So wurden beispielsweise beim Adenokarzinom der Lunge, beim kolorektalen Karzinom, beim Nierenzellkarzinom und beim hepatozellulären Karzinom Verluste in Chromosom 8p, meist über die konventionelle Array-basierte vergleichende genomische Hybridisierung (array-based comparative genomic hybridisation, acgh), nachgewiesen [90-94]. Bei Blasenkrebs scheinen Verluste des genetischen Materials auf Chromosom 8p mit einer gesteigerten Progression des Tumors assoziiert zu sein [95]. Bisher konnten aber noch keine eindeutigen Kandidatengene identifiziert werden. Ziel der Arbeit war es 26
27 Einleitung deshalb unter anderem, neue potentielle Progressionsmarker auf 8p für das papilläre Urothelkarzinom zu identifizieren, die durch diese Deletionen betroffen sind. Abbildung 1-7: Schematische Darstellung von Chromosom 8 mit Bänderungsmuster; der kurze Arm wird auch als Chromosom 8p, der lange Arm als Chromosom 8q bezeichnet; SFRP1 liegt auf dem kurzen Arm bei 8p Single Nucleotide Polymorphisms (SNPs) in SFRP1 Single Nucleotide Polymorphisms (SNPs), also Einzelbasen-Polymorphismen sind natürlich vorkommende und zufällig über das Genom verteilte Variationen einzelner DNA-Basenpaare, die von Generation zu Generation vererbt werden. Solche Variationen werden auch als erfolgreiche Punktmutationen bezeichnet, da sie sich erfolgreich und stabil in den Genpool einer Population etabliert haben. SNPs treten bei etwa 1% der Bevölkerung auf und es wird vermutet, dass etwa drei bis sechs Millionen solche Polymorphismen in unserem Erbgut versteckt sind. Ungefähr alle 1000 Basenpaare findet sich statistisch gesehen ein SNP [96]. Etwa 90% aller genetischen Variationen sind auf SNPs zurückzuführen; sie bestimmen die Einzigartigkeit eines jeden Individuums und sind auch die Ursache für charakteristische Merkmale einer Familie, wie beispielsweise die Vererbung einer 27
28 Einleitung familientypischen Nasen- oder Mundform oder die Neigung zu Übergewicht oder nervöser Unruhe. Je nachdem ob der genetische Code durch das Auftreten des SNP verändert wird, spricht man von synonymen oder nicht-synonymen SNPs. Beim synonymen SNP codiert das Basentriplett trotzdem noch für die gleiche Aminosäure, beim nicht-synonymen SNP hingegen bewirkt der Basenaustausch einen Aminosäurewechsel. Liegt der SNP in einer proteincodierenden Region (codingsnp, csnp) kann der Basensäureaustausch zu einer veränderten Proteinfunktion führen und somit physiologische Effekte nach sich ziehen. Doch auch beim Auftreten in einer nicht-codierenden DNA-Region, kann der SNP die Genexpression beeinflussen: regulatory SNPs (rsnps) und structural RNA SNPs (srsnps) liegen in Regionen die die Transkription (z.b. über mirnas) und damit die Proteinkonzentration verändern oder auch die RNA-Prozessierung und das Spleißen beeinflussen. Der häufigste Basenaustausch ist der von Cytosin durch Thymin. Dies kommt dadurch zustande, dass Cytosin im Wirbeltiergenom häufig methyliert ist. Durch spontan auftretende Desaminierungen wird aus 5-Methylcytosin Thymin [97, 98]. SNPs machen uns nicht nur einzigartig, sondern sie beeinflussen auch die Prädisposition gegenüber bestimmten Erkrankungen und die Wirksamkeit und Verträglichkeit von Medikamenten. Deshalb sind sie auch der Hauptfokus vieler medizinischer oder pharmakologischer Forschungsgruppen. Das SNP-Konsortium TSC (The SNP Consortium), eine non-profit Organisation aus den USA hat 1999 begonnen alle im menschlichen Genom vorkommenden SNPs zu kartieren. Das internationale HapMap Projekt hat sich im Jahre 2002 darauf hin zum Ziel gesetzt, alle krankheitsrelevanten Gene und Haplotypen (Kombinationen gemeinsam vererbter SNPs) zu identifizieren; unter anderem also auch krankheitsassoziierte SNPs [99]. Ein bekannter SNP ist beispielsweise der SNP rs333 im Chemokinrezeptor CCR5, der zur Resistenz bzw. sogar zur Immunität gegenüber HI- Viren führt [100]. Mehrere SNPs in Apo E4 (z.b. rs7412 und rs429358), einer Variante des Apolipoprotein E, spielen hingegen eine wichtige Rolle bei der Entstehung von Morbus Alzheimer [101]. Laut dbsnp ( sind für SFRP1 860 humane SNPs bekannt (Stand: ), wobei aber bisher nur zwei Studien dazu publiziert wurden. Anne-Marie Sims und Kollegen untersuchten den Zusammenhang zwischen Knochendichte (bone mineral density, BMD) und den Genotypen von verschiedenen 28
29 Einleitung SNPs in SFRP1: bei rs921142, rs , rs und rs konnten signifikante Assoziationen nachgewiesen werden [102]. Ohnaka et al konnten 2009 einen signifikanten Zusammenhang zwischen zwei SNPs in SFRP1 (rs3242 und rs ) und der Lendenwirbel-Knochendichte Wert finden. Sie konnten dabei den homozygoten TT-Genotyp in rs3242 als denjenigen mit höherer Knochendichte identifizieren [103]. Eine Assoziation von SNPs in SFRP1 und malignen Erkrankungen ist nach unserem Kenntnisstand bisher nicht nachgewiesen worden. 1.6 Ziele der Arbeit Das papilläre Urothelkarzinom der Harnblase ist bei frühzeitiger Erkennung eine meist gut therapierbare, aber dennoch chronische Erkrankung, die einer lebenslangen und kostenintensiven Nachsorge bedarf. Um eine Verbesserung der individuellen Behandlung zu erreichen und eine bessere Risikoabschätzung jedes einzelnen Patienten zu ermöglichen, ist es notwendig neue molekulare Marker zu identifizieren, die ein eventuelles Fortschreiten der Erkrankung und die Prognose des Patienten vorhersagen können. Ziel der hier vorliegenden Doktorarbeit ist es deshalb, den durch Vorarbeiten unserer Arbeitsgruppe identifizierten potenziellen Progressionsmarker SFRP1 funktionell weiter zu charakterisieren und ihn in einer prospektiven Studie zu validieren. Dabei soll besonders die Rolle der für viele andere Tumorentitäten bereits gut charakterisierten kanonischen Wnt-Signaltransduktion in Abhängigkeit vom Wnt- Inhibitor SFRP1 untersucht werden. Für das Harnblasenkarzinom ist die Bedeutung dieser Signalkaskade für Entstehung und Progression noch weitgehend unklar und die publizierten Ergebnisse sind widersprüchlich. Für die funktionelle Charakterisierung von SFRP1 wurde die Expression des Wnt- Antagonisten in Harnblasenkarzinom-Zelllininen untersucht und der Einfluss von Überexpression, Knockdown und epigenetischen Faktoren in Hinblick auf Viabilität, Proliferation, Migration und Wnt-Aktivität analysiert. Die parallel durchgeführte prospektive Studie sollte die klininsche Relevanz von SFRP1-Veränderungen aufklären. Gleichzeitig wurde der Einfluss von zwei Einzelnukleotid-Polymorphismen in SFRP1, rs3242 und rs921142, auf das Erkrankungsrisiko untersucht um auch populationsgenetische Merkmale zu berücksichtigen und eine mögliche Assoziation 29
30 Einleitung mit der Erkrankung abzuklären. Dabei wurde zudem der Einfluss von zwei mikrornas (hsa-mir-603 und hsa-mir-3646) auf den rs3242 SNP und die SFRP1 Expression analysiert. Ein weiteres Ziel war die Identifizierung von neuen Kandidaten-Genen auf Chromosom 8p, die eine entscheidende Bedeutung für die allgemeine Tumorentwicklung und Progression besitzen. Obwohl Veränderungen auf 8p aus fast allen Tumorentitäten bekannt sind, fehlen bisher potentielle Kandidatengene, die von diesen chromosomalen Veränderungen betroffen sind. Mittels einer umfassenden und hoch-auflösenden Analyse des Chromosomenarms 8p in 19 Harnblasentumoren wollten wir deletierte Bereiche engmaschig eingrenzen und so mögliche Kandidaten- Gene herausarbeiten. Ein vielversprechendes identifiziertes Gen, MTUS1, wurde ebenfalls funktionell in Zellkulturexperimenten validiert und auf klinische Relevanz überprüft. 30
31 Material und Methoden 2 Material und Methoden 2.1 Material Standard-Chemikalien, -Reagenziensätze, -Lösungen, -Puffer und -Gerätschaften, die im Zusammenhang mit Kooperationsprojekten von anderen Laboren genutzt wurden, tauchen im Materialteil der hier vorliegenden Arbeit nicht auf; an entsprechender Stelle wird aber darauf hingewiesen Patientenmaterial Für alle verwendeten Erlanger Patientenmaterialien lag ein Ethikvotum ( ) für den retrospektiven Gebrauch von Gewebeproben im Rahmen der CCC- Gewebebank Erlangen (Stellungnahme vom und ) des UK Erlangen vor. Die Ethik-Kommission der Friedrich-Alexander-Universität Erlangen-Nürnberg hatte den entsprechenden Antrag überprüft und genehmigt. Die Verwendung von Patientengewebe aus dem UK Regensburg wurde mit dem Ethik-Antrag Nr CH abgedeckt. Das Grading der Tumoren erfolgte, je nach Alter des Materials, nach der WHO 1973 (G1-G3) [31]oder nach der neuen WHO Klassifikation von 2004 (lg und hg) [30]. Tissue Micro Array papillärer Harnblasenkarzinome Zur Untersuchung papillärer Urothelkarzinome wurden drei tissue micro arrays (TMAs) aus insgesamt 143 Tumoren von 91 Patienten (67 Männer, 24 Frauen) erstellt. Es wurden dabei alle geeigneten, im Jahre 2008 in der Erlanger Tumorbank asservierten, papillären Harnblasentumoren, samt aller zusätzlich aufgetretenen papillären Tumoren der gleichen Patienten aus anderen Jahren (z.b. bei Rezidiven) verwendet. Die Patienten waren zwischen 29 und 97 Jahren alt, das Durchschnitts- Alter betrug etwa 70 Jahre (Median 72 Jahre, ±11,4 Jahre). Charakteristische Parameter des Patientenkollektivs sind in Tabelle 2-1 zusammengestellt. Es handelte sich um 89 nicht-invasive (pta und PUNLMP) und 54 invasivwachsende (pt1-4) Tumoren, 70 Fälle waren low-grade und 70 Fälle high-grade. 31
32 Material und Methoden Parameter Eigenschaften Anzahl Patienten n = 91 Anzahl Tumoren n = 143 Alter Mittelwert: 70,3 Jahre Median: 72 Jahre (± 11,4 Jahre) Range: Jahre Geschlecht männlich: n= 67 (73,6%) weiblich: n = 24 (26,4%) Verhältnis Mann : Frau = 2,8 : 1 Stage PUNLMP n = 1 pta n = 88 pt1 n = 43 pt2-4 n = 11 Grade lg n = 70 hg n = 70 lg + hg n = 1 k.a. n = 2 Tabelle 2-1: Wichtige Eigenschaften und histopathologische Parameter des Patientenkollektivs des papillären Tissue Micro Arrays; es setze sich aus 143 papillären Tumoren von 91 Patienten zusammen. Die TMAs der papillären Harnblasentumoren wurden immunhistochemisch mit Antikörpern gegen die folgenden Proteine gefärbt: SFRP1, MTUS1, TP53, KI67/MIB, CK20. Die klinischen Follow-up Daten wurden in Zusammenarbeit mit dem Tumorzentrum Erlangen (TUZ, Fr. Dr. Petsch, Herr Schick) und der Urologischen Klinik/Waldkrankenhaus des Universitätsklinikums Erlangen erhoben. Tissue Micro Array fortgeschrittener Harnblasenkarzinome Neben den papillären TMAs wurden außerdem sechs TMAs mit fortgeschrittenen Harnblasenkarzinomen (mind. pt2 mit/ohne Metastasen, alle Patienten mit Zystektomie) immunhistochemisch gefärbt (SFRP1, MTUS1). Die Tumoren dieser TMAs stammen aus einer Chemotherapie-Studie aus dem Jahr 2005 mit ursprünglich 327 Patienten [104]. Für die Studie lag ein positives Ethikvotum der Arbeitsgemeinschaft Urologische Onkologie der Deutschen Krebsgesellschaft, sowie der lokalen Ethikkommissionen der teilnehmender Zentren und Kliniken vor. 32
33 Material und Methoden Die histopathologischen Patientendaten sind in eben dieser Publikation zusammengefasst. Vergleichende genomische Hybridisierung (acgh) in papillären Harnblasentumoren Mit Hilfe der acgh (array-based comparative genomic hybridisation) wurde das Genom von insgesamt 19 papillären Tumoren (neun nicht-invasive pta-tumoren und zehn invasive pt1-tumoren) verglichen. Dazu wurde das kryokonservierte Tumorgewebe zuerst manuell mikrodisseziert und dann daraus die DNA isoliert. Die Daten aller 19 Tumor-Patienten sind in Tabelle 2-2 zusammengefasst. Tumor Geschlecht Alter Stage Grade pta_1 männlich 53 pta low grade pta_2 männlich 57 pta high grade pta_3 weiblich 71 pta low grade pta_4 männlich 68 pta low grade pta_5 männlich 95 pta low grade pta_6 männlich 76 pta high grade pta_7 männlich 66 pta low grade pta_8 weiblich 61 pta low grade pta_9 weiblich 55 pta high grade pt1_1 weiblich 72 pt1 high grade pt1_2 weiblich 74 pt1 high grade pt1_3 männlich 64 pt1 high grade pt1_4 männlich 79 pt1 high grade pt1_5 männlich 68 pt1 high grade pt1_6 männlich 68 pt1 high grade pt1_7 männlich 62 pt1 high grade pt1_8 männlich 79 pt1 high grade pt1_9 männlich 75 pt1 high grade pt1_10 männlich 73 pt1 high grade Tabelle 2-2: Zusammenfassung der kliniko- und histopathologischen Parameter der Patienten-Kohorte für die array-cgh. Der Altersdurchschnitt betrug bei Patienten mit pta-tumoren 67 Jahre, bei Patienten mit pt1- Tumoren 71 Jahre. 33
34 Material und Methoden Untersuchung der MTUS1-Expression in Harnblasenkarzinom-Gewebe Für die initiale Analyse der Expression von MTUS1 in Harnblasenkarzinom-Gewebe mittels qrt-pcr und Westernblot wurden in der AG Uropathologie sechs willkürliche Tumoren aus der Tumorbank ausgewählt, deren Daten in Tabelle 2-3 zusammengefasst sind. Tumor Geschlecht Alter Stage Grade Probe 1 männlich 67 pta G2 Probe 2 weiblich 61 pt1 G3 Probe 3 männlich 50 pta G2 Probe 4 männlich 64 pta G2 Probe 5 männlich 66 pt1 G3 Probe 6 männlich 47 pta G2 Tabelle 2-3: Zusammenfassung der kliniko- und histopathologischen Parameter der sechs Harnblasen-Tumoren für die Analyse der MTUS1-Expression. Analyse der SFRP1 SNPs rs3242 und rs in Harnblasenkarzinom-Gewebe Die bei der Analyse der SNPs rs3242 und rs verwendeten DNA-Proben waren in der AG Uropathologie verfügbar und entstammten dem Universitätsklinikum Regensburg, wo auch die DNA isoliert wurde. Insgesamt wurde für die kaukasische Fall-Kontroll-Studie die aus Blut und normalem, nicht malignem Blasengewebe gewonnene DNA von 732 (rs3242) bzw. 618 (rs921142) Patienten untersucht. Davon waren 332 bzw. 328 Patienten der Kontroll-Gruppe ( Kontrollen ; ohne maligne Tumor-Läsion) zugeordnet. Von den 403 bzw. 290 Tumor-Patienten ( Fälle alle ) handelte es sich in 188 bzw. 184 Fällen um Patienten einer konsekutiven Harnblasenkarzinom-Studie (konsekutive Studie, Fälle KS ). Bei den restlichen 215 bzw. 106 Patienten handelte es sich um so genannte Early-Onset Patienten, bei denen der Tumor vor dem 45. Lebensjahr diagnostiziert wurde (Junge Patienten, Fälle JP ). Die unterschiedliche Größe des Studienkollektivs ist jeweils auf die divergente Verfügbarkeit des DNA-Materials zurückzuführen. Die kliniko- und histopathologischen Parameter des gesamten Patienten-Kollektivs sind in den Tabellen 2-4 und 2-5 zusammengefasst. 34
35 Material und Methoden rs3242 Kontrollen Fälle alle Fälle KS Fälle JP Anzahl n = 332 n = 403 n = 188 n = 215 Alter Median Mittelwert Altersbereich unbekannt 69 67,65 (±10,75) ,8 (±9,145) n = ,06 (±12,55) ,61 (±5,74) n = 20 n = 0 n = 0 Geschlecht männlich weiblich unbekannt n = 313 n = 19 n = 0 n = 185 n = 64 n = 154 n = 143 n = 45 n = 0 n = 42 n = 19 n = 154 Stage pta pt1 pt2 - pt4 Andere (inkl. CIS + ptx) unbekannt n = 147 n = 57 n = 56 n = 51 n = 92 n = 84 n = 37 n = 28 n = 39 n = 0 n = 63 n = 20 n = 28 n = 12 n = 92 Grade G1 G2 G3 unbekannt n = 75 n = 112 n = 97 n = 119 n = 42 n = 69 n = 66 n = 11 n = 33 n = 43 n = 31 n = 108 Tabelle 2-4: Zusammenfassung der kliniko- und histopathologischen Parameter der Patienten, die bezüglich des SFRP1 SNPs rs3242 analysiert wurden. rs Kontrollen Fälle alle Fälle KS Fälle JP Anzahl n = 328 n = 290 n = 184 n = 106 Alter Median Mittelwert Altersbereich unbekannt 69 67,6 (±10,8) n = ,8 (±17,6) n = ,2 (±12,9) n = ,2 (±6,6) n = 17 Geschlecht männlich weiblich unbekannt n = 309 n = 19 n = 0 n = 200 n = 64 n = 26 n = 141 n = 43 n = 0 n = 59 n = 21 n = 26 Stage Papillom PUNLMP CIS pta n = 4 n = 1 n = 22 n = 105 n = 0 n = 1 n = 19 n = 82 n = 4 n = 0 n = 3 n = 23 35
36 Material und Methoden pt1 - n = 41 n = 35 n = 6 pt2 - pt4 - n = 46 n = 29 n = 17 ptx - n = 18 n = 18 n = 0 unbekannt - n = 53 n = 0 n = 53 Grade G1 - n = 55 n = 41 n = 14 G2 - n = 76 n = 65 n = 11 G3 - n = 83 n = 67 n = 16 G1-2 - n = 1 n = 0 n = 1 G1+3 - n = 1 n = 0 n = 1 unbekannt - n = 74 n = 11 n = 63 Tabelle 2-5: Zusammenfassung der kliniko- und histopathologischen Parameter der Patienten, die bezüglich des SFRP1 SNPs rs analysiert wurden. Analyse der mikrorna Expression in Harnblasenkarzinom-Gewebe Für die Analyse der mikrorna-expression, wurden sieben Patienten mit papillärem Urothelkarzinom ausgewählt. Die entsprechenden Parameter sind in Tabelle 2-6 zu sehen. Patient # Geschlecht Alter Stadium Grad Patient 1 männlich 66 pta G2 Patient 2 weiblich 61 pt1 G3 Patient 3 männlich 50 pta G2 Patient 4 männlich 64 pta G1 Patient 5 männlich 67 pta G1 Patient 6 männlich 66 pt1 G3 Patient 7 männlich 46 pta G2 Tabelle 2-6: Zusammenfassung der kliniko- und histopathologischen Parameter der sieben Harnblasen-Tumoren, die für die Expressionsanalyse der mikrorna-603 und ausgewählt wurden. 36
37 Material und Methoden Zelllinien Für die funktionellen Untersuchungen der SFRP1-, der MTUS1- und der mirna- Expression wurden vier verschiedene Blasenkrebszelllinien (RT112, RT4, J82 und BFTC905) [ ], sowie die zwei immortalisierte Normal-Urothelzelllinine UROtsa [109] und HCV29 [110] verwendet. Außerdem stand von der Arbeitsgruppe Molekulare Urologie der Urologischen Klinik (Prof. Wullich) eine primäre Urothelzelllinie zur Verfügung. Sie wurde aus einem Prostata-Zystektomie-Präparat gewonnen. Als diverse Kontrollen dienten die Prostatakarzinomzelllinie LNCaP (Positivkontrolle MTUS1-Expression) [111], die Melanomzellline SK-Mel-28 (Positivkontrolle SFRP1-Expression) [112] und die Kolonkarzinomzelllinie SW480 (Positivkontrolle TOP/FOP Assay) [113]. Die androgen-abhängige Zelllinie LNCaP wurde ebenfalls von der AG Molekulare Urologie bereitgestellt. Die Zellen wurden alle bei 37 C, 5% CO 2 -Gehalt in RPMI-Medium kultiviert. Die Eigenschaften der Zelllinien sind in folgender Tabelle 2-7 zusammen gestellt. Zelllinie Eigenschaften RT112 Harnblasenkarzinom-Zelllinie; etabliert aus einem unbehandelten, papillären primären ptxg2-tumor einer kaukasischen Frau unbekannten Alters (1973) Morphologie: adhärente Epithelzellen (Monolayer), Verdopplungszeit 35 Stunden RT4 Harnblasenkarzinom-Zelllinie; etabliert aus papillärem pt2g1- Blasenrezidiv eines 63-jährigen Mannes (1968) Morphologie: adhärente epithel-ähnliche Zellen (Monolayer) J82 Harnblasenkarzinom-Zelllinie; etabliert aus solidem pt3g3-tumor eines 58-jährigen kaukasischen Mannes (1972) Morphologie: adhärente Epithelzellen BFTC905 Harnblasenkarzinom-Zelllinie; etabliert aus papillärem G3-Tumor einer 51-jährigen chinesischen Frau (1990) Morphologie: adhärente Epithelzellen (Monolayer, große Inseln) UROtsa Normal-Urothel-Zelllinie; immortalisiert mit SV40 T-Antigen-Genkonstrukt Morphologie: tropfenförmige Zellen HCV29 Normal-Urothel-Zelllinie; transformiertes nicht-malignes Blasenepithel 37
38 Material und Methoden SK-Mel-28 Maligne Melanom-Zelllinie, etabliert aus einem Tumor eines 51-jährigen Mannes Morphologie: adhärente, polygonale Zellen (Monolayer) SW480 Kolorektale Adenokarzinom-Zelllinie, etabliert aus einem primären Dukes Typ B-Tumor, etabliert von 50-jährigem kaukasischen Mann Morphologie: adhärente Epithelzellen (Monolayer) LNCaP Prostatakarzinom-Zelllinie; androgen-abhängig; etabliert aus Lymphknoten-Metastase eines 50-jährigen Mannes mit Prostatakarzinom (1977) Morphologie: adhärente Fibroblasten (Aggregate und einzelne Zellen) Tabelle 2-7: Übersicht über die verwendeten Zelllinien mit Angaben über ihre wichtigsten Eigenschaften, Herkunft und Morphologie Bakterienstamm Für die Amplifikation von Plasmiden (Midi- oder Maxi-Prep) wurde der im TOPO TA Cloning Kit for Sequencing enthaltenen Escherichia coli Stamm TOP10 (Genotyp: F- mcra Δ(mrr-hsdRMS-mcrBC) Φ80lacZΔM15 ΔlacX74 reca1 arad139 Δ(ara-leu)7697 galu galk rpsl (Str R ) enda1 nupg) verwendet. Die Bakterien sind chemisch- sowie elektrokompetent und werden bei -80 C gelagert Chemikalien und Reagenzien Chemikalie/ Reagenz 1,4-Dithiothreitol (DTT) 10x NEBuffer 2 10x NEBuffer 3 10x NEBuffer 4 10x NEBuffer EcoRI 10x Rotiphorese TBE-Puffer 10x TG (Tris/Glycine) Buffer 10x TGS (Tris/Glycine/SDS) Buffer 2-Mercaptoethanol 2-Propanol 2x Power SYBR Green PCR Master-Mix Hersteller* Roth New England BioLabs New England BioLabs New England BioLabs New England BioLabs Roth Bio-Rad Bio-Rad Roth Roth Applied Biosystems 38
39 Material und Methoden 2x QIAGEN Multiplex PCR Master-Mix Qiagen 40 % Acrylamide/ Bis solution, 29:1 Bio-Rad 50x TAE Electrophoresis Buffer Fermentas 5-Aza-2 -deoxycytidin Sigma-Aldrich 5x Colorless (Green) GoTaq Reaction Buffer Promega Aceton ROTIPURAN Roth AEC (3-Amino-9-Ethylcarbazol), 90% Sigma Agar-Agar, Kobe I Roth Agarose LE Biozym Albumin (BSA) Sigma Ampicillin Natriumsalz Roth APS Roth Aquatex Merck Biozym LE Agarose Biozym Borax March Bromphenolblau Sigma BSA für Restriktionsenzym-Verdau New England Biolabs BSA-Pulver Roth Buffer solutions ph 4 (ph7) VWR complete Mini Protease Inhibitor Cocktail Tablets Roche DEPC Treated Water (DNase/ RNase Free) Bioline Dimethyl Sulphoxide (DMSO) Sigma DMF (Dimethylformamid) Roth DPBS Invitrogen EDTA ( Roth Essigsäure (96%) Roth Ethanol ROTIPURAN Roth Ethidiumbromidlösung 0,5 % Roth FCS Pan-Biotech FuGene HD Transfektions-Reagenz Roche G-418 Seletions-Antibiotikum (50mg/ml) Roche GeneScan TM -120LIZ TM Size Standard Applied Biosystems Glycerol Sigma Glycin Roth Hämalaun Roth 39
40 Material und Methoden HEPES Hi-Di TM Formamide 3500 Dx Series Immobilon TM Western Chemiluminescent HRP Substrate Immunoblot Blocking Reagent (non-fat-dry milk) Kaliumchlorid LB-Medium (Lennox) L-Glutamin, 200mM Magnesiumchlorid MegaTran 1.0 Transfektions-Reagenz Methanol Methylenblau (Löfflers) Milchpulver Natriumacetat-Trihydrat (IH, Amanns) Natriumchlorid Natriumhydroxid Natriumpyruvat, 100mM NHS - LC - Biotin Opti-MEM PerfeCta Sybr Green Super Mix (low ROX) Ponceau S Puromycin Selektions-Antibiotikum (10mg/ml) Restore TM Western Blot Stripping Buffer RNase-free water Rotiphorese 10x TBE Puffer Rotistock 20 % SDS RPMI 1640 Medium S-Adenosylmethionin (SAM, 200x) SAHA Salzsäure rauchend ROTIPURAN 37 % SNaPshot Multiplex Ready Reaction Mix TaqMan Universal Master Mix (2x) TEMED Trichostatin A TRIS (Ultra Qualität) PUFFERAN Triton X-100 Roth Applied Biosystems Millipore Millipore Roth Roth Pan-Biotech Fermentas OriGene Roth Roth Roth Roth Roth Roth Pan-Biotech Thermo Scientific Invitrogen Quanta Biosciences Roth InvivoGen Thermo Scientific Qiagen Roth Roth Invitrogen NEB Biozol Roth Applied Biosystems Applied Biosystems Roth Sigma-Aldrich Roth AppliChem 40
41 Material und Methoden Trypan Blue Solution 0,4 % Sigma Trypsin 0,25 %ig / 0,02 % EDTA in PBS ohne Ca 2+, Mg 2+ Pan-Biotech TurboFectin TM 8.0 Transfektions-Reagenz OriGene Tween 20 Roth Tyramin Hydrochlorid Sigma Wasserstoffperoxid 30 % ROTIPURAN Roth Zitronensäure-Monohydrat Roth Tabelle 2-8: Auflistung aller verwendeten Chemikalien und Reagenzien mit Herstellerangaben *Weitere Angaben zu allen im Material und Methoden-Teil aufgelisteten Herstellern befinden sich in Anhang Lösungen und Puffer Lösung/ Puffer Inhalt Menge 1x Protein-Lysepuffer (WB) NaCl (5 M) 7,5 ml Tris/ HCl (1 M; ph 7,2) 12,5 ml Triton X (100x) 2,5 ml 20% SDS 625 μl EDTA (0,5 M; ph 8) 2,5 ml DTT (2 M) 125 μl Aqua dest. ad 250 ml 5x Protein-Ladepuffer (WB) Tris-HCl (ph 6,8) 0,313 M SDS 10 % Bromphenolblau 0,05 % Glycerol 50 % Trenngel (7,5 %) (WB) Tris (1,5 M; ph 8,8) 2,5 ml 10 % SDS 200 μl 40 % Acrylamide/ Bis solution (29:1) 1,9 ml 10 % APS 200 μl TEMED 20 μl Aqua dest. 5,4 ml Sammelgel (WB) Tris (1,0 M; ph 6,8) 380 μl 10 % SDS 30 μl 40 % Acrylamide/ Bis solution (29:1) 375 μl 10 % APS 30 μl TEMED 3 μl Aqua dest. 2,185 ml 41
42 Material und Methoden 1x Tris-Glycin-SDS-Laufpuffer (WB) 10x TGS Puffer 100 ml Aqua dest. 900 ml Towbin-Blotting-Puffer (WB) 10x TG Puffer 100 ml Methanol 200 ml Aqua dest. 700 ml 10x TBS/Tween Waschpuffer (WB) Tris (Pulver) 24,2 g NaCl 80 g HCl 38 ml Tween-20 5 ml Aqua dest. ad 1 l ph 7,6 einstellen mit HCl 1x TBS/Tween Puffer (WB) 10x TBS/Tween Puffer 100 ml Aqua dest. 900 ml Tris-Waschpuffer (IHC) Tris (Pulver) 6,1 g NaCl 9 g Aqua dest. add 1 l ph 7,4 einstellen mit HCl Zitronensäure-Puffer (IHC) Citronensäure Monohydrat 2,1 g Aqua dest. ad 1 l ph 6,0 einstellen mit HCl Borat-Puffer (IHC) Stammlösung A (19,007 g Borax + 83,5 ml 1000 ml Aqua dest.) Stammlösung B (0,1 N HCl) 16,5 ml ph 9,0 einstellen BT-Reagenz (IHC) Borat-Puffer 40 ml NHS - LC - Biotin 0,1 g Tyramin - Hydrochlorid 0,03 g TSA-Lösung (IHC) Tris-Puffer 500 μl BT-Reagenz 2,5 μl 30% Wasserstoffperoxid 1,5 μl Aceat-Puffer 1M ph 5,5 (20x) (IHC) Natriumacetat-Trihydrat 13,6 g Aqua dest 100 ml ph 5,5 einstellen mit Essigsäure 96% ca. 400 µl AEC-Stock-Solution (1%) (IHC) AEC 90% 0,1 g DMF 10 ml 42
43 Material und Methoden AEC-Working-Solution (IHC) Acetatpuffer 1 ml AEC-Stock 1Tropfen H2O2 0,3% 1 Tropfen Wasserstoffperoxid 3% (IHC) Wasserstoffperoxid 30% 5 ml Tris ph7,4 45 ml Wasserstoffperoxid 0,3% (IHC) Wasserstoffperoxid 30% 100 µl Aqua dest. 10 ml RPMI Arbeitslösung RPMI Fertigmedium 500 ml FCS 50ml (10%) L-Glutamin 5 ml (1%) Sodium-Pyruvat 5 ml (1%) SAM-Arbeitslösung 40x SAM 200x 1µl Wasser add 20µl TAE-Electrophoresis Buffer (1x) 10x TAE Puffer 20ml Aqua dest. 980ml TBE-Roitphorese Puffer (0,5x) 10x Rotiphorese TBE 50ml Aqua dest. 950ml Ethidiumbromid-Arbeitslösung 0,5x TBE Puffer 500ml Ethidiumbromid (0,5%, 5mg/ml) 5 Tropfen Tabelle 2-9: Auflistung aller verwendeten Lösungen und Puffer. Die Bezeichnungen WB (für Westernblot) bzw. IHC (für Immunhistochemie) geben an, bei welcher Methode die jeweilige Lösung/ der jeweilige Puffer zum Einsatz kam Kommerzielle Reagenziensätze (Kits) Kit mit Inhalt AEC Peroxidase Substrate Kit BigDye Terminator v1.1 Cycle Sequencing Kit DyeEx 2.0 Spin Kit NucleoBond Xtra Midi Kit Pierce BCA Protein Assay Kit QIA58 BrdU Cell Proliferation Assay QIAshredder TM RNeasy Mini Kit RevertAid TM Minus First Strand cdna Synthesis Kit VECTASTAIN Elite ABC Kit TOPO TA Cloning Kit Hersteller Vector Laboratories Applied Biosystems Qiagen Machery Nagel Thermo Scientific Merck Qiagen Qiagen Fermentas Vector Laboratories Invitrogen 43
44 Material und Methoden RNase-free DNAse Set QIAamp DNA Mini Kit CellTiter-Glo Luminescent Cell Viability Assay BrdU Cell Proliferation Assay Dual-Luciferase Reporter Assay System sirna Reagent System Amaxa Cell Line Nuleofactor Kit V U ultra View DAB (für IHC Färbeautomat) TaqMan MicroRNA Reverse Transcription Kit High Pure PCR Template Preparation Kit TSA TM Indirect (Tyramide Signal Amplification) qscript microrna Synthesis Kit Qiagen, Hilden Qiagen, Hilden Promega Calbiochem/Merck Promega Santa Cruz Lonza Ventana Applied Biosystems Roche Perkin Elmer Quanta Tabelle 2-10: Auflistung aller verwendeten kommerziellen Reagenzien-Sätze mit Angabe des Herstellers Nukleinsäuren Primer Alle Primer Stock-Lösungen haben eine Konzentration von 100µM. Primer Sequenz (5 3 ) Primer für konventionelle RT-PCR: GAPDH (Metabion) - forward: TGGTCACCAGGGCTGCTT - reverse: GTCTTCTGGGTGGCAGTGAT SFRP1 (Metabion) - forward: CACAACGTGGGCTACAAGAA - reverse: GAAGTGGTGGCTGAGGTTGT Primer für methylierungsspezifische PCR SFRP1_methyliert (Metabion) - forward: TGTAGTTTTCGGAGTTAGTGTCGCGC - reverse: CCTACGATCGAAAACGACGCGAACG SFRP1_unmethyliert (Metabion) - forward: GTTTTGTAGTTTTTGGAGTTAGTGTTGTGT Primer für quantitative real-time PCR: AXIN2 (Metabion) BMP4 (Metabion) CD44 (Metabion) - reverse: CTCAACCTACAATCAAAAACAACACAAACA - forward: CTGGCTCCAGAAGATCACAAAG - reverse: ATCTCCTCAAACACCGCTCCA - forward: ACTGGTCCACCACAATGTGACACG - reverse: GCTGAAGTCCACATAGAGCGAGTG - forward: TTCATCCTCGGGTGTGCTAT 44
45 Material und Methoden - reverse: GTACACCCCAACCTCAGTGG CMYC (Metabion) - forward: TGAGGAGACACCGCCCAC - reverse: CAACATCGATTTCTTCCTCATCTTC CCND1 (Metabion) - forward: CCGAGAAGCTGTGCATCTACAC - reverse: AGGTTCCACTTGAGCTTGTTCAC SFRP1(Metabion) - forward: CTACTGGCCCGAGATGCTTA - reverse: GCTGGCACAGAGATGTTCAA GAPDH (Metabion) - forward: TGGTCACCAGGGCTGCTT - reverse: AGCTTCCCGTTCTCAGCC MTUS1 (Metabion) - forward: AGCTTCGGGACACTTACATT - reverse: ATAGGCCTTCTTTAGCAATTC Primer für SNP-Analyse: SFRP1_rs3242 (Metabion) - forward: CCAGATGTTTTGATGTTATCG - reverse: TCACAGCTCACAGTATCATTG SFRP1_rs (Metabion) - forward: TCAGGAGTGCACTGGATTTAG - reverse: CCCAAGTCAGGAGTAAATCTC Primer für Mutations-Analyse: (alle von Metabion) FGFR3 (Multiplex, Exon 7) - forward: AGTGGCGGTGGTGGTGAGGGAG - reverse: GCACCGCCGTCTGGTTGG FGFR3 (Multiplex, Exon 10) - forward: CAACGCCCATGTCTTTGCAG - reverse: AGGCGGCAGAGCGTCACAG FGFR3 (Multiplex, Exon 15) - forward: GACCGAGGACAACGTGATG - reverse: GTGTGGGAAGGCGGTGGTG PIK3CA (Multiplex, Exon 9) - forward: AGTAACAGACTAGCTAGAGA - reverse: ATTTTAGCACTTACCTGTGAC PIK3CA (Multiplex, Exon 15) - forward: GACCCTAGCCTTAGATAAAAC - reverse: GTGGAAGATCCAATCCATTT FGFR3 (SNaPshot, R248C) T(46) CGTCATCTGCCCCCACAGAG FGFR3 (SNaPshot, S249C) T(36) TCTGCCCCCACAGAGCGCT T(28) TCTGCCCCCACAGAGCGCT FGFR3 (SNaPshot, G372C) T(29) GGTGGAGGCTGACGAGGCG FGFR3 (SNaPshot, Y375C) T(43) ACGAGGCGGGCAGTGTGT FGFR3 (SNaPshot, A393E) T(34) CCTGTTCATCCTGGTGGTGG FGFR3 (SNaPshot, K652M/T) T(20) CACAACCTCGACTACTACAAGA FGFR3 (SNaPshot, K652E/Q) T(50) GCACAACCTCGACTACTACAAG FGFR3 (SNaPshot, S373C) T(19) GAGGATGCCTGCATACACAC 45
46 Material und Methoden FGFR3 (SNaPshot, G382R) T(56) GAACAGGAAGAAGCCCACCC PIK3CA (SNaPshot, E542K) T(20) ACACGAGATCCTCTCTCT PIK3CA (SNaPshot, E545G) T(30) CCTCTCTCTGAAATCACTG PIK3CA (SNaPshot, E545K) T(34) ATCCTCTCTCTGAAATCACT PIK3CA (SNaPshot, H1047R) T(47) GAAACAAATGAATGATGCAC Primer für MicroRNA Assay: hsa-mir-603 (Quanta) Target Sequence: CACACACUGCAAUUACUUUUGC hsa-mir-3646 (Quanta) Target Sequence: AAAAUGAAAUGAGCCCAGCCCA RNU6 (Quanta) Target Sequence: SNORD44 (Quanta) Target Sequence: PerfeCta Universal PCR Primer Quanta Biosciences CGCAAGGAUGACACGCAAAUUCGUGAAGCGUUCCAUAUUUUU CCUGGAUGAUGAUAAGCAAUGCUGACUGAACAUGAAGUCUU AAUUAGCUCUAACUGACU Tabelle 2-11: Auflistung aller verwendeten Primer mit zugehörigen Sequenzen (in 5 3 -Richtung) der senseund antisense-primer. Desoxyribonukleinsäuren (DNAs) (Plasmid-)DNA Expressionsplasmid für hu SFRP1 in pcmv6-neo Vektor Plasmid-DNA Leervektor pcmv6-neo Expressionsplasmid für hu SFRP1 shrna in pgfp-v-rs sh RNA Vektor Plasmid-DNA Leervektor shrna in pgfp-v-rs sh RNA Expressionsplasmid für hsa-mir-603 in pcmv-mir Vektor Plasmid-DNA Leervektor pcmv-mir Expressionsplasmid für MTUS1 in pcmv6-xl5 Vektor Plasmid-DNA Leervektor pcmv6-xl5 TOPglow/FOPglow TCF Reporter Kit TCF-Bindestelle, Firefly-Luziferase pgl4.10 [lus2] Vector, Leervektor pgl4.13[luc2/sv40] Vector, Firefly-Luciferase pgl4.74[hrluc/tk] Vector, Renilla-Luziferase humane Placenta DNA (D4642), 1unit 46 OriGene OriGene OriGene OriGene OriGene OriGene OriGene OriGene Millipore Promega Promega Promega Sigma Hersteller
47 Material und Methoden Tabelle 2-12: Auflistung aller verwendeten Desoxyribonukleinsäuren (DNAs), inklusive aller Plasmide mit Herstellerangaben. Desoxyribonukleotid-Triphosphate (dntps) dntp datp, 100mM, 250 μl dctp, 100mM, 250 μl dgtp, 100mM, 250 μl dttp, 100mM, 250 μl Promega Promega Promega Promega Hersteller Tabelle 2-13: Auflistung der verwendeten Desoxyribonukleotid-Triphosphate mit Herstellerangaben. DNA-Standards DNA-Standard 50bp-DNA-Längenstandard (0,1 μg/μl), Gene Ruler 100bp-DNA-Längenstandard (0,1 μg/μl), Gene Ruler Hyper ladder TM I ( bp) Hersteller Fermentas Fermentas Bioline Tabelle 2-14: Auflistung der verwendeten DNA-Standards mit Herstellerangaben Proteine Enzyme Enzym Hersteller QuantiLum Recombinant Luciferase Promega, Madison/USA XhoI, units NEB, New England Biolabs, Ipswich/USA HindIII, units NEB, New England Biolabs, Ipswich/USA EcoRI, units NEB, New England Biolabs, Ipswich/USA AflIII, 250 units NEB, New England Biolabs, Ipswich/USA BbsI, 300 units NEB, New England Biolabs, Ipswich/USA NotI, units NEB, New England Biolabs, Ipswich/USA SmaI, units NEB, New England Biolabs, Ipswich/USA GoTaq DNA Polymerase # M3175 Promega, Madison/USA M. SssI, CpG Methyltransferase, # M0226S NEB, New England Biolabs, Ipswich/USA Tabelle 2-15: Auflistung aller verwendeten Enzyme mit Herstellerangaben. 47
48 Material und Methoden Antikörper Primär-Antikörper: Antikörper Mouse-anti-ß-AKTIN (WB), monoklonal Rabbit-anti-SDHA (WB), polyklonal Mouse-anti-MTUS1 (WB, IHC, IF) Rabbit-anti-SFRP1 (WB, IF) Rabbit-anti-CCND1 (WB), polyklonal Rabbit-anti-CMYC (WB) Rabbit-anti-CD44 (WB), monoklonal Rabbit-anti-BMP4 (WB), polyklonal Rabbit-anti-AXIN2 (WB), monoklonal Mouse-anti-SURVIVIN (WB), monoklonal Mouse-anti-E-Cadherin (IF) Rabbit-anti-SFRP1 (IHC) Mouse-anti P53 (IHC) Mouse-anti-Ki67 (IHC) Mouse-anti-CK20 (IHC) Sekundär-Antikörper: Goat-anti-Biotin HRP-konjugiert (WB) Donkey-anti-rabbit, HRP-konjugiert (WB) Goat-anti-mouse HRP-konjugiert (WB) Goat-anti-rabbit, biotinyliert (IHC) Rabbit-anti-mouse (IHC) Goat-anti-rabbit, DyLight 549-konjugiert (IF, SFRP1) Sheep-anti-mouse, DyLight 488-konjugiert (IF, E- Cadherin) DAPI (IF) Sigma Abcam Abnova Cell Signaling Abcam Abcam Abcam Abcam Hersteller Biolmol/Thermo Santa Cruz BD Biosciences Pineda Dako Cytomation Dako Cytomation Dako Cytomation Cell Signaling Dianova/Jackson Jackson Vector Dako Dianova/Jackson Dianova/Jackson Invitrogen Tabelle 2-16: Auflistung aller verwendeten Antikörper mit Herstellerabgaben. Die Bezeichnungen WB (Westernblot), IH (Immunhistochemie) bzw. IF (Immunfluoreszenz) geben an, bei welcher Methode der jeweilige Antikörper zum Einsatz kam. Protein-Standards Protein-Standard Precision Plus Protein TM Dual Color Standard Biotinylated Protein Ladder Bio-Rad Cell Signaling Hersteller Tabelle 2-17: Auflistung der verwendeten Protein-Standards mit Herstellerangaben. 48
49 Material und Methoden Geräte und Laborausstattung Gerät Modell Hersteller 6-Well-Platte (Transfektion) Tissue Culture Plate 6-Well, Flat Sarstedt Bottom, Cell+ 96-Well-Platte (BCA-Assay) Rotilabo -Mikrotest-Platte, U-Profil Roth 96-Well-Platte (BrdU-Assay) Cellstar 96 Well Cell Culture Plate, F- Greiner Bio-One bottom 96-Well-Platte (qrt-pcr) MicroAmp Fast Optical 96-Well Applied Biosystems Reaction Plate with Barcode (0,1 ml) Abzug Airflow Controller AC3 Waldner Agarosegel-Detektion E-Box VX2 Vilber Lourmat Agarosegel-Lauf-Apparatur Wide Mini-Sub Cell GT Bio-Rad Blotting-Papier Extra Thick Blot Paper, Mini blot size Bio-Rad Brutschrank (Labor) APT.line TM Binder Brutschrank (Zellkultur) CO 2 -Brutschrank CB210 Binder Culture Slides BD Falcon TM 8-well Culture Slides BD Biosciences Dampfkochtopf Decloaking Chamber Biocare Medical Deckgläschen 24x60 mm #1 Menzel Drehrad (Protein-Isolation) PTR-30 Grant-bio Eismaschine AF 200 Scotsman Falcons 15 ml Centrifuge Tube Roth Falcons Cellstar Tube, 50 ml Greiner Bio-One Färbeautomat für IHC BenchMark ULTRA ICH/ISH Staining Ventana Module Filtertips, steril 0,1-10 μl (Rack); 1-20 μl (Rack); Starlab μl (Rack); μl (Rack) Fluoreszenz-Mikroskop Olympus BX60 Olympus Freezing Container Nalgene Cryo1 C Freezing Container Thermo Scientific Klebefolie (qrt-pcr) Optical Adhesive Covers Applied Biosystems Kryo-Röhrchen Mikro-Schraubröhre 2 ml, PP Sarstedt Microcentrifuge Tubes 1,5 ml; 2,0 ml (Natural Flat Cap) Starlab Mikroskop (Zellkultur) Olympus CKX31 Olympus Mikroskop (Zellkultur, Migration) Olympus IX81 Olympus 49
50 Material und Methoden Mikrowelle - Severin Multipette Multipette plus Eppendorf Multipetten-Aufsatz Combitips plus 0,5 ml Eppendorf Multiplate Reader Synergy 2 BioTek (Absorption, Lumineszenz) Multiplate Reader (TOP/FOP) Mithras LB 940 (mit Injektor) Berthold Technologies Neubauer-Zählkammer Neubauer-improved Marienfeld Nitrocellulose-Membran Amersham Hybond ECL Nitrocellulose GE Healthcare Membrane Nucleofactor II AAP-1001S Amaxa biosystems PCR Tubes, Natural Flat Cap 0,5 ml Starlab ph-meter ph 210 Microprocessor ph Meter HANNA Instruments Pipetten Research (Plus) 0,1-2,5 μl; 0,5-10 μl; 2-20 μl; Eppendorf μl; μl; μl Pipettierhilfe (Labor) macro Pipettierhelfer Brand Pipettierhilfe (Zellkultur) Pipetboy Integra Power Supply (Agarosegel- PowerPac Basic Bio-Rad Lauf-Apparatur) Power Supply (Western Blot- PowerPac HC Bio-Rad Apparatur) Schüttel-Inkubator Typ 3031 GFL Schüttler (Westernblot) - VWR Sequencer Genetic Analyzer 3500 Dx Applied Biosystems Serologische Pipetten, steril 2 ml; 5 ml; 10 ml; 25 ml Sarstedt Sicherheitswerkbank Infinity Class II Microbiological Safety Esco Cabinet Sterilfilter Acrodisc PSF Syringe Filters PALL Life Sciences Thermocycler (PCR) DNA Engine Peltier Thermal Cycler Bio-Rad Thermocycler (qrt-pcr) 7500 Fast (96 Well) Real-time PCR Applied Biosystems System Thermocycler (Seq-PCR) Mastercycler pros Eppendorf Thermomixer Thermomixer comfort Eppendorf Tisch-Zentrifuge Galaxy Mini VWR Ultraschall-Sonifikator HTU SONI130 G.Heinemann 50
51 Material und Methoden Vortexer (Post-PCR) Reax top Heidolph Vortexer (Prä-PCR) MS1 Minishaker IKA Waage Präzisionswaage PCB Kern Wasserbad - Memmert Westernblot-Apparatur Mini Protean Tetra System Bio-Rad Western Blot-Detektion Fusion FX7 Vilber Lourmat Zellkultur-Inserts Culture-Inserts for Live Cell Analysis Ibidi Zellkultur-Flaschen Cellstar T75 Greiner Bio-One Zentrifuge (Post-PCR) Centrifuge 5424 Eppendorf Zentrifuge (Prä-PCR) Centrifuge 5415 R Eppendorf Zentrifuge (Zellkultur) Centrifuge 5810 R Eppendorf Tabelle 2-18: Auflistung der verwendeten Geräte und sonstigen Labor-Ausstattung mit Angabe des jeweiligen Modells (wenn vorhanden bzw. bekannt) und des Herstellers Softwares und Webtools Software 51 Hersteller 7500 Software v2.0.5 (qrt-pcr) Applied Biosystems Bio1D (WB, Agarosebilder) cell^p (Fluoreszenz-Mikroskop) E-Capt (Agarose-Gele) Fusion-Capt (WB) Gen5 (Synergy 2) Genotyping Console (acgh) Axio Vision Rel NEBCutter V2.0 [ PASW Statistics 19 Sequencing Analysis v5.4 (Sequenzierung) Test auf Abweichung vom Hardy-Weinberg-Gleichgewicht und auf Assoziation [ PubMed, BLAST, etc. Ensembl mirbase Tabelle 2-19: Auflistung der verwendeten Softwares und Webtools mit Herstellerangaben. Vilber Lourmat Olympus Vilber Lourmat Vilber Lourmat Biotek Affymetrix Olympus New England BioLabs SPSS Applied Biosystems Helmholtz-Zentrum München NCBI Wellcome Trust, Sanger Institute, EBI, EMBL University of Manchester
52 Material und Methoden 2.2 Methoden Zellbiologische Methoden Alle Zellkultur-Versuche wurden an einer sterilen Sicherheitswerkbank mit sterilen Einmal-Pipetten durchgeführt Auftauen und Einfrieren von Zellen Die in flüssigem Stickstoff kryokonservierten Zelllinien wurden bei Raumtemperatur ca. 10min aufgetaut und kurz in 37 C warmem Wasser geschwenkt. Anschließend wurden die Zellen in 10ml kaltem RPMI Komplett-Medium resuspendiert und einmal 8min bei 900rpm zentrifugiert. Der Medienüberstand wurde verworfen. Hierbei sollte insbesondere das zellschädigende DMSO des Einfriermediums entfernt werden. Es folgte ein Waschschritt mit RPMI-Medium, wobei das Zellpellett erneut in 10ml Medium resuspendiert und zentrifugiert wurde. Das Zellpellet wurde dann in 15ml 37 C-warmem RPMI-Medium resuspendiert, in eine T75 Flasche ausgesät und bei 37ºC und 5% CO 2 -Konzentration in einem Zell-Inkubator kultiviert. Zum Einfrieren wurden drei mittlere, maximal 80% konfluente Zellkulturflaschen (T75) abtrypsiniert, mit Medium gewaschen und bei 900rpm 8min zentrifugiert. Die Pellets wurden vereinigt und dann in 10ml Einfriermedium (9,5ml FCS + 5% DMSO (500µl)) resuspendiert, in 1ml-Fraktionen aliquotiert und zunächst bei -80ºC in einem auf - 20 C vorgekühlten Nalgene-1 C Freezing Container weggefroren. Nach 2-3 Tagen wurden die Röhrchen zur dauerhaften Lagerung in flüssigen Stickstoff bei -196 C überführt Kultivieren und Splitten adherenter Zellen Das Zellkulturmedium wurde alle 2-3 Tage gewechselt (5ml in den T25, 15ml in den T75 Kulturflaschen). Bei einem Konfluierungsgrad von ca. 80% mussten die Zellen gesplittet, das heißt verdünnt werden. Der Überstand, inklusive der abgestorbenen Zellen, wurde abgesaugt, die Zellen einmal mit PBS gewaschen und anschließend ca. 5 min mit Trypsin versetzt (2ml pro T75-Flasche). Das Enzym bewirkte, dass sich die Zellen innerhalb von 2-10min vom Flaschenboden lösten, so dass sie, in 8ml 52
53 Material und Methoden Medium resuspendiert, abgesaugt werden konnten. Durch Zugabe von FCS-haltigem Medium wurde das Enzym verdünnt und gleichzeitig mit Substrat abgesättigt, womit eine Zerstörung der Zellen verhindert wurde. Die Zellen wurden nach Zentrifugation (je 900rpm, 8min) resuspendiert und in der gewünschten Verdünnung (z.b. 1:10) ausgesäht Zählen von Zellen mit der Neubauer-Zählkammer Die gewünschten Zellen wurden in 1ml Medium aufgenommen und um den Faktor 1:10 mit PBS verdünnt. 10µl dieser Verdünnung wurden wiederum mit 10 µl Trypanblau vermischt (1:2-Verdünnung). Anschließend wurde die Neubauer- Zählkammer (Abb. 2-1) mit Ethanol gereinigt und das Deckgläschen aufgelegt, so dass Newton schen Ringe zu sehen waren. Daraufhin wurden ca. je 10µl der 1:2- Verdünnug auf jede Seite der Zählkammer unter das Deckgläschen pipettiert. Durch die Kapillarkräfte wird die Suspension unter das Deckgläschen gesaugt. Jedes einzelne der vier äußeren Eckquadrate (Fläche von 1mm 2 unterteilt in 16 Kleinquadrate) wurde ausgezählt und ein Mittelwert (MW) gebildet. Dieser Wert wurde noch auf die Verdünnung und das Volumen rückgerechnet: MW x 10 x 2 x (Kammerfaktor) = n. n entspricht der Anzahl der Zellen in einem Milliliter der Ausgangskonzentration. Abbildung 2-1: Neubauer Zählkammer mit zugehörigem Glasraster. Abgestorbene Zellen wurden durch das Trypanblau angefärbt und durften nicht mitgezählt werden. 53
54 Material und Methoden Aus der Zellkonzentration in einem Milliliter (Zellstock) konnte sodann das benötigte Volumen bzw. die Anzahl an Zellen für weitere Versuche mit folgender Formel errechnet werden: c1 x V1 = c2 x V2 (c1 = Ausgangskonzentration, c2 = Endkonzentration, V1 = Volumen aus der Stocklösung, V2 = Volumen der benötigten Endlösung) Transfektion von Nukleinsäuren Um den Einfluss bestimmter Gene oder non-coding-rnas auf das Zellverhalten und - funktion zu untersuchen, kann man die gewünschten Nukleinsäuren (sirna, mirna, Plasmid-DNA) mit verschiedenen Methoden in die Zelle bringen. Die geläufigste Form ist die transiente oder stabile Lipid-basierte Transfektion. Dabei wird das Überexpressionsplasmid oder die sirna in serumfreiem Medium mit einem Lipidreagenz inkubiert, sodass sich ein Transfektionskomplex aus Nukleinsäure und umgebenden Lipidtröpfchen formen kann. Diese Bio-Mizellen können dann leicht die Zytoplasmamembran der Zielzellen durchdringen und somit die Nukleinsäure in die Zelle bringen. Je nach Nukleinsäuretypus können dann die kodierenden Gene in mrna transkribiert und anschließend in Proteine translatiert werden oder die nichtkodierenden Gene beispielsweise zu mirna transkribiert werden und als Regulatoren der Genexpression wirken. sirnas, hingegen wirken direkt in der Zelle, indem sie die mrna des untersuchten Genes binden und somit deren Translation unterbinden. In der hier vorliegenden Arbeit wurde die Expression des Gens SFRP1 in RT112 durch stabile Transfektion von anti-sfrp1-shrna herunterreguliert, in BFTC905 durch stabile Transfektion mit einem SFRP1-Überexpressionsplasmides heraufreguliert. Außerdem wurde in RT112 das potentielle Kandidatengen MTUS1 transient überexprimiert, um einen möglichen funktionellen Hinweis auf den Zusammenhang mit der malignen Progression zu erhalten. Für die Untersuchung des Einflusses der mikrorna hsa-mir-603 auf die Expression von SFRP1, in Abhängigkeit des rs3242-genotyps, wurde hsa-mir-603 in den drei humanen Blasenkrebszelllinine RT112, RT4 und J82 überexprimiert. Für die Überexpression von hsa-mir-3646 war noch kein kommerziell erwerbliches Plasmid verfügbar. 54
55 Material und Methoden Für den TOP flash/fop flash Assay wurden die stabil transfizierten Zellen RT112 und BFTC905 mit den TOP, FOP und Renilla Plasmiden transfiziert. Diese Methodik ist jedoch im Punkt (TOP flash/fop flash Assay) beschrieben. Für die jeweilige Transfektion wurden die Zellen zunächst in der geeigneten Verdünnung in eine 6Well-Patte ausgesäht. Nach der Zelladhäsion am Kulturgefäß, wurde das Kulturmedium von den Zellen abgenommen und durch 900µl frisches Kulturmedium (RPMI) ersetzt. Dann wurde der Transfektionsmix bestehend aus OptiMEM, Plasmid-DNA und Transfektionsreagenz hergestellt und 10 bis 30min bei Raumtemperatur inkubiert. Im Anschluss wurden 100µl des Transfektionsmixes pro 6Well auf die Zellen pipettiert, gemischt und dann bei 5% CO 2 und 37 C im Brutschrank inkubiert. Zur Reduzierung zytotoxischer Effekte wurde nach ca. 5 Stunden, jeweils 2ml Kulturmedium auf das Transfektionsmedium gegeben. Bei der stabilen Transfektion erfolgte jeweils nach 3 bis 4 Tagen ein Mediumwechsel mit Selektionsmedium. Die unterschiedlichen Versuchsparameter der verschiedenen Transfektionen sind in den folgenden Tabellen 2-20 bis 2-23 zusammengefasst. Parameter Eigenschaft Menge/Volumen Zelllinie RT112, SFRP1-knockdown Plattenformat 6-Well-Platte Zellzahl Zellen Pro 6-Well Dauer der Zelladhäsion Ca. 37 Stunden Dann 50% Konfluenz Transfektionsmedium OptiMEM 100µl Transfektionsreagenz Turbofectin (Origene) 3µl Nukleinsäure(n) Anti-SFRP1-shRNA-Überexpressionsplasmid (A) Nonsense-Plasmid (B) Leervektor Je 1µg Ratio shrna:turbofectin 1:3 Kulturmedium Selektionsmedium (RPMI + Die Zellen waren erst bei Puromycin 0.5, 1 bzw. 3 3µg/ml abgestorben µg/ml) Inkubationszeit 30min, RT Transfektionsmix Inkubationszeit der 4 Wochen nach Puromycinzugabe, dann klonale Selektion Nukleinsäure in der Zelle 55
56 Material und Methoden Sonstiges Selektionsmedium mit AB wurde bei erster Passagierung nach Transfektion hinzugegeben Tabelle 2-20: Parameter der stabile Transfektion der anti-sfrp1-shrna in RT112 nach Optimierung. Parameter Eigenschaft Menge/Volumen Zelllinie BFTC905, SFRP1-Überexpression Plattenformat 6-Well-Platte Zellzahl Zellen Pro 6-Well Dauer der Zelladhäsion 24h Transfektionsmedium OptiMEM 100µl Transfektionsreagenz FuGene HD (Roche) 6µl Nukleinsäure(n) SFRP1-Überexpressionsplasmid (A) Nonsense-SFRP1-Überexpressionsplasmid (B) Leervektor pvmc6-neo (mock) je 2µg Ratio DNA:FuGene 2:6 Kulturmedium Selektionsmedium (RPMI mit 250µg/µl Neomycin/G-418) Inkubationszeit 15min, RT Transfektionsmix Inkubationszeit der Ca. 1 Woche, dann klonale Nukleinsäure in der Zelle Selektion Tabelle 2-21: Parameter der stabile Transfektion des SFRP1-Überexpressionsplasmids in BFTC905 nach Optimierung. Parameter Eigenschaft Menge/Volumen RT112 MTUS1-Überexpression Plattenformat 6-Well-Platte Zellzahl Zellen Pro 6Well Dauer der Zelladhäsion 24h Transfektionsmedium OptiMEM 100µl Transfektionsreagenz Megatran 3µl Nukleinsäure(n) MTUS1-1µg Überexpressionsplasmid Ratio DNA:Megatran 1:3 Kulturmedium RPMI 3ml 56
57 Material und Methoden Inkubationszeit Transfektionsmix Inkubationszeit Nukleinsäure in der Zelle der 10min 48h Tabelle 2-22: Parameter der transienten Transfektion des MTUS1-Überexpressionsplasmids in RT112 nach Optimierung. Parameter Eigenschaft Menge/Volumen Zelllininen Plattenformat RT112, RT4, J82, hsa-mir-603-überexpression 6-Well-Platte Zellzahl Zellen Pro 6Well Dauer der Zelladhäsion 24h Transfektionsmedium OptiMEM 100µl Transfektionsreagenz Megatran (Origene) 3µl Nukleinsäure hsa-mir-603 Origene Ratio DNA:Megatran 1:3 Kulturmedium Inkubationszeit Transfektionsmix Inkubationszeit Nukleinsäure in der Zelle der RPMI 10min, RT 24 und 48h 1µg (10µl aus 0.1µg/µl Stock) Vor Transfektion: 3ml pro Well, für Transfektion: 900µl Tabelle 2-23: Parameter der transienten Transfektion der hsa-mir-603 in RT112, RT4 und J82 nach Optimierung Bestimmung der Viabilität mittels Cell Titer Glo Assay Der Viabilitätsassay ist ein Lumineszenz-basierter Assay um die Anzahl an lebenden, das heißt metabolischen aktiven Zellen zu bestimmen. Der Cell Titer Glo Assay bedient sich dabei des im Zytoplasma lebendiger Zellen befindlichen ATPs um die chemische Umsetzung des Substrates Beetle Luziferin zum Oxyluziferin zu katalysieren. Die Menge an ATP bzw. die Intensität des Lumineszenzsignals ist dabei direkt proportional zur Zellzahl. Das bei der chemischen Reaktion entstandene Lichtsignal kann mittels Lumineszenz-Messgerät detektiert werden und ist ein Maß der Zelllebendigkeit. Ein starkes Lichtsignal weist somit viele, ein schwaches 57
58 Material und Methoden Lichtsignal hingegen wenige lebende Zellen nach. Folgende Gleichung veranschaulicht schematisch die ablaufende Reaktion: Ultra-Glo-Luziferase Mg 2+ Beetle Luciferin + ATP + O 2 --> Oxyluciferin + AMP + PP i + Licht + CO2 In eine weiße 96Well-Platte mit durchsichtigem Boden wurden Zellen in 100µl Medium ausgesäht. Nach 24stündigem Adherieren bei 37 C und 5% CO 2 und 30minütigem Abkühlen auf Raumtemperatur wurden 100µl Substrat pro Well zugegeben und 2min orbital im Synergy 2 geschüttelt. Im Anschluss folgte eine 10minütige Inkubation, bei der sich das Lumineszenzsignal stabilisieren konnte. Dann wurde die Lumineszenz bei einer Sensitivität von 135 im Synergy 2 von BioTek gemessen Bestimmung der Proliferation mittels BrdU Assay Der BrdU Assay ist ein kolorimetrischer Immuno-Assay der den Einbau von Bromodesoxyuridine (BrdU), einem interkalierenden Agenz, in neu-synthetisierte DNA von aktiv-proliferierende Zellen quantifizieren kann. Dabei detektiert und bindet ein Primärantikörper zunächst das eingebaute BrdU. Ein zweiter HRP-konjugierter sekundär-antikörper bindet im nächsten Schritt den Primärantikörper. Die Meerrettich-Peroxidase katalysiert dann die Reaktion des chromogenen Substrates Tetra-Methylbenzidin (TMB) von einer farblosen zu einer blauen (bzw. nach Zugabe des Stopp-Substrates gelben) Lösung. Die im Folgenden gemessene optische Dichte der gelben Lösung ist direkt proportional zur Menge der neu-synthetisierten DNA und damit ein Maß für die Proliferation. In Abbildung 2-2 ist dieser Farbumschlag veranschaulicht. 58
59 Material und Methoden Abbildung 2-2: Veranschaulichung der Plattenbelegung beim BrdU Assay; A und D 1-3: Medium, B und E 1-3 Mock Zellen, C und F 1-3 A-Klone; A bis C ohne BrdU-Zugabe, D bis F: mit BrdU Zugabe. Nach Zugabe des ELISA- Substrates entsteht ein blauer Farbkomplex, nach Zugabe der ELISA- Stopp-Lösung schlägt dieser in eine gelbe Färbung um; von dieser Lösung wird dann die Absorption gemessen. Es wurden Zellen pro Well einer 96-Well-Platte in 100µl RPMI Medium ausgesäht. 24, 48 und 72 Stunden nach dem Adhärieren der Zellen wurden 20µl der 5x Working Solution (500µl RPMI + 0,25µl der x BrdU-Stock-Lösung) für vier Stunden hinzugegeben. Danach folgte die Versuchsdurchführung gemäß den Herstellerangaben. Die Messung der Absorption erfolgte sofort nach Zugabe der ELISA-Stopp-Lösung bei 450 und 540nm Wellenlänge am Synergy Bestimmung der Migration mittels Wound Scratch Assay Für den Wundheilungs-Assay (Wound Scratch Assay) wurden die Inserts von IBIDI gemäß der Herstellerangaben benutzt. Pro Well wurden 70µl der Zellsuspension zugegeben; Die Konzentration der Zellsuspension betrug Zellen/ml bei RT112 (SFRP1) und Zellen/ml bei BFTC905 (SFRP1) und der Assay wurde jeweils dreimal durchgeführt. Bei der Überexpression von MTUS1 in RT112 Zellen wurden zwei verschiedene Zellkonzentrationen verwendet: Zellen/ml und ca Zellen/ml. Der Assay wurde für jede Zellkonzentration zweimal durchgeführt. Nachdem die Zellen zu einem dichten Rasen zugewachsen waren, wurden die Inserts vorsichtig mit einer sterilen Pinzette entfernt. Im Anschluss wurden innerhalb von 24 Stunden Fotos vom Zellspalt gemacht um so das Migrationsverhalten der Zellen zu dokumentieren. Die Flächenberechnungen erfolgten mit der Olympus Software Axio Vision Rel
60 Material und Methoden Bestimmung der Wnt-Aktivität mittels TOP flash/fop flash Assay Alle Versuche zur Bestimmung der Wnt-Aktivität wurden an der Universitätsmedizin Göttingen in der Klinischen Forschergruppe 176 in Zusammenarbeit mit Emil Kendziorra und Dr. Melanie Spitzner durchgeführt. Um die Aktivität des Wnt-Signalweges in den Zelllinien RT112 und BFTC905 in Abhängigkeit von der SFRP1-Expression nachzuweisen, wurde der Lumineszenzbasierte TOP flash/fop flash Assay angewendet. Dabei wurde mittels transienter Transfektion ein Plasmid in die Zellen eingebracht, welches neben einem Gen für die Firefly-Luziferase, eine funktionsfähige (TOP-Plasmid) oder mutierte (FOP-Plasmid) Promotor-Bindestelle für den Transkriptionsfaktor TCF/LEF besitzt. Ist der Wnt- Signalweg aktiv, wird der Transkriptionsfaktor in der Zelle exprimiert und kann so an den Firefly-TOP-Promotor binden. Dies bewirkt dann die Transkription und folglich Expression des Luziferase-Gens. Die Luziferase-Aktivität konnte dann nach Zugabe eines Substrates und durch die dabei entstandene Lichtemission (Biolumineszenz) in einem Multiplatten-Lesegerät gemessen werden. Als Kontrolle wurde die Kolonkarzinomzellinie SW480 mitgeführt, die durch eine Mutation im APC-Gen, einen konstitutiv aktiven Wnt-Signalweg besitzt. Um die Transfektionseffizienz der jeweiligen Zelllinie zu bestimmen, wurde neben dem TOP oder FOP-Plasmid zusätzlich ein Plasmid mit einem Renilla-Luziferasegen transfiziert, welches bei erfolgreicher Transfektion immer exprimiert wurde. Nach Zugabe des Firefly- Luziferase-Substrates wurde in einem zweiten Schritt das Renilla-Substrat zugegeben und erneut die ausgesendete Lumineszenz gemessen. Um die Funktionalität des Assays zu überprüfen, wurden im Vorfeld auch die Lumineszenzsignale von reiner Firefly-Luciferase, sowie des Firefly- Expressionsplasmides und des zugehörigen Leervektors gemessen. Die Zelllinien RT112 A, RT112 Mock, BFTC905 A, BFTC905 Mock, sowie SW480 wurde in T75 Flaschen mit normalem oder Selektions-RPMI-Medium kultiviert, gezählt und je 1 Million Zellen in einem 50ml Falcon abzentrifugiert. Der Überstand wurde verworfen und das Pellet mit 200µl Solution V von Lonza versetzt. Je 100µl dieser Lösung wurden mit 500ng TOP oder FOP-Plasmid (5µl aus 100ng/µl Stock- Lösung) und 50ng Renilla-Plasmid (5µl aus 10ng/µl Stock-Lösung) versetzt und luftblasenfrei in eine Lonza-Einmalküvette überführt. Nach 2-maligem Aufklopfen 60
61 Material und Methoden wurde die Küvette in den Nucleofector II von Amaxa Biosystems eingeführt und die Transfektion mit dem Programm T-30 gestartet. Die Nucleofactor Technologie ist eine Transfektionsmethode, die sich einer Kombination aus Zell-spezifischen Transfektionsreagenzien und elektrischen Parametern bedient und somit auch für schwierig zu transfizierende Zellen geeignet ist. Nach der Transfektion wurde die Zell-Lösung in normales RPMI- oder Selektions- Medium aufgenommen und auf je drei Wells einer 6Well-Platte mit je 3ml Medium aufgeteilt. Pro Well wurden somit ca transfizierte Zellen ausgesäht. Die Zellen wurden 31 Stunden im Brutschrank kultiviert und anschließend einmal mit PBS gewaschen und dann mit 100µl Lysepuffer versetzt. Nach dem Ablösen der Zellen vom Well-Boden mittels CellScraper und mehrmaligem Auf- und Abpipettieren (aktive Lyse), wurden die Lysate 2x in flüssigem Stickstoff Schock-gefroren und dann wieder aufgetaut. Eine vollständige Zelllyse konnte so noch besser unterstützt werden. Die Lumineszenzmessung erfolgte in Triplikaten in einer weißen 96Well- Platte nach folgendem Schema: BFTC 905 A TOP BFTC 905 A TOP BFTC 905 A TOP BFTC 905 A FOP BFTC 905 A FOP BFTC 905 A FOP BFTC9 05 Mock TOP BFTC9 05 Mock TOP BFTC9 05 Mock TOP BFTC9 05 Mock FOP BFTC9 05 Mock FOP BFTC9 05 Mock FOP BFTC9 05 A UB RT112 A TOP BFTC9 05 A UB RT112 A TOP BFTC9 05 A UB RT112 A TOP BFTC9 05 Mock UB RT112 A FOP BFTC9 05 Mock UB RT112 A FOP BFTC9 05 Mock UB RT112 A FOP RT112 Mock TOP RT112 Mock TOP RT112 Mock TOP RT112 Mock FOP RT112 Mock FOP RT112 Mock FOP RT112 A UB SW480 TOP RT112 A UB SW480 TOP RT112 A UB SW480 TOP RT112 Mock UB SW480 FOP RT112 Mock UB SW480 FOP RT112 Mock UB SW480 FOP LP LP LP leer leer leer Als Kontrolle wurden untransfizierte RT112 A/Mock bzw. BFTC905 A/Mock Zelllinien, sowie Lysepuffer, leere Wells und die SW480 TOP und FOP-Zellen gemessen. Pro Well wurden zunächst 100µl LAR II Promega Puffer (Substrat für die Firefly- Luciferase) vorgelegt, dann entweder 20µl Lysat oder Lysepuffer hinzu pipettiert. Der 61
62 Material und Methoden Stop&Glo Promega Puffer wurde nach dem Waschen und Primen der Injektorschläuche mit dem Injektor aufgezogen. Nach der ersten Messung der Firefly- Luziferase-Aktivität, wurde je 100µl des Stop&Glo-Substrats pro Wells zugegeben und dann die Renilla-Luziferase-Aktivität bestimmt. Die Lumineszenz wurde über die RLU (relative light units) gemessen. Die Messung erfolgte für 10 Sekunden mit 2 Sekunden delay im Multiplate-Reader Mithras LB 940 von Berthold Technologies. Die Auswertung des TOP/FOP flash Assays erfolgte mit Excel und die Wnt-Aktivität wurde mit folgenden Formeln berechnet: TOP normalisiert = TOP/Renilla (für Behandlung und Kontrolle) FOP normalisiert = FOP/Renilla (für Behandlung und Kontrolle) Ratio= TOP normalisiert /FOP normalisiert (für Behandlung und Kontrolle) Ein Ratio ab dem Wert 2 wurde als aktiver Wnt-Signalweg gewertet. Die Differenz der Ratien von Behandlung und Kontrolle zeigt dann schließlich den sogenannten fold-change bzw. die Änderung der Wnt-Aktivität in Assoziation mit der SFRP1- Expression in den beiden Zelllinien auf Behandlung der Zellen mit 5-Aza, SAHA und Trichostatin Eine Möglichkeit der epigenetischen Regulation ist die Stillegung von Genen mittels Methylierung. Dabei werden bestimmte Cytosinbasen des DNA-Stranges mit Methylgruppen versehen, die dann die Anlagerung der RNA-Polymerase verhindern und so die Transkription hemmen. Um DNA-Methylierungen nachzuweisen bedient man sich der Bisulfitbehandlung und der methylierungs-spezifischen PCR. Um solche Hypermethylierungen der DNA aber wieder aufzuheben und eine nachfolgende Reexpression nachzuweisen, inkubiert man die DNA, bzw. die Zellen mit dem demethylierenden Agens 5-Aza-2 -deoxyzytidin (auch bekannt als Decitabine oder Dacogen, kurz: 5-Aza). Um die Methylierung des SFRP1-Promotors aufzuheben und wieder normale Genexpression zu erreichen wurden Zellen zusammen mit 3ml Kulturmedium in einer 6-Well-Schale ausgesäht. Nach der Zelladhäsion wurden 2µM 5-Aza zu den Zellen pipettiert und für drei Tage inkubiert. Alle 24 Stunden erfolgte ein Mediumwechsel mit jeweils erneuter Zugabe von 2µM 5- Aza. Eine weitere Möglichkeit der epigenetischen Regulation ist das gene silencing 62
63 Material und Methoden mittels Acetylierung. Um sicher zu stellen, dass die fehlenden SFRP1-Expression nicht durch eine Acetylierung bedingt war, wurden die Zellen mit SAHA (suberoylanilide hydoxamic acid, auch bekannt als Vorinostat oder Zolinza) und Trichostatin inkubiert zwei Histon-Deacetylase-Inhibitoren. Diese verhindern die Funktion des Enzyms Histon Deacetylase. Somit kann ausgeschlossen werden, dass Deacetylierungen am SFRP1 Promotor spontan durch die Histon-Deacetylasen auftreten und damit die Reexpression nur auf die Wirkung von 5-Aza zurück zu führen ist Zellen von BFTC905 wurden mit 3ml Medium und je 2µM SAHA oder 1,65µM Trichostatin versetzt. Die Inkubation erfolgte ebenfalls über drei Tage mit Mediumwechsel nach 24 Stunden. Im Anschluss wurde die RNA isoliert, cdna synthetisiert und eine Reexpression mittels nested PCR überprüft. 63
64 Material und Methoden Molekularbiologische Methoden Mikrodissektion von gefrorenen Gewebedünnschnitten Um intakte DNA aus humanen Blasentumoren und gegebenfalls zugehörigem Normalurothel zu erhalten, wurden die kryokonservierten Gewebeproben zunächst in ca. 5µm dicke Scheiben geschnitten und dann auf einen Glasobjektträger aufgezogen. Ein Dünnschnitt wurde anschließend mit Hämalaun-Eosin-gefärbt und das entsprechenden Tumor- bzw. Normalgewebsareal vom Pathologen (AH) angezeichnet. Dieser Schnitt diente dann als Referenz für die Mikrodissektion. Die restlichen Schnitte wurden in Ethanol fixiert, mit Methylenblau angefärbt und unter dem Binokular mit dem Referenzschnitt verglichen. Die entsprechenden Tumor- oder Normalgewebsareale wurden dann mit einer sterilen Einmalkanüle abgekratzt und anschließend in den Lysepuffer des DNA-Isolationskits aufgenommen. Im Anschluss erfolgte eine Proteinase K-Behandlung und dann die DNA-Isolation mit dem entsprechenhden Kit (siehe unten). Auf diese Weise wurde eine Reinheit der Tumorzellen von mindestens 85% gewährleistet Isolierung von Ribonukleinsäure (RNA) Zur Untersuchung der Expression verschiedener Gene und mirnas wurde RNA aus Zelllininen und aus humanem Tumorgewebe isoliert. Zur Isolation der mrna aus Zelllininen wurde der RNeasy Mini Kit von Qiagen gemäß den Herstellerangaben verwendet. Für 6Well-Platten und kleinere Gefäßformate wurden 350µl Puffer RLT, bei größeren Formaten (z.b. T25 Flaschen) 600µl eingesetzt. Dem Puffer wurde jedes Mal frisches ß-Mercaptoethanol zugegeben (10µl pro 1ml Puffer). Die RNA wurde in 40µl Wasser eluiert. Zur Isolation der gesamten RNA samt mirnas aus Zelllininen und humanem Gewebe wurde die Trizol-Chlorophorm-Isolation (Invitrogen by life technologies) gemäß den Herstellerangaben durchgeführt. Pro Zellpellet oder Gewebestück wurde 1ml Trizol zur Homogenisierung eingesetzt. Die RNA wurde aus der wässrigen Phase isoliert. Im Anschluß erfolgte eine DNase-Behandlung mit dem RNase-free DNase Set von Qiagen (30min 37 C, 5 min 65 C). Die Phenol- Chlorophorm-Phase wurde zur Isolation von DNA und Proteinen gesammelt. Isolierte RNA wurde bei -80 C gelagert. 64
65 Material und Methoden Isolierung von Desoxy-Ribonukleinsäure (DNA) Zur Untersuchung der SNPs in SFRP1 und der SFRP1-Promotor-Methylierung sowie für die acgh wurde die DNA aus Zelllininen bzw. humanem Gewebe isoliert. Dies erfolgte mit dem High Pure PCR Template Preparation Kit von Roche und mit dem QIAamp DNA Mini Kit (bei der acgh) gemäß den Herstellerangaben. Wenn, wie oben beschrieben, RNA-Isolation mit Trizol erfolgte, wurde anschließend auch die DNA aus der Phenol-Chlorophorm-Phase gemäß den Herstellerangeben isoliert. Die DNA wurde in 8mM NaOH mit 1m EDTA eluiert und der ph-wert zur dauerhaften Lagerung mit HEPES auf 7-8 eingestellt Quantitäts- und Qualitätskontrolle von Nukleinsäuren Die Messung der RNA- bzw. DNA-Konzentration und die Bestimmung der Reinheit erfolgte am Multiplate Reader Synergy 2 von BioTek. Dazu wurde jeweils die Absorption bei einer Licht-Wellenlänge von λ = 260nm (Absorptionsmaximum von Nukleinsäuren) und λ = 280nm (Absorptionsmaximum von Proteinen) gemessen. Mit Hilfe des Lambert-Beer schen Gesetzes konnte daraus die Konzentration der Nukleinsäure berechnet werden: A = ε x c x d c = A / ε x d [mit A = Absorption bei der Wellenlänge λ; ε = molarer (dekadischer) Extinktionskoeffizient bei der Wellenlänge λ; c = Konzentration der zu vermessenden Lösung; d = Schichtdicke (meist 1 cm)]. Für die Messung der Konzentration wurden jeweils 3μl RNA bzw. DNA eingesetzt, für die Bestimmung eines Blank-Wertes wurde RNase-freies Wasser, bzw. Elutionspuffer verwendet. Eine Absorption von 1,0 bei λ = 260nm entspricht einer RNA-Konzentration von 40 μg/ml bzw. einer DNA-Konzentration von 50 μg/ml. Um von einer proteinfreien Nukleinsäure sprechen zu können, sollte der Quotient aus A 260 /A 280 > 2,0 sein [28]. Zusätzlich wurde das Absorptionsspektrum graphisch ermittelt um aus dem Kurvenverlauf die DNA-Qualität zu ersehen Synthese von komplementärer DNA (cdna) Um mrna für die konventionelle RT-PCR oder für die SybrGreen-basierte qrt-pcr in cdna umzuschreiben, wurde der RevertAid TM H Minus First Strand cdna Synthesis Kit (Fermentas Life Sciences) nach den Herstellerangeben verwendet. Es 65
66 Material und Methoden wurde jeweils 1µg RNA für die cdna-synthese eingesetzt. Um die Expression der mirnas hsa-mir-603 und hsa-mir-3646 in Zelllinien und humanem Gewebe zu bestimmen, wurde eine Polyadenylierung und eine cdna-synthese mit dem qscript microrna cdna Synthesis Kit nach den Herstellerangeben durchgeführt. Die synthetisierte cdna wurden zunächst auf 2 ng/µl mit Wasser verdünnt (Gesamtvolumen dabei immer 200µl). In der RT-Reaktion wurden dann 5µl dieser Lösung (also 10ng) eingesetzt. Für den mikrorna Assay wurde 1ng cdna eingesetzt Konventionelle Polymerase Kettenreaktion Zur Amplifikation von DNA oder cdna wurde eine konventionelle PCR bzw. eine spezielle Form davon die nested-pcr durchgeführt. Das DNA-Template, also die DNA-Vorlage wurde dabei nach initiierender Denaturierung bei 95 C, der Anlagerung der Primer (Annealing bei Primer-spezifischer Temperatur) und der darauf folgenden Verlängerung des komplementären DNA-Stranges mittels DNA-Polymerase (bei 72 C) vervielfältigt. Der Reaktionsansatz wurde nach folgendem Basis-Schema pipettiert. Reagenz Volumen im Einfach-Ansatz (µl) 5x Puffer 5 dntps (10mM) 0,5 Primer (15µM) 0,3 Taq-Polymerase 0,125 Wasser 17,075 DNA-Template add 25ml (je 100ng) Gesamt 25 Tabelle 2-24: Allgemeiner PCR-Ansatz. Der PCR-Reaktionsmix wurde in sterile Einmal-Tubes pipettiert und dann folgendem Thermocycler-Grundprogramm unterzogen: 66
67 Material und Methoden Schritt Zeit Temperatur Step 1 3min 95 C Step 2 (Denaturierung) 1min 95 C Step 3 (Annealing) 1min je nach Primer Step 4 (Elongation) 1min 72 C Step 5 go to Step 2 34x Step 6 10min 72 C Step 7 forever 8 C Step 8 end Tabelle 2-25: Thermocycler Bedingungen einer allgemeinen PCR. Je nach PCR konnte das Pipettierschema und das Thermocyclerprogramm an die jeweiligen Bedingungen angepasst werden. Beipielsweise benötigten manche PCRs die Anwesenheit von Dimethylsulfoxid (DMSO) im Reaktionsmix um die die Primerspezifität für das Template zu erhöhen und somit unspezifische Banden zu vermeiden. Änderungen zum Basis-Protokoll werden an entsprechender Stelle angemerkt. Die PCR-Produkte wurden bis zur weiteren Aufarbeitung bei 4-8 C im Post-PCR-Kühlschrank gelagert. Bei der nested- oder verschachtelten PCR wurde das (c)dna-template mittels zweier aufeinanderfolgender PCRs amplifiziert. Dazu wurden zwei Primerpaare verwendet: ein äußeres, welches ein größeres PCR-Produkt erzeugte und ein inneres, welches nur das erste Amplikon weiter amplifizierte. Vorteil dieser Methode ist eine erhöhte Spezifität und Sensitivität der Gesamtreaktion, wodurch Nebenprodukte der ersten PCR entfallen. Die nested-pcr wurde zum Screening der Harnblasenkarzinomzelllinine für die SFRP1-Expression verwendet. Als House-Keeping-Gen wurde GAPDH mitgeführt. Als äußere Primer dienten jene als RT-Primer bezeichneten, als innere Primer die der qrt-pcr (siehe Tabelle 2-11). Bei GAPDH war die PCR mit den äußeren Primern ausreichend, um gut detektierbare PCR-Produkte zu erhalten. Es wurde dehalb auf eine zweite PCR verzichtet. Es wurden jeweils 15µl vom SFRP1-Produkt (168bp) bzw. 5µl vom GAPDH-Produkt (600bp) auf ein 2,5%iges Agarosegel aufgetragen. Nach einer Stunde 67
68 Material und Methoden Elektrophorese bei 110V, wurde das Gel 20min in einem Ethidiumbromid-Gel gefärbt und anschließend unter UV-Licht visualisiert Bisulfitbehandlung und methylierungsspezifische PCR (MSP) Die DNA-Methylierung ist ein epigenetischer Mechanismus, der ohne Veränderung der Basenpaar-Sequenz trotzdem zu einer Alteration der Genexpression führt. DNA- Methylierung erfolgt nur an Cytosinbasen und hauptsächlich in CpG-Inseln, also kleinen DNA-Bereiche mit einem CG-Gehalt von 55% und mehr. Für die Analyse der Promotormethylierung in SFRP1 wurde eine Methylierungs-spezifische PCR (MSP) mit einerseits methylierungsspezifischen- und andererseits mit nichtmethylierungsspezifischen Primern durchgeführt. Dazu wurde isolierte DNA zunächst einer Bisulfit-Behandlung unterzogen. Dafür wurde der EpiTect Bisulfite Kit von Qiagen gemäß den Herstellerangaben verwendet. Bei der Bisulfitbehandlung werden nur unmethylierte Cytosinbasen in Uracil umgeschrieben, methyliertes Cytosin bleibt unverändert. So entstehen nach der Bisulfit-Behandlung zwei unterschiedliche Basensequenzen für die methylierte und die unmethylierte DNA. Diese können dann mittels ausgewählter Primer in einer PCR detektiert werden. Die Primer, die unmethylierte DNA nachweisen sollen, enthalten in der 5-3 Sequenz kein Cytosin und in der komplementären Sequenz kein Guanin. Die methylierungsspezifischen Primer hingegen, enthalten dann folglich aber Cytosin bzw. Guanin. Als unmethylierte Positivkontrolle wurde Placenta-DNA, als methylierte Positivkontrolle SssI-behandelte Placenta-DNA verwendet. SssI ist eine Methylase, die unmethylierten Cytosinen Methylgruppen anhängen kann. Die Placenta-DNA wurde nach folgendem Ansatz mit SssI inkubiert: Reagenz Volumen im Einfach-Ansatz (µl) Puffer NEB 2 (10x) 2 S-adenosylmethionin (SAM, 200x) 1 (40x) Enzym SssI 1 Placenta DNA (1µg) 5 Wasser 11 Gesamt 20 Tabelle 2-26: Ansatz zur Methylierung von Placenta-DNA, zur Herstellung einer Positivkontrolle für die MSP. 68
69 Material und Methoden Der Ansatz wurde insgesamt vier Stunden bei 37 C inkubiert. Nach drei Stunden wurde erneut 1µl SAM (200x) zugegeben um die Bereitstellung einer ausreichenden Menge an Methylgruppen zu gewährleisten. Nach erfolgter Bisulfitbehandlung und der Aufreinigung der DNA-Produkte wurden diese in der methylierungsspezifischen (M-PCR) und der nichtmethylierungsspezifischen (UM-PCR) nach folgendem Schema amplifiziert: Reagenz (M-PCR) Volumen im Einfach-Ansatz (µl) Green Go Taq Reaction Buffer (5x) 5,0 dntps (10mM) 0,4 Primermix (M) 2,0 DMSO 1,25 Wasser 14,225 Go Taq DNA Polymerase (5u/µl) 0,125 Bis. DNA 2,0 Gesamt 25,0 Tabelle 2-27: Ansatz einer methylierungsspezifischen PCR mit Primern, die einen methylierten Promotor nachweisen (M-MSP). Schritt (M-PCR) Zeit Temperatur Step 1 5 min 95 C Step 2 (Denaturierung) 30 sec 94 C Step 3 (Annealing) 30 sec 66,5 C Step 4 (Elongation) 30 sec 72 C Step 5 go to Step 2 36x Step 6 10 min 72 C Step 7 forever 8 C Step 8 end Tabelle 2-28: Thermocycler-Bedingungen der methylierungsspezifischen PCR mit Primern, die einen methylierten Promotor nachweisen(m-msp). Reagenz (UM-PCR) Volumen im Einfach-Ansatz (µl) Green Go Taq Reaction Buffer (5x) 5,0 dntps (10mM) 0,4 Primermix (UM) 2,0 69
70 Material und Methoden MgCl 2 (25mM) 1,0 DMSO 1,25 Wasser 8,35 Bis. DNA 2,0 Gesamt 25,0 Tabelle 2-29: Ansatz einer methylierungsspezifischen PCR mit Primern, die einen unmethylierten Promotor nachweisen(um-msp). Schritt (UM-PCR) Zeit Temperatur Step 1 5min 95 C Step 2: Pause drücken, je 5µl Taq/Wasser (0,3µl Go Taq + 4,7µl Wasser) pro Tube hinzugeben, dann Pause aufheben, Programm fortfahren Step 3 (Denaturierung) 30sec 94 C Step 4 (Annealing) 30sec 63,8 C Step 5 (Elongation) 45sec 72 C Step 6 go to Step 3 36x Step 7 10min 72 C Step 8 Forever 8 C Step 9 end Tabelle 2-30: Thermocycler-Bedingungen der methylierungsspezifischen PCR mit Primern, die einen unmethylierten Promotor nachweisen (UM-MSP). Es wurden jeweils 5µl der M-(126bp) oder der UM-(135bp) Produkte auf ein 2,5%iges Agarosegel aufgetragen. Nach einer Stunde Elektrophorese bei 110V, wurde das Gel 20 min in einem Ethidiumbromid-Gel gefärbt und anschließend unter UV-Licht visualisiert Agarose-Gelelektrophorese Die Agarose-Gelelektrophorese diente dazu DNA-Fragmente der Größe nach aufzutrennen und sie dann mit dem interkalierenden Phenanthridin-Farbstoff Ethidiumbromid unter UV-Licht sichtbar zu machen. Es wurden jeweils 100ml 1xTAE Puffer (Fermentas) und, je nach Porengröße, die entsprechende Menge pulverisierte Agarose (Biozyme) gemischt (für ein 2,5%iges Gel zum Beispiel 2,5g Agarose + 100ml 1x TAE-Puffer) und 5min in der Mikrowelle aufgekocht. Die nicht mehr kochende, aber noch warme Agaroselösung wurde dann in den Gelschlitten 70
71 Material und Methoden ausgegossen. Nach 20 Minuten wurde der Kamm aus dem erkalteten und ausgehärteten Agarosegel gezogen. Der Gelschlitten wurde in die mit Puffer befüllte Elektrophorese-Kammer eingelegt. Nach dem Beladen der Taschen mit PCR- Produkten und geeignetem Längenmarker wurde für eine Stunde eine Spannung von 110V angelegt. Aufgrund ihrer negativen Ladung kann die DNA im elektrischen Feld von der Kathode zur Anode wandern. Hierbei wandern kleine Moleküle schneller als große, da die Laufgeschwindigkeit der einzelnen DNA-Fragmente umgekehrt proportional mit der Größe der Moleküle korreliert. Die DNA-Fragmente werden somit nach ihrer Größe aufgetrennt. Im Anschluss wurde das Gel 20 min in einem 0,05%igem Ethidiumbromidbad (500ml 0,5x TBE + 5 Tropfen Ethidiumbromid aus der Tropfflasche) gefärbt und dann in der E-Box VX2 von Vilber Lourmat visualisiert Quantitative Real-Time PCR (qrt-pcr) Die quantitative Real-Time PCR dient, wie auch die konventionelle PCR dazu, DNA- Fragmente zu vervielfältigen. Zusätzlich kann aber auch die Menge der DNA mittels Fluoreszenzmessung während der exponentiellen Phase eines PCR-Laufes ermittelt werden. Dazu werden dem Reaktionsgemisch interkalierende Fluoreszenzfarbstoffe, wie SybrGreen oder aber TaqMan-Sonden (z.b. gequenchte, FAM-gekoppelte genspezifische Sonden) beigemischt, die dann in neusynthetisierte DNA eingebaut werden, bzw. an komplementäre DNA-Fragmente binden und vom Gerät detektiert werden können. Die Zunahme der Fluoreszenz ist dabei proportional der Zunahme der DNA. Die Anzahl der Zyklen, die notwendig ist, um ein konstant definiertes Fluoreszenzniveau zu erreichen, wird als C T - oder auch CP-Wert (Crossing Point) bezeichnet. Dieser Wert wird schließlich auch als Maß für die Quantifizierung der Startmenge herangezogen: je höher der C T -Wert, desto mehr Zyklen werden benötigt um ein adäquates Fluoreszenzsignal zu erhalten und desto weniger DNA war zu Beginn der PCR im Ansatz enthalten [114]. In der vorliegenden Arbeit wurde ausschließlich mit der relative Quantifizierung gearbeitet um die Veränderung der Genexpression bzw. die Expression von mirnas zu untersuchen. Als Referenzgen wurde GAPDH bei der Genexpressionsanalyse und RNU6 und SNORD44 bei der mirna-expressionsanalyse mitgemessen. Die Berechnung der Genexpression erfolgte dann mit der ΔΔC T -Methode. Die 71
72 Material und Methoden Messungen erfolgten mit dem Thermocycler Applied Biosystems 7500 Fast Real- Time PCR System. Genexpressionsanalyse (SYBRGreen-basiert) Vor den eigentlichen Messungen wurde für jeden Primer die optimale Konzentration im PCR-Ansatz ausgetestet und die Effizienz bestimmt. Die Primeroptimierung erfolgte anhand der Schmelzkurven und sollte das Auftreten von Primerdimeren ausschließen. Dazu wurden die Primer mit unterschiedlichen Konzentrationen (100, 150, 200, 250, 300, 350 und 400nM) in der PCR eingesetzt und die jeweilige Schmelzkurve untersucht. Die Bestimmung der Primereffizienz war nötig um zu gewährleisten, dass bei jedem PCR-Zyklus von einer Verdoppelung der Nukleinsäuren ausgegangen werden kann. Um eventuelle Abweichungen vom Faktor 2, der einer Primereffizienz von 100% entspricht, zu detektieren wurde anhand einer Verdünnungsreihe (1:4, 1:16, 1:64, 1:256, 1:1024, 1: 4096, Gesamtvolumen 200µl, 30min Schütteln bei RT) eines definierten DNA-Pools eine Eichgerade erstellt, aus deren Steigung die jeweilige Effizienz berechnet wurde. Diese wurde dann bei der Auswertung berücksichtigt. Die ermittelten optimalen Primerkonzentrationen und die dazu gehörigen Volumina im einfachen Gesamtansatz von 12,5µl, sowie die Effizienzen sind in folgender Tabelle zusammen gefasst. Die zugehörigen Schmelzkurven und Eichgeraden sind im Anhang zu sehen. Gen Konzentration Volumen Volumen Effizienz (nm) Primermix (µl) Wasser (µl) AXIN ,25 3,5 98,6% BMP ,166 3,584 96,7% CD ,34 3,41 94,5% CMYC 200 0,34 3,41 86,3% CCND ,25 3,5 81,3% SFRP ,166 3,584 94,3% GAPDH 250 0,4166 3,33 99,2% MTUS ,34 3,41 95,1% Tabelle 2-31: Auflistung der optimierten Primerkonzentrationen, der zugehörigen Volumina und Effizienzen bei der qrt-pcr. 72
73 Material und Methoden Die PCR wurde nach folgendem Schema pipettiert: Reagenz Volumen im Einfach-Ansatz (µl) SYBR Green Mix (2x) 6,26 Primermix (15µM) Je nach Optimierung Wasser Je nach Primervolumina (add 12,5) cdna (10ng/µl) 2,5 Gesamt 12,5 Tabelle 2-32: Pipettieransatz der Standard-qRT-PCR. Pro Well wurden 25ng cdna eingesetzt. Dazu wurde die umgeschriebene RNA 1:5, die SFRP1-Positivkontrolle SK-Mel-28 1:20 mit Wasser verdünnt. Die Reaktion erfolgte im Triplikatansatz. Die Ansätze wurden in sterile Einmal-96Well-Platten von Applied Biosystems pipettiert und mit Adhesive Covers zugeklebt. Das PCR-Programm am Thermocycler erfolgte nach folgendem Schema: Schritt Art Zeit Temperatur Step 1 Holding 2min 50 C Step 2 Holding 10min 95 C Step 3 Cycling 40x 15sec 95 C 30sec 60 C Step 4 Melt Curve 15sec 95 C Step 5 Melt Curve 1min 60 C Step 6 Melt Curve 30sec 95 C Step 7 Melt Curve 15sec 60 C Step 8 end Tabelle 2-33: Thermocycler-Konditionen der Standard-qRT-PCR. Die Auswertung erfolgte mit der 7500 Software v2.0.5 von Applied Biosystems. Die ΔΔC T -Methode berechnete die Genexpression zwischen Behandlung und Kontrolle mit folgenden Formeln: ΔC T = C T Zielgen C T Referenzgen (=Normalisierung) 73
74 Material und Methoden ΔΔC T = ΔC T Behandlung ΔC T Kontrolle Ratio = 2 (-ΔΔC T ) Das Ratio entspricht der relativen Genexpression, bzw. der Expressionsdifferenz zwischen zwei untersuchten Proben (z.b. Behandlung und Kontrolle). Das Ratio einer untersuchten Probe wurde auf 100% (Referenz) gesetzt und die anderen Proben wurden damit verglichen. MicroRNA Assay (SYBR-Green-basiert) Um die relative Expression der SFRP1 SNP rs3242-assoziierten mikrornas hsamir-603 und hsa-mir-3646 in Harnblasenkarzinom-Zelllinien und Blasentumorgewebe, sowie in Normalurothel zu ermitteln, wurde ein PerfeCta microrna Assay von Quanta Biosciences nach den Herstellerangaben durchgeführt. Zunächst wurde jeweils 1µg RNA mit dem qscript microrna cdna Synthesis Kit polyadenyliert und anschließend in cdna konvertiert. Im Folgenden wurde die quantitative Real-time PCR am 7500 Fast Real-time PCR System von Applied Biosystems nach folgendem Schema durchgeführt: Reagenz Volumen im Einfach-Ansatz (µl) PerfeCta Universal PCR Primer 0,5 mirna spezifische Primer 0,5 cdna 2µl von 0,5ng/µl Konz. (1ng) TaqMan Universal Master Mix 12,5 Wasser 9,5 Gesamt 25 Tabelle 2-34: Pipettierschema der qrt-pcr für den Nachweis der hsa-mir-603. Die Messungen wurden im Triplett-Ansatz durchgeführt. Der Mastermix wurde pro Probe 3,5x angesetzt und dann je 25µl pro Well pipettiert. Das PCR-Programm erfolgte gemäß Hersteller-Empfehlungen nach folgendem Schema (2-step cycling protocol): 74
75 Material und Methoden Schritt Art Zeit Temperatur Step 1 Holding 2min 95 C Step 2 Cycling 40x 5sec 95 C 30sec 60 C Step 3 end Tabelle 2-35: Thermocycler-Konditionen der qrt-pcr für den Nachweis der hsa-mir-603 (2-step cycling protocol). Die Auswertung erfolgte, wie auch bei der Genexpressionsanalyse, mit der ΔΔC T - Methode (siehe oben) RFLP-Analyse der SNPs Zur Untersuchung des Genotyps eines Single Nucleotid Polymorphisms (SNPs) wurde die Restriktionsfragmentlängenpolymorphismus-Technik (restriction fragment length polymorphism, RFLP) angewendet. Dabei wurde das den SNP enthaltende DNA-Fragment zunächst mittels PCR amplifiziert und dann einem Restriktionsenzym-Verdau unterzogen. Das Restriktionsenzym wurde mit dem NEB cutter 2.0 so ausgewählt, dass es die DNA beim Vorliegen des einen Genotyps schnitt und beim Vorliegen des anderen möglichen Genotyps nicht schnitt (single cutter). Im Folgenden sind DNA-Sequenz-Ausschnitte von SFRP1 mit den beinhalteten SNPs und den Bindestellen des jeweiligen Restriktionsenzyms abgebildet. rs3242: GTGTTGTTTT TTTAACTGCA TTTTACCAGA TGTTTTGATG TTATCGCTTA TGTTAATAGT AATTCCCGTA Rsa I C/TGTGTTCATTT TATTTTCATG CTTTTTCAGC CATGTATCAA TATTCACTTG ACTAAAATCA CTCAATTAAT CAATGATACT GTGAGCTGTG ACTTTTTTTT CCCACTCAGT CATACACTTC rs921142: GGGTCTGGGA GGAGTCAGGA GTGCACTGGA TTTAGGATTT GGGGTCTTCT CCCATCACTC CCTGTTCCAC GGAGAGACAA CTGTGTTCCC AGCAGGGGTC AGTAAAGCAG TAGGACCAC TA/GGGGGTGAG TGGGGGAGGT GGTGACTGGA GGTGATCAAA GTCTACTCGG AGTGACCAGA CATAGGCGAG GTCTTCCCCT GAATGGATTT GTGAGATTTA CTCCTGACTT GGGACTTCCA GG Nachfolgend wurden die DNA-Fragmente auf einem 2,5%igem Agarose-Gel sichtbar gemacht. Die Genotypen konnte jetzt anhand unterschiedlicher Bandenanzahl und 75
76 Material und Methoden Bandengröße auf dem Agarosegel unterschieden werden. Lag ein heterozygoter Genotyp vor, so konnte sowohl das ungeschnittene, als auch das geschnittene Fragment auf dem Gel visualisiert werden. Mit der RFLP-Technik wurden 2 SNPs untersucht: rs3242 (in der 3 UTR von SFRP1) und rs (5 -upstream von SFRP1). Die DNAs der Zelllininen und der Patientenproben wurde mit dem High Pure PCR Template Preparation Kit oder Trizol-Methode isoliert, bzw. lagen schon isoliert in der Arbeitsgruppe vor und wurde dann in einer konventionellen PCR (Protokoll siehe ) primerspezifisch amplifiziert. Nachfolgend wurden die PCR-Produkte mit RsaI bzw. BmrI nach folgendem Schema verdaut: SNP rs3242 rs Lokalisation 8p: 3 UTR SFRP1 8p: 5 upstream SFRP1 Annealing-Temp. 57 C 57,8 C Restriktionsenzym RsaI BmrI Genotyp I Homozygot CC (44bp + 93 bp) Homozygot AA (218 bp) Genotyp II Homozygot TT (137bp) Homozygot GG (114bp + 104bp) Genotyp III Heterozygot CT (44bp + 93bp + 137bp) Heterozygot AG (104bp bp + 218bp) Verdau 4h, 37 C 10h, 37 C PCR-Produkt 20µl 10µl Puffer NEB 4: 3µl NEB 2: 1,5µl Enzym 0,5µl 1µl Wasser 6,5µl 2,5 Gesamt 30µl 15µl Tabelle 2-36: Übersicht über die wichtigsten Parameter der RFLP-Analyse der beiden SNPs in SFRP1 rs3242 und rs Pro PCR-Produkt wurden 15µl auf ein 2,5%iges Agarosegel aufgetragen. Nach einer Stunde Elektrophorese bei 110V, wurde das Gel 20min in einem Ethidiumbromid-Gel gefärbt und anschließend unter UV-Licht visualisiert. 76
77 Material und Methoden Amplifikation von Plasmiden mittels Transformation in E. coli Um die für Transfektionen benötigten Plasmide in ausreichender Menge vorrätig zu haben, wurden sie zunächst in E.coli Bakterien transformiert, darin amplifiziert und dann mit dem NucleoBond Xtra Midi Kit von Machery-Nagel isoliert und aufgereinigt. Eine solche Amplifikation wurde durchgeführt für SFRP1 in pcmv6- Neo Vektor, scrumbled SFRP1 in pcmv6-neo, Leervektor pcmv6-neo, hsamir-603 in pcmv-mir, Leervektor pcmv-mir, MTUS1 in pcmv6-xl5v, Leervektor pcmv-xl5v, sowie für das TOP, FOP und das pgl4.74[hrluc/tk] Renilla-Plasmid. Das Plasmid hu SFRP1 shrna in pgfp-v-rs sh Vetor und der zugehörige Leervektor wurden nicht amplifiziert. Die Transformation der Plasmide erfolgte in chemisch kompetenten Escherichia coli Bakterien (TOP 10) aus dem TOPO TA Cloning Kit for Sequencing von Invitrogen gemäß den Herstellerangaben (One Shot Chemical Transformation Protocol). Zur Selektion der transformierten Bakterien wurde Ampicillin in einer Konzentration von 50µg/ml im LB-Medium eingesetzt. Zur Herstellung des LB-Mediums wurde, je nach benötigtem Volumen, die entsprechende Menge Fertig-LB-Pulver (von Lennox) mit Aqua bidest. versetzt (z.b. 2g LB-Pulver + 100ml Aqua bidest) und autoklaviert. Zur Herstellung von Agarplatten wurde dem LB-Medium zusätzlich noch 1,5g Agar pro 100ml zugefügt (100ml sind ausreichend für 4 Agarplatten). Die Zugabe von Ampicillin erfolgte nach dem Autoklavieren. Pro Bakterienröhrchen wurden 0,5µg Plasmid-DNA für die Transformation eingesetzt. Nach dem Ausplattieren der transformierten Zellen und Übernacht-Inkubation bei 37 C wurden die farblosen Bakterienkolonien mit einer sterilen Pipettenspitze gepickt und in 5ml LB-Medium als Vorkultur überführt. Nach ca. 6-stündigem Schütteln bei 350rpm wurden 100 µl der Vorkultur in ml Übernachtkultur überführt (Volumen je nach Midi oder Maxi-Prep) und unter Schütteln inkubiert. Die Übernachtkultur wurde dann am nächsten Tag mit dem NucleoBond Xtra Midi Kit aufgereinigt. Bei der Aufreinigung wurde zwischen dem Protokoll für high (FOP, Renilla, SFRP1, scrumbled SFRP1, LV SFRP1)- und low (TOP, MTUS1, LV MTUS1)-copy Plasmide unterschieden. Am Ende der Aufreinigung wurde das DNA-Pellet in 50µl Wasser aufgenommen und die Konzentration photometrisch bestimmt. 77
78 Material und Methoden Restriktionsverdau von Plasmiden Zur Qualitätskontrolle wurden je 1µg der amplifizierten Plasmide TOP (5200bp), FOP (5200bp), pgl4.74 [hrluc/tk] (4237bp) und MTUS1 in pcmv6-xl5 (8282, davon 3800bp MTUS1 und 4482bp Vektorplasmid) einem Restriktionsverdau unterzogen. Dabei konnten durch die Kombination mehrerer Restriktionsendonukleasen unterschiedlich große DNA-Fragmente erzeugt werden, die auf die richtige Größe und Qualität des Plasmides rückschließen ließen. Es wurde je 1 unit eines jeden Restriktionsenzyms eingesetzt. Die Pipettierschemata aller eingesetzten Enzyme sind in folgender Tabelle 2-37 zusammengefasst. Enzym 1 unit Puffer (je 3µl) BSA Wasser HindIII 0,25µl NEB2 - add 30µl XhoI 0,25µl NEB4 3µl (10x) add 30µl BbsI 1,0µl NEB2 - add 30µl AflIII 1,0µl NEB3 3µl (10x) add 30µl EcoRI 0,25µl NEB EcoRI - add 30µl NotI 0,5µl NEB3 0,3µl (100x) add 30µl SmaI 0,25µl NEB4 - add 30µl BbsI+HindIII 1,0+0,25µl NEB2 - add 30µl BbsI+XhoI 1,0+0,25µl NEB2 - add 30µl HindIII+EcoRI 0,25+0,25µl NEB2 - add 30µl Tabelle 2-37: Pipettierschema der verwendeten Restriktionsenzyme; zu beachten war vor allem, dass bei Not I, Afl III und Xho I BSA im Ansatz benötigt wurde. Eine Übersicht über die durchgeführten Restriktionsverdaus ist in folgender Tabelle dargestellt: Plasmid Enzyme Verdau [1x] Erwartete Produkte TOP HindIII 4h, 37 C 1 (5200bp) XhoI 4h, 37 C 1 (5200bp) BbsI 4h, 37 C 3 (116bp, 614bp, 4470bp) HindIII + EcoRI 4h, 37 C 2 (2767bp, 2433bp) FOP HindIII 4h, 37 C 1 (5200bp) XhoI 4h, 37 C 1 (5200bp) 78
79 Material und Methoden BbsI 4h, 37 C 0 (ccc-form) HindIII + EcoRI 4h, 37 C 2 (2759bp, 2441bp) pgl4.74[hrluc/tk] AflIII 4h, 37 C 2 (2700bp, 1537bp) HindIII 4h, 37 C 1 (4273bp) BbsI+ HindIII 4h, 37 C 3 (754bp, 1319bp, 2164bp) MTUS1 in pcmv6- EcoRI 7,5h, 37 C 3 (1630bp, 2010bp, 4640bp) XL5 NotI 7,5h, 37 C 2 (3820bp, 4460bp) SmaI 7,5h, 25 C 1 (8282bp) SFRP1 in in pcmv6- EcoRI 4h, 37 C 2 (5800bp, 950bp) Neo Scrumbled SFRP1 in EcoRI 4h, 37 C 2 (5800bp, 950bp) pcmv6-neo LV pcmv6-neo EcoRI 4h, 37 C 1 (5800bp) hsa-mir-603 in HindIII 4h, 37 C 1 Fragment (linear) pcmv-mir XhoI 4h, 37 C 1 Fragment (linear) HindIII + XhoI 4h, 37 C 3 Fragmente (1 davon nicht sichtbar, da sehr klein) Tabelle 2-38: Übersicht über die Restriktionsverdaue der verwendeten Plasmide. Die Verdauprodukte wurden auf 1%igen Agarose-Gelen visualisiert. Die erhaltenen DNA-Fragmente aller einzelnen Restriktionsverdaus stimmten mit den erwarteten Produktgrößen überein. Die so erhaltene Bestätigung unserer Datenintegrität erlaubte uns das Einsetzten der Plasmid-DNA in den entsprechenden Transfektionen. In Abbildung 2-3 ist das Agarose-Gelbild des MTUS1-Restriktionsverdaus exemplarisch dargestellt und veranschaulicht die verschieden großen Verdauprodukte entsprechend dem verwendeten Restriktionsenzym. Die schematische Plasmidkarte hebt farbig die Schnittstellen der eingesetzten Enzyme hervor. Alle Fragmente hatten die erwartete Größe. 79
80 Material und Methoden Abbildung 2-3: Bild A zeigt das Gelbild des Restriktions-Enzym-Verdaus der Plasmid-DNA mit den Restriktions- Endonukleasen EcoRI, NotI und SmaI. Bild B zeigt eine schematische Plasmid-Karte, das MTUS1-Insert ist durch die beiden dicken Striche markiert. Die Schnittstellen der Restriktions-Enzyme sind farbig markiert, EcoRI (grün) schneidet dreimal, NotI (orange) zweimal und SmaI (pink) besitzt nur eine einzige Schnittstelle im gesamten Plasmid Mutationsanalyse mittels SNaPshot-Assay Die Mutationsanalyse in den Genen FGFR3 und PIK3CA wurde mit den 19 papillären Tumoren durchgeführt, die auch für die vergleichende genomische Hybridisierung untersucht wurden. Die FGFR3 Mutationsanalyse wurde außerdem mit allen verfügbaren DNAs der papillären Tumoren (n=81) der prospektiven Studie durchgeführt. Mit Hilfe der Mutations-Analyse können Gen-Mutationen ausfindig gemacht werden. Dabei können in dem hier verwendeten Ansatz bis zu zehn Einzelbasen-Austausche in bis zu zehn PCR-Produkten detektiert werden [115]. Im ersten Schritt wurde eine so genannte Multiplex-PCR durchgeführt. Dabei werden mit Hilfe der entsprechenden Primer die Exons 7, 10 und 15 des FGFR3-Gens bzw. die Exons 9 und 15 des PIK3CA-Gens in einem PCR-Ansatz pro Gen amplifiziert. Ein Multiplex-PCR-Ansatz setzte sich dabei aus folgenden Komponenten zusammen: Reagenz 2x Qia Multiplex Mix Primer-Mix (jew. 10μM) Volumen im Einfach-Ansatz 12,5μl 2,5μl 80
81 Material und Methoden Tumor-DNA RNase-freies Wasser 100ng ad 25μl Tabelle 2-39: Zusammensetzung eines Multiplex-PCR-Ansatzes für die Mutations-Analyse. Von der Tumor-DNA wurde pro Ansatz 100ng eingesetzt, das zu pipettierende Volumen richtete sich nach der jeweiligen Konzentration der DNA. Mit RNase-freiem Wasser wurde jeder Ansatzes auf ein Gesamt-Volumen von 25μl aufgefüllt. Die PCR lief im Thermocycler unter folgenden Bedingungen ab: Schritt Zeit Temperatur Step 1 5min 95 C Step 2 (Denaturierung) 45sec 95 C Step 3 (Annealing) 45sec 60 C Step 4 (Elongation) 45sec 72 C Step 5 go to Step 2 39x Step 6 10min 72 C Step 7 forever 8 C Step 8 end Tabelle 2-40: Thermocycler-Konditionen der Multiplex PCR. Im Anschluss daran wurden die entstandenen PCR-Produkte mit den zwei Enzymen SAP (= shrimp alkaline phosphatase) und ExoI (= Exonuklease I) behandelt. Das aus Eismeer-Garnelen isolierte Enzym SAP sorgt über die Dephosphorylierung des 5 - Phosphats für den Abbau der nicht-eingebauten Nukleotide. Die Behandlung mit der Exonuklease dient der Beseitigung der verbliebenen Primer, da diese in Richtung abgebaut werden. Der Verdau lief im Thermocycler (37 C für 60min, anschließend 72 C für 15min); dabei setzte sich ein Ansatz wie folgt zusammen: Reagenz Multiplex-PCR-Produkt SAP (1.000 U/ml) ExoI (1.000 U/ml) Volumen im Einfach-Ansatz 15μl 3μl 2μl Tabelle 2-41: Zusammensetzung eines Ansatzes für den Verdau der Multiplex-PCR-Produkte mit SAP und ExoI. Das Gesamtvolumen betrug 20 μl. Im dritten Schritt wurde das mit SAP und ExoI behandelte Multiplex-PCR-Produkt ein weiteres Mal amplifiziert. Bei dieser so genannten SNaPshot-PCR enden die Primer 81
82 Material und Methoden direkt vor der zu untersuchenden Base. Sie sind so designt, dass sie vor der eigentlichen Erkennungs-Sequenz eine unterschiedliche Anzahl von Thyminen tragen. Aufgrund der im Reaktions-Ansatz enthaltenen Fluoreszenz-markierten Didesoxynukleotide (ddntps) erfolgt nach dem ersten Einbau einer Base jeweils sofort ein Amplifikations-Stop. Die entstandenen Produkte weisen dann die Länge des Primers (unterschiedlich lange T-Schwänze) plus eine Base auf. Die verwendeten ddntps sind wie bei der Sequenzierung mit vier unterschiedlichen Fluoreszenz-Farbstoffen gelabelt, so dass eine anschließende elektrophoretische Auftrennung und Analyse im ABI-Sequencer möglich ist. Die SNaPshot PCR wurde nach folgendem Schema pipettiert: Reagenz SNaPshot Ready-Reaktions-Mix 5x Sequenzierungs-Puffer SNaPshot Multiplex Primer-Mix RNase-freies Wasser verdautes Multiplex PCR-Produkt Volumen im Einfach-Ansatz (µl) 2,5μl 2,0μl 1,0μl 2,5μl 2,0μl Tabelle 2-42: Pipettieransatz der SNaPshot PCR. Die SNaPshot-PCR lief im Thermocycler unter folgenden Bedingungen ab: Schritt Zeit Temperatur Step 1 (Denaturierung) 10sec 96 C Step 2 (Annealing und 40sec 58,5 C Elongation) Step 3 go to step 1 34x Step 4 end Tabelle 2-43: Thermocyclerkonditionen der SNaPshot PCR. Anschließend wurde das SNaPshot PCR-Produkt ein weiteres Mal mit SAP behandelt, indem der Ansatz nach Zugabe von 1 μl SAP (1.000 U/ml) erneut 60 Minuten bei 37 C und 15 Minuten bei 72 C im Thermocycler inkubiert wurde. Für die Sequenzierung wurde das verdaute SNaPshot-PCR-Produkt denaturiert. Es wurde zunächst 1:50 in RNase-freiem Wasser verdünnt und dann 0,5μl dieser 82
83 Material und Methoden Verdünnung mit 19μl HiDi Formamid sowie 0,1μl LIZ-Standard versetzt. Nach zweiminütigem Erhitzen des Ansatzes auf 95 C wurden die Proben auf Eis abgekühlt und dann bei 4 C gelagert. Die Beladung des Genetic Analyzer 3500 Dx erfolgte durch Mitarbeiterinnen der AG Molekulare Diagnostik Sanger-Sequenzierung von DNA Um die Integrität unserer SNP-Daten zu bestätigen wurde zusätzlich zur RFLP- Analyse eine Sequenzierung von stichprobenartig-ausgewählten DNA-Proben durchgeführt. Für rs3242 wurden 10 und für rs DNA-Proben randomisiert ausgewählt. Zunächst wurden die Patienten-DNAs in einer konventionellen PCR mit SNP-spezifischen Primern amplifiziert (siehe Protokoll konventionelle PCR ). Zu beachten war nur, dass an Stelle des grünen Puffers, der weiße PCR-Puffer verwendet werden musste, damit die grüne Farbe bei der späteren Kapillarelektrophorese nicht stören würde. Im Anschluss erfolgte dann die Aufreinigung der PCR-Produkte mit dem Dye Ex 2.0 TM Spin Kit von Qiagen gemäß Herstellerangaben. Davon wurden 5µl, zusammen mit dem 50bp-DNA- Längenstandard, auf ein 2,5%iges Agarose-Gel aufgetragen und etwa 25 Minuten bei 110V elektrophoretisch aufgetrennt. Anhand der Bandenstärke wurde enschieden, wieviel PCR-Produkt in der nachfolgenden Sequenzierungs-PCR eingesetzt werden würde (1-4µl). Im folgenden Schritt wurden die aufgereinigten PCR-Produkte dann in der eigentlichen Sanger-Sequenzierungs-PCR amplifiziert. Die Sanger-Sequenzierung ist eine Kettenabbruch-Methode, bei der neben den normalen dntps auch ddntps (ddatp, ddctp, ddgtp, ddttp) im Reaktionsgemisch anwesend sind. Die Fluoreszenz-markierten ddntps führen, bei Einbau in den neu-synthetisierten DNA-Strang, zum Abbruch der DNA- Polymerisation, da ihnen die 3 -OH-Gruppe für die Verknüpfung mit der Phosphatgruppe des nächsten Nukleotides fehlt. Somit entstehen unterschiedlich große DNA-Fragmente, die dann elektrophoretisch aufgetrennt werden können. Die ddntps sind mit vier verschiedenen Fluoreszenzfarbstoffen gekoppelt, was dann eine Farb-basierte Unterscheidung der eingebauten Nukleotide möglich macht. So kann der Sequencer durch Koppelung der Fragmentlänge und des jeweiligen Lichtsignals die Basensequenz errechnen und dann in einem Chromatogramm darstellen. 83
84 Material und Methoden Das Schema der Sequenzierungs-PCR ist in folgender Tabelle dargestellt: Reagenz Volumen im Einfach-Ansatz (µl) Terminator Ready Reaction Mix 4µl 5x Sequenzierungspuffer 4µl Primer (sense oder antisense, je 3,2µM) 2µ PCR-Produkt 1-4µl Wasser ad 20µl Gesamt 20µl Tabelle 2-44: Pipettieransatz der Sequenzierungs-PCR. Die Sequenzierungs-PCR erfolgte im Thermocycler unter folgenden Bedingungen: Schritt Zeit Temperatur Step 1 (Denaturierung) 15sec 96 C Step 2 (Annealing) 15sec 57 C (rs3242) 57,8 C (rs921142) Step 3 (Elongation) 4min 60 C Step 4 go to step 1 24x Step 5 forever 8 C Step 6 end Tabelle 2-45: Thermocycler-Konditionen der SNP-PCRs. Nachfolgend wurden die PCR-Produkte erneut mit dem Dye Ex 2.0 TM Spin Kit von Qiagen aufgereinigt und dann für die Kapillarelektrophorese denaturiert. Dazu wurden 2µl des aufgereinigten PCR-Produktes mit 18µl HiDi (Formamid) versetzt und dann für 2 Minuten bei 95 C aufgekocht. Im Anschluss wurden die Proben auf Eis abgekühlt und dan bis zu Beladung bei 4 C im Kühlschrank gelagert. Die Beladung des Genetic Analyzer 3500 Dx erfolgte durch Mitarbeiterinnen der AG Molekulare Diagnostik. 84
85 Material und Methoden Vergleichende genomische Hybridisierung (acgh) 19 papilläre Urotheltumoren (9 pta und 10 pt1, siehe Tabelle 2-2) wurden mittels acgh (array-based comparative genomic hybridisation) auf die Veränderung der Kopienzahl bestimmter chromosomaler Abschnitte bzw. ganzer Chromosomen untersucht. Die Untersuchung erfolgte in Zusammenarbeit mit dem IZKF Core Unit Z3 Affymetrix-Chip-Analysen am Institut für Humangenetik (Ansprechpartner Dr. Arif Ekici). Die Tumor-DNAs wurden, zusammen mit gesunden Referenz-DNAs auf den Genome-Wide SNP Array 6.0 von Affymetrix mit 1.8 Millionen genetischen Markern ( Sonden zur Detektion von Kopiezahlvarianten und SNP- Sonden) hybridisiert. Die Referenz-DNAs stammten von einer gesunden Patientenkohorte (167 Kinder, Frauen und Männer) aus einer Studie zur mentalen Retardierung von Kindern. Die Kontroll-DNAs wurden freundlicherweise vom Institut für Humangeneitk bereitgestellt. Eine Übersicht über die verschiedenen Arbeitsschritte der acgh sind in Abbildung 2-4 dargestellt. Abbildung 2-4: Übersicht über alle wichtigen Arbeitsschritte bei der acgh: Restriktionsverdau, Adaptor Ligation, PCR, Aufreinigung, Fragmentierung, Labeling und im Anschluss die eigentliche Hybridisierung auf dem Affymetrix Chip. Die 19 Tumorproben wurden zunächst mikrodisseziert und anschließend daraus die DNA mit dem QIAamp DNA Mini Kit nach dem Protokoll DNA Purification from Tissues isoliert. Nach der DNA-Qualitätsuntersuchung mittels Agarose- Gelelktrophorese, wurden 500ng genomischer DNA zunächst mit den beiden 85
86 Material und Methoden Restriktionsenzymen NspI und StyI verdaut. Die entstandenen DNA-Fragmente wurden dann mit Adaptoren ligiert und in einer PCR amplifiziert. Die PCR-Produkte wurden aufgereinigt, gepoolt und quantifiziert. Daran schlossen sich die DNA- Fragmentierung, das Labeling mit dem entsprechenden Fluoreszenzfarbstoff und schließlich die eigentliche Hybridisierung an. Diese erfolgte Stunden lang bei 50 C. Danach wurden die Array-Chips erneut gewaschen, gefärbt und dann mit dem GeneChip Scanner G gescannt. Die Daten-Analyse erfolgte mit der kostenlos zugänglichen Software Genotyping Console von Affymetrix. Eine detaillierte Anleitung zur Versuchsdurchführung ist im Affymetrix Genome-Wide Human SNP Nsp/Sty 6.0 User Guide zu finden. 86
87 Material und Methoden Proteinbiochemische Methoden Isolierung von Proteinen aus Zellen und Gewebe Es wurden sowohl aus Zelllininen, als auch aus humanem Gewebe Gesamtproteinlysate hergestellt. Dazu wurden zwei unterschiedliche Methoden verwendet. Die Gewebeproben wurden mittels Trizol aufgearbeitet und die kultivierten Zellen mit Hilfe eines speziellen Lysepuffers und Ultraschall-Behandlung aufgeschlossen. Die Zellen wurden in einem geeigneten Kulturgefäß (T75, T175 oder 10cm- Petrischale) bis zu einer Konfluenz von 80% kultiviert. Zu Beginn der Proteinisolation wurden die Zellen auf Eis gestellt, dort das Medium abgesaugt und 1x mit eiskaltem PBS gewaschen. Durch die Kälte wurden die Zellen in eine Art Schockzustand versetzt, was verhindern sollte, dass sie als Reaktion auf die Stresssituation, bestimmte Signalwege an- oder ausschalten, die unter normalen Wachstumsbedingungen nicht aktiv gewesen wären. Nach dem Waschen wurden 300µl Lysepuffer (T75-Flasche) auf die Zellen pipettiert und 15 Minuten auf Eis inkubiert. Dann wurden die angedauten Zellen mit einem Cell Scraper vom Flaschenboden gelöst und in ein eisgekühltes 1,5ml Eppi überführt. Es erfolgte eine 45minütige Inkubation auf Eis oder im Drehrad im Kühlschrank. Im Anschluss wurde das Lysat mit einem Ultraschallstab auf Eis sonifiziert (20 Sekunden mit Puls 1sec on/1sec off, bei einer Amplitude von 30%), um die Wirkung des Lysepuffers zu unterstützen. Dann wurde das Lysat für 30 Minuten bei 4 C und xg zentrifugiert um die unlöslichen Zelltrümmer vom Proteinlysat abzutrennen. Der Überstand wurde abgenommen und zur Langzeitlagerung bei -80 C eingefroren. Die Proteinisolation der Gewebeproben mittels Trizol erfolgte gemäß den Herstellerangaben Protein-Konzentrationsbestimmung mittels BCA-Assay Die Konzentrationsbestimmung erfolgte mit dem BCA Protein Assay Kit von Thermo Scientific gemäß den Herstellerangaben. Zur Erstellung einer Eichgeraden wurde ein BSA (bovine serum albumin)-standard mit folgenden Verdünnungen hergestellt: 2000, 1500, 1000, 750, 500, 250, 125, 62,5 mg/ml. Es wurden jeweils 25µl der 87
88 Material und Methoden Standards, der Proteinlysate (1:5 mit Lysepuffer verdünnt) und des Blanks (Lysepuffer) in Dupletts in eine 96Well-Platte pipettiert. Nachfolgend wurden 200µl der zuvor hergestellt Working-Solution (Lsg. A : Lsg. B = 50:1) pro Well hinzugegeben. Nach kurzem Schütteln der Platte wurde diese 30min bei 37 C inkubiert. Im Anschluss erfolgte die Messung der Absorption am Synergy 2 mit einer Wellenlänge von 595nm. Bei der hier ablaufenden Biuret-Reaktion macht man sich die Eigenschaften von Kupfer zunutze, sich an Proteine anzulagern. Bei der Komplexbildung wird das Cu 2+ - Ion der Kupfer-2-Sulfats zu Cu + reduziert. Das wasserlösliche Natriumsalz der 2,2 - Bichinolin-4,4 -dicarbonsäure-säure (kurz Bicinchoninsäure oder BCA) bildet einen spezifischen Komplex mit Cu + -Ionen, der sich konzentrationsabhängig in alkalischem Milieu purpur färbt SDS-Polyacrylamid-Gelelektrophorese Bei der diskontinuierlichen Sodium-Dodecyl-Sulfat-Polyacrylamid-Gelelektrophorese (SDS-PAGE) nach Laemmli werden die Eiweißmoleküle des Gesamtproteinlysates zunächst denaturiert und dann ihrer Größe nach auf einem Polyacrylamidgel aufgetrennt. Das zugegebene Natrium-Dodecylsulfat überdeckt dabei die Eigenladung der Proteine und führt so zu einer einheitlichen negativen Ladung. Während die Proteinlysate auf Eis auftauten, wurden die Acrylamidgele ausgegossen. Zuerst wurde ein 7,5 (MTUS1) oder 10%iges Trenngel-Gemisch (ph 8.8, siehe Tabelle 2-9) zwischen die Glasplatten der Biorad-Gießstation gegossen, welches dann ca. 30 Minuten polymerisierte. Um eine Austrocknung zu verhindern wurde es mit einer dünnen Schicht Isopropanol überschichtet. Nach dem Aushärten wurde das Isopropanol entfernt und das Trenngel mit dem Sammelgel-Gemisch (ph 6.8) überschichtet und der Kamm luftblasenfrei eingesetzt. Nach 30-45minütiger Polymerisation wurde das fertige Gel in die Elektrophorese-Apparatur eingespannt und die Kammern bis zur Markierung mit dem Elektrolyten (1x TBS-Puffer) befüllt. Nun wurden 30µg der aufgetauten Proteinlysate mit 5x Ladepuffer und 2M DTT versetzt und auf 60µl mit Lysepuffer aufgefüllt. Der Ladepuffer enthielt neben dem Negativ-Ladungs-Donor auch Bromphemolblau, was eine bessere Visualisierung der Proben im Gel garantierte. Die Proben wurden 5 Minuten bei 95 C denaturiert. Durch die hohe Temperatur wurde die Sekundär- und die Tertiär-Struktur der Proteine 88
89 Material und Methoden durch die Trennung von Wasserstoffbrücken aufgebrochen. Das zugegebene Thiol DTT bewirkte außerdem eine Spaltung der Disufidbrücken durch Reduktion. Der sichtbare Marker wurde 1 Minute bei 40 C, der biotinylierte, lumineszierende Marker 2 Minuten bei 95 C inkubiert. Im Anschluss wurden die Protein-Proben, der Blank (nur Lysepuffer), sowie die Längenmarker mit einer Hamilton-Pipette in die Geltaschen gefüllt. Bei der nachfolgenden Elektrophorese wurde für 15 bis 20 Minuten zunächst eine Spannung von 100 Volt angelegt (Sammeln der Proteine im Sammelgel) und dann für 45 bis 60 Minuten auf 150 Volt erhöht (Trenngel). Zur Kontrolle einer erfolgreichen Elektrophorese wurde das Gel mit Ponceau-Rot gefärbt Westernblot Beim Westernblot werden die vorher mittels SDS-PAGE aufgetrennten Proteine auf eine Nitrozellulose-Trägermembran übertragen um diese später mit entsprechenden Antikörpern auf die Anwesenheit eines bestimmten Proteins zu untersuchen. Die Übertragung der Proteine vom Polyacrylamidgel auf die Nitrozellulosemembran erfolgte durch die Wet-Blot-Methode. Dabei wurden Gel und Membran aufeinanderliegend zwischen, in Puffer getränkte, Blottingpapiere und Glasfaserkissen eingespannt und in Anwesenheit eines elektrolytischen Puffers (Towbinpuffer) für 2 Stunden und 11 Minuten bei 100Volt oder über Nacht bei 25Volt geblottet. Das senkrecht zum Gel ausgerichtet elektrische Feld bewirkte dabei das Wandern der Proteine aus dem Gel auf die Nitrozellulosemembran, wo sie aufgrund der hydrophoben Wechselwirkungen hängen blieben. Nach dem Blotten wurde die Membran 3mal 5 Minuten in TBST gewaschen, um Methanolrückstände des Blottingpuffers zu entfernen. Danach wurde die Membran ca. 40 min mit BSA, Milchpulver oder der synthetischen Blockingreagenz Immunoblot Blocking Reagent geblockt um mögliche, unspezifische Antikörperbindestellen abzusättigen. Nach erneutem Waschen wurde der Primärantikörper auf der Membran inkubiert. Die jeweiligen Bedingungen (z.b. Konzentration, Inkubationszeit, Temperatur, etc. sind in Tabelle 2-46 zusammen gefasst). Nach der Inkubation des Primärantikörpers erfolgten ein weiterer Waschschritt und dann die Inkubation des Sekundärantikörpers. Dieser war gegen ein Epitop der Primärantikörperspezies gerichtet und mit HRP (horse-raddish-peroxidase = Meerrettichperoxidase) gekoppelt, die dann später das zugegebene Substrat unter Lichtabgabe 89
90 Material und Methoden (Lumineszenz) umsetzen konnte. Der Sekundärantikörper wurde für 40 Minuten bei Raumtemperatur inkubiert. Danach wurde nicht-gebundener Antikörper durch 3maliges Waschen entfernt. Als HRP-Substrat diente das Immobilion Western Chemiluminescent HRP Substrat von Millipore. Es wurden je 1ml der HRP Substrate Peroxide Solution und 1ml des HRP Substrate Luminol Reagent gemischt und für 5min auf der Membran bei Raumtemperatur inkubiert. Im Anschluss erfolgte die Detektion des Lumineszenzsignals im Fusion FX7 von Vilber Lourmat. Nach der Antikörperbehandlung gegen das jeweilige Zielprotein wurden die Membranen mit einem Antikörper gegen das ubiquitär exprimierte House-Keeping-Protein ß-Aktin behandelt und gefärbt. Dies diente dazu eine gleichmäßige Gel-Beladung mit identischer Proteinmenge nachzuweisen und die Datenintegrität zu garantieren. Beim initiierenden Screening der Zelllininen nach SFRP1-Expression wurde SDHA als House-Keeping-Protein verwendet. Die Auswertung der Blots, einschließlich der Quantifizierung erfolgte mit der Bio1D-Software von Vilber Lourmat. pak Name Positiv-Ko. Spezies AXIN2 SW480 rabbit monoklonal BMP4 SK-MEL-28 rabbit polyklonal CD44 HCV29 rabbit monoklonal CMYC HeLa rabbit - CCND1 SW480 rabbit polyklonal SURVIVIN SW480 mouse monoklonal SFRP1 SK-MEL-28, rabbit rek. Protein - ß-AKTIN - mouse monoklonal SDHA - rabbit polyklonal Molekulargewicht Blocking- Reagenz Verdünnung pak Zeit und Temperatur kda BSA 1:133 1h, RT 47 kda BSA 1:1000 1h, RT DB: 100 kda 82 kda BSA 1:5000 1h, RT kda BSA 1:1000 1h, RT 34 kda Künstl 1:8000 1h, RT 16,5 kda MP 1:75 1h, RT 37 kda BSA 1:250 1h, RT 42 kda MP 1: h, RT 73kDa BSA 1:300 1h, 4 C Tabelle 2-46: Übersicht über die im Westernblot verwendeten Antikörper. 90
91 Material und Methoden Herstellung eines Tissue Micro Arrays Für die immunhistochemische Untersuchung von Patientenmaterial wurde ein Tissue Micro Array (TMA) bestehend aus 143 papillären Urothelkarzinomen aus der Erlanger Tumorbank hergestellt. Dazu wurde aus den entsprechenden Paraffinblöcken zunächst ein HE-Schnitt angefertigt, der vom Pathologen angezeichnet wurde. Geeignete Tumorblöcke wurden zuerst am Mikrotom angeschnitten um die Paraffinschicht auf dem Gewebe zu entfernen. Dann wurde das entsprechende Tumorareal mit einem dunklen Stift markiert, das Gewebe an der markierten Stelle ausgestanzt und in eine TMA-Schablone (leerer Paraffinblock mit 60 Stanzlöchern) eingepasst. Zur Orientierung wurde auch eine Markierstanze am Anfang oder Ende einer TMA-Reihe eingepasst (hier: Lebergewebe). Nachdem die einzelnen Stanzen eingesetzt und gleichmäßig angedrückt worden waren, wurden sie etwa 4 Minuten bei ca 60 C in flüssigem Paraffin mit dem Leerblock verschmolzen. Im Anschluss wurden 1-4µm dünne Gewebeschnitte angefertigt, die dann histo- und immunhistochemisch gefärbt werden konnten. Dies Repräsentativität des Materials in den Stanzen wurde wiederum durch einen Pathologen bestätigt Anfertigung einer HE-Färbung Die Hämatoxilin-Eosin- oder auch HE-Färbung ist die Standardfärbung in der Histologie, die einen Überblick über die Struktur des Gewebes liefert und dabei die Unterscheidung der untersuchten Strukturen in normal, entzündlich- oder z.b. maligne ermöglicht. Die Paraffinschnitte wurden dazu Minuten in einem 60 C- Schrank stehen gelassen um Großteile des Paraffinmaterials abzuschmelzen. Im Anschluss wurden die verbliebenen Paraffinreste in einer absteigenden Xylol- Isopropanol-Reihe (3x 10min Xylol, 1 x 5min 100% Isoprop, 1 x 5min 96% Isoprop, 1 x 5min 70% Isoprop) entfernt. Nach kurzem Abspülen in Aqua dest. wurde der Schnitt zur Kernfärbung für 90sec in Hämatoxilin getaucht und dann mit Leitungswasser abgespült. Daraufhin folgte die 10sekündige Gegenfärbung mit Eosin, die das Zytoplasma sichtbar machte. Abschließend wurden die Schnitte 2 x für 10 Sekunden in Xylol getaucht. Dann wurden die gefärbten Gewebedünnschnitte mit Eukitt eingedeckelt. 91
92 Material und Methoden Immunhistochemie (IHC) pak Name Anti- SFRP1 MTUS1 P53 CK20 Ki67 Spezies Hersteller Konzentration Hase Maus monoklonal Maus monoklonal Maus monoklonal Maus monoklonal Pineda, system custommade Zeit und Temperatur 1:600 ÜN, RT Abnova 1:20 ÜN, RT Dako Cytomation sak Bedingungen 1:200 30, RT 1:100 30, RT Besonderheit TSA TSA Detektions- 1:50 32, 37 C U ultra View DAB am Färbeautomat Dako Cytomation 1:50 32, 37 C U ultra View DAB am Färbeautomat Dako Cytomation 1:100 32, 37 C U ultra View DAB am Färbeautomat AEC AEC Tabelle 2-47: Übersicht über die in der Immunhistochemie verwendeten Antikörper. Die Immunhistochemie wird dazu verwendet, Proteine in hauchdünn geschnittenem Gewebe mittels Antikörperfärbung sichtbar zu machen. Entwässertes, mit Formaldehyd fixiertes und in Paraffin eingebettetes Gewebe oder Zellmaterial wurde am Mikrotom in 1-4µm dünne Schichten geschnitten und auf einen Glasobjektträger aufgezogen. Die Färbungen gegen SFRP1 und MTUS1 wurden manuell nach folgendem Protokoll durchgeführt. Zur Entfernung des Paraffins wurden die jeweiligen Schnitte in einer absteigenden Xylol-Alkoholreihe entparaffiniert (3x 10min in Xylol, dann je 2min in 100% (2x) Ethanol, 96% (2x) Ethanol und abschließend 1x in 70%igem Ethanol). Im Anschluss wurden die Schnitte in 3%igem Wasserstoffperoxid 10 Minuten inkubiert, um die endogene Peroxidase zu blockieren und somit später störende unspezifische Färbung zu verhindern. Daraufhin wurden die Schnitte in einer Plastikküvette in Zitronensäurepuffer bei 120 C im Dampfkochtopf gekocht (1min für SFRP1 und 4min für MTUS1), um die durch die Paraffinfixierung entstandenen Quervernetzungen der Proteine zu brechen. Dann wurden die Schnitte einmal mit Tris+Tween gewaschen und anschließend mit dem Primärantikörper über Nacht inkubiert (je 100µl pro Schnitt oder TMA, SFRP1/Tier1 1:600 bzw. 1:400 für die Nierengewebskontrolle; MTUS1 1:20, immer in Albuminpuffer verdünnt). Das Waschen mit Tris+Tween sollte die Oberflächenspannung des jeweiligen Puffers herabsetzen und die Proteine so besser zugänglich für die Antikörper und Folgereagenzien machen. Alle weiteren 92
93 Material und Methoden Schritte erfolgten bei Raumtemperatur. Nach jedem Inkubationsschritt erfolgte ein Waschschritt mit Tris-Tween-Puffer. Am nächsten Morgen wurden die Schnitte mit Tris+Tween gespült und dann mit dem biotinylierten Sekundärantikörper (sak) für 30 Minuten bei Raumtemperatur inkubiert (SFRP1 sak antirabbit 1:200; MTUS1 sak anti-mouse 1:100, gelöst in Trispuffer ph 7.4). Der Sekundärantikörper erkennt bestimmte Epitope des Primärantikörpers und bindet daran. Im nächsten Schritt wurden die Schnitte mit einer ABC-Lösung (Antikörper-Biotin-Komplex, Vectastain, 1 Tropfen A + 1 Tropfen B in TRIS Puffer ph 7.4) für 20 min bei RT inkubiert. Diese Lösung enthielt unter anderem das Enzym Meerrettich-Peroxidase, welche an das am sak gebundene Biotin binden und später das zugegeben Substrat umsetzen kann. Um das Signal zu verstärken wurde eine Signal-Amplifikations-Lösung für 10 Minuten auf die Schnitte pipettiert. Diese sogenannte Tyramide-Signal-Amplification (TSA) amplifiziert das chromogene Signal vielfach und führt so zu einem intensiveren Farbsignal und einer leichteren Detektion der immunhistochemischen Reaktion. Dann wurde erneut die ABC-Lösung für 20 Minuten und im Anschluss die frisch angesetzte AEC-Lösung (3-Amino-9-Ethylcarbazol) hinzugegeben. Die Meerrettich- Peroxidase konnte nun das zugegebene Substrat umsetzen, was durch einen rötlichbraunen Farbumschlag an den Stellen der gesuchten Proteine sichtbar wurde. Nach 10 Minuten wurde die Reaktion gestoppt und die Schnitte erst in Leitungswasser und dann kurz in VE-Wasser geschwenkt. Ein darauffolgender 2minütiger Färbeschritt in Hämalaun machte durch eine Gegenfärbung auch die Zellgrenzen und die Zellkerne sichtbar, was eine genauere Lokalisation des angefärbten Proteins möglich machte. Die Färbungen gegen P53, KI67 und CK20 erfolgten automatisiert mit dem BenchMark ULTRA IHC/ISH Staining Module von Ventana mit dem U ultra View DAB KIT gemäß den Herstellerangaben. Die Primärantikörper wurden jeweils für 32min bei 37 C inkubiert. Die so angefärbten Gewebedünnschnitte konnten nun unter dem Mikroskop vom Pathologen (AH) ausgewertet werden Immunfluoreszenz (IF) Für den Nachweis der SFRP1-Expression auf Proteinebene in den Zelllinien wurde neben dem Westernblot und der Immunhistochemie auch die Immunfluoreszenz angewendet. Dazu wurden die Zellen auf sterilen 8-Kammer Glasobjektträgern (BD 93
94 Material und Methoden Falcon 8-well culture slides von BD Biosciences) kultiviert. Nach Erreichen der gewünschten Konfluenz (ca %) wurden die Zellen mit je 500µl eiskaltem Aceton fixiert (20min, -20 C). Das Aceton wurde abgekippt und die Objektträger konnten dauerhaft bei -20 C gelagert werden. Für die Immunfluoreszenzfärbung wurden die Objektträger ca. 2min aufgetaut und dann mit 0,1%igem PBS+TritonX versetzt. Das Detergens diente dazu, die Zellmembran permeabel zu machen und so das Eindringen der immunreaktiven Reagenzien in die Zelle zu erleichtern. Im Anschluss wurde der erste Primärantikörper (rabbit-anti-sfrp1 1:100 oder mouseanti-cdh1 1:100, je 100µl pro Chamber Slide Well) für 1h bei Raumtemperatur inkubiert. Zwischen dem nächsten und allen folgenden Inkubationsschritten erfolgten drei 5minütige Waschschritte mit PBS+Tween20 (0,1%). Im nächsten Schritt wurde der entsprechende fluoreszenz-gekoppelte Sekundärantikörper auf die Zellen pipettiert (Goat-anti-Rabbit, DyLight 549-konjugiert (rot) oder Sheep-anti-mouse, DyLight 488-konjuiert (grün), beide 1:250, je 100µl pro Well). Ab diesem Schritt erfolgte die Inkubation im Dunkeln. Für die Doppelimmunfluoreszenz wurden die Zellen mit dem zweiten Primärantikörper (1h, RT, 100µl) und dann mit dem zweiten Sekundärantikörper (30min, RT, 100µl) versetzt. Um die Zellkerne sichtbar zu machen wurden die Zellen mit einer 1:1000 mit PBS verdünnten DAPI-Lösung inkubiert (5min, RT). Nach einem letzten Waschschritt wurde das Plastikgehäuse gemäß den Herstellerangaben abgenommen und die gefärbten Zellen mit Mowiol eingedeckelt. Die Begutachtung der Fluoreszenzfärbung erfolgte mit dem Zeiss Analysis Mikroskop Statistische Methoden Um bei der SNP Analyse zu testen, ob die Genotypenverteilung dem Hardy- Weinberg-Equilibrium folgte, wurde die öffentlich zugängliche Software verwendet. Für alle weiteren statistischen Berechnungen wurde PASW/SPSS 19.0 benutzt. Signifikanzwerte, die eine unterschiedliche Genotypenverteilung zwischen Fällen und Kontrollen, sowie eine Assoziationen zwischen Genotypen und Alter bzw. histopathologischen Parametern anzeigen, wurden mit dem Chi-Quadrat-Test (2-seitige Signifikanz) berechnet. Für die Bestimmung der Risk-Allel-Verteilung wurde Fisher s exact test (2-seitige exakte Signifikanz) angewendet. 94
95 Material und Methoden Für die Berechnung des Signifikanznineaus der Unterschiede bei den funktionellen Experimenten zwischen Behandlung und Kontrolle (Viability-, BrdU- und Wound- Scratch-Assay) wurden der nicht-parametrische Kruskal-Wallis-Test für unabhängige Stichproben (einfaktorielle ANOVA für k-stichproben, paarweise Mehrfachvergleiche) verwendet. Für die Berechnungen des SFRP1-, MTUS1-, P53-, Ki67 und CK20-assoziierten Überlebens wurden Kaplan-Meier Kurven mit dem Log-Rang-Test erstellt. Die Überlebenswahrscheinlichkeiten und das zugehörige Risiko (95% Konfidenzintervall) wurden mit der univariaten bzw. der multivariaten Cox-Regression berechnet. Um alle Patientendaten untereinander zu korrelieren und Hinweise auf signifikante Assoziationen zu erhalten wurde eine bivariate Korrelation mit dem Spearman-Test durchgeführt. Signifikante Unterschiede wurden dann mit dem Chi-Quadrat-Test (bzw. Fisher s exact test) überprüft. P-Werte <0,05 wurden als statisisch signifikant angesehen. Die Überlebenskurven wurden in Zusammenarbeit mit der AG Molekulare Urologie der Urologischen Klinik des Universitätsklinikums Erlangen (Prof. Wullich, Prof. Taubert, Dr. Sven Wach) erstellt. 95
96 Ergebnisse 3. Ergebnisse 3.1 Untersuchung der SFRP1-Expression bei Blasenkrebs In der vorliegenden Arbeit wurde eine mögliche Assoziation der SFRP1-Expression mit dem Urothelkarzinom der Harnblase untersucht. Dazu wurden einerseits Harnblasenkarzinom-Zelllininen funktionell und andererseits Auswirkungen auf den Wnt-Signalweg untersucht. Außerdem wurden zwei Kollektive mit papillären und fortgeschrittenen Blasentumoren auf einen möglichen Zusammenhang der SFRP1- Expression mit Entstehung oder Fortschreiten der Erkrankung analysiert Funktionelle Charakterisierung der SFRP1-Expression in Harnblasenkarzinom-Zelllinien Für die funktionelle Charakterisierung von SFRP1 wurden zunächst verschiedene Harnblasenkarzinomzelllininen auf die Expression von SFRP1 gescreent. Schließlich wurden zwei papilläre Zelllinine mit und ohne SFRP1 Expression ausgewählt und funktionelle Auswirkungen auf Viabilität, Proliferation, Migration, Wnt-Signalweg, sowie verschiedene Wnt-Zielgene untersucht Screening der SFRP1-Expression in Harnblasenkarzinom- Zelllininen Die vier Harnblasenkarzinom-Zelllinien RT112, RT4, J82 und BFTC905, sowie die immortalisierte Urothelzelllinine UROtsa wurden mittels konventioneller RT-PCR auf die Expression von SFRP1 untersucht. Gleichzeitig wurden die Zellen mit dem demethylierenden Agenz 5-Aza-2 -deoxyzytidin (kurz: 5-Aza) behandelt um eventuelle Promotormethylierungen nachzuweisen. Eine SFRP1-Expression konnte in RT112, RT4, J82 und UROtsa nachgewiesen werden. Lediglich bei BFTC905 konnte keine SFRP1-Expression detektiert werden. Nach der 5-Aza-Behandlung konnte allerding auch hier eine starke SFRP1-Expression nachgewiesen werden. Die gleichzeitige Untersuchung der GAPDH-Expression in allen Proben zeigte eine gleichmäßige Expression (siehe Abb. 3-1). 96
97 Ergebnisse Abbildung 3-1: Untersuchung der SFRP1 und GAPDH Expression in unbehandelten (1) und 5-Aza-behandelten (2) Zelllininen mittels PCR und Agarose Gelelektrophorese; RT112, RT4, J82 und UROtsa zeigten, BFTC905 zeigte hingegen keine konstitutive Expression von SFRP1; nach 5-Aza-Behandlung konnte wieder SFRP1 in BFTC905 exprimiert werden. Um zu bestätigen, dass es sich bei BFTC905 um eine Hypermethylierung des SFRP1-Promotors handelte, wurden die Zelllinien mittels methylierungsspezifischer PCR (MSP) untersucht. Dabei wurden pro Zelllinie jeweils zwei Polymerase- Kettenreaktionen mit verschiedenen Primern durchgeführt: einerseits mit Primern, die einen methylierten Promoter nachweisen und andererseits mit Primern, die einen unmethylierten Promotor nachweisen. Als Negativkontrolle wurde immer eine Wasserkontrolle mitgeführt, als Positivkontrolle in beiden Ansätzen jeweils unmethylierte bzw. mittels SssI methylierte Placenta-DNA. In Abbildung 3-2 ist das Agarosegel der MSP dargestellt. methyliert: 126bp unmethyliert: 135bp Abbildung 3-2: Ergebnisse der methylierungsspezifischen PCR des SFRP1 Promotors; nur BFTC905 weist eine Hypermethylierung am Promotor auf, alle anderen Zelllinine waren unmethyliert; 1 RT112, 2 J82, 3 BFTC905, 4 RT4, 5 UROtsa, 6 methylierte Placenta DNA, 7 unmethylierte Placenta DNA, 8 Negativkontrolle (Wasser). Bei der PCR mit den methylierungsspezifischen Primern konnten eindeutige 126bpgroße PCR-Produkte bei BFTC905 und bei der Positivkontrolle detektiert werden. Andersherum konnte bei der PCR mit den unmethylierten Primern in allen Proben ein PCR-Produkt nachgewiesen werden, außer bei BFTC905 und der methylierten 97
98 Ergebnisse Placenta-DNA. Bei RT112, J82, RT4 und UROtsa ist eine charakteristische 135bpgroße Bande zu sehen. Die Wasserkontrolle war in beiden Fällen negativ. Die MSP wurde bei BFTC905 dann erneut nach 5-Aza-Behandlung durchgeführt. In Abbildung 3-3 ist zu erkennen, dass SFRP1 ohne 5-Aza-Behandlung einen stark methylierten Promotor aufwies. Nach Zugabe des demethylierenden Agens war die Promotermethylierung nahezu verschwunden. Bei der PCR, die einen unmethylierten Promotor nachweisen sollte, war lediglich die unmethylierte Kontrollbande positiv. Die Wasserkontrolle war in beiden Fällen negativ. Unmethyliert: 135bp methyliert: 126bp Abbildung 3-3: Die MSP des SFRP1 Promotors in BFTC905 konnte eine eindeutige Hypermethylierung nachweisen; linke Seite: Nachweis des unmethylierten Promotors (UM-PCR), rechts: Nachweis des methylierten Promotors (M-PCR), nach 5-Aza Behandlungwar die Methylierungsbande nur noch ganz schwach zu sehen; die unmethylierte Bande konnte aber nicht detektiert werden; 1 unbehandelte BFTC905 Zellen, 2 5-Aza-behandelte BFTC905 Zellen, 3 methylierte Plazenta DNA, 4 unmethylierte Plazenta DNA, 5 Negativkontrolle (Wasser). Um eine Genstilllegung mittels Acetylierung auszuschließen, wurden die BFTC905 Zellen mit den Histon-Deacetylase-Inhibitoren SAHA (subeoylanilide hydroxamic acid, auch bekannt als Vorinostat) und Trichostatin A behandelt. Abbildung 3-4 zeigt die Ergebnisse der PCR von SFRP1 und GAPDH in BFTC905 nach verschiedenen Behandlungszuständen. Eine Reexpression von SFRP1 kam nur nach 5-Aza-Zugabe zu Stande. Eine Inkubation mit Trichostatin A und SAHA brachte keine Reexpression. Abbildung 3-4: Darstellung des Agarosegels nach SFRP1-PCR der unterschiedlich behandelten BFTC905 Zellen zum Nachweis der SFRP1 Expression; eine Reexpression konnte nur nach 5-Aza-Gabe erreicht werden. Die Genstilllegung scheint somit nicht durch Acetylierung sondern lediglich durch eine Hypermethylierung zu Stande gekommen zu sein; unbeh = unbehandelt, 5-Aza = 5 -Aza-2 -deoxyzytidin, Tricho = Trichostatin A, SAHA = suberoylanilide hydroxamic acid; GAPDH wurde in allen Spuren gleichmäßig exprimiert. 98
99 Ergebnisse Um relative Expressionsunterschiede in den Zelllinien aufzuzeigen, wurden die unbehandelten, bzw. die 5-Aza-behandelten Zellen mit der quantitativen Real-Time- PCR (qrt-pcr) untersucht. In Abbildung 3-5 ist die relative Quantifizierung der Zelllinien nach qrt-pcr zu sehen. RT112 wurde willkürlich als 100% definiert. Die unbehandelten und 5-Azabehandelten Proben sind jeweils nebeneinander aufgetragen. Die höchste Expression von SFRP1 auf mrna-niveau zeigte RT112, gefolgt von J82 (50,8%), RT4 (1,4%) und UROtsa (0,2%), wobei die beiden letztgenannten nur basale Expressionswerte aufwiesen. Unbehandelte BFTC905 Zellen zeigten, wie auch in der konventionellen PCR, keine Expression von SFRP1. Nach 5-Aza-Behandlung konnte auch in der qrt-pcr wieder eine Expression verzeichnet werden (27,8%). Doch auch bei den anderen Zelllininen scheint die SFRP1-mRNA-Expression von 5-Aza beeinflusst zu werden. Bei RT112 (126,9%), RT4 (16,1%) und UROtsa (8,1%) stiegen die Expressionswerte an. Nur bei J82 beeinflusste 5-Aza die Zellen negativ, so dass weniger SFRP1 exprimiert wurde (35,6%). Nach 5-Aza Behandlung wurden 15,2% weniger SFRP1 exprimiert, als ohne Behandlung. Abbildung 3-5: Darstellung der relativen Quantifizierung der SFRP1 Expression in den untersuchten Zelllinien mittels qrt-pcr mit und ohne 5-Aza Behandlung; RT112 zeigte die höchste, BFTC905 die niedrigste Expression, nach 5-Aza-Behandlung konnte eine SFRP1 Reexpression in BFTC905 detektiert werden. Um die SFRP1-Expression auch auf Proteinebene zu analysieren, wurden die Gesamtprotein-Zelllysate mittels SDS-PAGE aufgetrennt und die Proteine 99
100 Ergebnisse nachfolgend über Westernblot und Antikörper-Behandlung visualisiert. SK-Mel-28 und rekombinantes SFRP1-Protein dienten als Positivkontrolle für SFRP1, SDHA als House Keeping Protein. Es zeigte sich, dass die vier Harnblasenkarzinomzelllininen RT112, RT4, J82, BFTC905 und die Urothelzelllinine UROtsa keine detektierbare Expression von SFRP1 zeigten. Die beiden Positivkontrollen zeigten eine prägnante Bande bei ca. 37 kda (siehe Abb. 3-6) SFRP1 SDHA Abbildung 3-6: Westernblot-Analyse der Zelllinien nach Behandlung mit anti-sfrp1 und SDHA-Antikörper; nur in den beiden Positivkontrollen (bei SK-Mel-28 und beim rekombinanten Protein) konnten Banden für das 37kDa große SFRP1 detektiert werden; 1 Blank (nur Lysepuffer), 2 RT112, 3 RT4, 4 J82, 5 BFTC905, 6 UROtsa, 7 SK- Mel-28, 8 rekombinantes SFRP1 Protein. Um die Proteinexpression dennoch in den Zelllinien nachweisen zu können wurde zusätzlich eine Immunfluoreszenzfärbung mit anti-sfrp1 Antikörper durchgeführt (siehe Abbildung 3-7). Um die Zellgrenzen besser sichtbar zu machen wurde gleichzeitig E-Cadherin angefärbt (grün). Man erkennt eine deutliche Kappen -artige Rotfärbung über dem Kern in RT112, J82, UROtsa und SK-Mel-28, wobei sich die Färbung bei SK-Mel-28 bis ins Zytoplasma ausdehnt. Bei BFTC905 konnte keine, bei RT4 eine nur sehr schwache SFRP1-Färbung detektiert werden. Diese Ergebnisse passen auch zu den Resultaten der qrt-pcr (siehe oben, Abbidung 3-5). J82 und SK-Mel-28 hatten die E-Cadherin-Expression verloren, was für einen Verlust der Zelladhäsion und damit für einen maligneren Phänotyp spricht. Die Lokalisation von SFRP1 um den Nukleus herum spricht für eine Proteinexpression am Golgi Apparat. 100
101 Ergebnisse Abbildung 3-7: Immunfluoreszenz der Zelllinine RT112, RT4, J82, BFTC905, UROtsa und SK-Mel-28 mit Antikörpern gegen SFRP1 (rot) und E-Cadherin (grün); BFTC905 zeigt keine, RT4 nur schwache SFRP1- Expression. SK-Mel-28 und J82 haben hingegen die E-Cadherin-Expression verloren. Für die weiteren funktionellen Versuche wurde je eine papilläre Zellline mit SFRP1- mrna-expression (RT112) und eine papilläre Zellinine mit SFRP1-mRNA- Expressionsverlust (BFTC905) ausgewählt. In BFTC905 wurde SFRP1 mit Hilfe eines Expressionsplasmides überexprimiert und in RT112 mittels shrna herunterreguliert. Funktionelle und morphologische Veränderungen wurden im Anschluss untersucht. Dabei wurde mit dem BRdU Assay die Proliferationsrate, mit dem Cell Titer Glo Assay die Viabilität, mit dem Wound Scratch Assay die Migrationsrate und mit dem TOP flash/fop flash Assay die Wnt- 101
102 Ergebnisse Signalwegs-Aktivität bestimmt. Außerdem wurde die Auswirkung der veränderten SFRP1-Expression auf Wnt-Zielgene über qrt-pcr und Westernblot analysiert Analyse der Wnt-Zielgene in SFRP1-exprimierenden und SFRP1 defizienten RT112 und BFTC905 Zellen mittels qrt-pcr Nach der jeweiligen Transfektion und der Zugabe des Selektionsmediums konnten, nach ein- bis vierwöchiger Inkubationszeit, Klone isoliert werden, die das Plasmid aufgenommen hatten und im Selektionsmedium wuchsen. Von jeder Zelllinie wurden mindestens 10 Klone gepickt, die dann weiter kultiviert wurden, bis eine ausreichende Zellmenge zur RNA-Isolation vorhanden war. Nach RNA-Isolation und cdna-synthese wurde zunächst die SFRP1-Expression in der quantitativen Real- Time PCR überprüft. Die Klone Mock4 und A1 bei RT112, sowie Mock2 und A2 bei BFTC905 wurden für die weiteren Versuche ausgewählt. Bei ihnen wurde der größte Effekt festgestellt. Mit Mock ist jene Zellline gemeint, die mit dem Kontrollplasmid transfiziert wurde: also bei RT112 mit einem Vektor ohne funktionsfähige shrna und bei BFTC905 ein Kontrollplasmid ohne funktionsfähige SFRP1-DNA-Sequenz, was dem Wildtyp (wt) entspricht. Der A-Klon ist der gewählte Klon mit dem funktionierenden Plasmid. Demnach exprimieren RT112 Mock (wt) und BFTC905 A SFRP1, bei RT112 A und BFTC905 Mock (wt) ist die Expression herunterreguliert bzw. verloren gegangen. In Abbildung 3-8 ist der SFRP1-Expressionsunterschied zwischen transfizierten Zellen und den jeweilige Mock-Kontrollen in der relativen Quantifizierung dargestellt. Man erkennt einen deutlichen Unterschied zwischen A- und Mock-Klonen. Die shrna konnte SFRP1 in RT112 um über 95% herunterregulieren. Die Überexpression in BFTC905 bewirkte hingegen eine fast fach stärkere Expression von SFRP1. Nach Auswahl und Validierung der geeigneten Klone wurden die transfizierten Zellen bezüglich der Expression der Wnt-Zielgene AXIN2, BMP4, CD44, CMYC und CCND1 gescreent. Als House Keeping Gen diente GAPDH, als Kontrollzelllinie wurde SK-Mel-28 mitgeführt. Jedes Zielgen wurde 3mal pro Zelllinie in unabhängingen Messungen analysiert. Die Mess-Schwelle (threshold) konnte für alle Gene auf den Wert 0,1 festgelegt werden. Die Baseline wurde für jedes Gen einzeln festgelegt und ist in nachfolgender Tabelle 3-1 abgebildet. 102
103 Ergebnisse A B Abbildung 3-8: Relative Quantifizierung der SFRP1 Expression vor und nach Knockdown mittels shrna in RT112 (A) bzw. vor und nach Überexpression in BFTC905 (B). Die Baseline repräsentiert die initialen PCR-Zyklen, die durch einen kaum merklichen Anstieg des Fluoreszenzsignals gekennzeichnet sind und die als Hintergrundrauschen von den eigentlichen Fluoreszenzsignalen abgezogen werden müssen. Gen AXIN2 BMP4 CD44 CMYC CCND1 GAPDH SFRP1 Baseline Tabelle 3-1: Auflistung der Baselines der verschiedenen Gene, deren relative Expression in der qrt-pcr gemessen wurden. Im Anhang 9.3 sind die Schmelzkurven der Primeroptimierung, sowie die Eichgeraden der Primereffizienz-Bestimmung zu sehen. Abbildung 3-9 zeigt die Ergebnisse der qrt-pcr. Die Zelllinien mit SFRP1-Expression, also RT112 Mock4 und BFTC905 A2, wurden je auf einen Expressionswert von 100% bzw. 1 festgelegt. Die Zelllinine mit Expressionsverlust und die SFRP1-Positivzelllinie SK-Mel-28 wurden dann damit verglichen. Es zeigte sich, dass RT112 im Grundzustand im Vergleich zu SK-Mel-28 nur sehr wenig SFRP1 exprimierte. Die Melanomzelllinie zeigte eine ca. 75fach höhere Expression als RT112. BFTC905 A2 zeigte allerdings nach Überexpression von SFRP1 annähernd so hohe Expressions-Werte wie SK- Mel-28. Die Expression von SFRP1 in SK-Mel-28 war dabei nur noch 1,7fach erhöht. Betrachtet man RT112 fällt auf, dass eine verminderte SFRP1-Expression auch zu einer verminderten Expression der Zielgene führte, wobei der Knockdown bei BMP4 103
104 Ergebnisse am stärksten (ca. 92% weniger) und bei CD44 am schwächsten (ca. 34% weniger) ausgeprägt war. Bei BFTC905 war genau der gegenteilige Effekt zu beobachten: eine Überexpression von SFRP1 bewirkte eine Herunterregulation von BMP4 um das ca. 3,1fache. Bei CD44 war allerdings der gleiche Effekt zu beobachten, wie bei RT112. Bei einer SFRP1-Überexpression stieg auch die Expression von CD44 leicht an (um 29%). Bei AXIN2, CMYC und CCND1 waren nur minimale Veränderungen der SFRP1-abhängigen Genexpression zu erkennen, die aber im Rahmen der Standardabweichung vernachlässigt werden können. Bei AXIN2 konnte zudem eine starke Dimerbildung der Primer nachgewiesen werden, die die relative Quantifizierung beeinflusste und die eine scheinbar vorhandene Genexpression anzeigte. Da die primerfreien Amplification Plots aber sehr hohe C T -Werte aufwiesen, ist von einer fehlenden oder nur sehr basalen AXIN2-Expression auszugehen. Die Werte der relativen Quantifizierung sind in Tabelle 3-2 zu sehen. A B C D Abbildung 3-9: Expressionsunterschiede der Wnt-Zielgene AXIN2, BMP4, CD44, CMYC und CCND1 zwischen SFRP1-exprimierenden (RT112 Mock und BFTC905 A-Klone) und SFRP1-defizienten (RT112 A und BFTC905 Mock-Klonen) Zellen. SK-Mel-28 wurde als Positivkontrolle mitgeführt; A und C Übersicht, B und D Darstellung mit kleinerer Skala der y-achse, um die Unterscheide besser zu verdeutlichen; die SFRP1-positiven Zellen wurden auf 100% bzw. den Wert 1 festgelegt. 104
105 Ergebnisse RT112 RQ Mean BFTC905 RQ Mean Mock4 (SFRP1+) AXIN2 1 A2 (SFRP1+) AXIN2 1 BMP4 1 BMP4 1 CD44 1 CD44 1 CMYC 1 CMYC 1 CCND1 1 CCND1 1 SFRP1 1 SFRP1 1 A1 (SFRP1-) AXIN2 0, Mock2 (SFRP1-) AXIN2 1, BMP4 0, BMP4 3, CD44 0, CD44 0, CMYC 0, CMYC 1, CCND1 0, CCND1 0, SFRP1 0, SFRP1 0, SK-Mel-28 AXIN2 3, SK-Mel-28 AXIN2 37, BMP4 0, BMP4 0, CD44 0, CD44 1, CMYC 0, CMYC 0, CCND1 2, CCND1 2, SFRP1 75, SFRP1 1, Tabelle 3-2: Auflistung der relativen Expressionswerte der RT112 und BFTC905 Zellen mit und ohne SFRP1- Expression, sowie der SFRP1-Positivkontrolle-Zelllinie SK-Mel Analyse der Wnt-Zielgene in SFRP1-exprimierenden und SFRP1 defizienten RT112 und BFTC905 Zellen mittels Westernblot Um eine veränderte Genexpression auch auf Proteineben nachweisen zu können, wurden die SFRP1- und Wnt-Zielgen-Expression auch mittels Westernblot untersucht. Exemplarische und repräsentative Ausschnitte der gefärbten Westernblot-Membranen sind in Abbildung 3-12 zu sehen. Die mitgeführten Positivkontrollen zeigten in allen Blots positive Banden. Im Anschluss an die Zielprotein-Färbung, wurden die Membranen mit einem anti-ß-aktin-antikörper (House Keeping Protein) angefärbt, um so eine gleichbleibende Proteinqualität und quantität für alle Spuren nachzuweisen. Die ß-AKTIN Blots sind jeweils unter dem entsprechenden Zielprotein abgebildet. Für die relative Quantifizierung wurde jeweils der Expressionswert der Wildtypzelllinie (Mock) auf 100% gesetzt. Die Expression der Proteine in den transfizierten Zelllinien wurde dann damit verglichen. Jeder Westernblot wurde dreimal durchgeführt und die Banden separat quantifiziert. Aus den einzelnen Werten wurden dann der Mittelwert und die Standardabweichung gebildet. Eine graphische Zusammenfassung der relevantesten 105
106 Ergebnisse Bandenquantifizierungen ist in Abbildung 3-10 und 3-11, sowie in Tabelle 3-3 dargestellt. Protein BMP4 CMYC CCND1 BIRC5 SFRP1 RT112 Mock4 (wt) 100% 100% 100% 100% 100% RT112 A1 (- SFRP1) 77,6% 76,8% 126,2% 123,7 95,1% RT112 p- Wert 0,102 0,487 *0,037 *0,037 0,487 BFTC905 Mock2 (wt) 100% 100% 100% 100% 100% BFTC905 A1 +SFRP1 104% 80% 101% 62,7% 1136,2% BFTC905 p- Wert 1,0 *0,037 0,487 *0,037 *0,037 Tabelle 3-3: Auflistung der relativen Quantifizierungswerte der Westernblot-Analyse der Wnt-Zielgene in RT112 und BFTC905; es ergaben sich signifikante Werte für CCND1 und BIRC5 bei RT112 und für CMYC und BIRC5 bei BFTC905 in Abhängigkeit der SFRP1-Expression. SFRP1 ließ sich anhand zweier dominanter Banden sowohl in der Positivkontrolle (hier: rekombinantes Protein) als auch in der transfizierten Zelllinie BFTC905 A2 nachweisen. In den RT112 Wildtyp-Zellen und in den transfizierten RT112-Zellen, konnte hingegen keine eindeutige Bande detektiert werden. Die Expression des SFRP1-Proteins in RT112 konnte also mit der Westernblot-Methode nicht eindeutig nachgewiesen werden. Die relative Quantifizierung konnte in der SFRP1- überexprimierenden BFTC905-Zelllinie eine 11,3fach signifkant erhöhte Expression im Vergleich zur Wildtypzellline nachweisen (BFTC905 A2: 1136,2%, p=0,037). Die beiden Wnt-Zielproteine AXIN2 und CD44 konnten in keiner der untersuchten Zelllinien nachgewiesen werden. Auf den Westernblot-Membranen waren hier keine Banden zu sehen, sie wurden deshalb auch nicht quantifiziert. BMP4 wurde von allen Zelllinien exprimiert, wobei jene mit positiver SFRP1- Expression eine etwas höhere, wenn auch nicht signifikante Proteinkonzentration zeigten. Die relative Quantifizierung der Banden konnte bei RT112 Mock eine um 22,4% höhere (p=0,102), bei BFTC905 A eine um 4% höhere Expression feststellen (p=1,0). 106
107 Ergebnisse Die Expression des CMYC Genproduktes konnte durch die Anwesenheit von zwei knapp übereinander liegenden Banden nachgewiesen werden. Laut Datenblatt des Antikörpers handelt es sich hierbei um eine spezifische (kleinere Bande bei ca. 47kDa) und um eine unspezifische Bande bei etwa 60kDa. Für die relative Quantifizierung wurden beide Banden, für die endgültige Bestimmung der Expression, jedoch nur die spezifische Bande ausgewertet. Dabei zeigte die SFRP1- defiziente RT112 Zelllinine eine 23,2% niedrigere Expression, als die Wildtyplinie. Die detektierten Banden waren aber eher schwach ausgeprägt und der Unterschied nicht signifikant (p=0,487), was auf eine insgesamt niedrige CMYC-Expression hindeutet. Bei BFTC905 konnten in beiden Zelllinien starke CMYC-Banden bei 47kDa nachgewiesen werden. Bei BFTC905 A2 war die Expression um 20% geringer, als im Wildtyp (p=0,037). CCND1 wurde in beiden BFTC905 Zelllininen stark exprimiert. Die Expressionsunterschiede waren hierbei minimal (A2: 101%, p=0,487). Beide RT112 Zelllininen zeigten im Vergleich zu BFTC905 viel schwächere Banden, was wiederum auf eine viel geringere Expression hindeutet. Die SFRP1-defiziente RT112-Zelllinine hatte eine signifikant höhere Expression (126,2%) als die Wildtyplinie (p=0,037). Die Expression von BIRC5 in RT112 ähnelte der von CCND1. Auch hier zeigte die SFRP1-defiziente A1-Zellinine signifikant höhere Wert (123,7%, p=0,037). Umgekehrt hatte die SFRP1-exprimierende BFTC905 A2 Zellen eine um 37,3% niedrigere BIRC5-Expression als die Mock-Zellen (p=0,037). 107
108 Ergebnisse A B C E Abbildung 3-10: Quantifizierung der Proteinexpression von BMP4 (A), CMYC (B), CCND1 (C), BIRC5 (D) und SFRP1 (E) mittels Westernblot in RT112 nach knockdown von SFRP11; A1 = RT112 mit verminderter SFRP1-Expression durch shrna Knockdown, Mock4: RT112 +SFRP1 (wt). D A B C D Abbildung 3-11: Quantifizierung der Proteinexpression von BMP4 (A), CMYC (B), CCND1 (C), BIRC5 (D) und SFRP1 (E) mittels Westernblot in BFTC905 nach Überexpression von SFRP1; A2 BFTC905 +SFRP1, Mock2 BFTC905 ohne SFRP1-Expression (wt). E 108
109 Ergebnisse A B Abbildung 3-12: Exemplarische Darstellung der Expression von SFRP1 (A) und den Wnt-Zielgenen AXIN2 (B), BMP4 (C), CD44 (D), CMYC (E), CCND1 (F) und BIRC5 (G) im Westernblot nach SFRP1 Knockdown bzw. Überexpression in RT112 bzw. BFTC905; in der jeweiligen letzten Spur des Blots ist die jeweilige Positivkontrolle zu sehen. Unter der Membran des Zielproteins ist die Expression von ß-AKTIN in derselben Membran dargestellt. C D E F G 109
110 Ergebnisse Wnt-Aktivität mittels TOP/FOP Assay Alle vier Zelllinien zeigten im Vergleich zur Positivkontrolle SW480 nur minimale Wnt- Aktivitäten. Die Kolonkarzinomzelllinie wies sehr hohe Lumineszenzwerte und damit korrelierend einen hohen Wnt-Aktivitätswert von 798 auf. RT112 A1 mit SFRP1- Expressionsverlust hatte eine Wnt-Aktivität von ca. 0,8, die Wildtypzelllinie Mock4 hingegen von ca. 1,2. Bei BFTC905 konnten ähnliche Ergebnisse detektiert werden: die SFRP1-defiziente Zelllinie BFTC905 Mock2 hat mit etwa 0,6 einen etwas niedrigeren Wert, als BFTC905 A2 (1,12). Bei den beiden Zelllinien konnte, sowohl mit als auch ohne SFRP1-Expression, kein aktiver Wnt-Signalweg nachgewiesen werden, da die Ratien alle <2 waren. Die Ergebnisse sind in Abb verdeutlicht. Die Werte der Wnt-Aktivitäten sind in Tabelle 3-4 aufgelistet. A B C Abbildung 3-13: Veranschaulichung der Wnt- Aktivität in RT112 und BFTC905 Zellen mit und ohne SFRP1-Expression, sowie in SW480 (Positivkontrolle); A Übersicht, B y-skala 0-40, C y-achse mit Skala 0-1,8; die SFRP1-Expression schein keinen nennenswerten Einfluss auf die Wnt-Aktivität zu haben; in allen Fällen liegt sie unter dem Wert 2, was auf eine fehlende Wnt- Aktivität hindeutet. Zelllinie Wnt-Aktivität Stabw BFTC905 A2 +SFRP1 1, , BFTC905 Mock2 (Wt) -SFRP1 0, , RT112 A1 -SFRP1 0, , RT112 Mock4 Wt +SFRP1 1, , SW480 Positivkontrolle 798, , Tabelle 3-4: Auflistung der Werte der Wnt-Aktivitäten in RT112, BFTC905 und SW
111 Ergebnisse Bestimmung der SFRP1-abhängigen Viabilität (Viability Assay) Die Zellviabilität wurde über einen Zeitraum von 72 Stunden untersucht. Nach 24, 48 und 72 Stunden wurde die Viabilität mit dem Cell Titer Glo Assay bestimmt. Die Wildtyp BFTC905 Zellen ohne SFRP1-Expression zeigten dabei zu jedem Zeitpunkt eine signifikant höhere Viabilität, als die SFRP1-exprimierenden BFTC905 Zellen (24h p=0,005, 48h p=0,002, 72h p=0,009). Die Lumineszenzwerte stiegen über den 3-Tages-Zeitraum gesamt etwas an, das Verhältnis der transfizierten und der untransfizierten Zellen veränderte sich aber kaum (siehe Abb. 3-14A). Bei RT112 war keine signifikante Änderung der Viabilität zu beobachten. Nach 24 und 48 Stunden konnte noch eine geringfügig gesteigerte Viabilität der SFRP1- defizienten Zellen beobachtet werden. Nach 72 Stunden Inkubation kehrte sich dieser Trend um, blieb aber zu jedem Zeitpunkt im Rahmen der Standardabweichung (24h p=0,402, 48h p=0,566, 72h p=0,233, Abb. 14B). A Abbildung 3-14: Graphische Darstellung der Ergebnisse des Viabilitäts-Assays in BFTC905 (A) und RT112 (B) in Abhängigkeit der SFRP1-Expression. B Es kann also davon ausgegangen werden, dass der SFRP1 Knockdown in RT112 nicht zu einer Veränderung der Zell-Viabilität und des ATP-Stoffwechsels führte. In Tabelle 3-5 sind die geblankten Lumineszenz-Werte aufgelistet. 111
112 Ergebnisse Viabilität BFTC905 RT112 Lumineszenzwerte A2 Mock2 A1 Mock4 24h h h Tabelle 3-5: Auflistung der geblankten Lumineszenzwerte des Viabilitäts-Assays in RT112 und BFTC Bestimmung der SFRP1-abhängigen Proliferation (BrdU Assay) Der BRdU Assay diente dazu, eine SFRP1-vermittelte Änderung der Zellproliferation nachzuweisen. Bei BFTC905 zeigte sich kein signifikanter Unterschied zwischen der Proliferation der Wildtyp- und der transgenen Klone (24h, p=0,453, 48h p=0,156, 72h p=0,691). Mit fortschreitender Zeit, konnten lediglich abnehmende Absorptionswerte beobachtet werden (von ca. 1,3 bis 0,9). Bei RT112 war ebenfalls kein signifikanter Unterschied in der SFRP1-abhängigen Proliferation zu erkennen (24h p=0,896, 48h p=0,825, 72h p=0,27). A Abbildung 3-15: Graphische Darstellung der Ergebnisse des BrdU-Proliferations-Assays in BFTC905 (A) und RT112 (B) in Abhängigkeit der SFRP1-Expression. B 112
113 Ergebnisse Die Absorptionswerte blieben über die Zeit relativ konstant und schwankten zwischen etwa 1,7 und 2,1. In Abbildung 3-15 sind die Ergebnisse des Proliferations-Assays graphisch dargestellt. In Tabelle 3-6 sind die geblankten Absorptionswerte aufgelistet. Proliferation BFTC905 RT112 Absorptionswerte A2 Mock2 A1 Mock4 24h 1,264 1,281 1,753 1,739 48h 1,108 1,085 2,051 1,994 72h 0,916 0,867 1,879 2,054 Tabelle 3-6: Auflistung der geblankten Absorptionswerte des BrdU Assays in RT112 und BFTC Untersuchung des SFRP1-abhängigen Migrationsverhaltens mit dem Wound Scratch Assay Der Wound Scratch Assay wurde über 24 Stunden im Triplett-Ansatz durchgeführt. Es hat sich gezeigt, dass die SFRP1-defizienten RT112 Zellen um 20,5% schneller zugewachsen sind, als die RT112 Wildtyp Zellen mit SFRP1-Expression. Nach 24 Stunden waren bei RT112 Mock4 erst 41,6% des Spaltes zugewachsen, wobei es bei RT112 A1 bereits 62,1% waren. Das Ergebnis war allerdings nicht signifikant (p=0,127). Bei BFTC905 zeigte sich ein signifikanter Unterschied im Migrationsverhalten (p=0,021). Es konnte beobachtet werden, dass die SFRP1- defizienten Zellen nahezu doppelt so schnell zu einander migrierten, wie die SFRP1- exprimierenden Zellen. Dabei waren im Mittel nach 24 Stunden bei BFTC905 A2 erst 47,8% der Spaltfläche von einem Zellrasen bedeckt, wobei die Mock2 Zellen den Spalt nahezu komplett bedeckten (ca. 98% zugewachsenen Fläche). In Abbildung 3-16 ist jeweils ein exemplarisches Foto der Wundheilung von SFRP1-exprimierenden und SFRP1-defiziente Zellen zum Zeitpunkt 0 und nach 24 Stunden dargestellt. Die zugehörigen Balkendiagramme finden sich in Abbildung
114 Ergebnisse A B Abbildung 3-16: Exemplarische Dokumentation des Wound Scratch Assays in RT112 (A) und BFTC905 (B) in Abhängigkeit der SFRP1-Expression; bei BFTC905 ist ein deutlicher Unterschied im Wundheilungsverhalten innerhalb von 24 Stunden zu erkennen, Zellen mit SFRP1-Expression wachsen langsamer zusammen. A B Abbildung 3-17: Graphische Darstellung der Unterschiede im Migrationsverhalten von RT112 (A) und BFTC905 (B) mit und ohne SFRP1-Expression, in beiden Zelllininen konnte ein schnelleres Wachstum für SFRP1-defiziente Zellen beobachtet werden. 114
115 Ergebnisse Prospektive Untersuchung der Bedeutung der SFRP1 Expression in papillären Blasentumoren Um die Expression von SFRP1 in humanen Blasentumoren zu überprüfen, wurden 3 TMAs bestehend aus 143 papillären Urothelkarzinomen von 91 Patienten mit einem Antikörper gegen SFRP1 immunhistochemisch gefärbt. Um die Integrität der Daten zu überprüfen wurden die TMAs außerdem mit den krankheitsassoziierten Markern der Routine-Immunhistochemie P53, Ki67 und CK20 gefärbt. In Zusammenarbeit mit dem Tumorzentrum Erlangen wurden die Follow-up Daten der Patienten ermittelt. 17 der 91 Patienten sind während des Beobachtungszeitraumes verstorben, 9 davon direkt in Folge der Erkrankung. 40 Patienten wiesen ein oder mehrere Redizive auf, 14 zeigten eine Progression des Tumors und bei 8 Patienten sind Metastasen aufgetreten. Zur Auswertung der Progression wurden zunächst alle Patienten ausgewählt, bei denen mindestens ein Rezidiv zusätzlich zum Primärtumor aufgetreten war. Eine Erhöhung des Stadiums um mindesten eine Stufe bei mindestens einem der aufgetretenen Rezidive wurde als Progression gewertet. Eine kurze Zusammenfassung der Follow-up-Daten ist in Tabelle 3-7 abgebildet. 91 Patienten Rezidiv Progression Metastase Tod Ja Nein Gesamt Fehlend (k.a.) Dod Tabelle 3-7: Zusammenfassung der Follow-up Daten des papillären Tumorkollektivs, k.a. =keine Angaben, Dod = death of disease. Für die Auswertung der immunhistochemischen Färbungen wurden verschiedene Auswerteschemata angewendet. Bei P53, Ki67 und CK20 wurde die Prozentzahl der angefärbten Tumorzellen vom Pathologen (AH) angegeben. Bei SFRP1 wurde hingegen ein immunreaktiver Score (IRS) ähnlich dem Remmele Score bei der Brustkrebs-Diagnostik gebildet. Dabei wurde einerseits die Intensität der Färbung beurteilt (0=negativ, 1=schwach, 2=moderat, 3=stark) und gleichzeitig die Anzahl der angefärbten Tumorzellen in Prozent bestimmt. Aus den beiden Zahlenwerten wurde dann der Score berechnet. Dazu wurde den Prozentangaben nach folgendem 115
116 Ergebnisse Schema ein Zahlenwert zugeordnet: 0=0, 1=1-25%, 2=26-50%, 3=51-75%, 4=76-100%. Dieser Zahlenwert wurde dann mit dem Wert der Intensität multipliziert, so dass sich Werte von 0 bis 12 ergeben konnten; diese Werte entsprachen dem immunreaktiven Score (IRS). Bei unserem papillären TMA konnten 128 SFRP1- Färbungen ausgewertet werden. Bei 15 Stanzen war entweder kein Gewebe oder kein Tumor mehr vorhanden. 26 Stanzen hatten einen IRS von 0, 28 von 1, 40 von 2, 5 von 3, 19 von 4, 8 von 6, einer von 8 und einer von 9. Um die immunhistochemischen Daten mit den histopathologischen, sowie den Follow-up Daten zu korrelieren, wurde jeweils immer nur der Primärtumor des Patienten ohne zusätzliche Rezidive ausgewählt, sodass sich folgende Verteilung für die SFRP1- Färbung ergab: 86 der 91 Primärtumoren konnten ausgewertet werden. 19 Stanzen hatten einen IRS von 0, 20 von 1, 26 von 2, vier von 3, 13 von 4, drei von 6 und eine von 8. Fünf Stanzen enthielten entwender kein Gewebe oder keinen Tumor und konnte nicht analysiert werden. Für die Überlebenskurven und die statistischen Berechungen wurden geeignete Gruppen für jede immunhistochemische Färbung definiert. Bei SFRP1 wurden folgende Gruppen, angelehnt an den Median (2 ±1,7) gebildet: Gruppe 1 = IRS 0 und 1, Gruppe 2 = 2 bis 12. Für die Marker P53, Ki67 und CK20 wurden Gruppeneinteilungen gewählt, die bereits in der Literatur beschrieben wurden [116, 117]. Dabei wurde jeweils zwischen normaler und aberranter Expression unterschieden. Die Expression wurde als normal gewertet, wenn bei P53 weniger als 10%, bei Ki67 weniger als 15% und bei CK20 10% der Zellen gefärbt waren (entsprichet jeweils IHC-Gruppe 1). Gruppe 2 (aberrante Expression) setzte sich vice versa aus den Fällen zusammen, bei denen eine P53-Expression von 10%, eine Ki67-Expression von 15% oder eine CK20-Expression von >10% vorlag. Die Verteilung der verschiedenen IHC-Gruppen innerhalb der Primärtumore ist in folgender Tabelle 3-8 zusammengefasst. SFRP1 IRS k.a. n= Gruppen Gruppe 1 Gruppe 2 n= P53% 0 < k.a n=
117 Ergebnisse Gruppen Gruppe 1 Gruppe 2 n= Ki67% 0 < k.a n= Gruppen Gruppe 1 Gruppe 2 n= CK20% 0 < k.a n= Gruppen Gruppe 1 Gruppe 2 n= Tabelle 3-8: Ergebnisse der immunhistochemischen Begutachtung (IRS oder Prozentsatz der gefärbten Zellen) und Gruppeneinteilung des papillären Tumorkollektivs nach Färbung mit Antikörpern gegen SFRP1, P53, Ki67, CK20 Exemplarische Färbungen für jeden Marker sind in Abbildung 3-18 zu sehen. Auf der linken Seite sind jeweils die normalen bzw. schwachen Färbungen, auf der rechten Seite aberrante bzw. starke Färbungen dargestellt. Ki67 und P53 sind im Nukleus, CK20 und SFRP1 im Zytoplasma lokalisiert. Zum Nachweis der Datenintegrität wurden die Marker P53, Ki67 und CK20 mit dem jeweiligen Stadium und Tumorgrad korreliert (Chi-Quadrat-Test). Es zeigte sich in allen Fällen ein signifikanter Zusammenhang. So gingen ein höheres Stadium und ein höherer Grad auch mit einer aberranten Expression des Tumorsuppressors P53 (Stadium p=0,049, Grad p=0,012) und der Proliferationsmarker Ki67 (Stadium p=0,007, Grad p=0,00036) und CK20 (Stadium p=0,034, Grad p=0,004) einher. Die Integrität unserer Daten war somit gewährleistet und erlaubte eine tiefgreifendere Analyse. 117
118 Ergebnisse Abbildung 3-18: Exemplarische immunhisto-chemische Färbungen von Tumorarealen des papillären TMA mit Antikörpern gegen CK20, Ki67, P53 und SFRP1; in der linken Spalte sind die normalen bzw. schwachen Färbungen abgebildet, auf der rechten Seite sind Tumoren mit starker bzw. aberranter Proteinexpression dargestellt. 118
119 Ergebnisse Dazu wurden die immunhistochemischen Färbungen mit dem Überleben korreliert. Dabei wurde unterschieden zwischen Gesamtüberleben, rezidivfreiem Überleben, metastasefreiem Überleben und progressionsfreiem Überleben. Für jeden Marker wurde eine Kaplan-Meier-Analyse (Log-Rang-Test) und eine univariate Cox- Regression durchgeführt. Für SFRP1 konnte kein signifikanter Unterschied zwischen den beiden Gruppen IRS 0+1 und IRS 2 bis 12 gefunden werden. Für das Gesamtüberleben konnte dennoch ein Trend erkannt werden. So zeigten die Patienten mit SFRP1 positven Tumoren besseres Überleben (p=0,069), als die Patienten mit Tumoren mit Expressionsverlust. Letztere Gruppe hatte ein 2,7fach erhöhtes Risiko an dem Tumor zu versterben, als die IRS 2bis12 -Gruppe. Auch die Überlebenszeit unterschied sich sehr stark bei den beiden Gruppen. Die SFRP1-defiziente Gruppe lebte 97,8 Monate, wobei die SFRP1-exprimierende Gruppe 212,9 Monate mittlere Überlebenszeit aufwies. Hinsichtlich der Progression konnte kein signifikanter Unterschied zwischen den beiden Gruppen festgestellt werden (p=0,509). Doch auch hier lässt sich festhalten, dass die SFRP1-defiziente Gruppe eine geringere progressionsfreie-überlebenszeit aufwies (58,5Monate), als die SFRP1- exprimierenden Tumoren (154,1 Monate). Mittels Cox-Regression konnte ein 1,5faches Risiko für die SFRP1-defiziente Gruppe ermittelt werden. Bezüglich der anderen immunhistochemischen Marker konnten drei signifikante Unterschiede festgestellt werden. So zeigte sich, dass Tumoren mit aberranter Ki67- Überexpression kürzer Metastasen- (p=0,035) und progressionsfrei (p=0,047) blieben als Patienten mit normaler Expression. Auch Patienten mit CK20- Überexpression im Tumor zeigten eine signifikant höhere Progressionsneigung als die normale Gruppe (p=0,035). Die Graphen der Kaplan-Meier-Analysen und der Cox-Regression für SFRP1, P53, Ki67 und CK20 bezüglich Gesamtüberleben, rezidivfreiem Überleben, metastasefreiem Überleben und progressionfreiem Überleben sind in den Abbildungen 3-19 bis 3-22 zusammen gestellt. Abbildungen 3-19 bis 3-22 (S ): Kaplan-Meier-Analysen (A-D) und univariate Cox-Regression(E bis H) des papillären Tumorkollektivs für Gesamt- (A und E), Rezivivfreies- (B und F), Metastasefreies- (C und G) und Progressionsfreies (D und H) Überleben in Monaten in Korrelation mit der Expression von SFRP1 (3-18), P53 (3-19), Ki67 (3-20) und CK20 (3-21). 119
120 Abbildung 3-19: SFRP1 Ergebnisse A E B F C G D H 120
121 Abbildung 3-20: P53 Ergebnisse A E B F C G D H 121
122 Abbildung 3-21: Ki67 Ergebnisse A E B F C G D H 122
123 Abbildung 3-22: CK20 Ergebnisse A E B F C G D H 123
124 Ergebnisse In folgender Tabelle 3-9 sind die mittleren Überlebenszeiten, sowie die Risikowerte der verschiedenen Analysen dargestellt. Monate SFRP1 P53 Ki67 CK20 Gesamtüberleben Gruppe 1 97,8 186,2 233,6 112,6 Gruppe 2 212,9 161,4 132,6 192,1 Risiko 2,697 0,709 0,705 0,402 Rezidivfreies Überleben Gruppe 1 48,3 37,5 38,6 44,5 Gruppe 2 32,6 46,1 35,2 35,2 Risiko 0,65 1,424 1,48 1,118 Metastasefreies Überleben Gruppe 1 116,2 252,5 125,3 261,2 Gruppe 2 232,8 176,4 217,4 160 Risiko 1,96 0,341 0,137 0,366 Progressionsfreies Überleben Gruppe 1 58,5 152,9 94,2 227,6 Gruppe 2 154,1 101,7 118,2 78,1 Risiko 1,531 0,543 0,236 0,274 Tabelle 3-9: Auflistung der mittleren Überlebenszeiten in Monaten, sowie -Risikowerte des papillären Tumorkollektivs für die jeweils zwei Gruppen der SFRP1, P53, Ki67 und CK20-Färbungen. Im Anschluss wurde die SFRP1-Färbung mit Patientencharakteristika (wie Alter, Geschlecht), anderen immunhistochemischen Färbungen, sowie histopathologischen Parametern korreliert. Dabei zeigte sich lediglich mit dem Tumorgrad eine signifikante Assoziation (p=0,047, exakter Test nach Fisher, 2-seitige Signifikanz). Bei der Einteilung in die zwei immunhistochemischen Gruppen IRS0+1 und IRS2bis12, sowie in die beiden Gradierungen lg und hg zeigte sich eine konträre Verteilung. Zeigten in der IRS0+1-Gruppe nur 13 Tumoren (33,3%) eine low-grade, aber 26 Tumoren (66,6%) eine high-grade-differenzierung, so drehte sich diese Verteilung in der IRS2bis12 -Gruppe um. 25 Tumoren (56,8%) waren hier gut differenziert, wohingegen nur 19 Tumoren (43,2%) schlecht differenziert waren. Die Verteilung in den beiden Gruppen ist auch in Abbildung 3-23 dargestellt. 124
125 Ergebnisse Abbildung 3-23: Signifikante Korrelation der SFRP1 Expression und des Differenzierungsgrades beim papillären Tumorkollektiv: die Gruppe der Tumoren mit wenig oder nur ganz schwacher SFRP1-Expression wies mehr highgrade als low-grade Tumoren auf. Bei der Gruppe mit moderater oder starker SFRP1-Expression, wurden hingegen mehr low-grade-differenzierungen befundet. Um den Verlust der Expression mit einer Promotermethylierung zu korrelieren, wurden geeignete Tumorschnitte mikrodisseziert, daraus DNA isoliert und dann einer methylierungsspezifischen PCR unterzogen (exemplarisches Agarosegel in Abb. 3-24). Da für die DNA-Isolation ausreichend Gewebematerial vorhanden sein musste, reduzierte sich die Anzahl geeigneter Tumoren auf 99. Da die DNA-Qualität aus Paraffinmaterial nicht immer optimal ist und die Ergebnisse der MSP stark davon anhängen, wurden Qualitätskriterien definiert, die eine eindeutige Auswertung zuließen. Waren sowohl die methylierte, als auch die unmethylierte PCR negativ, das heißt, waren also keine Banden auf dem Gel zu sehen, wurde dieser Tumor von der Analyse ausgeschlossen. Waren beide PC-Reaktionen oder nur die methylierte MSP positiv, so wurde dies als Promoter-Methylierung gewertet. War nur die unmethylierte PCR positv, wurde der SFRP1 Promoter als nicht-methyliert gewertet. Von den 99 geeigneten Tumoren, wiesen lediglich 38 eine hinreichend gute Qualität auf, so dass der Methylierungsstatus analysiert werden konnte. 44,7% (17/38) der Tumoren zeigten eine Methylierung des SFRP1-Promoter, 55,3% (25/38) waren nicht-methyliert. Abbildung 3-24: Repräsentatives Gelbild der MSP-Analyse der papillären Tumoren; 44,7% der Tumoren zeigten eine Methylierung des SFRP1-Promotors (obere Reihe, M), bei 55,3% war der Promotor nicht methyliert (untere Reihe, UM). 125
126 Ergebnisse SFRP1-Expression in fortgeschrittenen Blasentumoren Um den SFRP1-Expressionsverlust auch in forgeschrittenen Harnblasentumoren zu untersuchen, wurden die TMAs eines Kollektivs mit lokal fortgeschrittenen Harnblasen-Karzinomen nach adjuvanter Chemotherapie angefärbt. Es konnten 242 Stanzen ausgewertet werden. Die Verteilung des IRS war wie folgt: 101 negative Tumoren, 68 mit IRS1, 51 mit IRS2, 17 mit IRS4, 3 mit IRS 6 und jeweils ein Tumor mit IRS 9 und 12. Zur Berechnung des SFRP1-bedingten Gesamtüberlebens und des progressionsfreien Überlebens wurden Gruppen bezüglich des IRS gebildet. Der Median der IRS-Werte lag bei 1 (±1,6). Um die fortgeschrittenen Tumoren besser mit den papillären vergleichen zu können, wurden allerdings die gleichen Gruppen gewählt, wie bei den papillären Tumoren( IRS 0 und 1, sowie IRS 2 bis 12 ). Zur Erstellung der Kaplan-Meier-Kurven (Abbildung 3-25) für das Gesamtüberleben und das progressionsfreie Überleben standen 202 auswertbare Tumoren zur Verfügung. Es konnte kein signifikanter Unterschied im Gesamtüberleben (p=0,579) und im progressionfreien Überleben (p=0,162) zwischen den immunhistochemischen Gruppen festgestellt werden. Von den 141 Patienten, die eine negative oder schwache SFRP1-Färbung aufwiesen zeigten 55 eine Progression der Erkrankung und 46 starben an ihren Folgen. Von den 61 Patienten, die hingegen eine moderate oder starke Färbung im Tumor aufwiesen, schritt die Erkrankung in 25 Fällen fort. 20 Patienten verstarben am Tumor. A B Abbildung 3-25: Bei der Kaplan-Meier-Analyse für das Gesamt- (A) und das progressionsfreie (B) Überleben bei den fortgeschrittenen Blasentumoren konnte kein signifikanter Unterschied zwischen Tumoren mit fehlender und schwacher bzw. mit moderater und starker Expression gefunden werden. 126
127 Ergebnisse Die bivariate Korrelation ergab auch keine signifikante Assoziation mit histopathologischen Parametern und Patientencharakteristika. 127
128 Ergebnisse 3.2 rs3242 und rs SNP-Analysen in SFRP Genotypisierung von humanen Blasentumoren mittels RFLP und Sequenzierung Für den SNP rs 3242 in SFRP1 wurden insgesamt 403 Tumorpatienten (188 aus einer konsekutiven Studie und 215 Patienten mit Krankheitsbeginn 45 Jahre) und 332 gesunde Kontrollen untersucht. Aufgrund der unterschiedlichen DNA- Verfügbarkeit konnte für den rs SNP nur noch 184 Patienten der konsekutiven Studie und 106 Early-Onset Patienten analysiert werden. Die stichprobenartige Verifizierung der RFLP-Analyse durch Sequenzierung zeigte 100%ige Übereinstimmung zwischen den beiden Methoden. Die Sequenzierungen konnten die Ergebnisse der RFLP-Analyse bestätigen. Repräsentative Ergebnisse der RFLP-Anayse sind in Abbildung 3-26 für rs3242 und 3-29 für rs921142, dazugehörige Sequenzen in Abbildung 3-27 für rs3242 und 3-30 für rs dargestellt. Die Genotypenverteilung in unserer Kohorte folgte dem Hardy-Weinberg-Equilibrium bei allen Blasenkrebsfällen (rs3242: p=0.3; rs921142: p=0.26), sowie bei allen individuellen Gruppen der konsekutiven Blasenkrebsfälle (rs3242: p=1.0; rs921142: p=0.17), der Early-Onset-Patienten (rs3242: p=0.21; rs921142: p=1.0) und der Kontrollen (rs3242: p=0.12; rs921142: p=0.42). Bei rs3242 zeigte sich ein auffälliger Unterschied in der Genotypenverteilung zwischen allen Blasenkrebsfällen und der Kontrollgruppe (p=0,05). Die Blasenkrebspatienten zeigten dabei ein erhöhtes Auftreten des heterozygoten Genotyps CT und ein vermindertes Auftreten des homozygoten Genotyps CC im Vergleich zur Kontrollgruppe (siehe Abbildung 3-28A). Das T-Allel trat signifikant häufiger bei den Krebspatienten auf, als bei der gesunden Gruppe (p=0.028, OR: 0.715, 95% CI: ). Beim Vergleich der Einzelgruppen (konsekutive Fälle gegen Early-Onset-Patienten gegen Kontrollen) konnte ebenfalls ein signifikanter Unterschied der Genotypenverteilung festgestellt werden (p=0,032), die mit einer gesteigerten Frequenz des T-Allels bei der Early- Onset-Gruppe einher ging (p=0.002, OR: % CI: ). Beim Vergleich von jeweils zwei individuellen Gruppen wurde der größte Unterschied zwischen den jungen Patienten und der Kontrollgruppe gefunden (p=0,007, siehe Abbildung 3-28B). Die Unterschiede zwischen Kontrollgruppe und der konsekutiven 128
129 Ergebnisse Studienkohorte (p=0,559), sowie zwischen Early-Onset- und konsekutiven Patienten (p=0,095) waren hingegen nicht signifikant. Ebenfalls nicht signifikant war die Assoziation der Allel-Verteilung zwischen rs3242 und dem Patientengeschlecht (p=0,211), sowie dem histopathologischen Stadium (p=0,776). Abbildung 3-26: Repräsentatives Gelbild der RFLP-Analyse des rs3242 SNP in SFRP1; je nach Genotyp können drei verscheidene Produkte auf dem Gel detektiert werden: CC = bp, TT = 137 bp, CT = bp (siehe Pfeile), Positivkontrolle: RT112 (CC), Negativkontrolle: Wasser. Abbildung 3-27: Repräsentative Sequenzen der rs3242 SNP-Analysen zur Verifizierung der mit Pfeilen markierten Proben aus Abb.3-40; es zeigte sich eine 100%ige Übereinstimmung beider Methoden. 129
130 Ergebnisse A B Abbildung 3-28: Verteilung der Genotypen des rs3242 SNP in Kontrollen und Tumorpatienten (A), sowie Verteilung des Risikoallels T in Kontrollen und Early-Onset-Patienten (B): es zeigte sich ein vermindertes Auftreten des CC-Genotyps bzw. ein erhöhtes Auftreten des CT+TT Genotyps in jungen Patienten in Vergleich zur gesunden Kontrollgruppe. Für rs wurde kein signifikanter Unterschied in der Genotypenverteilung zwischen Tumorpatienten und gesunden Kontrollen gefunden (p=0,306, siehe Abbildung 3-31). Auch beim Vergleich aller drei Gruppen untereinander (p=0,432) und bei Korrelation mit dem histopathologischen Stadium (p=0,317) konnte keine signifikante Assoziation mit einem erhöhten Risiko für Blasenkrebs nachgewiesen werden. Die Genotypenverteilung der beiden SNPs sind in den entsprechenden Tabellen im Anhang 9.6 und 9.7 zu sehen. 130
131 Ergebnisse Abbildung 3-29: Repräsentatives Gelbild der RFLP-Analyse des rs SNP in SFRP1; je nach Genotyp können drei verscheidene Produkte auf dem Gel detektiert werden: AA = 218 bp, GG = bp, AG = bp (siehe Pfeile), Positivkontrolle: BFTC905 (GG), Negativkontrolle: Wasser, aufgrund der ähnlichen Größe sind die beiden 104 und 114bp-großen DNA-Fragmente in einer Bande zu sehen. Abbildung 3-30: Repräsentative Sequenzen der rs SNP-Analysen zur Verifizierung der mit Pfeilen markierten Proben aus Abb.3-43; es zeigte sich eine 100%ige Übereinstimmung beider Methoden Abbildung 3-31: Verteilung der Genotypen des rs SNP in Kontrollen und Tumorpatienten; es konnte kein signifikanter Unterschied festgestellt werden. 131
132 Ergebnisse Auswirkung des rs3242 SNP auf die SFRP1-mRNA-Sekundärstruktur Die Analyse einer möglichen Genotyp-bedingten Änderung der mrna Sekundärstruktur mittels CONTRAfold Software konnte keine Unterschiede für die beiden Allel-Varianten von rs3242 feststellen. Die Ergebnisse können unter für das T-Allel und unter für das C-Allel eingesehen werden Expressionsanalyse von hsa-mir-603 und hsa-mir-3646 Um eine Erklärung für das gesteigerte Krankheitsauftreten bei jungen Patienten mit T-Allel in rs3242 zu finden, wurde die Bindefähigkeit von mikrornas an SFRP1- mrna in Abhängigkeit des Genotyps analysiert. Mit Hilfe von mirbase konnten zwei mikrornas identifiziert werden, die nur bei Anwesenheit eines T-Allels bindefähig waren: hsa-mir-603 (Chromosom 10p12.1: ) und hsa-mir-3646 (Chromosom 20q13.12: ). Die Ergebnisse können für mir-603 auf und für mir-3646 auf abgerufen werden. In Abbildung 3-32 sind die Bindemöglichkeiten der beiden mirnas der jeweiligen T-Variante des SNPs rs3242 im Vergleich zum C-Genotyp dargestellt. Nach der in silico Analyse wurde die Expression der beiden mikrornas mittels Quanta microrna Assay in den Blasenkrebszelllinien RT112, RT4, J82, BFTC905, sowie in UROtsa (normale Urothelzelllinie), einer primären urothelialen Zelllinie und außerdem in sieben Tumorproben untersucht. Um die mikrorna Expression zu normalisieren wurden die beiden endogenen Kontrollen RNU6 und SNORD44 verwendet. Die mikrorna-expression in RT112 und in Patient 1 wurde als 100% definiert. 132
133 Ergebnisse Abbildung 3-32: Veranschaulichung der möglichen Bindefähigkeiten von hsa-mir-603 und hsa-mir-3646 an der mrna von SFRP1 in Abhängigkeit des rs3242 Genotyps: in beiden Fällen scheint nur eine Bindung bei Anwesenheit des T-Allels möglich zu sein. Es zeigte sich, dass hsa-mir-3646 (C T -Werte 23,42 bis 27,62) im Vergleich zu hsamir-603 (C T -Werte>30) sowohl in den Zelllininen, als auch in den Tumorproben relativ hoch exprimiert wurde. Die Normalisierung mit zwei verschiedenen House- Keeping-non-coding RNAs brachte in einigen Fällen heterogene Ergebnisse, was darauf schließen lässt, dass mindestens eine Kontrolle genetisch reguliert wurde. Die höchste Expression von hsa-mir-3646 konnte jedoch trotzdem für beide Normalisierungen in BFTC905 beobachtet werden (6,7fach und 22,08fach höher als in RT112). Die zweithöchste Expression konnte, nach Normalisierung mit SNORD44 in normalem Urothel (Primärzelllinie) gemessen werden (20,59fach). Normalisierung mit RNU6 brachte hierfür eine nur 2fach erhöhte Expression, jedoch eine 6,13fach erhöhte Expression in UROtsa. RT112, RT4 und J82 wiesen sehr ähnliche aber auch die niedrigsten Expressionswerte um 100% (=1) auf. Die Patientenproben zeigten durchgehend eine ähnlich starke Expression mit Werten zwischen 0,324 (Patient 2) und 1,496 (Patient 4). 133
134 Ergebnisse A B C D Abbildung 3-33: Relative Quantifizierung der Expression von hsa-mir-3646 (A und B) und hsa-mir-603 (C und D) in den Zelllinine RT112, RT4, J82, BFTC905, UROtsa und in primärem Urothel; A und C Normalisierung mit RNU6, B und D Normalisierung mit SNORD44, hsa-mir-3646 wird am stärksten in BFTC905 exprimiert, hsa-mir- 603 wurde nur sehr wenig exprimiert, am meisten jedoch in UROtsa bzw RT4. Nach Normalisierung mit RNU6 konnte die stärkste hsa-mir-603 Expression in UROtsa gefolgt von RT4, RT112 und J82 nachgewiesen werden. In BFTC905 und primären Urothelzellen konnte hingegen eine nur sehr geringe Expression detektiert werden. Die Amplifikationsplots waren zudem sehr heterogen und die C T -Werte sehr hoch (>34), was eher auf einen Expressionverlust hindeutet. Nach Normalisierung mit SNORD44 konnte die höchste hsa-mir-603 Expression in RT4 Zellen (1,748fach höher als in RT112) und in BFTC905 (1,2fach höher) nachgewiesen werden. In den Patientengeweben konnte eine Expression nicht vor 35 PCR-Zyklen nachgewiesen werden, was ebenfalls auf eine sehr geringe 134
135 Ergebnisse Expression oder sogar Expressionsverlust hindeutet. Die höchste Expression war dennoch in Patient 3 (2,253fach bzw 1,499fach für RNU6 bzw. SNORD44) und Patient 2 (1,495fach für RNU6 und 1,106fach für SNORD44) zu beobachten. Die C T - Werte und Expressions-Ratios beider mikrornas, die sowohl mit RNU6 als auch mit SNORD44 normalisiert wurden sind in Tabelle 3-10 zu sehen. Eine graphische Darstellung der hsa-mir-3646 und hsa-mir-603 Expression in Zelllinien ist in Abbildung 3-33 und in Tumoren in Abbildung 3-34 dargestellt (jeweils normalisiert mit RNU6 und SNORD44). A B C D Abbildung 3-34: Relative Quantifizierung der Expression von hsa-mir-3646 (A und B) und hsa-mir-603 (C und D) in sieben willkürlich ausgewählten Blasentumoren; A und C Normalisierung mit RNU6, B und D Normalisierung mit SNORD44, hsa-mir-3646 wird in allen Tumoren exprimiert, hsa-mir-603 zeigt auch in den Tumoren nur eine sehr schwache Expression. 135
136 Ergebnisse Ct_3646 Ratio_3646 _RNU6 Ratio_3646 _SNORD44 Ct_603 Ratio_603_ RNU6 Ratio_603_ SNORD44 RT112 24, , RT4 24,96 0,77 0,96 30,75 1,508 1,748 J82 24,7 0,868 1,12 31,28 0,95 0,846 BFTC905 23,42 6,717 22,08 34,32 0,365 1,201 UROtsa 23,87 6,129 1,21 31,58 2,953 0,563 Urothel 25,47 2,146 20,59 37,15 0,064 0,755 Patient 1 26, , Patient 2 27,62 0,324 0,271 36,71 1,459 1,106 Patient 3 25,85 0,961 0,637 36,04 2,253 1,499 Patient 4 25,6 1,496 0, Patient 5 24,97 1,347 0,266 35,63 0,911 0,449 Patient 6 24,7 1,325 1,038 37,01 0,324 0,308 Patient 7 23,785 1,107 1,148 36,34 0,366 0,498 Tabelle 3-10: C T-Werte und Expressionsratien der beiden mikrornas hsa-mir-3646 und hsa-mir-603 in Zelllinien und Tumorproben Überexpression von hsa-mir-603 in RT112, RT4 und J82 Für die Zelllinien wurden im Anschluss die Genotypen von rs3242 bestimmt. RT112, BFTC905 und UROtsa zeigten einen homozygoten CC-Genotyp, J82 und normales Primärurothel einen homozygoten TT-Genotyp und RT4 eine heterozygote Allelverteilung. Ergebnisse der Genotypisierung sind in Abbildung 3-35 dargestellt. 136
137 Ergebnisse Abbildung 3-35: Genotypisierung der Zelllininen im rs3242 SNP; RT112, BFTC905 und UROtsa: CC, J82 und Urothel: TT, RT4: CT; 1=RT112, 2=RT4, 3=J82, 4=BFTC905, 5=UROtsa, 6=Urothel. Als repräsentative Zelllinie für jeden Genotyp wurden RT112, J82 und RT4 für die Überexpression von hsa-mir-603 ausgewählt. Das hsa-mir-603 Überexpressionsplasmid wurde in die Zellen transfiziert und Effekte auf die SFRP1- Expression wurden 24 und 48 Stunden nach Transfektion bestimmt. Es war zunächst auffällig, dass sich alle transfizierten RT4 Zellen nach 24 Stunden vom Flaschboden gelöst hatten und offensichtlich abgestorben waren. Untransfizierte und nur mit dem Transfektionsreagenz behandelten Zellen waren hingegen noch adhäriert und in gutem morphologischem Zustand. Um die Überexpression zu kontrollieren, wurde im Anschluss ein qrt-pcr basierter Quanta microrna Assay durchgeführt. Es zeigten sich wieder nicht ganz einheitliche Ergebnisse bei der Normalisierung mit RNU6 und SNORD44. Die deutlichste Heraufregulierung zeigte sich in beiden Fällen bei RT4, gefolgt von J82. Bei RT112 konnten eine nur sehr geringe Überexpression nachgewiesen werden (siehe Abbildungen 3-36 und 3-37). 137
138 Ergebnisse A B C D Abbildung 3-36: Kontrolle der Überexpression von hsa-mir-603 in RT112, RT4 und J82 mittels qrt-pcr; A Übersicht, B RT112, C RT4, D J82; Normalisierung mit RNU6. 138
139 Ergebnisse A B C D Abbildung 3-37: Kontrolle der Überexpression von hsa-mir-603 in RT112, RT4 und J82 mittels qrt-pcr; A Übersicht, B RT112, C RT4, D J82; Normalisierung mit SNORD44. In Abbildung 3-38 ist die relative Expression von SFRP1 in den drei Zelllinien RT112, RT4 und J82 nach hsa-mir-603 Expression zu sehen. In 3-52 D ist die SFRP1- Expression im Vergleich zur Positivkontrolle SK-Mel 28 abgebildet. Bei RT112 und J82 konnte keine hsa-mir-603 bedingte Änderung der SFRP1-Expression beobachtet werden. Lediglich bei RT4 kam es 24 Stunden nach der Überexpression zu einer erhöhten Expression von SFRP1. 139
140 Ergebnisse A B C D Abbildung 3-38: Untersuchung der Auswirkung der hsa-mir-603 Überexpression auf die SFRP1-Expression in RT112, RT4 und J82; A J82, B RT4, C RT112, D Übersicht mit Positivkontrolle SK-Mel
141 Ergebnisse 3.3 Deletionsmapping von Chromosom 8p mittels acgh Vergleichende genomische Hybrisisierung Um neue Progressions-assoziierte Gene auf Chromosom 8p zu finden, wurden 19 papillären Blasentumoren mittels Genome-Wide SNP Array 6.0 von Affymetrix analysiert und die Daten mit der Software Genotyping Console von Affymetrix ausgewertet. Die Software kann gesamtgenomische Veränderungen, wie Deletionen (rote Dreiecke) und Amplifikationen (blaue Dreiecke), sowie den Kopienzahl-Status (CNV, copy number variation) aller untersuchten Proben im Vergleich zum Referenzgenom (167 gesunde Kontrollen) anzeigen. Ein Dreieck entsprach dabei einem Gewinn oder Verlust genetischen Materials mit einer Größe von mindestens 500kb. Viele untereinander gereihte Dreiecke sprachen für den Zugewinn bzw. den Verlust eines ganzen Chromosomen-Arms. In Abbildung 3-39 ist je ein exemplarisches Karyogramm von einem nicht-invasiven (A) und einem invasiven (B) papillären Tumor dargestellt. Es fällt auf, dass der pta-tumor weniger gesamtgenomische Veränderungen aufwies, als der pt1-tumor. Der nicht-invasive Tumor wies lediglich drei größere Veränderungen auf, nämlich zwei Amplifikationen (auf Chromosom 1q und Chromosom 15q) sowie eine Deletion auf Chromosom 9q. Beim invasiven pt1-tumor war hingegen eine deutlich erhöhte Frequenz an Chromosomen-Veränderungen zu erkennen: 12 Chromosomen zeigten den Zugewinn oder den Verlust von Chromosomen-Abschnitten. Auch im Vergleich aller Tumoren fiel auf, dass die pta-tumoren insgesamt weniger Alterationen zeigten, als pt1-tumoren. Vier der invasiven Tumoren konnten auf nahezu jedem Chromosom eine Veränderung vorweisen. Diese Beobachtung deckt sich mit der allgemein gültigen Tatsache, dass Tumoren umso aggressiver, also auch invasiver werden, je mehr chromosomale Veränderungen im Genom des Tumors zu finden sind. Die einzelnen Karyogramme aller Tumoren finden sich im Anhang 9.4. Im Vergleich zu aktuellen Literatur-Daten lassen sich viele Übereinstimmungen mit dort beschriebenen Chromosomen-Aberrationen finden: Eine der häufigsten Aberrationen in pta-tumoren ist der Verlust des kurzen Arms von Chromosom 9 (9p) [118]. Von den hier untersuchten neun pta-tumoren wiesen drei einen kompletten Verlust des p-arms auf, bei allen sechs anderen war immer zumindest ein Teil verloren gegangen. 141
142 Ergebnisse A B C D E F Abbildung 3-39 (S.129): Ergebnisse der vergleichenden gesamtgenomischen Hybridisierung (acgh) von 9 pta und 10 pt1 Tumoren; A und B zeigen je ein repräsentatives Karyogramm von einem pta (A) und einem pt1 (B) Tumor, chromosomale Deletionen sind in rot, Amplifikationen in blau dargestellt; in C und D ist das Chromosom 8 in horizontaler Ausrichtung von allen pta (C) und pt1 (D) Tumoren abgebildet, die nicht-invasiven Tumoren weisen viel weniger genomische Veränderungen auf, als die invasiven Tumoren; auf Chromosom 8p dominieren Deletionen, auf 8q hingegen Amplifikationen; E unf F zeigen einen Abschnitt auf 8p22, in dem das Gen MTUS1 liegt; nur ein nicht-invasiver, aber schon fünf invasive Tumoren weisen hier eine Deletion auf. Ebenfalls häufig beschrieben in pta-tumoren sind (Teil-) Verluste des langen Arms von Chromosom 9 (9q) [119]. Auch das kann bei der Betrachtung der neun analysierten pta-tumoren bestätigt werden, in drei von neun Fällen war der 142
143 Ergebnisse komplette Verlust des q-arms zu beobachten; vier weitere Tumoren zeigten einen Teil-Verlust. Der von Blaveri et al. beschriebene häufig beobachtete Verlust von Abschnitten auf dem kurzen Arm von Chromosom 17 (17p) [119] kann ebenfalls in unseren Tumoren bestätigt werden. In vielen Fällen ist dabei das Tumorsuppressor-Gen P53 betroffen, dessen Veränderungen beim Harnblasenkarzinom von prognostischer Bedeutung sind [120]. Nur ein pta-tumor zeigte den Verlust von P53, wohingegen das Gen bei drei der zehn invasiven pt1-tumoren fehlte. Somit kann die Tatsache, dass Veränderungen in diesem Tumorsuppressor-Gen mit dem invasiven Phänotyp und somit einer schlechteren Prognose assoziiert ist, bestätigt werden. Auch in Bezug auf den Zugewinn von Chromosomen-Abschnitten können unsere Daten Übereinstimmungen mit in der Literatur beschriebenen Veränderungen nachweisen: Eine der meist genannten Aberrationen in pt1-tumoren betrifft den langen Arm von Chromosom 8 (8q) [118]. Dabei ist oft das Onkogen CMYC (lokalisiert auf 8q24) betroffen [121], wobei Veränderungen in der Kopienzahl dieses Gens nicht die Prognose von Harnblasenkrebs-Patienten betreffen. Vielmehr stehen Zugewinne von CMYC wohl mit genetisch instabilen Tumoren, die durch einen hohen histologischen Grad und/oder invasives Wachstum gekennzeichnet sind, in Zusammenhang [122]. Die hier untersuchten zehn pt1-tumoren wiesen bezüglich Chromosom 8q in drei Fällen einen Zugewinn des gesamten langen Arms, in drei weiteren Fällen einen teilweisen Zugewinn, der jeweils als ein blaues Dreieck dargestellt wird, auf. Auch der in der Literatur beschriebene, Chromosom 17qbetreffende Zugewinn [118], konnte in drei Fällen durch den kompletten, in fünf weiteren durch den partiellen Zugewinn des Chromosomen-Arms bestätigt werden. Die gute Übereinstimmung der acgh-ergebnisse unserer 19 untersuchten Harnblasenkarzinome mit den Literatur-Daten bestätigt die Integrität und Validität unserer Daten und erlaubt somit eine tiefer gehende Analyse und Interpretation. Da in der Vergangenheit viele Arbeitsgruppen und auch Vorarbeiten in unserer eigenen Arbeitsgruppe darauf hinwiesen, dass chromosomale Verluste auf Chromosom 8p mit einer Progression der Blasenkrekserkrankung assoziiert sind, lag der Fokus unserer Untersuchungen auf 8p. In Abbildung 3-39 C und D ist das gesamte Chromosom 8 in längs-liegender Ansicht für die 9 pta (C) und die 10 pt1 (D) Tumoren dargestellt. 143
144 Ergebnisse Bei dieser Ansicht ist zu beachten, dass Zugewinne bzw. Verluste von Chromosomen-Abschnitten bereits ab einer Größe von 100 kb angezeigt werden. Es fiel auf, dass die invasiven Tumoren deutlich mehr Veränderungen auf Chromosom 8 zeigten als die nicht-invasiven Tumoren. Während bei den pta- Tumoren vereinzelt kleine Chromosomen-Abschnitte fehlten oder amplifiziert waren, zeigten die pt1-tumoren teilweise Zugewinne oder Verluste ganzer Chromosomen- Arme. Beispielsweise schien der kurze Arm bei sechs der zehn pt1-tumoren nahezu vollständig deletiert zu sein. Drei Tumoren zeigten einen nahezu kompletten Zugewinn des q-arms, bei drei weiteren Fällen lag zumindest ein Teil in erhöhter Kopienzahl vor. In Abbildung 3-39 E und F ist ein Bereich auf Chromospm 8p22 (Position ), dargestellt, bei dem eine Mikrodeletion in einem pta Tumor (E) gefunden wurde (1/9 Tumoren, entspricht 11%). Nach unserer Vermutung, könnte diese Mikrodeletion einen Hinweis auf maligne Progression darstellen. Bei den pt1 Tumoren (F) war der Bereich schon häufiger, nämlich bei fünf von zehn Tumoren (50%) deletiert. Um neue potenzielle progressionsrelevante Kandidaten-Gene zu identifizieren, wurden im Folgenden alle in den pta-tumoren auftretenden Mikro-Amplifikationen und -Deletionen mit den entsprechenden Regionen in den pt1-tumoren verglichen. Im Anschluss daran wurde untersucht, welche Gene in den betroffenen Regionen liegen und ob diese in der Literatur bereits bekannt und mit einer bestimmten Krebs- Erkrankung assoziiert sind. Folgende Tabelle 3-11 zeigt alle Refseq-Gene, die durch eine pta-mikroaberration betroffen waren. Nicht erwähnt werden dabei die nicht-kodierenden Bereiche. Die grau-weiße Abstufung zeigt an, dass es sich um eine zusammenhängende Deletion oder Amplifikation handelt. Man erkennt, dass manche copy number-variationen eine ganze Fülle von Genen betreffen, andere lediglich nur ein Gen (Mikrodeletion), wie z.b. GFRA2 oder UNC5D. 144
145 Ergebnisse Gen (Refseq) Region Mikrodeletion/- amplifikation Tumor or4f21 8p23.3 Deletion pta3 defb103a 8p23.1 Amplifikation pta4 defb103b 8p23.1 Amplifikation pta4 spag11b 8p23.1 Amplifikation pta4 defb104a 8p23.1 Amplifikation pta4 defb104b 8p23.1 Amplifikation pta4 defb106a 8p23.1 Amplifikation pta4 defb106b 8p23.1 Amplifikation pta4 defb105a 8p23.1 Amplifikation pta4 defb105b 8p23.1 Amplifikation pta4 defb107a 8p23.1 Amplifikation pta4 defb107b 8p23.1 Amplifikation pta4 spag11a 8p23.1 Amplifikation pta4 defb103a 8p23.1 Amplifikation pta4 defb103b 8p23.1 Amplifikation pta4 defb4 8p23.1 Amplifikation pta4 fam86b1 8p23.1 Amplifikation pta3 defb1130 8p23.1 Amplifikation pta3 mtmr7 8p22 Deletion pta7 slc7a2 8p22 Deletion pta7 pdgfrl 8p22 Deletion pta7 MTUS1 8p22 Deletion pta7 fgl1 8p22 Deletion pta7 pcm1 8p22 Deletion pta7 gfra2 8p21.3 Deletion pta7 xpo7 8p21.3 Deletion pta7 npm2 8p21.3 Deletion pta7 epb49 8p21.3 Deletion pta7 fam160b2 8p21.3 Deletion pta7 nudt18 8p21.3 Deletion pta7 hr 8p21.3 Deletion pta7 reep4 8p21.3 Deletion pta7 lgi3 8p21.3 Deletion pta7 sftpc 8p21.3 Deletion pta7 bmp1 8p21.3 Deletion pta7 phyhip 8p21.3 Deletion pta7 polr3d 8p21.3 Deletion pta7 piwil2 8p21.3 Deletion pta7 slc39a14 8p21.3 Deletion pta7 ppp3cc 8p21.3 Deletion pta7 sorbs3 8p21.3 Deletion pta7 pdlim2 8p21.3 Deletion pta7 kiaa1967 8p21.3 Deletion pta7 bin3 8p21.3 Deletion pta7 egr3 8p21.3 Deletion pta7 pepb4 8p21.3 Deletion pta7 rhobtb2 8p21.3 Deletion pta7 tnfrsf10b 8p21.3 Deletion pta7 tnfrsf10c 8p21.3 Deletion pta7 tnfrsf10d 8p21.3 Deletion pta7 tnfrsf10a 8p21.3 Deletion pta7 chmp7 8p21.3 Deletion pta7 loxl2 8p21.3 Deletion pta7 145
146 Ergebnisse entpd4 8p21.3 Deletion pta7 slc25a37 8p21.2 Deletion pta7 nkx3-1 8p21.2 Deletion pta7 stc1 8p21.2 Deletion pta7 adam28 8p21.2 Deletion pta7 adamdec1 8p21.2 Deletion pta7 adam7 8p21.2 Deletion pta7 nefm 8p21.2 Deletion pta7 nefl 8p21.2 Deletion pta7 dock5 8p21.2 Deletion pta7 kctd9 8p21.2 Deletion pta7 cdca2 8p21.2 Deletion pta7 ebf2 8p21.2 Deletion pta7 ppp2r2a 8p21.2 Deletion pta7 bnip3l 8p21.2 Deletion pta7 pnma2 8p21.2 Deletion pta7 dpysl2 8p21.2 Deletion pta7 adra1a 8p21.2 Deletion pta7 unc5d 8p12 Deletion pta7 Tabelle 3-11: Auflistung aller durch Mikroaberrationen betroffenen Gene in pta-tumoren, die grau-weiß- Abstufung zeigt an, dass es sich um eine zusammenhängende Deletion oder Amplifikation handelt; das von uns für funktionelle Versuche ausgewählte Zielgen, MTUS1, ist in rot markiert. Die meisten Veränderungen traten bei Tumor pta_7, gefolgt von pta_3 auf. Diese beiden Tumoren waren auch die einzigen nicht-invasiven Tumoren, die überhaupt eine Deletion aufwiesen. Das auffälligste Merkmal der neun pta-tumoren war jedoch eine Mikroamplifikation auf 8p , die bei sechs der neun Tumoren auftrat (pta1, 3, 5, 6, 7, 8), jedoch aber nur eine nicht-kodierende Region betraf, die zwischen den beiden Genen ADAM32 und ADAM18 liegt (siehe Abbildung 3-40). Abbildung 3-40: Darstellung der auffälligen Mikroamplifikation von sechs pta-tumoren auf Chromosom 8p; die Amplifikation liegt zwischen den beiden Genen ADAM32 und ADAM18, betrifft selbst jedoch scheinbar nur einen nicht-kodierenden Bereich. 146
147 Ergebnisse Eine genauere Betrachtung der bereits erwähnten, deletierten Region auf Chromosom 8p22 (3-25 E und F), konnte folgende Zielgene identifizieren: SLC7A2 (= solute carrier family 7, member 2), PDGFL (= platelet-derived growth factor receptor-like), MTUS1 (= microtubule associated tumor suppressor 1), FGL1 (= fibrinogen-like 1) und PCM1 (= pericentriolar material 1). Die Deletionen in dem Bereich gingen in jedem Fall mit einer Verringerung der Kopienzahl auf nurmehr eine Kopie einher (CN =1). Ein kompletter Verlust (CN=0) dieser Chromosomenregion war jedoch nicht zu verzeichnen. Das vielversprechendste Gen schien uns dabei aber MTUS1 zu sein. MTUS1 wird in der Literatur als möglicher Tumorsuppressor beim Pankreas- [123], Ovarial- [124], Kolon- [125] und beim Mammakarzinom [126] beschrieben. Eine Assoziation von MTUS1 mit dem Harnblasenkarzinom ist nach unserem Kenntnisstand noch nicht nachgewiesen worden. Basierend auf der bekannten Assoziation des Gens mit anderen Tumor-Erkrankungen wurde MTUS1 von unserer Arbeitsgrupe als erstes mögliches Progressions-assoziiertes Zielgen der acgh-untersuchung ausgewählt und im Anschluss eingehend beim Harnblasenkarzinom untersucht. Bei der Untersuchung des Kandidatengens SFRP1 zeigte sich keine Veränderung der Kopienzahl des DNA-Abschnittes in den pta-tumoren. Bei den pt1 Tumoren zeigten zwei Fälle eine Deletion und ein Fall eine Amplifikation im entsprechenden Genlokus (siehe Abbildung 3-41). Die Deletionen gingen jeweils mit einer Verringerung der Kopienzahl auf eine Genkopie, die Amplifikation mit einer Erhöhung der Kopienzahl auf drei Genkopien einher. Bei allen anderen Tumoren konnten zwei SFRP1-Allele (Diploidie) nachgewiesen werden. 147
148 Ergebnisse A B Abbildung 3-41: Darstellung der genetischen Veränderungen am SFRP1 Lokus auf Chromosom 8p bei den pta (A) und den pt1 (B) Tumoren nach acgh; in pta Tumoren konnten keine Aberrationen nachgewiesen werden, bei pt1 Tumoren konnte in zweien eine Deletion und bei einem Tumor eine Amplifikation detektiert werden Cluster-Analyse Vor der funktionellen Untersuchung des MTUS1-Gens wurde zunächst noch eine Cluster-Analyse der 19 Tumoren durchgeführt. Es sollte untersucht werden, ob sich die nicht-invasiven pta-tumoren und die invasiven pt1-tumoren anhand ihrer chromosomalen Veränderungen in zwei Gruppen einteilen ließen; außerdem war dies eine weitere Möglichkeit, die Integrität unserer Daten zu prüfen. Zunächst wurden alle Amplifikationen und Deletionen, die größer als kb waren, erfasst und in eine Liste eingetragen (siehe Anhang). In Zusammenarbeit mit dem Core Unit Z3 Affymterix-Chip-Analysen konnten dann anhand des Kopienzahl-Status der einzelnen Amplifikationen und Deletionen so genannte Pseudo-Marker generiert werden. Für die endgültige Clusterung wurden die 19 besten diskriminierenden Marker verwendet (siehe Tabelle im Anhang 9.5). Abbildung 3-42 zeigt das Ergebnis der durchgeführten Analyse in Form einer Heatmap. Die Spalten entsprechen den einzelnen Tumoren, zeilenweise sind die verwendeten Marker dargestellt. Die dargestellten Farben stehen für Genom-Amplifikationen (grün) bzw. -Deletionen (rot) 148
149 Ergebnisse an der Stelle des entsprechenden Markers; die Farbabstufungen kommen durch die unterschiedliche Kopienzahl zustande. Es lässt sich beobachten, dass sich die 19 Tumoren sehr gut in zwei Untergruppen einteilen lassen. Nur jeweils ein pta- und ein pt1-tumor fallen aus der Reihe (Pfeile). Abbildung 3-42 : Heatmap der Cluster- Analyse. Die verwendeten Abkürzungen ninv (nicht-invasiv, pta) bzw. inv (invasiv, pt1) bezeichnen die einzelnen Tumoren. Nur jeweils ein nicht-invasiver (hellblauer Pfeil), sowie ein invasiver Tumor (dunkelblauer Pfeil) weicht von den anderen ab. Die Farben grün und rot stellen Genom-Amplifikationen bzw. - Deletionen der entsprechenden Marker dar Mutations-Analyse in FGFR3 und PIK3CA Wie in der Einleitung bereits erwähnt, sind pta-tumoren (im Gegensatz zu invasiven pt1-tumoren) häufig mit Mutationen im FGFR3-Gen assoziiert. Auch Veränderungen im PIK3CA-Gen lassen sich nicht selten in nicht-invasiven Tumoren nachweisen. Im Rahmen der Dissertation wurden die 19 in der acgh analysierten 149
150 Ergebnisse Tumoren auf Mutationen in diesen beiden Genen untersucht, um zu überprüfen, ob sich die angegebenen Literatur-Daten in unseren Tumoren bestätigen lassen. Zur Auswertung der erhaltenen Ergebnisse bezüglich FGFR3-Mutationen diente das in Abbildung 3-43 dargestellte Schema. In dieser Darstellung ist schematisch der Teil des Gens zu sehen, in dem sich die bekannten Mutationen befinden; die ausgefüllten Peaks symbolisieren Basen der Wildtyp-Sequenz, nicht-ausgefüllte, leere Peaks stellen schematisch die möglichen Mutationen dar. Abbildung 3-43: Schematische Darstellung des partiellen FGFR3-Gens mit allen bekannten Mutationen, dargestellt als leere Peaks und mit der Bezeichnung der jeweiligen Mutation. Ausgefüllte Peaks symbolisieren die Basen der Wildtyp-Sequenz. Die Basen werden durch die folgenden Farben dargestellt: A = grün; C = schwarz; G = blau; T = rot. Abbildung aus. Die durchgeführten Mutations-Analysen lieferten folgendes Ergebnis: Acht der neun pta-tumoren wiesen eine Veränderung im FGFR3-Gen auf, fünf davon die Mutation S249C. Jeweils einmal konnten die Mutationen Y375C, A393E und K652E nachgewiesen werden. Von den pt1-tumoren zeigten nur drei eine Mutation im FGFR3-Gen, es handelte sich dabei immer um die S249C Mutation (siehe Abbildung 3-44). 150
151 Ergebnisse Abbildung 3-44: Repräsentative Sequenzen von FGFR3 mit den verschiedenen aufgetretenen Mutationen (Pfiel); A zeigt die am häufigsten (u.a. in Tumor pt1_9) gefundene Mutation S249C. Die Mutationen Y375C (B; in pta_8), 393E (C; in pta_5) und K652E (D; in pta_6) wurden jeweils einmal beobachtet. Für die Auswertung der Mutationen im PIK3CA-Gen diente das in Abbildung 3-46 dargestellte Schema der möglichen Sequenzierungs-Ergebnisse als Vorlage [127]. Innerhalb der 19 untersuchten Tumoren wurden bei einem pta-tumor sowie bei drei pt1-tumoren Mutationen gefunden. Der nicht-invasive Tumor zeigte die Mutation H1047R (siehe Abbildung 3-45A), während die invasiven Tumoren alle drei die Mutation E545K aufwiesen (siehe Abbildung 3-45B). Abbildung 3-45: Repräsentative PIK3CA Sequenzen mit aufgetretenen Mutationen (Pfeile). Bild A zeigt die Mutation H1947R in einem pta-tumor, Bild B die in drei pt1-tumoren detektierte Mutation E545K. 151
152 Ergebnisse Abbildung 3-46: Mögliche Ergebnisse einer Mutations-Analyse im PIK3CA-Gen: Abbildung A zeigt die Wildtyp- Sequenz, die orangefarbenen Peaks repräsentieren den internen Genescan-LIZ-Standard. Die Basen werden durch die folgenden Farben dargestellt: A = grün; C = schwarz; G = blau; T = rot. Bilder B-E zeigen die möglichen Mutationen E542K (B), E545G (C), E545K (D) und H1047R (E) [127]. 152
153 Ergebnisse 3.4 Untersuchung der MTUS1-Expression bei Blasenkrebs MTUS1-Expression in Harnblasenkarzinom-Zelllininen Um den Zusammenhang zwischen einer MTUS1-Expression und Blasenkrebs zu untersuchen, wurden zunächst die vier Blasenkarzinom-Zelllinine RT112, RT4, J82 und BFTC905, sowie die beiden Urothelzelllinine HCV29 und UROtsa mittels qrt- PCR, Immunhistochemie und Westernblot auf die Expression von MTUS1 gescreent. LNCaP, eine Prostatakarzinom-Zelllinie, in der der mikrotubulus-assoziierte Tumorsuppressor 1 bereits nachgewiesen wurde [128], wurde als Positivkontrolle mitgeführt. Als Erstes wurde die MTUS1-Expression auf mrna-level untersucht. Dazu wurde die RNA aus den Zelllinine isoliert, daraus cdna synthetisiert und dann mit MTUS1-spezifischen Primern (die alle Isoformen berücksichtigen) in der SYBR Green-basierten quantitativen Real-Time PCR eingesetzt. Zur Auswertung erfolgte eine relative Quantifizierung mittels ΔΔC T -Methode und Normalisierung am House Keeping Gen GAPDH. Als Referenz-Zelllinine wurde RT112 definiert, deren Expressionsstatus auf 100%, bzw. den Wert 1 festgelegt wurde und mit der alle anderen Proben verglichen wurden. Abbildung 3-47 zeigt die Ergebnisse der qrt-pcr. Die Prostatakarzinom-Zelllinie LNCaP wies insgesamt die höchste und eine etwa 20fach höhere MTUS1- Expression auf, als RT112. Die Zelllinien UROtsa, RT4 und BFTC905 zeigten eine fünf- bis achtfach erhöhte Expression von MTUS1 im Vergleich zu RT112, während die Expression in J82- und HCV29-Zellen ebenfalls bei etwa 1 lag. Abbildung 3-47: Relative Expression (RQ = relative quantification) von mtus1 in den untersuchten Zelllinien im Vergleich zur Positivkontrolle LNCaP; RT112 wurde als 100% definiert. 153
154 Ergebnisse Im Anschluß an die Analyse der MTUS1-mRNA-Expression, wurde die Expression auch auf Protein-Ebene untersucht. Dazu wurde ein Westernblot mit einem Antikörper gegen das MTUS1-Protein durchgeführt (siehe Abbildung 3-34). In Tabelle 3-12 sind die verschiedenen Isoformen von MTUS1, sowie die zugehörigen Transkriptvarianten mit Basenpaar- und Aminosäurelänge aufgelistet. Das Molekulargewicht wurde anhand eines mittleren Gewichtes von 112 Dalton pro Aminosäure errechnet. Aufgrund der Schwankungen des Molekulargewichts der einzelnen Aminosäuren stellen diese Werte jedoch nur einen Anhaltspunkt dar und geben das tatsächliche Gewicht wahrscheinlich nicht exakt wider. MTUS1-Isoform Protein-Alias mrna Protein Molekulargewicht 1 ATIP3a 6435bp 1270 aa 142 kda 2 ATIP3b 6273bp 1216 aa 136 kda 3 ATIP4 4022bp 517 aa 58 kda 4? 2667bp 415 aa 46 kda 5 ATIP1 3819bp 436 aa 49 kda 6 ATIP2 2787bp 770 aa 86 kda 7? 3160bp 342 aa 38 kda 8 ATIP3b 6256bp 1216 aa 136 kda Tabelle 3-12: Eigenschaften der verschiedenen MTUS1-Isoformen. Die in fast allen Spuren auf Höhe von etwa 60 kda sichtbare Bande entspricht der Isoform 3 von MTUS1, die auch als ATIP4 bezeichnet wird. Die Prostatakarzinom- Zelllinie LNCaP zeigte die stärkste Expression, gefolgt von HCV29 und UROtsa. Alle anderen Zelllinien exprimierten diese Isoform schwach (J82, BFTC905, RT4) bis kaum (RT112). Die für die Harnblase spezifische Isoform ATIP3 [129] besitzt ein Molekulargewicht von etwa 140 kda (142 kda für ATIP3a und 136 kda für ATIP3b) und ist als oberste Bande zu erkennen (siehe Pfeil in Abbildung 3-48). Sie wurde allerdings nur in den Zelllinien LNCaP und BFTC905 und schwach in RT112, J82 und UROtsa exprimiert. In RT4 und HCV29 fehlte die Expression dieser Isoform. Zwischen den beiden Banden von ATIP3 und ATIP4, auf Höhe von etwa 80 kda ist, besonders in der Zelllinie RT4, eine weitere dominante Bande zu sehen. Dabei handelte es sich wahrscheinlich um ATIP2 bzw. die Isoform 6 von MTUS1, die aus 154
155 Ergebnisse 2787 Basenpaaren und 770 Aminosäuren besteht. Die nachfolgende Behandlung der Membran mit einem Antikörper gegen ß-AKTIN zeigte eine gleichmäßige Expression des House-Keeping Gens (HKG) (Abbildung 3-48B) und bestätigt so die Integrität unserer Daten. Abbildung 3-48: Nachweis von MTUS1 (A) mittels Westernblot in den Zelllinine HCV29, RT112, J82, BFTC905, RT4, UROtsa; LNCaP diente als Positivkontrolle; es sind verschiedene Isoformen zu erkennen; ß-AKTIN diente als endogene Kontrolle und konnte in allen Zelllinein gleichmäßig nachgewiesen werden (B); die Belichtungszeit betrug drei Minuten (für MTUS1) bzw. 40 Sekunden (für ß- AKTIN), blank= Lysepuffer MTUS1-Expression in Tumorgewebe Um die MTUS1-Expression auch in Patientenmaterial zu überprüfen, wurde zunächst eine kleine Kohorte von 6 primären Harnblasentumoren mittels qrt-pcr und Westernblot untersucht. In der quantitativen Realtime-PCR wurden die Proben wieder mit dem HKG GAPDH normiert, RT112 wurde wieder als Referenzprobe und LNCaP als Positivkontrolle mitgeführt. Die Tumorproben zeigen alle eine deutlich höhere MTUS1-Expression, als RT112. Den höchsten Wert erzielte dabei Tumor- Probe 6 mit einer 50fach erhöhten MTUS1-Expression. Die Proben 1, 2, 3, 5 und 6 zeigen sogar höhere Werte, als die Postivkontrolle LNCaP. Die Ergebnisse der qrt- PCR sind graphisch in Abbildung 3-49 dargestellt. 155
156 Ergebnisse Abbildung 3-49: Relative Expression (RQ) von MTUS1 in den untersuchten Tumoren im Vergleich zur Positivkontrolle LNCaP, RT112 wurde als 100% definiert; alle Tumoren haben MTUS1 auf mrna-ebene exprimiert. In der Westernblotanalyse konnte aufgrund der niedrigen Protein-Konzentrationen der einzelnen Tumor-Proben nur eine relativ geringe Protein-Menge (15 μg) eingesetzt werden. Die Positiv-Kontrolle LNCaP zeigte, wie auch im vorherigen Blot, auf Höhe von 60 kda die deutlichste Bande und zwei schwache Banden bei ca. 140 und 75 kda. Bei der Analyse der Tumorproben fiel auf, dass insgesamt nur sehr schwache MTUS1-Banden zu sehen waren. Die Banden der beiden Isoformen 1/ATIP3 (ca. 140 kda) und 3/ATIP4 (ca. 60 kda) fehlten komplett. Nur die Isoform 6/ATIP2 (ca. 80 kda) schien bei den Proben 1 und 3 präsent zu sein. Bei den anderen Tumoren ließ sich diese lediglich erahnen. Außerdem fiel auf, dass die Tumoren 2 bis 6 ein ganz schwaches Signal bei ca. 50 kda zeigten. Dabei könnte es sich um die Isoform 5 (ATIP1) handeln, die ein Molekulargewicht von etwa 49 kda aufweist (Abbildung 3-50A). Die Behandlung der Proteinmembran mit dem anti-ß-aktin Antikörper lieferte etwas schwächere Signale für die Tumorproben 2, 3 und 4, was wohl auf eine etwas geringere oder qualitativ schlechtere Gesamtproteinmenge hinweist (Abbildung 3-50B). 156
157 Ergebnisse Abbildung 3-50: Nachweis von MTUS1 (A) mittels Westernblot in den Blasentumorgeweben; LNCaP diente als Positivkontrolle; es sind verschiedene Isoformen zu erkennen; ß-AKTIN diente als endogene Kontrolle und wurde in den Tumoren 2, 3 un 4 etwas schwächer exprimiert (B); die Belichtungszeit betrug 60 Sekunden (für MTUS1) bzw. 103 Sekunden (für ß- AKTIN), blank = Lysepuffer Funktionelle Untersuchung der MTUS1-Überexpression in RT112 Um funktionelle Konsequenzen einer MTUS1-Expression untersuchen zu können, wurde das Gen mittels transienter Transfektion in der Harnblasenkarzinom-Zelllinie RT112 überexprimiert. Im Anschluss wurden die Auswirkungen auf Proliferation, Viabilität und Migrationsverhalten analysiert. RT112 wurde ausgewählt, da diese Zelllinie sowohl auf Protein- als auch auf RNA-Ebene eine relativ geringe Expression von MTUS1 zeigte. Somit konnte davon ausgegangen werden, dass hier der Effekt der Transfektion am stärksten zu beobachten sein würde Kontrolle des Transfektionserfolges mittels qrt-pcr Um zu kontrollieren, ob die Überexpression des Plasmides erfolgreich verlaufen war, wurde aus einem Teil der Zellen vor den entsprechenden funktionellen Versuchen die RNA isoliert, daraus cdna gewonnen und diese in der quantitativen Real-Time- PCR mit MTUS1-spezifischen Primern eingesetzt. Der MTUS1-Expressionsstatus wurde sowohl 24 als auch 48 Stunden nach der Transfektion durch die PCR bestimmt. Die Überexpression konnte in allen Fällen über die qrt-pcr nachgewiesen werden. Die mitgeführte Kontrolle LNCaP zeigte dabei stets die höchsten Expessionswerte von MTUS1. Im abgebildeten Beispiel wurde MTUS1 von 157
158 Ergebnisse LNCaP etwa 25mal so stark exprimiert, wie in RT112 Zellen 24 Stunden nach der Transfektion. 48 Stunden nach der Transfektion waren die MTUS1-Expressionswerte jeweils höher als nach 24 Stunden. Im Vergleich zu den nur mit dem Transfektionsmedium Megatran behandelten RT112 Kontrollzellen, wurde MTUS1 in den behandelten Zellen etwa 22mal (nach 24 Stunden) bzw. etwa 40mal (48 Stunden) so stark exprimiert (Abbildung 3-51). A B Abbildung 3-51: Nachweis der Überexpression von MTUS1 in RT112 mittels RQ in der qrt-pcr; in A ist die Expression nach 24 und 48 Stunden im Vergleich zur Positivkontrolle LNCaP zu sehen; in B sind 24- und 48- Stunden Werte ohne LNCaP abgebildet, nach 48 Stunden war die Expression höher als nach 24 Stunden. Neben der Kontroll-PCR wurden außerdem jeweils ein Viability Assay, ein BrdU Assay und ein Wound Scratch Assay durchgeführt. Die Transfektion erfolgte in 6Well-Platten 24 Stunden nach dem Aussähen und Adhärieren der Zellen. Nach der Transfektion wurden die Zellen 24 Stunden bei 37 C und 5% CO 2 inkubiert. Danach wurden die Zellen mittels Trypsin geerntet, gezählt und für den entsprechenden Assay ausgesäht. Nach weiteren 24 Stunden wurde dann der entsprechende Assay durchgeführt, also entweder das Substrat bzw. die Fixierlösung auf die Zellen gegeben oder das Insert entfernt und mit der fotografischen Dokumentation begonnen. Die Ergebnisse sind im Folgenden aufgelistet. 158
159 Ergebnisse Bestimmung der MTUS1-abhängigen Viabilität (Viability Assay) Der Viability Assay wurde dreimal durchgeführt. Es zeigte sich, dass bei den RT112 Zellen mit MTUS1-Expression signifikant weniger Zellen metabolisch aktiv waren, als bei den Kontrollzellen. Das Lumineszenzsignal war für die MTUS1-transfizierten Zellen signifikant geringer (35733), als bei den Kontrollzellen (50345, p=0,002, Abb. 3-52). Abbildung 3-52: Graphische Darstellung der Ergebnisse des Viability Assays in RT112 mit und ohne MTUS1- Überexpression; nach MTUS1- Überexpression zeigt sich ein geringeres Lumineszenzsignal; es sind weniger Zellen metabolisch aktiv, als in den untransfizierten Zellen Bestimmung der MTUS1-abhängigen Proliferation (BrdU Assay) Der Proliferations-Assay wurde viermal durchgeführt. Es konnte ein kleiner, jedoch nicht signifikanter Unterschied bei der Proliferation der MTUS1-transfizierten Zellen (od=1,48) und der Kontrollzellen (od=1,6) festgestellt werden (p=0,603). Die untransfizierten Zellen hatten eine etwas höhere Proliferationsrate als die Zellen mit MTUS1-Überexpression. Die Absorptionswerte unterschieden sich um 0,12. Die Differenz lag jedoch innerhalb der Standardabweichung (Abb. 3-53). 159
160 Ergebnisse Abbildung 3-53: Graphische Darstellung der Ergebnisse des BrdU- Proliferations-Assay in RT112; es konnte kein MTUS1-abhängiger Unterschied in der Proliferation festgestellt werden Untersuchung des MTUS1-abhängigen Migrationsverhaltens mit dem Wound Scratch Assay Der Wound Scratch Assay wurde zweimal mit jeweils zwei unterschiedlichen Ausgangs-Zellkonzentrationen durchgeführt: Zellen/ml und Zellen/ml. Es war ein deutlicher, jedoch nicht signifikanter Unterschied in der Migrationsgeschwindigkeit zu beobachten (p=0,121 für beide Konzentrationen). RT112 Zellen, die mit dem Tumorsuppressor MTUS1 transfiziert wurden, schlossen den Zellspalt langsamer, als die untransfizierten Kontrollzelle (Abb und 55). Bei der geringer konzentrierten, MTUS1-transfizierten Zellsuspension waren nach 24 Stunden erst 19,7% der Fläche zugewachsen, wohingegen die untransfizierten Zellen bereits 37,6% der Fläche bedeckten. Bei den höher konzentrierten Zellen war insgesamt schon mehr Fläche zugewachsen, die Differenz blieb aber ähnlich. So waren bei den MTUS1-defizienten RT112 Zellen 65,9% der Fläche bewachsen, wobei es schon 92,4% bei den Kontrollzellen waren. Der mittlere Unterschied aller 4 Messungen betrug etwa 22,2% (±6,8%) zwischen Behandlung und Kontrolle. 160
161 Ergebnisse Abbildung 3-54: Repräsentative Ergebnisse des Wound Scratch Assays in RT112 mit und ohne MTUS1- Überexpression zum Zeitpunkt 0 und nach 24 Stunden; bei Zellen mit einer MTUS1- Überexpression konnte ein langsameres Wachstum beobachtet werden; der Spalt hat sich langsamer geschlossen. A B Abbildung 3-55: Ergebnisse des Wound Scratch Assays in RT112 nach ektopischer MTUS1-Expression mit zwei verschiedene Zelldichten, A Zellen pro ml, B Zellen pro ml Immunhistochemische Untersuchung der MTUS1-Expression an zwei TMA-Studien Um die Expression von MTUS1 auch an einer großen Anzahl humaner Tumoren zu analysieren und gegebenenfalls eine aberrante Expression zu identifizieren, die eine Assoziation zu der Erkrankung darstellt, wurden die zwei TMA-Studien immunhistochemisch auf ihre MTUS1-Expression untersucht, die auch schon auf die Expression von SFRP1 untersucht worden waren (siehe 2.1.1). Dabei handelte es sich um den TMA, der ausschließlich papilläre Tumoren beinhaltete, und um den TMA mit ausschließlich fortgeschrittenen Blasentumoren, der aus der bereits publizierten Chemotherapiestudie entstammte. 161
162 Ergebnisse TMA mit papillären Harnblasenkarzinomen Bei der Auswertung der MTUS1-Färbung wurde ähnlich vorgegangen wie bei der SFRP1-Färbung: Aus der Intensität und der Prozentzahl der angefärbten Zellen wurde ein immunreaktiver Score (IRS) gebildet. So wurde zunächst jeder Prozentzahl eine Zahl von 0 bis 4 nach folgendem Schema zugeordnet: 0=0% positive Zellen 1=<10% positive Zellen 2=10-50% positive Zellen 3=51-80% positive Zellen 4=81-100% positive Zellen Diese Zahl wurde dann mit dem Wert der Intensität multipliziert. Das Ergebnis (Zahlen von 0 bis 12) stellte den IRS für die MTUS1-Färbung dar. Von den 143 Tumoren konnten 128 ausgewertet werden. Der IRS zeigte folgende Verteilung: 65 Tumoren hatten einen IRS von 0, 45 von 2, 18 von 4, 4 von 6, einer von 8, zwei von 9 und zwei von 12. In Abbildung 3-56 sind exemplarische MTUS1- negative (A und B) und positive Färbungen (C und D) dargestellt. Die Lokalisation von MTUS1 in der Zelle liegt im Zytoplasma und ist durch eine rote Färbung im Gewebe gekennzeichnet. Besonders stark gefärbte Bereiche sind durch einen Pfeil markiert. 162
163 Ergebnisse A B 100x 400x C D 400x 400x Abbildung 3-56: Immunhistochemische Färbung von papillären Harnblasentumoren mit einem anti-mtus1- Antikörper; A und B zeigen einen MTUS1-negativen Tumor, C und D zeigen einen Tumor mir positiver, zytoplasmatischer MTUS1-Färbung (Pfeile), MTUS1 scheint in Form von kleinen punktförmigen Arealen im Zytoplasma vorzuliegen. Einige Tumoren zeigten außerdem eine auffällige Färbung der Deckzellen (siehe Abbildung 3-57). A B 100x 100x Abbildung 3-57: Exemplarische immunhistochemische Färbungen der papillären Harnblasenkarzinome. Die Pfeile markieren die gefärbten Deckzellen. Um die immunhistochemischen Daten mit den histopathologischen, sowie den Follow-up Daten zu korrelieren, wurde, wie auch bei den anderen IHC-Färbungen, nur der unbehandelte Primärtumor des Patienten ohne zusätzliche Rezidive ausgewählt, sodass sich folgende Verteilung für die MTUS1-Färbung ergab: 85 der 91 Primärtumor-Stanzen konnten ausgewertet werden. 43 Stanzen hatten einen IRS 163
164 Ergebnisse von 0, 29 von 2, 8 von 4, drei von 6, eine von 8 und eine von 9. Sechs Stanzen konnten mangels Tumor- oder Gewebematerial nicht ausgewertet werden. Für die Überlebenskurven und die statistischen Berechnungen wurden ebenfalls wieder geeignete Gruppen definiert. Angelehnt an den Median (=0±1,9) wurden zwei Gruppen gebildet: Gruppe 1 IRS 0 und Gruppe 2 IRS 1bis12. Die Verteilung der verschiedenen IHC-Gruppen innerhalb der Primärtumore ist in folgender Tabelle 3-13 zusammengefasst. MTUS1 IRS k.a. n= Gruppen Gruppe 1 Gruppe 2 - n= Tabelle 3-13: Verteilung der MTUS1-Expression innerhalb der Gruppe der primären, papillären Harnblasenkarzinome. Bezüglich des Gesamtüberlebens, des rezidivfreien-, des metastasefreien- und des progressionsfreien Überlebens ergaben sich keine signifikanten Unterschiede. Die Kaplan-Meier-Kurven, sowie die Graphen der univariaten Cox-Regression sind in Abbildung 3-58 dargestellt. Abbildung 3-58: Kaplan-Meier-Analysen (A-D) und univariate Cox-Regression (E bis H) des papillären Tumorkollektivs für Gesamt- (A und E), rezivivfreies- (B und F), metastasefreies- (C und G) und progressionsfreies (D und H) Überleben in Monaten in Korrelation mit der Expression von MTUS1. 164
165 Abbildung 3-58: MTUS1 Ergebnisse A E B F C G D H 165
166 Ergebnisse Die jeweilige Überlebenszeit und das zugehörige Risiko sind in Tabelle 3-14 zusammengestellt. [Monate] Überleben Gruppe 1 Überleben Gruppe 2 Risiko Gesamtüberleben 112,6 192,1 0,402 Rezidivfreies Überleben 34,7 49,1 1,56 Metastasefreies Überleben 114, ,253 Progressionsfreies Überleben 67,1 174,4 1,586 Tabelle 3-14: Mittlere Überlebenszeiten des papillären Tumorkollektivs in Abhängigkeit der MTUS1-Expression; Gruppe 1 = IRS 0, Gruppe 2 = IRS Auch wenn kein signifikanter Unterschied festzustellen war, kann man trotzdem festhalten, dass bei der Gruppe mit MTUS1-Expression sowohl das Gesamtüberleben, als auch das rezidiv-, metastase- und progressions-freie Überleben länger ist, als bei den Patienten, deren Tumoren MTUS1 verloren haben. Insbesondere der Zeitraum bis zum Auftreten einer Metastase wird durch die MTUS1-Expression scheinbar beeinflusst. So tritt bei Patienten mit MTUS1-Defizienz nach durchschnittlich 114 Monaten und bei Patienten mit MTUS1-Expression erst nach 255 Monaten eine Metastase auf. Das Gesamtüberleben war bei MTUS1- exprimierenden Tumoren etwa sechseinhalb Jahre länger als bei den Tumoren mit Expressionsverlust. Im Anschluss wurde auch die MTUS1-Färbung mit den Patientencharakteristika (wie z.b. Alter und Geschlecht), den anderen immunhistochemischen Färbungen, sowie den histopathologischen Parametern korreliert. Es zeigten sich signifikante Korrelationen mit dem Tumorgrad (p=0,004), Stadium (p=0,004), der Ki67 (p=0,004)- und CK20-Expression (p=0,005). Dabei war auffällig, dass eine positive MTUS1- Expression jeweils mit einer aberranten Ki67 und CK20-Expression, sowie mit höherem Stadium und Grad einhergingen. Umgekehrt zeigten Tumoren ohne MTUS1-Expression normale Ki67 und CK20-Expression mit niedrigerem Stadium und Grad. Die Verteilung der IRS-Gruppen in Abhängigkeit von Stadium, Grad, Ki67 und CK20 ist in Abbildung 3-59 dargestellt. 166
167 Ergebnisse A *p=0,005 B *p=0,004 C *p=0,004 D *p=0,004 Abbildung 3-59: Korrelationen der MTUS1-Expresison mit CK20-Expression (A), Grad (B), Ki67-Expression(C) und Stadium (D); eine MTUS1-Expression ging mit einer erhöhten Proliferation, sowie höherem Stadium und Grad, also einem höheren malignen Potential einher. Um die Datenintegrität zu überprüfen, wurde von allen verfügbaren Tumoren (n=81) eine FGFR3-Mutations-Analyse durchgeführt, die dann mit dem Tumorstadium korreliert wurde. Es ist allgemein bekannt, dass eine FGFR3-Mutation in papillären nicht-muskel-invasiven Karzinomen mit einem weniger malignen Phänotyp, wie z.b. weniger invasivem Wachstum und weniger Progression, einhergeht. 27 Tumoren (33,3%) zeigten den Wildtyp-Genotyp, bei 54 Tumoren (66,7%) konnte mindestens eine Mutation nachgewiesen werden. Die Mehrzahl (66,7%, n=18) der Wildtyp- Tumoren zeigte ein invasives Stadium, wohingegen nur 33,3% (n=9) der Tumoren ein nicht-invasives Stadium aufwiesen. Bei den Tumoren mit mutiertem FGFR3 war die Anzahl an nicht-invasiven Tumoren hingegen höher (57%, n=31) und die Anzahl an invasiven Neoplasien geringer (42,6%, n=23), als beim Wildtyp. Die unterschiedliche Verteilung bezüglich Stadium und FGFR3 Mutationsstatus deckte sich zwar mit unseren Erwartungen, war jedoch nicht signifikant (p=0,059). Dies 167
168 Ergebnisse könnte vor allem daran liegen, dass es sich bei den hier vorliegenden Tumoren nur um papilläre Wachstumsmuster handelt, die ja bekanntlich generell ein geringeres malignes Potential in sich tragen als solide Tumoren. So könnte die Unterscheidung hinsichtlich der FGFR3-Mutationen und des Stadiums nicht so deutlich ausfallen. Bei einer gemischten Gruppe von soliden und papillären Blasentumoren würde es sicherlich zu einer deutlicheren stadien-bezogenen Untergliederung in FGFR3- mutierte und Wildtyp Tumoren kommen. Die nachfolgende Korrelation des FGFR3- Status mit der MTUS1-Expressison brachte folgende Ergebnisse (Abbildung 3-60): Abbildung 3-60: Korrelation der MTUS1-Expression in der papillären Tumorkohorte mit der FGFR3-Mutationsfrequenz. Es zeigte sich eine inverse Verteilung der MTUS1-Expression bei Tumoren mit FGFR3-Wildtyp bzw. Mutation. So wiesen 34,8% (n=8) der Wildtyptumoren einen MTUS1-Expressionsverlust auf, 65,2% (n=15) exprimierten MTUS1. Bei den mutierten Tumoren konnte in 57,4% der Fälle (n=31)= ein Expressionsverlust und in 42,6% der Fälle (n=23) eine Expression nachgewiesen werden (p=0,085). Tumoren mit bzw. ohne MTUS1 Expression zeigten eine unterschiedliche, wenn auch nicht signifikante (p=0,062) Verteilung hinsichtlich der P53-Expression. So hatten 59,5% der Tumore (n=25) mit MTUS1-Expression ( IRS1bis12 ) eine normale P53-Expression (0-9%), aber 40,5% (n=17) eine Überexpression (10-100%). In der Gruppe mit MTUS1-Expressionsverlust ( IRS0 ) zeigten hingegen 79,1% (n=34) eine normale P53-Expression, wobei nur 20,9% (n=9) ein aberrantes Färbemuster aufwiesen. 168
169 Ergebnisse TMA mit fortgeschrittenen Harnblasenkarzinomen Um das Vorhandensein von MTUS1 nicht nur in papillären, sondern auch in fortgeschrittenen Tumoren zu untersuchen, wurden auch die sechs TMAs der Chemotherapiestudie immunhistochemisch mit dem Antikörper gegen MTUS1 gefärbt. Auch hier wurde die Intensität der Färbung (0-3) und der Prozentsatz der gefärbten Zellen beurteilt. Auffällig dabei war, dass plasmozytoide Tumoren (PUCs) keine Färbung des Zytoplasmas, sondern des Kerns aufwiesen (siehe Abbildung 3-61A). Von 17 anfärbbaren PUCs zeigten neun keine MTUS1-Färbung (IRS1), acht aber hingegen eine MTUS1-Expression (IRS2) im Kern. Außerdem zeigten alle mikropapillären Tumoren (MUCs, n=10) ein Vorhandensein von MTUS1 (siehe Abbildung 3-61B). A x400 B x400 Abbildung 3-61: Exemplarische immunhistochemische Färbungen der fortgeschrittenen Harnblasenkarzinome: plasmozytoide Tumoren zeigten häufig eine Färbung des Kerns (A, Pfeil); bei den meisten mikropapillären Tumoren konnte eine positive zytoplasmatische Expression beobachtet werden (B, Pfeil). Nach der Berechnung des immunreaktiven Scores (IRS) für jeden Tumor erfolgte die Auswertung der erhaltenen Daten hinsichtlich des Überlebens. Die Einteilung in immunreaktive Gruppen erfolgte, wie beim papillären TMA der prospektiven Studie, in negative (IRS 0, Gruppe 1) und positive (IRS 1 bis 12, Gruppe 2) Tumoren (Tabelle 3-15). In der Kaplan-Meier-Analyse ergab sich ein signifikant schlechteres Gesamt (p=0,029)- und Tumor-spezifisches (p=0,027) Überleben für die Patienten ohne MTUS1-Expression im Tumor (siehe Abbildung 3-62 A und B). Auch in der multivarianten Cox Regression (adjustiert nach histologischem Subtyp und adjuvanter Chemotherapie) zeigte die Gruppe 1 (IRS 0) ebenfalls ein signifikant schlechteres Überleben (p=0,012), als Gruppe 2 (IRS 1bis12) (siehe Abbildung 3-169
170 Ergebnisse 62C). Es konnte keine signifikante Assoziation hinsichtlich der Progression festgestellt werden. MTUS1 IRS k.a. n= Gruppen Gruppe 1 Gruppe 2 - n= Tabelle 3-15: Verteilung der MTUS1-Expression innerhalb der Gruppe der fortgeschrittenen Harnblasenkarzinome. *p=0,029 *p=0,027 A B C *p=0,012 Abbildung 3-62: Kaplan-Meier-Analysen für das Gesamt- (A) und das tumorspezifische (B) Überleben, sowie multivariate Cox-Regression (C) adjustiert nach histologischem Subtyp und adjuvanter Chemotherapie in Abhängigkeit der MTUS1-Expression:, Tumoren mit MTUS1-Expression (grüne Kurve) zeigten signifikant bessere Überlebenskurven. 170
171 Diskussion 4 Diskussion SFRP1 im Urothelkarzinom der Harnblase: Secreted frizzled-related protein 1 (SFRP1) ist als Inhibitor des Wnt-Signalweges bekannt und spielt eine wichtige Rolle bei der Entwicklung und Zelldifferenzierung. Auch in Zusammenhang mit verschiedenen Krebserkrankungen, unter anderem beim Kolon- [77], Leber- [80] und Brustkrebs [74] sind Fehlregulationen in SFRP1 und im gesamten Wnt-Signalweg bekannt. Für die Assoziation von SFRP1 mit Entstehung und Verlauf des papillären Urothelkarzinoms gibt es allerdings nur sehr wenige aussagekräftige Daten. In den meisten Studien wurde ein Hypermethylierungsbedingter Verlust der SFRP1-Expression in Zusammenhang mit der malignen Erkrankung gebracht [71-85]. Um die Rolle von SFRP1 und des kanonischen Wnt- Signalweges beim papillären Urothelkarzinom der Harnblase besser verstehen zu können, wurden zunächst zwei papilläre Harnblasenkarzinom-Zelllinien, RT112 und BFTC905, nach Knockdown bzw. Überexpression des Gens funktionell untersucht. Außerdem wurde die Auswirkung auf verschiedene Wnt-Zielgene auf mrna und Protein-Level, sowie auf die Aktivität des Wnt-Signalwegs selbst untersucht. RT112 wies als Wildtypzelllinie eine SFRP1-Expression auf, BFTC905 hatte sie im Wildtyp hingegen verloren. Nach der Überexpression von SFRP1 in BFTC905 und dem shrna-vermittelten Knockdown in RT112 wurde die Auswirkung auf Viabilität, das heißt auf den ATP-Stoffwechsel, auf die Proliferation und auf die Wundheilungseigenschaften untersucht. Es zeigte sich für BFTC905, dass Zellen mit SFRP1-Überexpression eine signifikant niedrigere Viabilität und auch langsamere Wundheilung aufwiesen, als in der Wildtyplinie. Die Proliferationseigenschaften änderten sich jedoch nicht. Bei RT112 konnte gar keine signifikante Änderung in Stoffwechsel, Proliferation und Wundheilung beobachtet werden. Die funktionellen Versuche in BFTC905 lassen vermuten, dass SFRP1 die Rolle eines Tumorsuppressors übernimmt und durch Verlangsamung der Stoffwechselaktivität bzw. der Migration zu einem weniger malignen Phänotyp führen kann. Dies lässt annehmen, dass die Tumorzellen mit SFRP1-Expression in vivo folglich auch langsamer wachsen, und die Erkrankung so weniger schnell fortschreiten würde. In RT112 kann diese Vermutung aber nicht bestätigt werden. Hier war gar kein signifikanter, funktioneller Effekt sichtbar. Das könnte eventuell daran liegen, dass SFRP1 durch die shrna nicht in ausreichender Menge herunter reguliert wurde, um 171
172 Diskussion funktionelle Konsequenzen nach sich zu ziehen. Andererseits ist es auch möglich, dass die in der Wildtypzelllinine vorhandene Menge an SFRP1 schon so gering war (siehe nicht nachweisbares Protein im Westernblot), dass ein weiterer Knockdown ohne Effekt bliebe. Im Weiteren wurde untersucht, ob die veränderte SFRP1-Expression Einfluss auf die Wnt-Zielgene AXIN2, BMP4, CD44, CMYC, CCND1 und BIRC5 (Survivin) hatte. In RT112 wurden alle Zielgene auf mrna-ebene zusammen mit SFRP1 herunterreguliert, am stärksten BMP4. Dies spricht zunächst gegen die Vermutung, dass verminderte SFRP1-Expression zu einer gesteigerten Aktivität des Wnt- Signalweges und damit auch der Expression seiner Targetgene führt. Bei BFTC905 zeigte auch BMP4 die stärkste Herunterregulation, jedoch nach SFRP1- Überexpression, also genau umgekehrt, wie bei RT112. Auf Proteinebene zeigte sich aber ein anderes Bild. Für RT112 konnte nur für CCND1 und BIRC5 ein signifikanter Unterschied in der Proteinexpression zwischen Mock und A-Klonen gefunden werden. Nach Expressionsverlust von SFRP1 wurden die beiden Wnt-Zielgene signifikant um 26,2 (CCND1) bzw. um 23,7% (BIRC5) hochreguliert. Leider konnte die Herunterregulation von SFRP1 in RT112 nicht mit dem Westernblot nachgewiesen werden. Das lag wahrscheinlich daran, dass schon die in Wildtypzelllinien exprimierte Proteinmenge nicht detektiert werden konnte und somit eine weitere Herunterregulation nicht nachweisbar war (siehe weiter oben). In BFTC905 konnte hingegen eine signifikante Überexpression von SFRP1 in den A- Klonen um 1136,2% nachgewiesen werden. Diese wurde von einer signifikanten Herunterregulierung von CMYC und BIRC5 um 20 bzw. 37,3% begleitet. Die Proteine AXIN2 und CD44 konnten mittels Westernblot in keiner der beiden Zelllininen detektiert werden, was wiederum dafür spricht, dass der Wnt-Signalweg, nicht oder nur sehr schwach aktiv ist. Für BMP4 konnte auf Proteinebene, im Gegensatz zur mrna-ebene, kein signifikanter Unterschied festgestellt werden. Die SFRP1- abhängige Proteinregulation von CCND1, CMYC und BIRC5 in RT112 und BFTC905 spricht allerdings dafür, dass der Wnt-Signalweg, wie vermutet, von SFRP1 negativ reguliert wird. Somit würde die Interaktion von SFRP1 mit dem Frizzled-Rezeptor eine Aktivierung der Signalkaskade verhindern und somit zum proteosomalen Abbau vom CTNNB1 führen. Dies behindert dann wiederum die Transkription von Wnt- Zielgenen und somit auch eine verstärkte Migration, Metabolismus, Proliferation, sowie eine verminderte Adhäsion. 172
173 Diskussion Die Vermutung der fehlenden oder nur sehr geringen Aktivität des kanonischen Wnt- Signalweges konnte auch bei der Untersuchung der SFRP1-abhängigen Wnt- Aktivität mittels TOP/FOP flash Assay bestätigt werden. RT112 und BFTC905 wiesen sowohl mit als auch ohne SFRP1 Expression keine nennenswerte Wnt-Aktivität (<2) auf. Eine, wie aus anderen Krebsentitäten bekannte Überaktivierung des kanonischen Wnt-Signalweges [ ], kann für unsere beiden Blasenkrebsmodelle somit nicht bestätigt werden. Der Wnt-Inhibitor SFRP1 scheint somit keine Auswirkung auf die kanonische Wnt-Signalkaskade über TCF/LEF in den beiden Zelllinien zu haben. Bei der Untersuchung von papillären Urothelkarzinomen aus Patientengewebe konnte kein signifikanter Unterschied im Überleben zwischen der IRS1 (keine und schwache Expression) und IRS2-Gruppe (mittlere und starke Expression) gefunden werden. Es zeigte sich aber dennoch, dass die SFRP1-exprimierenden Tumoren mit längerem Überleben verknüpft sind, im Vergleich zu jenen ohne oder mit nur schwacher Expression. Somit war möglicherweise die Anzahl der gefärbten Tumoren (n=86) nicht ausreichend, um ein signifikantes Ergebnis zu bekommen. Das Ergebnis sollte mit einer größeren Kohorte papillärer Tumoren verifiziert werden. Auffällig ist auch, dass der Anteil der Tumoren mit Expressionsverlust oder nur schwacher Expression (IRS1), nahezu mit dem Prozentsatz der am SFRP1-Promoter methylierten Tumoren übereinstimmt. Dies könnte darauf hindeuten und unsere Vermutung unterstützen, dass der Verlust der SFRP1-Expression in hohem Maße mit einer Methylierung des Promotors einhergeht. Dies würde auch zu den Befunden aus anderen Tumorentitäten passen, bei denen die Hypermethylierung des SFRP1- Promotos ja bereits mehrfach nachgewiesen und mit der Erkrankung assoziiert werden konnte. Im Vergleich zum Gesamtüberleben konnte für das progressionsfreie Überleben aber keine Assoziation mit der SFRP1-Expression detektiert werden. Die einzige signifikante Assoziation von SFRP1 wurde mit dem Tumorgrad gefunden. Es zeigte sich, dass, Tumoren mit wenig oder fehlender Expression häufiger eine highgrade Differenzierung aufwiesen, was wiederum für eine prognostische Bedeutung spräche. Zusammengefasst betrachtet, scheint SFRP1 aber kein generell gültiger, neuer molekularer Marker für die Vorhersage einer Progression beim papillären Urothelkarzinom der Harnblase zu sein, da eine prognostische Bedeutung 173
174 Diskussion möglicherweise nur für eine Subgruppe von papillären Tumoren eine Rolle spielt. Es ließ sich aber auch nicht nachweisen, dass SFRP1 keine wichtige Rolle in der biologischen Funktion des Urothels bzw. von Blasenkrebszellen einnimmt. Wir konnten bestätigen, dass es beim Blasenkrebs zu einem Verlust der SFRP1- Expression kommt. Diese ist in hohem Maße durch eine Promotorhypermethylierung und in geringem Maße auch durch Deletionen auf 8p bedingt. Sie beeinflusst den kanonischen Wnt-Signalweg scheinbar aber nur geringfügig. In Anbetracht der vorliegenden Ergebnisse der funktionellen Zellkulturversuche und der immunhistochemischen Expressionsanalyse in Tumorgewebe, ist es schwierig eine endgültige Aussage über die Rolle von SFRP1 beim papillären Urothelkarzinom der humanen Harnblase zu treffen. Es konnte nicht eindeutig nachgewiesen werden, dass SFRP1 die Rolle eines Wnt-Signalwegs-vermittelten Tumorsuppressor innehat. Unsere Hypothese, dass SFRP1-Verlust zu einer Überaktivierung des kanonischen Wnt-Signalweges und damit zur gesteigerten Malignität und Progression des Tumors führt, konnte nicht rückhaltlos bewiesen werden. Einerseits gibt es Hinweise, dass SFRP1 wirklich die Funktionalität und auch die Malignität von Zellen beeinflusst. Dies konnte vor allem am Zellkultursystem der BFTC905 Zellen, der Assoziierung mit dem Tumorgrad, sowie an der Tendenz zu besserem Gesamtüberleben bei SFRP1- exprimierenden Tumoren nachgewiesen werden. Andererseits gibt es aber auch Hinweise, dass SFRP1 keinen Effekt auf die malignen Eigenschaften von Blasenkrebszellen bzw. auf die Progression derselben hat, was durch die funktionellen Versuche mit RT112 bestätigt werden konnte. Bei fortgeschrittenen Blasentumoren konnte keine Assoziation zwischen dem SFRP1-Expressionsstatus und histopathologischen Parametern, sowie dem Überleben gefunden werden. Diese Tatsache spricht dafür, dass SFRP1 beim Urothelkarzinom, wenn überhaupt, nur bei papillären Tumoren eine Rolle spielen könnte. Die heterogenen Ergebnisse bezüglich SFRP1, könnten darauf zurück zu führen sein, dass es sich bei SFRP1 nicht nur um einen Antagonisten des Wnt-Signalweges handelt, sondern, dass das Signalmolekül auch an anderen Funktionen in der Zelle beteiligt ist. Dies soll im Folgenden diskutiert werden. 174
175 Diskussion In der Literatur werden die Aufgaben von SFRP1 und anderen Wnt-Inhibitoren kontrovers diskutiert. Viele Studien konnten bereits nachweisen, dass SFRP1 nicht nur eine Rolle bei der Inhibition des Wnt-Signalwegs, sondern auch bei dessen Aktivierung spielt. Bovolenta et al postulierten, dass sowohl der kanonische als auch der nicht-kanonische Signalweg über zwei verschiedene Mechanismen inaktiviert und über zwei andere Mechanismen aktiviert werden kann: durch die klassische Bindung von SFRP1 mit dem WNT-Molekül über die Cystein-reiche (CRD)- und die Netrin-Domäne (NTR) und der dadurch verhinderten Bindung von WNT mit dem FZD-Rezeptor, sowie über die Bildung eines inhibitorischen SFRP1-FZD-Komplexes, der die WNT-Ligand-Bindung verhindert, kann die Wnt-Signalgebung inaktiviert werden. Andererseits kann aber auch über die gleichzeitige Bindung von WNT und FZD deren Interaktion und somit auch die Signalgebung unterstützt werden. Des Weitern besteht die Möglichkeit, dass SFRP1 sich durch Bindung mit anderen SFRP1-Molekülen selbst hemmt und somit die Inhibition des Wnt-Signalwegs verhindert wird [133]. Neben der Beeinflussung der Wnt-Signalwegs-Aktivität wurde beispielsweise auch eine Wnt-unabhängige Beeinflussung des Axon-Wachstums und der Axon-Reorientierung in retinalen Ganglienzellen beobachtet [134]. Außerdem, wurde vielfach beschrieben, dass SFRP s auch Bindungen mit weiteren Molekülen, z.b. FN1 (Fibronektin), UNC5H3, RANKL und BMP/Tolloid, eingehen können, die nicht in den Wnt-Signalweg involviert sind. So bewirkte die Bindung von SFRP2 mit einem Fibronektin-Integrin-Komplex eine gesteigerte Viabilität und verminderte Apoptose bei Brustkrebszellen. Eine ähnliche Verbindung wäre somit auch für SFRP1 denkbar. Durch die Einbindung von SFRP1 im Fibronektin-Integrin-Komplex würden die Zellen dann besser vor apoptotischen Stimuli geschützt werden [135]. Dies könnte eine vom Wnt-Signalweg unabhängige Beeinflussung der Viabilität erklären. SFRP1 zeigte zudem auch eine hohe Bindungsaffinität zu dem Peptid-Motiv L/V-VDGRW-L/V, welches weder ein Bindungsmotiv von FZD noch von WNT darstellt. Stattdessen wurde dieses Bindungsmotiv aber in beispielsweise zwei anderen Molekülen nachgewiesen: in UNC5H3 und RANKL [136]. Bei UNC5H3 handelt es sich um einen Netrin1-induzierten Rezeptor, der bei der Axonabstoßung, Zytoskelett-Remodellierung und bei der Dynamik der Mikrotubuli in neuronalen Populationen eine Rolle spielt [137]. Auch eine Beeinflussung der Transkription wird diskutiert. RANKL gehört zur Familie der Tumornekrosefaktoren und ist ein wichtiger Mediator in der Osteoklasten-Bildung. SFRP1 scheint über die direkte Bindung von 175
176 Diskussion RANKL die Osteoklastenbildung zu hemmen [138]. So könnte auch eine RANKLvermittelte Inhibition der Tumorzell-Bildung initiiert werden. Sizzled (kurz für secreted frizzled), ein Mitglied der SFRP-Familie, das zuerst in Xenopus Embryonen als putativer WNT8-Antagonist entdeckt wurde [139], konnte zudem auch als negativer Feedback-Regulator des BMP-Signalwegs nachgewiesen werden [140]. So könnte es durch eine Interaktion von Sizzled oder auch anderen Mitgliedern der SFRP- Familie, wie z.b. SFRP1, zu einer verringerten Transkription von Targetgenen des BMP-Signalweges, wie z.b. Id (inhibitor of differentiation oder inhibitor of DNA binding) kommen. Id ist ein negativer Regulator der Zelldifferenzierung und ein positiver Regulator der Zellproliferation [141]. Bei verminderter Expression käme es dann zu verstärkter Zelldifferenzierung und geringerer Proliferation. Letzteres wurde ja in SFRP1-überexprimierenden BFTC905 Zellen beobachtet. Ein Crosstalk von BMP/TGF-ß und Wnt-Signalweg ist aber auch aus anderen Studien bekannt. So wurde beispielsweise beschrieben, dass SMAD3 mit LEF1 interagiert und so die Transkription von TGF-ß- und Wnt-Zielgene synergistisch aktiviert werden kann [142]. Außerdem scheint auch SMAD4 einen Komplex mit TCF/LEF und CTNNB1 zu formen und so den Wnt-Signalweg zu beeinflussen [143]. Auch eine BMP-abhängige Aktivierung von MSX2 wird durch die beidseitige Bindung von SMAD4 und LEF1 an den MSX2-Promotor vermittelt [144]. Ein weiteres Beispiel der Interaktion von BMP- und Wnt-Signalweg ist TCF7. Dies ist ein Downstream- Effektor beider Signalwege und inhibiert die myogene Differenzierung durch die Unterdrückung von Myogenin und MyoD-Expression. SFRPs sollten also eher als multifunktionelle Regulatoren des Wnt-Signalweges, denn nur als Antagonisten betrachtet werden. Sie haben scheinbar mehr Einfluss auf andere Signalwege (wie z.b. den Shh- und den BMP-Signalweg) als bisher vermutet und sind selbst auch Einflüssen eben dieser Signalwege ausgesetzt. Neben der Beeinflussung durch andere Signalwege, sollte auch die Involvierung der nicht-kanonischen Wnt-Signalwege beleuchtet werden. Wie bereits in Kapitel 1.2 erwähnt, sind neben dem kanonischen CTNNB1-Signalweg auch noch mehrere nicht-kanonische Wnt-Signalwege bekannt. Beispiele hierfür sind der WNT/planar cell polarity (WNT/CPC)-, WNT/Ca 2+, WNT/JNK-, WNT/ROR-, WNT/GSK3ßMT-, WNT/aPKC-, WNT/RYK- und der WNT/mTOR Signalweg. Die bekanntesten nicht- 176
177 Diskussion kanonischen Signalwege sind aber der WNT/Ca 2+ - und der WNT/CPC-Signalweg. Der WNT/Ca 2+ -Signalweg zeichnet sich dadurch aus, dass der WNT-Ligand, z.b. WNT5a neben dem Hauptrezeptor Frizzled auch den Co-Rezeptor ROR1/2 bindet. Im Folgenden kommt es in der Zelle zu einer kurzzeitigen Erhöhung der Konzentration von bestimmten intrazellulären Signalmolekülen, wie IP 3, DAG und Ca 2+. Dies führt wiederum zur Aktivierung weiterer Moleküle der Signalkaskade, wie CN, CAMKII und PKC und schließlich zur Aktivierung von Transkriptionsfaktoren, wie NFAT, NFκB und CREB, die die Expression von Zielgenen beeinflussen können. Durch die alleinige Bindung von WNT5A mit dem ROR1/2 Rezeptor kommt es ebenfalls zu einer Erhöhung der Ca 2+ -Konzentration, nachfolgend aber zur Aktivierung von SIAH2, CALPAIN und CDX2. SIAH2 hat die Fähigkeit CTNNB1 herunter zu regulieren und somit negativ auf den kanonischen Wnt-Signalweg zu wirken. CALPAIN kann die Zytoskelettproteine Filamin und Spectrin spalten. CDX2 ist ein weiterer Transkriptionsfaktor, der ebenfalls die Transkription von Targetgegen beeinflusst [145]. Der WNT/CPC-Signalweg zeigt zum Teil Überlappungen mit dem WNT/Ca 2+ - Signalweg und ist durch folgende Hauptmerkmale gekennzeichnet: durch die Bindung des Wnt-Liganden am Transmembran-Rezeptor wird DVL-1 an die Plasmamembran rekrutiert. Nachfolgend werden Adaptorproteine (STAB und PRICKLE) aktiviert und die Aktivierung der kleinen GTPasen RHO A, CDC42 und RAC 1 getriggert. Diese aktivieren im Weiteren ROCK (Rho-assoziierte Kinase) und JNK (c-jun N-terminale Kinase), die dann wiederum die Transkription von Zielgenen beeinflussen [146]. Beim Brustkrebs ist bereits bekannt, dass ektopische Expression von SFRP1 in Brustkrebszelllininen zu einer Inhibition des kanonischen und des nicht-kanonischen Wnt-Signalweges führte [147]. Es wäre interessant, auch in Blasenkrebszelllinien mit ektopischer SFRP1-Expression, wie zum Beispiel in BFTC905, eine zusätzliche Untersuchung der nicht-kanonischen Signalwege vorzunehmen. Wie auch für die Messung der TCF/LEF-vermittelten Luziferaseaktivität mittels TOP/FOP Reporter Assay, könnte hierfür ein Luziferase-basierter Reporter-Assay verwendet werden. Dieser wurde bereits von Yang et al [147] beschrieben und kann die Transkriptionsrate eines Promotors messen, der unter der Kontrolle von Tandemrepeats einer der beiden Transkriptionsfaktoren NFAT (WNT/Ca 2+ ) oder AP1 177
178 Diskussion (WNT/CPC) steht. So könnte die Beeinflussung und Aktivität des nicht-kanonischen Wnt-Signalweges untersucht werden. SNP-Analyse in SFRP1: In der vorliegenden Arbeit wurde, nach unserem Kenntnisstand, zum aller ersten Mal eine Assoziation von SNPs in SFRP1 (rs3242 und rs921142) mit dem Erkrankungsrisiko für eine maligne Erkrankung untersucht. Die Untersuchung von 403 Blasenkrebspatienten, bestehend aus einer konsekutiven Kohorte und einer Gruppe mit frühem Erkrankungsalter ( 45 Jahre), sowie 332 Kontrollen ohne Tumorerkrankung, zeigte einen signifikanten Unterschied in der Genotypen- Verteilung des SNP rs3242. Bei den erkrankten Patienten zeigte sich ein vermindertes Auftreten des homozygoten CC-Genotyps (36%) im Vergleich zur Kontrollgruppe, bei der noch 44,3% diese Allelvariante aufwiesen. Auch die Verteilung des heterozygoten CT-Genotyps war bei den Blasenkrebspatienten im Vergleich zu den Kontrollen verändert und stieg von 41,6 auf 50,1%. Die Verteilung des homozygoten T-Genotyps blieb bei erkrankten Patienten (13,9%) und gesunden Kontrollen (14,1%) nahezu konstant. Eine kohortenspezifische Untersuchung der Allelverteilung im Vergleich zur Kontrollgruppe konnte aufdecken, dass dieser Unterschied durch die Patientengruppe mit Erkrankungsalter 45 Jahre (Early- Onset) bedingt war. So konnte ein um 13,1% verringertes Auftreten des homozygoten CC-Genotyp und ein um 11,9% erhöhtes Auftreten der heterozygoten Variante CT beobachtet werden. Auch hier blieb die Verteilung des TT-Genotyps nahezu unverändert. Beim Vergleich der Kontrollen mit den Patienten der konsekutiven Studie alleine, konnte kein Unterschied mehr festgestellt werden. Wir vermuten deshalb, dass die Anwesenheit eines T-Allels bzw. der Verlust des anzestralen C-Allels das Blasenkrebsrisiko erhöht bzw. das Erkrankungsalter herabsetzt. Auch in single nucleotid polymorphisms anderer Gene konnten altersabhängige Erkrankungsrisiken für die verschiedenen Allelvarianten beobachtet werden. So konnten beispielsweise Grochola et al einen SNP im PPP2R5E Gen identifizieren (ɛ- SNP2), der eine signifikante Assoziation mit dem Alter bei Erkrankungsausbruch, mit dem Erkrankungsrisiko im Allgemeinen und dem Gesamtüberleben bei Weichteilsarkomen zeigte. So war bei Patienten unter 51 Jahren ein gehäuftes Auftreten des TT- und ein vermindertes Auftreten des CC-Genotyps im Vergleich zur 178
179 Diskussion Kontrollgruppe zu beobachten [148]. Auch bei anderen Mediatoren der P53- Signalkaskade konnten altersabhängige SNPs determiniert werden. So zeigten Träger von P53-Mutationen (Li-Fraumeni-Syndrom) mit einem G-Allel im MDM2 SNP 309 ein 7, 10 und 16 Jahre früheres Auftreten von Tumoren, als T-Allelträger [ ]. Doch auch bei G-Allelträgern ohne P53-Mutation konnte ein früherer Krankheitsbeginn bei Weichteilsarkomen [149], Lymphomen [152], Leukämie [153], Kopf-, Hals- und oralen Plattenepithelkarzinomen [154, 155], bei Neoplasien des Kolons [156], der Brust [157], des Ovars [158], des Gehirns [159], der Leber [160] und der Blase [161] beobachtet werden. Es scheint also durchaus plausibel, dass der Zeitpunkt des Krankheitsausbruchs maßgeblich von SNPs beeinflusst werden kann. Es ist demnach essentiell, mögliche biologische Grundlagen und den Mechanismus des frühen Genotyp-bedingten Erkrankungszeitpunktes in rs3242 aufzudecken. Wie bereits oben erwähnt liegt der Genlokus des rs3242 SNP in der 3 UTR von SFRP1. In dieser Region liegen zwar keine kodierenden Gene, jedoch aber potenzielle Bindestellen für mikrornas. Damit ist einerseits zwar ausgeschlossen, dass der rs3242 SNP die Expression oder Faltung des SFRP1 Proteins direkt und translational beeinflusst, andererseits ist es aber sehr plausibel, dass die Bindefähigkeit bestimmter mirnas derart verändert wird, dass diese nicht mehr so gut oder aber auch verstärkt an die 3 UTR binden können und es somit trotzdem zu einer verminderten oder gegebenenfalls auch gesteigerten Genexpression von SFRP1 kommt. Die in silico Untersuchung der SFRP1-Gensequenz mittels mirbase in Abhängigkeit des jeweiligen Genotyps konnte zwei mirnas identifizieren, denen nur in Anwesenheit des T-Allels des rs3242 SNP eine Bindefähigkeit vorher gesagt wurde: hsa-mir-603 und hsa-mir Dies spricht dafür, dass diese beiden mirnas nur an jene SFRP1-mRNA-Sequenzen binden, die ein T-Allel in rs3242 aufweisen. Deshalb kommt es nur bei T-Allel Trägern zur mikrorna-bedingten Destabilisierung bzw. zum Abbau der SFRP1 mrna und somit zu einer verminderten oder fehlenden Genexpression von SFRP1. Das hat dann zur Folge, dass das Protein seine biologische Funktion als Wnt-Regulator und Tumorsuppressor nicht mehr erfüllen kann. Ein erhöhtes malignes Potential der Zelle wäre die Folge. Die bisherigen Ergebnisse warfen aber die Frage auf, warum nur der heterozygote Genotyp gehäuft bei den jungen Patienten auftritt, die Verteilung der homozygoten 179
180 Diskussion TT-Variante sich zwischen Erkrankten und Kontrollen kaum unterscheidet. Wir würden erwarten, dass ein Vorliegen des homozygoten TT-Genotyp zu einer noch stärkeren Bindung der hsa-mir-3646 führt, was dann eine noch stärkere Herunterregulierung von SFRP1 nach sich ziehen und das maligne Potential der Zelle noch mehr erhöhen würde. So wäre zu erwarten gewesen, dass sich das Auftreten der TT-Variante zwischen Fällen und Kontrollen noch mehr unterscheiden und noch mehr Krebspatienten den TT-Genotyp aufweisen würden. Um den Einfluss von hsa-mir-603 und hsa-mir-3646 bei Entstehung und Progression des Urothelkarzinoms der Harnblase aufzuklären, wurden zunächst die Loci der beiden mikrornas in unseren 19 acgh Tumoren auf Deletionen oder Amplifikationen bzw. auf eine Veränderung der Kopienzahl untersucht. Für hsa-mir- 603 (Chromosom 10p12.1: ) konnten keine Veränderungen der Kopienzahl und auch keine genetischen Verluste oder Zugewinne sowohl in pta als auch in pt1 Tumoren verzeichnet werden. Es waren immer zwei Kopien des entsprechenden DNA-Abschnittes auf Chromosom 10 vorhanden. Für hsa-mir-3646 (Chromosom 20q13.12: ) konnten wir jedoch einen beträchtlichen Unterschied zwischen pta und pt1 Tumoren feststellen. 1/9 pta (11%), jedoch 6/10 (60%) der pt1-tumoren wiesen eine Amplifikation des hsa-mir Lokus auf. Die Amplifikation ging jeweils mit dem Zugewinn einer Genkopie einher, sodass die Kopienzahl des für die mirna kodierenden Abschnittes jeweils drei Kopien betrug. Diese Ergebnisse bestärken unsere Vermutung, dass es beim Fortschreiten der Erkrankung zu einer erhöhten Expression von hsa-mir-3646 und somit zu verstärktem Abbau der SFRP1 mrna bei T-Allelträgern in rs3242 kommt. Interessant ist dabei aber auch, dass der hsa-mir-3646 Genlokus in dreifacher Ausführung vorliegt. Eine noch stärkere Amplifikation mit vier oder mehr Genkopien konnte nicht beobachtet werden. Das bedeutet auch, dass wahrscheinlich eine geringfügige Steigerung der mirna Expression schon gravierende funktionelle und phänotypische Ausprägungen mit sich bringt. Bisherige Ergebnisse deuten darauf hin, dass lediglich hsa-mir-3646, nicht aber hsa-mir-603 eine Funktion als Onkogen bei der urothelialen Karzinogenese spielen könnte. Eine mikrorna-induzierte Aktivierung von Progressions- und Tumor-assoziierten Signalwegen in der Blase ist auch schon aus anderen Signalwegen, wie beispielsweise dem Sonic Hedgehog (Shh)-Signalweg bekannt. Hier war die 180
181 Diskussion Deregulation von hsa-mir-92a, 19A und 20A mit verkürztem Gesamtüberleben und mit Überexpression von Shh und Gli-induzierbaren Zielgenen beim muskel-invasiven Blasenkrebs korreliert [162] Es wäre also denkbar, dass auch beim Wnt-Signalweg mikrornas eine wichtige Rolle bei der Entstehung und Progression der Erkrankung spielen könnten. Für eine tiefgehendere Analyse wurde im Weiteren eine Expressionsanalyse der beiden mikrornas in Blasenkrebszelllinien und Blasentumoren durchgeführt. HsamiR-603 wurde nur sehr schwach, hsa-mir-3646 hingegen recht stark in Blasenkrebs-Zelllinien und in Tumorgewebe exprimiert. Möglicherweise repräsentiert die Expressionsstärke der hsa-mir-603 die normale und nur sehr geringe mikrorna- Menge, die in der Zelle exprimiert wird. Dies wird auch dadurch bestärkt, dass in der acgh keine Deletion und keine Verringerung des Kopienzahl-Status für hsa-mir-603 beobachtet werden konnte. Die erhöhte Expression von hsa-mir-3646 könnte durch eine Überexpression im Rahmen einer Amplifikation bzw. einer Kopienzahl-Erhöhung begründet sein (siehe oben). Nach der Überexpression von hsa-mir-603 in RT4 konnte eine erhöhte Expression von SFRP1 auf mrna-ebene, sowie das Absterben der Zellen beobachtet werden. Bei RT112 und J82 war kein solcher Effekt sichtbar. RT4 wies den heterozygoten CT-Genotyp des rs3242 SNPs in SFRP1 auf. mirbase konnte eine Bindung von hsamir-603 bei Vorliegen des T-Allels vorhersagen. Man würde erwarten, dass bei der Bindung von hsa-mir-603 an die SFRP1-mRNA, diese abgebaut oder inaktiviert wird, es so zur Aktivierung des Wnt-Signalweges und zur Erhöhung des malignen Potentials (z.b. gesteigerte Proliferation und Migration) der Zelle kommt. Doch das Gegenteil schien der Fall zu sein. Durch die Anwesenheit von hsa-mir-603 in der Zelle kam es zur Erhöhung der SFRP1-Expression und zu einem scheinbar dadurch bedingten Wachstumsstopp bzw. Zelltod der Zellen. Es ist natürlich auch möglich, dass hsa-mir-603 auch an andere mrnas, als SFRP1 bindet, die dann wiederum die Expression von SFRP1 aktivieren könnten. Bei der Analyse der hsa-mir-603 Sequenz mit dem basic local alignement search tool (BLAST) ergaben sich 7797 Treffer für verschiedenste Gene auf unterschiedlichen Chromosomen. Kruepple-likefactor 6, Lysozyme-like protein 1, Frizzled-8 precursor, Rho-GTPase-activating protein 21, Neuropilin-1, Calmoduline-like protein 3, Ras-related protein Rab-18 und Homeobox protein Mohawk sind nur einige der möglichen Kandidatengene, die durch hsa-mir-603 gebunden und gegebenenfalls auch reguliert werden (Stand 181
182 Diskussion ). Es bleibt also sehr spekulativ zu vermuten, durch welches andere Gen SFRP1 in RT4 durch die Anwesenheit von hsa-mir-603 heraufreguliert wurde. Die vorliegenden Untersuchungen lassen vermuten, dass hsa-mir-603 keine, durch Amplifikation oder anderweitige Überexpression bedingte, herausragende Rolle bei der SFRP1-Regulation von Blasenkrebs spielt. Die Überexpression scheint dennoch eine wichtige Funktion auf die biologischen Effekte der Zelle zu haben, was aber wohl hauptsächlich auf die Funktion eines sozusagen universellen Mediators und Genregulators zurückzuführen ist. Es wäre aber dennoch interessant abzuklären, ob es in der Zelle zu einer reellen Bindung von hsa-mir-603 mit der SFRP1-mRNA kommt. Leider war ein Überexpressions-Plasmid von hsa-mir-3646 zum Zeitpunkt der Experimentendurchführung noch nicht verfügbar. Sobald es kommerziell erhältlich ist, soll auch der Einfluss der Überexpression von hsa-mir-3646 in Blasenkrebszelllinien bzw. in einer normalen Urothelzelllinie untersucht werden. Alternativ ist geplant, die Vorläuferform der mikrorna (premature mirna) in die Zelle zu schleusen und dann funktionelle Effekte zu analysieren. Ein entsprechendes Konstrukt ist bereits kommerziell erhältlich. Es lässt sich aber auch für diese mikrorna vermuten, dass sie die Funktion eines universellen Regulators übernimmt und deshalb möglicherweise auch Auswirkungen auf die SFRP1-mRNA hat. Beim Vergleich der Nukleotidsequenz mit BLAST konnten 2984 Treffer verzeichnet werden, unter anderem mit TATA box-binding protein-like protein 2, Estrogen receptor beta, DNA repair protein RAD51, Steroid hormone receptor ERR2, Serine-protein kinase ATM und vielen anderen (Stand ). In unserer Studie konnte nachgewiesen werden, dass der Genotyp des SFRP1 SNP rs3242 das Erkrankungsalter signifikant beeinflusst und eine mögliche Überexpression von hsa-mir-3646 darin involviert ist. Die genauen biologischen Mechanismen dahinter bedürfen aber noch weiterer Aufklärung und sollen in folgenden Experimenten und Studien in unserer Arbeitsgruppe weiter analysiert werden. Die Genotypenverteilung in rs zeigte keine Assoziation mit einem Risiko für Blasenkrebs, weder in der gesamten Tumorkohorte, noch in den jungen Patienten 182
183 Diskussion mit Erkrankungsalter unter 45 Jahren. Sims et al postulierte, dass der SNP in der 3 UTR von SFRP1 liegt und somit potentielle mikrorna-bindestellen beeinflussen könnte. Weitere Nachforschungen ergaben aber, dass der SNP nicht in der 3 UTR, sondern 5 -upstream vor dem SFRP1-Gen liegt. Dort liegen bekanntlicherweise keine mikrorna-bindestellen, sondern Enhancer- und Silencer-Strukturen, die die Anlagerung von Transkriptionskomplexen an den Promotor verändern können. In unserem Fall scheinen Enhancer- und/oder Silencer-Strukturen aber durch den rs SNP nicht verändert zu werden. Rs spielt beim Harnblasenkarzinom keine tragende Rolle. acgh-analyse: Bei SFRP1 handelt es sich um ein vielversprechendes Kandidatengen auf Chromosom 8p, das häufig von Deletionen auf diesem Chromosomenabschnitt bei Blasenkrebs betroffen ist. Um auch andere Gene zu identifizieren, die von solchen Deletionen betroffen sind, haben wir eine hochauflösende vergleichende genomische Hybridisierung von 9 nicht-invasiven (pta) und 10 nicht-muskel-invasiven (pt1) Tumoren durchgeführt. Wir konnten zahlreiche Gene identifizieren, die durch Mikrodeletionen in pta-tumoren betroffen waren und die somit potenzielle Progressionsmarker papillärer Blasentumoren darstellen. Vor der Konzentration auf ein bestimmtes Gen und die damit verbundenen funktionellen Analysen wurde zunächst eine Cluster-Analyse mit den Daten der array-cgh durchgeführt. Alle 19 analysierten Tumoren wurden hinsichtlich Kopienzahl-Veränderungen (= CNVs = copy number variations), d.h. homo- oder heterozygoten Deletionen bzw. mindestens triploiden Amplifikationen untersucht. Die zwei Untergruppen entstanden dann durch Clusterung der 19 markantesten Marker, die aufgrund der CNV-Ergebnisse erhalten worden waren. Gruppe 1 fasst alle nichtinvasiven Tumoren, Gruppe 2 alle invasiven Tumoren zusammen. Lediglich jeweils ein Tumor weicht von den anderen ab und befindet sich in der jeweils falschen Gruppe. Möglicherweise handelt es sich bei dem pta-tumor, der fälschlicherweise in die Gruppe der invasiven Tumoren geclustert wurde, um die Vorstufe eines Tumors mit erhöhter Invasivität und Malignität, der aus einer Dysplasie (und nicht aus einer Hyperplasie) hervorgegangen ist und somit bezüglich der genetischen Veränderungen den pt1-tumoren ähnlicher ist. Dazu passt die Beobachtung, dass es sich bei diesem Tumor zwar nicht um den Tumor mit der MTUS1-Deletion handelt, 183
184 Diskussion er jedoch als high-grade-tumor beurteilt wurde. Jedoch könnte auch eine fokale Invasivität in dem Schnittpräparat, aus dem die DNA für die array-cgh isoliert wurde, dafür gesorgt haben, dass der Tumor bezüglich der chromosomalen Veränderungen den invasiven pt1-tumoren ähnlicher ist. Bei erneuter Begutachtung des falsch geclusterten pt1-tumors unter dem Mikroskop fällt auf, dass der Tumor minimal invasiv ist, vereinzelt Nekrosen aufweist und deshalb als pt1-tumor gewertet werden muss. Jedoch scheint aufgrund des Gesamtbildes des Tumors eine Clusterung zu den genetisch stabileren pta-tumoren nicht außergewöhnlich. Möglicherweise handelt es sich um einen minimal invasiven pt1-tumor mit einer besseren Prognose [163]. Insgesamt konnte die Cluster-Analyse aber bestätigen, dass es sich bei den beiden Tumorkohorten nicht nur hinsichtlich der Invasivität, sondern auch hinsichtlich der genetischen Veränderungen um zwei unterschiedliche Gruppen handelt. Die acgh- Analyse und die Betrachtung chromosomaler Veränderungen könnte zukünftig ein wichtiges Hilfsmittel des Pathologen darstellen, die histologische Diagnose zu sichern, beispielsweise bei nicht-zweifelsfreiem Grading und fraglicher Invasion. Doch auch die Analyse von Mutationen in bestimmten Genen spielt eine immer wichtigere Rolle bei der Erstellung von Diagnosen und Prognosen beim Harnblasenkarzinom. Die durchgeführten Mutations-Analysen der 19 Tumoren lieferten folgendes Ergebnis: Acht der neun pta-tumoren wiesen eine Veränderung im FGFR3-Gen auf, fünf davon die Mutation S249C. Diese wird auch in der Literatur als die häufigsten Mutation beschrieben [164], was erneut die Integrität unserer Daten bestätigte. Somit scheint es sich bei diesen pta-tumoren um klassische, gut differenzierte, nicht-invasive Tumoren zu handeln, die aus einer Hyperplasie hervorgegangen sind. Ein Vergleich der Mutations-Analyse mit der Clusterung lieferte allerdings die Erkenntnis, dass es sich bei dem falsch geclusterten pta-tumor und dem pta-tumor ohne FGFR3-Mutation nicht um denselben Tumor handelte, was möglicherweise dessen Zuordnung zur Gruppe der invasiven pt1-tumoren erklärt hätte. Bei den pt1-tumoren waren in drei Fällen Mutationen zu beobachten, wobei es sich immer um die Mutation S249C handelte. Insgesamt passen diese Ergebnisse gut zu der in der Literatur beschriebenen Tatsache, dass sich FGFR3-Mutationen häufiger in gut differenzierten und nicht-invasiven als in schlecht differenzierten und invasiven Tumoren nachweisen lassen [165]. Doch auch Mutationen im PIK3CA-Gen werden als relativ häufig in nicht-invasiven papillären Tumoren beschrieben. Von 184
185 Diskussion unseren 19 untersuchten Tumoren zeigen jedoch nur ein pta- sowie drei pt1- Tumoren eine Mutation in PIK3CA. Die von Lopez-Knowles et al beschriebene Assoziation der PIK3CA-Mutationen mit dem Auftreten von Mutationen im FGFR3- Gen [166] kann in unseren Tumoren nur teilweise bestätigt werden. Der nichtinvasive Tumor pta_5, der als einziger pta-tumor die H1047R-Mutation im PIK3CA- Gen besitzt, zeigte auch eine FGFR3-Mutation (nämlich A393E). Bei den pt1- Tumoren zeigten jedoch drei Tumoren (pt1_7, pt1_8 und pt1_10) jeweils die PIK3CA-Mutation E545K, während drei andere Tumoren (pt1_2, pt1_6 und pt1_9) eine Mutation im FGFR3-Gen (immer S249C) aufwiesen. Bei unseren Tumoren konnte keine deutliche Korrelation zwischen FGFR3- und der PIK3CA-Mutationen nachgewiesen werden. Allerdings ist unsere Kohorte zu klein, um von einem Trend sprechen zu können. Nachdem die Cluster- und Mutationsanalyse die Integrität unserer Daten bestätigt hatte, wurden zunächst alle Gene mit aktuellen Literaturdaten verglichen um eine mögliche bekannte Assoziation mit anderen malignen Erkrankungen abzuklären. Nach eingehender Prüfung, wurde MTUS1 als ein potenzielles Zielgen ausgewählt und seine Expression in Harnblasenkarzinom-Zelllinien, sowie in Blasentumorgewebe analysiert. Im Weiteren wurde MTUS1 ektopisch in RT112 exprimiert und funktionelle Effekte wurden untersucht. Die Rolle von MTUS1 im Urothelkarzinom der Harnblase soll anhand der erhaltenen Ergebnisse im Folgenden diskutiert werden. MTUS1 im Urothelkarzinom der Harnblase: Der Genlokus von MTUS1 oder auch MTSG1 (mitochondrial oder microtubulusassociated protein 1) liegt auf Chromosom 8p ( ) in der Nähe des Markers D8S254, erstreckt sich über 112 kb genomische DNA und besteht aus 17 kodierenden Exons. Die Verwendung von alternativen Exons führt dazu, dass 30 Transkriptvarianten entstehen können, von denen wiederum neun in Proteine translatiert werden. Bei 8 Proteinen handelt es sich um funktionsfähige Polypeptide, ein Protein ist jedoch ein nonsense-derivat. Informationen dazu liefert beispielsweise ( ;r=8: ). Die Bezeichnung des Genprodukts ATIP (Angiotensin II AT2 receptor-interacting protein) oder ATBP (AT2-receptor bindingprotein) leitet sich von seiner Funktion als Interaktionspartner des AT 2 -Rezeptors ab. 185
186 Diskussion Das Protein interagiert mit dem C-Terminus des Rezeptors und unterstützt diesen bei der Hemmung der ERK2-Aktivität des klassischen MAP-Kinase-Weges, bei der Inhibierung der Wachstumsfaktor-induzierten Autophosphorylierung von Rezeptor- Tyrosin-Kinasen, und der Zellproliferation [167]. Die acht verschiedenen MTUS1-Genprodukte werden fünf verschiedenen ATIP- Varianten zugeordnet, nämlich ATIP1, ATIP2, ATIP3a, ATIP3b und ATIP4. Die fünf Transkripte lassen sich, basierend auf der Verteilung im Gewebe und dem Gebrauch der 5 Exons in drei Hauptgruppen einteilen (ATIP1, ATIP3 und ATIP4). ATIP3a, ATIP3b und ATIP2 verwenden alle die gleichen 5 -Exons (1 und 2) und unterscheiden sich durch alternatives Splicing der Exons 3 und/oder 4. ATIP4 und ATIP1 verwenden die Exons 5 und 8, wohingegen ATIP2 das Exon 3 verwendet, welches ein Stopcodon enthält, das zu verfrühtem Abbruch (truncation) des Proteins führt [129]. Die verschiedenen Transkripte lassen sich auch den verschiedenen Isoformen von MTUS1 zuordnen und zeigen eine unterschiedliche Verteilung in menschlichen Geweben. Isoform 1 entspricht ATIP3a und damit dem Protein, das fast ubiquitär in allen Körpergeweben, exklusive Gehirn, exprimiert wird. Die Isoformen 2 und 8 werden dem Transkript ATIP3b zugeordnet, welches ebenfalls in nahezu allen Körpergeweben exprimiert wird. Auch in der Harnblase ist ATIP3 die Variante, die bisher am häufigsten nachgewiesen wurde. Isoform 3 entspricht ATIP4, welches fast ausschließlich im adulten und embryonalen Gehirn, sowie im Cerebellum exprimiert wird. Isoform 4 ist mit ATIP2 gleichzusetzen, über dessen Funktion aber noch nicht sehr viel bekannt ist. Isoform 5 ist lässt sich schließlich ATIP1 zuordnen, welches, wie auch ATIP4 ubiquitär im Gehirn exprimiert wird. Aber auch eine Expression in anderen Geweben, z.b. in der Mundschleimhaut konnte für ATIP1 nachgewiesen werden [168]. Den Isoformen 6 und 7 lassen sich, nach heutigem Kenntnisstand, noch keine Transkriptvarianten zuordnen [129]. MTUS1 wurde zum ersten Mal 2003 von einer Würzburger Forschungsgruppe beschrieben, wo seine Expression funktionell in Pankreaskarzinomzelllinien und diversen Normalgeweben untersucht wurde. Es zeigte sich, dass MTUS1 in allen untersuchten Normalgeweben (z.b. Herz, Gehirn, Placenta, Lunge, Niere) exprimiert wurde. Es wurde zudem festgestellt, dass MTUS1 in den Mitochondrien der humanen Pankreaskarzinomzelle MIA PaCa-2 lokalisiert ist. Außerdem konnte gezeigt werden, dass eine umgekehrte Korrelation zwischen MTUS1-Expression und der Proliferation bzw. dem Differenzierungsgrad bei Pankreastumoren und Zelllinien 186
187 Diskussion bestand. So exprimierten undifferenzierte und schnell proliferierende Zellen und Tumoren (G3) wenig oder kein MTUS1, gut differenzierte (G1 und G2) und langsam proliferierende Zellen oder Tumoren hingegen viel MTUS1. Diese Erkenntnisse führten dann dazu, dass dieses neue potenzielle Tumorsuppressor-Gen den Namen mitochondrial tumor-supressor-1 erhielt. Neben der Rolle als Tumorsuppressor spielt MTUS1 auch eine große Rolle bei der Quieszenz und Differenzierung von benignen Zellen, sowie bei der Gehirnfunktion [123]. Spätere Untersuchungen konnten auch eine enge Assoziation mit der Bewegung der Mikrotubuli und der Mitose nachweisen, die dann die zweite Genbezeichnung microtubule-associated tumor suppressor 1 rechtfertigte [169]. Unsere Untersuchungen zeigten, dass MTUS1 sowohl in normalem Urothel als auch in Blasentumoren exprimiert wurde. In vielen Tumoren war die Expression aber auch verloren gegangen. Die androgen-abhängige Prostatakarzinom-Zelllinie LNCaP wurde als Positivkontrolle eingesetzt und zeigte sowohl in der qrt-pcr als auch im Westernblot die höchste Expression. Im Westernblot konnten Banden bei ca. 60, 80 und 140 kda nachgewiesen werden, wobei jene bei 60 kda (wahrscheinlich ATIP4) die prägnanteste war. Ähnlich wie bei den Pankreaskarzinomzelllinien gab es bei der Analyse der Blasenkrebszelllinien eine Differenzierungsgrad-assoziierte MTUS1- Expression auf mrna-level. So hatten die Normalurothelzellline UROtsa und die gut differenzierte Zelllinie RT4 (G1) die höchsten Expressionslevel, die mittel und schlecht differenzierten Zelllinien BFTC905, J82 (beide G3) und RT112 (G2) hingegen geringere Expressionslevel. Nicht ins Bild passte hierbei aber die Expression in normalen HCV Zellen. Diese Normalurothel-Zelllinie wies die niedrigste Menge an MTUS1-mRNA auf. Festzuhalten bleibt aber, dass alle Zelllinien MTUS1 exprimierten und es keinen Verlust zu verzeichnen gab. Beim anschließenden Vergleich der mrna-expression mit der Proteinexpression mittels Westernblot war die Bande bei ca. 80 kda die dominanteste. Dabei handelt es sich wahrscheinlich um ATIP2 oder ein Dimer der 38 kda-variante. RT4 zeigte hier auf Proteinebene die stärkste Expression. Die ubiquitär vorkommende ATIP3 Variante fehlte hingegen in RT4 und war auch bei allen anderen Zelllinien nur als sehr schwache Bande detektierbar. Auffällig war außerdem auch, dass nur HCV29, J82 und UROtsa eine Bande bei 60 kda (ATIP4) zeigten. Die bisherigen Ergebnisse zeigen, dass sowohl in benignen als auch malignen urothelialen Zelllinien die drei verschiedenen MTUS1-187
188 Diskussion Transkriptvarianten ATIP1, ATIP3 und ATIP4 exprimiert werden und diese somit möglicherweise bei der Krebsentstehung eine Rolle spielen könnten. Die initiale Untersuchung der MTUS1-mRNA-Expression in 7 Tumorproben konnte auch eine Expression nachweisen, die ähnlich der von LNCaP oder höher war. Die Proteinexpression war aber auch hier wieder sehr schwach. Es bleibt zu vermuten, dass es während der Proteinbiosynthese zu einem Abbau oder einer Modifikation der mrna kommt, sodass diese nicht in ein funktionsfähiges Protein umgeschrieben werden kann, bzw. nur noch wenig mrna in das Protein translatiert wird. Eine Möglichkeit für die Regulierung der Genexpression auf posttranslationaler Ebene sind mikrornas [170]. Diese kleinen nicht-kodierenden RNAs binden an die 3 -UTR der Zielgen-mRNA, wodurch entweder deren Translation gehemmt oder die mrna selbst abgebaut wird [171]. Eine in silico-untersuchung der Sequenzen aller proteinkodierenden Ensembl-MTUS1-mRNA-Varianten nach potenziellen mikrorna- Bindestellen mittels mirbase konnte tatsächlich mehrere nicht-kodierende RNAs identifizieren. Als Software-Template wurde die 3 UTR des jeweiligen Transkriptes mit allen anzestralen SNPs eingesetzt. Die verschiedenen SNP-Varianten wurden dabei nicht beachtet. mirbase konnte sieben mikrornas identifizieren, die an die 3 UTR von nahezu allen MTUS1-Transkripten binden. Lediglich MTUS1-004, bestehend aus 4089 Basenpaaren und 1216 Aminosäuren (ATIP3b) zeigte eine ganz andere potenzielle mikrorna an: hsa-mir p. Allen anderen Transkripten wurden eine hohe Bindewahrscheinlichkeit mit den mikrornas hsa-mir p (X- Chromosom), hsa-mir513b (X-Chromosom), hsa-mir-4511 (Chromosom 15), hsamir p (Chromosom 18), hsa-mir-199a-3p (Chromosom 19), hsa-mir-199b- 3p (Chromosom 9) und hsa-mir-450-3p (X-Chromosom) vorausgesagt. Es bestünde die Möglichkeit, dass diese mikrornas im Zuge der urothelialen Karzinogenese amplifiziert oder hochreguliert wären, somit verstärkt an die MTUS1-mRNA binden und somit die Translation inhibieren oder drosseln könnten. Bei bestimmten Entitäten könnten aber auch Deletionen der mikrorna Loci zu einer verminderten Expression der mikrornas und somit zu einer verstärkten MTUS1-Expression führen. In folgenden Experimenten soll deshalb die Expression der genannten mikrornas sowohl in papillären, als auch soliden Blasentumoren untersucht und mit der MTUS1- Expression korreliert werden. Außerdem sollen die mikrornas in Blasenkarzinomzellen überexprimiert und funktionelle Effekte analysiert werden. 188
189 Diskussion Doch auch andere epigenetische Veränderungen könnten eine Rolle spielen. So könnte die Methylierung des MTUS1-Promotors zur (teilweisen) Inaktivierung des MTUS1-Gens und damit zu einem Expressions-Verlust auf Protein-Ebene führen. Aber auch ein, durch die (teilweise) Deletion des MTUS1-Lokus verursachter, Gendosiseffekt wäre denkbar. So könnte eine verminderte, aber nicht gänzlich fehlende MTUS1-Expression, eine Dosis-abhängige veränderte Wirkungsweise der ATIPs nach sich ziehen. Interessant wäre auch herauszufinden, ob Mutationen in MTUS1 vorliegen, die beispielsweise die Halbwertszeit von MTUS1 in der Zelle oder die Bindefähigkeit am AT 2 -Rezeptor verändern. In zukünftigen Experimenten soll deshalb eine Methylierungsanalyse mittels MSP und Promotorsequenzierung, sowie eine mtus1-mutationsanalyse bei Blasenkrebszelllinine und in Blasentumoren aller Varianten durchgeführt werden. Unsere bereits durchgeführten funktionellen Zellkulturversuche bestätigten die Vermutung, dass MTUS1 tumorsuppressive Eigenschaften aufweist. Durch die Überexpression in RT112 wurde die Viabilität, die Migration und in geringem Maße auch die Proliferation herabgesetzt. Um die Expressionsanalyse von MTUS1 in Tumorgewebe zu validieren, wurden zwei große Blasenkrebskohorten auf die Expression von MTUS1 untersucht: ein Kollektiv bestehend aus lediglich biologisch weniger aggressiven papillären Tumoren und ein Kollektiv mit fortgeschrittenen und folglich biologisch aggressiveren Blasenkrebstumoren inklusive seltener Varianten. Bei den analysierten papillären Tumoren zeigte sich, dass die Hälfte aller Tumoren die Expression von MTUS1 verloren hatte. Eine Assoziation mit Überleben und Progression konnte jedoch nicht festgestellt werden. Unsere Vermutung, dass es sich bei MTUS1 um einen neuen Progressionsmarker für das papilläre Harnblasenkarzinom handelt, konnte nicht bestätigt werden. Stattdessen konnten wir aber ein sehr interessantes Phänomen aufdecken, was noch für keine weitere Krebsentität in Zusammenhang mit MTUS1- Expression beobachtet wurde. Eine MTUS1-Expression ging in den papillären Tumoren jeweils mit höherem Stage und Grade, sowie mit einer aberranten Ki67 und CK20 Expression und geringerer Mutationsfrequenz in FGFR3 einher. Das würde bedeuten, dass Tumoren mit MTUS1-Expression ein höheres malignes Potential aufweisen, als Tumoren mit MTUS1-Verlust. Dies widerspricht allen bisherigen Studien zur MTUS1 Expression in menschlichen Zellen. Bisher konnten nur 189
190 Diskussion Korrelationen des MTUS1-Verlustes mit gesteigerter Proliferation und schlechterer Differenzierung beobachtet werden [125, 172]. Interessant war dann der Vergleich zu der Gruppe der fortgeschrittenen und teilweise seltenen Varianten der Harnblasenkarzinome. Hierbei konnten wir eine eindeutige Assoziation mit dem Gesamt- und dem tumorspezifischen Überleben nachweisen. Die Tumoren, die MTUS1 exprimiert hatten, zeigten ein signifikant besseres Überleben als Tumoren mit Expressionsverlust. Diese Beobachtung passte auch wieder zu den Ergebnissen aus Studien zum Pankreas-, Kolon-, Brust- und Prostatakarzinom, in denen eine eindeutige Korrelation zwischen MTUS1-Verlust und erhöhtem malignen Potenzial beobachtet wurde [123, 125, 126, 128]. Die Ergebnisse geben aber erneute Hinweise auf die immer plausibler scheinende Vermutung, dass es sich bei der Karzinogenese des Urothelkarzinoms um zwei verschiedene molekular Entstehungswege mit unterschiedlichen biologischen Funktionen und unterschiedlichem malignem Potenzial handelt [173]. So scheinen sich die papillären von den soliden Tumoren auch hinsichtlich der MTUS1- Expression und der damit verbundenen Funktionen in der Zelle bzw. der involvierten Signalkaskaden zu unterscheiden. Um die Rolle von MTUS1/ATIP bei der Entstehung und Progression des Urothelkarzinoms der Harnblase besser verstehen zu können, ist es essentiell den biologischen Wirkmechanismus in der Zelle, sowie alle beteiligten Signalwege zu charakterisieren. Eine Unterscheidung zwischen papillärem und solidem Entstehungsweg und eine möglicherweise konträre Funktion von MTUS1/ATIP in beiden Wegen sollte in Erwägung gezogen werden. In der Literatur wird sowohl die biologische Funktion von MTUS1/ATIP als auch die des Angiotensin II AT 2 Rezeptors kontrovers diskutiert und ist auch noch nicht gänzlich aufgeklärt. Verschiedene Studien sind sich aber einig, dass ATIP einen wichtigen und regulierenden Bindungspartner des AT 2, nicht aber des AT 1 -Rezeptors des Renin-Angiotensin- Aldosteron-Systems (RAAS) darstellt [174, 175]. Die beiden transmembranen Rezeptoren AT 1 und AT 2 sind zwei wichtige Bestandteile des RAAS und fugieren beide als Rezeptoren für den Oktapeptid- Liganden Angiotensin II. Beim AT 1- Rezeptor handelt es sich um einen klassischen G- Protein-gekoppelten Rezeptor, der die meisten physiologischen Effekte von Angiotensin II vermittelt und dessen Wirkungsweise schon sehr gut charakterisiert ist [176]. Die Aktivierung des AT 1 -Rezeptors durch die Bindung von Angiotensin II 190
191 Diskussion bewirkt vor allem eine Kontraktion von Blutgefäßen, sowie eine, durch eine Konstriktion der efferenten Blutgefäße bedingte, Konstanthaltung der glomerulären Filtrationsrate der Niere. In der Nebenniere stimuliert Angiotensin II die Aldosteronund Adrenalin-Freisetzung und in der Hypophyse eine Freisetzung von Vasopressin. Auch das Durstgefühl wird auf eine akute Stimulation von AT 1 -Rezeptoren im Hypothalamus zurückgeführt. Eine chronische Stimulation des AT 1 -Rezeptors führt hingegen zu einer Stimulation mitogener Effekte und somit beispielsweise zur Hypertrophie des Herzes [177]. Neben der Beeinflussung von Blutdruck und Wasserhaushalt wird dem RAAS aber auch eine wichtige Rolle bei anderen physiologischen Prozessen, wie der Gehirnfunktion, der Gewebe-Remodellierung und eben auch Tumor-assoziierten Prozessen (wie Zellzyklus, Apoptose, Proliferation, Migration, etc.) zugeordnet [178, 179]. MTUS1 bzw. ATIP fungiert also als Interaktionspartner des Angiotensin II AT 2 - Rezeptors des RAAS. Die Bindung des Liganden, Angiotensin II, an den Angiotensin AT 2 Rezeptor führt einerseits zu einem negativem Feedback der Angiotensin AT 1 - Rezeptor-Aktivierung (siehe oben) und andererseits zu anti-proliferativen, antimigratorischen und anti-inflammatorischen Antworten in der Zelle. Die Bindung von ATIP an den Rezeptor imitiert den inhibitorschen Effekt des Rezeptors auf Zellproliferation, RTK-Aktivierung, ERK-Phosphorylierung und steigert den wachstums-inhibitorischen Effekt von AT 2 nach Angiotensin II-Stimulation zugleich noch weiter [180]. Louis et al konnten zeigen, dass eine Herunterregulation von ATIP in den Prostatakarzinom-Zelllininen LNCaP bzw. PC3 zu einer um 30% höheren DNA-Syntheserate bzw. gesteigerter Proliferation in den Zellen führte. Nach Überexpression in PC3 konnte eine verringerte Menge an phosphoryliertem ERK2, sowie verlangsamtes Wachstum beobachtet werden. Außerdem führte die Stimulation der Zellen mit EGF zu einer verminderten Expression von MTUS1/ATIP mrna. Dieser Effekt konnte aber durch die Gabe von Angiotensin II wieder inhibiert werden [128]. Dies lässt vermuten, dass es bei der Angiotensin II-AT2-ATIP- Interaktion einen Crosstalk mit dem MAP-Kinase-Signalweg gibt und dieser vor allem das Zellwachstum über die Komponenten EGF bzw. ERK2 beeinflusst. Auch Nouet et al konnten zeigen dass murines ATIP1 die Phosphorylierung der extracellular signal-related kinase 2 (ERK2), des klassischen MAP-Kinase-Weges vermindert, falls diese durch Insulin und die Wachstumsfaktoren bfgf (basic fibroblast growth factor) und EGF (epidermal growth factor) stimuliert worden waren. Des Weiteren hemmte 191
192 Diskussion das transient transfizierte matip1 die Proliferation von CHO-AT 2 -Klonen und Gefäßmuskelzellen der Ratte, falls diese vorher mit fetalem Kälberserum, EGF, PDGF (platelet-derived growth factor) und bfgf induziert wurden. Diese Effekte setzen lediglich die Expression des Angiotensin II AT 2 -Rezeptors, nicht aber dessen Liganden-Aktivierung voraus. Durch Anwesenheit und Bindung von Angiotensin II wurde die wachstums-inhibitorische Signalkaskade jedoch noch verstärkt [167]. Neben der Fähigkeit von ATIP, durch die Bindung des AT 2 -Rezeptors diesen zu aktivieren, könnten die ATIPs aber auch eine wichtige Rolle bei der Rezeptor-Homooder Hetero-Dimerisierung bzw. bei der Liganden-unabhängigen Rezeptoraktivierung spielen [181]. In zukünftigen Experimenten soll unter anderem überprüft werden, ob es durch das sirna-vermittelte Gensilencing von MTUS1 in UROtsa oder RT4 zu einer Steigerung des malignen Potentials (Proliferation, Migration, Viabilität) kommt. Außerdem sollen Effekte auf die Apoptose nach Überexpression und nach Knockdown mittels sirna untersucht werden. Es scheint auch sehr wichtig zu sein, die verschiedenen Transkriptvarianten von ATIP mittels spezifischen Antikörpern in normalem Urothel, sowie in Urothelkarzinomzelllininen und gewebe genau zu analysieren. Möglicherweise spielt die veränderte Expression von einer oder mehreren Trankskriptvarianten eine entscheidende Rolle bei der Karzinogenese. Es ist auf jeden Fall wichtig MTUS1 nicht isoliert als ein oder das MTUS1 Protein zu sehen. Vielmehr müssen alle Transkripte, sowohl einzeln als auch in Hinblick auf eine mögliche Interaktion oder gemeinsame Wirkungsweise bei der Karzinogenese des humanen Urothels untersucht werden. Es ist deshalb essentiell sowohl auf mrna- Ebene, als auch auf Proteinlevel die Expression aller Transkriptvarianten in Harnblasentumoren zu überprüfen. Des Weiteren soll untersucht werden, ob der AT 2 - Rezeptor überhaupt in Tumoren exprimiert wird und somit als potenzieller Bindungspartner in Frage käme. Interessant wäre dabei auch die Einbeziehung von Protein-Protein-Interaktions-Studien, vor allem zwischen den verschiedenen ATIP- Varianten und dem AT 2 -Rezeptor, in zukünftigen Experimenten. Neben der weiteren Untersuchung von MTUS1 sollte der Fokus auch auf weitere durch die acgh identifizierte potenzielle Progressions-assoziierte Gene gelegt werden. So sollen beispielsweise auch UNC5D, SLC7A2, PDGFRL, FGL1 oder 192
193 Diskussion PCM1 in funktionellen Zellkulturexperimenten sowie in prospektiven Studien analysiert werden. Schlußfolgerung und Ausblick: In der hier vorliegenden Arbeit wurde ein Versuch unternommen, Gene auf Chromosom 8p zu identifizieren und zu charakterisieren, die bei der Risikoabschätzung beim papillären Urothelkarzinom der Harnblase eine entscheidende Rolle spielen könnten. Sowohl SFRP1, als auch MTUS1 sind als Tumorsuppressorgene bekannt und häufig durch Deletionen auf 8p bei Blasenkrebs betroffen. Doch keines der beiden Gene konnte als verlässlicher prognostischer und progressions-assoziierter Marker bestätigt werden. Beide Gene scheinen zwar wichtige Funktionen in den Tumorzellen zu erfüllen und auch für eine Subgruppe von papillären Tumoren eine Aussagekraft zu besitzen, aber die Aussagekraft ist in beiden Fällen nicht eindeutig genug, um sie für eine Anwendung in der Routinediagnostik vorzuschlagen. Dennoch ist es wichtig den biologischen Wirkungsmechanismus und die involvierten Signalwege der beiden Proteine in der Zelle restlos aufzuklären. Möglicherweise liefert der Genotyp des SFRP1 SNP rs3242 wichtige Informationen über das Erkrankungsalter und damit häufig verknüpften seltenen und aggressiven Varianten von Blasenkrebs. Um eine Assoziation mit der hsa-mir-3646 zu bestätigen, soll in geplanten Experimenten die Auswirkung der hsa-mir-3646 Überexpression in Blasenkarzinomzelllinien funktionell untersucht werden. Falls sich bestätigen sollte, dass die mikrorna als Onkogen fungiert und die Expression des Tumorsuppressors SFRP1 reprimiert, könnte die Möglichkeit einer anti-hsa-mir Therapie in Erwägung gezogen werden. Es wäre denkbar, die betreffenden mikrorna mittels Sequenz-spezifischer silencerrnas aus den Urothelzellen zu eliminieren und so den Krankheitsausbruch zu verhindern oder zu verzögern. Außerdem sollte weiter hinterfragt werden, welcher Signalweg für die funktionellen Effekte der SFRP1-Überexpression verantwortlich ist. Es ist unter anderem geplant, eine Involvierung und Aktivität des nicht-kanonischen Signalweges mittels Luziferase-basiertem Assay in papillären Zelllinien zu untersuchen. Doch auch MTUS1 sollte in zukünftigen Experimenten weiter charakterisiert werden. Vor allem in Hinblick auf Patientenkohorten mit fortgeschrittenen Blasenkarzinomen sollte eine Validierung mit großen Studienkollektiven vorgenommen werden um die 193
194 Diskussion Funktion als prognostischen Marker zu bestätigen. Möglicherweise kann MTUS1 als zusätzlicher prognostischer Marker beim fortgeschrittenen Urothelkarzinom Anwendung finden. Doch auch im papillären Urothelkarzinom sollte abgeklärt werden, warum es hier durch den Verlust des vermeintlichen Tumorsuppressors zu einer Erhöhung des malignen Potentials, aber nicht zu einer Beeinflussung des Überlebens und der Progression kommt. So soll MTUS1 mittels sirna in papillären und fortgeschrittenen Harnblasenkarzinomzellen herunterreguliert und funktionelle Effekte, sowie Auswirkungen auf den AT 2 -Rezeptor-Signalweg des RAS analysiert werden. Außerdem sollen wie schon weiter oben erwähnt Methylierungsanalysen des MTUS1-Promotors, sowie Mutationsanalysen im MTUS1-Gen durchgeführt werden. Ziel unserer zukünftigen Experimente und Studien wird bleiben, die biologischen Mechanismen der Karzinogenese des Urothelkarzinoms der Harnblase weiter zu erforschen und zur deren Klärung maßgeblich beizutragen. Außerdem soll weiterhin nach molekularen Markergenen gesucht werden, die zu einer Erleichterung der Risikoeinschätzung von Blasenkrebspatienten, vor allem in Hinblick auf Progression und Prognose, beitragen können. Dabei soll der Schwerpunkt auf genetischen Veränderungen zwischen nicht-invasiven und minimal-invasiven, aber auch zwischen nicht-muskelinvasiven und fortgeschrittenen, muskel-invasiven Tumoren liegen. 194
195 Zusammenfassung 5 Zusammenfassung Bisher fehlen noch immer verlässliche prognostische und progressions-relevante Marker für das papilläre Urothelkarzinom der Harnblase, um eine bessere Risikoabschätzung für den Patienten zu gewährleisten. In der hier vorliegenden Arbeit wurde deshalb ein vielversprechender Marker auf Chromosom 8p12, SFRP1, funktionell in papillären Harnblasenkarzinomlinien untersucht, sowie in einer prospektiven Studie papillärer Tumoren validiert. Außerdem wurde der Einfluss von SFRP1 auch in fortgeschrittenen Tumoren untersucht. Um auch evolutionsbiologische Faktoren in die individuelle Risikoabschätzung zu involvieren, wurden außerdem zwei SNPs in SFRP1, rs3242 und rs921142, in zwei großen Blasenkrebskohorten analysiert und mit der gesunden Kontrollgruppe verglichen. Es zeigte sich, dass SFRP1 das maligne Potential (z.b. Migration und Viabilität) in BFTC905 verringern konnte, der kanonische Wnt-Signalweg aber scheinbar nicht den biologischen Mechanismus dahinter darstellt. Das Gesamtüberleben der Patienten mit papillären Tumoren wurde maßgeblich, wenn auch nicht signifikant, durch SFRP1 beeinflusst. Patienten mit SFRP1-Expression lebten länger. Eine Assoziation mit der Progression konnte aber nicht nachgewiesen werden. Bei fortgeschrittenen Blasenkarzinomen spielte SFRP1 keine Rolle. Der SFRP1-SNP rs3242 beeinflusste das Risiko von Patienten, die im Altern von 45 Jahren an Blasenkrebs erkrankten, maßgeblich. Bei der Gruppe der Erkrankten konnte ein signifikant gehäuftes Auftreten des Risikoallels T beobachtet werden. Eine Erklärung hierfür könnte die verstärkte Expression der mikrorna-3646 bei jungen Blasenkrebspatienten sein. Diese bindet möglicherweise SFRP1 im Bereich des rs3242-snps und beeinflusst so die mrna-stabilität. Der SNP rs hatte keinen Einfluss auf das Erkrankungsrisiko. Diese Studie war, nach unserem Kenntnisstand die erste, die eine Assoziation von SNPs in SFRP1 bei Krebs untersuchte. Neben der Untersuchung von SFRP1, sollten auch andere Kandidatengene auf Chromosom 8p identifiziert werden, die zu einer individuellen Risikoabschätzung beim nicht-invasiven, papillären Urothelkarzinom beitragen könnten. Dazu wurden 9 pta und 10 papilläre pt1-blasentumoren mittels Array-basierter genomischer Hybridisierung (acgh) verglichen. Dieses hochauflösende Deletionsmapping konnte verschiedenen Zielregionen in pta-tumoren identifizieren, in denen Mikrodeletionen 195
196 Zusammenfassung auf Chromosom 8p aufgetreten waren und in denen mögliche Kandidatengene lokalisiert sind. Betroffene Gene waren unter anderem SLC7A2, PDGFL, MTUS1, FGL1, PCM1, UNC5D und GFRA. MTUS1, der microtubule-associated tumor suppressor 1, auf 8p22 wurde anschließend für weitere Analysen ausgewählt und sowohl funktionell in Zelllinien, als auch prospektivisch in den verschiedenen Blasenkrebskohorten untersucht. Ähnlich wie bei SFRP1 konnte gezeigt werden, dass MTUS1 das maligne Potential in einer Blasenkrebszelllinien, RT112, herabsetzte. Bei papillären Tumoren konnte hingegen keine Assoziation mit dem Überleben und der Progression beobachtet werden. Es bestand aber eine inverse Korrelation zwischen MTUS1-Expression und den histopathologischen Parametern Grade, Stage, sowie mit der Ki67 und CK20-Expression. MTUS1 scheint das maligne Potential in papillären Tumoren zu erhöhen. In fortgeschrittenen Tumoren, hingegen wirkt MTUS1 scheinbar als klassischer Tumorsuppressor: ein Expressionsverlust ging mit einem schlechteren Gesamt- und tumorspezifischen Überleben einher. 196
197 Literaturverzeichnis 6 Literaturverzeichnis 1. e.v., R.K.I.R.u.G.d.e.K.i.D., Krebs in Deutschland 2005/2006. Häufigkeiten und Trends. Vol , Berlin, p Ferlay, J., D.M. Parkin, and E. Steliarova-Foucher, Estimates of cancer incidence and mortality in Europe in Eur J Cancer, (4): p Bostrom, P.J., et al., Sex differences in bladder cancer outcomes among smokers with advanced bladder cancer. BJU Int, Castelao, J.E., et al., Gender- and smoking-related bladder cancer risk. J Natl Cancer Inst, (7): p Brennan, P., et al., Cigarette smoking and bladder cancer in men: a pooled analysis of 11 case-control studies. Int J Cancer, (2): p (IARC), I.A.f.R.o.C., Monographs on the evaluation of carcinogenic risks on humans. Tobacco smoke and involutary smoking. Vol : World Health Organisation. 7. Hecht, S.S., Cigarette smoking: cancer risks, carcinogens, and mechanisms. Langenbecks Arch Surg, (6): p Freedman, N.D., et al., Association between smoking and risk of bladder cancer among men and women. JAMA, (7): p Dietrich, H. and B. Dietrich, Ludwig Rehn ( )--pioneering findings on the aetiology of bladder tumours. World J Urol, (2): p Clapp, R.W., M.M. Jacobs, and E.L. Loechler, Environmental and occupational causes of cancer: new evidence Rev Environ Health, (1): p Jankovic, S. and V. Radosavljevic, Risk factors for bladder cancer. Tumori, (1): p Tanguay, C., et al., Leiomyosarcoma of urinary bladder following cyclophosphamide therapy: report of two cases. Mod Pathol, (5): p Murta-Nascimento, C., et al., Epidemiology of urinary bladder cancer: from tumor development to patient's death. World J Urol, (3): p Botelho, M.C., J.C. Machado, and J.M. da Costa, Schistosoma haematobium and bladder cancer: what lies beneath? Virulence, (2): p Fried, B., A. Reddy, and D. Mayer, Helminths in human carcinogenesis. Cancer Lett, (2): p Grossfeld, G.D., et al., Asymptomatic microscopic hematuria in adults: summary of the AUA best practice policy recommendations. Am Fam Physician, (6): p Khadra, M.H., et al., A prospective analysis of 1,930 patients with hematuria to evaluate current diagnostic practice. J Urol, (2): p Tanaka, M.F. and G. Sonpavde, Diagnosis and management of urothelial carcinoma of the bladder. Postgrad Med, (3): p De Dominicis, C., et al., Role of 5-aminolevulinic acid in the diagnosis and treatment of superficial bladder cancer: improvement in diagnostic sensitivity. Urology, (6): p Bubendorf, L., P. Dalquen, and S. Savic, [Cytology of the urinary tract: Between uncertainty and clarity]. Pathologe, Suppl 2: p Lotan, Y. and C.G. Roehrborn, Sensitivity and specificity of commonly available bladder tumor markers versus cytology: results of a comprehensive literature review and meta-analyses. Urology, (1): p ; discussion Budman, L.I., W. Kassouf, and J.R. Steinberg, Biomarkers for detection and surveillance of bladder cancer. Can Urol Assoc J, (3): p Bubendorf, L., et al., Multiprobe FISH for enhanced detection of bladder cancer in voided urine specimens and bladder washings. Am J Clin Pathol, (1): p
198 Literaturverzeichnis 24. Irani, J., et al., BTA stat and BTA TRAK: A comparative evaluation of urine testing for the diagnosis of transitional cell carcinoma of the bladder. Eur Urol, (2): p Kundal, V.K., et al., Role of NMP22 Bladder Check Test in early detection of bladder cancer with recurrence. Asian Pac J Cancer Prev, (5): p Dey, P., Urinary markers of bladder carcinoma. Clin Chim Acta, (1-2): p Eltz, S., et al., Molecular and histological markers in urothelial carcinomas of the upper urinary tract. BJU Int, (5): p Schroeder, G.L., et al., A side by side comparison of cytology and biomarkers for bladder cancer detection. J Urol, (3): p Sobin L.H., Gospodarowicz M., Wittekind C. TNM. Classification of Malignant Tumors. 2009, New York: UICC, p Eble J.N., Sauter G., Epstein J.I., Sesterhenn I.A., editors, World Health Organisation Classification of Tumours. Pathology and Genetics: Tumours of the Urinary System and Male Genital Organs. 2004, Lyon, France: IARC Press, p Mostofi F.K., International Histological Classification of Tumors. Histological Typing of Urinary Bladder Tumors. Vol. No , Geneva: Springer. 32. Tuna, B., et al., Histologic grading of urothelial papillary neoplasms: impact of combined grading (two-numbered grading system) on reproducibility. Virchows Arch, (6): p Retz, M., et al., [The latest news on bladder cancer]. Urologe A, (7): p , Otto, W., et al., The WHO classification of 1973 is more suitable than the WHO classification of 2004 for predicting survival in pt1 urothelial bladder cancer. BJU Int, (3): p Stöhr R, H.A., Histopathologie und Molekulargenetik des Harnblasenkarzinoms. Onkologe, : p Dalbagni, G., The management of superficial bladder cancer. Nat Clin Pract Urol, (5): p Babjuk, M., et al., EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder, the 2011 update. Eur Urol, (6): p Volpe, A., et al., Mitomycin C for the treatment of bladder cancer. Minerva Urol Nefrol, (2): p Manoharan, M., Intravesical therapy for urothelial carcinoma of the bladder. Indian J Urol, (2): p Feifer, A.H., et al., Maximizing cure for muscle-invasive bladder cancer: integration of surgery and chemotherapy. Eur Urol, (6): p Knuchel, R., et al., [Precancerous lesions of the urothelium. From Feulgen staining to single cell CGH]. Pathologe, (5): p Luis, N.M., E. Lopez-Knowles, and F.X. Real, Molecular biology of bladder cancer. Clin Transl Oncol, (1): p Devlin, J., A.J. Keen, and M.A. Knowles, Homozygous deletion mapping at 9p21 in bladder carcinoma defines a critical region within 2cM of IFNA. Oncogene, (9): p van Rhijn, B.W., et al., The fibroblast growth factor receptor 3 (FGFR3) mutation is a strong indicator of superficial bladder cancer with low recurrence rate. Cancer Res, (4): p Cordon-Cardo, C., Molecular alterations associated with bladder cancer initiation and progression. Scand J Urol Nephrol Suppl, 2008(218): p De, A., Wnt/Ca2+ signaling pathway: a brief overview. Acta Biochim Biophys Sin (Shanghai), Nusslein-Volhard, C. and E. Wieschaus, Mutations affecting segment number and polarity in Drosophila. Nature, (5785): p
199 Literaturverzeichnis 48. Nusse, R. and H.E. Varmus, Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome. Cell, (1): p Nelson, W.J. and R. Nusse, Convergence of Wnt, beta-catenin, and cadherin pathways. Science, (5663): p Kawano, Y. and R. Kypta, Secreted antagonists of the Wnt signalling pathway. J Cell Sci, (Pt 13): p Moon, R.T., et al., WNT and beta-catenin signalling: diseases and therapies. Nat Rev Genet, (9): p Loughlin, J., et al., Functional variants within the secreted frizzled-related protein 3 gene are associated with hip osteoarthritis in females. Proc Natl Acad Sci U S A, (26): p Konigshoff, M., et al., Functional Wnt signaling is increased in idiopathic pulmonary fibrosis. PLoS One, (5): p. e Miyaoka, T., H. Seno, and H. Ishino, Increased expression of Wnt-1 in schizophrenic brains. Schizophr Res, (1): p Klaus, A. and W. Birchmeier, Wnt signalling and its impact on development and cancer. Nat Rev Cancer, (5): p Bodmer, W.F., et al., Genetic analysis of colorectal cancer. Princess Takamatsu Symp, : p Senda, T., A. Shimomura, and A. Iizuka-Kogo, Adenomatous polyposis coli (Apc) tumor suppressor gene as a multifunctional gene. Anat Sci Int, (3): p Hu, J., et al., Blockade of Wnt signaling inhibits angiogenesis and tumor growth in hepatocellular carcinoma. Cancer Res, (17): p Wei, W., et al., Blockade of Wnt-1 signaling leads to anti-tumor effects in hepatocellular carcinoma cells. Mol Cancer, : p Polakis, P., Wnt signaling and cancer. Genes Dev, (15): p Stoehr, R., et al., No evidence for involvement of beta-catenin and APC in urothelial carcinomas. Int J Oncol, (5): p Thievessen, I., et al., E-cadherin involved in inactivation of WNT/beta-catenin signalling in urothelial carcinoma and normal urothelial cells. Br J Cancer, (12): p Rieger-Christ, K.M., et al., Restoration of plakoglobin expression in bladder carcinoma cell lines suppresses cell migration and tumorigenic potential. Br J Cancer, (12): p Marsit, C.J., et al., Epigenetic inactivation of SFRP genes and TP53 alteration act jointly as markers of invasive bladder cancer. Cancer Res, (16): p Urakami, S., et al., Epigenetic inactivation of Wnt inhibitory factor-1 plays an important role in bladder cancer through aberrant canonical Wnt/beta-catenin signaling pathway. Clin Cancer Res, (2): p Jensen, T.J., et al., Epigenetic mediated transcriptional activation of WNT5A participates in arsenical-associated malignant transformation. Toxicol Appl Pharmacol, (1): p Costa, V.L., et al., Epigenetic regulation of Wnt signaling pathway in urological cancer. Epigenetics, (4): p Ahmad, I., et al., Ras mutation cooperates with beta-catenin activation to drive bladder tumourigenesis. Cell Death Dis, : p. e Shin, K., et al., Hedgehog/Wnt feedback supports regenerative proliferation of epithelial stem cells in bladder. Nature, (7341): p Fukuhara, K., et al., Secreted frizzled related protein 1 is overexpressed in uterine leiomyomas, associated with a high estrogenic environment and unrelated to proliferative activity. J Clin Endocrinol Metab, (4): p Foronjy, R., et al., The divergent roles of secreted frizzled related protein-1 (SFRP1) in lung morphogenesis and emphysema. Am J Pathol, (2): p
200 Literaturverzeichnis 72. Wang, W.H., et al., Increased expression of the WNT antagonist sfrp-1 in glaucoma elevates intraocular pressure. J Clin Invest, (3): p Dahl, E., et al., Frequent loss of SFRP1 expression in multiple human solid tumours: association with aberrant promoter methylation in renal cell carcinoma. Oncogene, (38): p Veeck, J., et al., Aberrant methylation of the Wnt antagonist SFRP1 in breast cancer is associated with unfavourable prognosis. Oncogene, (24): p Ugolini, F., et al., WNT pathway and mammary carcinogenesis: loss of expression of candidate tumor suppressor gene SFRP1 in most invasive carcinomas except of the medullary type. Oncogene, (41): p Takada, T., et al., Methylation-associated silencing of the Wnt antagonist SFRP1 gene in human ovarian cancers. Cancer Sci, (9): p Tanaka, J., et al., Silencing of secreted frizzled-related protein genes in MSI colorectal carcinogenesis. Hepatogastroenterology, (85): p Suzuki, H., et al., A genomic screen for genes upregulated by demethylation and histone deacetylase inhibition in human colorectal cancer. Nat Genet, (2): p Caldwell, G.M., et al., The Wnt antagonist sfrp1 in colorectal tumorigenesis. Cancer Res, (3): p Shih, Y.L., et al., SFRP1 suppressed hepatoma cells growth through Wnt canonical signaling pathway. Int J Cancer, (5): p Gumz, M.L., et al., Secreted frizzled-related protein 1 loss contributes to tumor phenotype of clear cell renal cell carcinoma. Clin Cancer Res, (16): p Stoehr, R., et al., Deletions of chromosome 8p and loss of sfrp1 expression are progression markers of papillary bladder cancer. Lab Invest, (4): p Urakami, S., et al., Combination analysis of hypermethylated Wnt-antagonist family genes as a novel epigenetic biomarker panel for bladder cancer detection. Clin Cancer Res, (7 Pt 1): p Neuhausen, A., et al., DNA methylation alterations in urothelial carcinoma. Cancer Biol Ther, (8): p Sun, J., et al., Hypermethylated SFRP1, but none of other nine genes "informative" for western countries, is valuable for bladder cancer detection in Mainland China. J Cancer Res Clin Oncol, (12): p Serizawa, R.R., et al., Integrated genetic and epigenetic analysis of bladder cancer reveals an additive diagnostic value of FGFR3 mutations and hypermethylation events. Int J Cancer, (1): p Chen, P.C., et al., Distinct DNA methylation epigenotypes in bladder cancer from different Chinese sub-populations and its implication in cancer detection using voided urine. BMC Med Genomics, : p Nusbaum, C., et al., DNA sequence and analysis of human chromosome 8. Nature, (7074): p Tabares-Seisdedos, R. and J.L. Rubenstein, Chromosome 8p as a potential hub for developmental neuropsychiatric disorders: implications for schizophrenia, autism and cancer. Mol Psychiatry, (6): p Yen, C.C., et al., Chromosomal aberrations of malignant pleural effusions of lung adenocarcinoma: different cytogenetic changes are correlated with genders and smoking habits. Lung Cancer, (3): p Shen, H., et al., Genomic alterations in lung adenocarcinomas detected by multicolor fluorescence in situ hybridization and comparative genomic hybridization. Cancer Genet Cytogenet, (2): p Hughes, S., et al., Meta-analysis and pooled re-analysis of copy number changes in colorectal cancer detected by comparative genomic hybridization. Anticancer Res, (5A): p
201 Literaturverzeichnis 93. Sanjmyatav, J., J. Schubert, and K. Junker, Comparative study of renal cell carcinoma by CGH, multicolor-fish and conventional cytogenic banding analysis. Oncol Rep, (5): p Emi, M., et al., Frequent loss of heterozygosity for loci on chromosome 8p in hepatocellular carcinoma, colorectal cancer, and lung cancer. Cancer Res, (19): p Wolff, E.M., G. Liang, and P.A. Jones, Mechanisms of Disease: genetic and epigenetic alterations that drive bladder cancer. Nat Clin Pract Urol, (10): p A haplotype map of the human genome. Nature, (7063): p Brookes, A.J., The essence of SNPs. Gene, (2): p Stephens, J.C., Single-nucleotide polymorphisms, haplotypes, and their relevance to pharmacogenetics. Mol Diagn, (4): p Altshuler, D.M., et al., Integrating common and rare genetic variation in diverse human populations. Nature, (7311): p Samson, M., et al., Resistance to HIV-1 infection in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature, (6593): p Rubinsztein, D.C. and D.F. Easton, Apolipoprotein E genetic variation and Alzheimer's disease. a meta-analysis. Dement Geriatr Cogn Disord, (3): p Sims, A.M., et al., Genetic analyses in a sample of individuals with high or low BMD shows association with multiple Wnt pathway genes. J Bone Miner Res, (4): p Ohnaka, K., et al., Association of single nucleotide polymorphisms in secreted frizzled-related protein 1 gene with bone mineral density in Japanese women. Geriatr Gerontol Int, (3): p Lehmann, J., et al., Adjuvant cisplatin plus methotrexate versus methotrexate, vinblastine, epirubicin, and cisplatin in locally advanced bladder cancer: results of a randomized, multicenter, phase III trial (AUO-AB 05/95). J Clin Oncol, (22): p Masters, J.R., et al., Tissue culture model of transitional cell carcinoma: characterization of twenty-two human urothelial cell lines. Cancer Res, (7): p Tzeng, C.C., et al., Characterization of two urothelium cancer cell lines derived from a blackfoot disease endemic area in Taiwan. Anticancer Res, (4A): p Rieger, K.M., et al., Human bladder carcinoma cell lines as indicators of oncogenic change relevant to urothelial neoplastic progression. Br J Cancer, (3): p Hatina, J., et al., [Bladder carcinoma cell lines as models of the pathobiology of bladder cancer. Review of the literature and establishment of a new progression series]. Urologe A, (6): p Rossi, M.R., et al., The immortalized UROtsa cell line as a potential cell culture model of human urothelium. Environ Health Perspect, (8): p Christensen, B., et al., A classification of human urothelial cells propagated in vitro. Anticancer Res, (6): p Horoszewicz, J.S., et al., LNCaP model of human prostatic carcinoma. Cancer Res, (4): p Carey, T.E., et al., Cell surface antigens of human malignant melanoma: mixed hemadsorption assays for humoral immunity to cultured autologous melanoma cells. Proc Natl Acad Sci U S A, (9): p Leibovitz, A., et al., Classification of human colorectal adenocarcinoma cell lines. Cancer Res, (12): p
202 Literaturverzeichnis 114. Pfaffl, M.W., A new mathematical model for relative quantification in real-time RT- PCR. Nucleic Acids Res, (9): p. e van Oers, J.M., et al., A simple and fast method for the simultaneous detection of nine fibroblast growth factor receptor 3 mutations in bladder cancer and voided urine. Clin Cancer Res, (21): p Burger, M., et al., Mcm2 predicts recurrence hazard in stage Ta/T1 bladder cancer more accurately than CK20, Ki67 and histological grade. Br J Cancer, (11): p Stoehr, R., et al., Histologic-genetic mapping by allele-specific PCR reveals intraurothelial spread of p53 mutant tumor clones. Lab Invest, (11): p Knowles, M.A., Molecular subtypes of bladder cancer: Jekyll and Hyde or chalk and cheese? Carcinogenesis, (3): p Blaveri, E., et al., Bladder cancer stage and outcome by array-based comparative genomic hybridization. Clin Cancer Res, (19 Pt 1): p Erill, N., et al., Genetic and immunophenotype analyses of TP53 in bladder cancer: TP53 alterations are associated with tumor progression. Diagn Mol Pathol, (4): p Veltman, J.A., et al., Array-based comparative genomic hybridization for genomewide screening of DNA copy number in bladder tumors. Cancer Res, (11): p Zaharieva, B., et al., High-throughput tissue microarray analysis of CMYC amplificationin urinary bladder cancer. Int J Cancer, (6): p Seibold, S., et al., Identification of a new tumor suppressor gene located at chromosome 8p FASEB J, (9): p Pils, D., et al., Five genes from chromosomal band 8p22 are significantly downregulated in ovarian carcinoma: N33 and EFA6R have a potential impact on overall survival. Cancer, (11): p Zuern, C., et al., Down-regulation of MTUS1 in human colon tumors. Oncol Rep, (1): p Rodrigues-Ferreira, S., et al., 8p22 MTUS1 gene product ATIP3 is a novel anti-mitotic protein underexpressed in invasive breast carcinoma of poor prognosis. PLoS One, (10): p. e Hurst, C.D., et al., A SNaPshot assay for the rapid and simple detection of four common hotspot codon mutations in the PIK3CA gene. BMC Res Notes, : p Louis, S.N., et al., Expression and function of ATIP/MTUS1 in human prostate cancer cell lines. Prostate, (14): p Di Benedetto, M., et al., Structural organization and expression of human MTUS1, a candidate 8p22 tumor suppressor gene encoding a family of angiotensin II AT2 receptor-interacting proteins, ATIP. Gene, (2): p Liu, Y.L., et al., The hypomethylation agent bisdemethoxycurcumin acts on the WIF-1 promoter, inhibits the canonical Wnt pathway and induces apoptosis in human nonsmall-cell lung cancer. Curr Cancer Drug Targets, (9): p Kariola, R., et al., APC and beta-catenin protein expression patterns in HNPCCrelated endometrial and colorectal cancers. Fam Cancer, (2): p Liu, C., et al., Wnt/beta-Catenin pathway in human glioma: expression pattern and clinical/prognostic correlations. Clin Exp Med, (2): p Bovolenta, P., et al., Beyond Wnt inhibition: new functions of secreted Frizzledrelated proteins in development and disease. J Cell Sci, (Pt 6): p Rodriguez, J., et al., SFRP1 regulates the growth of retinal ganglion cell axons through the Fz2 receptor. Nat Neurosci, (10): p Lee, J.L., et al., Autocrine/paracrine secreted Frizzled-related protein 2 induces cellular resistance to apoptosis: a possible mechanism of mammary tumorigenesis. J Biol Chem, (15): p
203 Literaturverzeichnis 136. Chuman, Y., et al., Identification of a peptide binding motif for secreted frizzledrelated protein-1. Peptides, (11): p Round, J. and E. Stein, Netrin signaling leading to directed growth cone steering. Curr Opin Neurobiol, (1): p Hausler, K.D., et al., Secreted frizzled-related protein-1 inhibits RANKL-dependent osteoclast formation. J Bone Miner Res, (11): p Salic, A.N., et al., Sizzled: a secreted Xwnt8 antagonist expressed in the ventral marginal zone of Xenopus embryos. Development, (23): p Yabe, T., et al., Ogon/Secreted Frizzled functions as a negative feedback regulator of Bmp signaling. Development, (12): p Yokota, Y. and S. Mori, Role of Id family proteins in growth control. J Cell Physiol, (1): p Labbe, E., A. Letamendia, and L. Attisano, Association of Smads with lymphoid enhancer binding factor 1/T cell-specific factor mediates cooperative signaling by the transforming growth factor-beta and wnt pathways. Proc Natl Acad Sci U S A, (15): p Nishita, M., et al., Interaction between Wnt and TGF-beta signalling pathways during formation of Spemann's organizer. Nature, (6771): p Hussein, S.M., E.K. Duff, and C. Sirard, Smad4 and beta-catenin co-activators functionally interact with lymphoid-enhancing factor to regulate graded expression of Msx2. J Biol Chem, (49): p De, A., Wnt/Ca2+ signaling pathway: a brief overview. Acta Biochim Biophys Sin (Shanghai), (10): p Veeman, M.T., J.D. Axelrod, and R.T. Moon, A second canon. Functions and mechanisms of beta-catenin-independent Wnt signaling. Dev Cell, (3): p Yang, Z.Q., et al., Methylation-associated silencing of SFRP1 with an 8p11-12 amplification inhibits canonical and non-canonical WNT pathways in breast cancers. Int J Cancer, (7): p Grochola, L.F., et al., Recent natural selection identifies a genetic variant in a regulatory subunit of protein phosphatase 2A that associates with altered cancer risk and survival. Clin Cancer Res, (19): p Bond, G.L., et al., A single nucleotide polymorphism in the MDM2 promoter attenuates the p53 tumor suppressor pathway and accelerates tumor formation in humans. Cell, (5): p Bougeard, G., et al., Impact of the MDM2 SNP309 and p53 Arg72Pro polymorphism on age of tumour onset in Li-Fraumeni syndrome. J Med Genet, (6): p Ruijs, M.W., et al., The single-nucleotide polymorphism 309 in the MDM2 gene contributes to the Li-Fraumeni syndrome and related phenotypes. Eur J Hum Genet, (1): p Bond, G.L., et al., MDM2 SNP309 accelerates tumor formation in a gender-specific and hormone-dependent manner. Cancer Res, (10): p Swinney, R.M., et al., MDM2 promoter variation and age of diagnosis of acute lymphoblastic leukemia. Leukemia, (11): p Huang, S.F., et al., Combined effects of MDM2 SNP 309 and p53 mutation on oral squamous cell carcinomas associated with areca quid chewing. Oral Oncol, (1): p Nakashima, M., et al., Impact of MDM2 single nucleotide polymorphism on tumor onset in head and neck squamous cell carcinoma. Acta Otolaryngol, (7): p Menin, C., et al., Association between MDM2-SNP309 and age at colorectal cancer diagnosis according to p53 mutation status. J Natl Cancer Inst, (4): p
204 Literaturverzeichnis 157. Wasielewski, M., et al., MDM2 SNP309 accelerates familial breast carcinogenesis independently of estrogen signaling. Breast Cancer Res Treat, (2): p Bartel, F., et al., Both germ line and somatic genetics of the p53 pathway affect ovarian cancer incidence and survival. Clin Cancer Res, (1): p Khatri, R.G., K. Navaratne, and R.J. Weil, The role of a single nucleotide polymorphism of MDM2 in glioblastoma multiforme. J Neurosurg, (5): p Yoon, Y.J., et al., MDM2 and p53 polymorphisms are associated with the development of hepatocellular carcinoma in patients with chronic hepatitis B virus infection. Carcinogenesis, (6): p Sanchez-Carbayo, M., et al., A polymorphism in HDM2 (SNP309) associates with early onset in superficial tumors, TP53 mutations, and poor outcome in invasive bladder cancer. Clin Cancer Res, (11): p Pignot, G., et al., Hedgehog pathway activation in human transitional cell carcinoma of the bladder. Br J Cancer, (6): p Bertz, S., et al., Substaging by estimating the size of invasive tumour can improve risk stratification in pt1 urothelial bladder cancer-evaluation of a large hospital-based single-centre series. Histopathology, (4): p Cappellen, D., et al., Frequent activating mutations of FGFR3 in human bladder and cervix carcinomas. Nat Genet, (1): p van Oers, J.M., et al., FGFR3 mutations and a normal CK20 staining pattern define low-grade noninvasive urothelial bladder tumours. Eur Urol, (3): p Lopez-Knowles, E., et al., PIK3CA mutations are an early genetic alteration associated with FGFR3 mutations in superficial papillary bladder tumors. Cancer Res, (15): p Nouet, S., et al., Trans-inactivation of receptor tyrosine kinases by novel angiotensin II AT2 receptor-interacting protein, ATIP. J Biol Chem, (28): p Ding, X., et al., Down-regulation of tumor suppressor MTUS1/ATIP is associated with enhanced proliferation, poor differentiation and poor prognosis in oral tongue squamous cell carcinoma. Mol Oncol, (1): p Molina, A., et al., [ATIP, a novel superfamily of microtubule-associated proteins]. Med Sci (Paris), (3): p He, L. and G.J. Hannon, MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genet, (7): p Wienholds, E. and R.H. Plasterk, MicroRNA function in animal development. FEBS Lett, (26): p Zuern, C., et al., Microtubule associated tumor suppressor 1 deficient mice develop spontaneous heart hypertrophy and SLE-like lymphoproliferative disease. Int J Oncol, (4): p Castillo-Martin, M., et al., Molecular pathways of urothelial development and bladder tumorigenesis. Urol Oncol, (4): p Horiuchi, M., J. Iwanami, and M. Mogi, Regulation of angiotensin II receptors beyond the classical pathway. Clin Sci (Lond), (4): p Reinemund, J., et al., Poly(ADP-ribose) polymerase-1 (PARP-1) transcriptionally regulates angiotensin AT2 receptor (AT2R) and AT2R binding protein (ATBP) genes. Biochem Pharmacol, (12): p Timmermans, P.B., et al., Angiotensin II receptors and angiotensin II receptor antagonists. Pharmacol Rev, (2): p Fyhrquist, F. and O. Saijonmaa, Renin-angiotensin system revisited. J Intern Med, (3): p Carey, R.M. and H.M. Siragy, Newly recognized components of the renin-angiotensin system: potential roles in cardiovascular and renal regulation. Endocr Rev, (3): p
205 Literaturverzeichnis 179. Dinh, D.T., et al., Angiotensin receptors: distribution, signalling and function. Clin Sci (Lond), (5): p Rodrigues-Ferreira, S. and C. Nahmias, An ATIPical family of angiotensin II AT2 receptor-interacting proteins. Trends Endocrinol Metab, (11): p Mogi, M., M. Iwai, and M. Horiuchi, New insights into the regulation of angiotensin receptors. Curr Opin Nephrol Hypertens, (2): p
206 Abbildungsverzeichnis 7 Abbildungsverzeichnis 1-1 Internet: (Frau), (Mann) 1-2 Internet: /harn2.jpg 1-3 aus: Stöhr R, H.A., Histopathologie und Molekulargenetik des Harnblasenkarzinoms. Onkologe, (12): S aus: Stöhr R, H.A., Histopathologie und Molekulargenetik des Harnblasenkarzinoms. Onkologe, (12): S Internet: l.jpg&imgrefurl= WoDSq6RFBTHq_nbZ7tpG7ByoYug=&h=774&w=1200&sz=170&hl=de&sta rt=41&zoom=1&tbnid=zgfrvi3ozyde1m:&tbnh=97&tbnw=150&ei=hkh4tvna MMyK4gS0gc35Cw&prev=/search%3Fq%3Dwntsignalweg%26start%3D21%2 6um%3D1%26hl%3Dde%26sa%3DN%26tbm%3Disch&um=1&itbs=1 1-6 Internet: ;r=8: Internet/Wikipedia: aus: atasheet.pdf 206
207 Publikationen, Kongresse, Fortbildung 8 Publikationen, Kongressbeiträge, Fortbildungen Publizierte Beiträge: P53 codon 72 (Arg72Pro) polymorphism and prostate cancer risk: association between disease onset and proline genotype. Rogler A, Rogenhofer M, Borchardt A, Lunz JC, Knoell A, Hofstaedter F, Tannapfel A, Wieland W, Hartmann A, Stoehr R. Pathobiology. 2011;78(4): Epub 2011 Jul 19. PMID: Plasmacytoid and micropapillary urothelial carcinoma: rare forms of urothelial carcinoma. Keck B, Stoehr R, Wach S, Rogler A, Nolte E, Hartmann A, Wullich B. Urologe A Feb;50(2): German. PMID: Mutational activation of FGFR3 is not involved in the development of prostate cancer. Koufou S, Lunz JC, Borchardt A, Keck B, Kneitz B, Gaisa NT, Hafner C, Giedl C, Rau TT, Rogler A, Wieland WF, Hartmann A, Stoehr R. Pathobiology. 2010;77(5): Epub 2010 Nov 29. PMID: The plasmacytoid carcinoma of the bladder--rare variant of aggressive urothelial carcinoma. Keck B, Stoehr R, Wach S, Rogler A, Hofstaedter F, Lehmann J, Montironi R, Sibonye M, Fritsche HM, Lopez-Beltran A, Epstein JI, Wullich B, Hartmann A. Int J Cancer Jul 15;129(2): doi: /ijc Epub 2010 Dec 1. PMID:
208 Publikationen, Kongresse, Fortbildung Akzeptierte Beiträge: Methylation dependent activation of CDX1 trough NFκB a link from inflammation to intestinal metaplasia in the human stomach. Rau T, Rogler A, Frischauf M, Jung A, Konturek P, Dimmler A, Faller G, Sehnert B, El-Rifai W, Hartmann A, Voll R, Schneider-Stock R Am J Pathol Beiträge in Vorbereitung (Stand ): 1 Role of rs3242 and rs for the risk of bladder cancer: association between disease onset and genotype in rs3242. British Journal of Cancer. 2 Functional characterisation of SFRP1 expression loss in papillary urothelial carcinoma. 3 Deletion mapping of chromosome 8p and the role of MTUS1 in papillary bladder cancer. Kongressbeiträge: 3rd International IZKF-Symposium (Molecular Therapies), Mai 2009, Kloster Banz/Deutschland Poster: Role of chromosome 8p deletions and loss of SFRP1 in human bladder cancer. Bladder Cancer Meeting (the potential for a multidisciplinary integrative approach), Juni 2009, CNIO, Madrid/Spanien Poster: Histopathological, molecular and clinical characterization of plasmacytoid urothelial carcinoma of the bladder. AACR 2010 (American Association for Cancer Research), 101 st annual meeting, April 2010, Washington/USA Poster: P53 codon 72 SNP (R72P) and prostate cancer risk. (publiziert in den Proceedings 2010) 208
209 Publikationen, Kongresse, Fortbildung 4 th Mildred Scheel Cancer Conference, Mai 2010, Königswinter/Deutschland Poster: Chromosom 8q24 rs SNP and bladder cancer risk. 94. Jahrestagung der Deutschen Gesellschaft für Pathologie e.v. (DGP 2010), Mai 2010, Berlin/Deutschland Poster: P53 Codon 72 SNP (R72P) und HPV als Risikofaktoren für das Prostata- Karzinom. AACR 2011 (American Association for Cancer Research), 102 nd meeting, April 2011, Orlando/USA Poster: Functional Characterisation of SFRP1 expression loss in human papillary bladder cancer. (publiziert in Proceedings 2011) 95. Jahrestagung der Deutschen Gesellschaft für Pathologie e.v. (DGP 2011), Juni 2011, Leipzig/Deutschland Poster 1: Role of SFRP1 SNP rs3242 for the risk of prostate and bladder cancer. Poster 2: Functional characterisation of SFRP1 expression loss in human papillary bladder cancer. (beides publiziert in Der Urologe) 2. Symposium des Deutschen Forschungsverbundes Blasenkarzinom e.v Oktober 2011, Erlangen/Deutschland Kurzvortrag: Progressionsmarker des papillären Urothelkarzinoms. 3. Symposium Urologische Forschung der Deutschen Gesellschaft für Urologie, November 2011, Jena/Deutschland Poster: MTUS1 als neuer Progressionsmarker auf Chromosom 8p beim Harnblasenkarzinom. AACR 2012 (American Association for Cancer Research), 103 rd meeting,31. März-4. April 2012, Chicago/USA Poster: MTUS1 as a potential progression marker at chromosome 8p in bladder cancer. (publiziert in den Proceedings 2012) 209
210 Publikationen, Kongresse, Fortbildung Angemeldet und akzeptiert: 64. Kongress der Deutsche Gesellschaft für Urologie 2012 (DGU 2012), September 2012, Leipzig/Jena Poster: Die Rolle von Chromosom 8p-Deletionen und Verlust der sfrp1 Expression beim Urothelkarzinom der Harnblase. Sonstige Forschungsreisen und Fortbildungen: Workshop Protein Analysis of Tissues, 6. März 2009, TU München Forschungsaufenthalt (acgh-auswertung mit Nexus), August 2009, Erasmus MC, Rotterdam/Niederlande Forschungsaufenthalt (TOP/FOP Assays), August 2009, TU München, Klinikum rechts der Isar, AG Experimentelle Urologie Werksbesichtigung Roche, , Penzberg/Deutschland Forschungsaufenthalt (TOP/FOP Assay), Mai 2011, Universitätsmedizin Göttingen Klinische Forschergruppe 179 Einführung in NGS und Einarbeitung des GS Junior Systems (Roche, Shotgun), September
211 Anhang 9 Anhang 9.1 Abkürzungsverzeichnis (wichtigste Abkürzungen): 5-Aza 5-Aza-2 -deoxyzytidin μ mikro µl Mikroliter µm Mikrometer µm Mikromolar A Absorption AEC 3-Amino-9-Ethylcarbazol APS Ammoniumpersulfat BCA Bicinchoninsäure BIRC5 baculoviral IAP repeat containing 5, Survivin BMP4 bone morphogenetic protein 4 bp Basenpaare BrdU Bromdesoxyuridin BSA Bovine Serum Albumin c Konzentration CCND1 cyclin D1 CDH1 E-Cadherin cdna complementary DNA CIS Carcinoma in situ CMYC v-myc myelocytomatosis viral oncogene homolog CTNNB1 ß-Catenin acgh array-based Comparative Genomic Hybridization csnp codingsnp d Schichtdicke Da Dalton DAPI 4,6-Diamidin-2-phenylindol ddntp Didesoxyribonucleosid Triphosphate DEPC Diethylpyrocarbonat DMSO Dimethylsulfoxid DNA Desoxyribonucleic Acid dntp Desoxyribonucleosid Triphosphate DPBS Dulbecco's Phosphate Buffered Saline DTT 1,4-Dithiothreitol ε molarer (dekadischer) Extinktionskoeffizient E.coli Escherichia coli EDTA Ethylendiamintetraacetat ELISA Enzyme Linked Immunosorbent Assay FCS Fetal Calf Serum FGFR3 fibroblast growth factor receptor 3 FN1 Fibronectin g Gramm GAPDH glyceraldehyde-3-phosphate dehydrogenase HE Hämalaun-Eosin Hg high-grade HKG House-Keeping-Gen HRP Horseradish Peroxidase 211
212 Anhang hsa-mir- Homo sapiens micro Ribonucleic Acid IBR Immunblot Blocking Reagent IF Immunfluoreszenz IHC Immunhistochemie JUP junction plakoglobin k Kilo l Liter LB Lysogeny Broth (Nähr-Medium) lg low-grade m milli M Molar min Minuten ml Milliliter M-MuLV Moloney Murine Leukemia Virus mrna messenger RNA MSP Methylierung-spezifische PCR MTUS1 microtubule associated tumor suppressor 1 MW Mittelwert n Anzahl n nano Opti-MEM modifiziertes Minimum Essential Medium PCR Polymerase Chain Reaction PIK3CA phosphoinositide-3-kinase qrt-pcr quantitative real-time PCR RFLP Restriction-Fragment-Length Polymorphism RNA Ribonucleic Acid rpm rounds per minute RPMI 1640 Roswell Park Memorial Institute (Zellkultur-Medium) rsnp regulatorysnp RT Raumtemperatur SAHA Suberoylanilide Hydoxamic Acid SDS-PAGE Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis sec Sekunden SFRP1 secreted frizzled-related protein 1 SNP Single Nucleotide Polymorphism TAE Tris-Acetat-EDTA TBE Tris-Borat-EDTA TCC Transitional Cell Carcinoma TEMED Tetramethylethylendiamin TG(S) Tris/Glycin (SDS) TMA Tissue-Microarray Tris Tris-(hydroxymethyl)-aminomethan TSA Tyramid Signal Amplification TUR Transurethrale Resektion UC Urothelial Carcinoma UTR untranslated region UV ultraviolet V Volumen WB Westernblot WHO World Health Organization WT/wt Wildtyp 212
213 Anhang 9.2 Hersteller-Angaben Abkürzung Hersteller Abcam Abcam plc, Camebridge/UK Abnova Abnova GmbH c/o EMBLEM, Heidelberg Affymetrix Affymetrix GmbH, München Amaxa Biosystems Amaxa Biosystem, Gaithersbirg/USA bzw. Lonza Group Ltd, Basel/Schweiz Amersham Biosciences Amersham Biosciences Europe GmbH, Freiburg AppliChem AppliChem GmbH, Darmstadt Applied Biosystems Applied Biosystems by Life Technologies GmbH, Darmstadt BD Biosciences Becton Dickinson GmbH, Heidelberg Binder BINDER GmbH, Tuttlingen Biocare Medical Biocare Medical, Concord/USA Bioline Bioline GmbH, Luckenwalde Biomol Biomol GmbH, Hamburg Bio-Rad Bio-Rad Laboratories GmbH, München Biozym Biozym Scientific GmbH, Hessisch Oldendorf BioTek BioTek Instruments GmbH, Bad Friedrichshall Brand Brand GmbH & Co. KG, Wertheim Cell Signaling Cell Signaling Technology Inc., Danvers/USA Dako DakoCytomation, Glostrup/Dänemark Eppendorf Eppendorf AG, Hamburg Esco Esco Technologies Inc., Hatboro/USA Fermentas Fermentas Life Sciences GmbH, St. Leon-Rot GE Healthcare GE Healthcare, München GFL Gesellschaft für Labortechnik GmbH, Burgwedel G. Heinemann G. Heinemann Medizintechnik GmbH, Hamburg Grant-bio Grant Instruments (Cambridge) Ltd, Cambridgeshire/UK Greiner Bio-One Greiner Bio-One GmbH, Frickenhausen HANNA Instruments HANNA Instruments Deutschland GmbH, Kehl am Rhein Hartmann IVF HARTMANN AG, Neuhausen am Rheinfall Heidolph Heidolph Instruments GmbH & Co. KG, Schwabach Ibidi Ibidi Gmbh, Martinsried IKA IKA -Werke GmbH & Co. KG, Staufen Integra INTEGRA Biosciences GmbH, Fernwald Invitrogen Invitrogen by life technologies, Karlsruhe InvivoGen InvivoGen, San Diego, California Jackson Jackson ImmunoResearch Laboratories, Inc., Baltimore/ USA Kern Kern & Sohn GmbH, Balingen-Frommern Lonza Lonza Group Ltd, Basel/Schweiz Machery Nagel MACHERY-NAGEL GmbH & Co. KG, Düren Marienfeld Paul Marienfeld GmbH und Co. KG, Lauda-Königshofen Memmert Memmert GmbH & Co. KG, Schwabach Menzel Menzel Glasbearbeitungswerk GmbH & Co. KG, Braunschweig Metabion metabion international AG, Martinsried Merck Merck KGaA, Darmstadt Millipore Millipore, Billerica/ USA MoBiTec MoBiTec GmbH, Göttingen 213
214 Anhang New England BioLabs Olympus OriGene PALL Life Sciences Pan-Biotech Promega Quanta Qiagen Roche Roth Santa Cruz Sarstedt Scotsman Severin Sigma-Aldrich SPSS Starlab Thermo Scientific Vector laboratories Vilber Lourmat VWR New England BioLabs GmbH, Frankfurt Olympus Europa Holding GmbH, Hamburg Origene Technologies, Inc., Rockville/ USA Pall GmbH, Dreieich PAN-BIOTECH GmbH, Aidenbach Promega GmbH, Mannheim Quanta BioSciences, Inc., Gaithersburg/USA Qiagen GmbH, Hilden Roche Deutschland Holding GmbH, Penzberg Carl Roth GmbH & Co. KG, Karlsruhe Santa Cruz Biotechnology, Inc., Santa Cruz, California/USA Sarstedt AG & Co., Nümbrecht Scotsman Ice Systems, Vernon Hills/USA A. Severin GmbH & Co. KG, Bünde Sigma-Aldrich Chemie GmbH, Taufkirchen SPSS, Chicago/ USA Starlab GmbH, Ahrensburg Thermo Fischer Scientific, Bonn Vector Laboratories, Inc., Burlingame/ USA Vilber Lourmat Deutschland GmbH, Eberhardzell VWR International GmbH, Ismaning 9.3 Schmelzkurven und Eichgeraden der Primeroptimierung und Primereffizienzbestimmung der qrt-pcr Primer Run 1 Run 2 Run 3 Run4 Gesamt [%] AXIN2 Slope -3,179-3,664-3,2733 Threshold 0,177 0,339 0,257 Baseline 3 bis 15 3 bis 20 3 bis 20 Effizienz [%] 106,3 87, ,09 98,62 BMP4 Slope -3,267-3,447-3,508 Threshold 0,03 0,367 0,239 Baseline 3 bis 15 3 bis 15 3 bis 15 Effizienz [%] 102,34 95,04 92,77 96,72 CD44 Slope -3,44-3,47-3,474 Threshold 0,366 0,258 0,297 Baseline 3 bis 15 3 bis 15 3 bis 15 Effizienz [%] 95,294 94,19 94,023 94,5 CMYC Slope -3,614-3,694-3,799 Threshold 0,258 0,251 0,257 Baseline 3 bis 15 3 bis 15 3 bis
215 Anhang Effizienz [%] 89,098 86,513 83,339 86,32 CCND1 Slope -3,776-3,875-3,962 Threshold 0,389 0,474 0,223 Baseline 3 bis 15 3 bis 15 3 bis 15 Effizienz [%] 83,993 81,161 78,81 81,32 GAPDH Slope -3,27-3,31-3,426 Threshold 0,252 0,417 0,297 Baseline 3 bis 15 3 bis 15 3 bis 15 Effizienz [%] 102,074 99,635 95,84 99,18 SFRP1 Slope -3,246-3,57-3,447-3,636 Threshold 0,514 0,382 0,368 0,562 Baseline 3 bis 15 3 bis 15 3 bis 15 3 bis 15 Effizienz [%] 103,251 90,599 95,025 88,36 94,3088 MTUS1 Slope -3,304-3,412-3,645 Threshold 0,1 0,1 0,1 Baseline 3 bis 18 3 bis 18 3 bis 18 Effizienz [%] 100,771 96,378 88,083 95,1 Standardkurven AXIN2: Standardkurven BMP4: 215
216 Anhang Standardkurven CD44: Standardkurven CMYC: Standardkurven CCND1: Standardkurven SFRP1: 216
217 Anhang Standardkurven GAPDH: Standardkurven MTUS1: Schmelzkurven AXIN2: 217
218 Anhang Schmelzkurven BMP4: Schmelzkurve CD44: 218
219 Anhang Schmelzkurven CMYC: Schmelzkurven CCND1: 219
220 Anhang Schmelzkurven SFRP1: Schmelzkurven GAPDH: 220
221 Anhang Schmelzkurve MTUS1: 9.4 Karyogramme der 19 Tumoren der acgh pta_1 pta_3 221
222 Anhang pta_4 pta_5 pta_6 pta_7 pta_8 pta_9 pt1_1 pt1_2 222
223 Anhang pt1_3 pt1_4 pt1_5 pt1_6 pt1_7 pt1_8 pt1_10 223
Molekulare Diagnostik in der Zytologie
 Molekulare Diagnostik in der Zytologie Nicole Pawlaczyk Karsten Neumann Institut für Pathologie Pneumologische Onkologie Lungenkarzinom häufigste krebsbedingte Todesursache für beide Geschlechter dritthäufigste
Molekulare Diagnostik in der Zytologie Nicole Pawlaczyk Karsten Neumann Institut für Pathologie Pneumologische Onkologie Lungenkarzinom häufigste krebsbedingte Todesursache für beide Geschlechter dritthäufigste
Übung 8. 1. Zellkommunikation. Vorlesung Bio-Engineering Sommersemester 2008. Kapitel 4. 4
 Bitte schreiben Sie Ihre Antworten direkt auf das Übungsblatt. Falls Sie mehr Platz brauchen verweisen Sie auf Zusatzblätter. Vergessen Sie Ihren Namen nicht! Abgabe der Übung bis spätestens 05. 05. 08
Bitte schreiben Sie Ihre Antworten direkt auf das Übungsblatt. Falls Sie mehr Platz brauchen verweisen Sie auf Zusatzblätter. Vergessen Sie Ihren Namen nicht! Abgabe der Übung bis spätestens 05. 05. 08
Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information):
 Frauenklinik Gynäkologie und Gynäkologische Onkologie Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information): Universitätsspital Basel Frauenklinik PD Dr. med. Nicole
Frauenklinik Gynäkologie und Gynäkologische Onkologie Patienteninformation: Gentestung bei familiärem Brust- und Eierstockkrebs (Basis-Information): Universitätsspital Basel Frauenklinik PD Dr. med. Nicole
3.9 Brustdrüse der Frau
 ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
ICD-10 C50 Ergebnisse zur 77 3.9 Brustdrüse der Frau Kernaussagen Inzidenz und Mortalität: Die altersstandardisierte Inzidenz von Krebserkrankungen der weiblichen Brustdrüse (Mammakarzinom) ist seit den
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
WAS finde ich WO im Beipackzettel
 WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
WAS finde ich WO im Beipackzettel Sie haben eine Frage zu Ihrem? Meist finden Sie die Antwort im Beipackzettel (offiziell "Gebrauchsinformation" genannt). Der Aufbau der Beipackzettel ist von den Behörden
Darmgesundheit. Vorsorge für ein gutes Bauchgefühl. OA Dr. Georg Schauer
 Vorsorge für ein gutes Bauchgefühl OA Dr. Georg Schauer Darmkrebs ist bei Männern und Frauen die zweithäufigste Krebserkrankung Knapp 7 % der Bevölkerung erkranken bei uns im Laufe ihres Lebens daran Es
Vorsorge für ein gutes Bauchgefühl OA Dr. Georg Schauer Darmkrebs ist bei Männern und Frauen die zweithäufigste Krebserkrankung Knapp 7 % der Bevölkerung erkranken bei uns im Laufe ihres Lebens daran Es
Diese Broschüre fasst die wichtigsten Informationen zusammen, damit Sie einen Entscheid treffen können.
 Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Aufklärung über die Weiterverwendung/Nutzung von biologischem Material und/oder gesundheitsbezogen Daten für die biomedizinische Forschung. (Version V-2.0 vom 16.07.2014, Biobanken) Sehr geehrte Patientin,
Osteoporose. Ein echtes Volksleiden. Schon jetzt zählen die Osteoporose und die damit verbundene erhöhte Brüchigkeit der Knochen
 Osteoporose Osteoporose 9 Osteoporose Ein echtes Volksleiden Schon jetzt zählen die Osteoporose und die damit verbundene erhöhte Brüchigkeit der Knochen in den entwickelten Ländern zu den häufigsten Erkrankungen
Osteoporose Osteoporose 9 Osteoporose Ein echtes Volksleiden Schon jetzt zählen die Osteoporose und die damit verbundene erhöhte Brüchigkeit der Knochen in den entwickelten Ländern zu den häufigsten Erkrankungen
Behandlung von Krebsvorstufen. Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe
 Behandlung von Krebsvorstufen Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe Krebsvorstufen - Was sind Vorstufen von Brustkrebs? - Wie fallen die Krebsvorstufen in der Diagnostik auf? - Welche
Behandlung von Krebsvorstufen Dr. K. Röder Klinik für Frauenheilkunde und Geburtshilfe Krebsvorstufen - Was sind Vorstufen von Brustkrebs? - Wie fallen die Krebsvorstufen in der Diagnostik auf? - Welche
«Eine Person ist funktional gesund, wenn sie möglichst kompetent mit einem möglichst gesunden Körper an möglichst normalisierten Lebensbereichen
 18 «Eine Person ist funktional gesund, wenn sie möglichst kompetent mit einem möglichst gesunden Körper an möglichst normalisierten Lebensbereichen teilnimmt und teilhat.» 3Das Konzept der Funktionalen
18 «Eine Person ist funktional gesund, wenn sie möglichst kompetent mit einem möglichst gesunden Körper an möglichst normalisierten Lebensbereichen teilnimmt und teilhat.» 3Das Konzept der Funktionalen
Vor- und Nachteile der Kastration
 Vor- und Nachteile der Kastration Was versteht man unter Kastration? Unter Kastration versteht man die chirugische Entfernung der Keimdrüsen. Bei der Hündin handelt es sich dabei um die Eierstöcke, beim
Vor- und Nachteile der Kastration Was versteht man unter Kastration? Unter Kastration versteht man die chirugische Entfernung der Keimdrüsen. Bei der Hündin handelt es sich dabei um die Eierstöcke, beim
Klausur zum Modul Molekularbiologie ILS, SS 2010 Freitag 6. August 10:00 Uhr
 Klausur zum Modul Molekularbiologie ILS, SS 2010 Freitag 6. August 10:00 Uhr Name: Matrikel-Nr.: Code Nummer: Bitte geben Sie Ihre Matrikel-Nr. und Ihren Namen an. Die Code-Nummer erhalten Sie zu Beginn
Klausur zum Modul Molekularbiologie ILS, SS 2010 Freitag 6. August 10:00 Uhr Name: Matrikel-Nr.: Code Nummer: Bitte geben Sie Ihre Matrikel-Nr. und Ihren Namen an. Die Code-Nummer erhalten Sie zu Beginn
aus: Emons u.a., Brustkrebs Überlebenshilfe für junge Frauen (ISBN 9783830433972) 2008 Trias Verlag
 2 Diagnose Wenn der Verdacht zur Gewissheit wird Wenn Sie eine Veränderung an Ihrer Brust bemerken, gehen Sie gleich zu Ihrem Frauenarzt! Die meisten Veränderungen sind harmlos und kein Krebs. Aber Sie
2 Diagnose Wenn der Verdacht zur Gewissheit wird Wenn Sie eine Veränderung an Ihrer Brust bemerken, gehen Sie gleich zu Ihrem Frauenarzt! Die meisten Veränderungen sind harmlos und kein Krebs. Aber Sie
APP-GFP/Fluoreszenzmikroskop. Aufnahmen neuronaler Zellen, mit freund. Genehmigung von Prof. Stefan Kins, TU Kaiserslautern
 Über die Herkunft von Aβ42 und Amyloid-Plaques Heute ist sicher belegt, dass sich die amyloiden Plaques aus einer Vielzahl an Abbaufragmenten des Amyloid-Vorläufer-Proteins (amyloid-precursor-protein,
Über die Herkunft von Aβ42 und Amyloid-Plaques Heute ist sicher belegt, dass sich die amyloiden Plaques aus einer Vielzahl an Abbaufragmenten des Amyloid-Vorläufer-Proteins (amyloid-precursor-protein,
40-Tage-Wunder- Kurs. Umarme, was Du nicht ändern kannst.
 40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
40-Tage-Wunder- Kurs Umarme, was Du nicht ändern kannst. Das sagt Wikipedia: Als Wunder (griechisch thauma) gilt umgangssprachlich ein Ereignis, dessen Zustandekommen man sich nicht erklären kann, so dass
Markus Demary / Michael Voigtländer
 Forschungsberichte aus dem Institut der deutschen Wirtschaft Köln Nr. 50 Markus Demary / Michael Voigtländer Immobilien 2025 Auswirkungen des demografischen Wandels auf die Wohn- und Büroimmobilienmärkte
Forschungsberichte aus dem Institut der deutschen Wirtschaft Köln Nr. 50 Markus Demary / Michael Voigtländer Immobilien 2025 Auswirkungen des demografischen Wandels auf die Wohn- und Büroimmobilienmärkte
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß
 Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Soja-Lebensmittel - Quelle von hochwertigem Eiweiß Thesenpapier des wissenschaftlichen Beirats der ENSA Einleitung Eiweiß ist ein wichtiger Grundnährstoff, der für das Wachstum und die Reparatur aller
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Insiderwissen 2013. Hintergrund
 Insiderwissen 213 XING EVENTS mit der Eventmanagement-Software für Online Eventregistrierung &Ticketing amiando, hat es sich erneut zur Aufgabe gemacht zu analysieren, wie Eventveranstalter ihre Veranstaltungen
Insiderwissen 213 XING EVENTS mit der Eventmanagement-Software für Online Eventregistrierung &Ticketing amiando, hat es sich erneut zur Aufgabe gemacht zu analysieren, wie Eventveranstalter ihre Veranstaltungen
Die HIT ist keine Allergie! Da die von ihr ausgelösten. Krankheitsbild. Was ist eine Histamin- Intoleranz?
 Was ist eine Histamin- Intoleranz? Die Histamin-Intoleranz ist eine Pseudoallergie. Die HIT ist keine Allergie! Da die von ihr ausgelösten Gesundheitsstörungen jedoch von allergiebedingten Beschwerden
Was ist eine Histamin- Intoleranz? Die Histamin-Intoleranz ist eine Pseudoallergie. Die HIT ist keine Allergie! Da die von ihr ausgelösten Gesundheitsstörungen jedoch von allergiebedingten Beschwerden
Implantate. Modernste Zahnmedizin für perfekte Ästhetik. Lust auf schöne Zähne
 Implantate Modernste Zahnmedizin für perfekte Ästhetik. Lust auf schöne Zähne Implantate Künstliche Zahnwurzeln Von den meisten Patienten wird festsitzender Zahnersatz gegenüber herausnehmbaren Versorgungen
Implantate Modernste Zahnmedizin für perfekte Ästhetik. Lust auf schöne Zähne Implantate Künstliche Zahnwurzeln Von den meisten Patienten wird festsitzender Zahnersatz gegenüber herausnehmbaren Versorgungen
Primzahlen und RSA-Verschlüsselung
 Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Integration und Auswertung extern erhobener Daten in einem Klinischen Krebsregister am Beispiel von Schilddrüsenkarzinomen
 197 Wegener Folien-5/4_SD/D Dienstag 19.4.25 12:35:3 Integration und Auswertung extern erhobener Daten in einem Klinischen Krebsregister am Beispiel von Schilddrüsenkarzinomen G. Wegener 1, B. Braatz 2,
197 Wegener Folien-5/4_SD/D Dienstag 19.4.25 12:35:3 Integration und Auswertung extern erhobener Daten in einem Klinischen Krebsregister am Beispiel von Schilddrüsenkarzinomen G. Wegener 1, B. Braatz 2,
Privatinsolvenz anmelden oder vielleicht sogar vermeiden. Tipps und Hinweise für die Anmeldung der Privatinsolvenz
 Privatinsolvenz anmelden oder vielleicht sogar vermeiden Tipps und Hinweise für die Anmeldung der Privatinsolvenz Privatinsolvenz anmelden oder vielleicht sogar vermeiden Überschuldet Was nun? Derzeit
Privatinsolvenz anmelden oder vielleicht sogar vermeiden Tipps und Hinweise für die Anmeldung der Privatinsolvenz Privatinsolvenz anmelden oder vielleicht sogar vermeiden Überschuldet Was nun? Derzeit
Patienteninformationsbroschüre Valproat
 Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Patienteninformationsbroschüre Valproat Informationen für Patientinnen Die Informationen in dieser Broschüre sind für Frauen bestimmt, denen Valproat verschrieben wird und die schwanger werden können (Frauen
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Screening Das Programm. zur Früherkennung von Brustkrebs
 Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Mammographie Screening Das Programm zur Früherkennung von Brustkrebs das Mammographie Screening Programm Wenn Sie zwischen 50 und 69 Jahre alt sind, haben Sie alle zwei Jahre Anspruch auf eine Mammographie-Untersuchung
Übersicht Verständnisfragen
 Übersicht Verständnisfragen Herz-Kreislauf-Erkrankungen Chronisch-obstruktive Lungenerkrankung (COPD) Übergewicht und Adipositas Diabetes mellitus Krebserkrankungen HIV und AIDS Rheumatische Erkrankungen
Übersicht Verständnisfragen Herz-Kreislauf-Erkrankungen Chronisch-obstruktive Lungenerkrankung (COPD) Übergewicht und Adipositas Diabetes mellitus Krebserkrankungen HIV und AIDS Rheumatische Erkrankungen
HER2-Diagnostik. Ein Leitfaden für Brustkrebs-Patientinnen
 HER2-Diagnostik Ein Leitfaden für Brustkrebs-Patientinnen Was ist HER2? HER2 vielfach auch als erbb2 oder HER2/neu bezeichnet ist ein Eiweiß bzw. Proteinbaustein an der Oberfläche von Zellen (Rezeptor).
HER2-Diagnostik Ein Leitfaden für Brustkrebs-Patientinnen Was ist HER2? HER2 vielfach auch als erbb2 oder HER2/neu bezeichnet ist ein Eiweiß bzw. Proteinbaustein an der Oberfläche von Zellen (Rezeptor).
Begleittext zum Foliensatz Erbgänge beim Menschen
 Für ein besseres Verständnis der Folien werden vorab einige Begriffe definiert: Gen Genom Allel Ein Gen ist die physikalische und funktionelle Einheit der Vererbung. Biochemisch ist es eine geordnete Abfolge
Für ein besseres Verständnis der Folien werden vorab einige Begriffe definiert: Gen Genom Allel Ein Gen ist die physikalische und funktionelle Einheit der Vererbung. Biochemisch ist es eine geordnete Abfolge
Minimale Resterkrankung, Hochdurchsatz-Sequenzierung und Prognose beim multiplen Myelom
 Minimale Resterkrankung, Hochdurchsatz-Sequenzierung und Prognose beim multiplen Myelom Von Navneet Ramesh und Maike Haehle, übersetzt von Sabine Schock Vom 8. Apr 2014 7:41 Uhr; aktualisiert am 8. Apr
Minimale Resterkrankung, Hochdurchsatz-Sequenzierung und Prognose beim multiplen Myelom Von Navneet Ramesh und Maike Haehle, übersetzt von Sabine Schock Vom 8. Apr 2014 7:41 Uhr; aktualisiert am 8. Apr
in vivo -- Das Magazin der Deutschen Krebshilfe vom 09.11.2010
 Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 09.11.2010 Expertengespräch zum Thema Retinoblastom Und zu diesem Thema begrüße ich jetzt Professor Norbert Bornfeld, Direktor des Zentrums
Seite 1/5 in vivo -- Das Magazin der Deutschen Krebshilfe vom 09.11.2010 Expertengespräch zum Thema Retinoblastom Und zu diesem Thema begrüße ich jetzt Professor Norbert Bornfeld, Direktor des Zentrums
LÄNGER LEBEN BEI GUTER GESUNDHEIT
 LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
LÄNGER LEBEN BEI GUTER GESUNDHEIT Ein Informationsblatt für alle, die über das Angebot einer Vorsorgeuntersuchung nachdenken. Seit 2005 wird in Österreich die neue Vorsorgeuntersuchung angeboten. Bewährtes
Verband der TÜV e. V. STUDIE ZUM IMAGE DER MPU
 Verband der TÜV e. V. STUDIE ZUM IMAGE DER MPU 2 DIE MEDIZINISCH-PSYCHOLOGISCHE UNTERSUCHUNG (MPU) IST HOCH ANGESEHEN Das Image der Medizinisch-Psychologischen Untersuchung (MPU) ist zwiespältig: Das ist
Verband der TÜV e. V. STUDIE ZUM IMAGE DER MPU 2 DIE MEDIZINISCH-PSYCHOLOGISCHE UNTERSUCHUNG (MPU) IST HOCH ANGESEHEN Das Image der Medizinisch-Psychologischen Untersuchung (MPU) ist zwiespältig: Das ist
Das große ElterngeldPlus 1x1. Alles über das ElterngeldPlus. Wer kann ElterngeldPlus beantragen? ElterngeldPlus verstehen ein paar einleitende Fakten
 Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Das große x -4 Alles über das Wer kann beantragen? Generell kann jeder beantragen! Eltern (Mütter UND Väter), die schon während ihrer Elternzeit wieder in Teilzeit arbeiten möchten. Eltern, die während
Erfolg und Vermögensrückgänge angefertigt im Rahmen der Lehrveranstaltung Nachrichtentechnik von: Eric Hansen, eric-hansen@gmx.de am: 07.09.
 Abstract zum Thema Handelssysteme Erfolg und Vermögensrückgänge angefertigt im Rahmen der Lehrveranstaltung Nachrichtentechnik von: Eric Hansen, eric-hansen@gmx.de am: 07.09.01 Einleitung: Handelssysteme
Abstract zum Thema Handelssysteme Erfolg und Vermögensrückgänge angefertigt im Rahmen der Lehrveranstaltung Nachrichtentechnik von: Eric Hansen, eric-hansen@gmx.de am: 07.09.01 Einleitung: Handelssysteme
Neue Entwicklungen in der Behandlung von Darmkrebs. Priv.-Doz. Dr. med. G.-M. Robertz-Vaupel Spessartstrasse 9 53119 Bonn
 Neue Entwicklungen in der Behandlung von Darmkrebs Priv.-Doz. Dr. med. G.-M. Robertz-Vaupel Spessartstrasse 9 53119 Bonn Darmkrebs (kolorektale Karzinome, CRC) streng genommen handelt es sich dabei um
Neue Entwicklungen in der Behandlung von Darmkrebs Priv.-Doz. Dr. med. G.-M. Robertz-Vaupel Spessartstrasse 9 53119 Bonn Darmkrebs (kolorektale Karzinome, CRC) streng genommen handelt es sich dabei um
Behindert ist, wer behindert wird
 Behindert ist, wer behindert wird Alle Menschen müssen lernen, dass Menschen mit Behinderungen gleichberechtigt sind Auf der ganzen Welt leben sehr viele Menschen mit Behinderungen: über 1 Milliarde Menschen
Behindert ist, wer behindert wird Alle Menschen müssen lernen, dass Menschen mit Behinderungen gleichberechtigt sind Auf der ganzen Welt leben sehr viele Menschen mit Behinderungen: über 1 Milliarde Menschen
Studieren- Erklärungen und Tipps
 Studieren- Erklärungen und Tipps Es gibt Berufe, die man nicht lernen kann, sondern für die man ein Studium machen muss. Das ist zum Beispiel so wenn man Arzt oder Lehrer werden möchte. Hat ihr Kind das
Studieren- Erklärungen und Tipps Es gibt Berufe, die man nicht lernen kann, sondern für die man ein Studium machen muss. Das ist zum Beispiel so wenn man Arzt oder Lehrer werden möchte. Hat ihr Kind das
Ihre Protein Analyse
 Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Ihre Protein Analyse Patient Max Dusan Mustermann Sladek... geboren am 17.10.1986... Gewicht 83 kg... Probennummer P07245... Probenmaterial Plasma... Eingang 18.6.2014... Ausgang 7.7.2014 Sehr geehrter
Trockenes Auge. Haben Sie Trockene Augen?
 Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Trockenes Auge Jeder 3 bis 5 Patient, der den Augenarzt besucht, an der Krankheit Trockenes Auge leidet. Ein Trockenes Auge entsteht, wenn der Körper zu wenig Tränenflüssigkeit produziert oder die Zusammensetzung
Zahlenoptimierung Herr Clever spielt optimierte Zahlen
 system oder Zahlenoptimierung unabhängig. Keines von beiden wird durch die Wahrscheinlichkeit bevorzugt. An ein gutes System der Zahlenoptimierung ist die Bedingung geknüpft, dass bei geringstmöglichem
system oder Zahlenoptimierung unabhängig. Keines von beiden wird durch die Wahrscheinlichkeit bevorzugt. An ein gutes System der Zahlenoptimierung ist die Bedingung geknüpft, dass bei geringstmöglichem
Ein neues System für die Allokation von Spenderlungen. LAS Information für Patienten in Deutschland
 Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Ein neues System für die Allokation von Spenderlungen LAS Information für Patienten in Deutschland Ein neues System für die Allokation von Spenderlungen Aufgrund des immensen Mangels an Spenderorganen
Statistische Auswertung:
 Statistische Auswertung: Die erhobenen Daten mittels der selbst erstellten Tests (Surfaufgaben) Statistics Punkte aus dem Punkte aus Surftheorietest Punkte aus dem dem und dem Surftheorietest max.14p.
Statistische Auswertung: Die erhobenen Daten mittels der selbst erstellten Tests (Surfaufgaben) Statistics Punkte aus dem Punkte aus Surftheorietest Punkte aus dem dem und dem Surftheorietest max.14p.
Zu dieser Folie: Schulungsziel: TN kennen wesentliche diagnostische und therapeutische Maßnahmen bei Harnund Stuhlinkontinenz
 Schulungsziel: TN kennen wesentliche diagnostische und therapeutische Maßnahmen bei Harnund Stuhlinkontinenz Zielgruppe: Pflegefachkräfte Zeitrahmen: 90 Minuten Dokumente: Foliensatz 3 Relevante Kapitel:
Schulungsziel: TN kennen wesentliche diagnostische und therapeutische Maßnahmen bei Harnund Stuhlinkontinenz Zielgruppe: Pflegefachkräfte Zeitrahmen: 90 Minuten Dokumente: Foliensatz 3 Relevante Kapitel:
Bis zu 20% aller Menschen erkranken im Laufe ihres Lebens an Depression. Damit ist Depression eine der häufigsten seelischen Erkrankungen.
 Bis zu 20% aller Menschen erkranken im Laufe ihres Lebens an Depression. Damit ist Depression eine der häufigsten seelischen Erkrankungen. Im Jahr 2020 werden Depressionen die Volkskrankheit Nummer Eins
Bis zu 20% aller Menschen erkranken im Laufe ihres Lebens an Depression. Damit ist Depression eine der häufigsten seelischen Erkrankungen. Im Jahr 2020 werden Depressionen die Volkskrankheit Nummer Eins
Ein Blick in die Zukunft, Entwicklung neuer Testverfahren zum Nachweis von Salmonellen und Campylobacter. Dr. Janin Stratmann-Selke
 Ein Blick in die Zukunft, Entwicklung neuer Testverfahren zum Nachweis von Salmonellen und Campylobacter Dr. Janin Stratmann-Selke Salmonellen und Campylobacter als Erreger von Lebensmittelinfektionen
Ein Blick in die Zukunft, Entwicklung neuer Testverfahren zum Nachweis von Salmonellen und Campylobacter Dr. Janin Stratmann-Selke Salmonellen und Campylobacter als Erreger von Lebensmittelinfektionen
Die Post hat eine Umfrage gemacht
 Die Post hat eine Umfrage gemacht Bei der Umfrage ging es um das Thema: Inklusion Die Post hat Menschen mit Behinderung und Menschen ohne Behinderung gefragt: Wie zufrieden sie in dieser Gesellschaft sind.
Die Post hat eine Umfrage gemacht Bei der Umfrage ging es um das Thema: Inklusion Die Post hat Menschen mit Behinderung und Menschen ohne Behinderung gefragt: Wie zufrieden sie in dieser Gesellschaft sind.
Scheper Ziekenhuis Emmen. Tel.: + 31 (0) 591-691 320 Fax: + 31 (0) 591-691 321 Web: www.plastici.nl
 Scheper Ziekenhuis Emmen Tel.: + 31 (0) 591-691 320 Fax: + 31 (0) 591-691 321 Web: www.plastici.nl PREISE Wir bieten Ihnen Brustvergrößerungen von 3000,- bis 5.500,- Euro an. ALLGEMEINE INFORMATIONEN Die
Scheper Ziekenhuis Emmen Tel.: + 31 (0) 591-691 320 Fax: + 31 (0) 591-691 321 Web: www.plastici.nl PREISE Wir bieten Ihnen Brustvergrößerungen von 3000,- bis 5.500,- Euro an. ALLGEMEINE INFORMATIONEN Die
InVo. Information zu Verordnungen in der GKV. Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen. Stand: Februar 2010
 Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Nr. 1 2010 InVo Information zu Verordnungen in der GKV Stand: Februar 2010 Herstellung von Arzneimitteln durch Ärzte Anzeigepflicht bei Bezirksregierungen Bisher konnten Sie als Arzt Arzneimittel (z. B.
Behandlung von Diabetes
 04 Arbeitsanweisung Arbeitsauftrag Anhand des Foliensatzes werden die verschiedenen Behandlungsmethoden bei Diabetes Typ 1 und Typ 2 besprochen. Anschliessend werden noch kurz die Folgen bei einer Nichtbehandlung
04 Arbeitsanweisung Arbeitsauftrag Anhand des Foliensatzes werden die verschiedenen Behandlungsmethoden bei Diabetes Typ 1 und Typ 2 besprochen. Anschliessend werden noch kurz die Folgen bei einer Nichtbehandlung
DER SELBST-CHECK FÜR IHR PROJEKT
 DER SELBST-CHECK FÜR IHR PROJEKT In 30 Fragen und 5 Tipps zum erfolgreichen Projekt! Beantworten Sie die wichtigsten Fragen rund um Ihr Projekt für Ihren Erfolg und für Ihre Unterstützer. IHR LEITFADEN
DER SELBST-CHECK FÜR IHR PROJEKT In 30 Fragen und 5 Tipps zum erfolgreichen Projekt! Beantworten Sie die wichtigsten Fragen rund um Ihr Projekt für Ihren Erfolg und für Ihre Unterstützer. IHR LEITFADEN
Corpus uteri. 3.4 Corpus uteri
 77 Corpus uteri 3.4 Corpus uteri Das Korpuskarzinom ist nach Brust- und Darmkrebs gleich häufig wie Tumoren der Atmungsorgane und somit die dritthäufigste Krebserkrankung der Frau in Deutschland, die allerdings
77 Corpus uteri 3.4 Corpus uteri Das Korpuskarzinom ist nach Brust- und Darmkrebs gleich häufig wie Tumoren der Atmungsorgane und somit die dritthäufigste Krebserkrankung der Frau in Deutschland, die allerdings
Moderne Behandlung des Grauen Stars
 Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
Katarakt Moderne Behandlung des Grauen Stars Sehr geehrte Patientin, sehr geehrter Patient, Bei Ihnen wurde eine Trübung der Augenlinse festgestellt, die umgangssprachlich auch Grauer Star genannt wird.
infach Geld FBV Ihr Weg zum finanzellen Erfolg Florian Mock
 infach Ihr Weg zum finanzellen Erfolg Geld Florian Mock FBV Die Grundlagen für finanziellen Erfolg Denn Sie müssten anschließend wieder vom Gehaltskonto Rückzahlungen in Höhe der Entnahmen vornehmen, um
infach Ihr Weg zum finanzellen Erfolg Geld Florian Mock FBV Die Grundlagen für finanziellen Erfolg Denn Sie müssten anschließend wieder vom Gehaltskonto Rückzahlungen in Höhe der Entnahmen vornehmen, um
Der Gesundheitskompass für die junge Frau
 Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
Haarausfall? Blutentnahme zu Hormonlabor, Eisenwerte, Schilddrüsenwerte, Biotin und Zink 86,87 EURO Wiederholte Scheideninfektionen? Mit dem Vaginalstatus können Infektionen durch spezielle Kulturen auf
Was ist ein Prostatakarzinom?
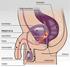 Was ist ein Prostatakarzinom? Das Prostatakarzinom ist die bösartige Neubildung des Prostatadrüsengewebes. Es entsteht meist in der äußeren Region der Drüse, so dass es bei der Untersuchung mit dem Finger
Was ist ein Prostatakarzinom? Das Prostatakarzinom ist die bösartige Neubildung des Prostatadrüsengewebes. Es entsteht meist in der äußeren Region der Drüse, so dass es bei der Untersuchung mit dem Finger
Anwenderdokumentation Prüfung nach dem Heilmittelkatalog
 Ausgabe August 2008 Anwenderdokumentation Prüfung nach dem Heilmittelkatalog 1 Einleitung... 2 2 Stammdateneinstellungen... 3 2.1 Zuordnung der Heilmittel... 3 3 Prüfung einer Verordnung... 7 3.1 Vorgehensweise
Ausgabe August 2008 Anwenderdokumentation Prüfung nach dem Heilmittelkatalog 1 Einleitung... 2 2 Stammdateneinstellungen... 3 2.1 Zuordnung der Heilmittel... 3 3 Prüfung einer Verordnung... 7 3.1 Vorgehensweise
Stammzellentherapien
 Können mit Stammzellen Krankheiten wie Autismus, bzw. das Kanner-Syndrom und Asperger behandelt werden? Diese Vorstellung klingt auf den ersten Blick sehr verlockend, doch was verbirgt sich hinter dem
Können mit Stammzellen Krankheiten wie Autismus, bzw. das Kanner-Syndrom und Asperger behandelt werden? Diese Vorstellung klingt auf den ersten Blick sehr verlockend, doch was verbirgt sich hinter dem
3.19 Non-Hodgkin-Lymphome
 140 Ergebnisse zur Non-Hodgkin-Lymphome 3.19 Non-Hodgkin-Lymphome Kernaussagen Inzidenz und Mortalität: Die altersstandardisierten Inzidenzraten von n und in Deutschland sind von 1980 bis zur Mitte der
140 Ergebnisse zur Non-Hodgkin-Lymphome 3.19 Non-Hodgkin-Lymphome Kernaussagen Inzidenz und Mortalität: Die altersstandardisierten Inzidenzraten von n und in Deutschland sind von 1980 bis zur Mitte der
Berechnung der Erhöhung der Durchschnittsprämien
 Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Wolfram Fischer Berechnung der Erhöhung der Durchschnittsprämien Oktober 2004 1 Zusammenfassung Zur Berechnung der Durchschnittsprämien wird das gesamte gemeldete Prämienvolumen Zusammenfassung durch die
Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON
 1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
1 Bericht über die Untersuchung zur Erblichkeit von Herzerkrankungen beim PON Einleitung Bei der Rasse PON wurden im APH in der letzten Zeit auffällig viele Herzkrankheiten und Herzveränderungen unterschiedlicher
Die Entwicklung der Keimbahn. wahrend der Embryogenese von Caenorhabditis elegans
 Die Entwicklung der Keimbahn wahrend der Embryogenese von Caenorhabditis elegans Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des
Die Entwicklung der Keimbahn wahrend der Embryogenese von Caenorhabditis elegans Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des
VORANGEGANGENE MODELLE
 VORANGEGANGENE MODELLE UNSER THEMA HEUTE Ziel dieses Papers: - Nähere Charakterisierung der AuxREs - Analyse eines zu den AuxREs gehörenden Transkriptionsfaktors WAS BEREITS BEKANNT WAR: - Auxin moduliert
VORANGEGANGENE MODELLE UNSER THEMA HEUTE Ziel dieses Papers: - Nähere Charakterisierung der AuxREs - Analyse eines zu den AuxREs gehörenden Transkriptionsfaktors WAS BEREITS BEKANNT WAR: - Auxin moduliert
IT-Governance und Social, Mobile und Cloud Computing: Ein Management Framework... Bachelorarbeit
 IT-Governance und Social, Mobile und Cloud Computing: Ein Management Framework... Bachelorarbeit zur Erlangung des akademischen Grades Bachelor of Science (B.Sc.) im Studiengang Wirtschaftswissenschaft
IT-Governance und Social, Mobile und Cloud Computing: Ein Management Framework... Bachelorarbeit zur Erlangung des akademischen Grades Bachelor of Science (B.Sc.) im Studiengang Wirtschaftswissenschaft
Diabetische Netzhauterkrankung
 Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
Diabetes und Auge Diabetische Netzhauterkrankung Die diabetische Retinopathie ist die häufigste Erblindungsursache in der Bevölkerung zwischen dem 30. und 65. Lebensjahren in der westlichen Welt. Das Auftreten
Implantate. Modernste Zahnmedizin für perfekte Ästhetik. Lust auf schöne Zähne
 Implantate Modernste Zahnmedizin für perfekte Ästhetik. Lust auf schöne Zähne Implantate Künstliche Zahnwurzeln Implantate sind heute in vielen Fällen geeignet, den Traum eigener, fest verankerter Zähne
Implantate Modernste Zahnmedizin für perfekte Ästhetik. Lust auf schöne Zähne Implantate Künstliche Zahnwurzeln Implantate sind heute in vielen Fällen geeignet, den Traum eigener, fest verankerter Zähne
PKV-Info. Lohnt der Wechsel innerhalb der PKV?
 PKV-Info Lohnt der Wechsel innerhalb der PKV? 2 Die Unternehmen der privaten Krankenversicherung (PKV) stehen miteinander im Wettbewerb. Das ist so gewollt, zum Nutzen der Versicherten. Denn jeder Wettbewerb
PKV-Info Lohnt der Wechsel innerhalb der PKV? 2 Die Unternehmen der privaten Krankenversicherung (PKV) stehen miteinander im Wettbewerb. Das ist so gewollt, zum Nutzen der Versicherten. Denn jeder Wettbewerb
Wie oft soll ich essen?
 Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Wie oft soll ich essen? Wie sollen Sie sich als Diabetiker am besten ernähren? Gesunde Ernährung für Menschen mit Diabetes unterscheidet sich nicht von gesunder Ernährung für andere Menschen. Es gibt nichts,
Genetisch... Unterschied. DNA zu... 99,9% identisch
 Genetisch... Unterschied DNA zu... 99,9% identisch Alle Menschen unterscheiden sich aus genetischer Sicht nur um 0,1% Die übrigen 99,9% sind exakt gleich, egal ob miteinander verwandt oder nicht. Diese
Genetisch... Unterschied DNA zu... 99,9% identisch Alle Menschen unterscheiden sich aus genetischer Sicht nur um 0,1% Die übrigen 99,9% sind exakt gleich, egal ob miteinander verwandt oder nicht. Diese
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Gehen wir einmal davon aus, dass die von uns angenommenen
 geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
Die Online-Meetings bei den Anonymen Alkoholikern. zum Thema. Online - Meetings. Eine neue Form der Selbsthilfe?
 Die Online-Meetings bei den Anonymen Alkoholikern zum Thema Online - Meetings Eine neue Form der Selbsthilfe? Informationsverhalten von jungen Menschen (Quelle: FAZ.NET vom 2.7.2010). Erfahrungen können
Die Online-Meetings bei den Anonymen Alkoholikern zum Thema Online - Meetings Eine neue Form der Selbsthilfe? Informationsverhalten von jungen Menschen (Quelle: FAZ.NET vom 2.7.2010). Erfahrungen können
Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR:
 München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
München, den 08.01.2015 Medikament zur Behandlung der Muskeldystrophie Duchenne jetzt in Deutschland VERFÜGBAR: TRANSLARNA TM mit dem Wirkstoff Ataluren Liebe Patienten, liebe Eltern, In einem Schreiben
Chemotherapie -ein Bilderbuch für Kinder
 Chemotherapie -ein Bilderbuch für Kinder Unser Körper besteht aus verschiedenen Zellen, die ganz unterschiedlich aussehen. Jede Art erfüllt eine besondere Aufgabe. Da gibt es zum Beispiel Gehirnzellen,
Chemotherapie -ein Bilderbuch für Kinder Unser Körper besteht aus verschiedenen Zellen, die ganz unterschiedlich aussehen. Jede Art erfüllt eine besondere Aufgabe. Da gibt es zum Beispiel Gehirnzellen,
Molekulares Profiling/Individualisierung - Konsequenzen für Standards, Studien und Therapien der Zukunft -
 PATHOLOGIE LEIPZIG Pathologie Bochum Molekulares Profiling/Individualisierung - Konsequenzen für Standards, Studien und Therapien der Zukunft - Andrea Tannapfel Institut für Pathologie Ruhr-Universität
PATHOLOGIE LEIPZIG Pathologie Bochum Molekulares Profiling/Individualisierung - Konsequenzen für Standards, Studien und Therapien der Zukunft - Andrea Tannapfel Institut für Pathologie Ruhr-Universität
TECHNISCHE UNIVERSITÄT MÜNCHEN
 TECHNISCHE UNIVERSITÄT MÜNCHEN Klinik und Poliklinik für Nuklearmedizin der Technischen Universität München Klinikum rechts der Isar (Univ.- Prof. Dr. M. Schwaiger) Vergleich verschiedener Parameter zur
TECHNISCHE UNIVERSITÄT MÜNCHEN Klinik und Poliklinik für Nuklearmedizin der Technischen Universität München Klinikum rechts der Isar (Univ.- Prof. Dr. M. Schwaiger) Vergleich verschiedener Parameter zur
Auswertung des Fragebogens zum CO2-Fußabdruck
 Auswertung des Fragebogens zum CO2-Fußabdruck Um Ähnlichkeiten und Unterschiede im CO2-Verbrauch zwischen unseren Ländern zu untersuchen, haben wir eine Online-Umfrage zum CO2- Fußabdruck durchgeführt.
Auswertung des Fragebogens zum CO2-Fußabdruck Um Ähnlichkeiten und Unterschiede im CO2-Verbrauch zwischen unseren Ländern zu untersuchen, haben wir eine Online-Umfrage zum CO2- Fußabdruck durchgeführt.
Physik & Musik. Stimmgabeln. 1 Auftrag
 Physik & Musik 5 Stimmgabeln 1 Auftrag Physik & Musik Stimmgabeln Seite 1 Stimmgabeln Bearbeitungszeit: 30 Minuten Sozialform: Einzel- oder Partnerarbeit Voraussetzung: Posten 1: "Wie funktioniert ein
Physik & Musik 5 Stimmgabeln 1 Auftrag Physik & Musik Stimmgabeln Seite 1 Stimmgabeln Bearbeitungszeit: 30 Minuten Sozialform: Einzel- oder Partnerarbeit Voraussetzung: Posten 1: "Wie funktioniert ein
Störung der Blasenfunktion und ihre Auswirkungen
 Unfreiwilliger Harnverlust oder Harninkontinenz In den ersten Lebensjahren können Babys und später Kleinkinder die Harnblase nicht kontrollieren. Der von den Nieren ausgeschiedene Harn wird in der Blase
Unfreiwilliger Harnverlust oder Harninkontinenz In den ersten Lebensjahren können Babys und später Kleinkinder die Harnblase nicht kontrollieren. Der von den Nieren ausgeschiedene Harn wird in der Blase
Mathematik. UND/ODER Verknüpfung. Ungleichungen. Betrag. Intervall. Umgebung
 Mathematik UND/ODER Verknüpfung Ungleichungen Betrag Intervall Umgebung Stefan Gärtner 004 Gr Mathematik UND/ODER Seite UND Verknüpfung Kommentar Aussage Symbolform Die Aussagen Hans kann schwimmen p und
Mathematik UND/ODER Verknüpfung Ungleichungen Betrag Intervall Umgebung Stefan Gärtner 004 Gr Mathematik UND/ODER Seite UND Verknüpfung Kommentar Aussage Symbolform Die Aussagen Hans kann schwimmen p und
4. Jeder Knoten hat höchstens zwei Kinder, ein linkes und ein rechtes.
 Binäre Bäume Definition: Ein binärer Baum T besteht aus einer Menge von Knoten, die durch eine Vater-Kind-Beziehung wie folgt strukturiert ist: 1. Es gibt genau einen hervorgehobenen Knoten r T, die Wurzel
Binäre Bäume Definition: Ein binärer Baum T besteht aus einer Menge von Knoten, die durch eine Vater-Kind-Beziehung wie folgt strukturiert ist: 1. Es gibt genau einen hervorgehobenen Knoten r T, die Wurzel
Charakteristikum des Gutachtenstils: Es wird mit einer Frage begonnen, sodann werden die Voraussetzungen Schritt für Schritt aufgezeigt und erörtert.
 Der Gutachtenstil: Charakteristikum des Gutachtenstils: Es wird mit einer Frage begonnen, sodann werden die Voraussetzungen Schritt für Schritt aufgezeigt und erörtert. Das Ergebnis steht am Schluß. Charakteristikum
Der Gutachtenstil: Charakteristikum des Gutachtenstils: Es wird mit einer Frage begonnen, sodann werden die Voraussetzungen Schritt für Schritt aufgezeigt und erörtert. Das Ergebnis steht am Schluß. Charakteristikum
Programm 4: Arbeiten mit thematischen Karten
 : Arbeiten mit thematischen Karten A) Anteil der ausländischen Wohnbevölkerung an der Wohnbevölkerung insgesamt 2001 in Prozent 1. Inhaltliche und kartographische Beschreibung - Originalkarte Bei dieser
: Arbeiten mit thematischen Karten A) Anteil der ausländischen Wohnbevölkerung an der Wohnbevölkerung insgesamt 2001 in Prozent 1. Inhaltliche und kartographische Beschreibung - Originalkarte Bei dieser
Fruchtbarkeit ist messbar!
 Fruchtbarkeit ist messbar! I n d i v i d u e l l & a u s s a g e k r ä f t i g Bestimmung der individuellen Fruchtbarkeitsreserve Hätten Sie s so genau gewusst? Weibliche Fruchtbarkeit und Lebensalter
Fruchtbarkeit ist messbar! I n d i v i d u e l l & a u s s a g e k r ä f t i g Bestimmung der individuellen Fruchtbarkeitsreserve Hätten Sie s so genau gewusst? Weibliche Fruchtbarkeit und Lebensalter
Protect 7 Anti-Malware Service. Dokumentation
 Dokumentation Protect 7 Anti-Malware Service 1 Der Anti-Malware Service Der Protect 7 Anti-Malware Service ist eine teilautomatisierte Dienstleistung zum Schutz von Webseiten und Webapplikationen. Der
Dokumentation Protect 7 Anti-Malware Service 1 Der Anti-Malware Service Der Protect 7 Anti-Malware Service ist eine teilautomatisierte Dienstleistung zum Schutz von Webseiten und Webapplikationen. Der
Die monatliche Selbstuntersuchung der Brust
 Die monatliche Selbstuntersuchung der Brust Kein Problem: die monatliche Selbstuntersuchung der Brust Hormone steuern nicht nur den weiblichen Monats zyklus, sondern beeinflussen auch das Brustgewebe.
Die monatliche Selbstuntersuchung der Brust Kein Problem: die monatliche Selbstuntersuchung der Brust Hormone steuern nicht nur den weiblichen Monats zyklus, sondern beeinflussen auch das Brustgewebe.
Bitte leiten Sie diese Information an die zuständige Fachabteilung, bzw. die Anwender der oben genannten Produkte weiter.
 3. April 2013 cobas Software v1.x und v2.0 auf den Systemen cobas 4800 und cobas z 480: Seltener Channel Shift bei der Fluoreszenzauswertung führt zu invaliden Ergebnissen oder
3. April 2013 cobas Software v1.x und v2.0 auf den Systemen cobas 4800 und cobas z 480: Seltener Channel Shift bei der Fluoreszenzauswertung führt zu invaliden Ergebnissen oder
Pädagogik. Melanie Schewtschenko. Eingewöhnung und Übergang in die Kinderkrippe. Warum ist die Beteiligung der Eltern so wichtig?
 Pädagogik Melanie Schewtschenko Eingewöhnung und Übergang in die Kinderkrippe Warum ist die Beteiligung der Eltern so wichtig? Studienarbeit Inhaltsverzeichnis 1. Einleitung.2 2. Warum ist Eingewöhnung
Pädagogik Melanie Schewtschenko Eingewöhnung und Übergang in die Kinderkrippe Warum ist die Beteiligung der Eltern so wichtig? Studienarbeit Inhaltsverzeichnis 1. Einleitung.2 2. Warum ist Eingewöhnung
Fehler und Probleme bei Auswahl und Installation eines Dokumentenmanagement Systems
 Fehler und Probleme bei Auswahl und Installation eines Dokumentenmanagement Systems Name: Bruno Handler Funktion: Marketing/Vertrieb Organisation: AXAVIA Software GmbH Liebe Leserinnen und liebe Leser,
Fehler und Probleme bei Auswahl und Installation eines Dokumentenmanagement Systems Name: Bruno Handler Funktion: Marketing/Vertrieb Organisation: AXAVIA Software GmbH Liebe Leserinnen und liebe Leser,
Qualitätsbedingungen schulischer Inklusion für Kinder und Jugendliche mit dem Förderschwerpunkt Körperliche und motorische Entwicklung
 Forschungsprojekt: Qualitätsbedingungen schulischer Inklusion für Kinder und Jugendliche mit dem Förderschwerpunkt Körperliche und motorische Entwicklung Leichte Sprache Autoren: Reinhard Lelgemann Jelena
Forschungsprojekt: Qualitätsbedingungen schulischer Inklusion für Kinder und Jugendliche mit dem Förderschwerpunkt Körperliche und motorische Entwicklung Leichte Sprache Autoren: Reinhard Lelgemann Jelena
Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt?
 DGSV-Kongress 2009 Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt? Sybille Andrée Betriebswirtin für und Sozialmanagement (FH-SRH) Prokuristin HSD Händschke Software
DGSV-Kongress 2009 Wann ist eine Software in Medizinprodukte- Aufbereitungsabteilungen ein Medizinprodukt? Sybille Andrée Betriebswirtin für und Sozialmanagement (FH-SRH) Prokuristin HSD Händschke Software
Gutes Leben was ist das?
 Lukas Bayer Jahrgangsstufe 12 Im Hirschgarten 1 67435 Neustadt Kurfürst-Ruprecht-Gymnasium Landwehrstraße22 67433 Neustadt a. d. Weinstraße Gutes Leben was ist das? Gutes Leben für alle was genau ist das
Lukas Bayer Jahrgangsstufe 12 Im Hirschgarten 1 67435 Neustadt Kurfürst-Ruprecht-Gymnasium Landwehrstraße22 67433 Neustadt a. d. Weinstraße Gutes Leben was ist das? Gutes Leben für alle was genau ist das
Versuch 8. Plasmid - Isolierung
 Versuch 8 Plasmid - Isolierung Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X C. Weindel & M. Schwarz Wird benotet?: Einleitung Ein Plasmid
Versuch 8 Plasmid - Isolierung Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X C. Weindel & M. Schwarz Wird benotet?: Einleitung Ein Plasmid
10.000 10.000. an Masern erkrankt. an Mumps erkrankt. mit Röteln infiziert
 Nutzen: Bei Viruskontakt ist mein geimpftes Kind auch künftig besser gegen Masern, Mumps und Röteln geschützt. Je mehr Menschen geimpft sind, desto unwahrscheinlicher werden Kontakte mit dem Virus. ohne
Nutzen: Bei Viruskontakt ist mein geimpftes Kind auch künftig besser gegen Masern, Mumps und Röteln geschützt. Je mehr Menschen geimpft sind, desto unwahrscheinlicher werden Kontakte mit dem Virus. ohne
Ergebnisse der Mitarbeiterinnen- und Mitarbeiterbefragung 2010. an der Friedrich-Schiller-Universität Jena zum Thema Mitarbeitergespräche
 Ergebnisse der Mitarbeiterinnen- und Mitarbeiterbefragung 2010 an der Friedrich-Schiller-Universität Jena zum Thema Mitarbeitergespräche Zielsetzung & Durchführung Im März/April 2010 wurden seitens der
Ergebnisse der Mitarbeiterinnen- und Mitarbeiterbefragung 2010 an der Friedrich-Schiller-Universität Jena zum Thema Mitarbeitergespräche Zielsetzung & Durchführung Im März/April 2010 wurden seitens der
trivum Multiroom System Konfigurations- Anleitung Erstellen eines RS232 Protokolls am Bespiel eines Marantz SR7005
 trivum Multiroom System Konfigurations- Anleitung Erstellen eines RS232 Protokolls am Bespiel eines Marantz SR7005 2 Inhalt 1. Anleitung zum Einbinden eines über RS232 zu steuernden Devices...3 1.2 Konfiguration
trivum Multiroom System Konfigurations- Anleitung Erstellen eines RS232 Protokolls am Bespiel eines Marantz SR7005 2 Inhalt 1. Anleitung zum Einbinden eines über RS232 zu steuernden Devices...3 1.2 Konfiguration
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
