LS3. Computergestützte Messwerterfassung und Datenverarbeitung Version vom 24. Januar 2019
|
|
|
- Evagret Hausler
- vor 5 Jahren
- Abrufe
Transkript
1 LS3 Computergestützte Messwerterfassung und Datenverarbeitung Version vom 24. Januar 2019
2 Inhaltsverzeichnis 1 Computergestützte Messwerterfassung und Datenverarbeitung Einsatzmöglichkeiten des Computers im Experimental-Unterricht Erste Schritte mit CASSY Lab 2 und Sensor-Cassy Erste Schritte mit MEASURE (und UT61) Allgemeine Grundlagen zur Theorie der Wärme Hauptsätze der Wärmelehre Wärmekapazität und spezische Wärmekapazität Mechanismen des Wärmetransports Wärmeleitung Konvektion Strahlung Newton'sches Abkühlverfahren Grundlagen Newton'sche Abkühlungsgesetz Aufgabenstellung Durchführung Schmelzwärme von Eis Grundlagen Begrie Latente Wärme Kalorimetrie, Kalorimeter und Dewar Kalorimetrie mit der Mischungsmethode Aufgabenstellung Versuchsaufbau und Durchführung
3 Inhaltsverzeichnis Lehr/Lernziele Ihr Ziel ist das Kennenlernen und Arbeiten mit verschiedenen Systemen zur computergestützten Messwerterfassung und Datenverarbeitung. Dabei üben Sie automatisierte computergestützte Messungen einzurichten und durchzuführen, sowie das Festlegen und Optimieren von Messparametern. Das Erlernen von Datenimports und -exports aus verschiedener Mess-Software ist ein weiterer Schwerpunkt dieses Praktikums. Anhand zweier thermodynamischer Experimente wird Ihnen so das selbstständige computergestützte Messen, Durchführen und Auswerten näher gebracht, sowie ein solides Verständnis für eigenständige Datensammlung und Auswertung näher gebracht. Beim Experiment zum Newton'schen Abkühlverfahren erlernen Sie den Umgang mit dem Datenaufzeichnungs- und Auswertungsprogramm CASSY Lab 2 und dem dazugehörigen Messmodul mit Temperaturfühler. Im zweiten Experiment verwenden Sie das praktikumseigene Programm Measure mit dem UT61-B Multimeter als Datalogger mit Temperatursensor. Zum besseren Überblick sind die wichtigsten Lernziele noch einmal zusammengefasst: Kennenlernen verschiedener Systeme zur computergestützten Messwerterfassung und Datenverarbeitung. Selbstständig Messungen computergestützt durchführen und auswerten können. Automatisierte computergestützte Messungen einrichten und durchführen lernen, Messparameter festlegen und optimieren lernen. Eigenständige Datensammlung und Auswertung. Daten aus verschiedener Mess-Software exportieren und importieren lernen. Kennenlernen verschiedener thermodynamischer Gesetze anhand computergestützter Messverfahren
4 1 Computergestützte Messwerterfassung und Datenverarbeitung 1 Computergestützte Messwerterfassung und Datenverarbeitung 1.1 Einsatzmöglichkeiten des Computers im Experimental-Unterricht Der Einsatz von Computern in der Lehre hat in den letzten Jahrzehnten groÿe Bedeutung erlangt. Besonders in der Physik wurden verschiedene computergestützte Experimente mit dem Computer in Vorlesungen und Praktika entworfen, die sich auch für den Einsatz im Schulunterricht eignen. Vielmehr bieten sich auch Möglichkeiten, Schülerinnen und Schüler selbst experimentieren zu lassen. Auch mit der Einführung der Smartphones und der steigenden Zahl an Apps mit denen man verblüend schnell hochkomplexe Messungen und Analysen vornehmen kann, haben sich zahlreiche neue Möglichkeiten für die Gestaltung von Lernsituationen aufgetan. Computer mit geeigneter Soft- und Hardware können eine vorteilhafte Unterstützung sein, wenn es darum geht, Schülerinnen und Schülern z.b. mit dem Modellbilden in der Physik, oder mit induktiven und deduktiven wissenschaftlichen Arbeitsweisen vertraut zu machen. Beispiele für solche Anwendungen sind unter anderem: CBL-Systeme (Computer Based Laboratories) Messdaten werden mit geeigneter Hardware in Echtzeit aufgenommen und mit geeigneter Software verarbeitet und präsentiert. Auch Steuereinheiten wurden hierfür entwickelt, die den Automatisierungsgrad erhöhen. In diesem Teil des Vorpraktikums beschäftigen wir uns schwerpunktmäÿig mit CBL- Systemen. In den meisten Fällen besteht ein solches System zur digitalen Messwerterfassung aus einem Rechner, der eine geeignete Verbindung zur Hardware aufweist (z.b. eine serielle Schnittstelle oder eine drahtlose Vebindung), welche wiederum imstande ist, Messdaten mit unterschiedlichen Sensoren aufzunehmen. Manche Systeme schalten zwischen Verarbeitungssoftware auf dem Rechner und dem Messsensor noch ein mobiles Zwischengerät (Data-Logger), welches die Verwendung von Grundfunktionen auch im Stand-Alone-Betrieb erlaubt, und maximale Mobilität und Flexibilität garantiert. Interaktive Simulationen bzw. Applets Java Applets (oder auch Flash / HTML5 Applets) mit physikalischem Inhalt sind simulierte Experimente mit hohem Grad an Interaktivität. Der Benutzer kann viele Parameter verändern, beobachten, messen etc. Der Lernende soll selbst Zusammenhänge knüpfen oder erkennen können. Applets sind jedoch auch zu Demonstrationszwecken gut geeignet. Im Internet ndet man eine groÿe Anzahl solcher Simulationen oder Applets. Die Entscheidung, ob und wie sehr so ein Applet für die geplante Lernsituation geeignet ist, obliegt jedoch einzig der Lehrperson. Video Analyse In der Video Analyse werden alltägliche, reale Ereignisse oder Experimente auf Video - 2 -
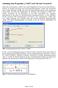
5 1 Computergestützte Messwerterfassung und Datenverarbeitung aufgenommen und Bewegungsabläufe nach einem Zeitraster mittels Ortsmessung per Mausklick untersucht. Auch statische Aufnahmen können untersucht werden (Winkel, Entfernung etc.) Interaktive Bildschirmexperimente (IBE) Für die Produktion eines IBEs wird ein echtes Experiment aufgebaut und der gesamte Ablauf schrittweise fotograert. Die Bilder werden in einem Multimediaprogramm (z.b. Flash) aufbereitet, danach sind sie im Gegensatz zu einem klassischen Video interaktiv steuerbar. Wesentliche Elemente wie zum Beispiel die Schalter und Knöpfe eines Oszilloskops können per Maus manipuliert werden. Die realistischen Bildsequenzen vermitteln so den Eindruck, am Bildschirm ein echtes Experiment durchzuführen Erste Schritte mit CASSY Lab 2 und Sensor-Cassy Abbildung 1: CASSY Lab 2, Screenshot Das Computerprogramm CASSY Lab 2 unterstützt ein oder mehrere CASSY-Module am USB-Port oder an der seriellen Schnittstelle RS232 des Computers. Im Praktikum sind 2 unterschiedliche Sensor-Cassy Module im Einsatz. Sensor-Cassy (serielle Schnittstelle RS232) und Sensor-Cassy 2 (USB). Ist das Sensor-Cassy 2 korrekt an den PC angeschlossen, sollte CASSY Lab 2 das Modul automatisch erkennen. Wenn nicht, so önen Sie das Einstellungen-Fenster (In der Menüleiste das Symbol mit dem Zahnrad und geben Sie im - 3 -
6 1 Computergestützte Messwerterfassung und Datenverarbeitung entsprechenden Dropdown-Menü dem Programm die Schnittstelle an, an der das Modul angeschlossen ist (z.b. COM1). Messeingänge festlegen Önet man die Software CASSY Lab 2, so sieht man das Programmfenster wie in Abb. 1. Wenn ein oder mehrere CASSYs erkannt worden sind, zeigt das Dialogfenster CASSYs (1) die aktuelle Konguration der Messeingänge (1a): Schwarze Buchsen symbolisieren inaktive Messeingänge, bunte Buchsen aktive. Wird ein Eingang aktiviert, so önet sich ein weiteres kleines Fenster (1b), die analoge und digitale Anzeige des momentanen Messwertes. Es besteht die Möglichkeit die Messeingänge anhand der graschen Darstellung des Sensor- Cassy zu aktivieren, in dem man auf einen inaktiven Eingang mit der Maus klickt, oder indem man im Dialogfenster Einstellungen (2) das dementsprechende Häkchen setzt. Ein aktiver Ein- oder Ausgang wird als Button rechts oben in der Menüleiste (3) zu den Speed-Buttons einsortiert (in Abb. 1 z.b. U A1 ). Diese Buttons stellen die einfachste Möglichkeit dar, die anaolg/digital-anzeige der Messgröÿe anzuzeigen, zu schlieÿen (linke Maustaste), oder seine Einstellungen zu verändern. Durch einen Rechtsklick werden im Einstellungen-Fenster (2) automatisch die Messeinstellungen dieses Einganges (4) und seine Messparameter (5) angezeigt. Auÿerdem erscheint die Messgröÿe dieses Einganges automatisch in der Messwerttabelle (6) und im Diagramm (7). Messeinstellungen festlegen Sind die gewünschten Eingänge aktiviert, müssen die Messeinstellungen (4) überprüft und gegebenenfalls abgeändert werden. Hier legen Sie den Messbereich fest, die Art der Messwerterfassung (z.b. gemittelte Werte, Eektivwerte, etc.) sowie die Nullpunktsetzung der Messskala und eine eventuelle Korrektur des Messwertes, um bekannte systematische Fehler zu eliminieren. Diese Funktion wird z.b. dann benötigt, wenn ein Sensor den Messwert bedingt etwa durch den Aufbau, immer um einen konstanten Wert oder Faktor zu groÿ oder zu klein anzeigt. Messparameter festlegen Um eine Messung durchführen zu können, müssen schlieÿlich auch die Messparameter (5) eingestellt werden. Sie gelten für alle aktivierten Messeingänge und werden immer gleichzeitig mit den Messeinstellungen (4) angezeigt. Sie müssen wählen, ob Sie eine automatische Aufnahme durchführen wollen, bei der Sie vorgeben, wie lange in welchen Zeitabständen wieviele Messungen gemacht werden sollen, oder ob Sie selbst den Zeitpunkt der Messung entscheiden (manuelle Aufnahme). Weiters können Sie einen Trigger festlegen, der die Bedingung für den automatischen Start der Messung deniert (z.b. Messung soll starten, wenn Spannung an Kanal U A1 > 0, 1V ). Zusätzlich können Mess- und Stopp-Bedingung angegeben werden. Eine Messbedingung = 1 AN, legt fest, dass eine Messung durchgeführt werden darf, ist ihr Wert = 0 AUS, so kann keine Messung gestartet werden. Die Stoppbedingung deniert in gleicher Weise, wann eine Messung automatisch beendet wird. Man benötigt sie z.b. wenn eine Temperaturmessung während eines Abkühlprozesses so lange dauern soll, bis ein bestimmter Wert erreicht ist und man nicht weiÿ, wieviel Zeit das beanspruchen wird. Für die Festlegung dieser Bedingungen stehen alle denierten - 4 -
7 1 Computergestützte Messwerterfassung und Datenverarbeitung Variablen, sowie zahlreiche Funktionen und logische Verknüpfungen zur Verfügung. Automatische Messwertverarbeitung - Rechner Abb. 2 zeigt das Einstellungs-Fenster für den Rechner. Dort haben Sie die Möglichkeit, Ihre Messdaten simultan zur laufenden Messung sofort in zusammengesetzte Gröÿen umzurechnen. Wenn Sie z.b. Strom und Spannung an einem Widerstand messen, können Sie sich damit den Widerstand ausrechnen lassen. Dazu klicken Sie auf Formel und Neu, dann önet sich für die Neue Gröÿe ein Einstellungsbereich, in der Sie festlegen können wie sie heiÿen soll, welches Symbol sie haben soll, in welchem Bereich sie mit wieviel Dezimalstellen dargestellt werden soll und welche Einheit sie besitzt. Natürlich legen Sie auch fest, wie sich die neue Gröÿe zusammensetzt. Dazu tragen Sie die Formel in dem in Abb. 2 mit einem roten Pfeil markierten Fenster ein. Abbildung 2: CASSY Lab 2, Einstellungsfenster - Rechner Die in Klammern darüber angegebenen Variablen haben Sie dabei zur Verfügung: Date = Systemdatum, Time = Systemzeit 1, n = Messwertindex (n=1...erster Messpunkt, n=2... zweiter Messpunkt usw.), t = Zeit ab Messbeginn, U A1 = Spannung am Eingang A1, usw. Sie können jedoch auch Parameter festlegen, oder Ableitungen, Fouriertransformationen etc. im Rechner einstellen. Darstellung der Ergebnisse Um Ihre Ergebnisse in einem Diagramm in gewünschter Art und Weise darzustellen, wählen Sie im Dialogfenster Einstellungen den Punkt Darstellungen (siehe Abb. 3). Die 1 Das ist die momentane, am Rechner eingestellte Uhrzeit
8 1 Computergestützte Messwerterfassung und Datenverarbeitung Darstellung Standard ist voreingestellt. Sie können Ihre Einstellungen aber jederzeit verändern, z.b. wenn Sie statt eines kartesischen Koordinatensystems, eine Darstellung in Polarkoordinaten bevorzugen. In der Darstellung Standard (auch in jeder anderen) können Sie bereits denierte Messgröÿen und Variablen hinzufügen und festlegen, auf welcher Achse sie in welcher Farbe dargestellt werden sollen, ob sie logarithmisch, quadratisch etc. aufgetragen werden soll (vgl. Abb. 3). Abbildung 3: CASSY Lab 2, Einstellungsfenster - Darstellungen Messen und Auswerten In der Menüleiste (Abb. 1 (3)) starten (und stoppen) Sie mit dem Symbol der Stoppuhr den festgelegten Messvorgang. Nun können Sie den Messverlauf am Diagrammfeld (Abb. 1 (7)) mitverfolgen. Nach dem Ende der Messung können Sie im Menü Messung (in der Menüleiste) z.b. eine neue Messreihe anhängen, die dann im selben Diagramm in anderer Farbe angezeigt wird. Sie können die gewonnen Daten auch Auswerten. Im Menü Diagramm in der Menüleiste (siehe Abb. 4) nden Sie eine groÿe Vielfalt verschiedener Auswertemöglichkeiten
9 1 Computergestützte Messwerterfassung und Datenverarbeitung Abbildung 4: CASSY Lab 2, Menü - Diagramm: Möglichkeiten zur Datenauswertung Wenn Sie z.b. eine lineare Funktion dem Datensatz anpassen wollen, wählen Sie Anpassung durchführen - Ausgleichsgerade. Nun müssen Sie nur mehr jene Datenpunkte markieren, durch die Sie den Fit legen wollen. Das tun Sie mit einem Klick auf die linke Maustaste und einer Bewegung entlang der gewünschten Punkte bei gehaltener Maustaste. Die markierten Datenpunkte erscheinen dann in einer anderen Farbe. Nach dem Loslassen werden die Ergebnisse des Fits unten links angezeigt. Um diese Ergebnisse als Textmarkierung in das Diagramm einzufügen, wählen Sie Markierung setzen - Text und legen Sie mit der Maus den gewünschten Platz für den Text fest. Diese Kurzanleitung erklärt bei weitem nicht alle Anwendungsmöglichkeiten. Für eine gezielte Suche verwenden Sie die eingebaute Hilfe, oder schlagen Sie im Handbuch nach, welches auf der Seite von LS3 verlinkt ist Erste Schritte mit MEASURE (und UT61) Das Programm MEASURE ist ein Programm zur Datenerfassung aus einem Datalogger mit USB-Schnittstelle (z.b. UT61B oder Arduino). Als Beispiel für eine einfache Messung wird hier eine Temperaturmessung mit dem UT61B Multimeter beschrieben. Hierfür muss das USB-Adapterkabel an UT61B auf der - 7 -
10 1 Computergestützte Messwerterfassung und Datenverarbeitung Rückseite angeschlossen, der Temperatursensor richtig angebracht /roter Stecker rechts, schwarzer Stecker links) und die gewünschte Messgröÿe am Einstellrad gewählt werden (siehe Abb. 5). Danach aktivieren ie die Ausgabe per USB durch langes Drücken des Druckknopfes REL -RS232(USB). Starten Sie nun das Programm und stecken Sie dann den oder die Datalogger an die USB Anschlüsse des Messcomputers an. Sie sollten sofort erkannt werden. Abbildung 5: Temperaturmessung mit UT61B - 8 -
11 1 Computergestützte Messwerterfassung und Datenverarbeitung Abbildung 6: Temperaturmessung mit Measure Abbildung 6 zeigt die Benutzeroberäche des Programms. Bevor die Messung gestartet wird, muss unter Browse (1) der Name (1a) und Speicherort der Ausgabedatei (.txt) festgelegt werden. In welchem Intervall die Messpunkte aufgenommen werden wird bei (2) eingestellt. Man kann wählen zwischen den Intervallen 0.25s, 1s, 30s, 60s und 600s. Das Programm erkennt automatisch welche Messgröÿe in welcher Einheit mit dem angeschlossenen Messgerät gemessen wird. Unter Punkt (3) kann der Parameter benannt werden, welcher in der Ausgabedatei 7 als Spaltenname angezeigt wird. Nachdem die korrekten Einstellungen festgelegt wurden, kann mit Start (4) und Stop (5) die Messung gestartet und beendet werden. Die Messpunkte werden sofort im Diagramm (6) angezeigt, welches aber nur zur momentanen Visualisierung dient. Die Messwerte müssen anschlieÿend in einem geeigneten Auswerteprogramm (z.b. SciDAVis oder QTI-Plot) ausgewertet werden. Das Programm kann auch mehrere Parameter gleichzeitig messen. Die verschiedenen Parameter werden in getrennten Diagrammen untereinander angezeigt. In der Ausgabedatei (*.txt) werden für jede Messgröÿe 2 neue Spalten hinzugefügt, eine für den Messwert, die andere für die Einheit. Die Ausgabedatei der beschriebenen Temperaturmessung zeigt Abbildung
12 1 Computergestützte Messwerterfassung und Datenverarbeitung Abbildung 7: Ausgabedatei der aufgenommenen Messpunkte In der ersten Zeile werden die Spaltennamen angezeigt, also die Parameter (hier: Temperatur). Die einzelnen Spalten werden durch ein Komma getrennt (csv-dateiformat comma seperated value). Die ersten drei Spalten werden automatisch bei jeder Art von Messung angezeigt und bieten unterschiedliche Zeitinformationen, wann genau die Messung stattgefunden hat 2. Im Falle der in Abb. 7 angezeigten Temperaturmessung wird in der vierten Spalte Zeit seit Messbeginn angezeigt, sowie in der fünften Spalte die zugehörige Einheit (s). In Spalte 6 und 7 werden die gemessenen Temperaturwerte und die zugehörige Einheit ( C) aufgelistet. Für jede weitere parallel gemessene Messgröÿe folgen dementsprechend weitere 2 Spalten. Die Ausgabedatei kann nun zur Auswertung in ein geeignetes Auswerteprogramm (z.b. SciDAVis oder QTI-Plot) importiert werden. Nutzen Sie dazu die Import-Funktion der Software, um als Spaltentrennzeichen das Komma und als Dezimaltrennzeichen den Punkt einzustellen. 2 POSIX Timestamp ist die sogenannte Unixzeit, eine absolute Zeitangabe, welche die vergangenen Sekunden seit Donnerstag, dem 1. Januar 1970, 00:00 Uhr UTC zählt
13 2 Allgemeine Grundlagen zur Theorie der Wärme 2 Allgemeine Grundlagen zur Theorie der Wärme Wärme ist eine Form von Energie. In der Wärmelehre werden zwei Betrachtungsweisen unterschieden, die Thermodynamik und die statistische Mechanik. Die Thermodynamik untersucht Beziehungen zwischen makroskopischen Zustandsgröÿen wie z.b. Volumen, Druck, Temperatur oder Gesamtenergie zur Charakterisierung des Gesamtsystems. Die statistische Physik versucht diese Beziehungen aus mikroskopischen Befunden herzuleiten. Die physikalische Grundlage zur Thermodynamik sind die Hauptsätze der Wärmelehre. 2.1 Hauptsätze der Wärmelehre 1. Der Nullte Hauptsatz: Sind zwei Systeme in einem thermischen Gleichgewicht mit einem dritten System, so sind sie auch miteinander in einem thermischen Gleichgewicht. Dieser Hauptsatz ist wichtig um die Temperatur mathematisch denieren zu können [?]. 2. Der Erste Hauptsatz: Führt man einem abgeschlossenen und ruhenden thermodynamischen System Wärme und Arbeit von auÿen zu, so ist deren Summe gleich der Zunahme der im System enthaltenen Energie, die Innere Energie genannt wird. Der Erste Hauptsatz ist also eine Form des Energieerhaltungssatzes. 3. Der Zweite Hauptsatz ist ein Postulat 3 und entspricht in der Formulierung von R. Clausius [?] unserer alltäglichen Erfahrung: Es gibt keinen Prozess, dessen einziges Ergebnis der Übergang von Wärme von einem Körper niedrigerer Temperatur auf einen Körper höherer Temperatur ist. In der äquivalenten Kelvin-Planck Formulierung lautet der Hauptsatz: Es ist unmöglich eine periodisch arbeitende Maschine zu konstruieren, deren einziger Eekt es ist, aus einem Reservoir Energie in Form von Wärme aufzunehmen und vollständig in der Form von Arbeit wieder abzugeben. Dieser Hauptsatz schränkt also die Aussage des Ersten Hauptsatzes über die Gleichwertigkeit von Wärme und Arbeit ein. 4. Der Dritte Hauptsatz ist auch unter dem Namen Nernst'sches Theorem bekannt. Es besagt, dass es nicht möglich ist, ein System in einer endlichen Anzahl von Schritten bis zum absoluten Nullpunkt abzukühlen. 2.2 Wärmekapazität und spezische Wärmekapazität Wird einer Substanz Wärmeenergie zugeführt, so steigt im Allgemeinen die Temperatur. (Anders ist dies bei Phasenübergängen wie Schmelzen, Verdampfen oder Sublimieren.) Die für einen Temperaturanstieg T notwendige Wärmemenge Q ist proportional zu T und zur Masse m der vorhandenen Substanz: 3 In der Statistischen Mechanik ist er selbst kein Postulat sondern eine Folge aus dem sogenannten Fundamentalpostulat [?]
14 2 Allgemeine Grundlagen zur Theorie der Wärme Q = cm T (1) Wobei man jene Wärmemenge Q, die zu einer Temperaturerhöhung eines Körpers mit der Masse 1 kg um 1 K führt, als spezische Wärmekapazität (oder auch kurz spezische Wärme) c bezeichnet. Die Wärmekapazität C eines Körpers mit der Masse m ist dann das Produkt aus spezischer Wärmekapazität und Masse. C = cm (2) Als Einheit der Wärmemenge diente früher die spezische Wärme von Wasser: Eine Kalorie 1 cal) wurde als die Wärmemenge deniert, durch die 1 g Wasser um 1 K erwärmt wird. (Werden die Werte der Verbrennungsenergie von Nahrungsmitteln in Kalorien angegeben, so sind Kilokalorien gemeint; 1 kcal = cal = 1 Cal.) Heute ist die SI-Einheit der Energie und somit auch der Wärmemenge das Joule (J). 2.3 Mechanismen des Wärmetransports Zum Begri der Wärmeübertragung gehören alle Erscheinungen und Eekte, die mit einem räumlichen Transport von Wärme in Zusammenhang stehen. Der Wärmeübergang erfolgt immer vom Zustand höherer Temperatur zu einem niederer Temperatur (siehe 2. Hauptsatz der Wärmelehre). Grundsätzlich existieren drei Möglichkeiten zur Wärmeübertragung (siehe Abb. 8): Wärmeleitung, Konvektion und Strahlung. Der direkte Energietransport erfolgt über die Wärmeleitung. Bei der Konvektion wird Energie über den Transport von Masse übertragen. Einzig die Wärmestrahlung ist als Transportphänomen vollständig unabhängig von Materie, sie kann auch im Vakuum erfolgen. Abbildung 8: Möglichkeiten zur Wärmeübertragung
15 2 Allgemeine Grundlagen zur Theorie der Wärme Wärmeleitung Wärmeleitung ist vor allem in Festkörpern wirksam. Die Wärmeleitfähigkeit weist dabei groÿe Unterschiede auf, die in den folgenden Experimenten gemessen werden. Die Übertragung der Bewegungsenergie durch Leitungselektronen ist besonders wirksam, daher sind gute elektrische Leiter auch gute Wärmeleiter (Wiedemann-Franz sches Gesetz). In Isolatoren erfolgt die Übertragung mittels Gitterschwingungen (in der Quantenphysik als Phononen bezeichnet - als der Teilchenaspekt der Gitterschwingungen). Die Wärmeübertragung mittels Phononen erfolgt meist mit wesentlich geringerer Wirksamkeit als mit Elektronen, da die Phononen eine viel kleinere freie Weglänge als die Leitungselektronen haben (Ausnahmen sind z.b. der Diamant) Konvektion In Flüssigkeiten und Gasen, in denen die Wärmeleitfähigkeit i.a. gering ist, kann es wirkungsvoller sein, erwärmte Materie mit einer Strömung zu transportieren. Dieser Mechanismus hat groÿe Bedeutung in der Natur (Klima und Wetter, Wärmehaushalt von Organismen, Vorgänge im Erdinneren) sowie für Heizung, Energietechnik, Wärmepumpen zur Kühlung von Bauteilen, chemische Verfahren etc. Treibende Kraft für die Strömung ist im Allgemeinen die Gravitation: Erwärmte Flüssigkeiten und Gase dehnen sich aus und erfahren einen Auftrieb (es gibt auch andere Möglichkeiten, z.b. Konvektion durch Oberächenspannung). Durch das Design von Doppelglasfenstern mit einer entsprechenden Dicke kann man Konvektion unterbinden, da die Luft an der Grenzschicht (Prandtl'sche Grenzschicht) haften bleibt. Damit die Konvektion in Gang kommt, ist es notwendig, dass die Temperaturunterschiede ein gewisses kritisches Maÿ überschreiten, denn innere Reibung und Wärmeleitung wirken der Konvektion entgegen. Im klassischen Benard-Experiment wird ein üssigkeitsgefülltes, aches Gefäÿ von unten beheizt. Bei ausreichender Temperaturdierenz bilden sich charakteristische, geordnete, meist hexagonale Konvektionszellen aus, wie sie auch aus der Meteorologie bekannt sind. Bei Steigerung der Heizleistung werden bei bestimmten kritischen Werten plötzliche Strukturänderungen (Konvektionszellen werden kleiner) beobachtet, wie sie für das Verhalten nichtlinearer dynamischer Systeme typisch sind Strahlung Für eine ausführlichere Behandlung der Strahlungsgesetze wird auf Fachliteratur verwiesen. Hier sei nur erwähnt, dass aufgrund des Stefan-Boltzmann-Gesetzes P (T ) = A ɛ(t ) σ T 4 die Bedeutung der Strahlung als Wärmetransportmechanismus sehr stark mit der Temperatur zunimmt. Zu beachten ist auch, dass nach dem Wien'schen Verschiebungsgesetz λ max T = const = 2, m K das Maximum der spektralen Energieverteilungskurve bei niedrigeren Temperaturen zu gröÿeren Wellenlängen wandert. Eine wichtige Konsequenz daraus ist der Glashauseekt: Sichtbares Licht entsprechend der Emissionstemperatur der Sonnenoberäche bei ca K geht durch das Glas hindurch und wird im Glashaus absorbiert. Ein Teil dieser Energie wird wiederum emittiert, jedoch entsprechend der Temperatur der Erdoberäche von ca. 300 K im Infrarotbereich. Für diese Wellenlänge jedoch
16 3 Newton'sches Abkühlverfahren ist das Glasdach nicht durchlässig, sodass die Wärmestrahlung am Glasdach reektiert wird. 3 Newton'sches Abkühlverfahren 3.1 Grundlagen Existiert in Festkörpern bzw. ruhenden Fluiden (Gasen oder Flüssigkeiten) ein Temperaturunterschied, so ensteht infolge dessen gemäÿ des zweiten Hauptsatzes der Thermodynamik, ein Wärmestrom in Richtung geringerer Temperatur. Steht ein abgeschlossenes System im thermischen Gleichgewicht so ist die Wärmeleitung Null. Als Abkühlung werden Vorgänge bezeichnet, bei denen einem Gegenstand oder einem System von Gegenständen Wärme entzogen wird. Die Geschwindigkeit, mit der die Temperatur des Körpers oder Gegenstandes sinkt, hängt von den äuÿeren Gegebenheiten wie wirksame Temperaturdierenz, Luftfeuchtigkeit, Strahlungsverhältnisse, Wind, Reibung sowie den thermischen Eigenschaften des Körpers oder Fluids (spezische Wärmekapazität, Oberächenbeschaenheit, Porosität) und seiner allfälligen Isolation (Boden, Verwitterungs- oder Baumrinde, Fell, Federkleid,...) ab. Diese Vorgänge können mittels Abkühlgesetzen analytisch beschrieben werden. 3.2 Newton'sche Abkühlungsgesetz Das Newton'sche Abkühlungsgesetz beschreibt einen solchen Abkühlungsprozess mittels folgender Dierenzialgleichung erster Ordnung d T (t) = at (t) + au(t). (3) dt Hier drückt T (t) die Temperatur des Körpers bei Umgebungstemperatur U(t) zum Zeitpunkt t aus. Die konstante Abkühlrate wird mit a bezeichnet. Weiters wählen wir T 0 als die anfängliche Temperatur des zu messenden Probekörpers zum Zeitpunkt t = 0. Ist die Umgebungstemperatur konstant, also U(t) = U 0, so lautet die Lösung der Dierentialgleichung nach dem Exponentialansatz T (t) = U 0 + (T 0 U 0 ) e ( at). (4) Ist die Objekttemperatur T gröÿer als die konstante Umgebungstemperatur U 0, so nimmt T (t) mit der Zeit ab und nähert sich für t der Umgebungstemperatur an. Ist dagegen T kleiner als U 0, so nimmt T (t) mit der Zeit zu und nähert sich für t ebenfalls der Umgebungstemperatur an. Beide Prozesse sind in Abb. 9 illustriert
17 3 Newton'sches Abkühlverfahren T T T 0 U 0 U 0 T 0 t t Abbildung 9: Temperaturabkühlkurven bei einer konstanten Umgebungstemperatur und einer bekannten Anfangstemperatur. Links ist die Objekttemperatur niedriger als die Umgebungstemperatur, rechts ist sie gröÿer. Beachten Sie, dass Temperaturen, die mit T notiert sind, stets in Kelvin anzugeben sind. Um Temperaturen, die im Anfängerpraktikum mit Celsius angegeben werden, von Kelvin unterscheiden zu können, wird die Variable ϑ verwendet. 3.3 Aufgabenstellung 1. Nehmen Sie je eine Abkühlkurve mit einer Kupferprobe oder Aluminiumprobe mittels einem Temperaturfühler in CASSY Lab 2 auf. 2. Diskutieren Sie den beobachteten Messvorgang und erklären Sie Ihre Wahl der Messintervalle. 3. Tragen Sie die Typ-B-Messunsicherheit als Fehlerbalken in Ihre Diagramme ein und berechnen Sie die Messunsicherheit der jeweiligen Messgröÿen. 4. Exportieren Sie diese in ein geeignetes Datenauswertungsprogramm (z.b.: QTI-plot), erstellen Sie ein geeignetes Diagramm und legen Sie eine Ausgleichsfunktion durch Ihre Datenreihe. 3.4 Durchführung Für die Durchführung des Versuchs werden eine zylindrische Kupfer- oder Aluminiumprobe in einem Mini-Backofen bis auf etwa 423 K (etwa 150 C) erhitzt (etwa 10 Minuten
18 3 Newton'sches Abkühlverfahren lang aufheizen). Während des Erhitzens der Probekörper (verwenden Sie zuerst nur einen) kann das CASSY Lab 2 Modul mit angestecktem Temperaturfühler eingeschalten werden. Verbinden Sie das Modul mit dem Computer und starten Sie wie in Kapitel beschrieben das Computerprogramm CASSY Lab 2. Messen Sie die Umgebungstemperatur und achten Sie darauf, ob sie konstant bleibt. Überlegen Sie sich den zu erwartenden zeitlichen Verlauf des Abkühlprozesses wie sieht die Temperaturkurve aus und wie sollten die Messintervalle gewählt werden? Stellen Sie anschlieÿend gemäÿ der CASSY Lab 2 Erklärung (Kapitel 1.1.1) alle Messparameter ein. Wählen Sie die Parameter Temperatur ϑ in Celsius auf der y-achse und die Zeit t in Sekunden auf der x-achse. Nach Erreichen der gewünschten Temperatur kann der Probekörper aus dem Backofen entfernt und unter der Schutzvorrichtung angebracht werden. Achtung! Greifen Sie die erhitzen Metallstücke auf keinen Fall mit bloÿen Händen an. Tragen Sie deshalb die vorgesehenen Wärmeisulationshandschuhe. Sollten die eingestellten Messintervalle nicht optimal gewählt worden sein, stoppen Sie die Messung und wählen Sie diese erneut. Entfernen Sie die Probe aus der Halterung und erhitzen diese wieder im Ofen auf die vorgegebene Anfangstemperatur T 0. Stoppen Sie die Messung wenn sich das Metallstück auf etwa 323 K ( 50 C) abgekühlt hat. Exportieren Sie die erhaltene Messreihe in ein geeignetes Datenauswertungsprogramm wie beispielsweise QTI-plot. Durch Umformen von Gl. 4, T (t) = U 0 + (T 0 U 0 ) e ( at) (T 0 U 0 ) T (t) T 0 U 0 = U 0 T 0 U 0 + e at U 0 T 0 U 0 ln() erhält man die endgültige Form, ( ) T (t) U0 ln = at (5) T 0 U 0 Es zeigt sich, dass die linke Seite der Gleichung der Funktionswert und auf der rechten Seite a der Anstieg sowie t das Argument ist. Diskutieren Sie warum diese Gleichung in Ihrer logarithmierten Form vorteilhaft ist. (Tipp: erstellen Sie ein Diagramm mit den schon logarithmierten Werten) Von jedem Temperaturwert T (t) muss der konstante Wert U 0 abgezogen werden. Solche Funktionen kann man in Programmen wie z.b. QTI-Plot automatisch berechnen lassen
19 4 Schmelzwärme von Eis Ihr Betreuer / Ihre Betreuerin zeigt Ihnen wie man Fehlerbalken in QTI-Plot einzeichnet und gewichtete Fit-Funktionen erzeugt. Sensordaten Ni-CrNi - Thermoelement (Leybold) Auösung: 0,1K 4 Schmelzwärme von Eis 4.1 Grundlagen Begrie Wärmekapazität, spezische Wärmekapazität, Kalorimeter, Temperatur, Celsius, Kelvin, Latente Wärme, Phasenübergänge, Kalorimetrie, Mischungsmethode, Schmelz- und Erstarrungswärme Latente Wärme Führt man einem Gas, einer Flüssigkeit oder einem Festkörper Wärme zu, so bewirkt dies entweder eine Temperaturerhöhung (siehe Gleichung (1)) und Volumsveränderung oder nur eine Volumsveränderung (Phasenübergänge: Verdampfen, Schmelzen, Sublimieren). Kommt es zu einem dieser Phasenübergange, so muss die latente Wärme berücksichtigt werden. Als latente Wärme bezeichnet man die bei einem dieser Phasenübergänge aufgenommene oder abgegebene Energiemenge. Abb. 10 zeigt den Temperaturverlauf beim stetigen Erwärmen einer festen Stomenge einer Substanz (z.b. H 2 O Eis, Wasser, Wasserdampf). Am jeweiligen Phasenübergangspunkt tritt trotz kontinuierlicher Energiezufuhr pro Zeiteinheit keine Temperaturerhöhung ein (sondern nur eine Volumsänderung, die allerdings in diesem Diagramm nicht sichtbar ist)
20 4 Schmelzwärme von Eis Abbildung 10: Temperatur/Energiezufuhr- Diagramm z.b. von H 2 O Eis, Wasser, Wasserdampf Die spezischen Umwandlungswärmen sind wie folgt deniert: spezische Schmelzwärme spezische Verdampfungswärme S = Q s m V = Q v m (6) (7) Formelzeichen Einheit Bezeichnung Q s J absolute Schmelzwärme eines Stoes der Masse m Q v J absolute Verdampfungswärme eines Stoes der Masse m m kg Masse des schmelzenden bzw. verdampfenden Stoes Die Angaben für Verdampfungswärme enthalten zwei Anteile: Energie zur Überwindung der intermolekularen Bindungskräfte der Flüssigkeit Energie zur Ausdehnung des entstehenden Dampfes gegen den Auÿendruck Für reine Stoe gilt: Erstarrungswärme = Schmelzwärme Kondensationswärme = Verdampfungswärme Für Legierungen und Lösungen sowie für amorphe Körper ergeben sich dagegen Schmelztemperaturintervalle. Flüssigkeitsgemische haben darüber hinaus im Allgemeinen auch keinen denierten Siedepunkt. Dies macht man sich als Abtrennungsverfahren zu Nutze: fraktionierte Destillation 4. 4 z.b. Schnapsbrennen
21 4 Schmelzwärme von Eis 4.2 Kalorimetrie, Kalorimeter und Dewar Als Kalorimetrie (calor: lat. die Wärme) wird die Messung der Wärmemengen bezeichnet, die bei physikalischen, chemischen oder biologischen Vorgängen auftreten und sowohl endotherm (die Reaktion muss von auÿen Wärme aufnehmen) als auch exotherm (die Reaktion gibt nach auÿen Wärme ab) sein können. Ein Kalorimeter ist das dazu verwendete Messgerät. In diesem Beispiel besteht das Kalorimeter aus einem Dewar (ein verspiegeltes, doppelwandiges, evakuiertes Glasgefäÿ), einem Thermoelement und zwei Heizwendel (die man seriell, parallel, oder einzeln in den Stromkreis schalten kann) mit den zugehörigen Messund Spannungsversorgungsgeräten. Der Deckel des im Beispiel verwendeten Dewars ist mit einem Rührer, einer Durchführung für das Thermoelement und den Durchführungen für die Heizwendel bestückt Kalorimetrie mit der Mischungsmethode Zur Messung der spezischen Wärme von Flüssigkeiten und Festkörpern bzw. zur Messung von Transferwärmemengen bedient man sich häug kalorimetrischer Methoden, wobei meist die Mischungsmethode Anwendung ndet: Eine Masse m 1 (üssig) der Temperatur T 1 und spezischen Wärmekapazität c 1 wird mit einer anderen Masse m 2 (üssig oder fest) der Temperatur T 2 und spezischen Wärmekapazität c 2 gemischt. Nach einer gewissen Zeit stellt sich eine Mischungstemperatur T m ein, die auch von der (absoluten) Wärmekapazität C k des Kalorimetergefäÿes (einschlieÿlich des Rührers und Thermometers) abhängt. Unter der Voraussetzung, dass T 1 > T 2 ist und auch das Kalorimeter selbst anfangs die Temperatur T 1 hat, gilt für die von m 1 und dem Kalorimeter abgegebene Wärmemenge: und für die von m 2 aufgenommene Wärmemenge Q 1 = (C k + c 1 m 1 )(T 1 T m ) (8) Q 2 = c 2 m 2 (T m T 2 ) (9) Wegen des Energieerhaltungssatzes müssen diese beiden Wärmemengen gleich sein: Q 1 = Q 2 = Q (10)
22 4 Schmelzwärme von Eis Formelzeichen Einheit Bezeichnung m 1 kg Masse des Stoes mit höherer Temperatur m 2 kg Masse des Stoes mit niedrigerer Temperatur T 1 K Anfangstemperatur Sto 1 und Kalorimeter T 2 K Anfangstemperatur Sto 2 T m K Mischungstemperatur c 1 J kg =1 K =1 spezische Wärmekapazität von Sto 1 c 2 J kg =1 K =1 spezische Wärmekapazität von Sto 2 C k J K =1 Wärmekapazität des Kalorimeters Q 1 J von Sto 1 und dem Kalorimeter abgegebene Wärmemenge Q 2 J von Sto 2 aufgenommene Wärmemenge Q J Transferwärmemenge Man macht von der Mischungsmethode Gebrauch, um latente Wärmemengen zu bestimmen. Sie sind in Flüssigkeiten bzw. Gasen latent vorhanden und werden bei Änderung des Aggregatzustandes (Gas Flüssigkeit Festkörper) frei, wobei das Volumen, aber nicht die Temperatur geändert wird. Diese Wärmemengen müssen entsprechend in den Gleichungen (8) und (9) berücksichtigt werden. Für genaue Messungen muss das Mischgefäÿ gegen Wärmeaustausch mit der Umgebung geschützt werden (Dewar-Gefäÿ, Styropor-Umhüllung u. dgl.). Etwaige Wärmeverluste können durch eine spezielle Extrapolationsmethode auf unendlich schnellen Temperaturausgleich berücksichtigt werden (Details siehe Westphal-Praktikum, Walcher-Praktikum): Abb. 12 stellt das Temperatur/Zeit-Verhalten des Kalorimeterinhalts vor (I), während (II) und nach (III) Vereinigung der ursprünglich vorhandenen Masse m 1 mit der neuen Masse m 2 dar. Aus diesem Temperaturverlauf lässt sich auf den Temperaturverlauf bei unendlich schnellem Ausgleich schlieÿen, indem man (I) und (III) zu längeren bzw. kürzeren Zeiten hin extrapoliert und eine Senkrechte AB so zieht, dass die Flächen DAS und BCS gleich groÿ sind. Die Abszissen der Schnittpunkte A und B sind jene für die Mischungsmethode exakt zu wählenden Temperaturen T 1 und T m. 4.3 Aufgabenstellung 1. Bestimmen Sie die Schmelzwärme von Eis mittels Mischungsmethode mit dem Kalorimeter
23 4 Schmelzwärme von Eis Abbildung 11: Photo des Aufbaus zur Schmelzwärmemessung Abbildung 12: Temperatur/Zeit- Diagramm des Kalorimeterinhalts bei der Mischungsmethode zur Schmelzwärmebestimmung [?]. 4.4 Versuchsaufbau und Durchführung Der Dewar fasst in etwa 220 g Wasser. Da er durch die Zugabe des Eises nicht übergehen soll, muÿ entsprechend weniger heiÿes Wasser anfänglich eingefüllt werden. Das Eis sollte man schon vor dem Experiment beim Betreuer/Tutor anfragen, da es aus dem Tiefkühlfach rechtzeitig entnommen werden muss, um sich auf eine Temperatur von 0 C erwärmen zu können. Wägen Sie das Eis direkt nach der Entnahme aus dem Tiefkühlfach ab. Wenn Sie im Laufe des Experimentes 220 g abzüglich der initialen Masse des Eises an Wasser einfüllen kann der Dewar nicht übergehen, da ein Teil des Eises durch das Erwärmen dann schon geschmolzen ist. Verwenden Sie den Wasserkocher um das Wasser auf ca. 70 C zu erhitzen. Beginnen Sie 3 min vor Einbringen des Eises die Temperatur fortlaufend zu messen. Trocknen Sie das Eis vor dem Einbringen ab und wägen Sie es nochmals. Somit erhalten Sie m e. Bei computergestützter Messung sollte die Messfrequenz über den gesamten Messbereich hoch genug gewählt werden, sodass der Temperaturverlauf während des Temperaturausgleiches adäquat aufgezeichnet werden kann. Der Schmelzvorgang sollte auÿerdem durch ständiges Rühren beschleunigt werden. Messen Sie nach dem Ende des Schmelzvorganges noch ein paar Minuten weiter. Als Datalogger verwenden Sie UT61-B und das Messsoftware Measure
24 4 Schmelzwärme von Eis Tragen Sie nun die gemessenen Temperaturwerte gegen die Zeit auf. Durch Extrapolation auf unendlich schnellen Temperaturausgleich bestimmen Sie die wahre Temperaturdierenz zwischen Anfangs- und Mischungstemperatur des Kalorimeters, (T 1 T m ). Dann können Sie zusammen mit Hilfe der Wärmekapazität C k = (100 ± 10) J K 1 des Kalorimeters und der spezischen Wärmekapazität des Wassers c w = kj kg 1 K 1 die spezische Schmelzwärme S berechnen. Setzen Sie die vom Kalorimeter samt anfänglicher Wassermenge m w abgegebene Wärmemenge Q 1 = (C k + m w c w )(T 1 T m ) (11) gleich der durch das Eis (m e ist die Masse des Eises) aufgenommenen Wärmemenge Q 2 = m e S + m e c w (T m T S ) (12) um so die spezische Schmelzwärme S zu bestimmen [?]. T S ist dabei die Schmelztemperatur des Eises. Vorbereitungsfragen 1. Zwei Körper unterschiedlicher Temperatur treten in wärmeleitende Verbindung. Was geschieht? 2. Welchen Zusammenhang beschreibt das Newton'sche Abkühlgesetz (unter welchen Randbedingungen)? Erklären Sie qualitativ. 3. Wie kann man die Gültigkeit des Newton'sche Abkühlgesetzes experimentell zeigen (welche Messungen muss man zumindest machen)? 4. Vervollständigen Sie: Um einen exponentiellen Zusammenhang linear in einem Diagramm aufzutragen, muss man die abhängige Variable Was ist der Unterschied zwischen einer Zeit-basierten und einer Ereignis-basierten (getriggerten) automatischen Messung. 6. Was ist der Unterschied zwischen einer zeitbasierten Messung und einer manuellen Messung? 7. Welche Messeinstellungen muss man zumindest vornehmen, um eine automatische zeitbasierte Messung einzurichten? 8. Was sagt der erste Hauptsatz der Wärmelehre aus? 9. Was sagt der zweite Hauptsatz der Wärmelehre aus? 10. Was sagt der dritte Hauptsatz der Wärmelehre aus?
25 4 Schmelzwärme von Eis 11. Erklären Sie den Begri Wärmekapazität. 12. Wie wirkt sich die Tatsache, dass jedes Kalorimeter selbst auch eine Wärmekapazität hat, auf kalorimetrische Experimente aus?
Messen mit CASSY und MEASURE. Version vom 18. Dezember 2018
 Messen mit CASSY und MEASURE Version vom 18. Dezember 2018 Erste Schritte mit CASSY Lab 2 und Sensor-Cassy 1/2 Das Computerprogramm CASSY Lab 2 unterstützt ein oder mehrere CASSY-Module am USB-Port oder
Messen mit CASSY und MEASURE Version vom 18. Dezember 2018 Erste Schritte mit CASSY Lab 2 und Sensor-Cassy 1/2 Das Computerprogramm CASSY Lab 2 unterstützt ein oder mehrere CASSY-Module am USB-Port oder
LS9. Wärme 1 Spezifische Wärmekapazität und Schmelzwärme von Eis Version vom 23. Mai 2016
 Wärme 1 Spezifische Wärmekapazität und Schmelzwärme von Eis Version vom 23. Mai 2016 Inhaltsverzeichnis 1 Allgemeine Grundlagen zur Theorie der Wärme 1 1.1 Hauptsätze der Wärmelehre..........................
Wärme 1 Spezifische Wärmekapazität und Schmelzwärme von Eis Version vom 23. Mai 2016 Inhaltsverzeichnis 1 Allgemeine Grundlagen zur Theorie der Wärme 1 1.1 Hauptsätze der Wärmelehre..........................
Erste Schritte. mit CASSY und ULAB Version vom 13. Juli 2012
 Erste Schritte mit CASSY und ULAB Version vom 13. Juli 2012 Erste Schritte mit CASSY Lab 2 und Sensor-Cassy 1/2 Das Computerprogramm CASSY Lab 2 unterstützt ein oder mehrere CASSY-Module am USB-Port oder
Erste Schritte mit CASSY und ULAB Version vom 13. Juli 2012 Erste Schritte mit CASSY Lab 2 und Sensor-Cassy 1/2 Das Computerprogramm CASSY Lab 2 unterstützt ein oder mehrere CASSY-Module am USB-Port oder
Versuch Nr.53. Messung kalorischer Größen (Spezifische Wärmen)
 Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
LS3. Computergestützte Messwerterfassung und Datenverarbeitung Version vom 23. Mai 2016
 Computergestützte Messwerterfassung und Datenverarbeitung Version vom 23. Mai 2016 Inhaltsverzeichnis 1 Computergestützte Messwerterfassung und Datenverarbeitung 2 1.1 Einsatzmöglichkeiten des Computers
Computergestützte Messwerterfassung und Datenverarbeitung Version vom 23. Mai 2016 Inhaltsverzeichnis 1 Computergestützte Messwerterfassung und Datenverarbeitung 2 1.1 Einsatzmöglichkeiten des Computers
Spezische Wärme von Festkörpern
 Spezische Wärme von Festkörpern Praktikumsversuch am 11.05.2011 Gruppe: 18 Thomas Himmelbauer Daniel Weiss Abgegeben am: 18.05.2011 Inhaltsverzeichnis 1 Einleitung 2 2 Vorbemerkung zur Fehlerrechnung 2
Spezische Wärme von Festkörpern Praktikumsversuch am 11.05.2011 Gruppe: 18 Thomas Himmelbauer Daniel Weiss Abgegeben am: 18.05.2011 Inhaltsverzeichnis 1 Einleitung 2 2 Vorbemerkung zur Fehlerrechnung 2
Anleitung zum Programm CASSY Lab für den Versuch S1
 Anleitung zum Programm CASSY Lab für den Versuch S1 Starten Sie das Programm CASSY Lab durch Doppelklick auf das Icon auf dem Windows- Desktop. Es erscheint ein Fenster mit Lizensierungsinformationen,
Anleitung zum Programm CASSY Lab für den Versuch S1 Starten Sie das Programm CASSY Lab durch Doppelklick auf das Icon auf dem Windows- Desktop. Es erscheint ein Fenster mit Lizensierungsinformationen,
Protokoll Grundpraktikum I: T6 Thermoelement und newtonsches Abkühlungsgesetz
 Protokoll Grundpraktikum I: T6 Thermoelement und newtonsches Abkühlungsgesetz Sebastian Pfitzner 5. Juni 03 Durchführung: Sebastian Pfitzner (553983), Anna Andrle (55077) Arbeitsplatz: Platz 3 Betreuer:
Protokoll Grundpraktikum I: T6 Thermoelement und newtonsches Abkühlungsgesetz Sebastian Pfitzner 5. Juni 03 Durchführung: Sebastian Pfitzner (553983), Anna Andrle (55077) Arbeitsplatz: Platz 3 Betreuer:
Einführung zu CASSY - Temperaturmessung
 Als Einführung in die Arbeit mit CASSY soll eine einfache Temperaturmessung durchgeführt werden. Das modular aufgebaute Messsystem besteht aus einem Analog-Digitalwandler, hier das Pocket- CASSY, und einer
Als Einführung in die Arbeit mit CASSY soll eine einfache Temperaturmessung durchgeführt werden. Das modular aufgebaute Messsystem besteht aus einem Analog-Digitalwandler, hier das Pocket- CASSY, und einer
An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern?
 An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern? Temperatur Der nullte Hauptsatz der Thermodynamik: Thermoskop und Thermometer Kelvin, Celsius- und der Fahrenheit-Skala Wärmeausdehnung
An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern? Temperatur Der nullte Hauptsatz der Thermodynamik: Thermoskop und Thermometer Kelvin, Celsius- und der Fahrenheit-Skala Wärmeausdehnung
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
Energie und Energieerhaltung. Mechanische Energieformen. Arbeit. Die goldene Regel der Mechanik. Leistung
 - Formelzeichen: E - Einheit: [ E ] = 1 J (Joule) = 1 Nm = 1 Energie und Energieerhaltung Die verschiedenen Energieformen (mechanische Energie, innere Energie, elektrische Energie und Lichtenergie) lassen
- Formelzeichen: E - Einheit: [ E ] = 1 J (Joule) = 1 Nm = 1 Energie und Energieerhaltung Die verschiedenen Energieformen (mechanische Energie, innere Energie, elektrische Energie und Lichtenergie) lassen
2.2 Spezifische und latente Wärmen
 1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
1 Einleitung Physikalisches Praktikum für Anfänger - Teil 1 Gruppe 2 Wärmelehre 2.2 Spezifische und latente Wärmen Die spezifische Wärme von Wasser gibt an, wieviel Energie man zu 1 kg Wasser zuführen
Versuch A06: Stefan-Boltzmannsches Strahlungsgesetz
 Versuch A06: Stefan-Boltzmannsches Strahlungsgesetz 14. März 2014 I Lernziele Plancksche Strahlungsformel Stefan-Boltzmannsches Strahlungsgesetz Wiensches Verschiebungsgesetz II Physikalische Grundlagen
Versuch A06: Stefan-Boltzmannsches Strahlungsgesetz 14. März 2014 I Lernziele Plancksche Strahlungsformel Stefan-Boltzmannsches Strahlungsgesetz Wiensches Verschiebungsgesetz II Physikalische Grundlagen
Arbeitsweisen der Physik
 Übersicht Karteikarten Klasse 7 - Arbeitsweisen - Beobachten - Beschreiben - Beschreiben von Gegenständen, Erscheinungen und Prozessen - Beschreiben des Aufbaus und Erklären der Wirkungsweise eines technischen
Übersicht Karteikarten Klasse 7 - Arbeitsweisen - Beobachten - Beschreiben - Beschreiben von Gegenständen, Erscheinungen und Prozessen - Beschreiben des Aufbaus und Erklären der Wirkungsweise eines technischen
Physik für Mediziner im 1. Fachsemester
 Physik für Mediziner im 1. Fachsemester #10 30/10/2008 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Thermisches Gleichgewicht Soll die Temperatur geändert werden, so muss dem System Wärme (kinetische
Physik für Mediziner im 1. Fachsemester #10 30/10/2008 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Thermisches Gleichgewicht Soll die Temperatur geändert werden, so muss dem System Wärme (kinetische
M0 BIO - Reaktionszeit
 M0 BIO - Reaktionszeit 1 Ziel des Versuches In diesem Versuch haben Sie die Möglichkeit, sich mit Messunsicherheiten vertraut zu machen. Die Analyse von Messunsicherheiten erfolgt hierbei an zwei Beispielen.
M0 BIO - Reaktionszeit 1 Ziel des Versuches In diesem Versuch haben Sie die Möglichkeit, sich mit Messunsicherheiten vertraut zu machen. Die Analyse von Messunsicherheiten erfolgt hierbei an zwei Beispielen.
Physikalische Chemie 1
 Physikalische Chemie 1 Christian Lehmann 31. Januar 2004 Inhaltsverzeichnis 1 Einführung 2 1.1 Teilgebiete der Physikalischen Chemie............... 2 1.1.1 Thermodynamik (Wärmelehre)............... 2 1.1.2
Physikalische Chemie 1 Christian Lehmann 31. Januar 2004 Inhaltsverzeichnis 1 Einführung 2 1.1 Teilgebiete der Physikalischen Chemie............... 2 1.1.1 Thermodynamik (Wärmelehre)............... 2 1.1.2
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen!
 1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
1. Klausur ist am 5.12.! (für Vets sowie Bonuspunkte für Zahni-Praktikum) Jetzt lernen! http://www.physik.uni-giessen.de/dueren/ User: duerenvorlesung Password: ****** Druck und Volumen Gesetz von Boyle-Mariotte:
Thermodynamik. Wechselwirkung mit anderen Systemen Wärme, Arbeit, Teilchen
 18a Temperatur 1 Thermodynamik Thermodynamik ist eine phänomenologische Wissenschaft Sie beschreibt die Wechselwirkung von Systemen mit ihrer Umgebung Aus der Erfahrung und durch zahllose Beobachtungen
18a Temperatur 1 Thermodynamik Thermodynamik ist eine phänomenologische Wissenschaft Sie beschreibt die Wechselwirkung von Systemen mit ihrer Umgebung Aus der Erfahrung und durch zahllose Beobachtungen
Spezifische Wärmekapazität fester Körper
 Version: 14. Oktober 2005 Spezifische Wärmekapazität fester Körper Stichworte Wärmemenge, spezifische Wärme, Schmelzwärme, Wärmekapazität, Wasserwert, Siedepunkt, innere Energie, Energiesatz, Hauptsätze
Version: 14. Oktober 2005 Spezifische Wärmekapazität fester Körper Stichworte Wärmemenge, spezifische Wärme, Schmelzwärme, Wärmekapazität, Wasserwert, Siedepunkt, innere Energie, Energiesatz, Hauptsätze
Versuch W1: Kalorimetrie
 Versuch W1: Kalorimetrie Aufgaben: 1. Bestimmen Sie die Wärmekapazität zweier Kalorimeter (Kalorimeterkonstanten). 2. Bestimmen Sie die spezifische Wärmekapazität von 2 verschiedenen festen Stoffen. 3.
Versuch W1: Kalorimetrie Aufgaben: 1. Bestimmen Sie die Wärmekapazität zweier Kalorimeter (Kalorimeterkonstanten). 2. Bestimmen Sie die spezifische Wärmekapazität von 2 verschiedenen festen Stoffen. 3.
Auswertung: Wärmekapazität
 Auswertung: Wärmekapazität M. Axwel & Marcel Köpke 4.06.202 Inhaltsverzeichnis spezische Wärmekapazität von Aluminium und Kupfer 3. einzelnes Metallstück.............................. 4.. Diskussion der
Auswertung: Wärmekapazität M. Axwel & Marcel Köpke 4.06.202 Inhaltsverzeichnis spezische Wärmekapazität von Aluminium und Kupfer 3. einzelnes Metallstück.............................. 4.. Diskussion der
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
Wärmemenge, spezifische Wärmekapazität, molare Wärmekapazität, Kalorimetrie, Dulong-Petitsches Gesetz.
 W1 Spezifische Wärmekapazität von festen Stoffen Stoffgebiet: Wärmemenge, spezifische Wärmekapazität, molare Wärmekapazität, Kalorimetrie, Dulong-Petitsches Gesetz. Versuchsziel: Bestimmung der spezifischen
W1 Spezifische Wärmekapazität von festen Stoffen Stoffgebiet: Wärmemenge, spezifische Wärmekapazität, molare Wärmekapazität, Kalorimetrie, Dulong-Petitsches Gesetz. Versuchsziel: Bestimmung der spezifischen
Bestimmung der spezifischen Wärmekapazität fester Körper
 - B02.1 - Versuch B2: Bestimmung der spezifischen Wärmekapazität fester Körper 1. Literatur: Demtröder, Experimentalphysik, Bd. I Bergmann-Schaefer, Lehrbuch der Physik, Bd.I Walcher, Praktikum der Physik
- B02.1 - Versuch B2: Bestimmung der spezifischen Wärmekapazität fester Körper 1. Literatur: Demtröder, Experimentalphysik, Bd. I Bergmann-Schaefer, Lehrbuch der Physik, Bd.I Walcher, Praktikum der Physik
Fachhochschule Flensburg. Die spezifische Wärmekapazität fester Körper
 Name : Fachhochschule Flensburg Fachbereich Technik Institut für Physik und Werkstoffe Name: Versuch-Nr: W4 Die spezifische Wärmekapazität fester Körper Gliederung: Seite Einleitung 1 Berechnung 1 Versuchsbeschreibung
Name : Fachhochschule Flensburg Fachbereich Technik Institut für Physik und Werkstoffe Name: Versuch-Nr: W4 Die spezifische Wärmekapazität fester Körper Gliederung: Seite Einleitung 1 Berechnung 1 Versuchsbeschreibung
Newtonsches Abkühlungsgesetz
 Newtonsches Abkühlungsgesetz Zielsetzung: Mit diesem Experiment soll die Abkühlgeschwindigkeit eines Körpers bestimmt und das dementsprechende mathematische Modell gefunden werden, um diesen Wechsel zu
Newtonsches Abkühlungsgesetz Zielsetzung: Mit diesem Experiment soll die Abkühlgeschwindigkeit eines Körpers bestimmt und das dementsprechende mathematische Modell gefunden werden, um diesen Wechsel zu
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
LS11. Wärmelehre Wärmeleitung in Metallen, spezische Wärmekapazität von Wasser Version vom 25. Januar 2019
 Wärmelehre Wärmeleitung in Metallen, spezische Wärmekapazität von Wasser Version vom 25. Januar 2019 Inhaltsverzeichnis 1 Allgemeine Grundlagen - Wärmetransport 1 1.1 Begrie.....................................
Wärmelehre Wärmeleitung in Metallen, spezische Wärmekapazität von Wasser Version vom 25. Januar 2019 Inhaltsverzeichnis 1 Allgemeine Grundlagen - Wärmetransport 1 1.1 Begrie.....................................
Experimentalphysik VO, Kapitel 4Wärme: Wärme als Energieform (1. Hauptsatz), Mischungsvorgänge,
 3 Wärme 3.1 Lernziel Die Studierenden vertiefen das Verständnis der Begriffe Innere Energie, Wärme, spezifische Wärmekapazität und molare Wärme von Festkörpern und Flüssigkeiten. Sie können den Wasserwert
3 Wärme 3.1 Lernziel Die Studierenden vertiefen das Verständnis der Begriffe Innere Energie, Wärme, spezifische Wärmekapazität und molare Wärme von Festkörpern und Flüssigkeiten. Sie können den Wasserwert
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #4 am 3.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 007 Vladimir Dyakonov #4 am 3.0.007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
(VIII) Wärmlehre. Wärmelehre Karim Kouz WS 2014/ Semester Biophysik
 Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Quelle: http://www.pro-physik.de/details/news/1666619/neues_bauprinzip_fuer_ultrapraezise_nuklearuhr.html (VIII) Wärmlehre Karim Kouz WS 2014/2015 1. Semester Biophysik Wärmelehre Ein zentraler Begriff
Einführung in den Umgang mit dem Pocket-CASSY im Schülerpraktikum (CASSY-Lab 2)
 (EinfCASSY2.docx) Renner, Schich 12.01.17 CASSY-Praktikum Seite 1 von 7 Einführung in den Umgang mit dem Pocket-CASSY im Schülerpraktikum (CASSY-Lab 2) Messwerterfassungs- und Auswertesystem CASSY CASSY
(EinfCASSY2.docx) Renner, Schich 12.01.17 CASSY-Praktikum Seite 1 von 7 Einführung in den Umgang mit dem Pocket-CASSY im Schülerpraktikum (CASSY-Lab 2) Messwerterfassungs- und Auswertesystem CASSY CASSY
Protokoll zum Versuch: Elektrisches Wärmeäquivalent
 Protokoll zum Versuch: Elektrisches Wärmeäquivalent Nils Brüdigam Fabian Schmid-Michels Universität Bielefeld Wintersemester 2006/2007 Grundpraktikum I 07.12.2006 Inhaltsverzeichnis 1 Ziel 2 2 Theorie
Protokoll zum Versuch: Elektrisches Wärmeäquivalent Nils Brüdigam Fabian Schmid-Michels Universität Bielefeld Wintersemester 2006/2007 Grundpraktikum I 07.12.2006 Inhaltsverzeichnis 1 Ziel 2 2 Theorie
Versuch 2. Physik für (Zahn-)Mediziner. c Claus Pegel 13. November 2007
 Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Praktikum Materialwissenschaft II. Wärmeleitung
 Praktikum Materialwissenschaft II Wärmeleitung Gruppe 8 André Schwöbel 1328037 Jörg Schließer 1401598 Maximilian Fries 1407149 e-mail: a.schwoebel@gmail.com Betreuer: Markus König 21.11.2007 Inhaltsverzeichnis
Praktikum Materialwissenschaft II Wärmeleitung Gruppe 8 André Schwöbel 1328037 Jörg Schließer 1401598 Maximilian Fries 1407149 e-mail: a.schwoebel@gmail.com Betreuer: Markus König 21.11.2007 Inhaltsverzeichnis
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
Protokoll für das NAWI-Profil. Namen: / Klasse: Datum:
 Protokoll für das NAWI-Profil Namen: / Klasse: Datum: Station B6: Messung und Regelung von Temperaturen Aufgabe: Untersuche den grundsätzlichen Unterschied eines P - und eines PI-Reglers hinsichtlich der
Protokoll für das NAWI-Profil Namen: / Klasse: Datum: Station B6: Messung und Regelung von Temperaturen Aufgabe: Untersuche den grundsätzlichen Unterschied eines P - und eines PI-Reglers hinsichtlich der
Phasengleichgewicht. 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. A fl. A g
 Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Numerische Integration
 A1 Numerische Integration Einführendes Beispiel In einem Raum mit der Umgebungstemperatur T u = 21.7 C befindet sich eine Tasse heissen Kaffees mit der anfänglichen Temperatur T 0 80 C. Wie kühlt sich
A1 Numerische Integration Einführendes Beispiel In einem Raum mit der Umgebungstemperatur T u = 21.7 C befindet sich eine Tasse heissen Kaffees mit der anfänglichen Temperatur T 0 80 C. Wie kühlt sich
Hydrodynamik: bewegte Flüssigkeiten
 Hydrodynamik: bewegte Flüssigkeiten Wir betrachten eine stationäre Strömung, d.h. die Geschwindigkeit der Strömung an einem gegebenen Punkt bleibt konstant im Laufe der Zeit. Außerdem betrachten wir zunächst
Hydrodynamik: bewegte Flüssigkeiten Wir betrachten eine stationäre Strömung, d.h. die Geschwindigkeit der Strömung an einem gegebenen Punkt bleibt konstant im Laufe der Zeit. Außerdem betrachten wir zunächst
Grundlagen der statistischen Physik und Thermodynamik
 Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
8.1. Kinetische Theorie der Wärme
 8.1. Kinetische Theorie der Wärme Deinition: Ein ideales Gas ist ein System von harten Massenpunkten, die untereinander und mit den Wänden elastische Stöße durchühren und keiner anderen Wechselwirkung
8.1. Kinetische Theorie der Wärme Deinition: Ein ideales Gas ist ein System von harten Massenpunkten, die untereinander und mit den Wänden elastische Stöße durchühren und keiner anderen Wechselwirkung
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
T1: Wärmekapazität eines Kalorimeters
 Grundpraktikum T1: Wärmekapazität eines Kalorimeters Autor: Partner: Versuchsdatum: Versuchsplatz: Abgabedatum: Inhaltsverzeichnis 1 Physikalische Grundlagen und Aufgabenstellung 2 2 Messwerte und Auswertung
Grundpraktikum T1: Wärmekapazität eines Kalorimeters Autor: Partner: Versuchsdatum: Versuchsplatz: Abgabedatum: Inhaltsverzeichnis 1 Physikalische Grundlagen und Aufgabenstellung 2 2 Messwerte und Auswertung
Thermodynamik 2. Zweiter Hauptsatz der Thermodynamik. Entropie. Die statistische Definition der Entropie.
 Thermodynamik 2. Zweiter Hauptsatz der Thermodynamik. Entropie. Die statistische Definition der Entropie. Die Hauptsätze der Thermodynamik Kurze Zusammenfassung der Hauptsätze 0. Hauptsatz: Stehen zwei
Thermodynamik 2. Zweiter Hauptsatz der Thermodynamik. Entropie. Die statistische Definition der Entropie. Die Hauptsätze der Thermodynamik Kurze Zusammenfassung der Hauptsätze 0. Hauptsatz: Stehen zwei
CPK-Terminal Bedienungsanleitung
 CPK-Terminal Bedienungsanleitung 1. Software Installation Führen Sie die Setup -Datei aus, die sich auf der DYNTEST-CD befindet. Wählen Sie Ihre Sprache und drücken dann den OK -Button, woraufhin die Installationsvorbereitung
CPK-Terminal Bedienungsanleitung 1. Software Installation Führen Sie die Setup -Datei aus, die sich auf der DYNTEST-CD befindet. Wählen Sie Ihre Sprache und drücken dann den OK -Button, woraufhin die Installationsvorbereitung
3. Berechnung der molaren Verbrennungsenthalpie. 4. Berechnung der Standardreaktionsenthalpie für die Hydrierung von Phthalsäureanhydrid
 Verbrennungswärme Aufgaben: 1. Ermittlung der Wärmekapazität des Kalorimeters durch Verbrennen einer Eichsubstanz. 2. Bestimmung der spezifischen Verbrennungswärmen von Phthalsäureanhydrid und Tetrahydrophthalsäureanhydrid.
Verbrennungswärme Aufgaben: 1. Ermittlung der Wärmekapazität des Kalorimeters durch Verbrennen einer Eichsubstanz. 2. Bestimmung der spezifischen Verbrennungswärmen von Phthalsäureanhydrid und Tetrahydrophthalsäureanhydrid.
PHYSIKTEST 3A 19. Dezember 2016
 PHYSIKTEST 3A 19. Dezember 2016 GRUPPE C ARBEITSZEIT: 15 Min. SCHÜLERNAME: PUNKTEANZAHL: /20 NOTE: NOTENSCHLÜSSEL 18-20 Sehr Gut (1) 15-17 Gut (2) 13-14 Befriedigend (3) 10-12 Genügend (4) 0-9 Nicht Genügend
PHYSIKTEST 3A 19. Dezember 2016 GRUPPE C ARBEITSZEIT: 15 Min. SCHÜLERNAME: PUNKTEANZAHL: /20 NOTE: NOTENSCHLÜSSEL 18-20 Sehr Gut (1) 15-17 Gut (2) 13-14 Befriedigend (3) 10-12 Genügend (4) 0-9 Nicht Genügend
Planungsblatt Physik für die 3B
 Planungsblatt Physik für die 3B Woche 20 (von 15.01 bis 19.01) Hausaufgaben 1 Bis Montag 22.01: Lerne die Notizen von Woche 20! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Planungsblatt Physik für die 3B Woche 20 (von 15.01 bis 19.01) Hausaufgaben 1 Bis Montag 22.01: Lerne die Notizen von Woche 20! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
PHYSIKALISCHES PRAKTIKUM FÜR ANFÄNGER LGyGe. W 3 - Kalorimetrie
 10.08.2008 PHYSIKALISCHES PRAKTIKUM FÜR ANFÄNGER LGyGe Versuch: W 3 - Kalorimetrie 1. Grundlagen Definition und Einheit von Wärme und Temperatur; Wärmekapazität (spezifische und molare); Regel von Dulong
10.08.2008 PHYSIKALISCHES PRAKTIKUM FÜR ANFÄNGER LGyGe Versuch: W 3 - Kalorimetrie 1. Grundlagen Definition und Einheit von Wärme und Temperatur; Wärmekapazität (spezifische und molare); Regel von Dulong
Physik für Mediziner im 1. Fachsemester
 Physik für Mediziner im 1. Fachsemester #12 10/11/2010 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Konvektion Verbunden mit Materietransport Ursache: Temperaturabhängigkeit der Dichte In Festkörpern
Physik für Mediziner im 1. Fachsemester #12 10/11/2010 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Konvektion Verbunden mit Materietransport Ursache: Temperaturabhängigkeit der Dichte In Festkörpern
13.Wärmekapazität. EP Vorlesung 14. II) Wärmelehre
 13.Wärmekapazität EP Vorlesung 14 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Mechanisches Wärmeäquivalent
13.Wärmekapazität EP Vorlesung 14 II) Wärmelehre 10. Temperatur und Stoffmenge 11. Ideale Gasgleichung 12. Gaskinetik 13. Wärmekapazität 14. Hauptsätze der Wärmelehre Versuche: Mechanisches Wärmeäquivalent
Lösungen Serie 16: Kalorimetrie
 en Serie 16: Kalorimetrie Aufgabe 16.1 A Sie wollen in einem Kochtopf ( =0.6, =0.4 ( =4.182 k K gegeben: =0.6 =0.4 k K ) einen halben Liter Wasser ) von 10 auf 40 erwärmen. Welche Wärmemenge ist dazu notwendig?
en Serie 16: Kalorimetrie Aufgabe 16.1 A Sie wollen in einem Kochtopf ( =0.6, =0.4 ( =4.182 k K gegeben: =0.6 =0.4 k K ) einen halben Liter Wasser ) von 10 auf 40 erwärmen. Welche Wärmemenge ist dazu notwendig?
Beispielprojekt: Datenloggen mit MSD200 und Auswertung mit Tabellenkalkulation (Teil1)
 Beispielprojekt: Datenloggen mit und Auswertung mit Tabellenkalkulation (Teil1) In diesem Beispielprojekt werden das Datenloggen sowie die anschließende Auswertung mittels des und einem Tabellenkalkulationsprogramm
Beispielprojekt: Datenloggen mit und Auswertung mit Tabellenkalkulation (Teil1) In diesem Beispielprojekt werden das Datenloggen sowie die anschließende Auswertung mittels des und einem Tabellenkalkulationsprogramm
Whitekalorimeter. Wärmekapazitätsbestimmung verschiedener Materialien. Dominik Büchler 5HL. Betreuer: Mag. Dr. Per Federspiel
 Dominik Büchler Physikalisch chemisches Laboratorium Betreuer: Mag. Dr. Per Federspiel 5HL Whitekalorimeter sbestimmung verschiedener Materialien Note: Datum: Unterschrift: Whitekalorimetrie Seite 1 von
Dominik Büchler Physikalisch chemisches Laboratorium Betreuer: Mag. Dr. Per Federspiel 5HL Whitekalorimeter sbestimmung verschiedener Materialien Note: Datum: Unterschrift: Whitekalorimetrie Seite 1 von
Flüssigkeitsthermometer Bimetallthermometer Gasthermometer Celsius Fahrenheit
 Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
Wärme Ob etwas warm oder kalt ist können wir fühlen. Wenn etwas wärmer ist, so hat es eine höhere Temperatur. Temperaturen können wir im Bereich von etwa 15 Grad Celsius bis etwa 45 Grad Celsius recht
Moderne Theoretische Physik III (Theorie F Statistische Mechanik) SS 17
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
DepoTrend 0 INSTALLATION 1 DATEN SICHERN UND IMPORTIEREN 1.1 STARTEN DES PROGRAMMS 1.2 PROJEKTE ANLEGEN 1.3 IMPORTIEREN DER ROHDATEN
 DepoTrend Software zur Anzeige und Archivierung der DEPOSENS 3 Daten Version 2.3 Kurzanleitung 0 INSTALLATION Entpacken Sie die Datei DepoTrend.zip in ein Verzeichnis Ihrer Wahl. Nach dem Entpacken sollten
DepoTrend Software zur Anzeige und Archivierung der DEPOSENS 3 Daten Version 2.3 Kurzanleitung 0 INSTALLATION Entpacken Sie die Datei DepoTrend.zip in ein Verzeichnis Ihrer Wahl. Nach dem Entpacken sollten
Temperatur. Temperaturmessung. Grundgleichung der Kalorik. 2 ² 3 2 T - absolute Temperatur / ºC T / K
 Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
Temperatur Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen 2 ² 3 2 T - absolute Temperatur [ T ] = 1 K = 1 Kelvin k- Boltzmann-Konst. k = 1,38 10-23 J/K Kelvin- und Celsiusskala
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
E2: Wärmelehre und Elektromagnetismus 10. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 10. Vorlesung 14.05.2018 Heute: - Wärmetransport: Wärmeleitung, Konvektion, Wärmestrahlung - Diffusion & Stofftransport - Thermodynamische Potentiale https://xkcd.com/793/
E2: Wärmelehre und Elektromagnetismus 10. Vorlesung 14.05.2018 Heute: - Wärmetransport: Wärmeleitung, Konvektion, Wärmestrahlung - Diffusion & Stofftransport - Thermodynamische Potentiale https://xkcd.com/793/
Auswertung. B04: Spezifische Wärme
 Auswertung zum Versuch B04: Spezifische Wärme Alexander FufaeV Partner: Jule Heier Gruppe 254 Inhaltsverzeichnis 2. Bestimmung der Wärmekapazität C1 des blauen Dewargefäßes... 3 3. Bestimmung der Schmelzwärme
Auswertung zum Versuch B04: Spezifische Wärme Alexander FufaeV Partner: Jule Heier Gruppe 254 Inhaltsverzeichnis 2. Bestimmung der Wärmekapazität C1 des blauen Dewargefäßes... 3 3. Bestimmung der Schmelzwärme
Grundlagen der Wärmelehre
 Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Ausgabe 2007-09 Grundlagen der Wärmelehre (Erläuterungen) Die Wärmelehre ist das Teilgebiet der Physik, in dem Zustandsänderungen von Körpern infolge Zufuhr oder Abgabe von Wärmeenergie und in dem Energieumwandlungen,
Wärmelehre Wärme als Energie-Form
 Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
Wärmelehre Wärme als Energie-Form Joule's Vorrichtung zur Messung des mechanischen Wärme-Äquivalents alte Einheit: 1 cal = 4.184 J 1 kcal Wärme erwärmt 1 kg H 2 O um 1 K Wird einem Körper mit der Masse
4.6.5 Dritter Hauptsatz der Thermodynamik
 4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
4.6 Hauptsätze der Thermodynamik Entropie S: ds = dq rev T (4.97) Zustandsgröße, die den Grad der Irreversibilität eines Vorgangs angibt. Sie ist ein Maß für die Unordnung eines Systems. Vorgänge finden
Grundwissen. Physik. Jahrgangsstufe 8
 Grundwissen Physik Jahrgangsstufe 8 Grundwissen Physik Jahrgangsstufe 8 Seite 1 1. Energie; E [E] = 1Nm = 1J (Joule) 1.1 Energieerhaltungssatz Formulierung I: Energie kann nicht erzeugt oder vernichtet
Grundwissen Physik Jahrgangsstufe 8 Grundwissen Physik Jahrgangsstufe 8 Seite 1 1. Energie; E [E] = 1Nm = 1J (Joule) 1.1 Energieerhaltungssatz Formulierung I: Energie kann nicht erzeugt oder vernichtet
Vorlesung 15 II Wärmelehre 15. Wärmetransport und Stoffmischung
 Vorlesung 15 II Wärmelehre 15. Wärmetransport und Stoffmischung a) Wärmestrahlung b) Wärmeleitung c) Wärmeströmung d) Diffusion 16. Phasenübergänge (Verdampfen, Schmelzen, Sublimieren) Versuche: Wärmeleitung
Vorlesung 15 II Wärmelehre 15. Wärmetransport und Stoffmischung a) Wärmestrahlung b) Wärmeleitung c) Wärmeströmung d) Diffusion 16. Phasenübergänge (Verdampfen, Schmelzen, Sublimieren) Versuche: Wärmeleitung
Versuch: Spezifische Wärmekapazität fester Körper
 ersuch T1 SPEZIFISHE WÄRMEKAPAZITÄT FESTER KÖRPER Seite 1 von 5 ersuch: Spezifische Wärmekapazität fester Körper Anleitung für folgende Studiengänge: Physik, L3 Physik, Biophysik, Meteorologie, hemie,
ersuch T1 SPEZIFISHE WÄRMEKAPAZITÄT FESTER KÖRPER Seite 1 von 5 ersuch: Spezifische Wärmekapazität fester Körper Anleitung für folgende Studiengänge: Physik, L3 Physik, Biophysik, Meteorologie, hemie,
Physikalisches Praktikum Bestimmung der Schmelzwärme von Eis
 Physikalisches Praktikum Bestimmung der Schmelzwärme von Eis Autoren: Markus Krieger Nicolai Löw Erstellungsdatum: 4. Juni 2000 Disclaimer: Alle von mir im Internet unter http://www.krieger-online.de veröffentlichten
Physikalisches Praktikum Bestimmung der Schmelzwärme von Eis Autoren: Markus Krieger Nicolai Löw Erstellungsdatum: 4. Juni 2000 Disclaimer: Alle von mir im Internet unter http://www.krieger-online.de veröffentlichten
TD 3: Neutralisationswärme
 TD 3: Neutralisationswärme Theoretische Einleitung Chemische Umsetzungen sind stets von einer Energieänderung begleitet, wobei der umgesetzte Energiebetrag entweder vom System aufgenommen (endotherme Reaktion)
TD 3: Neutralisationswärme Theoretische Einleitung Chemische Umsetzungen sind stets von einer Energieänderung begleitet, wobei der umgesetzte Energiebetrag entweder vom System aufgenommen (endotherme Reaktion)
Physik Erster Hauptsatz (mechanisches und elektrisches Wärmeäquivalent)
 Physik Erster Hauptsatz (mechanisches und elektrisches Wärmeäquivalent) 1. Ziel des Versuches Umwandlung von mechanischer Reibungsarbeit in Wärme, Umwandlung von elektrischer Arbeit bzw. Energie in Wärme,
Physik Erster Hauptsatz (mechanisches und elektrisches Wärmeäquivalent) 1. Ziel des Versuches Umwandlung von mechanischer Reibungsarbeit in Wärme, Umwandlung von elektrischer Arbeit bzw. Energie in Wärme,
Planungsblatt Physik für die 3B
 Planungsblatt Physik für die 3B Woche 24 (von 12.02 bis 16.02) Hausaufgaben 1 Bis Montag 19.02: Lerne die Notizen von Woche 24! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Planungsblatt Physik für die 3B Woche 24 (von 12.02 bis 16.02) Hausaufgaben 1 Bis Montag 19.02: Lerne die Notizen von Woche 24! Kernbegriffe dieser Woche: Energie, Leistung, Wärme, Wärmeleitung, Konvektion,
Teilchenmodell: * Alle Stoffe bestehen aus Teilchen (Atomen, Molekülen). * Die Teilchen befinden sich in ständiger Bewegung.
 Teilchenmodell Teilchenmodell: * Alle Stoffe bestehen aus Teilchen (Atomen, Molekülen). * Die Teilchen befinden sich in ständiger Bewegung. *Zwischen den Teilchen wirken anziehende bzw. abstoßende Kräfte.
Teilchenmodell Teilchenmodell: * Alle Stoffe bestehen aus Teilchen (Atomen, Molekülen). * Die Teilchen befinden sich in ständiger Bewegung. *Zwischen den Teilchen wirken anziehende bzw. abstoßende Kräfte.
Konvektion. Prinzip: Bei Konvektion ist Wärmetransport an Materialtransport. Beispiel: See- und Landwind
 Konvektion Fluides Medium dehnt sich durch Erwärmung lokal aus erwärmte Stoffmenge hat kleinere Dichte steigt auf und wird durch kälteren Stoff ersetzt Konvektionskreislauf Prinzip: Warme Flüssigkeit steigt
Konvektion Fluides Medium dehnt sich durch Erwärmung lokal aus erwärmte Stoffmenge hat kleinere Dichte steigt auf und wird durch kälteren Stoff ersetzt Konvektionskreislauf Prinzip: Warme Flüssigkeit steigt
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas. Thermodynamik
 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
T5 - Hydratations- und Neutralisationsenthalpie
 T5 - Hydratations- und Neutralisationsenthalpie Aufgaben: 1. Messung der molaren integralen Lösungsenthalpie von Natriumhydrogenphosphat Na 2 HPO 4, Natriumhydrogenphosphat-dihydrat Na 2 HPO 4 2H 2 O,
T5 - Hydratations- und Neutralisationsenthalpie Aufgaben: 1. Messung der molaren integralen Lösungsenthalpie von Natriumhydrogenphosphat Na 2 HPO 4, Natriumhydrogenphosphat-dihydrat Na 2 HPO 4 2H 2 O,
9. Thermodynamik. 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala. 9.4 Wärmekapazität
 9. Thermodynamik 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala 93 9.3 Thermische h Ausdehnung 9.4 Wärmekapazität 9. Thermodynamik Aufgabe: - Temperaturverhalten von Gasen,
9. Thermodynamik 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala 93 9.3 Thermische h Ausdehnung 9.4 Wärmekapazität 9. Thermodynamik Aufgabe: - Temperaturverhalten von Gasen,
Physikalisches Praktikum I
 Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Praktikumsvorbereitung Wärmestrahlung
 Praktikumsvorbereitung Wärmestrahlung André Schendel, Silas Kraus Gruppe DO-20 14. Juni 2012 I. Allgemein Schwarzer Körper Ein schwarzer Körper ist ein idealisiertes Objekt, das jede elektromagnetische
Praktikumsvorbereitung Wärmestrahlung André Schendel, Silas Kraus Gruppe DO-20 14. Juni 2012 I. Allgemein Schwarzer Körper Ein schwarzer Körper ist ein idealisiertes Objekt, das jede elektromagnetische
Arbeit = Kraft Weg ; W = F s ; 1 Joule = 1 Newton Meter ; 1 J = 1 N m
 GRATIS-Übungsdokument Gymnasium Klasse 8 Physik Thema: Mechanik, Wärmelehre, Elektrizitätslehre CATLUX de Energie Arbeit = Kraft Weg ; W = F s ; 1 Joule = 1 Newton Meter ; 1 J = 1 N m Energie ist gespeicherte
GRATIS-Übungsdokument Gymnasium Klasse 8 Physik Thema: Mechanik, Wärmelehre, Elektrizitätslehre CATLUX de Energie Arbeit = Kraft Weg ; W = F s ; 1 Joule = 1 Newton Meter ; 1 J = 1 N m Energie ist gespeicherte
PHYSIKTEST 3C Dezember 2015 GRUPPE A
 PHYSIKTEST 3C Dezember 2015 GRUPPE A Korrekturvorlage Aufgabe 1. (3 Punkte) Kreuze die richtigen 2 Aussagen an! Die Einheit von Energie ist Kelvin. Die Einheit von Wärmekapazität ist Joule pro Kilogramm
PHYSIKTEST 3C Dezember 2015 GRUPPE A Korrekturvorlage Aufgabe 1. (3 Punkte) Kreuze die richtigen 2 Aussagen an! Die Einheit von Energie ist Kelvin. Die Einheit von Wärmekapazität ist Joule pro Kilogramm
PHYSIKTEST 3C Dezember 2015 GRUPPE A
 PHYSIKTEST 3C Dezember 2015 GRUPPE A SCHÜLERNAME: PUNKTEANZAHL: /20 NOTE: NOTENSCHLÜSSEL 18-20 Sehr Gut (1) 15-17 Gut (2) 13-14 Befriedigend (3) 10-12 Genügend (4) 0-9 Nicht Genügend (5) Aufgabe 1. (3
PHYSIKTEST 3C Dezember 2015 GRUPPE A SCHÜLERNAME: PUNKTEANZAHL: /20 NOTE: NOTENSCHLÜSSEL 18-20 Sehr Gut (1) 15-17 Gut (2) 13-14 Befriedigend (3) 10-12 Genügend (4) 0-9 Nicht Genügend (5) Aufgabe 1. (3
Grundpraktikum der Physik. Versuch Nr. 21 TEMPERATURSTRAHLUNG. Versuchsziel: Verifizierung von Strahlungsgesetzen.
 Grundpraktikum der Physik Versuch Nr. 21 TEMPERATURSTRAHLUNG Versuchsziel: Verifizierung von Strahlungsgesetzen. 1 1. Einführung Neben Konvektion und Wärmeleitung stellt die Wärmestrahlung eine der wichtigsten
Grundpraktikum der Physik Versuch Nr. 21 TEMPERATURSTRAHLUNG Versuchsziel: Verifizierung von Strahlungsgesetzen. 1 1. Einführung Neben Konvektion und Wärmeleitung stellt die Wärmestrahlung eine der wichtigsten
Formel X Leistungskurs Physik 2001/2002
 Versuchsaufbau: Messkolben Schlauch PI Barometer TI 1 U-Rohr-Manometer Wasser 500 ml Luft Pyknometer 2 Bild 1: Versuchsaufbau Wasserbad mit Thermostat Gegeben: - Länge der Schläuche insgesamt: 61,5 cm
Versuchsaufbau: Messkolben Schlauch PI Barometer TI 1 U-Rohr-Manometer Wasser 500 ml Luft Pyknometer 2 Bild 1: Versuchsaufbau Wasserbad mit Thermostat Gegeben: - Länge der Schläuche insgesamt: 61,5 cm
Konfiguration der Messkanäle. Konfiguration der Zeitachse. Abb. 3: Konfigurationsmenü des Sensoreingangs A. Abb. 4: Messparameter Konfigurationsmenü
 Anleitung zum Programm CASSY Lab für den Versuch E12 Starten Sie das Programm CASSY Lab durch Doppelklick auf das Icon auf dem Windows- Desktop. Es erscheint ein Fenster mit Lizensierungsinformationen,
Anleitung zum Programm CASSY Lab für den Versuch E12 Starten Sie das Programm CASSY Lab durch Doppelklick auf das Icon auf dem Windows- Desktop. Es erscheint ein Fenster mit Lizensierungsinformationen,
1. Ziel des Versuchs. 2. Theorie. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 12: Gasthermometer 1. Ziel des Versuchs In diesem Versuch soll die Temperaturmessung durch Druckmessung erlernt werden. ußerdem soll der absolute Nullpunkt des Thermometers bestimmt werden.
Versuch Nr. 12: Gasthermometer 1. Ziel des Versuchs In diesem Versuch soll die Temperaturmessung durch Druckmessung erlernt werden. ußerdem soll der absolute Nullpunkt des Thermometers bestimmt werden.
Physik 4 Praktikum Auswertung PVM
 Physik 4 Praktikum Auswertung PVM Von J.W, I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Solarzelle......... 2 2.2. PV-Modul......... 2 2.3. Schaltzeichen........ 2 2.4. Zu ermittelnde
Physik 4 Praktikum Auswertung PVM Von J.W, I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Solarzelle......... 2 2.2. PV-Modul......... 2 2.3. Schaltzeichen........ 2 2.4. Zu ermittelnde
Erstabgabe Übung nicht abgegeben
 Erstabgabe Übung 9 6 5 4 3 2 1 nicht abgegeben T. Kießling: Auswertung von Messungen und Fehlerrechnung - Graphische Darstellungen, Etrapolation 18.01.2018 Vorlesung 10-1 Übungsaufgaben So soll es sein:
Erstabgabe Übung 9 6 5 4 3 2 1 nicht abgegeben T. Kießling: Auswertung von Messungen und Fehlerrechnung - Graphische Darstellungen, Etrapolation 18.01.2018 Vorlesung 10-1 Übungsaufgaben So soll es sein:
Schmelzdiagramm eines binären Stoffgemisches
 Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Versuch 17: Kennlinie der Vakuum-Diode
 Versuch 17: Kennlinie der Vakuum-Diode Inhaltsverzeichnis 1 Einleitung 3 2 Theorie 3 2.1 Prinzip der Vakuumdiode.......................... 3 2.2 Anlaufstrom.................................. 3 2.3 Raumladungsgebiet..............................
Versuch 17: Kennlinie der Vakuum-Diode Inhaltsverzeichnis 1 Einleitung 3 2 Theorie 3 2.1 Prinzip der Vakuumdiode.......................... 3 2.2 Anlaufstrom.................................. 3 2.3 Raumladungsgebiet..............................
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung.
 Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische
TEMPERATUR UND WÄRMEKAPAZITÄT... 2 KALORIMETRIE I... 3 KALORIMETRIE II... 5 PHASENUMWANDLUNGEN... 6
 E-Mail: Homepage: info@schroeder-doms.de schroeder-doms.de München den 11. Mai 2009 W1 Kalorimetrie (Skript zur Vorbereitung) TEMPERATUR UND WÄRMEKAPAZITÄT... 2 Wärme und Temperatur, Kelvin-Skala:... 2
E-Mail: Homepage: info@schroeder-doms.de schroeder-doms.de München den 11. Mai 2009 W1 Kalorimetrie (Skript zur Vorbereitung) TEMPERATUR UND WÄRMEKAPAZITÄT... 2 Wärme und Temperatur, Kelvin-Skala:... 2
Protokoll zum Versuch: Wärmeausbreitung
 Protokoll zum Versuch: Wärmeausbreitung Fabian Schmid-Michels Nils Brüdigam Universität Bielefeld Wintersemester 006/007 Grundpraktikum I 14.1.006 Inhaltsverzeichnis 1 Ziel Theorie 3 Versuch 3 3.1 Versuchsaufbau............................
Protokoll zum Versuch: Wärmeausbreitung Fabian Schmid-Michels Nils Brüdigam Universität Bielefeld Wintersemester 006/007 Grundpraktikum I 14.1.006 Inhaltsverzeichnis 1 Ziel Theorie 3 Versuch 3 3.1 Versuchsaufbau............................
2 Grundbegriffe der Thermodynamik
 2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
Grundpraktikum der Physik. Versuch Nr. 21 TEMPERATURSTRAHLUNG. Versuchsziel: Verifizierung von Strahlungsgesetzen.
 Grundpraktikum der Physik Versuch Nr. 21 TEMPERATURSTRAHLUNG Versuchsziel: Verifizierung von Strahlungsgesetzen. 1 1. Einführung Neben Konvektion und Wärmeleitung stellt die Wärmestrahlung eine der wichtigsten
Grundpraktikum der Physik Versuch Nr. 21 TEMPERATURSTRAHLUNG Versuchsziel: Verifizierung von Strahlungsgesetzen. 1 1. Einführung Neben Konvektion und Wärmeleitung stellt die Wärmestrahlung eine der wichtigsten
