Schaper & Brümmer GmbH & Co. KG SB-VMP 0212
|
|
|
- Pia Lange
- vor 6 Jahren
- Abrufe
Transkript
1 Seite: 1 von 5 ABSCHLUSSBERICHT analog 67 Abs. 6 AMG für die klinische Erfahrungsbeobachtung zum Einsatz der Vaginalcreme Remifemin FeuchtCreme (RFC) Untersuchtes Medizinprodukt Indikation Verantwortliche Personen des Sponsors Ärztlicher Leiter der Erfahrungsbeobachtung Remifemin FeuchtCreme Scheidentrockenheit Dr. Hans-Heinrich Henneicke-von Zepelin Referent Klinik und Präklinik Bereich Arzneimittelzulassung Schaper & Brümmer GmbH & Co. KG Bahnhofstr Salzgitter Dr. Ralf-Peter Schneeweis Mammutring Salzgitter Datum des Berichts Autoren des Berichts Dr. rer. nat. Jörg Schnitker Dipl.-Math. Annette Holtdirk Institut für angewandte Statistik Dr. Jörg Schnitker GmbH Oberntorwall Bielefeld Eigentum der Schaper & Brümmer GmbH & Co. KG. Dieser Abschlussbericht und alle darin enthaltenen Angaben dürfen ohne schriftliches Einverständnis der Schaper & Brümmer GmbH & Co. KG, Salzgitter, Deutschland nicht an Dritte weiter gegeben werden.
2 Seite: 2 von 5 SYNOPSIS 1 Titel der Studie Klinische Erfahrungsbeobachtung 1 zum Einsatz der Vaginalcreme Remifemin Feucht- Creme. 2 Begründung der Studie Die nicht-interventionelle Studie SB-VMP 0212 ist als klinische Erfahrungsbeobachtung gemäß 3 Nr. 25c MPG durchgeführt worden, unterlag also nicht den Regeln der 20 bis 23b des MPG zu klinischen Prüfungen. Sie erfüllt die Leitlinie der europäischen Kommission MEDDEV 2.12/2 rev2 für Post Market Clinical Follow-up Studies aus Januar 2012 und ist Bestandteil des für Remifemin FeuchtCreme erstellten und mit der für die Erlaubnis zur CE- Zertifizierung verantwortlichen Benannten Stelle abgestimmten Post-Market-Clinical-Followup-Plans (PMCF-Plan für Medizinprodukte mit CE-Kennzeichnung). Ziel eines PMCF-Plans ist es, auf der Basis sachlicher Beweise die klinische Leistung und Sicherheit über die gesamte Lebensdauer des Medizinprodukts sowie die Vertretbarkeit der ermittelten Risiken zu bestätigen und (neu) auftretende Risiken auf einer gesicherten Grundlage zu erkennen. Die Guideline MEDDEV 2.12/2 rev2 nennt verschiedene Gegebenheiten, die die Durchführung einer PMCF-Studie rechtfertigen. Dazu zählen an erster Stelle Innovationen wie Remifemin FeuchtCreme. 3 Ziele der Studie 3.1 Primäre Ziele Primärer Funktionsparameter: Arzturteil zur Besserung der Scheidenfeuchtigkeit auf einer Visuellen Analogskala (VAS) von 0 (= maximale vaginale Trockenheit) bis 10 (= maximale vaginale Feuchtigkeit) Urteil der Patientin zur Besserung der Scheidenfeuchtigkeit, ermittelt anhand der Befragung der Patientin durch den Arzt zum Schweregrad der Scheidentrockenheit auf einer Skala von 1 bis 5. 1 Erfahrungsbeobachtung gemäß 3 Nr. 25c Medizinproduktegesetz (d.h. nicht-interventionelle Studie, die der Leitlinie der europäischen Kommission MEDDEV 2.12/2 rev2 für "Post Market Clinical Follow-Up Studies" aus Januar 2012, aber nicht den Regeln der 20 bis 23b des Medizinproduktegesetzes zu klinischen Prüfungen unterliegt).
3 Seite: 3 von Sekundäre Ziele Urteile der Patientin zur Besserung des vaginalen Juckreizes des vaginalen Brennens des vaginalen Schmerzes, ermittelt anhand der Befragung der Patientin durch den Arzt zum Schweregrad der subjektiven Beschwerden auf einer Skala von 1 bis 5. Gynäkologische Urteile zur Besserung der Symptome Erythem Ödem leichte Verletzung kleinflächige Entzündung Atrophie, ermittelt auf einer Skala von 0 bis Erfassung der Sicherheit Unerwünschte Ereignisse, ggf. Beschreibung Detaildokumentation bei Verdacht auf "Unerwünschte Medizinproduktentwicklung oder Produktmangel". 4 Studienpopulation Patientinnen waren geeignet für die Dokumentation für diese Studie, wenn sie folgende Bedingungen erfüllten: Es liegt eine Indikation zur Anwendung der Vaginalcreme RFC wegen Scheidentrockenheit vor. Die Anwendung der Vaginalcreme RFC erfolgt gemäß Gebrauchsanweisung. Es liegen keine Anwendungsbeschränkungen der Vaginalcreme RFC vor. Die schriftliche Einwilligungserklärung zur Datenerhebung liegt vor. Es war die Einbeziehung von 160 Ärzten mit je 3 Patientinnen geplant. In dem nur kurzen Rekrutierungsintervall konnten 230 auswertbare Fälle von 84 gynäkologischen Facharztpraxen in Deutschland realisiert werden.
4 Seite: 4 von 5 5 Untersuchungsmethoden Visuelle Analogskala zur Beurteilung der Scheidenfeuchtigkeit durch den Arzt 5-stufige Likert-Skalen zur Beurteilung der Scheidenfeuchtigkeit sowie des vaginalen Juckreizes, des vaginalen Brennens und des vaginalen Schmerzes durch die Patientin 5-stufige Likert-Skalen zur gynäkologischen Beurteilung der Symptome Erythem, Ödem, leichte Verletzung, kleinflächige Entzündung und Atrophie Anwendungszufriedenheit (sehr zufrieden / zufrieden / unzufrieden / sehr unzufrieden) bzgl. Bequemlichkeit der Anwendung / Schnelligkeit des Wirkeintritts / Zufriedenheit mit RFC insgesamt Erfassung der Begleitmedikation Erfassung unerwünschter Ereignisse Beobachtungsdauer: etwa 8 Wochen empfohlen. 6 Ergebnisse der Studie 6.1 Ergebnisse zur Effektivität Primäre Ergebnisse zur Effektivität (Funktion) sind die Änderung der gynäkologischen Beurteilung der vaginalen Feuchtigkeit auf einer VAS und der subjektiven Beurteilung der vaginalen Trockenheit. Die Besserungsraten betragen im gynäkologischen Urteil auf der VAS : 83.8% im subjektiven Urteil zur vaginalen Trockenheit : 87.9%. Für die sekundären Ergebnisse zur Effektivität betragen die Besserungsraten in der gynäkologischen Beurteilung der Symptome: Erythem : 77.1% Ödem : 79.0% Leichte Verletzung : 84.6% Kleinflächige Entzündung : 86.7% Atrophie : 85.0%. Die Besserungsraten für die subjektive Beurteilung der Beschwerden liegen zwischen 82% und 89%. Für die Zeit zwischen RFC-Anwendung und Beginn des Feuchtigkeitsgefühls (d.h. Wirkungseintritt) berichteten 51.8% der Anwenderinnen, dass dieser binnen 30 Sekunden und 81.7% binnen zwei Minuten eintrat. Für die durchschnittliche Dauer des Feuchtigkeitsgefühls gaben sie median 12 Stunden an, 31.7% der Anwenderinnen sogar 24 Stunden (17.9%) oder länger (13.8%).
5 Seite: 5 von Ergebnisse zur Sicherheit Unerwünschte Medizinproduktwirkungen sind in 9 Fällen aufgetreten. Sie waren in keinem Falle schwerwiegend, führten aber in 4 Fällen zum Abbruch der Anwendung. Es wurden keine Produktmängel festgestellt. 6.3 Andere Endpunkte Sehr zufrieden bis zufrieden waren mit der Bequemlichkeit der Anwendung : 91.3% mit der Schnelligkeit des Wirkungseintritts : 91.7% mit RFC insgesamt : 84.3% der Patientinnen. Änderungen der bestehenden Begleitmedikation standen in 4 Fällen mit der Studienindikation in Zusammenhang. In 2 Fällen handelte es sich um die Umstellung von einem hormonhaltigen Produkt auf RFC, in 2 weiteren Fällen um die Umstellung von RFC auf ein hormonhaltiges Präparat. 7 Schlussfolgerung Remifemin FeuchtCreme wirkt schnell, effektiv, langanhaltend und nachhaltig. Das Produkt lässt sich einfach anwenden. Zudem zeigen sich kaum klinisch relevante Nebenwirkungen. Die Anwenderzufriedenheit ist dementsprechend hoch. 8 Datum des Studienbeginns Erster Patienteneinschluss : 22. Oktober Datum der Studienbeendigung Letzter Patientenabschluss : 14. Juli 2015
Meine tägliche. Feuchtigkeitspflege. FeuchtCreme. Informationen und Tipps rund um das Thema Scheidentrockenheit
 Meine tägliche Feuchtigkeitspflege FeuchtCreme Informationen und Tipps rund um das Thema Scheidentrockenheit 1. Was sind die Ursachen für Scheidentrockenheit? Ursachen für Scheidentrockenheit sind variabel
Meine tägliche Feuchtigkeitspflege FeuchtCreme Informationen und Tipps rund um das Thema Scheidentrockenheit 1. Was sind die Ursachen für Scheidentrockenheit? Ursachen für Scheidentrockenheit sind variabel
Post Market Surveillance (PMS) - Erwartungen Die Bedeutung des PMCF im Rahmen
 TÜV Süd Akademie Umsetzung der MDR/IVDR in der Praxis Post Market Surveillance (PMS) - Erwartungen Die Bedeutung des PMCF im Rahmen der Marktüberwachung Dr. Andrea Röthler Head of Project Management, Manager
TÜV Süd Akademie Umsetzung der MDR/IVDR in der Praxis Post Market Surveillance (PMS) - Erwartungen Die Bedeutung des PMCF im Rahmen der Marktüberwachung Dr. Andrea Röthler Head of Project Management, Manager
Klinische Evidenz vor und nach der Markteinführung
 Klinische Evidenz vor und nach der Markteinführung Sandra Bugler, M. Sc. sbugler@prosystem-nsf.com PROSYSTEM GmbH Beim Strohhause 17 20097 Hamburg, Germany Tel.: + 49 40 66 87 88-429 www.prosystem-nsf.com
Klinische Evidenz vor und nach der Markteinführung Sandra Bugler, M. Sc. sbugler@prosystem-nsf.com PROSYSTEM GmbH Beim Strohhause 17 20097 Hamburg, Germany Tel.: + 49 40 66 87 88-429 www.prosystem-nsf.com
Inhalt des Leitfadens. Wo wird der neue Leitfaden zu finden sein?
 NEU! LEITFADEN Klinische Prüfung von Medizinprodukten (MP) und Leistungsbewertungsprüfung von In-vitro-Diagnostika (IVD) Einreichung und Durchführung Dr. med. Violetta Zmuda AGES MEA, Institut Überwachung,
NEU! LEITFADEN Klinische Prüfung von Medizinprodukten (MP) und Leistungsbewertungsprüfung von In-vitro-Diagnostika (IVD) Einreichung und Durchführung Dr. med. Violetta Zmuda AGES MEA, Institut Überwachung,
Nr. Anforderung n.a. Status Bemerkung
 Version vom 26.09.2016 Seite 1 von 5 1 Stage 0: Definition des Umfangs der klinischen Bewertung - Ziel der klinischen Bewerbung definieren - allgemeine Beschreibung des Produkts inkl. Hersteller, Zweckbestimmung
Version vom 26.09.2016 Seite 1 von 5 1 Stage 0: Definition des Umfangs der klinischen Bewertung - Ziel der klinischen Bewerbung definieren - allgemeine Beschreibung des Produkts inkl. Hersteller, Zweckbestimmung
Rechtliche Aspekte der klinischen Prüfung mit Medizinprodukten (Verordnung (EU) 2017/745)
 19. Sommertagung des Arbeitskreises medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland e.v. Berlin 14.06.2018 Rechtliche Aspekte der klinischen Prüfung mit Medizinprodukten (Verordnung
19. Sommertagung des Arbeitskreises medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland e.v. Berlin 14.06.2018 Rechtliche Aspekte der klinischen Prüfung mit Medizinprodukten (Verordnung
Programm Grundlagenkurs für Prüfer/Stellvertreter nach MPG und/oder AMG
 Programm Grundlagenkurs für Prüfer/Stellvertreter nach MPG und/oder AMG Termin: Freitag, 27.04.2018 & Samstag 28.4.2018 Ort: Osteosyntheseinstitut Ahrensburg Seminarraum 1. Stock Roggenweg 8, 22926 Ahrensburg
Programm Grundlagenkurs für Prüfer/Stellvertreter nach MPG und/oder AMG Termin: Freitag, 27.04.2018 & Samstag 28.4.2018 Ort: Osteosyntheseinstitut Ahrensburg Seminarraum 1. Stock Roggenweg 8, 22926 Ahrensburg
Erfahrungen mit GCP Inspektionen von MPG Studien
 Erfahrungen mit GCP Inspektionen von MPG Studien Yvonne Borck, Universitätsklinik Bonn Arbeitsgemeinschaft für angewandte Humanpharmakologie (AGAH) e.v Hintergrund Nach 26 MPG unterliegen Betriebe und
Erfahrungen mit GCP Inspektionen von MPG Studien Yvonne Borck, Universitätsklinik Bonn Arbeitsgemeinschaft für angewandte Humanpharmakologie (AGAH) e.v Hintergrund Nach 26 MPG unterliegen Betriebe und
Cikatridina. Stoppt die vaginale Dürre. Zur vaginalen Anwendung bei Scheidentrockenheit. Hormonfrei! Rezeptfrei in Ihrer Apotheke erhältlich.
 Hormonfrei! Zur vaginalen Anwendung bei Scheidentrockenheit. Rezeptfrei in Ihrer Apotheke erhältlich. Viele Frauen, auch junge, leiden an vaginaler Trockenheit. In der Scheide wird nicht genügend Feuchtigkeit
Hormonfrei! Zur vaginalen Anwendung bei Scheidentrockenheit. Rezeptfrei in Ihrer Apotheke erhältlich. Viele Frauen, auch junge, leiden an vaginaler Trockenheit. In der Scheide wird nicht genügend Feuchtigkeit
Anforderungen an klinische Bewertung (MEDDEV Rev4)
 Nr. Anforderung Bereits gefordert durch Stage 0: Definition des Umfangs der klinischen Bewertung 1 - Allgemeine Beschreibung des Produkts - spezifische Anforderungen durch Produkt od. Zielpopulation -
Nr. Anforderung Bereits gefordert durch Stage 0: Definition des Umfangs der klinischen Bewertung 1 - Allgemeine Beschreibung des Produkts - spezifische Anforderungen durch Produkt od. Zielpopulation -
Studiencode. AGO-PRO 2 / Mapisal. Sponsor. AGO Research GmbH AGO Studiengruppe Kaiser-Friedrich-Ring Wiesbaden Deutschland.
 Studientitel Behandlung des Palmo-Plantaren-Erythems (PPE) in der gynäkologischen Onkologie mit Mapisal - eine interventionelle, prospektive, randomisierte, doppelblinde, placebo-kontrollierte Studie in
Studientitel Behandlung des Palmo-Plantaren-Erythems (PPE) in der gynäkologischen Onkologie mit Mapisal - eine interventionelle, prospektive, randomisierte, doppelblinde, placebo-kontrollierte Studie in
Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie
 Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie Abschlussarbeit zur Erlangung des Titels: Bachelor of Science vorgelegt
Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie Abschlussarbeit zur Erlangung des Titels: Bachelor of Science vorgelegt
Empfehlung für den Umgang mit multizentrischen Studien außerhalb von AMG oder MPG durch Ethik-Kommissionen I. Vorbemerkungen
 Empfehlung für den Umgang mit multizentrischen Studien außerhalb von AMG oder MPG durch Ethik-Kommissionen gemäß Beschluss des Arbeitskreises Medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland
Empfehlung für den Umgang mit multizentrischen Studien außerhalb von AMG oder MPG durch Ethik-Kommissionen gemäß Beschluss des Arbeitskreises Medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland
Von der Idee zum richtigen Studiendesign
 BMBF- und DFG-Förderung für klinische Studien: Rahmenbedingungen und Erfolgsfaktoren Von der Idee zum richtigen Studiendesign Unterstützung durch das Institut für Biometrie und Klinische Forschung Dr.
BMBF- und DFG-Förderung für klinische Studien: Rahmenbedingungen und Erfolgsfaktoren Von der Idee zum richtigen Studiendesign Unterstützung durch das Institut für Biometrie und Klinische Forschung Dr.
Unverzichtbar für ein effizientes Beobachtungs- und Meldesystem sind:
 Medizintechnologie.de Vigilanzsystem Probleme mit Medizinprodukten treten häufig erst auf, nachdem die Produkte bereits langfristig im Einsatz sind oder von einer größeren Population von Anwendern oder
Medizintechnologie.de Vigilanzsystem Probleme mit Medizinprodukten treten häufig erst auf, nachdem die Produkte bereits langfristig im Einsatz sind oder von einer größeren Population von Anwendern oder
MPG-Verordnungen (relevant für klinische Prüfungen mit Medizinprodukten)
 Medizintechnologie.de Klinische Prüfung Klinische Prüfungen mit Medizinprodukten gemäß den 20 bis 23a des Gesetzes über Medizinprodukte (MPG) sind klinische Studien, die die Leistungsfähigkeit und Sicherheit
Medizintechnologie.de Klinische Prüfung Klinische Prüfungen mit Medizinprodukten gemäß den 20 bis 23a des Gesetzes über Medizinprodukte (MPG) sind klinische Studien, die die Leistungsfähigkeit und Sicherheit
Clinical trial. to investigate clinical efficacy and tolerability of tretinoin in actinic keratosis. EudraCT: Study no: H
 Clinical trial to investigate clinical efficacy and tolerability of tretinoin in actinic keratosis EudraCT: 2007 000093-23 Study no: H 565 000-0620 Report (LKP) (Statistics) (sub-investigator) Datum des
Clinical trial to investigate clinical efficacy and tolerability of tretinoin in actinic keratosis EudraCT: 2007 000093-23 Study no: H 565 000-0620 Report (LKP) (Statistics) (sub-investigator) Datum des
Formantrag Version 2-00 vom
 Antrag zur formalen inhaltlichen Beschreibung (FIB) von klinischen Studien und anderen Forschungsvorhaben am Menschen, die keine klinische Arzneimittelprüfungen sind Arbeitskreis Medizinischer Ethik-Kommissionen
Antrag zur formalen inhaltlichen Beschreibung (FIB) von klinischen Studien und anderen Forschungsvorhaben am Menschen, die keine klinische Arzneimittelprüfungen sind Arbeitskreis Medizinischer Ethik-Kommissionen
MDR - WIE SPÜRBAR FÜR EIN GROSSUNTERNEHMEN?
 MDR - WIE SPÜRBAR FÜR EIN GROSSUNTERNEHMEN? Dr. Roland Prestel Berlin, 22. Juni 2018 FACTS AND FIGURES 2 MDR Patientensicherheit MDR, Erwägung (2) Ausgehend von einem hohen Gesundheitsschutzniveau für
MDR - WIE SPÜRBAR FÜR EIN GROSSUNTERNEHMEN? Dr. Roland Prestel Berlin, 22. Juni 2018 FACTS AND FIGURES 2 MDR Patientensicherheit MDR, Erwägung (2) Ausgehend von einem hohen Gesundheitsschutzniveau für
CE-Kennzeichnung von Medizinprodukten Handlungsempfehlungen für den Zulassungsprozess
 CE-Kennzeichnung von Medizinprodukten Handlungsempfehlungen für den Zulassungsprozess IHK Dialog Gesundheitswirtschaft: Medizintechnik in der Region Köln-Bonn 14. Februar 2017 2017 by qcmed GmbH, Dr. Carola
CE-Kennzeichnung von Medizinprodukten Handlungsempfehlungen für den Zulassungsprozess IHK Dialog Gesundheitswirtschaft: Medizintechnik in der Region Köln-Bonn 14. Februar 2017 2017 by qcmed GmbH, Dr. Carola
Antrag auf biometrische und datentechnische Unterstützung von medizinischen Forschungsprojekten
 Antrag auf biometrische und datentechnische Unterstützung von medizinischen Forschungsprojekten Angaben zur Person Anrede Frau Titel Professor Herr Doktor Name Vorname Email Telefon Klinik-/Institutsbezeichnung
Antrag auf biometrische und datentechnische Unterstützung von medizinischen Forschungsprojekten Angaben zur Person Anrede Frau Titel Professor Herr Doktor Name Vorname Email Telefon Klinik-/Institutsbezeichnung
Titel der Studie. Indikation Patientinnen mit primären, hormonrezeptor-positiven Mammakarzinom. Wirkstoff Letrozol. Marke/Handelsname FEMARA
 Titel der Studie Femara Anwendungsbeobachtung Eva Anwendungsbeobachtung zur Verträglichkeit, Wirksamkeit und Compliance in der adjuvanten Femara (Letrozol)- Therapie des primären, hormonrezeptor-positiven
Titel der Studie Femara Anwendungsbeobachtung Eva Anwendungsbeobachtung zur Verträglichkeit, Wirksamkeit und Compliance in der adjuvanten Femara (Letrozol)- Therapie des primären, hormonrezeptor-positiven
Aufgaben der MP-Berater und Sicherheitsbeauftragten im Medizinprodukte-Beobachtungs- und Meldesystem
 Aufgaben der MP-Berater und Sicherheitsbeauftragten im Medizinprodukte-Beobachtungs- und Meldesystem Referent: Ralf Kitschmann Seite 1/ 09-2009 30 MPG*, Sicherheitsbeauftragter für Medizinprodukte * Achtung:
Aufgaben der MP-Berater und Sicherheitsbeauftragten im Medizinprodukte-Beobachtungs- und Meldesystem Referent: Ralf Kitschmann Seite 1/ 09-2009 30 MPG*, Sicherheitsbeauftragter für Medizinprodukte * Achtung:
Qualitätsmanagement Verlag. Seiler. Dokumentationen. Vorlagen Technische Dokumentation. Gemäß VERORDNUNG (EU) 2017/745. Auflage 1
 Qualitätsmanagement Verlag Seiler Dokumentationen Vorlagen Technische Dokumentation Gemäß VERORDNUNG (EU) 2017/745 Auflage 1 Liste der Dokumente Produktakte Dokument Revision vom Ersteller/-in Verteiler
Qualitätsmanagement Verlag Seiler Dokumentationen Vorlagen Technische Dokumentation Gemäß VERORDNUNG (EU) 2017/745 Auflage 1 Liste der Dokumente Produktakte Dokument Revision vom Ersteller/-in Verteiler
Anlage V zum 2. Kapitel VerfO
 Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
Formular zur Übermittlung von Informationen über den Stand der wissenschaftlichen Erkenntnisse für die Bewertung einer neuen Untersuchungs- oder Behandlungsmethode mit Medizinprodukten hoher Risikoklasse
MP-/IVD-VO Klinische Bewertung Leistungsbewertung Anhänge XIV/XIII
 MP-/IVD-VO Klinische Bewertung Leistungsbewertung Anhänge XIV/XIII Spiegelgruppe BMGF Dr. Wolfgang Ecker Wien, 28 Juni 2017 Entwicklung der Klinischen Bewertung in EU-Recht und -Guidance FDA/CDRH: Benefit/Risk
MP-/IVD-VO Klinische Bewertung Leistungsbewertung Anhänge XIV/XIII Spiegelgruppe BMGF Dr. Wolfgang Ecker Wien, 28 Juni 2017 Entwicklung der Klinischen Bewertung in EU-Recht und -Guidance FDA/CDRH: Benefit/Risk
ARBEITSBOGEN 4: PRÜFUNG DER FERTIGARZNEIMITTEL UND APOTHEKENPFLICHTIGEN MEDIZIN- PRODUKTE
 I Hinweis zur Bearbeitung des Arbeitsbogens Überprüfen Sie ein Fertigarzneimittel (FAM) oder ein apothekenpflichtiges Medizinprodukt (MP) gemäß 12 Apothekenbetriebsordnung (ApBetrO). Grundlage des Arbeitsbogens
I Hinweis zur Bearbeitung des Arbeitsbogens Überprüfen Sie ein Fertigarzneimittel (FAM) oder ein apothekenpflichtiges Medizinprodukt (MP) gemäß 12 Apothekenbetriebsordnung (ApBetrO). Grundlage des Arbeitsbogens
Tschüss Cellulite! 93 % zufriedene Patientinnen noch drei Jahre danach 1 3
 Tschüss Cellulite! 93 % zufriedene Patientinnen noch drei Jahre danach 1 3 Warum Cellfina? Eigentlich sind Sie zufrieden mit Ihrem Aussehen. Nur auf die lästigen Dellen an Po und Oberschenkeln könnten
Tschüss Cellulite! 93 % zufriedene Patientinnen noch drei Jahre danach 1 3 Warum Cellfina? Eigentlich sind Sie zufrieden mit Ihrem Aussehen. Nur auf die lästigen Dellen an Po und Oberschenkeln könnten
Bedeutung der Norm EN ISO GCP für Medizinprodukte in der Praxis -
 Bedeutung der Norm EN ISO 14155 - GCP für Medizinprodukte in der Praxis - Dr. Violetta Zmuda AGES MEA, Institut Überwachung, Abteilung Klinische Prüfung violetta.zmuda@ages.at AGES-Gespräch Wien, 12. Oktober
Bedeutung der Norm EN ISO 14155 - GCP für Medizinprodukte in der Praxis - Dr. Violetta Zmuda AGES MEA, Institut Überwachung, Abteilung Klinische Prüfung violetta.zmuda@ages.at AGES-Gespräch Wien, 12. Oktober
Produktvorstellung. Seiler. Lieferung. Leseprobe. Besonderes. Qualitätsmanagement Verlag. Regelwerk Technische Dokumentation nach MDR 2017/745
 Produktvorstellung Qualitätsmanagement Verlag Regelwerk Technische Dokumentation nach MDR 2017/745 Seiler Dokumentationen Zielgruppe: Dieses Regelwerk ist für Inverkehrbringer von Medizinprodukten. Es
Produktvorstellung Qualitätsmanagement Verlag Regelwerk Technische Dokumentation nach MDR 2017/745 Seiler Dokumentationen Zielgruppe: Dieses Regelwerk ist für Inverkehrbringer von Medizinprodukten. Es
Modul 2 Arbeitskreis Medizinischer Ethik-Kommissionen in Deutschland
 Modul 2 Arbeitskreis Medizinischer Ethik-Kommissionen in Deutschland Entwickelt auf der Basis der Detailed guidance on the application format and documentation to be submitted in an application for an
Modul 2 Arbeitskreis Medizinischer Ethik-Kommissionen in Deutschland Entwickelt auf der Basis der Detailed guidance on the application format and documentation to be submitted in an application for an
Konsultationsgruppe Klinische Prüfungen von Medizinprodukten - Treffen am
 Konsultationsgruppe Klinische Prüfungen von Medizinprodukten - Treffen am 06.06.2018 Dr. Wolfgang Lauer, Dr. Ulf Schriever, Dr. Martina Mahne BfArM Konsultationsgruppe Klinische Prüfungen 06.06.2018 Seite
Konsultationsgruppe Klinische Prüfungen von Medizinprodukten - Treffen am 06.06.2018 Dr. Wolfgang Lauer, Dr. Ulf Schriever, Dr. Martina Mahne BfArM Konsultationsgruppe Klinische Prüfungen 06.06.2018 Seite
Vaginale Trockenheit. Keine Frage des Alters
 Vaginale Trockenheit Keine Frage des Alters Liebe Patientin, leiden Sie auch wie viele andere Frauen an Scheidentrockenheit? Auf den folgenden Seiten finden Sie Informationen zu Symptomen, den Ursachen
Vaginale Trockenheit Keine Frage des Alters Liebe Patientin, leiden Sie auch wie viele andere Frauen an Scheidentrockenheit? Auf den folgenden Seiten finden Sie Informationen zu Symptomen, den Ursachen
Formblatt 1: Informierte Zustimmung zur psychotherapeutischen Behandlung. Wir möchten Sie Frau/Herr noch einmal herzlich bei uns willkommen heißen.
 Formblatt 1: Informierte Zustimmung zur psychotherapeutischen Behandlung Sehr geehrte Patientin, sehr geehrter Patient, Wir möchten Sie Frau/Herr noch einmal herzlich bei uns willkommen heißen. Um mit
Formblatt 1: Informierte Zustimmung zur psychotherapeutischen Behandlung Sehr geehrte Patientin, sehr geehrter Patient, Wir möchten Sie Frau/Herr noch einmal herzlich bei uns willkommen heißen. Um mit
Vorlesung Medizinrecht
 Vorlesung Medizinrecht Angewandte Gesundheitswissenschaften Teil 4: Arzneimittel- und Medizinprodukterecht Rechtsanwalt Wolfgang Wiefelspütz Fachanwalt für Medizinrecht Inhaltsangabe A. Einführung B. AMG
Vorlesung Medizinrecht Angewandte Gesundheitswissenschaften Teil 4: Arzneimittel- und Medizinprodukterecht Rechtsanwalt Wolfgang Wiefelspütz Fachanwalt für Medizinrecht Inhaltsangabe A. Einführung B. AMG
Merkblatt zur natürlichen Hormonersatz-Therapie. Liebe Patientin,
 Merkblatt zur natürlichen Hormonersatz-Therapie Liebe Patientin, Herzlichen Dank für Ihr Interesse an einer Hormonersatz-Therapie mit naturidentischen Hormonen. Auf den folgenden Seiten finden Sie wichtige
Merkblatt zur natürlichen Hormonersatz-Therapie Liebe Patientin, Herzlichen Dank für Ihr Interesse an einer Hormonersatz-Therapie mit naturidentischen Hormonen. Auf den folgenden Seiten finden Sie wichtige
Patienteninformation:
 Patienteninformation: Synthetisches Netz versus kein Netz bei Nabelbrüchen: eine prospektive, doppelblinde, randomisierte, kontrollierte Studie Synthetic mesh versus no mesh for umbilical hernias: a prospective
Patienteninformation: Synthetisches Netz versus kein Netz bei Nabelbrüchen: eine prospektive, doppelblinde, randomisierte, kontrollierte Studie Synthetic mesh versus no mesh for umbilical hernias: a prospective
Study fact sheet für ID: Knapp, 2004
 Study fact sheet für ID: Knapp, 2004 (Name, Jahr (ggf. a,b,c)) 1. Vollständige Referenz Knapp P, Raynor DK, Berry DC. Comparison of two methods of presenting risk information to patients about the side
Study fact sheet für ID: Knapp, 2004 (Name, Jahr (ggf. a,b,c)) 1. Vollständige Referenz Knapp P, Raynor DK, Berry DC. Comparison of two methods of presenting risk information to patients about the side
LisaVienna Business Treff
 www.i-med.ac.at/kks LisaVienna Business Treff Klinische Prüfung und Leistungsbewertungsprüfung Sabine Embacher-Aichhorn Koordinierungszentrum für klinische Studien, Anichstraße 29-31, 6020 Innsbruck, Austria,
www.i-med.ac.at/kks LisaVienna Business Treff Klinische Prüfung und Leistungsbewertungsprüfung Sabine Embacher-Aichhorn Koordinierungszentrum für klinische Studien, Anichstraße 29-31, 6020 Innsbruck, Austria,
VERORDNUNG? Umsetzung der MDR/IVDR in der Praxis. TÜV Süd, München. Silja du Mont
 VIGILANZ, MELDUNGEN WAS ÄNDERT SICH DURCH DIE EU VERORDNUNG? 07.07.2016 Umsetzung der MDR/IVDR in der Praxis TÜV Süd, München Silja du Mont INHALT Gesetzliche Grundlagen für klinischen Prüfungen mit Medizinprodukten
VIGILANZ, MELDUNGEN WAS ÄNDERT SICH DURCH DIE EU VERORDNUNG? 07.07.2016 Umsetzung der MDR/IVDR in der Praxis TÜV Süd, München Silja du Mont INHALT Gesetzliche Grundlagen für klinischen Prüfungen mit Medizinprodukten
GVP Module VIII Post-authorisation safety studies
 GVP Module VIII Post-authorisation safety studies Dr. Susanne Wolf Institut für Pharmakovigilanz AGES - Gespräche Wien, 26.04.2012 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Guideline
GVP Module VIII Post-authorisation safety studies Dr. Susanne Wolf Institut für Pharmakovigilanz AGES - Gespräche Wien, 26.04.2012 Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Guideline
WAS IST ANDERS BEI STUDIEN MIT MEDIZINPRODUKTEN?
 WAS IST ANDERS BEI STUDIEN MIT MEDIZINPRODUKTEN? DR.-ING. DAVID KELLER COUNTRY CLINICAL RESEARCH SPECIALIST MEDTRONIC COUNTRY CLINICAL GERMANY DACH-SYMPOSIUM FÜR KLINISCHE PRÜFUNGEN VIELFALT DER MEDIZINPRODUKTE
WAS IST ANDERS BEI STUDIEN MIT MEDIZINPRODUKTEN? DR.-ING. DAVID KELLER COUNTRY CLINICAL RESEARCH SPECIALIST MEDTRONIC COUNTRY CLINICAL GERMANY DACH-SYMPOSIUM FÜR KLINISCHE PRÜFUNGEN VIELFALT DER MEDIZINPRODUKTE
GEBRAUCHSINFORMATION
 GEBRAUCHSINFORMATION Gebrauchsanweisung Sulgan - Hämorrhoidalsalbe Liebe Patientin, lieber Patient! Bitte lesen Sie die gesamte Gebrauchsanweisung sorgfältig durch. Wenden Sie sich an Ihren Arzt oder Apotheker,
GEBRAUCHSINFORMATION Gebrauchsanweisung Sulgan - Hämorrhoidalsalbe Liebe Patientin, lieber Patient! Bitte lesen Sie die gesamte Gebrauchsanweisung sorgfältig durch. Wenden Sie sich an Ihren Arzt oder Apotheker,
Mustertext. (Studienteilnehmer und schwangere Partnerin des Studienteilnehmers)
 Mustertext Klinische Prüfung von Arzneimitteln: Information und Einwilligungserklärung zur Nachverfolgung einer Schwangerschaft der Partnerin eines Studienteilnehmers und zur Gesundheit des Kindes (Studienteilnehmer
Mustertext Klinische Prüfung von Arzneimitteln: Information und Einwilligungserklärung zur Nachverfolgung einer Schwangerschaft der Partnerin eines Studienteilnehmers und zur Gesundheit des Kindes (Studienteilnehmer
Inhalt: Themenkomplex III:
 26.1.2018 Inhalt: Themenkomplex I: Themenkomplex II: Themenkomplex III: Definitionen FSCA Trendmeldungen I Themenkomplex: Definitionen 1 Frage: Wie ist eine schwerwiegende Verschlechterung des Gesundheitszustandes
26.1.2018 Inhalt: Themenkomplex I: Themenkomplex II: Themenkomplex III: Definitionen FSCA Trendmeldungen I Themenkomplex: Definitionen 1 Frage: Wie ist eine schwerwiegende Verschlechterung des Gesundheitszustandes
Betrifft: DRINGENDER SICHERHEITSHINWEIS FÜR MEDIZINPRODUKTE (RÜCKRUF) CHARGENSPEZIFISCH
 31. Mai 2017 An: Chirurgen Betrifft: DRINGENDER SICHERHEITSHINWEIS FÜR MEDIZINPRODUKTE (RÜCKRUF) CHARGENSPEZIFISCH Betroffenes Produkt: Trauma-Implantate, siehe Anlage 2 Zimmer Biomet leitet einen Rückruf
31. Mai 2017 An: Chirurgen Betrifft: DRINGENDER SICHERHEITSHINWEIS FÜR MEDIZINPRODUKTE (RÜCKRUF) CHARGENSPEZIFISCH Betroffenes Produkt: Trauma-Implantate, siehe Anlage 2 Zimmer Biomet leitet einen Rückruf
S c h m e r z t a g e b u c h
 Schmerztagebuch Vorwort Liebe Patientin, lieber Patient, Sie haben dieses Schmerztagebuch erhalten um die Stärke wie den Zeitpunkt Ihrer Schmerzen besser einschätzen und damit effektiver behandeln zu können.
Schmerztagebuch Vorwort Liebe Patientin, lieber Patient, Sie haben dieses Schmerztagebuch erhalten um die Stärke wie den Zeitpunkt Ihrer Schmerzen besser einschätzen und damit effektiver behandeln zu können.
Informationspflichten nach Art. 13 und Art. 14 EU-DSGVO Ethik-Kommission bei der Landesärztekammer Hessen
 Informationspflichten nach Art. 13 und Art. 14 EU-DSGVO Ethik-Kommission bei der Landesärztekammer Hessen Mit dieser Übersicht möchte die Ethik-Kommission bei der Landesärztekammer Hessen Sie über die
Informationspflichten nach Art. 13 und Art. 14 EU-DSGVO Ethik-Kommission bei der Landesärztekammer Hessen Mit dieser Übersicht möchte die Ethik-Kommission bei der Landesärztekammer Hessen Sie über die
Revision RL 93/42/EWG Aufgaben der Benannten Stelle
 RICHTLINIE 2007/47/EG DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 5. September 2007 zur Änderung der Richtlinien 90/385/EWG des Rates zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über aktive
RICHTLINIE 2007/47/EG DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 5. September 2007 zur Änderung der Richtlinien 90/385/EWG des Rates zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über aktive
Mit. Schmerzprotokoll. für 4 Wochen! Schmerztagebuch.
 Mit Schmerzprotokoll für 4 Wochen! Schmerztagebuch www.schmerz.de 2 Inhalt Vorwort... 4 Patientendaten... 6 So füllen Sie das Schmerzprotokoll aus!... 8 Ihr Schmerzprotokoll... 10 Hinweis... 18 Haben Sie
Mit Schmerzprotokoll für 4 Wochen! Schmerztagebuch www.schmerz.de 2 Inhalt Vorwort... 4 Patientendaten... 6 So füllen Sie das Schmerzprotokoll aus!... 8 Ihr Schmerzprotokoll... 10 Hinweis... 18 Haben Sie
1 Einführung 15 J. Sehouli 1.2 Das Aufklärungsgespräch 18
 Inhaltsverzeichnis 1 Einführung 15 J. Sehouli 1.2 Das Aufklärungsgespräch 18 2 Die klinische Studie 21 2.1 Definitionen 22 2.1.1 Klinische Prüfung 22 2.1.2 Nicht interventionelle Prüfung 27 2.1.3 Anwendungsbeobachtung
Inhaltsverzeichnis 1 Einführung 15 J. Sehouli 1.2 Das Aufklärungsgespräch 18 2 Die klinische Studie 21 2.1 Definitionen 22 2.1.1 Klinische Prüfung 22 2.1.2 Nicht interventionelle Prüfung 27 2.1.3 Anwendungsbeobachtung
MDR (Medical Device Regulation): wichtigste Handlungsfelder und praktische Umsetzungsmöglichkeiten
 MDR (Medical Device Regulation): wichtigste Handlungsfelder und praktische Umsetzungsmöglichkeiten Dr. Karin Schulze Head of Regulatory Affairs & Medical Devices SFL Regulatory Affairs & Scientific Communication
MDR (Medical Device Regulation): wichtigste Handlungsfelder und praktische Umsetzungsmöglichkeiten Dr. Karin Schulze Head of Regulatory Affairs & Medical Devices SFL Regulatory Affairs & Scientific Communication
Aufgaben der Ethikkommission
 Aufgaben der Ethikkommission 4. Augsburger Forum für Medizinprodukterecht freiburger ethik kommission international (gegr. 1980) www.feki.com und www.vipcheck.org Hans Peter Graf 25.09.2008 Ursprüngliche
Aufgaben der Ethikkommission 4. Augsburger Forum für Medizinprodukterecht freiburger ethik kommission international (gegr. 1980) www.feki.com und www.vipcheck.org Hans Peter Graf 25.09.2008 Ursprüngliche
Competence Mall Initiative (CMI) Competence for Compliance
 CMI Workshop ": Vademecum für den Marktzugang" - 29. November 2011 Competence Mall Initiative (CMI) Competence for Compliance BMG, Wien, Dr. Wolfgang Ecker 29. 11. 2011 Österreich: 5 große Life Science
CMI Workshop ": Vademecum für den Marktzugang" - 29. November 2011 Competence Mall Initiative (CMI) Competence for Compliance BMG, Wien, Dr. Wolfgang Ecker 29. 11. 2011 Österreich: 5 große Life Science
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation. Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group
 Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Scheidentrockenheit. Anna Raggi Nüssli
 Scheidentrockenheit Anna Raggi Nüssli Hôpital Cochin, Unité de Médécine de la Reproduction, Paris Universitätsspital Basel, Klinik für gynäkologische Endokrinologie und Reproduktionsmedizin Make love is
Scheidentrockenheit Anna Raggi Nüssli Hôpital Cochin, Unité de Médécine de la Reproduction, Paris Universitätsspital Basel, Klinik für gynäkologische Endokrinologie und Reproduktionsmedizin Make love is
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome
 Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
Lang wirksame Beta-Mimetika Long Acting Beta Agonists (LABAs) erhöhtes Risiko einer Exazerbation der Asthmasymptome Basisinformation FACHINFORMATION Lang wirksame Beta-Mimetika - Long Acting Beta Agonists
Consilium Digitales Management von Tumor-Patienten
 Apps für Patienten Consilium Digitales Management von Tumor-Patienten Andreas Trojan, Swiss Tumor Institute, Klinik im Park, Zürich Mathis Brauchbar, advocacy AG Marco Egbring, Klinik für Klinische Pharmakologie
Apps für Patienten Consilium Digitales Management von Tumor-Patienten Andreas Trojan, Swiss Tumor Institute, Klinik im Park, Zürich Mathis Brauchbar, advocacy AG Marco Egbring, Klinik für Klinische Pharmakologie
Frühe Nutzenbewertung aus Sicht des IQWiG. Jürgen Windeler
 Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Frühe Nutzenbewertung aus Sicht des IQWiG Jürgen Windeler AMNOG, aus der Begründung Die Datenlage für neue Wirkstoffe (insbesondere in der Onkologie) wird von Experten als unbefriedigend bezeichnet. Die
Abschlußbericht Anwendungsbeobachtung Biatain Silikon Ag. Dr. rer.nat. Horst Braunwarth, Hamburg 21.Mai 2012
 1 Abschlußbericht Anwendungsbeobachtung Biatain Silikon Ag Dr. rer.nat. Horst Braunwarth, Hamburg 21.Mai 12 2 Gliederung Allgemeines 3 Ziel der Anwendungsbeobachtung 3 Durchführung der Anwendungsbeobachtung
1 Abschlußbericht Anwendungsbeobachtung Biatain Silikon Ag Dr. rer.nat. Horst Braunwarth, Hamburg 21.Mai 12 2 Gliederung Allgemeines 3 Ziel der Anwendungsbeobachtung 3 Durchführung der Anwendungsbeobachtung
Gleitmittel G E R M A N Y. Unterstützt bei der natürlichen Empfängnis
 Gleitmittel MADE IN G E R M A N Y Unterstützt bei der natürlichen Empfängnis Unerfüllter Kinderwunsch Stellt sich nach Absetzen von mechanischen oder hormonellen Verhütungsmitteln innerhalb von ein paar
Gleitmittel MADE IN G E R M A N Y Unterstützt bei der natürlichen Empfängnis Unerfüllter Kinderwunsch Stellt sich nach Absetzen von mechanischen oder hormonellen Verhütungsmitteln innerhalb von ein paar
fortgeschrittenem Lungenemphysem
 PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
PneumRx Coils: Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Pa PneumRx Coils Neue randomisierte klinische Studien bestätigen wiederholt positive Ergebnisse bei Patienten
Klinische Prüfung für Medizinprodukte und Leistungsbewertungsprüfungen für In-Vitro-Diagnostika in Österreich: Statistik 2018
 Klinische Prüfung für Medizinprodukte und Leistungsbewertungsprüfungen für In-Vitro-Diagnostika in Österreich: Statistik 2018 Abteilung Klinische Prüfung (CLTR) Die Tradition des jährlichen Newsletters
Klinische Prüfung für Medizinprodukte und Leistungsbewertungsprüfungen für In-Vitro-Diagnostika in Österreich: Statistik 2018 Abteilung Klinische Prüfung (CLTR) Die Tradition des jährlichen Newsletters
Erfahrungen von Patientinnen meiner Praxis mit der GyneFix
 Praxisadresse: Gutenbergstr. 3 35037 Marburg Erfahrungen von Patientinnen meiner Praxis mit der GyneFix Liebe Patientin, die GyneFix als Verhütungsform ist vielen Patientinnen nicht bekannt und meistens
Praxisadresse: Gutenbergstr. 3 35037 Marburg Erfahrungen von Patientinnen meiner Praxis mit der GyneFix Liebe Patientin, die GyneFix als Verhütungsform ist vielen Patientinnen nicht bekannt und meistens
Validierung vs. Klinische Bewertung: Herausforderungen bei der praktischen Umsetzung. Validierung vs. Klinische Bewertung 1
 Validierung vs. Klinische Bewertung: Herausforderungen bei der praktischen Umsetzung Lukas Vogler, M.Sc. PROSYSTEM Software GmbH Dipl.-Ing. Sarah Panten PROSYSTEM Clinical Services GmbH Validierung vs.
Validierung vs. Klinische Bewertung: Herausforderungen bei der praktischen Umsetzung Lukas Vogler, M.Sc. PROSYSTEM Software GmbH Dipl.-Ing. Sarah Panten PROSYSTEM Clinical Services GmbH Validierung vs.
Klinische Prüfung von Medizinprodukten in Deutschland
 Klinische Prüfung von Medizinprodukten in Deutschland Notwendigkeit und Anforderungen 9. DVMD-Fachtagung, 31.03.2006, Erlangen Anne Eichberger 3M 2006 1 Anne Eichberger 30.03.2006 Was ist ein Medizinprodukt?
Klinische Prüfung von Medizinprodukten in Deutschland Notwendigkeit und Anforderungen 9. DVMD-Fachtagung, 31.03.2006, Erlangen Anne Eichberger 3M 2006 1 Anne Eichberger 30.03.2006 Was ist ein Medizinprodukt?
PROGRAMM. 1. Schulungstag: Mittwoch, von 09:00-16:30 Uhr 2. Schulungstag: Mittwoch, von 09:00-16:30 Uhr
 PROGRAMM GCP-Schulung für Prüfer/Stellvertreter/Mitglieder der Prüfgruppe für klinische Prüfungen nach AMG mit Wissensprüfung* ) + Teilnahmezertifikat 1. Schulungstag: Mittwoch, 30.09.2015 von 09:00-16:30
PROGRAMM GCP-Schulung für Prüfer/Stellvertreter/Mitglieder der Prüfgruppe für klinische Prüfungen nach AMG mit Wissensprüfung* ) + Teilnahmezertifikat 1. Schulungstag: Mittwoch, 30.09.2015 von 09:00-16:30
96 % zufriedene Patientinnen noch zwei Jahre danach 1. Tschüss Cellulite!
 96 % zufriedene Patientinnen noch zwei Jahre danach 1 Tschüss Cellulite! Warum Cellfi na? Eigentlich sind Sie zufrieden mit Ihrem Aussehen. Nur auf die lästigen Dellen an Po und Oberschenkeln könnten Sie
96 % zufriedene Patientinnen noch zwei Jahre danach 1 Tschüss Cellulite! Warum Cellfi na? Eigentlich sind Sie zufrieden mit Ihrem Aussehen. Nur auf die lästigen Dellen an Po und Oberschenkeln könnten Sie
Klinische Bewertung & Marktbeobachtung
 Klinische Bewertung & Marktbeobachtung, Senior Regulatory Affairs Manager EU: Medical Device Recast Es bleibt kaum ein Stein mehr auf dem anderen Sicherheits- und Leistungsanforderungen an ein Medizinprodukt
Klinische Bewertung & Marktbeobachtung, Senior Regulatory Affairs Manager EU: Medical Device Recast Es bleibt kaum ein Stein mehr auf dem anderen Sicherheits- und Leistungsanforderungen an ein Medizinprodukt
IQWiG Herbstsymposium / Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V)
 IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
IQWiG Herbstsymposium 19.11./20.11.2010 Unterschied zwischen Risiko-Nutzenabwägung (nach AMG) und Nutzen-Schadenabwägung (nach SGB V) Referent: Maximilian Grüne, Justiziar Gemeinsamer Bundesausschuss Seite
Das Informationssystem des DIMDI Gegenwart und Zukunft Dr. Renate Laby DIMDI, Köln
 Das Informationssystem des DIMDI Gegenwart und Zukunft Dr. Renate Laby DIMDI, Köln Im Geschäftsbereich des Gliederung DIMDI Verordnung, Bekanntmachung Online Erfassungssysteme Datenbanken MPI Dr. Renate
Das Informationssystem des DIMDI Gegenwart und Zukunft Dr. Renate Laby DIMDI, Köln Im Geschäftsbereich des Gliederung DIMDI Verordnung, Bekanntmachung Online Erfassungssysteme Datenbanken MPI Dr. Renate
Psychosoziale Beratung im Kontext von Pränataldiagnostik
 Psychosoziale Beratung im Kontext von Pränataldiagnostik Evaluation der Modellprojekte in Bonn, Düsseldorf und Essen Bearbeitet von A. Rohde, G. Woopen 1. Auflage 2007. Taschenbuch. 153 S. Paperback ISBN
Psychosoziale Beratung im Kontext von Pränataldiagnostik Evaluation der Modellprojekte in Bonn, Düsseldorf und Essen Bearbeitet von A. Rohde, G. Woopen 1. Auflage 2007. Taschenbuch. 153 S. Paperback ISBN
SPECTARIS zur aktuellen ImplantFiles - Berichterstattung
 SPECTARIS e.v. Werderscher Markt 15 10117 Berlin SPECTARIS zur aktuellen ImplantFiles - Berichterstattung Ihr Ansprechpartner: Marcus Kuhlmann Fachverbandsleiter Medizintechnik kuhlmann@spectaris.de Die
SPECTARIS e.v. Werderscher Markt 15 10117 Berlin SPECTARIS zur aktuellen ImplantFiles - Berichterstattung Ihr Ansprechpartner: Marcus Kuhlmann Fachverbandsleiter Medizintechnik kuhlmann@spectaris.de Die
A n t r a g. Name:... Straße:... PLZ/Ort:... Telefon:... Facharzt für:... Niedergelassen seit:... Niederlassung geplant ab:...
 A n t r a g auf Genehmigung zur Durchführung und Abrechnung von Balneophototherapie nach der Qualitätssicherungsvereinbarung gemäß 135 Abs. 2 SGB V zur Balneophototherapie (EBM-Ziffer 10350) Name:... Praxisanschrift
A n t r a g auf Genehmigung zur Durchführung und Abrechnung von Balneophototherapie nach der Qualitätssicherungsvereinbarung gemäß 135 Abs. 2 SGB V zur Balneophototherapie (EBM-Ziffer 10350) Name:... Praxisanschrift
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie
 PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie... (Vollständiger Titel der klinischen Studie) Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer! Wir laden
PatientInneninformation 1 und Einwilligungserklärung zur Teilnahme an der klinischen Studie... (Vollständiger Titel der klinischen Studie) Sehr geehrte Teilnehmerin, sehr geehrter Teilnehmer! Wir laden
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung
 Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
POST MARKET CLINICAL FOLLOW UP
 POST MARKET CLINICAL FOLLOW UP (MEDDEV 2.12-2 May 2004) Dr. med. Christian Schübel 2007/47/EG Änderungen Klin. Bewertung Historie: CETF Report (2000) Qualität der klinischen Daten zu schlecht Zu wenige
POST MARKET CLINICAL FOLLOW UP (MEDDEV 2.12-2 May 2004) Dr. med. Christian Schübel 2007/47/EG Änderungen Klin. Bewertung Historie: CETF Report (2000) Qualität der klinischen Daten zu schlecht Zu wenige
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung
 Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
Erläuterung zum Ausfüllen des Formulars Erstanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Abs. Bitte verwenden Sie dieses Formular ausschließlich
Gleitmittel G E R M A N Y. Unterstützt bei der natürlichen Empfängnis
 Gleitmittel MADE IN G E R M A N Y Unterstützt bei der natürlichen Empfängnis Unerfüllter Kinderwunsch Stellt sich nach Absetzen von mechanischen oder hormonellen Verhütungsmitteln innerhalb von ein paar
Gleitmittel MADE IN G E R M A N Y Unterstützt bei der natürlichen Empfängnis Unerfüllter Kinderwunsch Stellt sich nach Absetzen von mechanischen oder hormonellen Verhütungsmitteln innerhalb von ein paar
Alle mit einem Sternchen gekennzeichneten Felder sind Pflichtfelder. Ohne Angaben in diesen Feldern ist ein Absenden der Anzeige nicht möglich.
 Erläuterung zum Ausfüllen des Formulars Abschlussanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Bitte verwenden Sie dieses Formular ausschließlich
Erläuterung zum Ausfüllen des Formulars Abschlussanzeige einer Anwendungsbeobachtung nach 67 Abs. 6 AMG / nichtinterventionellen Unbedenklichkeitsprüfung nach 63f Bitte verwenden Sie dieses Formular ausschließlich
Die Medical Device Regulation MDR 2017/745. Marcus Wenzel Market DACH, Q&R Hamburg,
 Die Medical Device Regulation MDR 2017/745 Marcus Wenzel Market DACH, Q&R Hamburg, 23.11.2017 1 Medical Device Regulation MDR im Überblick Inkrafttreten am 25. Mai 2017 20 Tage nach Veröffentlichung in
Die Medical Device Regulation MDR 2017/745 Marcus Wenzel Market DACH, Q&R Hamburg, 23.11.2017 1 Medical Device Regulation MDR im Überblick Inkrafttreten am 25. Mai 2017 20 Tage nach Veröffentlichung in
Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig durch, denn sie enthält wichtige Informationen für Sie.
 Gebrauchsinformation RECESSAN Lauromacrogol 400 (Polidocanol) 30 mg/g Schmerzbetäubende Salbe für die Mundschleimhaut Liebe Patientin, lieber Patient! Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig
Gebrauchsinformation RECESSAN Lauromacrogol 400 (Polidocanol) 30 mg/g Schmerzbetäubende Salbe für die Mundschleimhaut Liebe Patientin, lieber Patient! Bitte lesen Sie die gesamte Gebrauchsinformation sorgfältig
Dossierbewertung A17-24 Version 1.0 Nivolumab (Plattenepithelkarzinom des Kopf-Hals-Bereichs)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Nivolumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
Präsentation der Marktforschungsergebnisse Rechtsanwälte Jakobs, Schmitz, Wollweber & Collegen:
 Präsentation der Marktforschungsergebnisse Rechtsanwälte Jakobs, Schmitz, Wollweber & Collegen: Zertifizierung TÜV Service tested Im Juni 2010 Zertifizierung TÜV Service tested 1 Zertifizierung TÜV Service
Präsentation der Marktforschungsergebnisse Rechtsanwälte Jakobs, Schmitz, Wollweber & Collegen: Zertifizierung TÜV Service tested Im Juni 2010 Zertifizierung TÜV Service tested 1 Zertifizierung TÜV Service
Tagebuch für. Schmerzen. Ein Service der HEXAL AG.
 Tagebuch für Schmerzen Ein Service der HEXAL AG www.schmerz.de Inhalt Vorwort Patientendaten So füllen Sie das Schmerzprotokoll aus! Ihr Schmerzprotokoll Hinweis Haben Sie noch Fragen? Vorwort Liebe Patientin,
Tagebuch für Schmerzen Ein Service der HEXAL AG www.schmerz.de Inhalt Vorwort Patientendaten So füllen Sie das Schmerzprotokoll aus! Ihr Schmerzprotokoll Hinweis Haben Sie noch Fragen? Vorwort Liebe Patientin,
Versorgungsforschungsstudie zur peripheren arteriellen Verschlusskrankheit (PAVK)- Baseline Ergebnisse zur Diagnostik
 Versorgungsforschungsstudie zur peripheren arteriellen Verschlusskrankheit (PAVK)- Baseline Ergebnisse zur Diagnostik Dipl. oec. troph. Rebecca Jahn, Prof. Dr. Curt Diehm, Dr. rer. medic. Elke Driller,
Versorgungsforschungsstudie zur peripheren arteriellen Verschlusskrankheit (PAVK)- Baseline Ergebnisse zur Diagnostik Dipl. oec. troph. Rebecca Jahn, Prof. Dr. Curt Diehm, Dr. rer. medic. Elke Driller,
Landesamt für Gesundheit und Soziales 1
 Landesamt für Gesundheit und Soziales 1 Ethik-Kommission des Landes Berlin Tätigkeitsbericht für das Jahr 2011 v. 30.04.2012 Das Jahr 2011 stand unter dem Zeichen der Wahrnehmung des erweiterten aufgrund
Landesamt für Gesundheit und Soziales 1 Ethik-Kommission des Landes Berlin Tätigkeitsbericht für das Jahr 2011 v. 30.04.2012 Das Jahr 2011 stand unter dem Zeichen der Wahrnehmung des erweiterten aufgrund
Einladung. GCP-Training. Auffrischungskurs. Klinische Prüfungen mit Arzneimitteln: GCP-Auffrischungskurs für Prüfer, Stellvertreter und Prüfgruppe
 Einladung GCP-Training Auffrischungskurs Klinische Prüfungen mit Arzneimitteln: GCP-Auffrischungskurs für Prüfer, Stellvertreter und Prüfgruppe CME-zertifiziert von der Landesärztekammer Samstag, den 09.12.2017-09:00-16:30
Einladung GCP-Training Auffrischungskurs Klinische Prüfungen mit Arzneimitteln: GCP-Auffrischungskurs für Prüfer, Stellvertreter und Prüfgruppe CME-zertifiziert von der Landesärztekammer Samstag, den 09.12.2017-09:00-16:30
Einladung. GCP-Training. Auffrischungskurs. Klinische Prüfungen mit Arzneimitteln: GCP-Auffrischungskurs für Prüfer, Stellvertreter und Prüfgruppe
 Einladung GCP-Training Auffrischungskurs Klinische Prüfungen mit Arzneimitteln: GCP-Auffrischungskurs für Prüfer, Stellvertreter und Prüfgruppe CME-zertifiziert von der Landesärztekammer Samstag, den 09.12.2017-09:00-16:30
Einladung GCP-Training Auffrischungskurs Klinische Prüfungen mit Arzneimitteln: GCP-Auffrischungskurs für Prüfer, Stellvertreter und Prüfgruppe CME-zertifiziert von der Landesärztekammer Samstag, den 09.12.2017-09:00-16:30
Myomembolisation Uterusarterien-Embolisation UAE Uterine Fibroid Embolization UFE
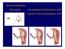 Myomembolisation Synonyme: Uterusarterien-Embolisation UAE Uterine Fibroid Embolization UFE Fast idealer Verlauf Pat., 1999 Reduktion der Myomgröße und des Uterusvolumens innerhalb von 3 Monaten mit spontaner
Myomembolisation Synonyme: Uterusarterien-Embolisation UAE Uterine Fibroid Embolization UFE Fast idealer Verlauf Pat., 1999 Reduktion der Myomgröße und des Uterusvolumens innerhalb von 3 Monaten mit spontaner
So vermeiden Sie Wechselwirkungen. Der Sanitas Medikamentencheck
 So vermeiden Sie Wechselwirkungen Der Sanitas Medikamentencheck Steigende Lebenserwartung, steigende Medikamenteneinnahme Männer leben hierzulande durchschnittlich 80 Jahre, Frauen sogar 85 Jahre. Damit
So vermeiden Sie Wechselwirkungen Der Sanitas Medikamentencheck Steigende Lebenserwartung, steigende Medikamenteneinnahme Männer leben hierzulande durchschnittlich 80 Jahre, Frauen sogar 85 Jahre. Damit
Clotrimazol 3 Heumann Vaginalcreme
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clotrimazol 3 Heumann Vaginalcreme Vaginalcreme mit 20 mg Clotrimazol/g zur 3-Tage-Behandlung Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Clotrimazol 3 Heumann Vaginalcreme Vaginalcreme mit 20 mg Clotrimazol/g zur 3-Tage-Behandlung Lesen Sie die gesamte Packungsbeilage sorgfältig durch,
MediPreis Produktsteckbrief
 MediPreis Produktsteckbrief CLOTRIMAZOL AL 1% CLOTRIMAZOL AL 1% Creme ALIUD Pharma GmbH PZN: 04941490 Menge: 20 g Art: Creme Link: https://www.medipreis.de/04941490 Clotrimazol Al 1% Creme - Gegen Pilzinfektionen
MediPreis Produktsteckbrief CLOTRIMAZOL AL 1% CLOTRIMAZOL AL 1% Creme ALIUD Pharma GmbH PZN: 04941490 Menge: 20 g Art: Creme Link: https://www.medipreis.de/04941490 Clotrimazol Al 1% Creme - Gegen Pilzinfektionen
