Organische Experimentalchemie
|
|
|
- Samuel Kuntz
- vor 6 Jahren
- Abrufe
Transkript
1 PD Dr. Alexander Breder Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und Biologie (Lehramt) Marburg, 28. April 2017
2 Lösungen zu Übung 1: Atombau und die chemische Bindung Aufgabe: 1. Wodurch werden die chemischen Eigenschaften eines Elementes bestimmt? 2. Bitte geben Sie die Elektronenkonfiguration des Natrium- und des Chloratoms an. 3. Was ist die Triebkraft für eine Reaktion zwischen den vorgenannten Elementen? 4. Ordnen Sie die folgenden Atomorbitale in der Reihenfolge ihrer Besetzung und geben Sie die maximal mögliche Besetzung mit Elektronen an: 3s, 2p, 3d, 4s, 3p, 1s, 4p, 2s. Antwort: 1. Durch die Valenzelektronen 2. Na: 1s 2, 2s 2, 2p 6, 3s 1 (11 El.; 1 VE) Cl: 1s 2, 2s 2, 2p 6, 3s 2, 3p 5 (17 El.; 7 VE) 3. Erlangung der Edelgaskonfiguration (für Na + ergibt sich die Konf. des Neons (10 El.) und für Cl ergibt sich die des Argons (18 El.)) 4. 1s 2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 2, 3d 10, 4p 6 (Elektronenkonfiguration des Kryptons) 2
3 Lösungen zu Übung 1: Atombau und die chemische Bindung Aufgabe: 5. Welche räumliche Struktur hat Ammoniak (N 3 )? Begründen Sie Ihre Antwort! Antwort: 5. Da das N-Atom sp 3 -hybridisiert vorliegt, besitzt Ammoniak die Struktur eines verzerrten Tetraeders. 6. Formaldehyd hat die Summenformel C 2 O. Zu welchem Kohlenwasserstoff weist dieses Molekül eine strukturelle Analogie auf? 6. Formaldehyd ist strukturell analog zu Ethen (C- und O-Atom sind sp 2 -hybridisiert) Quelle: 3
4 Lösungen zu Übung 1: Atombau und die chemische Bindung Aufgabe: 7. Die Reaktion zwischen Kaliumhydroxid (KO) und Blausäure (CN) liefert das anorganische Salz Kaliumcyanid. andelt es sich bei der Blausäure ebenfalls um ein anorganische Molekül? Antwort: 7. nein! Blausäure enthält sowohl Kohlenstoff als auch Wasserstoff in seiner Molekülstruktur 4
5 Fazit der Woche 1: Atombau und die chemische Bindung Elektronenkonfigurationen: Orbitale: ybridisierung und Bindungsbildung 5
6 3. Wichtige Reaktionsklassen: Allgemeiner Überblick Die vier elementaren Reaktionstypen in der organischen Chemie Substitution: Austausch eines Substituenten durch einen anderen Beispiel: A B + C A C + B Addition: Anlagerung eines Moleküls an eine hrfachbindung (Doppel- oder Dreifachbindung) eines anderen Moleküls A B + C D A B C D Eliminierung: Formale Abspaltung eines Moleküls aus einer Verbindung unter Ausbildung einer hrfachbindung (Doppel- oder Dreifachbindung). C A D B A B + C D Umlagerung: Reaktion, bei der die Bindungen innerhalb eines Moleküls neu ausgerichtet werden (Veränderung der Konnektivität) C A D B D A C B 3. Grundlegende Reaktionsklassen und wichtige reaktive Intermediate 6
7 3. Wichtige Reaktionsklassen: Allgemeiner Überblick Einordnung der Reaktionspartner Radikal: (R. ) Beispiele:. Teilchen mit mindestens einem ungepaarten Valenzelektron Alkylradikale: R 3 C. Stickstoffmonoxid: NO Nukleophil: (Nu oder Nu ) Sauerstoff:. O-O. Teilchen, das als Elektronenpaardonor (z.b. als Anion oder ydroxidion: O mit freiem Elektronenpaar oder π-bindung(en)) Alkohole: RO neue Bindungen knüpft Amine: RN 2, R 2 N, R 3 N Elektrophil: (E oder E + ) Teilchen, das als Elektronenpaarakzeptor (z.b. als Kation oder Carbocationen: R 3 C + Gruppe mit stark polarisierten s- oder π-bindungen) neue Proton: + Bindungen knüpft Carbonyle: R 2 C=O Imine: R 2 C=NR 3. Grundlegende Reaktionsklassen und wichtige reaktive Intermediate 7
8 3. Wichtige Reaktionsklassen: Exemplarische Reaktionen Die vier elementaren Reaktionstypen in der organischen Chemie Substitution: Austausch eines Substituenten durch einen anderen Beispiel: O Br Br + 2 O chanismus: (X = Abgangsgruppe) Nukleophiler Angriff auf unbesetztes p-orbital 3. Grundlegende Reaktionsklassen und wichtige reaktive Intermediate 8
9 3. Wichtige Reaktionsklassen: Exemplarische Reaktionen Die vier elementaren Reaktionstypen in der organischen Chemie Substitution: Austausch eines Substituenten durch einen anderen Beispiel: O Br Br + 2 O Addition: Anlagerung eines Moleküls an eine hrfachbindung (Doppel- oder Dreifachbindung) eines anderen Moleküls Relevante Orbitalwechselwirkungen: π* Br Br freies Elektronenpaar Br Br σ* Br Br π Br Br 3. Grundlegende Reaktionsklassen und wichtige reaktive Intermediate 9
10 3. Wichtige Reaktionsklassen: Exemplarische Reaktionen Die vier elementaren Reaktionstypen in der organischen Chemie Substitution: Austausch eines Substituenten durch einen anderen Beispiel: O Br Br + 2 O Addition: Anlagerung eines Moleküls an eine hrfachbindung (Doppel- oder Dreifachbindung) eines anderen Moleküls Eliminierung: Formale Abspaltung eines Moleküls aus einer Verbindung unter Ausbildung einer hrfachbindung (Doppel- oder Dreifachbindung). σ C σ* C X Base X X + Base 3. Grundlegende Reaktionsklassen und wichtige reaktive Intermediate 10
11 3. Wichtige Reaktionsklassen: Exemplarische Reaktionen Die vier elementaren Reaktionstypen in der organischen Chemie Substitution: Austausch eines Substituenten durch einen anderen Beispiel: O Br Br + 2 O Addition: Anlagerung eines Moleküls an eine hrfachbindung (Doppel- oder Dreifachbindung) eines anderen Moleküls Eliminierung: Formale Abspaltung eines Moleküls aus einer Verbindung unter Ausbildung einer hrfachbindung (Doppel- oder Dreifachbindung). σ C σ* C X Base X X + Base Umlagerung: Reaktion, bei der die Bindungen innerhalb eines Moleküls neu ausgerichtet werden (Veränderung der Konnektivität) O itze O 3. Grundlegende Reaktionsklassen und wichtige reaktive Intermediate 11
12 : Definition und Eigenschaften Definition: Als Alkane bezeichnet man die Stoffgruppe der gesättigten (keine hrfachbindung!), acyclischen (keine Ringstrukturen!) Kohlenwasserstoffe, deren Vertreter nur aus den beiden Elementen Kohlenstoff (C) und Wasserstoff () bestehen und die sich über die Summenformel C n 2n+2 beschreiben lassen. Name: Valenzstrichformel: Summenformel: Skelettformel: Kugel-Stab-Modell: than C C 4 Ethan C C C 2 6 C C C Propan C 3 8 Butan C 4 10 C C C C 12
13 : Physikalische Eigenschaften Name: Summenformel: Mol.-Masse: Smp. [ C]. Sdp. [ C] Dichte than C 4 16,04 g mol Ethan C ,07 g mol Propan C ,10 g mol n-butan C ,12 g mol n-pentan C ,15 g mol ,626 g/cm 3 n-exan C ,18 g mol ,659 g/cm 3 n-eptan C ,2 g mol ,684 g/cm 3 n-octan C ,2 g mol ,703 g/cm 3 n-nonan C ,3 g mol ,718 g/cm 3 n-decan C ,3 g mol ,73 g/cm 3 n-undecan C ,3 g mol ,74 g/cm 3 n-dodecan C ,3 g mol ,75 g/cm 3 Quelle: 13
14 : Schmelz- und Siedepunkte Siedepunkte: Die Siedepunkte (Sdp.) der geradkettigen Alkane steigen regelmäßig mit zunehmender C-Zahl. Die Unterschiede zwischen den Siedepunkten benachbarter Glieder der homologen Reihe werden in Richtung der höheren Verbindungen geringer (Bedeutung für Trennung durch Destillation!). Die Schmelzpunkte (Smp.) der Alkane steigen mit wachsender Kettenlänge unter Wechsel von stärkerem und schwächerem Anstieg der Schmelzpunkte. Geradzahlige Alkane schmelzen relativ zu ihrer Atommasse bei höheren Temperaturen als ungeradzahlige (odd-even-effekt). Begründung: Bessere Packung und höhere Ordnung bei geradzahligen Ketten; Zwischen den Alkan-Ketten wirken Van-der-Waals Kräfte (London-Kräfte, Abstandsabhängigkeit 1/r 6 ). Temp. [C ] Quelle: Anzahl der C-Atome = Sdp. = Smp. 14
15 : Schmelz- und Siedepunkte London-Kräfte: London-Kräfte (benannt nach Fritz Wolfgang London) sind schwache Anziehungskräfte zwischen unpolaren Molekülen und Atomen, die durch spontane Polarisation eines Teilchens und dadurch induzierte Dipole in benachbarten Teilchen entstehen. Quelle: 15
16 : Isomerie bei Alkanen 3 C n-butan C 3 C 3 3 C C 3 Isobutan (2-thylpropan) 3 C C 3 3 C n-pentan C 3 C 3 Isopentan (2-thylbutan) C 3 3 C C C 3 3 Neopentan (2,2-Dimethylpropan) C4 Sdp. [C ] Smp. [C ] C6 Sdp. [C ] Smp. [C ] n-butan n-exan Isobutan thylpentan C5 3-thylpentan ,2-Dimethylbutan n-pentan ,3-Dimethylbutan Isopentan Neopentan
17 : Isomerie bei Alkanen Name: Zahl der Konstitutionsisomere Zahl der Konstitutionsisomere und Konfigurationsisomere than 1 1 Ethan 1 1 Propan 1 1 n-butan 2 2 n-pentan 3 3 n-exan 5 5 n-eptan 9 11 n-octan n-nonan n-decan n-triacontan (C ) > n-tretracontan (C ) ca Quelle: 17
18 : Nomenklatur der Alkylreste (Seitenketten) Regeln: 1. Abstraktion eines -Atoms von einem Alkan (C n 2n+2 ) ergibt ein Kohlenwasserstoffradikal (C n 2n+1 ), das Alkyl-Radikal genannt wird. Aliphatische Seitenketten lassen sich ebenfalls über die letztgenannte Summenformel beschreiben, sodass die Namen der Seitenketten in verzweigten Alkanen sich vom Stammnamen der Seitenkette und der Endung für Radikale ( yl) ableiten. thyl Ethyl Et 3 C 3 C Isoprpyl i-pr 3 C 3 C sec-butyl s-bu 3 C C 3 Propyl Butyl Pr Bu 3 C 3 C Isobutyl i-bu 3 C 3 C tert-butyl t-bu 3 C 3 C C 3 = primäres C-Atom = sekundäres C-Atom = tertiäres C-Atom = quartäres C-Atom 18
19 : Nomenklatur der Alkylreste (Seitenketten) Systematische Benennung: C-Atome in der Kette Stammname Präfix (Seitenkette) Verbindungsname (Suffix = an) generisch Alk Alkyl- Alkan 1 th thyl- than 2 Eth Ethyl- Ethan 3 Prop Propyl- Propan 4 But Butyl- Butan 5 Pent Pentyl- Pentan 6 ex exyl- exan 7 ept eptyl- eptan 8 Oct Octyl- Octan 9 Non Nonyl- Nonan 10 Dec Decyl- Decan 19
20 : Rotation um die C C s-bindung Torsionswinkel φ (Diederwinkel) zwischen den Wasserstoffen von 180 Newman- Projektion Torsionswinkel φ (Diederwinkel) zwischen den Wasserstoffen von 0 G. Solomons, C. Fryhle, Organic Chemistry, Wiley New York,
21 : Die Konformation Definition: Die Konformation eines organischen Moleküls beschreibt die räumliche Anordnung seiner Atome, die durch die Drehbarkeit um σ-bindungen resultiert. 60 Kugel-Stab- Modell Moleküle mit gleicher Konfiguration, die sich jedoch in der spezifischen Anordnung der Atome unterscheiden und in einem Energieminimum liegen, bezeichnet man als Konformere. 60 Newman- Projektion Die Untersuchung der Abhängigkeit physikalischer und chemischer Eigenschaften von bevorzugten Konformationen wird Konformationsanalyse genannt. 60 Sägebock- Projektion a) E. F. Eliel, Angew. Chem. 1965, 77, 784; b) G. Solomons, C. Fryhle, Organic Chemistry, Wiley New York,
22 : Die Konformation Gestaffelte Konformationen (engl. staggered) sind energieärmer als die ekliptischen Konformationen (engl. eclipsed). Die Energiebarriere für die Rotation um C C-Einfachbindung ist jedoch zu gering, um bei Raumtemperatur Konformere trennen zu können. Für die Isolierung von Konformeren ist eine Rotationsbarriere von mindestens 100 kj/mol erforderlich. P. Y. Bruice, Organische Chemie, Pearson,
23 : Die Konformation und die yperkonjugation Verantwortlich für die Stabilisierung der gestaffelten Konformation ist die Wechselwirkung von C σ-bindungsorbitalen mit C σ*-bindungsorbitalen der benachbarten (vicinalen) C Bindung. Diese Delokalisation von Elektronendichte wird (negative) yperkonjugation genannt. ekliptisch gestaffelt s C s C s C s* C s C s* C Pauli-Austausch (abstoßend) destabilisierende yperkonjugation stabilisierende yperkonjugation (anziehend) 23
24 : Die Konformation und die yperkonjugation Relevante Konformationen des n-butans: J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin eidelberg 24
25 : Die Konformation und die yperkonjugation Verantwortlich für die Stabilisierung der gestaffelten Konformation ist die Wechselwirkung von C σ-bindungsorbitalen mit C- σ*-bindungsorbitalen der benachbarten C Bindung. Diese Delokalisation von Elektronen wird (negative) yperkonjugation genannt. J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin eidelberg 25
26 : Nomenklatur der Cycloalkane Regel: Die Namen der Cycloalkane werden aus denjenigen der entsprechenden n-alkane mit gleicher Kohlenstoffanzahl durch die Vorsilbe Cyclo gebildet. Die Cycloalkane ohne Seitenketten bilden eine homologe Reihe mit der allgemeinen Summenformel C n 2n, wobei n 3 ist. Cyclopropan Cyclobutan Cyclopentan Cyclohexan Cycloheptan Cyclooctan Regeln bei substituierten Cycloalkanen: 1. Wenn der Ring Alkylsubstituenten trägt, ist der Ring in der Regel die Stammverbindung 2. Zwei oder mehrere Ringsubstituenten werden in alphabetischer Reihenfolge angegeben 3. Die Ringsubstituenten werden mit den kleinst möglichen Ziffern belegt 4-Ethyl-2-methyl-1-propylcyclohexan 1,1,2-Trimethylcyclopentan Quelle: 26
27 : Physikalische Eigenschaften der Cycloalkane Aufgrund der Abweichung von der durch die sp 3 -ybridisierung vorgegebenen Tetraedergeometrie kommt es bei kleinen und mittelgroßen Cycloalkanen (C-Zahl 3 und 4 bzw. 8-16) zur sogenannten Winkelspannung, die mit einer geringeren Überlappung der sp 3 -ybridorbitale in den endocyclischen σ-bindungen einhergeht. Im Beispielsfall des Cyclopropans werden die resultierenden C C Bindungen auch Bananenbindungen genannt. Im Cyclopropan liegen alle C σ-bindungen ekliptisch und das Molekül mithin planar (flach) vor. Abweichung von der Planarität im Cyclobutan und Cyclopentan (Briefumschlag-Konformation). Bananenbindungs-Modell Cyclopropan Cyclobutan Cyclopentan Quelle: 27
28 : Physikalische Eigenschaften der Cycloalkane Verbrennungswärmen repräsentativer n-alkane J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin eidelberg 28
29 : Physikalische Eigenschaften der Cycloalkane Ermittlung der Spannungsenergie in Cycloalkanen Cyclopropan Cyclobutan Cyclopentan Cyclohexan Valenzwinkel im Ring ( ) Valenzwinkel- Deformation gegenüber ca ca Verbrennungswärme pro C 2 -Gruppe (kj/mol) [kcal/mol] 697 [166.6] 686 [164.0] 664 [158.7] 659 [157.5] Spannungsenergie pro C 2 -Gruppe (kj/mol) [kcal/mol] 38 [9.1] 27 [6.5] 5 [1.2] 0 [ 0] 29
30 : Konformationsanalyse bei Cycloalkanen Axiale und äquatoriale Orientierung im Cyclohexanring = axiale Position = äquatoriale Position G. Solomons, C. Fryhle, Organic Chemistry, Wiley New York,
31 : Konformationsanalyse bei Cycloalkanen Ringinversion des Cyclohexanrings durch Rotation um C C s-bindungen a) P. Y. Bruice, Organische Chemie, Pearson, 2007; b) J. Clayden, N. Greeves, S. Warren, Organische Chemie, 2. Ed., 2013, Springer-Verlag Berlin eidelberg 31
32 : Konformationsanalyse bei Cycloalkanen Profil der relativen Energielagen bei Ringinversion des Cyclohexans G. Solomons, C. Fryhle, Organic Chemistry, Wiley New York,
33 : Konformationsanalyse bei Cycloalkanen Analyse der Boot-Konformation G. Solomons, C. Fryhle, Organic Chemistry, Wiley New York,
34 : Konformationsanalyse beim thylcyclohexan Axiale vs. äquatorialer Orientierung des -Substiuenten P. Y. Bruice, Organische Chemie, Pearson,
35 : A-Werte diverser Substituenten im Cyclohexanring 1,3-diaxiale Wechselwirkung R steht äquatorial R R R steht axial Substituent DG 0 [kj/mol] Substituent DG 0 [kj/mol] DG 0 [kj/mol] Isomerenverhältnis 0 F : Cl :25 Et 7.33 Br :10 i-pr 9.21 I :5 t-bu ~ 21 O :1 OOC (Carbonsäure) CO :0.01 OOC (thylester) N
36 : Disubstituierte Cyclohexanringe C 3 C 3 C 3 C 3 1,1-Dimethylcylohexan 3 C C 3 C 3 Regel: Wenn hypothetisch alle C-Atome eines Cycloalkans in einer gedachten Ebene liegen, dann werden Substituenten, die sich relativ zueinander auf derselben Seite dieser Ebene befinden (egal ob oberhalb oder unterhalb) als cis-ständig bezeichnet. 3 C C 3 C 3 3 C cis-1,4-dimethylcylohexan C 3 Befinden sich die Substituenten jedoch relativ zueinander auf gegenüberliegenden Seiten dieser Ebene, dann werden sie als trans-ständig bezeichnet. 3 C C3 3 C trans-1,4-dimethylcylohexan C 3 C 3 C 3 (vgl. Beispiel links) 36
37 : Anellierte Cycloalkane (polycyclische Alkane) trans-bicyclo[4.4.0]decan (trans-decalin) cis-bicyclo[4.4.0]decan (cis-decalin) Ringinversion nicht möglich 37
38 : Von-Baeyer-Nomenklatur polycyclischer Alkane Regeln: 1. Bestimmung des numerischen Präfix (Bi-, Tri- etc.) 2. Einfügen der Silbe cyclo 3. Angabe der Anzahl der Brückenglieder beginnend mit der größten Zahl x in Form [x.y.z...] 4. Angabe des Stammnamens des analogen n-alkans (z.b. bei 8 C-Atomen im Polycyclus oct ) 5. Angabe des Suffix (Verbindungsname; z.b. bei reinen Kohlenwasserstoffen an, da es sich im die Klasse der Alkane handelt) cis-bicyclo[3.3.0]octan trans-bicyclo[3.3.0]octan cis-bicyclo[4.3.0]nonan Bicyclo[2.2.1]heptan (Norbornan) 38
39 : Cycloalkane in der Natur Steroide Natürliche Steroide kommen in Tieren, Pflanzen und Pilzen vor. Ihre biochemischen Aufgaben reichen von Vitaminen und ormonen (z.b. Androgene, Estrogene) über Gallensäure und Krötengifte bis zu den herzaktiven Giften von Fingerhut und Oleander. In Tieren und im menschlichen Organismus stellt Cholesterin das wichtigste Steroid dar. Aus Cholesterin werden Lipoproteine und Steroidhormone aufgebaut. O O O Cholesterin mbranlipid, ubiquitär im allen Zelltypen und tierischen Organismen O Testosteron Männliches Sexualhormon O Progesteron Schwangerschaftshormon O Cholesterin Quelle: 39
40 Übung 2: Struktur und Nomenklatur von Alkanen Aufgaben: 1. Zeichnen Sie die Strukturen folgender Verbindungen: 2,4 Dimethylpentan, 4,8 Diethyl 2,5,9 trimethylundecan und 2-Ethyl-1-methyl-4-(1-ethyl-2-methylbutyl)cyclohexan. 2. Geben Sie die Strukturformeln der neun Konstitutionsisomere des eptans an und benennen Sie diese nach den IUPAC-Nomenklaturregeln! 3. Geben Sie die Summenformel, Valenzstrichformel und Skelettformel von Cyclopentan an. Zeichnen Sie zudem die energieärmste Konformation von Propan in der Sägebock- und Newman- Projektion. 4. Welche Sesselkonformation wird Ihrer Ansicht nach im cis-1-chlor-4-(1-methylethyl)cyclohexan vorliegen? Begründen Sie Ihren Vorschlag. 40
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Experimentalchemie
 PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Cycloalkane
 3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul Rademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 7: 24.11.2004) MILESS: hemie für Biologen 126 Was
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Übungen zur VL Chemie für Biologen und Humanbiologen Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur:
 Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Vorlesung 5. Alkane. Experimentalchemie, Prof. H. Mayr 20 Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. Anzahl C-Atome im n-alkan
 Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Vorlesung 5. Alkane Verbindungen aus Kohlenstoff und Wasserstoff, die nur Einfachbindungen enthalten, nennt man gesättigte Kohlenwasserstoffe. Sie sind ein auptbestandteil von Erdgas und Erdöl. Liegen
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Cycloalkane
 3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
ORGANISCHE CHEMIE. Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen
 ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
ORGANISE EMIE Struktur organischer Verbindungen: Formeln, Nomenklatur und Reaktionsmechanismen hemische Formeln Summenformeln Strukturformeln (Konstitutionsformeln) Ausführliche Strukturformeln Vereinfachte
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Organische Experimentalchemie
 PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und
PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und
Butanol Butanal Butansäure
 Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
Wiederholungsthema: Gesättigte Kohlenwasserstoffe (Alkane) Zusammenfassung: Gesättigte Kohlenwasserstoffe bestehen aus Ketten aus mit einander vernüpften Kohlenstoff-Atomen, an die die maximal mögliche
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
4.1. Gesättigte Kohlenwasserstoffe (Alkane)
 4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
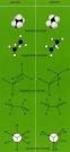 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
E 102.1: Grundlagen der hemie - Organische hemie Prof Dr. E. Landau und Prof. Dr. J. A. Robinson 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane: Moleküle ohne funktionelle Gruppen
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 11 2.1 Funktionellen Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer Substanzen.
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Chemisches Praktikum für Studierende der umanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 2. Klausur zum 2. Praktikumsteil (C) vom 25.07.17 NAME;
Kohlenwasserstoffe. Benzol Naphthalin usw. Alkane Alkene Alkine Cycloaliphaten. Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w.
 OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
OI_folie47 Kohlenwasserstoffe Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne
 1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
1 Lösung 6 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne 6.1 Konformationsanalyse a) Zeichnen Sie für 2-Methylbutan die Konformationen als Newman-Projektionen
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
III. Cycloalkane (Stereochemie II)
 49 III. Cycloalkane (Stereochemie II) (C 2 ) n-2 2 C C 2 (C 2 ) n-2 2 C C 2 C n 2n+2 Cn 2n Nomenklatur: Alkan Cycloalkan für n = 5 n-pentan Cyclopentan Bruttoformel allgemein C n 2n oder (C 2 ) n Cycloalkane
49 III. Cycloalkane (Stereochemie II) (C 2 ) n-2 2 C C 2 (C 2 ) n-2 2 C C 2 C n 2n+2 Cn 2n Nomenklatur: Alkan Cycloalkan für n = 5 n-pentan Cyclopentan Bruttoformel allgemein C n 2n oder (C 2 ) n Cycloalkane
Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen
 2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
2. Alkane Alkane = aliphatische Kohlenwasserstoffe, Paraffine Organische Verbindungen ohne funktionelle Gruppen 2.1 unverzweigte Alkane Formel: C n 2n+2 = -(C 2 ) n - homologe Reihe n Name Formel Schmp.
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Organische Chemie der Freien Universität Berlin. Klausur SS 2008 Teil 1
 rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 201a) Klausur SS 2008 Teil 1 Verfasser: Datum: 07.06.2008 Prof. Dr. H.-U. Reißig Semester: SS 08 Höchstpunktzahl:
rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 201a) Klausur SS 2008 Teil 1 Verfasser: Datum: 07.06.2008 Prof. Dr. H.-U. Reißig Semester: SS 08 Höchstpunktzahl:
Basisprüfung Allgemeine Chemie (Teil OC) Montag, 3. September 2007
 Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
Grundwissen Chemie 10. Klasse NTG
 Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Chemie. Elektrochemie, Alkane und Alkene
 Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Zinkhalbzelle Mehr Zusammenfassungen von Malte Jakob findest du hier: hemie Elektrochemie, Alkane und Alkene Elektrochemie Galvanische Zelle: Anode Oxidation - e - e- e U - e - + Kathode Reduktion Zinkelektrode
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Organische Chemie I. OC I Lehramt F. H. Schacher 1
 Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
2.1 Homologe Reihe, Nomenklatur, Konstitution, Konformation CH 2
 Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Organische Chemie I SS 2018
 Organische Chemie I SS 2018 Organische Chemie I LA / J. C. Brendel 1 Organisatorisches Kontakt: Johannes C. Brendel ZAF, Philosophenweg 7, Raum 103 Email: johannes.brendel@uni-jena.de Felix H. Schacher,
Organische Chemie I SS 2018 Organische Chemie I LA / J. C. Brendel 1 Organisatorisches Kontakt: Johannes C. Brendel ZAF, Philosophenweg 7, Raum 103 Email: johannes.brendel@uni-jena.de Felix H. Schacher,
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Homologe Reihe der Alkane. Benennung der Alkane. Konstitutionsisomerie. Isomerie. Was versteht man unter der Homologen Reihe der Alkane?
 Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
Grundwissen hemie: NTG 10 1/24 omologe eihe der Alkane Was versteht man unter der omologen eihe der Alkane? Grundwissen hemie: NTG 10 2/24 Benennung der Alkane Benenne die ersten zwölf Vertreter aus der
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Kohlenwasserstoffe. Alkane Alkene Alkine Cycloaliphaten. Ethin (Acetylen) Propin u.s.w. Cycloalkane Cycloalkene Cycloalkine
 Kohlenwasserstoffe Folie184 Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Kohlenwasserstoffe Folie184 Aliphaten Aromaten Benzol Naphthalin usw. Alkane Alkene Alkine ycloaliphaten Methan Ethan u.s.w Ethen (Ethylen) Propen u.s.w. Ethin (Acetylen) Propin u.s.w. ycloalkane ycloalkene
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Summenformel. Strukturformel. Halbstrukturformel. Fossile Energieträger. ( 10. Klasse NTG 1 / 47 ) ( 10. Klasse NTG 2 / 47 ) ( 10. Klasse NTG 3 / 47 )
 Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Basisprüfung Allgemeine Chemie (Teil OC) Montag, 3. September 2007
 Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. Nomenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B C D N 1.2 (10
Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. Nomenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B C D N 1.2 (10
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
Vorlesung Chemie für Biologen: Klausur 1 WS Sa
 1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2. Alkane. Allgemeines. Nomenklatur + Konstitutionsisomerie. Konformationsisomerie. Industrielle Bedeutung. Synthetische Darstellung
 2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane Organische Chemie I LA / J. C. Brendel 1 Allgemeines
2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane Organische Chemie I LA / J. C. Brendel 1 Allgemeines
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
wir-sind-klasse.jimdo.com
 Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
Alkane Alkane sind kettenförmige Kohlenwasserstoffe, deren Atome im Molekül durch Einfachbindungen miteinander verknüpft sind. Sie bilden eine homologe Reihe. Ihre allgemeine Summenformel lautet: C n H
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
2. Alkane. Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane
 2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
2. Alkane Allgemeines Nomenklatur + Konstitutionsisomerie Konformationsisomerie Industrielle Bedeutung Synthetische Darstellung Reaktionen der Alkane OC I Lehramt F. H. Schacher 1 Allgemeines Kohlenwasserstoffe
CH CH 2 H 2 C H 2 C CH 2 CH CH CH 2 CH 2 C H H 2 C CH 2 C 2 CH 2 H CH 2 CH 2
 Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Eine spezielle Form von Kohlenwasserstoffen, die ebenfalls nur Einfachbindungen besitzt, genügt nicht der allgemeinen Summenformel n n+ sondern besitzt die allgemeine Summenformel n n. Diese Alkane sind
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Drill&Practice: Alkene und Alkine
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Drill&Practice: Alkene und Alkine 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und
Nomenklatur von Alkyl Substituenten
 Organic Chemistry 4 th Edition Paula Yurkanis uice Chapter 2 Alkane: Kohlenwasserstoffe, die nur Einfachbindungen aufweisen Allgemeine Fmel: C n 2n+2 Eine Einführung In Organische Verbindungen Nomenklatur
Organic Chemistry 4 th Edition Paula Yurkanis uice Chapter 2 Alkane: Kohlenwasserstoffe, die nur Einfachbindungen aufweisen Allgemeine Fmel: C n 2n+2 Eine Einführung In Organische Verbindungen Nomenklatur
Inhaltsverzeichnis zu Kapitel 2. Alkane
 Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Kapitel 4. Cyclische Verbindungen
 Kapitel 4 Cyclische Verbindungen 1 Ringförmige Verbindungen Cholesterol: (von gr. chole: Galle und stereos: fest) O * C 3 * * 8 Stereozentren (256 mögliche Isomere!) Nur ein Isomer kommt in der Natur vor.
Kapitel 4 Cyclische Verbindungen 1 Ringförmige Verbindungen Cholesterol: (von gr. chole: Galle und stereos: fest) O * C 3 * * 8 Stereozentren (256 mögliche Isomere!) Nur ein Isomer kommt in der Natur vor.
IUPAC-Nomenklaturregeln als Grundlage für Q11 Chemie
 Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
Nomenklatur 1 IUPA-Nomenklaturregeln als Grundlage für Q11 hemie 1 Kohlenwasserstoffe und Derivate 1.1 Regeln zur Benennung von unverzweigten Alkanen (n-alkane) Der Name der n-alkane enthält die folgenden
s- und p-orbitale MO-Schema des Wasserstoffmoleküls H 2 y z z x p x p y p z antibindendes MO bindendes MO
 s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Grundwissen der 10.Klasse NTG
 Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Grundkurs Chemie Alkane
 Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Grundkurs Chemie Alkane Abituraufgaben 1975/I Monobrompropan soll auf zwei verschiedenen Synthesewegen aus zwei verschiedenen Kohlenwasserstoffen hergestellt werden. 1. Bennen Sie die dafür geeigneten
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
