Bestimmung von Eisen-55 und Nickel-63 im Abwasser mit extraktionschromatographischen Verfahren
|
|
|
- Christian Hauer
- vor 6 Jahren
- Abrufe
Transkript
1 Bestimmung von Eisen-55 und Nickel-63 im Abwasser mit extraktionschromatographischen Verfahren H-Fe-55/Ni-63-AWASS-0 Bearbeiter: M. Beyermann D. Obrikat Diese Version entspricht der Druckfassung mit den Lieferungen bis 7, Stand: Leitstelle für die Überwachung der Radioaktivität in Trinkwasser, Grundwasser, Abwasser, Klärschlamm, Reststoffen und Abfällen ISSN Version Oktober 2000 Messanleitungen für die Überwachung radioaktiver Stoffe in der Umwelt und externer Strahlung
2
3 H-Fe-55/Ni-63-AWASS-0-0 2a Bestimmung von Eisen-55 und Nickel-63 im Abwasser mit extraktionschromatographischen Verfahren Anwendbarkeit Die vorliegende Vorschrift ist für die Bestimmung von Fe-55 und Ni-63 in Abwasserproben aus Kernkraftwerken gemäß KTA 504 () anwendbar, wenn die Eisen- und Nickelgehalte kleiner als 30 bzw. 0 mg l sind. Die Anwesenheit von Fe-59 in der Probe muß γ-spektrometrisch geprüft und bei der Berechnung der Fe-55-Aktivitätskonzentration berücksichtigt werden. Die Nachweisgrenzen betragen bei einem Probenvolumen von 0,25 l für Fe-55 und Ni-63 etwa bzw. 0,5 Bq l -. Andere Wässer können ebenfalls nach diesem Verfahren untersucht werden. 2 Probeentnahme Zur Durchführung der Probeentnahme und zur Trägerung der Probe mit Eisen- und Nickelionen wird auf die Vorschrift H-γ-SPEKT-AWASS-0 dieser Messanleitungen verwiesen. Die Probe des zu untersuchenden Abwassers wird mit etwa 0 ml Salpetersäure (4 mol l - ) pro Liter auf einen ph-wert von angesäuert, wobei die bleibende saure Reaktion gewährleistet werden muß. Für das beschriebene Verfahren ist ein Probenvolumen von 0,6 Liter ausreichend, um Doppelbestimmungen beider Radionuklide durchführen zu können. Hinweis: Bei Proben mit hohen Schwebstoffgehalten oder sedimentierten Bestandteilen ist eine Homogenisierung vor der Teilung der Probe erforderlich. In der Regel wird dies durch intensives Durchmischen der Probe (z. B. durch den Einsatz einer Schüttelmaschine) erreicht. 3 Analytik 3. Prinzip der Methode Das Verfahren beinhaltet die aufeinanderfolgende extraktionschromatographische Trennung der Eisen- (z. B. Fe-55, Fe-59) und Nickelisotope (z. B. Ni-63, Ni-59) von anderen, im Abwasser enthaltenen Radionukliden. Eine Trennung einzelner Eisen- bzw. Nickelisotope ist nicht möglich, andererseits jedoch auch nicht erforderlich, da in den nach KTA 504 zu untersuchenden Jahresmischproben die Aktivitätskonzentrationen von Fe-55 und Ni-63 gegenüber denen anderer Eisen- und Nickelisotope dominieren.
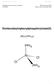
4 H-Fe-55/Ni-63-AWASS-0-02 Probenlösung mit M n+, X - Extraktion des Kations M + als Komplex M(X) n in die organische Phase des Trägermaterials Elutionsmittel Rückextraktion (Zerstörung des Komplexes), Elution des Kations M n+ vom Träger restliche Probenlösung Eluat mit M n+ Abb. : Schematische Darstellung der Extraktionschromatographie Das Prinzip der Extraktionschromatographie besteht in der Kombination von Flüssigflüssig-Extraktion und Säulenchromatographie in einem Arbeitsgang (siehe Abb. ). Ein stabiler, inerter Träger, an dem ein spezifisches organisches Extraktionsmittel (E) adsorptiv gebunden ist, bildet dabei die stationäre Phase. Die wässrige Probenlösung mit dem Anion X - wird als mobile Phase über die Säule gegeben, wobei im Idealfall nur das zu bestimmende Metallion M n+ in Form eines Komplexes M(X) n auf der Säule zurückgehalten wird. Grundlage ist die Verteilung zwischen wässriger und organischer Phase nach dem Gleichgewicht M n+ + nx - + E org M(X) n E org. Im letzten Schritt wird das Kation mit einem geeigneten Lösungsmittel wieder in eine wässrige Phase überführt und von der Säule eluiert. Das Verfahren zur Fe-55 und Ni-63-Bestimmung ist in Abb. 2 schematisch dargestellt. Zunächst werden beide Radionuklide durch eine Hydroxidfällung aus der Probenlösung angereichert. Für die Abtrennung von Fe-55 wird ein mit Octyl(phenyl)-N, N-diisobutylcarbamoyl-methyl-phoshinoxid in Tri-n-butylphosphat (CMPO/TBP) beladener Träger (TRU Spec, siehe 7.) verwendet, wobei der tetraedrisch koordinierte Chlorokomplex des Fe 3+ -Ions in die organische Phase extrahiert wird. Mit verdünnter Salzsäure wird Fe-55 anschließend eluiert. Für die Abtrennung der Ni-Ionen mit Ni-63 aus der restlichen Probenlösung wird ein mit Butandioxim-(2,3) [ältere Bezeichnung: Dimethylglyoxim, DMG] beladener Träger (Ni Spec, siehe 7.) eingesetzt, wobei Ni 2+ als DMG-Komplex auf der Säule zurückgehalten wird. Der Ni-DMG-Komplex wird dann mit verdünnter Salpetersäure wieder zerstört und Ni 2+ von der Säule gewaschen. Die chemischen Ausbeuten der Fe- und Ni-Abtrennung werden durch Atomabsorptionsspektrometrie (AAS) bestimmt.
5 H-Fe-55/Ni-63-AWASS-0-03 Probenvorbereitung Eindampfen der Probe, Rückstand naßveraschen (HNO 3, H 2 SO 4 ), Rückstand aufnehmen mit konz. HCl (0 mol l - ), Lösung auf ein definiertes Volumen auffüllen, Aliquot zur Elementbestimmung verwenden Hydroxidfällung mit KOH-Lösung (0 mol l - ), filtrieren, Niederschlag lösen in HCl (8 mol l - ) 2 5 ml HCl (8 mol l - ) 2 ml HCl (4 mol l - ) 0 ml HCl (0,2 mol l - ) TRU Spec verwerfen (Am, La, Ce, Eu) Fe-Eluat LSC-Messung und Elementbestimmung Hydroxidfällung restliche Probenlösung einengen, KOH-Lösung (0 mol l - ) zugeben, filtrieren, Niederschlag lösen in HCl (,2 mol l - ), Lösung puffern mit Ammoniumcitrat, ph-wert ~ 9 mit NH 3 einstellen 20 ml Pufferlösung 0 ml HNO 3 (,5 mol l - ) Ni Spec Ni-Eluat LSC-Messung und Elementbestimmung verwerfen Abb. 2: Schematische Darstellung der extraktionschromatographischen Bestimmungsmethode für Fe-55 und Ni-63 Die Aktivitätsmessung von Fe-55 und Ni-63 erfolgt mit einem Flüssigszintillationsspektrometer (LSC). 3.2 Probenvorbereitung Von der zu untersuchenden Wasserprobe wird ein Volumen von 275 ml entnommen und auf dem Sandbad eingedampft. Der Rückstand wird mit 0 ml konz. Salpetersäure (4 mol l - ) und 5 ml konz. Schwefelsäure (8 mol l - ) versetzt und die Lösung langsam bis zur Trockne eingeengt. Dieser Schritt wird wiederholt, bis sämtliche organischen
6 H-Fe-55/Ni-63-AWASS-0-04 Bestandteile zersetzt sind. Der Rückstand wird dann unter Rühren und Erwärmen mit ca. 5 ml konz. Salzsäure (0 mol l - ) aufgenommen und die Lösung anschließend mit ca. 50 ml dest. Wasser aufgefüllt. Nach dem Abkühlen wird die klare Lösung (ggf. wird filtriert) mit dest. Wasser auf ein Volumen von 275 ml aufgefüllt. Zur Bestimmung der Feund Ni-Gehalte der Probe werden 25 ml entnommen und in einen 50-ml-Maßkolben gegeben. Nach dem Auffüllen mit dest. Wasser bis zur Markierung wird die Lösung zur Atomabsorptionsspektrometrie eingesetzt. Die restlichen 250 ml der Probenlösung werden, wenn zu wenig inaktives Eisen bzw. Nickel in der Probe enthalten ist, mit Trägerlösung ( mg Fe 3+ bzw. mg Ni 2+ ) versetzt. 3.3 Radiochemische Trennung 3.3. Die vorbereitete Probenlösung wird mit einigen Tropfen einer Wasserstoffperoxidlösung (9 mol l - ) versetzt (Oxidation von Fe 2+ zu Fe 3+ ) und auf ein Volumen von ca. 200 ml eingedampft Mit 0 bis 5 ml Kaliumhydroxidlösung (0 mol l - ) werden in der Hitze die Hydroxide gefällt (alkalische Reaktion mit ph-papier prüfen); es entsteht ein brauner, voluminöser Niederschlag Der Niederschlag wird über ein Weißbandfilter abfiltriert, das Becherglas mit wenig dest. Wasser nachgespült. Das Filtrat wird verworfen. Fe-55-Bestimmung Die für die Eisenabtrennung erforderliche TRU-Säule (2 ml Säulenbettvolumen, 0,7 g Harz) wird mit 5 ml Salzsäure (8 mol l - ) konditioniert Der Hydroxidniederschlag im Filter (aus Schritt 3.3.3) wird mit 20 bis 30 ml Salzsäure (8 mol l - ) gelöst, das Filter dabei sorgfältig ausgespült. Diese Lösung wird auf die konditionierte TRU-Säule aufgetragen; zum Auffangen des Durchlaufes und der folgenden Waschwässer wird ein sauberes Becherglas verwendet. Das beim Probendurchlauf zurückgehaltene Chloroferration ([FeCl 4 ] - ) bildet ein breites gelbes Band auf der Säule Nachdem die Probenlösung durchgelaufen ist, wird zweimal mit 5 ml Salzsäure (8 mol l - ) gewaschen; mit der ersten Waschlösung wird das Becherglas ausgespült. Die durch die Säule gelaufene Probenlösung und die beiden folgenden HCl-Waschlösungen (8 mol l - ) werden für die Ni-63-Bestimmung verwendet (siehe 3.3.0) Mit weiteren 2 ml Salzsäure (4 mol l - ) werden Americium und Lanthanide von der Säule gewaschen, die Waschlösung wird verworfen (dieser Schritt kann entfallen, wenn das Vorhandensein entsprechender Radionuklide ausgeschlossen wird) Fe 3+ wird mit 0 ml Salzsäure (0,2 mol l - ) eluiert. Die erste -ml-fraktion der Elutionslösung wird evtl. (wenn eine Gelbfärbung nur im oberen Drittel der Säule aufgetreten ist) als Vorlauf in einem geeigneten Gefäß gesondert aufgefangen und verworfen. Empfohlen wird, zunächst ml Salzsäure (0,2 mol l - ) auf die Säule aufzutragen, nach dem Durchlauf das Auffanggefäß zu wechseln und erst dann mit 9 bis 9,5 ml Salzsäure (0,2 mol l - ) zu eluieren. Damit wird bei der LSC-Messung ein unnötig hoher Quench vermieden. Das gelb gefärbte Fe-Eluat wird mit Salzsäure (0,2 mol l - ) auf ein Volumen von genau 0 ml aufgefüllt.
7 H-Fe-55/Ni-63-AWASS ml des Eluates wird entnommen, in einen Maßkolben pipettiert und nach dem Verdünnen mit dest. Wasser auf 50 ml zur atomabsorptionsspektrometrischen Bestimmung der chemischen Ausbeute der Fe-Abtrennung verwendet ml des Eluates werden in ein 20-ml-Polyethylen-LSC-Messgefäß überführt und durch Zugabe von 200 µl 40 %iger Flußsäure (Handschuhe, Schutzbrille!) entfärbt. Anschließend wird mit 5 ml Szintillatorcocktail gemischt. Die Messprobe wird vor Beginn der Messung kühl und dunkel gelagert. Anmerkung Das zur Messung eingesetzte Eluat sollte in jedem Fall entfärbt werden, da sonst mit einem sehr hohen Farbquench zu rechnen ist. Nach Zusatz von Szintillatorcocktail tritt u. U. Chemolumineszenz auf, die nur sehr langsam abklingt (siehe Punkt 4.). Ni-63-Bestimmung 3.3. Die Lösung aus Schritt wird auf dem Sandbad auf ein Volumen von ca. 20 ml eingeengt. In der Wärme werden mit ca. 8 ml Kaliumhydroxidlösung (0 mol l - ) die Hydroxide gefällt Nach dem Abkühlen der Lösung wird über ein Weißbandfilter filtriert, das Becherglas mit wenig dest. Wasser gespült. Das Filtrat wird verworfen Der Hydroxidniederschlag im Filter wird mit 5 bis 20 ml Salzsäure (,2 mol l - ) gelöst, das Filter dabei sorgfältig ausgespült. Nach Zusatz von ml Ammoniumcitratlösung ( mol l - ) wird der ph-wert mit ca. 2 ml 25%iger Ammoniaklösung (3,5 mol l - ) auf 8 bis 9 eingestellt. Anmerkung Die Lösung muß evtl. erneut über ein Weißbandfilter filtriert werden (Ni 2+ -Ionen bleiben in Lösung, es können jedoch Hydroxide ausfallen, deren Metallionen keine Aminokomplexe bilden). Das Becherglas wird dann mit ca. 2 bis 5 ml einer basischen Pufferlösung (ph-wert 8 bis 9, siehe Punkt 7.) ausgespült, das Filter mit dem Rückstand wird verworfen Die Ni-Säule (2 ml Säulenbettvolumen, 0,7 g Harz) wird mit 5 ml einer basischen Pufferlösung (ph-wert 8 bis 9, siehe Punkt 7.) konditioniert Die Lösung von Schritt wird auf die konditionierte Ni-Säule aufgetragen. Der entstehende Ni-DMG-Komplex ist nach kurzer Zeit als rotes Band zu erkennen. Da der Komplex auf dem Trägermaterial ausfällt, läuft die Probenlösung u. U. sehr langsam durch, die Säule sollte jedoch nicht mit Druck betrieben werden. Anmerkung: Die Säulenkapazität beträgt etwa 3 mg Ni 2+ ; bei höherem Gehalt muß die Probenlösung geteilt werden. Jede Ni-Säule kann nur einmal verwendet werden! Nach dem Durchlaufen der Probenlösung wird die Säule mit 20 ml Ammoniumcitratlösung (0,2 mol l -, ph-wert 8 bis 9) gewaschen. Der Probendurchlauf und das Waschwasser werden verworfen Ni 2+ wird mit 9,5 bis 9,8 ml Salpetersäure (,5 mol l - ) eluiert, der DMG-Komplex wird dabei zerstört. Das Eluat wird in einem 20-ml-LSC-Messgefäß aufgefangen und mit Salpetersäure (,5 mol l - ) auf ein Volumen von 0 ml aufgefüllt.
8 H-Fe-55/Ni-63-AWASS ml des Eluates wird entnommen und nach dem Verdünnen mit dest. Wasser auf ein Volumen von 50 ml zur Bestimmung der chemischen Ausbeute der Ni-Abtrennung (AAS) eingesetzt Das restliche Eluat wird mit 2 ml Szintillatorcocktail gemischt und nach einer Wartezeit von ca. einer Stunde im Flüssigszintillationsspektrometer gemessen. 3.4 Störungen Die chemische Trennung bzw. die LSC-Messung können durch hohe Co-Konzentrationen, durch Fe-59, Pu-24 und durch Uran gestört werden. Bei unvollständiger Abtrennung der Fe-Isotope und bei sehr hohen Co-Konzentrationen der Abwasserprobe (> 30 mg l - ) kann die Ni-Bestimmung durch Bildung der Dimethylglyoxim- Komplexe des Fe 2+ (rot gefärbt) und des Co 2+ (braun gefärbt) gestört werden. Im Unterschied zum Ni-DMG-Komplex, der auf der Säule ausfällt, sind die Fe- und Co- DMG-Komplexe in wässriger Ammoniumcitratlösung löslich; ggf. wird für das vollständige Auswaschen dieser Komplexe ein größeres Volumen an Waschwasser (siehe Pkt ) benötigt. Die letzte Fraktion des durch die Säule gelaufenen Waschwassers muß farblos sein. Bei Anwesenheit von Pu-24 und/oder Uran in der Probe wird die Fe-55-Bestimmung gestört, da vierwertige Pu- und Th-Ionen sowie Uranylionen in salzsaurer Lösung an TRU Spec ein ähnliches Retentionsverhalten zeigen wie dreiwertige Fe-Ionen (5), und die β-strahlung des Pu-24 und des Th-234 bei der LSC-Messung ebenfalls in dem für die Bestimmung von Fe-55 gewählten Messbereich registriert wird. k' k' k' HNO 3 [mol l - ] HNO 3 [mol l - ] HNO 3 [mol l - ] Abb. 3: Retentionskoeffizienten k verschiedener Ionen an TRU Spec in Abhängigkeit von der Säurekonzentration nach (2)
9 H-Fe-55/Ni-63-AWASS-0-07 Um Fe 3+ von den Actiniden zu trennen, wird für die Elution gemäß Schritt Salpetersäure ( mol l - ) anstelle von Salzsäure (0,2 mol l - ) verwendet; dabei bleiben die Actinide am Träger, Fe-Ionen werden ausgewaschen (vgl. Abb. 3). Die LSC-Messung des Fe-Eluates erfolgt wie in Punkt 4. beschrieben, wobei der veränderte Probenquench, bedingt durch den Lösungsmittelwechsel von Salzsäure zu Salpetersäure, zu beachten ist. Die vollständige Abtrennung von Pu-24 und/oder Th-234 wird anhand des β-spektrums (siehe 4.) überprüft. Die Impulsrate im Messbereich von 6 bis 2000 kev muß dem üblichen Nulleffekt entsprechen. Vor der Aufbewahrung der Säule zur Wiederverwendung werden Pu 4+, Th 4+ und UO 2+ 2 mit den drei aufeinanderfolgenden Waschschritten vollständig entfernt: 0 ml eines Salzsäure (0, mol l - ) - Oxalsäure (0,05 mol l - ) Gemisches und zweimal 5 ml Ammoniumhydrogenoxalatlösung (NH 4 HC 2 O 4, 0, mol l - ). Bei Mehrfachnutzung der TRU-Säulen können zunehmend organische Bestandteile von der Säule gewaschen werden, die Probleme bei der LSC-Messung verursachen und die Trennleistung u. U. verschlechtern. Die Wiederverwendbarkeit der Säulen hängt hauptsächlich von der Probenmatrix und den eingesetzten Lösungsmittelvolumina ab. Zur Bestimmung der Fe-55-Aktivitätskonzentrationen an 250-ml-Abwasserproben sind bei zweimaliger Verwendung einer Säule keine Probleme zu erwarten. 4 Messung der Aktivität 4. Hinweise zur Messung Die Aktivität von Fe-55 wird durch Messung der niederenergetischen Röntgenstrahlung (K α : 5,9 kev und K β : 6,5 kev) mit einem Flüssigszintillationsspektrometer in einem Messbereich von 0 bis 6 kev bestimmt. Die Impulshöhenverteilung ist am Beispiel einer Fe-55-Messprobe in Abb. 4 dargestellt. Typische Messzeiten betragen 6000 Sekunden. Impulse Fe-55-Messprobe: 5 ml Fe-Eluat 200 µl 40 %ige HF 5 ml Instant Scint Gel Plus Abb. 4: Impulshöhenverteilung einer Fe-55-Messprobe Energie (kev)
10 H-Fe-55/Ni-63-AWASS-0-08 Impulse Ni-63-Messprobe: 9 ml Ni-Eluat 2 ml Quicksafe A Energie (kev) Abb. 5: Impulshöhenverteilung einer Ni-63-Messprobe Bei Messgeräten, die die Möglichkeit einer Lumineszenzkorrektur während der Messung aufweisen, sollte diese Option unbedingt genutzt werden. Besteht die Möglichkeit der automatischen Korrektur nicht, kann die abklingende Lumineszenz durch Wiederholungsmessungen erkannt werden. Anmerkung Die Chemolumineszenz bei Fe-55-Messproben klingt u. U. erst nach ca. 20 Stunden auf Werte unter 5 % (Anteil an den Impulsraten im niederenergetischen Messbereich) ab. Störung Durch anwesendes Fe-59 in der Probe wird die LSC-Messung der Fe-55-Aktivität gestört. Von der Gesamtzählrate muß der Fe-59-Anteil (z. B. nach γ-spektrometrischer Bestimmung der Fe-59-Aktivität) subtrahiert werden. Der Anteil der vom Fe-59 herrührenden Zählrate an der Gesamtzählrate im Fe-55-Messbereich beträgt ca. 5 %, wenn die Fe-55- und Fe-59-Aktivitäten in der Probe identisch sind. Die Aktivität des Ni-63 wird durch Messung der β-strahlung (maximale β-energie: 63 kev) mit einem Flüssigszintillationsspektrometer im Energiebereich von 0 bis 30 kev bestimmt. Andere Grenzen können in Abhängigkeit von der Probenzusammensetzung, des Szintillators und des Messgerätes anhand der Impulshöhenverteilung festgelegt werden. Die Impulshöhenverteilung ist am Beispiel einer Ni-63-Messprobe in Abb. 5 dargestellt. 4.2 Kalibrierung Zur Kalibrierung werden Fe-55- und Ni-63-Lösungen bekannter Aktivität mit unterschiedlichen Aktivitätskonzentrationen verwendet. Diese sollten auch unterschiedliche Fe- bzw. Ni-Konzentrationen (z. B. bis 5 mg Fe 3+ bzw. bis 3 mg Ni 2+ pro Probe) enthalten. Die Kalibrierungsproben werden mit den unter Punkt 4. beschriebenen Messbereichseinstellungen gemessen, dabei wird automatisch ein Lösch- bzw. Quenchparameter bestimmt. Dieser muß bei der Berechnung der Aktivitätskonzentration berücksichtigt werden, da der Quench hier angegeben als transformierter Spektralindex (tsie) die Zählausbeute (bzw. Nachweiswahrscheinlichkeit) und damit den Kalibrierfaktor beein-
11 H-Fe-55/Ni-63-AWASS-0-09 flusst. Mit den Messergebnissen der Kalibrierungsproben werden Quenchkurven erstellt (ggf. kann auch nachträglich gequencht werden, z. B. durch Zusatz von 20 µl Tetrachlorkohlenstoff oder 50 µl Aceton zur Messprobe). Die Zählausbeute wird in Abhängigkeit vom Quenchparameter als Regressionsgerade ermittelt. In Abb. 6 und 7 sind diese Funktionen für die Bestimmung der Fe-55- bzw. der Ni-63-Aktivität graphisch dargestellt. 0,35 ε [Bq ε - [ s Bq - ] s - - 0,30 0,25 0,20 0,5 0,0 0,05 0,00 Polynom - Regression: (N = 24) y=a+bx+... a=-0,265 b = 0,004 Korrelationskoeffizient = 0, tsie (Quenchparameter) (Quenchwert) Abb. 6: Nachweiswahrscheinlichkeit ε für Fe-55 in Abhängigkeit vom Quench (angegeben als tsie-wert) des Probenspektrums ε [Bq in - B s q - ] s - - 0,65 0,60 0,55 0,50 0,45 0,40 0,35 0,30 0,25 0,20 Polynom - Regression: (N = 5) y = a + bx +... a = 0,223 b = 0,004 Korrelationskoeffizient = 0,9548 0,5 0, ts IE (Q uenchparam eter) tsie (Quenchwert) Abb. 7: Nachweiswahrscheinlichkeit ε für Ni-63 in Abhängigkeit vom Quench (angegeben als tsie-wert) des Probenspektrums
12 H-Fe-55/Ni-63-AWASS-0-0 Der vom gerätespezifischen Quenchwert abhängige Kalibrierfaktor ϕ A (Bq s) ergibt sich zu: ϕ A = = () ε a + b tsie Die für die Fe-55- bzw. Ni-63-Bestimmung einzusetzenden Werte für die Koeffizienten a und b sind jeweils der Abb. 6 und 7 zu entnehmen. Bei üblichen Quenchwerten tsie = 300 für die Messung der Fe-55-Aktivität und tsie = 200 für die Messung der Ni-63-Aktivität ergeben sich die Kalibrierfaktoren ϕ Fe-55 = 3,4 Bq s und ϕ Ni-63 = 2,0 Bq s. 5 Berechnung der Analysenergebnisse Die Berechnung der Fe-55- bzw. Ni-63-Aktivitätskonzentration c der Probe erfolgt nach Gleichung (2): Darin bedeuten: c = ( ) V E λ ta ϕ A Rb Ro e (2) η VP VM c = Aktivitätskonzentration in Bq l - R b = Bruttozählrate in s - R o = Nulleffektzählrate in s - ϕ A = Kalibrierfaktor in Bq s η = chemische Ausbeute (Zahl <, siehe Gleichung 3) V E = Elutionsvolumen in ml = Probenvolumen, das für den chemischen Trennungsgang eingesetzt wurde in l V P V M = verwendetes Volumen des Eluates zur Herstellung der Messprobe in ml λ = Zerfallskonstante in s - (Fe-55: 8, s -, Ni-63: 2, s - ) t A = Zeitspanne zwischen dem Bezugsdatum und dem Messdatum in s Die chemische Ausbeute η erhält man nach Gleichung (3): C V neben den bereits erläuterten Symbolen bedeuten: E E η = (3) C P VP C E = Eisen- bzw. Nickelkonzentration des Eluates in mg ml - C P = Eisen- bzw. Nickelkonzentration der Probe in mg l - Für den Fall der nachträglichen Trägerung der Probe gemäß 3.2 ergibt sich: C V = m + m (4) P P 0 T
13 H-Fe-55/Ni-63-AWASS-0- wobei m 0 m T bedeuten. = Eisen- bzw. Nickelgehalt der Ausgangsprobe (nur für den Trennungsgang eingesetztes Volumen) in mg = mit der Trägerlösung zugesetzte Eisen- bzw. Nickelmasse in mg 5. Rechenbeispiel Mit den folgenden Zahlenwerten für übliche Nulleffekte, tsie-werte, eingesetzte Volumina und Zeitdifferenzen zwischen Bezugs- und Messdatum sowie den folgenden Messwerten Fe-55-Bestimmung Ni-63-Bestimmung t A = 280 d (2, s) t A = 280 d (2, s) C P = 0 mg l - C P < 0,0 mg l - vernachlässigbar = mg C E = 0,24 mg ml - C E = 0,092 mg ml - V P = 0,25 l V P = 0,25 l V E = 0 ml V E = 0 ml V M = 5 ml V M = 9 ml R o = 0,08 s - R o = 0,275 s - R b = 0,475 s - R b =,355 s - tsie = 300 tsie = 200 a = 0,265 a = 0,223 b = 0,004 b = 0,004 m 0 m T ergeben sich nach Gleichungen (), (2), (3) und (4) die Kalibrierfaktoren, die chemischen Ausbeuten und die Aktivitätskonzentrationen der Probe zu: ϕ ϕ Fe 55 Ni 63 = = 3,4 Bq s 0, ,265 = = 2,0 Bq s 0, , η η 0,24 0 = 0 0,25 Fe 55 = 0,092 0 = Ni 63 = 0,96 0,92 c Fe 55 = 3,4 0,96 0 0,25 5 8, ,49 7 ( 0,475 0,08) e 0 = 3,6 Bq l
14 H-Fe-55/Ni-63-AWASS-0-2 c Ni 63 = 2,0 0,92 0 0,25 9 2, ,49 7 (,355 0,275) e 0 = 0,7 Bq l 5.2 Fehlerbetrachtung Die relativen Standardabweichungen s(c)/c der Aktivitätskonzentration von Fe-55 bzw. Ni-63 werden nach Gleichung (5) berechnet: s( c) c = s( R Rn 2 2 n ) s( ϕ ) s( η) + ϕ 2 A + (5) η A mit s( R R n A n ) s(ϕ A) ϕ s(η) η = relative Standardabweichung der Nettozählrate R n, = relative Standardabweichung des Kalibrierfaktors ϕ A und = relative Standardabweichung der chemischen Ausbeute η. Die relative Standardabweichung der Nettozählrate wird wie folgt berechnet: s( R R n ) Rb Ro = + (6) R tm to n wobei neben den bereits definierten Symbolen folgende Größen in die Berechnung eingehen R n = Nettozählrate in s - t m = Messzeit der Probe in s t o = Messzeit des Nulleffektes in s. Der Beitrag von s(r n )/R n zur Unsicherheit der Messgröße spielt nur bei niedrigen Impulsraten bzw. kurzen Messzeiten eine nennenswerte Rolle. Die relativen Standardabweichungen der Kalibrierfaktoren ergeben sich aus den statistischen Kenngrößen der Regression (Berechnung der Zählausbeutefunktionen) bzw. werden anhand wiederholter Kalibrierungen geschätzt. Erfahrungsgemäß muß mit Standardabweichungen von bis zu 5 % gerechnet werden (s(φ A )/φ A = 0,5) Die relativen Standardabweichungen der chemischen Ausbeute betragen bei Anwendung der Atomabsorptionsspektrometrie zur Ausbeutebestimmung max. 0 % (s(η)/η = 0,). Dabei sind die Unsicherheiten von Pipettier- und Verdünnungsvorgängen bereits berücksichtigt. n
15 H-Fe-55/Ni-63-AWASS-0-3 Mit den in den Abschnitten 5. und 5.2 genannten Werten und t m t o = 6000 s = 6000 s ergeben sich die relativen Standardabweichungen der Aktivitätskonzentration des Fe-55 zu des Ni-63 zu s( c c s( c c Fe 55) Fe 55 Ni 63) Ni 63 = 0,8 und = 0,8. Damit lauten die Analysenergebnisse: c Fe-55 = (3,6 ± 2,5) Bq l - und c Ni-63 = (0,7 ±,9) Bq l -. Weitere präparationsbedingte Einflüsse, die meist nicht quantifizierbar sind, können zur Unsicherheit der Ergebnisse beitragen. Durch die wiederholte Analyse von Standardlösungen bzw. bei Teilnahme an Vergleichsanalysen können derartige Fehler erkannt werden. 6 Nachweisgrenzen des Verfahrens Die Nachweisgrenzen der Aktivitätskonzentration werden gemäß Kapitel IV.5 dieser Messanleitungen bei gleichen Messzeiten der Proben und der Nulleffekte nach Gleichung (7) berechnet: ϕ A g = η 2 Ro VE λ ta ( k + k ) α β e tm VP VM (7) Neben den bereits erläuterten Symbolen sind: g = Nachweisgrenze der Aktivitätskonzentration in Bq l - k -α, k -β = Quantile der Normalverteilung. Für Messzeiten (t m ) von jeweils 6000 s für Nulleffekt und Probe, den unter Punkt 5. angegebenen Werten, sowie den Werten k -α = 3 und k -β =,645 ergeben sich folgende Nachweisgrenzen: g Fe-55 = 0,8 Bq l - und g Ni-63 = 0,4 Bq l -. 7 Verzeichnis der erforderlichen Chemikalien und Geräte 7. Chemikalien Nach Möglichkeit sollten analysenreine Chemikalien verwendet werden: konz. Salpetersäure, HNO 3 (4 mol l - ) konz. Schwefelsäure, H 2 SO 4 (8 mol l - ) konz. Salzsäure, HCl (0 mol l - ) verdünnte Salzsäure: 8 mol l -,,2 mol l - und 0,2 mol l - verdünnte Salpetersäure:,5 mol l -
16 H-Fe-55/Ni-63-AWASS %ige Wasserstoffperoxidlösung, H 2 O 2 (9 mol l - ) 40 %ige Fluorwasserstoffsäure, HF (23 mol l - ) 25 %ige Ammoniaklösung, NH 3 (3,5 mol l - ) Kaliumhydroxidlösung, KOH (0 mol l - ) Ammoniumcitratlösung, NH 4 C 6 H 7 O 5 ( mol l - ) Fe-Träger-Lösung,,0 mg Fe 3+ ml - (2,42 g FeCl 3 6H 2 O in 0,5 l 0, N HNO 3 ) Ni-Träger-Lösung,, mg Ni 2+ ml - (0,8 g NiCl 2 6H 2 O in 0,2 l 0, N HCl) Pufferlösung, Ammoniumcitratlösung (0,2 mol l - ) mit NH 3 auf ph-wert 8,5 eingestellt Fertigsäulen bzw. loses Harz TRU Resin (3) (Eichrom Ind.) Ni Resin (4) Szintillatorcocktail z. B. Instant Scint Gel Plus (Fa. Packard) z. B. Qicksafe A (Fa. Zinsser) 7.2 Geräte Flüssigszintillationsspektrometer Atomabsorptionsspektrometer Übliche Ausrüstung eines radiochemischen Labors Literatur () Sicherheitstechnische Regel des Kerntechnischen Ausschusses KTA 504: Überwachung der Ableitung radioaktiver Stoffe mit Wasser KTA-Dok.-Nr. 504/93, Carl Heymanns Verlag, Köln, 993 (2) E. P. Horwitz, R. Chiarizia, M. L. Dietz, H. Diamond, D. M. Nelson Anlytica Chimica Acta 28 (993), (3) Eichrom ideas Vol. 4, No., März 997 (4) Eichrom ideas Vol. 3, No. 2, September 996 (5) E. A. Huff, D. R. Huff TRU-Spec and RE-Spec Chromatogaphy: Basic Studies and Applications 34th ORNL/DOE Conference on Analytical Chemistry in Energy Technology, Gatlinburg TN, October 993
Verfahren zur Bestimmung von Phosphor-32 im Abwasser
 Verfahren zur Bestimmung von Phosphor-32 im Abwasser H-P-32-AWASS-01 Bearbeiter: H.U. Fusban H. Rühle I. Gans Diese Version entspricht der Druckfassung mit den Lieferungen 1 bis 7, Stand: 1.3.2006 Leitstelle
Verfahren zur Bestimmung von Phosphor-32 im Abwasser H-P-32-AWASS-01 Bearbeiter: H.U. Fusban H. Rühle I. Gans Diese Version entspricht der Druckfassung mit den Lieferungen 1 bis 7, Stand: 1.3.2006 Leitstelle
Direkte Strontiumbestimmung in wässrigen Proben Version TKI. Inhaltsübersicht
 Direkte Strontiumbestimmung in wässrigen Proben Version 1.0 14.09.15 - TKI Inhaltsübersicht 1 Anwendungsbereich... 2 2 Zusammenfassung der Methode... 2 3 Bedeutsamkeit... Erreur! Signet non défini. 4 Querempfindlichkeiten...
Direkte Strontiumbestimmung in wässrigen Proben Version 1.0 14.09.15 - TKI Inhaltsübersicht 1 Anwendungsbereich... 2 2 Zusammenfassung der Methode... 2 3 Bedeutsamkeit... Erreur! Signet non défini. 4 Querempfindlichkeiten...
Trennungen, Mehrkomponenten-Bestimmungen 65
 Trennungen, Mehrkomponenten-Bestimmungen 65 Versuch 311 Hydrolysentrennung von Eisen und Magnesium Arbeitsanleitung Geräte: Bunsenbrenner, Dreifuß, Ceranplatte, 20-mL-Vollpipette, Messzylinder, 600-mL-Bechergläser,
Trennungen, Mehrkomponenten-Bestimmungen 65 Versuch 311 Hydrolysentrennung von Eisen und Magnesium Arbeitsanleitung Geräte: Bunsenbrenner, Dreifuß, Ceranplatte, 20-mL-Vollpipette, Messzylinder, 600-mL-Bechergläser,
1. Qualitativer Nachweis von Anionen und Sodaauszug
 Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anionennachweis 1 1. Qualitativer Nachweis von Anionen und Sodaauszug Die moderne Analytische Chemie unterscheidet zwischen den Bereichen der qualitativen und quantitativen Analyse sowie der Strukturanalyse.
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Radiochemie der Erdalkali-Metalle
 Spezielle Aspekte der Radiochemie, SS 2011 Radiochemie der Erdalkali-Metalle 14.7.2011 Udo Gerstmann Bundesamt für Strahlenschutz (BfS) Wichtige Radionuklide der Erdalkalimetalle Zerfallsart (bei ß - E
Spezielle Aspekte der Radiochemie, SS 2011 Radiochemie der Erdalkali-Metalle 14.7.2011 Udo Gerstmann Bundesamt für Strahlenschutz (BfS) Wichtige Radionuklide der Erdalkalimetalle Zerfallsart (bei ß - E
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung
 Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Übungsaufgaben zu Ionenreaktionen in wässriger Lösung 1) Berechnen Sie den phwert von folgenden Lösungen: a) 0.01 M HCl b) 3 10 4 M KOH c) 0.1 M NaOH d) 0.1 M CH 3 COOH (*) e) 0.3 M NH 3 f) 10 8 M HCl
Ansatzwerte: SurTec 691 I Ansatzlösung 8 Vol% (7-9 Vol%) SurTec 691 II Ansatzadditiv 2 Vol% (1,5-3 Vol%)
 SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung von Massenware erzeugt
SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung von Massenware erzeugt
Analytische Chemie. B. Sc. Chemieingenieurwesen. 14. März Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 14. März 2007 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Verfahren zur Bestimmung der Aktivitätskonzentration von Strontium-90 in Milch mit Proportionalzählrohr (Marathon C / Kryptand 2.2.
 Verfahren zur Bestimmung der Aktivitätskonzentration von Strontium-90 in Milch mit Proportionalzählrohr (Marathon C / Kryptand 2.2.2-Methode) F-Sr-90-MILCH-04 Bearbeiter: D. Tait Leitstelle für Boden,
Verfahren zur Bestimmung der Aktivitätskonzentration von Strontium-90 in Milch mit Proportionalzählrohr (Marathon C / Kryptand 2.2.2-Methode) F-Sr-90-MILCH-04 Bearbeiter: D. Tait Leitstelle für Boden,
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
DURNI-COAT DNC 25. Autokatalytischer Nickel/Phosphor-Prozess zur Kunststoff-Beschichtung
 Postfach 169 CH-9545 Wängi TG 08.12.2009 DURNI-COAT DNC 25 Autokatalytischer Nickel/Phosphor-Prozess zur Kunststoff-Beschichtung DNC 25 ist ein leicht alkalisches bei Raumtemperatur arbeitendes Verfahren,
Postfach 169 CH-9545 Wängi TG 08.12.2009 DURNI-COAT DNC 25 Autokatalytischer Nickel/Phosphor-Prozess zur Kunststoff-Beschichtung DNC 25 ist ein leicht alkalisches bei Raumtemperatur arbeitendes Verfahren,
SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge
 Protection upgraded SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung
Protection upgraded SurTec 691 Schwarzpassivierung für alkalische Zinküberzüge Eigenschaften Chrom(VI)-freie Schwarzpassivierung auf Basis von dreiwertigem Chrom speziell entwickelt für die Beschichtung
TROPANALKALOIDE. QUALITATIVE UNTERSUCHUNGEN Allgemeine Nachweisreaktionen (Alkaloide) Belladonnae folium. Belladonnae radix.
 QUALITATIVE UNTERSUCHUNGEN Allgemeine Nachweisreaktionen (Alkaloide) Belladonnae folium Belladonnae radix Stramonii folium 2.0 g pulverisierte Droge werden mit 40 ml 0.2 M H 2 SO 4 zwei Minuten lang in
QUALITATIVE UNTERSUCHUNGEN Allgemeine Nachweisreaktionen (Alkaloide) Belladonnae folium Belladonnae radix Stramonii folium 2.0 g pulverisierte Droge werden mit 40 ml 0.2 M H 2 SO 4 zwei Minuten lang in
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Arbeitsanweisung zur Ermittlung und Bewertung des Kalkstein-/Dolomit- Fülleranteils im Asphalt
 Arbeitsanweisung zur Ermittlung und Bewertung des Kalkstein-/Dolomit- Fülleranteils im Asphalt 2016, LISt Gesellschaft für Verkehrswesen und ingenieurtechnische Dienstleistungen mbh Impressum Auftraggeber:
Arbeitsanweisung zur Ermittlung und Bewertung des Kalkstein-/Dolomit- Fülleranteils im Asphalt 2016, LISt Gesellschaft für Verkehrswesen und ingenieurtechnische Dienstleistungen mbh Impressum Auftraggeber:
Gefahrenstoffe. 2 Bechergläser (230 ml), Bürette, Magnetrührer, Trichter, Rührschwein, Pipette, Stativ, Muffe, ph-meter
 1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
1.1 V1 Titration von Cola In diesem Versuch wird die in Cola enthaltene Phosphorsäure mittels Säure-Base-Titration titriert und bestimmt. Ebenfalls wird mit den erhaltenen Werten gerechnet um das chemische
Küvetten-Test LCK 320 Eisen 2+/3+
 ACHTUNG NEU! Das aktuelle Ausgabedatum finden Sie bei dem Arbeitsgang bzw. der. Küvetten-Test /3+ Prinzip Eisen(II)-Ionen bilden mit 1.10-Phenantrolin eine orangerote Komplexverbindung. Eisen(III)-Ionen
ACHTUNG NEU! Das aktuelle Ausgabedatum finden Sie bei dem Arbeitsgang bzw. der. Küvetten-Test /3+ Prinzip Eisen(II)-Ionen bilden mit 1.10-Phenantrolin eine orangerote Komplexverbindung. Eisen(III)-Ionen
Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13
 Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
Kantonsschule Kreuzlingen, Klaus Hensler Chemiebuch Elemente Lösungen zu Aufgaben aus Kapitel 13 Grundregeln für stöchiometrische Berechnungen Wenn es um Reaktionen geht zuerst die chem. Gleichung aufstellen
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
DEFINITIONEN REINES WASSER
 SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
SÄUREN UND BASEN 1) DEFINITIONEN REINES WASSER enthält gleich viel H + Ionen und OH Ionen aus der Reaktion H 2 O H + OH Die GGWKonstante dieser Reaktion ist K W = [H ]*[OH ] = 10 14 In die GGWKonstante
Versuchsprotokoll Kapitel 6
 Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Online Projektlabor Chemie. Durchführung für die Spurenanalytik in Wasser
 Online Projektlabor Chemie Technische Universität Berlin Durchführung für die Spurenanalytik in Wasser Leitung des Projektlabores: Prof. Dr. Th. Friedrich Ersteller des Dokumentes: Daniel Christian Brüggemann
Online Projektlabor Chemie Technische Universität Berlin Durchführung für die Spurenanalytik in Wasser Leitung des Projektlabores: Prof. Dr. Th. Friedrich Ersteller des Dokumentes: Daniel Christian Brüggemann
Qualitative Analyse. - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch,
 - Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
- Identifikation von Ionen (häufig in einem Gemisch) - Charakterisierung der Analyse nach Farbe, Morphologie, Geruch, Löslichkeit - charakteristische Nachweisreaktionen für Einzelionen: - Fällungsreaktionen
Praktikum Physik Radioaktivität 13GE RADIOAKTIVITÄT VERSUCHSAUSWERTUNG
 RADIOAKIVIÄ VERSUCHSAUSWERUNG I. VERSUCHSZIEL Die Zerfallskurve einer radioaktiven Substanz soll aufgenommen werden. Aus dieser Zerfallskurve soll das Gesetz des radioaktiven Zerfalls hergeleitet werden.
RADIOAKIVIÄ VERSUCHSAUSWERUNG I. VERSUCHSZIEL Die Zerfallskurve einer radioaktiven Substanz soll aufgenommen werden. Aus dieser Zerfallskurve soll das Gesetz des radioaktiven Zerfalls hergeleitet werden.
Verfahren zur Bestimmung der Gesamt-Alpha-Aktivitätskonzentration in Trinkwasser und Grundwasser
 Verfahren zur Bestimmung der Gesamt-lpha-ktivitätskonzentration in Trinkwasser und Grundwasser H-α-GESMT-TWSS-01 Bearbeiter: Th. Bünger H. ühle Leitstelle für die Überwachung der adioaktivität in Trinkwasser,
Verfahren zur Bestimmung der Gesamt-lpha-ktivitätskonzentration in Trinkwasser und Grundwasser H-α-GESMT-TWSS-01 Bearbeiter: Th. Bünger H. ühle Leitstelle für die Überwachung der adioaktivität in Trinkwasser,
1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid
 1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95.1) (63.0) (98.1) C 5 H 4 N 2 O 3 (140.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95.1) (63.0) (98.1) C 5 H 4 N 2 O 3 (140.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
Küvetten-Test LCK 554 BSB 5
 Küvetten-Test Prinzip Bestimmung des biochemischen Sauerstoffbedarfs in 5 Tagen unter zusätzlicher Hemmung der Nitrifikation mit 5 mg/l Allylthioharnstoff. Die Bestimmung des gelösten Sauerstoffs erfolgt
Küvetten-Test Prinzip Bestimmung des biochemischen Sauerstoffbedarfs in 5 Tagen unter zusätzlicher Hemmung der Nitrifikation mit 5 mg/l Allylthioharnstoff. Die Bestimmung des gelösten Sauerstoffs erfolgt
1007 Synthese von 2,4,6-Tribromanilin aus 4-Bromacetanilid
 1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
Verfahren zur Bestimmung von Schwefel-35 im Abwasser
 Verfahren zur Bestimmung von Schwefel-35 im bwasser H-S-35-WSS-01 Bearbeiter: H.U. Fusban H. Rühle I. Gans Diese Version entspricht der Druckfassung mit den Lieferungen 1 bis 7, Stand: 1.3.2006 Leitstelle
Verfahren zur Bestimmung von Schwefel-35 im bwasser H-S-35-WSS-01 Bearbeiter: H.U. Fusban H. Rühle I. Gans Diese Version entspricht der Druckfassung mit den Lieferungen 1 bis 7, Stand: 1.3.2006 Leitstelle
LSC. Applikationsnote 8 Überarbeitet von Dr. Ronald Edler Juli 2004. Cherenkov Messung von 32 P Geräte Performance. Einleitung
 LSC Applikationsnote 8 Überarbeitet von Dr. Ronald Edler Juli 2004 Cherenkov Messung von 32 P Geräte Performance Einleitung In den biologischen und chemischen Wissenschaften müssen viele Wissenschaftler
LSC Applikationsnote 8 Überarbeitet von Dr. Ronald Edler Juli 2004 Cherenkov Messung von 32 P Geräte Performance Einleitung In den biologischen und chemischen Wissenschaften müssen viele Wissenschaftler
Protokoll zur Übung Atomabsorptionsspektroskopie
 Protokoll zur Übung Atomabsorptionsspektroskopie im Rahmen des Praktikums Labor an der TU Wien Durchgeführt bei Privatdoz. Dipl.-Ing. Dr.techn. Andreas Limbeck Verfasser des Protokolls: Gwendolin Korinek
Protokoll zur Übung Atomabsorptionsspektroskopie im Rahmen des Praktikums Labor an der TU Wien Durchgeführt bei Privatdoz. Dipl.-Ing. Dr.techn. Andreas Limbeck Verfasser des Protokolls: Gwendolin Korinek
Zuckernachweis mit Tollens-Reagenz
 Zuckernachweis mit Tollens-Reagenz Betriebsanweisung nach 0 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeitsmerkmale Silbernitrat (öllenstein) AgN 3 3-0/3 6--60-61
Zuckernachweis mit Tollens-Reagenz Betriebsanweisung nach 0 Gefahrstoffverordnung Verwendete Chemikalien Bezeichnung R-Sätze S-Sätze Gefährlichkeitsmerkmale Silbernitrat (öllenstein) AgN 3 3-0/3 6--60-61
AnC I Protokoll: 6.1 Extraktionsphotometrische Bestimmung von Cobalt mit HDEHP! SS Analytische Chemie I. Versuchsprotokoll
 Analytische Chemie I Versuchsprotokoll 6.1 Extraktionsphotometrische Bestimmung von Mikromengen an Cobalt mit Phosphorsäure-bis- (2-ethylhexylester) (HDEHP) 1.! Theoretischer Hintergrund Zur Analyse wird
Analytische Chemie I Versuchsprotokoll 6.1 Extraktionsphotometrische Bestimmung von Mikromengen an Cobalt mit Phosphorsäure-bis- (2-ethylhexylester) (HDEHP) 1.! Theoretischer Hintergrund Zur Analyse wird
Ein Gemisch aus 13,2 g (0,1mol) 2,5-Dimethoxyterahydrofuran und 80ml 0,6 N Salzsäure werden erhitzt bis vollständige Lösung eintritt.
 1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
Anorganische-Chemie. Michael Beetz Arbeitskreis Prof. Bein. Grundpraktikum für Biologen 2017
 Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Michael Beetz Arbeitskreis Prof. Bein Butenandstr. 11, Haus E, E 3.027 michael.beetz@cup.uni-muenchen.de Anorganische-Chemie Grundpraktikum für Biologen 2017 Trennungsgänge und Nachweise # 2 Trennungsgänge
Leonardo da Vinci Innovationstransferprojekt TraWi. Projektnummer: DE/13/LLP-LdV/TOI/147629
 ŠPŠCH Pardubice Erarbeitung berufspädagogischer Konzepte für das berufliche Handlungsfeld Operator Chemist operator LEE 2b: 2. ph-wert-bestimmung Sie sind chemischer Operator in einem chemischen Betrieb,
ŠPŠCH Pardubice Erarbeitung berufspädagogischer Konzepte für das berufliche Handlungsfeld Operator Chemist operator LEE 2b: 2. ph-wert-bestimmung Sie sind chemischer Operator in einem chemischen Betrieb,
Inorganic Environmental Geochemistry (Anorganische Umweltgeochemie)
 Geographie Amalia Aventurin Inorganic Environmental Geochemistry (Anorganische Umweltgeochemie) Praktikumsbericht / -arbeit Praktikum Inorganic Environmental Geochemistry (Anorganische Umweltgeochemie)
Geographie Amalia Aventurin Inorganic Environmental Geochemistry (Anorganische Umweltgeochemie) Praktikumsbericht / -arbeit Praktikum Inorganic Environmental Geochemistry (Anorganische Umweltgeochemie)
Trisacetylacetonatoferrat(III) Fe(acac) 3
 Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Trisacetylacetonatoferrat(III) Fe(acac) 3 Mols, 21. 11. 2004 Marco Lendi, AC II 1. Synthese 1.1 Methode Wasserfreies Eisen(III)chlorid wird in wässriger, basischer Lösung durch Erhitzen in Eisen(III)hydroxid
Kohlenhydrat-Analytik
 Kohlenhydrat-Analytik Kohlenhydrate sind in ihrem strukturellen Aufbau sehr ähnlich. Eine spezifische Bestimmung wird dadurch erschwert. Ein gruppenweises Unterscheiden mit verschiedenen einfachen Nachweisreaktionen
Kohlenhydrat-Analytik Kohlenhydrate sind in ihrem strukturellen Aufbau sehr ähnlich. Eine spezifische Bestimmung wird dadurch erschwert. Ein gruppenweises Unterscheiden mit verschiedenen einfachen Nachweisreaktionen
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1. Lambert Beer sches Gesetz - Zerfall des Manganoxalations
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
5007 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin
 57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
Tris(acetylacetonato)eisen(III)
 Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
Praktikum rg. und Anorg. Chemie II DCHAB Wintersemester 04/05 Zürich, den 15. November 2004 Tris(acetylacetonato)eisen(III) [Fe(acac) 3 ] Fe 1 1. SYNTHESE 1.1 Methode [1] Eisen(III)chlorid wird mit Ammoniak
3.Präparat / Versuch 8.3
 .Präparat ersuch 8. Herstellung von Nitropentainkobalt(III)-chlorid ([NH ) 5 NO ]Cl ) 1. Herstellungsvorschrift: (Quelle 1, ) Es sollen g Nitropentainkobalt(III)-chlorid hergestellt werden. a) Herstellung
.Präparat ersuch 8. Herstellung von Nitropentainkobalt(III)-chlorid ([NH ) 5 NO ]Cl ) 1. Herstellungsvorschrift: (Quelle 1, ) Es sollen g Nitropentainkobalt(III)-chlorid hergestellt werden. a) Herstellung
7. Woche. Gesamtanalyse (Vollanalyse) einfacher Salze. Qualitative Analyse anorganischer Verbindungen
 7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
7. Woche Gesamtanalyse (Vollanalyse) einfacher Salze Qualitative Analyse anorganischer Verbindungen Die qualitative Analyse ist ein Teil der analytischen Chemie, der sich mit der qualitativen Zusammensetzung
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2009/10 vom 18.09.2009 A1 A2 A3 A4 A5 Σ Note 10 10 10 10 10 NAME:... VORNAME:...MUSTERLÖSUNG... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Analytische Chemie. B. Sc. Chemieingenieurwesen. 9. September 2015, Uhr. Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc.
 Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
Analytische Chemie B. Sc. Chemieingenieurwesen 9. September 2015, 13.30 16.30 Uhr Prof. Dr. Thomas Jüstel, Stephanie Möller M.Sc. Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe
RI 55. Cyanidisches Glanzkupferverfahren
 Postfach 169 CH-9545 Wängi TG 19.08.2009 RI 55 Cyanidisches Glanzkupferverfahren Das cyanidische Glanzkupferbad RI 55 ist ein reiner Kaliumelektrolyt und dient zum Abscheiden glänzender Kupferniederschläge
Postfach 169 CH-9545 Wängi TG 19.08.2009 RI 55 Cyanidisches Glanzkupferverfahren Das cyanidische Glanzkupferbad RI 55 ist ein reiner Kaliumelektrolyt und dient zum Abscheiden glänzender Kupferniederschläge
Dichlorobis(triphenylphosphin)nickel(II)
 Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Praktikum Org. und Anorg. Chemie II D-CHAB Wintersemester 04/05 Zürich, den 8. November 2004 Dichlorobis(triphenylphosphin)nickel(II) [Ni 2 ( ) 2 ] Ni 1 1. SYNTHESE 1.1 Methode [1] Nickel(II)chlorid reagiert
Einführungsseminar S2 zum Physikalischen Praktikum
 Einführungsseminar S2 zum Physikalischen Praktikum 1. Organisatorisches 2. Unterweisung 3. Demo-Versuch Radioaktiver Zerfall 4. Am Schluss: Unterschriften! Praktischer Strahlenschutz Wechselwirkung von
Einführungsseminar S2 zum Physikalischen Praktikum 1. Organisatorisches 2. Unterweisung 3. Demo-Versuch Radioaktiver Zerfall 4. Am Schluss: Unterschriften! Praktischer Strahlenschutz Wechselwirkung von
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Arbeitsvorschrift und Laboranweisung für die Messung von Öl- in Wasser, Schlamm und im Boden. Messung von Luft auf Anfrage.
 Stand Januar 2004 Arbeitsvorschrift und Laboranweisung für die Messung von Öl- in Wasser, Schlamm und im Boden. Messung von Luft auf Anfrage. Mit Hilfe des OMS- Systems Typ OMS-2 Technische Fragen bitte
Stand Januar 2004 Arbeitsvorschrift und Laboranweisung für die Messung von Öl- in Wasser, Schlamm und im Boden. Messung von Luft auf Anfrage. Mit Hilfe des OMS- Systems Typ OMS-2 Technische Fragen bitte
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12
 Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Seminar zum Quantitativen Anorganischen Praktikum WS 2011/12 Teil des Moduls MN-C-AlC Dr. Matthias Brühmann Dr. Christian Rustige Inhalt Montag, 09.01.2012, 8-10 Uhr, HS III Allgemeine Einführung in die
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität Duisburg-Essen Analyse 2 (NH 4 ) 2 CO 3 -Gruppe Ba 2+ Sr 2+ Ca 2+ Lösliche Gruppe Na + Mg 2+ NH 4+ Eigenschaften
SingleQuant Assay Kit
 GEBRAUCHSANLEITUNG SingleQuant Assay Kit Kit für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39226) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010
GEBRAUCHSANLEITUNG SingleQuant Assay Kit Kit für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39226) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010
Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Chemische Gleichgewichte, Säuren und
 Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
Wiederholung der letzten Vorlesungsstunde: Das chemische Gleichgewicht, Massenwirkungsgesetz, Löslichkeit von Salzen in Flüssigkeiten, Löslichkeitsprodukt, Thema heute: Chemische Gleichgewichte, Säuren
!!! NEUE ÖAB-MONOGRAPHIE!!!
 !!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.05.2014 an folgende
!!! NEUE ÖAB-MONOGRAPHIE!!! Die folgende neue Monographie ist für die Aufnahme in das ÖAB (österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.05.2014 an folgende
a) Wie viel Mal schwerer ist ein Liter Helium (He) als ein Liter Wasserstoff (H2) bei gleichen äußeren Bedingungen?
 Grundlagen A) Gehaltsbestimmung a) Bei 20 C lösen sich 197 g Saccharose in 100 ml Wasser. Berechnen Sie für diese Lösung den Massenanteil w von Saccharose. b) Wie viel Prozent Eisen sind in Eisen(III)-oxid
Grundlagen A) Gehaltsbestimmung a) Bei 20 C lösen sich 197 g Saccharose in 100 ml Wasser. Berechnen Sie für diese Lösung den Massenanteil w von Saccharose. b) Wie viel Prozent Eisen sind in Eisen(III)-oxid
Betreuer: Tobias Olbrich Literatur: Nach Organic Syntheses Coll. Vol. 10 (2004), 96.
 rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
Grundlagen der Radiochemie
 Grundlagen der Radiochemie RAD-CHEM/GRUNDL Bearbeiter: A. Heckel K. Vogl H. Wershofen ISSN 1865-8725 Grundlagen der Radiochemie RAD-CHEM/GRUNDL-01 1 Einleitung In diesem Kapitel werden wesentliche Grundlagen
Grundlagen der Radiochemie RAD-CHEM/GRUNDL Bearbeiter: A. Heckel K. Vogl H. Wershofen ISSN 1865-8725 Grundlagen der Radiochemie RAD-CHEM/GRUNDL-01 1 Einleitung In diesem Kapitel werden wesentliche Grundlagen
E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung
 Versuch E1/E2 1 Versuch E1/E2 E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung E2: Konduktometrische Titration I Aufgabenstellung
Versuch E1/E2 1 Versuch E1/E2 E1: Bestimmung der Dissoziationskonstante einer schwachen Säure durch Messung der elektrischen Leitfähigkeit der Elektrolytlösung E2: Konduktometrische Titration I Aufgabenstellung
Analytische Chemie. B. Sc. Chemieingenieurwesen. 02. Februar Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 02. Februar 2011 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol
 7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
Projekt- Nachweisreaktionen. Dieses Skript gehört: NaT-Lab für Schülerinnen und Schüler Johannes Gutenberg-Universität Mainz
 Projekt- Nachweisreaktionen NaT-Lab für Schülerinnen und Schüler Johannes Gutenberg-Universität Mainz Dieses Skript gehört: 1 Nachweise von Anionen 1. Nachweis von Sulfat 3 Reagenzgläser im Reagenzglasständer
Projekt- Nachweisreaktionen NaT-Lab für Schülerinnen und Schüler Johannes Gutenberg-Universität Mainz Dieses Skript gehört: 1 Nachweise von Anionen 1. Nachweis von Sulfat 3 Reagenzgläser im Reagenzglasständer
Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether)
 Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Stoffe oder Teilchen, die Protonen abgeben kånnen, werden als SÄuren bezeichnet (Protonendonatoren).
 5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
5 10 15 20 25 30 35 40 45 O C 50 Chemie Technische BerufsmaturitÄt BMS AGS Basel Kapitel 6 SÄuren und Basen Baars, Kap. 12.1; 12.2; 13 Versuch 1 Ein Becherglas mit Thermometer enthält violette FarbstofflÅsung
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP2 - Anionenreaktionen und Vorprobenanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 21.04.2006
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP2 - Anionenreaktionen und Vorprobenanalyse» Martin Wolf Betreuerin: Frau Sachse Datum: 21.04.2006
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Theoretische Grundlagen Physikalisches Praktikum. Versuch 8: Radioaktivität
 Theoretische Grundlagen Physikalisches Praktikum Versuch 8: Radioaktivität Radioaktivität spontane Umwandlung instabiler tomkerne natürliche Radioaktivität: langlebige Urnuklide und deren Zerfallsprodukte
Theoretische Grundlagen Physikalisches Praktikum Versuch 8: Radioaktivität Radioaktivität spontane Umwandlung instabiler tomkerne natürliche Radioaktivität: langlebige Urnuklide und deren Zerfallsprodukte
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 2,
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr., 6.04.11 1. Sie legen 100 ml einer 0, mol/l Natronlauge vor. Als Titrant verwenden Sie eine 0,8 mol/l Salzsäure. Berechnen
Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan
 Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Der Messkolben wird mit dest. Wasser auf 250 ml aufgefüllt und gut geschüttelt, damit die
 Versuch 1: Acidimetrie Titration von NaOH Der Messkolben wird mit dest. Wasser auf 250 ml aufgefüllt und gut geschüttelt, damit die Lösung homogen wird. Mit einer 50 ml Vollpipette werden 50 ml in einen
Versuch 1: Acidimetrie Titration von NaOH Der Messkolben wird mit dest. Wasser auf 250 ml aufgefüllt und gut geschüttelt, damit die Lösung homogen wird. Mit einer 50 ml Vollpipette werden 50 ml in einen
4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester
 NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
Trennungsmöglichkeit
 Trennungsmöglichkeit Erst Fällung mit Urotropin, dann mit (H 4 ) 2 S Was ist Urotropin? (H 2 S im basischen Milieu) 6 H 12 4 + 6 H 2 O 6 H 2 O + 4 H 3 Urotropin Formaldehyd H 2 H 2 H 2 H 2 H 2 H2 Adamantan-Gerüst
Trennungsmöglichkeit Erst Fällung mit Urotropin, dann mit (H 4 ) 2 S Was ist Urotropin? (H 2 S im basischen Milieu) 6 H 12 4 + 6 H 2 O 6 H 2 O + 4 H 3 Urotropin Formaldehyd H 2 H 2 H 2 H 2 H 2 H2 Adamantan-Gerüst
STÖCHIOMETRIE. die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen
 1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
1 STÖCHIOMETRIE die Lehre von der mengenmäßigen Zusammensetzung chemischer Verbindungen und den Mengenverhältnissen bei chemischen Reaktionen 1) STOFFMENGE n(x) reine Zählgröße Menge der Elementarteilchen
Synthese von 1,10- Phenanthrolin (CAS: )
 Aqua regia labor Synthese von 1,10- Phenanthrolin (CAS:66-71-7) Synonym: 1,10-Diazaphenanthren. Es ist ein farbloses oder blassbraunes, kristallines Pulver. Das Monohydrat kann entwässert werden.der Schmelzpunkt
Aqua regia labor Synthese von 1,10- Phenanthrolin (CAS:66-71-7) Synonym: 1,10-Diazaphenanthren. Es ist ein farbloses oder blassbraunes, kristallines Pulver. Das Monohydrat kann entwässert werden.der Schmelzpunkt
Probe- und Vergleichslösungen: Trennschicht (stationäre Phase): Kieselgel. Fließmittel (mobile Phase):
 , der Allrounder aus dem Supermarkt Welche Zucker sind in enthalten? Nachweis mittels Dünnschichtchromatografie (DC) [6] 27.06.03 / 04.07.03 Jessica Bornemann Grundlagen: Für die DC verwendet man Kunststofffolien,
, der Allrounder aus dem Supermarkt Welche Zucker sind in enthalten? Nachweis mittels Dünnschichtchromatografie (DC) [6] 27.06.03 / 04.07.03 Jessica Bornemann Grundlagen: Für die DC verwendet man Kunststofffolien,
Seminar zum Grundpraktikum Anorganische Chemie
 Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität DuisburgEssen 4 CO Cl Analyse 4 SalzsäureGruppe Ag + Pb 2+ Hg 2 2+ Bi + Cu 2+ Cd 2+ Sb +/5+ Sn 2+/4+ As +/5+
Seminar zum Grundpraktikum Anorganische Chemie Sommersemester 2012 Christoph Wölper Universität DuisburgEssen 4 CO Cl Analyse 4 SalzsäureGruppe Ag + Pb 2+ Hg 2 2+ Bi + Cu 2+ Cd 2+ Sb +/5+ Sn 2+/4+ As +/5+
Text Anlage. Heparin-Calcium
 Kurztitel 27. Nachtrag zum Arzneibuch Kundmachungsorgan BGBl. II Nr. 307/2008 /Artikel/Anlage Anl. 1 Inkrafttretensdatum 03.09.2008 Text Anlage Heparin-Calcium Definition Heparinum calcicum Heparin-Calcium
Kurztitel 27. Nachtrag zum Arzneibuch Kundmachungsorgan BGBl. II Nr. 307/2008 /Artikel/Anlage Anl. 1 Inkrafttretensdatum 03.09.2008 Text Anlage Heparin-Calcium Definition Heparinum calcicum Heparin-Calcium
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom
 Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Klausur zum Vorkurs des Chemischen Grundpraktikums WS 2015/16 vom 18.09.2015 A1 A2 A3 A4 A5 Note 15 5 9 11 10 NAME:... VORNAME:...LÖSUNGSSTICHPUNKTE... Pseudonym für Ergebnisveröffentlichung:... Schreiben
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau
 Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
Versuch 6.14 ph-abhängigkeit eines Indikators am Beispiel Thymolblau Einleitung Lösungen mit verschiedenen ph-werten von stark sauer bis stark basisch werden mit gleich viel Thymolblau-Lösung versetzt.
ETHANOL 70 Prozent Ethanolum 70 per centum. Aethanolum dilutum. Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser.
 ÖAB 2008/004 ETHANOL 70 Prozent Ethanolum 70 per centum Aethanolum dilutum Definition Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser. Gehalt: Ethanol 70 Prozent enthält mindestens
ÖAB 2008/004 ETHANOL 70 Prozent Ethanolum 70 per centum Aethanolum dilutum Definition Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser. Gehalt: Ethanol 70 Prozent enthält mindestens
Name: Punktzahl: von 57 Note:
 Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Testen Sie Ihr Wissen! Übungsprobe zu den Tertia-Themen und Säure-Base-Reaktionen Name: Punktzahl: von 57 Note: Für die folgenden Fragen haben Sie 60 Minuten Zeit. Viel Erfolg! Hilfsmittel: das ausgeteilte
Extraktion. Extraktion: Unter Extrahieren versteht man das Herauslösen eines oder mehrerer Stoffe aus einem festen Gemisch oder einer Lösung.
 Extraktion Extraktion: Unter Extrahieren versteht man das Herauslösen eines oder mehrerer Stoffe aus einem festen Gemisch oder einer Lösung. a) Festkörper Zum Extrahieren gut löslicher Substanzen genügt
Extraktion Extraktion: Unter Extrahieren versteht man das Herauslösen eines oder mehrerer Stoffe aus einem festen Gemisch oder einer Lösung. a) Festkörper Zum Extrahieren gut löslicher Substanzen genügt
Praktikum Chemie für Biologen, SS 2003/Kurse SS
 1 Praktikum Chemie für Biologen, SS 2003/Kurse SS Klausur in Anorganischer Chemie (KlAC) - Sa 14.06.2003 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
1 Praktikum Chemie für Biologen, SS 2003/Kurse SS Klausur in Anorganischer Chemie (KlAC) - Sa 14.06.2003 Name:... Vorname:... Wenn Nachschreiber aus einem der Vorkurse, bitte eintragen: Matrikel-Nr. Semester
Fragen zum Thema chemische Reaktionen Klasse 4 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion
 1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
1. Was gehört zu einer chemische Reaktionsgleichung? 2. Wie nennt man die Stoffe, die vor der Reaktion vorliegen? 3. Wie nennt man die Stoffe, die nach der Reaktion vorliegen? 4. Womit wird die Richtung
Chemisches Rechnen. Diese Lerneinheit befasst sich mit verschiedenen chemisch relevanten Größen Konzentrationsangaben mit den folgenden Lehrzielen:
 Chemisches Rechnen Diese Lerneinheit befasst sich mit verschiedenen chemisch relevanten Größen Konzentrationsangaben mit den folgenden Lehrzielen: Verständnis der unterschiedlichen Größen Sichere Anwendung
Chemisches Rechnen Diese Lerneinheit befasst sich mit verschiedenen chemisch relevanten Größen Konzentrationsangaben mit den folgenden Lehrzielen: Verständnis der unterschiedlichen Größen Sichere Anwendung
6016 Oxidation von 2,2-Dimethyl-1,3-propandiol zu 2,2- Dimethylmalonsäure
 6016 Oxidation von 2,2-Dimethyl-1,3-propandiol zu 2,2- Dimethylmalonsäure HNO 3 O O C 5 H 12 O 2 HNO 3 C 5 H 8 O 4 (104.2) (63.0) (132.1) Klassifizierung Reaktionstypen und Stoffklassen Oxidation Alkohol,
6016 Oxidation von 2,2-Dimethyl-1,3-propandiol zu 2,2- Dimethylmalonsäure HNO 3 O O C 5 H 12 O 2 HNO 3 C 5 H 8 O 4 (104.2) (63.0) (132.1) Klassifizierung Reaktionstypen und Stoffklassen Oxidation Alkohol,
Säuren und Basen. Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17.
 Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Säuren und Basen Dr. Torsten Beweries AC I - Allgemeine Chemie LAC-CH01 WS 2016/17 torsten.beweries@catalysis.de http://www.catalysis.de/forschung/koordinationschemische-katalyse/koordinationschemische-wasserspaltung/
Versuch 412: Photometrische Bestimmung von Phosphatspuren als "Phosphormolybdänblau"
 Instrumentelle Bestimmungsverfahren 131 Versuch 412: Photometrische Bestimmung von Phosphatspuren als "Phosphormolybdänblau" Phosphationen reagieren mit Molybdat MoO 4 in saurer Lösung zur 2 gelben Dodekamolybdatophosphorsäure
Instrumentelle Bestimmungsverfahren 131 Versuch 412: Photometrische Bestimmung von Phosphatspuren als "Phosphormolybdänblau" Phosphationen reagieren mit Molybdat MoO 4 in saurer Lösung zur 2 gelben Dodekamolybdatophosphorsäure
Nachweis- (NG) und Bestimmungsgrenzen (BG)
 1 Freiheitsgrade Nachweis- (NG) und Bestimmungsgrenzen (BG) - Die Anzahl von Freiheitsgraden hängt vor allem von der Anzahl der verfügbaren Informationen ab (A). (A) f = n-v-m f: Freiheitsgrade n: Anzahl
1 Freiheitsgrade Nachweis- (NG) und Bestimmungsgrenzen (BG) - Die Anzahl von Freiheitsgraden hängt vor allem von der Anzahl der verfügbaren Informationen ab (A). (A) f = n-v-m f: Freiheitsgrade n: Anzahl
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14
 Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
Beispiel 5: Gravimetrie
 Beispiel 5: Gravimetrie Aufgabenstellung Gravimetrische Bestimmung des Bariumgehaltes einer Lösung durch Fällung von Bariumsulfat. Grundlagen Löslichkeit, Löslichkeitsprodukt, Fällungsreaktionen. siehe
Beispiel 5: Gravimetrie Aufgabenstellung Gravimetrische Bestimmung des Bariumgehaltes einer Lösung durch Fällung von Bariumsulfat. Grundlagen Löslichkeit, Löslichkeitsprodukt, Fällungsreaktionen. siehe
Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3
![Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3 Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3](/thumbs/54/34171592.jpg) Kap. 11.5 - Komplexe u. Namen Frage 1 Kap. 11.5 - Komplexe u. Namen Antwort 1 Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3 Kap. 4.2 - Aufbau des PSE Frage
Kap. 11.5 - Komplexe u. Namen Frage 1 Kap. 11.5 - Komplexe u. Namen Antwort 1 Benennen Sie folgende Salze: 1. K 4 [Fe(CN) 6 ] 2. K 3 [AlF 6 ] 3. [Al(OH) 2 (H 2 O) 4 ]NO 3 Kap. 4.2 - Aufbau des PSE Frage
Photometrische Bestimmung von Phosphat in Nahrungsmitteln
 Photometrische Bestimmung von Phosphat in Nahrungsmitteln Grundlagen Die photometrische Bestimmung erfolgt nach der DIN EN 1189, D11-1 beziehungsweise nach dem DVGW W 504- Verfahren Die Vorteile der Vanadat-
Photometrische Bestimmung von Phosphat in Nahrungsmitteln Grundlagen Die photometrische Bestimmung erfolgt nach der DIN EN 1189, D11-1 beziehungsweise nach dem DVGW W 504- Verfahren Die Vorteile der Vanadat-
Chemie. Schwerpunktfach. Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor Sie mit dem Lösen der Aufgaben beginnen.
 Maturitätsprüfung 2006 Klasse 4B + 4AB Gymnasium Muttenz Chemie Schwerpunktfach Name: Vorname: Klasse: Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor Sie mit dem Lösen der Aufgaben beginnen.
Maturitätsprüfung 2006 Klasse 4B + 4AB Gymnasium Muttenz Chemie Schwerpunktfach Name: Vorname: Klasse: Bitte lesen Sie die folgenden Hinweise sorgfältig durch bevor Sie mit dem Lösen der Aufgaben beginnen.
Bradford Reagent, 5x
 GEBRAUCHSANLEITUNG Bradford Reagent, 5x Reagenz für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39222) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 HeidelbergPhone +49-6221-138400, Fax +49-6221-1384010
GEBRAUCHSANLEITUNG Bradford Reagent, 5x Reagenz für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39222) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 HeidelbergPhone +49-6221-138400, Fax +49-6221-1384010
Massenwirkungsgesetz (MWG) und Reaktionskombinationen
 Massenwirkungsgesetz (MWG) und Reaktionskombinationen Das Massenwirkungsgesetz stellt den Zusammenhang zwischen Aktivitäten (bzw. Konzentrationen) der Produkte und der Edukte einer chemischen Reaktion,
Massenwirkungsgesetz (MWG) und Reaktionskombinationen Das Massenwirkungsgesetz stellt den Zusammenhang zwischen Aktivitäten (bzw. Konzentrationen) der Produkte und der Edukte einer chemischen Reaktion,
Michaelis-Menten-Gleichung
 Physikalisch-Chemische Praktika Michaelis-Menten-Gleichung Versuch K4 1 Aufgabe Experimentelle Bestimmung der Kinetik der Zersetzung von Harnsto durch Urease. 2 Grundlagen Im Bereich der Biochemie spielen
Physikalisch-Chemische Praktika Michaelis-Menten-Gleichung Versuch K4 1 Aufgabe Experimentelle Bestimmung der Kinetik der Zersetzung von Harnsto durch Urease. 2 Grundlagen Im Bereich der Biochemie spielen
Gravimetrie und Redoxtitration
 Praktikum 1 Chemie Gravimetrie und Redoxtitration WS 006 /07 Verfasser: David Weibel, Carlo Weingart E-mail: weibeld@student.ethz.ch carlow@student.ethz.ch Datum: 7.1.007 Assistentin: Maha Maglinao Zusammenfassung:
Praktikum 1 Chemie Gravimetrie und Redoxtitration WS 006 /07 Verfasser: David Weibel, Carlo Weingart E-mail: weibeld@student.ethz.ch carlow@student.ethz.ch Datum: 7.1.007 Assistentin: Maha Maglinao Zusammenfassung:
