Alicyclische Verbindungen:
|
|
|
- Markus Müller
- vor 6 Jahren
- Abrufe
Transkript
1 ycloalkane: n n (n =,,,...) Alicyclische Verbindungen: I_folie yclopropan yclobutan yclopentan yclohexan Br Br,-Dibromcyclobutan -hlor--methylcyclopentan Br l l -yclohexyl--methylpentan Bicycloalkane: n n- (n =,,,...) 8 8 Bicyclo[..0]butan Bicyclo[..0]pentan Bicyclo[..]pentan Bicyclo[..]heptan Bicyclo[..]octan Bicyclo[..]octan Bicyclo[..0]octan (Norbornan)
2 Tricycloalkane: n n- (n =, 7, 8,...) I_folie79 8 Tricyclo[...0, ]pentan Tricyclo[...0, ]heptan Tricyclo[...,7 ]decan Adamantan Polycyclen t- 9 t- 9 t- 9 t- 9 Tetrahedran Tetra-t-butyl-tetrahedran Prisman 8 8 uban 0 0 Dodecahedran Platonische Körper
3 I_folie80 ycloalkene Monocyclen yclopenten,-yclopentadien,-yclohexadien,-yclohexadien Bicyclen (Norbornen) Bicyclo[..]hept--en 7 Bicyclo[..]- oct--en Bicyclo[..]- oct--en Bicyclo[..0]- non--en ycloalkine yclooctin yclononin
4 Kohlenstoff-Modifikationen I_folie8 pm 0 pm 9 pm Benzol 9 pm Struktur des Graphits 0 70 pm 0 pm Buckminsterfulleren (Buckminster Fuller Architekt) Entdeckung: Kroto et al. 98 Synthese: Krätschmer et al. 990
5 Synthese von cyclischen Verbindungen ) Synthese von ycloalkanen aus Aromaten (katalytische ydrierung) Beispiele: I_folie8 + Ni, T Druck Benzol yclohexan + Ni, T Druck S - Phenol yclohexanol yclohexen ) yclisierung von α, ω-bifunktionellen acyclischen Vorläufern l l l,-dichlorpropan l l + Zn δ - δ + δ + Znl l δ - yclopropan + Znl ) ycloadditionen a) [+] ycloaddition von arbenen an Alkene (chelotrope eaktion) N N Diazomethan N N T oder hν + N N Methylen +
6 I_folie8
7 I_folie8 Elektronenstruktur von a) Singulett-Methylen 0 zwei gepaarte Elektronen im ybrid-rbital mit antiparallelem Spin b) Triplett-Methylen (Grundzustand, stabiler als der Singulett-Zustand) zwei ungepaarte Elektronen in zwei energetisch gleichen p-rbitalen vergleichbar mit : exp.: Aufspaltung im magnetischen Feld E E E E = 0 E = hν E E MagnetfeldstärkeB B B B B Singulett: keine Aufspaltung im Magnetfeld Dublett: Aufspaltung in zwei Energieniveaus, verursacht durch den Elektronenspin des einsamen Elektrons Triplett: Aufspaltung in drei Energieniveaus, verursacht durch die Spins der beiden ungepaarten Elektronen
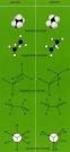
8 eaktivität von Singulett- und Triplett-Methylen a) Singulett-Methylen: stereospezifische cis-addition I_folie8 cis--buten Übergangszustand + cis-,-dimethylcyclopropan trans--buten + trans-,-dimethylcyclopropan b) Triplett-Methylen: stereounspezifische Addition + ) IS ) ingschluss + Diradikal - Zwischenstufe Ausgehend von cis- und trans--buten erhält man jeweils ein Gemisch von cis- und trans-,-dimethylcyclopropan.
9 I_folie8 Spinerhaltungssatz: Bei thermischer oder photochemischer Anregung bleibt der Gesamtspin des Systems erhalten. N N Singulett hν - N IS Triplett + stereospezifisch stereounspezifisch Aus dem Diazomethan im Singulettzustand entsteht nach dem Spinerhaltungssatz Methylen und N jeweils im Singulettzustand. In einer Folgereaktion, dem sogenannten Intersystem rossing (IS) lagert sich das Singulett-Methylen in das thermodynamisch stabilere Triplett-Methylen um. Das Singulett-Methylen reagiert stereospezifisch mit einem Alken während das Triplett-Methylen stereounspezifisch reagiert.
10 I_folie87 Synthese von Triplett-Methylen mittels sensibilisierter Photolyse Sens - Sensibilisator z.b. Benzophenon 0 [Sens] Singulett- Grundzustand hν [Sens] * IS [Sens] * elektronischangeregter Singulett-Zustand elektronisch angeregter Triplett-Zustand S 0 π* n E = hν S T π* π* n n [Sens]* + 0 [ N ] 0 [Sens] + T S 0 S 0 [ N ] * T [ N ]* + 0 N N (Spinerhaltungssatz) T T 0 S 0
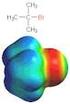
11 Generierung von arbenen mit α-eliminierung I_folie88 α X Y X α β Y arben + X Y α-eliminierung + X Y β-eliminierung Beispiele: I δ - + Zn (u) ZnI δ+ I I Diiodmethan arbenoid IZn I stereospezifischer Methylen-Transfer Simmons-Smith-eaktion l + ( ) K schnell l + K + ( ) hloroform Kalium-tert.-butylat langsam K l l +K l (zweistufige α-eliminierung) l Dichlorcarben (Singulett-Grundzustand) + l l l stereospezifische [+]ycloaddition
12 I_folie89 Dichlorcarben-Erzeugung in l + Na Na l + Na langsam l -Na l l Na schnell + Na ydrolyse von Dichlorcarben Phasentransfer-Katalyse (PT-Phase Transfer atalysis) Phasentransfer-Katalysator: N Q l a) b) c) d) Na Na + Na + Na l l l l + Q l l Q wässrige Phase Phasengrenze organische Phase zu b): Na / l - Doppelschicht l ist an der Phasengrenze "verankert" l + l l Q l
13 I_folie89 Dichlorcarben-Erzeugung in l + Na Na l + Na langsam l -Na l l Na schnell + Na ydrolyse von Dichlorcarben Phasentransfer-Katalyse (PT-Phase Transfer atalysis) Phasentransfer-Katalysator: N Q l a) b) c) d) Na Na + Na + Na l l l l + Q l l Q wässrige Phase Phasengrenze organische Phase zu b): Na / l - Doppelschicht l ist an der Phasengrenze "verankert" l + l l Q l
14 I_folie90 b) [+] ycloadditionen von Alkenen an Alkene: Vierring-Synthesen + hν (oder T) Beispiele: + hν,-yclobutandicarbonsäureanhydrid Ethen Maleinsäureanhydrid + hν -yclobuten-,-dicarbonsäureanhydrid Ethin N + N T N N N N Acrylnitril Diradikal-Zwischenstufe N N,-yclobutandicarbonitril cis-trans-gemisch
15 I_folie9 c) [+] ycloadditionen von konjugierten,-dienen an Alkene oder Alkine Diels-Alder-eaktionen: Sechsring-Synthesen + yclohexen-derivat Dien Alken Dienophil +,-yclohexadien-derivat Beispiele: Alkin Dienophil + aumtemp. cis--yclohexen-,-dicarbonsäureanhydrid,-butadien + Me Me T Dienophil Acetylendicarbonsäure-dimethylester Me Me,-yclohexadien-,-dicarbonsäure-dimethylester
16 I_folie9 Alder sche endo-egel exo-norbornen-,-dicarbonsäureanhydrid endo-norbornen-,-dicarbonsäureanhydrid exo-übergangszustand endo-übergangszustand +,-yclopentadien Dienophil Dimerisierung von,-yclopentadien "endo-dicyclopentadien" T>0 endo-übergangszustand aumtemp. + Dienophil Dien
17 M-Schemata I_folie9 E E LUM E E M E Gewinn: E bindende WW Gewinn: E bindende WW Gewinn: E Verlust: E E > E antibindende WW Frage: + konzertierte [+]-ycloaddition? nein Wechselwirkung der Grenzorbitale: M-LUM (ighest ccupied M Lowest Unoccupied M) ~ Knotenebene: LUM π * Diese WW ist rbitalsymmetrie-verboten M π Frage: konzertierte [+]-ycloaddiotion? ja * M ψ LUM ψ Beide WW sind rbitalsymmetrie-erlaubt. LUM π * M π
18 Stabilität der cyclischen Verbindungen Adolf von Bayer 88: Spannungstheorie Winkelspannung: (Anstieg des Bindungswinkels unter der Annahme von planaren ingstrukturen) I_folie9 n-propan Tetraederwinkel Gruppeninkremente: yclopropan yclobutan yclopentan yclohexan Verbrennungswärme + ¾ kcal/mol (acyclische -Gruppe) inggröße n Verbrennungswärme pro Spannungsenergie E S acyclisch (eferenzsystem): 7. yclopropan. 7. yclobutan.0. yclopentan 8.7. yclohexan 7. 0 ycloheptan yclooctan yclononan yclodecan ycloundecan 8..0 yclododecan 7.. Spannungsenergie E S = n (Verbrennungswärme pro -7.)
19 Nicht-planare Geometrie bei ingverbindungen : äquatorial (e equatorial) : axial (a) Sesselkonformation von yclohexan I_folie9 Torsionsspannung, verursacht durch ekliptische Wechselwirkungen in den planaren Konformationen () n n = 0,,,... Abbau der Torisionsspannung durch nicht-planare Geometrie yclobutan: yclopentan: Briefumschlag ("envelope") albsessel
20 Konformative Isomerisierung im yclohexan I_folie9 a e Br hν - -Br Br a e + Br a Br e a Br e inginversion des yclohexan-sessels E A [kcal/mol] albsessel Wanne.8Å Twist.. Sessel
21 I_folie97 = > = (e) (a) anti-konformation gauche-konformation stabiler weniger stabil a e 9 : G 0 = 7. KJ mol - (.7 kcal mol - ) e a Gebogene Bindungen im yclopropan (oulson und Moffit) ( Bananenbindungen ) starke Bindung durch wirksame Überlappung der Molekülorbitale schwache Bindung durch weniger wirksame Überlappung der Molekülorbitale
22 eaktionen von yclopropan I_folie98 Br I Br Br I,-Dibrompropan -Iodpropan elektrophile Addition /Ni 80 Propan katalytische ydrierung Decalin (Teil des Steroidgerüstes) a trans-bicyclo[..0]decan trans-decalin a starr, nur eine Konformation möglich cis-bicyclo[..0]decan cis-decalin a e e a flexibel, zwei Konformationen möglich
23 Steroide I_folie99 Anreicherung im Gewebe und an den Arterienwänden, mitverantwortlich für Kreislauf- und erzerkrankungen (Gallensäuren) Im Sekretgemisch enthalten, dient im Zwölffingerdarm zur Emulgierung, Verdauung und Absorption von Fetten eins der Nebennierenrindenhormone, dient zur Behandlung rheumatischer Erkrankungen, reguliert Elektrolyt- und Wasserhaushalt. männliches Sexualhormon, verantwortlich für sekundäre männliche Geschlechtsmerkmale (tiefe Stimme, Bartwuchs etc.), wird in den oden produziert. weibliches Sexualhormon, verantwortlich für die sekundären weiblichen Geschlechtsmerkmale, ist an der egulierung des Menstruationscyclus beteiligt. Schwangerschaftshormon, sorgt dafür, daß der Uterus für die Einnistung der befruchteten Eizelle bereit ist. Steroidhormone sind die Wirkstoffe der Pille.
24 Terpene I_folie00 -Methyl-,-butadien (Isopren) Isopren-Einheit in Terpenen (einige enthalten Doppelbindungen) Menthol Pfefferminzöl trans-hrysanthemensäure ( = ) trans-hrysanthemensäureester ( ) natürliches Insektizid (Pyrethrum) Grandisol Pheromon Sexuallockstoff des männlichen Baumwollrüsselkäfers ( ) ampfer ampferbaum β-adinen Wacholder Zeder Monoterpen 0 Sesquiterpen Diterpen 0
Diene: C n H 2n-2 : 2 Doppelbindungen
 Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
hemie für Biologen Vorlesung im WS 2004/05 V2, Mi 10-12, S04 T01 A02 Paul ademacher Institut für Organische hemie der Universität Duisburg-Essen (Teil 8: 01.12.2004) MILESS: hemie für Biologen 142 Nomenklatur
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe
 1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
Prof. Dr. P. Rademacher Organische Chemie IV
 Prof Dr P ademacher rganische hemie IV arbene und itrene 1 Einleitung arbene sind Verbindungen mit zweibindigem Kohlenstoff, der ein Elektronensextett besitzt Einfachstes arben : 2 = thylen Substituierte
Prof Dr P ademacher rganische hemie IV arbene und itrene 1 Einleitung arbene sind Verbindungen mit zweibindigem Kohlenstoff, der ein Elektronensextett besitzt Einfachstes arben : 2 = thylen Substituierte
Eliminierungsreaktionen: E1- und E2- Mechanismen; Olefine
 Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Photochemie von Carbonylverbindungen
 R 1 n π* R 2 otochemie von Carbonylverbindungen 1 R 1 ISC R 2 3 R 1 R 2 folie213 S 0 S 1 T 1 π* n π* n π* n π π π S Grundzustand 0 S 1 1. angeregter Singulett-Zustand T 1 1. angeregter Triplett-Zustand
R 1 n π* R 2 otochemie von Carbonylverbindungen 1 R 1 ISC R 2 3 R 1 R 2 folie213 S 0 S 1 T 1 π* n π* n π* n π π π S Grundzustand 0 S 1 1. angeregter Singulett-Zustand T 1 1. angeregter Triplett-Zustand
Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung. Pflanzenschutz. Organische Synthese.
 OCI_folie1 Proteine DNA, RNA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische Oligo-
OCI_folie1 Proteine DNA, RNA Enzyme polymere Werkstoffe und Materialien Makromoleküle Peptide Nucleotide Supramolekulare Chemie: zwischenmolekulare Wechselwirkungen molekulare Erkennung Synthetische Oligo-
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
Die Welt der Gifte. Bearbeitet von Karsten Strey
 Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Die Welt der Gifte Bearbeitet von Karsten Strey 2., erweiterte und überarbeitete Auflage 2015. Buch. 512 S. Softcover ISBN 978 3 86541 728 2 Format (B x L): 14,9 x 21,1 cm Gewicht: 954 g Weitere Fachgebiete
Vorlesung 20/21. Alkine sind Kohlenwasserstoffe mit einer CC-Dreifachbindung
 Vorlesung 0/1. Alkine sind Kohlenwasserstoffe mit einer -Dreifachbindung Nomenklatur (Vollhardt, 3. Aufl., S. 563-564, 4. Aufl. S. 631-63; art, S. 85-89; Buddrus, S. 87-88) Die längste Kette mit möglichst
Vorlesung 0/1. Alkine sind Kohlenwasserstoffe mit einer -Dreifachbindung Nomenklatur (Vollhardt, 3. Aufl., S. 563-564, 4. Aufl. S. 631-63; art, S. 85-89; Buddrus, S. 87-88) Die längste Kette mit möglichst
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
OP II Seminar. Kapitel 6. Dr. M. Breuning
 PII WS 2009/10 Ih P II Seminar Kapitel 6 Dr. M. Breuning PII WS 2009/10 Ih Kapitel 6: 6: Pericyclische Reaktionen 6.1 Übersicht 6.2 Theoretische Modelle 6.3 Elektrocyclische Umlagerungen 6.4 ycloadditionen
PII WS 2009/10 Ih P II Seminar Kapitel 6 Dr. M. Breuning PII WS 2009/10 Ih Kapitel 6: 6: Pericyclische Reaktionen 6.1 Übersicht 6.2 Theoretische Modelle 6.3 Elektrocyclische Umlagerungen 6.4 ycloadditionen
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2016
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
2 Grundlagen der Photochemie
 folie191 2 Grundlagen der Photochemie 2.1 UV-Vis-Absorptionsspektren in organischen Verbindungen; Jablonski-Diagramm, Franck-Condon-Prinzip, Emissionsspektren (Fluoreszens, Phosphoreszens, Stokes-Verschiebung)
folie191 2 Grundlagen der Photochemie 2.1 UV-Vis-Absorptionsspektren in organischen Verbindungen; Jablonski-Diagramm, Franck-Condon-Prinzip, Emissionsspektren (Fluoreszens, Phosphoreszens, Stokes-Verschiebung)
Umwandlung in substituierte Amide
 Umwandlung in substituierte Amide CI_folie356 R C 3 R C Cl - Cl 2 Carbonsäurechlorid Amid S Cl 3 Sulfonsäurechlorid - Cl S 2 Sulfonamid S Cl Benzolsulfonylchlorid 3 C S Cl Ts Cl p-toluolsulfonylchlorid
Umwandlung in substituierte Amide CI_folie356 R C 3 R C Cl - Cl 2 Carbonsäurechlorid Amid S Cl 3 Sulfonsäurechlorid - Cl S 2 Sulfonamid S Cl Benzolsulfonylchlorid 3 C S Cl Ts Cl p-toluolsulfonylchlorid
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
2.1 Homologe Reihe, Nomenklatur, Konstitution, Konformation CH 2
 Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.)
 Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Vorlesung Organische Chemie II Reaktionsmechanismen (3. Sem.) Gliederung Grundlagen der physikalisch-organischen Chemie Radikalreaktionen Nukleophile und elektrophile Substitution am gesättigten C-Atom
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Spektroskopische Methoden
 Spektroskopische Methoden OCIfolie367 MS - Massenspektroskopie (Bestimmung von Molekulargewichten, charakteristischen Fragmentierungen von Molekülen) Absorptionsspektroskopische Methoden (Absorption =
Spektroskopische Methoden OCIfolie367 MS - Massenspektroskopie (Bestimmung von Molekulargewichten, charakteristischen Fragmentierungen von Molekülen) Absorptionsspektroskopische Methoden (Absorption =
Organische Chemie für MST 3. Lienkamp / Prucker / Rühe
 Organische Chemie für MST 3 Lienkamp / Prucker / Rühe Inhalt 3 Ether Nomenklatur, Herstellung, Reaktionen, Etherperoxide, Epoxide, SU 8 Alkohole Nomenklatur, Eigenschaften, Herstellung, Reaktionen, Oxidations
Organische Chemie für MST 3 Lienkamp / Prucker / Rühe Inhalt 3 Ether Nomenklatur, Herstellung, Reaktionen, Etherperoxide, Epoxide, SU 8 Alkohole Nomenklatur, Eigenschaften, Herstellung, Reaktionen, Oxidations
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
ESR vs. NMR NMR ESR. ESR - Messung. Kernmagneton. 2cm P. m p 1800 µ e = 1800 m p. m e. (Bohr Magneton)
 M-Spektroskopie M ES vs. M M-Spektren von paramagnetischen Verbindungen? M µ e ist 0 3 mal grösser als das Kernmoment µ hν 0 = γ hb 0 µ = e h cm P Kernmagneton longitudinale elaxation wird zu stark (T
M-Spektroskopie M ES vs. M M-Spektren von paramagnetischen Verbindungen? M µ e ist 0 3 mal grösser als das Kernmoment µ hν 0 = γ hb 0 µ = e h cm P Kernmagneton longitudinale elaxation wird zu stark (T
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Organische Stofflehre
 Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Organische hemie hemielaboranten 1-01 Organische Stofflehre 1 Kohlenwasserstoffe Die Kohlenwasserstoffe, abgekärzt KW, sind die einfachsten organischen Verbindungen. Sie bestehen nur aus den Elementen
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
1. Gruppe: Nucleophile Substitution
 1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
Organische Chemie I/II. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
1. Klausur zur Vorlesung. Einführung in die organische Chemie WS 03/04 11.12.2003
 1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
[4+2] Cycloaddition Diels Alder
![[4+2] Cycloaddition Diels Alder [4+2] Cycloaddition Diels Alder](/thumbs/53/32900999.jpg) [4+2] Cycloaddition Diels Alder Additionsreaktion zwischen einem 1,3 Dien und einem Alken (Dienophil). Methode zur Synthese von einfach ungesättigten 6 Ringen. 3 Bindungen werden zu 2 Bindungen und einer
[4+2] Cycloaddition Diels Alder Additionsreaktion zwischen einem 1,3 Dien und einem Alken (Dienophil). Methode zur Synthese von einfach ungesättigten 6 Ringen. 3 Bindungen werden zu 2 Bindungen und einer
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
L.9 Organische Chemie I
 L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1.) Organometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte).
 Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration
 g 4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration a () ϕ ( 2) ϕ ( 2) ϕ ( 1) ψ = ϕ + 1 b a b Heitler-London ( ) ϕ ( 2) + ϕ ( 2) ϕ ( 1) + [ ϕ ( 1) ϕ (
g 4.2.2.Das Wasserstoff-Molekül H 2 Vergleich der Wellenfunktionen für antiparallele Spinkonfiguration a () ϕ ( 2) ϕ ( 2) ϕ ( 1) ψ = ϕ + 1 b a b Heitler-London ( ) ϕ ( 2) + ϕ ( 2) ϕ ( 1) + [ ϕ ( 1) ϕ (
H 3 C 1. 1-Brom-4-methyl-1-penten (nicht: 5-Methyl-3-hexen)
 Alkene und Alkine Merkmal von Salatöl: enthält --Doppelbindungen. Oft werden Alkene durch Eliminierung dargestellt. Umgekehrt kann eine Doppelbindung durch Addition wieder in eine Einfachbindung umgewandelt
Alkene und Alkine Merkmal von Salatöl: enthält --Doppelbindungen. Oft werden Alkene durch Eliminierung dargestellt. Umgekehrt kann eine Doppelbindung durch Addition wieder in eine Einfachbindung umgewandelt
Substituenten-Effekt auf die Orientierung der Zweitsubstituenten Orientierung bei der Toluolsubstitution
 Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Alkane und Cycloalkane
 Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Systematik und Nomenklatur Alkane und ycloalkane einfachstes Alkan: Methan 4 Summenformel Strukturformel schrittweise Verlängerung um eine - 2 - Einheit homologe Reihe rganische hemie I 1 Alkane Gesättigte
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Beuth Hochschule für Technik Berlin, Studiengang Pharma- und Chemietechnik Tutorium Organische Chemie 1 (SS 2011), Tutor: Sascha Behne
 IUPAC-Nomenklatur 1.) Zeichnen Sie die Struktur von: a) 4-(1-Methylethyl)heptan b) 2,3,4,4-Tetramethylhexan c) cis-1,2-dimethylcyclohexan d) 6-Brom-7-(chlormethyl)nonan-2,3-diol e) Isopren f) trans-1,2-diethylcyclopropan
IUPAC-Nomenklatur 1.) Zeichnen Sie die Struktur von: a) 4-(1-Methylethyl)heptan b) 2,3,4,4-Tetramethylhexan c) cis-1,2-dimethylcyclohexan d) 6-Brom-7-(chlormethyl)nonan-2,3-diol e) Isopren f) trans-1,2-diethylcyclopropan
Bindungskonzepte in der. Organischen Chemie. 1.1 Hybridisierung
 O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
O:/Wiley/Organische_Chemie_Aufl_1/3d/c01.3d from 19.07.2012 09:18:28 1 Bindungskonzepte in der 1 Organischen Chemie In diesem Kapitel Die Organische Chemie wird gemeinhin als die Chemie der Kohlenstoffverbindungen
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik
 Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Kapitel 3 Alkene Struktur, Nomenklatur, Reaktivität Thermodynamik und Kinetik 34 Geben Sie die systematischen Namen jeder der folgenden Verbindungen an: Welche der Verbindungen aus Übung besitzen E- und
Klausur - Lösungsbogen
 Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
C. Röhr, Phosphor, WS 09/10. Phosphor Phosphane Phosphide -
 Phosphor Phosphane Phosphide - Inhalt Einleitung Elementmodifikationen Phosphane/Phosphide mit PH/P : P > 1 (Kettenstücke) Phosphane/Phosphide mit PH/P : P = 1 (Ketten und Ringe) Phosphane/Phosphide mit
Phosphor Phosphane Phosphide - Inhalt Einleitung Elementmodifikationen Phosphane/Phosphide mit PH/P : P > 1 (Kettenstücke) Phosphane/Phosphide mit PH/P : P = 1 (Ketten und Ringe) Phosphane/Phosphide mit
Organische Chemie III: Pericyclische Reaktionen, Photochemie, Synthesemethoden WS 2001/2002
 Prof. Dr. P. ademacher rganischechemie3 Version 30.03.2005 rganische Chemie III: Pericyclische eaktionen, otochemie, Synthesemethoden WS 2001/2002 Vorlesung für das 5. Fachsemester, auptstudium DII V2,
Prof. Dr. P. ademacher rganischechemie3 Version 30.03.2005 rganische Chemie III: Pericyclische eaktionen, otochemie, Synthesemethoden WS 2001/2002 Vorlesung für das 5. Fachsemester, auptstudium DII V2,
6 Additionen an Alkene und Alkine
 6 Additionen an Alkene und Alkine Additionen sind die bei weitem wichtigsten eaktionen ungesättigter Verbindungen, wobei man zwischen vier verschiedenen Mechanismen unterscheiden kann. Drei davon verlaufen
6 Additionen an Alkene und Alkine Additionen sind die bei weitem wichtigsten eaktionen ungesättigter Verbindungen, wobei man zwischen vier verschiedenen Mechanismen unterscheiden kann. Drei davon verlaufen
Hinweise zur Zusatzaufgabe Permanentes magnetisches Moment
 1 Hinweise zur Zusatzaufgabe Permanentes magnetisches Moment Zusatzaufgaben zu Versuch 316 : 1. Berechnen Sie das magnetische Moment des Co + - Ions.. Welche Niveaus der Valenzelektronen sind beim Co +
1 Hinweise zur Zusatzaufgabe Permanentes magnetisches Moment Zusatzaufgaben zu Versuch 316 : 1. Berechnen Sie das magnetische Moment des Co + - Ions.. Welche Niveaus der Valenzelektronen sind beim Co +
Aufgaben zu ungesättigten Kohlenwasserstoffen und ihren Reaktionen
 Aufgaben zu ungesättigten Kohlenwasserstoffen und ihren eaktionen wichtige Fachbegriffe: positive und negative induktive Effekte, elektrophile Addition, egel von Markovnikov, Eliminierung, cis-trans-isomerie
Aufgaben zu ungesättigten Kohlenwasserstoffen und ihren eaktionen wichtige Fachbegriffe: positive und negative induktive Effekte, elektrophile Addition, egel von Markovnikov, Eliminierung, cis-trans-isomerie
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. Christoffers, Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 6. Aromaten 6.1 Aromatizität Benzol ist eine Verbindung mit der Summenformel
Prof. Christoffers, Vorlesung rganische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 6. Aromaten 6.1 Aromatizität Benzol ist eine Verbindung mit der Summenformel
INHALTSVERZEICHNIS. 1. Allgemeine Grundlagen 2. Grundbegriffe organisch-chemischer Reaktionen 3. Stereochemie 4. Stoffgruppen
 IALTSVERZEIIS 1. Allgemeine Grundlagen 2. Grundbegriffe organisch-chemischer Reaktionen 3. Stereochemie 4. Stoffgruppen 4.1. Alkane 4.2. Alkene, Alkine 4.3. Aromatische Systeme 4.4. alogenkohlenwasserstoffe
IALTSVERZEIIS 1. Allgemeine Grundlagen 2. Grundbegriffe organisch-chemischer Reaktionen 3. Stereochemie 4. Stoffgruppen 4.1. Alkane 4.2. Alkene, Alkine 4.3. Aromatische Systeme 4.4. alogenkohlenwasserstoffe
Chemie 2. Klausur. Nachname: Vorname: Matrikelnummer: SoSem 2008 ( ) Bei den Multiple-Choice Fragen ist immer nur eine mögliche Antwort
 Chemie 2 Klausur A SoSem 2008 (16.07.2008) Nachname: Vorname: Matrikelnummer: Welche Jahreszulassung? Erreichte Klausur-Punktzahl: Bei den Multiple-Choice Fragen ist immer nur eine mögliche Antwort - und
Chemie 2 Klausur A SoSem 2008 (16.07.2008) Nachname: Vorname: Matrikelnummer: Welche Jahreszulassung? Erreichte Klausur-Punktzahl: Bei den Multiple-Choice Fragen ist immer nur eine mögliche Antwort - und
Organische Chemie III
 1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Übungsblatt 04 - OC I - SoSe 2014 (Prof. Bunz)
 Übungsblatt 04 - C I - SoSe 2014 (Prof. Bunz) 1. Setzen Sie die folgenden Verbindungen jeweils mit 2 und KMn 4 um (gefolgt von einer wässrigen Aufarbeitung) und zeichnen Sie die daraus resultierenden Reaktionsprodukte.
Übungsblatt 04 - C I - SoSe 2014 (Prof. Bunz) 1. Setzen Sie die folgenden Verbindungen jeweils mit 2 und KMn 4 um (gefolgt von einer wässrigen Aufarbeitung) und zeichnen Sie die daraus resultierenden Reaktionsprodukte.
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Tuesday, January 30, 2001 Allgemeine Chemie B II Page: 1 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Moderne Konzepte der phosphororganischen Chemie
 Moderne Konzepte der phosphororganischen Chemie Wahlpflichtvorlesung für Studierende des Studiengangs Chemie-Diplom R. Streubel Institut für Anorganische Chemie http://anorganik.chemie.unibonn.de/akstreubel/streubel_home.html
Moderne Konzepte der phosphororganischen Chemie Wahlpflichtvorlesung für Studierende des Studiengangs Chemie-Diplom R. Streubel Institut für Anorganische Chemie http://anorganik.chemie.unibonn.de/akstreubel/streubel_home.html
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
Vinyl-Polymerisation (Vollhardt, 3. Aufl., S , 4. Aufl. S ; Hart, S , S )
 Vorlesung 23. Polyolefine Vinyl-Polymerisation (Vollhardt, 3. Aufl., S. 532-538, 4. Aufl. S. 599-605; art, S. 116-118, S. 497-507) Thermodynamik: Die π-bindung der Alkene ist um etwa 80 kj mol 1 schwächer
Vorlesung 23. Polyolefine Vinyl-Polymerisation (Vollhardt, 3. Aufl., S. 532-538, 4. Aufl. S. 599-605; art, S. 116-118, S. 497-507) Thermodynamik: Die π-bindung der Alkene ist um etwa 80 kj mol 1 schwächer
Stoffklasse Alkane Alkene/Alkine Aromaten
 Stoffklasse Alkane Alkene/Alkine Aromaten funktionelle Gruppe Bezeichnung Einfachbindung Doppel-/Dreifachbindung aromatisches System Präfix Alkyl- Alkenyl/Alkinyl- Phenyl- Suffix -alkan -en/-in -Benzol
Stoffklasse Alkane Alkene/Alkine Aromaten funktionelle Gruppe Bezeichnung Einfachbindung Doppel-/Dreifachbindung aromatisches System Präfix Alkyl- Alkenyl/Alkinyl- Phenyl- Suffix -alkan -en/-in -Benzol
5.3. Homodesmische Reaktionen (wird nicht geprüft)
 5.3. Homodesmische Reaktionen (wird nicht geprüft) Es wird oft beobachtet, dass einige Moleküle stabiler bzw. unstabiler als Verbindungen ähnlicher Struktur sind. Z. B. ist Benzol sehr viel stabiler als
5.3. Homodesmische Reaktionen (wird nicht geprüft) Es wird oft beobachtet, dass einige Moleküle stabiler bzw. unstabiler als Verbindungen ähnlicher Struktur sind. Z. B. ist Benzol sehr viel stabiler als
Inhaltsverzeichnis zu Kapitel 2. Alkane
 Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Inhaltsverzeichnis zu Kapitel 2. Alkane 2. Alkane 2.1. Valenzstrichformel, omologe Reihe, Nomenklatur, Konstitution, 22 Konformation 2.1.1. Valenzstrichformel 22 2.1.2. omologe Reihe 23 2.1.3. Konstitutionsisomere
Illustration des Crack-Prozesses am Beispiel der Pentan-Pyrolyse
 Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Vorlesung 9. Erdölverarbeitung. (Vollhardt, 3. Aufl., S. 92-95, 4. Aufl., S. 108-111; art, S. 127-129; Buddrus, S.87-88) Nach Entfernung von Wasser, Feststoffen und Erdgas (Erhitzen) erfolgt eine fraktionierte
Orbitalmodell SPF BCH am
 Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
3. Bindungsverhältnisse in organischen Molekülen:
 3. Bindungsverhältnisse in organischen Molekülen: Der Begriff hemische Bindung umschreibt den Tatbestand einer starken Anziehungskraft zwischen 2 Atomen Interatomare Anziehungskräfte (chemische Bindungen)
3. Bindungsverhältnisse in organischen Molekülen: Der Begriff hemische Bindung umschreibt den Tatbestand einer starken Anziehungskraft zwischen 2 Atomen Interatomare Anziehungskräfte (chemische Bindungen)
13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität
 13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Edelgas-polarisierte. NMR- Spektroskopie. Jonas Möllmann Jan Mehlich. SoSe 2005
 Edelgas-polarisierte NMR- Spektroskopie Jonas Möllmann Jan Mehlich SoSe 2005 NMR Prinzip Aufspaltung der Kernspins in verschiedene Niveaus durch angelegtes Magnetfeld Messung des Besetzungs- unterschiedes
Edelgas-polarisierte NMR- Spektroskopie Jonas Möllmann Jan Mehlich SoSe 2005 NMR Prinzip Aufspaltung der Kernspins in verschiedene Niveaus durch angelegtes Magnetfeld Messung des Besetzungs- unterschiedes
Kapitel 5: Additionen an C-C- Mehrfachbindungen
 Kapitel 5: Additionen an C-C- hrfachbindungen» Theorie, Konzepte, chanismus - MO Theorie: elektrophile Addition (Brom/Olefin) und [2+4]- Cycloaddition (Diels-Alder-Reaktion) - Bromierung der Doppelbindung:
Kapitel 5: Additionen an C-C- hrfachbindungen» Theorie, Konzepte, chanismus - MO Theorie: elektrophile Addition (Brom/Olefin) und [2+4]- Cycloaddition (Diels-Alder-Reaktion) - Bromierung der Doppelbindung:
Organische Chemie 2. Skript. zur. Vorlesung. Wintersemester 2010/2011. Prof. H. Mayr
 Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
Vorlesung Allgemeine Chemie Teil 3: Grundlagen der Organischen Chemie
 Vorlesung Allgemeine hemie Teil 3: Grundlagen der rganischen hemie Einführung Was ist rganische hemie Kohlenstoff und Wasserstoff machen bevorzugt kovalente (nicht ionische) Bindungen Kohlenstoff macht
Vorlesung Allgemeine hemie Teil 3: Grundlagen der rganischen hemie Einführung Was ist rganische hemie Kohlenstoff und Wasserstoff machen bevorzugt kovalente (nicht ionische) Bindungen Kohlenstoff macht
Übungsklausur zur Vorlesung Organische Chemie für Biologen im Sommersemester am
 Übungsklausur zur Vorlesung Organische Chemie für Biologen im Sommersemester 2014 am 18.06.2014 Name: Matrikelnummer: Studiengang: Unterschrift: Aufgabe 1 2 3 4 5 6 7 8 9 10 Gesamt max. Punktzahl 10 10
Übungsklausur zur Vorlesung Organische Chemie für Biologen im Sommersemester 2014 am 18.06.2014 Name: Matrikelnummer: Studiengang: Unterschrift: Aufgabe 1 2 3 4 5 6 7 8 9 10 Gesamt max. Punktzahl 10 10
NMR Spektroskopie I = 0 : C, 16 O (sogenannte gg-kerne haben immer I=0!) I = 1/2: 1 H, 13 C, 15 N, 19 F, 31 P,... I = 1: 2. H=D, 6 Li, 14 N I = 3/2: 7
 NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
NMR Spektroskopie folie00 Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
LMPG 2, ÜB21, Molekülbau & UV/VIS-Absorption LÖSUNG 1 von 11
 LMPG 2, ÜB21, Molekülbau & UV/VISAbsorption LÖSUG 1 von 11 Übung 1: Charakterisierung von Absorptionsbanden Veränderungen der Molekülstruktur können zu Verschiebungen der einzelnen Absorptionsbanden im
LMPG 2, ÜB21, Molekülbau & UV/VISAbsorption LÖSUG 1 von 11 Übung 1: Charakterisierung von Absorptionsbanden Veränderungen der Molekülstruktur können zu Verschiebungen der einzelnen Absorptionsbanden im
Methoden-Kurs - Teil IR-Spektroskopie. Anwendungen der IR-Spektroskopie
 Methoden-Kurs - Teil I-Spektroskopie Dr. Markus berthür Fachbereich Chemie, Uni Marburg aum 6217 oberthuer@chemie.uni-marburg.de Anwendungen der I-Spektroskopie Strukturaufklärung von organischen Molekülen
Methoden-Kurs - Teil I-Spektroskopie Dr. Markus berthür Fachbereich Chemie, Uni Marburg aum 6217 oberthuer@chemie.uni-marburg.de Anwendungen der I-Spektroskopie Strukturaufklärung von organischen Molekülen
3. FACHSEMESTER Organische Chemie Sommersemester 2008
 3. FASEMESTER rganische hemie Sommersemester 2008 Multiple-choice-Klausur S T E R E E M I E Datum: 26. Mai 2008 AME: (leserlich) UTERSRIFT: (Mit meiner Unterschrift erkläre ich mich prüfungsfähig das erste
3. FASEMESTER rganische hemie Sommersemester 2008 Multiple-choice-Klausur S T E R E E M I E Datum: 26. Mai 2008 AME: (leserlich) UTERSRIFT: (Mit meiner Unterschrift erkläre ich mich prüfungsfähig das erste
Klausur Grundvorlesung Testat vom Seite 1 von 1 Punkte
 Klausur Grundvorlesung Testat vom 16.6.2004 Seite 1 von 1 Punkte Matrikelnummer: Name: Vorname: Bitte eintragen Fachsemester: Fachrichtung: Bitte ankreuzen: Chemie Biologie Biotechnologie Pharmazie Bitte
Klausur Grundvorlesung Testat vom 16.6.2004 Seite 1 von 1 Punkte Matrikelnummer: Name: Vorname: Bitte eintragen Fachsemester: Fachrichtung: Bitte ankreuzen: Chemie Biologie Biotechnologie Pharmazie Bitte
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Geänderter Termin zur Nachholklausur: 11.April, Uhr, H46. Klausur zur Vorlesung OCII Reaktionsmechanismen WS 2007/2008.
 liver eiser, Institut für rganische Chemie der Universität egensburg Geänderter Termin zur Nachholklausur: 11.April, 10-12 Uhr, 46 Klausur zur Vorlesung CII eaktionsmechanismen W 2007/2008 Lösungsblatt
liver eiser, Institut für rganische Chemie der Universität egensburg Geänderter Termin zur Nachholklausur: 11.April, 10-12 Uhr, 46 Klausur zur Vorlesung CII eaktionsmechanismen W 2007/2008 Lösungsblatt
Grundlagen der organischen Chemie
 H. Kaufmann А. Hädener Grundlagen der organischen Chemie 10., vollständig neu überarbeitete und erweiterte Auflage Birkhäuser Verlag Basel Boston Berlin г 1.1 Definition der organischen Chemie 1 1.2 Unterschiede
H. Kaufmann А. Hädener Grundlagen der organischen Chemie 10., vollständig neu überarbeitete und erweiterte Auflage Birkhäuser Verlag Basel Boston Berlin г 1.1 Definition der organischen Chemie 1 1.2 Unterschiede
 =!'04 #>4 )-:!- / )) $!# & $ % # %)6 ) + # 6 0 %% )90 % 1% $ 9116 69)" %" :"6. 1-0 &6 -% ' 0' )%1 0(,"'% #6 0 )90 1-11 ) 9 #,0. 1 #% 0 9 & %) ) '' #' ) 0 # %6 ;+'' 0 6%((&0 6?9 ;+'' 0 9)&6? #' 1 0 +& $
=!'04 #>4 )-:!- / )) $!# & $ % # %)6 ) + # 6 0 %% )90 % 1% $ 9116 69)" %" :"6. 1-0 &6 -% ' 0' )%1 0(,"'% #6 0 )90 1-11 ) 9 #,0. 1 #% 0 9 & %) ) '' #' ) 0 # %6 ;+'' 0 6%((&0 6?9 ;+'' 0 9)&6? #' 1 0 +& $
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1
 Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
H 3 C. alphabetische Reihenfolge! kleinerer Ring wird zum Rest
 ycloalkane Kohlenwasserstoffe, die einfach geundene -Atome in ringförmiger Anordnung enthalten, werden als ycloalkane, cyclische Alkane oder arocyclen ezeichnet. Die Mehrzahl aller organischer Verindungen
ycloalkane Kohlenwasserstoffe, die einfach geundene -Atome in ringförmiger Anordnung enthalten, werden als ycloalkane, cyclische Alkane oder arocyclen ezeichnet. Die Mehrzahl aller organischer Verindungen
1. Übungsblatt Radikale
 Prof. Dr. liver Reiser Institut für rganische Chemie Universität Regensburg 1. Übungsblatt Radikale Aufgabe 1: Mittels radikalischer Chlorierung oder omierung können Alkylhalogenie aus Alkanen effektiv
Prof. Dr. liver Reiser Institut für rganische Chemie Universität Regensburg 1. Übungsblatt Radikale Aufgabe 1: Mittels radikalischer Chlorierung oder omierung können Alkylhalogenie aus Alkanen effektiv
Die Verwendung von Rot- und Bleistift sowie Tipp-Ex ist untersagt!!!
 Chemisches Praktikum für Studierende der Biologie (Bachelor) Universität zu Köln Department für Chemie Prof. Dr. A. G. Griesbeck Prof. Dr. H.-G. Schmalz Dipl.-Chem. Anna Falk Greinstr. 4 50939 Köln Modul:
Chemisches Praktikum für Studierende der Biologie (Bachelor) Universität zu Köln Department für Chemie Prof. Dr. A. G. Griesbeck Prof. Dr. H.-G. Schmalz Dipl.-Chem. Anna Falk Greinstr. 4 50939 Köln Modul:
Inhaltsverzeichnis zu Kapitel 3. Alkene
 Inhaltsverzeichnis zu Kapitel 3. Alkene 3. Alkene 3.1 Nomenklatur, Konfiguration 37 3.1.1 Nomenklatur 37 3.1.2 Konfiguration 37 3.2 Darstellung 38 3.2.1 Petrochemie 38 3.2.2 ydrierung von Alkinen 38 3.2.3
Inhaltsverzeichnis zu Kapitel 3. Alkene 3. Alkene 3.1 Nomenklatur, Konfiguration 37 3.1.1 Nomenklatur 37 3.1.2 Konfiguration 37 3.2 Darstellung 38 3.2.1 Petrochemie 38 3.2.2 ydrierung von Alkinen 38 3.2.3
Atommodell. Atommodell. Atommodell. Atommodell. Magnetquantenzahl: m l Orientierung von l im Magnetfeld. Spinquantenzahl: s = S
 π µ e E = Z n R = n Bor-Sommerfeld:. Postulat: Bandreimpuls des e - at diskrete Werte U = n n = Hauptquantenal: n =,,, π = Planck sces Wirkungsquantum µ = red. Masse des e - U = Umlaufban n a R = Rdberg-Konstante
π µ e E = Z n R = n Bor-Sommerfeld:. Postulat: Bandreimpuls des e - at diskrete Werte U = n n = Hauptquantenal: n =,,, π = Planck sces Wirkungsquantum µ = red. Masse des e - U = Umlaufban n a R = Rdberg-Konstante
Übungsbeispiele Kapitel Organische Verbindungen
 Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen
 Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
Inhalt Index 2. Organische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle Gruppen Es gibt heute ungefähr neun Millionen bekannter organischer
6. Die Chemische Bindung
 6. Die Chemische Bindung Hauptbindungsarten Kovalente Bindung Ionenbindung Metallische Bindung Nebenbindungsarten Van der Waals Wechselwirkung Wasserstoffbrückenbindung Metalle www.webelements.com Eigenschaften
6. Die Chemische Bindung Hauptbindungsarten Kovalente Bindung Ionenbindung Metallische Bindung Nebenbindungsarten Van der Waals Wechselwirkung Wasserstoffbrückenbindung Metalle www.webelements.com Eigenschaften
4 Additionen an CC-Mehrfachbindungen
 4 Additionen n -Mehrfchindungen Thermodynmische Aspekte der Additionsrektionen n Ethylen Mittlere Bindungsenergien (hängig von der Art der Alkylreste): : 345 kj mol 1 =: 610 kj mol 1 : 837 kj mol 1 610
4 Additionen n -Mehrfchindungen Thermodynmische Aspekte der Additionsrektionen n Ethylen Mittlere Bindungsenergien (hängig von der Art der Alkylreste): : 345 kj mol 1 =: 610 kj mol 1 : 837 kj mol 1 610
Literatur. Organische Chemie - Chemie der Kohlenstoffverbindungen
 Literatur Breitmeier, Jung: rganische hemie (Thieme) art, raine, art: rganische hemie (Wiley-V) Vollhardt: rganische hemie (Wiley-V) Weiterführend: rganikum (Wiley-V) Brückner eaktionsmechanismen (Spektrum)
Literatur Breitmeier, Jung: rganische hemie (Thieme) art, raine, art: rganische hemie (Wiley-V) Vollhardt: rganische hemie (Wiley-V) Weiterführend: rganikum (Wiley-V) Brückner eaktionsmechanismen (Spektrum)
