Beiträge zur Gesundheitsökonomie und Versorgungsforschung (Band 12) Prof. Dr. h.c. Herbert Rebscher (Herausgeber) AMNOG-Report 2016
|
|
|
- Susanne Fried
- vor 6 Jahren
- Abrufe
Transkript
1 Beiträge zur Gesundheitsökonomie und Versorgungsforschung (Band 12) Prof. Dr. h.c. Herbert Rebscher (Herausgeber) AMNOG-Report 216
2
3 Beiträge zur Gesundheitsökonomie und Versorgungsforschung (Band 12) AMNOG-Report 216 Nutzenbewertung von Arzneimitteln in Deutschland. Herausgeber: Prof. Dr. h.c. Herbert Rebscher, Vorsitzender des Vorstands der DAK-Gesundheit DAK-Gesundheit, Nagelsweg 27-31, D-297 Hamburg Autoren: Prof. Dr. Wolfgang Greiner, Julian Witte (M.Sc.) Gastautoren: Nadine Fröhlich, Dr. Antje Haas, Prof. Dr. Dieter Paar, Dr. Tania Schink, Gerhard Schulte, Dr. Anja Tebinka-Olbrich Unter Mitarbeit von: Dr. Cordula Riederer, Dr. Melanie Harling Redaktion: Martin Kordt DAK-Gesundheit Nagelsweg 27-31, D-297 Hamburg Bielefeld und Hamburg Januar 216
4 Bibliografische Informationen der Deutschen Nationalbibliothek Die Deutsche Nationalbibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über abrufbar. 216 medhochzwei Verlag GmbH, Heidelberg ISBN Dieses Werk, einschließlich aller seiner Teile, ist urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechtsgesetzes ist ohne Zustimmung des Verlages unzulässig und strafbar. Dies gilt insbesondere für Vervielfältigungen, Übersetzungen, Mikroverfilmungen und die Einspeicherung und Verarbeitung in elektronischen Systemen. Druck: M.P. Media-Print Informationstechnologie GmbH, Paderborn Printed in Germany
5 V Vorwort Seit Inkrafttreten des Gesetzes zur Neuordnung des Arzneimittelmarktes (AMNOG) werden in Deutschland alle Arzneimittel mit neuen Wirkstoffen einer frühen Nutzenbewertung unterzogen. Das Ziel: Die Arzneimittelausgaben der gesetzlichen Krankenkassen sollen eingedämmt werden. Nach fünf Jahren und 134 abgeschlossenen Bewertungen hat sich das Verfahren in weiten Teilen eingespielt. Größter Gewinn der frühen Nutzenbewertung ist die höhere Transparenz um die Wirksamkeit neuer Arzneimittel. Auch die Diskussion um die versorgungswirksame Anwendung von Methoden der evidenzbasierten Medizin hat durch das AMNOG einen dringend benötigten Schub bekommen. Die zuletzt noch einmal vom Gemeinsamen Bundesausschuss betonte aktive Beteiligung der wissenschaftlichen Fachgesellschaften am Verfahrensdiskurs trägt zudem zu einer Verstetigung des fachlichen Austausches aller beteiligten Parteien über Stärken und Schwächen sowie den aktuellen Korrekturbedarf bei. Die Nutzenbewertung führt jedoch zwangsläufig zu interessengeleiteten Kontroversen. Auf der Reformagenda stehen zum Beispiel der Umgang mit Herstellern, die Nutzendossiers nicht einreichen oder die Bewertung von Präparaten aus dem Bestandsmarkt, wenn diese ein neues Anwendungsgebiet erhalten. Am dringlichsten scheint jedoch die Klarstellung von zwei Fragen: Sollen pharmazeutische Unternehmen weiterhin die Möglichkeit haben, den Preis für die ersten zwölf Vertriebsmonate frei festzulegen? Und inwiefern schützt ein im Anschluss an die Nutzenbewertung verhandelter Rabatt den verordnenden Arzt vor Regressen? Mit dem AMNOG-Report möchten wir einen fachlich objektiven Beitrag zu der Weiterentwicklung des Verfahrens leisten. Dazu führen wir zu allen zentralen Fragen rund um die frühe Nutzenbewertung aktuelle Diskussionslinien zusammen und zeigen gezielt Änderungspotentiale auf. Die Resonanz auf den ersten Report war trotz zum Teil kontroversem Inhalt sehr positiv. Heute sind noch mehr Verfahren abgeschlossen, so dass wir den Zusammenhang von Nutzenbewertung und Verordnungsverhalten der Ärzte noch belastbarer analysieren können. Im Fokus dieser Ausgabe stehen die Verfahren, bei denen es nach Abschluss der Nutzenbewertung keine Einigung über die Höhe des Erstattungsbetrags zwischen pharmazeutischem Unternehmer und GKV-Spitzenverband gegeben hat. Hier greift die Schiedsstelle ein und entscheidet stellvertretend über die Höhe des Preises. Besonders häufig kommt dies vor, wenn der Gemeinsame Bundesausschuss zuvor keinen Zusatznutzen feststellen konnte. Wir freuen uns, dass Vertreter aller drei am Schiedsverfahren beteiligten Parteien der GKV-Spitzenverband, ein Hersteller und die Schieds-
6 VI Vorwort stelle selbst ihre Erfahrungen zum Schiedsverfahren in Gastbeiträgen darstellen und diskutieren. Wir hoffen, so einen substantiellen Beitrag zur Weiterentwicklung dieses wichtigen Verfahrensbestandteiles leisten zu können. Die auf den Versichertendaten der DAK-Gesundheit basierenden versorgungsbezogenen Analysen konzentrieren sich in diesem Jahr auf die Verordnung von Wirkstoffen ohne Zusatznutzen. Bisher hatten die Ergebnisse der Nutzenbewertung kaum nachhaltigen Einfluss auf die Verschreibungspraxis. Forscher des Bremer Leibniz- Instituts für Präventionsforschung und Epidemiologie gehen in einem Gastbeitrag am Beispiel des Wirkstoffes Aclidiniumbromid der Frage nach, inwiefern die Verordnung eines Arzneimittels ohne Zusatznutzen im Vergleich zu seiner zweckmäßigen Vergleichstherapie durch patientenbezogene Faktoren beeinflusst wird. Darüber hinaus bieten heute viele Verfahren Interpretationsspielräume bei Subgruppen und Mischpreisen, bei denen strittig ist, wann eine Verordnung im Sinne des Sozialgesetzbuches wirtschaftlich ist. Um abzuschätzen, inwiefern diese Unsicherheit Einfluss auf die Patientenversorgung hat, haben wir niedergelassene Ärztinnen und Ärzte sowie die kassenärztlichen Vereinigungen um ihre Erfahrungen und Einschätzungen gebeten. Mit Abschluss des Pharma-Dialogs steht uns 216 eines der vermutlich spannendsten AMNOG-Jahre bevor. Es ist davon auszugehen, dass eine Vielzahl der aktuellen Diskussionsfelder der Nutzenbewertung auch auf die politische Agenda kommen. Wir hoffen deshalb auf breites Interesse an den vorliegenden Ergebnissen und freuen uns auch zukünftig auf spannende Diskussionen. Prof. Dr. Wolfgang Greiner, Prof. Dr. h.c. Herbert Rebscher Bielefeld und Hamburg, den
7 VII Inhaltsverzeichnis Vorwort... V Inhaltsverzeichnis... VII Glossar... X Abkürzungsverzeichnis... XII Executive Summary... XIV I Ergebnisse aus dem Verfahren 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 Ablauf der frühen Nutzenbewertung Veränderung methodischer, politischer und rechtlicher Rahmenbedingungen Literatur Abgeschlossene Verfahren der frühen Nutzenbewertung Nutzenbewertungsverfahren Ergebnisse der frühen Nutzenbewertung Abweichungen in der Zusatznutzenbewertung Literatur Verfahrensfragen Zweckmäßige Vergleichstherapien Subgruppen Endpunkte Indirekte Vergleiche Re-Evaluationen und Befristungskriterien Literatur Ergebnisse der Erstattungsbetragsverhandlungen Übersicht der Nutzenbewertungsrabatte Übersicht der Marktrücknahmen
8 VIII Inhaltsverzeichnis 4.3 Erstattungsbetrag als Mischkalkulation Literatur Ergebnisse der Schiedsverfahren AMNOG-Schiedsstelle Quo vadis? Vier Jahre AMNOG-Schiedsstelle ein kritischer Überblick Ein Gastbeitrag von Gerhard Schulte Stellvertretender Vorsitzender der Schiedsstelle AMNOG 5.3 Die Schiedsstelle nach 13b Abs. 1 SGB V Eine Bilanz nach vier Jahren Spruchpraxis Ein Gastbeitrag von Dr. Antje Haas und Dr. Anja Tebinka- Olbrich Abteilung für Arznei- und Heilmittel, GKV-Spitzenverband 5.4 Schlichtung nach einem gescheiterten AMNOG- Verfahren. Ein Plädoyer für eine Schiedsstelle Ein Gastbeitrag von Prof. Dr. med. W. Dieter Paar Medizinische Abteilung, Sanofi-Aventis Deutschland GmbH, Berlin-Frankfurt 5.5 Literatur II Ergebnisse aus der Versorgung 6 Umsetzung des AMNOG in der Verordnungspraxis Methodik Effekte der Arzneimittelbewertung auf die Marktdurchdringung Verordnungsentwicklung nutzenbewerteter Wirkstoffe ohne Zusatznutzen Prädiktoren für Verordnungen von Wirkstoffen ohne Zusatznutzen Ein Gastbeitrag von Nadine Fröhlich und Dr. Tania Schink, Leibniz-Institut für Präventionsforschung und Epidemiologie BIPS-GmbH, Bremen 6.5 Literatur
9 Inhaltsverzeichnis IX 7 Rückwirkung des 13b-Rabattes 7.1 Die freie Preisbildung in der Kritik Rationale für eine Stärkung der Kosten-Nutzen- Bewertung Literatur III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene Augenerkrankungen Hauterkrankungen Herz-Kreislauf-Erkrankungen Infektionskrankheiten Krankheiten des Atmungssystems Krankheiten des Muskel-Skelett-Systems Krankheiten des Nervensystems Krankheiten des Urogenitalsystems Krankheiten des Verdauuungssystems Hämatologie und Onkologie Psychische Erkrankungen Sonstige Erkrankungen Stoffwechselkrankheiten Anhang Autoren Gastautoren... 33
10 X Glossar AMNOG Budget Impact Erstattungsbetrag Frühe Nutzenbewertung Indirekter Vergleich Neues Anwendungsgebiet Off Label Die frühe Nutzenbewertung ist Kern des Gesetzes zur Neuordnung des Arzneimittelmarktes (AMNOG). Der Gemeinsame Bundesausschuss (G-BA) bewertet innerhalb von drei Monaten nach Marktzulassung eines Arzneimittels, ob es einen Zusatznutzen gegenüber einer zweckmäßigen Vergleichstherapie aufweist. Sechs Monate nach Marktzulassung trifft der G-BA einen Beschluss auf Basis der Nutzenbewertung und Stellungnahmen von Unternehmen, Verbänden und Sachverständigen. Stellt er einen Zusatznutzen fest, beginnen Verhandlungen über den Erstattungspreis. Medikamente, bei denen der G-BA keinen Zusatznutzen feststellt, werden in das Festbetragssystem eingruppiert. Wenn das nicht möglich ist, wird ein Erstattungsbetrag vereinbart, bei dem die Jahrestherapiekosten nicht höher sein dürfen als die der zweckmäßigen Vergleichstherapie. Anhand von Budget Impact Modellen kann die Finanzierbarkeit einer Intervention, einer neuen Therapie o- der eines Medikaments eingeschätzt werden. Durch diese Analyse über die zu erwartenden Kosten neuer Arzneimittel für die Kostenträger wird eine bessere Planbarkeit der zukünftigen Ausgaben ermöglicht. Abgabepreis des pharmazeutischen Unternehmers abzüglich des Nutzenbewertungsrabattes nach 13b Verpflichtung des G-BA, für alle neu zugelassenen Arzneimittel mit neuen Wirkstoffen eine Zusatznutzenbewertung unverzüglich nach der Markteinführung nach 35a SGB V durchzuführen. Wenn im Rahmen der frühen Nutzenbewertung kein direkter Vergleich zwischen dem neuen Wirkstoff und der durch den G-BA festgelegten zweckmäßigen Vergleichstherapie möglich ist, wird bei Vorliegen eines dritten gemeinsamen Komparators ein indirekter Vergleich durchgeführt. Die zwei daraus resultierenden Studien werden dabei so in Beziehung gesetzt, dass die Wirkung zwischen den ursprünglichen Wirkstoffen abgeleitet werden kann. Wenn Arzneimittel ein neues Anwendungsgebiet erhalten, erfolgt ebenfalls eine Nutzenbewertung nach 35a SGB V. Zulassungsüberschreitender Einsatz eines Arzneimittels außerhalb der von den nationalen und europäischen Zulassungsbehörden genehmigten Anwendungsgebiete. Um einen Off-Label-Use als GKV-Leistung zu ermöglichen, beurteilt das Bundesministerium für Gesundheit mit Expertengruppen nach 35c Abs.1
11 Glossar XI Opt-Out Ein pharmazeutischer Unternehmer macht Gebrauch von 4 Abs. 7 der RahmenV nach 13b Abs. 9 SGB V und zieht innerhalb von vier Wochen nach G-BA-Beschluss sein Arzneimittel aus dem Markt zurück. Rahmenvereinbarung Regress Saldierung Slicing (Orphanisierung) SGB V die Einsatzmöglichkeiten des entsprechenden Arzneimittels im Auftrag des G-BA. Die Maßstäbe für Vereinbarungen über Erstattungsbeträge für neue, nicht festbetragsfähige Arzneimittel werden gem 13b Abs. 9 SGB V in einer Rahmenvereinbarung zwischen dem GKV-Spitzenverband und den für die Wahrnehmung der wirtschaftlichen Interessen gebildeten maßgeblichen Spitzenorganisationen der pharmazeutischen Unternehmer auf Bundesebene geregelt. Strafzahlung, die bei einer signifikanten Überschreitung des festgelegten Arznei-, Hilfs- oder Heilmittelbudgets im Vergleich zum Fachgruppendurchschnitt von einer Prüfungskommission angefordert werden kann. Summierung von Nutzen- und Schadensaspekten einer Intervention. Ergebnisse mit unterschiedlichen Effektrichtungen und in unterschiedlichen Kategorien wie Überleben, Morbidität, Lebensqualität und unerwünschte Wirkungen zu einem Gesamtergebnis saldiert werden. Der G-BA führt eine Saldierung gegenwärtig im Rahmen der jeweiligen Einzelfallentscheidung durch. Aufteilung einer Zielpopulation einer Intervention in mehrere Subgruppen nach Abschluss einer Studie.
12 XII Abkürzungsverzeichnis ABDA AKdÄ 3. AMG- ÄndG AMNOG AM-NutzenV AM-RL ApU AV AVR AWG AWMF BAH BfArM BMG BPI BSC BSG CFQ-R COPD DAV DDD DGfE Dggö e.v. DGHO DIMDI DMP EBM EMA EPAR FDA G-BA GePaRD Bundesvereinigung Deutscher Apothekerverbände Arzneimittelkommission der deutschen Ärzteschaft Drittes Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften Arzneimittelmarktneuordnungsgesetz Verordnung über die Nutzenbewertung von Arzneimitteln nach 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach 13b SGB V Arzneimittel-Richtlinie Netto-Herstellerabgabepreis außer Vertrieb Arzneiverordnungs-Report Anwendungsgebiet Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften Bundesverband der Arzneimittel-Hersteller e.v. Bundesinstitut für Arzneimittel und Medizinprodukte Bundesministerium für Gesundheit Bundesverband der Pharmazeutischen Industrie e.v. Best Supportive Care Bundessozialgericht Cystic Fibrosis Questionnaire-Revised Chronic Obstructive Pulmonary Disease Deutscher Apothekerverband Defined daily dose; definierte Tagesdosen Deutsche Gesellschaft für Epileptologie Deutsche Gesellschaft für Gesundheitsökonomie Deutsche Gesellschaft für Hämatologie und Onkologie e.v. Deutsches Institut für Medizinische Dokumentation und Information Disease Management Programm Evidenzbasierte Medizin European Medicines Agency European public assessment reports Food and Drug Administration Gemeinsamer Bundesausschuss German Pharmacoepidemiological Research Database
13 Abkürzungsverzeichnis XIII GKV GKV-SV GKV-VSG HTA IQWiG JTK KBV KV LSG MID Morbi-RSA MS OTC PAS PEI PKV PUMA PVS PZN QALYs RahmenV RCT SGB V SGB X Spitzenverband der Krankenkassen GKV-Versorgungsstärkungsgesetz Health Technology Assessment Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen Jahrestherapiekosten Kassenärztliche Bundesvereinigung Kassenärztliche Vereinigung Landessozialgericht Minimal important difference morbiditätsorientierten Risikostrukturausgleich Multiple Sklerose Over the counter Patient Access Scheme Paul-Ehrlich-Institut Private Krankenversicherung Paediatric-use marketing authorisation Praxisinformationssysteme Pharmazentralnummer quality adjusted life years Rahmenvereinbarung nach 13b Abs. 9 SGB V Randomized controlled trial; randomisierte kontrollierte Studie Sozialgesetzbuch, Gesetzliche Krankenversicherung Sozialgesetzbuch, Sozialverwaltungsverfahren und Sozialdatenschutz SVR-Gesundheit VAD VerfO Vfa zvt Gesetzliche Krankenversicherung Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen Verband der Arzneimittelimporteure Deutschlands Verfahrensordnung Verband forschender Arzneimittelhersteller zweckmäßige Vergleichstherapie
14 XIV Executive Summary Die frühe Nutzenbewertung wird nach fünf Jahren in ihren Grundzügen von allen Beteiligten akzeptiert. Im Detail gibt es jedoch immer wieder Anlass zu Diskussionen. Im Vordergrund stehen derzeit Debatten um die freie Preisbildung innerhalb der ersten zwölf Vertriebsmonate sowie die Bildung und Umsetzung von Mischpreisen. Auch der Ausgang bisheriger Schiedsverfahren, auf welche mehrfach Marktrücknahmen seitens der pharmazeutischen Unternehmer folgten, sorgte für Diskussionen. Drei Schwerpunktbeiträge von Vertreterinnen und Vertretern des GKV-Spitzenverbandes, der Industrie und der Schiedsstelle selbst beleuchten deshalb die bisherige Schiedspraxis, diskutieren Änderungsbedarfe und zeigen Entwicklungspfade auf. An einigen Stellen hat der Gesetzgeber in den letzten Jahren bereits nachjustiert denn er hat das AMNOG selbst stets als lernendes System begriffen. Dennoch kommen seit Einführung des AMNOG kontinuierlich neue Diskussionsthemen auf die politische, wie wissenschaftliche Agenda. Die frühe Nutzenbewertung hat sich deshalb abseits der inhaltlichen Ergebnisdiskussion auch als Methodenkatalysator entwickelt und der versorgungswirksamen Anwendung von Methoden der evidenzbasierten Medizin dringend benötigte Impulse verliehen. Auch die öffentlichen Stellungnahmen und Diskussionen mit Fachexperten und medizinischen Fachgesellschaften können in dieser Form als großer Gewinn der frühen Nutzenbewertung betrachtet werden. Vertreter und Interessensverbände der Krankenkassen, Ärzteschaft sowie der pharmazeutischen Industrie formulierten jedoch nicht zuletzt anlässlich des fünften AMNOG-Jubiläums im November 215 und als Reaktion auf Marktrückzüge und zum Teil nicht am Zusatznutzen orientierte Verordnungsentwicklungen nach wie vor Weiterentwicklungsbedarf. Der AMNOG-Report 216 untersucht daran anknüpfend aktuelle Fragestellungen entlang des kompletten Nutzenbewertungsprozesses, vom Beginn eines Verfahrens bis hin zu Effekten der Nutzenbewertung im ambulanten Verordnungsgeschehen. Ziel ist eine möglichst differenzierte und sachliche Bestandsaufnahme vorliegender Diskussionspfade sowie das Aufzeigen konkreter Handlungsfelder. Insgesamt zeigen sich entlang aller Verfahrensschritte auch nach fünf Jahren Ergebnisse, deren Bewertung zwischen den am Verfahren direkt und indirekt beteiligten Parteien höchst unterschiedlich ausfällt. Zentrale Diskussionsfelder des AMNOG sind:
15 Executive Summary XV 1. Nutzenbewertung als iterativen Prozess verstehen 111 Wirkstoffe haben in 134 Verfahren bis zum die frühe Nutzenbewertung durchlaufen. Umstritten ist die vom Gesetzgeber zugestandene Möglichkeit, das Verfahren der frühen Nutzenbewertung durch Nichtvorlage eines Dossiers zu umgehen. 15-mal war dies bislang der Fall. Sechs dieser Wirkstoffe sind Ende 215 in Deutschland nicht mehr verfügbar. Die übrigen Wirkstoffe werden heute auf niedrigem Preisniveau erstattet. Weitere Abschläge als Risikozuschlag, da diese Wirkstoffe zumindest theoretisch auch einen geringeren Nutzen als die Vergleichstherapien haben können, wurden erwogen, erscheinen jedoch nicht sachgerecht. In 52 % aller Verfahren hat der G-BA einen Zusatznutzen zumindest in einer Teilindikation anerkannt. In subgruppen- und patientenspezifischen Betrachtungen sinkt der Anteil positiver Bewertungsergebnisse auf 41 % bzw. 19 %. Jeder vierte Nutzenbewertungsbeschluss ist heute befristet. Der G-BA stützt dies in der Regel auf Unsicherheiten im Evidenzmaterial und fordert weitere Studiendaten entweder aus noch laufenden oder neu zu initiierenden Studien ein. Neubewertungen nach Fristablauf liegen für die ersten Verfahren vor mit unterschiedlichem Ergebnis. Hinsichtlich der zunehmenden beschleunigten Zulassungen neuer Arzneimittel insbesondere in der Onkologie erscheint eine kontinuierliche Re-Evaluation der G-BA-Beschlüsse unter expliziter Berücksichtigung realer Versorgungseffekte sinnvoll. Entsprechende Methoden haben es bislang jedoch schwer (z. B. Register). Lesen Sie weiter in Kapitel Indikationsspezifische Besonderheiten in der Nutzenbewertung abbilden Im Zeitraum von 211 bis Mitte 215 bekamen Onkologika und Arzneimittel gegen Infektionskrankheiten überproportional häufig einen Zusatznutzen zugesprochen. Neue Medikamente aus den Bereichen Diabetologie und Neurologie, welche ein Drittel aller Verfahren entfallen, erreichten dagegen deutlich seltener ein positives Bewertungsergebnis. Aus regulatorischer Sicht ist zu prüfen, ob es bei entsprechenden Verfahren ohne Zusatznutzen ausreicht, auf Ebene der Preisfindung einzugreifen und nicht immer automatisch die billigste Vergleichstherapie als Preisanker zu nutzen, um so ggf. nachteilige Bewertungsergebnisse auszugleichen. Lesen Sie weiter in Kapitel 2.2.
16 XVI Executive Summary 3. Gesundheitsbezogene Lebensqualität adäquat berücksichtigen Auch im Jahr 215 hatten Ergebnisse zur gesundheitsbezogenen Lebensqualität zum Nachweis eines Zusatznutzens nicht den Stellenwert anderer im Verfahren berücksichtigter Endpunkte. Dabei wurden in 71 % (n=84) der Herstellerdossiers Daten zur gesundheitsbezogenen Lebensqualität berichtet. Nach Einschätzung des G-BA konnten diese jedoch nur in sieben Verfahren zur Einstufung des Zusatznutzens berücksichtigt werden. Der bislang in den Dossiers am häufigsten verwendete Fragebogen ist der krankheitsübergreifende EQ-5D. Nach Einschätzung des G-BA ist dieses Instrument zur Anwendung im deutschen Versorgungskontext nicht geeignet. Begründet wird dies damit, dass der EQ-5D im Vergleich zu anderen generischen Instrumenten eher in Bewertungssystemen mit Kosten-Nutzen- Bewertungen geeignet sei. Diese Annahme ist falsch. Vor dem Hintergrund, dass G-BA und IQWiG selbst immer wieder Daten zu patientenberichteten Endpunkten bzw. zur gesundheitsbezogenen Lebensqualität fordern, ist der Umgang des G-BA mit den Ergebnissen eines international etablierten und als eines der Standardinstrumente geltenden Lebensqualitätsmessinstrumentes wie dem EQ-5D daher unverständlich. Lesen Sie weiter in Kapitel Effekte der Nutzenbewertung im Versorgungsalltag diskutieren Auch nach fünf Jahren zeigt sich, dass das Ergebnis der Nutzenbewertung gemessen am festgestellten Zusatznutzen nur begrenzten Einfluss auf die Marktentwicklung neuer Wirkstoffe hat. Der um absolute Umsatzmengen gewichtete durchschnittliche Anstieg des Verordnungsvolumens innerhalb eines Jahres nach G-BA-Beschluss (basierend auf definierten Tagesdosen, DDD) liegt für alle AMNOG-Produkte zum Stichtag bei 14, %. Differenziert nach dem Ergebnis der Nutzenbewertung zeigt sich, dass die Verordnungen von Wirkstoffen mit beträchtlichem Zusatznutzen (14,2 %) nahezu gleichschnell zunehmen wie die für Wirkstoffe ohne Zusatznutzen (14,7 %). Neue Präparate mit geringem (12,6 %) bzw. nicht quantifizierbarem Zusatznutzen (9,8 %) zeigen einen etwas geringeren mittleren Verordnungsanstieg. Die Marktdurchdringung neuer Arzneimittel ist insofern in hohem Maße kontextbezogen. Der Patientennutzen aus der Sicht
17 Executive Summary XVII des Arztes wird jedoch ggf. anders beurteilt als der Nutzen innerhalb des rechtssicheren und damit weitestgehend formalisierten Bewertungsverfahrens. Die Vereinbarung eines nutzenbasierten Erstattungsbetrages entfaltet indes keine verordnungslenkende Wirkung, weder bei Wirkstoffen mit noch bei denen ohne Zusatznutzen. Die Entscheidung über eine Verordnung trifft letztlich der Arzt. Ziel muss es aber sein, dass ihm zu einer differenzierten Therapieentscheidung alle relevanten Informationen über die Nutzenbewertung zur Verfügung stehen. Mehr Transparenz für den verordnenden Arzt über die Ergebnisse der frühen Nutzenbewertung ist deshalb wünschenswert, z. B. über eine bessere Integration in die Praxisverwaltungssysteme. Inwiefern die Ergebnisse der Nutzenbewertung Einfluss auf das Verordnungsverhalten niedergelassener Ärzte haben, wurde im Rahmen des AMNOG-Reportes erstmalig untersucht. Niedergelassene Ärzte wurden um ihre Einschätzung zur Umsetzung des Wirtschaftlichkeitsgebotes unter Berücksichtigung der Nutzenbewertungsergebnisse und derzeitiger Interpretationsfragen des Mischpreises gebeten. Nur knapp die Hälfte der teilnehmenden Ärzte gab eine regelmäßige Informationsbeschaffung über die Ergebnisse der frühen Nutzenbewertung an (einmal pro Quartal oder häufiger). Zudem scheinen die bisherigen Dokumente von G-BA und IQWiG nicht praxiskompatibel: Lediglich 12 % der Ärzte beziehen ihre Informationen aus diesen Quellen. Häufiger wird auf unabhängige Informations- und Nachrichtendienste (59,7 %) bzw. Informationen der Kassenärztlichen Vereinigungen (66,9 %) zurückgegriffen. Die Ergebnisse der Nutzenbewertung selbst haben dann jedoch eine gewisse Praxisrelevanz: 8 % der Ärzte gaben an, dass das Ausmaß des Zusatznutzens bei Verordnungsentscheidungen von Relevanz sei. Die vonseiten des G-BA differenzierten Subgruppen nannten noch zwei Drittel der Ärzte als relevant für ihre Verordnungsentscheidungen. Insbesondere die fehlende Regresssicherheit und die Antizipation möglicher Marktrücknahmen neuer Arzneimittel kann als Diffusionsbarriere gewertet werden. 67 % der teilnehmenden Ärzte gaben an, bei ihren Verordnungsentscheidungen eine mögliche spätere Marktrücknahme zu berücksichtigen. Lesen Sie weiter in Kapitel 4.3 und 6.2.
18 XVIII Executive Summary 5. Mischpreisbildung weiterentwickeln Die Erstattungsbeträge für neue Medikamente werden zwischen dem GKV-Spitzenverband und dem Hersteller ausgehandelt. Sie orientieren sich am Zusatznutzen für alle Patienten im zugelassenen Anwendungsgebiet. Dabei wird ein einheitlicher Erstattungsbetrag für ein Arzneimittel über alle Subindikationen hinweg vereinbart (sog. Mischpreis). Gerade wenn der Arzt ein Medikament in einer Subgruppe verordnet, für die kein Zusatznutzen festgestellt wurde, ist die Wirtschaftlichkeit der Verordnung derzeit umstritten. Vorschläge zu verschiedenen Korrekturmodellen liegen vor und werden diskutiert. Allen Lösungsansätzen gemein ist, dass die alleinige Verordnungsentscheidung beim Arzt verbleibt. Um zu einer fundierten und sachlichen Entscheidung über den indikationsspezifischen Einsatz neuer Arzneimittel zu kommen, muss jedoch seine Informationsgrundlage verbessert werden. Lesen Sie weiter in Kapitel Temporär begrenzte freie Preisbildung differenziert betrachten Die Möglichkeit, Arzneimittel mit neuem Wirkstoff ab Marktzugang zwölf Monate lang zu einem frei festgelegten Abgabepreis zu vertreiben, stößt spätestens seit der Markteinführung teurer neuer Hepatitis-C-Präparate auf massive Kritik. Erst ab dem 13. Monat greift der (niedrigere) nutzenbasierte Erstattungsbetrag. Drei Alternativszenarien sind u. a. denkbar: (1) Rückwirkung des Erstattungsbetrages ab dem ersten Vertriebstag, (2) eine weitere zeitliche Begrenzung der freien Preisbildung, z. B. auf sechs Monate (Abschluss der Nutzenbewertung durch den G-BA) sowie (3) eine Beschränkung der freien Preisbildung auf bestimmte Arzneimittelgruppen (mit Zusatznutzen; mit eingereichtem Herstellerdossier). Eine Berechnung potentieller Einsparvolumina zeigt, dass sich aus DAK-Perspektive bei vollständiger Rückwirkung des Erstattungsbetrages Einsparungen in Höhe von ca. 41 Millionen erzielen ließen. Zu berücksichtigen ist, dass bislang nur drei Wirkstoffe höhere Umsatzmengen im ersten als im zweiten Vertriebsjahr erzielten. Für weitere neue Hepatitis-C-Präparate ist dies zwar ebenfalls zu erwarten, von einer systematischen Fehlleitung der freien Preisbildung kann aufgrund der weitestgehend typisch verlaufenden Marktdiffusion neuer Arzneimittel sowie unter Berücksichtigung industrie- und wettbewerbsökonomischer Aspekte nicht ausgegangen werden. Lesen Sie weiter in Kapitel 7.1.
19 Executive Summary XIX 7. Kosten-Nutzen-Bewertungen einbinden Bei der Nutzenbewertung von Arzneimitteln im AMNOG-Verfahren hat sich grundsätzlich bewährt, den Preis für neue Arzneimittel stärker an deren Zusatznutzen zu binden. Es fehlen aber weiterhin Kosten-Nutzen-Analysen als zusätzliches Entscheidungskriterium für die Preisfindung. Die Diskussion um hohe Einstiegspreise vernachlässigt, dass neben den mit der Administration eines neuen Arzneimittels verbundenen unmittelbaren Kosten- und Nutzen-Aspekten unter anderem auch Cost-offsets (vermiedene Kosten in anderen Leistungsbereichen) berücksichtigt werden sollten. Kosten-Nutzen-Bewertungen sind durch den fakultativen Stellenwert nach gescheitertem Schiedsverfahren jedoch derzeit faktisch irrelevant. Eine in Frankreich gewählte Option, die Rolle gesundheitsökonomischer Evidenz im Nutzenbewertungsverfahren zu stärken und die Informationsbasis insbesondere im Rahmen der Erstattungsbetragsverhandlungen zu vergrößern, stellt eine Schwellenwertlösung vergleichbar zur Nutzenbewertungsarithmetik von Orphan Drugs, also eine verpflichtende Vorlage von Kosten-Nutzen-Bewertungs-Daten ab einem bestimmten zu erwartenden Budget-Impact, dar. Alternativ wäre auch ein fakultatives Modell zur Einbringung der Ergebnisse von Kosten-Nutzen-Bewertungen innerhalb der Nutzenbewertung denkbar. Lesen Sie weiter in Kapitel Schiedsverfahren prüfen Hersteller und GKV-Spitzenverband können sich bislang (Stand: ) in 73 % aller Verfahren auf einen gegenüber dem ursprünglichen Listenpreis des Herstellers reduzierten Erstattungsbetrag einigen. In 2 Verfahren gelang ein solcher Interessensausgleich nicht. Diese Verfahren landen dann vor der Schiedsstelle, wenn der Hersteller zuvor nicht die rahmenvertragliche festgelegte sog. Opt-Out -Option gezogen hat und sein Präparat mit sofortiger Wirkung vom Markt nimmt. 14 Verfahren sind bis zum mit einem Schiedsspruch abgeschlossen worden, von diesen sind jedoch nur noch zwei Wirkstoffe in Deutschland erhältlich, für eines davon ist die Marktrücknahme jedoch bereits angekündigt. Vertreter aller am Schiedsverfahren beteiligten Bänke haben in Gastbeiträgen ihre Perspektive zum bisherigen Schiedsprozess dargelegt, Änderungsbedarfe diskutiert und Entwicklungspfade aufgezeigt. Lesen Sie weiter in Kapitel 5.
20
21 1 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/ Ablauf der frühen Nutzenbewertung Übersicht des Verfahrensablaufes Im Rahmen der frühen Nutzenbewertung wird für alle seit dem 1. Januar 211 erstmals in den Verkehr gebrachten Arzneimittel (oder Erweiterungen des bisherigen Anwendungsgebietes) eine Bewertung des Zusatznutzens gegenüber einer zweckmäßigen Vergleichstherapie durchgeführt. Im Falle eines positiven Zusatznutzens folgen anschließende Erstattungsbetragsverhandlungen zwischen dem GKV-Spitzenverband und dem pharmazeutischen Unternehmen. Anders als mit der international verbreiteten sog. 4. Hürde als für den Zugang zum Versorgungssystem notwendige Bewertungsvoraussetzung bleibt mit dem AMNOG der in Deutschland an die arzneimittelrechtliche Zulassung geknüpfte freie Zugang zum GKV-Markt erhalten. Das Verfahren der frühen Nutzenbewertung beginnt antragsunabhängig mit der Einreichung eines Dossiers durch den pharmazeutischen Unternehmer spätestens zum Zeitpunkt des Inverkehrbringens (entspricht der Aufnahme in die Lauer-Taxe) eines neuen Arzneimittels oder der Zulassung eines neuen Anwendungsgebietes. Der G-BA kann die Bewertung anschließend selbst durchführen oder das IQWiG hiermit beauftragen. Letzteres ist der Regelfall, wenngleich das IQWiG selbst nur einen Vorschlag für die Bewertung des Zusatznutzens abgeben kann und die finale Entscheidung Gegenstand des normativen Ermessensspielraumes des G-BA bleibt. Die Verfahrenssystematik überlässt es jedoch dem pu, ob und in welchem Umfang er dem G-BA ein Dossier einreicht. Der G-BA unterliegt dabei keiner Amtsermittlungspflicht, der pu trägt die Darlegungs- und Beweislast. Nach 35a Abs. 1 Satz 5 SGB V gilt bei Nichteinreichung eines Dossiers durch den pu ein Zusatznutzen als nicht belegt. Ergibt sich aus der Nutzenbewertung ein nach den spezifizierten Anforderungen belegter Zusatznutzen, stellt der G-BA dies durch Beschluss öffentlich in der Arzneimittel-Richtlinie fest und übergibt die Arzneimittelinnovation zur Preisverhandlung an den GKV-Spitzenverband VerfO G-BA.
22 2 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 Abbildung 1: Erstattung patentgeschützter Arzneimittel im Rahmen der frühen Nutzenbewertung Frühe Nutzenbewertung durch den G-BA AM ohne Zusatznutzen mit FB AM ohne Zusatznutzen ohne FB AM mit Zusatznutzen Festbetrag nach 35 SGB V Vereinbarung nach 13b SGB V zwischen GKV-SV und pharmazeutischem Unternehmer über Erstattungsbetrag Erstattungsbetrag mit nicht höheren JTK als ZVT Rabatt auf den ApU. Anforderungen an die Verordnung Optional: Dezentrale Verträge nach 13c SGB V ApU Abgabepreis des pharmazeutischen Unternehmers; JTK Jahrestherapiekosten; zvt zweckmäßige Vergleichstherapie Wie Abbildung 1 zeigt, führt ein nicht anerkannter Zusatznutzen ungeachtet des gültigen Patentschutzes in das Festbetragspreisniveau (bzw. das Preisniveau der Vergleichstherapie, sollte eine Festbetragsgruppierung nicht möglich sein). Für nicht festbetragsfähige Arzneimittel beauftragt der G-BA das IQWiG mit der Bewertung des ihm eingereichten Dossier geltend gemachten Zusatznutzens. Grundlegend sind dabei die Prinzipien der evidenzbasierten Medizin. Konnte nach IQWiG-Prüfung ein Zusatznutzen vom G-BA bestätigt werden, tritt der Hersteller mit dem GKV-Spitzenverband in Verhandlungen über einen entsprechend höheren Erstattungspreis auf Grundlage des belegten Zusatznutzens und der davon begünstigten Populationsgrößen. 2 Wird innerhalb eines Jahres nach Inverkehrbringen bzw. nach Zulassung kein Preis vereinbart, wird das Verfahren an ein im AMNOG gebildetes Schiedsamt übergeben, welches einen Erstattungspreis festlegt. Der Automatismus, keinen Zusatznutzen zu schlussfolgern, wenn der pharmazeutische Unternehmer kein Dossier vorlegt, ist anfällig 2 Ärzte Zeitung (21), S. 6; Müller, Kirch (212), S. 78.
23 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 3 für strategisches Kalkül. Denn in diesem Fall ist nicht nachgewiesen, ob der Nutzen z. B. in Folge eines höheren Schadenpotentials nicht auch geringer als der der zvt ausfällt und damit auch ein Erstattungsbetrag auf Festbetragsniveau nicht im Sinne der Versichertengemeinschaft wäre. 3 Es wurde deshalb vorgeschlagen, in solchen Fällen auch Abschläge unterhalb des in der Regel generischen Preisniveaus der in Frage kommenden Vergleichstherapien zu ermöglichen. 4 Tabelle 1: Schematischer Ablauf und Fristen in der frühen Nutzenbewertung G-BA GKV-SV, pu Schiedsstelle GKV-SV, pu, G-BA 3 Monate 3 Monate 6 Monate 3 Monate offen Frühe Nutzenbewertung Veröffentlichung im Internet Mündliche Anhörung, Beschluss pu pharmazeutischer Unternehmer Verhandlung über Erstattungsbetrag Lauer Taxe, Aufruf der Schiedsstelle möglich Ergebnis geheim, Klagemöglichkeit Festlegung des Erstattungsbetrages Kosten-Nutzen-Bewertung Die Einreichungsfristen des Dossiers an den G-BA sind in 4 Abs. 3 AM-NutzenV geregelt. In summa sind diese abhängig von der Form der Arzneimittelinnovation unter anderem zum Zeitpunkt des erstmaligen Inverkehrbringens (für Arzneimittel mit neuen Wirkstoffen), vier Wochen nach erfolgter Zulassung (für Anwendungsgebietserweiterungen) bzw. für alle anderen drei Monate nach Aufforderung an den G-BA zu übergeben (vgl. Tab. 1). Es besteht jedoch die Möglichkeit, dass ein pu keinen Zusatznutzen geltend macht und die Eingruppierung des zu bewertenden Wirkstoffes in eine Festbetragsgruppe überführt. In diesem Fall reduzieren sich die Dossieranforderungen auf die Unterlagen, die von Seiten des G-BAs zur Feststellung der Festbetragsfähigkeit und der anschließenden Einordnung in eine Festbetragsgruppe benötigt werden. Nach einer Bearbeitungszeit von längstens drei Monaten veröffentlicht der G-BA die in der Regel vom IQWiG erstellte Nutzenbewertung und führt anschließend ein Stellungnahmeverfahren durch. Den Fachgesellschaften bleiben dabei drei Wochen zur Kommentierung nicht viel Enge Fristtaktung verhindert strategische Verzögerungen des Verfahrens 3 4 Die Beweisführung eines geringeren Nutzens ist im Hinblick auf die sozialrechtliche Bindung der Nutzenbewertung an die Zulassungsentscheidung nicht unproblematisch. Kapitel 2.1 betrachtet deshalb die bislang aus diesem Grund nicht bewerteten Verfahren. Haas, Tebinka-Olbrich (214), S. 38.
24 4 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 Rechtliche Legitimation des G-BA Zeit, bedenkt man, dass die entsprechenden Dossiers recht umfangreich und komplex sein können. Unter Berücksichtigung dieser Stellungnahmen von Sachverständigen, Verbänden, Fachkreisen und betroffenen pharmazeutischen Unternehmen kommt der G-BA dann innerhalb von drei weiteren Monaten zu einem Beschluss. Insgesamt sechs Monate nach Markteinführung liegt demzufolge eine Entscheidung zum Zusatznutzen vor, worauf aufbauend im nächsten Schritt Erstattungsbeträge verhandelt bzw. festgelegt werden. Die Möglichkeit, Ergebnisse aus dem Verfahren auf juristischem Weg anzufechten, steht dem pharmazeutischen Unternehmer erst im Anschluss an Entscheidungen der Schiedsstelle zu. Wegen 35a Abs. 8 SGB V sind Rechtsmittel im übrigen Verfahren weitreichend ausgeschlossen, womit insbesondere die aufschiebende Wirkung solcher Verfahren zur Klärung noch offener Rechtsfragen als Option entfällt. 5 Als Konsequenz bedeutet dies, dass pharmazeutische Unternehmen, die sich im Verfahren benachteiligt fühlen, derzeit häufig mit Marktaustritt reagieren. Eine Verfassungsbeschwerde zu den Anspruchsvoraussetzungen gesetzliche Krankenversicherter stellte zuletzt die grundsätzliche demokratische Legitimation des G-BA für die zu Arzneimitteln getroffenen Entscheidungen mit dem Verweis auf den hierfür eigentlich zuständigen Gesetzgeber in Frage. 6 Inhaltlich ging es im Wesentlichen um die Rechtssetzungskompetenz des G-BA im System der gesetzlichen Krankenversicherung. Der Gemeinsame Bundesausschuss sieht sich gemäß eines von ihm in Auftrag gegebenen Rechtsgutachtens jedoch hinreichend demokratisch legitimiert. 7 Im November 215 wies auch das Bundesverfassungsgericht die Klage als unzulässig zurück, äußerte jedoch grundlegende Zweifel am Konstrukt des Gremiums. 8 Anwendungsbereiche Eine frühe Nutzenbewertung nach 35a Abs. 1 und 6 SGB V betrifft in erster Linie verkehrsfähige Arzneimittel mit neuen Wirkstoffen bzw. neuen Wirkstoffkombinationen, die erstmals nach dem in Verkehr gebracht wurden. Darüber hinaus ist jedoch zwischen obligatorischen und zwingenden Bewertungstatbeständen sowie zwischen einer fakultativen Bewertung bzw. Beurteilung mit Ermessensspielraum auf Seiten des G-BA zu differenzieren (vgl. Tab. 2) Ausführlich bei Nitz (214) und Reese (214). Az.: 1 BvR 256/12. G-BA (215). Sucker-Sket (215). Stöckel (212), S. 1.
25 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 5 Tabelle 2: Anwendungsbereich der frühen Nutzenbewertung nach 35a SGB V Anwendungsbereich 1. Neu zugelassenes Arzneimittel mit neuem Wirkstoff 2. Zulassung eines neuen Anwendungsgebietes 3. Reevaluation von (1) oder (2) 4. Arzneimittel des Bestandsmarktes (aufgehoben) 5. Freistellungen/Ausnahmen Gegenstand Verpflichtende Nutzenbewertung ( 35a Abs. 1 S. 1 SGB V) Obligatorische Nutzenbewertung, falls für das betreffende Arzneimittel bereits eine Nutzenbewertung nach (1) vorausgegangen ist ( 35a Abs. 1 S. 3 SGB V) Verpflichtende Nutzenbewertung, falls vom pu ein Jahr nach bereits erfolgter Nutzenbewertung ein Antrag eingeht oder frühestens ein Jahr nach erfolgter Nutzenbewertung bei Vorliegen neuer Evidenz vom G-BA eine Re-Evaluation veranlasst wird oder bei Fristablauf, wenn der Gemeinsame Bundesausschuss über eine Nutzenbewertung mit Befristung beschlossen hat ( 3 AM-NutzenV) Ehemals fakultative Nutzenbewertung, vorrangig für Wirkstoffe, die (a) für die Versorgung allgemein von Bedeutung sind oder (b) mit einem Präparat im Wettbewerb stehen, für das bereits eine frühe Nutzenbewertung durchgeführt wurde. Ausgenommen sind davon Wirkstoffe, für die kein Unterlagenschutz mehr besteht ( 35a Abs. 6 SGB V) (a) Orphan Drugs mit einem jährlichen Umsatzvolumen von < 5 Millionen : Keine Nutzenbewertung aber Dossiereinreichung und Erstattungsbetragsverhandlung (b) Arzneimittel mit geringfügigen Ausgaben für die GKV im Sinne einer Erheblichkeitsschwelle (< 1 Millionen /Jahr) ( 35a Abs. 1 S. 1 SGB V) (c) Arzneimittel in rein stationärer Anwendung Arzneimittel, die ausschließlich im stationären Sektor angewendet werden, werden vom Geltungsbereich der frühen Nutzenbewertung zwar theoretisch erfasst, aufgrund der Rechtsumsetzung des G-BA aber faktisch ausgeschlossen. Beschlüsse nach 35a SGB V beziehen sich primär auf die ambulante Versorgung, 2 Abs. 1 S. 3 SGB V (Anspruch auf Qualität und Wirtschaftlichkeit der Leistungen) entfaltet jedoch auch für ausschließlich stationär angewendete Präparate eine hohe Bindungswirkung. Bei der Ermittlung der Umsätze für die Prüfung der Geringfügigkeitsschwelle ist der zu erwartende Faktischer Ausschluss stationärer Arzneimittel
26 6 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 Umsatz des Arzneimittels mit der gesetzlichen Krankenversicherung innerhalb von 12 Kalendermonaten maßgeblich ( 15 Abs. 4 S. 2 VerfO G-BA). Dieser bestimmt sich wiederum nach den zu erwartenden GKV-Arzneimittelschnellinformationen nach 84 Abs. 5 S. 4 SGB V (sog. GAmSi-Daten ). Diese erfassen jedoch nur die vertragsärztlichen Kosten, Krankenhauskosten werden davon nicht berücksichtigt. Reine Krankenhausarzneimittel dürften also regelmäßig die Geringfügigkeitsschwelle unterschreiten. Dies gilt zumindest, solange der pharmazeutische Unternehmer nachweisen kann, dass die Arzneimittel nur in Krankenhäusern ausgegeben werden. 1 1 Nitz (214), S. 12; Schickert, Schmitz (211), S. 22.
27 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/ Veränderung methodischer, politischer und rechtlicher Rahmenbedingungen Regulatorische Eingriffe in die frühe Nutzenbewertung Die frühe Nutzenbewertung ist seit Einführung des AMNOG mittlerweile durch eine Vielzahl von rechtlichen Änderungen auf gesetzlicher und untergesetzlicher Ebene angepasst und spezifiziert worden. Die zum Teil geringe Detailtiefe, mit welcher der Gesetzgeber maßgebliche Rahmenvorgaben sowohl zur Dossiererstellung als auch dessen Bewertung in 35a SGB V formuliert hat, hat in der Vergangenheit zu Kontroversen und gerichtlichen Auseinandersetzungen zwischen den Interessengruppen geführt. Der in Abb. 2 dargestellte zeitliche Verlauf gesetzlicher Eingriffe kann zumindest auf deskriptiver Ebene die Bereitschaft des Gesetzgebers zur Anpassung im Sinne des vielfach zitierten Lernprozesses dokumentieren. Das AMNOG ist dabei allerdings nur partiell weiter entwickelt worden. Gravierende Umbrüche hat es zur Wahrung der Verlässlichkeit und Stabilität der Rahmenbedingungen nicht gegeben. Abbildung 2: Meilensteine in der frühen Nutzenbewertung Geringe gesetzliche Regelungstiefe Änderung VerfO G-BA / AMG- Novelle SGB V ÄndG AMNOG AMG- Novelle 215 GKV-VSG IQWiG Methoden IQWiG Methoden IQWiG Methoden 4.2 Mit drei zentralen Gesetzesinitiativen hat das BMG in den vergangenen Jahren die frühe Nutzenbewertung zunächst mit dem AM- NOG im SGB V etabliert und dann mit der 16. und 17 AMG-Novelle in Detailfragen überarbeitet, zuletzt mit dem 14. SGB V Änderungsgesetz und der damit verbundenen Aufhebung des Bestandsmarktaufrufes sogar ganz entscheidend. Die Nutzenbewertung für neue Medikamente, die vor dem 1. Januar 211 auf den Markt gekommen sind (Bestandsmarkt), wurden im Zuge dieser letztgenannten Gesetzesänderung rückwirkend zum 1. Januar 214 ausgesetzt. Der seit 1. Januar 214 wieder bei sechs Prozent liegende Herstellerabschlag für patentgeschützte und keinem Festbetrag unterliegende Arzneimittel gem. 13a Abs. 1 SGB V wurde ab 1. April 214 auf sieben Prozent angehoben. Generika sind von dieser Anhebung Drei größere gesetzliche Eingriffe seit Einführung des AMNOG
28 8 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 ausgenommen; für sie gelten weiter sechs Prozent Herstellerabschlag (unabhängig vom zusätzlichen Generikaabschlag). Das Preismoratorium für verschreibungspflichtige Arzneimittel wird über den 31. März 214 hinaus bis zum 31. Dezember 217 verlängert. Das Preismoratorium gilt nicht für Arzneimittel, für welche die Krankenkassen einen Festbetrag bezahlen. Das BMG geht inzwischen davon aus, dass die insgesamt erhöhten Herstellerrabatte die Arzneimittelausgaben der GKV jährlich um etwa 1,1 Milliarden entlastet haben, das Preismoratorium um knapp,6 Milliarden. 11 Eine Erhöhung des gesetzlichen Herstellerabschlages von 6 auf 7 Prozent führt nach Schätzungen des GKV-SV dann zu weiteren Einsparungen von etwa,1 Milliarden. 12 Stargardt und Frey schätzen im Rahmen einer gutachterlichen Stellungnahme vor der letzten gesetzlichen Korrektur des AM- NOG, dass bei Fortführung des Moratoriums sowie des Herstellerabschlages im Jahr 214 um 9,3 %, im Jahr 215 um 11,7 % geringere Arzneimittelausgaben im Vergleich zur ursprünglich geplanten Aufhebung der Preisregulierungsinstrumente anfallen würden. 13 Interessant dürfte indes das Auslaufen des Preismoratoriums im Jahr 217 werden. Angesichts dann zu erwartender Preissteigerungen ist dann mit weiteren preisregulierenden Eingriffen oder gar einer Fortführung des Preismoratoriums zu rechnen, wenn auch in der Vergangenheit bei Auslaufen der zwei vorherigen, allerdings deutlichen kürzeren Moratorien die anschließenden Steigerungsraten mit durchschnittlich ca. 2,1 % geringer ausfielen aus vielfach angenommen. 14 Immerhin wurde zuletzt ein Inflationsausgleich erwogen, welcher jedoch aufgrund einer derzeit streng am Koalitionsvertrag orientierten Reformagenda eher zum Ende der Legislaturperiode noch einmal diskutiert werden dürfte. 15 Im Zuge des 14. SGB V Änderungsgesetzes hat der Gesetzgeber zudem Fragen zur Administration des nach 13b SGB V zu vereinbarenden Erstattungsbetrages über die Vertriebsstufen geklärt. Bei neuen Medikamenten gilt der nach der Nutzenbewertung zwischen Kassen und Herstellern vereinbarte tatsächliche Erstattungsbetrag als Basis für die Berechnung von Großhandels- und Apothekenzuschlag. Damit wird unterbunden, dass Hersteller mit dem Argument der aus Wettbewerbsgründen nötigen Geheimhaltung betreffende Medikamente weiter mit dem Originalpreis in den Handelsdatenbanken listen. An den Verhandlungen über einen Erstattungsbetrag nach dem AMNOG für neue Medikamente nimmt seit 215 zudem jeweils ein Vertreter einer Krankenkasse teil. Bislang hat nur der GKV-Spitzenverband stellvertretend für alle Kassen verhandelt BT-Drs 18/188, S. 5. BT-Drs 18/21, S. 5. Stragardt, Frey (213), S. 12. Wasem, Greß (213), S. 12. Obgleich dies zuletzt von Seiten der Politik eher ausgeschlossen wurde. Apotheke Adhoc (214).
29 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 9 Dass genaue Prozedere regelt der Spitzenverband in seiner Satzung. Das im Juli 215 in Kraft getretene GKV-Versorgungsstärkungsgesetz (GKV-VSG) 16 tangierte die frühe Nutzenbewertung zumindest indirekt. Wirtschaftlichkeitsprüfungen für verordnete Leistungen gem. 16 SGB V werden in ihrer jetzigen Form durch das GKV- VSG aufgehoben und durch regionale Vereinbarungen zwischen den Landesverbänden der Krankenkassen und den Ersatzkassen sowie den Kassenärztlichen Vereinigungen in 16b SGB V ersetzt. Diese Vereinbarungen sind schiedsstellenfähig. Dabei sind die Vertragspartner der Selbstverwaltung auf regionaler Ebene frei, den jeweiligen regionalen Besonderheiten Rechnung zu tragen. Dies gilt insbesondere auch hinsichtlich der Prüfungsarten. Bis zum Abschluss neuer regionaler Vereinbarungen werden die bisherigen Regelungen als regionale Vertragsinhalte fortgeführt. Im Hinblick auf die frühe Nutzenbewertung ist das GKV-VSG jedoch nicht wegen seiner Inhalte relevant, sondern wegen dem, was es nicht regelt. 16b Abs. 4 SGB V nimmt verschiedene Bereiche von einer Wirtschaftlichkeitsprüfung aus. Dies sind neben bestimmten Verordnungen von Heilmitteln auch Verordnungen von Arzneimitteln, für die ein Vertrag nach 13a Absatz 8 SGB V vereinbart wurde, dem der verordnende Arzt beigetreten ist. Die kassenärztliche Bundesvereinigung (KBV) sowie der Verband forschender Arzneimittelhersteller (Vfa) haben mehrfach darauf hingewiesen, dass auch die Verordnung von Arzneimitteln mit einem Erstattungsbetrag nach 13b SGB V von Wirtschaftlichkeitsprüfungen ausgenommen werden sollten. 17 Hintergrund ist die bestehende Uneinigkeit über die wirtschaftliche Verordnungsweise neuer Arzneimittel, wenn nicht in allen vom G-BA vorgesehenen therapeutischen Subgruppen einen Zusatznutzen nachweisen konnten. Der durch die Vertragsparteien vereinbarte oder durch die Schiedsstelle festgesetzte Erstattungsbetrag sorgt jedoch nach Auffassung der KBV sowie des Vfa für ein wirtschaftliches Erstattungsniveau eines Arzneimittels mit neuem Wirkstoff über alle seine Anwendungsgebiete und Subindikationen hinweg. Differenzierte Nutzenbewertungsergebnisse auch innerhalb eines Anwendungsgebietes werden demnach bereits bei der Findung von Erstattungsbeträgen (Mischpreisbildung) einkalkuliert. Eine nachgelagerte Wirtschaftlichkeitsprüfung auf Verordnungsebene sei damit überflüssig. Ein Umstand, der durch die gesetzliche Soll-Vorgabe zur Vereinbarung bundesweiter Praxisbesonderheiten für nutzenbewertete Arzneimittel bereits bei Einführung des AMNOG durch den Gesetzgeber be- GKV-VSG Gesetz zur Stärkung der Versorgung in der gesetzlichen Krankenversicherung (GKV-Versorgungsstärkungsgesetz GKV-VSG) vom KBV (214), Vfa (215a).
30 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 Einbindung der Zulassungsbehörden gefordert rücksichtigt wurde. Der GKV-Spitzenverband hat jedoch eine andere Rechtsauffassung 18, weshalb dieser Aspekt im Rahmen von Kapitel 4.2 dieses Reportes noch ausführlich diskutiert wird. Nicht ins Gesetz schaffte es auch ein Vorschlag des Bundesrates: Das Bundesinstitut für Arzneimittel und Medizinprodukte oder das Paul-Ehrlich-Institut sollten stärker an der Bestimmung der zweckmäßigen Vergleichstherapie beteiligt werden. Hintergrund ist, dass vom G-BA bislang häufig nicht der Komparator herangezogen wurde, der zuvor von der Zulassungsbehörde gewünscht wurde und dementsprechend in den für die arzneimittelrechtliche Zulassung erforderlichen klinischen Studien verwendet wurde. Diese Zulassungsstudien konnten daher im späteren Nutzenbewertungsverfahren kaum berücksichtigt werden. Indirekte Vergleiche pharmazeutischer Unternehmer wiederum scheitern in aller Regel an den methodischen Vorgaben des IQWiG. Da die Wahl der ZVT maßgeblichen Einfluss auf die Beurteilung des Ausmaßes des Zusatznutzens des Arzneimittels mit neuem Wirkstoff hat, sollte bei der Bestimmung der ZVT künftig die Fachkompetenz der zuständigen Bundesoberbehörde Bundesinstituts für Arzneimittel und Medizinprodukte oder des Paul-Ehrlich-Instituts (BfArM) (PEI) intensiver genutzt und diesbezüglich Einvernehmen zwischen G-BA und Zulassungsbehörde erzielt werden. Bislang sieht 35a Absatz 7 SGB V lediglich vor, dass der G-BA pharmazeutische Unternehmer vor Beginn von Zulassungsstudien der Phase III oder zur Planung klinischer Prüfungen zu den vorzulegenden Unterlagen, Studien und der ZVT unter Beteiligung des BfArM oder des PEI beraten soll. 19 Diese haben nach Angaben des BfArM in den vergangenen Jahren konstant zugenommen. 2 Unabhängig dieser vom Bundesrat vorgeschlagenen gesetzlichen Konkretisierung kommunizieren und arbeiten Bundesbehörden, Wissenschaftler und Unternehmen seit Einführung des AMNOG bereits enger zusammen. Das AMNOG dürfte unter Evidenzgesichtspunkten im Hinblick auf verbesserte Studien und angesichts der langen Studienzyklen eine echte Wirkung jedoch erst langfristig entfalten. Rahmenvereinbarung nach 13b Abs. 8 SGB V gekündigt Reorganisationen auf untergesetzlicher Ebene Auch als Konsequenz dieser Diskussion um die Mischpreisbildung ist die Rahmenvereinbarung nach 13b Abs. 8 SGB V erwartungsgemäß zum 3. September 215 gekündigt worden. Die Herstellerverbände BAH, BPI, Pro Generika und Vfa haben Neuverhandlungen mit dem GKV-Spitzenverband angestoßen, um die zur Umsetzung des AMNOG erforderliche Rahmenvereinbarung zu 18 Haas, Tebinka-Olbrich (215), S BT-Drs. 641/14, S. 11ff. 2 Broich (215).
31 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/ überarbeiten. 21 Die ursprüngliche Vereinbarung wurde im Jahr 212 geschlossen. Darin wurden die Kriterien festgelegt, die den Einzelverhandlungen der pharmazeutischen Unternehmen mit dem GKV- Spitzenverband im Rahmen des AMNOG-Verfahrens zu Grunde liegen. Gemäß 8 Abs. 2 der bislang noch gültigen Rahmenvereinbarung muss eine überarbeitete Fassung bis Ende März 216 vorliegen. Allerdings ist im Hinblick auf den derzeitigen Dissens in verschiedenen, insbesondere die Erstattungsbetragsverhandlungen betreffenden Verfahrensverfahren, eher mit dem Aufruf der AM- NOG-Schiedsstelle zu rechnen. Die bisherige Rahmenvereinbarung behält bis zur letztlichen Klärung ihre Gültigkeit. Allgemein wurde zuletzt angeregt, die Regelungen im Arzneimittelmarkt in bestimmten zeitlichen Abständen auf gesetzlicher Ebene zu überprüfen. Angesichts der engen Regulierungsdichte im Arzneimittelmarkt sind sowohl die Wirkung von Einzelmaßnahmen als auch deren Wirkung untereinander regelhaft zu evaluieren. Das Bundesministerium für Gesundheit ist diesem Gedanken folgend beispielsweise verpflichtet, der Wirkung von Preismoratorium und Herstellerabschlägen jährlich nachzugehen ( 13a Abs. 4 SGB V). So plant es der Gesetzgeber auch zukünftig mit der Möglichkeit zur Umgehung der frühen Nutzenbewertung zu handhaben. Dabei geht es um Fälle, in denen die Hersteller dem Gemeinsamen Bundesausschuss (G-BA) trotz Aufforderung kein Dossier vorlegen. Umgeht ein Hersteller auf diesem Weg die Nutzenbewertung, gilt der Zusatznutzen automatisch als nicht belegt. Dennoch sind entsprechende Wirkstoffe sofort verkehrs- und zu Lasten der GKV erstattungsfähig. Das entsprechende Präparat wird dann einer Festbetragsgruppe zugeordnet, oder es wird ein Erstattungsbetrag vereinbart, der den Preis der zweckmäßigen Vergleichstherapie nicht übersteigen darf. Manchem Hersteller wurde bei einem solchen Vorgehen strategisches Kalkül unterstellt, und es besteht die Befürchtung, dass etwaige Nachteile für den Patienten nicht aufgedeckt werden können, wenn der Hersteller sich nicht dem Bewertungsverfahren stellt. Die parlamentarische Staatssekretärin im Bundesministerium für Gesundheit erklärte jedoch 214, dass keine systematische Aushebelung der Nutzenbewertung erkennbar sei. Vielmehr seien weitere Entwicklungen abzuwarten, ehe gesetzlich nachgesteuert werde. 22 Durch ein vom Bundesverband der pharmazeutischen Industrie (BPI) in Auftrag gegebenes Gutachten kam im Jahr 215 ebenfalls noch einmal die Gouvernance-Struktur der Nutzenbewertung auf die politische Agenda. Die in dem Gutachten 23 enthaltene Forderung, den Posten des GKV Spitzenverbandes im G-BA zu streichen und Umgehung der frühen Nutzenbewertung geduldet Rolle des GKV-Spitzenverbandes in der Diskussion 21 Vfa (215b). 22 BT-Drucksache 18/2964, S Cassel-Ulrich (215).
32 12 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 Überarbeitete IQWiG Methoden 4.2 damit den Einfluss der Kassen auf die frühe Nutzenbewertung einzuschränken scheitert jedoch am Einspruch der Politik. 24 Vielmehr ist es erklärtes Ziel, die Nutzenbewertung im gemeinsamen Dialog aller Parteien weiter zu optimieren. Wenig Aufsehen erregte es allerdings, als im Juli 215 die maßgeblichen Dachverbände, der GKV-SV und der Vfa, eine temporäre Herausnahme Griechenlands aus dem für die Erstattungsbetragsverhandlungen maßgeblichen Länderkorb diskutierten. Vor dem Hintergrund der akuten Wirtschaftskrise in Griechenland schlug der GKV-Spitzenverband konkret eine Verkleinerung des Länderkorbs auf 14 Staaten für ein Jahr vor. Danach könnte Griechenland nach Überlegungen des GKV-Spitzenverbandes wieder in den Korb der Referenzländer aufgenommen werden. 25 Die unabhängige AM- NOG-Schiedsstelle hat im Jahr 212 festgelegt, dass die tatsächlichen Abgabepreise aus bisher 15 Ländern, darunter auch Griechenland, in den Verhandlungen berücksichtigt werden sollen. Ziel dieser Vereinbarung ist es zu verhindern, dass ein den wirtschaftlichen Rahmenbedingungen geschuldete Absenken von Arzneimittelpreisen für den griechischen Markt eine preismindernde Wirkung im Rahmen der deutschen Erstattungsbetragsverhandlungen habe. Das Methodenpapier des IQWiG, maßgebend für die methodische Vorgehensweise des Institutes im Rahmen der Nutzenbewertung, ist seit Einführung des AMNOG mehrfach aktualisiert worden. Die aktuelle Version 4.2 wurde am veröffentlicht. Für die frühe Nutzenbewertung maßgebliche Änderungen am Methodenpapier erfolgten darin mit der Konkretisierung der Anforderungen an die Beleglage zur Formulierung von Nutzenaussagen mit unterschiedlichen Aussagesicherheiten sowie der Operationalisierung der Feststellung des Ausmaßes des Zusatznutzens sowie dessen Rationale bereits zur Version 4.1. Wesentliche Änderung der Version 4.2 ist die Integration der Methoden zur Kosten-Nutzen-Bewertung in das Dokument. 26 Die Deutsche Gesellschaft für Gesundheitsökonomie (dggö e.v.) begrüßte zwar grundsätzlich die Erweiterung des Methodenpapieres, kritisierte jedoch, dass gegenüber der 29 erstmalig publizierten Methodik keine signifikante Weiterentwicklung zu erkennen sei. Neben einer erneuerten allgemeinen Kritik am Effizienzgrenzenkonzept des IQWiG wäre eine Präzisierung der rechtlichen Rahmenbedingungen einer Kosten-Nutzen-Bewertung im Methodenpapier wünschenswert gewesen, wobei seitens der Fachgesellschaft eine klare Trennung zwischen der inhaltliche Aufbereitung der wissenschaftlichen Evidenz zu Kosten und Nutzen ( Assessment ) und der eigentlichen überwiegend normativen Bewertung des Wirtschaftlichkeitsergebnisses ( Appraisal ) vorgeschlagen wird. 24 O.V. (215). 25 GKV-Spitzenverband (215). 26 IQWiG (215).
33 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/ Kritisiert wird ferner, dass viele methodische Defizite der Nutzenbewertung in der erneuten Überarbeitung nicht berücksichtigt wurden. Dazu zählen zum Beispiel: Die fehlende Validierung der Kriterien zur quantitativen Operationalisierung des Zusatznutzens sowie die fehlende Publikation des zugrundeliegenden Algorithmus. Eine ungenügende Methodik zur Berücksichtigung von Crossover in randomisierten Studien. Die Berechnung des Zusatznutzens für Subgruppen von Patienten auf der Basis von Ergebnissen der Verzerrungsanalyse, ohne dass die Power der jeweiligen Studien ausreichend zur Detektion von Unterschieden in diesen Subgruppen ist. 27 Die kurze Stellungnahmefrist. Vorgeschlagen wurde von Seiten der AWMF eine Verdopplung von drei auf sechs Wochen. 28 Ein konzeptioneller Fortschritt des gesamten Prozesses der Kosten- Nutzen-Bewertung ist allerdings die Aufnahme einer ausführlicheren Darstellung von Methoden zur gewichteten Bewertung von Endpunkten (Analytic Hierarchy Process, Conjoint Analyse). Diese Methodik kann auch die Basis für eine Hierarchisierung von Endpunkten im Rahmen einer Saldierung des endpunktspezifischen Nutzens im Verfahren der frühen Nutzenbewertung sein. Allerdings greife die Auseinandersetzung und Präzisierung des Konstrukts Lebensqualität als wichtigen Baustein für eine solide methodische Bewertung zu kurz. 29 Entsprechende Konzepte werden in der Version 4.2. des Methodenpapiers nur ansatzweise aufgearbeitet, diese sind jedoch für eine inzwischen auch politisch geforderte stärkere Integration von Lebensqualitätsdaten in der Nutzenbewertung von entscheidender Bedeutung. 3 Es gibt weiterhin gute Gründe für eine stärkere Integration der Ergebnisse von Kosten-Nutzen-Bewertungen im Verfahren. Denn hohe Listenpreise für neue Onkologika und Hepatitis-C-Präparate stehen im Verdacht, den zwölfmonatigen Zeitraum freier Preisdurchsetzung, ehe ein im Anschluss an die Nutzenbewertung verhandelter Preis Gültigkeit erhält, zur Realisierung überzogener Gewinne strategisch auszunutzen. Bereits im AMNOG-Report 215 wurde deshalb empfohlen, zusätzlich zur bestehenden Budget-Impact- Perspektive auf Daten aus Kosten-Nutzen-Bewertungen zurückzugreifen. 31 Eine solche würde neben den mit der Administration eines neuen Arzneimittels verbundene unmittelbare Kosten- und Nutzen- Aspekte u. a. auch Cost-offsets (vermiedene Kosten in anderen 27 DGHO, GTH (214). 28 AWMF (214). 29 Dggö (214). 3 Laschet (214). 31 Greiner, Witte (215), S. 167f.
34 14 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 Leistungsbereichen) berücksichtigen können. Kosten-Nutzen-Bewertungen sind durch den fakultativen Stellenwert nach gescheitertem Schiedsverfahren jedoch derzeit faktisch irrelevant. Eine solche könnte erst 15 Monate nach Markteinführung beginnen und würde dann beim IQWiG geschätzt mindestens ein Jahr in Anspruch nehmen. Darum ist der Anreiz einer Verhandlungslösung vor der Kosten-Nutzen-Bewertung hoch. Wohlfahrtsmaximal ist die Lösung jedoch aller Voraussicht nach nicht. 32 Auch der Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen (SVR-Gesundheit) regte in seinem Gutachten 214 noch einmal an, im Rahmen der Preisverhandlungen, Ergebnisse aus Kosten-Nutzen-Bewertungen fakultativ einbringen zu können. 33 Stärkere Einbindung der Fachgesellschaften geplant Einbindung der Fachgesellschaften Ganz ohne Initiative des Gesetzgebers haben sich G-BA und maßgebliche medizinische Fallgesellschaften auf eine zuletzt im Stellungnahmeprozess zum IQWiG-Methodenpapier 4.2 noch einmal öffentlich geforderte engere Zusammenarbeit verständigt. Insbesondere eine stärkere Berücksichtigung klinisch-wissenschaftlicher Expertise zur Beurteilung der vorliegenden Evidenz in Bezug auf die festzulegende Vergleichstherapie wurde zuvor von Seiten der Fachgesellschaften stellvertretend über die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) gefordert. 34 Dazu gehört nach Ansicht der Fachgesellschaften auch eine bessere Integration der zum Zeitpunkt der Nutzenbewertung vorliegenden evidenzbasierter Leitlinien, welche nicht nur verpflichtender Bestandteil der Nutzenbewertung des G-BA sondern bereits der Hersteller-Dossiers (systematische Recherche und Kommentierung) sein sollte. Pharma-Dialog 215 Im Herbst 214 startete die Bundesregierung den sogenannten Pharma-Dialog. Dieses Dialogforum aus Vertretern aus Bundesregierung, Wissenschaft, Industrie, Gewerkschaften und Verbänden sowie dem Geschäftsbereich des Bundesministeriums für Gesundheit soll den Beteiligten ermöglichen, sich auf einer vorparlamentarischen Ebene auszutauschen und die Attraktivität des Forschungs-, Innovations- und Produktionsstandort Deutschland für die pharmazeutische Industrie zu verbessern. Geplant waren vier Gesprächsrunden. Insbesondere die zweite Dialogrunde vom 3. Juni 215 beinhaltete dabei nutzenbewertungsrelevante Themen. GKV-Vertreter sprachen sich erneut für eine Neugestaltung der zwölfmonatigen 32 Kifmann (21). 33 SVR-Gesundheit (214), S AWMF (215), S. 1f.
35 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/ freien Preisgestaltung aus. Bereits ab dem siebten Monat sollen Erstattungspreise rückwirkend gelten, so ein Vorschlag (siehe ausführlich Kapitel 7.1). 35 Eine entsprechende Forderung bekäme aufgrund der immer schneller und kostengünstiger herzustellenden Metoo-Präparate, die i. d. R. keinen oder nur einen marginalen Zusatznutzen im Vergleich zu Bestandspräparaten vorweisen, weiteres Gewicht. 36 Weiteres kassenseitig vorgetragenes Thema des Pharma-Dialogs war die Abkehr von einer Mischpreiskalkulation bei der Preisbildung von neu zugelassenen Medikamenten. Stattdessen wurden subgruppenspezifisch-differenzierte Preise vorgeschlagen. Vorstellbar sei, dass niedergelassene Ärzte die Zugehörigkeit zu einer Subgruppe auf der elektronischen Gesundheitskarte dokumentieren. 37 Im Hinblick auf bundespolitische Implikationen aus dem Pharma-Dialog sind sich führende gesundheitspolitische Vertreter der Großen Koalition und Branchenvertreter einig, dass die Ergebnisevaluation des Pharma-Dialoges in eine anvisierte Umgestaltung des AMNOG einfließen wird. 38 Die frühe Nutzenbewertung dürfte damit im Jahr 216 vor ggf. weitreichenden Änderungen im Sinne eines AMNOG 2. stehen. Internationale Harmonisierung der frühen Nutzenbewertung Ein zur Verbesserung des AMNOG-Verfahrens häufig genannter Aspekt ist eine stärkere internationale Harmonisierung nationaler Bewertungsverfahren nach Zulassung. 39 Dabei ist von der Bewertung des Nutzens (engl. Assessment) von der Ableitung von Schlussfolgerungen (engl. Appraisal) für den Marktzugang bzw. die Erstattung zu trennen, welche zur Wahrung nationaler Budgetautonomie weiterhin länderspezifisch erfolgen sollte. Ein Zulassungsprozess ohne direkte Verbindung zur Nutzenbewertung ist im Hinblick auf die Evidenzanforderungen und den Zeitpunkt der Frühbewertung problematisch. Zu berücksichtigen sind jedoch international unterschiedliche Anforderungen an Outcomeparameter und Evidenzgrad. Ein Wettbewerb der Regulierer um den vermeintlich richtigen Bewertungsansatz ist jedoch wenig produktiv, da die Flexibilität der Evidenzgenerierung für den pharmazeutischen Unternehmer bei der Frühbewertungen naturgemäß beschränkt ist. Bemühungen, die Nutzenbewertung analog zur arzneimittelrechtlichen Zulassung auf die europäische Ebene zu verlagern (inkl. Definition relevanter Outcomes und Vergleichstherapie) sind deshalb zu europäische Nutzenbewertung als mittelfristige Perspektive 35 Ärzte Zeitung (215a). 36 Apotheke Adhoc (215). 37 Ärzte Zeitung (215a). 38 Ärzte Zeitung (215b), Ärzte Zeitung (215c), Pharmazeutische Zeitung (215). 39 Exemplarisch: AWMF (215), Haas (214).
36 16 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 begrüßen. Aus Sicht des deutschen Normgebers dürfte die Wahrung des methodischen (nationalen bzw. IQWiG-) Standards sowie des erreichten Transparenzniveaus oberste Priorität haben. Allerdings ist davon auszugehen, dass sich ein zentraleuropäisches Verfahren nicht zeitnah realisieren lässt. In Europa werden zurzeit sogenannte Joint Assessments diskutiert, also Nutzenbewertungen, die von mehreren HTA-Agenturen gemeinsam durchgeführt werden sollen. Dafür müssen gemeinsame Bewertungsmethoden gefunden werden. Das IQWiG wies in diesem Zusammenhang darauf hin, dass Angleichung nach unten in jedem Fall vermieden werden müsste. 4 Die sogenannten Early Advice-Verfahren (SEED Projekt und die Multi-HTA dialogues von EUnetHTA) können als erste Schritte in diese Richtung betrachtet werden. Um den Weg einer europäischen Nutzenbewertung zu verstetigen, dürfte jedoch, ähnlich zu den Scientific Advices in der europäischen Zulassung, die Etablierung weiterer zunächst organisatorischer Rahmenbedingungen (Einrichtung eines wissenschaftlichen Komitees sowie eines Sekretariates) erforderlich sein. Problematisch könnten indes aktuelle Projekte der EMA zum Adaptive Licensing bzw. Adaptive Pathways, eine frühere Zulassung von Arzneimitteln mit neuem Wirkstoff zur Anwendung an einer (kleinen) Subpopulation innerhalb der relevanten Patientengruppe, sein. 41 Entsprechende Verfahren induzieren eine noch frühere frühe Nutzenbewertung mit dem Nachteil, dass in der Regel noch weniger Daten über den Nutzen dieser Intervention zur Verfügung stehen bzw. diese erst im Zeitraum nach erfolgter Zulassung generiert werden können. Die EMA hat indes erkannt, dass dieser Weg Auswirkungen auf das Pricing and Reimbursement haben kann, in Deutschland vor allen Dingen auf das Verfahren der frühen Nutzenbewertung nach 35a SGB V. Sie hat daher auch Vertreter von HTA-Organisationen angehört und an der noch anhaltenden Diskussion beteiligt IQWiG (215). 41 EMA (214). 42 Sträter (215), S
37 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/ Literatur Apotheke Adhoc (214): AMNOG: Hartz IV der FDP. Apotheke Adhoc vom Apotheke Adhoc (215): Kassen: Erstattungspreis je nach Patientengruppe. Apotheke Adhoc vom Ärzte Zeitung (21): Innovationen unter Druck. Die frühe Nutzenbewertung nach dem AMNOG. Springer Medizin, Neu-Isenburg. Ärzte Zeitung (215a): Pharma-Dialog. Kassen wollen Geld dem Nutzen folgen lassen. Ärzte Zeitung vom Ärzte Zeitung (215b): Arzneiverordnungsreport. AMNOG kommt auf den Prüfstand. Ärzte Zeitung vom Ärzte Zeitung (215c): CDU-Gesundheitsexpertin im Interview: Wir wollen wissen, mit welchen Krankheiten sie kommen. Ärzte Zeitung vom AWMF Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.v. (214): Stellungnahme zum Entwurf des IQWiG- Methodenpapiers: Allgemeine Methoden Version 4.2 vom AWMF Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.v. (215): Stellungnahme zum Verfahren der Frühen Nutzenbewertung von Arzneimitteln nach 35a SGBV und aufgrund des Arzneimittelmarktneuordnungsgesetzes (AMNOG) von 21 vom BT-Drs. Bundesttagsdrucksache 18/2964 vom : Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Kathrin Vogler, Sabine Zimmermann (Zwickau), Susanna Karawanskij, weiterer Abgeordneter und der Fraktion DIE LINKE. Drucksache 18/2733 Umgehung der frühen Nutzenbewertung bei neuen Arzneimitteln. BT-Drs. Bundestagsdrucksache 641/14 vom : Stellungnahme des Bundesrates zum Entwurf eines Gesetzes zur Stärkung der Versorgung in der gesetzlichen Krankenversicherung (GKV-Versorgungsstärkungs-gesetz GKV-VSG). Broich K (215): Diskrepanz zwischen Zulassung und früher Nutzenbewertung. Vortrag im Rahmen der Veranstaltung AWMF im Dialog vom , Frankfurt a.m. Busse R, Panteli D, Henschke C (215): Arzneimittelversorgung in der GKV und 15 anderen europäischen Gesundheitssystemen. Ein systematischer Vergleich. Working papers in health policy and management, Band 11. Cassel D, Ulrich V (215): AMNOG auf dem ökonomischen Prüfstand. Funktionsweise, Ergebnisse und Reformbedarf der Preisregulierung für neue Arzneimittel in Deutschland. Gutachten für den Bundesverband der Pharmazeutischen Industrie e.v. (BPI) vom DGGÖ Deutsche Gesellschaft für Gesundheitsökonomie e.v. (214): Stellungnahme zu den inhaltlichen Aktualisierungen und Ergänzungen im Entwurf der Version 4.2 Allgemeine Methoden vom
38 18 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 DGHO Deutsche Gesellschaft für Hämatologie und medizinische Onkologie, GTH Gesellschaft für Thrombose- und Hämostaseforschung e.v. (214): Stellungnahme zu IQWiG Allgemeine Methoden Entwurf 4.2 vom 7. August 214. EMA European Medicines Agency (214): Pilot project on adaptive licensing. EMA/25435/212, G-BA Gemeinsamer Bundesausschuss (215): Newsletter. G-BA aktuell Nr. 2 April 215. URL: presse/newsletter/14/ (Stand: ). GKV-Spitzenverband (215): AMNOG-Verfahren berücksichtigt Situation in Griechenland. Pressemitteilung vom URL: _und_statements/pressemitteilung_ jsp (Stand: ). Glaeske G, Ludwig WD, Thürmann P (215): Innovationsreport 215. Wissenschaftliche Studie zur Versorgung mit innovativen Arzneimitteln Eine Analyse von Evidenz und Effizienz. SOCIUM, Bremen. Greiner W, Witte J (215): AMNOG-Report 215. Nutzenbewertung von Arzneimitteln in Deutschland. Medhochzwei Verlag, Heidelberg. Haas A (214): Drei Jahre für Nutzenbewertung Zwischenbilanz und Anspruch. Statement des GKV-Spitzenverbandes vom , Berlin. URL: AMNOG-Fachtagung-G-BA_Haas.pdf (Stand: ). Haas A, Tebinka-Olbrich A (214): Nutzenorientierte Medikamentenpreise, in: Pfeiffer D, Stackelberg JM v., Kiefer G (Hrsg.): GKV-Lesezeichen 214. Neues bewerten Bewährtes erneuern. GKV-Spitzenverband. Haas A, Tebinka-Olbrich A (215): Das Wirtschaftlichkeitsgebot im Einzelfall und der Mischpreis. Vortrag 2 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin. Hoppe A, Braun L, Nohlen M (215): OPG Spezial: Wie das AMNOG besser wird. Sonderausgabe, Mai 215. IQWiG Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (215): Frühe Nutzenbewertung erhöht Studiendatentransparenz. Pressemitteilung vom KBV Kassenärztliche Bundesvereinigung (214): Praxisnachrichten. KBV informiert Ärzte über Ergebnisse der frühen Nutzenbewertung. URL: (Stand: ). Kifmann M (21): Preisregulierung von patentgeschützten Arzneimitteln: Welchen Beitrag kann die Kosten-Nutzen-Bewertung leisten? In: Barmer GEK, Repschläger, U., Schulte C. und Osterkamp, N. (Hrsg.): Gesundheitswesen aktuell 21, Redaktion: 37 Grad GmbH, Düsseldorf: Laschet H (214): Nutzenbewertung Stärkerer Fokus auf Lebensqualität nötig. Ärzte Zeitung vom Müller EA, Kirch W (212): Frühe Nutzenbewertung von Arzneimitteln: Verfahrensweise und Entscheidungsgrundlagen. Deutsche Medizinische Wochenschrift; 137 (3):
39 1 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/ Nitz G (214): Aktuelle Probleme im Verfahren der frühen Nutzenbewertung, in: Voigt W (Hrsg.): Herausforderungen und Perspektiven des Pharmarechts. Marburger Schriften zum Gesundheitswesen. Nomos Verlagsgesellschaft, Baden-Baden. O.V. (215): Hauptstadtkongress 215. Politiker stellen AMNOG-Änderungen in Aussicht. Pharma-Fakten vom URL: (Stand: ) Pharmazeutische Zeitung (215): Nutzenbewertung: Gutachten betont AM- NOG-Defizite. Pharmazeutische Zeitung vom Reese U (214): Rechtsschutz und Kontrolldichte im System der frühen Nutzenbewertung, in: Voigt W (Hrsg.): Herausforderungen und Perspektiven des Pharmarechts. Marburger Schriften zum Gesundheitswesen. Nomos Verlagsgesellschaft, Baden-Baden. Schickert J, Schmitz A (211): Frühe Nutzenbewertung Bewertung erster Detailfragen zu Anwendungsbereich, Dossierpflicht und Vergleichstherapie. PharmR; 6/211: Stargardt T, Frey S (213): Gutachten zur Prognose der Arzneimittelausgaben der Techniker Krankenkasse nach Auslaufen des Preismoratoriums und des temporär erhöhten Kollektivrabattes für die Jahre 214 und 215. Gutachten im Auftrag der Techniker Krankenkasse vom , Hamburg. Stöckel F (212): Die frühe Nutzenbewertung nach dem Arzneimittelmarktneuordnungsgesetz (AMNOG). Implikationen aus Sicht der Akteure anhand einer empirischen Analyse. BoD, Norderstedt. Sträter B (215): Adaptive Pathways. Pharmind; 77 (9): Sucker-Sket (215): Verfassungsbeschwerde aus formalen Gründen abgewiesen. DAZ-online vom SVR Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen (214): Bedarfsgerechte Versorgung Perspektiven für ländliche Regionen und ausgewählte Leistungsbereiche. Gutachten 214. Vfa Verband Forschender Arzneimittelhersteller (215a): Stellungnahme zum Entwurf eines Gesetzes zur Stärkung der Versorgung in der gesetzlichen Krankenversicherung (GKV-Versorgungsstärkungsgesetz) BT-Drucksache 18/495 vom URL: (Stand: ). Vfa Verband Forschender Arzneimittelhersteller (215b): Herstellerverbände bringen Neuverhandlung auf den Weg. Gemeinsame Pressemitteilung 2/215 zur AMNOG-Rahmenvereinbarung vom URL: (Stand: ). Verordnungsentwurf des Bundesministerium für Gesundheit: Verordnung über die Nutzenbewertung von Arzneimitteln nach 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach 13b SGB V. Bearbeitungsstand: , 11:52 Uhr. URL:
40 2 Nutzenbewertung von Arzneimitteln in Deutschland Update 214/215 1 Wasem J, Greß S (213): Abschätzung der Arzneimittelausgaben der Gesetzlichen Krankenversicherung 214 und 215. Gutachterliche Stellungnahme für den Verband forschender Arzneimittelhersteller e.v. (Vfa) vom IBES Diskussionsbeitrag Nr. 22, Essen. Wörmann B (215): Frühe Nutzenbewertung neuer Arzneimittel in Deutschland Gesundheitspolitische Schriftenreihe der DGHO, Band 6. Hrsg.: Freund M, Lüftner D, Wilhelm M; DGHO, Berlin.
41 21 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 2.1 Nutzenbewertungsverfahren Nutzenbewertete Wirkstoffe Die Anzahl der seit Einführung des AMNOG jährlich abgeschlossenen Nutzenbewertungsverfahren nimmt kontinuierlich zu. 39 Nutzenbewertungsbeschlüsse legte der G-BA 214 vor. In der ersten Jahreshälfte 215 lagen bereits weitere 31 Beschlüsse vor, weshalb für 215 ein neuer Höchstwert zu erwarten ist (vgl. Abb. 3). Die zunehmende Anzahl abgeschlossener Verfahren ermöglicht dabei immer robustere Darstellungen der Zusammenhänge von Nutzenbewertung und Verordnungsgeschehen. Gleichzeitig nimmt jedoch auch die Komplexität des Verfahrens zu. Dabei zeigen sich Unstimmigkeiten im Verfahren erst mit einer verstätigten Anwendung. Aus diesem Grund ist der fortlaufenden wissenschaftlichen Begleitung der frühen Nutzenbewertung hohe Bedeutung beizumessen. Abbildung 3: Nutzenbewertungen mit G-BA-Beschluss Nachfolgende Auswertungen berücksichtigen alle Verfahren, für die bis zum eine Beschlussfassung des G-BA vorlag. Zu diesem Stichtag haben 111 Wirkstoffe bzw. Wirkstoffkombinationen in 134 Verfahren den AMNOG-Prozess durchlaufen. In diesem Zeitraum sind insgesamt 157 Nutzenbewertungsverfahren vom G-BA initiiert worden, wovon gem. G-BA sechs Verfahren wegen Geringfügigkeit von der Bewertung freigestellt und sechs weitere eingestellt wurden. In 89 % der Verfahren (119 von 134) lag ein durch den G-BA zu bewertendes Herstellerdossier vor, was bei nachfolgenden
42 22 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Reguläre Freistellung von der frühen Nutzenbewertung möglich Auswertungen in der Regel die relevante Bezugsgröße ist. Diese bislang abgeschlossenen Nutzenbewertungsverfahren lassen sich zudem anhand des Ausgangspunktes des Verfahrens differenzieren. Bis zum wurden für 2 Wirkstoffe insgesamt 25 erneute Bewertungsverfahren durchgeführt und abgeschlossen. Die Gründe für die erneuten Verfahren waren: Erweiterung des Anwendungsgebiets bei den folgenden 17 Wirkstoffen Abirateronacetat, Apixaban, Aflibercept, Fixkombination Emtricitabin/Rilpivirin/Tenofovirdisoproxil, Enzalutamid, Erbulin, Fingolimod, Insulin degludec, Ipilimumab, Ivacaftor, Linagliptin, Pasireotid, Regorafenib, Fixkombination Saxagliptin/Metformin Vorliegen neuer wissenschaftliche Erkenntnisse bei den drei Wirkstoffen Linagliptin, Retigabin und Perampanel Antrag auf erneute Nutzenbewertung durch den Hersteller für den Wirkstoff Retigabin nach 35a SGB V, Abs. 5b, weil beim vorherigen Verfahren aus der Anfangsphase der frühe Nutzenbewertung aufgrund nicht vollständig vorgelegter Nachweise kein Zusatznutzen anerkannt wurde Fristablauf der vormaligen Nutzenbewertung bei den Wirkstoffen Erbulin (neues AWG), Vemurafenib. Fertigarzneimittel nach 35a Abs. 1a SGB V können, obwohl sie die tatbestandlichen Voraussetzungen für eine Nutzenbewertung nach 35a Abs.1 SGB V erfüllen, von der Nutzenbewertung nach 35a Abs. 3 SGB V regulär freigestellt werden. Voraussetzung dafür ist, dass die zu erwartenden Ausgaben des Fertigarzneimittels für die gesetzlichen Krankenkassen geringfügig sind. Ausgehend von den im 5. Kap. 15 VerfO G-BA festgelegten Maßstäben zur Beurteilung der Geringfügigkeit der Ausgaben für das Arzneimittel und unter Berücksichtigung der vom pharmazeutischen Unternehmer eingereichten Unterlagen hat der G-BA dem Antrag auf Freistellung in folgenden Verfahren zugestimmt: Tabelle 3: Von der Nutzenbewertung freigestellte Wirkstoffe Wirkstoff Hersteller Indikation Datum Beschlussfassung Dexmedetomidin Andere Hypnotika und Sedativa, parenteral Ceftarolinfosamil Piperaquintetraphosphat, Dihydroartemisinin Orion Corporation AstraZeneca GmbH sigma-tau Arzneimittel GmbH Andere Beta- Lactam-Antibiotika Malariamittel
43 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 23 Wirkstoff Hersteller Indikation Datum Beschlussfassung Chloroprocain Meduna Arzneimittel GmbH Spinalanästhesie Defibrotid Gentium SpA Schwere hepatische veno-okklusive Erkrankung bei hämatopoetischer Stammzelltransplantation Delamanid Otsuka Novel Products GmbH Infektionen Dabei werden nicht alle freigestellten Verfahren auf der Webseite des G-BA gelistet. Die fünf Verfahren für Dabigatranetexilat, Denosumab, Parathyroidhormon, Rivaroxaban und Saxagliptin (neues Anwendungsgebiet) aus dem Bestandsmarktsaufruf wurden durch das am 1. April 214 in Kraft getretene 14. SGB V-Änderungsgesetz und die damit verbundene Aufhebung des 35a Abs. 6 SGB V gegenstandslos. Eingestellt wurde außerdem das Verfahren zu dem Orphan Drug Bedaquilin, da der Wirkstoff lediglich in Krankenhauspackungen im Vertrieb ist. Bedaquilin ist damit weder verordnungsnoch zu Lasten der GKV erstattungsfähig und wird damit nicht von 35a SGB V erfasst. Sieben weitere in 214 erstmals in den Markt eingeführte Arzneimittel wurden vom G-BA im Rahmen der frühen Nutzenbewertung ebenfalls nicht bewertet, darunter zwei weitere Antibiotika: Avanafil Lifestyle-Arzneimittel; Ceftobiprol medocaril kein Unterlagenschutz; Dexlansoprazol Festbetragsgruppenbildung; Levosimendan kein Unterlagenschutz; Peginterferon beta- 1a nach der Verfahrensordnung des G-BA kein neuer Wirkstoff; Präpandemischer Influenza-Impfstoff H5N1 als Mittel zur Prävention von Krankheiten nicht generell erstattungsfähig und daher nicht in die Nutzenbewertung des G-BA einbezogen; Telavancin kein Unterlagenschutz. Die vielfach als lernendes System beschriebene Nutzenbewertung hat in seiner Laufzeit bei den Beteiligten zu einem enormen Wissensaufbau und einer Verstetigung auch organisationaler Strukturen beigetragen. 53 Hersteller bzw. Kooperationen zwischen zwei Herstellern reichten bis zum ein Dossier zur Nutzenbewertung beim G-BA ein: In der Spitze wurden inzwischen elf Verfahren für neue Wirkstoffe oder Wirkstoffkombinationen eines Herstellers durchgeführt. Zu berücksichtigen ist allerdings auch, dass 28 Hersteller bislang mit lediglich einem Wirkstoff in der frühen Nutzen-
44 24 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Abweichung von gesetzlichen Fristen nur in Ausnahmefällen bewertung vertreten waren (Kooperationen hier nicht mitberücksichtigt), welche ggf. keine professionalisierten Strukturen für das Market-Access vorhalten (können). Für diese Hersteller ist der intensive Austausch mit den regulatorischen Instanzen sowie kleinere verfahrensbezogene Spielräume ( Clock-Stop : Nachlieferungen zum Dossier sind aufgrund kleinerer handwerklicher Mängel auch noch außerhalb der gesetzlichen Fristen nach Genehmigung durch den G-BA möglich 43 ) von großer Bedeutung. Der G-BA hat über den Zusatznutzen inklusive mündlicher Anhörung spätestens drei Monate nach Abschluss der Nutzenbewertung durch das IQWiG zu beschließen. In der Bewertung von Orphan Drugs fällt der ebenfalls dreimonatige Zeitraum zur Nutzenbewertung in den Kompetenzbereich des G-BA, da er diese selbst durchführt. Im Rahmen des Verfahrens von Alipogentiparvovec (Glybera ), einem Orphan Drug zur Behandlung der seltenen Stoffwechselerkrankung Lipoproteinlipasedefizienz (LPLD), beschloss der G-BA im April 215 erstmals seit der Einführung des AMNOG die gesetzliche Durchführungsfrist für diese nicht einzuhalten, indem er die Beschlussfassung vertagt hat. 44 Hintergrund ist der dem G-BA bekannt gewordene Umstand, wonach der europäischen Zulassungsbehörde EMA Anfang April mitgeteilt wurde, dass nach Auswertung von Follow-Up-Daten 214 ein negatives Nutzen-Risiko- Verhältnis für den Wirkstoff besteht. Der G-BA maß in diesem Fall dem Schutz der Sicherheit von schwerkranken Patientinnen und Patienten Vorrang bei. Unter Berücksichtigung der gesetzlichen Fiktion über einen Zusatznutzen für Orphan Drugs hätte der G-BA in diesem Verfahren ansonsten einen Zusatznutzen beschließen müssen. Strategisches Umgehen der frühen Nutzenbewertung? Verfahren ohne Herstellerdossier Umstritten ist die vom Gesetzgeber zugestandene Möglichkeit, das Verfahren der frühen Nutzenbewertung durch Nichtvorlage eines Dossiers zu umgehen. Nach aktueller Gesetzeslage können Hersteller die Aufforderung, ein Dossier beim G-BA einzureichen, ignorieren oder dieser nicht rechtzeitig oder vollständig nachkommen. Aufgrund einer Nichteinreichung der erforderlichen Unterlagen gilt ein Zusatznutzen als nicht belegt; somit wird das Arzneimittel nach 35 Abs. 1 SGB V in eine Festbetragsgruppe mit pharmakologischtherapeutisch vergleichbaren Arzneimitteln eingeordnet ( 35a Abs. 4 Satz 1 SGB V). Wegen der preisrechtlichen Bedeutung des Zusatznutzens ist es für pharmazeutische Unternehmen eigentlich von erheblicher Bedeutung, einen Nutzennachweis zu führen. In den Jahren 211 bis 215 wurde in 15 Fällen (11 %) kein Dossier für einen von der frühen Nutzenbewertung erfassten Wirkstoff vorgelegt (vgl. Tab. 4). Zwei Hersteller machten von dieser Möglichkeit 43 Wortprotokoll der mündlichen Anhörung zu Lomitapid, S G-BA (215).
45 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 25 bislang jeweils zweimal Gebrauch. Drei Verfahren ging eine Indikationserweiterung voraus. In zwei Fällen (Insulin degludec, Linagliptin) sprach der G-BA dabei im Rahmen der Erstbewertung keinen Zusatznutzen aus. Lediglich Regorafenib konnte zuvor einen geringen Zusatznutzen im Vergleich zur zweckmäßigen Vergleichstherapie nachweisen. Tabelle 4: Wirkstoff Verfahren ohne Dossierbewertung Status 215 Datum Beschlussfassung DDD-Nettokosten in Dossier vom Hersteller nicht vorgelegt Azilsartan Medoxomil Festbetrag,78 Bromfenac Außer Vertrieb,22 Cobicistat Keine Festbetragsgruppe 1,67 Fluticasonfuroat, Festbetrag 1,32 Vilanterol Insulin degludec Marktrücknahme 3,66 (neues AWG) ange- kündigt Lebende Larven Außer Vertieb n.v. von Lucilia sericata Linagliptin (neues Opt-Out 1,94 AWG) Nepafenac Keine Festbetragsgruppe,78 Olodaterol Festbetrag 1,26* Pitavastatin Opt-Out 2,8 Regorafenib (neues AWG) Retigabin (erneute Nutzenbewertung) Tegafur, Gimeracil, Oteracil Keine Festbetragsgruppe 18,2* Opt-Out 8, Keine Festbetragsgruppe 16,24 Materiell-unvollständiges Dossier eingereicht Lomitapid Opt-Out n.v. Regadenoson Keine Festbetragsgruppe 72,24 AWG Anwendungsgebiet; n.v. nicht verfügbar; * DDD-Bruttokosten
46 26 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Sechs von 15 Präparaten, für welche kein Dossier zur Nutzenbewertung vorgelegt wurde, sind in Deutschland zum nicht mehr verfügbar. Für einen weiteren Wirkstoff (Insulin degludec) ist die Marktrücknahme angekündigt. 45 Die übrigen acht Wirkstoffe bzw. Fixkombinationen kamen mit dem Preis einer bestehenden Festbetragsgruppe oder dem der günstigsten vergleichbaren Therapie auf den Markt. Kritiker dieser Regelung bemängeln, dass durch die Nichteinreichung eines Dossiers Medikamente zum Preis der Vergleichstherapie auf den Markt gebracht werden könnten, selbst wenn es eine Wahrscheinlichkeit dafür gibt, dass unter Aspekten der evidenzbasierten Medizin der Nutzen geringer als der vergleichbarer Therapiealternativen ist. 46 Durch eine ggf. kalkulierte Verweigerung von Daten könne der pharmazeutische Unternehmer so ein komplett negatives Bewertungsergebnis mit vermeintlich negativen Folgen für den Absatz verhindern. Für die Arzneimittelversorgung fehlen so wichtige Informationen für eine nutzenbasierte Verordnungsentscheidung. Klärungsbedürftig ist insofern, ob es sich bei der gesetzlich eingeräumten Möglichkeit zur Umgehung der Nutzenbewertung um eine gravierende und korrekturbedürftige Fehlregulierung handelt oder ob sich eine verfahrenspraktische Rechtfertigung für diese Regelung konstruieren lässt. Die von verschiedenen Seiten geforderten Sanktionierungsmechanismen, zum Beispiel in Form obligatorischer Abschläge vom Preisniveau der zvt, was einer Eingruppierung als geringerer Nutzen als die zvt gleichen würde, sind im Hinblick auf die Komplexität des Frühbewertungsverfahrens kritisch zu diskutieren. 47 Die Nichteinreichung eines Dossiers ist von Seiten des Herstellers nicht begründungspflichtig. Eine Auswertung der mündlichen Wortprotokolle 48 bzw. tragenden Gründe der entsprechenden G-BA-Beschlüsse zeigt jedoch, dass in 13 der 15 beschriebenen Verfahren der pharmazeutische Unternehmer bewusst auf eine Dossiereinreichung verzichtete. Dem liegen verschiedene Begründungsmuster zugrunde (vgl. Abb. 4). 45 Siehe hierzu ausführlich Kapitel Exemplarisch: IQWiG (215), S Haas (214); Wörmann (215), S Die Erfordernis zur Durchführung eines Stellungnahmeverfahrens seitens des G-BA liegt nur bei Dossiervorlage vor.
47 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 27 Abbildung 4: Herstellerseitige Gründe für eine Nichtvorlage des Nutzenbewertungsdossiers (n=15) Unvollständiges Dossier Bestehende Festbetragsgruppe Hohe Dossiererstellungskosten Freistellung wurde erwartet Daten nicht geeignet In 4 % der Verfahren (Azilsartan Medoxomil, Bromfenac, Linaglitpin [neues AWG], Nepafenac, Retigabin [erneute Nutzenbewertung], Regorafenib [neues AWG]) ist eine Nichteinreichung demnach auf das vorliegende Evidenzmaterial zurückzuführen. Insbesondere in unmittelbar nach Einführung des AMNOG durchgeführten Bewertungsverfahren (Azilsartan Medoxomil, Nepafenac) begründeten die Hersteller die Nichtvorlage mit zum Teil veralteten Studiendaten, welche nicht zum Zusatznutzennachweis gegenüber der vom G-BA festgelegten zvt geeignet sind. Nepafenac wurde beispielsweise bereits im Jahr 27 zugelassen, so dass eine Vielzahl der vorliegenden Studien nicht den Anforderungen des AM- NOG-Prozesses entsprach. Zwei Hersteller (Verfahren zur Fixkombination Tegafur, Gimeracil, Oteracil sowie zu Cobicistat) gaben an, durch eine Nichtvorlage Ressourcen für eine teure Dossiererstellung zu sparen, da beispielsweise in den Beratungsgesprächen mit dem G-BA absehbar war, dass ein Zusatznutzen aufgrund der vorliegenden Evidenzlage nicht zu belegen sein würde. Aufwand und Ertrag der Dossiererstellung stehen ggf. auch dann aus Sicht des Herstellers nicht in einem wirtschaftlichen Verhältnis, wenn die zvt hinsichtlich der eigenen Preisstrategie bereits ausreichend bepreist ist. Im Verfahren von Cobicistat kommt hinzu, dass im Hinblick auf das vorliegende Evidenzmaterial voraussichtlich nur für einen sehr geringen Teil der indizierten Patientenpopulation einen Zusatznutzen hätte generiert werden können, der aufgrund der Kostenneutralität zur zweckmäßigen Vergleichstherapie in den Preisverhandlungen nicht hätte abgebildet werden können. 49 Für die Wirkstoffe Lomitapid und Regadenoson reichte der Hersteller zwar ein Dossier ein, die abschließende Vollständigkeitsprüfung 49 Wortprotokoll der mündlichen Anhörung zu Cobicistat.
48 28 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 des G-BA ergab jedoch formale Mängel, die zur Unvollständigkeit entsprechend 35a Absatz 1 Satz 5 SGB V führten. Im Verfahren von Lomitapid führte der G-BA unter anderem eine unvollständige bibliographische Literaturrecherche, fehlende Volltexte, nicht zu öffnende RIS-Dateien sowie strukturelle Mängel, welche vor allem die Zuordnung und Verortung der dargestellten Nachweise betreffen, an. 5 Dies hat gemäß 35a Absatz 1 Satz 5 SGB V zur Folge, dass keine Bewertung zu der Fragestellung, ob der betreffende Wirkstoff einen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie aufweist, erfolgt. Legt ein pharmazeutischer Unternehmer die für die Nutzenbewertung eines Arzneimittels nach 35a SGB V erforderlichen Nachweise entsprechend der Vorgaben nach 5. Kapitel 17 Absatz 1 S. 6 VerfO nicht vollständig vor, können diese gem. 35a Absatz 1 Satz 5 SGB V im laufenden Bewertungsverfahren nicht mehr nachgereicht und berücksichtigt werden. Zudem merkte der G-BA an, dass der Hersteller nicht die Möglichkeit zur Vorprüfung der Unterlagen in Anspruch genommen hatte. 51 In Verfahren von Lomitapid hat der G-BA jedoch den Beschluss auf ein Jahr befristet. Die Zulassung erfolgte seitens der EMA mit Auflagen wie einer zusätzlichen Überwachung und der Erhebung weiterer Studiendaten. Es werden somit neue Daten erwartet, die eine Befristung durch den G-BA rechtfertigen. Zum einen besteht ein globales Register (Lomitapide Observational Worldwide Evaluation Registry, LOWER), in dem eine Registrierung von bis zu 4 Patienten im ersten Jahr nach Zulassung zu erwarten ist. Zudem laufen derzeit zwei Medikamenteninteraktionsstudien im Zusammenhang mit Cyp3A4-Inhibitoren, deren Abschluss bevorsteht sowie eine Extensionsstudie zur Zulassungsstudie. 52 Ungeklärt ist derzeit noch, inwieweit die Beweisführung eines gegenüber der zvt geringeren Nutzens an den Komparator in der Zulassungsstudie gebunden ist. In dem Verordnungsentwurf der Arzneimittelnutzenverordnung ist zur Einstufung des Zusatznutzenausmaßes in 5 Abs. 7 der AM-NutzenV hinsichtlich der Bindungswirkung der arzneimittelrechtlichen Zulassung dargelegt, dass in Fällen, in denen der Komparator der Zulassungsstudie identisch mit der zvt ist, das zu bewertende Arzneimittel mit neuem Wirkstoff der Vergleichstherapie nicht unterlegen sein kann. 53 Sind Vergleichstherapie und Komparator der Zulassungsstudie jedoch nicht identisch, kann der Nutzen des zu bewertenden Arzneimittels mit neuen Wirkstoffen gegebenenfalls geringer sein als der Nutzen der zweckmäßigen Vergleichstherapie. Entsprechende Sachverhalte sind bei abschließender Bewertung der Nichtvorlage eines Dossiers zu prüfen. 5 Wortprotokoll der mündlichen Anhörung zu Lomitapid. 51 Wortprotokoll der mündlichen Anhörung zu Lomitapid. 52 Wortprotokoll der mündlichen Anhörung zu Lomitapid. 53 Verordnungsentwurf der AM-NutzenV, S. 18.
49 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 29 Bewertete Anwendungsgebiete Auch im Jahr 214 sowie dem ersten Halbjahr 215 dominieren neue Wirkstoffe aus zwei Therapiegebieten das Verfahren: Onkologika (insgesamt 4 Verfahren, 13 in 214) und Arzneimittel zur Behandlung von Stoffwechselkrankheiten (insgesamt 29 Verfahren, 7 in 214), insbesondere des Diabetes Mellitus Typ 2 (18 Verfahren). Abbildung 5: Abgeschlossene Nutzenbewertungen nach therapeutischem Anwendungsgebiet Onkologika und Stoffwechselerkrankungen überwiegen Hauterkrankungen Krankheiten des Urogenitalsystems Krankheiten des Blutes und der blutbildenden Krankheiten des Verdauungssystems Krankheiten des Muskel-Skelett-Systems Psychische Erkrankungen Krankheiten des Atmungssystems Augenerkrankungen Herz-Kreislauf-Erkrankungen Sonstige Erkrankungen Krankheiten des Nervensystems Infektionskrankheiten Stoffwechselkrankheiten Onkologische Erkrankungen Ein Trend, welcher sich weiter verstetigen wird. Denn unter den 214 von der FDA neu zugelassenen Arzneimitteln waren mit einem Anteil von 22 % erneut Onkologika die zulassungsstärkste Wirkstoffgruppe. Für fünf dieser neuen Onkologika (Nivolumab, Pembrolizumab, Ramucirumab, Siltuximab, Idelalisib) wird wiederum in den kommenden Jahren ein jährliches Umsatzpotential von über einer Milliarde Dollar prognostiziert. 54 Mitgliedsunternehmen des Vfa bestätigten im Rahmen einer Erhebung vom August 215, dass dieser Trend auch zukünftig anhalten werde. So werden Onkologika unter den jährlich neu zugelassenen Arzneimitteln quantitativ die führende Indikation bleiben. 55 Ein Umstand, der zur Bewertung der AMNOG-Funktionalität zunächst nicht weiter von Bedeutung erscheint insbesondere vor dem Hintergrund, dass die bislang nutzenbewerteten Onkologika hinsichtlich des vom G-BA zugesprochenen Zusatznutzenausmaß überdurchschnittlich gut abgeschnitten haben. Kritisch bewertet wird jedoch, dass viele neue onkologische Wirkstoffe inzwischen als Arz- 54 Mullard (215), S Vfa (215).
50 3 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 neimittel zur Behandlung seltener Erkrankungen (Orphan Drugs) zugelassen würden, deren Zusatznutzen durch die Zulassung belegt ist. 56 Ein Trend, welcher anhält und deshalb auch zukünftig für Diskussionen im Nutzenbewertungskontext sorgen dürfte. Denn in den USA wurden im Jahr 214 alle neu zugelassenen Onkologika als Orphan Drugs zugelassen, in Europa waren es immerhin fünf von zehn. 57 Orphan Drugs 24 der bislang 119 Nutzenbewertungsverfahren hatten die Bewertung eines neuen Wirkstoffes zur Behandlung seltener Erkrankungen zum Gegenstand (2,2 %; vgl. Abb. 6). Drei dieser Orphan Drugs wurden inzwischen zweimal bewertet. Für Pasireotid (Signifor ) und Ivacaftor (Kalydeco ) folgte auf die Erstbewertung im Jahr 212 bzw. 213 eine Erweiterung des Anwendungsgebietes. Das zweite Bewertungsverfahren zu Ruxolitinib (Jakavi ), die erste zugelassene Behandlungsoption bei der seltenen Blutkrebsform Myelofibrose, wurde gem. 35a Abs. 1 Satz 11 SGB V nach Überschreiten der 5-Millionen- -Umsatzgrenze Ende 214 abgeschlossen. Übersteigt der Umsatz eines Orphan Drugs mit der gesetzlichen Krankenversicherung zu Apothekenverkaufspreisen einschließlich Umsatzsteuer in den letzten zwölf Kalendermonaten einen Betrag von 5 Millionen, hat der pharmazeutische Unternehmer innerhalb von drei Monaten nach Aufforderung durch den Gemeinsamen Bundesausschuss ein Dossier zu übermitteln und darin den Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie nachzuweisen. Für Ruxolitinib, dem erstmals aufgrund der Überschreitung der Umsatzgrenze erneut bewerteten Orphan Drug, ging diese erneute Bewertung mit einer Hochstufung des Zusatznutzenausmaßes einher (Kapitel 2.2). 56 Ärzteblatt (215a). 57 Ärzteblatt (215a).
51 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 31 Abbildung 6: Orphan Drug-Anteil in der frühen Nutzenbewertung (nach Anzahl der Verfahren) % 2% 4% 6% 8% 1% Orphan Drugs Übrige Verfahren Neben Ruxolitinib könnten zehn weitere Orphan Drugs bei voller Ausschöpfung des potentiellen GKV-Marktpotentials zukünftig einer vollständigen Nutzenbewertung unterzogen werden. Berücksichtigt man die vom G-BA geschätzte GKV-Zielpopulation 58 sowie die Jahrestherapiekosten pro Patient entstehen pro Jahr potentielle Kosten in Höhe von über 5 Millionen für Brentuximab Vedotin, Decitabin, Ibrutinib, Macitentan, Pirfenidon, Pomalidomid, Ponatinib, Riociguat, Siltuximab und Teduglutid. Unabhängig davon werden erneute Nutzenbewertungen aufgrund eines befristeten G-BA-Beschlusses für Cabozantinib, Bosutinib, Alipogentiparvovec, Ataluren und Ponatinib erfolgen. Die mit dem AMNOG verbundene Fiktion eines mit erfolgter Zulassung obligatorisch belegten Zusatznutzens, welcher lediglich hinsichtlich des Ausmaßes durch den G-BA 59 zu quantifizieren ist, bekommt durch die konstant steigende Anzahl entsprechender Bewertungsverfahren versorgungsrelevante Bedeutung. Der Orphan- Drug-Anteil an den Nutzenbewertungsverfahren stieg dabei von 11 % in 212 auf 21 % in 214 bzw. 26 % innerhalb der ersten Jahreshälfte 215. Um einen möglichen Trend einer strategischen Orphanisierung zu begegnen, forderte der GKV-SV zuletzt, die Freistellungsgrenze für Orphan Drugs auf 3 Millionen pro Jahr herabzusenken. 6 Bei theoretisch voller Ausschöpfung des potentiellen GKV-Marktpotentials wären nach dieser Logik statt zehn 17 weitere Bei angegebenen Spannenweiten wurde hier der Mittelwert berücksichtigt. Im Gegensatz zur regulären Nutzenbewertung durch das IQWiG ist die Methodik des G-BA zur Bewertung von Orphan Drugs ist nicht transparent. Die Diskrepanzen zwischen der Methodik des G-BA und des IQWiG kann indes dazu führen, dass die Dossiers für neue Arzneimittel in derselben seltenen Erkrankung je nach Status unterschiedlich ausgewertet werden. Haas (214).
52 32 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Orphan Drugs von einer vollständigen Nutzenbewertung erfasst. Die Bedeutung von Orphan Drugs ist trotz kontroverser methodischer wie rechtlicher Streitpunkte im Gesamtkontext der frühen Nutzenbewertung hinsichtlich der Größe der potentiellen GKV-Zielpopulation zunächst gering (vgl. Abb. 7). Mit einem Anteil von,1 % an der bislang von der frühen Nutzenbewertung theoretisch erfassten GKV- Population machen die bislang bewerteten Orphan Drugs einen sehr geringen Mengeneffekt aus. Die im Rahmen der Nutzenbewertung für die Orphan Drugs geschätzte maximale GKV-Zielpopulation liegt gemittelt bei ca Patienten, wobei alleine Riociguat (Adempas ) und Prifenidon (Esibret ) 36 % dieser theoretischen GKV-Population abdecken. Abbildung 7: GKV-Zielpopulation nutzenbewerteter Orphan Drugs Neu war in 215 die Bewertung eines für Kinder zugelassenen Wirkstoffes (sog. PUMA : Paediatric-use marketing authorisation), welchem der G-BA im Rahmen der frühen Nutzenbewertung erstmalig einen erheblichen Zusatznutzen attestierte. In der Bewertung von Propranolol (Hemangiol ), indiziert zur Behandlung von Säuglingen mit proliferativen infantilen Hämangiomen (Blutschwämmchen), die eine systemische Therapie erfordern, wurde von Seiten des G-BA das Vorliegen einer belastbaren vergleichenden Studie hervorgehoben, da die Evidenzgenerierung in diesem Anwendungsfeld ansonsten besonders anspruchsvoll ist. Dem voraus ging eine Verfahrensänderung des G-BA. In dem Beschluss vom 19. Juni 214 stellt der G-BA klar, dass Arzneimittel, die eine Zulassung ausschließlich für Kinder erhalten, in die Nutzenbewertung einbezogen werden. Diese Regelung hatte der G-BA schon durch eine frühere Änderung seiner Verfahrensordnung in 2 Abs. 1 Satz 4 VerfO übernommen. Der Grund dafür ist, dass diese Präparate nach der EU-Kinderverordnung Unterlagenschutz genie-
53 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 33 ßen, obwohl sie nur eine Weiterentwicklung eines bereits zugelassenen Arzneimittels sind eine sogenannte line extension. Angeregt wird dennoch, die Bewertung von PUMA-Wirkstoffen analog zum Orphan Status solcher Medikamente z. B. in den USA auch im Nutzenbewertungsverfahren als Orphan Drug zu führen und damit den Zusatznutzen a priori anzuerkennen. 61 Konditionale Beschlüsse und Re-Evaluationen Mit der Veröffentlichung der Beschlussfassung im Bundesanzeiger über eine Änderung der Arzneimittel-Richtlinie (AM-RL) sowie entsprechender Tragender Gründe ist der formale Prozess der frühen Nutzenbewertung im G-BA zunächst abgeschlossen. Allgemein sollte die frühe Nutzenbewertung des G-BA im Kontext der Erstattungssystematik der GKV nicht als einmaliger sondern vielmehr als zyklischer Prozess verstanden werden. Derzeit können drei Faktoren zu einer erneuten Nutzenbewertung führen, welche dann ggf. eine Zusatznutzenaktualisierung durch den G-BA sowie eine Nachverhandlung des Erstattungsbetrages anstoßen: Durch den pharmazeutische, Unternehmer, frühestens ein Jahr nach Veröffentlichung des Beschlusses zu einer Nutzenbewertung, wenn die Erforderlichkeit wegen neuer wissenschaftlicher Erkenntnisse nachgewiesen wird (5. Kapitel 14 VerfO G-BA). Hält der G-BA den Antrag für begründet, fordert er das Unternehmen auf, innerhalb von 3 Monaten nach Zustellung des Beschlusses ein neues Dossier vorzulegen. Durch den G-BA auf Antrag seiner Mitglieder wegen neuer wissenschaftlicher Erkenntnisse, frühestens ein Jahr nach dem Beschluss über eine Nutzenbewertung (5. Kapitel 13 VerfO G-BA). Durch den G-BA. durch Befristung der Beschlüsse ( 35a Abs. 3 S. 4 SGB V). Gemäß 3 Nr. 7 AM-NutzenV i. V. m. 5. Kapitel 1 Abs. 2 Nr. 6 VerfO G-BA beginnt das Verfahren der Nutzenbewertung für Arzneimittel mit Fristablauf erneut. Von der Befristungsmöglichkeit machte der G-BA bislang in jedem vierten Verfahren gebrauch, dem zuvor eine Auswertung der vorliegenden Evidenz vorausging (n=28). Zudem wurde der Beschluss über das Verfahren von Lomitapid, für welches der pharmazeutische Unternehmer ein aus Sicht des G-BA unvollständiges Dossier vorgelegt hat, auf ein Jahr befristet. Begründet wird dies mit der Zulassung von Lomitapid (Lojuxta ) durch die EMA, welche unter besonderen Umständen (exceptional circumstances) erfolgte. Lomitapid (Lojuxta ) erhielt trotz kleinem Anwendungsgebiet (ca. 7 Patienten in Deutschland) keinen Orphan Drug Status. Die Zulassung erfolgte 61 BAH (215).
54 34 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 mit Auflagen wie einer zusätzlichen Überwachung und der Erhebung weiterer Studiendaten. Es werden somit neue Daten erwartet, welche eine Befristung rechtfertigen. Die Befristungsdauer der G-BA-Beschlüsse variiert und liegt im Durchschnitt bei zweieinhalb Jahren (vgl. Abb. 8). Jeweils achtmal wurde der Beschluss auf zwei bzw. drei Jahre begrenzt. Siebenmal auf ein Jahr, einmal auf vier Jahre und insgesamt viermal beschloss der G-BA eine auf fünf Jahre befristete Beschlussgültigkeit. Abbildung 8: Dauer konditionaler G-BA-Beschlüsse Ø 2,5 Jahre 1 Jahr 2 Jahre 3 Jahre 4 Jahre 5 Jahre Eine Beschlussbefristung ist grundsätzlich sowohl durch sachliche Gründe als auch durch eine bedingte Zulassung durch die Europäische Kommission (Conditional Marketing Authorization) möglich (siehe ausführlich Kapitel 3.5). Hintergrund ist dabei in der Regel fehlende Evidenz zum Zeitpunkt der Frühbewertung. Auffällig ist die häufige Befristung der Beschlüsse zu onkologischen Verfahren (n=17). 42 % aller bislang abgeschlossenen Onkologika-Verfahren wurden bislang befristet. Die einer Befristung zugrunde liegenden Einschätzungen zum Ausmaß des Zusatznutzens sind indes breit gestreut, wobei es eine klare Häufung für Verfahren mit geringem Zusatznutzen (n=14, 5 %) gibt. Es werden jedoch auch Verfahren mit zumindest in einer Teilpopulation beträchtlichem Zusatznutzen (n=7, 25 %) befristet. In fünf Fällen lag einer Befristung ein im Ausmaß nicht quantifizierbarer Zusatznutzen, zweimal kein Zusatznutzen zugrunde. In beiden Fällen (Dabrafenib, Ipilimumab [neues AWG]) waren zuvor formale Gründe für den Entscheid über einen fehlenden Zusatznutzen ausschlaggebend.
55 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 35 Für den G-BA haben befristete Beschlüsse insbesondere organisatorische Konsequenzen, müssen zu der eh steigenden Anzahl neuer Nutzenbewertungsverfahren auch die Re-Evaluationen fristgerecht bewertet werden. In 215 laufen beispielsweise elf befristete Beschlüsse aus, für welche der pharmazeutische Unternehmer innerhalb von drei Monaten ein Dossier vorlegen muss (vgl. Abb. 9). Abbildung 9: Befristete G-BA Beschlüsse (Stand: ) 62 Ocriplasmin Bosutinib Pertuzumab Sipuleucel-T Cabozantinib Ipilimumab Ipilimumab (neues AWG) Dabrafenib Axitinib Vandetanib (Absatz 5b) Sofosbuvir Ataluren Alipogentiparvovec Idelalisib Vismodegib Sitagliptin, Metformin Sitagliptin Saxagliptin Belatacept Extrakt aus Canabis Sativa Lomitapid Afatinib Saxagliptin Metformin Crizotinib Fingolimod Regorafenib Ponatinib Eribulin Vemurafenib Die Beschlussbefristung von Sofosbuvir wurde mit Beschluss vom unter Verweis auf die Weiterentwicklung der therapeutischen Behandlungsoptionen der chronischen Hepatitis C aufgehoben.
56 36 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Das AMNOG hat eine Rückkopplungsschleife entwickelt Agenda des IQWiG Neben der konstant gestiegenen Zahl vollständiger Re-Evaluationen können pharmazeutische Unternehmen während des Stellungnahmeverfahrens zu einer IQWiG-Nutzenbewertung fehlende oder besser aufbereitete Daten beim G-BA nachreichen. Der G-BA beauftragt dann das IQWiG mit der Prüfung der weiteren Unterlagen woraufhin das Institut einen erweiterten Bericht in Form eines Addendums vorlegt. Insgesamt veröffentlichte das IQWiG zwischen 211 und Mitte solcher Folgebewertungen für 28 Verfahren (für Ipilimumab zur Behandlung des fortgeschrittenen Melanoms liegen zwei Addenda vor). Die frühe Nutzenbewertung entwickelt sich damit zunehmend zu einem Verfahren mit Rückkoppelungsschleife. Tabelle 5: Addenda mit Änderung der vorherigen Bewertung Wirkstoff Datum Addendum Hintergrund Crizotinib Weitere Endpunktdaten zur Symptomatik (Morbidität) und gesundheitsbezogener Lebensqualität Daclastavir Vorlage neuerer Studienergebnisse und Sensitivitätsanalysen Dabrafenib Änderung der Vergleichstherapie durch den G-BA Emtricitabin, Rilpivirin, Tenofovir Fehlende Subgruppenanalysen Enzalutamid Daten zu Nebenwirkungen und Schmerztherapie Fidaxomicin Fehlende Subgruppenanalysen Ledipasvir/ Sofosbuvir Bewertung von weiteren Daten aus fünf Studien Sipuleucel-T Bewertung des Ergebnisses zum Endpunkt Gesamtüberleben Änderung Zusatznutzen Zusatznutzen Auswertung eines indirekten Vergleiches Zusatznutzen Zusatznutzen, Aussagesicherheit Zusatznutzen Zusatznutzen Zusatznutzen 63 Abirateronacetat (neues AWG, Aflibercept (Visusbeeinträchtigung infolge eines diabetischen Makulaödems), Canagliflozin, Crizotinib, Dabrafenib, Daclatasvir, Dapagliflozin, Dimethylfumarat, Empagliflozin, Fixkombination Emtrictabin/Rilpivirin/Tenofovirdisoproxil, Enzalutamid, Eribulin (neues AWG, Neubewertung nach Fristablauf), Fidaxomicin, Fingolimod, Ipilimumab (neues AWG), Ledipasvir/Sofosbuvir, Mirabegron, Pertuzumab, Regorafenib, Simeprevir, Sipuleucel-T, Sitagliptin/Metformin, Sofosbuvir, Tafluprost/Timolol, Umeclidinium/Vilanterol, Vandetanib (Absatz 5b), Vildagliptin, Vildagliptin/Metformin.
57 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 37 Wirkstoff Sitagliptin/ Metformin Vandetanib (Absatz 5b) Vildagliptin/ Metformin Datum Addendum Hintergrund Auswertungen getrennt nach Metformin Exposition Weitere Endpunktdaten zum Schweregrad der Schmerzsymptomatik (Morbidität) und Nebenwirkungen Auswertungen getrennt nach Metformin Exposition Änderung Heranziehung weiterer Studiendaten Zusatznutzen Heranziehung weiterer Studiendaten Insgesamt achtmal konnte durch ein Addendum ein Zusatznutzen attestiert werden, wo zuvor von Seiten des IQWiG keiner festgestellt worden war (vgl. Tab. 5). Die Änderungen erfolgten dabei auf unterschiedlicher Ebene und bezogen sich sowohl auf die Kategorisierung des Zusatznutzens als auch auf die Aussagesicherheit. In drei Verfahren berücksichtigte das IQWiG im Addendum auf Antrag des G-BA weitere Evidenz (Dabrafenib, Sitagliptin/Metformin, Vildagliptin/Metformin). In keinem dieser drei Verfahren wurde daraufhin die Entscheidung über das Ausmaß des Zusatznutzens geändert.
58 38 Abgeschlossene Verfahren der frühen Nutzenbewertung Ergebnisse der frühen Nutzenbewertung Positiv bewertete Verfahren überwiegen Zusatznutzenspezifische Ergebnisse Zentrales Ergebnis der frühen Nutzenbewertung durch G-BA und IQWiG ist die quantitative Bezifferung eines Zusatznutzens sowie die Bewertung der Ergebnissicherheit der vorliegenden Evidenz. Aus einer verfahrensbezogenen Perspektive (z. B. hinsichtlich der Aufnahme von Erstattungsbetragsverhandlungen) ist es erforderlich, das Ergebnis der frühen Nutzenbewertung zunächst danach zu beurteilen, ob überhaupt ein Zusatznutzen festgestellt wurde oder nicht. In einer solchen Betrachtung wird jedem Verfahren, unabhängig von der Anzahl bewerteter Subgruppen, das jeweils höchste erreichte Zusatznutzenausmaß gemäß G-BA-Beschluss zugeordnet. Dementsprechend wurde in den bis zum abgeschlossenen Verfahren in 74 Fällen (55 %) ein Zusatznutzen vom G-BA festgestellt. Der Anteil positiv bewerteter Verfahren erhöht sich auf 62 %, wenn alle aufgrund eines fehlenden Dossiers nicht nutzenbewertete Wirkstoffe aus der Betrachtung ausgeschlossen werden. Bei Vorliegen zumindest eines Anhaltspunktes eines positiven Effektes auf Endpunktebene sind zur Operationalisierung der Feststellung des Ausmaßes des Zusatznutzens folgende quantitative Aussagen möglich: erheblich beträchtlich gering nicht quantifizierbar (was nicht mit nicht vorhanden verwechselt werden sollte) In den 74 Verfahren, in denen der G-BA den nutzenbewerteten Wirkstoffen in wenigstens einer Subgruppe einen Zusatznutzen zusprach, wurde das höchstmögliche Ausmaß eines erheblichen Zusatznutzen bislang erst einmal erreicht. Ein beträchtlicher Zusatznutzen konnte in 26 Verfahren (22 %), ein geringer Zusatznutzen in 34 Nutzenbewertungsverfahren (29 %) festgestellt werden. Ein im Ausmaß nicht-quantifizierbarer Zusatznutzen lag nach Einschätzung des G-BA in 13 Verfahren (11 %) vor. Die Ausmaßkategorie Zusatznutzen nicht quantifizierbar trägt dabei dem Umstand Rechnung, dass das Effektausmaß auf Endpunktebene nicht in jedem Fall eindeutig quantifizierbar ist. Falls z. B. ein statistisch signifikanter Effekt für ein ausreichend valides Surrogat vorliegt, eine verlässliche Schätzung für den jeweiligen Effekt der patientenrelevanten Zielgröße jedoch nicht möglich ist, lässt sich der (patientenrelevante) Effekt nicht zweifelsfrei quantifizieren. 64 Ein nicht quantifizier- 64 IQWiG (213), S. 52.
59 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 39 barer Zusatznutzen ist somit kein Ausdruck nicht vorhandener Evidenz. Für die sich der Nutzenbewertungen anschließenden Erstattungsbetragsverhandlungen ebenso wie für die Verordnungsentscheidung des Arztes ergibt sich jedoch das Problem, dass sich der Mehrwert entsprechender Wirkstoffe theoretisch zwischen kleinstund größtmöglichem bewegen könnte. Dennoch, bevor sich im Verfahren aufgrund entsprechender Unsicherheit kein Zusatznutzen abbilden lässt, stellt auch ein nicht quantifizierbarer Zusatznutzen für den pharmazeutischen Unternehmer einen Einstieg in die Verhandlungen mit dem GKV-SV über die Höhe des Erstattungsbetrages dar. Hinzu kommt, dass die beteiligten Parteien zunächst bestrebt waren, einen nicht quantifizierbaren Zusatznutzen als Ergebnis zu vermeiden. In den in der ersten Jahreshälfte 215 abgeschlossenen Nutzenbewertungsverfahren hat die Vergabe eines nicht quantifizierbarer Zusatznutzens jedoch wieder deutlich zugenommen und seinen bisherigen Höhenpunkt erreicht. G-BA und IQWiG führen differenzierte Zusatznutzenbewertungen für einzelne therapeutisch relevante Subgruppen durch und kommen dabei zum Teil zu abweichenden Einschätzungen (Kapitel 3.5). Als Ergebnis dieser subgruppenspezifischen Bewertungen verschiebt sich die Ergebnisbilanz der bislang abgeschlossenen Nutzenbewertungsverfahren (vgl. Abb. 1). Abbildung 1: Zusatznutzen gemäß G-BA-Beschluss , a) nach Verfahren (n=119), b) nach Subgruppen (n=257) 65 a) b) Erheblich Beträchtlich Gering Nicht quantifizierbar Kein Zusatznutzen Erheblich Beträchtlich Gering Nicht quantifizierbar Kein Zusatznutzen Geringerer Nutzen In 6 von 119 Verfahren (5,4 %) wird das Ausmaß des Zusatznutzens anhand von zwei oder mehr Subgruppen differenziert. In einer solchen, an dem versorgungs- und verordnungsrelevanten Output der Nutzenbewertung orientierten subgruppenspezifischen Betrachtung der Bewertungsergebnisse, nimmt der Anteil positiv bewerteter Verfahren ab. Ein erheblicher Zusatznutzen wurde bislang lediglich einmal vergeben. In insgesamt 3 Subgruppen identifizierte der G-BA einen beträchtlichen (12 %), in 5 Subgruppen einen geringen (19 %) und in weiteren 25 Subgruppen einen nicht quantifizierbaren Zusatznutzen (1 %). In 69 Subgruppen konnte der G-BA keinen 65 Nicht berücksichtigt sind Verfahren ohne Herstellerdossier.
60 4 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Zusatznutzen feststellen. Auf Subgruppenebene kam der G-BA darüber hinaus bislang in zwei Verfahren zu der Einschätzung, dass es einen Anhaltspunkt für einen gegenüber der zvt geringeren Nutzen gibt (vgl. Tab. 6). Tabelle 6: Zusatznutzen auf Subgruppenebene nach Jahr Zusatznutzen Anzahl Subgruppen Erheblich Beträchtlich Gering Nicht quantifizierbar Nicht belegt Geringerer Nutzen Stand: Unterschiede in versorgungs- und verhandlungsrelevanten Ergebnissen der Nutzenbewertung In 215 wurde für Propranolol (Hemangiol ), indiziert zur Behandlung von Säuglingen mit proliferativen infantilen Hämangiomen (Blutschwämmchen), die eine systemische Therapie erfordern, erstmalig ein im Ausmaß erheblicher Zusatznutzen vom G-BA vergeben. Der Nachweis einer nachhaltigen Heilung wird in einer frühen Nutzenbewertung aufgrund der kurzen Nachbeobachtung allerdings auch zukünftig kaum zu erwarten sein. 66 Die Festlegung eines gegenüber der Vergleichstherapie geringeren Zusatznutzens erfolgte bis Mitte 215 nur in zwei Verfahren und jeweils für kleine Subgruppen (Afatinib, Erbulin). Für die Afatinib-Subgruppe lag die geschätzte Patientenzahl bei 9-62, in der Eribulin- Subgruppe bei Patienten. In der Neubewertung von Eribulin nach Fristablauf wurde das Ergebnis in dieser Subgruppe auf keinen Zusatznutzen aufgewertet. Während für die Versorgung eine Differenzierung der Nutzenbewertungsergebnisse anhand der sich aus dem therapeutischen Anwendungsgebiet ergebenen Subpopulationen relevant ist, sind für die sich an die Nutzenbewertung anschließenden Verhandlungen über einen Erstattungsbetrag unterschiedliche Zusatznutzen in Subgruppen in Relation zu einander zu setzen. Hierfür ist die Größe der Subgruppen im Sinne der GKV-Zielpopulation als theoretischer GKV- Absatzmarkt 67 zur Abschätzung von Budget Impact-Effekten relevant. 66 Wörmann (215), S Eine solche Aufschlüsselung der Bewertungsergebnisse bezieht sich jedoch nicht auf die reale Versorgungssituation der nutzenbewerteten Wirkstoffe, sondern auf
61 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 41 Für lediglich 19 % der bislang von der Nutzenbewertung erfassten GKV-Population ist von Seiten des G-BA ein Zusatznutzen zugesprochen worden (vgl. Abb. 11). 68 Abbildung 11: Größe der GKV-Zielpopulation mit Zusatznutzen gemäß G-BA Erheblich Beträchtlich Gering Nicht quantifizierbar Kein Zusatznutzen Geringerer Nutzen Da der relative mittlere Anteil der positiv bewerteten Zielpopulationen je Wirkstoff bei 52 % (Median: 71 %) lag, liegt der Schluss nahe, dass das schlechte Abschneiden einiger weniger Wirkstoffe mit dafür großem GKV-Marktvolumen Grund für die beobachteten Zusammenhänge sind. Exemplarisch können hier Aclidiniumbromid, Ingenolmebutat, Linagliptin oder Vildagliptin genannt werden, welche bei fehlendem Zusatznutzen jeweils eine (theoretische) GKV- Zielpopulation von deutlich über einer Millionen Patienten aufweisen. 68 theoretische Absatzpotentiale. Im Rahmen der ambulant-ärztlichen Verordnung befinden sich diese Wirkstoffe im Wettbewerb mit anderen Wirkstoffen im Anwendungsgebiet, weshalb eine vollständige Ausschöpfung dieser Absatzpotentiale in der Regel unrealistisch ist. Zudem berücksichtigt eine solche Auswertung die Multimorbidität sowie die Überschneidung von Indikationsgebieten nicht. Die Angaben basieren auf insgesamt theoretisch erfassten 41,9 Millionen Patienten, welche Grundlage der Nutzenbewertungsbeschlüsse des G-BA sind. Zu berücksichtigen ist, dass diese Angabe nicht überschneidungsfrei ist. Prävalenzschätzungen für zwei Präparate mit demselben Anwendungsgebiet gehen hier doppelt in die Zählung ein.
62 42 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Neue Arzneimittel ohne Zusatznutzen: Berücksichtigung der bestverfügbaren Evidenz? In insgesamt 45 Verfahren bzw. 15 Subgruppen ist der G-BA zu der Einschätzung gekommen, dass für das zu bewertende Arzneimittel kein Zusatznutzen vorliegt. Dies hat neben den 15 Verfahren, in denen vom pharmazeutischen Unternehmer kein Dossier vorgelegt wurde, verschiedene weitere Gründe (vgl. Abb. 12). Betrachtet wurden ausschließlich die Verfahren, in denen der G-BA in keiner Subpopulation einen Zusatznutzen anerkannt hat (n=45). Für diese Verfahren dominieren Mängel im vom Hersteller zum Zusatznutzennachweis vorgelegten Evidenzmaterial (n=31; 69 %). Eingereichte Studien werden deshalb von vorneherein vielfach als aus formalen Gründen nicht bewertungsrelevant eingestuft. 69 Darunter subsummieren sich Fehler in der Ergebnisdarstellung sowie regelhaft nicht anerkannte indirekte Vergleiche. Vom Hersteller gegenüber der Argumentation des G-BA abweichende Zielpopulationen tragen wiederum dem Umstand Rechnung, dass das dem Hersteller vorliegende Evidenzmaterial nicht immer zum Zusatznutzennachweis geeignet ist. Elfmal wich der Hersteller in seiner Zusatznutzenargumentation zudem von der zuvor vom G-BA festgelegten zvt ab. Abbildung 12: Ausschlaggebende Gründe für fehlenden Zusatznutzen aus Sicht des G-BA (n=45) Durch Daten nicht belegt In Teilpopulation durch Daten nicht belegt Formale Gründe Cross-Over bleibt problematisch In mehreren Dossierbewertungen, insbesondere zu Onkologika bei fortgeschrittenen Krebserkrankungen, war ein erlaubter Behandlungswechsel eine zentrale Herausforderung, welcher letztlich vielfach dazu führte, dass kein Zusatznutzen vergeben werden konnte. Teilweise ließ sich aus den Studien, in denen ein Behandlungs- 69 VfA (214).
63 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 43 wechsel möglich war, aufgrund der inhärenten Interpretationsprobleme kein Zusatznutzen ableiten, zum Beispiel in der Bewertung von Dabrafenib. Bei der Bewertung von Vemurafenib (sowohl im regulären Verfahren, als auch im Addendum) hingegen war es möglich, einen Vorteil abzuleiten, weil hier für den patientenrelevanten Endpunkt Gesamtüberleben Ergebnisse eines Datenschnittes vorlagen, an dem noch keine Behandlungswechsel stattgefunden hatten. Die methodischen Herausforderungen von Behandlungswechseln sind auch bei der Zulassung ein Problem und werden in Wissenschaftskreisen auf internationaler Ebene diskutiert. Wegen der besonderen Herausforderungen bei der Nutzenbewertung von Studien mit erlaubtem Behandlungswechsel widmete das IQWiG die Veranstaltungsreihe IQWiG im Dialog 214 diesem Thema. Darüber hinaus liegt eine Simulationsstudie des IQWiG zu verschiedenen Methoden zur Reduktion des Verzerrungspotentials in Folge eines Behandlungswechsels vor. 7 Das Ergebnis der Untersuchung: Keine Methode konnte als best practice Modell identifiziert werden. Die Ergebnisse aller untersuchten Methoden sind bei Verzerrungen vielmehr kritisch zu hinterfragen. Insbesondere die den Methoden zugrunde liegenden Annahmen sind aus Sicht des IQWiG im Rahmen einer Dossiererstellung zu diskutieren, und gegebenenfalls durch weitere Sensitivitätsanalysen zu ergänzen. Eine Bewertung erfordert eine ausführliche Darstellung der Daten, insbesondere des Mechanismus, der zum vorzeitigen Behandlungswechsel führt. Der Einfluss eines Behandlungswechsels muss hinsichtlich aller relevanten Endpunkte analysiert werden und nicht nur für das Gesamtüberleben. In 214 hat zudem erstmals ein Hersteller der Offenlegung aller relevanten Daten für die Dossierbewertung widersprochen. Als Folge sprach das IQWiG keinen Zusatznutzen aus, der G-BA schloss sich dem an. Hintergrund war, dass das Dossier zu Insulin degludec in den Modulen 1 bis 4 nicht alle für die Nutzenbewertung notwendigen Informationen zu Methodik und Ergebnissen der Studien enthielt. Das IQWiG hätte diese Angaben dem Modul 5 entnehmen können, das aber im Unterschied zu den Modulen 1 bis 4 vertraulich und nicht zur Veröffentlichung bestimmt ist. In solchen Fällen ist es dem IQWiG möglich, die fehlenden Angaben in seinem Bericht zu publizieren, sofern der Hersteller dem nicht widerspricht. Dies hat das Unternehmen in diesem Fall ausdrücklich getan. Das IQWiG bezieht jedoch keine Daten in die Bewertung ein, die nicht veröffentlicht werden dürfen, denn das Ergebnis wäre dann nicht mehr transparent und nachvollziehbar Beckmann et al. (214). 71 IQWiG (215), S. 6f.
64 44 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Vollständige Datenbewertung nur in vier Fällen Zum Umgang mit bestverfügbarer Evidenz Basierend auf dem vom G-BA im Rahmen der Beschlusstexte und Tragenden Gründe vorgelegten Begründungsmuster ist bislang lediglich in vier Verfahren eine vollständige Auswertung des vom Hersteller vorgelegten Evidenzmaterials Grundlage der Feststellung eines fehlenden Zusatznutzens (Aflibercept [Visusbeeinträchtigung infolge eines diabetischen Makulaödem], Tafluprost/Timolol, Teriflunomid, Vildagliptin [erneute Nutzenbewertung]). Allerdings verzichtet der G-BA im Verfahren von Tafluprost/Timolol auf eine Darstellung der Studienergebnisse im Beschlusstext, da für die Teilpopulation der Patienten mit Prostaglandin analoga-vorbehandlung nur hochverzerrte Daten vorlagen und für die Teilpopulation mit Beta-Blocker-Vorbehandlung keine verwertbaren Daten vorlagen. In zehn weiteren Verfahren konnte zumindest auf Subgruppenebene die vorliegende Evidenz durch den G-BA bewertet werden (Colestilan; Fixkombination Elvitegravir/Cobicistat/Emtricitabin/Tenofovirdisoproxil; Empagliflozin; Fingolimod [neues AWG]; Linagliptin [Absatz 5b]; Lurasidon; Mirabegron; Umeclidinium/Vilanterol; Vildagliptin; Vildagliptin/Metformin). Cassel und Ulrich kamen im Rahmen einer gutachterlichen Stellungnahme für den BPI in einer subgruppenspezifischen Betrachtung zu einer annähernd vergleichbaren Quote. 72 Da das Ergebnis der frühen Nutzenbewertung Auswirkungen auf den Erstattungspreis eines Arzneimittels hat, sind entsprechende Ergebnisse von hoher Relevanz für das weitere Verfahren. Bekommt ein Arzneimittel mit neuem Wirkstoff keinen Zusatznutzen bescheinigt, bekommt der Hersteller keine Möglichkeit, mit dem GKV-SV über einen Erstattungsbetrag zu verhandeln, welcher über dem der vom G-BA festgesetzten Vergleichstherapie liegt. Dabei ist zu berücksichtigen, dass die Nutzenbewertung nicht konfirmatorisch angelegt ist, weshalb sämtliche zur Verfügung stehende Evidenz berücksichtigt werden sollte. Doch sofern es unmöglich oder unangemessen ist, Studien höchster Evidenz durchzuführen oder zu fordern, müssen nur Nachweise der bestverfügbaren Evidenz eingereicht werden. Die Bewertung hat dann auf der Grundlage der verfügbaren Evidenz unter Berücksichtigung der Studienqualität mit Angabe der Wahrscheinlichkeit für den Beleg eines Zusatznutzens zu erfolgen. 73 Alternativ kann der G-BA weitere Nachweise fordern und einen Nutzenbewertungsbeschluss befristen. So hat der G-BA bislang 4 % der Verfahren, denen ein im Ausmaß nicht quantifizierbarer Zusatznutzen zugesprochen werden konnte, befristet. Dies trägt zumindest ansatzweise der vielfach von Industrievertretern formulierten Kritik Rechnung, das Verfahren differenziere nicht ausreichend zwischen der gesetzlich geforderten bestverfügbaren Evidenz und jener, welcher im Idealfall (den es aufgrund zum Teil abweichender Evidenzanforderungen im Rahmen 72 Cassel, Ulrich (215), S Abs. 3 AM-NutzenV.
65 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 45 der Zulassung nicht gibt) möglich wäre. Anders in den Verfahren z. B. von Sofosbuvir oder Vismodegib, denen aufgrund starker Wirksamkeit basierend auf einarmigen Studien die Zulassung durch die EMA erteilt wurde. Im Fall von Vismodegib konnte seitens des IQWiG u. a. deshalb kein Zusatznutzen, im Verfahren von Sofosbuvir lediglich ein in einer Teilpopulation nicht quantifizierbarer Zusatznutzen festgestellt werden. Beide Einschätzungen korrigierte der G-BA und stufte das Ausmaß des Zusatznutzens später höher ein. Eine zukünftige Herausforderung der frühen Nutzenbewertung wird es deshalb sein, die Akzeptanz der bestverfügbaren Evidenz zum Zeitpunkt der Zulassung durch eine Harmonisierung von Zulassungs- und Frühbewertungsanforderungen zu verbessern. Dabei ist zu berücksichtigen, dass eine Nutzenbewertung vor allem zu dem frühen Zeitpunkt der Durchführung letztlich immer eine Entscheidung unter Unsicherheit ist. Bei Entscheidungen unter Unsicherheit besteht ein Zielkonflikt zwischen dem Begehen eines Fehlers 1. und 2. Art. Wissenschaftler der EMA legten hierzu ein vielfach beachtetes Papier aus Sicht der arzneimittelrechtlichen Zulassung vor, welches jedoch auf den Kontext der Nutzenbewertung übertragbar ist. 74 Grundsätzlich können Entscheidungen unter Unsicherheit im Rahmen der Frühbewertung zu zwei Arten von unerwünschten Ergebnisse führen: (1) Ein Produkt bekommt einen Zusatznutzen zugesprochen, hat aber gar keinen. (2) Ein Produkt bekommt keinen Zusatznutzen zugesprochen, hat aber einen. Je mehr Sicherheit (bestmögliche Evidenz) bei der Nutzenbewertung jedoch verlangt wird, desto höher liegt das Risiko für Fehler 2. Insofern sind auch Opportunitätskosten der Nicht-Akzeptanz von Risiko und Unsicherheit in der Abwägung von bestmöglicher und bestverfügbarer Evidenz zu berücksichtigen. Verwiesen wird zudem vielfach auf die Bewertungspraxis in europäischen Nachbarländern. Dort, so die Einschätzung einiger Experten, fände eine Bewertung neuer Therapieverfahren eher unter Berücksichtigung bestverfügbarer Evidenz statt, was im Vergleich zum deutschen System tendenziell bessere Bewertungsergebnisse insbesondere in der Diabetologie zur Folge hat. 75 Exemplarisch können neuere Antidiabetika wie Canagliflozin und Dapagliflozin/Metformin angeführt werden, welche sowohl in Deutschland als auch in Frankreich negativ bewertet wurden, in England und Australien jedoch erstattet werden. Auch Verfahren aus der Neurologie, welche in Deutschland komplett durch die Nutzenbewertung gefallen sind, werden in England heute überwiegend erstattet. Fraglich ist, welche Konsequenzen aus den vorliegenden Befunden zu ziehen sind. Grundlegende Aufweichungen der Verfahrensanforderungen von G-BA und IQWiG an die vorzulegende Evidenz Neue Zusatznutzenkategorie sinnvoll? 74 Eichler et al. (213). 75 Exemplarisch: Wörmann (215), S. 76ff.
66 46 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 scheinen zur Vermeidung grundsätzlicher Fehlanreize nicht geboten. Ausgehend von den Schwierigkeiten der Arzneimittelhersteller, für einzelne Subgruppen ausreichende zusatznutzenrelevante Daten vorzulegen, wird derzeit die Einführung einer neuen Zusatznutzenkategorie diskutiert: Aus technischen Gründen Zusatznutzen zur Zeit nicht belegbar. 76 Eine solche Zwischenkategorie soll demnach als Warteposition dienen und die Bewertung kein Zusatznutzen vermeiden. Fraglich wäre der Effekt einer entsprechenden Erweiterung der Zusatznutzennomenklatur ohne unmittelbaren Zusammenhang zur Preisverhandlung. Für die Ergebniskommunikation der frühen Nutzenbewertung erscheint die Aufnahme des Hauptgrundes für einen fehlenden Zusatznutzen (zum Beispiel: Zusatznutzen nicht belegt: Abweichende zvt ) gewinnbringender. Die genaue Ausgestaltung in diesem Punkt ist jedoch noch kritisch zu diskutieren. Eine klare Abgrenzung zu der bislang schwächsten Zusatznutzenkategorie ( Anhaltspunkt für einen geringen Zusatznutzen ) wäre dann ebenfalls erforderlich. Ein Anhaltspunkt für einen geringen Zusatznutzen besagt, dass aktuell Aussagen zu Nutzen und Schaden nur mit niedriger Sicherheit möglich sind. Nutzenbewertungsergebnisse von Orphan Drugs Eine besondere Rolle im Verfahren nehmen Orphan Drugs ein, deren Zusatznutzen mit erfolgter Zulassung nach dem Gesetz faktisch belegt ist. Lediglich das Ausmaß des Zusatznutzens ist für die Anzahl der Patienten und Patientengruppen, für die ein therapeutisch bedeutsamer Zusatznutzen besteht, bei jeder Dossiereinreichung nachzuweisen, selbst wenn 35a Abs. 1 S. 1 SGB V Anwendung findet, da auch Orphan Drugs einer nutzenbasierten Preisbildung zugeführt werden sollen. Die Nutzenbewertung von Orphan Drugs erforderte dabei schon im Rahmen des ersten Verfahrens von Pirfenidon eine Korrektur im Vorgehen des G-BA. Nachdem das IQWiG methodenkonform keinen Zusatznutzen attestieren konnte, stellte der G-BA einen nicht quantifizierbaren Zusatznutzen fest. Auf Verfahrensebene hat der G-BA jedoch inzwischen häufiger einen geringen Zusatznutzen für Orphan Drugs vergeben, was Rückschlüsse auf die zum Teil gute Evidenzbasis in entsprechenden Verfahren zulässt (vgl. Abb. 13). 76 Staeck (215), S. 48.
67 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 47 Abbildung 13: Bewertung des Zusatznutzens von Orphan Drugs auf Subgruppenebene Non-Orphan Drugs (n=75) Orphan Drugs (n=31) % 2% 4% 6% 8% 1% Erheblich Beträchtlich Gering Nicht quantifizierbar Im Vergleich zu Arzneimitteln ohne Orphan-Status schneiden die betroffenen Wirkstoffe damit bislang überaus erfolgreich in der Nutzenbewertung ab. Von insgesamt 31 Subgruppen aus 24 nutzenbewerteten Orphan Drugs stufte der G-BA das Ausmaß des Zusatznutzens in 14 Fällen als nicht quantifizierbar ein. 14-mal bescheinigte der G-BA Orphan Drugs subgruppenübergreifend einen geringen, dreimal einen beträchtlichen Zusatznutzen. In fünf Verfahren bewertete der G-BA dabei den Zusatznutzen in mehr als einer Subpopulation (Brentuximab Vedotin, Ibrutinib, Ivacaftor, Ponatinib, Riociguat). Abweichend davon stellt der Hersteller im Verfahren von Cabozantinib zulassungskonform Bewertungsergebnisse in fünf Subgruppen dar, obgleich der G-BA dieser Einteilung nicht folgt und den Zusatznutzen auch aufgrund einer Empfehlung der DGHO lediglich für die Gesamtpopulation zuspricht. Der erste Wirkstoff, welcher nach Überschreiten der 5-Millionen- - Umsatzschwelle erneut bewertet wurde, Ruxolitinib, zugelassen zur Behandlung der Myelofibrose, bekam im ersten Durchlauf 213 noch einen geringen Zusatznutzen vom G-BA zugesprochen. In der zweiten Dossierbewertung 214, in welcher auch das IQWiG eine vollständige Nutzenbewertung vorlegte, beantragte der pharmazeutische Unternehmer die Feststellung eines beträchtlichen Zusatznutzens. Das IQWiG hat in seinem Bericht Berechnungen zu einigen Daten für eine der beiden Zulassungsstudien (COMFORT-I) durchgeführt und sieht den Hinweis auf einen beträchtlichen Zusatznutzen. Basierend auf dem Dossier des pharmazeutischen Unternehmers, der vom IQWiG erstellten Dossierbewertung und der hierzu im schriftlichen und mündlichen Anhörungsverfahren vorgetragenen Stellungnahmen, bescheinigte der G-BA Ruxolitinib gegenüber der zweckmäßigen Vergleichstherapie Best Supportive Care ebenfalls einen beträchtlichen Zusatznutzen, weicht jedoch hinsichtlich der Aussagesicherheit von der Einschätzung des IQWiGs ab. Nach Abschluss einer erneuten Nutzenbewertung findet eine Nachverhandlung des Erstattungsbetrages statt. Die Hochstufung des Zusatznut- Erste Neubewertung erfolgreich
68 48 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 zens von gering auf beträchtlich hatte zur Folge, dass der Hersteller im Mai 215 als Ergebnis der erneuten Verhandlungen einen um knapp 2 % höheren Erstattungsbetrag realisieren konnte. Der Orphan Drugs qua Gesetz zugesprochene Zusatznutzen führt in der Praxis dazu, dass entsprechende Verfahren im G-BA methodisch anders ablaufen als die reguläre Nutzenbewertung im IQWiG. Dafür verwendet der G-BA weitestgehend dieselben Methoden der evidenzbasierten Medizin wie das IQWiG, verzichtet jedoch auf eine abschließende Kategorisierung des Zusatznutzens (z. B. über die vom IQWiG vorgelegten Konfidenzintervallschwellen, welche inzwischen Teil des Methodenpapiers sind). Kritisiert wird die damit für die Praxis fehlende, jedoch ggf. relevante Aussage zumindest über den Nutzen neuer Orphan Drugs (da ein Mehrwert aufgrund der fehlenden Vergleichsgrundlage nicht abbildbar ist). Fachkundige können entsprechende Daten jedoch bereits heute aus den Inhalten der Bewertungsdokumente recherchieren. Für die ärztliche Praxis dürfte ein solches Vorgehen allerdings nicht praktikabel sein. Problematisch ist somit, dass das methodische Vorgehen des G-BA nicht transparent, da nicht publiziert ist. Des IQWiG hat zuletzt wiederholt angeregt, zukünftig doch vollständige frühe Nutzenbewertungen für alle Orphan Drugs vorzunehmen. 77 Bislang ist lediglich ein verkürztes Modul 4 im Herstellerdossier vorzulegen. Im Rahmen eines im Auftrag des Bundesministeriums für Gesundheit erstellten Rapid Reports im Jahr 214 untersuchte das Institut, inwiefern bei der Studiendurchführung für Orphan Drugs methodische Besonderheiten zu berücksichtigen sind, welche eine vollständige Bewertung unter Umständen obsolet machen würden. 78 Das Institut kommt dabei zu dem Ergebnis, dass im Zeitraum von 21 bis 213 multizentrische Zulassungsstudien von Medikamenten für seltene Erkrankungen überwiegen. Das IQWiG kam darüber hinaus zu dem Fazit, dass insbesondere geringe Teilnehmerzahlen Kompromisse bei der Aussagesicherheit erfordern können. In diesem Fall sei eine Anhebung des statistischen Irrtumsniveaus einer Einschränkung der externen oder gar der internen Validität der Studien der Durchführung qualitativ schlechterer Studien vorzuziehen. Die Verfahrenspraxis bestätigt das IQWiG in dieser Haltung zumindest insofern, als dass in den bisherigen Orphan Drug-Verfahren vielfach RCT-Evidenz vom Hersteller vorgelegt werden konnte. Ein Umstand, welcher sich auch in den Bewertungsergebnissen wiederspiegelt. Bei ausschließlichem Vorliegen unkontrollierter Studien wurde vom G-BA durchgehend ein nicht quantifizierbarer Zusatznutzen, bei Vorliegen von Daten aus randomisierten klinischen Studien 77 IQWiG (215), S IQWiG (214).
69 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 49 fast durchgehend ein geringer oder beträchtlicher Zusatznutzen vergeben. Aussagenklassierung: Wie sicher sind die Nutzenbewertungsergebnisse? Neben dem Ausmaß des Zusatznutzens ist die Einstufung der Beleglage ein wesentliches (und preisrelevantes) Ergebnis der frühen Nutzenbewertung. 5 Abs. 4 der AM-NutzenV folgend ist darzulegen, [ ] mit welcher Wahrscheinlichkeit und in welchem Ausmaß ein Zusatznutzen vorliegt. Der Wahrscheinlichkeitsbegriff lässt sich in diesem Zusammenhang am ehesten durch das Konzept der Ergebnissicherheit operationalisieren, wofür das IQWiG in der Vergangenheit drei Kategorien vorgesehen hatte: Bei hoher Ergebnissicherheit wird ein Bewertungsergebnis als Beleg (für etwas) bezeichnet, bei niedriger(er) Ergebnissicherheit als Hinweis (auf etwas), bei (absolut) unzureichender Ergebnissicherheit wird das Fehlen eines Beleges bzw. Hinweises konstatiert. 79 In seinem Entwurf für die Methoden-Version 4. wurde 211 die zusätzliche Kategorie Anhaltspunkt eingeführt, die in ihrer (Ergebnis-)Sicherheit schwächer als ein Hinweis ist. Die geringwertigste Kategorie Anhaltspunkt drückt der IQWiG-Definition folgend aus, [...] dass bestimmte Mindestanforderungen an die vorliegenden Studien zwar erfüllt sind, Aussagen zu Nutzen und Schaden aber dennoch nur mit niedriger Sicherheit möglich sind [...]. 8 Eine entsprechende Erweiterung erscheint rückblickend sinnvoll, da sich die Bewertung im Rahmen der frühen Nutzenbewertung gemäß 35a Abs. 1 SGB V im Wesentlichen auf die Zulassungsstudien und damit zumindest zum Teil auf Ergebnisse zu Surrogaten und nicht zu patientenrelevanten Endpunkten stützen muss. Darüber hinaus kann es gemäß AM-NutzenV aufgrund fehlender direkter Vergleichsstudien erforderlich sein, die Bewertung auf Basis indirekter Vergleiche durchzuführen. Beide Aspekte können jedoch die Ergebnissicherheit beeinträchtigen, so dass die bisherige dreistufige Kategorisierung für spezifische Konstellationen aus Sicht des IQWiG nicht mehr ausreichend trennscharf erschien. 81 Eine Aufschlüsselung der bislang erteilten Einschätzungen zur Aussagesicherheit gibt demnach indirekt Aufschluss über die zum Zeitpunkt der frühen Nutzenbewertung zur Verfügung stehenden Evidenz. Dabei gehört zur Aussagesicherheit allerdings auch die Frage ob die vorliegende Evidenz den Untersuchungsgegenstand der frühen Nutzenbewertung überhaupt beantworten kann, also relevante Endpunkte und Subgruppen berücksichtigt Lange (211). 8 IQWiG (211). 81 Lange (211). 82 Kaiser et al. (215), S. 235.
70 5 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Innerhalb der bis Mitte 215 durchgeführten Verfahren verteilen sich die Einschätzungen zur Beleglage des G-BA nahezu gleichmäßig auf alle zur Verfügung stehenden Kategorien (vgl. Tab. 7). Zu berücksichtigen ist, dass 85 % der aufgeführten Belege (auf Subgruppenebene) auf die obligate Einstufung der Orphan Drugs zurückzuführen ist. Lediglich in der durch Überschreiten der 5-Millionen- -Umsatzschwelle angestoßenen Neubewertung von Ruxolitinib stufte der G-BA die Aussagesicherheit zum Zusatznutzen für dieses Orphan Drug auf einen Anhaltspunkt herab. Gründe waren das Vorliegen nur einer verwertbaren Studie sowie Unsicherheiten in der Datenlage. Tabelle 7: Zusammenhang von Zusatznutzen und Aussagensicherheit gemäß G-BA 83 Subgruppenebene (n=18) Zusatznutzen Anhaltspunkt Hinweis Beleg Geringer 1 1 Nicht quantifizierbar Gering Beträchtlich Erheblich 1 Anhaltspunkt als Einstiegswertung Gründe für einen Anhaltpunkt Auf Basis der vorliegenden Ergebnisse muss konstatiert werden, dass die Einführung der Größenordnung Anhaltspunkt viele Verfahren vor einem vermeintlich schlechteren Ergebnis bewahrt hat. Denn sowohl auf Subgruppen- als auch auf Wirkstoffebene haben jeweils die meisten Verfahren einen Anhaltpunkt für einen geringen Zusatznutzen vom G-BA zugesprochen bekommen. Dies bedeutet für viele Wirkstoffe in Verbindung mit einem geringen Zusatznutzen zumindest einen Einstieg in die Preisverhandlungen. 84 Den bisherigen Einstufungen eines Anhaltspunktes liegen verschiedene Argumentationslinien des G-BA zugrunde. Neben Effektverzerrungen in Subgruppen mit signifikantem Interaktionstest, generell gleichgerichteten, jedoch nicht über alle Subgruppen konsistent signifikanten Ergebnissen, bei Langzeiteffekten (z. B. Gesamtüberleben in der Onkologie) gleichgerichtete, aber nicht konsistent signifikante Resultate wurde die Vergabe eines Anhaltspunktes Nicht berücksichtigt wurden Subgruppen (n=15), denen vom G-BA kein Zusatznutzen zugesprochen wurde. Schwenke (212).
71 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 51 auch durch die Verwendung von Surrogatendpunkten 85, schwerwiegende Designmängel in den angeführten Studien sowie dem Rückgriff auf indirekte Vergleiche zurückgeführt. Indikationsspezifische Besonderheiten: Warum Onkologika überdurchschnittlich gut abschneiden und Diabetes die Verliererindikation unter AMNOG ist Besonders auffällig ist, dass im Zeitraum von 211 bis Mitte 215 knapp ein Drittel aller Verfahren auf onkologische Präparate entfielen, diese aber insgesamt 4 % aller vergebenen positiven Zusatznutzenkategorien ausmachen. Doch nicht nur Onkologika, auch Arzneimittel gegen Infektionskrankheiten bekommen überproportional häufig einen Zusatznutzen zugesprochen. Neue Medikamente aus den Bereichen Diabetologie und Neurologie, auf welche ein Drittel aller Verfahren, jedoch weniger als ein Viertel der vergebenen Zusatznutzen entfallen, erreichen ein positives Bewertungsergebnis in Relation zur absoluten Anzahl abgeschlossener Verfahren hingegen kaum (vgl. Abb. 14). Abbildung 14: Zusatznutzen nach therapeutischem Anwendungsgebiet 211 bis 215 Psychische Erkrankungen Krankheiten des Blutes und der Hauterkrankungen Krankheiten des Nervensystems Krankheiten des Verdauungssystems Augenerkrankungen Krankheiten des Urogenitalsystems Stoffwechselkrankheiten Krankheiten des Muskel-Skelett-Systems Krankheiten des Atmungssystems Sonstige Erkrankungen Herz-Kreislauf-Erkrankungen Infektionskrankheiten Onkologische Erkrankungen % 2% 4% 6% 8% 1% Zusatznutzen Kein Zusatznutzen 85 Auf eine detaillierte Aufstellung des Zusammenhangs zwischen Surrogatvalidierung und Aussagekraft wird hier verzichtet und stattdessen auf den Rapid Report A1-5 zu Surrogatparameter in der Onkologie des IQWiG verwiesen.
72 52 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Allgemein erscheint eine erfolgreiche Nutzenbewertung in bestimmten Situationen anfällig für Kontextfaktoren. Dies ist insbesondere dann der Fall, wenn therapeutische Veränderungen patientenrelevanter Endpunkte außerhalb der Zeiträume zu beobachten sind, welche klassischerweise in Zulassungsstudien als Beobachtungszeiträumen möglich sind. Beispiele sind hierfür Reduktionen venöser Tromboembolien im Verfahren von Apixaben, die Lipidsenkung z. B. im Verfahren von Lomitapid oder die Krampfrate bei neuen Antiepileptika. Es ist anzunehmen, dass sich Einschätzungen zum Zusatznutzen bislang vielfach zu stark an Überlebenszeit-Effekten orientieren. Das Gesamtüberleben bei Akuterkrankungen in der Onkologie und in der Infektiologie ist dabei gut messbar, bei chronisch kranken Menschen in der Diabetologie und Neurologie hingegen nicht. 86 Grundsätzlich sind therapeutische Fortschritte mit einer positiven AMNOG-Bewertung im Sinne des GKV-Systems, doch unter den bislang bewerteten Onkologika befinden sich vielfach Zweit- und Drittlinien-Therapien, welche in der Regel das Verfahren erfolgreich mittels einer Verlängerung des Gesamtüberlebens um wenige Monate absolvierten. Die Aussagekraft entsprechender Ergebnisse ist aber umso geringer, je länger der Anteil der Überlebenszeit in der Progressionsphase eines Tumors ist. 87 Das progressionsfreie Überleben wird jedoch als Surrogat zum Zusatznutzenbeleg regelhaft nicht anerkannt. Da häufig Aussagen zum Beispiel zur gesundheitsbezogenen Lebensqualität fehlen, ist der direkte Patientennutzen trotz Zusatznutzen zumindest zu diskutieren. Ein Aspekt, dem der G-BA in methodischen Diskussionsfragen zukünftig besondere Aufmerksamkeit schenken wird. 88 Durch vereinfachte und beschleunigte europäische Zulassungsverfahren sind zukünftig deutlich mehr Neuzulassungen insbesondere in der Onkologie zu erwarten. Aus Sicht des G-BA sollen entsprechende Zulassungsbeschleunigungen nicht ohne Konsequenzen für die Nutzenbewertung sein, weshalb vorgeschlagen wurde, den Einsatz solcher Arzneimittel auf spezialisierte Zentren zu begrenzen. 89 Ziel müsse es sein, in einem solchen Rahmen in Postzulassungsstudien bessere Evidenz zu Wirksamkeit und patientenrelevanten Endpunkten zu generieren. Anreize, solche Studien zu finanzieren, gibt es für Hersteller allerdings nur selten, alternative Finanzierungsmodelle gibt es zumindest in größerem Umfang ebenfalls nicht. Eine Option wäre die obligatorische Befristungen entsprechender Nutzenbewertungsverfahren nach 35a Abs. 3 SGB V. Hierzu müssten zukünftig in einem noch stärkeren Maße als bisher Studienanforderungen an den pharmazeutischen Unternehmer formuliert werden. Zudem müssen Befristungszeiträume insofern flexibel sein, als dass 86 Ärzteblatt (215b). 87 Laschet (215). 88 Laschet (214). 89 Laschet (215).
73 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 53 in begründeten Ausnahmefällen eine Verlängerung der Befristung möglich wird. 9 Anders gestaltet sich die Situation bei neuen Antidiabetika. Zu berücksichtigen ist hier das extreme Auseinanderdriften der Studienendpunkte zu Parametern des medizinischen Nutzens im Sinne des Nutzenbewertungsverfahrens. Vertreter der pharmazeutischen Industrie heben in Diskussionen stets hervor, dass eine Überlegenheit nach der Methodik des IQWiG Studiendauern erfordern würde, die so nicht umsetzbar sein. 91 Andererseits beklagen Fachverbände, dass zusatznutzenrelevante Studien aus fachlich nicht nachvollziehbaren Gründen aus der Evidenzbewertung ausgeschlossen würden zuletzt in der Bewertung der Fixkombination Dapagliflozin/Metformin. 92 Die Bedingungen, für diese Arzneimittel einen Zusatznutzen zu zeigen, sind daher möglicherweise deutlich schlechter als bspw. für Arzneimittel gegen Krebserkrankungen. 93 So wird zum Beispiel darum gerungen, wie Surrogatparameter in die Nutzenbewertung einfließen könnten, um entsprechenden Medikamenten zur Behandlung chronischer Krankheiten bessere Chancen einzuräumen, einen Nutzenvorteil zu belegen. Harte Endpunkte wie die mediane Überlebenszeit sind zur Bewertung von Langzeittherapien indes naturgemäß kaum geeignet. 94 Die Frage, inwiefern aus vorläufigen, nicht direkt patientenrelevanten Daten Aussagen über klinische Langzeiteffekte möglich sind, ist regelmäßig Gegenstand der Stellungnahmeverfahren und Beratungsprozesse sowie auch der Abstimmungen mit den Bundesoberbehörden und kann nicht pauschal beantwortet werden. Hier hat es in der Vergangenheit unterschiedliche Fallkonstellationen gegeben. 95 In manchen Fällen waren die Studien zur verlässlichen Beurteilung von Surrogatparametern nicht geeignet, weil zum Beispiel Dosierungsschemata nicht zulassungskonform erfolgten. Anpassungen auf Ebene der Verfahrensordnung dürften derzeit Teil der Verhandlungs- und Diskussionsmasse des Pharmadialogs sein. 96 Dabei muss auch berücksichtigt werden, dass bei vielen neuen Therapieverfahren neben dem patientenrelevanten Nutzen auch die Erweiterung des therapeutischen Algorithmus im Fokus stehen wird, insbesondere im Hinblick auf jene Patienten, welche auf die bislang verfügbaren Standardtherapien nicht im gewünschten Maße ansprechen oder bei denen Kontraindikationen bestehen. Ein Aspekt, welcher im Bewertungsverfahren so für einen Hersteller nicht abbildbar bzw. im Fall eines fehlenden Zusatznutzens monetarisierbar ist. Diabetes als Verliererindikation 9 Siehe zu diesem Vorschlag auch Wörmann (215), S Stellvertretend: BPI (215). 92 DDG (214). 93 Höer, Chen (215). 94 Fricke (215). 95 O.V. (215b). 96 Pharma-Fakten (215).
74 54 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Reformoptionen Eine Kehrtwende in dieser Diskussion könnte die Veröffentlichung der Ergebnisse der EMPA-REG -Studie markieren, welche erstmals (längerfristige) Outcomes für ein modernes orales Antidiabetikum dokumentiert. 97 Der darin untersuchte Wirkstoff Empagliflozin befindet sich derzeit nach gescheiterten Preisverhandlungen vor der AMNOG-Schiedsstelle. In der nun veröffentlichten Studie zeigen die Autoren bei einer medianen Beobachtungsdauer von 3,1 Jahren (n > 7.) eine erhebliche und unmittelbare Risikoreduktion für kardiovaskuläre Ereignisse unter Empagliflozin. Ende 215 hat die AM- NOG-Schiedsstelle über den Erstattungsbetrag von Empagliflozin entschieden, nachdem der G-BA aufgrund der bis dato eingereichten Unterlagen keinen Zusatznutzen festgestellt hat. Dennoch drohte die Marktrücknahme, weil die Schiedsstelle auf Basis der im Dossier eingereichten Studien entscheiden musste. 98 Dennoch wirft die Studie auch Fragen auf, z. B. ob es sich bei der Wirkung um einen Klasseneffekt der SGLT-2-Hemmer handelt und ggf. Konsequenzen für weitere im Rahmen der Nutzenbewertung bislang ebenso erfolglose neue Wirkstoffe aus den nun vorliegenden Ergebnissen erwachsen. Darüber hinaus sind grundsätzliche Lösungskonzepte für die systematische Benachteiligung von Wirkstoffen zur Behandlung chronischer Erkrankungen dringend erforderlich. Dies bezieht sich insbesondere auf Wirkstoffe zur Behandlung von Epilepsie, Multiple Sklerose sowie Diabetes und zeitnah zu erwartende Innovationen im Bereich Parkinson. Aus regulatorischer Sicht ist zu prüfen, ob es bei entsprechenden Verfahren ohne Zusatznutzen ausreicht, auf Ebene der Preisfindung einzugreifen, also eine Weichmachung des 13b SGB V ausreicht, um so ggf. nachteilige Bewertungsergebnisse auszugleichen. Denkbar wäre beispielsweise die preisrelevante Vergleichsgröße zweckmäßige Vergleichstherapie weiter zu flexibilisieren. So könnte beispielsweise eine Korridorlösung, in welcher nicht die kostengünstigste (i. d. R. generische) Vergleichstherapie sondern ein verordnungsgewichteter Warenkorb verschiedener Therapiealternativen Ausgangspunkt der Erstattungsbetragsverhandlungen ist, die Marktattraktivität neuer Wirkstoffe in entsprechenden Anwendungsgebieten erhöhen. Dies ist ein Modell, das Hersteller und Selbstverwaltung aktuell im Rahmen des Pharmadialogs für neue Antiepileptika diskutieren. 99 Der Erfolg einer entsprechenden Regelung dürfte allerdings wesentlich von der Bereitschaft der Vertragsparteien abhängen, dann andere Bewertungsfaktoren stärker zu berücksichtigen, damit die Erstattungsbetragsverhandlungen nicht durch eine algorithmische Logik ersetzt werden. Eine vonseiten des Vfa immer wieder beklagte Kostenfixierung ließe sich so zumindest umgehen. 1 Sollte ein Eingriff auf Preisfindungsebene 97 Zinman et al. (215). 98 Winnat (215). 99 O.V. (215b). 1 O.V. (215a).
75 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 55 nicht ausreichen, ist zu prüfen, ob ein verändertes Antragsrecht für eine erneute Nutzenbewertung ausreicht. Denkbar wäre zudem eine obligatorische Befristung aller Verfahren inklusive einer engmaschigen Beobachtung (Register). Der Aufbau entsprechender Register wäre zudem ein wichtiger Beitrag zur Entwicklung der Versorgungsforschung. 11 Dagegen spricht der bereits heute hohe Bewertungsaufwand für den G-BA, welcher sich noch einmal erhöhen würde. Ausblick: Sonderweg auch für Antibiotika erforderlich? Angeregt wurde zuletzt, die Diskussion um Ausnahmeregelungen auf weitere weniger innovationsintensive Anwendungsgebiete auszuweiten. 12 Als Beispiel werden neue Antibiotika genannt, da trotz zunehmender Raten von Bakterien mit Multiresistenz seit 211 nur wenige neue Antibiotika zugelassen worden sind, und wenn, dann regelhaft in bereits bekannten Substanzklassen. 13 Die Verbände der pharmazeutischen Industrie machen indes die wirtschaftlichen und rechtlichen Rahmenbedingungen für den derzeitigen Mangel an neuen Antibiotika verantwortlich und vertreten die Auffassung, dass das Verfahren die Vorteile von neuen Antibiotika nicht ausreichend würdige und somit einer Innovationsförderung in der Antibiotikaforschung entgegenstünde. 14 Neue Antibiotika in der Verfahrensordnung mit Orphan Drugs, welche bis zu einer prognostizierten jährlichen Umsatzschwelle einen Zusatznutzen mit Zulassung bereits zugesprochen bekommen, gleichzustellen lautet deshalb ein Vorschlag der pharmazeutischen Industrie. 15 Der G-BA hat bis auf einen Fall jedoch bereits jetzt sämtliche seit 211 neu zugelassenen Antibiotika von der Zusatznutzenbewertung mit Rückbezug auf 35a Abs. 1a S. 1 SGB V ausgenommen. Bei Fidaxomicin (Dificlir ) dem bislang einzigen Antibiotikum, das einer Nutzenbewertung nach AMNOG unterzogen wurde, konnte der G-BA in einer Patientengruppe mit schweren und/oder rekurrenten Krankheitsverläufen von Clostridium-difficile-assoziierten-Diarrhöen einen Beleg für beträchtlichen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie Vancomycin feststellen. Für die andere Subpopulation legte der Hersteller keine verwertbaren Daten vor. Das Ergebnis der Nutzenbewertung eröffnete jedoch den Einstieg in die Erstattungsbetragsverhandlungen. Erschwert werde die Findung eines aus Sicht des pharmazeutischen Unternehmers angemessenen Erstattungsbetrags jedoch durch das niedrige Preisniveau etablierter Antibiotika, das den Ausgangspunkt der Verhand- Antibiotika sollen Orphan Drug-Status bekommen Obgleich Windeler und Lange explizit auf die an Registerdaten gestellte überzogene Erwartungshaltung hinweisen. Vgl. Windeler, Lange (215), S Ärzte Zeitung (215). Holzgrabe (213). BPI (214). Zentner et al. (215), S. 56.
76 56 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 lungen über den Preis bildet. Eine monetäre Berücksichtigung weiterer aus Herstellersicht relevanter Nutzenfaktoren bei der Preisfindung ist derzeit jedoch problematisch, denn nach derzeitigem Verfahrensstand stellt eine Erweiterung des Therapiespektrums oder Resistenzüberwindung per se kein valides Kriterium für einen Zusatznutzen dar Zentner et al. (215). Eine entsprechende Diskussion wurde beispielsweise auch schon über die Berücksichtigung adhärenzfördernder Faktoren einer Arzneimittelinnovation, wie beispielsweise eine veränderte Applikationform, geführt.
77 2 Abgeschlossene Verfahren der frühen Nutzenbewertung Abweichungen in der Zusatznutzenbewertung Es liegt in der Natur des Verfahrens, dass pharmazeutische Unternehmer im Rahmen der Dossiers regelhaft zu anderen Einschätzungen über das Ausmaß des Zusatznutzens ihrer Produkte kommen, als die Prüfung des IQWiG bzw. der Beschluss des G-BA anschließend bestätigen können. Dabei haben die Nutzenbewertungsverfahren der vergangenen Jahre jedoch nicht nur Unterschiede in den Einschätzungen des Unternehmers auf der einen und des G-BA/ IQWiG auf der anderen Seite, sondern teilweise auch deutliche Abweichungen der G-BA-Beschlüsse von den vorangegangenen IQWiG-Bewertungen gezeigt. Diese betreffen vordergründig zwei entscheidende Parameter: (1) die Anzahl spezifizierter Subgruppen sowie (2) die Einschätzung zum Ausmaß des Zusatznutzens. Unterschiedliche Einschätzungen zur Differenzierung der Zielpopulation in therapeutische Subgruppen sind insbesondere durch aktuelle Diskussionen um zu vereinbarende Mischpreise von hoher Relevanz. Insgesamt differenzieren G-BA und IQWiG in der Bewertung des Zusatznutzens deutlich mehr Subgruppen als in den Herstellerdossiers dargestellt werden. Im Mittel differenzieren die pharmazeutischen Unternehmer in ihren Dossiers bislang 2,1 Subpopulationen (1.Quartil: 1 Subpopulation; 2. Quartil: 2 Subpopulationen). Das IQWiG differenziert hingegen im Mittel 2,6 verschiedene Subpopulationen je Dossier (1.Quartil: 1; 2. Quartil: 4), die Beschlusspraxis des G-BA liegt im Mittel mit 2,2 Subpopulationen wieder darunter (1.Quartil: 1; 2. Quartil: 3). In 38 % aller Verfahren weicht der G-BA in der Definition der Zielpopulation und damit von der Argumentationslinie zum Zusatznutzenbeleg des Herstellers entscheidend ab. In 18 % (n=21) der Verfahren erachtet der G-BA eine Differenzierung von weniger, in 2 % (n=24) der Verfahren von mehr Subgruppen erforderlich. Abweichungen zwischen dem G-BA und der Einschätzung zur Differenzierung der Zielpopulation des IQWiG zeigen ein anderes Verteilungsmuster. 17 In insgesamt 22 % (n=21) der Verfahren unterscheidet der G-BA weniger, in lediglich 11 % (n=11) mehr Subgruppen als das IQWiG. In Summe ist bislang zu beobachten, dass der G-BA die Anzahl der Subgruppen gegenüber der Vorlage des pharmazeutischen Unternehmers deutlich öfter erhöht, während er sie gegenüber der formalen Bewertung des IQWiG häufiger reduziert. Eine Differenzierung der therapeutischen Subgruppen durch den G-BA wird häufig mit der Begründung negativ bewertet, ursprünglich auf eine andere Zusammensetzung der Zielpopulation geplante bzw. gepowerte klinische Studien könnte in solchen Fällen den Evidenz- Abweichende Subpopulationsdefinitionen 17 Die unterschiedlichen Grundgesamtheiten im Vergleich der Subgruppendifferenzierung zwischen G-BA und Hersteller bzw. G-BA und IQWiG erklären sich durch lediglich vom G-BA Nutzenbewerteten Orphan Drugs mit Ausnahme des ersten Orphan-Verfahrens zu Pirfenidon sowie der ersten Neubewertung von Ruxolitinib.
78 58 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 anforderungen zum Nutzennachweis nicht mehr genügen. Eine ausführliche Diskussion dieser als Slicing bezeichneten Praxis erfolgt in Kapitel 3.2. Häufiger Zusatznutzen vom G-BA als vom IQWiG Abweichungen in Einschätzungen zum Ausmaß des Zusatznutzens Von gleichrangiger Bedeutung ist die Frage nach der Bewertungskonformität hinsichtlich des Zusatznutzenausmaßes. Für den pharmazeutischen Unternehmer dürfte es in der Regel Teil der strategischen Produktkommunikation und -platzierung sein, mit einem höchstmöglichen Zusatznutzenausmaß in das Bewertungsverfahren zu gehen. Die Beurteilungen des IQWiG (nach Berücksichtigung der Addenda) und des G-BA beruhen jedoch ebenso auf unterschiedlichen Sach- und Verfahrensständen. Das IQWiG wird vom G-BA allein mit der wissenschaftlichen Bewertung des Dossiers des pharmazeutischen Unternehmers beauftragt. Der G-BA trifft seine Beschlüsse zum Zusatznutzen auf der Basis des Dossiers des pharmazeutischen Unternehmers, der vom IQWiG erstellten Dossierbewertung und der hierzu im schriftlichen und mündlichen Anhörungsverfahren vorgetragenen Stellungnahmen, bei denen gegebenenfalls ergänzende Informationen und Unterlagen eingereicht werden, die vom G-BA bei der Entscheidung über den Zusatznutzen eines Arzneimittels zu berücksichtigen sind. 18 Abweichungen zwischen G-BA und IQWiG sind insofern begründet, als dass das IQWiG einem an den Prinzipien der evidenzbasierten Medizin orientierten Algorithmus folgt, während die Vorgehensweise des G-BA eher heuristisch geprägt ist und sich stets innerhalb eines normativen Entscheidungsspielraumes bewegt, der bei der Entscheidung die Versorgungspraxis miteinbezieht. Schließt man aufgrund der alleinigen Bewertung durch den G-BA Orphan Drugs aus nachfolgender Betrachtung aus, sieht der G-BA in mehr als der Hälfte aller bis Mitte 215 abgeschlossenen Nutzenbewertungsverfahren wenigstens in einer Subpopulation einen Anhaltspunkt für einen Zusatznutzen (vgl. Abb. 15). 18 BT-Drs. 18/188, S. 7.
79 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 59 Abbildung 15: Zusatznutzen auf Verfahrensebene nach Bewertungsinstanz (n=94) 19 Hersteller: 98 % IQWiG: 43 % G-BA: 52 % Das IQWiG selbst sieht im Rahmen einer rein auf standardisierten, wissenschaftlichen Kriterien basierende Begutachtung nur in 43 % aller Verfahren (n=54) in wenigstens einer Teilpopulation einen Zusatznutzen belegt. Wenig überraschend ist, dass von Seiten der pharmazeutischen Unternehmer fast ausnahmslos zumindest in einer Subgruppe ein Zusatznutzen beansprucht wird, erschiene doch der Aufwand der Dossiererstellung seltsam, ginge es darin nicht auch darum, den therapeutischen Stellenwert sowie den Innovationsgrad hinsichtlich des für die Erstattungsbetragsverhandlungen entscheidenden Ausmaßes des Zusatznutzens möglichst positiv darzustellen. Dennoch wurde zwei Wirkstoffen (Colestilan, Linagliptin) bereits herstellerseitig im Nutzenbewertungsverfahren kein Zusatznutzen zugesprochen. Im Dossier des Wirkstoffes Colestilan erkennt der Hersteller an, dass das zu bewertende Arzneimittel in einem Teilanwendungsgebiet nicht verordnungsfähig ist, da der G-BA durch den Beschluss, die als zvt gewählte kalziumhaltigen Phosphatbinder in die OTC-Ausnahmeliste aufzunehmen, diese als Therapiestandard bestimmt hat. In einer weiteren Teilpopulation führt der Hersteller darüber hinaus an, dass das zu bewertende Arzneimittel der zvt weder über- noch unterlegen ist. In der zum damaligen Zeitpunkt kontrovers diskutierte Nutzenbewertung von Linagliptin stuft der pharmazeutische Unternehmer wiederum aufgrund einer abweichenden Einschätzung zur Wahl der zvt den Zusatznutzen in allen Teilindikationen als nicht belegt ein, da für die aus seiner Sicht maßgeblichen zvt keine vergleichenden Studien vorlagen. 19 Nicht berücksichtigt sind Orphan Drugs und Verfahren ohne Herstellerdossier.
80 6 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Zusatznutzen und Größe des Anwendungsgebietes Die auf der Differenzierung bewertungsrelevanter Subgruppen basierende Quantifizierung des Zusatznutzens hat insbesondere hinsichtlich der Ableitung von Mischpreisen einen bedeutenden Stellenwert in AMNOG-Diskussionen eingenommen. Für eine Bestandsaufnahme der AMNOG-Funktionalität ist es insofern auch von Interesse, aus den bislang abgeschlossenen Verfahren jene mit Konfliktpotential zu identifizieren. Zunächst sind grundsätzlich drei Fallkonstellationen denkbar: 1. Der G-BA hat für das gesamte Anwendungsgebiet keinen Zusatznutzen anerkannt. 2. Der G-BA hat zumindest in Teilpopulationen einen Zusatznutzen anerkannt. 3. Der G-BA hat für das gesamte Anwendungsgebiet einen Zusatznutzen anerkannt. Fallkonstellation 1: Von den 119 auswertbaren Verfahren bis Mitte 215 hat der G-BA in 46 Verfahren insgesamt, entweder aus formalen oder aufgrund fehlender Belege, keinen Zusatznutzen ableiten können. Darunter sind jedoch neun Verfahren, in denen der pharmazeutische Unternehmer zumindest in Teilen des zugelassenen Anwendungsgebietes einen Zusatznutzen beansprucht (vgl. Abb. 16). Fallkonstellation 2: In 29 weiteren Verfahren konnte zumindest in einer Teilpopulation ein Zusatznutzen durch den G-BA anerkannt werden. Der Hersteller beansprucht davon jedoch 23 Mal einen Zusatznutzen für die gesamte Zulassungspopulation. Lediglich in drei Verfahren (Abb. 16. Legende: A Saxagliptin; B Sitagliptin; C Sitagliptin/Metformin) stimmte der Hersteller einer nur auf bestimmte Subpopulationen beschränkte Anerkennung eines Zusatznutzens bei Dossiereinreichung zu. 11 Fallkonstellation 3: In 44 Verfahren hat der G-BA dem gesamten Anwendungsgebiet des zu bewertenden Arzneimittels einen Zusatznutzen zugesprochen. Dies deckt sich erwartungsgemäß mit den jeweiligen Einschätzungen der pharmazeutischen Unternehmer. Lediglich im Verfahren von Sativex (Abbildung 16. Legende: D Extrakt aus Canabis Sativa) hat der Hersteller im Dossier nur für eine Teilpopulation einen Zusatznutzen beansprucht. Diese Abweichung ist jedoch eher durch formale als durch evidenzbasierte Gründe zu erklären. Der Hersteller definierte hier als Anwendungsgebiet Patienten mit mittelschwerer bis schwerer Spastik aufgrund von Multipler Sklerose, die nicht angemessen auf eine andere anti-spastische Arzneimitteltherapie angesprochen haben und unterteilt diese in Responder und Non-Responder auf einen Anfangstherapieversuch mit Sativex. Der G-BA wiederum betrachtet die Non-Responder- 11 Hinzu kommen die Verfahren von Ticagrelor und Oriplasmin, welche aufgrund der geringen Populationsgröße, für welche der Hersteller keinen Zusatznutzen beanspruchte, hier nicht dargestellt sind.
81 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 61 Population nicht, sondern bestätigt zumindest in geringem Ausmaß den vom Hersteller beanspruchten Zusatznutzen für die Responder- Population. Abbildung 16: Anteil der GKV-Zielpopulation mit Zusatznutzen, geordnet nach G-BA-Bewertung B C Zielpopulation mit Zusatznutzen in % A D 1 Hersteller-Bewertung G-BA-Bewertung Bewertungskongruenz zwischen IQWiG und G-BA In den meisten Verfahren bestätigt der G-BA in seinem Beschluss die grundsätzliche Einschätzung des IQWiG, in 18 Fällen hat jedoch der G-BA nach Anhörung des Herstellers und der Fachgesellschaften auf Wirkstoffebene einen Zusatznutzen entgegen der Empfehlung des IQWiG noch anerkannt. In 13 Verfahren wertete der G-BA die Einschätzung zum Ausmaß eines Zusatznutzens jedoch auf Verfahrensebene ab. 111 In sechs Verfahren ist die abweichende Bewertung auf die Untersuchung unterschiedlicher Subgruppen von G-BA und IQWiG zurückzuführen. Aufgrund der differenten Auswahl der Subgruppen sind die Bewertungsergebnisse des Zusatznutzens nicht direkt vergleichbar. Beispielsweise hat das IQWiG bei der Analyse des Wirkstoffes Apixaban zur Prophylaxe eines Schlaganfalls drei Subgruppen zur Analyse ausgewählt, während der G-BA keine Unterteilung des Anwendungsgebietes vornimmt. Das IQWiG kam in diesem Verfahren in einer nach Alter stratifizierten Betrachtung zu anderen Einschätzung über das Ausmaß des Zusatznutzens. Auffällig war der Bewertungsunterschied im Verfahren von Sofosbuvir, welcher auch für politischen Nachhall sorgte. 112 Das IQWiG hat diesem inzwischen umsatzstärksten neuen Arzneimittel der letzten G-BA wertet IQWiG- Ergebnis häufiger auf als ab Eine detaillierte Übersicht findet sich in den Kapiteln a-m unter III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene. Ärzteblatt (214).
82 62 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Jahre nur in einer kleinen Subgruppe mit einem fünfprozentigen Anteil an der gesamten GKV-Zielpopulation zugesprochen. Zumindest für die Infektionen mit Viren vom Typ 1 sowie Typ 3 bis 6 und für die HIV-Koinfektion gebe es keine angemessenen Analysen. Beim Genotyp 2 sei dagegen im Dossier eine offene, randomisierte kontrollierte Studie (FISSION) angeführt, in der noch nicht vorbehandelte Erwachsene mit einer Hepatitis-C-Infektion vom Genotyp 2 und 3 untersucht wurden. Zu verwerten seien allerdings nur die Daten für die Indikation Genotyp 2. Letztlich sieht das IQWiG für therapienaive Patienten mit chronischer Hepatitis C vom Genotyp 2 im Hinblick auf schwerwiegende Folgekomplikationen einen Hinweis auf einen Vorteil von Sofosbuvir. Als Surrogatendpunkt wurde hier das dauerhafte virologische Ansprechen akzeptiert. Das Ausmaß dieses Zusatznutzens sei jedoch nicht quantifizierbar, da unklar sei, wie häufig ein Leberkrebs tatsächlich vermieden werden kann. Bei den Nebenwirkungen sei eine Bewertung auch nur eingeschränkt möglich gewesen. Der G-BA hat in entsprechenden Verfahren jedoch die Möglichkeit, versorgungsreale Bezüge einzubringen und kommt deshalb u. a. im Verfahren von Sofosbuvir zu einem völlig anderen Bewertungsergebnis. Auf Subgruppenebene wie auf Verfahrensebene ist die sehr seltene Zuerkennung eines erheblichen Zusatznutzens durch den G-BA diskrepant zur Einschätzung der pharmazeutischen Unternehmer. Auch das IQWiG hat mehrfach die Anerkennung eines erheblichen Zusatznutzens vorgeschlagen. Der G-BA schloss sich der Einschätzung des IQWiG allerdings nicht an. Für die Wirkstoffe Enzalutamid (Prostatakarzinom), Ocriplasmin, Pertuzumab (bei Mammakarzinom) sowie Sitagliptin als Monopräparat und in Kombination mit Metformin (Typ-2-Diabetes) attestierte das IQWiG das höchste Ausmaß des Zusatznutzens. Der G-BA schloss sich der Einschätzung des IQWiG allerdings nicht an. Vielmehr stufte er für die Wirkstoffe Enzalutamid, Ocriplasmin und Pertuzumab das Nutzenausmaß von erheblich auf beträchtlich, und im Fall von Sitagliptin von erheblich auf gering herab. Insbesondere zusätzliche Erkenntnisse aus dem sich routinemäßig beim G-BA anschließenden Stellungnahmeverfahren hatten für die Abwertungen den Ausschlag gegeben.
83 2 Abgeschlossene Verfahren der frühen Nutzenbewertung Literatur Ärzteblatt (214): Arzneimittelnutzen: Spahn will im Einzelfall weniger strenge Bewertungskriterien. Ärzteblatt online vom Ärzteblatt (215a): Die Preise orientieren sich daran, was der Markt bereit ist zu zahlen. Ärzteblatt online vom Ärzteblatt (215b): AMNOG: Onkologen fordern stärkere Einbeziehung der Fachgesellschaften. Ärzteblatt online vom Ärzteblatt (215c): 5 Fragen an Jürgen Windeler: Es gibt Studien, die Fragen beantworten, die niemanden interessieren. Ärzteblatt online vom Ärzte Zeitung (215): Bundesrat will beim AMNOG nachjustieren. Ärzte Zeitung online vom BAH Bundesverband der Arzneimittelhersteller e.v. (215): Gemeinsame Pressemitteilung von BAH und IKAM: Kinderarzneimittel Zusatznutzen sollte grundsätzlich anerkannt werden vom Beckmann I, Grouven U, Guddat C, Bender R (214): Treatment Switching in randomisierten kontrollierten Studien: eine Simulationsstudie. GMDS 214: 59. Jahrestagung der Deutschen Gesellschaft für Medizinische Informatik, Biometrie und Epidemiologie; ; Göttingen. BPI Bund der Pharmazeutischen Industrie e.v. (214): Infektionsschutz muss Gesundheitsziel werden BPI-Forderungen an ein Präventionsgesetz. Pressemitteilung vom BPI Bund der Pharmazeutischen Industrie e.v. (215): Fünf Jahre AM- NOG-Beschluss des Bundestages/Positiv bewertete Arzneimittel erreichen Patienten unzureichend/jedes fünfte bewertete Arzneimittel geht vom Markt/Anteil der in Deutschland nicht eingeführten Arzneimittel stark gestiegen. Pressemitteilung vom Cassel D, Ulrich V (215): AMNOG auf dem ökonomischen Prüfstand. Funktionsweise, Ergebnisse und Reformbedarf der Preisregulierung für neue Arzneimittel in Deutschland. Nomos Verlag, Baden-Baden. DDG Deutsche Diabetes Gesellschaft (214): Deutsche Diabetes Gesellschaft kritisiert G-BA-Entscheidung: Kostenreduktion zu Lasten der Therapiesicherheit von Patienten mit Typ-2-Diabetes. Pressemitteilung vom Eichler HG, Bloechl-Daum B, Brasseuer D, Breckenridge A, Leufkens H, Raine J, Salmonson T, Schneider CK, Rasi G (213): The risks of risk aversion in drug regulation. Nature reviews drug discovry; 12: Fricke A (215): Fünf Jahre AMNOG Diese vernichtende Bilanz zieht die Industrie. Ärzte Zeitung online vom G-BA Gemeinsamer Bundesausschuss (215): Newsletter. G-BA aktuell Nr. 2 April 215. URL: newsletter/14/ (Stand: ) Haas A (214): Drei Jahre für Nutzenbewertung Zwischenbilanz und Anspruch. Statement des GKV-Spitzenverbandes vom , Berlin. URL: AMNOG-Fachtagung-G-BA_Haas.pdf (Stand: ).
84 64 Abgeschlossene Verfahren der frühen Nutzenbewertung 2 Höer A, Chen X (215): AMNOG-Reporting, in: Häussler B, Höer A, de Millas C (Hrsg.): Arzneimittel-Atlas 215. IGES Institut GmbH, Berlin. Holzgrabe U (213): Antibiotika. Neue Wirkstoffe in der Pipeline. Pharmazeutische Zeitung online; 2/213. Hoppe A, Braun L, Nohlen M (215): OPG Spezial: Wie das AMNOG besser wird. Sonderausgabe, Mai 215. IQWiG Institut für Qualität und Wirktschaftlichkeit im Gesundheitswesen (211): Pressemitteilung: IQWiG publiziert neue Version seiner Allgemeinen Methoden. IQWiG Institut für Qualität und Wirktschaftlichkeit im Gesundheitswesen (213): Allgemeine Methoden. Version 4.1 vom IQWiG, Köln. IQWiG Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (214): Bewertung und Auswertung von Studien bei seltenen Erkrankungen. Rapid Report. IQWiG-Berichte Nr. 241 vom IQWiG Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (215): Jahresbericht 214. IQWiG, Köln. Kaiser T, Vervölgyl V, Wieseler B (215): Nutzenbewertung von Arzneimitteln. Bundesgesundheitsblatt; 58: Lange S (211): Einschätzung der Ergebnissicherheit von Studien bei der Nutzenbewertung. Beitrag im Rahmen des Workshops Methodische Aspekte bei der Nutzenbewertung von Arzneimitteln bei der GMDS am , Mainz. Laschet H (214): Nutzenbewertung. Stärkerer Fokus auf Lebensqualität nötig. Ärzte Zeitung online vom Laschet H (215): Innovationsschub stellt G-BA vor neue Herausforderungen. Ärzte Zeitung online vom Ludwig W-D (215): Preise für innovative Arzneimittel Kommt das System an seine Grenzen? Präsentation im Rahmen des AOK-Forum love vom , Potsdam. Mullard A (215): 214 FDA drug approvals. Drug discovery; 14 (2): O.V. (215a): Das AMNOG ein Erfolgsmodell? Statements. Ersatzkasse Magazin, 95 (3/4), O.V. (215b): Arzneimittel für chronische Erkrankungen systematisch benachteiligt. Gerechte Gesundheit vom URL: (Stand: ). Pharma-Fakten (215): 3 Fragen an: Prof. Josef Hecken. Herausforderungen für die Nutzenbewertung. Pharma-Fakten vom URL: (Stand: ). Schwenke C (212): Gibt es einen Zusatznutzen durch die Einführung der Kategorie Anhaltspunkt zur Beschreibung der Ergebnissicherheit? Vortrag im Rahmen von IQWiG im Dialog am , Köln. Staeck F (215): Einigkeit gibt es über den Reformbedarf, nicht über die Inhalte. Zusammenfassung der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin.
85 2 Abgeschlossene Verfahren der frühen Nutzenbewertung 65 Vfa Verband Forschender Arzneimittelhersteller (214): Das AMNOG im vierten Jahr. Erfahrungsbericht und Regelungsvorschläge der forschenden Pharmaunternehmen vom , Berlin. Vfa Verband Forschender Arzneimittelhersteller (215): Perspektive 219 Neue Medikamente in Sicht. URL: (Stand: ). Windeler J, Lange S (215): Nutzenbewertung medizinischer Leistungen im deutschen Gesundheitswesen rechtlicher Rahmen, historische und internationale Perspektive. Bundesgesundheitsblatt; 58: Winnat C (215): Kommentar zu Empagliflozin. Die Realität nicht ignorieren. Ärzte Zeitung vom Wörmann B (215): Frühe Nutzenbewertung neuer Arzneimittel in Deutschland Gesundheitspolitische Schriftenreihe der DGHO, Band 6. Hrsg.: Freund M, Lüftner D, Wilhelm M; DGHO, Berlin. Zentner A, Tebinka-Olbrich A, Haas A (215): Sonderweg für Antibiotika im AMNOG-Verfahren? Gesundheit und Sozialpolitik; 2/215: Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ, Broedl UC, Inzucchi SE (215): Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. The New England Journal of Medicine; online first.
86 66 3 Verfahrensfragen Für den Beleg eines Zusatznutzens sind sowohl für die pharmazeutische Industrie als auch die regulatorischen Instanzen komplexe biometrische und statistische Sachverhalte in einem sehr kurzen Zeitraum aufzubereiten. Hierzu gehört insbesondere die Bewertung von Studiendaten, also die Einschätzung von Risikomaßen und Verzerrungspotentialen, die adäquate Durchführung von Subgruppenanalysen sowie Meta-Analysen und indirekten Vergleichen. Die Wahl der zweckmäßigen Vergleichstherapie bleibt jedoch nach wie vor die zentrale Stellschraube im Verfahren. Bezugnehmend auf die Begründungen des G-BA, keinen Zusatznutzen in einem Verfahren zu vergeben, wird nachfolgend geprüft, ob kausale Muster in der Dossierbewertung auftreten. So werden aktuelle Diskussionsfelder um die Wahl der zweckmäßigen Vergleichstherapie, der Differenzierung von Subgruppen, der Analyse von Endpunkten und indirekten Vergleichen sowie die Befristungsgründe von Nutzenbewertungsbeschlüssen nachvollzogen und aufgearbeitet. Bereits die Ergebnisse des AMNOG-Reportes 215 zeigten, dass die frühe Nutzenbewertung in vielen Verfahrensbereichen als Katalysator der Methoden der evidenzbasierten Medizin gewirkt hat. 113 Mitarbeiter des IQWiG bestätigen dies nun in einer Studie und heben den großen Transparenzgewinn des Verfahrens hervor. Ihr Fazit: Im Vergleich zu anderen öffentlich zugänglichen Dokumenten über klinische Studien (Fachzeitschriftenartikel, Studienregistereinträge und European public assessment reports [EPAR]) enthalten die Hersteller-Dossiers und die Dossierbewertungen des IQWiG, die im Rahmen der frühen Nutzenbewertung veröffentlicht werden, wesentlich mehr Informationen insbesondere zu patientenrelevanten Endpunkten in zugelassenen Teilpopulationen. 114 Während in den herkömmlichen Dokumenten nur 52 % der Studienergebnisse für die gesamten Studienpopulationen vollständig berichtet wurden, waren es in den AMNOG-Unterlagen 89 %. Bei den zugelassenen Teilpopulationen war die Diskrepanz noch größer. Für patientenrelevante Endpunkte betrug der Anteil in den herkömmlichen Dokumenten sogar nur fünf Prozent, im Vergleich zu 7 % in den AM- NOG-Unterlagen Siehe hierzu auch Vach, Klar (215), S Köhler et al. (215).
87 3 Verfahrensfragen Zweckmäßige Vergleichstherapien Diskussionsfelder Die zweckmäßige Vergleichstherapie (zvt) wird durch den G-BA zu Beginn des Verfahrens festgelegt und hat einen entscheidenden Einfluss auf den Ausgang des Bewertungsverfahrens. Auswahlkriterien der zvt sind in 6 der AM-NutzenV sowie in 5. Kapitel 6 der VerO des G-BA formuliert. Diese Vorgaben beinhalten einen wissenschaftlichen Bezug mit Orientierung an den Maßstäben der evidenzbasierten Medizin, einen aktuellen Bezug zum allgemein anerkannten Stand der medizinischen Erkenntnisse, einen ökonomischen Bezug mit der Vorgabe zur Auswahl der wirtschaftlicheren Therapie, wenn mehrere Alternativen vorliegen. Ist ein Arzneimittel mit neuem Wirkstoff für mehrere relevante Teilpopulationen zugelassen, können auch mehrere Vergleichstherapien festgelegt werden. Wenn mehrere Therapien den Kriterien der AM-NutzenV entsprechen, ist der G-BA nun verpflichtet, mehrere ZVT festzulegen ( oder -Verknüpfungen; 6 (2a) AM-NutzenV). Der pharmazeutische Unternehmer kann sich dann für eine dieser ZVT entscheiden, die er dann zur Dokumentation des medizinischen Zusatznutzens nach 35a (1) Satz 3, Ziffer 3, SGB V zugrunde legt. Die Orientierung am aktuellen Behandlungsstand erfolgt über interne Recherchen des G-BA. Der allgemeine Stand der medizinischen Erkenntnisse wird durch eine systematische Recherche nach Leitlinien sowie Übersichtsarbeiten zu klinischen Studien in der vorliegenden Indikation abgebildet. Der Standard in einem Anwendungsgebiet muss nicht zwingend ein Arzneimittel aus der gleichen Wirkstoffklasse sein. Sollte es keine zweckmäßige Vergleichstherapie mit Arzneimitteln geben, können auch nichtmedikamentöse Therapien in Betracht gezogen werden, sofern es sich um GKV-Leistungen handelt. Die Festlegung der zvt ist dabei sowohl im Verlauf der Nutzenbewertung als auch im Rahmen der abschließenden Erstattungsbetragsverhandlungen von entscheidender Bedeutung und insofern von kontroversen Diskussionen begleitet. Nach wie vor zeigen sich dabei drei zentrale Diskussionsfelder: 1. Die Wahl generisch verfügbarer Vergleichstherapien, welche später als generischer Preisanker Grund für Marktrücknahmen in Folge eines zu geringen, unter Umständen nicht kostendeckenden, Erstattungsbetragsniveaus sind.
88 68 Verfahrensfragen 3 2. Das Scheitern neuer Wirkstoffe an formalen Vorgaben, zum Beispiel aufgrund abweichender Vergleichstherapien im klinischen Studienprogramm nicht geeigneter Evidenz (sowie der Aussicht auf quasi sicher erfolglose indirekte Vergleiche). Daran schließt sich auch die vielfach von medizinischen Fachgesellschaften angestoßene Diskussion um die Ableitung des derzeit gültigen Behandlungsstandes an. 3. Die Berücksichtigung zeitlicher Veränderungen im Therapiestandard. Überwiegend generische Komparatoren Generika als dominierende Bezugsgröße Eine Auswertung der bis zum abgeschlossenen Verfahren zeigt, dass in 46 % (n=47) rein generische Komparatoren vom G-BA als Vergleichsmaßstab festgelegt wurden. In weiteren 32 % (n=33) wurden vom G-BA generische und patentgeschützte Vergleichstherapien innerhalb verschiedener Teilanwendungsgebiete eines neuen Wirkstoffes als Referenz definiert. In lediglich 14 % (n=14) der Verfahren wurden hingegen patentgeschützte Wirkstoffe als Vergleichstherapie herangezogen (vgl. Abb. 17). Die der 13. AMG Novelle Ende 213 einhergegangene Flexibilisierung der zvt- Festlegung für den Fall, dass mehrere gleichwertige Alternativen vorliegen, dürfte aus Sicht der pharmazeutischen Industrie nicht den gewünschten Effekt gezeigt haben. Unabhängig davon ist jedoch festzuhalten, dass sich die Hersteller trotz Kritik zumeist der Festlegung des G-BA anschließen, wohl auch in dem Wissen, ansonsten keine Aussichten auf ein positives Bewertungsergebnis zu haben Kaiser et al. (215), S. 235.
89 3 Verfahrensfragen 69 Abbildung 17: Anteil generischer Vergleichstherapien in abgeschlossenen Nutzenbewertungsverfahren (n=13; Stand: ) generische zvt patentgeschützte und generische zvt patentgeschützte zvt nichtmedikamentöse zvt best supportive care Bei Wirkstoffen mit belegtem Zusatznutzen hat sich die Festlegung generischer Vergleichstherapien als kontroverser Diskussionspunkt herausgestellt. Problematisch ist dies deshalb, weil die Ausstrahlung der ggf. niedrigen Jahrestherapiekosten der zweckmäßigen Vergleichstherapie als Preisanker dienen kann und so einen möglichst niedrigen Erstattungsbetrag eines neuen Arzneimittels bereits früh im Verfahren durch die Wahl der zvt determinieren. 116 Generell sehen es Cassel und Ulrich hierdurch als nahezu unmöglich an, im Falle generisch verfügbarer Vergleichstherapien profitable oder wenigstens nur kostendeckende Erstattungsbeträge zu vereinbaren. 117 Ihr Vorschlag: Grundsätzlich sollte es im Rahmen der späteren Erstattungsverhandlungen keine preisliche Orientierung an generischen Alternativen geben, da eine Neuentwicklung nicht genauso vergütet werden kann wie ein Arzneimittel, das seine Entwicklungskosten längst amortisiert habe. Dies würde jedoch eine Abkehr vom bisherigen Bottom-up-Modell der Erstattungsbetragsverhandlungen bedeuten, was zum jetzigen Zeitpunkt eher unrealistisch erscheint. Eine preisorientierte Festlegung wird auch aus Perspektive niedergelassener Ärzte abgelehnt. 118 Eine stärkere Orientierung zum Beispiel für reale Verordnungsanteile der Alternativtherapien an der wissenschaftlichen Datenlage sowie dem Versorgungsalltag ist anzustreben. Insofern erscheint es diskussionswürdig, warum zur Definition der zvt im Verfahren kein Zugriff auf Daten der Kostenträger über die im ambulanten Bereich tatsächlich administrierten Arzneimittel erfolgt. Denkbar wäre z. B. ein Rückgriff auf Versorgungsda Cassel, Ulrich (215), S. 13. Cassel, Ulrich (215), VIII. Dryden (215), S. 44.
90 7 Verfahrensfragen 3 ten des Morbi-RSA, welche im Zuge der Datentransparenzverordnung 119 vom beim DIMDI einem definierten Nutzenkreis zur Verfügung gestellt werden und im Rahmen der Erstattungsbetragsverhandlungen ohnehin bereits genutzt werden. 12 Dies würde das Risiko, dass die festgelegte Vergleichstherapie nicht Teil der Verordnungsrealität ist, mindern. Von Seiten des Gesetzgebers sind in dieser Thematik jedoch keine weitreichenden Vorgaben zu erwarten, hat dieser sich mit dem AM- NOG bewusst für eine zwischen den Parteien weitestgehend freie Verhandlungslösung zur Preisfindung entschieden. Deshalb delegierte der Gesetzgeber die inhaltliche Ausgestaltung der Preisfindung auch an die Verhandlungspartner, indem eine Rahmenvereinbarung über 13b Abs. 8 geschlossen werden musste. Diese Rahmenvereinbarung stellt sich nun aus Herstellersicht als problematisch heraus, wurde hier doch einer Aufschlagssystematik auf die zvt zugestimmt. Wohl auch deshalb wurde die Rahmenvereinbarung nun gekündigt und wird derzeit neu verhandelt. Wie bereits in 2.2 beschrieben wäre aber denkbar, 13b SGB V so zu verändern, dass bei Vorliegen mehrerer Vergleichstherapien im Rahmen der Erstattungsbetragsverhandlungen nicht mehr auf die wirtschaftlichste (womit hier die kostengünstigste gemeint ist) zurückgegriffen werden muss. Definitorische Konflikte Die Festlegung der zweckmäßigen Vergleichstherapie erfolgt durch den G-BA. Im Rahmen des AMNOG-Verfahrens haben medizinische Fachgesellschaften jedoch die Möglichkeit, eine Stellungnahme zu Verfahren u. a. zur Festlegung der zweckmäßigen Vergleichstherapie abzugeben. Nach Angaben der DGHO (Deutsche Gesellschaft für Hämatologie und Onkologie) hätten die Fachgesellschaften in 31 % der Verfahren die vom G-BA gewählte Vergleichstherapie substantiell kritisiert. Dabei stand in der Regel zur Diskussion, was als maßgeblicher Therapiestandard anzusehen sei. 121 Der G-BA kann entsprechende Hinweise der Fachgesellschaften im Verfahren berücksichtigen, ist dazu jedoch nicht gezwungen. Die Möglichkeiten zur Korrektur der Vergleichstherapie sind im laufenden Verfahren insbesondere aufgrund der knappen Fristen beschränkt. Die häufigste Reaktion des G-BA besteht in der Festlegung einer aktualisierten Vergleichstherapie für nachfolgende Verfahren zu neuen Arzneimitteln in der derselben Indikation. 122 Bislang Verordnung zur Umsetzung der Vorschriften über die Datentransparenz (Datentransparenzverordnung DaTraV) vom (BGBl. I S. 1895). 3 Abs. 6 der Rahmenvereinbarung nach 13b SGB V. Ärzteblatt (215b); Wörmann (215), S. 33. Wörmann (215), S. 37.
91 3 Verfahrensfragen 71 passte der G-BA drei Mal die Definition der zvt nach Kritik der Fachgesellschaften an, davon zweimal nicht im laufenden Verfahren, sondern erst für nachfolgende Bewertungen (Abirateronacetat, Cabazitaxel). Lediglich in der Nutzenbewertung von Dabrafenib wurde die Vergleichstherapie von Dacarbazin zu Vemurafenib im laufenden Verfahren geändert. Grundsätzlich ist zu berücksichtigen, dass sich in bestimmten Indikationen nicht eindeutig festlegen lässt, ob ein Arzneimittel in spezifischen Krankheitssituationen anderen Arzneimitteln eindeutig überlegen ist. Der Standard wird in Leitlinien zu solchen Indikationen als patientenindividuelle Therapie definiert. Zulassungsbehörden empfehlen in solchen Konstellationen Placebo als Kontrolle in den Zulassungsstudien und beraten die pharmazeutischen Unternehmen auch dahingehend. Problematisch ist dies aber, wenn, wie beispielsweise im Verfahren von Perampanel, dann in Folge fehlender Evidenz kein Zusatznutzen anerkannt werden kann (Kapitel 4.2). Fachgesellschaften hatten in diesem Fall frühzeitig darauf hingewiesen, dass in der Epileptologie eine Hierarchisierung der verschiedenen Therapiealternativen nach dem aktuellen Stand des Wissens nicht möglich ist und die Therapie individuell gestaltet wird. 123 Im Verfahren zu Perampanel zur Prophylaxe epileptischer Anfälle enthielt die Zulassungsstudie Placebo im Kontrollarm. Der G-BA legte initial Lamotrigin oder Topiramat als zweckmäßige Vergleichstherapie fest. Die Deutsche Gesellschaft für Epileptologie (DGfE) empfahl eine patientenindividuelle Therapie. Der Hersteller hatte im Rahmen der erneuten Nutzenbewertung 214 zwar die Vorgabe des G-BA aufgegriffen, diese dann aber nach Ansicht des IQWiG in unerlaubter Weise uminterpretiert. Für den Zusatznutzennachweis von Perampanel extrahierte der Hersteller aus dem Pool der schon im ersten Verfahren vorgelegten Zulassungsstudie nämlich jene Patienten mit pharmakoresistenten und anhaltend aktiven Epilepsien. Die geforderte Vergleichstherapie wurde als Bestandteil einer patientenindividuellen Basistherapie verstanden, mit der Begründung, dass in dieser Patientenpopulation eine Therapieoptimierung durch eine Zusatztherapie nicht mehr möglich sei und sich der Zusatznutzen aus einem Vergleich von Perampanel als Zusatztherapie gegenüber Placebo ergebe. Das erscheint zwar aus klinisch-praktischer Sicht plausibel und der Versorgungspraxis entsprechend, ist aber offensichtlich nicht in Übereinstimmung mit den formalen Vorgaben des G-BA. 124 So wurde im G-BA-Beschluss bemängelt, dass ausschließlich placebokontrollierte Studien und keine Vergleichsstudien vorgelegt worden seien. Besondere Herausforderung sind zudem Indikationen, bei denen ein für den Vergleich medizinisch geeignetes Medikament im Off-Label Schlenger (215). Schlenger (215).
92 72 Verfahrensfragen 3 Use eingesetzt wird 125 oder Indikationen, in denen kein geeigneter Standard in Leitlinien definiert ist. Letzteres wurde im Verfahren von Trastuzumab Emtansin beim rezidivierten, HER2 positiven Mammakarzinom deutlich. Vom G-BA wurde als Vergleichstherapie die Behandlung mit Anthrazyklinen festgelegt. Hierzu findet sich jedoch in keiner der aktuellen deutschen Leitlinien eine Empfehlung. Nach Angabe der DGHO ist dies zudem nicht durch Studienevidenz zu begründen. 126 Grundsätzlich berät der G-BA Hersteller möglichst schon bei den klinischen Zulassungsstudien und der Vorbereitung der Dossiers. An der Beratung vor Beginn der Zulassungsstudien oder klinischen Prüfungen in Phase III sollen auch aber müssen nicht die deutschen Institute für Arzneimittelzulassungen (BfArM; PEI) beteiligt werden. Dabei geht es letztlich um das Zusammenspiel zwischen Zulassung und Sozialrecht. Um zukünftig den Aufbau unnötiger doppelter Hürden in der Studienkonzeption zu umgehen, wäre eine Weiterentwicklung und Stärkung des Parallel Advice von EMA (inklusive BfArM und PEI) und G-BA zweckmäßig. Das grundsätzliche Problem, dass Zulassung und Nutzenbewertung unterschiedliche Fragestellungen adressieren, löst dies noch nicht. Dies aufzulösen erscheint aufgrund völlig unterschiedlicher Zielsetzungen der Zulassung und Nutzenbewertung jedoch auch langfristig nicht möglich. Ein Problem, dass sich angesichts aktueller Weiterentwicklungen der europäischen Zulassungsprozesse, z. B. hinsichtlich des adaptive pathways (bzw. licensing) 127 zukünftig an Bedeutung gewinnen. 128 AMNOG-Wirkstoffe werden zum Therapiestandard Im Zeitablauf kommt ein weiterer Sachverhalt hinzu, der die Umsetzung der Nutzenbewertung in der Praxis verkompliziert: Patentgeschützte Originale, welche selbst die frühe Nutzenbewertung durchlaufen haben, werden ggf. schnell zum maßgeblichen Therapiestandard und damit zum relevanten Vergleichsmaßstab neuer Wirkstoffe. Damit gibt es in einer vergleichenden Bewertung von AM- NOG-Präparaten aus demselben Anwendungsgebiet unterschiedliche Nenner. Ein fehlender Zusatznutzen ist insofern nicht pauschal, Off-Label eingesetzte Medikamente können nicht als Nutzenreferenz herangezogen werden, es sei denn es liegen positive Bewertungen gem. 35c SGB V vor. Vgl. Windeler, Lange (215a), S DGHO (o. A.). Unter adaptive pathways (bzw. licensing) schlägt die EMA einen Prozess bei der Arzneimittelzulassung vor, mit dem ein schnellerer Zugang von ausgewählten Patientengruppen zu Arzneimitteln gewährleistet werden soll. Dazu erhalten Patienten, für die keine alternative Therapie zur Verfügung steht, in einem früheren Stadium als bisher Zugang zu in der Zulassung befindlichen Arzneimitteln. Im Gegenzug folgt nach der früheren Zulassung ein Monitoring-Prozess, der dazu dienen soll weitere Informationen und Erkenntnisse für die vollständige Zulassung zu sammeln. Vgl. hierzu Bayerischer Pharmagipfel (215), S. 2.
93 3 Verfahrensfragen 73 sondern immer in Abhängigkeit weiterer Kontextfaktoren zu interpretieren. In den bislang abgeschlossenen Verfahren wurden in neuen Verfahren Wirkstoffe als zvt benannt, welche zuvor selbst die Nutzenbewertung durchlaufen haben. Diese wurde dabei entweder als einziger Vergleichsmaßstab innerhalb des Anwendungs- oder Teilanwendungsgebietes definiert oder sind Teil einer oder -Verknüpfung mehrerer möglicher Alternativtherapien. Für das Bewertungsergebnis des second movers hatte dies unterschiedliche Auswirkungen (vgl. Tab. 8). Tabelle 8: Verfahren mit AMNOG-zVT (Stand: ) Zeitliche Veränderungen im Therapiestandard Datum Verfahren zvt Zusatznutzen Dabrafenib Vemurafenib Kein ZN Ipilimumab (neues AWG) Dacabarcin, Vemurafenib Sofosbuvir Boceprevir, Ribavirin, Peginterferon, Telaprevir Simeprevir Boceprevir, Ribavirin, Peginterferon Daclastavir Boceprevir, Telaprevir, Ribavirin, Peginterferon Sipuleucel-T Abirateronacetat, Prednisolon, LHRH-Agonisten, GnRH-Antagonisten Simoctocog alfa Ledipasvir/ Sofosbuvir Turoctocog alfa, Octocog alfa, Moroctocog Peginterferon, Ribavirin, Boceprevir, Telaprevir Nintedanib Docetaxel, Pemetrexed, Erlotinib, Gefitinib, Crizotinib Kein ZN Beträchtlich Beträchtlich Beträchtlich Nicht quantifizierbar Kein ZN Beträchtlich Gering Vemurafenib wurde als erster AMNOG-Wirkstoff inzwischen in zwei Verfahren als Vergleichsmaßstab herangezogen. In seiner zugelassenen Indikation zur Behandlung des nicht-resezierbarem oder metastasierten Melanoms wurde Vemurafenib 212 gegen Dacarbazin als zweckmäßige Vergleichstherapie getestet und erzielte einen be-
94 74 Verfahrensfragen 3 trächtlichen Zusatznutzen. Für das später im selben Anwendungsgebiet zugelassenem Dabrafenib legte der G-BA zunächst ebenfalls Dacabarzin als zvt fest. Basierend auf Einsprüchen im Rahmen des Stellungnahmeverfahrens erkannte der G-BA dann jedoch Vemurafenib als gegenwärtigen Therapiestandard an. 129 Das Ergebnis der Nutzenbewertung: Dabrafenib hat keinen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie. Ein zweiter in diesem Anwendungsgebiet zugelassener neuer Wirkstoff, Ipilimumab, deckt mit seiner zugelassenen Indikation sowohl die Zulassung von Vemurafenib als auch weitere Typen des fortgeschrittenen Melanoms ab. Daher wurde Ipilimumab in der Nutzenbewertung in der übereinstimmenden Indikation gegen Vemurafenib als zweckmäßige Vergleichstherapie getestet, in dem nicht übereinstimmenden Indikationsbereich wurde wiederum Dacarbazin als zvt festgelegt. Das Ergebnis der Nutzenbewertung von Ipilimumab ergab ebenfalls kein Zusatznutzen, allerdings in beiden Subgruppen. Der fehlende Zusatznutzen in beiden Verfahren sagt aber nicht aus, dass sowohl Dabrafenib als auch Ipilimumab schlechter sind als Vemurafenib. Für die sich anschließenden Erstattungsbetragsverhandlungen ist dieses Ergebnis weniger relevant, da sich die Erstattungsbeträge von Dabrafenib und Ipilimumab am Preisniveau von Vermurafenib orientieren, das zuvor bereits einen höheren Preis in diesem Anwendungsgebiet etablieren konnte als der vorherige Therapiestandard. 13 Problematisch ist vielmehr die zum Teil fehlgeleitete Ergebniskommunikation in die Versorgung. Andererseits ließe sich argumentieren, dass Vemurafenib hier einen first mover -Vorteil genießt und diesen als Innovator gegen über vermeintlichen Me-too-Präparaten auch in der Nutzenkommunikation rechtfertigen kann. Eine andere Fallkonstellation zeigen die Verfahren neuer Hepatitis- C-Präparate, in denen es in jüngster Vergangenheit aufgrund einer hohen Innovationsgeschwindigkeit zu schnellen Änderungen im Therapiestandard kam. Während Boceprevir und Telaprevir im Jahr 212 zunächst nur einen nicht quantifizierbaren Zusatznutzen gegenüber älteren Therapieoptionen aus dem Bestandsmarkt zeigen konnten, wurden diese Wirkstoffe im Verfahren von Sofosbuvir als oder -Option in einzelnen Subgruppen als zvt herangezogen. In dem Bewertungsverfahren zeigte sich u. a. in einem der Teilanwendungsgebiete, in denen Boceprevir oder Telaprevir Teil der zu vergleichenden Therapieschemata waren, ein Zusatznutzen von Sofosbuvir. Weitere später bewertete Heaptitis-C-Therapien zeigten vergleichbare Ergebnisse. Für Simoctocog alfa, zugelassen zur Behandlung von Personen mit Hämophilie des Typs A, konnte hingegen nicht wegen des Vergleiches zudem zuvor bewerteten Turoctocog alfa, sondern aufgrund Tragende Gründe zu Dabrafenib, S. 5; Wörmann (215), S. 34. Die Jahrestherapiekosten des zuvor vom G-BA festgelegten Dacabarcin liegen bei ca. 5. pro Jahr, für Vemurafenib jedoch bei ca. 15..
95 3 Verfahrensfragen 75 von Mängeln im vorgelegten Evidenzmaterial kein Zusatznutzen belegt werden. Aus der Praxis des G-BA, zunehmend konditional zu beschließen, könnte geschlussfolgert werden, dass in Fällen, in denen für das zu bewertende Arzneimittel zeitnah therapeutische Alternativen aus derselben Wirkstoffgruppe verfügbar werden, zukünftig auch headto-head-studien der beiden innovativen Arzneimittel durch G-BA und IQWiG gefordert werden können. 131 Für pharmazeutische Unternehmer ergibt sich damit die Herausforderung, auf Anforderungen der Nutzenbewertung ausgelegte Vergleichsstudien (Test auf Überlegenheit, Antizipation nutzenrelevanter Subgruppen) anzulegen. 131 Den Mangel an head-to-head-studien nach Zulassung beklagt zuletzt auch der Institutsleiter des IQWiG. Vgl. Ärzteblatt (215a); Windeler, Lange (215b), S. 632.
96 76 Verfahrensfragen Subgruppen Rationale zur Subgruppenbildung Bis zum lagen 119 Verfahren mit Dossierbewertung vor, in denen der G-BA in jedem zweiten Verfahren (n=6) durchschnittlich 3,3 Subpopulationen im Rahmen der Beschlussfassung differenziert. Er weicht damit gegenüber den Dossiervorlagen der pharmazeutischen Unternehmer ab, welche in 59 Verfahren mit mindestens zwei Teilanwendungsgebieten durchschnittlich 3,1 Subpopulationen differenzierten. Gesetzliche Grundlage für eine subgruppenspezifische Bewertung ist die Feststellung des AMNOG, dass das Dossier der Hersteller unter anderem Angaben über Anzahl der Patienten und Patientengruppen, für die ein therapeutisch bedeutsamer Zusatznutzen besteht, enthalten sollen. 132 Denn nur mit solchen Analysen lässt sich zumeist überprüfen, ob einzelne Patientengruppen besonders oder gar nicht von der Therapie mit dem neuen Wirkstoff profitieren. 133 Entsprechende Unterteilungen ergeben sich aus der Formulierung des Anwendungsgebiets. Darüber hinaus sind im Rahmen der Nutzenbewertung potenzielle Effektmodifikationen für alle möglichen Teilindikationen und Endpunkte zu untersuchen. Kritisiert wird eine damit verbundene artifizielle Verkleinerung bzw. Ausweitung des Anwendungsgebietes mit gravierenden Auswertungen sowohl für die Bewertung des Zusatznutzens als auch für die sich anschließenden Erstattungsbetragsverhandlungen. Dabei geht der Effekt in beide Richtungen. Zum einen präsentieren die Hersteller in ihren Dossiers teilweise eine sehr große Zahl von Subgruppenanalysen, ohne eine Rationale für alle diese Subgruppen zu benennen. 134 Auf der anderen Seite fehlen jedoch zum Teil Subgruppenanalysen zu relevanten Endpunkten in den Herstellerdossiers, sodass keine abschließende Abwägung von Nutzen und Schaden in den relevanten Subgruppen möglich ist. Eine insbesondere zu Beginn des AMNOG befürchtete Orphanisierung in der Weise, dass Indikationen in viele kleine Subpopulationen zerteilt werden, ist nach Einschätzung des IQWiG jedoch nicht eingetreten. 135 Tatsächlich gibt es eine potenziell unbegrenzte Anzahl möglicher Subgruppen. Problematisch ist, dass sich durch den multiplikativen Zusammenhang verschiedener Effektmodifikationen und Teilanwendungsgebiete eine große Anzahl an Analysen mit teils deutlich Abs. 1 AM-NutzenV. Kaiser et al. (215), S Wörmann hat ermittelt, dass bis Ende 214 fünfmal der Hersteller und 18-mal das IQWiG Vorschläge zur weiteren Subgruppendifferenzierung vorgelegt haben, diese jedoch von Seiten des G-BA nur im Verfahren von Afatinib im Beschluss aufgenommen wurden. Vgl. Wörmann (215), S. 31. Ärzteblatt (215a).
97 3 Verfahrensfragen 77 reduzierten Subgruppengrößen ergibt. 136 Hieraus erfolgen häufig bereits bei schwachen Signalen auf Effektmodifikation (zum Niveau von =,2) einzelne formal-abstrakt abgeleitete Empfehlungen zum Vorliegen eines Zusatznutzens. 137 Vielfach kritisiert wird deshalb die fehlende Rationale zur subgruppenspezifischen Differenzierung der Nutzenbewertung, insbesondere in Fällen, in denen der Hersteller diese nicht im Rahmen der Evidenzgenerierung antizipieren konnte. Ausgangspunkt einer Subgruppendifferenzierung sollten in der Regel klinische Überlegungen sein. Eine vom G-BA vorgenommene ex-post Definition von Subgruppen geht dann zwangsläufig mit einem niedrigeren Evidenzgrad einher. Zunächst stellen a priori gebildete Subgruppen mit einer stratifizierten Randomisierung und anschließenden Interaktionstests international den Goldstandard dar. 138 Zudem ergibt sich insbesondere auf der Studienebene das Problem eines Verlustes an statistischer Power, so dass das Risiko steigt, tatsächlich vorhandenen Nutzen nicht mehr nachzuweisen. 139 Die AWMF legte deshalb den Vorschlag vor, dass die Unterteilung in Subgruppen im Hinblick auf die Evidenz, Stichhaltigkeit, statistische Aussagefähigkeit und klinische Anwendbarkeit kritisch durch klinisch-wissenschaftliche Fachexperten beurteilt werden sollte. 14 So nachvollziehbar diese Forderung ist, bleibt fraglich, wie eine engere Beratung des G- BA mit den Fachgesellschaften auch in dieser Fragen (neben weiteren z. B. zur Festlegung der zvt) in die enge Zeitschiene der frühen Nutzenbewertung integriert werden kann. Problemfelder im Rahmen der frühen Nutzenbewertung In der überwiegenden Zahl der Fälle kommt es aufgrund der Formulierung des Anwendungsgebiets des zu bewertenden Arzneimittels zur Subgruppenbildung im Rahmen der frühen Nutzenbewertung. Die Fachinformation wird in der Regel erst später öffentlich, so dass Schlussfolgerungen, die von Bedeutung sind für zu unterscheidende Patientenpopulationen, zu einem frühen Zeitpunkt für den G-BA unter Umständen nicht offensichtlich sind. 141 Zudem muss der G-BA im Rahmen seiner Überlegungen und Beratungen das Anwendungsgebiet der zvt beachten. Steht ein Arzneimittel mit einem sehr breiten Anwendungsgebiet zur Bewertung an und ist die zvt nur für einen Teil dieses Anwendungsgebiets zugelassen, liegt es nahe, dass Anwendungsgebiet in, hinsichtlich der Zulassung der zvt passende, Gruppen zu unterteilen. Damit zusammen hängt, dass bei der Fest Frick (215), S. 31f. Rasch, Dintsios (215). Sun et al. (212). Vergleiche hierzu die präsentierten Simulationsergebnisse von Leverkus et al. (215). AWMF (215), S. 3. Behring A (215), S. 22.
98 78 Verfahrensfragen 3 legung von Subgruppen die im Anwendungsgebiet etablierten Standardtherapien zu beachten sind. Dies gilt insbesondere dann, wenn in der klinischen Praxis im Anwendungsgebiet ganz unterschiedliche Therapiestrategien zum Tragen kommen. 142 Fragwürdig ist die Subgruppenbildung, wenn sie nicht der klinischen Praxis entspricht, wenn sie in Leitlinien nicht als solche definiert ist oder in dieser Subindikation keine Behandlungsnotwendigkeit mit dem neuen Arzneimittel besteht. Ein Beispiel war das Verfahren zu Pertuzumab. Als dritte Subgruppe wurden in diesem Verfahren Patientinnen mit lokal rezidiviertem, inoperablem Mammakarzinom definiert. Vergleichstherapie war die Strahlentherapie. Konsens der Fachexperten war, dass Pertuzumab für diese Patientinnen nicht indiziert ist, wenn eine Strahlentherapie möglich ist. 143 Die Folge: Im Beschluss des G-BA konnte die Patientenzahl in dieser Subgruppe nicht quantifiziert werden. Fragwürdig ist die Subgruppenbildung ebenfalls, wenn die Anzahl der betroffenen Patienten sehr klein und von vornherein klar ist, dass für diese kleinen Subgruppen keine vergleichenden Studien vorliegen. Beispiel ist die zweite Subgruppe bei Axitinib, definiert durch Vorbehandlung mit einem Zytokin. Die Patientenzahl wurde auf 1 % der Zielpopulation geschätzt, absolut 6 Patienten pro Jahr. 144 Ein aktuelles Beispiel in diesem Zusammenhang ist die subgruppenspezifische Bewertung bei Hepatitis C. In der klinischen Versorgung sind die einzelnen Genotypen, welche vom G-BA als zu bewertende Subgruppen differenziert wurden, teilweise nicht zu diagnostizieren, da beispielsweise keine genetischen Tests verfügbar sind. Insofern sollte auch im Hinblick auf die derzeitig diskutierte Mischpreisbildung langfristig berücksichtigt werden, dass im Rahmen der Nutzenbewertung differenzierte Subgruppen auch klinisch beobachtbar und letztlich auch kodierbar sein müssen. Daher sollte auch eine umfassendere Diskussion im Rahmen der frühen Nutzenbewertung hinsichtlich der Aussagekraft von Subgruppenanalysen unter Einbeziehung medizinischer, regulatorischer und biometrischer Expertise angestoßen werden. 145 Zu überlegen wäre auch, ob die Integration von IQWiG-Vertretern zu diesen Fragestellungen in die Dossierberatung aus organisatorischer Perspektive darstellbar wäre Behring A (215). S. 24. Ruof et al. (214). Wörmann (215), S. 3. Rasch, Dintsios (215). Leverkus et al. (215).
99 3 Verfahrensfragen Endpunkte Diskussionsfelder Aufgrund der Vielzahl und Heterogenität der behandelten Krankheitsbilder und Therapieindikationen gibt es eine große Anzahl möglicher Endpunkte, welche im Rahmen der frühen Nutzenbewertung durch G-BA und IQWiG einer intensiven Prüfung unterzogen werden. Insbesondere die Erfassung von Morbidität und Lebensqualität im Vergleich zu einer Verbesserung der Mortalität unterliegt aktuell bei verschiedenen Krankheitsbildern einer intensiven Diskussion. Dies hat mehrere Gründe. Im Kern geht es jedoch um die Frage, welche Endpunkte zum Zusatznutzensnachweis in welcher Situation geeignet sind. Ein Gutachten der DGHO zeigt, dass sich Beschlüsse über einen Zusatznutzen insbesondere in der Onkologie häufig auf die Überlebenszeit als wichtigstem Endpunkt stützen. 147 Eine pauschale Priorisierung von Morbiditätsendpunkten erscheint jedoch nicht sachgerecht. Denn gerade ältere Patienten würden oft der Lebensqualität ein höheres Gewicht einräumen. Eine Position, welche auch der G-BA vertritt und dem Aspekt Lebensqualität deshalb zukünftig mehr Beachtung schenken will. 148 Fraglich ist, auf welcher Basis dies geschehen wird. Eine grundsätzliche Diskussion über die geeigneten Endpunkte und eine Priorisierung dieser Endpunkte sollte nach Einschätzung der Fachgesellschaften jedoch multimodal und auch explizit unter Einbeziehung betroffener Patienten geführt werden. Für den Prozess der frühen Nutzenbewertung sieht ein Vorschlag der AWMF deshalb vor, eine präzise Definition und Hierarchisierung von Endpunkten zeitgleich mit dem Festsetzen der zweckmäßigen Vergleichstherapie unter Einbeziehung externer Expertise vorzunehmen. 149 Bei chronischen Erkrankungen kommt in der Endpunktdiskussion erschwerend die Zeitachse hinzu. In der Bewertung entsprechender neuer Wirkstoffe ist ein Rückbezug auf patientenrelevante harte Endpunkte häufig problematisch, da diese zu so einem frühen Zeitpunkt der Anwendung ggf. noch nicht beobachtbar sind. Lässt die Beobachtungsdauer der Studien eine abschließende Bewertung relevanter Endpunkte, zum Beispiel späterer Nebenwirkungen, nicht ausreichend zu, kann zukünftig überlegt werden, regelhafter von dem Instrument der Befristung und vor allem der Wiederaufnahme zur Neubewertung der Evidenz Gebrauch zu machen. 15 Darüber hinaus wird im Rahmen der Nutzenbewertung vielfach auf Surrogat-Endpunkte zurückgegriffen. Im Vergleich zur Akzeptanz Wörmann (215). Ärzteblatt (215b). AWMF (215), S. 2. AWMF (215), S. 2.
100 8 Verfahrensfragen 3 von Endpunkten wie Ansprechraten auf Veränderungen von Laborparametern (z. B. HbA1c oder Viruslast) in den Zulassungsstudien werden diese hinsichtlich der Patientenrelevanz in der Nutzenbewertung jedoch häufig eher kritisch gesehen. 151 Bislang haben insbesondere Angaben zur Verlängerung des medianen Überlebens bzw. zum progressionsfreien Überleben die Vergabe eines Zusatznutzens nach sich gezogen. Ansprechraten auf Laborparameter oder klinische Symptome dagegen nur in Ausnahmefällen. Während bislang in 44 Verfahren herstellerseitig ein Nutzenbeleg u. a. über Surrogatendpunkte vorgenommen wurde 152, wurden diese nur in jedem vierten Verfahren auch anerkannt (darunter insbesondere die Hepatits-C-Viruslast). Die Beschlusspraxis des G-BA hat dabei vielfach zur IQWiG-Bewertung abweichende Positionen zur Wertigkeit dieser Endpunkte im Rahmen der Frühbewertung dokumentiert. Beispiel ist hier das progressionsfreie Überleben. Ein Wunsch der pharmazeutischen Industrie dürfte analog zur Diskussion um die Subgruppendiskussion eine Klarstellung in 5 der AM-NutzenV sein, dass der G-BA bei der Bewertung patientenrelevanter Endpunkte der Praxis der Zulassungsinstanzen folgt und damit letztlich indirekt eine stärkere Konvergenz von Zulassung und Nutzenbewertung auf methodischer Ebene erfolgt. Eine derartige Dominanz der Zulassungsbehörden mit Fernwirkung auch auf die anschließende Nutzenbewertung ist aber kaum zu erwarten und aus HTA-Sicht auch eher kritisch zu sehen. Lebensqualität häufig ohne Nutzenrelevanz Stellenwert der gesundheitsbezogenen Lebensqualität Auch im Jahr 215 hatten Ergebnisse zur gesundheitsbezogenen Lebensqualität zum Nachweis eines Zusatznutzens nicht den Stellenwert anderer im Verfahren berücksichtigter Endpunkte. Grundsätzlich soll das Dossier ein möglichst vollständiges Bild des Wirkstoffs hinsichtlich Mortalität, Morbidität (Symptomatik), gesundheitsbezogenen Lebensqualität und zu Nebenwirkungen geben. 153 Die Tatsache, dass bislang in 71 % der bis zum vorgelegten und durch den G-BA abschließend bewerteten Herstellerdossiers Daten zur gesundheitsbezogenen Lebensqualität berichtet wurden, trägt dem auch in hohem Maße Rechnung (vgl. Tab. 9). Es ist deshalb kritisch zu hinterfragen, weshalb entsprechende Daten bislang nur in insgesamt sieben Fällen aus Sicht des G-BA geeignet waren, einen Zusatznutzen zu belegen Wörmann (215), S. 4. Die Zählung beinhaltet auch jene Verfahren, in denen der Hersteller zwar hinsichtlich einer Patientenrelevanz des Endpunktes argumentierte, dieser Argumentation vom IQWiG jedoch nicht gefolgt wurde und eine Einstufung als Surrogat erfolgte. 5 Abs. 2 AM-NutzenV.
101 3 Verfahrensfragen 81 Tabelle 9: Angaben zum Endpunkt Lebensqualität: Bilanz der frühen Nutzenbewertung n % Verfahren mit eingereichtem Dossier Angaben zum Endpunkt Lebensqualität % Instrumente Dossiers mit indikationsspezifischem Fragebogen % Dossiers mit generischem Fragebogen % EQ-5D % SF-36/SF-36v2/SF % Dossiers mit >1 Instrument 42 5 % Dossiers mit indikationsspezifischem und generischem Instrument % Zusatznutzen Zusatznutzen gemäß Hersteller % Zusatznutzen gemäß G-BA 7 8 % Gründe für fehlenden Nutzenbeleg gem. G-BA Endpunktspezifische Gründe % Kein Zusatznutzen für das gesamte Dossier/Subgruppe % Auffällig ist in diesem Zusammenhang zunächst, dass selbst nur knapp die Hälfte der Hersteller die von ihnen vorgelegten Daten zur Lebensqualität als zusatznutzenrelevant einstufen. Einer solchen Einschätzung schließt sich der G-BA jedoch nur selten an. Der G-BA sieht Daten zur gesundheitsbezogenen Lebensqualität grundsätzlich als [ ] sehr wichtige ergänzende und unterstützende Information zum Verständnis und zur wertenden Einschätzung der Daten zur Mortalität, Morbidität und zu Nebenwirkungen [ ]. 154 Ein lediglich unterstützender Charakter des Endpunktes Lebensqualität gegenüber anderen Endpunkten wie Mortalität oder Morbidität stellt allerdings eine im Gesetzestext nicht vorgesehene werturteilende Priorisierung dar. 155 Dies äußert sich auch in der bisherigen Beschlusspraxis, in welcher zwischen für die Anerkennung eines Zu Hecken (215). Weder aus der AM-NutzenV noch aus der Verfahrensordnung des G-BA lässt sich eine solche Priorisierung ableiten.
102 82 Verfahrensfragen 3 satznutzens begründende oder aus Sicht des G-BA lediglich unterstützende Ergebnisse zur gesundheitsbezogenen Lebensqualität unterschieden werden kann (vgl. Tab. 1). 156 Tabelle 1: Verfahren mit Zusatznutzen im Endpunkt Lebensqualität Verfahren Beschlussfassung Lebensqualitätsinstrument Zusatznutzen Ivacaftor CFQ-R (k) EQ-5D (g) Crizotinib EORTC QLQ-C3 (k) EORTC QLQ-LC13 (k) EQ-5D (g) Afatinib EORTC QLQ-C3 (k) EORTC QLQ-LC13 (k) EQ-5D (g) Unterstützend Begründend Unterstützend Trastuzumab Emtansin FACT-B (TOI-PFB) (k) Unterstützend Ruxolitinib EORTC QLQ-C3 (k) FACT-Lym (k) Unterstützend Siltuximab SF-36 (g) Begründend Ivacaftor CFQ-R (k) Begründend 1 erneute Nutzenbewertung; 2 neues AWG; k krankheitsspezifisches Messinstrument; g krankheitsübergreifendes ( generisches ) Messinstrument; Fett Ergebnisse dieser Erhebungsinstrumente für die Nutzenbewertung relevant Eine solche Unterscheidung ist vorzunehmen, da trotz signifikanter und klinisch relevanter Vorteile entsprechende Daten zur Lebensqualität nicht immer explizit als zusatznutzenrelevant in den Tragenden Gründen des G-BA-Beschlusses erwähnt werden. In drei Verfahren nimmt der G-BA jedoch explizit zum aus den Lebensqualitätsdaten abzuleitenden Zusatznutzenausmaß Stellung: Sieben Mal Zusatznutzen durch Vorteile hinsichtlich Lebensqualität Crizotinib wird bei vorbehandelten Patientinnen und Patienten mit fortgeschrittenem nicht kleinzelligem Bronchialkarzinom (NSCLC) eingesetzt. Lebensqualitätsdaten wurden in den dort herangezogenen Studien mittels der erkrankungsspezifischen Fragebögen EORTC QLQ-C3 sowie QLQ-LC13 und dem generischen EQ-5D 156 Vgl. hierzu auch Rasch (215).
103 3 Verfahrensfragen 83 erhoben. Die Ergebnisse aus dem EQ-5D-Fragebogen wurden aufgrund der zu geringen Anzahl an Patienten jedoch nicht für die Bewertung herangezogen. Die Ergebnisse des EORTC QLQ-C3 wertete der G-BA jedoch im Ausmaß als beträchtlich, was eine Aufwertung gegenüber der algorithmisch ermittelten IQWiG-Bewertung ( gering ) entsprach. Der Zusatznutzen wurde nicht basierend auf den Dossierangaben, sondern erst durch Nachreichung von Daten seitens des Herstellers vom G-BA anerkannt. Im Verfahren von Sultiximab war der Behandlungseffekt für die körperliche Summenskala des verwendeten generischen SF-36 statistisch zwar nicht signifikant, die Verbesserung im psychischen Bereich zeigte jedoch einen belastbaren Vorteil. Aufgrund der Größe des beobachteten Effekts sprach der G-BA von einem klinisch relevanten Unterschied, aus welchem ein im Ausmaß geringer Zusatznutzen hinsichtlich der Verbesserung der psychischen Lebensqualität abgeleitet wurde. Im Verfahren von Ivacaftor (neues AWG), einem Orphan Drug zur Behandlung der zystischen Fibrose, stufte der G-BA das Ausmaß des Zusatznutzens basierend auf Ergebnissen des krankheitsspezifischen CFQ-R-Fragebogens insgesamt als gering ein, [ ] da insbesondere eine Verbesserung der gesundheitsbezogenen Lebensqualität erreicht wird [ ]. 157 Im ersten Verfahren von Ivacaftor ließ sich ebenfalls eine statistisch signifikante Verbesserung der Lebensqualität belegen. Zum Einsatz kamen im Rahmen der klinischen Studie hierbei neben dem EQ-5D auch CFQ-R. Dabei wurden für den Indexwert des EQ-5D in einer Teilpopulation statistisch signifikante Vorteile durch G-BA anerkannt. Folglich kam der G-BA zu der Einschätzung, dass die Ergebnisse zur Lebensqualität als eine Verbesserung des therapierelevanten Nutzens einzuschätzen sind. Hinsichtlich des unmittelbaren Einflusses auf die Einschätzung zum Ausmaß des Zusatznutzens äußert sich der G-BA jedoch nicht. Auch in den Verfahren von Afatinib ( [ ] positiven Effekt in Bezug auf die Lebensqualität [ ] 158 ), Trastuzumab Emtansin ( [ ] positiven Einfluss auf die gesundheitsbezogene Lebensqualität [ ] ) und Ruxolitinib ( [ ] Vorteile bei der gesundheitsbezogenen Lebensqualität unterstützen die Ergebnisse zugunsten von Ruxolitinib bei den Morbiditätsendpunkten [ ] ) legte der G-BA vergleichbare Begründungsmuster vor. Methodische Fragen in der Auswertung von Lebensqualitätsdaten Lebensqualitätsdaten scheitern im Rahmen der bisherigen Dossierbewertungen häufig schon an einer frühen Hürde. Weicht der Hersteller z. B. in der Definition der zvt vom G-BA ab, findet keine wei Tragende Gründe zu Ivacaftor (neues AWG), S. 6. Tragende Gründe zu Afatinib, S. 12.
104 84 Verfahrensfragen 3 tere Auswertung der vorgelegten Daten statt. In insgesamt 13 Verfahren, in denen der Hersteller einen Zusatznutzen im Endpunkt Lebensqualität geltend machte, war dies bis Mitte 215 der Fall. Dennoch, die Zahl der nicht anerkannten Lebensqualitätsdaten in Folge methodischer Mängel überwiegt (58 %). Dies hat verschiedene Gründe: Fehlende Validierung des Instrumentes (bzw. der Version) Responsekriterium nicht validiert Verletzung des Intention-to-Treat -Prinzips in Folge geringer Rücklaufquoten Fehlende statistische Signifikanz Unklarer Umgang mit fehlenden Werten Der G-BA stellt im Hinblick auf Studiendesign sowie Datenanalyse und -bewertung an Daten zur Lebensqualität dieselben methodischen Anforderungen wie an andere patientenrelevante Endpunkte. Bislang häufig eingesetzte Instrumente sind die indikationsspezifischen Fragebögen FACT-P, FACT-B, FACT-M, FACT-G und der EORTC QLQ-C3. Generische Fragebögen zur Lebensqualität (zum Beispiel der EQ-5D oder SF-36), sind aus Sicht des G-BA häufig nicht sensitiv genug, um krankheitsspezifische Effekte zu erfassen 159, werden jedoch vereinzelt, wenn auch nicht im Zeitverlauf kongruent, akzeptiert und waren auch schon für den Nachweis eines Zusatznutzens begründend. Insgesamt basieren 64 % der von Herstellern bislang vorgelegten Lebensqualitätsdaten u. a. auf entsprechenden Instrumente, wobei Ergebnisse des EQ-5D in Dossiers bis Mitte 215 am häufigsten berichtet wurden (n=37). Als zur Bewertung der Lebensqualität untaugliche Instrumente werden Fragebögen zur Patientenzufriedenheit oder Arbeitsproduktivität durch IQWiG und G-BA angesehen (z. B. Verfahren zu Saxagliptin/Metformin). Auch patientenberichtete Instrumente, die ausschließlich Symptome erfassen, werden nicht als relevante Indikatoren der Lebensqualität angesehen auch wenn sie von den Autoren der Fragebögen als Lebensqualitätsinstrumente konzipiert waren. Ein Beispiel hierfür ist der EORTC QLQ- LC13 für Patienten mit Lungenkrebs; dieser wurde unter den patientenrelevanten Endpunkt Morbidität subsumiert, da er ausschließlich Symptome erfasst (Verfahren zu Crizotinib und Afatinib). Darüber hinaus waren die Effekte in einigen Fällen nicht statistisch signifikant oder erreichten nicht das Ausmaß einer klinisch relevanten Verbesserung. Hierfür wurde entweder der Responder-Anteil, die Zeit bis zur Verschlechterung, eine validierte MID ( minimal important difference, vgl. z. B. Verfahren zu Ruxoltinib) oder wenn eine MID nicht vorlag ersatzweise das standardisierte Effektmaß 159 Klakow-Franck (214), S. 154.
105 3 Verfahrensfragen 85 Hedges g (z. B. im Verfahren von Axtinib oder Macietan) angewandt. Schließlich konnte eine mangelhafte oder unvollständige Darstellung von Lebensqualitätsdaten dazu führen, dass diese nicht als Evidenz anerkannt wurden (z. B. im Verfahren von Aclidiniumbromid). 16 Tabelle 11: Methodische Ablehnungsgründe für vorgelegte Lebensqualitätsdaten mit herstellerseitig beanspruchtem Zusatznutzen Wirkstoff Instrumente Ablehnungsgrund der Lebensqualitätsdaten Abirateronacetat FACT-P Fehlende Validierung des Fragebogens, Responsekriterium nicht validiert. Keine Angabe beim G-BA Abirateronacetat* Aclidiniumbromid Axitinib Belimumab Decitabin Emtricitabin, Rilpivirin, Tenofovirdisoproxil Enzalutamid FACT-P SGRQ FKSI-15, EQ-5D SF-36, EQ- 5D EORTC QLQ-C3 SF-36v2 FACT-P, EQ-5D Ergebnisse als signifikant anerkannt, aufgrund fehlender Daten über den Zeitpunkt der Progression hinaus sowie fehlender Angaben zur klinischen Relevanz des Responsekriteriums nicht zusatznutzenrelevant Auswertung aufgrund der Qualität der Datenaufbereitung nicht möglich. Patientenpräferenz bezüglich der Verwendung eines Inhalators wurde als Surrogat unter dem Aspekt der Behandlungszufriedenheit angeführt FKSI-15 wird aufgrund ausschließlicher Erfassung der Symptomatik dem Endpunkt Morbidität zugerechnet. Keine Ergebnisse des EQ-5D für die relevante Population Keine signifikanten Ergebnisse Zu geringer Rücklauf, fehlende statistische Signifikanz Kein Zusatznutzen aus den Ergebnissen ableitbar Zu geringer Rücklauf. Erfassung der Lebensqualität wurde zudem erst spät begonnen und nicht in allen Studienzentren eingesetzt Macitentan SF-36 Keine Aussage zum Ausmaß des Zusatznutzens möglich. 95% Konfidenzintervall liegt nicht vollständig oberhalb der Irrelevanzschwelle,2 (Hedges g). Individuelle Responderanalyse liegt nicht vor. Nintedanib (nicht-kleinzelliges Karzinom) EORTC QLQ-C3, EQ-5D VAS Keine signifikanten Unterschiede zwischen den Behandlungsgruppen 16 Bullinger et al. (215).
106 86 Verfahrensfragen 3 Wirkstoff Instrumente Ablehnungsgrund der Lebensqualitätsdaten Ocriplasmin NEI VFQ-25 Ergebnisse nicht signifikant. Befristung des Beschlusses um weitere Daten auch zur Lebensqualität zu generieren Pasireotid CushingQoL Klinisch relevante Differenz nicht beurteilbar Pasireotid* AcroQoL Es wird von einem hohen Verzerrungspotential ausgegangen, da keine Verblindung vorgenommen wurde. Keine signifikanten Unterschiede zwischen den Behandlungsgruppen Pertuzumab FACT-B Nicht validierte Fragebogenversion, Endpunkt teilweise post-hoc definiert Ruxolitinib Teduglutid FACT-Lym, EORTC QLQ-C3 Tafamidis Meglumin TQoL/Norfolk, SF-36 SBS-QoL, IBDQ, SF- 36 Insgesamt zwar eine Verbesserung der Lebensqualität vom G-BA anerkannt ( positiven Effekt ). Aber keine Validität der ausgewerteten Subskalen sowie geringe Rücklaufquoten. In weiterer Studie offenes Design bzw. fehlende Verbildung (wurde bereits von EMA bemängelt) sowie eine geringe Rücklaufquote Ergebnis nur in einer Teilauswertung signifikant besser Keine signifikanten Unterschiede zwischen den Behandlungsgruppen Telaprevir EQ-5D Daten in Subpopulation 1 nicht signifikant, in Subpopulation 2 keine verwertbaren Daten verfügbar * neues AWG Ein indikationsbezogener Gradient in der bisherigen Bewertungspraxis im Endpunkt Lebensqualität lässt sich aufgrund stark unterschiedlicher Beobachtungsmengen zum gegenwärtigen Zeitpunkt nicht ableiten. Zumindest auf deskriptiver Ebene kann jedoch beobachtet werden, dass in den Verfahren zu chronischen Erkrankungen (insb. Stoffwechselkrankheiten und Herz-Kreislauf-Erkrankungen) verhältnismäßig selten herstellerseitig Daten zur gesundheitsbezogenen Lebensqualität beigebracht werden (vgl. Abb. 18). Der Anteil der Verfahren, für die Hersteller dann einen Zusatznutzen in diesem Endpunkt beanspruchen, ist wiederum bei onkologischen Erkrankungen und Wirkstoffen zur Behandlung von Infektionskrankheiten verhältnismäßig hoch. Einen Zusatznutzen konnten, wie bereits gezeigt, bislang nur fünf onkologische Präparate bzw. zwei Wirkstoffe zur Behandlung von Stoffwechselkrankheiten belegen.
107 3 Verfahrensfragen 87 Abbildung 18: Angaben und Einschätzungen zur Lebensqualität in den Herstellerdossiers 161 Krankheiten des Nervensystems (n=9) onkologische Erkrankungen (n=38) Augenerkrankungen (n=5) Infektionskrankheiten (n=13) Stoffwechselkrankheiten (n=25) Herz-Kreislauf-Erkrankungen (n=7) % 1% 2% 3% 4% 5% 6% 7% 8% 9% 1% Keine Daten Kein Zusatznutzen Zusatznutzen vom Hersteller beansprucht Zusatznutzen gem. G-BA Stellenwert generischer Messinstrumente Zur Erfassung der Lebensqualität kann man sich vielerlei Instrumente bedienen. Dabei stellt sich die Frage, welche Instrumente im Kontext der Nutzenbewertung sinnvoll eingesetzt werden können. Dies betrifft zuletzt die Diskussion um die grundsätzliche Eignung generischer in Abgrenzung zu indikationsbezogenen Instrumenten. Bislang wurden in der Hälfte der Verfahren, welche Angaben zur Lebensqualität im Herstellerdossier enthielten, entsprechende Daten mit mehr als einem Messinstrument erhoben, bei 42 % sowohl mit einem generischen als auch einem krankheitsspezifischen Instrument (vgl. Tab. 9). Der EQ-5D ist dabei der bislang am häufigsten verwendete Fragebogen. Nach Einschätzung des G-BA ist dieses Instrument zur Anwendung im deutschen Versorgungskontext jedoch nicht geeignet. Begründet wird dies damit, dass sich mit dem EQ-5D im Vergleich zu anderen generischen Instrumenten wie dem SF-36 [ ] kostenauslösende Momente [ ] abbilden lassen und dieser damit eher in Bewertungssystemen mit Kosten-Nutzen-Bewertungen geeignet sei. 162 Dies verkennt jedoch, dass der EQ-5D international ein etabliertes und anerkanntes Erhebungsinstrument der gesundheitsbezogenen Lebensqualität ist und dies unabhängig davon, ob das jeweilige Gesundheitssystem auf Kosten-Nutzen-Analysen ausgerichtet ist oder Ablehnung des EQ- 5D nicht nachvollziehbar Dargestellt sind nur Anwendungsgebiete, in denen wenigstens fünf Bewertungsverfahren basierend auf einem vorliegenden Herstellerdossier abgeschlossen wurden. Hecken (215).
108 88 Verfahrensfragen 3 nicht. 163 Der Fragebogen wird zwar international sehr häufig eingesetzt, um QALYs (quality-adjusted-life-years) zu berechnen, aber noch weit häufiger außerhalb von Kosten-Nutzwert-Analysen. 164 Eine zu vermutende Reduktion des EQ-5D auf die Möglichkeit zur Indexberechnung greift argumentativ auch deshalb zu kurz, da die separate Angabe der Profilergebnisse des EQ-5D neben den Indexwerten für klinische Studien grundsätzlich empfohlen 165 und so bereits im Rahmen der Nutzenbewertung explizit durchgeführt wurde. 166 Ein Blick auf den Beginn der frühen Nutzenbewertung zeigt, dass der EQ-5D Index und die EQ-5D VAS (Visuelle Analog- Skala) anfangs auch in Deutschland noch als valide Instrumente zur Erfassung der Lebensqualität anerkannt waren (siehe hierzu die Verfahren von Ivacaftor, Fingolimod, Telaprevir oder Sitagliptin). Im Verfahren von Ivacaftor hieß es 212 dazu, dass [ ] eine Verwendung dieses generischen Fragebogens zusätzlich zu der Erhebung der Lebensqualität durch [krankheitsspezifische Messinstrumente] wünschenswert [ist]. 167 Eine ausführliche, fachliche und auf methodischen Überlegungen basierende Begründung dieses inzwischen anders geltenden Stellenwertes (vgl. hierzu die Verfahren von Afatinib, Crizotinib, Dabrafenib oder Radium-223-dichlorid) liegt bislang nicht vor. Die pauschale Ablehnung des EQ-5D 168 als für die Bewertung eines Zusatznutzens im Endpunkt Lebensqualität geeigneten Instrumentes ist auch insofern nicht nachvollziehbar, als dass die bisherigen Beschlüsse unterschiedliche Begründungsmuster für die Ablehnung dieses Instrumentes enthielten (Ablehnung des Indexes als Nutzwert, Verweis auf den zugrunde liegenden Tarif des Indexes). 169 Vor dem Hintergrund, dass G-BA und IQWiG selbst immer wieder Daten zu patientenberichteten Endpunkten bzw. zur gesundheitsbezogenen Lebensqualität fordern, ist der Umgang des G-BA mit den Ergebnissen eines international etablierten und international als eines der Standardinstrumente geltenden EQ-5D zumindest unverständlich. Dies gilt insbesondere deshalb, weil eigentlich fachliche Überlegungen ausschlaggebend für den Einsatz und die Akzeptanz generischer Messinstrumente sein sollten. So konnte beispielsweise in einem Vergleich des SF-12 und des EQ-5D-3L 17 an einer USamerikanischen Stichprobe aufgrund der mangelnden Sensitivität ein eingeschränktes Diskriminieren zwischen Gesundheitszuständen mit leichten Einschränkungen unter Anwendung des EQ-5D-3L Massetti et al. (215). Greiner, Klose (214), S Krabbe, Weijnen (23), S. 11. Vgl. hierzu exemplarisch das Verfahren von Dabrefenib im Jahr 214. Nutzenbewertung des G-BA zu Ivacaftor, S. 1. Vgl. für die Position des G-BA Hecken (215). Vgl. hierzu exemplarisch die Anmerkungen des Vfa im Rahmen des Stellungnahmeverfahrens zu Dabrafenib. Zusammenfassende Dokumentation, S. 16f. Der EQ-5D-3L beinhaltet je drei Antwortkategorien/Level (keine Probleme, einige Probleme, extreme Probleme) innerhalb der fünf Dimensionen.
109 3 Verfahrensfragen 89 gezeigt werden. 171 Der EQ-5D ist aufgrund seiner Kürze gegenüber anderen generischen Erhebungsinstrumenten jedoch dort gut geeignet, wo Personen z. B. erkrankungsbedingt eine kurze Aufmerksamkeitsspanne haben oder aufgrund anderer eingesetzter Instrumente bereites eine starke kognitive Beanspruchung des Probanden vorliegt. Auch sollte beachtet werden, dass derzeit die Ermittlung der präferenzbasierten Abschlagswerte des von drei auf fünf Level erweiterten EQ-5D-5L zur Bildung des EQ-5D-5L-Indexes in Deutschland stattfindet. 172 Die 5L-Version bildet damit insgesamt verschiedene Gesundheitszustände ab (bei der 3L-Version waren es noch 243). Die Erweiterung des EQ-5D wurde seitens der EuroQol-Foundation angestoßen, um die Sensitivität des Instrumentes zu erhöhen. 173 Erste Ergebnisse mit dem erweiterten Fragebogen in anderen Ländern bestätigen diese Vorgehensweise. Inwiefern diese Weiterentwicklung des EQ-5D Einfluss auf die bisherige Bewertungspraxis von G-BA und IQWiG haben wird, muss abgewartet werden. Im klinischen Studienregister clinicaltrials.gov sind derzeit 171 Studien (davon 122 in Europa) registriert, welche den EQ-5D-5L als Outcome-Instrument verwenden. Es ist damit eines der am weitesten verbreiteten Lebensqualitätsinstrumente der Welt. Angesichts global geplanter Zulassungsstudien (und des international weit verbreiteten Einsatzes des EQ-5D) erscheint eine vollständige Abkehr von diesem Instrument im Rahmen der frühen Nutzenbewertung in Deutschland auch im Hinblick auf das Ziel, zukünftig Lebensqualitätsdaten noch stärker in die Bewertung einzubinden, nicht sachgerecht. Im Sinne der gem. 35 a Abs. 1 SGB V geforderten Berücksichtigung des internationalen Standards der evidenzbasierten Medizin und der Gesundheitsökonomie wäre deshalb ein intensiverer Austausch des G-BA mit Fachexperten zur Bewertung von Lebensqualitätsdaten im Rahmen der frühen Nutzenbewertung wünschenswert. Verbesserter Einbezug von Lebensqualitätsdaten in die Nutzenbewertung: Warten auf die Zulassungsbehörden oder imputieren? Die frühe Nutzenbewertung ist eine Herausforderung für die Analyse und Interpretation von Lebensqualitätsdaten. Die Erhebung von Lebensqualitätsdaten ist anders als vom Studienarzt zu erhebende bzw, dokumentierende Endpunkte in hohem Maße abhängig von der Patienten-Response. Fehlende Werte oder gar komplett fehlende Erhebungsbögen sind typische Probleme der Erhebung patientenberichteter Endpunkte. Um in den bereits laufenden bzw. zeit Johnson, Coons (1998). Greiner, Klose (214), S Herdman et al. (211), S
110 9 Verfahrensfragen 3 Wörmann (215), S. 117/12. Die Darstellung von Wörmann in Tabelle 14 auf Seite 39 des DGHO-Gutachtens ist insofern irreführend. Der G-BA vergibt zwar in beiden Verfahren einen im Ausmaß geringen Zusatznutzen, begründet diesen jedoch nicht über relevante Effekte im Endpunkt Lebensqualität. Siehe die Verfahren von: Eribulin, Idelalisib, Ipilimumab, Ipilimumab [neues AWG], Ocriplasmin, Pertuzumab, Regorafenib, Sipuleucel-T, Sofosbuvir, Vemurafenib. Schiffner-Rohe, Leverkus (215). Beschlussbefristungen zur Vorlage von Lebensqualitätsdaten nah anstehenden Nutzenbewertungen dennoch eine bessere Verarbeitung der eingeschlossenen Lebensqualitätsdaten zu erreichen, gilt es Überlegungen anzustoßen, über welche Verfahren eine Verbesserung der Methodik der Erhebung und Darstellung von Daten zur Lebensqualität erreicht werden kann. Grundsätzlich kann diskutiert werden, bereits von den Zulassungsbehörden detaillierte Informationen zu patientenberichteten Endpunkten wie Lebensqualität zu fordern. Bislang konnten nur zwei Hersteller (in den Verfahren von Indacaterol/Glycopyrronium und Tafamidis Meglumin) Daten zur gesundheitsbezogenen Lebensqualität als primären Endpunkt pivotaler Phase-III-Studien beim G-BA vorlegen. 174 Dass sich dies zukünftig ändert, ist auch durch einen auf methodischer Ebene stattfindenden fachlichen Austausch zwischen Zulassungs- und HTA-Institutionen kaum zu erwarten. Der G-BA selbst nutzt wiederum das Instrument der Beschlussbefristung um gezielt auch Lebensqualitätsdaten nachzufordern. Die Auswertung der Befristungskriterien des G-BA in Kapitel 3.5 zeigt, dass immerhin in zehn von bislang 29 befristeten Nutzenbewertungsbeschlüssen vom G-BA u. a. fehlende Lebensqualitätsdaten als Befristungsgrund genannt wurden. 175 Für den Prozess der Dossiererstellung und Nutzenbewertung besteht jedoch auch eine Möglichkeit darin zu prüfen, inwieweit Imputationsverfahren (Ersetzen fehlender Werte über statistische Verfahren) geeignet sind, wenn Daten zu bestimmten Datenschnitten in einer Studie nicht mehr in ausreichender Form vorliegen. Sind die Schätzer infolge fehlender Werte potentiell verzerrt, führt das zu einer Reduktion der Wahrscheinlichkeit des Zusatznutzens. In seinem Methodenpapier verweist das IQWiG darauf, dass es für den Umgang mit fehlenden Werten im Rahmen der Auswertung von Studien keine Patentlösung gibt. Dabei ist zu berücksichtigen, dass das Ersetzen von Daten immer zu Unsicherheit führt. Da es keine eindeutigen Aussagen des IQWiG dazu gibt, welche Imputationstechniken potenziell akzeptiert werden, ist eine darauf ausgerichtete Planung von Studien nur schwer umsetzbar. Grundsätzlich sind mögliche Gründe für fehlende Werte, sowie deren Konsequenzen auf die Ergebnisse und Aussagekraft der Studien zu diskutieren. Darüber hinaus verweist das IQWiG auf verschiedene Methoden zum Umgang mit den fehlenden Werten, insbesondere die Imputation von fehlenden Werten und die Anwendung mehrerer Verfahren (Sensitivitätsanalysen) zur Überprüfung der Robustheit getroffener Aussagen
111 3 Verfahrensfragen 91 In einem 214 durchgeführten Bewertungsverfahren (Radium-223- dichlorid, Xofigo ) hat das IQWiG erstmals selbst entsprechende Berechnungen basierend auf einer Varianzkorrektur gemäß data set resizing approach vorgenommen, kommt jedoch zu dem Ergebnis, dass die Ergebnisse dieser Ersetzungsstrategien nicht hinreichend robust waren, um daraus einen Zusatznutzen ableiten zu können. 177 Insbesondere neuere Ansätze zur Imputation fehlender Daten wurden in der Vergangenheit von Herstellern in den eingereichten Dossiers noch nicht berücksichtigt, können jedoch im Rahmen des Stellungnahmeverfahrens nachgereicht werden. Im Verfahren der erneuten Nutzenbewertung von Ruxolitinib legte der Hersteller auf Vorschlag des IQWiG beispielsweise LOCF-Analysen ( last observation carried forward ) für Daten zur Verbesserungen der Lebensqualität vor. 178 Zuvor hatte das IQWiG die Daten aufgrund eines zu großen Unterschiedes der Anteile fehlender Werte zwischen den Studienarmen (> 2 %) nicht berücksichtigt. Eine kürzlich publizierte Simulationsstudie zur Imputation fehlender Daten im EQ-5D-3L vergleicht verschiedene Ersetzungsstrategien auf Ebene der Fragendomänen sowie des Indexes unter Berücksichtigung unterschiedlicher fehlender Datenmengen. 179 Die Auswertungen basieren auf einer post hoc Simulation eines abgeschlossenen internationalen RCTs, aus welcher ein Subsample gezogen und über einen Zufallsalgorithmus fehlende Werte generiert wurden. Die Autoren der Studie kommen zu dem Ergebnis, dass in einem Rahmen von 5 2 % fehlender Werte auf Ebene der Einzeldomänen mittels multipler Imputation eine hohe Ersetzungsgenauigkeit erzielt werden kann. Ab einem fehlenden Werte-Anteil von 4 % und mehr sind jedoch statistisch bedeutsame Abweichungen innerhalb zweier Domänen bei multipler Imputation sichtbar. Ob eine verbesserte Imputation fehlender Werte in Auswertungen der Lebensqualität Auswirkungen auf die Akzeptanz seitens des G-BA haben könnte, muss die weitere Diskussion zu dieser methodischen Fragestellung zeigen. Anwendung von Imputationsverfahren durch das IQWiG IQWiG Nutzenbewertung zu Radium-223-dichlorid, S. 28. Wortprotokoll zum Verfahren von Ruxolitinib vom , S. 4. Simons et al. (215).
112 92 Verfahrensfragen Indirekte Vergleiche Indirekte Vergleiche nur selten erfolgreich Erfolgsaussichten indirekter Vergleiche Während im Rahmen des Zulassungsverfahrens ein Wirksamkeitsvergleich gegen Placebo hinreichend ist, sind bei Nutzenbewertungen generell head-to-head, also direkte Vergleichsstudien mit einem aktiven Komparator, zu bevorzugen. 18 Die mit der AM-NutzenV eröffnete Möglichkeit zur Nutzung indirekter Vergleiche im Frühbewertungsverfahren soll den Vergleich mit der zweckmäßigen Vergleichstherapie, für die keine direkten Vergleichsdaten vorliegen, ermöglichen. Dies war gerade in den ersten Jahren des AMNOG notwendig, in denen das klinische Studienprogramm der Hersteller die veränderten Verfahrensanforderungen in Deutschland noch nicht berücksichtigen konnte, hat jedoch an Aktualität nicht eingebüßt. Denn es wird in der Bewertung des von Herstellern aufgesetzten Studienprogramms auch zukünftig zu berücksichtigen sein, dass der standard of care international verschieden sein kann. Auch können sich relevante Therapiestandards im Laufe eines klinischen Forschungsprogramms ändern. In den bis zum abgeschlossenen Verfahren wird in 29 % der Verfahren (n = 35) der Zusatznutzen zumindest in einem Teilanwendungsgebiet durch den pharmazeutischen Unternehmer über einen indirekten Vergleich begründet. Hinsichtlich der Güte der bislang vorgelegten indirekten Vergleiche muss zwischen der grundsätzlichen methodischen Akzeptanz des Vergleiches sowie der darauf folgenden Ableitung eines Zusatznutzens unterschieden werden (vgl. Abb. 19). Abbildung 19: Erfolgsquote indirekter Vergleiche (Stand: ) Ja (n=35) Indirekter Vergleich vorgelegt Ja (n=35) Ja (n=8) Methodik akzeptiert Ja (n=8) Zusatznutzen belegt Ja (n=5) Ja (n=6) % 1% 2% 3% 4% 5% 6% 7% 8% 9% 1% Von den 35 bislang vorgelegten indirekten Vergleichen werden vom G-BA lediglich acht (23 %) hinsichtlich der verwendeten Methodik als zum Zusatznutzennachweis geeignet akzeptiert. 27-mal wurden 18 Bekkering, Kleijnen (28), S. S235.
113 3 Verfahrensfragen 93 die vom Hersteller vorgelegten Daten aus indirekten Vergleichen aus methodischen Gründen nicht weiter berücksichtigt. Unter den vom G-BA berücksichtigten Ansätzen waren bislang drei adjustierte indirekte Vergleiche nach Bucher (Ticagrelor, Empagliflozin, Aflibercept [neues AWG]). In fünf Fällen wurde hingegen ein im Methodenspektrum zunächst geringwertigerer nicht-adjustierter indirekter Vergleich vom G-BA akzeptiert (Daclatasvir, Ledipasvir/Sofosbuvir, Simeprevir, Sofosbuvir, Vismodegib). Von diesen acht grundsätzlich akzeptierten Vergleichen wurden letztlich in sechs Verfahren die Ergebnisse zur Begründung eines Zusatznutzens herangezogen (vgl. Tab. 12). Die im Verfahren von Empagliflozin und Aflibercept (neues AWG) vorgelegten Berechnungen genügten den hohen methodischen Ansprüchen nicht. Tabelle 12: Erfolgreiche indirekte Vergleiche gem. G-BA-Beschluss (Stand: ) Wirkstoff Beschlussfassung Methodik Ticagrelor Adjustierter nach Bucher Zusatznutzen Nicht quantifizierbar Vismodegib Nicht adjustiert Gering Sofosbuvir Nicht adjustiert Gering Simeprevir Nicht adjustiert Gering Daclatasvir Nicht adjustiert Gering Ledipasvir/ Sofosbuvir Nicht adjustiert Beträchtlich Grundsätzlich ist ein indirekter Vergleich auch nach Einschätzung des IQWiG bei adäquater Durchführung zum Zusatznutzennachweis geeignet. 181 Gemäß der Allgemeinen Methoden des IQWiG müssen jedoch adäquate Methoden für indirekte Vergleiche verwendet werden. Dazu zählen nach Institutsangaben sog. Netzwerk- Meta-Analysen und adjustierte indirekte Vergleiche nach Bucher. Die Anwendung nicht adjustierter Vergleiche wird hingegen abgelehnt. 182 Hauptproblem nicht-adjustierter indirekter Vergleiche ist, dass sich die Charakteristika der für den Vergleich herangezogenen Patientenkollektive in nicht kalkulierbarer Weise unterscheiden. Überraschend ist daher zunächst, dass nach einer Vielzahl bis Mitte 214 erfolglos vorgelegter indirekter Vergleiche zuletzt gleich fünfmal auf Basis eines solches naiven Ansatzes ein Zusatznutzen vom G-BA vergeben wurde. Die vorangegangenen Bewertungen des Wieseler (215). IQWiG (215), S. 178f.
114 94 Verfahrensfragen 3 IQWiG stützen diese Einstufung. 183 Vier dieser fünf Vergleiche wurden dabei für neue Hepatitis-C-Präparate vorgelegt. Zu klären ist deshalb, ob der Erfolg dieser Verfahren auf andere Nutzenbewertungen übertragbar ist, oder anderen Kontextfaktoren geschuldet ist. Woran scheitern indirekte Vergleiche, was sind Erfolgsfaktoren? Ob die Ergebnisse eines indirekten Vergleichs aussagekräftig sind oder nicht, hängt von einer Reihe von Faktoren ab: Zum einen muss die Methodik geeignet sein, zum anderen müssen die in den Vergleich eingehenden Daten hinsichtlich ihres Verzerrungspotentials und ihrer Strukturqualität bestimmten Mindestanforderungen genügen. Bei letzterem ist u. a. maßgeblich, ob die in den Studien untersuchten Patientinnen und Patienten hinreichend ähnlich sind. Die Gründe, warum indirekte Vergleiche in der methodischen Prüfung des IQWiG scheitern sind vielfältig: mangelnde Ähnlichkeit der Studien unvollständiger Studienpool Arzneimittel nicht gemäß Zulassung eingesetzt Komparator ist nicht die zweckmäßige Vergleichstherapie biometrische Methodik nicht geeignet Darüber hinaus wird in vielen indirekten Vergleichen kritisiert, dass die Ergebnisse klinischer Studien nicht oder nur unvollständig berichtet werden, sodass auch die resultierenden indirekten Vergleiche viele Fragen der frühen Nutzenbewertung unbeantwortet lassen. Neben der grundsätzlichen Eignung der methodischen Durchführung des indirekten Vergleiches sind jedoch auch Detailfragen innerhalb der Auswertungen selbst Gegenstand methodischer Diskussionen. Im Verfahren von Aflibercept (neues AWG) berechnete der pharmazeutische Unternehmer statistisch signifikante Vorteile basierend auf einem indirekten Vergleich und bestätigte diese durch den Effektschätzer Hedges g. Das IQWiG merkte im Rahmen der Nutzenbewertung sowie des anschließenden Stellungnahmeverfahrens Inkonsistenzen innerhalb entsprechender Berechnung an (der 183 Das IQWiG weist dennoch darauf hin, dass randomisierte kontrollierte Studien im Anwendungsgebiet von Sofosbuvir grundsätzlich möglich wären und auch (für bestimmte Patientengruppen) durchgeführt wurden. Aus der Akzeptanz nicht adjustierter indirekter Vergleiche in diesem Sonderfall (dramatische Effekte, zulassungskonforme Durchführung der Studien und hinreichende Ähnlichkeit zwischen Studien) ist insofern keine grundsätzliche und auf andere Verfahren übertragbare Aufweichung der methodischen Anforderungen an indirekter Vergleiche abzuleiten.
115 3 Verfahrensfragen 95 Hersteller rechnete mit gepoolten Varianzen, statt diese zu addieren, weshalb es aus Sicht des IQWiG zu einer Unterschätzung der Varianz kommt). 184 Manche Verfahren lassen hingegen den Schluss zu, dass der Hersteller den Aufwand und das vermeintlich negative Ergebnis eines indirekten Vergleiches antizipiert und diesen folglich nicht durchführt. So zum Beispiel im Verfahren von Apremilast. Der Hersteller legte für keine der beiden Indikationen (Plaque-Psoriasis bzw. aktive Psoriasis-Arthritis) Studien vor, in denen Apremilast gegen die jeweilige zweckmäßige Vergleichstherapie getestet wurde. Es wurden lediglich Daten aus placebokontrollierten Studien beschrieben, diese aber nicht für einen indirekten Vergleich genutzt. Auch eine systematische Recherche nach Studien mit der zweckmäßigen Vergleichstherapie, die sich gegebenenfalls für einen indirekten Vergleich mit Apremilast eignen würden, fehlte. Deshalb blieb offen, ob ein indirekter Vergleich möglich gewesen wäre und damit auch, ob Apremilast einen Zusatznutzen oder auch einen geringeren Nutzen als bereits verfügbare Präparate gezeigt hätte. Konsequenterweise beansprucht der Hersteller selbst für keine der beiden Indikationen einen Zusatznutzen. Im Fall des Mitte 214 bewerteten Sofosbuvir legte der Hersteller über historische Vergleiche einer einarmigen Studie im Sinne eines nicht adjustierten indirekten Vergleichs zunächst vom IQWiG nicht akzeptierte Daten zum Zusatznutzenbeleg vor. Denn nach 5. Kapitel 18 Abs. 2 Satz 4 VerfO des G-BA ist der Nachweis, dass ein kausaler Zusammenhang zwischen einer therapeutischen Intervention und einem Effekt im Vergleich zu einer anderen therapeutischen Intervention besteht, grundsätzlich auf der Grundlage von direkt vergleichenden klinischen Studien höchster Qualität zu führen. Es ist jedoch möglich, in besonders gelagerten Fallkonstellationen eine Bewertungsentscheidung auf der Grundlage qualitativ angemessener Unterlagen niedrigerer Evidenzstufe zu treffen (vgl. 2 Kapitel 13 Abs.2 VerfO). Diese Voraussetzungen werden vom G-BA in Bezug auf die Nutzenbewertung von Sofosbovir (und den danach folgenden neuen Wirkstoffen zur Hepatits-C-Therapie) als erfüllt angesehen. 185 Die bisherigen Behandlungsoptionen bestehen aus interferonhaltigen Kombinationstherapien, die über 16 bis 72 Wochen angewandt werden müssen. Interferonbasierte Therapien sind assoziiert mit einer Vielzahl zum Teil schwerwiegender Nebenwirkungen. Ausgehend hiervon sowie unter Berücksichtigung der Verkürzung der Therapiedauer und des Nebenwirkungsprofils von Interferon besteht eine Ausnahmekonstellation, die in Übereinstimmung mit der AKdÄ sowie der FDA 186 eine Berücksichtigung von einar- Erfolgreiche indirekte Vergleiche sind kontextbezogen Nutzenbewertung von Aflibercept (neues AWG), S. 69; Wortprotokoll zu Aflibercept (neues AWG), S. 8f. Tragende Gründe zu Sofosbuvir, S. 18. FDA (213), S. 18f.
116 96 Verfahrensfragen 3 migen Studien von Sofosbuvir im Vergleich mit historischen Kontrollen zu den bisherigen interferonhaltigen Behandlungsoptionen aus Sicht des G-BA rechtfertigt. Unter diesen Umständen würden die vorliegenden einarmigen Studien unter Berücksichtigung des historischen Vergleiches als verwertbare Bewertungsunterlagen ausnahmsweise zur Beurteilung des Zusatznutzens herangezogen werden. Eine Entscheidung, welche im Übrigen gegen die Stimme des GKV-SV im G-BA beschlossen wurde. Der G-BA selbst verwies in diesem Fall auf den extremen Ausnahmefall ( dramatischer Effekt 187 ), welcher der neue Wirkstoff Sofosbuvir hinsichtlich der Therapie des Hepatitis-C darstellen würde. 188 Im Verfahren von Vismodegib entschied der G-BA basierend auf einem nicht adjustierten Vergleich ebenfalls, dass mit Verweis auf die Schwere der Erkrankung (Basalzellkarzinom) ein Zusatznutzen vorliegt. Damit widerspricht der G-BA dem IQWiG, welches aus methodischen Gründen zuvor keinen Zusatznutzen anerkannt hatte Wieseler (215). Hoppe et al. (215), S. 33f.
117 3 Verfahrensfragen Re-Evaluationen und Befristungskriterien Befristungsgründe Der G-BA hat bis Mitte 215 den Beschluss jedes vierten Verfahrens (n=29) befristet. In Vergleich zu Neubewertungen in Folge eines Veränderten Anwendungsgebietes oder durch das Vorliegen neuer wissenschaftlicher Erkenntnisse sind Re-Evaluationen in Folge eines befristeten Beschlusses Teil des fachlichen Entwicklungsprozesses des AMNOG. Denn einem befristeten G-BA-Beschluss (Kapitel 2.1) liegen entweder sachliche Gründe oder eine bedingte Zulassung durch die europäische Kommission (Conditional Marketing Authorization) 189 zugrunde. Beide Ausgangspunkte einer Befristung sind mit Unsicherheiten im Evidenzmaterial verbunden. Als sachliche Gründe werden regelhaft bestehende Unsicherheiten hinsichtlich zuverlässiger, wissenschaftlich nachprüfbarer Aussagen zum Bestehen und zum Ausmaß eines Zusatznutzens bzw. zum allgemein anerkannten Stand der medizinischen Erkenntnisse, die die Beurteilung der Zweckmäßigkeit eines Arzneimittels einschränken, angeführt. In 19 der 29 befristeten Verfahren werden konkrete Endpunktdaten vom G-BA nachgefordert. In fast der Hälfte aller Fälle betrifft dies Daten zu unerwünschten Ereignissen (vgl. Tab. 13). Tabelle 13: Befristungskriterien des G-BA Verschiedene Nachforderungen druch den G-BA Befristungskriterium n 1 % Fehlende Mortalitätsdaten % Fehlende Morbiditätsdaten 9 31 % Fehlende Daten zu unerwünschten Ereignissen % Fehlende Lebensqualitätsdaten 1 34 % Fehlende Validität % Bedingte EMA-Zulassung % Laufende Studien % 1 3 Mehrfachnennungen möglich; 2 bzw. Zulassung unter besonderen Bedingungen; hierzu zählen auch Register oder Pharmakovigilanz-Auswertungen der EMA 189 Eine bedingte Zulassung gemäß Art. 14 Abs. 7 Verordnung (EG) 726/24 i. V. m. Art. 4 VO (EG) Nr. 57/26 besagt, dass eine Genehmigung für das Inverkehrbringen eines Arzneimittels vorbehaltlich besonderer Bedingungen (positives Nutzen-Risiko-Verhältnis, Antragssteller ist voraussichtlich in der Lage, umfassende klinische Daten nachzuliefern, es kann eine medizinische Versorgungslücke geschlossen werden, der Nutzen für die öffentliche Gesundheit überwiegt potentielle Risiken) erteilt werden kann, die jährlich von der EMA neu beurteilt werden.
118 98 Verfahrensfragen 3 Dabei ist zu unterscheiden, ob eine Beschlussbefristung Ergebnisse bereits laufender Studien antizipiert oder bewusst neue initiieren möchte. In 14 Verfahren bezieht sich der G-BA in den tragenden Gründen explizit auf vom Hersteller genannte zum Zeitpunkt der Nutzenbewertung noch laufende Studienprogramme. Im Verfahren von Ponatinib verweist der G-BA wiederum auf eine durch die EMA vorzunehmende Auswertung von Pharmakovigilanzdaten gem. Artikel der Verordnung (EG) Nr. 726/24 19, insbesondere zur Bewertung der Art, Schwere und Häufigkeit aller Behandlungsbedürftigen, unerwünschten Ereignisse. Die durchschnittliche Befristungsdauer bei laufenden Studienprogrammen beträgt dementsprechend nur 1,6 Jahre. Liegen zum Zeitpunkt der Nutzenbewertung keine laufenden Studien vor, müssen diese also erst noch durch den pharmazeutischen Unternehmer initiiert werden, räumt der G-BA durchschnittlich 3,5 Jahre zur weiteren Evidenzgenerierung ein. Sanktionierung unklar Unklar ist noch, was passiert, wenn der pharmazeutische Unternehmer nach Ablauf der Befristung nicht die geforderten Daten nachliefert. Der G-BA hat zwar die Möglichkeit, bei ausreichender Begründung die Befristung zu verlängern. Welche Begründungsmuster hierfür hinreichend wären und wie geeignete Sanktionierungsoptionen aussähen, ist bislang noch nicht abschließend geklärt. Ergebnisse der Neubewertungen nach Fristablauf Zum liegen zwei abgeschlossene Neubewertungen eines Wirkstoffes nach Ablauf eines befristeten G-BA-Beschlusses vor (vgl. Tab. 14). Tabelle 14: Ergebnisse der Re-Evaluationen (Stand: ) Wirkstoff Befristungsgrund Inhalt der Re- Evaluation Ergebnis Eribulin* Fehlende Daten zur Toxizität, Lebensqualität und zum Risiko von Nebenwirkungen EMBRACE-2-Studie Studie 31 Vemurafeniib Kurze Beobachtungszeit, EMA verlangte die Vorlage weiterer Daten zu Überlebensraten BRIM-3-Studie - * neues Anwendungsgebiet; entspricht keinen Änderungen 19 Verordnung (EG) Nr. 726/24 des europäischen Parlaments und des Rates vom 31. März 24 zur Festlegung von Gemeinschaftsverfahren für die Genehmigung und Überwachung von Human- und Tierarzneimitteln und zur Errichtung einer europäischen Arzneimittel-Agentur.
119 3 Verfahrensfragen 99 Die Neubewertung von Eribulin hat gezeigt, dass der G-BA das Ergebnis vorheriger Beschlüsse durch das Vorliegen neuer Evidenz bereit ist anzupassen. Die erneute Bewertung nach Fristablauf wurde mit dem Verfahren, dass durch eine Indikationserweiterung erforderlich war, zusammengelegt. Der zweite Beschluss ist unbefristet und kommt zu einem anderen Ergebnis als der erste. Während im ersten Beschluss der Zusatznutzen für beide berücksichtigte Populationen als gering eingestuft wurde, fand der G-BA in der zweiten Bewertung für die Patientinnen, bei denen eine erneute taxan- bzw. anthrazyklinhaltige Therapie nicht mehr möglich ist, einen beträchtlichen Zusatznutzen. Für Patientinnen, bei denen eine solche Therapie nochmals durchgeführt werden kann, konnte jedoch kein Beleg für einen Zusatznutzen festgestellt werden. Ein befristeter Nutzenbeschluss stellt für den pharmazeutischen Unternehmer insofern eine gute Möglichkeit dar, parallel zur Generierung weiterer Evidenz das ökonomische Potential neuer Produkte bereits zu einem frühen Zeitpunkt der Marktentwicklung auch bei aus HTA-Perspektive noch unzureichender Datenlage auszuschöpfen. Für die Re-Evaluation von Vemurafenib legte der Hersteller entsprechend der EMA-Nachforderungen Ergebnisse zu weiteren Datenschnitten der Studie BRIM3 vor. Daten aus neuen Untersuchung wurden nicht beigebracht. Der zweite Beschluss war identisch mit dem Beschluss des ersten Verfahrens und bestätigte den bereits zuvor festgestellten beträchtlichen Zusatznutzen gegenüber der zvt. Außerhalb des Auswertungszeitraumes dieses Reports wurde die Neubewertung von Fingolimod, ein Wirkstoff zur Behandlung von Erwachsenen mit hochaktiver, schubförmig verlaufender Multipler Sklerose (RRMS), abgeschlossen. Der Hersteller hat gegenüber der ersten Bewertung vor drei Jahren allerdings ebenfalls keine neuen Studien vorgelegt, sondern bereits vorhandene neu ausgewertet. Diese Ergebnisse weisen auf einen Zusatznutzen bei zwei von drei Patientengruppen hin. Entgegen dem ersten Bewertungsverfahren konnte der Hersteller (gemäß Beschluss des G-BA aus Oktober 215) damit nicht nur in einer zweiten Subgruppe einen Zusatznutzen belegen, sondern auch einen bereits zuvor gezeigten im Ausmaß geringen Zusatznutzen bei Patienten mit rasch fortschreitender schwerer RRMS hinsichtlich des Ausmaßes der Ergebnissicherheit verbessern (von Anhaltspunkt auf Hinweis). Ist eine verpflichtende Re-Evaluation sinnvoll? Zur Weiterentwicklung der Nutzenbewertung und Stärkung der Versorgungsforschung in Deutschland wäre zu überlegen, ob die kann- Option der Beschlussbefristung zukünftig nicht in eine verpflichtende Re-Evaluation umgewandelt wird. 191 Dafür müsse aber 191 Haas in Hoppe et al. (215), S. 11.
120 1 Verfahrensfragen 3 eine Postzulassungsstudienkultur etabliert werden. Hier werden jedoch verstärkt unabhängige wissenschaftsinitiierte und versorgungsrelevante Studien nach erfolgter Zulassung benötigt. 192 Fraglich ist, warum für Arzneimittel nach abgeschlossener Zulassung kaum noch valide Studien durchgeführt werden, die den Langzeitnutzen evaluieren. Das IQWiG beklagte deshalb zuletzt, dass es neben dem obligatorischen Monitoring von Nebenwirkungen kaum weitere Head-to-Head-Studien zu neueren Therapiealternativen gebe. 193 Zwischen den Zeilen ließe sich hier jedoch auch eine geringe Chance für die Akzeptanz klassischer Versorgungsstudien geringeren Evidenzniveaus (also keine RCTs) unter den derzeitigen Rahmenbedingungen interpretieren. Es darf insofern bezweifelt werden, dass Versorgungsforschungsstudien nach Marktzulassung eine große Chance hätten, den hohen methodischen Anforderungen des IQWiG zum Nachweis eines Zusatznutzens zu entsprechen. 194 Fraglich ist, für welche Wirkstoffe dies sinnvoll sein könnte. Die Industrie dürfte ein Interesse daran haben, entsprechende Studien für Wirkstoffe mit geringem oder keinem Zusatznutzen aufzusetzen. Die GKV könnte wiederum dafür plädieren, den Versorgungsnutzen neuerer Hochpreispräparate zu belegen. Daran dürfte jedoch die Industrie wiederum ein geringes Interesse zeigen, weil sich das Risiko für im Versorgungsalltag schlechtere Wirksamkeitsergebnisse hier kaum antizipieren lassen dürfte. 195 Gegen eine verpflichtende Versorgungsforschung für AMNOG-Wirkstoffe 196 spricht insofern auch die Gefahr, dass über aufgesetzte Patientenprogramme zum Teil auch schlecht bewertete Wirkstoffe abseits allgemeiner Marktmechanismen eine starke Marktdurchdringung erfahren könnten. Hier gilt es für den G-BA im Falle einer gesetzlichen Ausweitung dieses Verfahrensparameters praktikable Regelungen zu entwickeln Ludwig (215). Ärzteblatt (215a). Paar in Stegmaier (214), S. 14. Windeler, Lange (215), S Kleinfeld in Stegmaier (214), S. 14.
121 3 Verfahrensfragen Literatur Ärzteblatt (215a): 5 Fragen an Jürgen Windeler: Es gibt Studien, die Fragen beantworten, die niemanden interessieren. Ärzteblatt online vom Ärzteblatt (215b): AMNOG: Onkologen fordern stärkere Einbeziehung der Fachgesellschaften. Ärzteblatt online vom AWMF Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.v. (215): Stellungnahme zum Verfahren der Frühen Nutzenbewertung von Arzneimitteln nach 35a SGBV und aufgrund des Arzneimittelmarktneuordnungsgesetzes (AMNOG) von 21 vom Bayerischer Pharmagipfel (215): Gemeinsame Erklärung des bayerischen Pharmagipfels vom Bayerisches Staatsministerium für Gesundheit und Pflege sowie bayerisches Staatsministerium für Wirtschaft und Medien, Energie und Technologie im Dialog mit Vfa. VBCI, BPI und progenerika. Behring A (215): Methodische Zwänge bei der Subgruppenbildung und - bewertung. Vortrag 3 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin. Bekkering GE, Kleijnen J (28): Verfahrensweisen und Methoden zur Nutzenbewertung von Arzneimitteln in Deutschland. Ein Auftragsgutachten. Deutsche Medizinische Wochenschrift; 133 (Suppl. 7): S225-S246. Bullinger M, Blome C, Sommer R, Lohrberg D, Augustin M (215): Gesundheitsbezogene Lebensqualität ein zentraler patientenrelevanter Endpunkt in der Nutzenbewertung medizinischer Maßnahmen. Bundesgesundheitsblatt; 58: Cassel D, Ulrich V (215): AMNOG das Bermuda-Dreieck der GKV-Arzneimittelversorgung: Warum kommen Innovationen gar nicht oder erst verspätet beim Patienten an? IMPLICONplus 1/215. DGHO Deutsche Gesellschaft für Hämatologie und Onkologie (o.a.): AM- NOG 214: Fragwürdige Vergleichstherapien bei der Nutzenbewertung neuer Arzneimittel für Brust- und Prostatakrebs. URL: (Stand: ). Dryden WA (215): Ergebnisse der Nutzenbewertung für den Verordnungsalltag der Vertragsärzte. Vortrag 5 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin. FDA Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER) (213): Guidance for Industry Chronic Hepatitis C Virus Infection: Developing Direct-Acting Antiviral Drugs for Treatment. Draft Guidance, Revision 1. Oktober 213. URL: loads/drugs/guidancecomplianceregulatoryinformation/guidances/u cm pdf.
122 12 Verfahrensfragen 3 Frick M (215): AMNOG-Subgruppen versus wirtschaftliche Verordnungsweise aus Sicht der Industrie. Vortrag 4 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin. Gonnermann A, Kottas M, Koch A (215): Biometrische Entscheidungsunterstützung in Zulassung und Nutzenbewertung am Beispiel der Implikationen von heterogenen Ergebnissen in Untergruppen der Studienpopulation. Bundesgesundheitsblatt; 58: Greiner W, Klose K (214): Lebensqualität und Utilities in der Gesundheitsökonomie. Zeitschrift für Evidenz, Fortbildung und Qualität im Gesundheitswesen; 18: Hecken J (215): Lebensqualität: Aktuelle Standards und Herausforderungen für die Zukunft Perspektive der Gesundheitspolitik. Vortrag auf dem Deutschen Kongress für Versorgungsforschung vom , Berlin. Herdmann M, Gudex C; Lloyd A, Janssen MF, Kind P, Parkin D, Bonsel G, Badia X (211): Development and preliminary testing of the new fivelevel version of EQ-5D (EQ-5D-5L). Quality of life research; 2: Hoppe A, Braun L, Nohlen M (215): OPG Spezial: Wie das AMNOG besser wird. Sonderausgabe, Mai 215. IQWiG Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (215): Allgemeine Methoden. Version 4.2 vom Kaiser T, Vervölgyl V, Wieseler B (215): Nutzenbewertung von Arzneimitteln. Bundesgesundheitsblatt; 58: Klakow-Franck R (214): Die Bedeutung von Lebensqualität für die Arbeit des Gemeinsamen Bundesausschusses. Z. Evid. Fortbild. Qual. Gesundh. Wesen; 18 (2-3): Köhler M, Haag S, Biester K, Brockhaus AC, McGauran N, Grouven U, Kölsch H, Seay U, Hörn H, Möritz G, Staek K, Wieseler B (215): Information on new drugs at market entry: retrospective analysis of health technology assessment reports versus regulatory reports, journal publications, and registry reports. BMJ; 35: h796. Krabbe P, Weijnen T (23): Guidelines for analyzing and reporting EQ-5D outcomes, in: Brooks R; Rabin R, de Charro F: The measurement and valuation of health status using EQ-5D: A european perspective. Kluwer Academic Publishers; Dordrecht. Johnson JA, Coons SJ (1998): Comparison of the EQ-5D and SF-12 in an adult US-sample. Quality of Life Research; 7: Leverkus F, Henning M, Knoerzer D, Kupas K, Nicolay C (215): Konfirmatorische Nutzenbewertung? HTA meets EMA Methodische Spannungsfelder aus Sicht der Industrie. Vortrag im Rahmen von IQWiG im Dialog; , Köln. Ludwig W-D (215): Preise für innovative Arzneimittel Kommt das System an seine Grenzen? Präsentation im Rahmen des AOK-Foum love vom , Potsdam. Massetti M, Aballea S, Videau Y, Remuzat C, Roiz J, Toumi M (215): A comparison of HAS & NICE guidelines for the economic evaluation of health technologies in the context of their respective national
123 3 Verfahrensfragen 13 health care systems and cultural environments. Journal of Market Access and Health policy; 3: Rasch A (215): Gesundheitsbezogene Lebensqualität in der frühen Nutzenbewertung von Arzneimitteln: eine Bestandsaufnahme. Vortrag im Rahmen der dggö-jahrestagung 215, Bielefeld. Rasch A, Dintsios CH-M (215): Subpopulationen und Subgruppen in der frühen Nutzenbewertung von Arzneimitteln: zwischen Best Practice und inflationärem Gebrauch. Vortrag im Rahmen 16. Jahrestagung des Deutschen Netzwerks Evidenzbasierte Medizin. Berlin, Rothwell PM (25): Subgroup analysis in randomised controlled trials: importance, indications, and interpretation. Lancet; 365: Ruof J, Dintsios CM, Schwartz FW (214): Questioning Patient Subgroups for Benefit Assessment: Challenging the German Gemeinsamer Bundesausschuss Approach. Value in Health; 17: Ruof J, Flückiger O, Andre N (215): Early Benefit Assessment in Oncology in Germany: How Can a Clinically Relevant Endpoint Not Be Relevant to Patients? Drugs in R&D; 15: Schiffner-Rohe J, Leverkus F (215): Fehlende Werte in klinischen Studien: eine neue Hürde für die Nutzenbewertung? Vortrag im Rahmen der GMDS-Jahrestagung 215, Krefeld. Schlenger R (215): Wenn Scheitern Methode hat. Epilepsie und AMNOG: Gefährdet die Nutzenbewertung die Patientenversorgung? Deutsche Apotheker Zeitung vom Simons CL, Rivero-Arias O, Yu LM, Simon J (215): Multiple imputation to deal with missing EQ-5D-3L data: Should we impute individual domains or the actual index? Quality of Life Research; 24: 85:815. Stegmaier P (214): Preisverhandlungen finden in einer Mischwelt statt. Monitor Versorgungsforschung Kongress-Special; 1/214: Sun X, Briel M, Busse JW, You JJ, Akl EA, Mejza F, Bala MM, Bassler D, Mertz D, Diaz-Granados N, Vandvik PO, Malaga G, Srinathan SK, Dahm P, Johnston BC, Alonso-Coello P, Hassouneh B, Walter SD, Heels-Ansdell D, Bhatnagar N, Altman DG, Guyatt GH (212): Credibility of claims of subgroup effects in randomized controlled trials: systematic review. BMJ 212; 344:e1553 Vach W, Klar R (215): Nutzenbewertung bei medizinischen Maßnahmen. Bundesgesundheitsblatt; 58:219. Wieseler B (215): Erweiterung des Methodenspektrums bei der Nutzenbewertung: Fortschritt oder Rückschritt? Vortrag im Rahmen der 16. Jahrestagung des Deutschen Netzwerks Evidenzbasierte Medizin e.v. vom , Berlin. Windeler J, Lange S (215a): Nutzenbewertung medizinischer Leistungen im deutschen Gesundheitswesen rechtlicher Rahmen, historische und internationale Perspektive. Bundesgesundheitsblatt; 58: Windeler J, Lange S (215b): Kommentar zum Beitrag: Nutzenbewertung aus Sicht der Versorgungsforschung und der Epidemiologie. Wegscheider, Drabik, Bleich, Schulz. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz (215): Bundesgesundheitsblatt; 58:
124 14 Verfahrensfragen 3 Wörmann B (215): Frühe Nutzenbewertung neuer Arzneimittel in Deutschland Gesundheitspolitische Schriftenreihe der DGHO, Band 6. Hrsg.: Freund M, Lüftner D, Wilhelm M; DGHO, Berlin. Zeuzem S (215): Festlegung von Subgruppen aus Sicht der wissenschaftlichen Medizin. Vortrag im Rahmen der Veranstaltung AWMF im Dialog vom
125 15 4 Ergebnisse der Erstattungsbetragsverhandlungen 4.1 Übersicht der Nutzenbewertungsrabatte Ablauf der Erstattungsbetragsverhandlungen Im Anschluss an die frühe Nutzenbewertung wird zwischen dem pharmazeutischen Unternehmer und dem GKV-Spitzenverband ein Erstattungsbetrag als Rabatt auf den ursprünglichen Listenpreis des pharmazeutischen Unternehmers verhandelt.. Die absolute Höhe des Rabattes ist insofern nicht als Erfolgskriterium für die Verhandlungen nach 13b SGB V geeignet, da der Rabatt umso höher ausfällt, je höher der pharmazeutische Unternehmer den Abgabepreis nach 78 Abs. 3 AMG (so genannter Listenpreis) beim erstmaligen Inverkehrbringen festlegt hat. In den meisten Fällen wird der Preisabschlag als Pflichtrabatt des pharmazeutischen Unternehmers ausgewiesen. Der Pflichtrabatt unterteilt sich dabei in den Zwangsrabatt gemäß 13a Abs. 1 SGB V sowie den Nutzenbewertungsrabatt gemäß 13b SGB V. Zudem kann der Herstellerabschlag gemäß 13a Abs. 1 SGB V durch den Erstattungsbetrag nach 13b SGB V abgelöst werden. 197 Entscheidet sich der pharmazeutische Unternehmer innerhalb von vier Wochen nach Veröffentlichung des G-BA-Beschlusses die Verhandlung mit dem GKV-Spitzenverband nicht durchzuführen, verpflichtet er sich, sein neues Arzneimittel in Deutschland aus dem Verkehr zu nehmen. Dieses Vorgehen wird als opt-out bezeichnet und verfolgt die Strategie, dass kein Erstattungsbetrag in Deutschland gelistet ist. Damit können andere Länder ihren Arzneimittelpreis nicht auf einen ermäßigten deutschen Erstattungsbetrag referenzieren. Entscheidet sich der Hersteller für eine Verhandlung, enthält eine anschließend veröffentlichte Vereinbarung Angaben zu Zweckmäßigkeit, Qualität und Wirtschaftlichkeit der Verordnung des neuen Arzneimittels. Mit dem 14. SGB V Änderungsgesetz wurde zum 1. Januar 215 der Verhandlerkreis auf Seiten der GKV erweitert. An den Erstattungsbetragsverhandlungen nimmt nun auch ein Vertreter einer gesetzlichen Krankenkasse teil, um versorgungsrelevante Inhalte stärker in den Verhandlungen zu berücksichtigen. Die Grundlage für die Verhandlung bilden der G-BA-Beschluss (Zusatznutzen), in dem auch die Höhe der Kosten der zvt (meist Generika) aufgeführt ist, die Jahrestherapiekosten vergleichbarer Arzneimittel und der tatsächliche durchschnittliche Abgabepreis im europäischen Abs. 3 der Rahmenvereinbarung nach 13b SGB V.
126 16 Ergebnisse der Erstattungsbetragsverhandlungen 4 Ausland. Dieser wird mittels der Kaufkraftparität bereinigt. In Ermangelung einer zentralen europäischen Preisdatenbank sowie international stark abweichender Rabatten in den Handelsketten ist die Transparenz und Nachvollziehbarkeit dieser Angaben für den GKV- SV jedoch eingeschränkt. 198 Teilweise werden neue Arzneimittel zum relevanten Zeitpunkt nur in wenigen anderen Ländern vermarktet, die tatsächlichen Abgabepreise können vertraulich sein, oder aus strategischen Entscheidungen werden die entsprechenden Angaben nicht zur Verfügung gestellt. Im Zuge dessen kann sich die Anzahl der zur Verfügung stehenden tatsächlichen Abgabepreise stark reduzieren. Die Verhandlungen sind vertraulich. Am Ende einer abgeschlossenen Verhandlung wird lediglich der verhandelte Erstattungsbetrag in dem Preisverzeichnis (Lauer-Taxe ) veröffentlicht. Der verhandelte Erstattungsbetrag gilt spätestens ab dem 13. Monat nach erstmaligem Inverkehrbringen für alle Arzneimittel, die den betreffenden Wirkstoff enthalten. Davon abweichende Vereinbarungen zu Gunsten der GKV sind demnach möglich. Das 14. SGB V Änderungsgesetzt präzisierte dies, indem die Phase der freien Preisbildung nur einmalig je Wirkstoff gewährt wird. Dies soll unterbinden, dass pharmazeutische Unternehmer durch einen verzögerten Markteintritt oder eine strategische Aufteilung der Anwendungsgebiete die Phase der freien Preisbildung erneut auslösen oder verlängern können. Der vereinbarte Erstattungsbetrag gilt auch für die private Krankenversicherung, Beihilfeträger und Selbstzahler. Bringt ein Reimporteur ein Arzneimittel erstmalig auf den deutschen Markt, gelten der Nutzenbeschluss und der verhandelte Erstattungsbetrag des Originalpräparates auch für das Reimport-Arzneimittel. Wenn sich Hersteller und GKV-Spitzenverband innerhalb von sechs Monaten nach der Veröffentlichung des Beschlusses nicht einigen können, beginnt ein Schiedsstellenverfahren. Die Schiedsstelle nach 13b SGB V wurde vom GKV-Spitzenverband und den maßgeblichen Spitzenorganisationen der pharmazeutischen Industrie gebildet und verhandelt ausschließlich die Sachverhalte, bei denen bislang keine Enigung besteht. Die Schiedsstelle beschließt innerhalb von drei Monaten. Der festgesetzte Erstattungsbetrag gilt rückwirkend ab dem 13. Monat nach dem Inverkehrbringen des neuen Arzneimittels. Die Schiedssprüche können von jedermann bei der Schiedsstelle eingesehen werden. Eine Veröffentlichung z. B. auf einer Homepage erfolgt nicht. Die Mindestvertragslaufzeit eines Vertrags nach 13b SGB V beträgt ein Jahr. Im Falle eines neuen Beschlusses einer weiteren Nutzenbewertung oder Kosten-Nutzenbewertung oder der Voraussetzung zur Bildung einer Festbetragsgruppe kann vor Ablauf der Frist gekündigt werden. Damit unterscheiden sich Verträge nach 13b 198 Zipperer in Hoppe et al. (215), S. 21.
127 4 Ergebnisse der Erstattungsbetragsverhandlungen 17 maßgeblich von denen nach 13a Abs. 8 SGB V. Die Rabattverträge nach 13a Abs. 8 haben eine Laufzeit von zwei Jahren und bringen so ein höheres Maß an Planungssicherheit für den pharmazeutischen Unternehmer. Ergebnisse der Erstattungsbetragsvereinbarungen Bis zum wurden 134 Nutzenbewertungsverfahren basierend auf 111 Arzneimitteln mit neuem Wirkstoff vom G-BA abgeschlossen. Nachfolgend aufgelistete Rabatte ergeben sich aus der zum in der Lauer Taxe gelisteten Differenz des Netto- Herstellerabgabepreises (ApU) und dem Netto-Rabattwert nach 13b SGB V. Der zum auf 7 % angehobene Herstellerrabatt nach 13a SGB V wird, falls eine Ablösung im Rahmen der Erstattungsbetragsverhandlungen vereinbart wurde, ebenso berücksichtigt. 199 Die Berechnungen fanden auf Basis der stärksten Dosierung der größten Packung für die Wirkstoffe statt, die sich zum in Deutschland noch im Vertrieb befanden und für die ein vereinbarter Erstattungsbetrag nach 13b SGB V vorlagen. Vom Markt genommene Wirkstoffe wurden aus den Analysen ausgeschlossen. Die von den Vertragsparteien verhandelten Nutzenbewertungsrabatte liegen auf Basis von 8 (Stand: ) vereinbarten Erstattungsbeträgen 2 bei durchschnittlich 19,3 % (Spanne: % bis 57,4 %; Median: 16,9 %). In der Begründung zum Gesetzentwurf für das AMNOG wurde ursprünglich eine Einsparquote von 16 % angenommen. 21 Dieses Ziel wird inzwischen übertroffen. Teilweise findet sich nach der Verhandlung mit dem GKV-SV auch kein Rabatt mehr nach 13a SGB V in der Preisliste. Hier wurde der Rabatt nach 13a bei der Verhandlung des Nutzenbewertungsrabattes durch den 13b-Rabatt abgelöst bzw. verrechnet. Für knapp der Hälfte aller bislang vereinbarten Erstattungsbeträge (49 %, n=39) liegt eine solche Vereinbarung vor. 22 Entsprechende Abschläge sind auf den in der Lauer Taxe angegebenen Nutzenbewertungsrabatt anzurechnen. Steigende durchschnittliche Rabatte Allerdings wird der veränderte Zwangsrabatt des Herstellers bis dato noch sehr uneinheitlich umgesetzt, weshalb es zu geringfügigen Verzerrungen in den Gesamtabschlagsberechnungen kommen kann. Eine detaillierte Übersicht der vereinbarten Erstattungsbeträge findet sich in Abschnit III dieses Reportes. Nicht berücksichtigt werden konnten folgende Wirkstoffe, für die zwar gem. Angaben des GKV-SV ein Erstattunsgebetrag vereinbart wurde, diese jedoch nicht der Lauer Taxe zu entnehmen waren: Insluin degludec, Sucroferric Oxyhydroxide, Teduglutid. BT-Drs. 17/2413, S. 39. Die Ablösung des Herstellerabschlages durch den verhandelten Erstattungsbetrag dürfte bis zur gesetzlichen Klarstellung auch hinsichltich der Weitergabe des reduzierten Betrages in der Handelskette für den pharmazeutischen Unternehmer von Relevanz gewesen sein.
128 18 Ergebnisse der Erstattungsbetragsverhandlungen 4 Nachfolgende Darstellungen und Berechnungen beziehen sich auf den Herstellerabgabepreis bzw. rabattierten Herstellerabgabepreis (entspricht dem Erstattungsbetrag ). Statt des Herstellerabgabepreises wird in einigen Darstellungen auch der Apothekenverkaufspreis verwendet. 23 Letzterer enthält neben dem Herstellerabgabepreis auch Handelsaufschläge, die Mehrwertsteuer von 19 % und den gesetzlichen Herstellerabschlag von 7 %. Dies führt zu unterschiedlichen Berechnungsergebnissen. Das durchschnittliche Rabattniveau variiert stark nach therapeutischen Anwendungsgebiet (vgl. Abb. 2). Zu berücksichtigen ist jedoch, dass aufgrund der bislang noch geringen Fallzahl die Rabattergebnisse nur bedingt zwischen allen bislang bewerteten therapeutischen Anwendungsgebieten vergleichbar sind. Nachfolgende Darstellung beinhaltet deshalb nur jene Anwendungsgebiete mit vier oder mehr vereinbarten Erstattungsbeträgen nach 13b SGB V. Abbildung 2: Durchschnittliche Nutzenbewertungsrabatte auf den Listenpreis nach Anwendungsgebiet (Stand: ) Krankheiten des Nervensystems (n=5) onkologische Erkrankungen (n=29) Stoffwechselkrankheiten (n=12) Herz-Kreislauf-Erkrankungen (n=4) Infektionskrankheiten (n=12) Krankheiten des Atmungssystems (n=4) % Auffällig ist der hohe durchschnittliche Nutzenbewertungsrabatt von neuen Wirkstoffen zur Behandlung von Krankheiten des Nervensystems. Diese Auswertung umfasst fünf neue Präparate zur Behandlung der Multiplen Sklerose (Dimethylfumarat, Extrakt aus Cannabis Sativa, Fampridin, Fingolimod und Teriflunomid). Zu erklären ist dies durch die Kombination aus im Vergleich zur zvt hohen Jahrestherapiekosten (durchschnittliche Differenz: 41 %) und schlechten Nutzenbewertungsergebnissen. Unter den übrigen Wirkstoffen zur Behandlung onkologischer Erkrankungen und Stoffwechselkrankheiten findet sich ebenso ein vergleichbares Rabattniveau wie unter den Wirkstoffen, welche für Herz-Kreislauf-Erkrankungen, Krankheiten des Atmungssystems und zur Behandlung von Infektionskrankheiten indiziert sind. Unter den Wirkstoffen zur Behandlung von Infektionskrankheiten subsummieren sich insgesamt sechs neue 23 Schwabe (214), S. 187f.
129 4 Ergebnisse der Erstattungsbetragsverhandlungen 19 Wirkstoffe zur Behandlung der Hepatitis-C. Diese weisen mit durchschnittlich 17 % vergleichbar niedrige Nutzenbewertungsrabatte auf. Bei der Betrachtung der bislang vereinbarten Nutzenbewertungsrabatte sind unabhängig vom Anwendungsgebiet verschiedene Verhandlungsparameter zu berücksichtigen: Neben der Ablösung des Herstellerzwangsrabattes nach 13a Abs. 1 SGB V können auch differenzierte Vertragsinhalte zur Ablösung oder Staffelung der Nutzenbewertungsrabatte vereinbart werden. Da die Inhalte dieser Vereinbarungen in der Regel geheim sind, ist eine vollständige Aufarbeitung entsprechender Vereinbarungen schwierig. In seltenen Fällen können entsprechende Informationen zum Beispiel über Pressemitteilungen ermittelt werden. Ticagrelor war der erste Wirkstoff aus der frühen Nutzenbewertung, für den im Jahr 212 ein Erstattungspreis vereinbart wurde. Astra- Zeneca gewährt den Kassen 24 Rabatt, was 19 % des Listenpreises von 124 entspricht. Weil der Herstellerrabatt durch den neuen Nachlass abgelöst wurde, sind aber eigentlich nur 3 % den damaligen Verhandlungen zuzurechnen. Durch den inzwischen geänderten Herstellerrabatt nach 13a Abs. 1 SGB V (Absenkung von 16 % auf 7 %) sind veränderte Nutzenbewertungsrabatte zu berücksichtigten. Nicht ausgeschlossen werden kann, dass entsprechende Gesetzesänderungen im Rahmen der Erstattungsbetragsverhandlungen als Verhandlungsmasse berücksichtigt und Anpassungen ggf. ausgeschlossen wurden. Dies kann in den vorliegenden Auswertungen jedoch nicht berücksichtigt werden. Insgesamt liegt der durchschnittliche Nutzenbewertungsrabatt für Wirkstoffe mit ablösender Vereinbarung (18,9 %; Spanne: 2,1 % bis 57,4 %) zwei Prozentpunkte unterhalb der Wirkstoffe ohne entsprechende Regelung (2,9 %; Spanne: % bis 5, %). Im Verfahren von Bromfenac einigten sich die Vertragsparteien auf ein gesondertes Modell: Hier löst der Erstattungspreis nur die Differenz zwischen regulärem und erhöhtem Herstellerrabatt ab 24 : Für Bromfenac sind also 1 % des Nutzenbewertungsrabattes in vergleichenden Analysen abzuziehen. Eine andere gesonderte Vereinbarung wurde für den zur Kontrolle des Serumphosphatspiegels bei chronischer Nierenerkrankung zugelassenen Wirkstoff Sucroferric Oxyhydroxid bekannt. Hersteller und GKV-Spitzenverband haben sich im Herbst 215 auf eine Vertragslaufzeit des 13b-Vertrages von drei Jahren geeinigt. Zusätzlich dazu ist eine Preisstaffelung vorgesehen, die in 216 und 217 eine sukzessive Erhöhung des Herstellerabschlages vorsieht. 25 Eine weitere gesonderte Vereinbarung wurde für eines der neuen Hepatitis-C-Präparate öffentlich: Der Hersteller der zuletzt zugelassenen Fixkombination Ledipasvir und Gesonderte Vereinbarungen möglich Apotheke adhoc (213). GKV-Spitzenverband (215).
130 11 Ergebnisse der Erstattungsbetragsverhandlungen 4 Sofosbuvir hat sich mit dem GKV-SV darauf geeinigt, dass der Nutzenbewertungsrabatt bereits ab dem zehnten Monat nach Marktzugang gilt. 26 Dies ist insofern von Interesse, als dass die Phase der freien Preisbildung insbesondere wegen der hochpreisigen und zugleich schnell in den Markt diffundierenden neuen Hepatitis-C-Therapien zuletzt wiederholt zur Diskussion stand (Kapitel 7.1). In diesem Zusammenhang sorgte auch der geringe Nutzenbewertungsrabatt für Sofosbuvir (11 %) für Diskussionen, nachdem die Markteinführung und Nutzenbewertung dieses Polymerase-Inhibitors zur Behandlung einer chronischen Hepatitis C mit kontroversen Debatten über eine angemessene Höher der vom Hersteller zunächst frei festgelegten Listenpreises begleitet wurde. Nachdem sich Hersteller und GKV-Spitzenverband in der vorgesehenen Frist nicht auf einen angemessenen Rabatt einigen konnten, wurde Ende Januar 215 zunächst die Schiedsstelle angerufen. Allerdings kam es nicht zu einem Schiedsspruch. Im Februar 215 konnte sich der GKV-SV doch mit dem Anbieter Gilead auf einen rückwirkend zum 23. Januar 215 gültigen Erstattungsbetrag für Sofosbuvir einigen. 27 Demnach sinkt der bisherige Herstellerabgabepreis von für 28 Tabletten auf Der ausgehandelte Nachlass liegt somit deutlich unter dem zum Teil berichteten Nachlass in Höhe von 27 %. 28 Der G-BA geht von 1. Patienten aus, bei denen eine chronische Hepatitis C diagnostiziert ist. Würden alle diese Patienten für wenigstens 12 Wochen mit einem Sofosbuvirhaltigen Therapieregime behandelt, errechnen sich allein für den Polymerasehemmer Kosten in Höhe von über 5 Milliarden. Bezogen auf die Arzneimittelausgaben der Krankenkassen in Höhe von 31,4 Mrd. im Jahr 214 müssten demnach mindestens 16 % der finanziellen Mittel für einen einzigen Wirkstoff verwendet werden, wobei die Umsätze für das Monopräparat nach Einführung der Kombination mit Ledipasvir stark zurückgegangen sind (Kapitel 6.3). Insofern ist der vereinbarte Erstattungsbetrag heute praktisch wirkungslos. Ob dies bei den Verhandlungen bereits berücksichtigt wurde kann jedoch nur vermutet werden. Andererseits ist die Steuerungswirkung einer nutzenbasierten Preisbildung bei wichtigen Innovationen auch gesundheitspolitischen Grenzen unterworfen. Eine Marktrücknahme von Sofosbuvir in Folge gescheiterter Preisverhandlungen hätte im Hinblick auf die belegte Wirksamkeit und den dramatischen Effekt von den beteiligten Parteien nur schwerlich kommuniziert werden können O.V. (215). Ärztebaltt (215a). Ärztebaltt (215a). Es kann angenommen werden, dass der rabattierte Herstellerabgabepreis in entsprechenden Berechnungen fälschlicherweise mit dem Apothekenverkaufspreis gleichgesetzt wurde. Der Apothekenverkaufspreis ist jedoch deutlich höher: Er enthält neben dem Herstellerabgabepreis Handelsaufschläge und die Mehrwertsteuer von 19 % und beträgt seit Markteinführung , also rund 7 für eine einzige Tablette. Vgl. Arznei-telegramm (215).
131 4 Ergebnisse der Erstattungsbetragsverhandlungen 111 Einige Krankenkassen hatten sich angesichts der hohen Kosten jedoch schon vor Abschluss der Erstattungsbetragsverhandlungen mit dem pharmazeutischen Unternehmer auf einen reduzierten Abgabepreis verständigt, welcher unter dem schlussendlich mit dem GKV-SV vereinbartem Preis lag. Aktuell gibt es zudem zwei Versorgungsverträge ( 73c SGB V) in der KV Hessen und der KV Baden- Württemberg mit der regionalen AOK sowie darüber hinaus weitere Strukturverträge ( 73a SGB V) in der KV Nordrhein, ebenfalls mit regionalen AOK-Verbänden. 29 Inhalt dieser Verträge ist die Vorgabe von Qualitätskriterien zur abgestimmten Versorgung von Hepatitis- C-Patienten. Im Gegenzug verzichten die beteiligten Krankenkassen auf regelhafte Regresse. Die Vertragsparteien in der ambulanten Versorgung (GKV-SV und KBV) tragen dem gesteigerten Ausgabenvolumen für neue Hepatits- C-Therapie ebenfalls Rechnung. Für das Jahr 215 wurde das Sonderausgabenvolumen für die ab dem neu zugelassenen Arzneimittel zur Behandlung der chronischen Hepatitis C aufgrund der Kostenentwicklung des ersten Halbjahres 215 vorläufig neu auf 1,4 Milliarden festgelegt. Das Sonderausgabenvolumen steigert das Richtgrößenvolumen nicht und geht nicht in die Kalkulation der fachgruppenspezifischen Richtgrößen ein. Die Verordnungskosten der ab dem neu zugelassenen Arzneimittel sind damit nicht Gegenstand der Wirtschaftlichkeitsprüfung nach 16 Abs. 2 Satz 1 Nr. 1 SGB V (Auffälligkeitsprüfung). 21 Dies trifft jedoch nur auf eine dem Bewertungsergebnis des G-BA entsprechende indikationsgerechte Verordnung zu. Verordnungen für Patienten, die nach dem Beschluss keinen Zusatznutzen haben, sind grundsätzlich regressbedroht. So gibt es inzwischen erste Regressanträge bezüglich Sofosbuvirverordnungen bei Patienten, deren Behandlung ihrer Hepatitis-C-Infektion des entsprechenden Genotyps nach der Nutzenbewertung keinen Mehrnutzen aufweist. 211 Zur wirtschaftlichen Behandlung einer Hepatitis-C-Infektion ist also die Genotypisierung der Patienten im Rahmen der Indikationsstellung unerlässlich. Die entsprechende Laborabrechnungsziffer lautet: Bestimmung des Hepatitis-C-Virusgenotyps vor antiviraler Therapie mit Interferon und/oder Nukleosidanaloga. Bei der Behandlung von Hepatitis C treffen ein hoher Preis und eine große Patientengruppe aufeinander. Das hat international Fragen nach der Angemessenheit der Preisforderung aufgeworfen, da der Bezug zu den Entwicklungs- und Herstellungskosten nicht mehr erkennbar ist. 212 Dass das Beispiel Sofosbuvir so große auch mediale Simon (215), S. 11. Rahmenvorgaben nach 84 Abs. 7 SGB V für das Jahr 216 vom LangHeinrich (215), S. 4. Ärzteblatt (215d). Eine Studie zu Mindestproduktionskosten neuer antiviraler Mittel zur Behandlung der Hepatits-C errechnete zudem hohe Differenzen zwischen Mindestherstellkosten und den derzeitig ausgebotenen Listenpreisen. Vgl. Hill et al. (214).
132 112 Ergebnisse der Erstattungsbetragsverhandlungen 4 Aufmerksamkeit erlangt hat, hat wohl verschiedene Gründe, über die nur spekuliert werden kann. Auffällig ist dies deshalb, weil eine solche Kostenentwicklung nicht nur bei neuen Hepatitis-C-Präparaten sondern schon länger auch bei neuen Onkologika zu beobachten ist. 213 Ergebnis der Diskussion um angemessene Erstattungspreise ist, dass die derzeitig gesetzliche geltende Phase der zwölfmonatigen freien Preisfestsetzung in die Kritik geraten ist. Kapitel 7.1 beleuchtet entsprechende Regulierungsvorschläge deshalb auf Basis aktueller Umsatzdaten der DAK-Gesundheit hinsichtlich ihres Budget Impacts. Ergebnisse nach Re-Evaluationen und Bewertungen neuer Anwendungsgebiete Für insgesamt 2 Wirkstoffe liegt bis zum die Beschlussfassung über eine erneute Nutzenbewertung oder eine Anwendungsgebietserweiterung vor. Entsprechende Verfahren stoßen jeweils erneute Verhandlungen über einen Erstattungsbetrag an und können zu Änderungen des Nutzenbewertungsrabattes führen. Vier dieser Wirkstoffe (Linagliptin, Peramanel, Retigabin, Vildagliptin) sind auch nach erneuten Nutzenbewertungsverfahren nicht in Deutschland verfügbar (Kapitel 4.2), weshalb für diese Wirkstoffe auch keine auswertbaren Erstattungsbeträge vorliegen. Im Verfahren von Emtricitabin, Rilpivirin, Tenofovirdisoproxil hat die Bewertung des neuen Anwendungsgebietes und die damit verbundene Ausweitung des für eine Behandlung in Frage kommenden Patientenpools dazu geführt, dass ein Rabatt in Höhe von 3,16 % auf den Listenpreis vereinbart wurde. Zuvor war der Listenpreis noch deckungsgleich mit dem Erstattungsbetrag. Eine Anpassung des Nutzenbewertungsrabattes basierend auf einem Beschluss über ein neues Anwendungsgebiet erfolgte ebenso für die Wirkstoffe Abirateronacetat (6 %) und Saxagliptin/Metformin (1 %). Dass ein Beschluss über das Ergebnis der frühen Nutzenbewertung darüber hinaus auch Preissenkungen auslösen kann, zeigt das Beispiel Apixaban. In Folge der Bewertung des neuen Anwendungsgebietes wurde der Listenpreis des Anticoagulanz Anfang 213 um ca. 5 % gesenkt. Auch für Ipilimumab wurde durch die Erweiterung des Anwendungsgebietes, für die der G-BA keinen Zusatznutzen identifizieren konnte, der Preis um gut 11 % gesenkt. Für das regulär initiierte Verfahren zur Anwendungsgebietserweiterung von Regorafenib legte der Hersteller im Herbst 214 kein Dossier beim G-BA vor. Stattdessen senkte er den Preis um fast 66 %. Anders der Hersteller von Ruxolitinib: In der erneuten Nutzenbewertung, welche erforderlich wurde, da das Orphan Drug als erstes die 5-Millionen Umsatzschwelle überschritten hatte, stufte der G-BA das Ausmaß des 213 Ludwig, Schildmann (215), S. 713.
133 4 Ergebnisse der Erstattungsbetragsverhandlungen 113 Zusatznutzens von gering auf beträchtlich hoch. Die Folge: Der Hersteller erhöhte im Mai 215 den Abgabepreis um gut 17 %. 214 Rabatthöhe in Abhängigkeit von Ergebnissen und Inhalten der Nutzenbewertung Die Reichweite eines G-BA-Beschlusses über die reine Feststellung des ggf. nach Teilanwendungsgebieten zu differenzierenden Zusatznutzens hinaus z. B. auf die Erstattungsbetragsverhandlungen sowie die Verordnungsentwicklungen steht immer wieder im Mittelpunkt der Diskussionen. Ende 214 beklagte beispielsweise der unparteiische Vorsitzende des G-BA, dass die bislang vereinbarten Abschläge völlig losgelöst vom Bewertungsergebnis des G-BA seien. 215 Betrachtet man zunächst deskriptiv die mittleren Abschläge der Wirkstoffe, welche sich zum noch im Vertrieb befanden und für die bis zu diesem Datum ein Erstattungsbetrag vereinbart wurde (n=8), ist eine grundsätzliche Tendenz erkennbar: Ein Viertel der bislang verhandelten Erstattungsbeträge liegen für Wirkstoffe mit beträchtlichem Zusatznutzen (zumindest in einer Subpopulation) vor. Der durchschnittliche Herstellerrabatt beträgt für diese Wirkstoffe 15,9 %. Erwartungsgemäß liegt die durchschnittliche Rabatthöhe für die 25 Wirkstoffe mit geringem Zusatznutzen mit 2,2 % über diesem Wert. Bei zehn Wirkstoffen mit nicht quantifizierbarem Zusatznutzen ist hingegen zumindest näherungsweise zu erkennen, dass die Verhandlungspartner der Unsicherheit über die tatsächliche Höhe des Zusatznutzens Rechnung tragen. Der Zusatznutzen liegt grundsätzlich zwischen den Größenordnungen gering und erheblich. Mit einem mittleren Nutzenbewertungsrabatt von 14,5 % liegen Preisreduzierungen auf den Listenpreis gut 5 % unterhalb des Durchschnittes. Dabei muss jedoch auch berücksichtigt werden, dass unter den Wirkstoffen mit nicht quantifizierbarem Zusatznutzen überwiegend Orphan Drugs und zwei der neueren Hepatitis-C-Therapieverfahren (Boceprevir, Telaprevir) befinden, Die höchsten durchschnittlichen Nutzenbewertungsrabatte wurden für die 24 Wirkstoffe ohne Zusatznutzen verhandelt. Mit durchschnittlich 23,9 % liegen diese erwartungsgemäß 4,6 Prozentpunkte über den mittleren Preisabschlägen aller Wirkstoffe (vgl. Tab. 15) Vgl. Kapitel 2.2. Exemplarisch: Ärzte Zeitung (214).
134 114 Ergebnisse der Erstattungsbetragsverhandlungen 4 Tabelle 15: Nutzenbewertungsrabatte nach Zusatznutzen gem. G-BA- Beschluss (Stand: ) Zusatznutzen Anzahl Ø-Rabatt Median Spanne Erheblich ,6 % / Beträchtlich 2 15,9 % 14, % 5,9 % 35,5 % Gering 25 2,2 % 18,8 % 2, % 47,4 % Nicht quantifizierbar 1 14,5 % 13,9 % % 28,3 % Kein Zusatznutzen 24 23,9 % 24,5 % % 57,4 % Hohe Varianz in den Nutzenebwertungsrabatten Das heißt, dass auch für einen Großteil der Wirkstoffe ohne Zusatznutzen aufgrund fehlender Festbetragsgruppen über ein Erstattungsbetrag verhandelt werden musste. Dabei wurde insbesondere zu Beginn des Verfahrens beklagt, dass die Erstattungsbeträge für entsprechende Arzneimittel zum Teil deutlich über denen vergleichbarer Therapiealternativen liegen. 216 Andererseits ist auch bei neuen Medikamenten ohne belegten Zusatznutzen ein Verhandlungsergebnis möglich, welches für die GKV im Vergleich zu Vergleichstherapien Kosten spart. Der Erstattungsbetrag für die Kombination aus Umeclidinium/Vilanterol, zugelassen für die bronchialerweiternde Erhaltungstherapie zur Symptomlinderung bei erwachsenen Patienten mit COPD, stellt die derzeit günstigste Alternative für COPD-Patienten dar, die eine fixe LAMA/LABA-Kombination benötigen. 217 Der G-BA hatte zuvor in der Wirkstoffkombination keinen Zusatznutzen im Vergleich zur zweckmäßigen Vergleichstherapie, einem langwirksamen Beta-2-Sympathomimetikum (LABA) oder einem langwirksamen Muskarin-Antagonisten (LAMA) oder der Kombination beider Klassen, gesehen. Für Cobicistat (kein Zusatznutzen) wird nach Abschluss der Erstattungsbetragsverhandlungen heute der Listenpreis der pharmazeutischen Unternehmers auch als Erstattungsbetrag gelistet (Rabatt = %), was darauf zurückzuführen ist, dass die Jahrestherapiekosten bereits bei Marktzugang wenige Cent unterhalb der Kosten der zvt lagen. Der zweite Wirkstoff, für den in der Lauer Taxe kein Nutzenbewertungsrabatt nach Abschluss der Erstattungsbetragsverhandlungen gelistet ist, ist Cholsäure, welche als Orphan Drug zur Behandlung angeborener Störungen der primären Gallensäuresynthese indiziert ist. Allerdings hat der Hersteller im Monat nach den Erstattungsbetragsverhandlungen den Preis um 15 % gesenkt. Innerhalb der Zusatznutzenkategorien selbst weisen die bislang vereinbarten prozentualen Rabatte auf den Netto-ApU Rabatte jedoch eine deutliche Varianz auf (vgl. Abb. 21). Eine Korrelation zum Zusatznutzenausmaß kann dabei auch nach 8 abgeschlossenen (hier Arzneitelegramm (213). Apotheke adhoc (215).
135 4 Ergebnisse der Erstattungsbetragsverhandlungen 115 berücksichtigten) Erstattungsbetragsverhandlungen (Stand: ) nicht beobachtet werden. Abbildung 21: Verteilung der verhandelten Erstattungsbeträge nach Zusatznutzenkategorien (Stand: ) Kein Zusatznutzen N. q. Gering Beträchtlich % Dies ist jedoch nicht weiter überraschend, da die dargestellten Rabatte Verhandlungsergebnisse sind. Wäre aus dem Zusatznutzen selbst schon ein simpler multiplikativer Zusammenhang zum Nutzenbewertungsrabatt zu ermitteln, bräuchte es diesen Verfahrensschritt nicht. Eine algorithmische Festlegung würde in diesem Fall 218 Dunkel markiert sind jene Rabatte, die über dem zusatznutzenspezifischen Durchschnitt liegen.
136 116 Ergebnisse der Erstattungsbetragsverhandlungen 4 Weiterer Forschungsbedarf genügen. Der Gesetzgeber hat sich jedoch bei Einführung des AM- NOG bewusst für eine zentrale Verhandlungslösung entschieden. So können die Ergebnisse der Verhandlungen auch durch andere, harte (Ausgangspreis des pharmazeutischen Unternehmers, Preis der zweckmäßigen Vergleichstherapie, Aussagesicherheit, Gewichtung der Subgruppen) und weiche Faktoren (Erfahrung, Verhandlungsgeschick) beeinflusst werden. Darüber hinaus führt bereits jetzt (und zukünftig wohl in noch stärkerem Ausmaß) die Heranziehung bereits nutzenbewerteter Wirkstoffe als zvt zu Verzerrungen in entsprechenden Darstellungen. So wird Dabrafenib heute auf dem Niveau von Vemurafenib erstattet, obwohl lediglich Vemurafenib einen Zusatznutzen zugesprochen bekam. Der Grund: Vemurafenib diente als Komparator für Dabrafenib, wurde selbst jedoch gegen das deutlich ältere Dacabarzin verglichen. Insofern stellt sich die Frage, ob es andere, sinnvolle Bezugsgrößen für die verhandelte Rabatthöhe gibt. Grundsätzlich sind viele verschiedene Betrachtungsperspektiven denkbar, viele mit geringfügiger bis keiner Aussagekraft. 219 Neben dem prozentualen Abschlag könnte dieser auch absolut oder als letztlich erstattungsfähiger Fixbetrag in entsprechende Darstellungen einfließen. Auch die Abweichungen in den Jahrestherapiekosten zwischen neuen Wirkstoff und zvt sowie die Größe der GKV-Zielpopulationen können Vergleichsansätze sein. Es ist anzunehmen, dass sich im Zeitverlauf mit steigender Anzahl abgeschlossener Verfahren weitere Anhaltspunkte für Zusammenhänge ergeben. Festgesetzte Erstattungsbeträge Unter den bislang vorliegenden Erstattungsbeträgen sind zwei, welche nicht innerhalb der Verhandlung zwischen Hersteller und GKV- SV, sondern erst durch Festsetzung durch die Schiedsstelle erzielt werden konnten. Angesichts der 18 Verfahren, die bis zum zumindest bei der Schiedsstelle vorstellig wurden, ist dies eine bemerkenswert niedrige Quote. Von 18 Verfahren gab es 14 Schiedssprüche zu Produkten; in vier Fällen einigten sich die Parteien vor Ende der Verhandlungen (Dapagliflozin, Extrakt aus Cannabis Sativa, Siltuximab, Vemurafenib). Von den 14 geschiedsten Produkten ist heute nur noch die HIV- Fixkombination Elvitegravir/Cobicistat/Emtricitabin/Tenofovirdisoproxil zum Schiedsstellen-Preis auf dem Markt. Auch das Basalinsulin Insulin Degludec befindet sich noch im Markt, wird jedoch nach Ankündigung des Herstellers zeitnah vom Markt genommen. Für Pomalidomid konnten sich Hersteller und der GKV-Spitzenverband nur auf einen Erstattungsbetrag für zwei der vier angebotenen Wirkstoffstärken einigen. Für die 3 mg und 4 mg Packung liegt eine Einigung vor. Der Erstattungsbetrag für die 1 mg und 2 mg Packung 219 Ärzteblatt (215c).
137 4 Ergebnisse der Erstattungsbetragsverhandlungen 117 musste jedoch von der Schiedsstelle festgelegt werden. Ohne Erfolg, denn heute sind nur noch die höheren Wirkstoffstärken in Deutschland verfügbar. Zehn weitere Produkte haben den deutschen Markt nach einen Schiedsspruch wieder verlassen. Das Ergebnis des Schiedsverfahrens von Empagliflozin war zum Zeitpunkt des Redaktionsschlusses noch offen. Ausführliche Informationen zu den bislang verhandelten Schiedsverfahren finden sich im Schwerpunktkapitel Kapitel 5. Praxisbesonderheiten Für Arzneimitteln mit belegtem Zusatznutzen war mit Einführung des AMNOG vorgesehen, im Rahmen der Erstattungsbetragsverhandlungen bundeseinheitliche Anerkennungen als Praxisbesonderheit zu vereinbaren. Von dieser Kann-Regelung wurde bis dato nur in sieben Verfahren Gebrauch gemacht: Abirateronacetat, Enzalutamid, Pirfenidon, Propranolol, Ruxolitinib, Siltuxima und Ticagrelor. Im Verfahren von Siltuximab erfolgte die Festlegung durch die Schiedsstelle. Vier davon wurden zu Beginn des Verfahrens vereinbart, drei Wirkstoffe (Enzalutamid, Propanolol, Siltuximab) sind Ende 214 bzw. 215 als Praxisbesodnerheit ausgewiesen worden. Im Allgemeinen wird angenommen, dass die Anerkennung als Praxisbesonderheit die Diffusion eines neuen Arzneimittels in den Markt erleichtert, womit die Zuerkennung dieses Status offenbar schnell ein Teil der Verhandlungsmasse geworden ist. Während der pharmazeutische Unternehmer im Sinne einer raschen Marktentwicklung seines Präparates ein großes Interesse an einer entsprechenden Ausweisung haben dürfte, könnte der GKV-SV im Gegenzug weitere Preisnachlässe erwarten. Dabei sollen Praxisbesonderheiten bei einem Arzneimittel mit Mischgruppen Bezug auf diese verschiedenen Patientengruppen nehmen, um für die GKV zusätzliche Steuerungswirkung zu entfalten. 22 Zumindest für Abirateronacetat, Pirefenidon und Ticagrelor ist bekannt, dass dies auch so umgesetzt wurde, die vereinbarten Praxisbesonderheiten also nur für jene Anwendungsgebiete mit belegtem Zusatznutzen gelten. 221 Überraschenderweise formuliert der GKV-SV für Arzneimittel mit Zusatznutzen eine Schwellenwertarithmetik, ab wann ein Zusatznutzen in der Versorgung prioritär zum Einsatz kommen sollte. Demnach sei aus Sicht des GKV-SV ein Hinweis auf einen beträchtlichen Zusatznutzen ein hinreichendes Kriterium für die Vereinbarung einer Praxisbesonderheit. 222 Auch mit Verweis auf die eigentlich notwendige kontinuierliche Re-Evaluation neuer Arzneimittel im Versorgungsalltag erschließt sich eine solche Ausgrenzung nicht. Praxisbesonderheiten als Teil der Verhandlungsmasse Haas, Tebinka-Olbrich (215), S. 18. Laschet (214). Haas, Tebinka-Olbrich (215), S. 19.
138 118 Ergebnisse der Erstattungsbetragsverhandlungen 4 Zum Beispiel weist Afatinib, ein neuer Wirkstoff zur Behandlung des nicht-kleinzelligen Bronchialkarzinoms bei verschiedenen Mutationsvoraussetzungen der Krebszellen, fünf verschiedene Patientengruppen mit vier verschiedenen Zusatznutzenniveaus auf. Die Möglichkeit eines geringeren Nutzens in einem Teilanwendungsgebiet verdeutlich die Notwendigkeit, Praxisbesonderheiten patientengruppenspezifisch zu vereinbaren, da eine Vereinbarung über eine bevorzugte Abgabe für entsprechende Patienten entgegen jeglicher Nutzenbewertungs-Logik wäre. Probleme bereitet derzeit die mangelnde Monitorierbarkeit der Praxisbesonderheiten bei verschiedenen Patientengruppen und teilweise fehlendem Zusatznutzen. Auch für einige Hersteller dürften Praxisbesonderheiten nur unter bestimmten Konstellationen von Interesse sein. Komplizierte Regelungen in der Umsetzung von Praxisbesonderheiten, zum Beispiel die Differenzierung nach bundesweit gültigen Praxisbesonderheiten und solche, die zusätzlich regional vereinbart werden, machen dieses Instrument wenig praxistauglich. Problematisch dürfte auch die Kommunikation entsprechender Ergebnisse an den Vertragsarzt sein, da heutige Praxisverwaltungssysteme den Status Praxisbesonderheit aufgrund fehlender Digitalisierung nicht abbilden. 223 Das, wie vielfach gefordert, zukünftig in größerem Ausmaße Praxisbesonderheiten vereinbart werden 224, ist deshalb derzeit nicht absehbar. Die von Cassel und Ulrich in einem Gutachten für die pharmazeutische Industrie wiederholt formulierte Forderung, dass für alle AMNOG-Produkte eine Verschreibung als Praxisbesonderheit gelten sollte, wird im letzten Arzneiverordnungs-Report mit Verweis auf besonders breite Indikationen wie Diabetes oder Herzinsuffizienz abgelehnt. 225 Alternativ ließe sich diskutieren, die Bildung von Preisen für Subgruppen auf der Ebene der einzelnen Kassen, also nicht beim GKV- Spitzenverband, anzusiedeln. Die einzelnen Kassen könnten, insbesondere in den Fällen, die zwischen Herstellern und GKV-Spitzenverband strittig sind, individuelle Kompromisse für konkrete Versorgungssituationen mit dem Hersteller treffen. Auf Ebene der Einzelkassen wäre zudem das Datenmonitoring der Auswirkungen von Praxisbesonderheiten handhabbar. 226 Festbeträge Drei der bislang nutzenbewerteten neuen Arzneimittel sind in eine bestehende Festbetragsgruppe aufgenommen worden und befin Osterloh (215). BT-Drs. 598/13, S. 8; Fricke (215). Schaufler, Telschow (215), S Staeck (215), S. 48.
139 4 Ergebnisse der Erstattungsbetragsverhandlungen 119 den sich Ende 215 noch im Handel (Azilsartan Medoxomil, Fluticasonfuroat/Vilanterol-Trifenatat, Olodaterol). 227 Jeder dieser Festbetragseingruppierungen ging nur ein verkürztes Verfahren voraus, da herstellerseitig auf eine Dossiereinreichung verzichtet wurde. Umstritten ist, inwiefern das Festbetragssystem auch auf Wirkstoffe mit im Rahmen der Nutzenbewertung belegtem Zusatznutzen ausgedehnt werden kann bzw. sollte. In dieser Frage gibt es erwartungsgemäß Dissens zwischen den Beteiligten. Seit dem Erstattungsbetrag durch das 14. SGB V-Änderungsgesetz im Jahr 214 Listenpreischarakter zugewiesen worden ist, hat der GKV-SV angekündigt, das Erstattungsbetragssystem und das Festbetragssystem stärker verknüpfen zu wollen. 228 Die grundsätzliche Verbindung der Festbetragssystematik auch für Arzneimittel mit neuen Wirkstoffen leitet sich aus Sicht des GKV-SV daraus ab, dass für Arzneimittel, die pharmakologisch-therapeutisch vergleichbar mit Festbetragsarzneimitteln sind, der medizinische Zusatznutzen als therapeutische Verbesserung entsprechend der Festbetragsregelung nachzuweisen ist ( 35a Abs. 1 Satz 4 SGB V). Bei nicht nachgewiesener therapeutischer Verbesserung erfolgt, wenn möglich, eine unmittelbare Einordnung in eine bestehende Festbetragsgruppe ( 35a Abs. 4 SGB V). Zudem können vereinbarte Erstattungsbeträge bei späterem Vorliegen der Voraussetzungen zur Bildung einer Festbetragsgruppe außerordentlich gekündigt werden ( 13b Abs. 7 Satz 3 SGB V). Bei Festbetragsgruppenneubildung unter Aufnahme von Wirkstoffen mit Zusatznutzen wird der G-BA das Verhältnis von therapeutischer Verbesserung im Festbetragssystem und das Ausmaß sowie die Wahrscheinlichkeit eines konkreten Zusatznutzens im Einzelfall zu klären haben. Ein Anhaltspunkt auf geringen Zusatznutzen stellt nach Auffassung des GKV-SV indes keine therapeutische Verbesserung im Sinne des 35 SGB V dar. 229 Der Beleg eines mindestens beträchtlichen Zusatznutzens sei deshalb bei konkreter Festbetragsgruppenbildung zu prüfen. Dem entgegen gehalten wird, dass eine Zusammenführung neuer Arzneimittel mit belegtem Zusatznutzen in eine Festbetragsgruppe einer Doppelregulierung durch die Parallelität von Festbeträgen und zuvor verhandelten Erstattungsbeträgen gleich käme. 23 Dies ignoriert, dass beide Systeme von sich widersprechenden Grundannahmen ausgehen. Während das Festbetragssystem auf der Annahme austauschbarer Arzneimittel basiert, prüft die Nutzenbewertung das Ausweitung des Festbetragssystems? Pitavastatin wurde ebenfalls einer Festbetragsgruppe zugeordnet, im Februar 213 jedoch durch den Hersteller vom Markt genommen. Bode et al. (214). Haas (214). Frick, Bungenstock (215), S. 124.
140 12 Ergebnisse der Erstattungsbetragsverhandlungen 4 Vorliegen eines Zusatznutzens. 231 Eine nachgewiesene Überlegenheit im Sinne eines Zusatznutzens schließe jedoch eine vollständige Substituierbarkeit durch vergleichbare Wirkstoffe aus. Der GKV-SV weist selbst auf die eher langfristige Perspektive dieser Diskussion hin: Durch 35 Abs. 1 SGB V dürfen für Arzneimittel mit patentgeschützten Wirkstoffen, deren Wirkungsweise neuartig ist, keine Festbeträge festgesetzt werden. Eine Festbetragsgruppenbildung kann deshalb erst nach Patentablauf des ersten Wirkstoffes erfolgen. Die Ausnahme von patentgeschützten Arzneimitteln, die eine therapeutische Verbesserung darstellen, in 35 Abs. 1a SGB V lässt insofern eine rasche Ausweitung der Festbetragsregelungen auf AMNOG-Produkte nicht erwarten Frick (215), S. 36. Bode et al. (214), S. 13.
141 4 Ergebnisse der Erstattungsbetragsverhandlungen Übersicht der Marktrücknahmen Verhandlungsquote Neben den zwischen Hersteller und GKV-Spitzenverband verhandelten Erstattungsbeträgen ist die Anzahl der nach Abschluss der Nutzenbewertung wieder vom Markt genommenen Wirkstoffe ein häufig herangezogener Bewertungsfaktor der AMNOG-Funktionalität. Auch nach 134 abgeschlossenen Verfahren (Stand: ) zeigt sich, dass negative Bewertungsergebnisse oder gescheiterte Preisverhandlungen zu Marktrücknahmen führen können. Die verfahrensbereinigte Verhandlungsquote 233 liegt nach insgesamt 14 bewerteten neuen Wirkstoffen bei 73 %. Neben bislang zwei von der Schiedsstelle festgesetzten und einem zum Teil vereinbarten Erstattungsbetrag sowie drei gültigen Festbeträgen sind damit 2 Wirkstoffe nicht mehr in Deutschland verfügbar (vgl. Abb. 22). Der relative Anteil der Marktrücknahmen am gesamten Bewertungsvolumen ist über die Verfahrensdauer konstant. Abbildung 22: Verhandlungsquote abgeschlossener Erstattungsbetragsverhandlungen (n= 14; Stand: ) Nach wie vor hohe Marktrücknahmequote Vereinbart Z.T. vereinbart Festgesetzt Festbetrag Marktrücknahme Opt-Out Außer Vertrieb Zurückgezogen Übersicht bisheriger Marktrücknahmen Die bisherigen Marktrücknahmen sind hinsichtlich der Art und des Zeitpunktes des Marktaustrittes zu unterscheiden. Abgesehen vom Klageweg, welcher nach Abschluss eines Schiedsverfahrens zulässig ist, stehen dem Hersteller grundsätzliche zwei verschiedene Optionen zum Marktaustritt zur Verfügung: Der pharmazeutische Unternehmer kann dem GKV-SV innerhalb von vier Wochen nach G-BA-Beschluss anzeigen, dass er mit Bezug auf 4 Abs. 7 der 233 Gezählt werden demnach nur die bislang nutzenbewerteten Wirkstoffe. Verfahren zu erneuten Nutzenbewertungen, Anwendungsgebieten oder jene ohne bis zum vereinbartem Erstattungsbertrag werden nicht berücksichtigt.
142 122 Ergebnisse der Erstattungsbetragsverhandlungen 4 Rahmenvereinbarung sein Präparat zurückzieht (sog. Opt-out ). Daraufhin finden keine Preisverhandlungen mit dem GKV-SV mehr statt, das Medikament verliert seine Pharmazentralnummer, wird nach drei Monaten automatisch als zurückgezogen gelöscht und ist in Deutschland dauerhaft nicht mehr verfügbar. 234 Es kann jedoch auf Rezept für Auslandsapotheken importiert und auf Antrag des Patienten, Arztes oder Apothekers von den Krankenkassen erstattet werden. Das Präparat kann zudem zu einem späteren Zeitpunkt erneut in Verkehr gebracht werden. Hierzu bedarf es dann einer neuen PZN. Alternativ kann der pharmazeutische Unternehmer insbesondere nach Scheitern der Preisverhandlungen bzw. nach erfolgtem Schiedsspruch das Arzneimittel außer Vertrieb setzen. Nimmt der Hersteller das Medikament außer Vertrieb, wird es ebenfalls dauerhaft nicht mehr in Deutschland angeboten und kann ohne neue PZN nicht reaktiviert werden. 235 Für den pharmazeutischen Unternehmer besteht der Unterschied beider Optionen darin, dass beim Marktrückzug nach der Nutzenbewertung ( Opt-Out ) der bis dahin herstellerseitig festgesetzte und von den Kostenträgern erstattete Listenpreis (Abgabepreis des pharmazeutischen Unternehmers) unangetastet bleibt und im Hinblick auf internationale Preisreferenzierungen weiter als deutscher Referenzpreis gilt. Im Fall einer Außer-Vertriebnahme wird der verhandelte Erstattungsbetrag als Differenz von Listenpreis und Nutzenbewertungsrabatt zwar nach sechs Monaten in der Lauer-Taxe gelöscht, ist aber öffentlich bekannt und damit referenzierbar. 236 Neunmal wurde bislang von dieser Opt-Out-Lösung Gebrauch gemacht, also das neue Präparat unmittelbar nach Abschluss der Nutzenbewertung vom Markt genommen (vgl. Tab. 16). In zehn weiteren Fällen erfolgte eine Rücknahme als Reaktion auf das sich anschließende Preisbildungsverfahren. Tabelle 16: Marktrücknahmen (Stand: ) Wirkstoff Hersteller Datum Status Aliskiren/Amlodipin Bromfenac Canagliflozin Canagliflozin/Metformin Novartis Pharma GmbH Bausch & Lomb/Dr. Mann Pharma Janssen-Cilag GmbH Janssen-Cilag GmbH Opt-Out AV Opt-Out Opt-Out IFA (215). IFA (215). Cassel, Ulrich (215), S. 36.
143 4 Ergebnisse der Erstattungsbetragsverhandlungen 123 Wirkstoff Hersteller Datum Status Colestilan (BindDie Ren ) Lebende Larven von Lucilia sericata (Bio- Bag ) Linaclotid (Constella ) Linagliptin Lixisenatid Lomitapid Mitsubishi Pharma Deutschland GmbH AV BioMonde GmbH AV 237 Almirall Hermal GmbH Boehringer Ingelheim International GmbH Sanofi-Aventis Deutschland GmbH Aegorion Pharmaceuticals GmbH AV Opt-Out AV Opt-Out Lurasidon Takeda GmbH Opt-Out Microbielle Collagenase Mirabegron Pfizer Pharma GmbH Astellas Pharma GmbH Opt-Out AV Perampanel Eisai GmbH AV Pitavastatin Retigabin Sipuleucel-T Merckle Recordati GmbH GlaxoSmithKline GmbH & Co. KG Dendreon UK Limited Opt-Out Opt-Out zurückgezogen Tafluprost/Timolol Santen GmbH AV Vildagliptin Vildagliptin, Metformin Teilweise Novartis Pharma GmbH Novartis Pharma GmbH AV AV Pomalidomid Celgene GmbH - AV Angekündigt Insulin degludec Novo Nordisk Pharma GmbH AV außer Vertrieb; n.v. nicht verfügbar Außer Vertrieb für den ambulanten Sektor. Für den stationären Gebrauch ist weiterhin eine Klinikpackung verfügbar.
144 124 Ergebnisse der Erstattungsbetragsverhandlungen 4 Über die Gründe der bisherigen Marktrücknahmen kann in der Regel nur spekuliert werden. Problematisch dürfte für den pharmazeutischen Unternehmer in Abhängigkeit der Ergebnisse der Nutzenbewertung jedoch ein zu geringes Erstattungsbetragsniveau, die auf öffentlich zugängliche Listenpreise erfolgende internationale Preisreferenzierung sowie die ggf. zunehmende Exportquote vermeintlich günstigerer Präparate aus Deutschland in andere Hochpreisländer sein. In sechs Fällen legte der Hersteller zudem kein Nutzendossier beim G-BA vor (Bromfenac, lebende Larven von Lucilia sericata, Lomitapid, Pitavastatin). Für Linagliptin und Retigabin wurde zunächst noch eine reguläre Nutzenbewertung durchgeführt, an deren Ende der G-BA jedoch keinen Zusatznutzen feststellte. Zur Bewertung eines neuen Anwendungsgebietes bzw. einer erneuten Nutzenbewertung nach 35a Abs. 1 SGB V und 5. Kapitel 13 Abs. 1 Satz 2 VerfO G-BA reichte der Hersteller in diesen Fällen dann kein weiteres Nutzendossier ein. Lediglich in einem Verfahren (Sipuleucel-T) wurde zuvor ein im Ausmaß nicht quantifizierbarer Zusatznutzen festgestellt. Sipuleucel-T ist die erste, in Deutschland zugelassene, zelluläre Vakzine in der Onkologie und zur Behandlung von Männern mit metastasierendem Prostatakrebs indiziert, die keine oder nur wenig Beschwerden haben und noch keine Chemotherapie benötigen. Es ist der bislang erste Wirkstoff aus der Onkologie, welcher nach Abschluss der frühen Nutzenbewertung nicht mehr verfügbar ist. Allerdings nicht nur in Deutschland. Aus Wirtschaftlichkeitsgründen wurde auf Antrag des Herstellers die Zulassung durch die EMA europaweit zurückgezogen. Auffällig ist jedoch eine Häufung von Marktaustritten neuer Therapieverfahren zur Behandlung von Stoffwechselkrankheiten (acht Marktrücknahmen), insbesondere zur Behandlung des Diabetes Mellitus Typ 2 (sechs Marktrücknahmen; vgl. Abb. 23). Doch auch die Marktrücknahmen neuer Antiepileptika haben in vielerlei Hinsicht zu Kritik am Verfahren der frühen Nutzenbewertung geführt.
145 4 Ergebnisse der Erstattungsbetragsverhandlungen 125 Abbildung 23: Marktrücknahmen nach therapeutischem Anwendungsgebiet (n=2; Stand: ) Augenerkrankungen Herz-Kreislauf-Erkrankungen Krankheit des Nervensystems Krankheiten des Muskel-Skelett-Systems Krankheiten des Nervensystems Krankheiten des Urogenitalsystems Krankheiten des Verdauungssystems onkologische Erkrankungen Psychsiche Erkrankungen Sonstiges Stoffwechselkrankheiten Marktrücknahmen neuer Antidiabetika Knapp ein Drittel der seit Einführung der frühen Nutzenebewertung vom Markt genommenen Medikamente waren Antidiabetika. Damit sind 4 % der bislang nutzenbewerteten Antidiabetika nicht mehr in Deutschland verfügbar. Dreimal wurde zudem die Schiedsstelle angerufen (Dapagliflozin, Empagliflozin, Insulin degludec). Dapagliflozin wurde daraufhin Ende 213 ebenfalls außer Vertrieb gesetzt, Anfang 214 aufgrund einer nachträglichen Erstattungsbetragsvereinbarung jedoch wieder ausgeboten worden. Die Marktrücknahmen einiger dieser Wirkstoffe gingen mit medialer Aufmerksamkeit einher. Dies hat im Wesentlichen zwei Gründe: Erstens, die Häufung entsprechende Marktrücknahmen und damit verbundene Diskussionen um eine systematische Benachteiligung von Wirkstoffen zur Behanldung chronischer Erkrankungen (siehe ausführlich Kapitel 2.2). Zweitens, die mit einer Marktrücknahme einhergehene Umstellung der bislang mit jenen neuen Therapieverfahren behandelten Patienten. Für letzteres wurde der Hersteller von Insulin degludec, welcher die Marktrücknahme des Ende 214 zugelassenen Basalinsulins für Oktober 215 angekündigt hatte, stark kritisiert. 238 Nachdem der Gemeinsame Bundesausschuss (G-BA) dem langwirkenden Insulinanaloga im Vergleich zu Humaninsulin und Metformin keinen Zusatznutzen bescheinigt hatte und man sich anschließend auf keinen Erstattungspreis einigen konnte, wurde die Schiedsstelle angerufen. Ihr Schiedsspruch entsprach im Wesentlichen den Forderungen des Umstellungen erforderlich 238 Ziegler (215).
146 126 Ergebnisse der Erstattungsbetragsverhandlungen 4 GKV-Spitzenverbands der künftige Listenpreis wurde auf die Höhe der Kosten einer Therapie mit Humaninsulin festgesetzt. 239 Aus wirtschaftlichen Überlegungen heraus kündigte der Hersteller daraufhin den Vertriebsstopp an. Etwa 4. Patienten müssen daraufhin GKV-weit auf andere Therapiealternativen umgestellt werden. 24 Dabei sei die Umstellung auf ein neues Insulin häufig deutlich schwieriger als der Wechsel bei anderen Arzneimitteln. Entgegen ursprünglicher Ankündigungen hat der Hersteller das Ultralangzeitinsulin degludec dann doch nicht wie angekündigt Anfang Oktober außer Vertrieb genommen. Grund hierfür sei, dass Marktdaten zufolge ein großer Teil der der bislang behandelten Patienten noch nicht umgestellt worden seien. 241 Um eine sichere Umstellung aller Patienten auf ein anderes Basalinsulin zu ermöglichen, wurde nach Herstellerangaben die Übergangsfrist verlängert. Ein konkretes Datum für die Marktrücknahme liegt seitdem nicht vor, womit auch eine kurzfristige Vertriebseinstellung möglich bleibt. Nicht betroffen von der Rücknahme ist die fixe Kombination aus Insulin degludec und Liraglutid (Xultophy ). Das reguläre in diesem Report ansonsten noch nicht weiter berücksichtigte Verfahren hat ebenfalls zu einem nicht belegten Zusatznutzen geführt. Hintergrund waren auch in diesem Verfahren aus Sicht des G-BA nicht zum Zusatznutzennachweis geeignete Studiendaten, welche der Hersteller mit dem Dossier vorlegte. Marktrücknahmen neuer Antiepileptika Nach Retigabin im Jahr 212 wurde 213 mit Perampanel auch das zweite neue Antiepileptikum nach durchlaufener früher Nutzenbewertung vom Markt genommen. Ein Umstand, den auch der G-BA anders als bei einer Vielzahl der Rücknahmen neuer Antidiabetika kritisch bewertet. 242 Hintergrund ist, dass zwar alte, gut wirksame und generisch verfügbare Wirkstoffe (Lamotrigin, Topiramat), im Markt verfügbar sind, nach Schätzung der Deutschen Gesellschaft für Epileptologie jedoch ca. 3 % aller Patienten nicht ausreichend auf die bisher zur Verfügung stehenden Medikamente ansprechen. 243 Epilepsie-Patienten gelten als pharmakoresistent, wenn sie auf mehr als zwei Antiepileptika nicht angesprochen haben. Mit der Marktrücknahme von Retigabin und Perampanel stehen die beiden einzigen seit 21 neu zugelassenen Epileptika in Deutschland nicht zur Verfügung Ziegler (215). DDG (215). Borsch (215). Umsatzdaten der DAK-Gesundheit bestätigen, dass sich das Verordnungsvolumen von Insulin degludec auch im 2. Quartal 215 noch auf konstanten Niveau befindet. Siehe hierzu Abschnitt III des Reportes. Apotheke adhoc (214). DGfE (215).
147 4 Ergebnisse der Erstattungsbetragsverhandlungen 127 Ausgangspunkt der Marktrücknahme von Perampanel war die Nutzenbewertung, bei der im November 214 auch im zweiten Durchlauf kein Zusatznutzen im Vergleich zu den vom G-BA als Vergleichstherapie definierten konventionellen Antiepileptika festgestellt werden konnte. Streitpunkt war wie in den Verfahren zuvor eben diese Definition des Vergleichsmaßstabes der Bewertung. Der Hersteller verwies bei Vorlage des Dossiers auf eine klinisch-praktische Rationale und interpretierte die geforderte Vergleichstherapie als Bestandteil einer patientenindividuellen Basistherapie, mit der Begründung, dass in dieser Patientenpopulation eine Therapieoptimierung durch eine Zusatztherapie nicht mehr möglich sei und sich der Zusatznutzen aus einem Vergleich von Perampanel als Zusatztherapie gegenüber Placebo ergebe. 244 Grund hierfür sei das individuell sehr unterschiedliche Ansprechen auf eine bestimmte Therapie. Der G-BA-Beschluss wiederum bemängelte aus methodischer Sicht das Fehlen direkter Vergleichsstudien. Die Kritik der Fachgesellschaften sowie der maßgeblichen Industrieverbände richtete sich in der Folge an diesen methodischen Dogmatismus, welcher es dem G-BA nicht erlaube, relevante, krankheitsspezifische Kontextfaktoren in die Bewertung einzubeizehen. 245 Die Deutschen Gesellschaft für Epileptologie (DGfE) gab im Zuge der bislang erfolglosen Nutzenbewertungsverfahren neuer Antiepileptika 213 Empfehlungen zur Nutzenbewertung entsprechender Präparate heraus. 246 Die Vorschläge der Fachgesellschaft sehen vor, zukünftig von den bislang geforderten head-to-head-vergleich mit bestimmten anderen Antiepileptika abzusehen, weil diese Vorgehensweise das individuelle Ansprechen der Epilepsiepatienten auf unterschiedliche Antiepileptika unberücksichtigt lässt. Die DGfE schlägt deshalb vor, für die Bewertung neu zugelassener Antiepileptika durch das IQWiG und den G-BA einen Zusatznutzen als belegt zu betrachten, wenn die Wirksamkeit an einer bislang pharmakoresistenten Gruppe von Patienten in adäquaten Studien nachgewiesen wurde (d. h. als das klinisch relevante und statistisch signifikante Ansprechen nach den Zulassungskriterien von >5% Anfallsreduktion). Unabhängig vom Marktrückgang des Herstellers erhalten Patienten derzeit über einen Sonderweg Zugang zu Perampanel. Seit Anfang 214 können Apotheken das Präparat auf Antrag durch ein Individualimport-Programm (sog. Named-Patient-Access-Programm ) bestellen. Der Hersteller übernimmt dabei die anfallenden Kosten, sodass die Patienten das Arzneimittel kostenfrei über die Apotheke erhalten. 247 Dies allerdings nur bis April 216, dann läuft das vom Methodische Gründe ausschlaggebend Schlenger (215). Schlenger (215). DGfE (213). Obgleich dieses Abrechnungsverfahren hinsichtlich der genauen Umsetzung zunächst noch zum Teil auf Einzelkassenebene geklärt werden musste. Vgl. Sucker-Sket (214).
148 128 Ergebnisse der Erstattungsbetragsverhandlungen 4 Hersteller eingerichtete Individualimport-Programm aus. 248 Das Antiepileptikum wird dann nur über einen Einzelimport gem. 73 Abs. 3 Nr. 1 AMG zu beziehen sein. Konsequenzen aus der Opt-Out-Praxis? Offen ist, wie das Verhältnis von erfolgreich abgeschlossenen Nutzenbewertungsverfahren und vom Markt genommenen AMNOG- Produkten zu interpretieren ist. Denn während beispielsweise Cassel und Ulrich schlussfolgern, dass zu viele neue Arzneimittel in Folge verschiedener Regulierungsfehler im AMNOG nicht der Patientenversorgung zur Verfügung stehen, bezeichnet der G-BA die überwiegende Anzahl der vom Markt genommenen Präparate als für die Patientenversorgung verzichtbar. 249 Verschiedene Gutachten aus dem Jahr 215 beschäftigten sich deshalb mit der Fragestellung, ob die frühe Nutzenbewertung einen belegbar negativen Einfluss auf die Verfügbarkeit neuer Arzneimittel habe. Cassel und Ulrich ermittelten beispielsweise die Zahl der von der EMA von 26 bis 215 europaweit zugelassenen Wirkstoffe, die zwar AMNOG-fähig sind, aber bislang hierzulande nicht ausgeboten wurden. Sie stellten die Ergebnisse für die fünf Jahre vor (26-21) und nach Einführung der frühen Nutzenbewertung ( ) gegenüber. Das Ergebnis: Die Verfügbarkeitsquote ist seit Einführung des AMNOG um 17,5 Prozentpunkte von 94,8 % vor AMNOG auf 77,3 % (bzw. 79,3 %, abhängig von der Datenbasis) nach Einführung der frühen Nutzenbewertung zurückgegangen. 25 Dem im August 215 zuletzt erschienen Arzneiverordnungs-Report (AVR) ist jedoch zu entnehmen, dass retrospektiv betrachtet keine erhöhte Marktrücknahmequote durch die Einführung des AMNOG zu beobachten ist. 251 Die Autoren legen ebenfalls Zahlen der EMA zugrunde, beziehen sich jedoch lediglich auf die absolute Anzahl der pro Jahr zurückgezogenen neuen Wirkstoffe und berücksichitgen nicht die als Bezugsgröße relevante Anzahl an Neuzulassungen. Auch die Zeit bis zur Verfügbarkeit neuer Arzneimittel nach erfolgter Zulassung sei durch das AMNOG nicht eingeschränkt worden und im europäischen Vergleich in Deutschland nach wie vor am kürzesten. Dies dürfte nach Einschätzung der Autoren des AVR auch damit zu tun haben, dass aufgrund des uneingeschränkten Marktzuganges verbunden mit der Möglichkeit, einen frei festgelegten Preises in den Datenbanken Deutschland als Preisreferenzmarkt im Hinblick Sucker-Sket (215c). G-BA (214). BPI (215); Cassel, Ulrich (215b). Schaufler, Telschow (215), S. 228.
149 4 Ergebnisse der Erstattungsbetragsverhandlungen 129 auf den Zeitpunkt der Markteinführung von entscheidender strategischer Beudeutung ist. 252 Die Autoren einer vom GKV-Spitzenverband in Auftrag gegebenen Studie kommen zwar zu einem vergleichbaren Ergebnis, stützen ihre Ergebnisse jedoch überwiegend auf Daten aus dem Zeitraum zwischen 26 und hinsichtlich der Fragestellung ein nicht ausreichender Betrachtungszeitraum. 254 Fraglich ist, ob und inwiefern der Gesetzgeber auf diese Befunde im Rahmen sich nach Abschluss des Pharma-Dialogs anstehenden Überlegungen über Korrekturen am AMNOG-Prozess eingehen wird. Diskutiert wurden zuletzt weniger Änderungen auf methodischer Ebene im Nutzenbewertungsverfahren selbst, sondern Nachbesserungen am abschließenden Verhandlungsprozess. Im Wesentlichen lassen sich hierfür drei grundlegende Reformvorschläge differenzieren: (1) Denkbar wäre eine Flexibilisierung des 13b SGB V um in bestimmten Fallkonstellation eine Abkehr von preisgünstigen generischen Vergleichstherapien ( Preisanker ) zu ermöglichen. Umsetzbar wäre dies beispielsweise über eine Korridorlösung, in welcher nicht die kostengünstigste (i. d. R. generische) Vergleichstherapie sondern ein verordnungsgewichteter Warenkorb verschiedener Therapiealternativen Ausgangspunkt der Erstattungsbetragsverhandlungen ist. Zwei weitere Vorschläge tragen dem Umstand Rechnung, dass in manchen Situationen die methodischen Implikationen der Nutzenbewertung zu einem zwar nicht belegbaren Zusatznutzen führen, auf Seiten einzelner Krankenkassen jedoch durchaus eine Zahlungsbereitschaft für diese neuen Präparate auch oberhalb des Preisniveaus der maßgeblichen Vergleichstherapien bestehen könnte: (2) Im AMNOG-Verfahren stehen sich Selbstverwaltung und pharmazeutischer Unternehmer in einem extrem formalisierten Prozess gegenüber. Dieser wird zurzeit auch auf die Erstattungsbetragsverhandlungen übertragen, in welchen sich pharmazeutische Unternehmer seit Einführung des AMNOG veränderten Wettbewerbsparametern gegenüber sehen. Dadurch, dass der GKV-SV als alleiniger Verhandlungspartner und damit als Nachfragemonopolist auftritt, kommt der zuvor vom GKV-SV festgelegten zweckmäßigen Vergleichstherapie in Verbindung mit dem Nutzenbewertungsergebnis eine entscheidende Bedeutung für den Verlauf der Preisverhandlungen zu. Die derzeitige Form der Beteiligung einzelner Kassenvertreter an den zentralen Preisverhandlungen reicht zur Diversifizierung der Verhandlungsinteressen nicht aus. Weitere Flexibilisierung der zvt Dezentrale Verhandlungen Schaufler, Telschow (215), S Busse et al. (215). Gerbsch (215).
150 13 Ergebnisse der Erstattungsbetragsverhandlungen 4 Geheime Rabatte Insofern ist eine zu diskutierende Option, einzelnen Kassenarten und Großkassen Verhandlungsmandate zu übertragen und so auch regionale Versorgungsaspekte und kassenbezogene Wettbewerbselemente im Rahmen der Erstattungsbetragsverhandlungen zu berücksichtigen. 255 In konkreter Umsetzung würde dies eine Stärkung des 13c z. B. über Risk-Sharing- bzw. Pay-for-Performance-Verträge bedeuten, was zukünftig entgegen dem derzeitigen Vorrang von 13b-Verträgen auch Wettbewerbselemente innerhalb der GKV betonen würde. 256 Die vom Gesetz vorgesehene Weiterverhandlung mit einzelnen Krankenkassen wird durch die aktuelle Praxis der Preisvereinbarung und die nachträglich eingeführte Verpflichtung zur Offenlegung des Erstattungsbetrags kaum genutzt. Anstatt die zentralen 13b-Verhandlungen ganz zu ersetzen wäre deshalb denkbar, dies nur auf den Fall gescheiterter Erstattungsbetragsverhandlungen auf Antrag durch die Vertragspartner zu beschränken. Auf die positiven Steuerungseffekte dezentraler Preisverhandlungen wurde bereits an verschiedenen Stellen hingewiesen. 257 (3) Alternativ dazu wird diskutiert, den bislang in der Lauer Taxe einsehbaren reduzierten Erstattungsbetrag als Differenz aus Listenpreis und Nutzenbewertungsrabatt zukünftig in bestimmten Fallkonstellationen (kein Zusatznutzen belegt, gescheiterte Erstattungsbetragsverhandlungen) geheim zu halten. 258 Unter der Annahme, Hersteller seien bei fehlendem Zusatznutzenbeleg grundsätzlich zu substantiellen Abschlägen mit anschließenden Erstattungsbeträgen in der Regel auf Generikaniveau einverstanden, wenn dies nicht öffentlich einsehbar wäre, kommt dieser Vorschlag insbesondere der pharmazeutischen Industrie entgegen. 259 Der Hintergrund: Deutschland ist Referenzpreisland für andere Länder und damit vielfach maßgeblicher Ausgangspunkt für die jeweilige nationale Preisgestaltung. Vorbild dieses Modells könnte die vertrauliche Abwicklung der Rabattverträge nach 13a Abs. 8 SGBV sein. Der Vorschlag sieht im Detail vor, dass wie bislang in Fällen der Nicht-Einigung die Schiedsstelle über die Preisangebote beider Parteien informiert wird. Der GKV-SV bekommt darüber hinaus fakultativ also bei Vorliegen einer Versorgungsrelevanz des betreffenden Wirkstoffes die Möglichkeit, einen weiteren, höheren Erstattungsbetrag an die Schiedsstelle zu nennen. 26 Dieser wäre allerdings an die Voraussetzung gebunden, dass der Hersteller zusätzlich Rabattverträge mit einzelnen Krankenkassen schließt. Diese sollen die Differenz zu der ursprünglichen Forderung ausgleichen. Die Höhe der Hermann (215), S. 147ff. Ärzte Zeitung (214); Bayerischer Pharmagipfel (215), S. 3. Cassel, Ulrich (215a), S. 69; Greiner, Witte (215), S. 171, O.V. (214). TK (215). Tatsächlich würden die pharmazeutischen Unternehmer Herstellerabschläge sparen, denn diese müssen nicht auf den verhandelten Rabatt gezahlt werden. Vgl. Haas, Tebinka-Olbrich (214), S. 39. Sucker-Sket (215a).
151 4 Ergebnisse der Erstattungsbetragsverhandlungen 131 in den Einzelverträgen vereinbarten Abschläge bleibt geheim. Entscheidet sich die Schiedsstelle für diese Variante, muss das Pharmaunternehmen innerhalb von drei Monaten mit der Mehrheit der Kassen entsprechende Verträge vereinbaren. Dabei muss mindestens die vom GKV-SV veranschlagte zusätzliche Rabatthöhe zusammenkommen. Wird das Quorum nicht erreicht, gilt automatisch der ursprünglich vom GKV-SV geforderte niedrigere Preis ohne geheime Preiskomponente. 261 Die Möglichkeit der Außer-Vertriebnahme stehe dem Hersteller ebenfalls noch offen. Angelehnt ist dieses Modell an sog. Patient Access Schemes (PAS), ein Instrument, dass in England und Schottland zur Steuerung der Arzneimittelkosten eingesetzt wird. 262 Über ein PAS hat der Hersteller zweitinstanzlich die Möglichkeit, noch eine positive Erstattungsentscheidung zu erreichen, wenn zuvor auch aufgrund eines zu hohen Listenpreises keine akzeptables Verhältnis von Kosten und Nutzen festgestellt werden konnte. Hierzu ist von Seiten des Herstellers eine weitere Preisreduktion erforderlich. Die Teilnahme am Patient Access Schemes erlaubt dem Hersteller jedoch gleichzeitig, den zuvor festgesetzten und öffentlich einsehbaren Listenpreis unverändert zu lassen; eingeräumte Rabatte werden vertraulich behandelt. 263 Problematisch könnten sich im Modell geheimer Erstattungsbeträge jedoch mehrere Faktoren gestalten: Neben der fehlenden Bezugsgröße zur Berechnung der Mehrwertsteuer in der Vertriebskette dürfte ein geheimer Erstattungsbetrag auch langfristig die Festbetragsgruppenbildung erschweren (siehe hierzu die Vorschläge des GKV-SV in Kapitel 4.1). Diese eher technischen Probleme erscheinen aber lösbar. Zudem hat der Gesetzgeber mit dem 14. SGB V- Änderungsgesetz Anfang 214 erst dem Erstattungsbetrag Listenpreischarakter zugewiesen. Insofern wäre abzuwägen, inwiefern das durch die frühe Nutzenbewertung gewonnene Transparenzniveau auch im Hinblick auf Arzneimittelpreise nun wieder aufgegeben werden sollte, um eine höhere Verfügbarkeit neuer Arzneimittel im deutschen Markt zu ermöglichen Sucker-Sket (215a). Claxton et al. (211), S. Wasem et al. (215), S. 11. Haas, Tebinka-Olbrich (214), S. 32f.
152 132 Ergebnisse der Erstattungsbetragsverhandlungen Erstattungsbetrag als Mischkalkulation Mischpreisrelevante Verfahren Mischpreisbildung in der Diskussion Die Erstattungsbeträge für neue Medikamente werden zwischen dem GKV-Spitzenverband und dem Hersteller ausgehandelt. Sie orientieren sich am Zusatznutzen für alle Patienten im zugelassenen Anwendungsgebiet. Dabei wird ein einheitlicher Erstattungsbetrag für ein Arzneimittel über alle Subindikationen hinweg vereinbart (sog. Mischpreis). Der Zusatznutzen für verschiedene Patientengruppen kann aber unterschiedlich sein. Gerade wenn der Arzt ein Medikament in einer Subgruppe verordnet, für die kein Zusatznutzen festgestellt wurde, ist die Wirtschaftlichkeit der Verordnung derzeit umstritten, sofern der Preis die Kosten der zweckmäßigen Vergleichstherapie übersteigt. Umstritten ist dies deshalb, da der Beschluss des G-BA als eine Feststellung über die Zweckmäßigkeit im Sinne des 12 SGB V keinen (auch nicht faktischen) Verordnungsausschluss darstellt. 265 Die Wirtschaftlichkeit der Verordnung wird grundsätzlich durch einen Festbetrag nach 35 oder die Vereinbarung eines Erstattungsbetrages nach 13b SGB V hergestellt. 266 Bei mehr als einem zugelassenen Anwendungsgebiet und einer daraus folgenden anwendungsgebietsspezifischen Differenzierung des Zusatznutzens kann ein solcher Erstattungsbetrag nach derzeitigem Regelungsstand nur ein Mischpreis sein. Dies trägt dem Umstand Rechnung, dass gem. 13b Abs. 3 SGB V der Preis eines Arzneimittels mit neuem Wirkstoff ohne Zusatznutzen nicht zu höheren Jahrestherapiekosten als die zvt führen darf. Die Rahmenvereinbarung nach 13b Abs. 8 SGB V führt die Mischpreisbildung nicht explizit auf, sondern basiert eigentlich auf einem Erstattungsbetrag. Durch den G-BA-Beschluss fließen jedoch Subgruppen in den Geltungsbereich der Rahmenvereinbarung ein. Praktisch wird deshalb bei mehreren Subgruppen und damit auch Vergleichstherapien die Preisobergrenze über eine anhand der jeweiligen Populationsgrößen gewichtete Mischpreisbildung ermittelt. Unsicherheiten über die wirtschaftliche Verordnung in Anwendungsgebieten ohne Zusatznutzen sind die Folge. Einzuschränken ist, dass die Mischpreisproblematik nur einen vermeintlich kleinen Anteil aller durch das AMNOG erfassten Wirkstoffe betrifft. Werden jene Verfahren aus der Betrachtung ausgeschlossen, für die der Hersteller kein Dossier vorlegte sind noch 24 % der Verfahren (29 von 119) für die Mischpreisbildung relevant (vgl. Abb. 24) Grüne (214). 92 Abs. 2 S. 11 SGB V. Da der G-BA in der erneuten Nutzenbewertung von Eribulin nicht quantifizieren konnte, für wie viele Patientinnen mit HER2-positivem Brustkrebs, für die eine
153 4 Ergebnisse der Erstattungsbetragsverhandlungen 133 Abbildung 24: Mischpreisrelevante Verfahren (Stand: ) 1 9 Zielpopulation mit Zusatznutzen in % Trotz wiederholter Aufforderung einer gesetzlichen Klarstellung an das Bundesministerium für Gesundheit ist die versorgungspraktische Umsetzung der Mischpreisbildung nicht abschließend geklärt. 268 Der GKV-Spitzenverband vertrat zuletzt die Auffassung, dass [ ] mit der Einheitlichkeit des Erstattungsbetrages bei Arzneimitteln mit verschiedenen Anwendungsgebieten und unterschiedlichen Nutzenbewertungen für diese verschiedenen Anwendungsgebiete [kann] die Verordnung solcher Arzneimittel prinzipiell nur für Anwendungsgebiete mit Zusatznutzen wirtschaftlich sein [kann]. 269 Es sei unabhängig vom Ausgang der Nutzenbewertung Aufgabe des Arztes, bei Verordnungsentscheidungen neben der Zweckmäßigkeit auch die Wirtschaftlichkeit zu prüfen. Das bedeutet, dass demnach ein indikationsgerechter Einsatz ausserhalb der nutzenbelegten Indikationen prinzipiell als unwirtschaftlich zu betrachten ist. 27 Dieser Punkt wird kontrovers diskutiert, da im Einzelfall auch der Einsatz einer teureren Alternative ohne Zusatznutzenbeleg sinnvoll und notwendig sein kann. Die maßgeblichen Industrieverbände haben indes darauf hingewiesen, dass Arzneimittel mit positiver Nutzenbewertung und verhandeltem Preis entgegen der Auffassung des GKV-SV pauschal als wirtschaftlich anzusehen seien und unabhängig vom Preis verordnet werden können. 271 Der durch das AMNOG erzielte Erstattungsbetrag von Arzneimitteln reflektiere nach Auffassung der Industrie den vom Gesetzliche Klarstellung bleibt aus Therapieentscheidung für eine Behandlung mit Eribulin laut vorliegendem Anwendungsgebiet getroffen wird, eine Anti-HER2-Therapie angezeigt wäre (Teilpopulation c), wird diese Subpopulation nicht in den Berechnungen berücksichtigt. Dies erscheint vertretbar, da der G-BA in den Tragenden Gründen von einer sehr geringen Anzahl in der Versorgungsrealität ausgeht. Gleiches trifft auch für das Verfahren von Trastuzumab Emtansin zu. Kaesbach (215). GKV-Spitzenverband (214), S. 8. Laschet (214). Frick (215).
154 134 Ergebnisse der Erstattungsbetragsverhandlungen 4 Fehlende Rechtssicherheit Standpunkt der Kassenärztlichen Vereinigungen G-BA festgestellten Zusatznutzen und stelle deshalb die Wirtschaftlichkeit der Verordnung über alle Anwendungsgebiete her. Beklagt wird vielmehr, dass die frühe Nutzenbewertung eigentlich auf eine über verhandelte Preisabschläge vermittelte angebotsseitige Regulierung abzielt. Die geringe Anzahl bislang vereinbarter Praxisbesonderheiten in Kombination mit direkten (Regresse) sowie indirekt ( Verordnungshöchst- und Mindestquoten ) Steuerungsinstrumenten führe jedoch zu einer Vermengung angebots- und nachfrageseitigen Regulierung. 272 Wird trotz Mischpreis die Verordnung in Anwendungsgebieten ohne Zusatznutzen durch zusätzliche Steuerungsinstrumente faktisch ausgeschlossen, wird entsprechenden Vereinbarungen letzlich die kalkulatorische Grundlage entzogen. 273 Beklagt wird ferner, dass aufgrund der fehlenden Rechtssicherheit über den Begriff der Wirtschaftlichkeit im Kontext des AMNOGs Ärzte in Ihrer Entscheidung über die Verordnung neuer Arzneimittel eingeschränkt werden. 274 Die Autoren des Arzneimittel-Atlas berechnen in diesem Zusammenhang seit Einführung des AMNOGs Diffusionsbarrieren für neue Arzneimittel und weisen auf daraus folgende Versorgungsdefizite hin. 275 Anzunehmen ist, dass unterschiedlichen Argumentationsmuster von GKV-SV, Kassenärztlichen Vereinigungen und Industrie ohne gesetzliche Klarstellung Anteil daran haben dürften, dass die Nutzenbewertungsergebnisse nicht in vollem Umfang in der Versorgung ankommen. 276 Analysen des wissenschaftlichen Institutes der PKV haben Anfang 215 gezeigt, dass Medikamente, denen vom G-BA ein beträchtlicher Zusatznutzen attestiert wurde, in der PKV wo entsprechende Prüfmechanismen zur Wirtschaftlichkeit einer Verordnung nicht greifen eine deutlich größere Rolle als in der GKV spielen. 277 Ein Effekt, welcher aus politischer Sicht nicht beabsichtigt gewesen sei, weshalb auf politischer Ebene der Vorschlag zur Klarstellung der Wirksamkeit des Mischpreises diskutiert wurde. 278 In dem derzeitigen Spannungsfeld müssen sich auch die kassenärztlichen Vereinigungen gegenüber ihren Vertragsärzten positionieren. Nach Ansicht der KBV stellt der Erstattungsbetrag als Mischpreis die Wirtschaftlichkeit des jeweiligen Arzneimittels sicher unabhängig davon, ob für die entsprechende Patientengruppe ein Zusatznutzen festgestellt wurde oder nicht. 279 Auch im Hinblick auf die zukünftige Regionalisierung der Wirtschaftlichkeitsprüfungen mit dem GKV-VSG kommt den einzelnen KVen auf Landesebene eine wichtige Steuerungsfunktion zu, in dem sie die Ergebnisse u.a. auch nach 73 Abs. 8 SGB V für den Arzt aufbereiten und weiterleiten Cassel, Ulirch (215b). Cassel, Ulrich (215b). Exemplarisch: Postina (214), S Höer, Chen (215), S. 98. Dryden (215), S. 43. Wild (215), S. 73. Sucker-Sket (215b). KBV (214).
155 4 Ergebnisse der Erstattungsbetragsverhandlungen 135 Auffällig ist, dass es dort zu zum Teil unterschiedlichen Einschätzungen über die Interpretation des Mischpreises bzw. die Umsetzung des Wirtschaftlichkeitsgebotes im differenzierten Nutzenbewertungsergebnis gekommen ist. 28 Um abzuschätzen, welchen Einfluss die derzeit unklare Rechtssituation auf die vertragsärztliche Versorgung hat, ist eine Darstellung der Einschätzung der Kassenärztlichen Vereinigungen (KV) zur Umsetzung des 73 Abs. 8 SGB V bei neuen Arzneimitteln von Interesse. Manche KVen positionieren sich beispielsweise explizit in den jährlichen Arzneimittelvereinbarungen nach 84 Abs. 1 SGB V oder auf ihrer Webseite zur Umsetzung der Nutzenbewertungsergebnisse im Versorgungsalltag. Hinsichtlich der regressbefreienden Wirkung des Erstattungsbetrages (bzw. des Mischpreises) weist die KV-Nordrhein ihre Vertragsärzte darauf hin, dass die Vereinbarung eines Erstattungspreises nach 13b SGB V kein hinreichendes Kriterium für eine wirtschaftliche Verordnungsweise ist. 281 Auch die KV Sachsen gibt eine entsprechende Empfehlung ab, weist jedoch zusätzlich darauf hin, dass [ ] auch für Medikamente mit Zusatznutzen die Situation zu diesem Zeitpunkt [vor Vereinbarung eines Erstattungsbetrages] aufgrund eines hohen Preises im Verhältnis zur Vergleichstherapie mitunter unklar ist. 282 Die KV-Bayern empfiehlt ihren Vertragsärzten hingegen, dass zur Erreichung einer bedarfsgerechten, qualifizierten und wirtschaftlichen Arzneimittelversorgung Arzneimitteln grundsätzlich, also trotz Mischpreis, nur in den Anwendungsgebieten mit Zusatznutzen zu verordnen. 283 Um die Umsetzung der wirtschaftlichen Verordnungsweise systematisch auf regionaler Ebene zu erfassen, wurden im August 215 alle Kassenärztlichen Vereinigungen angeschrieben und um ihre Einschätzung gebeten. Die Ergebnisse der Befragung werden nachfolgenden kurz zusammengefasst: KV-Befragung zur Umsetzung der Nutzenbewertungsergebnisse im Versorgungsalltag Zielsetzung: Erhebung der KV-spezifischen Einschätzung zur Umsetzung des Wirtschaftlichkeitsgebotes unter Berücksichtigung der Nutzenbewertungsergebnisse und derzeitiger Interpretationsfragen des Mischpreises. Methodik: Im August 215 wurde allen 17 Kassenärztlichen Vereinigungen in zwei Wellen ein zweiseitiger Fragebogen zur wirtschaftlichen Verordnungsweise neuer Arzneimittel zugeschickt. Der Fragebogen (siehe Anhang) umfasste fünf Fragen zur Wirtschaftlichkeit einer Verordnung neuer Arzneimittel ohne Zusatznutzen bzw. ohne Zusatznutzen in Teilanwendungsgebieten. Darüber hinaus wurde die Informationspolitik der KVen in dieser Thematik Kleinfeld, Luley (214), S. 5. KV Nordrhein (215). KV Sachsen (215). KV Bayern (214).
156 136 Ergebnisse der Erstattungsbetragsverhandlungen 4 erfragt. Zu jeder Frage waren zusätzlich Freitextantworten möglich, welche in 9 % aller Fragen KV-übergreifend auch genutzt wurden. Die Auswertungen fanden anonymisiert statt. Ergebnisse: Von zehn der 17 KVen liegen Antworten vor, neun davon sind für alle Fragebogenbereiche verwertbar (vgl. Abb. 25). Abbildung 25: Position der KVen zur wirtschaftlichen Verordnungsweise neuer Arzneimittel (eigene Erhebung; n=1) Die Verordnung von Arzneimitteln ohne Zusatznutzen vor Abschluss der Erstattungsbetragsverhandlungen ist als unwirtschftlich zu bewerten Die Verordnung von Arzneimitteln ohne Zusatznutzen nach Abschluss der Erstattungsbetragsverhandlungen ist als unwirtschftlich zu bewerten Empfehlung, Arzneimittel mit Zusatznutzens in Teilanwendungsgebieten auch nur in diesen zu verordnen Kooperation mit GKV zur Information der Vertragsärzte zu Verordnungs- und Wirtschaftlichkeitsfragen neuer Arzneimittel gem. 73 Abs. 8 SGB V Öffentlich verfügbare Informationen zur wirtschaftlichen Verorndungsweise (Webseite bzw. in öffentlich einsehbaren Newslettern) Kassenärztliche Vereinigungen Ja Nein Fünf von neun KVen schätzen die Verordnung eines Arzneimittels ohne Zusatznutzen vor Abschluss der Erstattungsbetragsverhandlungen als unwirtschaftlich ein. Andererseits wird darauf hingewiesen, dass [ ] es sich um zugelassene Arzneimittel handelt, die nach medizinischer Notwendigkeit eingesetzt werden können. Entsprechende Arzneimittel seien nicht von vornherein unwirtschaftlich [ ]. Eine gut begründete und dokumentierte Verordnung sei jedoch zu empfehlen, da mit einer höheren Prüfwahrscheinlichkeit zu rechnen sei. Auch der Preis des Arzneimittels sei zu berücksichtigen. Entstehen durch die Verordnung auch vor dem Abschluss der Preisverhandlungen keine höheren Kosten gegenüber der zvt sei auch die Verordnung von Arzneimitteln ohen Zusatznutzen unter Wirtschaftlichkeitsaspekten möglich. Dennoch gab eine KV zusätzlich an, Ärzten explizit von der Verordnung entsprechender Medikamente abzuraten. Weitestgehend Einigkeit herrscht hinsichtlich der Einschätzung, dass die Verordnung von Arzneimitteln nach Abschluss der Erstattungsbetragsverhandlungen als wirtschaftlich zu bewerten ist. Dies erscheint logisch, da eine Vereinbarung nach 35 bzw. 13b SGB V die Wirtschaftlichkeit einer Verordnung herstellt. Lediglich eine KV gab an, dass nach ihrer Erfahrung der Erstattungsbetrag über dem Preis der zvt liegen kann, was wiederum zu Prüfanträgen führen kann.
157 4 Ergebnisse der Erstattungsbetragsverhandlungen 137 Sechs von neun KVen empfehlen ihren Vertragsärzten, im Falle eines differenzierten Nutzenbewertungsergebnisses Arzneimittel nur in den positiv bewerteten Teilpopulationen einzusetzen. Der Mischpreis greife hier deshalb nicht, da in Subgruppen ohne Zusatznutzen Regressanträge gestellt werden (u. a. Hepatitis-C-Therapie). Gegenteilige Einschätzungen wurden differenziert begründet. Eine KV weist darauf hin, dass Arzneimittel ohne Zusatznutzen nicht als Mittel der 1. Wahl eingesetzt werden sollten. Wenn das Behandlungsziel mit der zvt jedoch nicht erreicht wird, kann der Vertragsarzt auch mit dem Alternativpräparat in einem Bereich ohne belegten Zusatznutzen therapieren. Der vereinbarte Erstattungsbetrag wird von ein KV als Mischpreis angesehen, aufgrund dessen auch der Einsatz in nicht mit einem Zusatznutzen belegten Indikationen als wirtschaftlich angesehen werden muss. Da es nach Einschätzung dieser KV jedoch Abweichungen zur Einschätzung der gesetzlichen Krankenkassen gibt, wird dies nicht gegenüber den Vertragsärzten kommuniziert. Für den Zeitraum zwischen Bekanntgabe des G-BA-Beschlusses und Geltung des Erstattungsbetrages wird die Verordnung soweit das Arzneimittel teurer ist als die zvt deshalb doch als unwirtschaftlich angesehen. Wirtschaftlichkeit im Kontext der Phasen der frühen Nutzenbewertung Der Mischpreises wirft beim Transfers der Ergebnisse der frühen Nutzenbewertung in den Versorgungsalltag die Frage auf, ab welchem Zeitpunkt ein neues Arzneimittel seine Wirtschaftlichkeit im Sinne des 12 SGB V entfaltet. Zwei Faktoren sind im Kontext der frühen Nutzenbewertung relevant. Zunächst kann eine Verordnung in Relation zum zeitlichen Ablauf der Nutzenbewertung in vier Phasen betrachtet werden: I) Die Verordnung erfolgt vor Abschluss der Nutzenbewertung durch das IQWiG. II) III) IV) Die Verordnung erfolgt vor der Beschlussfassung über das Ausmaß des Zusatznutzens durch den G-BA. Die Verordnung erfolgt vor Abschluss der Erstattungsbetragsverhandlungen zwischen GKV-SV und Hersteller. Die Verordnung erfolgt nach Abschluss der Erstattungsbetragsverhandlungen nach 13b SGB V (ggf. nach Schiedsstellenentscheid) Ferner ist der Ausgang des Bewertungsverfahrens mit drei möglichen Konstellationen zu berücksichtigen: A) Kein Zusatznutzen im gesamten zugelassenen Anwendungsgebiet.
158 138 Ergebnisse der Erstattungsbetragsverhandlungen 4 B) Zusatznutzen in einem Teil des zugelassenen Anwendungsgebietes. C) Zusatznutzen im gesamten zugelassenen Anwendungsgebiet. Vor Abschluss der Nutzenbewertung durch das IQWiG ist eine Arzneimittel-Verordnung vergleichbar mit der Situation vor 211. Der verordnende Arzt muss die Evidenzlage selbst einschätzen und hinsichtlich der Entscheidungsgründe (Diagnosestellung, verfügbare, wirtschaftliche Alternativen) gut dokumentieren. 284 Die kassenärztliche Vereinigung Westfalen Lippe (KVWL) weist deshalb ihre Mitgliedsärzte darauf hin, dass bei Verordnungsentscheidungen für neue Arzneimittel, die das Bewertungsverfahren zum Zusatznutzen und das Preisverhandlungsverfahren noch nicht abgeschlossenen haben, Arzneimittel ohne Zusatznutzen, die teurer als die vergleichbare Standard-Arzneimittel sind, als unwirtschaftlich bewertet werden können. 285 Ein G-BA-Beschluss mit anschließender Änderung der Arzneimittelrichtlinie ist grundsätzlich bindend für den Vertragsarzt unabhängig von der diskutierten Interpretationsfrage. Strittig ist jedoch, inwiefern die Nutzenbewertung des IQWiGs als Grundlage für Prüfanträge herangezogen werden kann. 286 Ärzten dienen entsprechende Beschlüsse zunächst als Orientierung innerhalb der zur Verfügung stehenden Evidenz. Auf Basis eines IQWiG-Beschlusses sind Regressprüfungen jedoch grundsätzlich möglich, da gesetzeskonformen IQWiG-Bewertungen eine Richtigkeitsgewähr zukommt. 287 [ ] Eine Zuschreibung von Rechten oder Pflichten, insbesondere eine Pflicht zum Tätigwerden für den Vertragsarzt nach bestimmten Vorgaben, ergibt sich aus der Nutzenbewertung jedoch vor einer Umsetzungsentscheidung durch den G-BA nicht [ ]. 288 Derzeit unterliegt der G-BA weder einer Ausschlusspflicht bei fehlendem Zusatznutzen noch hat er fakultativ die Möglichkeit, neue Arzneimittel partiell von der GKV-Versorgung auszuschließen. Dem Arzt kommt damit auch sechs Monate nach Marktzugang eines neuen Arzneimittels mit dem Vorliegen eines G-BA-Beschlusses entscheidende Bewertungs- und Steuerungskompetenz zu. Auch aufgrund der bislang geringen Anzahl vereinbarter Praxisbesonderheiten wird der verordnende Arzt durch einen Nutzenbewertungsbeschluss nicht vom Wirtschaftlichkeitsgebot befreit. 289 Der verordnende Arzt muss sich nach Auffassung des GKV-Spitzenverbandes vielmehr innerhalb der komplexen Zusatznuztenmatrix, ggf. differen KV Sachsen (215). KVWL (215). KBV (214). BSG, Urt. V , B 1 KR 7/1 R. Grüne (214) nach BT-Drs.15/1525, S. 89, li.sp. zu 35b Abs. 4 SGB V idf GMG. Laschet (214); Richard (215), S. 25.
159 4 Ergebnisse der Erstattungsbetragsverhandlungen 139 ziert nach verschiedenen Teilanwendungsgebieten und unter Berücksichtigung verschiedener Vergleichstherapien, orientieren. 29 Anders als ein Therapiehinweis enthält der Beschluss des G-BA keine Therapieempfehlung; verordnungsrelevante Schlussfolgerungen ergeben sich erst durch eine Anwendung der Grundsätze des Wirtschaftlichkeitsgebotes durch den Vertragsarzt. 291 Für Wirkstoffe, die keinen Zusatznutzen aufweisen und für die es noch keinen Erstattungsbetrag gibt, erhalten Vertragsärzte nach Angaben der KBV deshalb den Hinweis, [ ] dass das Medikament als unwirtschaftlich gelten könnte und eine Regressgefahrt bei Einzelfallprüfungen nicht auszuschließen ist. [ ] 292 Hintergrund ist, dass ein fehlender Zusatznutzen als Ergebnis der frühen Nutzenbewertung unbestimmt und definitionswürdig ist. Abhängig von der Perspektive des Nutzenvergleichs ergeben sich unterschiedliche Referenzpunkte für die Interpretation eines Zusatznutzens. In (Teil-)Indikationen, in denen bei dem jeweiligen Arzneimittel kein Zusatznutzen festgestellt wurde und in denen eine preiswertere zweckmäßige Vergleichstherapie zur Verfügung steht, bedarf es insofern gewichtiger Gründe, wenn der Vertragsarzt eine Behandlung mit dem Präparat ohne Zusatznutzen durchführen möchte. Diese sind vom Arzt im Zeitpunkt der Verordnung entsprechend zu dokumentieren. Für die GKV ist ein Monitoring aufgrund fehlender Vergütungsrelevanz ambulanter Diagnosen jedoch nur schwer durchzuführen. Verpflichtende Kodierstandards gibt es für die vertragsärztliche Versorgung nicht. Ein Umstand, auf den der GKV-SV in diesem Zusammenhang zuletzt mehrfach hinwies und Änderungsbedarf anmerkte. 293 Die bisherige Praixs zur Vereinbarung von Mischpreisen sollte diesen Konflikt eigentlich auflösen. Nach Darstellung des GKV-SV lässt sich jedoch aus der Tatsache, dass ein Arzneimittel einen Mischpreis besitzt, kein Wirtschaftlichkeits-Automatismus konstruieren. 294 Es ist fraglich, ob durch eine Absenkung des Erstattungsbetrages auf ein Mischpreiniveau ein fehlender Zusatznutzen mit Blick auf das Wirtschaftlichkeitsgebot kompensiert werden kann. Denn der Nutzen eines Arzneimittels erhöht sich nicht durch die Senkung seiner Kosten. 295 Zu berücksichtigen sei auch der Regelungsgedanke des 35 Abs.1b Satz 9 SGB V, wonach ein Arzneimittel, das von einer Festbetragsgruppe freigestellt ist, weil es einen therapierelevanten höheren Nutzen nur für einen Teil der Patienten oder Indikationsbereiche des gemeinsamen Anwendungsgebietes hat, nur für Laschet (214). Grüne (214). KBV (214). GKV-Spitzenverband (214), S. 8; Haas, Tebinka-Olbrich (215), S. 16. Haas, Tebinka-Olbrich (215), S. 17. Grüne (214).
160 14 Ergebnisse der Erstattungsbetragsverhandlungen 4 diese Anwendungsgebiete wirtschaftlich ist. 296 Der GKV-SV leitet daraus zuletzt ab, dass Regresse auf entsprechende Arzneimittel möglich seien. 297 Praxistransfer der Nutzenbewertungsergebnisse fehlt Ergebnisse der frühen Nutzenbewertung aus Sicht der ärztlichen Verordnungspraxis Bislang weitestgehend ungeklärt ist die Frage, wie genau der einzelne Arzt sich mit der Arzneimittelrichtlinie und insbesondere den Beschlüssen des Frühen Nutzenbewertungsverfahrens befassen muss und innerhalb der derzeitigen Mischpreissystematik zu einer fundierten Entscheidung kommen soll. Dass die zum Teil mehrere tausend Seiten langen Herstellerdossiers außerhalb des IQWiG und des G-BA kaum gelesen werden können, ist offensichtlich. Doch auch die Nutzenbewertung durch das IQWiG und die im Anschluss im Bundesanzeiger veröffentlichte Beschlussfassung des G-BA (inklusiver später erscheinender zusammenfassender Dokumentation) dürften hinsichtlich ihres Praktikabilitätsgrades eher juristischen und wissenschaftlichen Zwecken dienen als nützliche Informationsgrundlage für die tägliche Praxis zu sein. 298 Es fehlt ein direkter Link zwischen Nutzenbewertung und Entscheidungswelt niedergelassener Ärzte. Medizinische Leitlinien füllen grundsätzlich diese Lücke, sind jedoch aufgrund ihres komplexen und langwierigen Erstellungsprozesses nicht geeignet, entsprechende Informationen zeitnah in die Versorgung zu bringen. 299 Zwar haben G-BA, GKV-Spitzenverband und die Kassenärztlichen Vereinigungen (auf Bundes- wie auch Länderebene) ebenso wie professionelle Dienstleister Ergebnisübersichten eingerichtet, die für interessierte Kreise gute und schnelle Informationsmöglichkeiten bieten. Für den täglichen Praxiseinsatz sind diese Angebote jedoch insbesondere vor dem Hintergrund der diskutierten indikationsspezifischen Bewertungsproblematik nicht ausreichend. Beklagenswert ist, dass bislang kaum Informationen darüber vorliegen, welchen Einfluss die unklare Rechtssituation zur wirtschaftlichen Verordnung in den Phasen der frühen Nutzenbewertung insbesondere im Hinblick auf die Interpretationsfrage des Mischpreises auf das ärztliche Verordnungsverhalten hat. Um dies abzuschätzen, Grüne (214). Ärzte Zeitung (215a). Ein Umstand, den bereits der Gesetzgeber bei Verabschiedung des AMNOG erkannte. Vgl. BT-Drs. 17/2413, S. 22. Die Autoren des Innovationsreport 215 legen hierzu Ergebnisse einer Ärztebefragung vor. Nach einer im Online-Portal doccheck durchgeführten Befragung beziehen sich Ärzte bei der Entscheidungsfindung zur Verordnung eines neuen Medikamentes häufiger auf medizinische Leitlinien als auf die Ergebnisse der frühen Nutzenbewertung. Angaben zur Methodik oder Fallzahl fehlen jedoch im Report, weshalb die Ergebnisse nur schwerlich einzuordnen sind. Vgl. Glaeske et al. (215), S. 155.
161 4 Ergebnisse der Erstattungsbetragsverhandlungen 141 wurde im Oktober 215 in Kooperation mit der Zeitschrift Der Hausarzt eine Befragung niedergelassener Ärzte durchgeführt. Die Ergebnisse der Befragung werden nachfolgenden kurz zusammengefasst: Ärzte-Befragung zur Umsetzung der Nutzenbewertungsergebnisse im Versorgungsalltag Zielsetzung: Erhebung der aktuellen Verordnungspraxis hinsichtlich der Umsetzung des Wirtschaftlichkeitsgebotes unter Berücksichtigung der Nutzenbewertungsergebnisse und derzeitiger Interpretationsfragen des Mischpreises. Methodik: Im Oktober 215 wurde ein zweiseitiger Fragebogen zur wirtschaftlichen Verordnungsweise neuer Arzneimittel als Heftbeilage der Zeitschrift Der Hausarzt verschickt. Zudem war eine online-teilnahme an der Befragung möglich. Der Fragebogen (siehe Anhang) umfasste elf Fragen zur Verordnung neuer Arzneimittel im Kontext der Nutzenbewertung. Darüber hinaus wurden demografische Daten erfragt. Die Auswertungen erfolgten anonymisiert. Ergebnisse: Es liegen 164 verwertbare Antwortbögen vor. Die Befragungsergebnisse sind hinsichtlich ihrer Verteilung der teilnehmenden Ärzte nach KV-Region annähernd repräsentativ verteilt (siehe Anhang). Die teilnehmenden Ärzte waren im Durchschnitt 55 Jahre alt (Spanne: Jahre), häufiger männlich, häufiger in ländlich geprägtem Umfeld und fast immer selbstständig tätig. 93 % der teilnehmenden Ärzte gaben Auskunft darüber, wie häufig sie sich aktiv über die Ergebnisse der frühen Nutzenbewertung informieren. Mehr als die Hälfte (55 %) gaben an, einmal pro Quartal (13 %) oder häufiger (1x in der Woche: 8 %, 1x im Monat: 31 %) Informationen über aktuelle Ergebnisse aus der frühen Nutzenbewertung zu beziehen. 36 % gaben hingegen an, dies selten bis unregelmäßig zu tun. 6 % beziehen nach eigener Angabe aktiv nie entsprechende Informationen. Anzunehmen war, dass bei der vorliegenden Befragung eher eine Positivselektion der Teilnehmer vorliegt, dass also jene Ärzte ihre Einschätzung zu dieser Thematik abgeben, die sich bereits intensiver mit dieser Thematik auseinandergesetzt haben. Diese Annahme ist basierend auf den vorliegenden Ergebnissen zu verwerfen. Vielmehr scheint sich zu bestätigen, dass es zukünftig einer praxistauglicheren Aufbereitung der Nutzenbewertungsergebnisse bedarf, damit deren Ergebnisse hinreichend Eingang in die Versorgungspraxis finden. Eine eigenständige, regelmäßige Informationsbeschaffung der Ärzte über die Ergebnisse der frühen Nutzenbewertung dürfte im Hinblick auf die Informationsmenge unrealistisch sein. 3 Die Ergebnisse der vorliegenden Befragung stützen 3 Ärzte Zeitung (215b).
162 142 Ergebnisse der Erstattungsbetragsverhandlungen 4 dies: Lediglich 12 % der teilnehmenden Ärzte gab an, Informationen über neue Arzneimttel von den Internetseiten des IQWiG/ G-BA zu beziehen. Häufiger stützen sich Ärzte auf unabhängige Informations- und Nachrichtendienste (6 %) bzw. Informationen der Kassenärztlichen Vereinigungen (67 %). Mit der Befragung liegen zudem erste explorative Einschätzungen zur Umsetzung der Ergebnisse der frühen Nutzenbewertung im Versorgungsalltag vor: Abbildung 26: Erfahrungen und Umgang niedergelassener Ärzte mit den Ergebnissen der frühen Nutzenbewertung (eigene Erhebung; n=15) Zusatznutzen ist bei Verordnungsentscheidung relevant Subgruppen sind bei Verordnungsentscheidung relevant Verordnung in Teilanwendungsgebieten ohne Zusatznutzen ohne Einschränkungen Nutzenbewertung schützt vor Regress Antizipation möglicher Martrücknahmen bei Verordnungsentscheidung % 2% 4% 6% 8% 1% Stimme zu stimme nicht zu Abbildung 26 zeigt, dass zumindest bei Teilen der Befragten die Ergebnisse der Nutzenbewertung Einfluss auf Verordnungsentscheidungen haben. So gaben 8 % der teilnehmenden Ärzte an, dass die vom G-BA veröffentlichten Ergebnisse zum Ausmaß des Zusatznutzens bei Verordnungsentscheidungen von Relevanz seien. Die vonseiten des G-BA differenzierten Subgruppen nannten noch zwei Drittel der Ärzte relevant für ihre Verordnungsentscheidungen. Anders die Einschätzung der Ärzte zu Verordnungen in Teilanwendungsgebieten ohne Zusatznutzen: Lediglich 17 % der teilnehmenden Ärzte gab an, in diesen Indikationen im Hinblick auf mögliche Regresse uneingeschränkt zu verordnen. Ein regionaler Gradient konnte dabei nicht identifiziert werden. Allgemein ist die Sorge vor dem Regressrisiko den Ärzten durch das AMNOG nicht genommen worden. Knapp die Hälfte der Teilnehmer gab an, sich durch die Ergebnisse der Nutzenbewertung nicht sicherer vor Regressen zu fühlen.
163 4 Ergebnisse der Erstattungsbetragsverhandlungen 143 Die KVWL weist ihre Vertragsärzte derzeit explizit darauf hin, dass im Kontext der Erstattungsbetragsverhandlungen Marktrücknahmen jederzeit möglich sind und Patienten ggf. wieder umgestellt werden müssen % der teilnehmenden Ärzte gaben an, dies bereits bei Einstellung der Patienten zu berücksichtigen. Es erscheint also möglich, dass Ärzte auf die Einstellung auf neueste Präparate unter Umständen verzichten, um die Unsicherheit zu vermeiden, ob insbesondere chronisch kranke Patienten langfristig eingestellt werden können. 32 Limitationen der Erhebung: Hinsichtlich der Interpretation der Ergebnisse sind verschiedene Limitationen zu berücksichtigen. Im Rahmen der Teilnehmerakquise wurden lediglich Hausärzte (bzw. Abonnenten von der Zeitschrift Der Hausarzt ) angesprochen. Zudem ist nicht auszuschließen, dass eine Positivselektion der Antwortenden (Affinität für die Thematik) vorliegt. Eine kurze Responsezeit von zwei Woche schränkt die Erreichbarkeit der Zielgruppe weiter ein. Lösungswege aus der Mischpreisproblematik Aus den vorigen Ausführungen ist deutlich geworden, dass derzeit noch nicht abschließend geklärt ist, wie bzw. ob die Wirtschaftlichkeit im Sinne des AMNOG bei der Vereinbarung von Erstattungsbeträgen, insbesondere bei der Bildung von Mischpreisen, gewährleistet werden kann. Grundsätzlich sind zur Lösung dieser offenen Frage verschiedene verfahrensmodifizierende Modelle denkbar und zum Teil bereits öffentlich diskutiert: 1. Es erfolgt eine gesetzliche Klarstellung, dass ein verhandelter Mischpreis für das gesamte Anwendungsgebiet wirtschaftlich ist. 2. Es erfolgt eine Einschränkung der Verordnungsfähigkeit neuer Arzneimittel auf jene Teilanwendungsgebiete mit Zusatznutzen (sog. Teil-Opt-Out ). 3. Erstattungsbeträge werden verpflichtend an Preis-Volumen- Verträge auf dem Niveau der Zielpopulation mit Zusatznutzen gekoppelt. 4. Es werden differenzierte subgruppenspezifische Preise vereinbart ( sog. nutzenorientierte Erstattung ) Eine Klarstellung der Wirtschaftlichkeit eines Mischpreises über das gesamte Anwendungsgebiet erscheint im derzeitigen Regulierungskontext zunächst einfach umsetzbar. Dies würde jedoch den Nutzenbewertungskontext in seiner Komplexität stark verkürzen: Hat der G-BA einzelne Subgruppen mit einem unterschiedlichen Zusatznutzenausmaß bewertet, kann ein einheitlicher Erstattungsbetrag KVWL (215). Ehlers, Erdmann (214).
164 144 Ergebnisse der Erstattungsbetragsverhandlungen 4 Modell Teil-Opt-Out die komplexe Entscheidungsmatrix des G-BA nur unvollkommen abbilden. Insbesondere in Teilanwendungsgebieten mit ggf. geringerem Nutzen erscheint die Zweckmäßigkeit und Wirtschaftlichkeit einer Verordnung auch unter einem Mischpreis nicht gegeben. Eine weitere Möglichkeit wäre, die Zulassung eines Arzneimittels bei differenziertem Beschluss auf jene Teilpopulationen mit Zusatznutzen einzuschränken (sog. Teil-Opt-Out). Dies würde die Preisbildung zunächst im Sinne einer Orientierung am Zusatznutzen umstellen. Die Einschränkung der Erstattungsfähigkeit auf Teilpopulationen mit Zusatznutzen geht in der Theorie mit einem höheren Erstattungsbetrag für die GKV einher. Der pharmazeutische Unternehmer trägt in diesem Modell allerdings das Risiko, dass sich trotz selektiver Zulassungsrücknahme die Verhandlungsposition gegenüber dem GKV-Spitzenverband nicht nachweisbar (und kontrollierbar) verändere. Zu berücksichtigen ist ferner, dass die Nutzenbewertung als Entscheidungsgrundlage auch für Erstattungsbetragsverhandlungen zeitpunktbezogen ist. Auch bei einem nicht festgestellten Zusatznutzen in einer Teilpopulation gibt es eine Chance, dass für entsprechende Patienten ggf. zu einem späteren Zeitpunkt doch eine Überlegenheit gegenüber relevanten Therapiealternativen gezeigt werden kann. Der fehlende Nachweis eines Zusatznutzens kann nicht zwangsläufig als Beleg für die Unzweckmäßigkeit oder die Unwirtschaftlichkeit des Arzneimittels in der betreffenden Indikation gewertet werden. 33 Dem verordnenden Arzt sowie den Patienten würde in einem solchen Modell so eine weitere ggf. nutzenstiftende Therapiealternative vorenthalten. Darüber hinaus wäre sicherzustellen, dass in einem Teil-Opt-Out- Modell nur noch jene Patienten mit Zusatznutzen tatsächlich auch behandelt würden. Dies müsste über Diagnose-Kodierungen des Arztes gelöst werden. Aus verschiedenen Untersuchungen ist jedoch bekannt, dass die ambulante Kodierqualität auch aufgrund des bislang fehlenden Abrechnungsbezuges indikationsübergreifend als mangelhaft zu bezeichnen ist. 34 Erschwerend kommt hinzu, dass sich Nutzenbewertungssubgruppen und die auf dem ICD-1- Katalog basierende abrechnungsrelevante EBM-Klassifikation nur in seltenen Fällen decken. Strittig dürfte ferner sein, wer ein Antragsrecht für eine teilweise Zulassungsrücknahme bekommt bzw. ob es im Hinblick auf die zentrale Zulassung europarechtlich überhaupt möglich wäre, ein verpflichtendes Teil-Opt-Out-Modell zu installieren. Unklar ist auch, wie sich dies für die PKV ausweiten lassen kann, denn entsprechende Patienten sind auch vom Geltungsbereich des AMNOG erfasst. Eine BT-Drs. 18/2673, S. 9. Exemplarisch: Erler et al. (29); Giersiepen et al. (27).
165 4 Ergebnisse der Erstattungsbetragsverhandlungen 145 Beschränkung der Erstattungsfähigkeit neuer Arzneimittel auf Patientengruppen mit durch den G-BA festgestelltem Zusatznutzen lehnte deshalb auch der Gesetzgeber mit dem Verweis auf zuvor genannte Gründe ab. 35 Als weitere Alternative zu Mischpreisen kommen auch verpflichtende Abschlüsse von Preis-Volumen-Verträgen in Frage, die sich an zuvor berechneten Prävalenzen der Teilanwendungsgebiete mit Zusatznutzen orientieren. Dies würde berücksichtigen, dass auch Subgruppen ohne Zusatznutzen in der Versorgungspraxis noch einen Nutzen zeigen können und das zur Verfügung stehende Therapiespektrum nicht weiter einschränken. Dass die frühe Nutzenbewertung insbesondere in bestimmten indikationsspezifischen Fallkonstellationen Fehler 2. Art produzieren kann, ist inzwischen breit diskutiert worden. 36 Bereits heute werden in den Erstattungsbetragsverhandlungen gem. 3 Abs. 3 und 4 Abs. 6 der Rahmenvereinbarung nach 13b SGB V die erwartete jährliche Absatzmenge differenziert nach den Anwendungsgebieten des G-BA-Beschlusses dem GKV- Spitzenverband vor der Verhandlung übermittelt. Zusätzlich zur Mengenvereinbarung, die sich theoretisch als Mindest- und Maximalgrenze realisieren lässt, wären in diesem Modell Konsequenzen bei Über- bzw. Unterschreitung zu vereinbaren. Zu diskutieren ist, ob der zu gewährende Rabatt, welcher bei Überschreitung einer realistischen Patientenpopulation gewährt wird, bei 1 % liegen sollte oder ein gestaffelter Preisabschlag zu vereinbaren wäre. Auch sind Sonderkündigungsrechte und darauf aufbauende Alternativszenarien (fakultativer Teil-Opt-Out) zu diskutieren. Daran knüpft sich auch die Frage an, wie ein nachgelagerter Rabatt abgewickelt werden könnte. Möglich wäre dies z. B. über das bereits existierende 13b-Nacherstattungsverfahren oder nach Anpassungen über die 217f oder 84 Abs. 5 SGB V. Diesem Vorschlag entgegenzuhalten ist, dass die Prävalenzangaben in den Nutzendossiers der Hersteller teilweise erheblich variierten oder nur als Spannweiten berichtet werden (können), was Umsatzvolumenvereinbarungen erschweren würde. 37 Zuletzt ist auch die Möglichkeit einer differenzierten Therapieempfehlung mit Reflektion im Preismodell zu diskutieren. Eine solche zuletzt von Seiten des GKV-Spitzenverbandes vorgeschlagene Variante sieht eine nutzenorientierte Erstattung vor. Darunter fällt, dass unterschiedliche Preise je Subgruppen-Zusatznutzen zu verhandeln wären. Auch könnten Subgruppen ohne den Nachweis eines Zusatznutzens ganz von der Erstattungsfähigkeit ausgenommen werden. 38 Aus Kassenperspektive ließe sich so sicherstellen, Modell Preis-Volumen-Verträge Modell nutzenorientierte Erstattung BT-Drs. 18/2673, S. 9. Vgl. für grundlegende Überlegungen: Eichler et al. (213). Staeck (215), S. 48. Ärzte Zeitung (215a).
166 146 Ergebnisse der Erstattungsbetragsverhandlungen 4 dass höhere Erstattungsbeträge unmittelbar dem Zusatznutzenergebnis folgen und keine Quersubventionierung der Anwendung bei fehlendem Zusatznutzenbeleg erfolgt. Allerdings sind Umsetzungsschwierigkeiten indikationsspezifischer Preise je Arzneimittel nicht auszuschließen (Kodierung und Dokumentation, Abrechnung in der Apotheke, Datenschutz). 39 Allen Lösungsansätzen gemein ist, dass die alleinige Verordnungsentscheidung beim Arzt verbleibt. Um zu einer fundierten und sachlichen Entscheidung über den indikationsspezifischen Einsatz neuer Arzneimittel zu kommen, muss jedoch seine Informationsgrundlage verbessert werden. Eine Einspielung der Informationen aus der frühen Nutzenbewertung in die Praxisinformationssysteme (PVS) ist hierfür zwingend erforderlich und vonseiten des Gesetzgebers auch vorgesehen ( 13b Abs. 2 S. 2). Fraglich sind der sinnvolle Informationsgrad sowie die Praxistauglichkeit der Informationen aus der Beschlussfassung und der Arzneimittelrichtlinie. Neben der Nutzenbewertungsergebnisse erscheint es im Kontext derzeitiger Diskussionen sinnvoll, zukünftig insbesondere Informationen zur Wirtschaftlichkeitsorientierung in differenzierten Therapiegebieten strukturierter in die ärztliche Praxis zu leiten. Auch ist eine kürzere Aktualisierung der PVS anzustreben (bislang alle drei Monate; zukünftig z. B. alle zwei Wochen), da sich Preis- und Produktinformationen in einem kurzen Zeitraum ändern. 31 Weitere Diskussionen zwischen den Systembeteiligten unter Einbezug der Ärzteschaft sind hierzu dringend erforderlich. Insbesondere eine Klarstellung zur Zukunft des Mischpreises ist zeitnah zu erwarten. Auswirkungen entsprechender Unsicherheiten bedürfen einer zeitnahen rechtlichen Klarstellung, da sie konkrete vermeintlich ungewünschte 311 Auswirkungen auf das Versorgungsgeschehen haben. Wichtig ist, dass jedwede Weiterentwicklung der Mischpreisbildung die Flexibilität in der Preisverhandlung erhalten muss. Dies beutetet, dass nach einer Neuordnung der Erstattungsbetragssystematik gewährleitet sein muss, dass ein neuer Wirkstoff auch in einer Subgruppe ohne vom G-BA attestierten Zusatznutzen verordnet werden kann, um Änderungen im Wissen über neue Therapieverfahren und ein breites Spektrum verfügbarer Behandlungsoptionen nicht ex ante auszuschließen Schaufler, Telschow (215), S. 233f. Laschet (214). Der ehemalige unparteiische Vorsitzende des G-BA spricht in diesem Zusammenhang von Kolleteraleffekten. Siehe Hess (215).
167 4 Ergebnisse der Erstattungsbetragsverhandlungen Literatur Apotheke adhoc (213): Von Preisen, Abschlägen, Rabatten und Spannen. Apotheke adhoc online vom Apotheke adhoc (214): Hecken verteidigt Fycompa-Beschluss. Apotheke adhoc online vom Apotheke adhoc (215): Preisverhandlungen. Anoro günstiger als Kombi- Therapie. Apotheke adhoc online vom Arznei-Telegramm (213): AMNOG-Rabatte in Relation zu Vergleichstherapie und Zusatznutzen. Arznei-Telegramm; 44: Arznei-Telegramm (215): Weiterhin Mondpreis für Hepatitis-C-Mittel Sofosbuvir (Sovaldi) Die Mär von 27% Preisnachlass. Arznei-Telegramm; 46: Ärzteblatt (215a): Hepatitis C-Therapie: Preis von Sovaldi sinkt um 27 Prozent. Ärzteblatt vom Ärzteblatt (215b): Die Preise orientieren sich daran, was der Markt bereit ist zu zahlen. Ärzteblatt vom Ärzteblatt (215c): 5 Fragen an Jürgen Windeler: Es gibt Studien, die Fragen beantworten, die niemanden interessieren. Ärzteblatt online vom Ärzteblatt (215d): Kaufmännische Krankenkasse warnt vor steigenden Arzneimittelausgaben. Ärzteblatt online vom Ärzte Zeitung (214): Hecken attackiert Kassen: Preisverhandlungen gleichen Lotterie. Ärzte Zeitung online vom Ärzte Zeitung (215a): Kassen wollen Geld dem Nutzen folgen lassen. Ärzte Zeitung online vom Ärzte Zetung (215b): Experten: G-BA-Infos besser aufbereiten. Ärzte Zeitung online vom Bayerischer Pharmagipfel (215): Gemiensame Erklärung des bayerischen Pharmagipfels vom Bayerisches Staatsministerium für Gesundheit und Pflege sowie bayerisches Staatsministerium für Wirt-schaft und Medien, Energie und Technologie im Dialog mit Vfa. VBCI, BPI und progenerika. Bode C, Haas A, Tebinka-Olbrich A (214): Ein ideales Paar: Erstat-tungsbeträge und Festbeträge zur Regulierung von Arzneimittelpreisen. G+S, 3/214: Borsch J (215): Hersteller verlängert Übergangsfrist für Tresiba. DAZ-online vom BPI Bund der Pharmazeutischen Industrie e.v. (215): Fünf Jahre AM- NOG-Beschluss des Bundestages / Positiv bewertete Arzneimittel errei-chen Patienten unzureichend / Jedes fünfte bewertete Arzneimittel geht vom Markt / Anteil der in Deutschland nicht eingeführten Arzneimittel stark gestiegen. Pressemitteilung vom BT-Drucksache 17/2413 vom : Entwurf eines Gesetzes zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung (Arzneimittelmarktneuordnungsgesetz AMNOG) (BT- Drucksache 17/2413). BT-Drs. Bundesttagsdrucksache 18/2673 vom : Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Kathrin
168 148 Ergebnisse der Erstattungsbetragsverhandlungen 4 Vogler, Sabine Zimmermann (Zwickau), Azize Tank, weiterer Abgeordneter und der Fraktion DIE LINKE. Drucksache 18/251 Die sogenannte 1-Dollar-Pille Sovaldi. Busse R, Panteli D, Henschke C (215): Arzneimittelversorgung in der GKV und 15 anderen europäischen Gesundheitssystemen. Ein systematischer Vergleich. Working papers in health policy and management, Band 11. Cassel D, Ulrich V (215a): AMNOG auf dem ökonomischen Prüfstand. Funktionsweise, Ergebnisse und Reformbedarf der Preisregulierung für neue Arzneimittel in Deutschland. Gutachten für den Bundesverband der Pharmazeutischen Industrie e.v. (BPI) vom Cassel D, Ulrich V (215b): AMNOG das Bermuda-Dreieck der GKV-Arzneimittelversorgung: Warum kommen Innovationen gar nicht oder erst verspätet beim Patienten an? IMPLICONplus 1/215. Claxton K, Sculpher M, Carroll S (211): Value-based pricing for pharmaceuticals: Its role, specification and prospects in a newly devolved NHS. CHE Research Paper 6. Centre for Health Economics, University of York. DDG Deutsche Diabetes Gesellschaft (215): Nach dem Aus für das Insulin degludec: Diabetesorganisationen raten Patienten zu häufigen Messungen in der Umstellungsphase. Pressemitteilung vom DGfE Deutschen Gesellschaft für Epileptologie (213): Empfehlungen der Deutschen Gesellschaft für Epileptologie (DGfE) für die Nutzenbewertung und den praktischen Einsatz neu zugelassener Antiepileptika (AED) vom DGfE Deutschen Gesellschaft für Epileptologie (215): Vergebene Therapiechancen für Epilepsiepatienten. Pressemitteilung vom URL: auth/cache/val_blob/514/514/138/alle-unterlagen-pdf- 213-Amnog.pdf (Stand: ). Dryden WA (215): Ergebnisse der Nutzenbewertung für den Verordnungsalltag der Vertragsärzte. Vortrag 5 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin. Eichler HG, Bloechl-Daum B, Brasseuer D, Breckenridge A, Leufkens H, Raine J, Salmonson T, Schneider CK, Rasi G (213): The risks of risk aversion in drug regulation. Nature reviews drug discovry; 12: Ehlers APF, Erdmann A (214): Wie genau muss sich der verordnende Arzt mit den Regelungen des AMNOG auseinandersetzen? Deutsche Medizinische Wochenschrift; 139: Erler A, Beyer M, Muth C, Gerlach FM, Brennecke (29): Garbage in Garbage out? Validität von Abrechnungsdiagnosen in hausärztlichen Praxen. Gesundheitswesen; 71: Frick M (215): AMNOG-Subgruppen versus wirtschaftliche Verordnungsweise aus Sicht der Industrie. Vortrag 4 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin.
169 4 Ergebnisse der Erstattungsbetragsverhandlungen 149 Frick M, Bungenstock J (215): Problem AMNOG-Governance: macht ohne Gewaltenteilung, in: Wille E (Hrsg.): Verbesserung der Patientenversorgung durch Innovation und Qualität. 19. Bad Orber Gespräche über kontroverse Themen im Gesundheitswesen. PL Academic Research, Frankfurt a.m. Fricke A (215): Fünf Jahre AMNOG Diese vernichtende Bilanz zieht die Industrie. Arzte Zeitung online vom G-BA Gemeinsamer Bundesausschuss (214): Hunderster Wirkstoff in der frühen Nutzenbewertung steht an. Pressemitteilung vom Gerbsch N (215): AVR 214 fragwürdige Daten. AMNOG 215 neue Daten. Erkenntnisse zum Barriere-Effekt des AMNOG. Präsentation des stv. Hauptgeschäftsführers des Bundesverbandes der Pharmazeutischen industrie e.v.. Giersiepen K, Pohlabeln H, Egidi G, Pigeot (27): Die ICD-Kodierqualität für Diagnosen in der ambualnten Versorgung. Bundesgesundheitsblatt; 5: GKV-Spitzenverband (214): 1 Handlungsfelder für Qualität und Finanzierbareit der Arzneimittelversorgung. Positionspapier des GKV- Spitzenverbandes vom SKV-Spitzenverband, Berlin. GKV-Spitzenverband: Erstattungsbetrag für Arzneimittel zur Kontrolle des Phosphatspiegels für dialysepflichtige Patienten vereinbart. Pressemitteilung vom , Berlin. Glaeske G, Ludwig WD, Thürmann P (215): Innovationsreport 215. Wissenschaftliche Studie zur Versorgung mit innovativen Arzneimitteln Eine Analyse von Evidenz und Effizienz. SOCIUM, Bremen. Greiner W, Witte J (215): AMNOG-Report 215. Nutzenbewertung von Arzneimitteln in Deutschland. Medhochzwei Verlag, Heidelberg. Grüne D (214): Umsetzung der aktuellen Gesetzgebung für Arzneimittel und Blick auf die weitere Legislaturperiode. Vortrag im Rahmen der Ta-gung Kollegium Medizin und Recht vom Haas A (214): Drei Jahre für Nutzenbewertung Zwischenbilanz und Anspruch. Statement des GKV-Spiutzenverbandes vom , Berlin. URL: AMNOG-Fachtagung-G-BA_Haas.pdf (Stand: ). Haas A, Tebinka-Olbrich A (214): Nutzenorientierte Medikamentenpreise das Arzneimittelmarktneuordnungsgesetzt AMNOG; in: Pfeiffer D, v. Stackelberg JM, Kiefer G: GKV-Lesezeichen 214. Neues bewerten Bewährtes erneuern. Beiträge zur Gesundheits- und Pflegepolitik. GKV-Spitzenverband, Berlin. Haas A, Tebinka-Olbrich A (215): Das Wirtschaftlichkeitsgebot im Einzelfall und der Mischpreis. Vortrag 2 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Im-pulse, Heft 1: Springer Medizin. Hermann C (215): Zentrale versus dezentrale Preisverhandlungen bei Arzneimitteln, in: Wille E (Hrsg.): Verbesserung der Patientenversorgung durch Innovation und Qualität. 19. Bad Orber Gespräche über kontroverse Themen im Gesundheitswesen. PL Academic Research, Frankfurt a.m.
170 15 Ergebnisse der Erstattungsbetragsverhandlungen 4 Hess R (215): Das AMNOG im Rückblick: Kostenbremse mit Kollateraleffekt. Vortrag 1 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Sprin-ger Medizin. Hill A, Khoo S, Fortunak J, Simmons B, Ford N (214): Minimum Costs for Producing Hepatitis C Direct-Acting Antivirals for Use in Large-Scale Treatment Access Programs in Developing Countries. Clinical Infectious Diseases; 58 (7): Hoppe A, Braun L, Nohlen M (215): OPG Spezial: Wie das AMNOG besser wird. Sonderausgabe, Mai 215. Höer A, Chen X (215): AMNOG-Reporting, in: Häussler B, Höer A, de Millas C (Hrsg.): Arzneimittel-Atlas 215. IGES Institut GmbH, Berlin. IFA Informationsstelle für Arzneimittelspezialitäten (215): Richtlinien zum Artikelstatus und Statuswechsel vom URL: (Stand: ). Kaesbach W (215): Erstattungsbeträge nach AMNOG. Mischpreise und Regressanträge bei negativ bewerteten Subgruppen. Vortrag im Rahmen des 77. Workshop Pharmakotherapieberatung vom Kassen-ärztliche Vereinigung Sachsen, Leipzig. Kassenärztliche Vereinigung Bayern (214): Arzneimittelvereinbarung Wirkstoffziele ab 214. Rundschreiben vom Kassenärztliche Vereinigung Nordrhein (215): Vereinbarung über das Arznei- und Verbandmittelausgabenvolumen für das Kalenderjahr 215. URL: (Stand: ). Kassenärztliche Vereinigung Sachsen (215): Frühe Nutzenbewertung nach 35a SGB V was müssen Vertragsärzte bei der Verordnung von Arzneimitteln mit neuen Wirkstoffen berücksichtigen? URL: (Stand: ). KBV Kassenärztliche Bundesvereinigung (214): KBV inofrmiert Ärzte über Ergebnisse der frühen nutzenbewertung. Praxisnachrichten vom URL: (Stand: ). Kleinfeld A, Luley C (214): Durchsetztung innovativer Wirkstoffe nach der frühen Nutzenbewertung. Monitor Versorgungsforschung; 2/214: KVWL Kassenärztliche Vereinigung Westfalen-Lippe (212): Informationen zu Verordnungen in der GKV. Frühe Nutzenbewertung nach 35a SGB V. Stand: Juni 212. URL: (Stand: ). KVWL Kassenärztliche Vereinigung Westfalen-Lippe (215): Frühe Nutzenbewertung: Erfahrungen nach vier Jahren. Mai 215. URL: fruehe_nutzenbewertung_rueckblick_invo.pdf (Stand: ). LangHeinrich W (215): Die Behandlung der chronischen Hepatits C bei erwachsenen patienten. Neue Therapieschemata und wirtschaftliche Verorndung. KVH aktuell; 2 (1): 4-7.
171 4 Ergebnisse der Erstattungsbetragsverhandlungen 151 Laschet H (214): Der Arzt erhält wertvolle Informationen. Ärzte Zeitung vom Laschet H (215): Subgruppen und Mischpreis. Ärzte fühlen sich verunsichert. Ärzte Zeitung vom Ludwig WD, Schildmann J (215): Kostenexplosion in der medikamentösen Therapie onkologischer Erkrankugnen. Ursachen, Lösungsansätze und medizinethische Herausforderungen. Der Onkologe; 21: Osterloh F (215): Neue Arzneimittel Kaum Praxisbesonderheiten. Deutsches Ärzteblatt; 112 (33-34): A136. O.V. (214): Hecken und Broich kritisieren Systemfehler. Pharma-Fakten vom URL: (Stand: ). O.V: (215): Gilead Sciences GmbH begrüßt vorzeitige Einigung zum Erstattungsbetrag für Harvoni mit dem GKV Spitzenverband. Aktiencheck-online vom URL: (Stand: ). Postina T (214): Ruf nach Innovationen bleibt ungehört. Pharm. Ind.; 76 (11): Richard S (215): Pillen am Ende der Preisspirale. Gesundheit und Gesellschaft; 18 (5/15): Schaufler J, Telschow C (215): Ökonomische Aspekte des deutschen Arzneimittelmarktes 214; in: Schwabe U, Paffrath D (Hrsg.): Arzneiverordnungsreport 2915, Springer-Verlag, Berlin-Heidelberg. Schlenger R (215): Epilepsie und AMNOG. Gefährdet die Nutzenbewertung die Patientenversorgung? DAZ-online vom Schwabe U (214): Drei Jahre Nutzenbewertung von neuen Arzneimitteln gemäß AMNOG, in: Schwabe U, Paffrath (Hrsg.): Arzneiverordnungsreport 214. Springer-Verlag, Heidelberg, Berlin. Simon KG (215): Gibt es Sicherheit vor Regressen in der Verordnung der Hepatits-C-Therapie? HepNet Journal; Sonderausgabe (9), März 215: Staeck F (215): Einigkeit gibt es über den Reformbedarf, nicht über die Inhalte. Zusammenfassung der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin. Sucker-Sket K (214): Bestellung und Abrechnung Verwirrung um Fycompa. DAZ-online vom Sucker-Sket K (215a): Techniker Krankenkasse schlägt Geheimvarian-te vor. DAZ-online vom Sucker-Sket K (215b): Frühere Familienministerin mit Herz für Pharmabranche. DAZ-online vom Sucker-Sket K (215c): Perampanel Kostenfreies Import-Programm für Fycompa läuft aus. DAZ-online vom
172 152 Ergebnisse der Erstattungsbetragsverhandlungen 4 TK Techniker Krankenkasse (215): Vorschläge zur Weiterentwicklung des AMNOG. URL: (Stand: ). Vfa Verband der forschenden Arzneimitelhersteller (215): Deutsch-land: Defizite in der Versorgung trotz sinkenden Preisniveaus. Presse-mitteilung vom Wasem J, Weegen L, Bauer C, Walendzik A, Grande F, May U (215): Regulatorische Handhabung der selektiven Erstattung von Arzneimitteln in den ausgewählten Ländern England, Niederlande, Frankreich und Schweden. IBES Diskussionsbeitrag Nr. 211; August 215. Wild P (215): Arzneimittelversorgung der Privatversicherten 213. Zahlen, Analysen, PKV-GKV-Vergleich. Wissenschaftliches Institut der PKV, Köln. Ziegler J (215): TK kritisiert Novo Nordisk für Marktrücknahme. DAZ-online vom
173 153 5 Ergebnisse der Schiedsverfahren 5.1 AMNOG-Schiedsstelle Quo vadis? Die Schiedsstelle tritt in Aktion, wenn sich Unternehmer und GKV- SV im Rahmen der Preisverhandlung nach erfolgter Nutzenbewertung nicht einigen können. Kommt es innerhalb von 6 Monaten zu keiner Einigung, setzt die Schiedsstelle innerhalb von drei Monaten den Vertragsinhalt fest und entscheidet damit insbesondere über die Höhe des Erstattungsbetrages ( 13b Abs. 4 SGB V). Die Schiedsstelle wird ferner aufgerufen, wenn eine Vereinbarung zwischen dem GKV-Spitzenverband und einem pharmazeutischen Unternehmen oder ein Schiedsspruch von einer Vertragspartei gekündigt worden ist. Vom Urteilsbereich der Schiedsstelle ausgenommen sind Entscheidungen über Vertragsteile, über die sich die Verhandlungspartner bereits geeinigt haben bzw. Entscheidung über Fragen, die durch Beschluss des G-BA bereits entschieden sind. Die Schiedsstelle nimmt folglich keine Korrekturen an Feststellungen des G-BA vor. Dies obliegt dem zuständigen Landessozialgericht Berlin-Brandenburg im Klageverfahren. Eine Klage hat in diesem Fall jedoch keine aufschiebende Wirkung. Dies sichert die sofortige Umsetzung des Schiedsspruchs und verhindert, dass ein Rechtsmittel allein deshalb eingelegt wird, um die Rechtswirkung der Entscheidung zu Lasten der Wirtschaftlichkeit der Arzneimittelversorgung in der gesetzlichen Krankenversicherung zu verzögern. Alternativ zur Klage kann ein Antrag auf Kosten-Nutzen-Bewertung nach 35b SGB V gestellt werden (was allerdings bislang noch nie vorgekommen ist). Der eigentliche Beschluss ist erst nach einem Jahr kündbar, außer es kommt zu einem erneuten G-BA-Beschluss nach 35a oder 35b SGB V. Die zwingende Dreimonatsfrist für Entscheidungen über Erstattungsvereinbarungen verlangt eine straffe Durchführung des Schiedsverfahrens. Es gilt Dispositionsfreiheit der Verhandlungspartner, d. h. die Parteien können jederzeit, also während des oder nach Ergehen des Schiedsspruchs eine abweichende Vereinbarung treffen. Bereits im AMNOG-Report 215 haben wir auf die hohe Anzahl jener Schiedsverfahren hingewiesen, die nicht mit einem Kompromiss, sondern mit einer Marktrücknahme seitens des Herstellers endeten. Im Sommer 215 wurde die AMNOG-Schiedsstelle turnusmäßig neu besetzt. Sie wird künftig von Professor Jürgen Wasem als Vorsitzenden und seinem Stellvertreter Herbert Rische geleitet. Aber schon die Besetzung der neuen Schiedsstelle offenbarte Konfliktpotential. Weder für die Besetzung des Vorsitzenden noch für den Stellvertreter gab es einen Konsens; sie mussten per Losverfahren gewählt werden. Die erstmalige Besetzung der Schiedsstelle im
174 154 Ergebnisse der Schiedsverfahren 5 Jahr 211 erfolgte noch einvernehmlich zwischen den maßgeblichen Verbänden. 312 Geloste Kandidaten sind nicht vier, sondern nur ein Jahr im Amt. Verhandlungen über die grundsätzliche Ausrichtung der Schiedsstelle gehen also spätestens 216 weiter. 313 Tabelle 17: Mitglieder der AMNOG-Schiedsstelle 215 Unparteiischer Vorsitzender Unparteiische Mitglieder Unparteiische Mitglieder 1. Besetzung Prof. Wasem Prof. Fricke Dr. Reichelt Stellvertreter Dr. Rische Prof. Nagels Dr. Hansen Stellvertreter Schulte Dr. Riederer Kaesbach Die folgenden drei Gastbeiträge sollen aus unterschiedlicher Perspektive der Beteiligten die bisherige Arbeit sowie die zukünftige Rolle der Schiedsstelle im AMNOG-Verfahren näher beleuchten. Dabei wird zunächst ein Vertreter der Schiedsstelle, dann Vertreterinnen des Spitzenverbandes der Krankenkassen und schließlich ein Vertreter der pharmazeutischen Industrie aktuelle und absehbare Problemlagen bei den Verhandlungen der Schiedsstelle erläutern GKV-SV (211). Sucker-Sket (215).
175 5 Ergebnisse der Schiedsverfahren Vier Jahre AMNOG-Schiedsstelle ein kritischer Überblick Gastbeitrag von Gerhard Schulte Stellvertretender Vorsitzender der Schiedsstelle AMNOG Die AMNOG-Schiedsstelle hat sich zum 1. Juli 211 konstituiert. Bis zum Ablauf der Amtszeit der von den Trägerverbänden bestellten Mitglieder am 3. Juni 215 wurden 24 Verfahren eingeleitet. 8 Verfahren wurden vor der mündlichen Verhandlung von den beteiligten Vertragspartnern nach Einigung für erledigt erklärt. 16 Verfahren wurden durch Schiedsspruch abgeschlossen. Davon betrafen 2 Verfahren die Rahmenvereinbarung nach 13b Abs. 9 SGB V und 14 Verfahren die Festsetzung des Vertragsinhalts von neuen Arzneimitteln. Gegen 12 Entscheidungen der Schiedsstelle wurden Rechtsmittel beim zuständigen Landessozialgericht (LSG) Berlin-Brandenburg eingelegt, davon 3 Anträge auf einstweiligen Rechtsschutz mit dem Ziel, die aufschiebende Wirkung einer Klage gegen den Schiedsspruch wieder herzustellen. Die 3 Anträge wurden abgewiesen. In einem Fall wurde ein Antrag auf Aufhebung des Beschlusses des LSG gestellt, über den noch nicht entschieden ist. Eine Klage betrifft die Rahmenvereinbarung. Eine Klage gegen die Festsetzung des Vertragsinhalts wurde zurückgenommen. In keinem der verbleibenden 8 Rechtsstreite hat bis Mitte November 215 eine mündliche Verhandlung stattgefunden. Die erste Klage wurde am eigereicht. 8 von 12 Herstellern haben nach der Entscheidung der Schiedsstelle opt-out gewählt. Rechtliche Grundlagen für Schiedssprüche Nach ständiger Rechtsprechung des Bundessozialgerichts sind Beschlüsse der Schiedsstelle vertragsgestaltende Verwaltungsakte (z. B. BSG vom B 3 P 19/ R). Es gelten insoweit die Regelungen der 31 ff SGB X über den Verwaltungsakt. Die gerichtlichen Kontrollmöglichkeiten eines Schiedsspruchs sind eingeschränkt (BSG vom B 3 P 7/8 R). Der Gesetzgeber hat die Schiedsstelle als weisungsfreies, mit den Vertretern der Interessen der betroffenen Vertragsparteien besetztes Konfliktlösungsgremium ausgestaltet. Der Schiedsstelle steht deshalb für ihre Bewertungen und Beurteilungen eine Einschätzungsprärogative zu, sodass bei Schiedsstellenentscheidungen ausschließlich zu prüfen ist, ob
176 156 Ergebnisse der Schiedsverfahren 5 1. die Ermittlung des Sachverhalts in einen fairen Verfahren unter Wahrung des rechtlichen Gehörs erfolgt ist, 2. zwingendes Gesetzesrecht beachtet ist, 3. der bestehende Beurteilungsspielraum eingehalten worden ist und 4. der Schiedsspruch mit einer hinreichenden Begründung versehen ist. Im Verwaltungsverfahren gilt zwar grundsätzlich der Untersuchungsgrundsatz, aufgrund der kurzen Dreimonatsfrist für das gesamte Verfahren vor der Schiedsstelle darf diese aber unstreitige Positionen der Vertragsparteien ohne weitere Prüfung ihrer Entscheidung zu Grunde legen. Die Entscheidungen der AMNOG- Schiedsstelle werden nicht veröffentlicht, sind aber in der Geschäftsstelle einsehbar. Nicht zur Verfügung stehen die konkretisierenden Anträge der Vertragsparteien, sodass sich allein aufgrund der Beschlussbegründung in einigen Fällen der Sachverhalt nicht vollständig erschließt. Die folgende Erörterung der Beschlüsse der Schiedsstelle beschränkt sich auf tatsächliche und rechtliche Fragen der Entscheidungsfindung. Eine Bewertung der medizinischen Grundlagen der vorausgehenden Beschlüsse des Gemeinsamen Bundesausschusses (G-BA) ist ohnehin nicht Auftrag der Schiedsstelle. Schiedsspruch vom (Wirkstoff Bromfenac) Das pharmazeutische Unternehmen (pu) hat trotz Aufforderung durch den G-BA kein Dossier vorgelegt, da es der Auffassung war, wegen der Geringfügigkeit der Ausgaben für die Gesetzliche Krankenkasse (GKV) hierzu nicht verpflichtet zu sein. Gemäß 35a Abs. 1 Satz 5 SGB V gilt ein Zusatznutzen in solchen Fällen als nicht belegt. Der G-BA hat auf eine Beauftragung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) zur Nutzenbewertung verzichtet und eine eigene Nutzerbewertung mit dem gesetzlich vorgesehenen Ergebnis veröffentlicht. Weiterhin hat er die zweckmäßige Vergleichstherapie (zvt) und deren Jahrestherapiekosten sowie die Zahl der Behandlungsfälle bestimmt. Die zentrale Frage für die Schiedsstelle war: wie weit reicht die Entscheidungskompetenz des G-BA im Nutzenbewertungsbeschluss, wenn kein Dossier vorliegt. Die Schiedsstelle hat in Übereinstimmung mit der Gesetzesbegründung zu 35a Abs. 1 SGB V festgestellt: ein fehlendes Dossier hat nicht zur Folge, dass die Ermittlung der Jahrestherapiekosten vom G-BA auf die Vertragsparteien oder die Schiedsstelle übergeht. Dies hätte andernfalls eine umfangreiche Ermittlung der Evidenz bzw. eine Beweisaufnahme unter Zuziehung von medizinischen Sachverständigen erfordert, wozu schon
177 5 Ergebnisse der Schiedsverfahren 157 die Dreimonatsfrist nicht ausreiche. Der G-BA könne neben der Nutzenbewertung auch in diesem Fall Folgeentscheidungen treffen. In diesem Kontext hat die Schiedsstelle auch erstmalig bestätigt, dass die Feststellungen des G-BA zu Jahrestherapiekosten für Vertragsparteien und Schiedsstelle bindend sind, sowie die Heranziehung des zum Zeitpunkt des Beschlusses wirtschaftlichsten Präparats als zvt nicht zu beanstanden ist. Eine entsprechende gesetzliche Klarstellung trat erst zum in Kraft. Schiedsspruch vom (Wirkstoff Retigabin) Der Originalhersteller hat den Wirkstoff zum in Verkehr gebracht und nach dem Nutzenbewertungsbeschluss des G-BA vom vom Markt genommen. Der verfahrensbeteiligte Importeur hat den Wirkstoff zum erneut in Kenntnis der Bewertung in Verkehr gebracht. Der G-BA hatte den Zusatznutzen im Verhältnis zur zvt als nicht belegt bewertet, da erforderliche Nachweise nicht vollständig vorgelegt wurden. Weiterhin hatte der G-BA die zvt in zwei Varianten, deren Jahrestherapiekosten und die Zahl der für eine Behandlung in Betracht kommenden Patienten bestimmt. Die Verhandlungen über den Erstattungsbetrag zwischen GKV-Spitzenverband (GKV-SV) und Importeur wurden von letzterem abgebrochen und das Arzneimittel zum außer Verkehr gesetzt. Der Importeur beantragte bei einem aktuellen Abgabepreis von 62,62 einen Erstattungsbetrag von 54,2, der GKV-SV einen Erstattungsbetrag von 6,3. Der Antrag des GKV-SV orientierte sich an den Jahrestherapiekosten der zvt, der Antrag des Importeurs an den Einkaufspreisen des Bezugslandes Österreich. Die Schiedsstelle musste sich zunächst mit der Bindungswirkung der Rahmenvereinbarung für Importeure befassen, da nach Auffassung des pu die Spitzenorganisation der Parallelimporteure bei der Festlegung hätte beteiligt werden müssen, was nicht der Fall war. Die Schiedsstelle ordnete zu Recht die Rahmenvereinbarung als öffentlich-rechtlichen Rahmenvertrag ein, der auch weitere vom Gesetz vorgesehene Adressaten bindet. Zur vom GKV-SV beantragten Höhe des Erstattungsbetrages trug der pu vor, dass ein Rabatt von 9 % ein enteignungsgleicher Eingriff im Sinne der Art. 14 und 12 Grundgesetz, zudem sittenwidrig und nach 138 Abs. 2 BGB nichtig sei. Außerdem sei Kartellrecht anzuwenden, da der GKV-SV ein marktbeherrschendes Unternehmen sei. Die Schiedsstelle stellte zur Frage der Anwendung des Kartellrechtes klar, dass die Ausnahme des 69 Abs. 2 Satz 2 SGB V greife, da es sich hier um Verträge handele, zu deren Abschluss die Parteien verpflichtet sind. Das beziehe sich auch auf den Vertragsinhalt und die Höhe der Erstattung.
178 158 Ergebnisse der Schiedsverfahren 5 Die Schiedsstelle hat dem Antrag des GKV-SV zur Höhe des Erstattungsbetrages entsprochen, da er die Verhandlungsobergrenze beachtet habe. Zudem sei es korrekt, die unterschiedlichen Dosierungen der beiden Wirkstoffe der zvt zu mitteln und die Verordnungszahlen auf der Grundlage von Daten nach 217f Abs. 7 SGB V zu verwenden. Das Gültigkeitsdatum des Erstattungsbetrages ist der , da die einjährige freie Preisbildung entsprechend 4 Abs. 8 der Rahmenvereinbarung nur einmalig gilt. Der Importeur hat in Kenntnis der Ausgangslage ein Risiko mit dem erneuten Inverkehrbringen des Wirkstoffes offensichtlich bewusst in Kauf genommen. Seine Argumentation mit Hinweis auf Einkaufspreise im Ausland konnte bei einem Arzneimittel ohne Zusatznutzen nicht tragen, ebenso wenig wie seine Auffassung, die Rahmenvereinbarung sei wegen Nichtbeteiligung des Verbandes der Importeure nicht anwendbar. Bedenklich erscheint zu diesem Zeitpunkt allerdings die Einführung von Daten nach 217f Abs. 7 SGB V, also der Morbi-RSA Daten, die dem pu zur Überprüfung nicht zur Verfügung standen. Die Schiedsstelle hat diesen Sachverhalt mit einer späteren Entscheidung zur Rahmenvereinbarung korrigiert. Schiedsspruch vom (Wirkstoff Cannabis Sativa) Die Schiedsstelle hat sich hier erstmals mit einem Arzneimittel mit Zusatznutzen befasst. Der G-BA hat einen Anhaltspunkt für einen geringen Zusatznutzen aufgrund der Linderung der krankheitsbedingten Symptome (MS) bei 4 bis 75 % der Patienten festgestellt. Er hat als zvt sechs Arzneimittel mit Jahrestherapiekosten zwischen 65,99 und 834,39 bestimmt und wegen unsicherer Datenlage eine Befristung von drei Jahren festgelegt. Um einen angemessen Erstattungsbetrag bei einem Arzneimittel mit Zusatznutzen zu ermitteln, sieht 13b SGB V i. V. m. 6 der Rahmenvereinbarung drei Kriterien vor: Den Zusatznutzen entsprechend der Nutzenbewertung des G-BA gemäß 35a Abs.3 SGB V, die Jahrestherapiekosten vergleichbarer Arzneimittel und die tatsächlichen Abgabepreise in anderen europäischen Ländern gemäß 13b Abs. 9 Satz 3 SGB V. Das Gewicht der drei Kriterien in einer Gesamtbewertung zur Ermittlung eines angemessenen Erstattungsbetrages ist im Gesetz nicht festgelegt und liegt im Ermessen der Vertragsparteien bzw. der Schiedsstelle. Die Schiedsstelle hat hier erstmals festgelegt, dass das Hauptkriterium für die Ermittlung des Erstattungsbetrages der vom G-BA festgestellte Zusatznutzen im Verhältnis zur zvt sein muss. Zur Ermittlung der Jahrestherapiekosten eines jeden der sechs Arzneimittel der zvt hat der GKV-SV auf den Jahresverbrauch der definierten Tagesdosen (DDD) zurückgegriffen und dadurch die mittleren Ausgaben der GKV in diesem Anwendungsgebiet bestimmt. Die
179 5 Ergebnisse der Schiedsverfahren 159 Schiedsstelle hat sich das aus der Tabelle 18 ersichtliche Ergebnis von 154, für seine Entscheidung zu eigen gemacht. Tabelle 18: Arzneimittel mit geringem Zusatznutzen Kombinationspräparat: Die zweckmäßige Vergleichstherapie Arzneimittel Jahresverbrauch definierter Tagesdosen je Patient (amtliche DDD)* Durchschnittliche Jahrestherapiekosten je Patient auf Ebene des ApU (amtliche DDD**) Anteil behandelter Patienten (%)* Anteil Preis je Arzneimittel auf Ebene des ApU 1*** 365 DDD (5 mg oral) DDD (125 mg oral) 89,6 6 53,44 475,96 1 4,76 3 Keine amtliche DDD vorhanden 1 441,89**** Vom Hersteller nicht berücksichtigt, GKV-SV nimmt 2% an (GamSi- Daten) 8,84 4*** 365 DDD (125 mg oral 5*** 365 DDD (12 mg oral) DDD (,2 g oral) 75,56 3 2,27 9, ,23 263, ,75 Anteilig gemittelte Gesamtkosten der zweckmäßigen Vergleichstherapie auf ApU-Ebene Anteilig gemittelte Gesamtkosten der zweckmäßigen Vergleichstherapie auf ApU-Ebene abzüglich Herstellerabschlag nach 13a Abs. 3b SGB V 168,32 154,18 ApU: Abgabepreis pharmazeutischer Unternehmer; 1 : ersatzweise wird Methode des G-BA-Beschlusses herangezogen; *: Vergl. Herstellerdossier zur Nutzenbewertung; **: bei Unterschieden in der Höhe der Kosten aufgrund unterschiedlicher Wirkstärken wurde die günstigere Packung verwendet. ***: Festbetrag; ****: Mittelwert der Jahrestherapiekosten lt. G-BA-Beschluss auf Ebene des ApU Für die Monetarisierung des Zusatznutzens berücksichtigt der GKV- SV das Ausmaß und die Wahrscheinlichkeit des Zusatznutzens sowie die patientenrelevanten Effekte. Dies führt, wie die Abbildung 27 zeigt, zu einem Zuschlag von 29,, der sich allerdings nicht aus der umfangreichen Darstellung der Position des GKV-SV in der Begründung des Schiedsspruchs nachvollziehen lässt.
180 16 Ergebnisse der Schiedsverfahren 5 Abbildung 27: Arzneimittel mit geringem Zusatznutzen Kombinationspräparat: Monetarisierung des Zusatznutzens Die Jahrestherapiekosten eines vergleichbaren Arzneimittels liegen nach Angaben des pu zwischen 3.96 und Der GKV-SV kommt aufgrund einer anderen Berechnung auf eine Betrag zwischen 1.24 und 1.5, wobei er die erstmalige Implantation einer erforderlichen Pumpe nicht berücksichtigt, sondern nur das Nachfüllen der Pumpe alle sechs Wochen. Die Schiedsstelle übernimmt den vom GKV-SV errechneten Betrag, allerdings mit dem ergänzenden Hinweis, dass das Arzneimittel lediglich bei rund 1 % der betroffenen Patienten eingesetzt werden kann. Die Höhe der tatsächlichen Abgabepreise europäischer Länder hat der GKV-SV, wie aus der Tabelle 19 ersichtlich, berechnet. Der bevölkerungsgewichtete Mittelwert der Jahreskosten von war nicht umstritten.
181 5 Ergebnisse der Schiedsverfahren 161 Tabelle 19: Arzneimittel mit geringem Zusatznutzen Kombinationspräparat: Europäische Preise des Arzneimittels Land Bevölkerung 211* Preis je Packung ( )** Kosten im Jahr Kaufkraftbereinigter Preis je Packung*** Kosten im Jahr Dänemark , ,66 399, , , ,19 443, ,2 Österreich , 5.15,84 439, , , ,38 379, ,26 Spanien , ,67 451, ,1 Maximum 522, ,66 451, ,1 Mittelwert 471, ,55 422, ,28 Minimum 42, ,67 379, ,26 Großbritannien Schweden Bevölkerungsgewichteter Mittelwert 45, ,38 439, ,61 *: Quelle: stat; **: Anlage des Antrags; ***: Für die Kaufkraftbereinigung der Preise werden die Kaufkraftparitäten des Warenkorbes BIP von 211 herangezogen (Stand ) Der GKV-SV kommt bei der Zusammenführung der drei Kriterien mit der Gewichtung 5 % für Zusatznutzen, 3 % für das vergleichbare Arzneimittel und 2 % für europäische Preise, wie aus der Abbildung 28 ersichtlich, zu einem Erstattungsbetrag für die Jahrestherapiekosten von bzw. zu einem Packungspreis von 128,9.
182 162 Ergebnisse der Schiedsverfahren 5 Abbildung 28: Arzneimittel mit geringem Zusatznutzen Kombinationspräparat: Einfluss des Zusatznutzens überbewertet? Der pharmazeutische Unternehmer ermittelt unter Berücksichtigung der dargestellten Unterschiede einen Erstattungsbetrag von 369,6 je Packung. Die Schiedsstelle hat aufgrund der Ausführungen der Patientenvertreterin und der Sachverständigen des pu in der mündlichen Verhandlung eine Verbesserung der Lebensqualität berücksichtigt und deshalb den Zusatznutzen höher als der GKV-SV bewertet. Sie setzte den Erstattungsbetrag auf 15, je Packung fest. Die Ermittlung des Erstattungsbetrages durch den GKV-SV ist bis auf den Zuschlag für den Zusatznutzen nachvollziehbar, die Entscheidung der Schiedsstelle kaum. Zunächst entfernt sich die Schiedsstelle von der fachlichen Bewertung des G-BA in Sachen Lebensqualität. Dann hätte die Schiedsstelle die Jahrestherapiekosten des vergleichbaren Arzneimittels zumindest im Hinblick auf die Kosten der Pumpe hinterfragen müssen, da insoweit keine unstreitige Position der Parteien vorlag. Der Hinweis auf den Einsatz des Arzneimittels bei nur 1 % der Patienten hätte ggf. eine grundsätzliche andere, zu begründende Bewertung erlaubt, nicht aber eine Übernahme der Position des GKV-SV. Wie die drei zu berücksichtigenden Kriterien gewichtet wurden, ist der Begründung nicht zu entnehmen, sodass der Erstattungsbetrag willkürlich erscheint. Bemerkenswert ist auch, dass der mit 5 % gewichtete Anteil des Zusatznutzens in der Berechnung des GKV-SV nur mit 14 % auf den Erstattungsbetrag durchschlägt. Wenn der Zusatznutzen tatsächlich das bestimmende Kriterium sein soll, müsste er wohl deutlich mehr ausmachen.
183 5 Ergebnisse der Schiedsverfahren 163 Schiedsspruch vom (Wirkstoff Vemurafenib) Bewertung des G-BA: Hinweis für einen beträchtlichen Zusatznutzen aufgrund einer moderaten Verlängerung der Überlebensdauer von 9,6 auf 13,2 Monate. Eine Verbesserung der Morbidität ist nicht belegt und der Lebensqualität nicht ableitbar. Nebenwirkungen sind behandelbar. Verhältnis der Jahrestherapiekosten zu zvt: zu Die Zahl der Patienten wird mit ca. 14 angegeben. Die Bewertung ist wegen unsicherer Datenlage befristet. Der GKV-SV hat seinen Antrag für die Ableitung des Erstattungsbetrages wie folgt erläutert: Die ermittelten Zuschläge je patientenrelevanten aggregierten Effekt (Mortalität, Morbidität, Lebensqualität) ergeben einen Gesamtzuschlag für das Zusatznutzenkriterium. Für einen Beleg des Zusatznutzens rechnet er mit einem Faktor 1, für einen Hinweis mit einem Faktor,67 und für einen Anhaltspunkt mit einem Faktor,33. Der GKV-SV kommt so zu einem Wert von für den Zusatznutzen. Die Jahrestherapiekosten eines vergleichbaren Arzneimittels werden mit 85. angegeben. Hierüber besteht Konsens. Der kaufkraftbereinigte, bevölkerungsgewichtete, europäische Preismittelwert wurde mit berechnet. Daraus ergibt sich bei einer Gewichtung der drei Kriterien von 5 zu 3 zu 2 ein Erstattungspreis p. a. von (vgl. Abb. 29). Abbildung 29: Arzneimittel mit beträchtlichem Zusatznutzen Monopräparat: Ableitung des Erstattungsbetrages GKV-Spitzenverband Das pu merkt an, der GKV-SV habe seine Vorstellungen über das Berechnungsverfahren weder transparent gemacht noch validiert. Für seinen Antrag gibt er andere Eckwerte an (vgl. Tab. 2).
184 164 Ergebnisse der Schiedsverfahren 5 Tabelle 2: Arzneimittel mit beträchtlichem Zusatznutzen Monopräparat: Antrag gegen Antrag 1 Abgabepreis pharmazeutischer Unternehmer 12.45, Jahrestherapiekosten der zvt 4.539, Antrag des GKV-Spitzenverbandes Antrag des Herstellers Jahresperspektive , , Je Packung 1.17, , Je DDD 3 158, , 1 : Angebote/alle Werte ohne Ablösung der Herstellerabschläge nach 13a Abs. 1 und 1a SGB V; 2 : Jahresverbrauch 2.92 Einheiten; 3 : 7 Tagesdosen je Packung Die Schiedsstelle hält den berechneten Erstattungsbetragsanteil des GKV-SV für zu niedrig angesetzt, da das tatsächliche Ausmaß des patientenrelevanten Nutzens bei einer Übersetzung in die Patientensphäre zu wenig berücksichtigt sei. Die Schiedsstelle bezieht sich bei dieser Einschätzung auf folgende Hinweise des pu: 6,87 Monate progressionsfreie Zeit das Arzneimittel kann gezielter eingesetzt werden schnelles Therapieansprechen, und folgert daraus einen Zugewinn an qualitativer hochwertiger Lebenszeit. Den Zusatznutzen bewertet sie mit Für die europäischen Vergleichspreise berücksichtigt die Schiedsstelle nur 4 Länder mit einem Durchschnittspreis von Bei der Quotierung von 5 zu 35 zu 15 ergibt sich ein Erstattungspreis p. a. von (vgl. Abb. 3). Abbildung 3: Arzneimittel mit beträchtlichem Zusatznutzen Monopräparat: Ableitung des Erstattungsbetrages Schiedsstelle
185 5 Ergebnisse der Schiedsverfahren 165 Das Berechnungsverfahren des GKV-SV ist auch in dieser Entscheidung, was den Zusatznutzen angeht, nicht nachvollziehbar. Das gleiche gilt für die Preisfindung der Schiedsstelle, die auf einen Betrag aufsetzt, der sich nicht selbst erklärt. Inwieweit abweichende Feststellungen der Schiedsstelle von der medizinischen Bewertung des G-BA möglich sind, bedarf zumindest einer näheren Begründung. Der Ausschluss eines Landes aus den europäischen Vergleichspreisen und die unterschiedliche Gewichtung der drei Kriterien liegen im Ermessen des Schiedsstelle. Von nachgelagertem Interesse ist in diesem Fall, dass sich GKV-SV und pu noch am Tage der Bekanntgabe des Schiedsspruchs auf einen höheren Erstattungsbetrag verständigt haben. Das ist höchst fragwürdig. Der Schiedsspruch ist ein vertragsgestaltender Verwaltungsakt, für den die entsprechenden gesetzlichen Folgen gelten. Zur Wirksamkeit des Verwaltungsaktes bestimmt 39 SGB X: Der Verwaltungsakt wird mit dem Inhalt wirksam, mit dem er bekanntgegeben wird. Und: Ein Verwaltungsakt bleibt wirksam, solange und soweit er nicht zurückgenommen, widerrufen, anderweitig aufgehoben oder durch Zeitablauf oder auf andere Weise erledigt ist. Die Möglichkeit von Rücknahme, Widerruf und Aufhebung liegen nicht im Ermessen der Vertragsparteien, für die der Verwaltungsakt bestimmt ist. Der Gesetzgeber hat eine vorzeitige Erledigung selbst abschließend bestimmt mit der Jahresfrist des 13b Abs. 7 oder der Neubewertung des Zusatznutzens entsprechend 35a Abs. 5 SGB V. Schiedsspruch vom (Wirkstoff Perampanel) Das Arzneimittel, für das nach der Bewertung durch den G-BA ein Zusatznutzen nicht belegt ist, wurde noch während der Verhandlungen mit dem GKV-SV vom pu außer Vertrieb gesetzt. Der G-BA hat als zvt ein Arzneimittel für Monotherapie und ein Arzneimittel für Zusatztherapie bestimmt mit Jahrestherapiekosten zwischen 17 und 42 bzw. 518 und 914. Der GKV-SV hat als Erstattungsbetrag keine Spanne, sondern einen einheitlichen Betrag je Packung ermittelt. Hierzu hat er die unterschiedliche Dosierung gemittelt und die tatsächlichen Verordnungszahlen des Jahres 212 auf der Grundlage von 217 Abs. 7 i. V. m. 268 SGB V (Morbi-RSA Daten) verwendet. Danach werden 92,3 % der Patienten in der Monotherapie und 7,7 % in der Zusatztherapie behandelt. Der GKV-SV kommt nach dieser Methode zu gewichteten Jahrestherapiekosten von 272 (für Monotherapie 246, für Zusatztherapie 589 ). Im Auftrag des pu hat IMS auf der Grundlage von Longitudinal-Daten ermittelt, in welchen durchschnittlichen Dosierungen die beiden Arzneimittel der zvt eingesetzt werden. Das entspricht nach seiner Auffassung deutlich besser dem tatsächlichen Einsatzspektrum des
186 166 Ergebnisse der Schiedsverfahren 5 Arzneimittels. Das pu kommt auf dieser Grundlage zu Jahrestherapiekosten von 414. Die Schiedsstelle hält die GKV Berechnungsmethode für aussagekräftiger, da sie alle nach der Zulassung in Frage kommenden Patienten erfasst. Dem Hinweis des pu, dass seine Methode pharmakoresistente Fälle umfasst, begegnet die Schiedsstelle mit der Feststellung, dass die Zulassung darauf nicht beschränkt ist. Im Ergebnis hat sie sich dem Antrag des GKV-SV angeschlossen, allerdings mit einem etwas höheren Betrag wegen anderer Berechnung des Herstellerabschlags. Die entscheidungsrelevanten Bewertungen der Schiedsstelle liegen unstreitig in seinem Ermessensspielraum. Mit der Frage der angemessenen Ermittlung der Verordnungszahlen und der Transparenz für den pu wird sich die Schiedsstelle noch weiter beschäftigen. Schiedssprüche vom (Wirkstoff Perampanel) Mit dem gleichen Wirkstoff hat sich die Schiedsstelle in zwei Verfahren noch einmal befasst, da dieser von Importeuren nach Marktaustritt des Originalherstellers angeboten wurde. Der Wirkstoff wurde erstmalig am in Verkehr gebracht, sodass die freie Preisbildung am endete. Die Importarzneimittel wurden am in Verkehr gebracht. Durch das 14. SGB V ÄndG wurde mit Wirkung von bestimmt, dass bei gleichem Wirkstoff ein gleicher Erstattungsbetrag gilt ( 13b Abs. 3a Satz 1 SGB V). Folglich musste für die Zeit vom bis zum ein Erstattungsbetrag festgesetzt werden. Die strittigen Fragen waren weitgehend formalrechtlicher Natur. Ein Importeur betrachtete sich nicht als pharmazeutischer Unternehmer und damit auch nicht als tauglicher Partner einer Erstattungsbetragsvereinbarung. Die Schiedsstelle stellte in Übereinstimmung mit der arzneimittelrechtlichen Kommentierung klar, dass bei europaweit zugelassenen Arzneimitteln der Parallelimporteur zusätzlich zum Inhaber der Zulassung pharmazeutischer Unternehmer ist und damit 13b SGB V für ihn gilt. Der weitere Importeur hat Verhandlungen mit dem GKV-SV abgelehnt und sich nicht am Schiedsverfahren beteilig, aber eine schriftliche Äußerung übermittelt. Nach seiner Auffassung muss die Schiedsstelle vom GKV-SV und den für die Wahrnehmung der wirtschaftlichen Interessen gebildeten maßgeblichen Spitzenorganisationen der pu auf Bundesebene gebildet werden. Daran fehle es, da der Verband der Arzneimittelimporteure Deutschlands (VAD) nicht an der Bildung beteilig worden sei. Nach der Gesetzesbegründung seien Verbände zu berücksichtigen, dessen Unternehmen potentielle Vertragspartner nach 13b SGB V sind. Die Beteiligung sei auch wegen der Sonderinteressen geboten, die die anderen Ver-
187 5 Ergebnisse der Schiedsverfahren 167 bände nicht abbilden, ja sogar bekämpfen. Da die Rahmenvereinbarung ohne den VAD zustande gekommen sei, könne sie für Importeure nicht bindend sein. Weiterhin sei die Schiedsstelle nicht demokratisch legitimiert, da der VAD nicht an der Bestellung der unparteiischen Mitglieder beteiligt worden sei. Die Schiedsstelle hat keinen Anlass gesehen, das Verfahren einzustellen und entschieden. Obwohl der Sachverhalt eine eingehende Betrachtung verdient hätte, hat sich die Schiedsstelle mit dem Hinweis zufrieden gegeben, dass der VAD selbst eine unmittelbare Beteiligung nicht gewünscht hat. Sie hatte aber wenig später Gelegenheit, die Grundsatzfrage zu entscheiden. Schiedsspruch zur Rahmenvereinbarung vom Da die Verhandlungen über eine notwendige Ergänzung der Rahmenvereinbarung nicht zu einem Vertragsschluss geführt haben, musste die Schiedsstelle u. a. über den VAD als Vertragspartei und die Datenauswertung nach 217f Abs. 7 SGB V entscheiden. Zum VAD als Vertragspartei erging folgender Beschluss: Es wird festgestellt, dass der VAD keine für die Wahrnehmung der wirtschaftlichen Interessen gebildete maßgebliche Spitzenorganisation der pu auf Bundesebene i. S. d. 13b Abs. 5 SGB V ist. Die Schiedsstelle begründet ihre Entscheidung mit Hinweis auf den Grundsatz der Betroffenheitspartizipation. Unternehmen und deren Verbände müssten typischerweise durch das AMNOG-Verfahren betroffen sein. Dies sei bei Parallelimporteuren wegen der Erstreckungswirkung auf alle wirkstoffgleichen Arzneimittel nicht der Fall. Außerdem zweifelt die Schiedsstelle an der Maßgeblichkeit des VAD. Mit seinen sieben Unternehmen, zwei davon nur Vertriebspartner, von 666 Unternehmen in der Roten Liste sei eine ausreichende Marktbeteiligung nicht gegeben. Zur Datenauswertung erging folgender Beschluss: Der GKV-SV informiert den pu mit der Einladung zum 1. Verhandlungstermin über Inhalt und Umfang der in 217f Abs. 7 genannten Daten nach 268 Abs. 3 Satz 14 SGB V und die damit verbundenen Analysemöglichkeiten. Der Ausschluss des VAD als Vertragspartei ist kritisch zu hinterfragen. Eine Betroffenheit ist für den pu im AMNOG-Verfahren dann zu unterstellen, wenn er aus welchen Gründen auch immer verhandeln muss. Und die Maßgeblichkeit eines Verbandes hängt nicht von der Zahl seiner Mitglieder, sondern allenfalls vom Umsatz seiner Mitglieder ab. Da der Gesetzgeber Parallelimporte als Teil des Wettbewerbs betrachtet, sollte ein Ausschluss aus gemeinsamen Institutionen der Vertragspartner sorgfältiger geprüft werden. Die Informationspflicht zur Datenauswertung ist dagegen uneingeschränkt in Sinne einer Chancengleichheit zu begrüßen.
188 168 Ergebnisse der Schiedsverfahren 5 Schiedsspruch vom (Wirkstoff Lixisenatid) G-BA: ein Zusatznutzen ist im Verhältnis zur zvt in vier Patientengruppen nicht belegt oder gilt als nicht belegt. Die Jahrestherapiekosten im Verhältnis zur zvt und die Zahl der für eine Behandlung infrage kommenden Patienten wurden jeweils für die Patientengruppen a),b),c) und d) bestimmt (Beschluss vom ). In einem Änderungsbeschluss vom wurden Kosten für zusätzliche GKV-Leistungen nachgetragen. Da in Übereinstimmung mit früheren Entscheidungen nur ein Erstattungsbetrag gelten kann, hat der GKV-SV die vier Patientengruppen zusammengeführt, sodass die Festsetzung eines Erstattungsbetrages in Mittel nicht zu höheren Jahrestherapiekosten führt als die zvt. Der pu hat die Höhe des Erstattungsbetrages mit den Patientenpopulationen der Gruppen c) und d) berechnet, da nach seiner Auffassung nur diese ärztlich indiziert mit dem Arzneimittel behandelt werden. Dies werde durch einen G-BA-Therapiehinweis gestützt und durch eine Verordnungsquote für GLP-1-Rezeptor-Antagonisten werde die Verschreibung auf die Patientengruppen c) und d) beschränkt. Die Schiedsstelle hat zunächst geprüft, ob die Bindungswirkung des G-BA-Beschlusses eine Beschränkung der Preisermittlung auf die Patientengruppen c) und d) ermöglicht. Ergebnis: Der Beschluss über die Nutzenbewertung ist Teil der Arzneimittelrichtlinie, daher ist eine Beschränkung auf die Stufen des Zusatznutzens offensichtlich nicht gewollt, was auch die Formulierung des 35a Abs. 3 Satz 3 SGB V mit insbesondere den Zusatznutzen feststellen nahelegt. Der G-BA stellt bei Nutzenbewertungsbeschlüssen die Krankenlast in Form von Prävalenzzahlen dar. Dabei handelt es sich um Marktpotentiale und keine Ge- oder Verbote zur Verordnung von Arzneimitteln. Beschlüsse des G-BA sind im Übrigen auch für Leistungserbringer verbindlich, soweit sie in die medizinische Versorgung einbezogen sind, was bei 13b SGB V der Fall ist. Die Schiedsstelle sieht sich deshalb an die Bildung von Patientengruppen und Prävalenzzahlen gebunden. Nicht im Ermessen der Schiedsstelle liegen Verordnungsausschlüsse, die ggf. der G-BA nach 92 Abs. 1 Satz 1 SGB V beschließen kann. Praxisbesonderheiten nach 13b Abs. 2 sind in Bundesmantelverträgen nach 82 Abs. 1 SGB V zu regeln. Insoweit konnte einer Anregung des pu nicht gefolgt werden. Der GKV-SV hat für seinen Antrag zunächst den Änderungsbeschluss des G-BA nicht berücksichtigt und kommt deshalb zu durchschnittlichen Jahrestherapiekosten von 52 (vgl. Tab. 21).
189 5 Ergebnisse der Schiedsverfahren 169 Tabelle 21: Mittlere Jahrestherapiekosten GKV-Spitzenverband (I) Berechnung des GKV-Spitzenverbandes für die mittleren Jahrestherapiekosten bei den vom G-BA ausgegebenen Preisspannen infolge unterschiedlicher Dosierungsmöglichkeiten nach jeweiligen Mittelwerten ohne Berücksichtigung des Änderungsbeschlusses des G-BA vom Wirtschaftliche zweckmäßige Vergleichstherapie Patientengruppe (a) Arzneimittel 1 Patientengruppe (b) Arzneimittel 2 Patientengruppe (c) Arzneimittel 3 Patientengruppe (d) Arzneimittel 4 Mittelwert 7 mg 2. mg Jahrestherapiekosten 56,7 Einheiten/7 mg 2. mg Patientenanteil 7 % 4 % 7 % 19 % Gewichtete Jahrestherapiekosten Durchschnittliche Jahrestherapiekosten 8,4,92 37,87 4,37 52 Unter Berücksichtigung des Änderungsbeschlusses und mit Saldierung der Negativwerte ergibt sich aufgerundet ein Betrag von 1. In seinem Schlussantrag hat der GKV-SV auf die Saldierung verzichtet und eine Festsetzung auf 37 beantragt (vgl. Tab. 22).
190 17 Ergebnisse der Schiedsverfahren 5 Tabelle 22: Mittlere Jahrestherapiekosten GKV-Spitzenverband (II) Berechnung des GKV-Spitzenverbandes für die mittleren Jahrestherapiekosten bei den vom G-BA ausgegebenen Preisspannen infolge unterschiedlicher Dosierungsmöglichkeiten nach jeweiligen Mittelwerten Wirtschaftliche zweckmäßige Vergleichstherapie Patientengruppe (a) Arzneimittel 1 Patientengruppe (b) Arzneimittel 2 Patientengruppe (c) Arzneimittel 3 Patientengruppe (d) Arzneimittel 4 Unter Berücksichtigung des Änderungsbeschlusses des G-BA vom Jahrestherapiekosten ,4-1,24 37,1-5,89 1 Unter Verzicht auf Saldierung der Negativwerte Gewichtete Jahrestherapiekosten Durchschnittliche Jahrestherapiekosten Jahrestherapiekosten Gewichtete Jahrestherapiekosten Durchschnittliche Jahrestherapiekosten Der pu beantragt unter Zugrundelegung seiner Berechnungsmethode einen Betrag von 665 für die Jahrestherapiekosten. Die Schiedsstelle hat zunächst den Änderungsbeschluss vom als verspätet nicht berücksichtigt, da zu diesem Zeitpunkt die Vertragsverhandlungen zwischen GKV-SV und pu schon weit fortgeschritten waren. Dann hat sie den Rahmen, den der Beschluss des G-BA gesetzt hat, soweit wie möglich ausgeschöpft und schließlich einen Betrag von gerundet 2 für die Jahrestherapiekosten festgesetzt (vgl. Tab. 23).
191 5 Ergebnisse der Schiedsverfahren 171 Tabelle 23: Mittlere Jahrestherapiekosten Schiedsstelle Berechnung der Schiedsstelle unter Berücksichtigung der maximalen, dem G-BA-Beschluss entsprechenden Dosierung der häufigsten Einnahmefrequenz der Obergrenzen der Spannen aus der zweckmäßigen Vergleichstherapie Für die Patientengruppe Jahrestherapiekosten von (a) (b) 34 1 (c) (d) Gewichtete Jahrestherapiekosten von Durchschnittliche Jahrestherapiekosten Gerundet 2 Die Schiedsstelle hat sich dem Grunde nach der Berechnungsmethode des GKV-SV angeschlossen und diese auch als nachvollziehbar bezeichnet. Andererseits war sie jedoch der Auffassung, dass der Schlussantrag des GKV-SV nicht den vom Gesetzgeber intendierten angemessenen Ausgleich der Interessen der Versichertengemeinschaft mit denen des pu entspricht. Deshalb hat sie alle Variablen ausgeschöpft. Die Schiedsstelle hat in gewisser Weise bedauert, dass bei einem zu erwartenden Ausstieg von Lixisenatid aus dem deutschen Markt die Ausgaben für die Krankenkassen nicht gesenkt werden können, da andere Arzneimittel dieser Gruppe im Bestandsmarkt, die einer Zusatznutzenbewertung nicht unterzogen wurden, teurer sind als die Preisvorstellung des pu für Lixisenatid. Schiedssprüche vom (Wirkstoffe Vildagliptin, Metformin) In beiden zu entscheidenden Fällen ist der Zusatznutzen nicht belegt. Die Arzneimittel wurden vor dem in Verkehr gebracht und gehören somit zum Bestandsmarkt. Das Bewertungsverfahren begann am , der Beschluss zur Nutzenbewertung erfolgte am Durch das 14. SGB V ÄndG wurden Bestandsmarktprodukte ab dem von der Bewertung ausgeschlossen. Am beantragt der GKV-SV die Festsetzung des Vertragsinhalts. Am stellte das pu Antrag auf Erlass einer einstweiligen Anordnung, der Schiedsstelle vorläufig zu untersagen, einen Erstattungsbetrag festzusetzen. Am bittet das
192 172 Ergebnisse der Schiedsverfahren 5 LSG die Schiedsstelle um Zusicherung, bis zur Entscheidung keinen Betrag festzusetzen, dem der Vorsitzende entspricht. Am wird der Antrag vom LSG zurückgewiesen. In der Schiedsstellenverhandlung stellt das pu den Antrag, die Festsetzung des Vertragsinhaltes abzulehnen. Mit Inkrafttreten der Gesetzesänderung am sei die Rechtsgrundlage für eine Bewertung der Bestandsmarktprodukte entfallen. Die Festsetzung eines Erstattungsbetrages setze eine Ermächtigungsgrundlage im Zeitpunkt der verfahrensbeendenden Entscheidung voraus. Die Schiedsstelle betrachtet das Verfahren als zulässig. Die Rechtslage war bei Beratung des 14. SGB V ÄndG bekannt. Das BMG hat im Bundestag festgestellt: Gefasste Beschlüsse vor dem behalten ihre Gültigkeit. Eine eindeutige Übergangsregelung ist allerdings nicht geschaffen worden. Der Bundesrat hat die Problematik erörtert, den Gesetzentwurf aber unverändert passieren lassen. Und schließlich spricht auch die Begründung zur Aufhebung des 35b Abs. 6 SGB V für die Fortsetzung der Nutzenbewertung von Arzneimitteln, die vor dem aufgerufen worden. Der sonstige Sachverhalt entspricht weitgehend dem Schiedsspruch vom Schiedsspruch vom (Wirkstoff Linaclotid) Ein Zusatznutzen ist im Verhältnis zur zvt nicht belegt. Die zvt ist eine Ernährungsumstellung entsprechend ärztlicher Beratung sowie symptomorientierte Behandlung. Die Beratung ist durch eine Grundpauschale im EBM gedeckt. Ein Teil der zugelassenen Wirkstoffe für symptomorientierte Behandlung ist nicht verschreibungspflichtig, ein Arzneimittel mit fiktiver Zulassung nicht zu Lasten der GKV zu verordnen. Zum Kostenvergleich bleibt nur ein Arzneimittel übrig. Der G-BA hat die Jahrestherapiekosten nicht abschließend festgesetzt und damit nach Auffassung des pu den Vertragsparteien einen Interpretationsspielraum eingeräumt. Da für Ernährungsumstellung und symptomorientierte Behandlung naturgemäß aber Kosten entstehen, müssten diese von den Vertragsparteien ermittelt werden. Die Schiedsstelle hat sich dieser Argumentation angeschlossen und festgestellt: Falls der G-BA unvollständig ermittelt hat, ist es den Vertragsparteien, und damit auch der Schiedsstelle, nicht verwehrt, diese Leerstellen zu ergänzen. Schiedsspruch vom (Wirkstoff Elvitegravir, Corbicistat, Emtricitabin, Tenofovirdisoproxil) Der G-BA hat für das HIV-Präparat einen Zusatznutzen in zwei Patientengruppen als nicht belegt bewertet.
193 5 Ergebnisse der Schiedsverfahren 173 In der Patientengruppe a) therapienaive Patienten hat der G-BA ein Arzneimittel mit zwei Kombinationsvarianten als zvt bestimmt. Der GKV-SV sieht hierin Alternativen im Sinne von 13b Abs. 3 Satz 2 SGB V. Der pu dagegen betrachtet das als Wahlmöglichkeit, da es sich nur um eine unterschiedliche Ausprägung einer zvt handele und deshalb 13b nicht anwendbar sei. Die Schiedsstelle hat sich für Alternativen im Sinne von 13b entschieden, da der G-BA ausdrücklich die Fixkombinationen nennt und nicht nur exemplarisch anführt. Für die Patientengruppe b) therapieerfahrene Patienten hat der G-BA als zvt individuelle Therapie in Abhängigkeit der Vortherapie(n), des Grundes für den Therapiewechsel, insbesondere Therapieversagen oder aufgrund von Nebenwirkungen bestimmt. Der GKV-SV vertritt die Auffassung, dass es sich bei den etwa 6 Wirkstoffkombinationen um gleichermaßen zweckmäßige Alternativen i. S. v. 13b Abs. 3 handelt und somit die kostengünstigste Therapie für die Preisbildung herangezogen werden muss. Nach Ansicht des pu hat der G-BA nur deshalb die individuelle Therapie als einheitliche zvt festgesetzt, weil er sich nicht in der Lage sah, die Aufteilung nach Patientenpopulationen vorzunehmen. Deshalb sei von verschiedenen Therapievariationen auszugehen und ein verordnungsgewichteter Monatsdurchschnitt der Abgabenpreise des pu aus allen Therapievarianten zu bilden. Die Schiedsstelle betrachtet wie der pu alle Wirkstoffkombinationen als Gesamtheit zur zvt. Da der G-BA keine explizite Vorgabe definiert hat, muss hier eine Leerstelle ausgefüllt werden. Die wirtschaftliche Alternative kann aber nicht der Mittelwert sein, sondern im Regelfall eine Wirkstoffkombination im unteren Bereich der Preisverteilung. Die Schiedsstelle betrachtet fünf mögliche Varianten und entscheidet sich für die mengengewichtete Drittelung auf Basis der Verbrauchsdaten nach 217f Abs. 7 SGB V als Schnittlinie zwischen dem preisgünstigsten und dem mittelpreisigen Drittel. Unter Berücksichtigung der unterschiedlichen Berechnungsmethoden ergeben sich folgende Jahrestherapiekosten: pu GKV-SV 6.7 Schiedsstelle Der pu hat in dieser Verhandlung über ein Arzneimittel ohne Zusatznutzen im Unterschied zu vielen anderen pu nicht das europäische Preisniveau bemüht. Vielmehr hat er sich in der Systematik der Preisbildung bewegt, die die Schiedsstelle in vergleichbaren Fällen für ihre Entscheidungen zu Grunde gelegt hat, und war damit relativ erfolgreich. Die Schiedsstelle hat sich offensichtlich bei ihrer Ent-
194 174 Ergebnisse der Schiedsverfahren 5 scheidung für eine mengengewichtete Drittelung an der Festbetragsbildung für generische Arzneimittel orientiert. Das liegt durchaus in ihrem Entscheidungsspielraum. Schiedsspruch vom (Wirkstoff Pomalidomid) Es handelt sich hier um ein Arzneimittel zur Behandlung eines seltenen Leidens (Orphan Drug). Der Zusatznutzen gilt in diesen Fällen durch die Zulassung als belegt, lediglich das Ausmaß des Zusatznutzens ist nachzuweisen. Der G-BA stuft den Zusatznutzen im Verhältnis zu der durch das pu in der Zulassungsstudie gewählten Vergleichstherapie als beträchtlich ein. Zur Zeit der Schiedsstellenverhandlung waren vier Packungsgrößen mit Wirkstärken von 1 mg, 2 mg, 3 mg und 4 mg pro Einheit in Vertrieb. GKV-SV und pu hatten sich für die Wirkstärken 3 mg und 4 mg auf einen einheitlichen Erstattungsbetrag von 8.5 verständigt. Das pu beantragte auch für alle anderen auf dem Markt befindlichen Packungen einen Erstattungsbetrag von 8.5, da der G-BA eine Differenzierung nach Wirkstärke nicht vorgenommen habe. Grund für eine Reduzierung auf 1 mg oder 2 mg sind Nebenwirkungen nach Therapiebeginn. Der GKV-SV beantragte eine lineare Bepreisung für Darreichungsformen unter 3 mg und eine Kappung ab 4 mg. Die Schiedsstelle hält einen einheitlichen Erstattungsbetrag ohne gleichwertigen Wirkungsnachweis für nicht plausibel, orientierte sich aber bei einer linearen Bepreisung an der 3 mg Packung, so dass der Erstattungsbetrag für die 1 mg Packung 2.833,33 und für die 2 mg Packung 5.666,67 beträgt. Der Hinweis des pu auf einen einheitlichen Erstattungsbetrag für alle Wirkstärken in anderen europäischen Ländern war von der Schiedsstelle nicht zu prüfen. Schiedsspruch vom (Wirkstoff Insulin degludec) Der G-BA hat den Zusatznutzen als nicht belegt bewertet. Von Interesse ist in diesem Fall nur, dass der pu die Auffassung vertritt, die Regelung des 35a Abs. 1 SGB V erlaube die Ausweisung von zwei Erstattungsbeträgen; einmal den in der Lauer-Taxe und zum andere den effektiven Erstattungsbetrag für Krankenkassen. Die Schiedsstelle sah es nicht als notwendig an, die Frage zu klären, ob das geltende Recht die Ausweisung von zwei Erstattungsbeträgen zulässt. Eine Regelung mit zwei Erstattungsbeträgen setze wegen der damit erzeugten künstlichen Intransparenz sowie der Notwendigkeit zur Etablierung von Verfahrensabläufen, in die die einzelnen Krankenkassen eingebunden werden müssen, mindesten voraus, dass die Vertragsparteien über eine solche Regelung Konsens erzielen.
195 5 Ergebnisse der Schiedsverfahren 175 Zusammenfassende Bewertung Bei den Schiedssprüchen zu Arzneimitteln ohne Zusatznutzen fällt auf, dass sich die Schiedsstelle deutlich näher an den Anträgen des GKV-SV als an denen der pu bewegt hat. Dies spricht aber keineswegs gegen die Angemessenheit der Entscheidungen. Der Entscheidungsrahmen, den der Gesetzgeber der Schiedsstelle bei Arzneimitteln ohne Zusatznutzen gelassen hat, ist insbesondere nach der Neufassung des 13b Abs. 3 Satz 2 SGB V, nach der bei mehreren Alternativen die wirtschaftlichste zu wählen ist, äußerst eng. Vor diesem Hintergrund hat die Schiedsstelle durchaus von dem verbleibenden Ermessen im Sinne eines fairen Interessenausgleichs Gebrauch gemacht. Die pu haben häufig versucht, in der Schiedsstellenverhandlung die Argumentation aus dem G-BA-Verfahren fortzusetzen, was nicht erfolgreich sein konnte, da eine Überprüfung der G-BA-Bewertung nur im Rahmen einer Klage gegen den Schiedsspruch vor den Sozialgerichten möglich ist. Dies erklärt möglicherweise auch die zahlreichen Klagen gegen die Schiedssprüche. Bei den beiden Schiedssprüchen zu Arzneimitteln mit Zusatznutzen hat es einen weitgehenden Konsens über die Ermittlung der Preise vergleichbarer Arzneimittel und des europäischen Preisniveaus, trotz der schwierigen Justierung der tatsächlichen Preise, gegeben. Die Monetarisierung des Zusatznutzens ist aber weder bei den Anträgen des GKV-SV noch bei der Entscheidungsfindung der Schiedsstelle nachvollziehbar dargestellt worden. Die pu haben sich erst gar nicht um eine Systematik bemüht, sondern im Wesentlichen argumentiert, ihr Preisangebot liege schon unter dem Niveau vergleichbarer europäischer Länder. Hier gibt es für weitere Entscheidungen der Schiedsstelle noch Einiges aufzuarbeiten.
196 176 Ergebnisse der Schiedsverfahren Die Schiedsstelle nach 13b Abs. 1 SGB V Eine Bilanz nach vier Jahren Spruchpraxis Gastbeitrag von Dr. Antje Haas und Dr. Anja Tebinka-Olbrich Abteilung für Arznei- und Heilmittel, GKV-Spitzenverband Entscheidungsübersicht zur Spruchpraxis der Schiedsstelle Innerhalb von rund vier Jahren AMNOG-Gesetzgebung sind insgesamt 113 Erstattungsbetragsverhandlungen für 88 Wirkstoffe durchgeführt worden. Die Mehrzahl der Verhandlungen konnte einvernehmlich abgeschlossen werden (97). In 25 Fällen wurde ein Schiedsverfahren eingeleitet; davon konnten 4% der Fälle (1) noch vor einem Schiedsspruch durch die Parteien geeint werden. Eine nähere Analyse zeigt, dass die überwiegende Anzahl der Schiedsverfahren zu Wirkstoffen mit fehlendem Zusatznutzen bei generischer zweckmäßiger Vergleichstherapie eingeleitet wurde. Daraus lässt sich ableiten: Die größte Herausforderung für die Schiedsstelle in den ersten vier Jahren lag im Umgang mit den Festsetzungen des G-BA-Beschlusses zur zweckmäßigen Vergleichstherapie und der entsprechenden Höhe der Jahrestherapiekosten bei Arzneimitteln mit fehlendem Zusatznutzen. Im Hintergrund steht die fehlende Akzeptanz der Rechtsvorgaben für die Preisfindung bei Arzneimitteln mit fehlendem Zusatznutzen seitens der pharmazeutischen Industrie. Dagegen hat sich der Verhandlungsweg bei Arzneimitteln mit Zusatznutzen als effektives und konsensfähiges Instrument der Preisfindung herausgestellt. Tabelle 24: Schiedsverfahren mit Festsetzung eines Erstattungsbetrages (Stand: ) Az. Wirkstoff Handelsname Datum ZN zvt 1-12 Bromfenac Yellox n g 3-12 Retigabin Trobalt n g 4-12 Extrakt aus Cannabis sativa Sativex j g 1-13 Vemurafenib Zelboraf j g 2-13 Perampanel Fycompa n g 1-14 Lixisenatid Lyxumia n g 4-14 Galvus/Jalra/Xiliarx 3-14 Eureas/Icandra/Zomarist Vildagliptin/Metformin n g Vildagliptin n g 5-14 Linaclotid Constella n g
197 5 Ergebnisse der Schiedsverfahren Elvitegravir/Cobicistat/Emtricitabin/Tenofovirdisoproxil 4-15 Insulin degludec Stribild n g Tresiba n g 8-15 lebende Larven von Lucilia sericata BioBag/ Bio- Monde Freie Larven n d 9-15 Siltuximab Sylvant j - 2 AZ Aktenzeichen der Schiedsstelle ZN Zusatznutzen (j = ja/n = nein) zvt Zweckmäßige Vergleichstherapie (g = generisch/p = patentgeschützt/d = zvt bestehend aus diversen Therapieoptionen) 1 Geplanter Tag der mündlichen Verhandlung 2 Hier wurde vom G-BA keine zvt festgesetzt, da es sich um ein Orphan handelt. Nach sieben von insgesamt 25 eingeleiteten Schiedsverfahren hat sich der Unternehmer nach Entscheidung der Schiedsstelle zu einer Marktrücknahme durch außer Vertrieb (AV)-Meldung 314 entschieden (Vildagliptin, Vildagliptin/Metformin, Lixisenatid, Linaclotid, Retigabin 315, Perampanel, Bromfenac). Diese Rücknahme entspricht keinesfalls einem sog. Opt-out im Sinne der Rahmenvereinbarung. 316 Vielmehr handelte es sich bei diesen AV -gemeldeten Präparaten stets um Arzneimittel ohne Zusatznutzen mit einer generischen zweckmäßigen Vergleichstherapie, bei denen es therapeutisch gleichwertige Alternativen gibt. Bei derzeit zehn mit einem Erstattungsbetrag abgeschlossenen Schiedsstellenverfahren wurde siebenmal gegen den Schiedsspruch Klage erhoben. Sechs Klagen bei Gericht laufen derzeit zu den Wirkstoffen Bromfenac, Lixisenatid, Linaclotid, Perampanel, Pomalidomid sowie der Fixkombination Elvitegravir/Cobicistat/Emtricitabin/Tenofovirdisoproxil. Eine Klage (gegen den Schiedsspruch zu Cannabis sativa) wurde zurückgezogen. In keinem Hauptsacheverfahren ist bisher ein Urteil ergangen. In fünf der sechs laufenden Klagen handelt es sich um Arzneimittel ohne Zusatznutzen mit einer D. h. nach den Richtlinien der Informationsstelle für Arzneispezialitäten GmbH wird dieser Artikel vom Anbieter nicht mehr ausgeliefert, im Handel befindliche Ware darf abverkauft werden. Schiedsverfahren wurde mit einem Importeur durchgeführt nach opt-out des Originalherstellers. Die Statistik aus dem DAK-AMNOG-Report 215, S. 165, Tab. 51 ist insofern unzutreffend, als dort in einer Tabelle Arzneimittel ausgewiesen werden, die optout gegangen seien. Als opt-out kann richtigerweise nur bezeichnet werden, wenn der Unternehmer Gebrauch von 4 Abs. 7 RahmenV macht und innerhalb von vier Wochen nach G-BA-Beschluss sein Arzneimittel aus dem Markt zurückzieht.
198 178 Ergebnisse der Schiedsverfahren 5 generischen zweckmäßigen Vergleichstherapie, bei denen es therapeutisch gleichwertige Alternativen gibt. In den letzten Monaten wird von Seiten der pharmazeutischen Industrie verstärkt ein Verbot von generischen Arzneimitteln in der zweckmäßigen Vergleichstherapie gefordert. Es stellt sich jedoch die Frage, weshalb die GKV-Versichertengemeinschaft für neue Arzneimittel ohne Nachweis eines Mehrwerts für die Patienten mehr ausgeben sollte. Zum allgemeinen Unternehmerrisiko gehört, dass ein Produkt, das nicht besser als vorhandene Alternativen ist und mehr kostet, in den Regalen liegen bleibt. Zudem war es gerade Anliegen und Anlass des AMNOG, die Kosten für neue Arzneimittel ohne Zusatznutzen ( me-toos ) zu senken. 317 Die Vorgabe des Gesetzgebers, dass bei Wirkstoffen ohne Zusatznutzen die Jahrestherapiekosten der Vergleichstherapie nicht überschritten werden, ist lediglich die konsequente Anwendung des Wirtschaftlichkeitsgebotes. Oder wie es die Gesetzesbegründung des AMNOG ausdrückte: Die Erstattungsfähigkeit von Arzneimitteln ohne Zusatznutzen wird dadurch gesichert, dass zwischen dem Spitzenverband Bund der Krankenkassen und dem pharmazeutischen Unternehmer ein Erstattungsbetrag für das Arzneimittel vereinbart wird, der sicherstellt, dass keine Mehrkosten gegenüber der Vergleichstherapie entstehen. 318 Die Alternative ist aus Sicht des GKV-Spitzenverbandes der Ausschluss aus der Versorgung. Bilanz und Bewertung Die bisher durchgeführten Schiedsverfahren haben einige wichtige Fragen zur Umsetzung des AMNOG zum Gegenstand gehabt. Die Schiedsstelle hat zur Rahmenvereinbarung wie zur Findung des Erstattungsbetrages bereits wesentliche Impulse gesetzt. Weitere zentrale Fragen sind jedoch noch offen. Tabelle 25: Wesentliche Schiedssprüche und ihre Entscheidungsinhalte von Thematik Übergreifende Fragestellungen Anwendbares Recht für Erstattungsbetrag Bindung Vertragsparteien und Schiedsstelle an G- BA-Beschluss Entscheidungsinhalt der Schiedssprüche Kartellrecht (GWB) ist auf Vereinbarungen nach 13b SGB V nicht anwendbar. Entscheidungsspielraum der Schiedsstelle ist ebenso wie der der Verhand BT-Drs. 17/2413, S. 1. BT-Drs. 17/2413, S. 31.
199 5 Ergebnisse der Schiedsverfahren 179 Thematik Erstattungsbetrag Netto- vs. Brutto-Prinzip Festsetzungsinhalte durch Schiedsstellenentscheidung Zusatztherapien vs. Therapieersatz Add-on - Thematik Entscheidungsinhalt der Schiedssprüche lungspartner durch Beschluss eingegrenzt; Bindung bejaht u. a. für Therapiekosten, Anzahl Patienten, Patientengruppenaufteilung, Qualitätsanforderungen, Krankheitslast in Prävalenzzahlen. Keine Korrektur von G-BA-Beschlüssen durch Schiedsstelle. Verweis auf den Rechtsweg. Nettoprinzip bei Erstattungsbetrag und Herstellerabschlag Keine Festsetzung nicht notwendiger Vertragsinhalte (z. B. Ablösung Herstellerabschlag), bloße Zweckmäßigkeitserwägungen reichen nicht aus. Für die Höhe des Erstattungsbetrags ist zwingend zu berücksichtigen, ob das Arzneimittel die zvt ersetzt oder zusätzlich zur Vergleichstherapie angewandt wird. Erstattungsbetrag bei Arzneimitteln ohne Zusatznutzen Obergrenze der Jahrestherapiekosten bei mehreren zweckmäßigen Vergleichstherapien und Patientengruppen (Gesetzesstand vor 3. AMG-Novelle) Kriterien Jahrestherapiekosten vergleichbarer Arzneimittel oder tatsächlicher Abgabepreise in anderen europäischen Ländern Ermittlung der Jahrestherapiekosten für die jeweilige Patientengruppe als Preisspanne; Preisobergrenzen für die jeweilige Patientengruppen werden nach der im G-BA-Beschluss aufgeführten Patientengruppengröße gewichtet und in einen einheitlichen betrag zusammengeführt. Keine Berücksichtigung bei Arzneimitteln ohne Zusatznutzen. Erstattungsbetrag bei Arzneimittel mit Zusatznutzen Zuschlag auf die Jahrestherapiekosten der zvt gem. 6 Abs. 1 RahmenV Gewicht der drei gesetzlichen Kriterien Bestätigung des Zuschlagsprinzips der RahmenV; Ausmaß und Wahrscheinlichkeit des Zusatznutzens schlägt sich in Zuschlagshöhe nieder. Hauptgewicht Zusatznutzen aus dem G- BA-Beschluss. EU-Preise und Jahrestherapiekosten vergleichbarer Arzneimittel nachrangige, inputorientierte Kriterien. Gewicht der EU-Preise hängt von Anzahl der Länder für die verlässliche Preisangaben mitgeteilt werden sowie Erstattungsfähigkeit im Gesundheitssystem ab.
200 18 Ergebnisse der Schiedsverfahren 5 Entscheidungen der Schiedsstelle zur Rahmenvereinbarung Gemäß 13b Abs. 9 SGB V sollen sich der GKV-Spitzenverband und die Industrieverbände auf eine gemeinsame Rahmenvereinbarung einigen und darin das Nähere zu den Maßstäben für Erstattungsbetragsvereinbarungen regeln. Prinzipiell können damit die Rahmenvertragspartner die Schiedsstelle durch die begriffliche wie methodische Präzisierung der gesetzlichen Kriterien in ihrer Entscheidungsfindung programmieren. Dieses Verhältnis kann sich aber auch umdrehen, sollten sich die Rahmenvertragspartner nicht einigen und stattdessen die Schiedsstelle die gesetzlichen Kriterien weiter ausformen. So gehen die Regelungen zum Kriterium tatsächliche Abgabepreise in europäischen Ländern nahezu allein auf die Schiedsstelle zurück. 212: Der EU-Länderkorb Die Erstfassung der Rahmenvereinbarung kam erst am 19. März 212 nach Entscheidung der Schiedsstelle zum sog. EU-Länderkorb zustande. Der Konsens zu grundsätzlichen Verfahrensfragen bestand, aber trotz langwieriger Verhandlungen konnten zwei Punkte zum Kriterium der tatsächlichen Abgabepreise in anderen europäischen Ländern nicht geeint werden: Aus wie vielen und aus welchen Ländern tatsächliche Abgabepreise vorgelegt werden sollen ( Länderkorb -Debatte). Die Rahmenvertragspartner teilten der Schiedsstelle am 9. November 211 das Scheitern der Verhandlungen mit. Die Schiedsstelle entschied im Februar 212 ausgewogen: Sie gab Vorstellungen der pharmazeutischen Industrie Raum, in dem sie einen Länderkorb mit Staaten festsetzte, die wirtschaftlich mit Deutschland vergleichbar sind. Länder mit von Deutschland stark abweichenden Wirtschaftszahlen wie Bulgarien, Island, Malta, Rumänien, Slowenien, Ungarn sowie Zypern ließ die Schiedsstelle außen vor. Die Schiedsstelle entschied den Länderkorb auf 15 Länder aus dem europäischen Wirtschaftsraum festzusetzen und gab vor, den Länderkorb bei Bedarf so fortzuschreiben, dass stets 8 Prozent des europäischen Wirtschaftsraums abgedeckt wären. 319 Insofern kann keinesfalls die Rede davon sein, dass die Schiedsstelle die Bedenken der Hersteller verworfen hätte 32, vielmehr hat sie diese weitgehend abgebildet. Der Schiedsspruch hat auch geklärt, dass sich die gesetzliche Übermittlungspflicht bezüglich der tatsächlichen Abgabepreise in anderen europäischen Ländern auf die Abgabepreise abzüglich sämtlicher gewährter Rabatte oder eingeräumter Preisnachlässe bezieht. 321 Die Schiedsstelle hat dabei deutlich gemacht, dass einfach Verfahren 13b-Sst. Rahmenvereinbarung Länderkorb, S. 15. Klein (212). Verfahren 13b-Sst. Rahmenvereinbarung Länderkorb, S. 17.
201 5 Ergebnisse der Schiedsverfahren 181 schuldrechtliche Vereinbarungen, wie z. B. Geheimhaltungsverpflichtungen, die Übermittlungspflicht nach 13b Abs. 1 Satz 9 SGB V nicht aushebeln können. Andernfalls hätte es jeder pharmazeutische Unternehmer in der Hand, durch entsprechende Abmachungen die gesetzliche Verpflichtung zu umgehen. 322 Die Schiedsstelle setzte eine Ausweichoption fest: Ist es dem pharmazeutischen Unternehmer aus rechtlichen Gründen oder faktisch nicht möglich, die tatsächlichen Abgabepreise zu erheben und mitzuteilen, soll er stattdessen diejenigen Informationen übermitteln, die tatsächlichen Preise abschätzen lassen. Hierüber sollen sich GKV-Spitzenverband und Unternehmer einvernehmlich abstimmen. Nach vier Jahren Verhandlungspraxis ist festzustellen, dass diese Regelung leider nicht zur Verbesserung der Datenlage hinsichtlich der tatsächlichen EU-Abgabepreise beigetragen konnte. Auch der damalige Vorsitzende der Schiedsstelle musste 214 feststellen, dass die Beweiskraft der europäischen Abgabepreise generell verbesserungsbedürftig ist : Beteiligung der Importeursverbände, Gewichtung der EU- Preise und Datenaustausch Mit Schiedsspruch vom 25. Juni 215 entschied die Schiedsstelle über die Frage der Notwendigkeit der Beteiligung von Importeursverbänden an der Rahmenvereinbarung. Des Weiteren hatte sie darüber zu befinden, wie die gesetzliche Vorgabe der Gewichtung der tatsächlichen Abgabepreise in anderen europäischen Ländern nach Umsatz und Kaufkraft zu erfolgen hat. Die Rahmenvereinbarung enthält als weiteres Ergebnis dieser Schiedsentscheidung nun auch eine Regelung zur Verwendung der Daten nach 217f SGB V in den Erstattungsbetragsverhandlungen. Die Schiedsstelle sah sich zunächst bei der den eigentlichen Festsetzungsinhalten vorgelagerten Streitfrage zur Beteiligung an den Rahmenvereinbarungsverhandlungen als entscheidungsbefugt an. Die Anrufung der Schiedsstelle in dieser Sache war notwendig, da Fehler bei der Beteiligung im Verfahren der Rahmenvereinbarung sich auf ihre formelle Rechtmäßigkeit auswirken können. Die Schiedsstelle stellte weiter fest, dass der Verband der Arzneimittelimporteure (VAD) keine maßgebliche Spitzenorganisationen der pharmazeutischen Unternehmer i. S. d. 13b Abs. 5 Satz 1 SGB V sei. Grundlage für die Entscheidung war, dass nach Maßgabe des hier zu beachtenden Prinzips der Betroffenenpartizipation Importeure nicht typischerweise Vertragspartner einer Vereinbarung nach 13b SGB V seien Verfahren 13b-Sst. Rahmenvereinbarung Länderkorb, S. 17. Zipperer (214a), Folie 16.
202 182 Ergebnisse der Schiedsverfahren 5 Zur Methode der Gewichtung der tatsächlichen Abgabepreise setzte die Schiedsstelle folgendes Vorgehen fest: 324 Der tatsächliche Abgabepreis wird um Kaufkraftunterschiede unter Verwendung der nunmehr explizit benannten Datenquelle für die Kaufkraftparitäten korrigiert. Die kaufkraftbereinigten Abgabepreise der jeweiligen Länder werden gewichtet mit dem Umsatzanteil des Landes an dem Gesamtumsatz der zu berücksichtigenden Länder. Für die Gewichtung mit dem Umsatz seien jeweils die der Realität am nächsten kommenden zugänglichen aktuellen Marktdaten zu berücksichtigen. Die so gewichteten Preise werden addiert. Der ermittelte Wert entspricht dem nach Kaufkraft und Umsatz gewichteten Preis. Die Vorgabe der Beschaffung von Umsatzdaten bei Dritten führt zu einer nicht unerheblichen finanziellen Mehrbelastung der Verhandlungspartner. Entscheidungen der Schiedsstelle zum Erstattungsbetrag In der Schiedsspruch-Praxis zu Erstattungsbeträgen in den ersten vier Jahren hat sich als Schwerpunkt die Ermittlung des Erstattungsbetrages für Arzneimittel ohne Zusatznutzen herausgestellt. Im Vordergrund stand in dieser Fallgruppe die Frage der Berechnung der Obergrenze der Jahrestherapiekosten aus der zweckmäßigen Vergleichstherapie. Bei Arzneimitteln mit Zusatznutzen lag der Fokus auf der Gewichtung der verschiedenen Kriterien der Erstattungsbetragsverhandlung. Arzneimittel ohne Zusatznutzen: Obergrenze der Jahrestherapiekosten bei mehreren zweckmäßigen Vergleichstherapien Die gesetzliche Vorgabe für die Verhandlung des Erstattungsbetrages für Arzneimittel ohne Zusatznutzen erscheint auf den ersten Blick einfach: Für ein Arzneimittel, das nach dem Beschluss des G-BA nach 35a Absatz 3 SGB V keinen Zusatznutzen hat, sind die Jahrestherapiekosten der zweckmäßigen Vergleichstherapie die Obergrenze für den Erstattungsbetrag. Seit dem 3. AMG-Änderungsgesetz gilt zusätzlich: Gibt es mehrere Alternativen in der zweckmäßigen Vergleichstherapie, sind die Jahrestherapiekosten der wirtschaftlichsten Alternative die Obergrenze. Diese Vorgabe ist allerdings nur dann leicht umsetzbar, wenn es eindeutig eine wirtschaftlichste Alternative gibt. In der Patientengruppe a) der therapienaiven Patienten bei Stribild gab es z. B. zwei Alternativen, deren Kosten jeweils durch einen konkreten Betrag beziffert werden konnten; die Schiedsstelle zog die Jahrestherapiekosten der günstigeren der beiden heran Verfahren 13b-Sst Rahmenvereinbarung Importeursbeteiligung/EU- Preise, S. 13. Verfahren 13b-Sst Elvitegravir etc., S. 18.
203 5 Ergebnisse der Schiedsverfahren 183 Häufig ist das Arzneimittel aber z. B. für mehrere Indikationen zugelassen und selbst wenn es nur eine Indikation gibt, sind bei den meisten Arzneimitteln unterschiedliche Patientengruppen und Behandlungssituationen (z. B. first/second line) mit unterschiedlichen Verordnungsmaßgaben wie z. B. Dosierungen zu unterscheiden. Der G-BA bestimmt nach dem allgemein anerkannten Stand der medizinischen Erkenntnisse, die spezifisch für die jeweilige Patientengruppe oder Behandlungssituation zweckmäßige Vergleichstherapie. Insofern gibt es häufig mehrere zweckmäßige Vergleichstherapien für einen Wirkstoff. Durch Dosierungsunterschiede oder Variationen zur Einnahmefrequenz können die Jahrestherapiekosten zudem häufig nur als Preisspannen angegeben werden. Resultat ist, dass der G-BA-Beschluss bei verschiedenen Patientengruppen mit verschiedenen Vergleichstherapien nicht die eine Preisobergrenze für die Jahrestherapiekosten der zweckmäßigen Vergleichstherapie enthält, sondern Preisspannen. Da es aufgrund gesetzlicher Vorgabe pro Wirkstoff nur einen Erstattungsbetrag geben darf, müssen die Obergrenzen der Preisspannen in einen einheitlichen Euro-Betrag umgerechnet werden, der die Preisobergrenze nach 13b Abs. 3 SGB V definiert. 326 Daraus ergibt sich, dass sich die gesetzliche Vorgabe eines Erstattungsbetrages für einen Wirkstoff nur durch eine Mischbetrachtung der zweckmäßigen Vergleichstherapien über die Patientengruppen/Behandlungssituationen hinweg umsetzen lässt. Im Verfahren zu Insulin degludec gab es z. B. fünf Patientengruppen, für die der G-BA jeweils zwei Alternativen (Glibenclamid oder Glimepirid) feststellte. Aufgrund von Dosierungsunterschieden wurden die Jahrestherapiekosten der zweckmäßigen Vergleichstherapie für die jeweilige Patientengruppen als Preisspannen ermittelt. Die jeweils ermittelten Preisobergrenzen wurden dann nach den Größen der Patientengruppen ins Verhältnis gesetzt und zusammengeführt. 327 Für die Bestimmung der Größe der Patientengruppen zog die Schiedsstelle die vom G-BA-Beschluss vorgegebenen Prävalenzzahlen heran. Insgesamt ist die Schiedsstelle bei der Berechnung der Obergrenze nach 13b Abs. 3 SGB V durch den G-BA-Beschluss gebunden. Eine Durchsicht der Schiedssprüche ergibt, dass sich die Schiedsstelle zu Recht an die Feststellungen des G-BA im Nutzenbeschluss zu Therapiekosten, Anzahl der Patienten, Patientengruppen und Qualitätsanforderungen 328 sowie zur Krankheitslast in Form von Prävalenzzahlen 329 gebunden sieht. Weder Verhandlungspartner noch Schiedsstelle hätten die Kompetenz zur Prüfung der Richtigkeit oder Rechtmäßigkeit der Feststellungen des G-BA oder zur Korrektur der Feststellungen des G-BA im So die Schiedsstelle explizit in Verfahren 13b-Sst Insulin degludec, S. 22. Verfahren 13b-Sst Insulin degludec, S. 22. Verfahren 13b-Sst Bromfenac, S. 16; Bindung an die Bildung der Patientengruppen bestätigt in Verfahren 13b-Sst Lixisenatid, S. 21. Verfahren 13b-Sst Lixisenatid, S. 21.
204 184 Ergebnisse der Schiedsverfahren 5 Schiedsstellenverfahren auf Basis eigener Ermittlungen. 33 Der Entscheidungsspielraum der Schiedsstelle wie der Verhandlungspartner sei durch den G-BA-Beschluss eingegrenzt. 331 So lehnte die Schiedsstelle in ihrem Schiedsspruch zu Linaclotid auch eine Ergänzung der zweckmäßigen Vergleichstherapien um eine im G-BA-Beschluss nicht benannte Therapieoption ab. 332 Die in Insulin degludec verwandte Methode der Obergrenzenberechnung hatte die Schiedsstelle bereits in Vildagliptin und Vildagliptin/Metformin eingesetzt mit dem Unterschied, dass für die schon länger auf dem Markt vorhandenen Bestandsmarktarzneimittel bereits Daten nach 217f SGB V vorlagen. Deshalb gilt: Je später eine erneute Nutzenbewertung stattfindet, umso mehr können Versorgungsdaten nach 217f SGB V zur Anpassung des G-BA-Beschlusses an die Versorgungsrealität eine Rolle spielen. Arzneimittel mit Zusatznutzen: Gewichtung der Kriterien Nutzenbeschluss, Jahrestherapiekosten vergleichbarer Arzneimittel und tatsächliche EU-Abgabepreise Für die Verhandlung eines Erstattungsbetrages in der Fallgruppe Arzneimittel mit Zusatznutzen sieht das Gesetz drei Kriterien vor: den Nutzenbeschluss, die Jahrestherapiekosten vergleichbarer Arzneimittel sowie die tatsächlichen Abgabepreise in anderen europäischen Ländern. Bereits aus der Platzierung der Kriterien im Gesetzestext lässt sich eine Rangordnung der Kriterien ablesen. Der Nutzenbeschluss als explizite Grundlage des Erstattungsbetrages wird an erster, prominenter Stelle gemeinsam mit dem Erstattungsbetrag in 13b Abs. 1 S. 1 SGB V erwähnt. Die Jahrestherapiekosten vergleichbarer Arzneimittel sowie die tatsächlichen europäischen Abgabepreise werden als weitere Kriterien hingegen erst in 13b Abs. 9 S. 3 SGB V erwähnt. Sie sollen zudem lediglich berücksichtigt werden, was eine Abstufung gegenüber dem Pflichtkriterium Nutzenbeschluss ist. Die Schiedsstelle hatte erstmals im Verfahren zu Cannabis sativa Gelegenheit, Stellung zur Frage zu nehmen, in welchem Verhältnis sie die drei gesetzlichen Kriterien zueinander stehen sieht. Die Schiedsstelle stellte fest, dass das Hauptkriterium für die Ermittlung des Erstattungsbetrages der patientenrelevante Zusatznutzen laut G-BA-Nutzenbeschluss sei. Die beiden anderen Kriterien seien Verfahren 13b-Sst Bromfenac, S. 16; Verfahren 13b-Sst Vemurafenib, S. 2, Nr.1.1 unten: Die Feststellungen aus dem Nutzenbewertungsbeschluss gelten in den Verhandlungen sowie im Schiedsverfahren als gesetzt. ; Verfahren 13b-Sst Vildagliptin/Metformin S. 31: Der Schiedsstelle ist es verwehrt, die Rechtmäßigkeit des Nutzenbewertungsbeschlusses zu prüfen. ; Verfahren 13b Sst Linaclotid, S. 13: Die Schiedsstelle kann sich mit Beanstandungen des G-BA-Beschlusses nicht befassen. Verfahren 13b SSt Vildagliptin/Metformin, S. 33. Verfahren 13b-Sst Linaclotid, S. 15.
205 5 Ergebnisse der Schiedsverfahren 185 zwar ebenfalls zu berücksichtigen, in der erforderlichen Gesamtschau ist ihnen jedoch im Verhältnis zum Zusatznutzen ein geringeres Gewicht beizumessen. 333 Die Kriterien Jahrestherapiekosten vergleichbarer Arzneimittel und Tatsächliche EU-Abgabepreise seien nicht geeignet, den patientenorientierten Wert eines Arzneimittels zu beurteilen. 334 Sie ließen allenfalls inputorientierte Schlüsse für die Angemessenheit des Erstattungsbetrages zu. Dabei sei eine Methode, bei der ihnen jeweils ein bestimmter Gewichtungsanteil zugemessen wird, hilfreich. Dieser könne aber je nach Fallgestaltung unterschiedlich ausfallen. 335 Umstände, die den Gewichtungsanteil der tatsächlichen EU-Abgabepreise für die Ermittlung des Erstattungsbetrages im konkreten Fall mitbestimmen, sind die Anzahl der Länder, für die tatsächliche Abgabepreise mitgeteilt wurden, die Verlässlichkeit der Preisangaben und ob das Arzneimittel erstattungsfähig zu Lasten des jeweiligen Gesundheitssystems ist. 336 Diese Umstände legte die Schiedsstelle im Verfahren zu Cannabis sativa zugrunde: Da sich das Arzneimittel nur in fünf EU-Ländern im Verkehr befände, sei der Erkenntnisgewinn verhältnismäßig gering, zumal Sativex nur in einem Land erstattungsfähig sei. 337 Ebenso verfuhr die Schiedsstelle in Vemurafenib: Hier führte der Umstand, dass für lediglich vier von zehn Ländern die tatsächlichen Abgabepreise gemeldet wurden, zu dem konkret bezifferten Gewichtsanteil von 15 Prozent. 338 Die Schiedsstelle formulierte hierzu die allgemeine Leitlinie: Je höher die Zahl der Länder, für die verlässliche Angaben zu den tatsächlichen Abgabepreisen vorliegen, umso höher können die EU-Preise gewichtet werden. 339 Beim Kriterium der Jahrestherapiekosten vergleichbarer Arzneimittel geht es nach Ansicht der Schiedsstelle hingegen vor allem darum, das Preisniveau der derzeitigen Arzneimittelausgaben der GKV in dem jeweiligen Indikationsgebiet zu illustrieren. 34 Die Preise der vergleichbaren Arzneimittel haben nach Ansicht der Schiedsstelle die Funktion, Indikator für die Angemessenheit zu sein. Dies lässt sich jedenfalls daraus ableiten, dass die Schiedsstelle die Jahrestherapiekosten von bereits nutzenbewerteten Arz Verfahren 13b-Sst Cannabis sativa, S. 18. Verfahren 13b-Sst Vemurafenib, S. 21. Verfahren 13b-Sst Cannabis sativa, S. 18. Zipperer (214b), S. 89, S. 94. Verfahren 13b-Sst Cannabis sativa, S. 18. Verfahren 13b-Sst Vemurafenib, S. 23. Verfahren 13b-Sst Vermurafenib, S. 21; Fettstellung durch Verfasserinnen. Verfahren 13b-Sst Vemurafenib, S. 23.
206 186 Ergebnisse der Schiedsverfahren 5 neimitteln mit Erstattungsbetrag höher als Bestandsmarktarzneimittel gewichtet. 341 Bei Bestandsmarktarzneimitteln hält die Schiedsstelle einen direkten Vergleich [ ] nicht zu 1 % für möglich. 342 Dies ist sachgerecht, da die Preise von Bestandsmarktarzneimitteln nicht nutzenbasiert sind. An die Gewichtung der Kriterien in den Schiedssprüche zu Cannabis sativa und Vemurafenib knüpfte sich die Algorithmus -Diskussion der Industrie an, dass ein solches als synthetisch bezeichnetes Vorgehen zur Ermittlung der Erstattungsbeträge die Ergebnisse des Schiedsverfahrens unzulässig eng determiniere. 343 Ein solcher Algorithmus d. h. die Festlegung auf gewichtete Teilbeträge als Preiskomponenten und ihre Aufsummierung im Sinne einer Rechenformel gäbe ein zahlenmäßiges eindeutiges Ergebnis für den Erstattungsbetrag vor und ließe in gesetzeswidriger Weise kaum noch Raum für die Verhandlung oder das Ermessen der Schiedsstelle. 344 Die Schiedsstelle sah sich veranlasst im Schiedsspruch zu Vemurafenib explizit zu erläutern, dass sich aus den Gewichtungsunterschieden bei den Kriterien kein Algorithmus ergäbe, der den drei Kriterien oder zumindest einem von ihnen einen für alle Schiedsverfahren gleichen Wert zuordnete. 345 Gleichwohl lieh der Gesetzgeber dem Bedenken Gehör und stellte in der Gesetzesbegründung zum 3. AMG-Änderungsgesetz die geltende Rechtslage nochmals explizit klar, dass die Rahmenvereinbarung [ ] die Entscheidung jedoch nicht im Sinne eines konkret vorgegebenen Entscheidungsalgorithmus [determiniere, Umstellung d. V.]. 346 Festzustellen ist, dass auch nach der Gesetzesänderung durch das 3. AMG-Änderungsgesetz eine unterschiedliche Gewichtung von Nutzenbeschluss, Jahrestherapiekosten und EU-Preisen weiterhin erforderlich ist. Aufgabe der Verhandlungspartner wie der Schiedsstelle ist laut Gesetzesbegründung 347 wie Rahmenvereinbarung, einen dem festgestellten Zusatznutzen angemessenen Erstattungsbetrag zu verhandeln sowie einen Ausgleich zwischen den Interessen des pharmazeutischen Unternehmers wie der GKV-Versichertengemeinschaft zu finden. Wenn widerstreitende Interessen in einen angemessenen Ausgleich gebracht werden sollen, ist abzuwägen. 348 Zu den notwendigen Schritten gehört die Gewichtung der die Abwägung leitenden Kriterien. Wenn die Schiedsstelle in Cannabis Verfahren 13b-Sst Cannabis, S. 12, 19, Verfahren 13b-Sst Vemurafenib, S. 23. Verfahren 13b-Sst Cannabis, S. 19. Cassel, Ulrich (214), S. 11. Cassel, Ulrich (214), S. 13; Cassel, Ulrich (215), S. VII, S. 78; Deutscher Bundestag (213), S ähnlich die Argumentation zum 3. AMG-ÄndG, Wortbeitrag Vfa, Wortprotokoll, Öffentliche Anhörung 3. AMG-ÄndG am , Deutscher Bundestag, 213, S. 19 von 26. Verfahren 13b-Sst Vemurafenib, S. 21. BT-Drs. 17/1377, S. 24. BT-Drs. 17/2413, S. 31. Müller (1997), Rn. 392; Koch (1996), S.9f., S. 22f.
207 5 Ergebnisse der Schiedsverfahren 187 sativa ausführt, dass es dem Grundgedanken des AMNOG entspricht, dem Nutzenbeschluss das Hauptgewicht zu verleihen und demgegenüber den anderen Kriterien ein nachrangiges Gewicht zuordnet, vollzieht sie lediglich die im AMNOG nachweisbar angelegte abstrakte Gewichtung der Kriterien-Trias. Zugleich hat die Schiedsstelle darauf hingewiesen, dass die konkrete Gewichtung der jeweiligen Kriterien im Einzelfall bestimmt werden muss. Auch die flexible Gewichtungs-Leitlinie der Schiedsstelle für das EU-Preis-Kriterium: Je höher die Zahl der Länder, für die verlässliche Angaben zu den tatsächlichen Abgabepreisen vorliegen, umso höher können die EU-Preise gewichtet werden. 349 Entspricht dem Vorgehen bei der Abwägung, das konkrete Gewicht eines Belanges situationsbedingt zu beurteilen. Ebenso ist die Bezifferung der konkreten Gewichte im Verfahren zu Vemurafenib mit Prozentzahlen ein zulässiger Ansatz, den wertentscheidungshaltigen Prozess der Abwägung rationaler zu gestalten. Dies dient der Entscheidungstransparenz und dem Gleichbehandlungsgrundsatz. Damit ist eine Umwandlung der Erstattungsbetragsfindung in eine algorithmische Rechenformel aber noch lange nicht erreicht, da mit ihr Wertentscheidungen verbunden sind, die nicht in Zahlen ausgedrückt werden können. Vor dem Hintergrund der Algorithmus -Kritik von Seiten der Industrie erstaunt es umso mehr, wenn in einem Gutachten für den Bundesverband der Pharmazeutischen Industrie e.v. (BPI) aus dem Jahr 215 beklagt wird, dass bei der Monetarisierung des Zusatznutzens unklar bleibe, mit welchen Annahmen und Werturteilen das Ausmaß des Zusatznutzens durch die Schiedsstelle quantifiziert werde. 35 Es wird ein stark schematisiertes, schrittweises algorithmisches Verfahren angesprochen 351 und postuliert, statt des verbal formulierten ordinalen Nutzenniveaus nach AM-NutzenV sei für eine nutzenbasierte[n] Entscheidung über die Höhe des Preises bzw. Erstattungsbetrags [..] ein kardinales Skalenniveau unabdingbar. 352 Dies lässt die Annahme zu, dass die pharmazeutische Industrie einer schematisch-algorithmischen Vorgehensweise durchaus ambivalent gegenübersteht. Zusammenfassung Schwerpunkt der ersten vier Jahre Spruchpraxis der 13b- Schiedsstelle waren Erstattungsbeträge für Arzneimittel ohne Zusatznutzen. Die meisten Schiedsstellenverfahren wurden zu Wirkstoffen mit fehlendem Zusatznutzen und generischer zweckmäßiger Vergleichstherapie (zvt) eingeleitet. Dies dokumentiert, dass die Verfahren 13b-Sst Vermurafenib, S. 21. Cassel, Ulrich (215), S. 26, S. 64; Cassel, Ulrich (214), S. 18. Cassel, Ulrich (215), S. 64; Cassel, Ulrich (214), S. 19. Cassel, Ulrich (215), S. 25.
208 188 Ergebnisse der Schiedsverfahren 5 größte Herausforderung für die Schiedsstelle zu Beginn der AM- NOG-Ära in der von Seiten der pharmazeutischen Industrie fehlenden Akzeptanz der Rechtsvorgaben für die Preisfindung bei Arzneimitteln ohne Zusatznutzen lag. Im Umkehrschluss hat sich der Verhandlungsweg bei Arzneimitteln mit Zusatznutzen als effektives und konsensfähiges Instrument der Preisvereinbarung herausgestellt. Bei Arzneimitteln mit Zusatznutzen konnte die Schiedsstelle Stellung beziehen zur Gewichtung der Kriterien auf dem Weg zum Erstattungsbetrag. Darüber hinaus fiel es in ihren Aufgabenbereich, das Kriterium der tatsächlichen EU-Abgabepreise zu konkretisieren. Die ersten vier Jahre Schiedsspruchpraxis haben damit maßgeblich zur Klärung einiger wichtiger Fragen zur Umsetzung des AMNOG beigetragen. Für die Zukunft stehen weitere prägende und klärende Entscheidungen zu Grundfragen des AMNOG wie der Monetarisierung des Zusatznutzens an. Ebenso müssen Antworten auf die Tendenz zu freien Kombinationen verschiedener Wirkstoffe gefunden werden. Neue Therapien ersetzen die vorhandenen zunehmend nicht mehr, sie ergänzen sie syn- und metachron. Damit kommen die Kosten für die neuen Wirkstoffe zu den bisher anfallenden Kosten hinzu. Die Schiedsstelle hat diese Problematik in Cannabis sativa andeutungsweise berücksichtigt und solche add-on -Kosten bei der Höhe des Erstattungsbetrages mindernd veranschlagt. 353 Doch möglicherweise stoßen hier Verhandlungspartner wie Schiedsstelle an ihre Grenzen und der Gesetzgeber ist gefragt. Fest steht: Wenn für Kombinationen keine Regelungen gefunden werden, kann dies die finanzielle Stabilität der Gesetzlichen Krankenversicherung zukünftig gefährden. Dies wird auch die Schiedsstelle in den nächsten Jahren (weiter) beschäftigen. 353 Verfahren 13b-Sst Cannabis sativa, S. 2.
209 5 Ergebnisse der Schiedsverfahren Schlichtung nach einem gescheiterten AMNOG-Verfahren. Ein Plädoyer für eine Schiedsstelle 2. Gastbeitrag von Prof. Dr. med. W. Dieter Paar Medizinische Abteilung, Sanofi-Aventis Deutschland GmbH, Berlin-Frankfurt Gut vier Jahre sind seit Inkrafttreten des Arzneimittelmarktneuordnungsgesetzes (AMNOG) vergangen. Der Geschäftsbericht 214 des Gemeinsamen Bundesausschuss gemäß 91 SGB V weist aus, dass zwischen 211 und 214 insgesamt 13 Nutzenbewertungen abgeschlossen wurden. 55 der bewerteten Wirkstoffe wiesen einen Zusatznutzen auf. Am häufigsten (26/55) wurde ein geringer Zusatznutzen festgestellt. Die höchste Zusatznutzenkategorie ( erheblich ) wurde bisher keinem neuem Wirkstoff zugesprochen. 354 Analysiert man die Ergebnisse der bisherigen Nutzenbewertungen auf der Basis der Patientensubpopulationen, die mit den neuen Wirkstoffen behandelt werden können, so ergibt sich ein deutlich ungünstigeres Ergebnis. Über 6 % der neuen Wirkstoffe haben nach Auffassung des G-BA keinen Zusatznutzen zur Behandlung der verschiedenen Patientensubpopulationen. Dehnt man die Analyse auf einzelne Patienten aus, so verschlechtert sich das Ergebnis weiter. Aufsummiert über alle Subpopulationen umfasst die gesamte GKV- Zielpopulation ca. 31 Millionen Patienten. Nach den bisherigen Ergebnissen der frühen Nutzenbewertung ergibt sich für ca. 25 Mio. Patienten kein Zusatznutzen. Dies sind fast 8 %. 355 Eine Analyse von Greiner und Witte zeigt, dass 19 % der Verfahren bis 213 eine Marktrücknahme nach sich gezogen haben. 356 Diese Zahlen verdeutlichen, dass die Verhandlungsposition der pharmazeutischen Unternehmen (pu) in den zentralen Preisverhandlungen mit dem GKV-Spitzenverband (GKV-SV) schlecht ist. Es verwundert daher nicht, dass innerhalb der ersten vier Jahre nach Inkrafttreten des AMNOG bereits 21 Schiedsverfahren notwendig wurden. In 6 Fällen erfolgte eine Einigung zwischen GKV-SV und pu vor dem Ende der Schiedsverhandlung. Ziel des vorliegenden Beitrages ist eine kurze Übersicht über die bisherigen Ergebnisse der frühen Nutzenbewertung sowie die bisher abgeschlossenen Preisverhandlungen. Des Weiteren werden die bisherige Bilanz der AMNOG-Schiedsstelle und ihre rechtlichen Rahmenbedingungen dargestellt. Abschließend wird über eine wünschenswerte stärkere Mediatorrolle der Schiedsstelle diskutiert G-BA (215). Cassel, Ulrich (215). Greiner, Witte (215).
210 19 Ergebnisse der Schiedsverfahren 5 Frühe Nutzenbewertung und Erstattungsbeträge für Arzneimittel-Innovationen: Fazit nach 4 Jahren Nach Angaben des Gemeinsamen Bundesausschuss wurden seit dem Start der Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen im Jahr 211 bis zum Stichtag 31. Dezember Nutzenbewertungen abgeschlossen. 357 Hauptdiskussionspunkte in vielen dieser Verfahren sind: 358 Zweckmäßige Vergleichstherapie Studiendesigns Endpunkte Zahl der Patientensubpopulationen Größe der Patientensubpopulationen Saldierung von Nutzen und Risiko Kategorisierung des Zusatznutzens Ergebniswahrscheinlichkeit des Zusatznutzens Die bisherigen Ergebnisse der frühen Nutzenbewertung sind aus Sicht der pharmazeutischen Hersteller ernüchternd. Bezogen auf die Zahl der GKV Patienten findet sich in der überwiegenden Mehrzahl der Fälle kein Zusatznutzen (vgl. Abb. 31) G-BA (215). Paar (214).
211 5 Ergebnisse der Schiedsverfahren 191 Abbildung 31: Zwischenauswertung der führen Nutzenwertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V nach 13 Verfahren (modifiziert nach Cassel und Ulrich 215) Erstattungsbeträge nach früher Nutzenbewertung Schwabe und Paffrath haben im Arzneiverordnungsreport 214 eine umfangreiche Analyse der Erstattungsbeträge nutzenbewerteter Arzneimittel publiziert. 359 Bei den 25 umsatzstärksten nutzenbewerteten Arzneimitteln zeigte sich eine große Spannbreite der erzielten Preissenkungen. Die Preissenkungen nach den zentralen Preisverhandlungen zwischen pu und GKV-SV lagen zwischen % und 63 %. Bezogen auf die Zusatznutzenkategorien ergab sich folgendes Bild: Tabelle 26: Nutzenbewertung und Preissenkungen (Stand: ) Zusatznutzen Arzneimittel Preissenkung (Mittelwert) Range (%) Beträchtlich 5-18,1 % % 34,4 % Gering 1-21,7 % % 47,7 % Nicht quantifizierbar 3-17,5 % 1,8 % 2,9 % Kein Zusatznutzen 7-29,5 % % 63,1 % 359 Schwabe, Paffrath (214).
212 192 Ergebnisse der Schiedsverfahren 5 Aus einem internationalen Preisvergleich der 25 führenden nutzenbewerteten Arzneimittel folgern Schwabe und Paffrath, dass die mit dem AMNOG angestrebte Angleichung der deutschen Arzneimittelpreise an das europäische Niveau bei den nutzenbewerteten Arzneimitteln erreicht ist. 36 Nach einer aktuellen Statistik des Verbandes der forschenden Arzneimittelhersteller (Vfa) aus dem Juni 215 zeigt sich ein anderes Bild. 73 % aller verhandelten Erstattungsbeträge liegen unterhalb des mittleren europäischen Vergleichspreises (vgl. Abb. 32). 361 Abbildung 32: Erstattungsbetrag von 63 Arzneimitteln in Deutschland nach zentraler Preisverhandlung. Statistik des Vfa Juni Schwabe (214), S Vfa (215).
213 5 Ergebnisse der Schiedsverfahren 193 Aufgaben der Schiedsstelle nach 13b SGBV Wenn sich GKV-SV und pu nicht innerhalb von 6 Monaten nach Veröffentlichung der Beschlüsse des G-BA auf einen Erstattungsbetrag einigen können, werden sowohl der Erstattungsbetrag als auch alle sonstigen möglicherweise noch strittigen Vertragsinhalte innerhalb von 3 Monaten durch die Schiedsstelle festgesetzt ( 13 b Abs. 4). Die Schiedsstelle hat bei ihrer Entscheidung sowohl die Vorgaben des 13 b Abs. 1 als auch die Inhalte der Rahmenvereinbarung ( 13 b Abs. 9) umzusetzen. 362 Erst die Entscheidung der Schiedsstelle ist rechtsmittelfähig. Vorher hat der pu keine Möglichkeit Rechtsmittel im Rahmen der frühen Nutzenbewertung einzulegen. Insbesondere ist eine Klage gegen die Nutzenbewertung des G-BA unzulässig. 363 Die Schiedsstelle ist mit drei unabhängigen Mitgliedern und jeweils zwei Mitgliedern des pu und des GKV-SV besetzt, so dass sie insgesamt sieben Mitglieder hat. Patientenorganisationen können beratend an den Sitzungen der Schiedsstelle teilnehmen. Das Bundesministerium für Gesundheit (BMG) hat die Rechtsaufsicht und kann ebenfalls an den Sitzungen teilnehmen. Auf einem Vortrag anlässlich des DAV-Wirtschaftsforums am in Berlin hat der damalige unparteiische Vorsitzende der AMNOG-Schiedsstelle Zipperer Aufgaben und Nicht-Aufgaben der Schiedsstelle wie folgt zusammengefasst. 364 Aufgaben der Schiedsstelle Festsetzung des Inhalts von Vereinbarungen über Erstattungsbeträge für Arzneimittel, soweit sich GKV-Spitzenverband und pharmazeutisches Unternehmen nicht einigen bei Arzneimitteln mit Zusatznutzen Arzneimitteln ohne Zusatznutzen und wenn das Arzneimittel keiner Festbetragsgruppe zugeordnet werden kann Festsetzung des Vertragsinhaltes, soweit eine Vereinbarung zwischen dem GKV-Spitzenverband und einem pharmazeutischen Unternehmen oder ein Schiedsspruch von einer Vertragspartei gekündigt worden ist Festsetzung einer Rahmenvereinbarung, soweit sich der GKV- Spitzenverband und die vier Spitzenverbände der pharmazeutischen Unternehmen nicht über die Rahmenvereinbarung einigen Luthe (211). Schulte (213). Zipperer (214a).
214 194 Ergebnisse der Schiedsverfahren 5 Keine Aufgabe der Schiedsstelle Entscheidung über Vertragsteile, über die sich die Verhandlungspartner bereits geeinigt haben Entscheidung über Fragen, die durch Beschluss des G-BA bereits entschieden sind Korrektur von Feststellungen des G-BA Berücksichtigung von Abgabepreisen im Länderkorb und von Praxisbesonderheit (bei Arzneimittel ohne Zusatznutzen) Berücksichtigung von Kosten außerhalb der Arzneimitteltherapie (z. B. Krankenhaus, Lohnfortzahlung, Rente) Aus dieser eigenen Sichtweise auf die Aufgaben ergibt sich, dass die Schiedsstelle bei vielen inhaltlichen Punkten keine Vermittlerrolle übernehmen kann oder will. Sie fühlt sich extrem stark an die bisherigen Ergebnisse des Verfahrens gebunden und versteht sich ganz offensichtlich auch nicht ansatzweise als Mediator bei strittigen Punkten. Ergebnisse bisheriger Verfahren der AMNOG-Schiedsstelle Die beiden Schiedssprüche zu Sativex und Zelboraf wurden im Diskussionspapier 3-14 der Rechts- und Wirtschaftswissenschaftlichen Fakultät der Universität Bayreuth eingehend dargestellt und analysiert. 365 Im Fall von Sativex hatte die Rabatt-Forderung des GKV-SV 72,2 % betragen. Dem stand ein Rabatt Angebot des Herstellers von 36 % gegenüber. Der Schiedsspruch setzte einen Rabatt von 77,5 % fest. Dieser Rabatt war somit höher als vom GKV-SV gefordert. Auch im Fall von Zelboraf war der Schiedsspruch Rabatt höher als der vom GKV-SV geforderte Rabatt (62,1 % versus 58,5 %). In beiden Fällen fanden nach Schiedsspruch erneute Verhandlungen zwischen den Herstellern und dem GKV-SV statt. Beide Nachverhandlungen führten zu deutlich niedrigeren Rabatten als von der Schiedsstelle festgesetzt. In der zitierten Publikation finden sich folgende Rabatte. Sativex 57,4 % versus 77,5 %; Zelboraf 46,3 % versus 62,1 %. Tabelle 27 zeigt die von den Herstellern an die IFA GmbH gemeldeten Rabatte auf Abgabepreis des pharmazeutischen Unternehmers aus öffentlich zugänglichen Datenbanken (Stand: ; Fischer: Lauer-Taxe, GKV-SV, Vfa) sowie anhand von Pressemitteilungen. 365 Cassel, Ulrich (214).
215 5 Ergebnisse der Schiedsverfahren 195 Tabelle 27: Ergebnisse von AMNOG Schiedsstellenverfahren aufgrund von Recherchen in öffentlich zugänglichen Datenbanken (nv: nicht verfügbar, Stand August 215) Wirkstoff Handelsnamen Therapiegebiet Außer Vertrieb (AV), zurückgezogen (Z) Rabatt 1 Ablösung 2 Erstattungsbetrag festgesetzt (AV) -78, % nein Bromfenac Yellox Postoperative Entzündungen am Auge nach Kataraktoperationen Elvitegravir/Cobicistat/Emtricitabin/Tenofovirdisoproxil Stribild HIV-Infektion - -34,6 % nein Linaclotid Constella Reizdarmsyndrom mit Obstipation (AV) nv - Lixisenatid Lyxumia Diabetes mellitus Typ (AV) Perampanel Fycompa Epilepsie 15.6/ (AV) Perampanel Fycompa Epilepsie (AV) Perampanel Fycompa Epilepsie (AV) Retigabin Trobalt Epilepsie (AV) Vildagliptin Vildagliptin/Metformin Pomalidomid Insulin degludec Galvus/ Jalra/ Xiliarx Eurecas/ Icandra/ Zomarist Imnovid Tresiba Diabetes mellitus Typ 2 Diabetes mellitus Typ 2 Multiples Myelom Lebende Larven von Lucilia sericata Bio- Bag/Bio- Monde Freie Larven Wundheilung/Debridement Diabetes mellitus (AV) (AV) (AV 1mg, 2mg) (AV) Rückzug angekündigt nv - nv - nv - -89,1 % nein nv - -31,9 % -5,1 % (28 St.) nein -31,9 % nein -19,2 % 3-72, % 4-44,9 % 5 nein nv - nv -
216 196 Ergebnisse der Schiedsverfahren 5 Wirkstoff Handelsnamen Therapiegebiet Außer Vertrieb (AV), zurückgezogen (Z) Rabatt 1 Ablösung 2 Erstattungsbetrag vereinbart (nach geltendem Schiedsstellenspruch) Extrakt aus Cannabis Sativa Vemurafenib Sativex Spastik bei Multipler Sklerose - -48,3 % ja Zelboraf Melanom - -35,2 % Nein In der Schiedsstelle (Stand: ) Mirabegron Betmiga Überaktive Blase Siltuximab Sylvant Castleman- Krankheit (MCD) Fingolimod Gilenya Multiple Sklerose (AV) auf Herstellerabgabepreis; 2 gesetzlicher Herstellerrabatt inkl./abgelöst; 3 i. M. 3 mgm 4 mg; 4 1 mg; 5 2 mg Bisher wurden bezogen auf Wirkstoffe oder Wirkstoffkombinationen 12 Schiedsverfahren abgeschlossen. Mit Stand August 215 waren drei weitere Verfahren noch nicht abgeschlossen. Die von der Schiedsstelle festgesetzten Rabatte lagen zwischen 19,2 % und 89,1 %, der Mittelwert betrug 5,1 % (bezogen auf den Herstellerabgabepreis). Sechs der 12 Wirkstoffe, für die AMNOG- Schiedsverfahren durchgeführt wurden, sind nicht mehr auf dem deutschen Markt verfügbar. Auf die Fälle Sativex und Zelboraf wurde bereits eingegangen. Möglicherweise waren Nachverhandlungen mit dem Ergebnis niedrigerer Rabatte im Vergleich zum Schiedsspruch dafür ausschlaggebend, dass nicht auch diese Präparate vom Markt zurückgezogen wurden. Die Ergebnisse der bisherigen Schiedsverfahren können aus Sicht der pu nicht zufriedenstellend sein. Es besteht eine 5 %ige Wahrscheinlichkeit, dass am Ende eine Schiedsstellenverfahrens ein Marktrückzug aufgrund Festsetzung eines extrem hohen Rabattes stehen wird. Die Rabatte, die von der Schiedsstelle gesetzt wurden, führen im Mittel zu einer Halbierung des Markteintrittspreises und können in Extremfällen bis zu 89 % betragen. Der stellvertretende Vorsitzende der Schiedsstelle Gerhard Schulte hat diese ungünstige Situation für die pu in einem Beitrag einmal plakativ auf den Punkt gebracht: Schulte (213).
217 5 Ergebnisse der Schiedsverfahren 197 Empfehlung: Verpassen Sie nicht die vorletzte Ausfahrt. Man sollte als forschender Arzneimittelhersteller wohl in der Tat nicht davon ausgehen, dass in der Schiedsstelle durch Schlichtung und Mediation Ergebnisse erzielt werden könnten, die besser sind als diejenigen, die in den 5 vorausgegangenen Verhandlungsrunden erreichbar waren. Wenn man die bereits erwähnten Einigungen außerhalb oder nach der Schiedsstelle berücksichtigt, ist es wohl eher so (um im Bild von Schulte zu bleiben) dass man nach der letzten Ausfahrt (Schiedsstelle) besser noch eine zusätzliche allerletzte Behelfsausfahrt baut. Rechtliche Rahmenbedingungen für die AMNOG-Schiedsstelle Das Schiedsverfahren ist rechtlich ein Verwaltungsverfahren im Sinne der 8ff SGB X und der Schiedsspruch stellt daher einen Verwaltungsakt dar. Der Schiedsspruch hat eine Doppelnatur. Für die nicht unmittelbar am Schiedsverfahren Beteiligten wirkt er als Normenvertrag und entspricht damit einer untergesetzlichen Rechtsnorm. Für die Vertragsparteien und damit auch für den am Verfahren beteiligten pu handelt es sich rechtlich um einen vertragsgestaltenden Verwaltungsakt (vgl. BSG, U. v , B1 KR 27/11 R juris, Rd-Nr. 13 zur Schiedsstelle nach 114 SGB V). Da die Schiedsstelle den gleichen vertragsgestalterischen Freiraum beanspruchen kann wie die Vertragsparteien selbst, kann nach der Rechtsprechung nicht auf ein bestimmtes Schiedsergebnis geklagt werden, sondern es kann nur der Schiedsspruch mit einer Anfechtungsklage angegriffen werden. Dies heißt, dass das Gericht lediglich den Schiedsspruch aufheben wird, aber den Inhalt nicht selbst festsetzen wird. In einem solchen Fall muss dann erneut die Schiedsstelle entscheiden. In den Gesetzestexten zum AMNOG finden sich keine detaillierten Anmerkungen zur Aufgabe der Schiedsstelle. In 13b Abs. 6 Satz 2 SGB V finden sich hinsichtlich der Geschäftsordnung beschränkte Verweise auf zwei andere Schiedsstellen. Es handelt sich hierbei zum einen um die Schiedsstelle für den Bundesapothekenrahmenvertrag ( 129 SGB V) und zum zweiten um das Schiedssamt für die vertragsärztliche Versorgung ( 89 SGB V). Der Verweis auf diese beiden Schiedsstellen legt nahe, dass sie für die AMNOG-Schiedsstelle einen gewissen Vorbildcharakter haben können oder vielleicht sogar haben sollen. Das Schiedsamt für die vertragsärztliche Versorgung hat eine lange Tradition und der o. g. Vorbildfunktion folgend ist die Geschäftsordnung der AMNOG-Schiedsstelle teilweise der Schiedsamtsverordnung nachgebildet. Die Parallelität liegt also auf der Hand. Nach 89 SGB V soll das Schiedsamt für vertragsärztliche Versorgung den Vertragsparteien Gelegenheit geben, sich nach Möglichkeit unter Vermittlung des Schiedsamtes zu einigen, ohne dass es zu einem Schiedsspruch kommt (Becker/Kingreen,
218 198 Ergebnisse der Schiedsverfahren 5 Rd.-Nr. 1 zu 89 SGB V; Schnapp, NZS 23, 337, 338; Berchtold- Huster/Rehborn-Reuter, Rd.-Nr. 64 zu 89 SGBV; Kasskomm- Hess, Rd-Nr. 9 zu 89 SGB V). Deshalb wird im Rahmen des 89 SGB V der Schiedsspruch als rechtsgestaltende Vertragshilfe eingestuft (Becker/Kingreen, Rd.-Nr. 18 zu 89 SGB V; BeckOK SGB V-Joussen, Rd-Nr. 1 zu 89 SGBV). Die Vertragsparteien können daher auch jederzeit durch eine Einigung das Schiedsverfahren beenden bzw. einem Schiedsspruch die Grundlage entziehen. Das BSG spricht daher davon, dass das Schiedsamt lediglich die Stellung eines Interessenmittlers und eines gegenüber der Autonomie der Vertragspartner nachrangigen, ihre Einigung ersetzendes Entscheidungsgremiums hat (SGB V, U. v , B 6 KA 2/99 R Juris, Rd-Nr. 28). Diese rechtlichen Festlegungen sind unschwer als Aufforderung zur Übernahme einer Mediatorrolle zu verstehen. Auch der 13 Abs. 1 Satz 1 der Geschäftsordnung der Gemeinsamen Schiedsstelle nach 13 b Abs. 5 SGB V spricht dafür, dass sich die AMNOG-Schiedsstelle in stärkerem Maße als bisher geschehen als echter Mediator verstehen sollte. Hier heißt es: Kommt ein Vertrag nach 13 b Abs.1 oder 3 SGB V ganz oder teilweise nicht zustande, stellt mindestens eine der Vertragsparteien den Antrag, eine Einigung über den Inhalt des Vertrages herbeizuführen. Die Schiedsstelle hat danach also eine Einigung über den Inhalt des Vertrages herbeizuführen. Dies spricht ebenfalls für eine Mediatorrolle. Der Beschlussempfehlung und dem Bericht des Ausschuss für Gesundheit (BT Drucksache 17/1377) ist ebenfalls eine Sichtweise auf die Rolle der Schiedsstelle zu entnehmen. 367 Im Dritten Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften findet sich die folgende Neuformulierung von Absatz 4 Satz 2: Die Schiedsstelle entscheidet unter freier Würdigung aller Umstände des Einzelfalls und berücksichtigt dabei die Besonderheiten des jeweiligen Therapiegebietes. 368 In den Begründungen und Diskussionen wird darauf abgehoben, dass der Schiedsstelle bei der Festlegung des Erstattungsbetrages sehr wohl ein eigener Entscheidungsspielraum zusteht und dass die Preisfindung durch die Schiedsstelle im Einzelfall und individuell erfolgen sollte. Diese gesetzlichen Formulierungen und parlamentarischen Kommentare können sicher als Aufforderung an die Schiedsstelle verstanden werden, sich stärker als ein wirklicher Schlichter und Mediator zu verstehen und nicht nur im engen Rahmen des G-BA Beschlusses einen Schiedsspruch zu verkünden BT-Drs. 17/1377. Drittes Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften (213).
219 5 Ergebnisse der Schiedsverfahren 199 Analysiert man öffentlich zugängliche Schiedssprüche, so hat die Schiedsstelle inzwischen in zwei Fällen eine etwas offenere Haltung eingenommen. Im Linaclotid-Schiedsspruch hat die Schiedsstelle immerhin anerkannt, dass in den Fällen, in denen der Beschluss eine Lücke lässt, die auch die tragenden Gründe nicht ausfüllen, die Schiedsstelle entscheiden kann. Im Vildagliptin-Schiedsspruch hat die Schiedsstelle nicht die Prävalenzen des G-BA zugrunde gelegt, sondern die sich aus der Versorgungsrealität ergebende Verteilung auf die Populationen. Schiedsstelle 2. Die bisherige Bilanz der Schiedsstelle und die Tatsache, dass der GKV-Spitzenverband faktisch zu keinen nennenswerten Zugeständnissen im Rahmen von Schiedsverfahren bereit war, oder bereit sein musste, belegt sehr klar die These von Cassel und Ulrich, dass sie sich als Richter und nicht als Schlichter versteht. 369 Die Schiedsergebnisse richten sich in der großen Mehrzahl klar an der Verhandlungsposition des GKV-Spitzenverbandes aus. Die in der Schiedsstelle diskutieren und später festgesetzten Rabatte bewegen sich in den vom GKV-Spitzenverband erwarteten Größenordnungen oder liegen sogar noch darüber. Cassel und Ulrich führen diesen Umstand u. a. darauf zurück, dass die Schiedsstelle bisher ihr Schiedsermessen faktisch ausschließlich auf den Grundlagen und Kriterien einer nur privatrechtlich vereinbarten Rahmenvereinbarung ( 5 und 6) ausrichtet und nur diese als rechtverbindliche Entscheidungsdeterminanten übernimmt. Wie dargelegt kann man die dargestellte Vorbildfunktion des Schiedsamt für vertragsärztliche Versorgung und andere gesetzliche Festlegungen aber durchaus auch so interpretieren, dass die Festlegungen in der Rahmenvereinbarung lediglich einen Orientierungsrahmen darstellen und es keinesfalls ausgeschlossen sein muss, auch eine deutlich stärkere Schlichter- oder Mediatorfunktion zu übernehmen. Aus Sicht eines pu, der ein Schiedsverfahren durchlaufen hat das letztlich zum Marktrückzug des Produktes geführt hat, erscheint es durchaus vorstellbar, dass eine Schiedsstelle 2. mit einer etwas veränderten Herangehensweise auch in den Fällen Lösungen zwischen pu und GKV-SV moderieren könnte, in denen es bisher zu einem Marktrückzug gekommen ist. Es wurde bereits dargelegt, dass die Preisverhandlungen sehr häufig in Konstellation ablaufen in denen über verschiedene Patientensubpopulationen verhandelt wird. Ein innovativer Wirkstoff hat dann bei der Verhandlung teilweise verschiedene Vergleichstherapien die zur Rabattfindung herangezogen werden. Gerade in chronischen 369 Cassel, Ulrich (214).
220 2 Ergebnisse der Schiedsverfahren 5 Behandlungsindikationen in denen es über viele Jahre kaum einen Therapiefortschritt in einzelnen Patientensubpopulationen gegeben hat, sind die Vergleichstherapien generisch und haben einen niedrigen Preis. Bei anderen Patientensubpopulationen in der gleichen Indikation können aber noch Vergleichstherapien mit noch laufendem Patentschutz Preisanker sein. Bei einem neuen Wirkstoff wird die Rabattforderung des GKV SV bei Patientenpopulationen ohne Zusatznutzen sehr hoch sein und bei Patientenpopulationen mit Zusatznutzen wird sie deutlich geringer ausfallen. Häufig sind solche Konstellationen letztlich nicht mehr mit einem Mischpreis zu überbrücken. Hier sollte es Ziel und Anspruch einer Schiedsstelle 2. sein, dabei zu helfen, eine Lösung zu finden, mit der das Produkt am Markt bleiben kann. Vorstellbar wäre es in diesem Zusammenhang zum Beispiel, auf Maßnahmen hinzuwirken, die sicherzustellen, dass im Versorgungsalltag hauptsächlich die Patientenpopulationen mit einem Zusatznutzen behandelt werden. Die AMNOG-Schiedsstelle könnte in diesem Kontext durchaus Therapiehinweise oder Verordnungseinschränkungen anregen und über die zusätzliche Festlegung von Mengengerüsten mit dazu beitragen, dass die richtigen Patienten mit dem innovativen Wirkstoff behandelt werden. Selbst in Schiedsverfahren mit innovativen Wirkstoffen ohne Zusatznutzen erscheint es theoretisch vorstellbar, in der Schiedsstelle doch noch eine Einigung zu erzielen. In der Logik des AMNOG dürfen solche Wirkstoffe ohne Zusatznutzen nicht zu höheren Jahrestherapiekosten führen als die nach 35a Absatz 1 Satz 7 bestimmte zweckmäßige Vergleichstherapien. Sind nach 35a Absatz 1 Satz 7 mehrere Alternativen für die zweckmäßige Vergleichstherapie bestimmt, darf der Erstattungsbetrag nicht höher sein als derjenige der wirtschaftlichsten Alternative. Es gibt Situationen in denen die zweckmäßigen Vergleichstherapien für bestimmte Patientenpopulationen ganz erhebliche Preisunterschiede aufweisen. Einem Beschluss des G-BA aus dem Jahr 213 ist zu entnehmen, dass die Jahrestherapiekosten der zweckmäßigen Vergleichstherapie zur Behandlung des Typ-2-Diabetes mellitus zwischen 62,58 und 849,49 variieren können (ohne Kosten für zusätzliche GKV Leistungen). 37 Die teuerste Variante der zweckmäßigen Vergleichstherapie ist somit 13-mal teurer als die wirtschaftlichste Alternative! Natürlich wird kein Arzt einen Patienten mit einem Diabetes mellitus Typ II mit einer intensivierten Insulintherapie mit Jahrestherapiekosten von ca. 85 behandeln, wenn eine Therapie mit generischen oralen Antidiabetika medizinisch möglich und therapeutisch ausreichend ist. Die wirtschaftlichste Alternative mit Jahrestherapiekosten von ca. 62 ist aber natürlich keine Option mehr für einen Diabetes Typ II Patienten, der insulinpflichtig geworden ist. Nach der AMNOG-Logik 37 G-BA (213).
221 5 Ergebnisse der Schiedsverfahren 21 bleibt die medizinisch nicht mehr sinnvolle Alternative sowohl bei den Verhandlungen mit dem GKV-Spitzenverband als auch in der Schiedsstelle formal die wirtschaftlichste Alternative. Faktisch ist sie es jedoch für viele Patienten nicht mehr. In dieser Konstellation wird man für eine innovative subkutan verabreichte Diabetestherapie (z. B. GLP-Rezeptoragonist) die eine Alternative zur intensivierten Insulintherapie (Jahrestherapiekosten ca. 85 ) auch dann keine Verhandlungslösung finden, wenn der Hersteller bereit ist, diese Jahrestherapiekosten (der faktisch realen zweckmäßigen Vergleichstherapie) für diese Patientengruppe nicht zu überschreiten. Es ist wünschenswert, dass die Mediatorfunktion der Schiedsstelle 2. genau in solchen Konstellationen in Zukunft verstärkt zum Tragen kommt. In einer solchen Konstellation kann eine Vermittlung zwischen GKV-SV und pu für einen innovativen Wirkstoff nur dann gelingen, wenn versucht wird zu schlichten und nicht im Kontext von Rahmenvereinbarung und den bisher erfolglosen Verhandlungsrunden zu richten. Die wirtschaftlichste Alternative ist im ärztlichen Versorgungsalltag eben gerade nicht die einzige Alternative, wie das o. g. Beispiel gut illustriert. Es sollte möglich sein, im Rahmen eines echten Schiedsverfahren die faktisch reale zweckmäßige Vergleichstherapie so stark zu gewichten, dass ein Erstattungsbetrag für die innovative Therapie, der nicht zu höheren Jahrestherapiekosten führt, eine Chance für eine Einigung bietet. Denn diese Kosten der realen zweckmäßigen Vergleichstherapie fallen ja auch im Versorgungsalltag bei den Krankenkassen und sind Teil der zu berücksichtigenden Versorgungsrealität, die gemäß Beschlussempfehlung des Gesundheitsausschusses zu AMNOG, also nach dem Geiste AMNOGs, unbedingt Berücksichtigung finden sollte Sollte ein solcher Gestaltungsrahmen im Rahmen des Schiedsverfahren auch in Zukunft nicht möglich sein, so werden auch weiterhin viele Konstellationen unüberbrückbar bleiben.
222 22 Ergebnisse der Schiedsverfahren Literatur BT-Drs. Bundestagdrucksache 17/2413 vom : Entwurf eines Gesetzes zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung (Arzneimittelmarktneuordnungsgesetz AMNOG). BT-Drs. Bundestagdrucksache 17/1377 vom : Beschlussempfehlung und Bericht zu dem Entwurf eines Dritten Gesetzes zur Änderung arzneimittelrechtlicher und anderer Vorschriften. Cassel D, Ulrich V (214): AMNOG-Schiedsstelle: Schlichter oder Richter? Schiedsamtliche Preisermittlung bei neuen Arzneimitteln jenseits von Angebot und Nachfrage. URL: (Stand: ). Cassel D, Ulrich V (215): AMNOG auf dem ökonomischen Prüfstand Funktionsweise, Ergebnisse und Reformbedarf der Preisregulierung für neue Arzneimittel in Deutschland: Gutachten für den Budenverband der Pharmazeutischen Industrie e.v. (BPI). URL: net/presse/pressekonferenzen/215/ _cassel-ulrich- AMNOG-Gutachten_Schlussfassung.pdf (Stand: ). Deutscher Bundestag (213): Ausschuss für Gesundheit: Wortprotokoll,19.Sitzung. URL: Docs/Downloads/DE/Bibliothek/Gesetzesmaterialien/17_wp/arzneimittelr3/wortproto.pdf? blob=publicationfile (Stand: 215). G-BA Gemeinsamer Bundesausschuss (213): Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel- Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB V Lixisenatid. URL: 186/ _AM-RL-XII_Lixisenatid_BAnz.pdf (Stand: ). G-BA Gemeinsamer Bundesausschuss (215): Geschäftsbericht 214 Gemeinsamer Bundesausschuss gemäß 91 SGB V. URL: (Stand: ). GKV-SV (211): Dr. Manfred Zipperer wird unparteiischer Vorsitzender der Schiedsstelle nach 13 b Abs. 5 SGB V. Gemeinsame Presseerklärung vom , Berlin. Greiner W, Witte J (215): AMNOG-Report 215. Arzneimittelreform auf dem Prüfstand. URL: (Stand: ). Klein L (212): Finaler Schiedsspruch zu Länderkorb. Schiedsstelle setzt sich über Bedenken der Hersteller hinweg. DAZ-online vom Koch HJ (1996): Die normtheoretische Basis der Abwägung, in: Ergbuth W, Oebbecke J, Rengeling HW, Schulte M (Hrsg.): Abwägung im Recht: Symposium und Verabschiedung von Werner Hoppe am 3. Juni 1995 in Münster aus Anlass seiner Emeritierung. Köln, Berlin Bonn, München: Heymann. Luthe EW (211): Erstattungsvereinbarungen mit pharmazeutischen Unternehmen. Pharma Recht, 6,
223 5 Ergebnisse der Schiedsverfahren 23 Müller F (1997): Juristische Methodik. Berlin: Duncker & Humblot. Paar WD (214): AMNOG: Hindernis und/oder Beschleuniger für Innovationen? Monitor Versorgungsforschung, 7 (3): Pohlmann, P, Schulze Schwienhorst, M, Steinmeyer, HD (Hrsg.): 19. Münsterische Sozialrechtstagung: Regulierung der Arzneimittelverordnung Zu viel des Guten? Karlsruhe: Verlag Versicherungswirtschaft. Sucker-Sket K (215): AMNOG-Schiedsstelle. Wasem neuer Vorsitzender. DAZ-online vom Schulte G (213): Letzte Ausfahrt AMNOG Schiedsstelle. URL: (Stand: ). Schwabe U, Paffrath D (Hrsg.) (214): Arzneitverordnungs-Report 214. Aktuelle Daten, Kosten, Trends und Kommentare. Berlin, Heidelberg: Springer-Verlag. Schwabe U (214): Drei Jahre Nutzenbewertung von neuen Arzneimitteln gemäß AMNOG, in Schwabe U, Paffrath D (Hrsg.): Arzneitverordnungs-Report 214. Aktuelle Daten, Kosten, Trends und Kommentare. Berlin, Heidelberg: Springer-Verlag. Zipperer M (214a): Aufgaben und Erfahrungen der Schiedsstelle nach 13b SGBV. URL: loads/214/1/dr.-manfred-zipperer_dav-wirtschaftsforum- 214.pdf (Stand: ). Zipperer M (214b): Preisbildung auf dem Arzneimittelmarkt Einschätzung aus Sicht der Schiedsstelle, in Dörner, H, Ehlers, D, Vfa Verband Forschender Arzneimittelhersteller e.v. (215): Niedrige Arzneimittelpreise in Deutschland: URL: (Stand: ).
224 24 6 Umsetzung des AMNOG in der Verordnungspraxis 6.1 Methodik Ein mit Einführung des AMNOG verfolgtes Ziel war es, Patienten im Krankheitsfall die besten und wirksamsten Arzneimittel zur Verfügung zu stellen. Die Feststellung der Qualität und Quantität des Mehrnutzens neuer Präparate ist zur Umsetzung dieser Zielsetzung nur der erste Schritt. Der zweite erfordert eine an den Ergebnissen der frühen Nutzenbewertung orientierte Weiterentwicklung des ärztlichen Verordnungsverhaltens. Die Grundlage für entsprechende Analyse zur Versorgung mit bislang nutzenbewerteten Arzneimitteln in Deutschland bilden nachfolgend ambulant-ärztliche Abrechnungsdaten von Versicherten der DAK-Gesundheit aus dem Zeitraum bis zum Auf eine ver-sichertenbezogene Analyse wurde verzichtet. Analog zu vergleichbaren Untersuchungen arzneimittelbezogener Verordnungsdaten entspricht eine ärztliche Verordnung einer Arzneimittelpackung, wobei die Anzahl der auf einem Rezept verordneten Packungen als Multiplikationsfaktor in die Berechnungen der Umsatz- und Verordnungsvolumina einfließt. Für Arzneimittel in Zubereitung werden nur die verordnungsbezogenen Mengenanteile sowie der Brutto-Apothekenverkaufspreis berücksichtigt. In die Analyse eingeschlossen wurden alle bis zum vom G-BA mit Veröffentlichung der Beschlussfassung nutzenbewerteten Wirkstoffe. Absolute und relative Veränderungen der Verordnungsvolumina werden über definierte Tagesdosen (DDD) abgebildet. Die definierte Tagesdosis (defined daily dose, DDD), als Maß für die verordnete Arzneimittelmenge, basiert auf der Menge eines Wirkstoffes bzw. eines Arzneimittels, die typischerweise auf die Hauptindikation bei Erwachsenen pro Tag angewendet wird. Quantifizierte Tagesdosen werden im Kontext des Sozialrechts u. a. zur Festbetragsermittlung in 35 Abs. 1 SGB V, verwendet. Auch in anderen Zusammenhängen, z. B. im Arzneiverordnungs-Report, für Verbrauchsentwicklungen, Kostenvergleiche und zur Ermittlung von Einsparpotenzialen werden rechnerische Tagesdosen verwendet und sie wurden hinsichtlich ihrer Vor- und Nachteile hinreichend diskutiert. Zu berücksichtigen ist, dass eine DDD nicht die empfohlene oder tatsächlich verordnete Tagesdosis wiedergibt, sondern eine technische Maßund Vergleichseinheit darstellt. Gegenüber anderen Messgrößen, wie der Anzahl abgegebener Verpackungen, oder dem damit erzielten Umsatz hat die DDD den Vorteil, dass der Verbrauch eines Arzneimittels anhand einer zuvor festgelegten Wirkstoffmenge direkt gemessen wird. Ein weiterer Vorteil der DDD als Vergleichsmaß ist, dass Änderungen der Packungsgrößen oder Dosisstärken den gemessenen Verbrauch nicht verfälschen können. Bei Wirkstoffen, bei
225 6 Umsetzung des AMNOG in der Verordnungspraxis 25 denen noch keine amtliche DDD vorhanden ist (Nintedanib, Ledipasvir/Sofosbuvir) wurde in den Berechnungen ersatzweise auf die in Modul 3 des Herstellerdossiers abgebebenen Verbrauchsmengen (z. B. prescribed daily dose ) zurückgegriffen. Darüber hinaus werden im Bericht Bruttoumsatzbeträge ausgewiesen. Brutto versteht sich als Preis des Arzneimittels bzw. der Verordnung gemäß Apothekenverkaufspreis inkl. MwSt. (also wie auf dem Rezept). Es werden keine Zuzahlungen, keine Zwangsrabatte und keine individuellen Rabatte, die zwischen der DAK und dem pharmazeutischen Unternehmer vereinbart wurden, berücksichtigt. Bei Wirkstoffen, die als individuelle Zubereitung eingesetzt werden, wurde die Packungsanzahl mit dem Preis multipliziert, um den korrekten Umsatz zu erhalten. Detaillierte, wirkstoffspezifische Übersichten finden sich in Abschnitt III am Ende dieses Reportes.
226 26 Umsetzung des AMNOG in der Verordnungspraxis Effekte der Arzneimittelbewertung auf die Marktdurchdringung Umsatzentwicklungen nutzenbewerteter Wirkstoffe Zur Einführung des AMNOG formulierte der Gesetzgeber drei mit der frühen Nutzenbewertung verbundene Ziele: 1. Menschen müssen im Krankheitsfall die besten und wirksamsten Arzneimittel zur Verfügung stehen. 2. Die Preise und Verordnungen von Arzneimitteln müssen wirtschaftlich und kosteneffizient sein. 3. Es müssen verlässliche Rahmenbedingungen für Innovationen, die Versorgung der Versicherten und die Sicherung von Arbeitsplätzen geschaffen werden. 371 Alle drei formulierten Ziele führen heute zu abweichenden Beurteilungen über den Regulierungserfolg der frühen Nutzenbewertung. Während die Ziele 2 und 3 im Kontext der Diskussion um die einjährige freie Preisbildung erneut aufgegriffen werden (Kapitel 7.1), führt insbesondere die mit Einführung der frühen Nutzenbewertung verbundene Forderungen nach einer bestmöglichen Patientenversorgung zu weitreichendem Dissens. Denn was eine bestmögliche Versorgung von Patienten in AMNOG-relevanten Märkten ausmacht ist definitionswürdig und vom Gesetzgeber nicht weiter konkretisiert. Es fehlt eine eindeutige Bezugsgröße. Diese ist folglich abhängig von der Bewertungsperspektive. Nachfolgend werden deshalb zunächst die allgemeinen Verordnungs- und Umsatzentwicklungen der AMNOG-Präparate basierend auf Abrechnungsdaten der DAK- Gesundheit aufgearbeitet. Darauf aufbauen erfolgt eine systematische Untersuchung nutzenbewertungsinduzierter Effekte auf die Marktentwicklung der bislang bewerteten neuen Wirkstoffe. Nachfolgenden Berechnungen liegen insgesamt 111 Arzneimittel mit neuem Wirkstoff in einem Betrachtungszeitraum vom bis zum zugrunde. Für 11 Wirkstoffe liegen keine Verordnungen vor, so dass insgesamt nur 1 Wirkstoffe in die Auswertungen eingingen. Eine detaillierte Übersicht der eingeschlossenen Wirktsoffe findet sich in indikationsspezifischen Übersichten in Teil III dieses Reportes. Im Jahr 211 liegen für 24 der betrachteten Wirkstoffe Umsätze vor, für sechs davon für das gesamte Kalenderjahr. Die Umsätze des Jahres 212 basieren auf insgesamt 42 Arzneimitteln mit neuem Wirkstoff, die Hälfte dieser Wirkstoffe wurde im gesamten Kalenderjahr verordnet. In 213 steigt die Anzahl der betrachteten Wirkstoffe auf 62 (41 mit vollem Beobach- 371 BT-Drs. 17/3116; S. 1.
227 6 Umsetzung des AMNOG in der Verordnungspraxis 27 tungsjahr), 214 auf insgesamt 94 (57 mit vollem Beobachtungsjahr). Für sechs weitere Wirkstoffe liegen nur Verordnungsdaten für das Jahr 215 vor. Die in 213 bewerteten Gliptine aus dem ersten Bestandsmarktaufruf werden in nachfolgenden Auswertungen nicht berücksichtigt, um nutzenbewertungsinduzierte Effekte nicht zu verzerren. Während basierend auf den verliebenen 95 Arzneimitteln mit neuem Wirkstoff die kummulierten Verordnungsvolumina von 211 auf 212 zunächst nur langsam anstiegen (+19 %) erhöhten sich die Bruttokosten überproportional stark (+82 %, vgl. Abb. 33). In 213 stiegen die Umsatzvolumina (+61 %) überproportional im Vergleich zu den Bruttokosten (+41 %) an. Dieser Effekt wird besonders getragen durch die stark gestiegenen Umsatzvolumen von Aclidiniumbromid, Apixaban oder Dapagliflozin. 214 verdoppelten sich noch einmal sowohl die registrierten Verordnungsmengen als auch die korrespondierenden Bruttoausgaben. Dies ist insbesondere auf die Markteinführung neuer hochpreisiger Hepatitis-C und MS-Threapien (Daclastavir, Simeprevir und Sofosbuvir bzw. Dimethylfumarat) in Kombination mit schnell ansteigenden Verordnungsvolumina auch in anderen Marktsegmenten (Dapagliflozin/Metformin bei Diabetes mellitus Typ 2, Fluticasonfuroat/Vilanterol-Trifenatat bei COPD oder Mirabegron bei überaktiver Blase) zurückzuführen. Zudem trägt die weitere Marktdurchdringung älterer AMNOG-Produkte zu diesem Trend bei. Abbildung 33: Umsatzmengen und Bruttokosten für AMNOG-Präparate Verdopplung der Umsatzvolumina in DDD Bruttokosten DDD Aus der Relation von Verordnungsmenge der nutzenbewerteten Wirkstoffe und den jeweiligen Bruttopreisen je DDD lässt sich das reale Mengen/Preis-Verhältnis des AMNOG-Marktes aus GKV-Perspektive entwickeln. Die Skalen in Abbildung 34 wurden dabei logarithmisch transformiert, um große Preis- und Mengenunterschiede
228 28 Umsetzung des AMNOG in der Verordnungspraxis 6 übersichtlich abzubilden. Die inzwischen fortgeschriebenen Zeitreihen bestätigen, dass im Rahmen der Erstattungsbetragsverhandlung eine auf prognostischen Überlegungen wie den erwarteten Versorgungsanteilen ruhende kostenbasierte Preisbildung Teil des Verhandlungsrahmens sein könnte. Im Mittel liegen Bruttopreise von 227,8 je DDD vor (Standardabweichung: 427,7). Dabei zeigt sich eine schwache Korrelation zwsichen hohen Absatzmengen und niedrigem Preis je DDD (r² =.35; Korrelationskoeffizient nach Pearson: -.11). Abbildung 34: Verhältnis von Verordnungsmenge und Bruttopreis je DDD nutzenbewerteter Arzneimittel (ln) Preis/DDD (ln) Menge in DDD Markteintritt hochpreisiger Präparate mit hoher Prävalenz Unter den fünf neuen Präparaten mit dem höchsten Bruttoumsatz im Jahr 214 sind mit Sofosbuvir (49 %), Abirateronacetat (85 %) und Ipilimumab (1 %) drei Wirkstoffe mit zumindest in einem Teilanwendungsgebiet beträchtlichem Zusatznutzen. Lediglich Dimethylfumarath, zugelassen zur Behandlung von Patienten mit schubförmig remittierender Multiplen Sklerose (RRMS), konnte im Vergleich zur zvt keinen Zusatznutzen belegen. Mit Sofosbuvir und Dimethylfumarat sind zudem zwei Wirkstoffe unter den Top 3, welche in 214 erstmalig zur Patientenversorgung zur Verfügung standen (vgl. Tab. 28).
229 6 Umsetzung des AMNOG in der Verordnungspraxis 29 Tabelle 28: Top 5 AMNOG-Wirkstoffe nach Höhe des Bruttoumsatzes in 214 Wirkstoff Bruttoumsatz ( ) Sofosbuvir Abirateron Dimethylfumarat Fingolimod Ipilimumab Die Markteinführung und Entwicklung von Sofosbuvir wurde von großem medialem Echo begleitet (vgl. Kapitel 4.1). Doch auch der Markteintritt von Dimethylfumarat (Tecfidera ) sorgte auch auf politischer Ebene für Diskussionen. 372 Der Wirkstoff Fumarsäure ist schon lange am Markt etabliert und kam bislang in der Dermatologie zur Behandlung der Psoriasis zum Einsatz. Nach neuen Forschungsergebnissen erfolgte Herstellerseitig jedoch die Zulassung für die Indikation Multiple Sklerose (MS). Der G-BA sah Dimethylfumarat (Tecfidera ) im Febraur 214 zunächst nicht als neuen Wirkstoff an, da dieser Wirkstoff bereits vor dem 1. Januar 211 seine erstmalige Zulassung erhalten hat und hierfür kein Unterlagenschutz mehr besteht, schwenkte dann jedoch nach weiterer Diskussion mit dem Hersteller um, sodass inzwischen doch eine frühe Nutzenbewertung erfolgt ist. 373 Nach Einschätzung des G-BA waren die in dem Psoriasismittel Fumaderm (Dimethylfumarat plus verschiedene Monoethylfumaratsalze) Wirkstoffe nicht als derselbe Wirkstoff anzusehen wie in Tecfidera. Im Ergebnis der G-BA-Bewertung konnte kein Zusatznutzen belegt werden. Als zweckmäßige Vergleichstherapie wurde Interferon-beta bzw. Glatirameracetat mit einem relativ hohen Preisniveau herangezogen. Dem hohen Preis bei Markteintritt folgt eine Absenkung nach der Nutzenbewertung, aber durch die hochpreisige, zweckmäßige Vergleichstherapie verbleibt der Preis auf hohem Niveau. In der Folge ließ sich auch für Dimethylfumarat dennoch ein hoher Erstattungsbetrag erzielen. Gegenüber anderen MS-Therapeutika zeigt Dimethylfumarat für die Basistherapie von MS ggf. bedeutende Vorteile hinsichtlich der Administration. Es kann zweimal täglich als Kapsel mit dem Essen eingenommen werden und es ist keine Injektion notwendig. Insbesondere aber das Nebenwirkungsspektrum ist im Hinblick auf bisherige Thrapieregime versorgungsrelevant. Im Arznei-Telegramm wird Dimethylfumarat als Mittel der Reserve bei Unverträglichkeit oder un- Versorgungsrelevanter Nutzen bei Dimethylfumarat? BT-Drs. 18/1671. Arznei-Telegramm (214).
230 21 Umsetzung des AMNOG in der Verordnungspraxis 6 zureichender Wirksamkeit von Beta-Interferonen oder Glatirameracetat gewertet. 374 Zur Erklärung des raschen Anstiegs im Verordnungsvolumen ist deshalb von Interesse, wieviele der mit Dimethylfumarat behandelten Patienten erstmals eine medikamentöse MS-Therapie erhielten. Eine Auswertung der Verordnungsdaten für DAK-Versicherte zeigt, dass im Zeitraum von Februar 214 bis Juli 215 insgesamt Patienten mit Dimethylfumarat behandelt wurden. Innerhalb dieses Zeitraumes fielen Bruttokosten in Höhe von 51,4 Millionen für 694 Tausend verordnete Tagesdosen an (vgl. Abschnitt III). 42,7 % der mit Dimethylfumarat im Beobachtungszeitraum eingestellten Pateinten wurden innerhalb eines Jahres vor erstmaliger Verschreibung nicht anderweitig innerhalb einer Erstlinien-Therapie zur Behandlung der MS medikamentös behandelt (vgl. Tab. 29). 375 Tabelle 29: Anteil medikamentös vorbehandelter Patienten mit Dimethylfumarat-Verordnung Wirkstoff ATC-Code Patienten % Dimethylfumarat N7XX Nicht medikamentös vorbehandelte Patienten ,7 % Medikamentös vorbehandelte Patienten ,3 % Beta-Interferone L3AB7 / L3AB8 569 / Glatirameracetat L3AX Teriflunomid L4AA Azathioprin L4AX Alemtuzumab L4AA Zusammenhang von Nutzenbewertung und Marktdurchdringung Zur Beurteilung des Einflusses der Nutzenbewertung auf die Marktdurchdringung neuer Arzneimittel lassen sich verschiedene Ergebnismaße konstruieren. Eine eher statische Beurteilung erlaubt die Betrachtung der Wirkstoffanteile je Zusatznutzenkategorie in Relation zum Anteil des im Jahr 214 erzielten Bruttoumsatzes (vgl. Tab. 3) Arznei-Telegramm (215). Für die Personen mit Dimethylfumarat-Verordnung konnte innerhalb des Betrachtungszeitraumes zudem kein vorheriger Off-Label-Einsatz des Psoriasismittels Fumaderm (Dimethylfumarat plus verschiedene Monoethylfumaratsalze) identifiziert werden.
231 6 Umsetzung des AMNOG in der Verordnungspraxis 211 Tabelle 3: Verteilung der bewerteten Wirkstoffe und korrespondierenden Brottoumsätze (in ) nach Zusatznutzen in 214 Anteil Beträchtlich Gering N. q. Kein ZN Top 5 Wirkstoffe 6 % 2 % % 2 % Bruttoumsatz 61 % 17 % % 22 % Top 1 Wirkstoffe 6 % 3 % % 1 % Bruttoumsatz 6 % 23 % % 17 % Top 2 Wirkstoffe 5 % 25 % 5 % 2 % Bruttoumsatz 56 % 21 % 2 % 21 % Top 5 Wirkstoffe 36 % 32 % 6 % 26 % Bruttoumsatz 51 % 24 % 2 % 23 % N. q. nicht quantifizierbar Zu erkennen ist, dass der Anteil von Wirkstoffen mit beträchtlichem Zusatznutzen unter denen mit hohen Burttoumsätzen am höchsten ist. Der Anteil diese Wirkstoffe am Bruttoumsatz ist zudem weitestgehend konstant. Wirkstoffe ohne Zusatznutzen verzeichnen im Vergleich zum gesamten AMNMOG-Markt eher niedrigere Bruttoumsätze in 214. Einschränkend muss berücksichtigt werden, dass sich die Klassifikation des Zusatznutzens in entsprechenden Darstellungen bei differenzierten Nutzenbewertungsbeschlüssen lediglich auf die am besten bewertete Teilindikation des Anwenundgsgebietes bezieht. Die Auswertungen erfassen damit zum Beispiel im Verfahren von Orciplasmin 95 % der Zielpopulation mit Zusatznutzen, im Verfahren von Axitinib liegt der Anteil der Patienten mit Zusatznutzen jedoch bei unter einem Prozent. Zudem ist die absolute Verteilung der Bruttoumsätze nach bislang vergebenen Zusatzntuzenkategorien abhängig von der Anzahl nutzenbewerteter Wirkstoffe sowie der Prävalenz und dem etablierten Preisniveau entsprechender Indikationen. Rückschluss auf die Nutzenbewertungsinduzierte Marktdynamik geben diese Kennzahlen noch nicht. Zu prüfen ist deshalb, inwiefern sich aus den seit Einführung der frühen Nutzenbewertung beobachteten Umsatzentwicklungen Zusammenhänge zu maßgeblichen Zeitpunkten der Nutzenbewertung beobachten lassen. Basierend auf Daten von 65 Wirkstoffen (alle Wirkstoffe, für die ein volles Beobachtungsjahr nach Veröffentlichung des G-BA-Beschlusses vorliegt) zeigt sich, dass das Ergebnis der Nutzenbewertung gemessen am festgestellten Zusatznutzen auch nach über vier Beobachtungsjahren nur begrenzten Einfluss Nach wie vor undifferenzierter Uptake
232 212 Umsetzung des AMNOG in der Verordnungspraxis 6 auf die Marktentwicklung neuer Wirkstoffe hat. 376 Die durchschnittliche Uptakerate (dargestellt als geometrisches Mittel) aller AMNOG- Präparate innerhalb eines Jahres nach G-BA-Beschluss liegt zunächst bei 12,4 %. Unter Berücksichtigung der absoluten Umsatzvolumina steigt das Umsatzvolumen der betrachteten AMNOG-Präparate im Mittel um 14, % (vgl. Abb. 35). Abbildung 35: DDD-Uptake innerhalb eines Jahres nach G-BA-Beschluss Kein ZN (n=23) Nicht quantifizierbar (n=6) Gering (n=19) Beträchtlich (n=17) Anstieg des Verordnungsvolumens (DDD) in % gewichtet ungewichtet Fehlende Proportionalität zur Nutzenbewertung Wirkstoffe mit einer großen GKV-Zielpopulation erreichen innerhalb eines Jahres nach Vorliegen des G-BA-Beschlusses demnach durchschnittlich stärkere Umsatzzuwächse als Wirkstoffe in kleinen Anwendungsgebieten unabhängig vom Ausmaß des Zusatznutzens. 377 In den Ergebnissen zeigt sich nach wie vor eine fehlende Proportionalität zwischen dem Ergebnis der Nutzenbewertung und dem ärztlichen Verordnungsverhalten. Wirkstoffe ohne Zusatznutzen verzeichnen gewichtet die größten Wachstumsraten verordneter Tagesdosen (14,7 %). Wirkstoffe mit zumindest in einer Teilinidkation beträchtlichem Zusatznutzen steigen im Verordnungsvolumen jedoch in annähernd vergleichbarer Größenordnung an (14,2 %). Im AMNOG-Report 215 konnte noch auf einen deutlicheren negativen Zusatznutzengradienten verwiesen werden. 378 Dieser ist basierend Nicht berücksichtigt werden dabei die Wirkstoffe aus dem ersten Bestandsmarktaufruf, da für diese aufgrund der längeren Vertriebszeiten keine AMNOG-spezifischen Veränderungsraten zu beobachten sind. Auch die Erweiterung des Anwendungsgebietes, welches eine erneute Nutzenbewertung anstößt, wird nicht berücksichtigt da sich in entsprechenden Auswertungen die Marktdurchdringung in der einzelen Subgebieten überlagert und aufgrund fehlender Kodierkongruenz der Subgruppen in den Routinedaten nicht isoliert betrachtet werden kann. Nicht zu verwechseln sind diese Daten mit den zwischen GKV-SV und pharmazeutischer Industrie unterschiedlich interpretierten Daten zum Versorgungsgrad mit AMNOG-Präparaten. Siehe hierzu Höer, Chen (215), S.98; Haas, Tebinka- Olbrich (215), S. 19ff. Greiner, Witte (215), S. 192.
233 6 Umsetzung des AMNOG in der Verordnungspraxis 213 auf den inzwischen vorliegenden Daten nicht mehr so stark ausgeprägt. Zu berücksichtigen ist dabei jedoch auch, dass insbesondere bei den modernen und umsatzstarken Präparaten zur Hepatitis-C- Behandlung, etwa Sovaldi (Sofosbuvir) und Harvoni (Sofosbuvir/Ledipasvir) von Gilead, aufgrund des derzeit kurzen Innovationszykluses in diesem Therapiegebiet die Marktdurchdringung in der Regel schon kurz nach Abschluss der Nutzenbewertung rückläufig war. Die Marktdurchdringung neuer Arzneimittel ist insofern in hohem Maße kontextbezogen. Der Patientennutzen aus der Sicht des Arztes wird jedoch ggf. anders beurteilt, als der Nutzen innerhalb des rechtssicheren und damit weitestgehend formalisierten Bewertungsverfahrens. 379 Die zum Teil entgegen der Zusatznutzenbewertung verlaufende Marktenwicklung z. B. von Fingolimod oder Fampridin lassen den Schluss zu, dass es im Versorgungsalltag weitere relevante Aspekte einer Verordnungsentscheidung abseits des Nutzenbewertungsspektrums (z. B. die Applikationsform z. B. Einnahmehäufigkeit) geben könnte. Derzeitige Versorgungsquoten wie zum Beispiel bei Axitinib oder Fingolimod bewertet der GKV-SV auch mit Verweis auf dezidierte Therapiehinweise und deutlich kleineren zusatznutzentragenden Teilindikationen als kritisch. 38 Dass Wirkstoffe mit im Ausmaß nicht quantifizierbarem Zusatznutzen deutliche geringere Verordnungsanstiege nach Abschluss der Nutzenbewertung zeigen, kann ebenfalls auf verschiedene Ursachen zurückzuführen sein. Der therapeutische Stellenwert der beiden Virostatika, Boceprevir und Telaprevir, ist beispielsweise zum Zeitpunkt der Beschlussfassung des G-BA schon überholt, da in der Hepatits-C-Therapie innerhalb kürzester Zeit zuletzt neue, hochwirksame Wirkstoffe auf den Markt kamen. Die übrigen vier Wirkstoffe mit nicht quantifizierbarem Zusatznutzen sind Orphans, welche eher diffuse Marktverläufe zu Beginn des Produktzykluses zeigen. Brentuximab Vendotin verzeichnet zudem erst ab September 214 und damit 15 Monate nach G-BA-Beschluss signifikante Umsatzzuwächse. Auf der anderen Seite zeigt das zur Behandlung der idiopathischen Lungenfibrose zugelassene Pirfenidon trotz Zusatznutzen und Praxisbesonderheit ebenfalls nur geringe Zuwachsraten. Ein Diffusionshindernis könnte in diesem Fall eine mit Pirfenidon assoziierte höhere Lichtempfindlichkeit sein, welche Ärzte von einer therapeutischen Umstellung abhält. 381 Aufgrund der fehlenden Ausschlussmöglichkeit des G-BA soll eine Steuerung der Diffusion innovativer Arzneimittel mit anerkanntem Zusatznutzen über eine Ex-Ante-Positivselektion für die Therapieentscheidung des Arztes erfolgen. Dabei stellte der Gesetzgeber schon bei Einführung des AMNOG klar, dass die Vereinbarung ei- Weitere Kontextfaktoren berücksichtigen Laschet (215). Haas, Tebinka-Olbrich (215), S. 21. EMA (215), S. 2.
234 214 Umsetzung des AMNOG in der Verordnungspraxis 6 Diskussion über den Vergleichsmaßstab nes nutzenbasierten Erstattungsbetrages keine verordnungslenkende Wirkung entfaltet. 382 Vereinfacht bedeutet dies, dass die Verordnung eines Arzneimittels mit beträchtlichem Zusatznutzen ebenso wie die von Arzneimitteln ohne belegten Zusatznutzen immer noch differenziert, im Einzelfall nach Abwägung aller Vor- und Nachteile, durch den Arzt bewertet werden muss. Komplex ist dann die Umsetzung eines abgewogenen Nutzenbewertungsergebnisses in der Praxis, da eine dichotome Unterteilung in Zusatznutzen vorhanden und Zusatznutzen nicht vorhanden in der Regel nicht möglich ist. Ein in diesem Kontext geprägter Begriff ist die AMNOG-gerechte Versorgungsquote, welche sich auf den Verordnungsanteil neuer Arzneimittel am zu erwartenden maximalen Gebrauch bezieht. 383 Zur Berechnung des maximal zu erwartenden Verbrauches werden die Prävalenzangaben aus dem G-BA aus der Nutzenbewertung herangezogen. Nach Ansicht des GKV-SV ist dies die falsche Berechnungsgrundlage, da sich dies auf das gesamte Anwendungsgebiet bezieht. 384 Aus dem Ergebnis der frühen Nutzenbewertung leitet sich jedoch kein Verordnungsautomatismus ab. Neue Arzneimittel stehen immernoch im Wettbewerb zu bereits etablierten Therapiealternativen. Darüber hinaus beschränkte sich das verordnungsfähige Marktsegment (im Fall eines differenzierten Nutzenbewertungsbeschlusses) auf die Teilpopulationen mit Zusatznutzen. Cassel und Ulirch kritisieren hingegen, dass der Versorgungsgrad selbst bei Innovationen mit hohem Zusatznutzen mehr oder weniger weit unter seinem Potenzial liegt und zudem nur eine langsame Diffusion in die Versorgung stattfindet. 385 Dass es gewichtige medizinische Gründe (Schwierigkeiten bei der Therapieumstellung chronisch Kranker oder detaillierte Verordnungsvorgaben, z. B. ein Fachärztbezug, seitens des G-BA) stehe dabei außer Frage. Cassel und Ulrich vermuten jedoch auch, dass externe Steuerungsinstrumente wie Wirtschaftlichkeitsprüfungen und Regresse eine zeitnahe Substitution älterer Präparate durch in der Regel teuerere neue Arzneimittel verhindern könnte. 386 Die bislang vorliegenden Ergebnisse zum Uptake nach Abschluss der Nutzenbewertung unterstützen diese These. Interessanterweise zeigte eine Aufschlüsselung des Uptakes nach vom G-BA definierten Vergleichstherapiemaßstab, dass jene Wirkstoffe mit patentgeschütztem Komparator die höchsten Uptakeraten innerhalb eines Jahres nach G-BA-Beschluss erzielen (vgl. Abb. 36). Die mittlere Uptake-Rate für Wirkstoffe mit patentgeschützter zvt 387 liegt mit 16, % 2,8 Prozentpunkte oberhalb BT-Drs. 17/2413; S. 31. Vfa (215). Haas, Tebinka-Olbrich (215), S. 2. Cassel, Ulirch (215). Cassel, Ulirch (215). Afatinib, Aflibercept (Eylea), Apixaban, Axitinib, Dabrafenib und Teriflunomid.
235 6 Umsetzung des AMNOG in der Verordnungspraxis 215 der durchschnittlichen Verordnungszuwächse für Wirkstoffe mit generischer Vergleichstherapie. Abbildung 36: Uptake innerhalb eines Jahres nach G-BA-Beschluss nach Art des Komparators Patentgeschützte zvt (n=6) Generische und patentgeschützte zvt (n=17) Generische zvt (n=21) BSC / nicht-medikamentöse zvt (n=7) gewichtet Anstieg des Verordnungsvolumens (DDD) in % ungewichtet Der Argumentation von Cassel und Ulrich folgend könnte dies ein Hinweis darauf sein, dass Ärzte in noch patentgeschützten Marktsegmenten eher bereit sind, in der Regel noch hochpreisige Bestandspräparate durch neue Wirkstoffe auszutauschen da sie hier weniger preissensitiv reagieren. 388 Dabei wäre zu erwarten gewesen, dass eher in generisch geprägten Marktsegmenten, also Indikationen, in denen die letzte therapeutische Innovation bereits längere Zeit zurück liegt, neue Arzneimittel rasch in die Versorgung kommen. Angesichts der geringen Beobachtungszahl sind Rückschlüsse über mögliche Kausalzusammenhänge jedoch mit hoher Unsicherheit behaftet. Grundsätzlich sind auch innovationshemmende Faktoren in der Marktdurchdringung neuer Arzneimittel kritisch zu diskutieren. Ungeklärte Interpretationsfragen in der Wirtschaftlichkeit der Verordnungen in Relation zu den Phasen der Nutzenbewertung sowie der offenen Regressfrage für Verordnungen in Subgruppen ohne Zusatznutzen können den rationalen und wirtschaftlichen Einsatz neuer Arzneimittel negativ beeinflussen (vgl. Kapitel 4.3). Hervorgehoben wird zuletzt jedoch insbesondere die fehlende Digitalisierung der Nutzenbewertungsergebnisse in den PVS-Systemen. Beklagenswert ist, dass trotz gesetzlicher Rahmenvorgaben in 92 Absatz 2 SGB V sowie 73 Absatz 8 SGB V bislang keine flächendeckende Integration der Nutzenbewertungsergebnisse in die Verordnungsrealität niedergelassener Ärzte, also in die Praxisverwaltungssysteme, erfolgt ist. 13b Abs. 2 SGB V sieht vor, dass 388 Wobei dies auch im persönlichen Erfahrungsbereich des Arztes liegt und individuell höchst unterschiedlich ausfallen kann. Vgl. hierzu Richard (215), S. 25.
236 216 Umsetzung des AMNOG in der Verordnungspraxis 6 die PVS auch die Ergebnisse der frühen Nutzenbewertung anzeigen müssen doch dies geschehe bisher nicht. Vermeintliche Hürde dürfte die aufwändige und komplexe Übersetzung der Nutzenbewertungsbeschlüsse in praktikable Datenbankformate sein, insbesodnere, da dies rechtssicher erfolgen muss. Neben dem G-BA böte sich hier das IQWiG an, welche bereits heute umfassende Informationsaufarbeitungen für die interessierte Öffentlichkeit leistet. 389 Umsatzentwicklungen von Orphan Drugs Insgesamt DDD-Verordnungen lagen im Jahr 214 für 17 bis dahin nutzenbewertete Orphan Drugs für Versicherte der DAK- Gesundheit vor. Dies entspricht einem Bruttoumsatz von 39,1 Millionen. Damit entspricht der Anteil der Orphan Drugs am Gesamtumsatz 13 %, während lediglich 1 % der verordneten Tagesdosen auf dieses Marktsegment zurückgeht. Die durchschnittlichen Bruttokosten je DDD liegen mit 369 (+142 ) erwartungsgemäß deutlich über dem Durchschnitt des AMNOG-Marktes. Dabei zeigen Orphan Drugs in 214 unterschiedliche Verordnungsvolumina (vgl. Abb. 37). Zu berücksichtigen ist, dass acht dieser Wirkstoffe erst im Laufe des Jahres 214 verfügbar wurden und insofern nur ein begrenzter Beobachtungszeitraum in die Auswertungen eingeht (Cabozantinib, Elosulfase alfa, Ibrutinib, Macitentan, Obinutuzumab, Ponatinib, Riociguat, Teduglutid). Die übrigen Orphans sind alle bereits seit mindestens 213 im Markt verfügbar. Auffällig sind die überproportional hohen Bruttokosten in Relation zur Verordnungsmenge für Ivacaftor, Decitabin und Pomalidomid. Abbildung 37: Bruttoumsatz und Verordnungsmenge von Orphan Drugs in DDD DDD Bruttoumsatz Staeck (215), S. 49f.
237 6 Umsetzung des AMNOG in der Verordnungspraxis 217 Hinsichtlich des durchschnittlichen Uptakes innerhalb eines Jahres nach G-BA-Beschluss liegen Orphan Drugs geringfügig unterhalb der übrigen nutzenbewerteten Wirkstoffe. Für elf Orphan Drugs 39 liegen vollständige Umsatzdaten für den Zeitraum von einem Jahr nach Vorlage des G-BA-Beschlusses vor. Die mittlere Zunahme im Verordnungsvolumen liegt für Orphans gewichtet bei 11,8 % und damit 2,2 Prozentpunkte unter des AMNOG-Durchschnittes. 39 Bosutinib, Brentuximab Vedotin, Decitabin, Ivacaftor, Macitentan, Pasireotid, Pirfenidon, Pomalidomid, Ponatinib, Ruxolitinib und Tafamidis Meglumin.
238 218 Umsetzung des AMNOG in der Verordnungspraxis Verordnungsentwicklung nutzenbewerteter Wirkstoffe ohne Zusatznutzen Verordnungsprävalenz in Abhängigkeit von Kontextfaktoren Für insgesamt 23 Wirkstoffe ohne belegten Zusatznutzen liegen Verordnungsdaten für einen Zeitraum von mindestens einem Jahr nach Abschluss der Nutzenbewertung vor. Hinsichtlich der Zunahme des Verordnungsvolumens innerhalb dieses Zeitraumes zeigen sich unterschiedliche, zum Teil jedoch beachtliche Verordnungszuwächse (vgl. Abb. 38). Die geringste Uptake-Rate zeigt dabei Retigabin (2,6 %), die höchste Regadenoson (29,1 %). Abbildung 38: DDD-Uptake neuer Wirkstoffe ohne Zusatznutzen Fluticasonfuroat/Vilanterol-Trifenatat Olodaterol Azilsartan Medoxomil Fampridin Vandetanib Retigabin Linaclotid Lixisenatid Ingenolmebutat Dapagliflozin/Metformin Bromfenac Perampanel Dapagliflozin Tegafur, Gimeracil, Oteracil Nepafenac Regadenoson Pixantron Colestilan Aclidiniumbromid Lisdexamfetamindimesilat Teriflunomid Dabrafenib Aflibercept (Eylea) Festbetrag BSC und Physiotherapie Generische zvt Generische und patentgeschützte zvt Patentgeschützte zvt Anstieg des Verordnungsvolumens (DDD) in % Unter den betrachteten Wirkstoffen sind fünf, welche nachträglich noch vom Markt genommen wurden. 391 Retigabin, ein Antikonvulsivum zur Behandlung der Epilepsie bei fokalen Krampfanfällen ging bereits zwei Monate nach Abschluss der Nutzenbewertung Opt-Out, so dass der Absatz danach nur noch auf die Abgabe von Restbeständen zurückzuführen sein dürfte, was den geringen Uptake erklärt. Bromfenac und Colestilan wurden wiederum relativ spät nach Abschluss der Nutzenbewertung vom Markt genommen, so dass 391 Bromfenac, Colestilan, Lincalotid, Perampanel und Retigabin.
239 6 Umsetzung des AMNOG in der Verordnungspraxis 219 sich zunächst noch ein normaler Marktdurchdringungsprozess feststellbar ist. Die Marktrücknahme von Perampanel erfolgte zwar knapp vier Monate nach Abschluss der Nutzenbewertung, dennoch werden für knapp 6 Monate nach Marktrücknahme (Juli bis Dezember 213) noch konstant hohe Umsätze verzeichnet. Erst zum Januar 214 mit Beginn des Named-Patient-Access-Programm (Kapitel 4.2) gingen durch Umsätze nahezu auf Null zurück. Einen überdurchschnittlichen hohen Anstieg im Verordnungsvolumen zeigen Azilsartan Medoxomil (14,5 %), Fluticasonfuroat/Vilanterol-Trifenatat (2, %), Olodaterol (2,3 %) und Regadenoson (29,5 %). Die überproportional starke Uptake-Rate von Regadenoson, dem bislang einzigen bewerteten Diagnostikum, relativiert sich allerdings, wenn die absoluten Verordnungsvolumia berücksichtigt werden. In dem einjährigen Beobachtungszeitraum sind insgesamt nur 52 Tagesdosen verordnet worden. Die übrigen drei Wirkstoffe sind aufgrund nicht vorgelegter Herstellerdossiers in Festbetragsgruppen überführt worden (Kapitel 2.1). Für Azilsartan Medoxomil, einem selektiver AT1-Rezeptorblocker zur Behandlung der Hypertonie, liegen deutlich höhere Umsatzvolumia zugrunde. Ab Mitte 214 sind die Verordnungen für diesen Wirkstoff jedoch schlagartig auf ein niedriges Niveau abgesunken. Die übrigen Wirkstoffe zeigen zumindest weitestgehend vergleichbare Uptake-Raten, unabhängig von der Art des Marktumfeldes (generisch geprägt oder patentgeschützt). Ein valider indikationsübergreifender Vergleich ist grundsätzlich problematisch, da neben unterschiedlichen Prävalenzen auch unterschiedliche Reichweiten der verordneten Packungen berücksichtigt werden müssen. 392 Zudem muss betont werden, dass ein nicht belegter Zusatznutzen nicht bedeutet, dass gar kein Nutzen vorhanden wäre, sondern der zugelassene Wirkstoff hat einen vergleichbaren Nutzen wie bereits im Markt befindliche Therapieansätze. Zudem können, wie im Fall von Dabrafenib, auch bereits nutzenbelegte Wirkstoffe der Vergleichsmaßstab gewesen sein. Dabrafenib zeigt interessanterweise einen um zwei Prozentpunkte höheren Anstieg im Verordnungsvolumen (12,8 %) als der therapeutische First-Mover Vemurafenib (1,9 %). Oben genannte Wirkstoffe haben innerhalb des gesamten Anwendungsgebietes keinen Zusatznutzen zugesprochen bekommen. Interessant wäre es, dem die Marktdurchdringung jener Wirkstoffe gegenüberzustellen, für welche nur in Teilindikationen ein Zusatznutzen als belegt gilt. Da es allerdings kaum subgruppenspezifische Marker in den ambulant-ärztlichen Daten gibt, sind entsprechende Analysen nur schwer zu realisieren. Anhand der Uptake-Rate für mischpreisrelevante Wirkstoffe kann jedoch zumindest näherungsweise überprüft werden, ob differenzierte Nutzenbewertungsergebnisse in der Verordnungspraxis zu einem langsameren Uptake füh- Indikationsübergreifende Vergleiche schwierig 392 Kleinfeld, Luley (214), S. 49.
240 22 Umsetzung des AMNOG in der Verordnungspraxis 6 ren. Basierend auf 19 Verfahren mit differenziertem Nutzenbewertungsbeschluss sowie nur zum Teil zusatznutzentragenden Teilpopulationen zeigt sich ein durchschnittlicher Uptake von 13,2 % (gewichtet). Dabei zeigen Wirkstoffe mit nur sehr kleiner nutzentragender Teilindikationen (Axitinib, Fingolimod) keine sichtbaren Unterschiede zu jenen Wirkstoffen mit einem hohen Zusatznutzenanteil im Anwendungsgebiet. Vielmehr dürften auch hier Kontextfaktoren entscheidende Diffusionstreiber sein, unabhängig vom Ausmaß des Zusatznutzens. Ein wiederholt diskutiertes Beispiel hierfür ist Fingolimod, des trotz geringem Indikationsanteil mit Zusatznutzen (ca. 16 %) und detaillierten Vorgaben der EMA zur Indikationsstellung inzwischen GKV-weit für eine Vielzahl von MS-Patienten verschrieben wird. 393 Diskutiert wurde, ob die veränderte Darreichungsform (Fingolimod kann oral verabreicht werden) im Versorgungsalltag zu einem zusatznutzenäquivalenten Faktor werden kann. Umsatzentwicklung der Wirkstoffe ohne Herstellerdossier Umstritten ist die vom Gesetzgeber zugestandene Möglichkeit, das Verfahren der frühen Nutzenbewertung durch Nichtvorlage eines Dossiers zu umgehen. Nach aktueller Gesetzeslage können Hersteller die Aufforderung, ein Dossier beim G-BA einzureichen, ignorieren oder dieser nicht rechtzeitig oder vollständig nachkommen. Aufgrund einer Nichteinreichung der erforderlichen Unterlagen gilt ein Zusatznutzen als nicht belegt; somit wird das Arzneimittel nach 35 Abs. 1 SGB V dann in eine Festbetragsgruppe mit pharmakologisch-therapeutisch vergleichbaren Arzneimitteln eingeordnet ( 35a Abs. 4 Satz 1 SGB V). Die für diese Wirkstoffe nicht verfügbare wissenschaftliche Bewertung der Evidenz durch den G-BA hat jedoch zunächst keinen beobachtbaren Einfluss auf die Marktentwicklung nach Veröffentlichung der G-BA-Ergebnisse (vgl. Abb. 39). Abbildung 39: Uptake von Wirkstoffen ohne Herstellerdossier innerhalb eines Jahres nach G-BA-Beschluss Mit Dossier (n=58) Ohne Dossier (n=7) gewichtet ungewichtet Anstieg des Verordnungsvolumens (DDD) in % 393 Laschet (214).
241 6 Umsetzung des AMNOG in der Verordnungspraxis 221 Dabei ist zu berücksichtigen, dass von den sieben Wirkstoffen ohne Herstellerdossier drei (Azilsartan Medoxomil, Fluticasonfuroat/Vilanterol-Trifenatat und Olodaterol) einer Festbetragsgruppe zugeordnet wurden. Werden diese Wirkstoffe nicht berücksichtigt verringert sich die mittlere gewichtete Uptake-Rate der Wirkstoffe ohne Herstellerdossier auf 13,8 %, was im AMNOG-Durchschnitt liegt. Aufgrund der geringen Anzahl berücksichtigter Wirkstoffe sind entsprechende Ergebnisse bislang zudem von eingeschränkter Aussagekraft. Regionale Varianz in der Verordnungsprävalenz Abbildung 4 zeigt um die absoluten Versichertenzahlen der DAK-Gesundheit korrigierte Verordnungsprävalenzen (DDD) nutzenbewerteter Wirkstoffe mit und ohne Zusatznutzen. Eine versichertenbezogene Auswertung zeigt vergleichbare Ergebnisse. Über eine Betrachtung der DDD-Volumina lassen sich jedoch näherungsweise noch regionale Morbiditätsunterschiede abbilden. Abbildung 4: Summe DDD je Versicherte in 214 für neue Wirkstoffe a) ohne Zusatznutzen, b) mit Zusatznutzen Kein Zusatznutzen a) b) Mit Zusatznutzen Sowohl in der Verordnungsprävalenz von Wirkstoffen mit als auch ohne Zusatznutzen ist ein bereits aus anderen regionalen arzneimittelbezogenen Analysen bekannter Ost-West-Gradient zu beobachten. 394 Gravierende regionale Verordnungsunterschiede zwischen Arzneimitteln mit Zusatznutzen und jenen, die nach G-BA-Beschluss keinen Zusatznutzen belegen konnten, zeigen sich darüber hinaus nicht (vgl. Tab. 31). 394 Kleinfeld, Luley (214); Pieloth, Kleinfeld (213).
242 222 Umsetzung des AMNOG in der Verordnungspraxis 6 Tabelle 31: Regionale Verordnungsvarianz bei DAK-Versicherten 214 Bundesland Wirkstoffe mit Zusatznutzen Wirkstoffe ohne Zusatznutzen VO/Versicherte (%) DDD/Versicherte (n) VO/Versicherte (%) DDD/Versicherte (n) 2,28 4,6,89 1,5 Bayern 2,12 4,2,9 1,4 Berlin 1,96 3,7,71 1,4 2,23 4,4,72 1,7 Bremen 1,2 1,9,38,6 Hamburg 1,4 2,8,44 1, Hessen 2,81 6,2 1,3 2, Baden-Württemberg Brandenburg Mecklenburg-Vorpommern Niedersachsen Nordrhein- Westfalen Rheinland- Pfalz 3,12 6,5,9 2,1 1,96 3,9,79 1,4 2,11 4,,74 1,5 2,28 4,5,94 1,5 Saarland 1,96 3,8,83 1,3 Sachsen 3,14 6,6 1,15 2,4 Sachsen- Anhalt Schleswig- Holstein 3,5 6,8 1,19 2,4 1,9 3,6,67 1,2 Thüringen 3,18 6,6 1,22 2,4
243 6 Umsetzung des AMNOG in der Verordnungspraxis Prädiktoren für Verordnungen von Wirkstoffen ohne Zusatznutzen Gastbeitrag von Nadine Fröhlich und Dr. Tania Schink, Leibniz- Institut für Präventionsforschung und Epidemiologie BIPS GmbH, Bremen Aclidinium- oder Tiotropiumbromid? Untersuchung von Prädiktoren einer Aclidiniumbromidneuverordnung auf Basis von Routinedaten der DAK Gesundheit Hintergrund Aclidiniumbromid (Handelsname Eklira /Bretaris Genuair, im Folgenden Aclidinium) ist ein neues Arzneimittel aus der Gruppe der langwirksamen Anticholinergika, das in Deutschland seit dem 1. Oktober 212 zur symptomatischen Dauertherapie bei erwachsenen Patienten mit chronisch obstruktiver Lungenerkrankung (Chronic Obstructive Pulmonary Disease, COPD) zugelassen ist. 395 Die COPD ist gemäß der Global Initiative for Chronic Obstructive Pulmonary Disease (GOLD) eine häufige, vermeidbare und behandelbare Erkrankung, die durch eine meist progrediente Einschränkung der Lungenfunktion gekennzeichnet ist. Der Erkrankung liegt eine gesteigerte Entzündungsreaktion auf Reize (schädliche Partikel oder Gase), die über die Atmung aufgenommen werden, zugrunde. Hauptrisikofaktor der COPD ist das Rauchen, aber auch rezidivierende bronchiale Infekte in der Kindheit, Schadstoffe in der Atemluft und genetische Faktoren werden als Risikofaktoren diskutiert. 396 In Deutschland leiden je nach Studie und verwendeter Krankheitsdefinition zwischen 1,3% und 13,2% der Bevölkerung an einer COPD. 397 Die Erkrankung führt häufig zu Frühverrentungen und zählt mit ca. 27. Todesfällen pro Jahr zu einer der häufigsten Todesursachen. 398 Auch aufgrund der Alterung der Bevölkerung wird die Krankheitslast insgesamt voraussichtlich weiter ansteigen. Darüber hinaus gehen mit der notwendigen (Dauer-)Behandlung der COPD hohe Kosten für das Gesundheitssystem einher. 399 Mit den bisherigen Therapieansätzen ist es nicht möglich, den fortschreitenden Verlust der Lungenfunktion vollständig zu verhindern. 4 Zu den Zielen der COPD-Therapie zählen daher die Linderung von Symptomen, die Vermeidung von Verschlechterungen des ABDA (212); EMA (213). Global Initiative for Chronic Obstructive Lung Disease (215), S. 4. Aumann, Prenzler (213), S Aumann, Prenzler (213), S. 168; Statistisches Bundesamt (213). Aumann, Prenzler (213), S Global Initiative for Chronic Obstructive Lung Disease (215), S. 2.
244 224 Umsetzung des AMNOG in der Verordnungspraxis 6 Gesundheitszustandes (Exazerbationen) sowie die Verbesserung der körperlichen Belastbarkeit und der COPD-bezogenen Lebensqualität. 41 Anticholinergika sind eine bedeutende Wirkstoffgruppe in der COPD-Therapie, da sie der Verengung der Bronchien entgegen wirken. 42 Langwirksame Bronchodilatatoren wie z.b. Aclidinium oder Tiotropiumbromid (im Folgenden Tiotropium) werden nach dem Stufentherapieschema als Dauertherapie der COPD empfohlen, wenn die bedarfsorientierte Therapie mit kurzwirksamen Bronchodilatatoren nicht mehr ausreicht (Stufe 2). 43 Im Rahmen der frühen Nutzenbewertung wurde vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) und dem gemeinsamen Bundesausschuss (G-BA) kein Zusatznutzen von Aclidinium gegenüber Tiotropium festgestellt, da keine direkt vergleichenden Studien mit ausreichender Studiendauer vorlagen und die für den indirekten Vergleich eingereichten Daten nicht verwertbar waren. 44 Trotz des nicht belegten Zusatznutzens stiegen die Verordnungen von Aclidinium seit Markteinführung kontinuierlich an und erreichten bei den Versicherten der DAK-Gesundheit im November DDDs. 45 Ziel der vorliegenden Analyse war es deshalb, mögliche Determinanten einer Neuverordnung von Aclidinium (anstatt von Tiotropium) zu eruieren. Methodik Zur Untersuchung möglicher Prädiktoren für eine Neuverordnung von Aclidinium anstelle von Tiotropium wurden die Routinedaten der DAK-Gesundheit aus der Deutschen Pharmakoepidemiologischen Forschungsdatenbank (German Pharmacoepidemiological Research Database GePaRD) verwendet. GePaRD enthält neben einigen soziodemographischen Angaben Abrechnungsdaten aus dem ambulanten und stationären Bereich (Diagnosen und Prozeduren) sowie Informationen zur (ambulanten) Abgabe von Arzneimitteln. Die Studienpopulation setzte sich aus allen Patienten mit einer ersten Verschreibung von Aclidinium oder Tiotropium (Indexverschreibung) zusammen, die vor der Indexverschreibung mindestens ein Jahr durchgehend versichert waren und in den letzten 12 Monaten vor der Indexverschreibung weder Aclidinium noch Tiotropium verschrieben bekommen haben Abholz (212), S. 11; Global Initiative for Chronic Obstructive Lung Disease (215), S. 21. Chanez, Burge, et al. (21). Abholz H (212), S. 15. IQWiG (213), S. 8 ff; G-BA (213). Greiner, Witte (215), S. 21.
245 6 Umsetzung des AMNOG in der Verordnungspraxis 225 Der Studienzeitraum begann am 1. Oktober 212, dem Tag der Zulassung von Aclidinium in Deutschland, und endete am , dem Ende der zum Zeitpunkt der Analysen verfügbaren Daten in GePaRD. Die Daten des Jahres vor der Indexverschreibung wurden für die Erfassung möglicher Prädiktoren verwendet. Als potentielle Prädiktoren wurden neben den soziodemographischen Faktoren Alter, Geschlecht, Staatsangehörigkeit (deutsch/andere), Versichertenart (Haupt- oder Familienversicherter) und Größe des Wohnorts Indikatoren für den Schweregrad der COPD berücksichtigt. Hierzu zählte u.a. die Art der medikamentösen Behandlung, COPD-bedingte Hospitalisierungen und der chronische Gebrauch von Kortikosteroiden oder Antibiotika. Darüber hinaus wurden Versorgungaspekte wie z.b. die Teilnahme an einem Disease Management Programm (DMP) und die allgemeine Komorbidität mittels Charlson Comorbidity Index sowie eine Vorgeschichte von Nieren- und Lebererkrankungen betrachtet. Zusätzlich wurden Charakteristika des verordnenden Arztes (Fachgebiet und Region) in die Analysen einbezogen. Nach einem deskriptiven Vergleich der Patientengruppen wurden mögliche Prädiktoren der Gruppenzugehörigkeit mittels logistischer Regression ermittelt. Ergebnisse Im Studienzeitraum wurden 544 Neunutzer von Aclidinium und 4379 Neunutzer von Tiotropium identifiziert, die die Einschlusskriterien erfüllten. Das mediane Alter im Jahr des Kohorteneintritts war mit 69 Jahren (unteres Quartil (Q1) 6, oberes Quartil (Q3) 76) bei den Aclidiniumneunutzern etwas niedriger als bei den Tiotropiumneunutzern mit 71 Jahren (Q1 62, Q3 78). Von den Neunutzern von Aclidinium waren 61 % weiblich im Vergleich zu 58 % bei den Tiotropiumneunutzern. Die Charakteristika der Studienpopulation sind in den Tabellen 32 bis 35 im Detail dargestellt. Tabelle 32: Charakteristika von Aclidiniumneunutzern im Vergleich zu Tiotropiumneunutzern Soziodemografische Angaben Versichertenart Alter im Jahr der Indexverschreibung Geschlecht Staatsangehörigkeit Mittelwert (Std) Median (Q1, Q3) weiblich männlich deutsch andere Familienversicherte/r Hauptversicherte/r Neunutzer von Aclidinium N=544 67,3 (11,66) 69 (6, 76) 331 (6,8%) 213 (39,2%) 541 (99,4%) 3 (,6%) 27 (5,%) 517 (95,%) Neunutzer von Tiotropium N= ,3 (12,39) 71 (62, 78) 2534 (57,9%) 1845 (42,1%) 4342 (99,2%) 37 (,8%) 157 (3,6%) 4222 (96,4%)
246 226 Umsetzung des AMNOG in der Verordnungspraxis 6 Größe des Wohnorts kreisfreie Großstadt städtischer Kreis ländlicher Kreis mit Verdichtungsansatz dünn besiedelter ländlicher Kreis Kreis nicht zuzuordnen Neunutzer von Aclidinium N= (29,4%) 181 (33,3%) 77 (14,2%) 126 (23,2%) (,%) Neunutzer von Tiotropium N= (29,8%) 1676 (38,3%) 677 (15,5%) 72 (16,4%) 2 (,%) Tabelle 33: Charakteristika von Aclidiniumneunutzern im Vergleich zu Tiotropiumneunutzern Charakteristika des verschreibenden Arztes Neunutzer von Tiotropium N= (67,3 %) 15 (3,4 %) 185 (24,8 %) 86 (2, %) 113 (2,5 %) Fachrichtung des verschreibenden Arztes KV Region des verschreibenden Arztes Hausarzt Internist Pneumologe Sonstige Ärzte Fachrichtung nicht zuzuordnen Schleswig-Holstein Hamburg Bremen Niedersachsen Westfalen-Lippe Nordrhein Hessen Rheinland-Pfalz Baden-Württemberg Bayern Berlin Saarland Mecklenburg-Vorpommern Brandenburg Sachsen-Anhalt Thüringen Sachsen Region nicht zuzuordnen Neunutzer von Aclidinium N= (51,8 %) 12 (2,2 %) 241 (44,3 %) 3 (,6 %) 6 (1,1 %) 18 (3,3 %) 5 (,9 %) 2 (,4 %) 61 (11,2 %) 4 (7,4 %) 64 (11,8 %) 51 (9,4 %) 52 (9,6 %) 43 (7,9 %) 75 (13,8 %) 38 (7, %) 4 (,7 %) 19 (3,5 %) 29 (5,3 %) 15 (2,8 %) 16 (2,9 %) 11 (2, %) 1 (,2 %) 26 (4,7 %) 215 (4,9 %) 35 (,8 %) 467 (1,7 %) 367 (8,4 %) 465 (1,6 %) 412 (9,4 %) 317 (7,2 %) 493 (11,3 %) 62 (14,2 %) 174 (4, %) 51 (1,2 %) 13 (2,4 %) 132 (3, %) 92 (2,1 %) 135 (3,1 %) 88 (2, %) 7 (,2 %)
247 6 Umsetzung des AMNOG in der Verordnungspraxis 227 Tabelle 34: Charakteristika von Aclidiniumneunutzern im Vergleich zu Tiotropiumneunutzern COPD-relevante Informationen Indikation Hospitalisierung aufgrund einer Indikation Asthma Diagnose Niedrigster FEV1 Wert 1 Medikamentöse Behandlung im Jahr vor Indexverschreibung 2 Chronischer Gebrauch von systemischen Kortikosteroiden bzw. inhalativem Budesonid Chronischer Gebrauch von Antibiotika Teilnahme am DMP COPD Zusätzlich Neunutzer von 3 Neunutzer von Aclidinium N=544 Neunutzer von Tiotropium N=4.379 Diagnose einer COPD 44 (8,9 %) 3353 (76,6 %) Diagnose eines Emphysems 15 (19,3 %) 675 (15,4 %) Diagnose einer chronischen Bronchitis 143 (26,3 %) 182 (24,7 %) FEV1<35 % FEV1 >=35 % und <5 % FEV1 >= 5 % und <7 % FEV1 >= 7 % nicht verfügbar oder unspezifisch SABA SAMA LABA LAMA ICS anderen LAMA LABA davon Formoterol davon andere LABA/ICS 23 (4,2 %) 475 (1,8 %) 199 (36,6 %) 53 (9,7 %) 58 (1,7 %) 77 (14,2 %) 35 (6,4 %) 321 (59, %) 248 (45,6 %) 89 (16,4 %) 31 (55,3 %) (, %) 27 (49,6 %) 1331 (3,4 %) 446 (1,2 %) 415 (9,5 %) 514 (11,7 %) 171 (3,9 %) 2833 (64,7 %) 1592 (36,4 %) 555 (12,7 %) 1966 (44,9 %) (, %) 1829 (41,8 %) 61 (11,2 %) 296 (6,8 %) 1 (,2 %) 6 (,1 %) 159 (29,2 %) 954 (21,8 %) 1 (,2 %) 23 (4,2 %) 23 (1, %) (, %) 14 (2,6 %) 1 (, %) 285 (6,5 %) 274 (96,1 %) 12 (4,2 %) 395 (9, %) 1 Einsekundenkapazität (Forced Expiratory Volume in 1 second) 2 SABA= short-acting beta-2 agonists, SAMA=short-acting muscarinic antagonist, LABA= long-acting beta2-agonists, LAMA= long-acting muscarinic antagonists, ICS=inhaled corticosteroids 3 Neuverordnung am selben Tag der Indexverschreibung nach 12 Monaten naiver Periode.
248 228 Umsetzung des AMNOG in der Verordnungspraxis 6 Tabelle 35: Charakteristika von Aclidiniumneunutzern im Vergleich zu Tiotropiumneunutzern Komorbidität Charlson Comorbidity Index Hospitalisierte Personenzeit in % Diagnose einer Nierenerkrankung (u. a. Niereninsuffizienz) Diagnose einer Lebererkrankung (u. a. chronische Hepatitis) Mittelwert (Std) Median (Q1, Q3) Mittelwert (Std) Median (Q1, Q3) Neunutzer von Aclidinium N=544 2,4 (2,7) 2 (1, 3) 1,6 (3,88) (, 1) 579 (13,2 %) 615 (14. %) Neunutzer von Tiotropium N= , (2,37) 2 (1, 4) 3,5 (7,28) 1 (, 4) 61 (11.2 %) 67 (12.3 %) In beiden Gruppen hatte der Hauptanteil der Neunutzer (jeweils >99 %) die deutsche Staatsangehörigkeit und war der Hauptversicherte (95 % bzw. 96 %). Hinsichtlich der Größe des Wohnorts zeigten sich Unterschiede; so wohnte ein geringerer Anteil an Aclidiniumneunutzern in einem städtischen Kreis (33 % im Vergleich zu 38 %) und ein deutlich höherer Anteil in einem dünn besiedelten ländlichen Kreis (23 % im Vergleich zu 16 %). Bei der Fachrichtung des verschreibenden Arztes zeigten sich deutliche Unterschiede zwischen den beiden Medikamenten; während etwa die Hälfte der Aclidiniumneuverordnungen (52 %) von einem Hausarzt (Allgemeinmediziner, praktischer Arzt, Internist) ausgestellt wurde, waren dies etwa zwei Drittel (67 %) der Tiotropiumneuverordnungen (siehe Tabelle 33). Demgegenüber wurden 44 % der Neuverordnungen von Aclidinium, aber nur 25 % der Neuverordnungen von Tiotropium von Pneumologen verschrieben. Auch bei der regionalen Verteilung gab es Unterschiede zwischen Aclidiniumbzw. Tiotropiumneuverordnungen. So stammten beispielsweise 82 % der Tiotropiumneuverordnungen aus Westdeutschland, aber nur 76 % der Aclidiniumneuverordnungen. Ein etwas höherer Anteil der Aclidiniumneunutzer hatte eine ambulante oder stationäre Diagnose einer COPD, einer chronischen Bronchitis oder eines Emphysems. Demgegenüber wurden Neunutzer von Tiotropium aufgrund dieser Erkrankungen häufiger hospitalisiert (11 % im Vergleich zu 4 %, siehe Tabelle 34). Zudem war
249 6 Umsetzung des AMNOG in der Verordnungspraxis 229 der Anteil von Patienten mit einer Asthmadiagnose bei den Aclidiniumneunutzern etwas höher (37 % bzw. 3 %). Nur für 41 % bzw. 35 % der Patienten lag mindestens ein spezifischer FEV1 Wert (erfasst über die fünfte Stelle des ICD Codes) vor. Bei den Aclidiniumneunutzern war der Anteil der Patienten in den Kategorien mit einem höheren FEV1 Wert größer als bei den Tiotropiumneunutzern. Auch bei der medikamentösen Behandlung im Jahr vor der Indexverschreibung waren die Anteile der Patienten, die ein Präparat der jeweiligen Wirkstoffgruppe erhalten hatten, bei den Aclidiniumneunutzern höher als bei den Tiotropiumneunutzern. Chronischer Gebrauch von systemischen Kortikosteroiden bzw. inhalativem Budesonid (> 24 Tagesdosen im Jahr vor der Indexverschreibung) trat ebenfalls häufiger bei Aclidiniumneunutzern (11 % im Vergleich zu 7 %) auf, während der chronische Gebrauch von Antibiotika in beiden Gruppen sehr selten vorkam. Die Teilnahmerate an dem Disease Management Programm (DMP) für COPD war bei Aclidiniumneunutzern höher als bei Tiotropiumneunutzern (29 % bzw. 22 %). Zudem erhielt ein deutlich höherer Anteil an Tiotropiumneunutzern am Tag der Indexverschreibung zusätzlich eine erste Verschreibung eines LABA/ICS Kombinationsprodukts (long-acting beta-2 agonists (LABA), inhaled corticosteroids (ICS)) (9 % im Vergleich zu 3 %) nach zwölf Monaten ohne eine derartige Verschreibung. Sowohl der Charlson Comorbidity Index als auch die hospitalisierte Personenzeit im Jahr vor Indexverschreibung als Indikator für die allgemeine Komorbidität waren bei Neunutzern von Tiotropium etwas höher (siehe Tabelle 35). Eine Leber- oder Nierenerkrankung wurde ebenfalls bei einem etwas höheren Anteil von Tiotropiumneunutzern beobachtet. Die Ergebnisse der logistischen Regressionsanalyse mit den beschrieben Variablen als Prädiktoren einer Aclidiniumneuverschreibung sind in den Abbildung 41 und 42 dargestellt. Für die Regressionsanalyse wurde die Region des verschreibenden Arztes aufgrund der geringen Fallzahl pro KV Region in West- und Ostdeutschland gruppiert.
250 23 Umsetzung des AMNOG in der Verordnungspraxis 6 Abbildung 41: Prädiktoren für eine Aclidiniumneuverordnung im Vergleich zu einer Tiotropiumneuverordnung Teil 1 Abbildung 42: Prädiktoren für eine Aclidiniumneuverordnung im Vergleich zu einer Tiotropiumneuverordnung Teil 2
251 6 Umsetzung des AMNOG in der Verordnungspraxis 231 Eine signifikant höhere Wahrscheinlichkeit für eine Aclidiniumverordnung anstelle einer Tiotropiumverordnung zeigte sich für Personen aus dünn besiedelten ländlichen Kreisen. Charakteristika des verschreibenden Arztes hatten ebenfalls einen signifikanten Einfluss auf die Aclidiniumverordnung. Pneumologen hatten im Vergleich zu Hausärzten eine fast doppelt so hohe Wahrscheinlichkeit (OR 1,91, KI 1,55, 2,35) für eine Neuverordnung von Aclidinium und bei Ärzten aus Ostdeutschland erhöhte sich die Wahrscheinlichkeit einer Aclidiniumverordnung um fast 4 % (1,36, KI 1,7, 1,74). Weitere signifikante Prädiktoren für eine Aclidiniumverordnung waren die Teilnahme am DMP für COPD, die Verordnung von SABA im Jahr vor der Indexverschreibung, der chronische Gebrauch von systemischen Kortikosteroiden bzw. inhalativem Budesonid oder die Diagnose einer Nierenerkrankung im Jahr vor der Indexverschreibung. Eine Neuverordnung von Tiotropium war signifikant mit einer Hospitalisierung im Jahr vor der Indexverschreibung aufgrund einer COPD, einer chronischen Bronchitis oder eines Lungenemphysems, einem höherem Charlson Comorbidity Index und mehr hospitalisierter Personenzeit sowie einer Neuverordnung eines LABA/ICS Kombinationspräparats am Indextag assoziiert. Diskussion Prädiktoren für eine Aclidiniumneuverordnung waren in unserer Analyse das Fachgebiet und die Region des verschreibenden Arztes, die Größe des Wohnorts des Patienten, die Teilnahme an einem DMP für COPD und die Komorbidität. Bei einem Pneumologen ist die Wahrscheinlichkeit fast doppelt so hoch, Aclidinium verordnet zu bekommen wie bei einem Hausarzt. Ärzte anderer Fachrichtungen verordnen Aclidinium tendenziell seltener als Tiotropium. Eine Teilnahme am DMP für COPD erhöht die Wahrscheinlichkeit, Aclidinium verordnet zu bekommen, um 2 %. Bei Ärzten in Ostdeutschland ist die Wahrscheinlichkeit, Aclidinium verordnet zu bekommen um fast 4 % höher als bei Ärzten in Westdeutschland. Allerdings ist die Einteilung der KV-Regionen in Ost- und Westdeutschland mit Vorsicht zu interpretieren, da der höhere Anteil von Aclidiniumverschreibungen im Osten hauptsächlich in Berlin und Brandenburg zu beobachten war und Rheinland-Pfalz sich deutlich von den anderen westdeutschen Bundesländern unterschied. Soziodemographische Faktoren wie Alter, Geschlecht und Nationalität waren keine signifikanten Prädiktoren, allerdings ist ein dünn besiedelter ländlicher Kreis positiv mit einer Aclidiniumverschreibung assoziiert. Höhere Komorbidität führt zu einer geringeren Wahrscheinlichkeit, Aclidinium verordnet zu bekommen; sowohl der Charlson Comorbidity Index als auch die im Vorjahr verbrachte Zeit im Krankenhaus sind negativ mit einer Verschreibung von Aclidi-
252 232 Umsetzung des AMNOG in der Verordnungspraxis 6 nium assoziiert. Allerdings erhöht das Vorliegen einer Nierenerkrankung die Wahrscheinlichkeit, Aclidinium zu erhalten. Dies kann dadurch bedingt sein, dass laut Fachinformation bei der Anwendung von Aclidinium bei Patienten mit Nierenfunktionsstörung keine Einschränkungen gemacht werden, bei Tiotropium hingegen geraten wird, das Medikament bei Patienten mit mittlerer bis schwerer Nierenfunktionsstörung nur dann einzusetzen, wenn der erwartete Nutzen das Risiko übersteigt. Hinsichtlich des Schweregrads der COPD ergab sich kein einheitliches Bild. Chronischer Gebrauch von Kortikosteroiden und tendenziell auch der chronische Gebrauch von Antibiotika bzw. FEV1-Werte über 5% waren positiv, COPD-bedingte Krankenhausaufenthalte hingegen negativ mit einer Verschreibung von Aclidinium assoziiert. Eine Limitation unserer Analyse ist, dass nicht alle Informationen von Interesse in GePaRD zur Verfügung stehen und dementsprechend nicht mit einbezogen werden konnten. Beispielsweise kann aus den Daten nicht entnommen werden, ob der Patient bereits etwas über Aclidinium gehört hatte und ob er aufgrund dieser Informationen gezielt nach der Verordnung von Aclidinium gefragt hatte. Ebenso wenig ist bekannt, welche Informationen der Arzt über Aclidinium hatte und wie er insbesondere den fehlenden Zusatznutzen aufgrund der unzureichenden Datenlage beurteilte. Auch die bisherigen Erfahrungen des verschreibenden Arztes mit Tiotropium und die Präferenz des Arztes bzw. Patienten hinsichtlich neuer bzw. herkömmlicher Medikamente sind mögliche Prädiktoren, die nicht berücksichtigt werden konnten. Da Aclidinium im Gegensatz zu Tiotropium zweimal täglich eingenommen werden muss, spielt wohl auch die Compliance des Patienten eine Rolle bei der Abwägung. Ebenso können aufgrund der Vorgeschichte des Patienten Unterschiede im Nebenwirkungsprofil, bei den potentiellen Interaktionen mit anderen Medikamenten und bei den sonstigen Bestandteilen die Entscheidung zwischen Aclidinium und Tiotropium beeinflussen. Ein weiterer potentieller Prädiktor ist die Einsekundenkapazität (Forced Expiratory Volume in 1 second, FEV1) auf der die Schweregradeinteilung nach GOLD 46 und die Therapieempfehlungen nach dem Stufenschema der Nationalen Versorgungsleitlinie 47 beruhen. Ergebnisse von durchgeführten Lungenfunktionsprüfungen sind in GePaRD nicht enthalten, allerdings kann der auf dem FEV1-Wert basierende Grad der Obstruktion an der fünften Stelle des Codes für COPD der deutschen Fassung der International Classification of Diseases (ICD-1-GM) kodiert werden. 48 Die FEV1-Werte liegen aber nur bei 41% bzw. 35% der Patienten vor. Deshalb wurde versucht, den Schweregrad der COPD durch weitere Variablen, die die Global Initiative for Chronic Obstructive Lung Disease (215), S. 4. Abholz H (212), S. 15. Deutsches Institut für Medizinische Dokumentation und Information (215).
253 6 Umsetzung des AMNOG in der Verordnungspraxis 233 medikamentöse Therapie bzw. Exazerbationen beschreiben, abzubilden. Eine weitere Limitation ist der kurze Studienzeitraum von drei Monaten und die dadurch bedingte relativ geringe Zahl von Patienten. Allerdings konnten trotzdem Unterschiede zwischen den Gruppen beschrieben und Prädiktoren identifiziert werden. Weitere und insbesondere detailliertere Analysen sind geplant, sobald mehr Daten vorliegen. Eine Stärke dieser Analyse ist die populationsbasierte Erfassung der Aclidinium- bzw. Tiotropiumverordnungen sowie der weiteren Variablen u.a. bezüglich der medikamentösen Vorbehandlung und der Komorbidität. Verzerrungen durch Selektions-, Erinnerungs- o- der Berichtsbias werden dadurch so gut wie ausgeschlossen. Abrechnungsdaten gelten als Goldstandard für die Untersuchung von Arzneimittelexpositionen 49 und abgesehen von Neuverordnungen, die ausschließlich im Krankenhaus abgegeben wurden, kann davon ausgegangen werden, dass Neunutzer von Aclidinium und Tiotropium vollständig erfasst wurden. Auch wurde die Komorbidität vollständig abgebildet, sofern die Erkrankungen diagnostiziert und entsprechend kodiert wurden. Zusammenfassend zeigte unsere Analyse, dass ein ländlicher Wohnort, die Facharztrichtung Pneumologie, ein Praxisstandort in Ostdeutschland, Teilnahme am DMP für COPD, chronischer Gebrauch von Kortikosteroiden und eine Vorgeschichte von Nierenerkrankungen positiv und Hospitalisierungen aufgrund von COPD, chronischer Bronchitis oder Emphysem im Vorjahr, der Charlson Comorbidity Index und die im Vorjahr verbrachte Zeit im Krankenhaus negativ mit einer Verschreibung von Aclidinium assoziiert sind. Am 16. Juli 215 hat der G-BA beschlossen, dem am 22. Juni 215 durch den pharmazeutischen Unternehmer eingereichten Antrag auf eine erneute Nutzenbewertung von Aclidinium statt zu geben 41 und weitere randomisierte, kontrollierte Studien 411 mit einzubeziehen. Es bleibt abzuwarten, ob IQWiG und G-BA im Rahmen dieser erneuten Nutzenbewertung einen Zusatznutzen feststellen und welche Auswirkungen die Entscheidung auf die Verschreibungszahlen von Aclidinium, aber auch auf die Prädiktoren einer Aclidiniumverschreibung haben werden. Wir bedanken uns ganz herzlich bei Sandra Ulrich und Marieke Niemeyer für die Programmierung der Analysedatensätze und bei Bianca Kollhorst für die Unterstützung bei der statistischen Auswertung Schneeweiss, Avorn (25). G-BA (215). D Urzo, Rennard, et al. (214); Singh et al. (214).
254 234 Umsetzung des AMNOG in der Verordnungspraxis Literatur ABDA Bundesvereinigung Deutscher Apothekerverbände. (212). Aufnahme in den ABDA Artikel-Stamm. Abholz H, G. A., Magnussen H, Schott G, Schultz K, Ukena D, Worth H. (212). Nationale VersorgungsLeitlinie COPD. Version 1.9. URL: 3k_S3_COPD_abgelaufen.pdf, ( ). Arznei-Telegramm (214): Kurz und bündig: Jetzt doch frühe Nutzenbewertung von Dimethylfumarat (Tecfidera). a-t; 45: 63. Arznei-Telegramm (215): Bewertung Dimethylfumarat. Letzte Änderung vom URL: nummer=dimethylfumarat&ord=uaw (Stand: ). Aumann, I., & Prenzler, A. (213). Epidemiologie und Kosten der COPD in Deutschland eine Literaturrecherche zu Prävalenz, Inzidenz und Krankheitskosten. Der Klinikarzt, 42(4), BT-Drs. Bundestagsdrucksache 17/3116 vom : Entwurf eines Gesetzes zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung (Arzneimittelmarktneuordnungsgesetz AMNOG) BT-Drucksache 17/2413 vom : Entwurf eines Gesetzes zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung (Arzneimittelmarktneuordnungsgesetz AMNOG) (BTDrucksache 17/2413). BT-Drs. 18/1671: Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Kathrin Vogler, Sabine Zimmermann (Zwickau), Inge Höger, weiterer Abgeordneter und der Fraktion DIE LINKE. Drucksache 18/115 Versorgungslage, Evidenz und Kosten therapeutischer Verfahren bei Multipler Sklerose vom Cassel D, Ulrich V (215): AMNOG das Bermuda-Dreieck der GKV-Arzneimittelversorgung: Warum kommen Innovationen gar nicht oder erst verspätet beim Patienten an? IMPLICONplus 1/215. Chanez, P., Burge, P., Dahl, R., Creemers, J., Chuchalin, A., Lamarca, R., & Garcia Gil, E. (21). Aclidinium bromide provides long-acting bronchodilation in patients with COPD. Pulmonary pharmacology & therapeutics, 23(1), DIMDI Deutsches Institut für Medizinische Dokumentation und Information. (215): ICD-1-GM Version 215: Chronische Krankheiten der unteren Atemwege (J4-J47). URL: ( ). D Urzo AD, Rennard SI, Kerwin EM, Mergel V, Leselbaum AR, Caracta CF (214): Efficacy and safety of fixed-dose combinations of aclidinium bromide/formoterol fumarate: the 24-week, randomized, placebocontrolled AUGMENT COPD study. Respiratory Research, 15(1). EMA European Medicines Agency (213): Bretaris Genuair aclidinium bromide. URL: ( ).
255 6 Umsetzung des AMNOG in der Verordnungspraxis 235 EMA European Medicines Agency (215): Zusammenfassung des EPAR für die Öffentlichkeit: Esibret Pirfenidon. EMA/64972/215. G-BA Gemeinsamer Bundesausschuss. (213): Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGBV Aclidiniumbromid. URL: ( ). G-BA Gemeinsamer Bundesausschuss. (215): Beschluss des Gemeinsamen Bundesausschusses über einen Antrag auf erneute Nutzenbewertung nach 35a Abs. 5 SGBV. URL: ( ). Global Initiative for Chronic Obstructive Lung Disease. (215). Global Strategy For The Diagnosis, Management, And Prevention Of Chronic Obstructive Pulmonary Disease. URL: ( ). Greiner W, Witte J (215): AMNOG-Report 215. Nutzenbewertung von Arzneimitteln in Deutschland. Heidelberg: medhochzwei Verlag. Haas A, Tebinka-Olbrich A (215): Das Wirtschaftlichkeitsgebot im Ein-zelfall und der Mischpreis. Vortrag 2 der interdisziplinären Plattform zur Nutzenbewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Im-pulse, Heft 1: Springer Medizin. Höer A, Chen X (215): AMNOG-Reporting, in: Häussler B, Höer A, de Millas C (Hrsg.): Arzneimittel-Atlas 215. IGES Institut GmbH, Berlin. IQWiG Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen. (213): Aclidiniumbromid Nutzenbewertung gemäß 35a SGB V. URL: ( ). Kleinfeld A, Luley C (214): Durchsetzung innovativer Wirkstoffe nach der frühen Nutzenbewertung. Monitor Versorgungsforschung; 2/214: Laschet H (214): Der Arzt erhält wertvolle Informationen. Ärzte Zeitung vom Laschet H (215): Subgruppen und Mischpreis. Ärzte fühlen sich verunsichert. Ärzte Zeitung vom Pieloth, K, Kleinfeld A (213): AMNOG, Zusatznutzen, regionale Marktdurchdringung. Monitor Versorgungsforschung; 6/213: Richard S (215): Pillen am Ende der Preisspirale. Gesundheit und Gesellschaft; 18 (5/15): Schneeweiss S, & Avorn J (25): A review of uses of health care utilization databases for epidemiologic research on therapeutics. J Clin Epidemiol, 58(4), Singh D, Jones PW, Bateman ED, Korn S, Serra C, Molins E, Caracta C, Gil EG, Leselbaum A (214): Efficacy and safety of aclidinium bromide/formoterol fumarate fixed-dose combinations compared with individual components and placebo in patients with COPD
256 236 Umsetzung des AMNOG in der Verordnungspraxis 6 (ACLIFORM-COPD): a multicentre, randomised study. BMC pulmonary medicine, 14(1), 178. Staeck F (215): Einigkeit gibt es über den Reformbedarf, nicht über die Inhalte. Zusammenfassung der interdisziplinären Plattform zur Nutzen-bewertung. Schriftenreihe Vier Jahre AMNOG Diskurs und Impulse, Heft 1: Springer Medizin. Statistisches Bundesamt (213): Gesundheit. Todesursachen in Deutschland. Fachserie 12, Reihe 4. URL: blob=publicationfile, ( ). Vfa Verband der forschenden Arzneimitelhersteller (215): AMNOG-Praxis schafft Versorgungsdefizite! Pressemitteilung vom
257 237 7 Rückwirkung des 13b-Rabattes 7.1 Die freie Preisbildung in der Kritik Hintergrund der zwölfmonatigen freien Preisbildungsphase Zwei zur Einführung des AMNOG formulierte Ziele waren, dass (1) die Preise und Verordnungen von Arzneimitteln wirtschaftlich und kosteneffizient sein müssen und (2), dass verlässliche Rahmenbedingungen für Innovationen, die Versorgung der Versicherten und die Sicherung von Arbeitsplätzen geschaffen werden müssen. 412 Die Gewährung einer Phase freier Preisbildung dürfte zum Zeitpuntk der Einführung der frühen Nutzenebwertung ein Kompromiss zwischen der Erschließung von Wirtschaftlichkeitsreserven im patentgeschützten Marktsegement und der Wahrung unternehmerische Freiheit und Planungssicherheit gewesen sein. Kritik gibt es unter anderem deshalb, weil vermutet wird, Hersteller könnten spätere Preisnachlässe durch den nutzenbasierten Erstattungsbetrag bereits a priori einpreisen und zumindest teilweise innerhalb der ersten zwölf Vertriebsmonate kompensieren. Der hohe Listenpreis von Sofosbuvir führte in diesem Kontext zu großer medialer Aufmerksamkeit. 413 Wenn sich parallel die Umsätze mit neuen Arzneimitteln in wesentlichen Therapiegebieten immer weiter nach vorn, das heißt in die Phase kurz nach Markteintritt verlagern, müsse dieser Marktveränderung Rechnung getragen werden. Im Fall von Sofosbuvir kam bereits vor Ablauf der freien Preisbildung das Folgeprodukt Harvoni auf den Markt. Sofosbuvir diente bei der Bewertung von Harvoni zudem als zweckmäßige Vergleichstherapie und damit auch als Preisreferenz. 414 Auf dem Markt für die Hepatitis C- Therapien ist zudem zeitnah kein wesentlicher Preiswettbewerb zu erwarten. Viele der sich bis vor wenigen Jahren noch in den Entwicklungspipelines befindlichen Hepatits-C-Therapien wurden aufgrund des Erfolges der neuen HCV-Polymerase-Inhibitoren wie Sofosbuvir nicht weiter verfolgt. 415 Neben den hohen Erstattungsbeträgen neuer Hepatits-C-Therapien stehen jedoch auch die hohen Kosten neuer Onkologika in Relation zu zum Teil nur geringen Nutzenvorteilen in der Kritik. 416 Eine Untersuchung aus den USA hat zuletzt gezeigt, dass mediane (nicht rabattierte) Herstellerabgabepreise nicht durch den Innovationsgrad (gemessen an der prozentualen Verbesserung des Gesamtüberle- Preispolitik der Hersteller in der Kritik BT-Drs. 17/3116; S. 1. BT-Drs. 18/2673. Kailuweit (215). Richard (215), S. 23. Ärzte Zeitung (215a); Light, Kantarjian (213), S. 391.
258 238 Rückwirkung des 13b-Rabattes 7 Bislang nur Einzelfälle bens und der progressionsfreien Überlebenszeit) beeinflusst werden. 417 Daher gibt es Forderungen, die im AMNOG-Verfahren ausgehandelten Erstattungsbeträge bereits auf den ersten Vertriebstag zurückzubeziehen. 418 Allerdings kann bislang kein struktureller Negativeffekt der temporär begrenzten freien Preisbildung beobachtet werden. Der überwiegende Anteil der AMNOG-Produkte zeigt normale Marktdiffusionsverläufe, so dass eine strategische Preisgestaltung der Hersteller weitestgehend ohne Effekt bleiben dürfte. Die Marktentwicklung neuer Hepatits-C-Präparate ist unter den AMNOG-Präparaten bislang einzigartig. Werden alle AMNOG-Wirkstoffe berücksichtigt, für die seit Marktzugang bis zum zwei volle Beobachtungsjahre vorliegen (n=5), erzielen nur zwei (Boceprevir, Telaprevir) im ersten Vertriebsjahr über eine Millionen mehr Umsatz als im zweiten. Eine entsprechende Entwicklung ist zudem für Sofosbuvir und die Fixkombination Ledipasvir und Sofosbuvir erwartbar. Die übrigen neuen Wirkstoffe, die im ersten Vertriebsjahr einen höheren Umsatz als im zweiten erzielten, liegen hinsichtlich der Größenordnung auf vernachlässigbarem Niveau (vgl. Abb. 43). Abbildung 43: Bruttoumsatzdifferenz des ersten und zweiten Vertriebsjahres bei DAK-Versicherten (dargestellt sind nur Wirkstoffe mit einer Differenz von über 4. ) Fingolimod Fampridin Aflibercept (Eylea) Ipilimumab Ticagrelor Pirfenidon Ivacaftor Saxagliptin Metformin Vismodegib Lisdexamfetamindimesilat Boceprevir Telaprevir Bruttoumsatzdifferenz in Mailankody, Prasad (215), S. 54. Obgleich die Untersuchung in methodischer Hinsicht kritisch kommentiert wurde. Siehe hierzu: Burkholder (215). Richard (215), S. 22.
259 7 Rückwirkung des 13b-Rabattes 239 Budgeteffekte einer Aufhebung der freien Preisbildung Zur Anpassung des Zeitraumes der freien Preisbildung sind verschiedene Szenarien denkbar: 1. Rückwirkung ab dem ersten Vertriebstag 2. Weitere zeitliche Begrenzung der freien Preisbildung 3. Beschränkung der freien Preisbildung anhand verfahrensbezogener Kriterien Szenario eins ist die derzeit am häufigsten diskutierte Variante und würde den Effekt der freien Preisbildung nur noch auf die Listung eines höheren Herstellerabgabepreises beschränken. Szenario zwei könnte eine Rückwirkung zum Beispiel bis zum Abschluss der Nutzenbewertung, also eine Begrenzung der freien Preisbildung auf einen Zeitraum von sechs Monaten vorsehen. 419 Der Hersteller der zuletzt zugelassenen Fixkombination Ledipasvir und Sofosbuvir und der GKV-SV vereinbarten bereits, dass der Nutzenbewertungsrabatt bereits ab dem zehnten Monat nach Marktzugang gilt. 42 Der neue Apothekenverkaufspreis pro Packung tritt somit drei Monate vor dem üblichen Zeitpunkt nach Markteinführung, also zum in Kraft. Unabhängig von einer gesetzlichen Nachsteuerung gilt es demnach schon zwischen den Vertragspartner konsensfähige Rückwirkungsmodelle. Denkbar wäre als drittes Szenario, die Rückwirkung des 13b-Rabattes an bestimmte Verfahrenskonstellationen zu knüpfen. 421 Möglich wäre dies zum Beispiel für Wirkstoffe ohne Zusatznutzen, was jedoch an seiner praktischen Umsetzbarkeit scheitern dürfte. Denn einem nicht belegten Zusatznutzen liegen verschiedene Begründungsmuster zugrunde. Insbesondere in den Verfahren, in denen ein fehlender Zusatznutzen nicht über die Evidenzlage zu begründen ist, erscheint die selektive Ausdehnung wissenschaftlich-methodischer Kontroversen auf die Erstattungsrahmenbedingungen höchst fragwürdig. Auch die rechtliche Tragfähigkeit einer entsprechenden Ausweitung der Reichweite des Nutzenbewertungsbeschlusses wäre zu prüfen. Alternativ ist ein Rückwirkungsmodell für jene Verfahren zu diskutieren, in denen der pharmazeutische Unternehmer kein Dossier eingereicht hat. Im Gegensatz zu derzeit für die Fälle, in denen sich ein Hersteller verfahrenskonform gegen die Einreichung eines Dossiers entscheidet, diskutierten zwangsweisen Abschläge auf das Preisniveau der zvt erscheint eine entsprechende Rückwirkung der Erstattungsbeträge praktisch umsetzbar und angemessen Ärzte Zeitung (215b); Schaufler, Telschow (215), S. 23. O.V. (215c). Bode et al. (214), S. 13.
260 24 Rückwirkung des 13b-Rabattes 7 Eine Multiplikation der je nach zeitlichem Bezugszeitraum erzielten Bruttoumsätze aller bis zum nutzenbewerteten Wirkstoffe mit einem Ende 215 vorliegenden Erstattungsbetrag und vollem Beobachtungszeitraum zeigt für die zuvor skizzierten Rückwirkungsszenarien folgende Einsparpotentiale: Tabelle 36: Potentielle Einsparungen einer Aufhebung der freien Preisbildung bei der DAK-Gesundheit (Stand: ) Szenario Gesamt I. Volle Rückwirkung II. Rückwirkung 6 Monate III. Rückwirkung ohne Zusatznutzen Differenzierte Bewertungsperspektive erforderlich Eine simple Extrapolation 422 der auf Abrechnungsdaten der DAK-Gesundheit basierenden Berechnungen für die Gesamt-GKV ergibt ein Einsparpotential in Höhe von 365 bis 38 Millionen für eine vollständige zwölfmonatige Rückwirkung. Dies deckt sich zumindest näherungsweise mit anderen Berechnungen, wenn berücksichtigt wird, dass in oben gezeigten Berechnungen bereits die Erstattungsbeträge hochpreisiger Innovationen wie Dimethylfumarat oder Sofosbuvir berücksichtigt sind. Im AVR wurden zuletzt Einsparungen für den Zeitraum bis Ende 214 (56 berücksichtigte Arzneimittel mit Erstattungsbetrag) in Höhe von 245 Millionen errechnet. Im Rahmen einer Begrenzung auf sechs Monate reduzieren sich die von den Autoren berechneten Einsparungen auf 159 Millionen. 423 Zur Erschließung weiterer Kostendämpfungspotentiale erscheinen oben simulierte Rückwirkungsmodelle durchaus attraktiv. Letztlich geht dem gewährten freien Preisbildungszeitraum jedoch auch eine industrie- und ordnungspolitische Entscheidung des Gesetzgebers bei Einführung des AMNOG voraus, welche so ist aufgrund fehlender Angaben in der Gesetzesbegründung nur zu vermuten auch Innovations- und Investitionsanreize in Deutschland setzen sollte. Zu diskutieren ist hier insofern die grundsätzliche Steuerungsintention des AMNOG. Die Diskussion um den Fortbestand zumindest für einen kurzen Zeitraum herstellerseitig frei festgesetzter Abgabepreise wird bislang überwiegend aus Budget-Perspektive der GKV geführt. Industrie- und wettbewerbsökonomisch motivierte Argumentationen bleiben in der Regel aus. Arzneimittelpolitik bewegt sich jedoch stets im Spannungsfeld zwischen Gesundheitspolitik und Wirtschaftsförderung. 424 Eine rückwirkende Anpassung der Erstattungsbeträge wäre weitestgehend gleichbedeutend mit einem Die potentiellen Einsparungen wurden sowohl auf Basis des Versichertenanteils der DAK-Gesundheit als auch dem arzneimittelbezogenen Ausgabenanteil am GKV-Gesamtvolumen berechnet. Schaufler, Telschow (215), S. 23. Richard (215), S. 23.
261 7 Rückwirkung des 13b-Rabattes 241 Preisdiktat durch die Krankenkassen und würde für Hersteller finanziell nicht kalkulierbare Risiken implizieren. 425 Die Bundesregierung selbst hat im Rahmen einer Kleinen Anfrage hierzu Stellung bezogen. Nach Ansicht der Bundesregierung ist die aktuelle Ausgabenentwicklung von Sofosbuvir bislang einzigartig, die Ausgabenentwicklung von neuen Arzneimitteln im ersten Jahr werde jedoch auch weiterhin aufmerksam beobachtet. Vorschläge, die vorsehen, dass der zwischen dem pharmazeutischen Unternehmer und dem GKV-Spitzenverband ausgehandelte Erstattungsbetrag auch für das erste Jahr nach der Markteinführung gelten soll, seien am Grundrecht der Berufsfreiheit der pharmazeutischen Unternehmer und gegebenenfalls am verfassungsrechtlichen Rückwirkungsverbot zu messen. Die verfassungsrechtliche Zulässigkeit hängt dabei von der konkreten Ausgestaltung der Vorschläge ab. Sollte die Bundesregierung zu dem Schluss kommen, dass gesetzliche Änderungen erforderlich sind, so wird sie dem Deutschen Bundestag einen entsprechenden Vorschlag übermitteln. 426 Auch der G- BA hat zuletzt erkennen lassen, dass eine Rückwirkung an der Verpflichtung der Hersteller, Rückstellungen zu bilden, scheitern und zudem das Opt-Out-Risiko erhöhen könnte O.V. (215a). BT-Drs. 18/2673, S. 9. O.V. (215b).
262 242 Rückwirkung des 13b-Rabattes Rationale für eine Stärkung der Kosten-Nutzen-Bewertung Die Diskussion um den gesetzlich gewährten zwölfmonatigen Zeitraum freier Preisbildung greift letztlich ohne Rückbezug auf Daten einer Kosten-Nutzen-Bewertung zu kurz. Ohne Einbezug von Folgekosten oder, wie im Fall von Sofosbuvir wahrscheinlich Folgeeinsparungen zum Beispiel durch vermiedene Lebertransplantationen und Leberkarzinome wird die Bewertungsperspektive auf einen stark begrenzten Zeitraum eingeengt. Vielmehr sollten auch costoffsets, also Dimensionen wie vermiedene Pflegekosten, vermiedene Hospitalisierungskosten oder auch vermiedene Frühverrentung eine zentrale Rolle spielen. Allerdings sind Kosten-Nutzen-Bewertungen interpretationsbedürftig. Denn ihre Ergebnisse haben einen sehr viel größeren Interpretationsspielraum, sind also viel unsicherer, als manche Akteure im Gesundheitswesen es erwarten oder sich wünschen. Aber das Potenzial, das diese Methode bietet, ist durchaus vielversprechend und es lohnt, sie als zusätzliche Informations- und Entscheidungsgrundlage einzusetzen, wie der Sachverständigenrat zur Begutachtung der Entwicklung im Gesundheitswesen im Jahresgutachten 214 vorgeschlagen hat (vgl. Kapitel 1.2). 428 Auch Vertreter der gesetzlichen Krankenkassen haben sich zuletzt für eine Ausweitung dieses Verfahrensbestandteiles ausgesprochen. 429 Die derzeitige Rechtslage sieht eine strikte Trennung von evidenzbasierter Nutzenbewertung ( 35a SGB V) und evidenzbasierter Preisbildung ( 13b SGB V) für Arzneimittel mit neuem Wirkstoff vor. Allerdings wäre es denkbar, 13b SGBV insofern zu verändern, als dass es allen Vertragsparteien möglich ist, Ergebnisse einer Kosten-Nutzen-Bewertung fakultativ einzubringen. Die Stärkung der Rolle der Kosten-Nutzen-Bewertung in Deutschland sollte dabei nicht im Sinne einer expliziten Rationierung erfolgen, sondern eher als weitere Informationsgrundlage zur Entscheidungsfindung auf Basis bestverfügbarer Evidenz. 43 Windeler führt den bislang geringen Stellenwert entsprechender Analysen auf die (noch) gute finanzielle Ausstattung des GKV-Systems zurück. 431 Alternativ ließe sich mit Blick auf das IQWiG natürlich auch der fehlende Konsens hinsichtlich der richtigen Methoden zur Durchführung von Kosten-Nutzen-Bewertungen als Etablierungshürde diskutieren. Das international verbreitete Konzept der QALYs (quality adjusted life years) findet in Deutschland auf politischer Ärzteblatt (215a). Exemplarisch: Apotheke Adhoc (214); Ärzteblatt (215b); Breddemann, Grünauer (215); Glaeske et al. (215), S. 14. Windeler und Lange weisen zurecht darauf hin, dass Leistungsausschlüsse basierend auf Kostenüberlegungen trotz belegtem Nutzen bzw. Überlegenheit einer Intervention in Deutschland kaum denkbar sind. Vgl. Windeler, Lange (215), S Ärzteblatt (215a).
263 7 Rückwirkung des 13b-Rabattes 243 Ebene mit Verweis auf vermeintliche Probleme insbesondere in normativen Wertungsfragen wenig Akzeptanz. 432 Gleiches gilt jedoch auch auf wissenschaftlicher Ebene für das vom IQWiG abseits des internationalen Standards entwickelten Effizienzgrenzenkonzeptes, welches von verschiedenen wissenschaftlichen Fachgesellschaften und Experten kritisiert wurde und weder theoretisch überzeugen kann noch vielfach praktisch umsetzbar ist. 433 Abseits der Frage, nach welchem Berechnungsmodell Kosten-Nutzen-Daten Berücksichtigung finden könnten, ist zu prüfen, wie eine Integration entsprechender Ergebnisse in den derzeitigen Verfahrensalgorithmus sinnvoll möglich wäre. Das IQWiG hat 214 untersucht, wie stark der Einfluss von Kosten-Nutzen-Bewertungen auf die jeweilig nationalen Entscheidungsprozesse ist. 434 Betrachtet wurden dazu neben Deutschland, England, Schweden, Australien, Niederlande, Brasilien und Thailand. Grund für diese Länderauswahl war das Ziel, ein möglichst differenziertes Bild über verschiedene Sozialversicherungstypen sowie hinsichtlich des wirtschaftlichen Entwicklungsstandes zu skizzieren. Die Autoren kommen zu dem Ergebnis, dass Kosten-Nutzen-Bewertungen international einen rechtlich geregelten festen Bestandteil bei Entscheidungen im Gesundheitswesen bilden. Ihre Ergebnisse werden auch in anderen Ländern nie direkt eins zu eins in Erstattungsentscheidungen übersetzt, sondern immer in Abwägung mit anderen Kriterien wie Krankheitsschwere oder ethischen Überlegungen umgesetzt. Unklar ist jedoch, wieso die Autoren der Studie trotz Offenlegung der Einschlusskriterien in den Länderkorb keinen Blick auf das dem deutschen Nutzenbewertungsverfahren in vielerlei Hinsicht vergleichbaren Prozedere in Frankreich werfen. Eine dort gewählte Option, die Rolle gesundheitsökonomischer Evidenz im Nutzenbewertungsverfahren zu stärken und die Informationsbasis insbesondere im Rahmen der Erstattungsbetragsverhandlungen zu vergrößern, stellt eine Schwellenwertlösung vergleichbar zur Nutzenbewertungsarithmetik von Orphan Drugs, also eine verpflichtende Vorlage von Kosten-Nutzen-Bewertungs-Daten ab einem bestimmten zu erwartenden Budget-Impact innerhalb einer definierten Zeitperiode, dar. Für Sofosbuvir oder andere Wirkstoffe aus hochpreisigen und zudem eher prävalenten als inzidenten Indikationen wäre in einem solchen Verfahrensmodell die Evidenzbasis sehr sinnvoll vergrößert worden. Innerhalb der in Frankreich angewendeten Frühbewertungssystematik neuer Wirkstoffe werden seit Oktober 213 Kosten-Effektivitätsdaten explizit in die Preisbildung einbezogen. In 211 erfolgte dort zunächst die Verabschiedung des Social Security Financing Act for 212, welcher eine medizinisch-ökonomische Evaluation als Optionen zur Integration von Kosten-Nutzen-Bewertungen Kosten-Nutzen-Bewertungen bei hoher Budget-Relevanz Laschet (214). Exemplarisch: Greiner et al. (21). Gerber-Grote, Windeler (214).
264 244 Rückwirkung des 13b-Rabattes 7 vierte Determinante der Arzneimittelpreisbildung neben klinischem Mehrwert, Preisen von vergleichbaren Präparaten und Umsatzvolumina einführte. In 212 erfolgte eine weitere gesetzliche Stärkung gesundheitsökonomischer Studien ( Décret No vom 2. Oktober 212) mit der Forderung nach medico-economic evaluations bei innovativen Arzneimitteln und Medizinprodukten mit einem signifikantem Budget Impact für die Krankenkassen von jährlich mehr als 2 Millionen. 435 Forschungsergebnisse aus Frankreich belegen zudem, dass die verpflichtende Vorlage entsprechender Kosten-Effektivitätsdaten nicht zu Veränderungen im Dossier-Einreichungsverhalten der pharmazeutischen Unternehmer führt. 436 Die Autoren schlussfolgern daraus, dass den Herstellern nur geringe marginale Kosten zur länderspezifischen Adaption entsprechender Daten aus einem Core-Modell entstehen Dervaux et al. (213), S. 259ff. Yocolly, Moise (215).
265 7 Rückwirkung des 13b-Rabattes Literatur Apotheke Adhoc (214): Der Wunsch nach mehr AMNOG. Apotheke Adhoc vom Ärzteblatt (215a): 5 Fragen an Jürgen Windeler: Es gibt Studien, die Fragen beantworten, die niemanden interessieren. Ärzteblatt online vom Ärzteblatt (215b): Barmer GEK fordert Kosten-Nutzen-Analyse neuer Arzneimittel. Ärzteblatt online vom Ärzte Zeitung (215a): AMNOG kommt auf den Prüfstand. Ärzte Zeitung online vom Ärzte Zeitung (215b): Kassen wollen Geld dem Nutzen folgen lassen. Ärzte Zeitung online vom Bode C, Haas A, Tebinka-Olbrich A (214): Ein dieales Paar: Erstattungsund Festbeträge zur Regulierung von Arzneimittelpreisen. G+S; 3/214: BT-Drs. Bundestagsdrucksache 17/3116 vom : Entwurf eines Gesetzes zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung (Arzneimittelmarktneuordnungsgesetz AMNOG) BT-Drs. Bundesttagsdrucksache 18/2673 vom : Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Kathrin Vogler, Sabine Zimmermann (Zwickau), Azize Tank, weiterer Abgeordneter und der Fraktion DIE LINKE. Drucksache 18/251 Die sogenannte 1-Dollar-Pille Sovaldi. Breddemann A, Grünauer T (215): Arzneimittelinnovationen Analyse der Ausgaben- und Mengenentwicklung der AMNOG-Präparate in den Jahren 211 bis 214 bei der BARMER GEK, in: Repschläger U, Schulte C, Osterkamp N: Gesundheitswesen Aktuell 215. Beiträge und Analysen, BARMER GEK. Burkholder R (215): To the Editor: Pricing and Value of Cancer Drugs. JAMA Oncology; 1 (6): Dervaux B, Baseilhac E, Fagon JY; participants of round table N 6 of Giens Workshops XXVIII (th), Ameye V, Angot P, Audry A, Becquemont L, Borel T, Cazeneuve B, Courtois J, Detournay B, Favre P, Granger M, Josseran A, Lassale C, Louvet O, Pinson J, de Pouvourville G, Rochaix L, Rumeau-Pichon C, de Saab R, Schwarzinger M, Sun A (213): Medico-economic evaluation of health products in the context of the Social Security Financing Act for 212. Thérapie; 68 (4): Gerber-Grote A, Windeler J (214): Welchen Beitrag leisten Kosten-Nutzen- Bewertungen bei Entscheidungen im Gesundheitswesen: Erfahrungen aus 7 ausgewählten Ländern. Zeitschrift für Evidenz, Fortbildung und Qualität im Gesundheitswesen; 18 (7): Glaeske G, Ludwig WD, Thürmann P (215): Innovationsreport 215. Wissenschaftliche Studie zur Versorgung mit innovativen Arzneimitteln Eine Analyse von Evidenz und Effizienz. SOCIUM, Bremen. Greiner W, Kuhlmann A, Schwarzbach C (21): Ökonomische Beurteilung des Effizienzgrenzenkonzeptes. Gesundheitsökonomie und Qualitätsmanagement; 15 (5):
266 246 Rückwirkung des 13b-Rabattes 7 Hoppe A, Braun L, Nohlen M (215): OPG Spezial: Wie das AMNOG besser wird. Sonderausgabe, Mai 215. Kailuweit I (215): Bittere Pillen für das Gesundheitswesen. Potentiale und Herausforderungen einer zukünftigen modernen Arzneimittelversorgung. Vortrag im Rahmen des 19. Berliner Dialogs, Laschet H (214): Nutzenbewertung. Stärkerer Fokus auf Lebensqualität nötig. Ärzte Zeitung online vom Light D, Kantarjian H (213): Commentary. Market Spiral Pricing of Cancer Drugs. Cancer; 119 (22): Mailankody S, Prasad V (215): Five Years of Cancer Drug Approvals: Innovation, Efficacy, and Costs. JAMA Oncology; 1 (4): O.V. (215a): Positionspapier des GKV-Spitzenverbands hat große Schwächen. Pharma-Fakten vom URL: (Stand: ). O.V. (215b): PTB-Workshop zu AMNOG und Wirtschaftlichkeitsprüfung nach 16: keine rückwirkenden Preise geplant. Payers insight vom URL: A7-16-keine-rueckwirkenden-preise-geplant/ (Stand: ). O.V. (215c): Gilead Sciences GmbH begrüßt vorzeitige Einigung zum Erstattungsbetrag für Harvoni mit dem GKV Spitzenverband. Aktiencheck-online vom URL: news/artikel-gilead_sciences_gmbh_begruesst_vorzeitige_eini- gung_zum_erstattungsbetrag_fuer_harvoni_gkv_spitzenverband (Stand: ). Richard S (215): Pillen am Ende der Preisspirale. Gesundheit und Gesellschaft; 18 (5/15): Schaufler J, Telschow C (215): Ökonomische Aspekte des deutschen Arzneimittelmarktes 214; in: Schwabe U, Paffrath D (Hrsg.): Arzneiverordnungsreport 2915, Springer-Verlag, Berlin-Heidelberg. Windeler J, Lange S (215): Nutzenbewertung medizinischer Leistungen im deutschen Gesundheitswesen rechtlicher Rahmen, historische und internationale Perspektive. Bundesgesundheitsblatt; 58: Yocolly A, Moise P (215): Manufactures reactions in response to the new requirement for cost-effectiveness in France. Präsentation im Rahmen der 18. ISPOR-Jahreskonferenz, , Mailand.
267 247 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene Augenerkrankungen Abbildung 44: Umsatz- und Verordnungsentwicklung von Aflibercept (Eylea) von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15 Abbildung 45: Umsatz- und Verordnungsentwicklung von Bromfenac von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jul 11 Sep 11 Nov 11 Jan 12 Mrz 12 Mai 12 Jul 12 Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Sep 14
268 248 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 46: Umsatz- und Verordnungsentwicklung von Nepafenac von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Abbildung 47: Umsatz- und Verordnungsentwicklung von Ocriplasmin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jul 13 Sep 13 Okt 13 Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai 14 Jun 14 Jul 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
269 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 249 Hauterkrankungen Abbildung 48: Umsatz- und Verordnungsentwicklung von Ingenolmebutat von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
270 25 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Herz-Kreislauf-Erkrankungen Abbildung 49: Umsatz- und Verordnungsentwicklung von Aliskiren Amlodipin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mai 11 Jun 11 Jul 11 Aug 11 Sep 11 Dez 11 Abbildung 5: Umsatz- und Verordnungsentwicklung von Apixaban von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul
271 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 251 Abbildung 51: Umsatz- und Verordnungsentwicklung von Azilsartan Medoxomil von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Nov 11 Feb 12 Apr 12 Jun 12 Aug 12 Okt 12 Dez 12 Feb 13 Apr 13 Jun 13 Aug 13 Okt 13 Dez 13 Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15 Abbildung 52: Umsatz- und Verordnungsentwicklung von Macietan von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15
272 252 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 53: Umsatz- und Verordnungsentwicklung von Riociguat von 211 bis 215 bei DAK-Versicherten SummeDDD Summe Bruttokosten DDD Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 54: Umsatz- und Verordnungsentwicklung von Ticagrelor von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 11 Mrz Mai Jul Sep 11 Nov 11 Jan 12 Mrz Mai Jul Sep 12 Nov 12 Jan 13 Mrz Mai Jul Sep 13 Nov 13 Jan 14 Mrz Mai Jul Sep 14 Nov 14 Jan 15 Mrz Mai Jul
273 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 253 Infektionskrankheiten Abbildung 55: Umsatz- und Verordnungsentwicklung von Boceprevir von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 11 Nov 11 Jan 12 Mrz 12 Mai 12 Jul 12 Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Abbildung 56: Umsatz- und Verordnungsentwicklung von Cobicistat von 211 bis 215 bei DAK-Versicherten 6 5 Summe DDD Summe Bruttokosten DDD Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
274 254 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 57: Umsatz- und Verordnungsentwicklung von Daclastasvir von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 58: Umsatz- und Verordnungsentwicklung von Dolutegravir von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
275 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 255 Abbildung 59: Umsatz- und Verordnungsentwicklung von Dolutegravir/Abacavir/Lamivudin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 6: Umsatz- und Verordnungsentwicklung von Emtricitabin/ Rilpivirin/Tenofovirdisoproxil von 211 bis 215 bei DAK-Versicherten Summe DDD Summe von Bruttokosten DDD Feb 12 Apr 12 Jun 12 Aug 12 Okt 12 Dez 12 Feb 13 Apr 13 Jun 13 Aug 13 Okt 13 Dez 13 Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15
276 256 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 61: Umsatz- und Verordnungsentwicklung von Fidaxomicin von 211 bis 215 bei DAK-Versicherten 1 9 Summe DDD Summe Bruttokosten DDD Jan Feb Mrz Apr Mai Jun Jul 13 Aug 13 Sep Okt Nov Dez Jan Feb 14 Mrz Apr Mai Jun Jul 14 Aug 14 Sep Okt Nov Dez Jan Feb 15 Mrz Apr Mai Jun Jul 15 Abbildung 62: Umsatz- und Verordnungsentwicklung von Ledipasvir/Sofosbuvir von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
277 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 257 Abbildung 63: Umsatz- und Verordnungsentwicklung von Rilpivirin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mrz 12 Mai 12 Jul 12 Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15 Abbildung 64: Umsatz- und Verordnungsentwicklung von Simeprevir von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15
278 258 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 65: Umsatz- und Verordnungsentwicklung von Sofosbuvir von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15 Abbildung 66: Umsatz- und Verordnungsentwicklung von Telaprevir von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Okt 11 Jan 12 Apr 12 Jul 12 Okt 12 Jan 13 Apr 13 Jul 13 Okt 13 Jan 14 Apr 14 Jul 14
279 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 259 Krankheiten des Atmungssystems Abbildung 67: Umsatz- und Verordnungsentwicklung von Aclidiniumbromid von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Okt 12 Dez 12 Feb 13 Apr 13 Jun 13 Aug 13 Okt 13 Dez 13 Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15 Abbildung 68: Umsatz- und Verordnungsentwicklung von Fluticasonfuroat von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
280 26 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 69: Umsatz- und Verordnungsentwicklung von Indacaterol Glycopyrronium von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 7: Umsatz- und Verordnungsentwicklung von Olodaterol von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
281 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 261 Abbildung 71: Umsatz- und Verordnungsentwicklung von Pirfenidon von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Abbildung 72: Umsatz- und Verordnungsentwicklung von Umeclidinium Vilanterol von 211 bis 215 bei DAK-Versicherten 6 5 Anzahl DDD Summe Bruttokosten DDD Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
282 262 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Krankheiten des Muskel-Skelett-Systems Abbildung 73: Umsatz- und Verordnungsentwicklung von Belimumab von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug 11 Okt 11 Dez 11 Feb 12 Apr 12 Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Abbildung 74: Umsatz- und Verordnungsentwicklung von Microbieller Collagenase von 211 bis 215 bei DAK-Versicherten 9 8 Summe DDD Summe Bruttokosten DDD Jun 11 Jul 11 Aug 11 Sep 11 Okt 11 Nov 11 Dez 11 Jan 12 Feb 12 Mrz 12 Apr 12 Mai 12 Jun 12 Jul 12
283 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 263 Krankheiten des Nervensystems Abbildung 75: Umsatz- und Verordnungsentwicklung von Dimethylfumarat von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15 Abbildung 76: Umsatz- und Verordnungsentwicklung von Extrakt aus Cannabis Sativa von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun
284 264 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 77: Umsatz- und Verordnungsentwicklung von Fampridin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Abbildung 78: Umsatz- und Verordnungsentwicklung von Fingolimod von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Apr 11 Jun 11 Aug 11 Okt 11 Dez 11 Feb Apr Jun 12 Aug 12 Okt 12 Dez 12 Feb Apr Jun 13 Aug 13 Okt 13 Dez 13 Feb Apr Jun 14 Aug 14 Okt 14 Dez 14 Feb Apr Jun
285 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 265 Abbildung 79: Umsatz- und Verordnungsentwicklung von Perampanel von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 12 Okt 12 Nov 12 Dez 12 Jan 13 Feb 13 Mrz 13 Apr 13 Mai Jun Jul Aug 13 Sep 13 Okt 13 Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai Jun Jul Aug 14 Sep 14 Okt 14 Jan Mrz Abbildung 8: Umsatz- und Verordnungsentwicklung von Retigabin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jun 11 Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt Nov Dez Jan Apr Mai Jul Jun 14
286 266 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 81: Umsatz- und Verordnungsentwicklung von Teriflunomid von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 13 Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul 15
287 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 267 Krankheiten des Urogenitalsystems Abbildung 82: Umsatz- und Verordnungsentwicklung von Belatacept von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug 12 Okt 12 Dez 12 Feb 13 Apr 13 Jun 13 Aug 13 Okt 13 Dez 13 Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15 Abbildung 83: Umsatz- und Verordnungsentwicklung von Mirabegron von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
288 268 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Krankheiten des Verdauuungssystems Abbildung 84: Umsatz- und Verordnungsentwicklung von Linaclotid von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Apr Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt Jan Feb Mrz Apr Mai Jun Abbildung 85: Umsatz- und Verordnungsentwicklung von Teglutid von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
289 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 269 Abbildung 86: Umsatz- und Verordnungsentwicklung von Vedolizumab von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
290 27 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Hämatologie und Onkologie Abbildung 87: Umsatz- und Verordnungsentwicklung von Abirateronacetat von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Abbildung 88: Umsatz- und Verordnungsentwicklung von Afatinib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
291 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 271 Abbildung 89: Umsatz- und Verordnungsentwicklung von Aflibercept (Zaltrap) von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mrz 13 Apr 13 Mai Jun Jul 13 Aug 13 Sep 13 Okt 13 Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai Jun Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai Jun Jul Abbildung 9: Umsatz- und Verordnungsentwicklung von Axitinib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Okt 12 Dez 12 Feb 13 Apr 13 Jun 13 Aug 13 Okt 13 Dez 13 Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15
292 272 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 91: Umsatz- und Verordnungsentwicklung von Bosutinib von 211 bis 215 bei DAK-Versicherten 3 25 Summe DDD Summe Bruttokosten DDD Mai Jun Jul Aug Sep Okt 13 Nov Dez Jan Feb 14 Mrz 14 Apr Mai Jun Jul Aug Sep Okt 14 Nov Dez Jan Feb 15 Mrz 15 Apr Mai Jun Jul Abbildung 92: Umsatz- und Verordnungsentwicklung von Brentuximab Vedotin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
293 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 273 Abbildung 93: Umsatz- und Verordnungsentwicklung von Cabazitaxel von 211 bis 215 bei DAK-Versicherten Summe DDD Summe von Bruttokosten DDD Mai 11 Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Abbildung 94: Umsatz- und Verordnungsentwicklung von Cabozatinib von 211 bis 215 bei DAK-Versicherten 12 1 Summe DDD Summe Bruttokosten DDD Aug 14 Nov 14 Jan 15 Feb 15 Mai 15 Jun 15 Jul 15
294 274 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 95: Umsatz- und Verordnungsentwicklung von Crizotinib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD NovDez Jan Feb Mrz Apr Mai Jun Jul Aug Sep OktNovDez Jan Feb Mrz Apr Mai Jun Jul Aug Sep OktNovDez Jan Feb Mrz Apr Mai Jun Jul Abbildung 96: Umsatz- und Verordnungsentwicklung von Dabrafenib von 211 bis 215 bei DAK-Versicherten DDD Summe DDD Summe Bruttokosten Sep 13 Okt 13 Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
295 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 275 Abbildung 97: Umsatz- und Verordnungsentwicklung von Decitabin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD NovDez Jan Feb Mrz Apr Mai Jun Jul Aug Sep OktNovDez Jan Feb Mrz Apr Mai Jun Jul Aug Sep OktNovDez Jan Feb Mrz Apr Mai Jun Jul Abbildung 98: Umsatz- und Verordnungsentwicklung von Enzalutamid von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul
296 276 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 99: Umsatz- und Verordnungsentwicklung von Eribulin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Feb Jun 1 11 Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Aug Okt Dez Feb Apr Jun Abbildung 1: Umsatz- und Verordnungsentwicklung von Ibrutinib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
297 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 277 Abbildung 11: Umsatz- und Verordnungsentwicklung von Idealisib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 12: Umsatz- und Verordnungsentwicklung von Ipilimumab von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai Jul Sep Nov Jan Mrz Mai
298 278 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 13: Umsatz- und Verordnungsentwicklung von Nintedanib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 14: Umsatz- und Verordnungsentwicklung von Obinutuzumab von 211 bis 215 bei DAK-Versicherten 25 2 Summe DDD Summe Bruttokosten DDD Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
299 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 279 Abbildung 15: Umsatz- und Verordnungsentwicklung von Pertuzumab von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mrz 13 Apr 13 Mai Jun Jul 13 Aug 13 Sep 13 Okt 13 Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai Jun Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai Jun Jul Abbildung 16: Umsatz- und Verordnungsentwicklung von Pixantron von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15
300 28 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 17: Umsatz- und Verordnungsentwicklung von Pomalidomid von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul 15 Abbildung 18: Umsatz- und Verordnungsentwicklung von Ponatinib von 211 bis 215 bei DAK-Versicherten 35 3 Summe DDD Summe Bruttokosten DDD Aug 13 Sep 13 Okt 13 Nov 13 Dez 13 Feb 14 Mrz 14 Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Jun 15 Jul 15
301 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 281 Abbildung 19: Umsatz- und Verordnungsentwicklung von Radium 223- dichlorid von 211 bis 215 bei DAK-Versicherten 8 7 Summe DDD Summe Bruttokosten DDD Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Abbildung 11: Umsatz- und Verordnungsentwicklung von Regorafenib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 13 Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul 14 Aug 14 Sep 14 Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul 15
302 282 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 111: Umsatz- und Verordnungsentwicklung von Ruxolitinib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15 Abbildung 112: Umsatz- und Verordnungsentwicklung von Sipuleucel-T von 211 bis 215 bei DAK-Versicherten 3 25 Summe DDD Summe Bruttokosten DDD Feb 15 Mrz 15
303 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 283 Abbildung 113: Umsatz- und Verordnungsentwicklung von Tegafur/Gimeracil/Oeracil von 211 bis 215 bei DAK-Versicherten 35 3 Summe DDD Summe Bruttokosten DDD Aug Sep Okt NovDez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt NovDez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt NovDez Jan Feb Mrz Apr Abbildung 114: Umsatz- und Verordnungsentwicklung von Trastuzumab Emtansin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
304 284 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 115: Umsatz- und Verordnungsentwicklung von Vandetanib von 211 bis 215 bei DAK-Versicherten 6 5 Summe DDD Summe Bruttokosten DDD Mrz 12 Mai 12 Jul 12 Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15 Abbildung 116: Umsatz- und Verordnungsentwicklung von Vemurafenib von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mrz 12 Mai 12 Jul 12 Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
305 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 285 Abbildung 117: Umsatz- und Verordnungsentwicklung von Vismodegib von 211 bis 215 bei DAK-Versicherten 7 6 Summe DDD Summe Bruttokosten DDD Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mai Jun Jul 15
306 286 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Psychische Erkrankungen Abbildung 118: Umsatz- und Verordnungsentwicklung von Lisdexamfetamindimesilat von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mrz 13 Mai Jun Jul Aug 13 Sep 13 Okt 13 Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr 14 Mai Jun Jul Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai Jun Jul Abbildung 119: Umsatz- und Verordnungsentwicklung von Nalmefen von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
307 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 287 Sonstige Erkrankungen Abbildung 12: Umsatz- und Verordnungsentwicklung von Colestilan von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Apr 13 Mai Jun Jul Aug 13 Sep 13 Okt 13 Nov Dez Jan Feb 14 Mrz 14 Apr 14 Mai Jun Jul Aug 14 Sep 14 Okt 14 Nov Dez Jan Feb 15 Mrz 15 Apr 15 Mai Jun Abbildung 121: Umsatz- und Verordnungsentwicklung von Lebende Larven von Lucilia sericata von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15
308 288 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 122: Umsatz- und Verordnungsentwicklung von Propanolol von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 123: Umsatz- und Verordnungsentwicklung von Regadenoson von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mrz Jun Jul Aug 12 Sep 12 Okt 12 Nov 12 Dez 12 Jan 13 Feb 13 Mrz 13 Apr 13 Mai 13 Jun 13 Sep 13 Okt 13 Nov 13 Dez 13 Jan 14 Feb 14 Mrz 14 Apr Jun Jul Nov 14 Feb 15 Mrz 15 Apr Mai 15 15
309 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 289 Abbildung 124: Umsatz- und Verordnungsentwicklung von Sucroferric Osxhydroxide von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 125: Umsatz- und Verordnungsentwicklung von Tafamidis Meglumin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mai 12 Aug 12 Nov 12 Mrz 13 Jun 13 Aug 13 Okt 13 Dez 13 Feb 14 Apr 14 Jun 14 Aug 14 Okt 14 Dez 14 Feb 15 Apr 15 Jun 15
310 29 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Stoffwechselkrankheiten Abbildung 126: Umsatz- und Verordnungsentwicklung von Albiglutid von 211 bis 215 bei DAK-Versicherten 12 1 Summe DDD DDD Mrz. 15 Apr. 15 Mai. 15 Jun. 15 Jul. 15 Abbildung 127: Umsatz- und Verordnungsentwicklung von Canagliflozin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Feb 14 Mrz 14 Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14
311 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 291 Abbildung 128: Umsatz- und Verordnungsentwicklung von Canagliflozin/Metformin von 211 bis 215 bei DAK-Versicherten 25 9 Summe DDD Summe Bruttokosten DDD Aug 14 Okt 14 Nov 14 Dez 14 Abbildung 129: Umsatz- und Verordnungsentwicklung von Dapagliflozin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
312 292 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 13: Umsatz- und Verordnungsentwicklung von Dapagliflozin/MEtformin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15 Abbildung 131: Umsatz- und Verordnungsentwicklung von Elosulfase alfa von 211 bis 215 bei DAK-Versicherten 4 35 Summe DDD Summe Bruttokosten DDD Sep 14 Okt 14 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15
313 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 293 Abbildung 132: Umsatz- und Verordnungsentwicklung von Empagliflozin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15 Abbildung 133: Umsatz- und Verordnungsentwicklung von Insulin degludec von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Apr 14 Mai 14 Jun 14 Jul 14 Aug 14 Sep 14 Okt 14 Nov 14 Dez 14 Jan 15 Feb 15 Mrz 15 Apr 15 Mai 15 Jun 15 Jul 15
314 294 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 134: Umsatz- und Verordnungsentwicklung von Ivacaftor von 211 bis 215 bei DAK-Versicherten 7 6 Summe DDD Summe Bruttokosten DDD Sep 12 Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15 Abbildung 135: Umsatz- und Verordnungsentwicklung von Lixisenatid von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14
315 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 295 Abbildung 136: Umsatz- und Verordnungsentwicklung von Pasireotid von 211 bis 215 bei DAK-Versicherten 35 3 Summe DDD Summe Bruttokosten DDD Jul 12 Okt 12 Jan 13 Apr 13 Jul 13 Okt 13 Jan 14 Apr 14 Jul 14 Okt 14 Jan 15 Apr 15 Jul 15 Abbildung 137: Umsatz- und Verordnungsentwicklung von Pitavastatin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten 25 2 DDD Sep 11 Okt 11 Nov 11 Dez 11 Jan 12
316 296 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 138: Umsatz- und Verordnungsentwicklung von Saxagliptin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Dez 9 Mrz 1 Jun 1 Sep 1 Dez 1 Mrz 11 Jun 11 Sep 11 Dez 11 Mrz 12 Jun 12 Sep 12 Dez 12 Mrz 13 Jun 13 Sep 13 Dez 13 Mrz 14 Jun 14 Sep 14 Dez 14 Mrz 15 Jun 15 Abbildung 139: Umsatz- und Verordnungsentwicklung von Saxagliptin/Metformin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Nov 12 Jan 13 Mrz 13 Mai 13 Jul 13 Sep 13 Nov 13 Jan 14 Mrz 14 Mai 14 Jul 14 Sep 14 Nov 14 Jan 15 Mrz 15 Mai 15 Jul 15
317 III Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene 297 Abbildung 14: Umsatz- und Verordnungsentwicklung von Sitagliptin von 211 bis 215 bei DAK-Versicherten Anzahl DDD Summe Bruttokosten DDD Okt 9 Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai Abbildung 141: Umsatz- und Verordnungsentwicklung von Sitagliptin/Metformin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Nov Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai Aug Nov Feb Mai
318 298 Bewertungsergebnisse und Umsatzentwicklungen auf Wirkstoffebene III Abbildung 142: Umsatz- und Verordnungsentwicklung von Vildagliptin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun Abbildung 143: Umsatz- und Verordnungsentwicklung von Vildagliptin/Metformin von 211 bis 215 bei DAK-Versicherten Summe DDD Summe Bruttokosten DDD Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun Sep Dez Mrz Jun
319 299 Anhang Anhang I Abbildung 144: Eigene Befragung der Kassenärztlichen Vereinigungen zur wirtschaftlichen Verordnungsweise neuer Arzneimittel
320 3 Anhang Anhang II Abbildung 145: Eigene Befragung niedergelassener Ärzte zur wirtschaftlichen Verordnungsweise neuer Arzneimittel Abbildung 146: KV-Verteilung der Ärzte-Stichprobe (Quelle Referenzdaten: load/downloads/pdf-ordner/statistik214/stat14abb- Tab.pdf) 25 2 % Stichprobe Grundgesamtheit
1. Rechtsgrundlage. 2. Eckpunkte der Entscheidung
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung (VerfO):Änderung im 5.Kapitel Anpassung der Regelungen zur frühen Nutzenbewertung an Gesetzesänderungen
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Verfahrensordnung (VerfO):Änderung im 5.Kapitel Anpassung der Regelungen zur frühen Nutzenbewertung an Gesetzesänderungen
Themen. Insulinanaloga - Fragen und Antworten
 Themen Insulinanaloga - Fragen und Antworten Was sind Insulinanaloga? Als Humaninsulin wird die synthetische Nachbildung des körpereigenen, natürlichen Hormons Insulin bezeichnet. Insulinanaloga sind Abwandlungen
Themen Insulinanaloga - Fragen und Antworten Was sind Insulinanaloga? Als Humaninsulin wird die synthetische Nachbildung des körpereigenen, natürlichen Hormons Insulin bezeichnet. Insulinanaloga sind Abwandlungen
Eingangsformel. 1 Geltungsbereich. 2 Begriffsbestimmungen. AM-NutzenV. Ausfertigungsdatum: 28.12.2010. Vollzitat:
 Verordnung über die Nutzenbewertung von Arzneimitteln nach 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach 130b SGB V (Arzneimittel-Nutzenbewertungsverordnung - AM- NutzenV) AM-NutzenV Ausfertigungsdatum:
Verordnung über die Nutzenbewertung von Arzneimitteln nach 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach 130b SGB V (Arzneimittel-Nutzenbewertungsverordnung - AM- NutzenV) AM-NutzenV Ausfertigungsdatum:
Gesundheitspolitik unter AMNOG-Bedingungen - Chance oder Hürde für Arzneimittelinnovationen?
 Gesundheitspolitik unter AMNOG-Bedingungen - Chance oder Hürde für Arzneimittelinnovationen? ZIM-Netzwerktreffen, 21. April 2015 Anja Fließgarten Strategische Gesundheitspolitik, Bereich Marktzugang Agenda
Gesundheitspolitik unter AMNOG-Bedingungen - Chance oder Hürde für Arzneimittelinnovationen? ZIM-Netzwerktreffen, 21. April 2015 Anja Fließgarten Strategische Gesundheitspolitik, Bereich Marktzugang Agenda
Evaluationskonzepte bei neuen Methoden. Analyse und Konsequenz des GKV.SV
 Evaluationskonzepte bei neuen Methoden Analyse und Konsequenz des GKV.SV Dr. Diedrich Bühler Dr. Diedrich Bühler Überblick I) Situation und Position des GKV SV II) Methodenbewertung, Selbstverwaltung /
Evaluationskonzepte bei neuen Methoden Analyse und Konsequenz des GKV.SV Dr. Diedrich Bühler Dr. Diedrich Bühler Überblick I) Situation und Position des GKV SV II) Methodenbewertung, Selbstverwaltung /
Vergleich 130a SGV V alt vs neu
 In der folgenden Gegenüberstellung finden Sie in der linken Spalte den alten Text des 130a SGB V und in der rechten Spalte den neuen Text des 130a SGB V, der ab dem 1.8.2010 in Kraft tritt. Die Änderungen
In der folgenden Gegenüberstellung finden Sie in der linken Spalte den alten Text des 130a SGB V und in der rechten Spalte den neuen Text des 130a SGB V, der ab dem 1.8.2010 in Kraft tritt. Die Änderungen
Chancen und Risiken bei der Verordnung innovativer Arzneimittel - eine rechtliche Einordnung Denis Hübner Rechtsanwalt Fachanwalt für Medizinrecht
 RECHTSANWÄLTE / FACHANWÄLTE Theaterstraße 7, Hannover www.hoppe-medizinrecht.de www.anwalt-wirtschaftlichkeitspruefung.de Chancen und Risiken bei der Verordnung innovativer Arzneimittel - eine rechtliche
RECHTSANWÄLTE / FACHANWÄLTE Theaterstraße 7, Hannover www.hoppe-medizinrecht.de www.anwalt-wirtschaftlichkeitspruefung.de Chancen und Risiken bei der Verordnung innovativer Arzneimittel - eine rechtliche
AMNOG und die Folgen. PharmaDays 08.07.2011 Peter von Czettritz, Preu Bohlig & Partner
 PharmaDays 08.07.2011 Peter von Czettritz, Preu Bohlig & Partner I. Substitution gemäß 129 Abs. 1 Satz 2 SGB V 1. Erweiterung der Substitutionsvoraussetzungen a) ein gleiches Anwendungsgebiet b) identische
PharmaDays 08.07.2011 Peter von Czettritz, Preu Bohlig & Partner I. Substitution gemäß 129 Abs. 1 Satz 2 SGB V 1. Erweiterung der Substitutionsvoraussetzungen a) ein gleiches Anwendungsgebiet b) identische
Versorgung, Diffusion & Finanzierung intelligent optimieren: Das AMNOG zum Erfolgsmodell machen
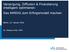 Versorgung, Diffusion & Finanzierung intelligent optimieren: Das AMNOG zum Erfolgsmodell machen Berlin, 15. Januar 2016 Dr. Markus Frick, MPH Arzneimittelausgaben: Keine Explosion BILD vom 05.01.2016,
Versorgung, Diffusion & Finanzierung intelligent optimieren: Das AMNOG zum Erfolgsmodell machen Berlin, 15. Januar 2016 Dr. Markus Frick, MPH Arzneimittelausgaben: Keine Explosion BILD vom 05.01.2016,
Marktentwicklung: Umsatz-, Mengen- und Strukturentwicklung bei Fertigarzneimitteln
 Faktenblatt Thema: Arzneimittelmarkt Ausgaben Arzneimittel (Quelle: Amtliche Statistik KV 45) 2014: 33,3 Mrd. Euro 2013: 30,4 Mrd. Euro 2012: 29,6 Mrd. Euro 2011: 29,2 Mrd. Euro Ausgaben für Arzneimittel
Faktenblatt Thema: Arzneimittelmarkt Ausgaben Arzneimittel (Quelle: Amtliche Statistik KV 45) 2014: 33,3 Mrd. Euro 2013: 30,4 Mrd. Euro 2012: 29,6 Mrd. Euro 2011: 29,2 Mrd. Euro Ausgaben für Arzneimittel
Preise für innovative Arzneimittel Kommt das System an seine Grenzen?
 AOK-Forum live Potsdam, 28. April 2015 Preise für innovative Arzneimittel Kommt das System an seine Grenzen? Wolf-Dieter Ludwig Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); HELIOS Klinikum
AOK-Forum live Potsdam, 28. April 2015 Preise für innovative Arzneimittel Kommt das System an seine Grenzen? Wolf-Dieter Ludwig Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ); HELIOS Klinikum
2. Anzahl der Patienten bzw. Abgrenzung der für die Behandlung infrage kommenden Patientengruppen
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Düsseldorfer Rechtswissenschaftliche Schriften 105
 Düsseldorfer Rechtswissenschaftliche Schriften 105 Jens Nimis Der Anspruch des Patienten auf neue Untersuchungs- und Behandlungsmethoden in der gesetzlichen Krankenversicherung Nomos Düsseldorfer Rechtswissenschaftliche
Düsseldorfer Rechtswissenschaftliche Schriften 105 Jens Nimis Der Anspruch des Patienten auf neue Untersuchungs- und Behandlungsmethoden in der gesetzlichen Krankenversicherung Nomos Düsseldorfer Rechtswissenschaftliche
.04.201. Diese Erläuterungen beziehen sich auf die Vorschläge des Vorstandes des GKV-Spitzenverbandes zur Festbetragsfestsetzung vom 22.02.2013.
 01.03.2013 Arzneimittel-Festbeträge: en zum Stellungnahmeverfahren vom 04.0.03.201.2013 bis 02.0.04.201.2013 Diese en beziehen sich auf die Vorschläge des Vorstandes des GKV-Spitzenverbandes zur Festbetragsfestsetzung
01.03.2013 Arzneimittel-Festbeträge: en zum Stellungnahmeverfahren vom 04.0.03.201.2013 bis 02.0.04.201.2013 Diese en beziehen sich auf die Vorschläge des Vorstandes des GKV-Spitzenverbandes zur Festbetragsfestsetzung
e) Kostenbeteiligung
 e) Kostenbeteiligung aa) Zuzahlungspflichten des Versicherten Z.B. Stationäre Krankenhausbehandlung, 39 Abs. 4 SGB V: Versicherte, die das achtzehnte Lebensjahr vollendet haben, zahlen vom Beginn der vollstationären
e) Kostenbeteiligung aa) Zuzahlungspflichten des Versicherten Z.B. Stationäre Krankenhausbehandlung, 39 Abs. 4 SGB V: Versicherte, die das achtzehnte Lebensjahr vollendet haben, zahlen vom Beginn der vollstationären
Reinhard Busse, Prof. Dr. med. MPH
 Reinhard Busse, Prof. Dr. med. MPH FG Management im Gesundheitswesen, Technische Universität Berlin (WHO Collaborating Centre for Health Systems Research and Management) & European Observatory on Health
Reinhard Busse, Prof. Dr. med. MPH FG Management im Gesundheitswesen, Technische Universität Berlin (WHO Collaborating Centre for Health Systems Research and Management) & European Observatory on Health
BAnz AT 25.04.2014 B4. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Glossar zum Gesetz zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung Arzneimittelmarktneuordnungsgesetz AMNOG
 Stand: 20. Dezember 2010 Glossar zum Gesetz zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung Arzneimittelmarktneuordnungsgesetz AMNOG Seite 1/30 Inhaltsverzeichnis Begriffe
Stand: 20. Dezember 2010 Glossar zum Gesetz zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung Arzneimittelmarktneuordnungsgesetz AMNOG Seite 1/30 Inhaltsverzeichnis Begriffe
Bedeutung der frühen Nutzenbewertung für die Preisverhandlungen nach 130b SGB V
 Bedeutung der frühen Nutzenbewertung für die Preisverhandlungen nach 130b SGB V Dr. iur. Susanne Götting LL.M. 15. DGRA Jahreskongress Bonn, 20.06. 1 AGENDA o o o o o o Die Kriterien zur Verhandlung des
Bedeutung der frühen Nutzenbewertung für die Preisverhandlungen nach 130b SGB V Dr. iur. Susanne Götting LL.M. 15. DGRA Jahreskongress Bonn, 20.06. 1 AGENDA o o o o o o Die Kriterien zur Verhandlung des
Arzneimittel Rezeptprüfung, Beratung und Regress
 Arzneimittel Rezeptprüfung, Beratung und Regress Ergänzbares Handbuch für Krankenkassen, Ärzte, Apotheker und Arzneimittelhersteller Von Dr. Werner Gerdelmann Diplom-Kaufmann Birger Rostalski Apotheker
Arzneimittel Rezeptprüfung, Beratung und Regress Ergänzbares Handbuch für Krankenkassen, Ärzte, Apotheker und Arzneimittelhersteller Von Dr. Werner Gerdelmann Diplom-Kaufmann Birger Rostalski Apotheker
Pressekonferenz Arzneimittel-Atlas 2014. Balance zwischen Kostendämpfung und Versorgungsqualität ist gestört!
 Pressekonferenz Arzneimittel-Atlas 2014 16. September 2014 Berlin Balance zwischen Kostendämpfung und Versorgungsqualität ist gestört! Statement von: Birgit Fischer Hauptgeschäftsführerin des vfa Es gilt
Pressekonferenz Arzneimittel-Atlas 2014 16. September 2014 Berlin Balance zwischen Kostendämpfung und Versorgungsqualität ist gestört! Statement von: Birgit Fischer Hauptgeschäftsführerin des vfa Es gilt
BAnz AT 20.11.2014 B3. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
IIT / AWB / NIS. Investigator Initiated Trials. Investigator Initiated Trials (IIT) 11.11.2015. IIT = Investigator Initiated Trials
 IIT / AWB / NIS IIT = Investigator Initiated Trials AWB = Anwendungsbeobachtungen NIS = Nicht-interventionelle Studien Medical-Advisor-IIT-AWB-NIS 11.11.2015 Healthcare Marketing Dr. Umbach & Partner www.umbachpartner.com
IIT / AWB / NIS IIT = Investigator Initiated Trials AWB = Anwendungsbeobachtungen NIS = Nicht-interventionelle Studien Medical-Advisor-IIT-AWB-NIS 11.11.2015 Healthcare Marketing Dr. Umbach & Partner www.umbachpartner.com
XI. Innovationskongress der Deutschen Hochschulmedizin 2015
 XI. Innovationskongress der Deutschen Hochschulmedizin 2015 Schnelle Nutzenbewertung für Hochrisiko- Medizinprodukte: kommen jetzt die Innovationszentren? Berlin, 02.10.2015 Dr. Gabriela Soskuty Medizinprodukte
XI. Innovationskongress der Deutschen Hochschulmedizin 2015 Schnelle Nutzenbewertung für Hochrisiko- Medizinprodukte: kommen jetzt die Innovationszentren? Berlin, 02.10.2015 Dr. Gabriela Soskuty Medizinprodukte
Häufig gestellte Fragen zu Rabattverträgen
 Häufig gestellte Fragen zu Rabattverträgen Teil I (zu den Verträgen selbst) Was sind Rabattverträge? Es handelt sich um Verträge, die zwischen Krankenkassen und pharmazeutischen Herstellern geschlossen
Häufig gestellte Fragen zu Rabattverträgen Teil I (zu den Verträgen selbst) Was sind Rabattverträge? Es handelt sich um Verträge, die zwischen Krankenkassen und pharmazeutischen Herstellern geschlossen
Weitere Beiträge finden Sie zu den Themen: Lebenszyklus eines Produktes, Apothekenabverkaufsdaten
 Liebe Leser, liebe Leserinnen, mit dem AMNOG wird es zu einer grundlegenden Neuordnung im Arzneimittelmarkt kommen. Frühbewertung und Nutzen-Dossier spielen dabei eine entscheidende Rolle. Die Anforderungen
Liebe Leser, liebe Leserinnen, mit dem AMNOG wird es zu einer grundlegenden Neuordnung im Arzneimittelmarkt kommen. Frühbewertung und Nutzen-Dossier spielen dabei eine entscheidende Rolle. Die Anforderungen
Die regulatorischen Strukturen in der Steuerung der Arzneimittelversorgung
 Die regulatorischen Strukturen in der Steuerung der Arzneimittelversorgung Vortrag bei dem Symposium der Deutschen Gesellschaft für Kassenarztrecht am 30. März 2006 in Berlin zu dem Thema Arzneimittelsteuerung
Die regulatorischen Strukturen in der Steuerung der Arzneimittelversorgung Vortrag bei dem Symposium der Deutschen Gesellschaft für Kassenarztrecht am 30. März 2006 in Berlin zu dem Thema Arzneimittelsteuerung
S D M K D M KV G ONKOLOGIE C üsseldorf D
 MDS MDK GKV ONKOLOGIE C Düsseldorf München 19. September 2007 Leistungsumfang der GKV bei Behandlungen unter Teilnahme an klinischen Studien - Prüfung durch den MDK Prof. Dr. Axel Heyll Leiter des Kompetenz
MDS MDK GKV ONKOLOGIE C Düsseldorf München 19. September 2007 Leistungsumfang der GKV bei Behandlungen unter Teilnahme an klinischen Studien - Prüfung durch den MDK Prof. Dr. Axel Heyll Leiter des Kompetenz
ARZNEIMITTEL. Ausgabe 2/12, 15. Jahrgang
 ARZNEIMITTEL Ringen um 34 den fairen Preis In Deutschland verhandeln Krankenkassen und Pharmahersteller erstmals über die Preise von neu zugelassenen Medikamenten. Die Vergütung darf nur dann über dem
ARZNEIMITTEL Ringen um 34 den fairen Preis In Deutschland verhandeln Krankenkassen und Pharmahersteller erstmals über die Preise von neu zugelassenen Medikamenten. Die Vergütung darf nur dann über dem
Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode
 Informationsblatt Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode (Bezug zu 2. Kapitel der Verfahrensordnung des G-BA (VerfO), Anlage II,
Informationsblatt Verfahrenstechnische und methodische Anforderungen an die Bewertung einer Untersuchungs- u. Behandlungsmethode (Bezug zu 2. Kapitel der Verfahrensordnung des G-BA (VerfO), Anlage II,
Marion Caspers-Merk: Weg frei für das Gesetz zur Verbesserung der Wirtschaftlichkeit in der Arzneimittelversorgung
 Pressemitteilung HAUSANSCHRIFT POSTANSCHRIFT INTERNET Wilhelmstraße 49, 10117 Berlin 11055 Berlin TEL +49 (0)1888 441-2225 FAX +49 (0)1888 441-1245 www.bmg.bund.de pressestelle@bmg.bund.de E-MAIL Berlin,
Pressemitteilung HAUSANSCHRIFT POSTANSCHRIFT INTERNET Wilhelmstraße 49, 10117 Berlin 11055 Berlin TEL +49 (0)1888 441-2225 FAX +49 (0)1888 441-1245 www.bmg.bund.de pressestelle@bmg.bund.de E-MAIL Berlin,
Sjögren- Betroffene Fragen - Experten Antworten. Die OTC- Liste. (Im Internet einzusehen unter: : www.g-ba.de)
 Sjögren- Betroffene Fragen - Experten Antworten Die OTC- Liste (Im Internet einzusehen unter: : www.g-ba.de) Allgemeine Informationen zur OTC- Liste Die Abkürzung OTC kommt aus dem Englischen und bedeutet:
Sjögren- Betroffene Fragen - Experten Antworten Die OTC- Liste (Im Internet einzusehen unter: : www.g-ba.de) Allgemeine Informationen zur OTC- Liste Die Abkürzung OTC kommt aus dem Englischen und bedeutet:
Tragende Gründe. Therapiehinweis zu Sitagliptin. vom 18. Oktober 2007. Inhaltsverzeichnis. 1. Rechtsgrundlagen 2. 2. Eckpunkte der Entscheidung 2
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Sitagliptin vom 18.
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses zur Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie in Anlage 4: Therapiehinweis zu Sitagliptin vom 18.
Leitfaden zur Definition des Generikaabschlages nach 130a Abs. 3b SGB V
 Leitfaden zur Definition des Generikaabschlages nach 130a Abs. 3b SGB V Anknüpfend an die im Bundesgesundheitsministerium getroffenen Absprachen zur Anwendung des Generikaabschlages vom 6. März 2006 haben
Leitfaden zur Definition des Generikaabschlages nach 130a Abs. 3b SGB V Anknüpfend an die im Bundesgesundheitsministerium getroffenen Absprachen zur Anwendung des Generikaabschlages vom 6. März 2006 haben
RUNDSCHREIBEN D3 14/2010
 An die Kassenärztlichen Vereinigungen Vorsitzender des Vorstandes der Kassenärztlichen Bundesvereinigung Dr. Andreas Köhler Herbert-Lewin-Platz 2 10623 Berlin Vorsitzenden und Mitglieder der Beratenden
An die Kassenärztlichen Vereinigungen Vorsitzender des Vorstandes der Kassenärztlichen Bundesvereinigung Dr. Andreas Köhler Herbert-Lewin-Platz 2 10623 Berlin Vorsitzenden und Mitglieder der Beratenden
Start des Pharmadialogs der Bundesregierung: Bilanz der Auswirkung des GKV- Modernisierungsgesetzes auf die Arzneimittelversorgung
 Start des Pharmadialogs der Bundesregierung: Bilanz der Auswirkung des GKV- Modernisierungsgesetzes auf die Arzneimittelversorgung Das Bundesministerium für Gesundheit und Soziale Sicherung hat heute Vertreter
Start des Pharmadialogs der Bundesregierung: Bilanz der Auswirkung des GKV- Modernisierungsgesetzes auf die Arzneimittelversorgung Das Bundesministerium für Gesundheit und Soziale Sicherung hat heute Vertreter
Die Einführung der Kosten-Nutzenbewertung in Deutschland
 Die Einführung der Kosten-Nutzenbewertung in Deutschland Vortrag im Rahmen des internationalen Workshops des VFA zur Methodik der Kosten-Nutzenbewertung Referent: Dr. jur. Rainer Hess, G-BA Kosten-Nutzenbewertungen
Die Einführung der Kosten-Nutzenbewertung in Deutschland Vortrag im Rahmen des internationalen Workshops des VFA zur Methodik der Kosten-Nutzenbewertung Referent: Dr. jur. Rainer Hess, G-BA Kosten-Nutzenbewertungen
Neue Entwicklungen im Arzneimittelbereich. Kosten-Nutzenbewertung Höchstbetrag Individualverträge
 Neue Entwicklungen im Arzneimittelbereich Kosten-Nutzenbewertung Höchstbetrag Individualverträge 42.Tagung der deutsch-österreichischen Kommission: Fragen der sozialen Krankenversicherung Villach, 8./9.10.2009
Neue Entwicklungen im Arzneimittelbereich Kosten-Nutzenbewertung Höchstbetrag Individualverträge 42.Tagung der deutsch-österreichischen Kommission: Fragen der sozialen Krankenversicherung Villach, 8./9.10.2009
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Vortioxetin wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Verhaltensempfehlungen für die Zusammenarbeit der pharmazeutischen Industrie mit Ärzten
 Verhaltensempfehlungen für die Zusammenarbeit der pharmazeutischen Industrie mit Ärzten herausgegeben vom Bundesverband der Arzneimittel-Hersteller e.v. (BAH) Bundesverband der Pharmazeutischen Industrie
Verhaltensempfehlungen für die Zusammenarbeit der pharmazeutischen Industrie mit Ärzten herausgegeben vom Bundesverband der Arzneimittel-Hersteller e.v. (BAH) Bundesverband der Pharmazeutischen Industrie
Kundenmanagement im Krankenhaus
 Kundenmanagement im Krankenhaus Volker Nürnberg Barbara Schneider Kundenmanagement im Krankenhaus Service Qualität Erreichbarkeit Volker Nürnberg Hochschule für angewandtes Management Erding Deutschland
Kundenmanagement im Krankenhaus Volker Nürnberg Barbara Schneider Kundenmanagement im Krankenhaus Service Qualität Erreichbarkeit Volker Nürnberg Hochschule für angewandtes Management Erding Deutschland
Bestellen Sie unsere vierteljährlich erscheinenden, aktuellen EEP-Nachrichten aus dem Medizinrecht beim Referenten oder unter www.eep-law.
 Bestellen Sie unsere vierteljährlich erscheinenden, aktuellen EEP-Nachrichten aus dem Medizinrecht beim Referenten oder unter www.eep-law.de Widenmayerstr. 29 D-80538 München Germany Telefon: +49(0)89-210969-0
Bestellen Sie unsere vierteljährlich erscheinenden, aktuellen EEP-Nachrichten aus dem Medizinrecht beim Referenten oder unter www.eep-law.de Widenmayerstr. 29 D-80538 München Germany Telefon: +49(0)89-210969-0
Musterantrag zur Feststellung der besonderen Schwere und Langfristigkeit einer Behinderung
 Musterantrag zur Feststellung der besonderen Schwere und Langfristigkeit einer Behinderung I. Vorbemerkung Bereits seit dem 01.07.2011 haben gesetzlich krankenversicherte Menschen mit schweren und langfristigen
Musterantrag zur Feststellung der besonderen Schwere und Langfristigkeit einer Behinderung I. Vorbemerkung Bereits seit dem 01.07.2011 haben gesetzlich krankenversicherte Menschen mit schweren und langfristigen
Management im Gesundheitswesen Industrie. Preisbildung. Reinhard Busse, Prof. Dr. med. MPH FFPH
 Management im Gesundheitswesen Industrie Preisbildung Reinhard Busse, Prof. Dr. med. MPH FFPH FG Management im Gesundheitswesen, Technische Universität Berlin (WHO Collaborating Centre for Health Systems
Management im Gesundheitswesen Industrie Preisbildung Reinhard Busse, Prof. Dr. med. MPH FFPH FG Management im Gesundheitswesen, Technische Universität Berlin (WHO Collaborating Centre for Health Systems
Teil I Ordnungspolitik... 7 1 Wissenschaftliche Beratung der Gesundheitspolitik: Ansatzpunkte, Erfolge und Misserfolge eine Bestandsaufnahme
 Vorwort Herbert Rebscher als Mensch und Unternehmer.... IX Einführung der Herausgeber... XI Ein kleines ABC der Sozialpolitik (Blüm)... 1 Teil I Ordnungspolitik... 7 1 Wissenschaftliche Beratung der Gesundheitspolitik:
Vorwort Herbert Rebscher als Mensch und Unternehmer.... IX Einführung der Herausgeber... XI Ein kleines ABC der Sozialpolitik (Blüm)... 1 Teil I Ordnungspolitik... 7 1 Wissenschaftliche Beratung der Gesundheitspolitik:
Die Distribution von Medikamenten im Rahmen des Arzneimittelmarktes
 Die Distribution von Medikamenten im Rahmen des Arzneimittelmarktes Referat im Rahmen des Kongresses des Bundesverbands Deutscher Versandapotheken (BVDVA) Arzneimittelversandhandel 2015: Strukturiert,
Die Distribution von Medikamenten im Rahmen des Arzneimittelmarktes Referat im Rahmen des Kongresses des Bundesverbands Deutscher Versandapotheken (BVDVA) Arzneimittelversandhandel 2015: Strukturiert,
BAnz AT 04.04.2014 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Nutzenbewertung von Medizinprodukten: Experten fordern eine kritische Hinterfragung der Kriterien und Maßnahmen
 Nutzenbewertung von Medizinprodukten: Experten fordern eine kritische Hinterfragung der Kriterien und Maßnahmen Der Wert eines Medizinproduktes soll sich am Nutzen für den Patienten orientieren. Maßgebend
Nutzenbewertung von Medizinprodukten: Experten fordern eine kritische Hinterfragung der Kriterien und Maßnahmen Der Wert eines Medizinproduktes soll sich am Nutzen für den Patienten orientieren. Maßgebend
Eine Initiative der Kassenärztlichen Bundesvereinigung zur Einführung von patientenrelevanten Innovationen in die vertragsärztliche Versorgung
 Eine Initiative der Kassenärztlichen Bundesvereinigung zur Einführung von patientenrelevanten Innovationen in die vertragsärztliche Versorgung Innovationsservice IMPRESSUM Herausgeber: Kassenärztliche
Eine Initiative der Kassenärztlichen Bundesvereinigung zur Einführung von patientenrelevanten Innovationen in die vertragsärztliche Versorgung Innovationsservice IMPRESSUM Herausgeber: Kassenärztliche
Was ist für den Anwender interessant und wie kommen Produkte auf den Markt?
 Was ist für den Anwender interessant und wie kommen Produkte auf den Markt? 3. Workshop Neue Horizonte für metallische Biomaterialien http://medalt.h-e-s.de/image/image_gallery?img_id=30298747 http://www.ifam-dd.fraunhofer.de/de/zellulare_metallische_werkstoffe/offenzellige_metallschaeume/technologie/biomaterialien/werkstoffe/_jcr_content/stage/image.img.jpg/1317812850007.jpg
Was ist für den Anwender interessant und wie kommen Produkte auf den Markt? 3. Workshop Neue Horizonte für metallische Biomaterialien http://medalt.h-e-s.de/image/image_gallery?img_id=30298747 http://www.ifam-dd.fraunhofer.de/de/zellulare_metallische_werkstoffe/offenzellige_metallschaeume/technologie/biomaterialien/werkstoffe/_jcr_content/stage/image.img.jpg/1317812850007.jpg
Beschluss. I. Die Anlage XII wird in alphabetischer Reihenfolge um den Wirkstoff Apixaban wie folgt ergänzt:
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Orphan Drugs: Marktentwicklung und Budget Impact bis 2020
 Gesundheit Mobilität Bildung Orphan Drugs: Marktentwicklung und Budget Impact bis 2020 Bertram Häussler, IGES Institut 10. IGES Innovationskongress: Seltene Helden? Orphan Drugs und seltene Erkrankungen
Gesundheit Mobilität Bildung Orphan Drugs: Marktentwicklung und Budget Impact bis 2020 Bertram Häussler, IGES Institut 10. IGES Innovationskongress: Seltene Helden? Orphan Drugs und seltene Erkrankungen
Der überproportionale Finanzierungsbeitrag privat versicherter Patienten im Jahr 2006
 Der überproportionale Finanzierungsbeitrag privat versicherter Patienten im Jahr 26 Dr. Frank Niehaus WIP-Diskussionspapier 9/7 Bayenthalgürtel 4 Telefon: Telefax: E-Mail: Internet: 5968 Köln (221) 376
Der überproportionale Finanzierungsbeitrag privat versicherter Patienten im Jahr 26 Dr. Frank Niehaus WIP-Diskussionspapier 9/7 Bayenthalgürtel 4 Telefon: Telefax: E-Mail: Internet: 5968 Köln (221) 376
Der GKV-Spitzenverband als neuer Player im Gesundheitswesen
 Der GKV-Spitzenverband als neuer Player im Gesundheitswesen Greifswald, 23. Januar 2009 Michael Weller Leiter des Stabsbereiches Politik beim GKV-Spitzenverband Finanzierung und Kostenkontrolle in der
Der GKV-Spitzenverband als neuer Player im Gesundheitswesen Greifswald, 23. Januar 2009 Michael Weller Leiter des Stabsbereiches Politik beim GKV-Spitzenverband Finanzierung und Kostenkontrolle in der
Tragende Gründe. Vom 23. Januar 2014
 Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Qualitätsmanagement- Richtlinie vertragszahnärztliche Versorgung: Umsetzung des 137 Absatz 1d Satz 1 SGB V Vom 23.
Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Qualitätsmanagement- Richtlinie vertragszahnärztliche Versorgung: Umsetzung des 137 Absatz 1d Satz 1 SGB V Vom 23.
Beschluss des Gemeinsamen Bundesausschusses gemäß 2. Kapitel 14 Absatz 4 Spiegelstrich 2 der Verfahrensordnung des Gemeinsamen Bundesausschusses
 Beschluss des Gemeinsamen Bundesausschusses gemäß 2. Kapitel 14 Absatz 4 Spiegelstrich 2 der Verfahrensordnung des Gemeinsamen Bundesausschusses Der Gemeinsame Bundesausschuss hat im Rahmen der Bewertung
Beschluss des Gemeinsamen Bundesausschusses gemäß 2. Kapitel 14 Absatz 4 Spiegelstrich 2 der Verfahrensordnung des Gemeinsamen Bundesausschusses Der Gemeinsame Bundesausschuss hat im Rahmen der Bewertung
Service-Angebote des BPI
 Pharmakovigilanz Service-Angebote des BPI BPI-Pharmakovigilanz Knowledge Base Mit dem EU-Pharmapackage und dem Zweiten Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften vom 19. Oktober
Pharmakovigilanz Service-Angebote des BPI BPI-Pharmakovigilanz Knowledge Base Mit dem EU-Pharmapackage und dem Zweiten Gesetz zur Änderung arzneimittelrechtlicher und anderer Vorschriften vom 19. Oktober
Der GKV-Arzneimittelmarkt 2014
 Gesundheit Mobilität Bildung Der GKV-Arzneimittelmarkt 2014 Bertram Häussler, IGES Institut IGES Arzneimittel-Atlas 2015 Haus der Bundespressekonferenz, 09. Juni 2015 IGES Arzneimittel-Atlas 2015 IGES
Gesundheit Mobilität Bildung Der GKV-Arzneimittelmarkt 2014 Bertram Häussler, IGES Institut IGES Arzneimittel-Atlas 2015 Haus der Bundespressekonferenz, 09. Juni 2015 IGES Arzneimittel-Atlas 2015 IGES
GKV-Spitzenverband 1. Vereinigungen der Träger der Pflegeeinrichtungen auf Bundesebene
 Vereinbarung nach 115 Abs. 1a Satz 6 SGB XI über die Kriterien der Veröffentlichung sowie die Bewertungssystematik der Qualitätsprüfungen nach 114 Abs. 1 SGB XI sowie gleichwertiger Prüfergebnisse in der
Vereinbarung nach 115 Abs. 1a Satz 6 SGB XI über die Kriterien der Veröffentlichung sowie die Bewertungssystematik der Qualitätsprüfungen nach 114 Abs. 1 SGB XI sowie gleichwertiger Prüfergebnisse in der
Innovationsservice der KBV: neue Chance für HTA in Deutschland
 Innovationsservice der KBV: neue Chance für HTA in Deutschland Dr. med. Roman Schiffner Dezernat 1 Nutzenbewertung ärztlicher Leistungen (HTA) Kassenärztliche Bundesvereinigung Wer ist die KBV? GMDS_Leipzig_120906
Innovationsservice der KBV: neue Chance für HTA in Deutschland Dr. med. Roman Schiffner Dezernat 1 Nutzenbewertung ärztlicher Leistungen (HTA) Kassenärztliche Bundesvereinigung Wer ist die KBV? GMDS_Leipzig_120906
Entwurf eines Zwölften Gesetzes zur Änderung des Fünften Buches Sozialgesetzbuch (Zwölftes SGB V-Änderungsgesetz 12. SGB V ÄndG)
 Gesetzentwurf Stand: 31.10.2002, 21.30 Uhr der Fraktionen SPD und BÜNDNIS 90/DIE GRÜNEN Entwurf eines Zwölften Gesetzes zur Änderung des Fünften Buches Sozialgesetzbuch (Zwölftes SGB V-Änderungsgesetz
Gesetzentwurf Stand: 31.10.2002, 21.30 Uhr der Fraktionen SPD und BÜNDNIS 90/DIE GRÜNEN Entwurf eines Zwölften Gesetzes zur Änderung des Fünften Buches Sozialgesetzbuch (Zwölftes SGB V-Änderungsgesetz
Finanzergebnisse der GKV 2014: Finanz-Reserven der gesetzlichen Krankenversicherung bei 28 Milliarden Euro
 HAUSANSCHRIFT POSTANSCHRIFT Friedrichstraße 108, 10117 Berlin 11055 Berlin Pressemitteilung TEL +49 (0)30 18441-2225 FAX +49 (0)30 18441-1245 www.bundesgesundheitsministerium.de E-MAIL pressestelle@bmg.bund.de
HAUSANSCHRIFT POSTANSCHRIFT Friedrichstraße 108, 10117 Berlin 11055 Berlin Pressemitteilung TEL +49 (0)30 18441-2225 FAX +49 (0)30 18441-1245 www.bundesgesundheitsministerium.de E-MAIL pressestelle@bmg.bund.de
Qualitätsbüro Berlin (QBB)
 Qualitätsbüro Berlin (QBB) Gemeinsame Einrichtung der Krankenkassenverbände Berlin, der Berliner Krankenhausgesellschaft e.v., der Ärztekammer Berlin und des Landespflegerates Berlin-Brandenburg Die nachfolgende
Qualitätsbüro Berlin (QBB) Gemeinsame Einrichtung der Krankenkassenverbände Berlin, der Berliner Krankenhausgesellschaft e.v., der Ärztekammer Berlin und des Landespflegerates Berlin-Brandenburg Die nachfolgende
nachfolgende Vereinbarung zum Inhalt und zur Anwendung der elektronischen Gesundheitskarte
 Vereinbarung zum Inhalt und zur Anwendung der elektronischen Gesundheitskarte Stand: 1. Januar 2015 Zwischen dem GKV-Spitzenverband (Spitzenverband Bund der Krankenkassen) K.d.ö.R, Berlin und der Kassenärztlichen
Vereinbarung zum Inhalt und zur Anwendung der elektronischen Gesundheitskarte Stand: 1. Januar 2015 Zwischen dem GKV-Spitzenverband (Spitzenverband Bund der Krankenkassen) K.d.ö.R, Berlin und der Kassenärztlichen
An die Kassenärztliche Vereinigung Bayerns Elsenheimerstraße 39 80687 München Datum
 Absender: An die Kassenärztliche Vereinigung Bayerns Elsenheimerstraße 39 80687 München Datum Vorab per Fax 089/57093-64939 Vergütung von Leistungen in Zusammenhang mit dem Vertrag nach 115 b SGB V zwischen
Absender: An die Kassenärztliche Vereinigung Bayerns Elsenheimerstraße 39 80687 München Datum Vorab per Fax 089/57093-64939 Vergütung von Leistungen in Zusammenhang mit dem Vertrag nach 115 b SGB V zwischen
DAS GRÜNE REZEPT. Für eine sichere Medikation mit rezeptfreien Arzneimitteln
 DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
DAS GRÜNE REZEPT Für eine sichere Medikation mit rezeptfreien Arzneimitteln Was ist das Grüne Rezept? Obwohl das Grüne Rezept schon seit Jahren in Arztpraxen verwendet wird, ist es vielen Patienten und
Einordnung der Diät- und Ernährungstherapie im deutschen GKV-System Das Dilemma der Finanzierung!
 Einordnung der Diät- und Ernährungstherapie im deutschen GKV-System Das Dilemma der Finanzierung! Doris Steinkamp Präsidentin VDD e.v. Diätassistentin, Ernährungsberaterin DGE Fachberaterin für Essstörungen
Einordnung der Diät- und Ernährungstherapie im deutschen GKV-System Das Dilemma der Finanzierung! Doris Steinkamp Präsidentin VDD e.v. Diätassistentin, Ernährungsberaterin DGE Fachberaterin für Essstörungen
Gliederung. Gliederung. Stellenwert der Versorgungsforschung in der Onkologie und praktische Beispiele
 art\vorveran\dgho10\graphik1.cdr Stellenwert der Versorgungsforschung in der Onkologie und praktische Beispiele Symposium Anforderungen an vorsorgungsrelevante, nichtkommerielle Studien zu Arzneimitteln
art\vorveran\dgho10\graphik1.cdr Stellenwert der Versorgungsforschung in der Onkologie und praktische Beispiele Symposium Anforderungen an vorsorgungsrelevante, nichtkommerielle Studien zu Arzneimitteln
Referentenentwurf des Bundesministeriums für Wirtschaft und Energie
 Referentenentwurf des Bundesministeriums für Wirtschaft und Energie Entwurf eines Zweiten Gesetzes zur Änderung des Buchpreisbindungsgesetzes A. Problem und Ziel Das Buchpreisbindungsgesetz regelt zum
Referentenentwurf des Bundesministeriums für Wirtschaft und Energie Entwurf eines Zweiten Gesetzes zur Änderung des Buchpreisbindungsgesetzes A. Problem und Ziel Das Buchpreisbindungsgesetz regelt zum
Faktenblatt Thema: Brustimplantate
 Beispiel für Produkte mit Schadenspotential: Implantate zur Brustvergrößerung oder zur Brustrekonstruktion Zulassungsmodalitäten in Europa und verfügbare Produkte: Bei den sogenannten Brustimplantaten
Beispiel für Produkte mit Schadenspotential: Implantate zur Brustvergrößerung oder zur Brustrekonstruktion Zulassungsmodalitäten in Europa und verfügbare Produkte: Bei den sogenannten Brustimplantaten
vom 15. März 2012 Der Gemeinsame Bundesausschuss hat in seiner Sitzung am 15. März 2012 beschlossen:
 Beschluss des Gemeinsamen Bundesausschusses über eine Beauftragung der Institution nach 137a SGB V: Entwicklung eines sektorenübergreifenden Qualitätssicherungsverfahrens zur Versorgung bei psychischen
Beschluss des Gemeinsamen Bundesausschusses über eine Beauftragung der Institution nach 137a SGB V: Entwicklung eines sektorenübergreifenden Qualitätssicherungsverfahrens zur Versorgung bei psychischen
Der Beschluss des G-BA ist zum 3. Januar 2015 in Kraft getreten.
 Qualifikationsanforderungen für die Erbringung einer EMDR-Behandlung im Rahmen einer Richtlinienpsychotherapie bei Patienten mit einer Posttraumatischen Belastungsstörung Hintergrund: Der Wissenschaftliche
Qualifikationsanforderungen für die Erbringung einer EMDR-Behandlung im Rahmen einer Richtlinienpsychotherapie bei Patienten mit einer Posttraumatischen Belastungsstörung Hintergrund: Der Wissenschaftliche
 Health Technology Assessment (HTA) vom Market Access zum Market Success Medical Valley Talk 10.03.2011 Inhalt Aktuelle Entwicklungen in der Gesundheitspolitik Bedeutung von HTA für Kostenerstattung Prospective
Health Technology Assessment (HTA) vom Market Access zum Market Success Medical Valley Talk 10.03.2011 Inhalt Aktuelle Entwicklungen in der Gesundheitspolitik Bedeutung von HTA für Kostenerstattung Prospective
Methodische Fragen zur frühen Nutzenbewertung nach 35a SGB V
 Die frühe Nutzenbewertung nach AMNOG Rechtssymposium des G-BA, Berlin, 16. Nov. 2010 Methodische Fragen zur frühen Nutzenbewertung nach 35a SGB V Jürgen Windeler AMNOG Nutzenbewertung für Arzneimittel
Die frühe Nutzenbewertung nach AMNOG Rechtssymposium des G-BA, Berlin, 16. Nov. 2010 Methodische Fragen zur frühen Nutzenbewertung nach 35a SGB V Jürgen Windeler AMNOG Nutzenbewertung für Arzneimittel
Verfahren bei Entgelterhöhungen. hungen. Stefan Wilderotter M.A. Referent, Abteilung Gesundheit Verband der Ersatzkassen e.v.
 Verfahren bei Entgelterhöhungen hungen Stefan Wilderotter M.A. Referent, Abteilung Gesundheit Verband der Ersatzkassen e.v. BIVA Fortbildungsveranstaltung für Multiplikatoren und Multiplikatorinnen am
Verfahren bei Entgelterhöhungen hungen Stefan Wilderotter M.A. Referent, Abteilung Gesundheit Verband der Ersatzkassen e.v. BIVA Fortbildungsveranstaltung für Multiplikatoren und Multiplikatorinnen am
SOZIALGERICHT BREMEN BESCHLUSS
 SOZIALGERICHT BREMEN S 7 KR 74/11 ER BESCHLUSS In dem Rechtsstreit A., A-Straße, A-Stadt, Antragsteller, gegen Deutsche Angestellten-Krankenkasse, vertreten durch den Vorstand, Nagelsweg 27-31, 20097 Hamburg,
SOZIALGERICHT BREMEN S 7 KR 74/11 ER BESCHLUSS In dem Rechtsstreit A., A-Straße, A-Stadt, Antragsteller, gegen Deutsche Angestellten-Krankenkasse, vertreten durch den Vorstand, Nagelsweg 27-31, 20097 Hamburg,
Checkliste Interessenkonflikte in der Medizin
 Thomas Bade 2012 Checkliste Interessenkonflikte in der Medizin Kooperationen zwischen Arztpraxis Krankenhaus und Sanitätshaus HomeCare Aufrechterhaltung und ständige Verbesserung eines Management Systems
Thomas Bade 2012 Checkliste Interessenkonflikte in der Medizin Kooperationen zwischen Arztpraxis Krankenhaus und Sanitätshaus HomeCare Aufrechterhaltung und ständige Verbesserung eines Management Systems
Anbei übersende ich Ihnen den angeforderten Bericht der Bundesregierung.
 Bundesrat Drucksache 723/08 08.10.08 Unterrichtung durch die Bundesregierung Stellungnahme der Bundesregierung zu der Entschließung des Bundesrates zum Gesetz zur Stärkung des Wettbewerbs in der gesetzlichen
Bundesrat Drucksache 723/08 08.10.08 Unterrichtung durch die Bundesregierung Stellungnahme der Bundesregierung zu der Entschließung des Bundesrates zum Gesetz zur Stärkung des Wettbewerbs in der gesetzlichen
MARKT IM ÜBERBLICK Kapitel 1 Marktdaten von Pro Generika 11/2013 2
 MARKT IM ÜBERBLICK Kapitel 1 Marktdaten von Pro Generika 11/2013 2 Generikaunternehmen decken 73 % des Arzneimittelbedarfs der GKV 31,3 3,9 4,2 5,7 33,1 4,0 4,7 4,6 35,1 4,1 4,6 3,9 22,5 35,8 3,9 4,9 3,6
MARKT IM ÜBERBLICK Kapitel 1 Marktdaten von Pro Generika 11/2013 2 Generikaunternehmen decken 73 % des Arzneimittelbedarfs der GKV 31,3 3,9 4,2 5,7 33,1 4,0 4,7 4,6 35,1 4,1 4,6 3,9 22,5 35,8 3,9 4,9 3,6
Dietmar Kirchberg Das Medizinproduktegesetz: Was Pflegende wissen müssen Bestimmungen Beispiele Konsequenzen
 Dietmar Kirchberg Das Medizinproduktegesetz: Was Pflegende wissen müssen Bestimmungen Beispiele Konsequenzen Bibliografische Information der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese
Dietmar Kirchberg Das Medizinproduktegesetz: Was Pflegende wissen müssen Bestimmungen Beispiele Konsequenzen Bibliografische Information der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese
Anlage 6b Qualitätssicherung COPD
 Anlage 6b Qualitätssicherung COPD V 3.1 - Stand 03.07.2008 QUALITÄTSSICHERUNG COPD Auf Grundlage der Datensätze nach Anlage 2 RSAV in Verbindung mit Ziffer 5 der DMP-RL, Teil B III Teil 1 Bestandteil des
Anlage 6b Qualitätssicherung COPD V 3.1 - Stand 03.07.2008 QUALITÄTSSICHERUNG COPD Auf Grundlage der Datensätze nach Anlage 2 RSAV in Verbindung mit Ziffer 5 der DMP-RL, Teil B III Teil 1 Bestandteil des
Management im Gesundheitswesen
 Management im Gesundheitswesen Reinhard Busse Jonas Schreyögg Tom Stargardt (Hrsg.) Management im Gesundheitswesen Das Lehrbuch für Studium und Praxis 3., vollständig überarbeitete und erweiterte Auflage
Management im Gesundheitswesen Reinhard Busse Jonas Schreyögg Tom Stargardt (Hrsg.) Management im Gesundheitswesen Das Lehrbuch für Studium und Praxis 3., vollständig überarbeitete und erweiterte Auflage
Entwurf eines Gesetzes zur Änderung des Elften Buches Sozialgesetzbuch
 Bundesrat Drucksache 766/04 (Beschluss) 05.11.04 Gesetzentwurf des Bundesrates Entwurf eines Gesetzes zur Änderung des Elften Buches Sozialgesetzbuch A. Problem und Ziel 72 Abs. 2 Satz 1 SGB XI sieht vor,
Bundesrat Drucksache 766/04 (Beschluss) 05.11.04 Gesetzentwurf des Bundesrates Entwurf eines Gesetzes zur Änderung des Elften Buches Sozialgesetzbuch A. Problem und Ziel 72 Abs. 2 Satz 1 SGB XI sieht vor,
BAnz AT 12.10.2015 B2. Beschluss
 Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach 35a SGB
Lückentext zum deutschen Gesundheitswesen
 Lückentext zum deutschen Gesundheitswesen Füllen Sie die Lücken mit den nachstehenden Begriffen! Allgemeinärzte / Arzneimitteln / ambulante / Arbeitseinkommen / Basisfallwert / Beiträge / Bundesgesetze
Lückentext zum deutschen Gesundheitswesen Füllen Sie die Lücken mit den nachstehenden Begriffen! Allgemeinärzte / Arzneimitteln / ambulante / Arbeitseinkommen / Basisfallwert / Beiträge / Bundesgesetze
Verschreibungsfreie Arzneimittel wieder in der Erstattung
 Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Satzungsleistungen Verschreibungsfreie Arzneimittel wieder in der Erstattung Was sind Satzungsleistungen? Der Rahmen für die Leistungen der gesetzlichen Krankenversicherung wird im Fünften Sozialgesetzbuch
Faktenblatt. Thema: Beitragsrückstände - Ermäßigung und Erlass
 Zum 1. August 2013 ist das Gesetz zur Beseitigung sozialer Überforderung bei Beitragsschulden in der Krankenversicherung ( Beitragsschuldengesetz ) in Kraft getreten. Mit dem Gesetz ist der erhöhte Säumniszuschlag
Zum 1. August 2013 ist das Gesetz zur Beseitigung sozialer Überforderung bei Beitragsschulden in der Krankenversicherung ( Beitragsschuldengesetz ) in Kraft getreten. Mit dem Gesetz ist der erhöhte Säumniszuschlag
Kein seriöser Preisvergleich
 Zum Beitrag Teure Tabletten - Pillen, Preise und die Pharmaindustrie von Klaus Balzer im ZDF, 15. Januar 2014 um 22.45 Uhr, nimmt der BPI wie folgt Stellung: Der Autor beginnt den Beitrag mit dem Kauf
Zum Beitrag Teure Tabletten - Pillen, Preise und die Pharmaindustrie von Klaus Balzer im ZDF, 15. Januar 2014 um 22.45 Uhr, nimmt der BPI wie folgt Stellung: Der Autor beginnt den Beitrag mit dem Kauf
