SKRIPTUM zum Modul AC-4 (Sundermeyer) empfohlene Literatur: Elschenbroich, Organometallchemie, 5. Auflage, Teubner Verlag, Stuttgart 2005 (750 Seiten)
|
|
|
- Albert Möller
- vor 8 Jahren
- Abrufe
Transkript
1 SKIPTUM zum Modul A-4 (Sundermeyer) 1 Metallorganische hemie (2 SWS + 1 SWS Üb) empfohlene Literatur: Elschenbroich, rganometallchemie, 5. Auflage, Teubner Verlag, Stuttgart 2005 (750 Seiten) Ausführlichere Skripten (J. Sundermeyer): Metallorganische hemie der auptgruppen (2 SWS) Metall-Element-Mehrfachbindungen (2 SWS) omogene Katalyse durch Metallkomplexe (2 SWS) Gliederung der 2 SWS Vorlesung 1. Einführung: Metallorganische Verbindungen 1.1 Definition, Abgrenzung, istorische Entwicklung 1.2 Klassifizierung nach Bindungstyp, Polarität der M- Bindung und Elektronegativität 1.3 Energetik, Stabilität / Instabilität, Inertheit / Labilität 1.4 Überblick über Knüpfungsmethoden für M--Bindungen 2. Metallorganische hemie ausgewählter Elemente des s- und p-blocks 2.1 Lithiumorganyle 2.2 Magnesiumorganyle 2.3 Aluminiumorganyle / öhere omologe 2.4 Zinnorganyle
2 2 3. Metallorganische hemie der Elemente des d-blocks mit d 10 Konfiguration 3.1 Kupfer(I)organyle 3.2 Zink(II)organyle / öhere omologe 4. Einführung in die Metallorganische hemie der Elemente des d-blocks mit d n Konfiguration 4.1 Unterschiede in der rganometallchemie der Metalle des s-, p-, d- und f-blocks 4.2 Elektronenzählregeln und ihre Ausnahmen 4.3 Überblick über die d-metall-kohlenstoff- Bindungswechselwirkung 4.4 Wichtige Stoffklassen als Arbeitspferde der d-metall-organischen hemie 5. Liganden mit σ-bindungen zu einem -Atom 5.1 Alkylverbindungen, P-Ylide 5.2 -Atom Teil eines π-systems (Aryl, Alkenyl, Alkinyl, σ-allyl, Acyl) 6. Liganden mit σ,π-bindungen zu einem -Atom 6.1 arbonyl-, Thiocarbonyl- und Isonitril-Komplexe 6.2 arben- bzw. Alkyliden-Komplexe 6.3 arbin- bzw. Alkylidin-Komplexe 6.4 Vinyliden- und Allenyliden-Komplexe
3 3 7. Liganden mit σ,π-bindungen zu einem organischen π-system 7.1 lefin-liganden 7.2 1,3-Dien-Liganden 7.3 Alkin-Liganden 7.4 Aren-Liganden 7.5 π-allyl-liganden 7.6 π-yclopentadienyl-liganden 7.7 Andere Enyl-Liganden 8. Ausgewählte Anwendungen in der homogenen Katalyse (Katalyseskript) 8.1 lefin-ydrierung 8.2 lefin-isomerisierung 8.3 lefin-polymerisation 8.4 lefin-metathese 8.5 ydrierende lefin-arbonylierung (ydroformylierung, xosynthese) 8.6 arbonylierung von Methanol
4 4 1. Einführung: Metallorganische Verbindungen 1.1 Definition, Abgrenzung, istorische Entwicklung Eine metallorganische Verbindung enthält mindestens eine Metall-Kohlenstoff-Bindung zu einer organischen Baugruppe (σ- od. σ,π-gebunden) ausgehend von Metallen des s-blocks Metallen des p-blocks Metallen des d-blocks Metallen des f-blocks Seltenerdmetallen: (Li, Mg...), (Al, In, Pb, Bi...), (3d Metalle: Sc, Ti, V,... u), (ebenso 4d- und 5d-Metalle). (Lanthanoide La...Lu), (Acinoide Ac...Pu ). Gruppe 3 + Lanthanoide Abgrenzung: Als nicht metallorganisch im engeren Sinn gelten Pseudohalogenide, d.h. yanokomplexe L n M-N und Fulminate L n M-N, Graphit-Interkalationsverbindungen, metallische arbide. Als elementorganische Verbindungen gelten kovalente Verbindungen der Nichtmetalle und albmetalle des p- Blocks (B, Si, P, As, S, Se...) mit mindestens einer Metall-Kohlenstoff-Bindung zu einer organischen Baugruppe (σ- od. σ,π-gebunden).
5 istorische Entwicklung adet: "Kakodyloxid" erste elementorgan. Verb.: As [ 3 ]K [(Ac) 2 As--As(Ac) 2 ] + K 3 [As 3 ] Δ Me 2 As--AsMe Zeise'sches Salz: erster lefinkomplex Na( 2 ) [Ptl 3 ( 2 4 )] nach heutiger Kenntnis Ptl 2 + Nal {Ptl 2. Nal. Ethen. 2 } 1849 Frankland: Zinkorganyle auf der Suche nach "isolierbaren Ethylradikalen" EtI + Zn // { 2 5 } + ZnI 2 Et 2 Zn (flüssig, pyrophor) + Et-ZnI (fest) + ZnI Frankland: g-alkyle: MeX + Na/g Me 2 g Alkylgruppenübertragung durch Me 2 g und Et 2 Zn Me 3 B u. Et 4 Sn Frankland führt das Konzept der "Valenz" ein und prägt den Begriff "metallorganisch" Friedel, rafts: rganochlorsilane n Sil 4-n (Alkylgruppenübertragung durch 2 Zn) 1901 Kipping: hochmolekulares Diphenylsilicon [Ph 2 Si] n
6 1943 ochow, Müller: Direktsynthese X + Si (u-kat. 300 ) Siliconindustrie Schützenberger: erster arbonylkomplex [Pt()l 2 ] Mond: erstes binäres Metallcarbonyl Ni() 4 ; flüchtig Ni-affination ieber: hemie der Metallcarbonyle, z.b. [Fe() 4 X 2 ] (X = al, ) erster ydridokomplex oelen: o-arbonyl katalysierte ydroformylierung (xo-prozess) Barbier + Grignard (sein Schüler, Nobelpreis): -MgX eagenzien; Vorteile gegenüber -ZnX bzw. 2 Zn: weniger luftempfindlich, größeres Spektrum an X einsetzbar und reaktiveres Synton für arbanionen rganische Synthese 1909 Pope: erstes Übergangsmetall-σ-rganyl [Me 3 PtI] Schlenk: Li-Alkyle durch Transalkylierung 2 Li + 2 g 2 Li + g 1930 Ziegler, Gilman, Wittig: Li-Alkyle direkt aus Li + X ( = al, ) rganische Synthese.
7 1951 Pauson, Miller: Darstellung + Struktur des Ferrocens p 2 Fe ("Sandwich-Komplex") Dewar, 1953 hatt, Duncanson: Bindungsmodell für Alken-ÜM-Komplexe Gilman: Erschließt mit der Synthese von Liu( 3 ) 2 die synthetisch wichtige Klasse der rganocuprate Wittig (Nobelpreis): Auf der Suche nach Phosphoranen Ph 4 P-Me (versuchte Synthese über [Ph 3 P-Me]l + PhLi) werden die Phosphorylide entdeckt Wittig-eaktion Fischer: Dibenzolchrom aus rl 3 + Al / All 3 in Benzol [(η ) 2 r] All eduktion mit Dithionit S 2 4 zu [(η -6 6 ) 2 r] (18-VE), isoelektronisch zu [(η ) 2 Fe] 1955 Ziegler, Natta (Nobelpreis): Niederdruck- Polymerisation von Ethylen und Propylen; Ziegler-Natta-Mischkatalysator Al 3 / frühes ÜM-alogenid (z.b. Til 3 ), 1980 Kaminsky: Methylalumoxan [-Al(Me)--] n (MA) + p 2 ZrMe 2 aktiver omogenkatalysator 1982 Brintzinger: stereorigide, 2 -symmetr. ansa-metallocene isotaktisches PP
8 1985 Brintzinger, Kaminsky: Kombination beider Entdeckungen Brown (Nobelpreis): ydroborierung rganische Synthese rowfoot odgkin (Nobelpreis) weist durch öntgenstrukturanalyse o- Bindung in der wohl wichtigsten, von der Natur synthetisierten metallorganischen Verbindung, Vitamin B 12 -oenzym, nach awthorne u.a.: Entwicklung der hemie der arborane, z.b. Dicarba-closo-dodecaboran(12) [ 2 B ] und arbolide L n M [ 2 B 9 11 ] Fischer (Nobelpreis): erster arbenkomplex [() 5 W=(Me)Me] 1973 Fischer: erster arbinkompl. [I() 4 r ] ab 1974 Schrock: Alkyliden- / Alkylidin-Komplexe über α--abstraktion an Alkylen, katalyt. lefin- und Alkin-Metathese; metathetische ycloolefin-polymerisation. ab 1995 Grubbs: Grubbs-Katalysator für lefin-metathese [u(=-ph)(pipr 3 ) 2 l 2 ] Wilkinson (Nobelpreis): omogenkatalytische ydrierung von lefinen durch [h(pph 3 ) 3 l] 8
9 ab 1972 Knowles (Nobelpreis): Enantioselektive ydrierungen prochiraler lefine mit chiralen Bis(phosphan)-helatkomplexen vom Typ [L* 2 h(solv) 2 ]+ über diastereomere lefinkomplexe Aminosäure L-Dopa gegen Morbus Parkinson (Monsanto 1977) Noyori: Erstes Beispiel einer asymmetrischen metallkatalysierten eaktion: u(ii)- Schiffbasen*- Komplex in der yclopropanierung von lefinen durch Diazoacetate Streitwieser: rganometallchemie der f-elemente, Darstellung von "Uranocen" [U(η ) 2 ] Wilkinson: omoleptische, kinetisch inerte Übergangsmetallorganyle n M durch Blockierung der β--eliminierung eck entdeckt die nach ihm genannte --Kupplung, die Pd-katalysierte Substitution vinylischer -Atome mittels Aryl-, Benzyl- od. Styrylhalogeniden (Auslöser der Entwicklung vieler weiterer Pdkatalys. --Kupplungen Negishi, Sonogashira...).
10 Lappert: [(Me 3 Si) 2 ] 2 Sn=Sn[(SiMe 3 ) 2 ] 2 erstes Distannen, Auslöser für die Synthese kinet. stabilisierter E=E- u. E=X-Verb. > 3. Periode 1981 West: Mes 2 Si=SiMes 2, erste stabile Verbindung mit Si-Si-Doppelbindung offmann (Nobelpreis): Isolobalkonzept: semiempirische M-Betrachtung der Grenzorbitale anorganischer, organischer und metallorganischer Molekülfragmente Becker: tbu P und tbu- P, erste -P-Dreifachbindung, Auslöser für die Synthese kinetisch stabilisierter E E- und E X-Verb. > 3. Periode 1982 Bergmann: Intermolekulare eaktion von Übergangsmetallorganylen mit Alkanen: ("--Aktivierung") Noyori: Enantioselektive Addition von Zinkorganylen an prochirale organische arbonylverbindungen in Gegenwart katalyt. Mengen chiraler β-aminoalkohole.
11 Schnöckel: erzeugt Aluminium(I)-chlorid [All(solv)] und leitet die metallorganische lusterchemie subvalenter auptgruppenmetalle ein, z.b. [p*al] Sita: [Ar*Sn] 8 Stanna-uban 1991 Uhl: [ibu 12 Al 12 ]2- closo-alan mit Ikosaederstruktur Noyori (Nobelpreis): Enantioselektive + chemoselektive (arbonyl vor lefin) katalytische ydrierung prochiraler Arylketone mit einem chiralen u-binap (Bisphosphin)-Katalysator Brookhart: Aufbauend auf Arbeiten von tom Diek: Katalytisch aktive, relativ unempfindliche Fe, o, Ni, Pd-Diimin-Komplexe in der α-lefin- Polymerisation, Mechanismen des hain-walkings und hain-transfers Schrock [Mo(N)(=')( f ) 2 ] Grubbs [u(p 3 ) 2 (=')l 2 ] und hauvin (Mechanismus) erhalten den hemie-nobelpreis für ihre Leistungen auf dem Gebiet der katalytischen lefin-metathese
12 Klassifizierung nach Bindungstyp, Polarität der M- Bindung und Elektronegativität Klassifizierung nach dem M--Bindungstyp: Die Elektronegativität EN() und EN() nach Pauling und Allred unterscheiden sich nur wenig, wobei EN() 2.2 < EN() 2.5 ist. Ähnlich wie bei den Metallhydriden lassen sich Metallorganyle je nach Differenz der Elektronegativitäten EN(M) und EN() und Anzahl der Valenzelektronen vier verschiedene Gruppen definieren: hoher ionischer Anteil M- σ-bindungen E-- σ-bindungen M- π-bindungen E--π-Bindungen (selten) Η Lanthanoide: M- σ-bindungen, höherer ionischer Anteil (größere Ionenradien) σ Actinoide: M- σ-bindungen überwiegend kovalent (Lanthanoidenkontraktion)
13 Grenzen fließend: - Auch u zeigt aufgrund des hohen Ionenpotentials u--u Mehrzentrenbindungen - a- und Y-rganyle, Li- und Mg-rganyle sehr ähnlich: Schrägbeziehung, gleiches Ionenpotential..W VI - 3 kovalenter als polarere W II - 3 Bindung (Ionenpotential!). 13 Gruppe 1: kovalente Elektronenmangel- Verbindungen (< 8 VE für G) mit M- 3 -M Mehrzentrenbindungen bei kleinen hochgeladenen, stark polarisierenden "Kationen M n+ " hohen Ionenpotentials z.b. [LiMe] 4, [BeMe 2 ] n, [MgPh 2 ] n, [AlMe 3 ] 2, [Ln(AlMe 4 ) 3 ], [ume] n etc. Gruppe 2: Verbindungen mit hohem ionischen Anteil; große und stark elektropositive Kationen, stabile arbanionen mit hoher Gruppenelektronegativität (sp 2, sp); nicht flüchtig, Ionengitter; z.b. Na[ ], Kp, K+[Ph 3 ]. Gruppe 3: kovalente auptgruppenorganyle, flüchtig, überwiegend σ-bindungen, Stabilisierung des Elektronenmangels (< 8VE) über yperkonjugation B 3 hauptsächlich M- σ-bindungen (GaEt 3, PbEt 4, Ph 3 Sn-, BiMe 5 )
14 14 in seltenen Fällen: M- π-bindungen (z.b. Si=, P=, bzw. η n -gebundene π-donor-liganden, z.b. p 2 Sn) Gruppe 4: kovalente Übergangsmetallorganyle, häufig flüchtig, σ- und π-bindungen, ggf. Stabilisierung des Elektronenmangels (< 18 VE) über agostische Ww mit σ-bindenden El.paaren z.b. in Ti( 2 ) 4, durch Adduktbildung mit L oder mit nichtbindenden El.paaren von l, z.b. in 2 Al-l oder Assoziate mit π-elektronenpaaren, z.b. u- sowohl M- σ-bindungen: Alkyl-, Aryl-, Vinyl-, Alkinylals auch M- π-bindungen: arben-, arbin-, η n -gebundene σ,π-donor-liganden (η ) σ-donor-π-acceptor-liganden (η 2 -lefine, η 2 -Alkine, η 2 -Ketone). seltene Ausnahmefälle: M- Mehrzentrenbindungen (z.b. 5- und 6-fach koordiniertes, interstitielles -Atom in arbidoclustern: z.b. [(LAu) 6 ] 2+, [Fe 5 ()() 15 ], [u 6 ()() 17 ] etc.
15 Elektronegativität und eaktivität 15 Die Polarität der M- Bindung hängt ab von der Elektronegativitätsdifferenz der Bindungspartner nicht etwa eines isolierten M- oder -Atoms, sondern der Baugrupppen [L n M] δ+ bzw. [ 3 ] δ ("Gruppenelektronegativität") Die Gruppenelektronegativität EN(- n m ) einer Kohlenstoff-Baugruppe hängt stark ab vom ybridisierungsgrad: Da s-elektronen einer stärkeren Kernanziehung unterliegen als p-elektronen, wächst EN() mit steigendem s-anteil (gleichzeitig Zunahme des ionischen Bindungsanteils und der -Acidität) EN: sp 3 = 2.5 sp 2 = 2.75 sp = = EN G, ionischer Anteil und s-anteil steigt Die M--Bindung in Alkinyl-Komplexen ist polarer (thermodynamisch stabiler) als die in Alkyl-Komplexen von den Substituenten am -Atom, die eine Partialladung am -aftatom induzieren können: EN G ( 3 ) = 2.31 M- 3 reaktiv EN G (F 3 ) = 3.47 M-F 3 unreaktiv, vgl. M-l) ähnlicher Trend: vs - 6 F 5
16 Die Gruppenelektronegativität EN(-ML n X m ) einer Metall-Baugruppe / eines Komplexfragments hängt stark ab von induktiven / mesomeren Effekten der Liganden / Substituenten am M Starke σ-donoren wie Alkylgruppen oder starke π-donoren (mit lone Pair am aftatom), z.b. N 2 (Imido) > 2 (xo) und N 2 (Amido) > (Alkoxo) Liganden / Substituenten erhöhen die Elektronendichte am Metallzentrum, reduzieren folglich dessen Fähigkeit, in einer weiteren Bindung mit Kohlenstoff -Bindungselektronen an das Metall zu binden an elektronenreichen Komplexfragmenten gebunden behält der anionische Ligand (z.b. 3 oder ) seine negative Ladung an elektronenarmen Komplexfragmenten gebunden wird das arbanion hin zu einer unpolaren Bindungssituation bis hin zu 3 δ+ (bzw. δ+ ) polarisiert. Vgl. Umpolung der eaktivität in 1,2-Additionen von Germanen: 16
17 17 Starke π-acceptoren (, N mit leeren π* rbitalen) vermindern die Elektronendichte am Metallzentrum der anionische Ligand (z.b. 3 oder ) wird stark zu einer unpolaren Bindungssituation oder darüber hinaus zu 3 δ+ (bzw. δ+ ) polarisiert. Vgl. Umpolung der Acidität δ+ -o()4 Metall-Protonensäure (acides ) δ -o(pme 3 ) 4 eher hydridisches von der xidationsstufe: je höher die Metall-xidationsstufe, desto stärker polarisierend wirkt M auf anionische -Liganden z.b. EN(Tl + ) 1.62 EN(Tl 3+ ) 2.04 (nach Pauling); 6. Periode: s Ba 2 La 3 f 4 Ta 5 W 6 kovalenter harakter nimmt zu EN(M n+ ) nimmt zu 1.3 Energetik, Stabilität / Instabilität, Inertheit / Labilität eaktivität einer M--Bindung bestimmt durch: 1. Thermodynamische Stabilität Frage stabil oder instabil? Bildungsenthalpien (ΔG f bzw. Δ f )
18 2. Kinetische Labilität Frage inert oder labil Aktivierungsenergien der eaktionen (E a ) Energiegewinn d. irreversible Folgereaktionen M--Bindung (z.b. Grignard), Solvatationsenergie, adikal-dimerisierung etc. 1. Thermodynamische Stabilität: Bezug auf den homolytischen Zerfall in die Elemente in den Standardzuständen (1 atm, 298 K) M( 3 ) 4 M (s) (Graphit) Δ f positiv (endotherme Verb. / exothermer Zerfall) negativ (exotherme Verb. / endothermer Zerfall) Da die Standardbildungsentropien ΔS f in der egel unbekannt sind, werden in erster Näherung die Standardbildungsenthalpien Δ f (statt der freien Standardbildungsenergien ΔG f ) als Maß für die thermodynamische Stabilität gewertet.
19 Bezug auf den homolytischen Zerfall (Dissoziation) in Metallradikal und Alkylradikal 19 g( 3 ) 2 D 1 g( 3 ) + 3 D 2 g Dissoziationsenergien D n D 1 = 214 kj/mol D 2 = 29 kj/mol mittlere molare Bindungsenergie D (g-) 121 kj/mol Beispiele: Energiebeträge in kj/mol Gruppe 12 Δ f D (M-) ZnMe endotherm 177 dme endotherm 139 gme endotherm 121 Gruppe 14 Δ f D (M-) D (M-l) Me exotherm 358 SiMe exotherm GeMe 4-71 exotherm 249 SnMe 4-19 exotherm PbMe endotherm 152
20 Merke: M--Bindungsenergien sind nicht generell gering. Die thermodynamische Stabilität gleicht derjenigen anderer kovalenter Bindungen D(N-N), D(S-S), D(-N) etc. Faustregel I: D (M-l) ist etwa das fache von D (M-) Faustregel II: Die mittlere Bindungsenergie D (M-) von autgruppenmetall-rganylen (+ d 10 Gruppe 12) nimmt innerhalb der Gruppe zu den schwereren Metallen hin ab, bei den Übergangsmetall-rganylen dagegen zu (z.b. Ti 4 Zr 4 f 4 ). Faustregel III: Alle metallorganischen Verbindungen sind thermodynamisch instabil - in Bezug auf eaktion mit Sauerstoff M n + 2 M m Δ 20 - in Bezug auf ydrolyse M n + 2 M() n + n -Δ allerdings sind diese eaktionen häufig kinetisch gehemmt (E a ).
21 21 Trends der molaren Standardbildungsenthalpien Δ f homoleptischer Methylverbindungen: 2. Kinetische Labilität bzw. Inertheit Merke: Kinetisch weitgehend inert sind metallorganische Verbindungen - mit abgeschlossener Valenzschale ("elektronische Absättigung") 8 VE bei auptgruppenmetallen: SnMe 4
22 18 VE bei Übergangsmetallen: pu() 2 Me, pmo() 2 Me (p = η yclopentadienyl) 22 - mit koordinativ abgeschlossener Ligandsphäre ("koordinative Absättigung") hohe Koordinationszahlen: (bipy)beet 2, [WMe 8 ]2-, TaMe 5 (dmpe) 1,2-Dimethylphosphino-ethan - mit sterisch anspruchsvoller Ligandhülle, sofern die dadurch erzielte kinetische Stabilisierung nicht durch den gegenläufigen Effekt (niedrige Koordinationszahl + elektronisch ungesättigtes Metallzentrum) überkompensiert wird. Typisch: kinetische Stabilisierung ungewöhnlicher G-Verb. Mes 2 Sn=SnMes 2 (Mesityl), p* 2 Sn p* = [ 5 Me 5 ] Kinetisch labil sind metallorganische Verbindungen - mit nicht abgeschlossener Valenzschale ("elektronisch ungesättigt"), d.h., wenn ein energetisch niedrig liegendes Acceptororbital (LUM der Verbindung) sterisch erreichbar ist (Angriff durch Nucleophile wie Wasser und adikale wie 3 2 ): z.b. Al 2 Me 6, TlMe 3, TiMe 4, WMe 6, VMes 3 - mit zwar abgeschlossener Valenzschale, aber einem nichtbindenden Elektronenpaar (M der Verbindung, Angriff durch Elektrophile + und
23 23 adikale 3 2 ): z.b. SbMe 3 - mit β--atom in der Alkylkette bei gleichzeitig vorhandenem, energetisch niedrig liegendem Acceptororbital am Metallzentrum (insbesondere bei den Gruppen 1, 2, 13 und bei den Übergangsmetallverbindungen) Zerfallsweg über die sogenannte "β--eliminierung" zum lefin wird eröffnet (weniger typisch für die Gruppen 14-16). Einer der wichtigsten eaktionspfade der Metallorganik! M M M M M od. M+ syn-coplanare Eliminierung M mit Elektr.mangel (Akzeptororbital) β-agostische Wechselwirkung 3z,2e - Bindung (M--) lefin-insertion (ydrometallierung) β-eliminierung von lefin Der konzertierte harakter der in der egel reversiblen β--verschiebung bewirkt eine Senkung der Aktivierungsenergie E a. Alkyle mit β- sind generell weniger stabil als solche ohne β-! Beispiel 8 VE Alkyle: [TiMe 4 ] (Zers. ab -40, bimolekular über α--abstr.) [TiEt 4 ] (Zers. ab -80, intramolekular über β--abstr.) [Ti( 2 - t Bu) 4 ] (kein β- + Sterik, stabil, Smp +90 )
24 I.d.. existieren allerdings mehrere Zerfallswege - homolytisch und β--eliminierung - nebeneinander. Beispiele für thermodynamische Stabilität und kinetische Labilität: 24 Verbrennungsenthalpie thermodynamisch kinetisch ZnEt kj/mol, instabil labil pyrophor, mit 2 rad. Autoxidation, sehr hydrolyseempfindlich, 14 VE SnMe kj/mol, instabil inert luftstabil, kinetisch inhibiert, 8 VE eaktivität gegenüber: 2 2 Gründe Me 3 B + - Elektronenlücke hyperkonjugativ zu, geringe Bindungspolarität Me 6 Al Nucleophiler Angriff via 3d, hohe Bindungspolarität Me 3 In + + Elektronensextett, hohe Bindungspolarität Me 4 Si - - Si (3d) sterisch perfekt abgeschirmt, geringe Bindungspolarität Me 3 Sb + - freies Elektronenpaar, hohe Elektronendichte nicht abgeschirmt.
25 1.4 Überblick über 15 Knüpfungsmethoden für M--Bindungen (W) = WITIG Direktsynthese (Metall + X) (W) 2 M + n X n M + MX n (bzw. n MX n ) Prinzip: Δ f (Ml) < 0 dient zur Kompensierung von Δ f (M) > 0; darüber hinaus: 2 Li + Mel MeLi + Lil extra Triebkraft durch Gitterenergie Lil Mg + PhBr PhMgBr(TF) 2 extra Triebkraft d. Solvatationsenergie Mg 2+ Si + 2 Mel u Me 2 Sil 2 (+ Me 3 Sil + MeSil 3 ) Erniedrigung der Aktivierungsenergie durch beigefügtes u (bildet + ul, das 2 Sil chloriert). Diese eaktionen sind radikalischer Natur: Ein Elektron wird aus der Metalloberfläche auf das elektronenarme organische alogenid übertragen. Es bildet sich ein adikalanion [X] -, das in ein organisches adikal und das alogenid zerfällt. Das organische adikal wird auf der Metalloberfläche weiter zum arbanion reduziert. eterogene eaktion Beschleunigung durch Ultraschall.
26 eaktivität: -F (funktioniert i.a. nicht) -l < -Br < -I Gerade mit -I gibt es aber häufiger Probleme mit Nebenreaktionen: Direktsynthese Li-I + Li I Li β- Eliminierung Li- + Li-I + Ethen Wurtz-Kopplung Li-I 3 2 Li 2 Li 3 X Li 2 Li 3 X = Br und insbesondere X = I werden in die eterocuban-stuktur eingebaut nicht salzfreie eagenzien, z.b. [(MeLi) 3 (Li-I)] 2 Doppeltitration nach Gilman zur Bestimmung des Anteils X = (durch 2 -Autoxidation), al: 1 ml {Li + -Li} wird in Wasser gegeben und gegen Phenolphthalein titriert ergibt Gesamt-Alkali-Gehalt. 1 ml {Li + -Li} wird in trockenen Ether gegeben, der 0.5 ml 1,2-Dibromethan enthält. Nach 3 Min. wird mit 3 ml Wasser hydrolysiert und gegen Phenolphthalein titriert ergibt Anteil des Alkoxids, das mit 1,2-Dibromethan nicht reagiert. -Li + Br Br -Br + Li Br Ethen + Li-Br
27 Aus der Differenz der zugegebenen ml Maßlösung (0.1 M l) lässt sich der allein auf Li beruhende Anteil der ydrolyse errechnen. 27 Legierungsverfahren: Zur Kompensation von stark positivem Δ f (M) der schwereren Elemente (Tl, Pb, Bi, g) wird die entsprechende Natriumlegierung eingesetzt: 2 Na + g + 2 MeBr Me 2 g + 2 NaBr Δ = -530 kj/mol 4 NaPb + 4 Etl Et 4 Pb + 3 Pb + 4 Nal Na 3 Bi + Arl Ar 3 Bi + 3 Nal 2. Transmetallierung (Metall + Metallorganyl) (W) M + M' M + M' Prinzip: Das unedlere Metall M (Alkali-, Erdalkalimetall, Al, Ga, Sn, Zn, Sb, Bi, Se, Te) verdrängt das edlere Metall M' aus einer endothermeren Verbindung M' (z.b. Me 2 g + 94 kj/mol, 3 Tl, 4 Pb, 3 Bi): Triebkraft: Unterschiede in ΔG f von -M und '-M Zn + Me 2 g Me 2 Zn + g Δ = -35 kj/mol
28 4 Li + Pb(= 2 ) 4 4 Li-= 2 + Pb (ebenso Sn) 2 Na + SnPh 4 N 3 (l) NaPh + NaSnPh 3 (ebenso Pb) 2 Na + SbPh 3 N 3 (l) NaPh + NaSbPh 2 (ebenso P) Metallaustausch (Metallorganyl + Metallorganyl) (W) M + 'M' 'M + M' Prinzip: Gleichgewichtsverschiebung infolge Ausfällung, höhere Flüchtigkeit oder Bildung stabilerer arbanionen: 4 PhLi + (Allyl) 4 Sn 4 Allyl-Li + Ph 4 Sn Assoziativer Mechanismus n BuLi + Bu3 Sn- 2 - Li Bu 4 Sn Li--Kontakte! P(SiMe 3 ) 3 + MeLi(dme) (dme)li-p(sime 3 ) 2 + SiMe 4 abdestillierbar 4. Nucleophile Alkylierung von M'X (W) (Metallorganyl + M'X, X = al,, Ac) M + M'X M' + MX (X = l,, Ac, Tf)
29 Prinzip: M muß elektropositiver als M' sein: 3 MeLi + Sbl 3 Me 3 Sb + 3 Lil 2 K 2 Ph + Bal 2 TF (Ph 2 ) 2 Ba(TF) Kl 3 Me 6 Al 2 + Wl 6 Me 6 W + 3 (Me 2 All) 2 Die eaktivität der rganyle elektropositiver Metalle nimmt in folgender eihenfolge ab: K > Na > Li (rein) > Li(+LiX) > MgX > 3 Al > 2 Zn > 3 Sn- 3 Sb > 3 Si- Mit Abnahme der Nucleophilie sinkt auch das eduktionsvermögen dieser Metallorganika. Problem: Viele Metallhalogenide und -oxide insbesondere des d-blocks reagieren mit den reaktivsten, elektronenreichen arbanionen unter eduktion. Deshalb ist die Ausbalancierung der Nucleophilie und des eduktionsvermögens auf das jeweilige Substrat essentiell. Me 3 Si- 5 Me 5 + Nbl 5 p*nbl 4 + Me 3 Sil (Nb-eduktion mit Lip*) Me 4 Sn + 3 e--e 3 Me-e 3 + Me 3 Sn-e 3 (e-eduktion m. ZnMe 2 ) 29
30 5. alogen-metall-austausch an -al (W) (Metallorganyl + I bzw. Br) M + 'X X + 'M (M = Li) Prinzip: Triebfeder ist die Bildung des stabileren arbanions ' (im Vergleich zu ). 30 BuLi + ArI BuI + ArLi (kinet. Kontrolle, tiefe Temp.) BuLi + (Me 3 Si) 2 Br BuBr + (Me 3 Si) 2 Li (thermodyn. Prod. wäre Bu-(SiMe 3 ) 2 ) 2 Br 2 + n BuLi n BuBr + [Li- 2 Br] (arbenoid) α-elimin. { 2 } + LiBr aber: 2 l 2 + n BuLi n Bu + [Li-l 2 ] (arbenoid) α-elimin. {l} + Lil da -l weniger polarisierbar ist - höher liegendes σ* (LUM) Deprot. v. 2 l 2 bevorzugt 1-Br,2-F n BuLi n BuBr + [1-Li,2-F- 6 4 ] {Arin} + LiF 2 =Br 2 + n BuLi n BuBr + 2 =(Li)Br
31 Mechanismus: Der nucleophile Angriff von BuLi auf das σ*-rbital der -X Bindung ist bei tiefen Temperaturen (unter kinetischer Kontrolle) gegenüber Konkurrenzreaktionen (-Metallierung oder 'X Alkylierung) begünstigt. Geschwindigkeit nimmt zu: Br < I bzw. exan << Et 2 < TF < MPT Ar-I + Bu-Li TF [Ar-I-Bu] [Li(TF) 4 ] + Zerfall Li-Ar + Bu-I Der Zerfall des Zwischenproduktes eines Iod-at- Komplexes wird durch den polarisierenden Angriff von Li + auf das stabilere arbanion ausgelöst Metallierung (Metall, -organyl, -hydrid od. -amid + -acide Verbindung) (W) M + ' + 'M (M = Alkalimetall) Prinzip: Säure-Base-Gleichgewicht, das stabilere arbanion bildet sich (alternativ: edoxreaktion): PhNa + Ph 3 Ph + Ph 2 Na BuLi / exan + 5 Me 5 Bu- + Li 5 Me 5 Et-Mgl + Ph Et- + Ph -Mgl
32 32 K / TF + 5 Me K 5 Me 5 NaN 2 / N 3 (l) + 5 Me 5 N 3 + Na 5 Me 5 g[n(sime 3 ) 2 ] 2 + Aceton g( 2 -Me) N(SiMe 3 ) 2 Ti(NMe 2 ) pti(nme 2 ) 3 + NMe 2 Me 3 Sn-NMe N 2 Me 3 Sn-(N 2 ) + NMe 2 Na / TF /2 2 + Na 5 5 Li / N Li Li Phänomene: Die folgende Tabelle der thermodynamischen Acidität (Gleichgewichtsbedingungen) gibt nicht unbedingt die kinetische Acidität wider (Geschwindigkeit der Deprotonierung): Me = Me Me l N 9.5 Ph Br 3 9 Daraus lässt sich eine hypothetische eaktionsfolge konstruieren:
33 EtNa Na Propen 3 5 Na Acetylen Na 5 6 pna 33 Die kinetische Inhibierung vieler Metallierungsreaktionen hat ihre Ursache in dem hohen kovalenten Anteil der Li- Bindung der Base (Li + wirkt als hartes Ion stark polarisierend auf arbanionen). Lösung des Problems der kinetischen Inhibierung: 1) Li + muss durch Liganden (Et 2, TF, TMEDA) solvatisiert werden (erhöht Polarität und Basizität der Li- Bindung): eines Benzol und Toluol reagieren nicht mit n BuLi, doch bei Zugabe des helatbildners TMEDA (Tetramethylethylendiamin) tritt die thermodynamisch erwartete Metallierung ein. Tert. Amine haben gegenüber Etherliganden den Vorteil, dass sie nicht auf dem Weg der Etherspaltung in das Energietal der thermodynamisch begünstigten Li-Alkoxide abstürzen: n BuLi hat folgende albwertszeiten bei 25 : in TF (τ ca. 2 Minuten), in Et 2 (τ ca. 20 Minuten).
34 Li MeLi in Et 2 bei 25 stabil 34-3 Et 2 + n BuLi - n Bu- 2-3 Li Ethen TF unterliegt rascher Li der Wittig-Umlagerung - 2 TF + n BuLi - n Bu- - 2 Li= 2 + Ethen 2) Der polare Anteil der Metall-Kohlenstoff-Bindung (die Basizität) kann durch Austausch von Li + gegen K + drastisch erhöht werden. Diese Strategie wird bei den sogenannten Lochmann-Schlosser-Superbasen, den stärksten Basen, die wir kennen, verfolgt: n t t n + BuLi + BuK {Li Bu + BuK} Komplex (Li härter) Ph- 3 + {Li t Bu + n BuK} Komplex [Ph- 2 ]K Benzylkalium Propen+ {LitBu + nbuk} Komplex Allylkalium 7. Mercurierung / Thallierung (g- bzw Tl- Elektrophil + organisches Nucleophil) MX n + MX n-1 + X Prinzip: Elektrophile aromatische Substitution durch Metallkation n M +
35 g(ac) 2 + Ar Arg(Ac) + Ac Tl(Ac) 3 + Ar ArTl(Ac) 2 + Ac 35 Benzol < Thiophen < Furan (Zunahme der eaktivität und des Substitutionsgrades) 8. Elektronentransfer (unedles Metall + Elektronenakzeptor n m ) x M + n m M x [ n m ] (M = Alkali-, Erdalkalimetall) Prinzip: edoxreaktion von M und n m unter Bildung von M n+ und [ n m ] n in TF oder N 3 (l) TF 2 K + 10π K + K + TF Mg + TF TF Mg TF Mg + 2 Na + TF Dicyclopentadien TF Mg TF n Na yclopentadienid
36 36 9. ydrometallierung (Insertion von Alken in M-) (W) Prinzip: Konzertierte 1,2-Addition von M- an Alkene bzw. Alkine = Umkehrung der α--eliminierung in Metallalkylen. konzertiert polar: stabileres arbanion mit 6 VE-G-ydriden: _ + M- = X 2 B-, X 2 Al- od. 2 Al mit < 16 VE-ÜM-ydriden M- = L n Zr-, L n Pd- stereoselektiv cis, konzertiert, lefin-präkoordination, regioselektiv anti-markovnikov stabileres arbeniumion "Konzertiert" schließt den egelfall mit ein, dass die Knüpfung der M--Bindung der Knüpfung der -- Bindung etwas voraus eilt: eaktion über das stabilere arbeniumion (ÜZ) zum stabileren arbanion (GZ). [Et 2 Al-] n + Ethen [Et 3 Al] 2 (ydroaluminierung) [M-] + 2 = 2 - [M ] M- + M--- bevorzugt + M--- + [-B 2 ] n B 2
37 schrittweise radikalisch: mit 8 VE-G-ydriden (M = Si, Ge, Sn, Pb, P) oder 18 VE-ÜM-ydriden radikalische Addition ausgelöst durch Starterradikal ad. Additionsfreudigkeit: Si- < Ge- < Sn- < Pb- Ph 3 Sn- + ad ad- + Ph 3 Sn Ph 3 Sn + Ph-= 2 Ph 3 Sn- [Ph 3 Sn- 2 --Ph] -Ph 3 Sn [Ph 3 Sn Ph stabileres adikal-intermediat 37 Et 3 Sn ,4-Addition Et 3 Sn Et 3 Sn Alkine: B 2 Ph Ph [-B 2 ] n cis-addition -Si 3 Ph Ph Ph polar radikalisch: trans-addition Ph Si 3 Peroxid oder AIBN Starter oder UV 10. arbometallierung (Insertion von Alken in M-) (W) Prinzip: Konzertierte 1,2-Addition von M- an Alkene bzw. Alkine (Umkehrung selten).
38 konzertiert polar, stereoselektiv cis, regioselektiv anti-markovnikov: elektropositivste auptgruppenmetalle oder Übergangsmetall-Alkyle mit Elektronenmangelsituation 38 M- + ' ' M--- ' + M--- M= Alkalimetall, Al oder 14/16 VE d-metall n BuLi + Ph Ph bevorzugt Ph Ph + Ph Ph cis-addition Bu Li Bu Industriell wichtige Polymerisation von Butadienen z.b. Isopren, zu Polyisopren (Synthesekautschuk) + n BuLi Li Bu Die vinylische Polymerisation von lefinen mit Koordinationskatalysatoren ist vom Wesen her eine Polycarbometallierung L n M- 2 -P + n 2 = 2 L n M-[ ] n - 2 -P bei Übergangsmetallen neben Ti, Zr auch weniger elektropositive Metalle wie Ni, Pd in Elektronenmangelsituationen
39 11. arben-insertion in M-X-Bindung (in M-, M-al häufig, in M- selten) Me 2 Snl N 2 Me 2 Sn( 2 l)l + N 2 Ph 3 Ge + Phg-Br 3 Ph 3 Ge-Br 2 + PhgBr (1,1-Eliminierung bzw. α-br-abstraktion durch g) 39 g-l + ' 2 =N 2 g-' 2 -l + N 2 pmo() N 2 pmo() N Arylierung über Diazoniumsalz [ArN 2 ] X + As() 3 Ar-As() 2 + N 2 + X (Arylarsonsäure, Bart-eaktion) [ArN 2 ] X + gl 2 [ArN 2 ] + [gl 3 ] Δ Ar-gl + N 2 + Arl Decarboxylierung vs. 2 -Insertion in M- oder M--Bindung g() 2 Δ 2 g [(Ac) 2 As--As(Ac) 2 ] Δ Me 2 As--AsMe 2 + 2
40 40 Vergleichbare eaktionen auch von Formiaten zu ydriden: Bu 3 Sn(()) Δ Bu 3 Sn + 2 [L n h(())] [L n h-] xidative 1,1-Addition von -X an L n M (W) Prinzip: 2 adikale und X oder aber ein Elektrophil + und ein Nucleophil X werden unter Erhöhung der Metall-xidationsstufe um zwei an einen niedervalenten Komplexbaustein oder an eine niedervalente auptgruppen-verbindung addiert. Typisch für die d-metall-hemie, einige Beispiele finden sich jedoch auch in der hemie subvalenter p- Metall-Verbindungen: PbI 2 + MeI Me-PbI 3 Me-Tl + MeI Me 2 Tl-I Die Direktsynthese (z.b. Grignard) ist ein Spezialfall der xidativen Addition am elementaren Metall. [Ir +1 (PPh 3 ) 2 ()l] MeI [Ir +3 (PPh 3 ) 2 ()(Me)l(I)] [Pd 0 (PPh 3 ) 4 ] Ph-Br [Pd +2 (Ph)(Br)(PPh 3 ) 2 ] + 2 PPh 3
41 15. Metall-Nucleophil + -Elektrophil (W) 41 (Metall-)Nucleophil-Erzeugung über eduktive Spaltung der Si-Si, P- oder M-M Bindung: 3 Si-Si Na 2 NaSi 3 6 F 6 3 Si- 6 F 5 PPh Na NaPh + NaPPh 2 MeI Toluol + Me-PPh NaI () 5 Mn Mn() K 2 K[Mn() 5 ] 3 -l () 5 Mn-- 3 Deprotonierung von ydriden mit starken Basen: Ph 3 Sn + K 2 + K[SnPh 3 ] EtBr Ph 3 SnEt pfe() 2 + BuLi Bu + Li[pFe() 2 ] Allyl-Br pfe() 2 (allyl) All diese eaktionen lassen sich auch als oxidative Additionen auffassen, siehe 14).
42 2. Metallorganische hemie ausgewählter Elemente des s- und p-blocks Lithiumorganyle Wichtigste Darstellungsmethoden: Direktsynthese oder Lithiierung -acider Verbindungen mit n BuLi (käuflich) -X + 2 Li 1/n [-Li] n + LiX - + BuLi 1/n [-Li] n + Bu Wichtigstes technisches Produkt: n BuLi 80% gehen in die anionische Polymerisation von Isopren zu Polyisopren ( Synthesekautschuk) EtLi Pentan L n Li n BuLi TMEDA L n Li x Isopren σ- und π-allyl-intermediate keine 1,2-, 3,4- od. trans-1,4-add. cis-1,4-addition ydrolyse + Vulkanisation liefert Synthesekautschuk Struktur und Bindungsverhältnisse: Überwiegend kovalent mit ionischen Bd.-anteilen Elektronenmangel-Verb. [-Li] 1 2 VE! Mehrzentrenbindungen unterschiedlichen Aggregationsgrades [Li] n (oligomere Untereinheiten) Assoziate mit Lösungsmittel L 3 Li- 8 VE
43 Li - Lösungsmittel - Aggregationsgrad n MeLi in KW unlöslich, im Kristallgitter: (n = 4, ), hoher ion. Anteil, nicht unzersetzt sublimierbar. in Lösung: L = TF, Et 2 (n = 4) Li 4 Tetraeder, alle Flächen 3 überkappt in Lsg. und Kristall [MeLi(L)] 4 43 Li Li Li Li Li (od. Solv. L) L Typ [AB] 4 Li-Li 236 pm Li- 231 pm Li 236 pm vgl. Li-Li 267 pm Li-Li 304 pm Li Li 2 (g) (s) kubisch raumzentr. Packung von [MeLi] 4 Einheiten ebenso: [PhLi(Et 2 )] 4, [ t BuLi] 4, [ n BuLi] 4 EtLi in Benzol löslich (n = 6) verzerrtes Li 6 -ktaeder 2 Flächen nicht überkappt Typ [AB] 6 ax. Li Li Li Li Li ax. Li Li 6 -ktaeder 6 der 8 Flachen uberkappt! ax. Li.. Li Li Li Li Li ax.
44 n BuLi in Alkanen löslich, destillierbare Flüssigkeit (!) kristalliner einstoff bei -40 (n = 6) n = 4 in Et 2 44 t BuLi in Alkanen löslich Li 4 -Tetraeder wie MeLi, aber abgeschirmt sublimierbar bei 70 /1 mbar PhLi n = 4 in TF, Et 2 sowie im krist. einstoff n = 2 in TMEDA Typ [AB] 2 sp 2 + vgl. sp 3 N N Li Li N N (Me 3 Si) 3 Li Li (SiMe 3 ) 3 nicht verwechseln! [PhLi(TMEDA)] 2 Benzyl-Li Allyl-Li n = 1 in TF, Et 2 n = 1 in TF n = >10 in Et 2 n = Ketten: kolumnar im Kristall
45 45 Typ [AB] Li 2 Li (SiMe 3 ) 2 Li Li 2 Li (SiMe 3 ) 2 n Li Li Allyl-Li p-li n = 1 in TF, n = kristallisiert kolumnar, sofern frei von Donorliganden Typ [AB] 1 pli + Ph 4 Pl - Lil PPh 4 + Lip Li Li Lithiocen
46 46 Bindungsverhältnisse Li + _ Li Li Li Blick auf Fläche Li + + Li Li Li Li + + _ M's Li Li 4 -Tetraeder 1 axiales sp 3 - (Solvens, 3 -Gruppe der nächsten Li 4 -Einheit) 3 tangentiale sp 3 - (bilden Gruppenorbitale einer Tetraederfläche) Li Li Li Blick auf Spitze Li Li Li + _ + + sp 3 - Li A 1 * Li E (nb).. Li A 1 Li 4z-2e-Bindung Li 3 Gruppenorbitale aus 3 sp 3 -A's Spektroskopische Eigenschaften: siehe Elschenbroich
47 Typische eaktionen von Lihiumorganylen: 47 Solv. "Monomerisierung" exan<benzol<et 2 <TF<DME<TMEDA<MPT (Li) n 'M K t Bu Metallate ( neg. geladene...at-komplexe) [Na(TMEDA)] 3 [LiPh 4 ], Na[BPh 4 ], Li[uMe 2 ] elektropos. Metall als Kation Schlosser-Base aus (EtLi) 6 3 Li K t Bu n unübertroffene Basizität maskiertes K-Ethyl Stereoselektive eaktionen von Lithiumorganylen: arbolithiierung: regio- und stereoselektiv Ph Ph Li TF Li Ph cis-1,2-add. Ph eaktionsgeschwindigkeit MeLi vs. n BuLi = 1:3600 Isopren EtLi Pentan BuLi TMEDA ( Li ) n ausschließlich cis-1,4-addition
48 Additionsfreudigkeit an --Mehrfachbindungen nimmt zu: MgX Li ( 3 Al) 2 48 arbolithiierung unter Ausnutzung des chiralen (-)-Sparteins als Liganden: Deprotonierung unter Ausnutzung von TMEDA bzw. des chiralen (-)-Sparteins als Liganden: Li n BuLi + Fe TMEDA Fe + n Bu Li ebenso Dibenzolchrom Gl.gew.einstellung langsam (nach Zugabe von TMEDA rasch) Lithiierung dient zum Aufbau A A L n M B B ML n planar-chiraler Komplexe / Liganden
49 49 hemoselektive --Knüpfungsreaktionen: Methode zur Synthese von Ketonen und Aldehyden -Li 1) 2) 3 + 1) '-N 2) 3 + NMe 2 ' Steigerung der hemoselektivität und Diastereoselektivität durch Ummetallierung v. Li auf Ti, u, Mn, Zn, Pd, Ni... Beispiel: Ummetallierung von Li auf X 3 Til (X = l, ipr, NMe 2 ; eetz, Seebach > 1980) Toleranz des Ti-rganyls gegenüber funktionellen Gruppen FG = N, N 2, Br etc. Differenzierung der spezifischen eaktivität funktioneller Gruppen, z.b. versus () Differenzierung durch kinet. helatkontrolle Energie diastereotoper Übergangszustände
50 2.2 Magnesiumorganyle 50 Schrägbeziehung Li-Mg, ähnliches Ionenpotential, ähnliche Trends: ohe kovalente Anteile, löslich in Ethern, tert.-aminen, bevorzugte KZ 4 der rganyle -Li(S) 3 u. -MgX(S) 2, stabile Etherate (S), kantenverknüpfte Tetraeder, ohne Solvens: Mehrzentrenbindungen Mg-rganyle weniger reaktiv (selektiver) als Li- rganyle Darstellung von Diorganomagnesium-Verbindungen: Grignard-eaktion, Verschiebung des Schlenk- Gleichgewichts (technisch: Arbeiten in billigeren Kohlenwasserstoffen in Gegenwart von Ethern 2 und Aminen N 3 (= S) Mg + X 2 MgX(S) 2 Dioxan (stöchiom.) [ 2 Mg] n + MgX 2 (Dioxan) 2 (Koord.polymer, Diether) MgX(S) 2 Li 2 Mg(S) Lil EtMgX + p pmgx(s) 220, Vak. [(η ) 2 Mg] + MgX 2 technisch: ydromagnesierung von 1-lefinen in Gegenwart katalytischer Mengen Anthracen / Til 4 Mg Buten 100, Druck n Bu 2 Mg
51 51 ydrierung von Mg gelingt unter milden Bedingungen in Gegenwart des Aktivatorgemisches {Kat.} = {Mg- Anthracen + Übergangsmetallhalogenid, z.b. Til 4, rl 3, Fel 2 }: Mg + 2 {Kat.}, Mg 2 n 2 {Mg 2 ( 2 ) n } Mg 2 wichtig in der Wasserstofftechnologie als ochtemperatur 2 -Speicher: Kurios: Auf Zwischengitterplätzen von kristallinem Mg 2 läßt sich mehr 2 reversibel einlagern ("lösen") als im gleichen Volumen flüssigem Wasserstoff enthalten ist: Mg (akt. Schwamm) + n 2 Mg 2 ( 2 ) n-1 + Energie 2 Gewichtsanteil: 7.7 %, Energiedichte 9000kJ/kg Problem: Zersetzungsdruck 1 atm 2 bei 284 Besonders reaktive Formen des Magnesiums (pyrophor, frei von xid-aut): Mg-Aktivierung für Grignard-eaktion: Mg + I 2, MeI, Br 2-2 Br, l 4 Pyrophores-Mg: Mg Mg + 2 ieke-mg: Mgl K / TF Mg (reagiert auch mit -F oder -) Fürstner: Mgl K Mg (fein verteilt auf Graphit)
52 Bogdanovic: Mg + Mg-Anthracen + Til 4 (katal.) + 2 (für ydromagnesierung) 52 Grignard-Verbindungen [MgX(S)] n Bildungsmechanismus und Schlenk-Gleichgewicht Zunächst adikalreaktion! Elektron ins σ* -M der -X Bdg. Nachweis: adikalfänger TEMP... piperidin-nitroxyl -X e- ET X.. Mg. MgX solv. Mg Mg Mg Mg ohne koord. Solvens S kein Grignard-eagenz N. KZ 4! solv. S Mg X S S Mg X X Mg S -S +S S Mg S S + - S X Mg X -S S S Mg X X + S S Mg +S S S Mg X X Mg unlöslich für S= Dioxan (Polymer) S vergleichsweise schwach gebunden -S Mg Mg Mg n kantenverknüpfte Tetraederkette (vgl. SiS 2 -Struktur) Mg- 3 -Mg Mehrzentrenbdg. in Abwesenheit v. S u. X
53 Nachweis des dynamischen Schlenk-Gleichgewichts: Isotopenmarkierung mit adiomarker 28 Mg: 28 MgBr Mg 2 im thermodynamischen Gleichgewicht alle Teilchen markiert 25 Mg-NM (TF, 37 ): Et 2 Mg (δ 99), EtMgBr (δ 56), MgBr 2 (δ 14); Koaleszenz bei 67 : Beobachtung eines gemittelten Signals infolge rascher Austauschprozesse; dasselbe gilt für 1 - NM Experimente bei eaktivität von X in Grignard-eaktionen: I > Br > l >> F, Alkyl > Ar, Vinyl doch neigen manche -I Verbindungen zu Nebenreaktionen, z.b. β--eliminierung: t Bu-I + Mg Isobuten + [-MgI] t t Bu-l reagiert glatt zu [ Bu-Mgl] 53 Stukturprinzipien von Magnesiumorganylen: Monomere -MgX(S) 2 KZ 4 in Et 2 nur bei hoher Verdünnung < 0.1 M, bei höherer Konzentration Dimere + Ketten. Brückenpositionen werden bevorzugt besetzt durch X = al, X-Brücken bevorzugt vor -Brücken bevorzugt vor -Brücken -Brücken und -Brücken: 3z-2e-Bindungen X-Brücken haben eine andere Qualität:
54 X dient mit freien Elektronenpaaren als 4- oder 6- Elektronen-Ligand mit lokalisierten, dativen 2z-2e- Bindungen. 54 KZ 4 typisch ' ' Mg Mg Mg Mg ' ' kantenverknüpfte Tetraederkette M M M n M= Be, Mg = Me, Ph S Mg Mg S aus Mg 2 + Mg 2 M M M M sp 3 sp 3 sp 3 sp 3 sp 2 sp 3 3z-2e-Bindung l S Mg Mg S l aus Mg' 2 + oder Mg' ( = ') KZ 2 erzwungen KZ 6 (p besetzt 3 faciale Stellen) Me 3 Si SiMe 3 -Mg- Me 3 Si Me 3 Si SiMe 3 SiMe 3 Trisyl-Magnesium Mg Magnesocen sublimierbar bei 50 / 10-3 mbar arbanion-gehaltsbestimmung: Titration mit Diphenylditellurid PhTe-TePh rot + MgX TePh blassgelb + PhTeMgX
55 eaktivitätsprinzipien von Magnesiumorganylen: Nicht ganz so reaktiv wie Lithiumorganyle, dafür aber häufig selektiver und toleranter gegenüber funktionellen Gruppen (FG). Typisch: --Knüpfung und Ummetallierung auf andere Metalle. Bildung von At-Komplexen mit anderen rganylen Mit anderen Metallorganylen, z.b. Li oder Al 3 werden gemischte Dimetall-rganyle gebildet, die einen hohen kovalenten Bindungsanteil besitzen. Das elektronegativere Metall bildet tendenziell das anionische At-Komplexion: EN(Pauling) Li(1.0) < Mg(1.3) < Al(1.6) < Sb(2.0) 55 z.b. [Mg 2 6 ] 2- [Al 2 6 ] isoel. / isostrukt. Mg Mg Mg n Li / TMEDA SbMe 3 Mg [SbMe 4 ] 2 Li [SbMe 4 ], Li-Stibat bekannt Al 2 6 ( = Me) N N Li Mg Mg Li N N Al 2+ Mg Al Li-Magnesiat Kettenendglied Mg-Aluminat Funktionalisierte Grignard-eagenzien über Iod- Magnesium-Austausch bei tiefer Temperatur: Funktioniert mit iprmgl + Ar-Br erst bei + 40 (vgl. BuLi schon bei -80 ) Verwendung von nucleophileren Magnesiaten LiMg 3 bei Aluminiumorganyle / öhere omologe
56 Aluminiumorganyle zeichnen sich aus durch unübertroffene elektrophile eaktivität des 6 VE " 3 Al" (6 VE falls kein Etherkomplex) daraus folgend sehr bereitwillige ydroaluminierung und arbaluminierung von Alkenen und Alkinen kostengünstige technische Produktion (billigstes Aktivmetall in der technischen metallorganischen hemie). 56 Technische Darstellungsverfahren: Trimethylaluminium über die Sesqui-chlorid- Direktsynthese (Fa. üls) "Sesqui" = Al (mit Et 3 Al aktiviert) + 6 Mel 2 Me 3 Al 2 l 3 2 Me 3 Al 2 l 3 Me 4 Al 2 l 2 + Me 2 Al 2 l 4 "Methylaluminium- DMA MAD sesquichlorid" MAS + 2 Nal Me 4 Al 2 l 2 (l) + 2 Na [MeAll 3 ] 3 Me 4 Al 2 l Na 2 Al 2 Me Al + 6 Nal TMA MAD wird durch Zugabe von L.-Base Nal als dem Gleichgewicht entfernt, angereichertes DMA wird durch Natrium reduziert, es disproportioniert.
57 57 Formaler Mechanismus: eduktive Erzeugung subvalenter Al(II) Spezies / Me 2 Al adikale. Sie dimerisieren formal zu "Me 2 Al-AlMe 2 ", das ohne sterischen und elektronischen (hyperkonjugativen) Schutz der Al-Al Bindung mit sich selbst intermolekular reagiert ( Disproportionierung zu Al(0) und Al(III) AlMe 3 ). Für sterisch anspruchsvolle este sind subvalente Verbindungen 2 Al-Al 2 kinetisch stabil (s.u.). Ziegler-Direktverfahren: Vermehrung: oxidative Addition von 2 zu Alkylhydriden, , bar. Al [Et 3 Al] 2 3/n [Et 2 Al] n Anlagerung: ydroaluminierung zu Alkylen , 1-10 bar 3/n [Et 2 Al] n + 3 Ethen 3/2 [Et 3 Al] 2 2 Al Ethen [Et 3 Al] 2 Prinzip: Al reagiert mit 2 nicht zu Al 3, allerdings reagiert Al in Gegenwart v. Et 3 Al mit 2 zu löslichem [Et 2 Al-] 3 (Sechsring über -Brücken), Al- addiert Alkene, anti-markovnikov.
58 58 eaktionsfähigkeit von Al wird durch Zulegieren von % Ti erhöht. Anlagerungsschritt (ydroaluminierung) ist reversibel (β--eliminierung) und die Affinität von Al- zu Alkenen nimmt mit steigendem sterischen Anspruch ab. Verdrängung: Isobuten als höchstalkyliertes Alken, das sich noch hydroaluminieren lässt, wird aus technischen Triisobutylaluminium (TIBA) mit weniger anspruchsvollen lefinen ( n-dodecen Propen Ethen) im Gleichgewicht verdrängt. 2 Al =Me 2 [ i Bu 3 Al] [ i Bu 3 Al] [ i Bu 2 Al-] =Me 2 [ i Bu 2 Al-] Propen [ i Bu 2 ( n Pr)Al] 2 [ n Pr 3 Al] Triisobutylaluminium ist monomer, die Aluminiumalkyle mit kleineren esten dimer (Al--Al 3c2e-Bdg. s.u.). [ i Bu 3 Al] +3 1-Dodecen [( n Dodecyl) 3 Al] + Isobuten Gl.gew. über Sdp. verschieben Weitere Darstellungsmethoden: Al 3 mit = Vinyl, Aryl, Benzyl, tert-butyl geht über oben genannte 2 Methoden nicht! Ausweichen auf klassische Laborverfahren: 3 Ph 2 g + 2 Al 2 Ph 3 Al + 3 g
59 59 3 Li + All 3 3 Al + 3 Lil (in eptan) Problem: Aluminate Li[Al 4 ] Technische Anwendung von Tri(alkyl)aluminium- Verbindungen: 1. erstellung höherkettiger 1-Alkene, synthetischer Fettalkohole und ihrer Sulfate (Tenside) durch Aufbaureaktion (Ziegler): ier gehen die Tonnen AlEt 3 hin "Aufbaureaktion" arbometallierung Ethen Et 3 Al bar Al ( 2 4 ) m Et ( 2 4 ) n Et ( 2 4 ) o Et 2 Al ( 2 4 ) m Et ( 2 4 ) n Et ( 2 4 ) o Et Al 1.β--Eliminierung 2.ydrometallierung Ethen 250 "Verdrangung" Et 3 Al =-( 2 4 ) m,n,o - Konkurrenz zw. arbaluminierung u. β-elimin. bestimmt Kettenlänge m,n,o < 100 m,n,o = Alkyle 2 ydrolyse - Al() 3 3 -( 2 4 ) m,n,o - 1. S 3 2. Na 3 -( 2 4 ) m,n,o -S 3 Fettalkoholsulfate biologisch abbaubare Tenside - Al 2 3 Alox mit extrem hoher berfläche Kat.-Träger Adsorbens Na +
60 2. Katalytische Propen-Dimerisierung: Isopren nach Goodyear-Verfahren: Im Gegensatz zu Ethen dimerisieren höhere 1-Alkene nur 60 Propen- Dimerisierung n Pr 3 Al Synthesekautschuk 1,4-cis-Polyisopren n Pr 2 Al n Pr n Pr Zeolith racken n BuLi Propen n Pr 2 Al 2-Methylpent-1-en - 4 Isopren 3. Ziegler-Natta-Niederdruck-lefinpolimerisation: eterogen: Polyolefine über unlösliche Mischkatalysatoren Al 3 / frühes ÜM-alogenid omogen: über ansa-metallocene (s.u.) / MA (Methylalumoxan = partiell hydrolysiertes Me 3 Al = Lewis-Säure, wandelt l bzw. 3 in nichtkoordinierendes Aluminat-Anion um). Aktuelle ewiews: IUZ 1994, 28, , hem. ev. 2000, eft 4 komplett. Prinzip: Ummetallierung von Al auf Ti führt zu - drastrischer Erniedrigung der E a der arbometallierung - weniger Kettenabbruch durch β- Eliminierung (höhermolekulares PP / PE mit einheitlicher Molmassenverteilung
61 eterogene Phase: ossee-arlman-mechanismus der Ziegler-Natta Niederdruck-lefinpolimerisation ab 1953 Til 4 + Et 3 Al Til 3 + Et 2 All P * l l * l l Mg l l Ti l Propen l Al P P P Ti cis Ti Ti Kristall-Kante / Ecke anti-markownikow mit 2 wechselseitig arbeitenden Koordinationsstellen 61 Modell der "Active Site" eines auf Mgl 2 geträgerten Ti(III)-Alkyls (braune Suspension in KW) hain-end-ontrol der stereoselektiven --Knüpfung im Fall der isotaktischen Propen-Polymerisation (gleich konfigurierte asymm. -Atome in der Kette) omogene Phase: ansa-metallocene (Brintzinger, Ewen) Methylalumoxan MA (Kaminsky) ab 1980 benötigt: latent kationisches, 16 VE stereorigides ansa-metallocen (ansa = enkel) - - Zrl 4 l Zr l MA + Zr Propen P s -symmetrischer Komplex syndiotaktisches PP - - Zrl 4 l Zr l MA Propen + Zr P MA: Al Käfig- Verbindungen 3 Zirconocenium-MA-at 2 -symmetrischer Komplex isotaktisches PP 3 L n Zr l TMA 3 MA + 3 Al L n Zr Ln Zr l 3 3 n inaktiv aktiv: LUM Kontaktionenpaar aktiv in der katalytischen arbometallierung - n
62 62 Alkylalumoxane: Neuere Erkenntnisse zur Kondensation und Struktur von MA-Modellverbindungen Ursprünglich ging man von Ketten und ingen [-Al- ] n aus, doch die Arbeiten von Barron (JAS 1993, 115, 4971) zeigen, dass selbst mit sterisch anspruchsvollen tert-butylgruppen inge [ 2 Al--Al 2 ]n (n = 2, 3 ) Käfige [-Al-]n (n = ) gebildet werden. Wichtigste Strukturmerkmale der Käfigverbindungen: Al (KZ 4), (KZ 3), 6-inge und 4-inge begrenzen Käfig, gespannte 4-inge (Al-) 2 liefern acideres Al, relaxte Sechsringe (Al-) 3 enthalten weniger acides Al. Technisch kontrollierte ydrolyse von Al 3 : us 4 x 5 2 bzw. Al 2 (S 4 ) 3 x 18 2 in Toluol Problem: thermodynamische Instabilität von MA 3 [Me-Al-] Me 3 Al (TMA) + Al 2 3
63 Modellchemie: 2 t Bu 3 Al + 2 [ t Bu 2 Al--Al t Bu 2 ] Butan 63
64 Struktur- und Bindungsverhältnisse von Alanen: 64 Ausgeprägte Dimerisierungstendenz von 3 Al: im Feststoff in der egel dimer in der Lösung Monomer Dimer -Gleichgewichte in der Gasphase in der egel monomer (L.-Säure!) o Al Al Al + Al o Al Al Al Al Modell I Modell II sp 2 sp 3 sp 3 sp 3 sp 3 sp 2 sp 3 sp 2 schwache starke 2e-2c-Bdg. (Al-Al) 2 x 2e-3c-Bdg. 2e-4c-Bdg. (Al 2 2 ) π-bindungsbeteiligung ' Al Al ' ' Al Al sp 3 ' Al ' ~ ~ Al ' 2 Δ = Δ + Δ Al- eorg. ' Al sp 2 Al 2 ' reagiert als Mischung von Al 3, Al 2 ', Al' 2, Al' 3
65 elative Fähigkeit zur Brückenbildung (Δ ) nimmt ab: 65 2 N > > > l > Br > Ph > Ph > Me > Et > i Pr > i Bu > t Bu 2e-2c-Bdg. 2e-3c-Bdg. 2e-3c-Bdg. Lewis-Basizität bestimmt Trend ungesätt. Brücke aumbedarf σ- und π-ww. bestimmt Trend Beispiel X = l 3 Δ : kj/mol Typische eaktionen: 1. arbaluminierung: Die arbaluminierung (s.o.) erfolgt auch an unpolare isolierte >=< und - Bindungen (vgl. Li + MgX nur an konjugierte --Doppelbindungen). Dafür nimmt die eaktivität gegenüber polaren Bindungen N und >= in der eihenfolge Li > MgX > 3 Al ab.
66 2. ydroaluminierung: 66 i Bu 3 Al i Bu 3 Al β--elim. - i Buten [Al 3 ] n Al Al Al = 2 = 2 lefin Al 2 2 Al = Alkyl 97% 3% = Phenyl 75% 25% DIBAL auch 4-ing oder 2n-inge 3. Addukt-Bildung Me 3 Al ist die stärkste Lewis-Säure in der Gruppe 13 Me 3 M Me 3 Al liegt im Gegensatz zu den omologen der Gruppe 13 Me 3 M dimer vor Me 3 Al harte Lewis-Säure Stärke der Donor- Acceptor-Bindung nimmt wie folgt ab: Me 3 N > Me 3 P > Me 2 > Me 2 S 4. Subvalente Aluminium(II,I)-rganyle Synthesen:
67 67 SiMe 3 SiMe 3 Me 3 Si 266 SiMe All + 2 K Al Al Me 3 Si = (SiMe SiMe 3 3 ) 2 K SiMe 3 SiMe 3 = i Bu erstes Al(II)-rganyl (Uhl 1988) [Al ] 2-2 K + closo-dodecaalan(12) Ikosaeder Dialan kinetische (sterische) hyperkonjugative (elektron.) Stabilisierung Alan Al[(SiMe 3 ) 2 ] 3 + Al 2 Al + 2 l Metallverdampfung okondensation langsames Auftauen 1) 1200 K 2) 77 K 2 All + 2 Et 2, Toluol All(Et 2 ) 2 stabile Lösung bis -50 p * 2Mg erstes Al(I)-rganyl Al (Schnöckel 1991) Al Al Subl. 140 I Al in der Gasphase :monomer Al l 2 Al III + [p * All 3 ] öhere omologe M = Ga, In, Tl: Allgemeine Trends Neigung zur Bildung von Dimeren M 3 mit 2e3c- Bindung besteht nur bei "Al 3 "
68 Die Lewis-Aciditäten der Verbindungen M 3 nehmen für die auf Al folgenden Elemente wieder ab: B < Al (max) > Ga > In > Tl 68 Die Stabilität der M- Bindung wie auch der höchsten xidationsstufe nimmt vom B Tl ab. Aufgrund des Effektes des inerten Elektronenpaares sind stabile subvalente In(I) und Tl(I)-rganyle zu erwarten: Die Stabilität der einwertigen Metallorganyle nimmt bei den schwereren omologen zu: Inl Nap (η ) 3 In(III) 150 (η )In(I) Pi-Komplexe mit einwertigem Al, Ga, In, Tl M + M = Ga,In,Tl sp z Isolobal dazu: sp z + M + y M z x M a 1 sp z M p x + + e 1 + p y σ π 1 π 2 3 VE M (Ga,In,Tl) kann auch durch die isolobalen 3 VE Fragmente Be, Mg, B +, Al + Ge +, Sn +, Pb + ausgetauscht werden + M = Ga,In,Tl Arenkomplexe mit Ga(I), In(I), Tl(I) erklärt die Löslichkeit von "Gal 2 " in Benzol, Disprop., es liegt ein π-komplex [(η ) 2 Ga I ] + [Ga III l 4 ] - vor
69 Anwendungen: Ga- und In-rganyle dienen als Dotierungskomponenten in der III-V-albleiterproduktion: MVD-Verfahren: Metal rganic hemical Vapor Deposition 69 ( 3 ) 3 Ga (g) + As 3 (g) GaAs (s) (g) neuerdings auch t BuAs 2 (g) Me 2 In N Me 2 + P 3 oder t BuP InP Schichten Flüchtige und labile Single Source Precuroren (1:1 Verbindungen): Ga-l + Li-As Ga As Me 3 In-PEt 3 monomer in kondensierter Phase, flüchtig, zersetzt sich bei 400 M(I)-Trisyl-Derivate mit Tetrahedran-Struktur: SiMe 3 Me 3 Si SiMe 3 SiMe 3 Δ Tl M = Tl : Me 3 Si SiMe 3 M M M M = (SiMe 3 ) 3 N 2 S 8 Se 8 Te x M = Ga, In X M M X M X X M X =, S, Se, Te.. In Ni(D) 2 - D M und [In] bzw. [Ga] isolobale Liganden leere p x, p y leere π x *, π y * monomer M Ni M M E o E = Ga, In isolobale π-akzeptorliganden
Chemische Bindung. Wie halten Atome zusammen? Welche Atome können sich verbinden? Febr 02
 Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
Chemische Bindung locker bleiben Wie halten Atome zusammen? positiv Welche Atome können sich verbinden? power keep smiling Chemische Bindung Die chemischen Reaktionen spielen sich zwischen den Hüllen der
Eliminierungsreaktionen: E1- und E2- Mechanismen; Olefine
 Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Wird vom Korrektor ausgefüllt: Aufgabe 1 2 3 4 5 6 7 8 9 10 11 12 Punkte
 Klausur zur Vorlesung Grundlagen der Chemie für Mediziner und Biologen & Chemie-Praktikum für Molekulare Medizin und Biologie Gehalten im Wintersemester 2008/2009 Bitte diese 3 Felder ausfüllem: Name Matrikelnummer
Klausur zur Vorlesung Grundlagen der Chemie für Mediziner und Biologen & Chemie-Praktikum für Molekulare Medizin und Biologie Gehalten im Wintersemester 2008/2009 Bitte diese 3 Felder ausfüllem: Name Matrikelnummer
Funktionelle Gruppen Alkohol
 Alkohol Unter Alkohol versteht man (als hemiker) alle Verbindungen, in denen eine ydroxyl-gruppe an ein aliphatisches oder alicyclisches Kohlenstoffgerüst gebunden ist. ydroxylgruppe: funktionelle Gruppe
Alkohol Unter Alkohol versteht man (als hemiker) alle Verbindungen, in denen eine ydroxyl-gruppe an ein aliphatisches oder alicyclisches Kohlenstoffgerüst gebunden ist. ydroxylgruppe: funktionelle Gruppe
Atombau, Periodensystem der Elemente
 Seminar zum Brückenkurs Chemie 2015 Atombau, Periodensystem der Elemente Dr. Jürgen Getzschmann Dresden, 21.09.2015 1. Aufbau des Atomkerns und radioaktiver Zerfall - Erläutern Sie den Aufbau der Atomkerne
Seminar zum Brückenkurs Chemie 2015 Atombau, Periodensystem der Elemente Dr. Jürgen Getzschmann Dresden, 21.09.2015 1. Aufbau des Atomkerns und radioaktiver Zerfall - Erläutern Sie den Aufbau der Atomkerne
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig?
 1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
1) Welche Aussagen über die Hauptgruppenelemente im Periodensystem sind richtig? 1) Es sind alles Metalle. 2) In der äußeren Elektronenschale werden s- bzw. s- und p-orbitale aufgefüllt. 3) Sie stimmen
Kapitel 8 MO-Verbindungen der Übergangsmetalle - Bindungsverhältnisse und Strukturen
 Kapitel 8 MO-Verbindungen der Übergangsmetalle - Bindungsverhältnisse und Strukturen 8.1 Vergleich Hauptgruppen-Nebengruppen Hauptgruppen (p-block) Bindigkeit: entsprechend der 8-n-Regel (Ausnahme: hypervalente
Kapitel 8 MO-Verbindungen der Übergangsmetalle - Bindungsverhältnisse und Strukturen 8.1 Vergleich Hauptgruppen-Nebengruppen Hauptgruppen (p-block) Bindigkeit: entsprechend der 8-n-Regel (Ausnahme: hypervalente
Oxidation und Reduktion Redoxreaktionen Blatt 1/5
 Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Organische Chemie I Chemie am 16.11.2012. Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2
 Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 6 Entropie und Gibbs Enthalpie Gibbs-elmholtz-Gleichung Absolute Entropien Gibbs Standardbildungsenthalpien Kinetik
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 6 Entropie und Gibbs Enthalpie Gibbs-elmholtz-Gleichung Absolute Entropien Gibbs Standardbildungsenthalpien Kinetik
Carbonyl- und Enolatchemie
 Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
Metallorganik Teil 2. OFP-Seminar. Marburg, 31.01.06
 Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
Homologe Reihe. Alkane. Alkene. Alkine
 GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
GW Chemie 8.-10. NTG GA omologe eihe eihung von Stoffen, deren Moleküle sich durch eine sich wiederholende Einheit unterscheiden. Bsp.: Methan Ethan Propan Butan usw. unterscheiden sich durch je eine C
Organische Moleküle. Verschiedene Ansichten des Methans
 Organische Räumlicher Bau, Elektronendichteverteilungen Verschiedene Ansichten des Methans Ansicht des Methans mit seiner Elektronenhülle (Solid-Darstellung) Ansicht des Methans mit seiner Elektronenhülle
Organische Räumlicher Bau, Elektronendichteverteilungen Verschiedene Ansichten des Methans Ansicht des Methans mit seiner Elektronenhülle (Solid-Darstellung) Ansicht des Methans mit seiner Elektronenhülle
Moderne Aldol-Reaktionen
 Moderne Aldol-Reaktionen Katrina Brendle Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktium KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum in der Helmholtz-Gemeinschaft
Moderne Aldol-Reaktionen Katrina Brendle Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktium KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum in der Helmholtz-Gemeinschaft
Übergangsmetall-π-Komplexe
 Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Klausur - Lösungsbogen
 Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Bereich der 1 H-chemischen Verschiebung (Abb. nach: Friebolin)
 Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Bereich der 1 -chemischen Verschiebung (Abb. nach: Friebolin) 1 -NM-Spektroskopie 1 Der esonanzbereich der Protonen in organischen Molekülen ist ca. 10 ppm breit. Nur saure Protonen (z.b. COO oder SO 3
Übergangsmetall-π-Komplexe
 Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Redoxreaktionen. Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden
 Nach Lavoisier: : Redoxreaktionen Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden Aufnahme von Sauerstoff zb.: Verbrennen von Magnesium : Abgabe von Sauerstoff
Nach Lavoisier: : Redoxreaktionen Redoxreaktionen: Reaktionen bei denen Elektronen zwischen den Komponenten übertragen werden Aufnahme von Sauerstoff zb.: Verbrennen von Magnesium : Abgabe von Sauerstoff
Grundlagen. Maximilian Ernestus Waldorfschule Saarbrücken
 Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Grundlagen Maximilian Ernestus Waldorfschule Saarbrücken 2008/2009 Inhaltsverzeichnis 1 Chemische Elemente 2 2 Das Teilchenmodell 3 3 Mischungen und Trennverfahren 4 4 Grundgesetze chemischer Reaktionen
Chemie Zusammenfassung KA 2
 Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
Allotrope Kohlenstoffmodifikationen. Ein Vortrag von Patrick Knicknie. Datum: 04.05.06 Raum:112
 Allotrope Kohlenstoffmodifikationen Ein Vortrag von Patrick Knicknie Datum: 04.05.06 Raum:112 Themen: 1. Was ist Allotrop? 2. Unterschiedliche Kohlenstoffmodifikationen 3. Der Graphit 4. Der Diamant 5.
Allotrope Kohlenstoffmodifikationen Ein Vortrag von Patrick Knicknie Datum: 04.05.06 Raum:112 Themen: 1. Was ist Allotrop? 2. Unterschiedliche Kohlenstoffmodifikationen 3. Der Graphit 4. Der Diamant 5.
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Anorganische Chemie III
 Seminar zu Vorlesung Anorganische Chemie III Wintersemester 01/13 Christoph Wölper Universität Duisburg-Essen Koordinationszahlen Ionenradien # dichteste Packung mit 1 Nachbarn -> in Ionengittern weniger
Seminar zu Vorlesung Anorganische Chemie III Wintersemester 01/13 Christoph Wölper Universität Duisburg-Essen Koordinationszahlen Ionenradien # dichteste Packung mit 1 Nachbarn -> in Ionengittern weniger
Thermodynamik. Basics. Dietmar Pflumm: KSR/MSE. April 2008
 Thermodynamik Basics Dietmar Pflumm: KSR/MSE Thermodynamik Definition Die Thermodynamik... ist eine allgemeine Energielehre als Teilgebiet der Chemie befasst sie sich mit den Gesetzmässigkeiten der Umwandlungsvorgänge
Thermodynamik Basics Dietmar Pflumm: KSR/MSE Thermodynamik Definition Die Thermodynamik... ist eine allgemeine Energielehre als Teilgebiet der Chemie befasst sie sich mit den Gesetzmässigkeiten der Umwandlungsvorgänge
Alkylwanderungen. Mechanismus: HCl. HCl. Cl β-pinen. Bornylchlorid. OC4_folie185
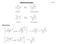 Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen
 Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
Wiederholung der letzten Vorlesungsstunde: Thema: Das wellenmechanische h Atommodell (Orbitalmodell) ll) Zustände der Elektronen sind Orbitale, die durch 4 Quantenzahlen beschrieben werden, Hauptquantenzahl
Professionelle Seminare im Bereich MS-Office
 Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik
 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1 6. Tag: Chemisches Gleichgewicht und Reaktionskinetik 1. Das chemische Gleichgewicht Eine chemische Reaktion läuft in beiden Richtungen ab. Wenn
Katalysatoren - Chemische Partnervermittlung im virtuellen Labor
 Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Seite 1 von 6 Katalysatoren - Chemische Partnervermittlung im virtuellen Labor Katalysatoren Der Katalysator in der Großindustrie Was passiert im Inneren? Das virtuelle Labor. Katalysatoren Katalysatoren
Einheiten und Einheitenrechnungen
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 1: allgemeine Chemie, einfache Berechnungen, Periodensystem, Orbitalbesetzung, Metalle und Salze Einheiten und Einheitenrechnungen
1. Man schreibe die folgenden Aussagen jeweils in einen normalen Satz um. Zum Beispiel kann man die Aussage:
 Zählen und Zahlbereiche Übungsblatt 1 1. Man schreibe die folgenden Aussagen jeweils in einen normalen Satz um. Zum Beispiel kann man die Aussage: Für alle m, n N gilt m + n = n + m. in den Satz umschreiben:
Zählen und Zahlbereiche Übungsblatt 1 1. Man schreibe die folgenden Aussagen jeweils in einen normalen Satz um. Zum Beispiel kann man die Aussage: Für alle m, n N gilt m + n = n + m. in den Satz umschreiben:
UV/VIS-Spektroskopie
 UV/VIS-Spektroskopie Dies ist die älteste spektroskopische Methode, die aber wegen begrenzter Aussagekraft heute in der Praxis keine allzu große Rolle mehr spielt. Es werden elektronische Übergänge angeregt,
UV/VIS-Spektroskopie Dies ist die älteste spektroskopische Methode, die aber wegen begrenzter Aussagekraft heute in der Praxis keine allzu große Rolle mehr spielt. Es werden elektronische Übergänge angeregt,
GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie
 Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und Reaktionen Reinstoff Element Kann chemisch nicht mehr zerlegt
Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und Reaktionen Reinstoff Element Kann chemisch nicht mehr zerlegt
2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände
 2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände Als Fettsäuren wird die Gruppe aliphatischer Monocarbonsäuren bezeichnet. Der Name Fettsäuren geht darauf
2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände Als Fettsäuren wird die Gruppe aliphatischer Monocarbonsäuren bezeichnet. Der Name Fettsäuren geht darauf
1.4. Die Darstellung von Strukturen
 1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
Grundlagen der Chemie Polare Bindungen
 Polare Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Elektronegativität Unter der Elektronegativität
Polare Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Elektronegativität Unter der Elektronegativität
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Hydrierung von Kohlenmonoxid zu Methanol Kataly?sche Umsetzung von Ethen mit Wasser zu Ethanol
 Oxida&onsreak&onen Von Alkenen und Alkokolen zu Aldehyden, Ketonen und Carbonsäuren H. Wünsch 2012 1 Vorbemerkung Grundlage der hier betrachteten Reak?onen sind Alkene und Alkohole. Alkohole sind Produkte
Oxida&onsreak&onen Von Alkenen und Alkokolen zu Aldehyden, Ketonen und Carbonsäuren H. Wünsch 2012 1 Vorbemerkung Grundlage der hier betrachteten Reak?onen sind Alkene und Alkohole. Alkohole sind Produkte
Typische Eigenschaften von Metallen
 Typische Eigenschaften von Metallen hohe elektrische Leitfähigkeit (nimmt mit steigender Temperatur ab) hohe Wärmeleitfähigkeit leichte Verformbarkeit metallischer Glanz Elektronengas-Modell eines Metalls
Typische Eigenschaften von Metallen hohe elektrische Leitfähigkeit (nimmt mit steigender Temperatur ab) hohe Wärmeleitfähigkeit leichte Verformbarkeit metallischer Glanz Elektronengas-Modell eines Metalls
Christian-Ernst-Gymnasium
 Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und en Element kann chemisch nicht mehr zerlegt werden Teilchen
Christian-Ernst-Gymnasium Am Langemarckplatz 2 91054 ERLANGEN GRUNDWISSEN CHEMIE 9 - MuG erstellt von der Fachschaft Chemie C 9.1 Stoffe und en Element kann chemisch nicht mehr zerlegt werden Teilchen
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
1. Einleitung und Aufgabenstellung
 1. Einleitung und Aufgabenstellung 1 1. Einleitung und Aufgabenstellung Reaktionen von starken Elektronenakzeptoren mit Amidinen und Aminen sind seit den Arbeiten von Rappoport et al. [1] in den 60-er
1. Einleitung und Aufgabenstellung 1 1. Einleitung und Aufgabenstellung Reaktionen von starken Elektronenakzeptoren mit Amidinen und Aminen sind seit den Arbeiten von Rappoport et al. [1] in den 60-er
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2015
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2015 Nachtrag Aromatische Substitution Sicherheitsbelehrung: Regeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse September
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2015 Nachtrag Aromatische Substitution Sicherheitsbelehrung: Regeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse September
Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015
 Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015 Name: Vorname: Matrikel-Nr.: geborenam: in: Wiederholer dieser Klausur:
Studiengang Biowissenschaften Modulbegleitende Prüfung zum Praktikum in Organischer Chemie (gemäß MPO vom 12.09.2005) 21.07.2015 Name: Vorname: Matrikel-Nr.: geborenam: in: Wiederholer dieser Klausur:
Quantenzahlen. Magnetquantenzahl m => entspricht der Zahl und Orien- (m = -l, -(l-1) 0 +(l-1), +l) tierung der Orbitale in jeder Unterschale.
 Quantenzahlen Magnetquantenzahl m => entspricht der Zahl und Orien- (m = -l, -(l-1) 0 +(l-1), +l) tierung der Orbitale in jeder Unterschale. l = 0, 1, 2, 3, (Orbital-)Symbol s, p, d, f, Zahl der Orbitale
Quantenzahlen Magnetquantenzahl m => entspricht der Zahl und Orien- (m = -l, -(l-1) 0 +(l-1), +l) tierung der Orbitale in jeder Unterschale. l = 0, 1, 2, 3, (Orbital-)Symbol s, p, d, f, Zahl der Orbitale
Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch. Reinstoff, Element, Verbindung. Zweiatomige Elemente.
 1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
1 1 Einteilung der Stoffe: Stoff, Reinstoff, Gemisch, homogenes Gemisch, heterogenes Gemisch Stoff Reinstoff Mischen Gemisch Bei gleichen Bedingungen (Temperatur, Druck) immer gleiche Eigenschaften (z.b.
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m(h) = 1 u
 Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Analytische Chemie Stöchiometrie Absolute Atommasse Die Einheit der Atommasse m ist u. Das ist der 12. Teil der Masse eines Kohlenstoffatoms. 1 u = 1,6608 * 10-27 kg m() = 1 u Stoffmenge n Die Stoffmenge
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 17 xidation und eduktion Dr. ermann A. Wegner hermann.wegner@unibas.ch xidationszahlen in organisch chemischen Verbindungen Bestimmung
eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 17 xidation und eduktion Dr. ermann A. Wegner hermann.wegner@unibas.ch xidationszahlen in organisch chemischen Verbindungen Bestimmung
Klausur WS 03/04. 1 Schutzgruppen 10
 Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
Christine Peetz (OStRin B/C) Seite 1
 Ist Wasser ein DipolMolekül? Mit einem einfachen kann man untersuchen, ob eine Flüssigkeit ein Dipol ist. Es liegen nachfolgende Flüssigkeiten vor. Definition: Moleküle, bei denen die positiven und negativen
Ist Wasser ein DipolMolekül? Mit einem einfachen kann man untersuchen, ob eine Flüssigkeit ein Dipol ist. Es liegen nachfolgende Flüssigkeiten vor. Definition: Moleküle, bei denen die positiven und negativen
Übungsblatt zu Säuren und Basen
 1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
Organisch-Chemisches Grundpraktikum. trans-1,2-cyclohexandiol
 rganischhemisches Grundpraktikum Präparat 06: trans1,2yclohexandiol Gliederung: I. Literatur... 1 II. Präparateigenschaften... 1 III. Stöchiometrische Reaktionsgleichung... 1 IV. Reaktionsmechanismus...
rganischhemisches Grundpraktikum Präparat 06: trans1,2yclohexandiol Gliederung: I. Literatur... 1 II. Präparateigenschaften... 1 III. Stöchiometrische Reaktionsgleichung... 1 IV. Reaktionsmechanismus...
Physikalische Eigenschaften der Alkohole
 Physikalische Eigenschaften der Alkohole Die Struktur von Alkoholen ist ähnlich der von Wasser 96pm 110pm 143pm 96pm Methanol 109 104.5 108.9 I_folie228 Wasserstoffbrückenbindungen: BDE = 21KJ/mol 207pm
Physikalische Eigenschaften der Alkohole Die Struktur von Alkoholen ist ähnlich der von Wasser 96pm 110pm 143pm 96pm Methanol 109 104.5 108.9 I_folie228 Wasserstoffbrückenbindungen: BDE = 21KJ/mol 207pm
Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s 2 3p 6. Geben Sie isoelektronische Ionen zu den folgenden Atomen an
 Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Übung 05.11.13 Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 Ne / F - / O 2- / N 3- / Na + / Mg 2+ / Al 3+. Welches Element / Ion hat die Elektronenkonfiguration 1s 2 2s 2 2p 6 3s
Abb. 1: Exotherme und endotherme Reaktionen Quelle: http://www.seilnacht.com/lexikon/aktivi.htm#diagramm
 Energie bei chemischen Reaktionen Chemische Reaktionen sind Stoffumwandlungen bei denen Teilchen umgeordnet und chemische Bindungen gespalten und neu geknüpft werden, wodurch neue Stoffe mit neuen Eigenschaften
Energie bei chemischen Reaktionen Chemische Reaktionen sind Stoffumwandlungen bei denen Teilchen umgeordnet und chemische Bindungen gespalten und neu geknüpft werden, wodurch neue Stoffe mit neuen Eigenschaften
VIOSIL SQ FUSED SILICA (SYNTHETISCHES QUARZGLAS)
 VIOSIL SQ FUSED SILICA (SYNTHETISCHES QUARZGLAS) Beschreibung VIOSIL SQ wird von ShinEtsu in Japan hergestellt. Es ist ein sehr klares (transparentes) und reines synthetisches Quarzglas. Es besitzt, da
VIOSIL SQ FUSED SILICA (SYNTHETISCHES QUARZGLAS) Beschreibung VIOSIL SQ wird von ShinEtsu in Japan hergestellt. Es ist ein sehr klares (transparentes) und reines synthetisches Quarzglas. Es besitzt, da
Video Unlimited -Nutzungsbeschränkungen
 Video Unlimited -Nutzungsbeschränkungen In diesem Dokument werden Beschränkungen erklärt, die für die Verwendung von Videos gelten, die Sie über Video Unlimited -Dienste gekauft oder ausgeliehen haben
Video Unlimited -Nutzungsbeschränkungen In diesem Dokument werden Beschränkungen erklärt, die für die Verwendung von Videos gelten, die Sie über Video Unlimited -Dienste gekauft oder ausgeliehen haben
Rolle des Katalysators
 olle des Katalysators Aktivierungsenergie der unkatalysierten eaktion Aktivierungsenergie der katalysierten eaktion Energie E a E a ' Edukte nicht katalysierte eaktion eaktion mit Katalysator zu stark
olle des Katalysators Aktivierungsenergie der unkatalysierten eaktion Aktivierungsenergie der katalysierten eaktion Energie E a E a ' Edukte nicht katalysierte eaktion eaktion mit Katalysator zu stark
Grundwissen Chemie. Jahrgangsstufe 9 (SG) von Christiane Markreiter und Thomas Gerl
 Grundwissen Chemie Jahrgangsstufe 9 (SG) von Christiane Markreiter und Thomas Gerl Ludwig-Thoma-Gymnasium Seestr. 25b 83209 Prien am Chiemsee Tel.: 08051 / 96 404 0 Fax.: 08051 / 96 404 100 thomas.gerl@gmx.de
Grundwissen Chemie Jahrgangsstufe 9 (SG) von Christiane Markreiter und Thomas Gerl Ludwig-Thoma-Gymnasium Seestr. 25b 83209 Prien am Chiemsee Tel.: 08051 / 96 404 0 Fax.: 08051 / 96 404 100 thomas.gerl@gmx.de
Thema: Chemische Bindungen Wasserstoffbrückenbindungen
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen Wasserstoffbrückenbindungen Wasserstoffbrückenbindungen, polare H-X-Bindungen, Wasser, Eigenschaften des Wassers, andere Vbg. mit H-Brücken
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen Wasserstoffbrückenbindungen Wasserstoffbrückenbindungen, polare H-X-Bindungen, Wasser, Eigenschaften des Wassers, andere Vbg. mit H-Brücken
Grundwissen Chemie - 9. Jahrgangsstufe
 1. Betrachtungsebenen: Stoffebene Teilchenebene Charakteristisch für die Denkweise der Chemie sind zwei Betrachtungsebenen Stoffportion: Reinstoff: Beobachtungen an Stoffportionen und Reaktionen (Fakten,
1. Betrachtungsebenen: Stoffebene Teilchenebene Charakteristisch für die Denkweise der Chemie sind zwei Betrachtungsebenen Stoffportion: Reinstoff: Beobachtungen an Stoffportionen und Reaktionen (Fakten,
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Übung zur Vorlesung Organische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 O 2 N
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Grundlagen der Elektronik
 Grundlagen der Elektronik Wiederholung: Elektrische Größen Die elektrische Stromstärke I in A gibt an,... wie viele Elektronen sich pro Sekunde durch den Querschnitt eines Leiters bewegen. Die elektrische
Grundlagen der Elektronik Wiederholung: Elektrische Größen Die elektrische Stromstärke I in A gibt an,... wie viele Elektronen sich pro Sekunde durch den Querschnitt eines Leiters bewegen. Die elektrische
3 Gestreckte Abschlussprüfung, Teil 1 Allgemeine und Präparative Chemie
 43 3 Gestreckte Abschlussprüfung, Teil 1 Allgemeine und Präparative Chemie 3.1 Atombau, chemische Bindung, Periodensystem der Elemente 3.1.1 Elektronegativität und Beurteilung der Polarität Zur Beurteilung
43 3 Gestreckte Abschlussprüfung, Teil 1 Allgemeine und Präparative Chemie 3.1 Atombau, chemische Bindung, Periodensystem der Elemente 3.1.1 Elektronegativität und Beurteilung der Polarität Zur Beurteilung
Redox- Titrationen PAC I - QUANTITATIVE ANALYSE ANALYTIK I IAAC, TU-BS, 2004. Manganometrie. Bestimmung von Eisen(III) in salzsaurer Lösung
 Redox Titrationen ANALYTK AAC, TUBS, 2004 Dr. Andreas Martens a.mvs@tubs.de nstitut f. Anorg.u. Analyt. Chemie, Technische Universität Braunschweig, Braunschweig, Germany PAC QUANTTATVE ANALYSE Manganometrie
Redox Titrationen ANALYTK AAC, TUBS, 2004 Dr. Andreas Martens a.mvs@tubs.de nstitut f. Anorg.u. Analyt. Chemie, Technische Universität Braunschweig, Braunschweig, Germany PAC QUANTTATVE ANALYSE Manganometrie
Grundbegriffe der Informatik
 Grundbegriffe der Informatik Einheit 15: Reguläre Ausdrücke und rechtslineare Grammatiken Thomas Worsch Universität Karlsruhe, Fakultät für Informatik Wintersemester 2008/2009 1/25 Was kann man mit endlichen
Grundbegriffe der Informatik Einheit 15: Reguläre Ausdrücke und rechtslineare Grammatiken Thomas Worsch Universität Karlsruhe, Fakultät für Informatik Wintersemester 2008/2009 1/25 Was kann man mit endlichen
3.4. Leitungsmechanismen
 a) Metalle 3.4. Leitungsmechanismen - Metall besteht aus positiv geladenen Metallionen und frei beweglichen Leitungselektronen (freie Elektronengas), Bsp.: Cu 2+ + 2e - - elektrische Leitung durch freie
a) Metalle 3.4. Leitungsmechanismen - Metall besteht aus positiv geladenen Metallionen und frei beweglichen Leitungselektronen (freie Elektronengas), Bsp.: Cu 2+ + 2e - - elektrische Leitung durch freie
Grundlagen des Periodensystems der Elemente
 Aus der regelmäßigen Wiederholung ähnlicher Eigenschaften der Elemente leitete Mendelejew das Gesetz der Periodizität ab. Diese Periodizität liegt im Aufbau der Atomhülle begründet. Atomradius Als Atomradius
Aus der regelmäßigen Wiederholung ähnlicher Eigenschaften der Elemente leitete Mendelejew das Gesetz der Periodizität ab. Diese Periodizität liegt im Aufbau der Atomhülle begründet. Atomradius Als Atomradius
Werkstoffkunde Chemische Bindungsarten
 Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Folie 1/27 Die Elektronen auf der äußersten Schale eines Atoms (Außenelektronen oder Valenzelektronen genannt) bestimmen maßgeblich die chemischen Eigenschaften. Jedes Atom hat dabei das Bestreben die
Der Schmelzpunkt von Salzen
 Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
Der Schmelzpunkt von Salzen Vergleich die Smp. der Salze (links). Welche Rolle könnten die Ionenradien bzw. die Ladung der enthaltenen Ionen spielen? Der Schmelzpunkt von Salzen ist i.d.r. sehr hoch. Er
CCI Swing Strategie. Cut your losers short and let your winners run
 CCI Swing Strategie Cut your losers short and let your winners run Charts: - H4 - Daily Indikatoren: - Simple Moving Average (200) - Commodity Channel Index CCI (20 Period) - Fractals Strategie: 1. Identifizieren
CCI Swing Strategie Cut your losers short and let your winners run Charts: - H4 - Daily Indikatoren: - Simple Moving Average (200) - Commodity Channel Index CCI (20 Period) - Fractals Strategie: 1. Identifizieren
2. Chemische Bindungen 2.1
 2. Chemische Bindungen 2.1 Chemische Bindungen Deutung von Mischungsversuchen Benzin und Wasser mischen sich nicht. Benzin ist somit eine hydrophobe Flüssigkeit. Auch die Siedepunkte der beiden Substanzen
2. Chemische Bindungen 2.1 Chemische Bindungen Deutung von Mischungsversuchen Benzin und Wasser mischen sich nicht. Benzin ist somit eine hydrophobe Flüssigkeit. Auch die Siedepunkte der beiden Substanzen
SUPERABSORBER. Eine Präsentation von Johannes Schlüter und Thomas Luckert
 SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
SUPERABSORBER Eine Präsentation von Johannes Schlüter und Thomas Luckert Inhalt: Die Windel Die Technik des Superabsorbers Anwendungsgebiete des Superabsorbers Ein kurzer Abriss aus der Geschichte der
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6
 Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
7.9 Reaktionen mit Kohlenstoff-Nucleophilen
 7.9 eaktionen mit Kohlenstoff-Nucleophilen Die Addition von yanwasserstoff ist reversibel und wird durch Basen katalysiert. N N N yanhydrin Beim Behandeln der yanhydrine mit einer stöchiometrischen Menge
7.9 eaktionen mit Kohlenstoff-Nucleophilen Die Addition von yanwasserstoff ist reversibel und wird durch Basen katalysiert. N N N yanhydrin Beim Behandeln der yanhydrine mit einer stöchiometrischen Menge
Chemie für Biologen. Vorlesung im. WS 2004/05 V2, Mi 10-12, S04 T01 A02. Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen
 Chemie für Biologen Vorlesung im WS 200/05 V2, Mi 10-12, S0 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil : 03.11.200) MILESS: Chemie für Biologen 66 Chemische
Chemie für Biologen Vorlesung im WS 200/05 V2, Mi 10-12, S0 T01 A02 Paul Rademacher Institut für Organische Chemie der Universität Duisburg-Essen (Teil : 03.11.200) MILESS: Chemie für Biologen 66 Chemische
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Primzahlen und RSA-Verschlüsselung
 Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Gegeben sind die folgenden Werte kovalenter Bindungsenthalpien:
 Literatur: Housecroft Chemistry, Kap. 22.1011 1. Vervollständigen Sie folgende, stöchiometrisch nicht ausgeglichene Reaktions gleichungen von Sauerstoffverbindungen. Die korrekten stöchiometrischen Faktoren
Literatur: Housecroft Chemistry, Kap. 22.1011 1. Vervollständigen Sie folgende, stöchiometrisch nicht ausgeglichene Reaktions gleichungen von Sauerstoffverbindungen. Die korrekten stöchiometrischen Faktoren
14. Minimale Schichtdicken von PEEK und PPS im Schlauchreckprozeß und im Rheotensversuch
 14. Minimale Schichtdicken von PEEK und PPS im Schlauchreckprozeß und im Rheotensversuch Analog zu den Untersuchungen an LDPE in Kap. 6 war zu untersuchen, ob auch für die Hochtemperatur-Thermoplaste aus
14. Minimale Schichtdicken von PEEK und PPS im Schlauchreckprozeß und im Rheotensversuch Analog zu den Untersuchungen an LDPE in Kap. 6 war zu untersuchen, ob auch für die Hochtemperatur-Thermoplaste aus
Mobile Intranet in Unternehmen
 Mobile Intranet in Unternehmen Ergebnisse einer Umfrage unter Intranet Verantwortlichen aexea GmbH - communication. content. consulting Augustenstraße 15 70178 Stuttgart Tel: 0711 87035490 Mobile Intranet
Mobile Intranet in Unternehmen Ergebnisse einer Umfrage unter Intranet Verantwortlichen aexea GmbH - communication. content. consulting Augustenstraße 15 70178 Stuttgart Tel: 0711 87035490 Mobile Intranet
Chemische Bindung. Chemische Bindung
 Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
Chemische Bindung Atome verbinden sich zu Molekülen oder Gittern, um eine Edelgaskonfiguration zu erreichen. Es gibt drei verschiedene Arten der chemischen Bindung: Atombindung Chemische Bindung Gesetz
2.8 Grenzflächeneffekte
 - 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
- 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
Selbst-Test zur Vorab-Einschätzung zum Vorkurs Chemie für Mediziner
 Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Übungen zur VL Chemie für Biologen und Humanbiologen 04.11.2011 Lösung Übung 2
 Übungen zur VL Chemie für Biologen und Humanbiologen 04.11.2011 Lösung Übung 2 1. Wie viel mol Eisen sind in 12 x 10 23 Molekülen enthalten? ca. 2 Mol 2. Welches Volumen Litern ergibt sich wenn ich 3 mol
Übungen zur VL Chemie für Biologen und Humanbiologen 04.11.2011 Lösung Übung 2 1. Wie viel mol Eisen sind in 12 x 10 23 Molekülen enthalten? ca. 2 Mol 2. Welches Volumen Litern ergibt sich wenn ich 3 mol
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht
 8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
Lineare Gleichungssysteme
 Lineare Gleichungssysteme 1 Zwei Gleichungen mit zwei Unbekannten Es kommt häufig vor, dass man nicht mit einer Variablen alleine auskommt, um ein Problem zu lösen. Das folgende Beispiel soll dies verdeutlichen
Lineare Gleichungssysteme 1 Zwei Gleichungen mit zwei Unbekannten Es kommt häufig vor, dass man nicht mit einer Variablen alleine auskommt, um ein Problem zu lösen. Das folgende Beispiel soll dies verdeutlichen
AGROPLUS Buchhaltung. Daten-Server und Sicherheitskopie. Version vom 21.10.2013b
 AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
A1.7: Entropie natürlicher Texte
 A1.7: Entropie natürlicher Texte Anfang der 1950er Jahre hat Claude E. Shannon die Entropie H der englischen Sprache mit einem bit pro Zeichen abgeschätzt. Kurz darauf kam Karl Küpfmüller bei einer empirischen
A1.7: Entropie natürlicher Texte Anfang der 1950er Jahre hat Claude E. Shannon die Entropie H der englischen Sprache mit einem bit pro Zeichen abgeschätzt. Kurz darauf kam Karl Küpfmüller bei einer empirischen
WasserKreuzworträtsel
 Wasser als Lösungsmittel ARBEITSBLATT WasserKreuzworträtsel Teste dein WasserWissen! Um dir etwas zu helfen, haben wir dir ein paar Buchstaben bereits richtig eingesetzt. Tipp: Bei der WasserWerkstatt
Wasser als Lösungsmittel ARBEITSBLATT WasserKreuzworträtsel Teste dein WasserWissen! Um dir etwas zu helfen, haben wir dir ein paar Buchstaben bereits richtig eingesetzt. Tipp: Bei der WasserWerkstatt
Schneiden der Alkalimetalle und Autoxidation
 Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 g KO 2 s Zeitbedarf Vorbereitung: 1 min. Durchführung: 10 min. Nachbereitung: 1 min. Chemikalienliste Edukte Chemikalien
Reaktionsgleichungen 4 Li s + O 2 g 2 Li 2 O s 2 Na s + O 2 g Na 2 O 2 s K s + O 2 g KO 2 s Zeitbedarf Vorbereitung: 1 min. Durchführung: 10 min. Nachbereitung: 1 min. Chemikalienliste Edukte Chemikalien
