Inzidenz und Risikofaktoren des sekundären Lymphödems nach Therapie des Mammakarzinoms
|
|
|
- Lilli Färber
- vor 6 Jahren
- Abrufe
Transkript
1 Aus der Klinik für Frauenheilkunde der Albert-Ludwigs-Universität Freiburg im Breisgau Inzidenz und Risikofaktoren des sekundären Lymphödems nach Therapie des Mammakarzinoms I N AU G U R AL - D I S S E R T AT I O N zur Erlangung des Medizinischen Doktorgrades der Medizinischen Fakultät der Albert-Ludwigs-Universität Freiburg im Breisgau Vorgelegt 2015 von Negar Vaezipour geboren in Teheran, Iran
2 Dekanin: Prof. Dr. Kerstin Krieglstein 1. Gutachter: Prof. Dr. med. Annette Hasenburg 2. Gutachter: Prof. Dr. med. Etelka Földi Jahr der Promotion: 2016
3 Meiner Familie
4
5 I Inhalt 1 Einleitung Einführung Das Lymphödem Definition Pathophysiologie Ätiologie Stadieneinteilung Diagnostik und Differentialdiagnostik Therapie Komplikationen, Verlauf und Prognose Das sekundäre Lymphödem nach Mammakarzinomtherapie Anatomie und Physiologie Inzidenz Risikofaktoren Das sekundäre Lymphödem der Brust Ziele der Arbeit Einfluss lokaler Therapieverfahren Einfluss systemischer Therapieverfahren Individuelle Faktoren Material und Methoden Studiendesign Patientinnenkollektiv Ausschlusskriterien Datenerhebung Anamnese und klinische Untersuchung Volumenmessung Auswertung der Messungen und Statistik Ergebnisse Patientinnenkollektiv Übersicht der Ergebnisse Analyse der Ergebnisse Deskriptive Analyse des Gesamtkollektivs Patientinnencharakteristika...20
6 II Tumorcharakteristika Art und Verlauf der Tumortherapie Operative Therapie Systemische Therapie Radiatio Rezidiv-Operationen Vorliegen lymphologisch relevanter Begleiterkrankungen Körperliche Beanspruchung Deskriptive Analyse des Patientinnenkollektivs mit Lymphödem Alter bei Auftreten des Lymphödems, Latenzzeit und Lokalisation Anamnese des Lymphödems unseres Patientinnenkollektivs Klinik des Lymphödems unseres Patientinnenkollektivs Therapie des Lymphödems bei unserem Patientenkollektiv Zusammenhangsanalyse Analyse mit logistischer Regression Univariate Analyse Patientinnencharakteristika und Lymphödemrisiko Tumorcharakteristika und Lymphödemrisiko Therapie des Mammakarzinoms und Lymphödemrisiko Operative Therapie und Lymphödemrisiko Adjuvante Radiatio und Lymphödemrisiko Systemische Therapie und Lymphödemrisiko Begleiterkrankungen und Lymphödemrisiko Körperliche Beanspruchung und Lymphödemrisiko Multivariate Analyse der logistischen Regressionsanalyse Analyse mit der Cox Regression Univariate Analyse Patientinnencharakteristika und Lymphödemrisiko Tumorcharakteristika und Lymphödemrisiko Therapie des Mammakarzinom und Lymphödemrisiko Operative Therapie und Lymphödemrisiko Adjuvante Radiatio und Lymphödemrisiko Systemische Therapie und Lymphödemrisiko Begleiterkrankungen und Lymphödemrisiko Körperliche Beanspruchung und Lymphödemrisiko Multivariate Analyse der Cox- Regressionsanalyse...40
7 III Zusammenhangsanalyse des reines Brustlymphödems in Abhängigkeit Patientinnen- Tumor- und Therapiebezogener Faktoren Zusammenfassung der Ergebnisse Erhöhter BMI Nodalstatus Therapeutische Risikofaktoren Begleiterkrankungen Körperliche Beanspruchung Diskussion Inzidenz Inzidenz des Lymphödems der Brust Latenzzeit Patientinnencharakteristika und Lymphödemrisiko BMI und Adipositas BMI als Risikofaktor für das Auftreten des alleinigen Brustlymphödems Tumorcharakteristika und Lymphödemrisiko Nodalstatus Tumorstadium Tumorlokalisation Therapie des Mammakarzinoms und Lymphödemrisiko OP-Verfahren SNL vs. Axilla SNL vs. Axilla als Lymphödemrisikofaktoren des Armes, der Brust und/ oder Thoraxwand SNL als möglicher Risikofaktor für das Auftreten des alleinigen Brustlymphödems Rekonstruktion Rezidiv-/Zweitoperationen Komplikationen Radiatio Chemotherapie Begleiterkrankungen und Lymphödemrisiko Adipositas Arterielle Hypertonie Diabetes mellitus Schilddrüsenerkrankungen Erkrankungen des Bewegungsapparates...75
8 IV 4.7 Körperliche Beanspruchung und Lymphödemrisiko Zusammenfassung Literaturverzeichnis Danksagung Anhang Anamnesebogen und Befund Einverständniserklärung Generalisierte Ödeme Votum der Ethik-Kommission...92
9 V Abkürzungsverzeichnis AU BEO BET BMI bzw CHT CI cm CVI d.h. DCIS ED HR KHK KPE KPU LAW LGS LK LL LNE MRM OP OR RF SNL TBVT TE TW u.a. vs. WHS z.b. Armumfangsmessung Brusterhaltende Operation Brusterhaltende Therapie Body-Maß-Index beziehungsweise Chemotherapie Konfidenzintervall Centimeter Chronisch venöse Insuffizienz Das heißt Duktales Carcinoma in situ Erstdiagnose Hazard Ratio Koronare Herzkrankheit Komplexe Physikalische Entstauungstherapie Körperliche Untersuchung Lymphabflusswege Lymphgefäßsystem Lymphknoten Lymphpflichtige Lasten Lymphonodektomie Modifiziert radikale Mastektomie Operation Odds Ratio Risikofaktor Sentinellymphonodektomie Tiefe Beinvenenthrombose Tumorexzision Thoraxwand unter anderem versus Wundheilungsstörungen Zum Beispiel
10 VI Abbildungs- und Tabellenverzeichnis Abbildung 1.1 Tabelle 1.1 Abbildung 3.1 Abbildung 3.2 Abbildung 3.3 Abbildung 3.4 Abbildung 3.5 Tabelle 3.1 Abbildung 3.6 Abbildung 3.7 Abbildung 3.8 Tabelle 3.2 Tabelle 3.3 Tabelle 3.4 Tabelle 3.5 Tabelle 3.6 Tabelle 3.7 Tabelle 3.8 Tabelle 3.9 Tabelle 3.10 Anatomie des Lymphgefäßsystems der Mamma Übersicht einiger Publikationen zu Risikofaktoren des Lymphödems Alter aktuell, Alter bei ED des Mammakarzinoms Verteilung der BMI-Werte der Patientinnen zum Zeitpunkt der Untersuchung Übersicht über die systemische Therapie im Patientinnenkollektiv Übersicht über Bergleiterkrankungen im Patientinnenkollektiv Zusammenhangsanalyse des Lymphödems mit Tumor- sowie Patientenbezogenen Faktoren, logistische Regressionsanalyse Zusammenhangsanalyse des Lymphödems mit therapiebezogenen Faktoren, logistische Regressionsanalyse Zusammenhangsanalyse des Lymphödems mit weitere therapiebezogenen Faktoren, logistische Regressionsanalyse Zusammenhangsanalyse des Lymphödems mit Begleiterkrankungen, logistische Regressionsanalyse Multivariate Analyse des Lymphödems und Risikofaktoren aus univariater Analyse mit p<0,001, logistische Regressionsanalyse Zusammenhangsanalyse des Lymphödem mit Patientinnen-sowie Tumorcharakteristika, Cox- Regressionsanalyse Zusammenhangsanalyse des Lymphödems mit therapiebedingten Faktoren, Cox- Regressionsanalyse Zusammenhangsanalyse des Lymphödems mit weiteren therapiebezogenen Faktoren, Cox- Regressionsanalyse Zusammenhangsanalyse des Lymphödems mit Begleiterkrankungen, Cox- Regressionsanalyse Multivariate Analyse der Cox- Regressionsanalyse mit Variablen mit p<0,001 aus univariater Analyse Zusammenhangsanalyse des reinen Brustlymphödems mit Patientinnen- und Tumorcharakteristika Zusammenhangsanalyse des reinen Brustlymphödems mit therapiebezogenen Faktoren Zusammenhangsanalyse des reinen Brustlymphödem mit weiteren therapiebezogenen Faktoren Zusammenhang zwischen der Gabe der Chemotherapie und der Art der Lymphonodektomie
11 VII Tabelle 3.11 Tabelle 3.12 Tabelle 4.1 Abbildung 4.1 Zusammenhangsanalyse für die Ausbildung des kombinierten Lymphödems in Abhängigkeit der Chemotherapie sowie der Art der Lymphonodektomie Zusammenhangsanalyse des reinen Brustlymphödems mit Begleiterkrankungen Studien zur Inzidenz des Lymphödems Strahlentherapie als Risikofaktor für ein Lymphödem
12
13 1 1 EINLEITUNG 1.1 Einführung Das Mammakarzinom ist mit einer Inzidenz von etwa Neuerkrankungen im Jahr (Deutschland) der häufigste maligne Tumor der Frau (Robert-Koch Institut, deutsches Krebsregister, Prognose für 2014) (Kaatsch et al 2013). Bei über Achtzigjährigen Frauen erkrankt eine von zehn Frauen am Mammakarzinom wurden Sterbefälle bei Frauen durch Brustkrebs registriert (Robert-Koch Institut, deutsches Krebsregister) (Kaatsch et al 2013). Die brustkrebsbedingte Mortalität beträgt 41,9/ Einwohner (Kaatsch et al. 2013), sodass das Mammakarzinom die häufigste Todesursache der Frau darstellt. Deshalb stellt die Diagnostik, die Prävention und die Therapie des Mammakarzinoms eine große Herausforderung dar. Durch die Einführung der Screening-Mammographie im Jahre 2005 werden mehr Tumoren in frühen Stadien erkannt. Die Therapie kann dadurch in häufiger vor einer systemischen Ausbreitung der Tumorzellen begonnen und durchgeführt werden, was die Prognose des Mammakarzinom verbessert hat (Albert et al., 2008). Das Therapiekonzept des Mammakarzinoms erfuhr in den vergangenen Jahrzehnten einen drastischen Wandel. Durch die Erkenntnisse über die Tumorbiologie des Mammakarzinoms wird das dieses als eine systemische Erkrankung angesehen, sodass auch der Stellenwert der systemischen Therapie stieg. Dabei fand gleichzeitig eine Rücknahme der chirurgischen Radikalität ohne Einschränkung der onkologischen Sicherheit statt. Heute gilt die brusterhaltende Therapie des Mammakarzinoms, nach Ausschluss entsprechender Kontraindikationen, als Standard. Ebenfalls konnte durch die Einführung der Sentinellymphonodektomie als Standard des axillären Stagings bei klinisch nodalnegativer Axilla eine deutliche Rücknahme der operativen Radikalität im Bereich der Lymphabflußwege erzielt werden ( Interdisziplinäre S3- Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms, Juli 2012, Seite 36-38). Unter den heutigen Maßnahmen zur Diagnostik und Therapie beträgt die relative 5-Jahres- Überlebensrate 87% (Stand 2010, deutsches Krebsregister). Durch den Wandel im therapeutischen Konzept kam es jedoch auch zur Verschiebung im Nebenwirkungsspektrum: viele Frauen leiden nach Abschluss der
14 2 Chemotherapie zum Beispiel unter zytostatikabedingten Polyneuropathien (z.b. Parästhesien in den Fingerspitzen), mangelndem Haarwuchs oder Arthralgien. Trotz der Rücknahme der Radikalität in der Lokaltherapie führt diese weiterhin Langzeitkomplikationen mit sich, wie zum Beispiel aufgrund der obligaten Strahlentherapie nach der brusterhaltenden Operation auftretenden Komlikationen. Durch eine Radiatio konnten vermehrt KHK, Pericarditis (McGale et al., 2011), Pneumonitis und Hautschäden beobachtet werden. Die häufigste Langzeitkomplikation nach Mammakarzinomtherapie stellt das sekundäre Lymphödem dar. Angaben zur Inzidenz des sekundären Lymphödems schwanken in der Literatur. In der Metaanalyse von Disipio et al. wurde die Inzidenz des sekundären Lymphödems des Armes mit 16,6% zusammengefasst (DiSipio et al., 2013). Durch die Einführung des SNL konnte die Inzidenz des sekundären Armlymphödems von 16% (Patientinnen mit Axilladissektion) auf 5% (alleinige SNL) gesenkt werden. (McLaughlin et al., 2008). Zum sekundären Lymphödem der Brust gibt es bisher nur sehr wenige Daten. Die Inzidenz wurde in verschiedenen Studien von Lawenda et al. mit 6-48% zusammengefasst. Die große Streuung spiegelt u.a. Unterschiede bei der Definition der Diagnose Lymphödem, heterogene Studiendesigns und damit das Fehlen vergleichbarer fundierter Daten wieder (Lawenda et al., 2009). 1.2 Das Lymphödem Definition Nach Földi M. und E. ist das Lymphödem definiert als ein durch eine mechanische Insuffizienz des Lymphgefäßsystems verursachtes chronisch- entzündliches lymphostatisches Krankheitsbild. Auch die International Society of Lymphology definiert das Lymphödem als eine externe Manifestation der Insuffizienz der lymphatischen Systems mit gestörtem Lymphabtransport. Klinisch ist das Lymphödem gekennzeichnet durch eine Schwellung, welche grundsätzlich in allen Körperregionen auftreten kann. Am häufigsten sind Extremitäten von einer Lymphabflussstörung betroffen, aber auch Rumpf, Brustdrüse, Gesicht und Kopf, Genitalien oder innere Organe können ein Lymphödem aufweisen.
15 Pathophysiologie Im Lymphgefäßsystem (LGS) finden im Wesentlichen zwei Vorgänge statt: die Lymphbildung und der Lymphtransport. Unter Lymphbildung verstehen wir die Aufnahme der Gewebsflüssigkeit ins Lymphgefäßsystem hinein, die nicht über den venösen Schenkel der Blutkapillaren resorbiert werden kann (sogenannte Lymphpflichtige Lasten, Netto-Ultrafiltrat. Die Aufnahme erfolgt in die initialen Lymphgefäße (Lymphkapillaren). Gewebsflüssigkeit, welche ins LGS aufgenommen ist, bezeichnen wir als Lymphe. Lymphtransport bezeichnet den aktiven Transport der Lymphe durch die einzelnen anatomischen Abschnitte des LGS hindurch, bis zu den Venenwinkeln, wo die Lymphe dem Blutkreislauf zugeführt wird. Ins LGS zwischengeschaltet befinden sich die Lymphknoten. In den Lymphknoten finden immunologische Vorgänge statt. Außerdem wird die Lymphe in den Lymphknoten unter physiologischen Bedingungen durch Resorption von Wasser ins venöse System konzentriert. Als Folge einer mechanischen Insuffizienz des Lymphgefäßsystems (LGS) tritt das Lymphödem auf. Es handelt sich dabei um ein eigenständiges, chronisches Krankheitsbild. Durch die mechanische Insuffizienz ist die Transportkapazität des LGS für die lymphpflichtigen Lasten herabgesetzt. Es kommt zum chronischen Rückstau der Lymphe bzw. Gewebsflüssigkeit. Als Folge dieses Rückstaus entsteht ein lokalisiertes eiweißreiches Ödem. Die eiweißreiche Ödemflüssigkeit induziert eine chronische Entzündung im Lymphstaugebiet. Als Folge dieser Entzündung kommt es zu einer Proliferation von Bindegewebe im Lymphstaugebiet. Diese Umbauprozesse werden als lymphostatische Fibrosen bezeichnet. Durch eine fortschreitende mechanische Beeinträchtigung, zum Beispiel Abschnürungen oder Vernarbungen im Lymphstaugebiet, kann sich die Transportkapazität weiter verringern, was zu einer Lymphödem-Verschlechterung führen kann. Doch auch ein Anstieg der lymphpflichtigen Lasten (LL) kann zu einer Lymphödem- Aggravierung führen, indem das ohnehin schon insuffiziente LGS durch zusätzliches Volumen belastet wird. Zu einem Anstieg der LL kann es zum Beispiel kommen im Zusammenhang mit akuten Entzündungen im Lymphstaugebiet. Aber auch diverse Begleiterkrankungen
16 4 führen über eine Beeinflussung der Mikrozirkulation zu einem Anstieg der LL, so zum Beispiel unter anderem Diabetes mellitus, weitere endokrinologische Erkrankungen sowie Erkrankungen des rheumatischen Formenkreises. Solche Erkrankungen werden als Lymphödem-aggravierende Faktoren bezeichnet Ätiologie Das Lymphödem lässt sich in ein primäres und ein sekundäres Lymphödem einteilen. Das primäre Lymphödem beruht auf einer mechanischen Insuffizienz des LGS, welche auf eine Entwicklungsstörung der Lymphgefäße und/oder der Lymphknoten zurückzuführen ist. Hier besteht eine genetische Prädisposition zur Ausbildung eines Lymphödems. Das primäre Lymphödem kann sich von Geburt an, im Kindes- oder Erwachsenenalter manifestieren. Häufiger als das primäre ist das sekundäre Lymphödem. Hier handelt es sich pathogenetisch um eine erworbene mechanische Behinderung des Lymphtransports. Diese kann verschiedene Ursachen haben: Zum einen können Malignome ein Lymphödem verursachen, indem maligne Zellen die Lymphgefäße infiltrieren, sodass ein Lymphtransport nicht mehr gewährleistet ist. Hier spricht man von einer Lymphangiosis carcinomatosa. Zum anderen können Malignome die Lymphgefäße von außen komprimieren, sodass diese in ihrer Transportfähigkeit gestört werden. In beiden Fällen, in denen also der Tumor selbst zu einer Lymphblockade führt, wird das resultierende sekundäre Lymphödem als malignes Lymphödem bezeichnet. Von hoher klinischer Relevanz ist das Auftreten des sekundären Lymphödems nach Lymphonodektomien im Rahmen der Tumortherapie, in diesen Fällen handelt es sich um das sog. benigne sekundäre Lymphödem. Weiterhin können u.a. Traumata vor allem in Folge großer Weichteilverletzungen die Lymphgefäße so beschädigen, dass der Abtransport der lymphpflichtigen Lasten aus den Geweben behindert wird Stadieneinteilung Man teilt das Lymphödem klinisch in drei Stadien ein: Stadium 1: Reversibles Ödemstadium, d.h. z.b. Hochlagern reduziert die Schwellung. In diesem Stadium ist eine Schwellung klinisch nachweisbar. Sie tastet sich weich, der Dellentest ist positiv (konstanter Druck mit dem Finger auf hinterlässt durch lokale Verdrängung der Flüssigkeit eine Delle im Gewebe).
17 5 Stadium 2: Chronisches Ödemstadium. Dieses Stadium wird als spontan irreversibles Stadium bezeichnet. Das Hochlagern führt nicht zu einer Abnahme der Schwellung, die Schwellung selbst ist von derber Konsistenz. Die Fibrosklerose aufgrund lymphostatischer Gewebsveränderungen ist ausgedehnt. Gleichzeitig kann eine pathologische Fettgewebsvermehrung im Lymphstaugebiet stattfinden. Stadium 3: Dieses Stadium wird auch Elephantiasis genannt. Hier ist die Schwellung stärker ausgeprägt als in Stadium 2, bis hin zu invalidisierenden Ausmaßen. Sie ist von derber Konsistenz mit ausgedehnter Fibrosklerose und Fettgewebsvermehrung, und geht mit einer starken Einschränkung der Lebensqualität einher. Neben diesen 3 klinischen Lymphödemstadien ist das präklinische Stadium 0 oder Latenzstadium von Bedeutung: Stadium 0 der Latenz: Hier ist klinisch keine Schwellung sichtbar. Die Lymphgefäße sind geschädigt, zum Beispiel aufgrund operativer Eingriffe, jedoch reicht ihre Transportkapazität noch aus um die Lymphe ausreichend abzutransportieren. Lediglich könnte man die verminderte Transportkapazität der Lymphgefäße mittels funktioneller Isotopenlymphographie nachweisen Diagnostik und Differentialdiagnostik Die Basisdiagnostik des Lymphödems beruht nach Földi M. und E. hauptsächlich auf der Klinik, somit auf der Anamnese, der Inspektion, sowie der Palpation der betroffenen Körperregion, sowie dem Seitenvergleich. Für ein Lymphödem spricht, wenn das Ödem einseitig oder beidseitig asymmetrisch auftritt. Auch ist für ein Lymphödem charakteristisch, dass die Finger und die Zehen, sowie auch die Hand- und Fußrücken betroffen sind. Die Hautfalten sind vertieft. An den Füßen können charakteristische Kastenzehen auftreten. Gekennzeichnet ist das Lymphödem durch das Stemmersche Zeichen: Hier lassen sich die Hautfalten über den Zehen oder Fingern verbreitert, erschwert oder überhaupt nicht abheben. Wenn das Stemmersche Zeichen positiv ist, handelt es sich immer um ein Lymphödem, allerdings schließt ein negativer Stemmer das Vorliegen eines Lymphödems nicht aus. Kann ein Fingerabdruck tief in eine Delle hinterlassen, so spricht man vom positiven Dellentest. Die Hautfarbe ist meist unverändert, gegebenenfalls sind Lymphzysten oder Lymphfisteln sichtbar. Diese sind zusammen mit einer Umfangsmessung objektive Kriterien, die für das Lymphödem charakteristisch sind.
18 6 Das Lymphödem kann auch subjektive Beschwerden verursachen, die anamnestisch erfragt werden können und den klinischen Verdacht auf ein Lymphödem erhärten. Bei jedem Ödem sollten differentialdiagnostisch andere Ursachen für die Ausbildung eines Ödems ausgeschlossen werden. Einige Beispiele sind endokrinologische (Myxödem bei Schilddrüsenfunktionsstörungen), nephrologische (Niereninsuffizienz), hepatologische, kardiologische oder vaskuläre (Herzinsuffizienz oder chronisch venöse Insuffizienz) Ursachen der Ödembildung. Ödeme können jedoch auch durch Eiweißmangel aufgrund von Malabsorptionssyndromen oder Mangelernährung bedingt sein. Hier sind die Ödeme jedoch systemisch bedingt und beidseitig vorhanden. Außerdem ist auf weitere klinische Symptomatik zu achten. Eine wichtige Differentialdiagnose ist die Filariasis, die vor allem in den tropischen Regenwäldern vorkommt und ein Lymphödem verursacht. Deshalb sollte auch in Europa bei einem neu aufgetretenen Lymphödem neben der körperlichen Untersuchung eine Auslandsanamnese durchgeführt werden. Bei neu aufgetretenen Lymphödemen oder bei Verschlechterung bestehender Lymphödeme trotz suffizienter Therapie muss stets ein malignes Geschehen als zugrunde liegende Ursache ausgeschlossen werden. Bei entsprechenden Symptomen sollte auch an ein Erysipel als die häufigste Lymphödem-Komplikation gedacht und dieses entsprechend ausgeschlossen werden. Eine sehr seltene Komplikation des Lymphödems ist das Lymphangiosarkom, das bei klinischem Verdacht bei der körperlichen Untersuchung ebenfalls dringend durch Biopsie und histologische Diagnostik ausgeschlossen werden sollte. Neben der Anamnese und der klinischen Untersuchung können daher einige laborchemische Parameter wie zum Beispiel Schilddrüsen- Nieren- und Entzündungsparameter einerseits zur Differentialdiagnostik des Lymphödems, andererseits zum Ausschluss Lymphödem-aggravierender Begleiterkrankungen herangezogen werden. In Einzelfällen (unklare Diagnosen oder spezielle Fragestellungen) kann neben der Basisdiagnostik die erweiterte (apparative) Diagnostik zum Einsatz kommen. Mögliche Verfahren sind u.a. die indirekte Lymphographie, die farbkodierte Duplex- Sonographie, sowie die Computer- oder Magnetresonanztomographie Bereits im präklinischen Stadium 0 der Latenz kann die Diagnose mittels einer Isotopenlymphograhie erfolgen.
19 7 Die häufigste und im klinischen Alltag gängigste Methode zur objektiven Beurteilung der Ausprägung des Lymphödems sowie des zeitlichen Ödemverlaufs Verlauf stellt die konventionelle Armumfangsmessung dar, wie auch Disipio et al. in ihrer Metaanalyse feststellen (DiSipio et al., 2013). Hierbei wird der Umfang von mehreren Punkten einer Extremität gemessen und mittels der Truncated Cone Methode das Volumen der Extremität berechnet (Kolemeyer et al., 2004). Dennoch kann durch die Armumfangsmessung allein nicht das Ausmaß des Lymphödems beurteilt werden. Da die Therapie des Lymphödems stadienabhängig ist, gehört die Beurteilung des Stadiums zu jeder Diagnostik des Lymphödems dazu. Hieraus geht hervor, dass bei der Diagnostik des Lymphödems die klinische Untersuchung mit der Beurteilung der Konsistenz des Gewebes zusätzlich zur Armumfangsmessung unabdingbar ist. Zudem wird in manchen Studien auch die subjektive Selbstbeurteilung in Patientenfragebögen zur Diagnostik eingesetzt. Dazu gehört eine Befragung über mögliche Lymphödem-assoziierte Symptome, neben der Umfangsvermehrung gegebenenfalls auch Sensibilitätsstörungen, Schweregefühl, Rötung, oder Gewebekonsistenzveränderungen Therapie Aufgrund der Neigung zur Progredienz, der möglichen Komplikationen (siehe ) und damit einhergehend der schweren gesundheitlichen und psychsosozialen Folgen besteht eine Indikation zur Behandlung der Lymphödeme. Die Grundlage der konservativen Therapie der Lymphödeme ist die Komplexe Physikalische Entstauungstherapie (KPE). KPE Die KPE ist eine Tetrade bestehend aus den Maßnahmen Manuelle Lymphdrainage Kompressionstherapie Entstauende Krankengymnastik Hautpflege bzw. Hautsanierung Für einen nachhaltigen Therapieerfolg ist erforderlich, dass diese vier Maßnahmen immer in Kombination angewendet werden. Gleichzeitig ist die Therapie bestehender Begleiterkrankungen Bestandteil des Therapiekonzepts der Lymphödeme.
20 8 Die KPE besteht aus zwei Phasen, einer Phase I der Entstauung, sowie einer Phase II der Konservierung. Diese beiden Phasen sollten unmittelbar ineinander übergehen. Das Ziel der Phase I ist zunächst die Mobilisierung der eiweißreichen Ödemflüssigkeit, und damit die Entstauung der betroffenen Körperregionen. Außerdem ist der Abbau der lymphostatischen Gewebsfibrosen entscheidendes Therapieziel. Die Phase I beruht auf einer intensiven mindestens einmal täglichen Therapie mittels aller Maßnahmen der KPE. Die Kompressionstherapie erfolgt mittels lymphologischer Kompressionsbandagen. Das Ziel der Phase II ist die Konservierung des Therapieerfolges der Phase I. Die Therapieintensität ist geringer als in der Phase I und richtet sich nach dem individuellen Lymphödem-Schweregrad- und Verlauf. In der Phase II erfolgt die Kompressionsbehandlung mittels maßangefertiger lymphologischer Kompressionsstrümpfe. Weitere Therapieziele der KPE im Allgemeinen sind die Mobilisation der Lymphe, die Kräftigung der Extremität und die Verbesserung deren Funktion, die Verbesserung der Hauttrophik, und weitere präventive Maßnahmen wie zum Beispiel eine Erysipel- Prophylaxe. Neben der KPE gibt es weitere Therapieansätze, die in der vorliegenden Arbeit nicht weiter vertieft werden (siehe hierzu AWMF- Leitlinie Diagnostik und Therapie der Lymphödeme ) Komplikationen, Verlauf und Prognose Das Lymphödem ist eine fortschreitende Erkrankung. Deshalb ist das frühe Erkennen, aber auch die richtige Therapie unabdingbar um die Progredienz dieser Erkrankung zu verhindern. Die Hauptkomplikationen des Lymphödems stellen sowohl Pilzbefall der Haut dar, als auch das Auftreten von Erysipelen. Einerseits ist das Erysipel ein Risikofaktor für die Ausbildung des Lymphödem, andererseits stellt das Lymphödem ein ideales Milieu zur Ausbreiten von Bakterien dar, sodass es die Ausbildung des Lymhödemes begünstigt. Somit entsteht ein Circulus vitiosus, der immer weiter zur Progredienz des Lymphödems beiträgt. Eine sehr seltene Komplikation des Lymphödems, die aber nicht zu vernachlässigen ist, ist die maligne Entartung zum Lymphangiosarkom (Synonym: Steward-Treves-Syndrom).
21 9 Gleichzeitig ist die Lebensqualität der Patientinnen und Patienten mit einem Lymphödem deutlich eingeschränkt. Das Lymphödem stellt zum einen ein kosmetisches Problem dar, welches bei Patienten zu sozialem Rückzugsverhalten und Isolation bei vermindertem Selbstwertgefühl führt. Gleichzeitig kommt es zu einer funktionellen Einschränkung der Beweglichkeit der betroffenen Extremität oder Körperstelle (DiSipio et al., 2013). 1.3 Das sekundäre Lymphödem nach Mammakarzinomtherapie Anatomie und Physiologie Das Lymphgefäßsystem der Mamma lässt sich in ein oberflächliches, ein subkutanes und ein tiefes System einteilen. Aus onkochirurgischer Sicht ist das tiefe System von Bedeutung, denn hier beginnen die Lymphkapillaren an den Drüsenendstücken. Die ersten Filterstationen sind die axillären Lymphknoten (hier fließt der Hauptteil der Lymphe) und nach medial parasternale Lymphknoten. Die axillären Lymphknoten werden in Level unterteilt. Die Lymphknoten lateral des M. pectoralis minor werden dem Level I, diejenigen auf Höhe des Muskels pectoralis minor als Level II und diejenigen medial des Muskels als Level III bezeichnet (Abbildung 1.1). Durch den operativen Eingriff an der Brust sowie im Bereich der Lymphknoten der Axilla werden einerseits zahlreiche Lymphgefäße geschädigt, andererseits wird durch die Herausnahme der nächsten Filterstation der Lymphe der Brust, die axillären Lymphknoten, das Lymphgefäßsystem komplett durchtrennt. Dies führt dazu, dass sich im Rahmen der Therapie des Mammakarzinoms sekundär ein Lymphödem des Armes, sowie auch der Brust und der Thoraxwand ausbilden kann. Das Lymphödem kann unterschiedlich stark ausgeprägt sein, je nachdem welche weiteren Faktoren das Lymphödem beeinflussen (Schünke et al., 2005).
22 10 Abbildung 1.1: Anatomie des Lymphsystems der Mamma (aus Schünke et al.: Prometheus LernAtlas der Anatomie: Allgemeine Anatomie und Bewegungssystem [2005]) Inzidenz Die Metaanalyse von Disipio et al (2013) gibt die Inzidenz des sekundären Lymphödems des Armes nach Therapie des Mammakarzinoms mit 16,6 % an (DiSipio et al., 2013) Risikofaktoren Risikofaktoren können eingeteilt werden in von der Patientin abhängige und von ihr unabhängige Risikofaktoren. Diese sind vor allem Faktoren, welche die onkologische Therapie betreffen Zu den von der Patientin abhängigen Risikofaktoren gehören vor allem internistische Begleiterkrankungen, aber auch der Lebensstil, im Sinne von körperlicher Überbeanspruchung oder Überlastung. Die folgende Tabelle soll einen Überblick über die bisherige Datenlage darstellen (Tabelle 1.1).
23 11 Risikofaktor Autor p-wert BMI Clark et al Shapar et al 2013 P<0,001 McLaughlin et al 2008 P<0,001 Crosby et al 2012 P=0,008 Helyer et al 2010 P=0,003 Nodalstatus/pos.LK Crosby et al 2012 P=0,004 Yen et al 2009 P<0,05 Shapar et al 2013 P<0,001 Tumorstadium Herd- Smith et al Paiva et al 2013 P=0,216 Goffman et al 2004 Monleon et al 2014 Park et al 2008 P=0,0027 P<0,001 P=0,005 Tumorlokalisation Goffman et a 2004l P=0,0042 MRM vs BEO Clark et al Nesvold et al 2008 P=0,04 Monleon et al 2014 P=0,235 Meeske et al 2008 P<0,05 Paiva et al 2013 P=0,91 Axilla vs SNL McLaughlin et al 2008 P<0,0001 Crosby et al 2012 P<0,001 Monleon et al 2014 Park et al 2008 P<0,001 P<0,001 Rekonstruktion Paskett et al 2007 P=0,08 Crosby et al 2012 Meeske et al 2008 P=0,95 P<0,05 -als protektiven Faktor Avraham et al 2010 P<0,02 Infektionen Mc Laughlin et a 2008l P<0,0001 Petrek et al 2001 P<0,001 Soran et al 2006 P<0,0001 Serome Monleon et al 2014 P=0,014 Paiva et al 2013 P<0,01 Radiatio McLaughlin et al 2008 P=0,16 Meeske et al 2008 Herd-Smith et al 2001 P<0,05 - Paiva et al 2013 P=0,478 Paskett et al 2007 P=0,26 Park et al 2008 P=0,000 CHT Norman et al Shahpar et al 2013 p=0,42 Paiva et al 2013 p=0,69 Paskett et al 2007 Monleon et al 2014 p=0,02 p<0,001 Art. Hypertonie Meeske et al 2008 P<0,05 Overgaard et al 2000 Paiva et al 2013 P<0,005 P=0,30 Diabetes mellitus Paiva et al 2013 P=0,49 Erkrankungen Bewegungsapparat Paiva et al 2013 P<0,001 Tabelle 1.1: Übersicht einiger Publikationen zu Risikofaktoren des Lymphödems Das sekundäre Lymphödem der Brust Das sekundäre Lymphödem der Brust wurde bisher in der Literatur seltener diskutiert als das sekundäre Lymphödem der Arme. Die Inzidenz wurde von Lawenda et al etwa mit 6-48% (Lawenda et al., 2009), von Goffmann et al mit 9,6% (Goffman et al., 2004) und von Rönka et al mit 23% (Rönka et al., 2004) angegeben.
24 12 In Anbetracht der Tatsache der fehlenden und uneinheitlichen Datenlage über das sekundäre Lymphödem der Brust und seine Risikofaktoren soll in dieser Arbeit ein besonderes Augenmerk hierauf gelegt werden. Insbesondere soll das reine Lymphödem der Brust im Vergleich zum aus klinischer Erfahrung häufigeren kombinierten Arm-/und Brustlymphödem detailliert betrachtet werden. 1.4 Ziele der Arbeit Im Rahmen dieser Doktorarbeit sollte untersucht werden, wie häufig und in welchem zeitlichen Verlauf das sekundäre Lymphödem bei einem aktuellen Patientenkollektiv der Universitäts- Frauenklinik Freiburg nach Primärtherapie des Mammakarzinoms auftrat. Die Inzidenz, der zeitlichen Verlauf sowie das subjektive Beschwerdebild des sekundären Brustlymphödems nach brusterhaltender Operation sowie der alleinigen Sentinellymphonodektomie wurde ebenfalls untersucht. Zum anderen sollte evaluiert werden, ob folgende Faktoren das Auftreten des Lymphödems begünstigten und somit als Risikofaktoren identifiziert werden können: Einfluss lokaler Therapieverfahren Radikalität der axillären Lymphonodektomie (Sentinellymphonodektomie vs Axilladissektion, Anzahl der entfernten Lymphknoten) Art der Brustoperation (Brusterhaltende Operation, Mastektomie, onkoplastische Rekonstruktion, Technik, Zeitpunkt) Adjuvante Radiatio (Radikalität und Lokalisation) Einfluss systemischer Therapieverfahren Verabreichung der Chemotherapie, insbesondere Taxan-haltiges versus nicht Taxan-haltiges Protokoll Verabreichung von antihormoneller Medikation (Tamoxifen, Aromatasehemmer, Kombination) Individuelle Faktoren Tumorstadium bei Erstdiagnose Lokalisation des Tumors Postoperative Komplikationen (Hämatom, Serom, Infektion) Vorliegen von Begleiterkrankungen, welche zur Kapillarmembranschädigung bzw. Beeinflussung der Mikrozirkulation in den Geweben führen können und
25 13 somit eine Erhöhung der lymphpflichtigen Lasten bedingen können, insbesondere Adipositas, Schilddrüsenerkrankungen, Diabetes mellitus, arterielle Hypertonie, rheumatische Erkrankungen sowie chronische Hauterkrankungen (pathophysiologisch Lymphödem-aggravierende Faktoren) Nikotinabusus Lebensstil (Bewegung, Belastung der Arme) Zu diesem Ziel führten wir eine retrospektive Auswertung an der Universitäts- Frauenklinik Freiburg durch. In die Auswertung eingeschlossen wurden Patientinnen, die zwischen den Jahren 2001 und 2010 wegen eines Mammakarzinoms behandelt wurden. Nach Prüfung der Ausschlusskriterien (siehe 2.3) wurden die Patientinnen telefonisch kontaktiert und zu einer Befragung und körperlichen Untersuchung anhand eines lymphologischen Anamnese- und Befunderhebungsbogens eingeladen. Auch Daten zur Lebensqualität wurden erhoben. Diese wurden in einer anderen Arbeit ausgewertet und analysiert.
26 14 2 MATERIAL UND METHODEN 2.1 Studiendesign Bei dieser Arbeit handelt es sich um eine retrospektive Fall-Kontroll-Studie. Eine Genehmigung der Ethik-Kommission wurde eingeholt, Bescheid vom (Auftragsnummer 385/10, siehe Anhang). 2.2 Patientinnenkollektiv Zum Patientinnenkollektiv dieser Untersuchung gehörten alle Frauen, die im Zeitraum vom bis an der Universitäts-Frauenklinik leitliniengerecht an einem primären Mammakarzinom therapiert wurden und nach Aufklärung über Art, Inhalt und Zielsetzung der Studie ihr schriftliches Einverständnis (Aufklärungs- und Einverständnisbogen siehe Anhang) zur Teilnahme gaben. 2.3 Ausschlusskriterien Ausgeschlossen wurden Patientinnen mit Primär metastasiertem Mammakarzinom Bei Erstdiagnose bestehendem Lymphödem Nicht leitliniengerecht durchgeführter Primärtherapie (z.b. Ablehnung durch Patientin, Abbruch wegen Toxizität) Des weiteren wurden nicht mit einbezogen Männer mit Brustkrebs Patientinnen, die innerhalb Deutschlands oder ins Ausland umgezogen waren Patientinnen, bei denen aus der Akte hervorging, dass sie die deutsche Sprache nicht beherrschten und ein anderssprachiger Arzt empfohlen wurde Patientinnen, die zum Zeitpunkt der Rekrutierung verstorben waren. Patientinnen, die zwar an der Frauenklinik behandelt wurden, jedoch nicht in Deutschland wohnhaft waren Patientinnen mit DCIS Patientinnen mit weiteren gynäkologischen Tumorerkrankungen, wie Zervixoder Ovarialkarzinom. Patientinnen, bei denen die Erstdiagnose des Brustkrebs vor 2000 gestellt wurde
27 15 Patientinnen, bei denen zum Zeitpunkt der Rekrutierung keine ausreichenden Daten vorhanden oder zu organisieren waren, weil etwa die Primärtherapie im Ausland stattfand 2.4 Datenerhebung Zunächst wurden die Patientinnen, die nach Durchsicht der vorhandenen Daten für die Studie in Frage kamen, telefonisch kontaktiert und über die Studie informiert. Konnte eine Patientin erfolgreich rekrutiert werden, wurde ein Termin für eine gezielte lymphologische Anamnese- und Befunderhebung vereinbart. In einem persönlichen Gespräch wurde die Anamnese mithilfe eines standardisierten Anamnesebogens durchgeführt (Anlage). Ebenfalls fand eine ausführliche körperliche Untersuchung sowie eine genaue Umfangsmessung beider Arme anhand der Truncated Cone Methode (Kuhnke 1976) statt Anamnese und klinische Untersuchung Die Anamnese wurde anhand eines Anamnesebogens (siehe Anhang) durchgeführt. Bei unklaren Befunden bei der körperlichen Untersuchung wurde die Patientin an die Földiklinik, Fachklinik für Lymphologie, weiter überweisen, wo die Diagnose überprüft wurde. Bei Patientinnen mit einem Lymphödem wurde zunächst eruiert, wann und in welchem zeitlichen Abstand zur Therapie des Mammakarzinoms das Lymphödem aufgetreten war. Es wurde nach den Umständen gefragt, unter denen das Lymphödem bemerkt wurde. So konnten die Auslöser des Lymphödems erfasst werden. Es wurde speziell nach den Symptomen des Lymphödems wie Schwellung, eindrückbare Dellen, eventueller Besserung nach Hochlagern, Missempfindungen, Sensibilitätsstörungen, Schmerzen, Rötung, oder Bewegungseinschränkungen, gefragt. Ebenso eruierten wir, ob in der Vergangenheit bereits eine lymphologische Therapie stattgefunden hatte, welches die therapeutischen Maßnahmen waren, und wie regelmäßig sie durchgeführt wurden. Es wurde besprochen, ob eine alltägliche Hautpflege, eine regelmäßige Bewegung, oder etwa übermäßige Beanspruchung im Sinne von Belastung der Arme stattgefunden hatte, wenn ja, wurde die Zeit der Belastung dokumentiert. Daraufhin wurde eine ausführliche lymphologische Untersuchung durchgeführt. Zunächst wurde eine Inspektion (Hautfarbe, Seitendifferenzen, Haltung) durchgeführt. Bei der Palpation wurde auf Seitendifferenzen, positives Stemmersches Zeichen, eindrückbare Dellen, Gewebekonsistenzveränderungen im
28 16 Bereich der Arme, der Hände der Brust und der Thoraxwand, durchgeführt. Dem folgte eine Untersuchung des Bewegungsausmaßes der Arme. Schließlich wurde eine Armumfangsmessung (siehe unten) durchgeführt. Die vorhandenen Daten wurden in eine speziell entwickelte Access-Datenbank eingetragen Volumenmessung Verwendetes Material: Maßband (150cm, von Hoechstmaß) mit 2 Senkloten (je 100g), wobei jeweils eines an jedem Ende befestigt wurde Lineal 50 cm schwarzer Eyeliner, zur Markierung der zu messenden Punkte, abwaschbar Methode: Die Probandin wurde gebeten beide Arme freizumachen, sodass beide Seiten im Vergleich gemessen werden konnten. Dafür wurde die Probandin sitzend mit senkrecht zum Rumpf nach lateral ausgerichtetem Arm positioniert. Der Arm musste dabei für die Messung frei zugänglich sein. Deshalb lag nur die Handfläche auf einer Ablage auf. Anschließend wurden für jede Probandin standardisiert die Messpunkte festgelegt. Dies erfolgte entsprechend der Größe der Probandin und der Form ihres Armes: Dafür wurde das Lineal am Mittelfinger angesetzt und parallel zum Arm angelegt. Der erste Punkt befand sich auf der Mittelhand und wurde unterhalb der Fingerknöchel gesetzt. Hier war wichtig, darauf zu achten, dass das Maßband bei der späteren Messung unterhalb der Fingerknöchel, gerade und faltenfrei um die Mittelhand gelegt werden konnte. Meist lag dieser Punkt zwischen 10 und 12 cm. Für die zweite Markierung blieb das Lineal angelegt, und der zweite Punkt wurde auf Höhe des processus styloideus ulnae gesetzt. Auch hier war es wichtig darauf zu achten, dass das Maßband gerade und faltenfrei um den distalen Unterarm gelegt werden konnte. Ab hier wurden alle 4 cm bis zum proximalen Ende des Armes hin gemessen, soweit es noch möglich war, das Maßband gerade um die Extremität zu legen. Aus den Meßwerten wurde anhand der Truncated Cone Methode das Armvolumen berechnet und anschließend dokumentiert.
29 Auswertung der Messungen und Statistik In Zusammenarbeit mit einem Statistiker des Masem Research Institute Gießen (A. Traut) wurden die Daten mit der Anaylsesoftware IBM/ SPSS 20.0 statistisch ausgewertet. Die Grafiken wurden mit GraphPadPrism 4, MS- Excel dargestellt. Im ersten Teil fand eine deskriptive Analyse statt. Alle erfassten Daten wurden gelistet und tabellarisch zusammengefasst. In einem zweiten Teil wurde eine Zusammenhangsanalyse erstellt. Diese wurde mit der logistischen Regressionsanalyse (Risikodarstellung durch Odds Ratio) sowie der Cox Regression (Risikodarstellung durch Hazard Ratio) durchgeführt. Zunächst erfolgte eine univariate Analyse, die Daten hieraus mit p<0,01 wurden für eine multivariate Analyse weiter verwendet. Als graphische Darstellungsformen dienten Balkendiagramme, Boxplots, Forrest Plots (zur Darstellung der Odds Ratio), Errorplots (zur Darstellung des Mittelwertes sowie der Standardfehler), Kreuztabellendiagramme und Kreisdiagramme, Scatter plots und Kaplan- Meier- Kurven. Auf alle p-werte wurde die Wald-Statistik angewendet. Das Signifikanzniveau wurde auf p-wert<0,05 festgelegt.
30 18 3 ERGEBNISSE 3.1 Patientinnenkollektiv Die Patientinnenzahl in der initialen Liste, die vom Rechenzentrum der Uniklinik Freiburg nach Anforderung der Patientinnen mit Diagnose Mammakarzinom (ICD 10 C 50.1 bis 50.9) im Zeitraum erstellt wurde, betrug 2077 Patientinnen. Nach Durchsicht der Akten wurden aufgrund vorhandener Ausschlusskriterien 517 Patientinnen ausgeschlossen, 121 Patientinnen waren zum Studienzeitpunkt verstorben. Von 1439 Patientinnen konnten 792 Patientinnen unter der in der Universitätsklinik Freiburg hinterlegten Telefonnummer nicht oder nur über den Anrufbeantworter erreicht werden. 647 Patientinnen wurden persönlich erreicht. Hiervon lehnten 13 Patientinnen die Studie ab, 315 Patientinnen konnten keinen Termin in einem Rekrutierungszeitraum vom September Februar 2012 sowie September Mai 2013 wahrnehmen. 12 Patientinnen erschienen trotz Termin nicht oder sagten kurzfristig aufgrund akuter Erkrankung ab. Somit konnten für die vorliegende Studie 307 Patientinnen rekrutiert werden. Im Nachhinein mussten 2 Patientinnen aufgrund vorliegender Ausschlusskriterien ausgeschlossen werden. Insgesamt wurden 305 Patientinnen in die statistische Auswertung eingeschlossen. Von den 305 ausgewerteten Patientinnen hatten 21 (6,5%) Patientinnen ein bilaterales Karzinom, sodass die Bezugsgröße auf n = 326 (100%) Karzinome festgelegt wurde. 3.2 Übersicht der Ergebnisse Im folgenden Abschnitt wurden unsere Ergebnisse unterteilt in eine deskriptive Analyse und eine Zusammenhangsanalyse. Im Rahmen der deskriptiven Analyse wurde zunächst unser gesamtes Patientinnenkollektiv bezüglich folgender Kriterien beschrieben: Patientinnencharakteristika (Karzinom-Manifestation, Erkrankungsalter, Menopausenstatus, BMI, Nikotinabusus) Tumorcharakteristika (Tumorstadium, Nodalstatus, Lokalisation)
31 19 Art und Verlauf der Tumortherapie (Operative Therapie, Systemische Therapie, Radiatio, Rezidiv- Operationen) Vorliegen lymphologisch relevanter Begleiterkrankungen Körperliche Beanspruchung Anschließend wurde die Gesamtheit derjenigen Patientinnen, bei denen in der Folge der Mammakarzinom Therapie ein sekundäres Lymphödem aufgetreten war, anhand der folgenden Kriterien beschrieben: Alter bei Auftreten des Lymphödems, Latenzzeit, Lokalisation des Lymphödems Anamnese der Patientinnen mit Lymphödem Klinik des Lymphödem in unserem Patientinnenkollektiv Therapie des Lymphödems in unserem Patientinnenkollektiv In der Zusammenhangsanalyse wurde der Zusammenhang zwischen dem Auftreten des Lymphödems und patientinnenbezogenen sowie therapeutischen Faktoren zunächst mittels der logistischen Regressionsanalyse, danach mittels der Cox- Regressionsanalyse, untersucht. Die jeweilige univariate Analyse gliederte sich auf in folgende Unterpunkte: Patientinnencharakteristika und Lymphödemrisiko Tumorcharakteristika und Lymphödemrisiko Therapie des Mammakarzinoms und Lymphödemrisiko Begleiterkrankungen und Lymphödemrisiko Körperliche Beanspruchung und Lymphödemrisiko Zunächst wurde die gesamte Zusammenhangsanalyse für das kombinierte Lymphödem der Arme gegebenenfalls mit Brust und/ oder Thoraxwand durchgeführt (Kapitel und ). Anschließend wurde unter den Patientinnen, bei denen ein reines Brustlymphödem aufgetreten war, der Zusammenhang zwischen der Ausbildung des Brustlymphödems in Bezug auf Patientinnen- und Tumorbedingten sowie therapeutischen Faktoren und Begleiterkrankungen dargestellt (Kapitel ).
32 Analyse der Ergebnisse Deskriptive Analyse des Gesamtkollektivs Patientinnencharakteristika Bei 10 (3,1%) Patientinnen lag gleichzeitig ein beidseitiger Tumor vor, bei 11 (3,4%) von Patientinnen trat das kontralaterale Karzinom mit zeitlichem Abstand zum Ersten auf. Der Altersdurchschnitt der Patientinnen, die an der Studie teilnahmen, betrug 60,9 Jahre. Der Altersdurchschnitt unseres Patientinnenkollektivs bei Erstdiagnose des Primärtumors lag bei 54.8 Jahren. Im Durchschnitt fand die Erstdiagnose des Mammakarzinoms 6 Jahre vor Studienteilnahme statt (Abbildung 3.1). Bei Erstdiagnose des Mammakarzinoms konnte bei unserem Patientinnenkollektiv 0.20 Alter aktuell Alter ED MaCa Relative Häufigkeit Alter Abbildung 3.1: Alter aktuell, Alter bei ED des Mammakarzinoms folgender Menopausenstatus festgestellt werden: 195 (63,9%) Patientinnen waren post- und 110 (36,1%) Patientinnen waren prämenopausal. Die Angaben der Körpergröße und Gewicht zum Studienzeitpunkt ergab folgende BMI Werte: Im Mittelwert hatten unsere Studienteilnehmerinnen einen BMI von 25, (78,5%) Patientinnen hatten einen BMI von <30, 46 (14,1%) Patientinnen hatten einen BMI von und 24 (7,4%) Patientinnen einen BMI von >35 (Abbildung 3.2).
33 21 Relative Häufigkeit BMI Abbildung 3.2: Verteilung der BMI-Werte der Patientinnen zum Zeitpunkt der Untersuchung Tumorcharakteristika Die Tumorstadien bei Erstdiagnose des Mammakarzinoms waren in unserem Patientinnenkollektiv wie folgt verteilt: Bei 198 (60,7%) Karzinomen lag ein pt1 Stadium vor, bei 103 (31,6%) ein pt2 und bei 6 (1,8%) Karzinomen ein pt3 Stadium. Bei 8 (2,5%) Patientinnen wurde bei Erstdiagnose ein pt4 Stadium diagnostiziert und bei 11 (3,4%) Karzinomen war das Tumorstadium bei Erstdiagnose unbekannt. Klinisch und pathologisch waren zum Zeitpunkt der Erstdiagnose 203 (62,3%) Karzinome nodalnegativ und 118 (36,2%) nodalpositiv. Zum Zeitpunkt unserer Datenerhebung lag bei keiner Patientin eine Fernmetastasierung vor (Ausschlusskriterium). Die Lokalisation der Karzinome bei den Patientinnen unserer Studie war wie folgt verteilt: 124 (38%) Karzinome befanden sich im oberen äußeren Quadranten der Mamma, 202 (62%) Karzinome befanden sich in den übrigen Quadranten der Mamma Art und Verlauf der Tumortherapie Operative Therapie In unserem Patientinnenkollektiv wurde bei 265 (81,3%) Patientinnen eine brusterhaltende Operation mit adjuvanter Radiatio der Brustdrüse durchgeführt, bei 61 (18,7%) Patientinnen primär eine Mastektomie. Zum Staging des Lymyphknotenstatus wurde bei 175 (53,7%) der Patientinnen eine alleinige Sentinellymphonodektomie durchgeführt, bei 16 (4,9%) eine Sentinellymphonodektomie mit nachfolgender Axilladissektion in einer Zweitoperation (sekundäre Axilladissektion) und bei 135 (41,4%) eine primäre Axilladissektion.
34 22 Bei insgesamt 44 Karzinomen fand eine Brustrekonstruktion statt, hierbei wurden 33 (10,1%) primär und 11 (3,4%) sekundär durchgeführt. Unter den primären Brustrekonstruktionen waren 4 (1,2%) autolog und 30 (9,2%) heterolog. Bei einer Patientin wurde primär sowohl eine autologe als auch eine heterologe Rekonstruktion durchgeführt. Bei den sekundär durchgeführten waren 5 autolog (1,5%) und 6 (1,8%) heterolog. Bei 104 (31,9%) Patientinnen fand eine Zweitoperation statt. Hier wurden bei 62 (19%) Patientinnen eine Nachresektion, bei 33 (10,1%) Patientinnen eine sekundäre Ablatio, bei 18 (5,5%) der Patientinnen eine sekundäre Axilladissektion, und bei 4 (1,2%) Patientinnen eine Revision durchgeführt. Bei 14 (4,3%) Patientinnen wurde eine sonstige Zweitoperation durchgeführt (hierzu zählten die Mastopexie und Mamillenrekonstruktion, eine Prothesenkorrektur und Neueinlage der Prothese, Narbenkorrekturen, Wunddebridement bei Wundheilungsstörungen, TE eines DCIS). Perioperativ ergaben sich bei 76 (23,3%) Patientinnen unseres Kollektivs Komplikationen. Am häufigsten hatten die Patientinnen eine Wundheilungsstörung (7,1%) an, weitere Komplikationen waren Nachblutungen und Hämatome (n=17; 5,2%), Serome (n=31; 9,5%) und sonstige Komplikationen (n=18; 5,5%) Systemische Therapie 298 (91,4%) der diagnostizierten Karzinome unseres Patientenkollektivs wurden systemisch therapiert. 209 Patientinnen erhielten eine Chemotherapie. Bei 136 (41,7% des Gesamtkollektivs) Patientinnen wurde sie adjuvant und bei 73 (22,4%) Patientinnen neoadjuvant durchgeführt. Bei 125 Patientinnen war die Chemotherapie taxanhaltig. 78,4% der Patientinnen, die eine taxanhaltige Chemotherapie erhielten, bekamen Paclitaxel, 21,6% der Patientinnen Docetaxel. Von den Patientinnen mit systemischer Therapie, bekamen 248 Patientinnen (83,2%) eine endokrine Therapie, und 42 Patientinnen (14%) eine Therapie mit Trastuzumab (Abbildung 3.3).
35 23 Abbildung 3.3: Übersicht über die systemische Therapie im Patientinnenkollektiv Radiatio 269 (82,5%) der Karzinome wurden bestrahlt. Hierbei wurde bei 234 brusterhaltend operierten Patientinnen die Restbrust und bei 34 Patientinnen die Thoraxwand eingeschlossen, in 62 Fällen wurden die Lymphabflusswege bestrahlt Rezidiv-Operationen Insgesamt wurden im vorliegenden Patientinnenkollektiv 20 Rezidivoperationen durchgeführt, hiervon 9 Mastektomien (45% der Rezidivoperationen),10 Tumorentfernungen aus der Brust (50% der Rezidivoperationen) und 1 Lymphonodektomie der Axilla. 16 (61,5%) der Rezidivoperationen wurden in den ersten fünf Jahren nach Erstdiagnose des Mammakarzinoms durchgeführt, 10 (38,5%) danach Vorliegen lymphologisch relevanter Begleiterkrankungen Folgende Begleiterkrankungen kamen in unserem Patientinnenkollektiv vor: 105 Patientinnen (34,4%) gaben eine orthopädische Erkrankung im Schultergürtelbereich an. Bei 24 (7,9%) Patientinnen lag ein Diabetes mellitus vor, Arterielle Hypertonie
36 24 wurde von 105 (34,4%) Patientinnen angegeben. 136 (44,6%) Patientinnen litten an einer Schilddrüsenfunktionsstörung. Die Adipositas wurde mittels BMI ermittelt werden. 84 (27,5%) Patientinnen waren adipös (BMI>25). Desweiteren gaben 22 (7,2%) Patientinnen eine rheumatische Erkrankung an. Psychiatrische Erkrankungen (Depression) lagen bei 62 (20,3%) Patientinnen vor, Hauterkrankungen bei 50 (16,4%) Patientinnen. An CVI litten 3 Patientinnen, am nephrotischen Syndrom 1 Patientin (Abbildung 3.4). Abbildung 3.4: Übersicht über Bergleiterkrankungen im Patientinnenkollektiv Körperliche Beanspruchung Wir erfragten, wie viele Stunden am Tag die Patientinnen ihre Arme beanspruchten. 271 (83,1%) Patientinnen gaben an, ihre Arme im Alltag nicht zu belasten. 55 (16,9%) Patientinnen belasteten ihre Arme im Alltag im Median 6 Stunden (Minimum 1 Stunde, Maximum 12 Stunden). Unter Beanspruchung zählten wir, wenn Patientinnen die Beanspruchung als Belastung empfanden, also hohen alltäglichen Anforderungen ausgesetzt waren, wie zum Beispiel beruflich bedingt als Reinigungskraft oder an der Kasse, oder durch tägliche schwere Hausarbeit.
37 Deskriptive Analyse des Patientinnenkollektivs mit Lymphödem Alter bei Auftreten des Lymphödems, Latenzzeit und Lokalisation Zum Zeitpunkt der Untersuchung hatten 116 (35,6%) Patientinnen ein sekundäres Lymphödem an Arm- und/ oder Brust bzw. Thoraxwand der jeweils vom Karzinom betroffenen Seite. Wir wählten als Bezugsgröße nicht die Patientinnenzahl, sondern die Karzinomanzahl, um das Auftreten des Lymphödems jeweils der rechten bzw. linken Seite voneinander unabhängig zu betrachten. Im Durchschnitt waren die vom Lymphödem betroffenen Patientinnen 56 (± 0,9) Jahre alt. Die Latenzzeit zwischen der Lymphonodektomie und dem Auftreten des Lymphödems betrug durchschnittlich 15 Monate, die Zeit zwischen der Radiatio und dem Auftreten des Lymphödems 12,2 Monate, und die Zeit von der Chemotherapie bis zum Auftreten des Lymphödems 12,3 Monate. Lokalisation der Ödemmanifestation: Bei 54 (46,6%) Patientinnen war das Lymphödem zentral betont, d.h. vor allem der Oberarm war betroffen, bei 53 (45,7%) Patientinnen distal, d.h. der Unterarm war eher betroffen. Der Handrücken war bei 21 (18,1%) Patientinnen betroffen. Ein Lymphödem der Brust lag bei 53 (45,7%) Lymphödempatientinnen vor und an der Thoraxwand konnte das Lymphödem bei 56 (48,3%) Patientinnen beobachtet werden. Es konnten auch mehrere Regionen bei einer Patientin gleichzeitig betroffen sein. Bei den meisten Patientinnen trat das Lymphödem an der vom Mammakarzinom betroffenen Seite auf. Jedoch gab es 6 Patientinnen, bei denen das Lymphödem auf der kontralateralen Seite, der Seite der Portanlage, auftrat. Hier war das Lymphödem bei 6 Patientinnen zentral betont, bei 4 trat das Lymphödem zusätzlich distal, und bei einer Patientin zusätzlich an der Thoraxwand auf Anamnese des Lymphödems unseres Patientinnenkollektivs Das Lymphödem trat bei 70 (60,3%) Patientinnen schleichend und bei 34 (29,3%) Patientinnen plötzlich auf. 12 (10,3%) Patientinnen konnten sich diesbezüglich nicht festlegen. 41 (35,3%) Patientinnen gaben an, einen Lymphödem auslösenden Faktor identifiziert zu haben. Angegebene auslösende Faktoren waren beispielsweise Hitze oder Sonnenbrand, iatrogen durch Port- oder Infusionsanlage sowie Verabreichung von Cortisonspritzen bei Sehnenscheidenverletzung. Verletzung im Garten am Rosendorn, Nordic walking oder berufliche Tätigkeiten wie die Arbeit an der Kasse oder in der Hauswirtschaft wurden ebenfalls als auslösende Faktoren berichtet. Einige Patientinnen gaben eine schwere körperliche Belastung als auslösenden
38 26 Faktor an. Auch therapeutische Faktoren zählten zu den auslösenden Faktoren. 7 Patientinnen bezeichneten die Radiatio als auslösenden Faktor, 4 Patientinnen die Chemotherapie, 5 Patientinnen die Rezidiv- bzw. die Zweitoperation. Mehrfach wurde das Auftreten eines Erysipels als auslösender Faktor für das Lymphödem genannt. Die Anamnese der subjektiven Beschwerden zeigte folgendes Ergebnis: Schweregefühl der betroffenen Stelle wurde 66 mal (56,9% der Patientinnen mit Lymphödem) angegeben, Schmerzen 30 mal (25,9%) und Sensibilitätsstörung 25 mal (21,6%). Die Patientinnen führten entweder nur eine oder gleichzeitig mehrere dieser Beschwerden an. Bei 14 Patientinnen (12,1%) war bereits ein- oder mehrfach ein Erysipel als Lymphödemkomplikation aufgetreten Klinik des Lymphödems unseres Patientinnenkollektivs Die klinische Untersuchung ergab folgende Befunde: 77 Mal befand sich das Lymphödem im Stadium 1, 19 Mal im Stadium 2 und 20 Mal wurde das Stadium des Lymphödems als unbekannt eingestuft. Dies lag daran, dass durch die fehlende einheitliche Definition für die Stadieneinteilung des reinen Lymphödems der Brust sowie der Thoraxwand solche Lymphödemmanifestationen in der vorliegenden Studie als Stadium unbekannt eingestuft wurden (20 Patientinnen mit reinem alleinigem oder kombiniertem Lymphödem der Brust und der Thoraxwand). Bei 88 (75,9%) Patientinnen wurde die Gewebekonsistenzveränderung des Lymphödems im Rahmen von lymphostatischen Fibrosen als weich bindegewebig, bei 17 (14,7%) Patientinnen als hart bindegewebig eingestuft. Bei 4 (3,45%) Patientinnen konnte eine Fettgewebsvermehrung festgestellt werden. Die Gewebekonsistenzänderung wurde bei 7 (6%) Patientinnen als unbekannt eingestuft. Bei diesen Patientinnen lag ein uneinheitlicher Befund zwischen Brust bzw. Thoraxwand, Ober- und Unterarm vor. Hier waren bei 46 (39,7%) Patientinnen der BH-Abdruck im Vergleich zur Gegenseite verstärkt. Generalisierte Ödeme (siehe Anhang) waren zusätzlich zum sekundären Lymphödem bei 48 (41,4%) unserer Patientinnen vorhanden.
39 Therapie des Lymphödems bei unserem Patientenkollektiv Die manuelle Lymphdrainage des Lymphödems war bei 3 (2,6%) Patientinnen zum Zeitpunkt der Studie noch nie durchgeführt worden. Bei 40 Patientinnen fand sie prophylaktisch statt. 50 (43%) Patientinnen erhielten eine manuelle Lymphdrainage seit der Manifestation des Lymphödems kontinuierlich und 23 (19,8%) Patientinnen intermittierend. Zum Zeitpunkt der Untersuchung war bei 55 (47,4%) Patientinnen noch nie eine Kompressionsbehandlung durchgeführt worden. Intermittierend wurde sie bei 36 (31%) Patientinnen und regelmäßig bei 16 (13,8%) Patientinnen durchgeführt. Bei 9 (7,8%) Patientinnen blieb es unklar, diese Patientinnen konnten sich nicht erinnern, ob und ggf. wie das Lymphödem z.b. während ihres Aufenthaltes in der Rehaklinik therapiert wurde. Auf die konsequente Hautpflege achteten 83 (71,6%) Patientinnen, 97 (83,6%) Patientinnen war die regelmäßige Bewegung des betroffenen Armes im Alltag sehr wichtig und wurde konsequent fortgeführt. Unter regelmäßiger Bewegung wurden die nicht belastenden, sondern wohltuenden Tätigkeiten, wie Sport, Dehnübungen oder Physiotherapie einbezogen Zusammenhangsanalyse Unsere Ergebnisse wurden sowohl mittels der logistischen Regression als auch mittels der Cox Regression analysiert. Mit beiden Modellen sollte der Zusammenhang zwischen dem Auftreten des Lymphödems und Patientinnen bezogenen, Tumor bezogenen sowie therapeutischen Faktoren dargestellt werden. Der Unterschied lag darin, dass im Cox- Regressionsmodell die Zeit als Variable mit einging Die Ergebnisse wurden wie folgt präsentiert: Im ersten Teil erfolgte die Darstellung der Ergebnisse aus der Berechnung mit der logistischen Regression, in einem zweiten Teil aus der Berechnung mittels der Cox-Regression. Beim univariaten Modell wurde jeweils der Zusammenhang zwischen nur einem Faktor mit dem Auftreten des Lymphödems analysiert. Beim multivariaten Modell gingen alle diejenigen Faktoren aus der univariaten Analyse, die hoch signifikant waren (p<0,01) in die Analyse mit ein.
40 Analyse mit logistischer Regression Univariate Analyse Patientinnencharakteristika und Lymphödemrisiko In der univariaten Analyse war der Zusammenhang zwischen BMI der Patientin und dem Auftreten des Lymphödems hoch signifikant. Je höhergradig die Adipositas der Patientin war, umso höher war ihr Risiko, an einem sekundären Lymphödem zu erkranken: Patientinnen mit einem BMI zwischen 30 und 35 hatten ein 2,13 fach höheres Risiko ein Lymphödem zu entwickeln als Patientinnen mit einem BMI<30 (95%CI für OR:1,12-4,03, p-wert=0,020). Das Risiko an Lymphödem zu erkranken war für Frauen mit einem BMI>35 sogar um das 5,64 fache erhöht im Vergleich zu Patientinnen mit einem BMI<30 (95% CI: 2,25-14,16, p-wert< 0,001). Keinen signifikanten Zusammenhang ergab sich aus dem Alter der Patientin bei Erstdiagnose des Mammakarzinom (p-wert= 0,627), ihrem Menopausenstatus (p- Wert= 0,824), und dem Nikotinabusus (p-wert= 0,7333; Abbildung 3.5) Tumorcharakteristika und Lymphödemrisiko Patientinnen, bei denen ein Lymphknotenbefall vorlag (pn1 Stadium bei Erstdiagnose des Mammakarzinom), hatten ein 2,64 höheres Risiko am Lymphödem zu erkranken als Patientinnen mit nodalnegativem Karzinom (95% CI 1,66-4,23, p- Wert <0,001). Die Tumorgröße und Lokalisation des Tumors hatten keinen Einfluss auf die Ausbildung des Lymphödems (Abbildung 3.5).
41 29 OR (95% CI) P Postmenopausal Prämenopausal N1/X N0 >T1/X T1 Oben-Außen Ja Obe-Außen Nein Li Ref. Ref. Ref. Ref ( ) ( ) < ( ) ( ) ( ) Re Ref. Nikotinabusus Ja 1.13 ( ) Nikotinabusus Nein BMI >35 Ref ( ) <0.001 BMI BMI <30 Alter ED MaKa Alter aktuell Ref ( ) ( ) ( ) Therapie des Mammakarzinoms und Lymphödemrisiko Operative Therapie und Lymphödemrisiko Folgende Faktoren beeinflussten die Entstehung eines Lymphödems: Das Risiko nach einer brusterhaltenden Operation war fast doppelt so hoch als nach Mastektomie (OR 1,90 mit 95%CI:1,003-3,55, p-wert=0,049). Patientinnen, bei denen eine primäre Axilladissektion durchgeführt wurde, hatten ein etwa 4 fach höheres Risiko am Lymphödem zu erkranken, als Patientinnen, bei denen lediglich eine Sentinellymphonodektomie durchgeführt wurde (OR 3,97 mit 95%CI: 2,34-6,73, p-wert<0,001) odds ratio Abbildung 3.5: Zusammenhangsanalyse des Lymphödems mit Tumor- sowie Patientenbezogenen Faktoren, logistische Regressionsanalyse
42 30 Bei Patientinnen, bei denen eine sekundäre Axilladissektion (in einer zweiten Operation) durchgeführt wurde, konnte eine Risikoerhöhung für das Auftreten des Lymphödems um das 3,61 fache festgestellt werden als bei Patientinnen, bei denen eine alleinige SNL durchgeführt wurde. Wurden mehr als 10 Lymphknoten entfernt, stieg das Lymphödem-Risiko um 3,37 fache an verglichen mit der Entnahme von 1 bis 5 Lymphknoten (95%CI: 2,03-5,59, p-wert <0,001). Postoperative Komplikationen erhöhten das Lymphödemrisiko um das Doppelte (OR 2,05 mit 95%CI: 1,22-3,46, p-wert=0,007). Traten Wundheilungsstörungen auf, so stieg das Risiko um das 2,52 fache am Lymphödem zu erkranken im Vergleich zu Patientinnen mit komplikationslosem postoperativem Verlauf (95% CI:1,07-5,95, p- Wert=0,034). Keinen Einfluss auf das Lymphödemrisiko hatte der Zeitpunkt der Sentinellymphonodedektomie in Bezug zur Chemotherapie (p-wert=0,504), sowie eine Nachblutung oder die Ausbildung eines Seroms (Tabelle 3.1), Zweit- oder Rezidivoperationen, und die Rekonstruktion der Brust (Abbildung 3.6).
43 31 Variablen Gesamt LÖ- LÖ+ OR (CI95%) P-Wert N (64,4%) 116 (35,6%) OP-Art (ErstOP) Ablatio (75,4%) 15 (24,6%) 1 BEO (61,9%) 101 (38,1%) 1,90 (1,003-3,55) 0,049 LNE <0,001 Nur SLN (78,3%) 38 (21,7%) 1 SLN->Axilladissektion (50%) 24 (50%) 3,61 (1,84-7,05) <0,001 Nur Axilladissektion (47,6%) 54 (52,4%) 3,97 (2,34-6,73) <0,001 LK entfernt <0, (75,9%) 38 (24,1%) (68,2%) 14 (31,8%) 1,47 (0,71-3,06) 0,229 > (48,4%) 64 (51,6%) 3,37 (2,03-5,59) <0,001 ZweitOP Nein (63,5%) 81 (36,5%) 1 Ja (66,3%) 35 (33,7%) 0,88 (0,54-1,44) 0,619 SLN vor Chemo Nein (63,9%) 107 (36,1%) 1 Ja (70%) 9 (30%) 0,76 (0,34-1,71) 0,504 Rekonstruktion (prim) Nein (62,8%) 109 (37,2%) Ja (78,8%) 7 (21,2%) 0,45 (0,19-1,08) 0,075 Komplikationen Nein (68,4%) 79 (31,6%) 1 Ja (51,3%) 37 (48,7%) 2,05 (1,22-3,46) 0,007 WHS Nein (66%) 103 (34%) 1 Ja (43,5%) 13 (56,5%) 2,52 (1,07-5,95) 0,034 Nachblutung/Hämatom Nein (64,7%) 109 (35,3%) 1 Ja (58,8%) 7 (41,2%) 1,28 (0,48-3,47) 0,622 Serom Nein (66,1%) 100 (33,9%) 1 Ja (48,4%) 16 (51,6%) 2,08 (0,99-4,38) 0,054 Tabelle 3.1: Zusammenhangsanalyse des Lymphödems mit therapiebezogenen Faktoren, logistische Regressionsanalyse Adjuvante Radiatio und Lymphödemrisiko Die adjuvante Radiatio der Brust nach brusterhaltender Operation oder der Thoraxwand nach Mastektomie hatten jeweils keinen Einfluss auf das Lymphödemrisiko. Jedoch spielte die Radiatio der Lymphabflusswege eine Rolle. Hier stieg das Risiko um das 2,48 fache, wenn die Lymphabflusswege bestrahlt wurden im Vergleich zu Patientinnen, bei denen die Lymphabflusswege nicht bestrahlt wurden (CI:1,41-4,36, p-wert=0,002; Abbildung 3.6) Systemische Therapie und Lymphödemrisiko Patientinnen, die eine Chemotherapie erhielten, hatten ein fast doppelt so hohes Risiko am Lymphödem zu erkranken als Patientinnen ohne Chemotherapie (OR 1,78 mit CI 1,09-2,92, p-wert=0,021). Einen Einfluss hatte auch, welche Substanzen verabreicht wurden. War die Chemotherapie taxanhaltig, so hatten Patientinnen etwa
44 32 ein dreifach hohes Risiko am Lymphödem zu erkranken (OR 2,86 mit CI 1,55-5,25, p-wert=0,001), als Patientinnen, bei denen keine taxanhaltige Chemotherapie verabreicht wurde. Ob die Chemotherapie adjuvant (p-wert=0,107) oder neoadjuvant (p-wert=0,402) durchgeführt wurde, spielte keine Rolle. Ebenfalls nicht signifikant war es, wenn Patientinnen eine endokrine Therapie (p- Wert=0,736) oder eine spezifische Antikörpertherapie mit Trastuzumab (p- Wert=0,744) erhielten (Abbildung 3.6). OR (95% CI) P RezOP (Ja) RezOP (Nein) Bestrahlung (LAW/Ja) Bestrahlung (LAW/Nein) Bestrahlung (Brust/Nein)) Bestrahlung (Thoraxwand) Bestrahlung (Restbrust) Bestrahlung (Ja) Bestrahlung (Nein) Endokrintherapie (Ja) Endokrintherapie (Nein) Trastuzumab (Ja) Trastuzumab (Nein) keine CT CT taxanhaltig (Ja) CT taxanhaltig (Nein) Chemotherapie neoad. (Ja) Chemotherapie neoad. (Nein) Chemotherapie ad. (Ja) Chemotherapie ad. (Nein) Chemotherapie (Ja) Chemotherapie (Nein) Syst. Therapie (Ja) Syst. Therapie (Nein) Ref. Ref. Ref. Ref. Ref. Ref. Ref. Ref. Ref. Ref. Ref ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) odds ratio Abbildung 3.6: Zusammenhangsanalyse des Lymphödems mit weiteren therapiebezogenen Faktoren, logistische Regressionsanalyse Begleiterkrankungen und Lymphödemrisiko In der univariaten Analyse hatten Patientinnen mit arterieller Hypertonie ein doppelt so hohes Risiko am Lymphödem zu erkranken als gesunde Patientinnen (OR 2,03 mit CI 1,27-3,26, p-wert=0,003).
45 33 Bei der Adipositas (BMI>35) stieg das Risiko im Vergleich zu Frauen mit Normalgewicht um das Dreifache an (OR 3,10 mit CI 1,88-5,14, p-wert <0,001). Patientinnen mit chronisch venöser Insuffizienz hatten ein höheres Lymphödemrisiko (p-wert=0,044), sowie Patientinnen, bei denen gleichzeitig ein Lipödem vorlag (p- Wert=0,015; Abbildung 3.7). Weitere internistische Erkrankungen wie Diabetes mellitus, rheumatische Erkrankungen und Schilddrüsenerkrankungen hatten keinen signifikanten Einfluss auf das Lymphödemrisiko. Ebenfalls konnte kein Einfluss auf die Ausbildung des Lymphödems bei Hauterkrankungen, orthopädischen Erkrankungen oder psychiatrischen Erkrankungen nachgewiesen werden Körperliche Beanspruchung und Lymphödemrisiko Patientinnen, die sich im Alltag stark körperlich beanspruchten, hatten ein doppelt so hohes Risiko am Lymphödem zu erkranken als Patientinnen mit normaler körperlicher Belastung (OR 2,16 mit CI 1,20-3,88, p-wert=0,010; Abbildung 3.7). OR (95% CI) P Körperliche Beanspruchung 2.16 ( ) Adipositas 3.10 ( ) <0.001 Hormon-Einnahme 1.07 ( ) Z.n. TBVT 0.79 ( ) Hauterkrankungen 1.43 ( ) Rheumatische Erkrankungen 2.09 ( ) Arterielle Hypertonie 2.03 ( ) psychiatrische Erkrankungen 1.33 ( Schilddrüsenfunktionsstörung 1.18 ( ) Diabetes mellitus 2.28 ( ) Orthopd. Erkrankungen 1.53 ( ) odds ratio Abbildung 3.7: Zusammenhangsanalyse des Lymphödems mit Begleiterkrankungen, logistische Regressionsanalyse
46 Multivariate Analyse der logistischen Regressionsanalyse Abbildung 3.8 zeigt die Odds Ratios der multivariaten Analyse des Lymphödems mit Variablen aus der univariaten Analyse der logistischen Regression mit p<0,001. Hieraus geht hervor, dass die primäre (OR 6,99, 95%CI 2, ), sowie sekundäre (OR 6,30, 95%CI 1,68-23,6) Axilladissektion, sowie ein BMI>35 (OR 2,52, 95%CI 1,14-5,53) mit einem erhöhten Lymphödemrisiko einhergingen. >10 LK entf LK entf. Körperliche Beanspruch. Diabetes M. Orthop. Erkrankung A. Hypertonie LAW Bestrahlung Taxanhaltige CT Komplikationen nur Axilla SLN->Axilla Prim. Rekonstruktion (Ja) BEO Oben-Außen N1/X >pt1 BMI >35 BMI OR (95% CI) P 0.79 ( ) 0.86 ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ( ) Abbildung 3.8: Multivariate Analyse des Lymphödems und Risikofaktoren aus univariater Analyse mit p<0,001, logistische Regressionsanalyse Analyse mit der Cox Regression Univariate Analyse adjustierte odds ratio Patientinnencharakteristika und Lymphödemrisiko Tabelle 3.2 zeigt Hazard ratios der univariaten Cox- Regressionsanalyse zum Zusammenhang des Lymphödem und Patientinnen- sowie Tumorcharakteristika.
47 35 Hieraus war die Assoziation des BMI, des Nodalstatus, der Tumorlokalisation mit dem Lymphödem ersichtlich: Patientinnen mit einem BMI>35 hatten in dieser Analyse ein dreifach höheres Risiko am Lymphödem zu erkranken als die Referenzgruppe (HR 3,28, 95%CI 1,93-5,57, p-wert<0,001). Die Gruppe mit BMI hatte statistisch kein signifikant erhöhtes Risiko (p-wert=0,018). Das Alter, der Menopausenstatus und Nikotinabusus hatten auch in der Cox Analyse keine Auswirkung auf die Ausbildung des Lymphödems Tumorcharakteristika und Lymphödemrisiko Nodalpositive Karzinome erhöhten das Lymphödemrisiko um das Doppelte im Vergleich zu nodalnegativen (HR 2,02, 95%CI 1,40-2,92, p-wert<0,001). Die Tumorlokalisation war in der Cox Regressionsanalyse ein Risikofaktor für die Ausbildung des Lymphödems. Tumoren des oberen äußeren Quadranten erhöhten das Risiko um 1,5 fache (HR 1,47, 95%CI 1,02-2,12, p-wert=0,04). Das Tumorstadium hatte in der Cox Regressionsanalyse keinen statistisch signifikanten Einfluss auf die Ausbildung eines Lymphödems (Tabelle 3.2). Variablen Gesamt LÖ- LÖ+ HR (CI95%) P-Wert N (64,4%) 116 (35,6%) BMI 26±0,3 25±0,3 28±0,6 <0,001 < (69,9%) 77 (30,1%) (52,2%) 22 (47,8%) 1,78 (1,11-2,87) 0,018 > (29,2%) 17 (70,8%) 3,28 (1,93-5,57) <0,001 pt T (68,2%) 63 (31,8%) 1 >T1/x (58,6%) 53 (41,4%) 1,40 (0,97-2,03) 0,071 pn N (72,9%) 55 (27,1%) 1 N1/x (50,4%) 61 (49,6%) 2,02 (1,40-2,92) <0,001 Seite Re (63,4%) 56 (36,6%) 1 Li (65,3%) 60 (34,7%) 0,93 (0,65-1,34) 0,702 Oben-Außen Nein (68,3%) 64 (31,7%) 1 Ja (58,1%) 52 (41,9%) 1,47 (1,02-2,12) 0,040 Tabelle 3.2: Zusammenhangsanalyse des Lymphödems mit Patientinnensowie Tumorcharakteristika, Cox-Regressionsanalyse Therapie des Mammakarzinom und Lymphödemrisiko Operative Therapie und Lymphödemrisiko Tabelle 3.3 zeigt die univariaten Hazard Ratios der operativen Therapiemaßnahmen des Mammakarzinom im Zusammenhang zum Lymphödem.
48 36 Folgende Faktoren zeigten einen Zusammenhang zu einem erhöhtem Lymphödemrisiko: Patientinnen mit BEO hatten ein höheres Risiko am Lymphödem zu erkranken als bei einer Ablatio (HR 1,78 mit 95%CI 1,04-3,07, p-wert=0,037). Patientinnen mit Axilladissektion (primär (HR 2,14, 95%CI 1,40-3,68, p-wert<0,001) und sekundär (HR 2,30, 95%CI 1,62-4,50, p-wert<0,001) hatten ein doppelt so hohes Lymphödemrisiko als Patientinnen mit alleiniger Sentinellymohonodektomie. Wurden mehr als 10 Lymphknoten entfernt, stieg das Lymphödemrisiko auf das Doppelte an (HR 2,16 mit 95%CI 1,44-3,23, p-wert<0,001). Ergaben sich postoperative Komplikationen, so stieg das Lymphödemrisiko um das 1,7 fache an (HR 1,70 mit 95%CI 1,15-2,51, p-wert=0,008). Hier waren vor allem Wundheilungsstörungen ausschlaggebend: das Lymphödemrisiko stieg auf das Doppelte (HR 2,21 mit 95%CI 1,23-3,94, p-wert=0,008). Die Ausbildung eines Seroms erhöhte das Risiko um das 1,71 fache am Lymphödem zu erkranken, im Vergleich zu Patientinnen, bei denen postoperativ kein Serom aufgetreten war (HR 1,71 mit 95%CI 1,01-2,91, p-wert 0,046). Folgende Faktoren hatten keinen Einfluss auf ein erhöhtes Lymphödemrisiko: Rezidivoperation (p-wert=0,829), Nachblutungen (p-wert=0,454), Zeitpunkt der Chemtherapie bezüglich der Axilladissektion (p-wert=0,995). Die primäre Rekonstruktion schien einen protektiven Effekt zu haben (HR 0,40 mit 95%CI 0,18-0,86, p-wert=0,019).
49 37 Variablen Gesamt LÖ- LÖ+ HR (CI95%) P-Wert N (64,4%) 116 (35,6%) OP-Art (ErstOP) Ablatio (75,4%) 15 (24,6%) 1 BEO (61,9%) 101 (38,1%) 1,78 (1,04-3,07) 0,037 LNE <0,001 Nur SLN (78,3%) 38 (21,7%) 1 SLN->Axilladissektion (50%) 24 (50%) 2,30 (1,62-4,50) <0,001 Nur Axilladissektion (47,6%) 54 (52,4%) 2,14 (1,40-3,68) <0,001 LK entfernt <0, (75,9%) 38 (24,1%) (68,2%) 14 (31,8%) 1,45 (0,78-2,67) 0,239 > (48,4%) 64 (51,6%) 2,16 (1,44-3,23) <0,001 ZweitOP Nein (63,5%) 81 (36,5%) 1 Ja (66,3%) 35 (33,7%) 0,85 (0,58-1,28) 0,447 SLN vor Chemo Nein (63,9%) 107 (36,1%) 1 Ja (70%) 9 (30%) 1,00 (0,50-1,98) 0,995 Rekonstruktion (prim) Nein (62,8%) 109 (37,2%) Ja (78,8%) 7 (21,2%) 0,40 (0,18-0,86) 0,019 Komplikationen Nein (68,4%) 79 (31,6%) 1 Ja (51,3%) 37 (48,7%) 1,70 (1,15-2,51) 0,008 WHS Nein (66%) 103 (34%) 1 Ja (43,5%) 13 (56,5%) 2,21 (1,23-3,94) 0,008 Nachblutung/Hämatom Nein (64,7%) 109 (35,3%) 1 Ja (58,8%) 7 (41,2%) 1,34 (0,62-2,87) 0,454 Serom Nein (66,1%) 100 (33,9%) 1 Ja (48,4%) 16 (51,6%) 1,71 (1,01-2,91) 0,046 Tabelle 3.3: Zusammenhangsanalyse des Lymphödems mit therapiebedingten Faktoren, Cox- Regressionsanalyse Adjuvante Radiatio und Lymphödemrisiko Die adjuvante Radiatio der Restbrust (p-wert=0,166) und der Thoraxwand (p- Wert=0,065) hatten keinen Einfluss auf das Lymphödemrisiko, während die adjuvante Radiatio der Lymphabflusswege das Lymphödemrisiko verdoppelte (HR 1,97 mit 95% CI 1,31-2,96, p-wert=0,001; Tabelle 3.4) Systemische Therapie und Lymphödemrisiko Tabelle 3.4 zeigt die Hazard Ratios der systemischen Therapie im Zusammenhang mit dem Lymphödem. Hier war es ausschlaggebend, ob die Patientin eine Chemotherapie erhalten hatte (HR 1,58 mit 95%CI 1,05-2,38, p-wert=0,029), und ob diese Taxanhaltig war (HR 2,57 mit 95%CI 1,56-4,25, p-wert<0,001). Ob die Chemotherapie adjuvant (p-wert=0,196) oder neoadjuvant (p-wert=0,266) durchgeführt wurde, war für das Lymphödemrisiko unerheblich. Die endokrine
50 38 Therapie (p-wert=0,669), sowie die Therapie mit Trastuzumab (p-wert=0,744) hatten keinen Effekt auf das Lymphödemrisiko (Tabelle 3.4). Variablen Gesamt LÖ- LÖ+ HR (CI95%) P-Wert N (64,4%) 116 (35,6%) Syst. Therapie (gesamt) Nein (67,9%) 9 (32,1%) 1 Ja (64,1%) 107 (35,9%) 1,39 (0,69-2,81) 0,363 Chemotherapie Nein (72,6%) 32 (27,4%) 1 Ja (59,8%) 84 (40,2%) 1,58 (1,05-2,38) 0,029 Chemotherapie adjuv. Nein (68,1%) 60 (31,9%) 1 Ja (59,4%) 56 (40,6%) 1,27 (0,88-1,83) 0,196 Chemotherapie neoadjuv. Nein (65,6%) 87 (34,4%) 1 Ja (60,3%) 29 (39,7%) 1,27 (0,83-1,94) 0,266 Taxanhaltig <0,001 Nein (73,8%) 22 (26,2%) 1 Ja (50,4%) 62 (49,6%) 2,57 (1,56-4,25) <0,001 Keine CHT (72,4%) 32 (27,4%) 1,18 (0,68-2,04) 0,560 Trastuzumab Nein (64,1%) 102 (35,9%) 1 Ja (66,7%) 14 (33,3%) 1,01 (0,57-1,76) 0,744 Endokrintherapie Nein (62,8%) 29 (37,2%) 1 Ja (64,9%) 87 (35,1%) 1,10 (0,71-1,69) 0,669 Bestrahlung (gesamt) Nein (73,7%) 15 (26,3%) 1 Ja (62,5%) 101 (37,5%) 1,67 (0,96-2,89) 0,150 Bestrahlung (Brust) 0,084 Restbrust (61,1%) 91 (38,9%) 1 Toraxwand (73,5%) 9 (26,5%) 0,60 (0,30-1,19) 0,166 Keine (72,4%) ,6%) 0,65 (0,35-1,03) 0,065 Bestrahlung (LAW) Nein (68,6%) 83 (31,4%) 1 Ja (46,8%) 33 (53,2%) 1,97 (1,31-2,96) 0,001 RezidivOP Nein (64,7%) 108 (35,3%) 1 Ja (60%) 8 (40%) 0,92 (0,45-1,91) 0,829 Tabelle 3.4: Zusammenhangsanalyse des Lymphödems mit weiteren therapiebezogenen Faktoren, Cox- Regressionsanalyse
51 Begleiterkrankungen und Lymphödemrisiko Adipöse Patientinnen hatten ein mehr als doppelt so hohes Risiko am Lymphödem zu erkranken als normalgewichtige Patientinnen (HR 2,67 mit 95% CI 1,83-3,89, p- Wert<0,001), siehe oben. Unter den internistischen Erkrankungen zeigte die Hazard Ratio der arteriellen Hypertonie einen Zusammenhang mit dem Auftreten des Lymphödems (HR 1,60 mit 95%CI 1,10-2,30, p-wert=0,013). Auch das Vorhandensein eines Lipödems erhöhte das Lymphödemrisiko (p-wert=0,015), zur Berechnung des Hazard Ratio waren die Fallzahlen hier zu klein. Andere Internistische Erkrankungen, sowie orthopädische oder psychiatrische Erkrankungen hatten keinen Einfluss auf das Lymphödemrisiko (Tabelle 3.5) Körperliche Beanspruchung und Lymphödemrisiko Patientinnen, die sich stark körperlich beanspruchten hatten ein signifikant höheres Lymphödemrisiko (HR 1,53 mit 95% CI 1,01-2,53, p-wert=0,048), als Patientinnen, die die betroffene Extremität nicht übermäßig belasteten (Tabelle 3.5). Variablen Gesamt LÖ- LÖ+ HR (CI95%) P-Wert N (64,4%) 116 (35,6%) Orthopäd. Erkrankungen Nein (67,7%) 70 (32,3%) 1 Ja (57,8%) 46 (42,2%) 1,19 (0,82-1,73) 0,358 Diabetes mellitus Nein (65,9%) 103 (34,1%) 1 Ja (45,8%) 13 (54,2%) 1,73 (0,97-3,10) 0,062 Schilddrüsenfunktionsstörung Nein (66,1%) 61 (33,9%) 1 Ja (62,3%) 55 (37,7%) 1,18 (0,80-1,66) 0,456 psychiatrische Erkrankungen Nein (65,8%) 89 34,2%) 1 Ja (59,1%) 27 (40,9%) 1,33 (0,86-2,05) 0,195 Arterielle Hypertonie Nein (70,1%) 64 (29,9%) 1 Ja (53,6%) 52 (46,4%) 1,60 (1,10-2,30) 0,013 Rheumatische Erkrankungen Nein (65,7%) 104 (34,3%) 1 Ja (47,8%) 12 (52,2%) 1,69 (0,93-3,07) 0,087 Hauterkrankungen Nein (65,8%) 93 (34,2%) 1 Ja (57,4%) 23 (42,6%) 1,34 (0,85-2,12) 0,211 Lipödem Nein (65,2%) 112 (34,8%) 1 Ja (100%) - 0,015 Adipositas Nein (71,7%) 67 (28,3%) 1 Ja (44,9%) 49 (55,1%) 2,67 (1,83-3,89) <0,001 Körperliche Beanspruchung Nein (67,5%) 88 (32,5%) 1 Ja (49,1%) 28 (50,9%) 1,53 (1,01-2,53) 0,048 Tabelle 3.5: Zusammenhangsanalyse des Lymphödems mit Begleiterkrankungen, Cox- Regressionsanalyse
52 Multivariate Analyse der Cox- Regressionsanalyse Tabelle 3.6 zeigt in der multivariaten Analyse die Erhöhung des Lymphödemrisikos bei einem BMI>35 im Initialmodell (HR 2,223 mit 95%CI 1,226-4,030m p- Wert=0,009) sowie im Finalmodell (HR 3,031 mit 95%CI 1,764-5,210, p- Wert=0,000). Die Gruppe BMI hatte statistisch kein signifikant erhöhtes Lymphödemrisiko. Ebenfalls statistisch signifikant war im Initialmodell, dass taxanhaltige Chemotherapeutika das Risiko am Lymphödem zu erkranken, erhöhten (HR 1,848, 95%CI 1,019-3,350, p- Wert=0,043). Dies konnte im Finalmodell nicht reproduziert werden. Postoperative Komplikationen erhöhten das Lymphödemrisiko sowohl im Initialmodell (HR 1,581 mit 95%CI 1,050-2,380, p-wert=0,028), als auch im Finalmodell (HR 1,631 mit 95%CI 1,098-2,425, p-wert=0,016). Die primäre Axilladissektion war ein Risikofaktor für die Ausbildung des Lymphödems, dies war im Initialmodell (HR 2,580 mit 95%CI 1,034-6,439, p- Wert=0,042), sowie auch im Finalmodell statistisch signifikant (HR 2,989 mit 95%CI 1,773-5,039, p-wert=0,00). Im Finalmodell war auch die sekundäre Axilladissektion ein statistisch signifikanter Risikofaktor (HR 2,263 mit 95%CI 1,465-3,496, p-wert=0,00). Weiterhin wurde die BEO im Finalmodell als Risikofaktor für das Auftreten des Lymphödem identifiziert (HR 2,001 mit 95%CI 1,139-3,515, p-wert=0,016).
53 41 P-Wert HR 95,0% für HR Initialmodel Finalmodel BMI <30 0,031 1 BMI ,482 1,206 0,716 2,031 BMI >35 0,009 2,223 1,226 4,030 >T1 0,796 1,062 0,673 1,674 N1 0,723 0,890 0,466 1,699 Oben-Außen 0,322 1,225 0,820 1,830 BEO 0,054 1,827 0,989 3,372 Nur SLN 0,127 1 SLN->Axilla 0,042 2,580 1,034 6,439 Nur Axilla 0,102 1,877 0,883 3, LK 0, LK. 0,831 1,082 0,526 2,225 >10 LK 0,921 1,039 0,490 2,201 Rekonstruktion 0,230 0,589 0,248 1,398 Komplikation 0,028 1,581 1,050 2,380 Taxanhaltig 0,125 1 Taxanhaltig 0,043 1,848 1,019 3,350 Keine CT 0,246 1,433 0,781 2,630 LAW bestrahlung 0,464 1,219 0,718 2,070 Diabetes M. 0,352 1,356 0,714 2,574 A.Hypertonie 0,245 1,287 0,8410 1,970 Rheumatische Erk. 0,167 1,570 0,829 2,976 Körp. Beanspruchung 0,187 1,343 0,866 2,082 BMI <30 0,000 1 BMI ,088 1,520 0,940 2,459 BMI >35 0,000 3,031 1,764 5,210 BEO 0,016 2,001 1,139 3,515 Nur SLN 0,000 1 SLN->Axilla 0,000 2,989 1,773 5,039 Nur Axilla 0,000 2,263 1,465 3,496 Rekonstruktion 0,051 0,455 0,206 1,005 Komplikationen 0,016 1,631 1,098 2,425 Tabelle 3.6: Multivariate Analyse der Cox- Regressionsanalyse mit Variablen mit p<0,001 aus univariater Analyse Zusammenhangsanalyse des reines Brustlymphödems in Abhängigkeit Patientinnen- Tumor- und Therapiebezogener Faktoren Unter den Patientinnen mit Lymphödem (116) hatten 13 Patientinnen (11,2% aller Lymphödempatientinnen und 3,99% des Gesamtkollektivs) ein reines Brustlymphödem. Tabelle 3.7 zeigt die Zusammenhangsanalyse des reinen Brustlymphödems im Vergleich zum kombinierten Lymphödem der Arme mit Brust und/ oder Thoraxwand bezüglich der Patientinnen- und Tumorcharakteristika. Hier zeigte sich, dass Patientinnen mit reinem Brustlymphödem bei Erstdiagnose des Mammakarzinoms im Durchschnitt älter waren als Patientinnen mit kombiniertem Lymphödem der Arme mit Brust und/ oder Thoraxwand (p=0,038). Zudem zeigte sich, dass bei den Frauen mit reinem Brustlymphödem in 76,9% der Fälle ein nodalnegatives Karzinom vorlag,
54 42 bei 3 Patientinnen mit reinem Lymphödem der Brust waren bei Erstdiagnose die Lymphknoten befallen. Der Menopausenstatus, der BMI- Wert, Nikotinabusus, das Tumorstadium oder die Tumorlokalisation hatten keinen Einfluss auf die Erhöhung des Risikos am reinen Brustlymphödem zu erkranken im Vergleich zum kombinierten Lymphödem der Arme mit Brust und/ oder Thoraxwand. Variablen Gesamt LÖ (Brust) LÖ (andere) P-Wert N Alter aktuell 60,8±0,8 63,7±2,8 60,5±0,9 0,228 Alter ED MaKa 54,5±0,9 59,6±3,1 53,8±0,9 0,038 Menopausenstatus Prämenopausal 40 (34,4%) 3 (23,1%) 37 (35,9%) 0,538 Postmenopausal 76 (75,5%) 10 (76,9%) 66 (64,1%) BMI 28,1±0,6 29±2,2 28±0,6 0,599 Nikotinabusus Nein 103 (88,8%) 12 (92,3%) 91 (88,3%) 1,000 Ja 13 (11,2%) 1 (7,7%) 12 (11,7%) pt T1 63 (54,3%) 7 (53,8%) 56 (54,4%) 0,972 >T1/x 47 (45,5%) 6 (46,2%) 47 (45,6%) pn* N0 55 (47,4%) 10 (76,9%) 45 (43,7%) 0,024 N1/x 61 (52,6%) 3 (23,1%) 58 (56,3%) Seite Re 56 (48,3%) 4 (30,8%) 52 (50,5%) Li 60 (51,7%) 9 (69,2%) 51 (49,5%) 0,180 Oben-Außen Nein 64 (55,2%) 7 (53,8%) 57 (55,3%) 0,919 Ja 52 (44,8%) 6 (46,2%) 46 (44,7%) Tabelle 3.7: Zusammenhangsanalyse des reinen Brustlymphödems mit Patientinnen- und Tumorcharakteristika Tabelle 3.8 zeigt die Zusammenhangsanalyse des reinen Brustlymphödems im Vergleich zum kombinierten Arm- und Brust-/ oder Thoraxwandlymphödems bezüglich der operativen Therapie. Hieraus ging hervor, dass unter den Patientinnen mit reinem Brustlymphödem 76,9% eine alleinige Sentinellymphonodektomie bekommen hatten. Unter den Patientinnen, mit kombinierten Lymphödem der Arme und/ oder Brust mit/ ohne Thoraxwand erhielten 72,8% eine primäre oder sekundäre Axilladissektion (p-wert=0,003). Die Wahl der Primäroperation (Brusterhaltende Operation im Vergleich zur Mastektomie) hatte keinen signifikanten Einfluss auf die Ausbildung des reinen Brustlymphödems (p-wert=1,0). Ebenso konnte keine Risikoerhöhung für die Ausbildung eines reinen Brustlymphödems für eine Zweitoperation (p-wert=0,339), einer Brustrekonstruktion (p-wert=1,0) oder perioperativen Komplikationen (p- Wert=0,220) gezeigt werden.
55 43 Gesamt LÖ (Brust) LÖ (andere) P-Wert N OP-Art (ErstOP) Ablatio 15 (12,9%) 1 (7,7%) 14 (13,6%) BEO 101 (87,1%) 12 (92,3%) 89 (86,4%) 1,000 LNE Nur SLN 38 (32,8%) 10 (76,9%) 28 (27,2%) SLN->Axilladissektion 24 (20,7%) 1 (7,7%) 23 (22,3%) Nur Axilladissektion 54 (46,6%) 2 (15,4%) 52 (50,5%) 0,003 LK entfernt 12±0,8 5,6±1,4 12,6±0,8 0,004 Zweitoperation Nein 81 (69,8%) 11 (84,6%) 70 (68%) Ja 35 (30,2%) 2 (15,4%) 33 (32%) SLN vor Chemo Nein 107 (92,2%) 10 (76,9%) 97 (24,2%) Ja 9 (7,8%) 3 (23,1) 6 (5,8%) Rekonstruktion Nein 109 (94%) 13 (100%) 96 (93,2%) Ja 7 (6%) 0 (0%) 7 (6,8%) Komplikationen Nein 79 (68,1%) 11 (84,6%) 68 (66%) Ja 37 (31,9%) 2 (15,4%) 35 (34%) WHS Nein 103 (88,8%) 13 (100%) 90 (87,4%) Ja 13 (11,2%) 10 (0%) 13 (12,6%) Nachblutung/Hämatom Nein 109 (94%) 12 (92,3%) 97 (94,2%) Ja 7 (6%) 1 (7,7%) 6 (5,8%) Serom Nein 100 (86,2%) 13 (100%) 87 (84,5%) Ja 16 (13,8%) 0 (0%) 16 (15,5%) 0,339 0,063 1,000 0,220 0,356 0,575 0,210 Tabelle 3.8: Zusammenhangsanalyse des reinen Brustlymphödems mit therapiebezogenen Faktoren Tabelle 3.9 zeigt die Zusammenhangsanalyse des reinen Brustlymphödems bezüglich der systemischen- sowie der Strahlentherapie im Vergleich zum kombinierten Lymphödem. Hieraus ging hervor, dass Patientinnen, die eine Chemotherapie erhielten, häufiger am kombinierten Arm- und Brust-/ oder Thoraxwandlymphödem erkrankten als am reinen Brustlymphödem (p-wert=0,043). Weitere Faktoren der systemischen Therapie wie die Therapie mit Trastuzumab oder der endokrinen Therapie hatten keinen Einfluss auf die Ausbildung eines reinen Lymphödems der Brust im Vergleich zum kombinierten Lymphödem mit den Armen.
56 44 Variablen Gesamt LÖ (Brust) LÖ (andere) P-Wert N Syst. Therapie (gesamt) Nein 9 (7,8%) 0 (0%) 9 (8,7%) 0,595 Ja 107 (92,2%) 13 (100%) 94 (91,3%) Chemotherapie* Nein 32 (27,6%) 7 (53,8%) 25 (24,3%) 0,043 Ja 84 (72,4%) 6 (46,2%) 78 (75,7%) Taxanhaltig Nein 22 (19%) 1 (7,7%) 21 (20,4%) 0,072 Ja 62 (53,4%) 5 (38,5%) 57 (55,3%) Keine CT 32 (27,6%) 7 (53,8%) 25 (24,3%) Trastuzumab Nein 102 (87,9%) 12 (92,3%) 90 (87,4%) 1,000 Ja 14 (12,1%) 1 (7,7%) 13 (12,6%) Endokrine Therapie Nein 29 (25%) 1 (7,7%) 28 (27,2%) 0,180 Ja 87 (75%) 12 (92,3%) 75 (72,8%) Bestrahlung (gesamt) Nein 15 (12,9%) 1 (7,7%) 14 (13,6%) 1,000 Ja 101 (87,1%) 12 (92,3%) 89 (86,4%) Bestrahlung (Brust) Restbrust 91 (78,4%) 12 (92,3%) 79 (76,7%) 0,389 Toraxwand 9 (7,8%) 0 (0%) 9 (8,7%) Keine 16 (13,8%) 1 (7,7%) 15 (14,6%) Bestrahlung (LAW) Nein 83 (71,6%) 12 (92,3%) 71 (68,9%) 0,106 Ja 33 (28,4%) 1 (7,7%) 32 (31,1%) Tabelle 3.9: Zusammenhangsanalyse des reinen Brustlymphödem mit weiteren therapiebezogenen Faktoren Tabelle 3.10 zeigt, den Zusammenhang zwischen der Lymphonodektomie und der Gabe der Chemotherapie. Es wurde deutlich, dass Patientinnen mit Axilladissektion häufiger eine Chemotherapie erhalten hatten, als Patientinnen mit SNL (60,4% vs. 12,1%). LNE SNL SNL->Axilla Axilla CT Nein Ja Gesamtsumme ,7% 12,1% 32,8% ,0% 20,7% 20,7% ,9% 39,7% 46,6% Tabelle 3.10: Zusammenhang zwischen der Gabe der Chemotherapie und der Art der Lymphonodektomie Tabelle 3.11 zeigt die Zusammenhangsanalyse für die Ausbildung des kombinierten Arm- und/ oder Brust und/ oder Thoraxwandlymphödems bezüglich der Variablen Chemotherapie sowie Lymphonodektomie. Hieraus geht hervor, dass nicht die Gabe der Chemotherapie, sondern die damit einhergehende häufiger durchgeführte
57 45 Axilladissektion zur erhöhten Rate am kombinierten Lymphödem geführt hatte (OR 8,436, 95%CI 1,503-47,341, p-wert=0,015). P-Wert Risiko 95% Konfidenzintervall für OR (OR) Chemo,782,820,201 3,347 SNL,032 1 SNL->axilla,015 8,436 1,503 47,341 Axilla,902 1,167,099 13,691 Tabelle 3.11: Zusammenhangsanalyse für die Ausbildung des kombinierten Lymphödems in Abhängigkeit der Chemotherapie sowie der Art der Lymphonodektomie Tabelle 3.12 stellt die Zusammenhangsanalyse des reinen Brustlymphödems mit lymphologisch relevanten Nebenerkrankungen dar. Hieraus ging hervor, dass unter den Patientinnen mit reinem Brustlymphödem der Anteil der am Diabetes mellitus erkrankten Patientinnen höher war unter den Patientinnen unter den Patientinnen mit kombiniertem Lymphödem. Weitere internistische, orthopädische oder psychiatrische Erkrankungen zeigten keinen signifikanten Einfluss auf die Ausbildung des reinen Brustlymphödems im Vergleich zur Ausbildung eines kombinierten Arm-Brust-/oder Thoraxwandlymphödems.
58 46 Variablen Gesamt LÖ (Brust) LÖ (kombiniert) p-wert N Orthopäd. Erkrankungen Nein 70 (60,3%) 6 (46,2%) 64 (62,1%) Ja 46 (39,7%) 7 (53,8%) 39 (37,1%) 0,267 Diabetes mellitus Nein 103 (88,8%) 8 (61,5%) 95 (92,2%) Ja 13 (11,2%) 5 (38,5%) 8 (7,8%) 0,006 Schilddrüsenfunktionsstörung Nein 61 (52,6%) 6 (46,2%) 55 (53,4%) Ja 55 (47,4%) 7 (53,8%) 48 (46,6%) 0,622 psychiatrische Erkrankungen Nein 89 (76,7%) 8 (61,5%) 81 (78,6%) Ja 27 (23,3%) 5 (38,5%) 22 (21,4%) 0,178 Nephrotisches Syndrom Nein 115 (99,1%) 13 (100%) 102 (99%) Ja 1 (0,9%) 0 1 (1%) 1,000 Arterielle Hypertonie Nein 64 (55,2%) 6 (46,2%) 58 (56,3%) Ja 52 (53,8%) 7 (53,8%) 45 (43,7%) 0,488 Rheumatische Erkrankungen Nein 104 (89,7%) 11 (84,6%) 93 (90,3%) Ja 12 (10,3%) 2 (15,4%) 10 (9,7%) 0,623 Hauterkrankungen Nein 93 (80,2%) 82 (79,6%) 11 (84,6%) Ja 23 (19,8%) 21 (20,4%) 2 (15,4%) 1,000 CVI Nein 113 (97,4%) 13 (100%) 100 (97,1%) Ja 3 (2,6%) 0 3 (2,9%) 1,000 Z.n. TBVT Nein 114 (98,3%) 13 (100%) 101 (98,1%) Ja 2 (1,7%) 0 (0%) 2 (1,9%) 1,000 Lipödem Nein 112 (96,6%) 13 (100%) 99 (96,1%) Ja 4 (3,4%) 0 4 (3,9%) 1,000 Hormon-Einnahme Nein 106 (91,4%) 12 (92,3%) 94 (91,3%) Ja 10 (8,6%) 1 (7,7%) 9 (8,7%) 1,000 Adipositas Nein 67 (57,8%) 6 (46,2%) 61 (59,2%) Ja 49 (42,2%) 7 (53,8%) 42 (40,8%) 0,369 Körperliche Beanspruchung Nein 88 (75,9%) 12 (92,3%) 76 (73,8%) Ja 28 (24,1%) 1 (7,7%) 27 (26,2%) 0,184 Tabelle 3.12: Zusammenhangsanalyse des reinen Brustlymphödems mit Begleiterkrankungen 3.4 Zusammenfassung der Ergebnisse In der vorliegenden Studie lag die Inzidenz des sekundären Lymphödems nach Mammakarzinom-Therapie bei 35,6%. Die Inzidenz des reinen Brustlymphödems betrug 3,99% des Gesamtkollektivs. Die Latenzzeit zur Lymphonodektomie war durchschnittlich 15 Monate. Folgende Faktoren konnten als Lymphödemrisikofaktoren identifiziert werden:
59 Erhöhter BMI Ein erhöhter BMI stellte einen Lymphödemrisikofaktor dar. Bei einem BMI>35, zeigte sowohl die uni- als auch die multivariate Analyse mittels der logistischen Regression ein fünffach erhöhtes Lymphödemrisiko im Vergleich zu Patientinnen mit BMI<30. Ebenfalls ergab sich in der Cox- Regressionsanalyse im multivariaten Initialmodell ein doppelt so hohes Lymphödemrisiko und im Finalmodell ein dreifach erhöhtes Lymphödemrisiko im Vergleich zu Patientinnen mit BMI< Nodalstatus Der Nodalbefall stellte sowohl in der univariaten Analyse der logistischen Regression als auch in der Cox- Regressionsanalyse ein doppelt so hohes Lymphödemrisiko für das kombinierte Lymphödem der Arme mit Brust und/ oder Thoraxwandlymphödem dar im Vergleich zu nodalnegativen Karzinomen Therapeutische Risikofaktoren Die Art der Operation hatte einen Effekt auf das Lymphödemrisiko. Hier stellte die brusterhaltende Operation der Brust sowohl in der univariaten Analyse mittels der logistischen Regression, als auch in der uni- sowie im Finalmodell der multivariaten Analyse mittels der Cox- Regression ein doppelt so hohes Lymphödemrisiko dar als die Mastektomie. Sowohl das Initialmodell der multivariaten Analyse mittels der logistischen Regression als auch Initial- und Finalmodell der multivariaten Analyse mittels der Cox-Regression manifestierten ein mindestens doppelt so hohes Risiko, nach einer Axilladissektion am kombinierten Lymphödem des Armes, der Brust und/oder der Thoraxwand zu erkranken als bei einer alleinigen Sentinellymphonodektomie. Dies wurde durch die Risikoerhöhung mit steigender Anzahl der entnommenen Lymphknoten bestätigt. Wurden mehr als 10 Lymphknoten entfernt, so zeigte sich in der logistischen Regressionsanalyse ein dreifach erhöhtes und in der Cox- Regressionsanalyse ein doppelt so hohes Risiko am Lymphödem zu erkranken als bei einer Lymphknotenentnahme von 1-5 Lymphknoten. Bei der Betrachtung des reinen Lymphödems der Brust wurde deutlich, dass der Anteil der Patientinnen mit SNL unter den Patientinnen mit reinem Brustlymphödem Patientinnen signifikant höher war, als unter den Patientinnen mit kombiniertem
60 48 Lymphödem. Gleichzeitig wurde deutlich, dass Patientinnen mit Axilladissektion häufiger am kombinierten Lymphödem erkrankten. Die Rekonstruktion der Brust stellte in der Analyse mittels logistischer Regressionsanalyse kein erhöhtes Lymphödemrisiko dar. Die univariate Cox Regressionsanalyse zeigte für die Brustrekonstruktion einen protektiven Effekt in Bezug auf das Lymphödem auf. Postoperative Komplikationen, vor allem Wundheilungsstörungen, erhöhten das Lymphödemrisiko. Dies konnte sowohl in der Berechnung mittels der logistischen als auch mittels der Cox- Regressionsanalyse festgestellt werden. Andere peri- und postoperative Komplikationen wie die Nachblutung oder die Ausbildung eines Hämatoms hatten keinen Einfluss auf die Erhöhung des Lymphödemrisikos. Für die Ausbildung eines Seroms konnte mittels der logistischen Regressionsanalyse kein Zusammenhang mit einem erhöhten Lymphödemrisiko festgestellt werden. Jedoch erwies die univariate Cox Regressionsanalyse ein erhöhtes Risiko früher am Lymphödem zu erkranken, wenn postoperativ ein Serom entstanden war im Vergleich zu Patientinnen ohne postoperativen Komplikationen. Die Radiatio der Lymphabflusswege stellte sowohl in der univariaten Analyse mittels der logistischen Regression als auch in der univariaten Cox-Regressionsanalyse ein Lymphödemrisikofaktor dar, während die Radiatio der Restbrust und der Thoraxwand keinen relevanten Einfluss auf die Erhöhung des Lymphödemrisikos aufwiesen. Ebenfalls konnte ein Zusammenhang zwischen einer Chemotherapie, insbesondere der taxanhaltigen Chemotherapie als möglichem Lymphödemrisikofaktor für das Auftreten des kombinierten Lymphödems der Arme mit Brust und/ oder Thoraxwand gezeigt werden. Sowohl das Initialmodell der multivariaten Analyse der logistischen Regression als auch das Initialmodell der multivariaten Analyse der Cox- Regressionsanalyse manifestierten ein etwa doppelt so hohes Lymphödemrisiko bei taxanhaltiger Chemotherapie als bei Patientinnen, die keine Chemotherapie erhielten Begleiterkrankungen Die Adipositas und die arterielle Hypertonie stellten in der Analyse der logistischensowie in der Cox- Regressionsanalyse einen Risikofaktor für das kombinierte Lymphödem des Armes, der Brust und/ oder der Thoraxwand dar. Für weitere
61 49 internistische, orthopädische und psychiatrische Erkrankungen konnte kein Zusammenhang nachgewiesen werden. Zusätzlich konnte in der Zusammenhangsanalyse des reinen Brustlymphödems mit lymphologisch relevanten Begleiterkrankungen gezeigt werden, dass unter den Patientinnen mit reinem Brustlymphödem der Anteil der am Diabetes mellitus erkrankten Patientinnen höher war, als der Patientinnen, die nicht am Diabetes mellitus erkrankt waren (p-wert=0,006) Körperliche Beanspruchung Beide Analyse-Methoden zeigten einen signifikanten Zusammenhang zwischen schwerer körperlicher Beanspruchung und der Erhöhung des Lymphödemrisikos..
62 50 4 DISKUSSION Im Rahmen dieser Doktorarbeit wurden folgende Fragestellungen untersucht: 1. Inzidenz und zeitlicher Verlauf des Auftretens des sekundären Lymphödem des Armes, der Brust und/oder der Thoraxwand bei einem aktuellen Patientinnenkollektiv der Universitäts- Frauenklinik Freiburg nach Primärtherapie des Mammakarzinoms. 2. Einfluss von Patientinnencharakteristika, Tumorcharakteristika sowie Therapieverfahren des Mammakarzinoms auf das Auftreten des Lymphödems. 4.1 Inzidenz In der vorliegenden Studie betrug die Inzidenz des sekundären Lymphödems nach Mammakarzinom-Therapie 35,6%. Verglichen mit weiteren Untersuchungen (siehe Tabelle 4.1) war auffällig, dass die vorliegende Studie eine höhere Inzidenz aufwies als die anderen Studien: Clark publizierte 2005 eine prospektive Studie und gab nach drei Jahren postoperativ eine Inzidenz von 20,7% an. Er führte bei 188 Mammakarzinompatientinnen präoperativ, nach 6 Monaten und nach drei Jahren Armumfangsmessungen (alle 4 cm von Handgelenk bis Axilla) durch. Bei 80% der Patientinnen wurde im ersten Jahr postoperativ ein Lymphödem diagnostiziert (Clark, 2005). Einerseits war die Patientenzahl dieser Arbeit deutlich geringer als die vorliegende Evaluation, andererseits wurden fortgeschrittene Stadien des Mammakarzinoms ausgeschlossen, welches die mögliche Ursachen für die niedrigere Inzidenz gewesen sein könnten. Monleon et al. führten bei 371 Patientinnen, die zwischen 2005 und 2009 am Mammakarzinom therapiert wurden, an sieben Punkten Armumfangsmessungen beider Arme durch und fanden eine Inzidenz des sekundären Armlymphödems von 33,4% (Monleon et al., 2014). Hayes et al beschrieben eine ähnliche Inzidenz des Lymphödems wie unsere Studie von 33% nach 18 Monaten nach Mammakarzinomtherapie. Hier wurde die Diagnose des Lymphödems mittels der Bioimpedanz-Spektroskopie gestellt, die bei 287 Patientinnen in einem Zeitraum zwischen 6 und 18 Monaten nach Mammakarzinomtherapie alle 3 Monate durchgeführt wurde (Hayes et al., 2008). Im Artikel von Schünemann und Willich fanden sich nach Therapie von 5868 Mammakarzinomen 1405 Armlymphödeme, somit eine Inzidenz von 24% (Schünemann und Willich, 1997).
63 51 Ozcinar et al. zeigten hingegen mit 24,8% nach einem Jahr und 7,3% nach 64 Monaten eine viel geringere Inzidenz des Lymphödems als unsere Arbeit. Sie führten bei 218 Mammakarzinompatientinnen prä- und postoperativ, 12 und 64 Monate postoperativ Armumfangsmessungen durch. Allerdings wurden bei den Messungen lediglich zwei Punkte gemessen, nämlich 10 cm unterhalb und 10 cm oberhalb des Olecranon, sodass die Umfangsmessung nicht so genau war wie die Messungen, die in der vorliegenden Arbeit durchgeführt wurden (Ozcinar et al., 2012). Shahpar et al. beschrieben in ihrer retrospektiven Fall-Kontroll-Studie eine Inzidenz des unilateralen Armlymphödems von 30%. Sie führten genauere Messungen durch, da insgesamt an fünf Punkten gemessen wurde (Shahpar et al., 2013). Prinzipiell könnte es sich bei der auf den ersten Blick hohen Lymphödeminzidenz in der vorliegenden Evaluation um einen Bias handeln, der seinen Ursprung in der Art und Durchführung der Studie hat. Dadurch, dass hier die Probandinnen ihre Zustimmung gaben, nachdem sie telefonisch genaue Auskunft über die Studie erhalten hatten, wäre es möglich, dass sich die Patientinnen, die vom Lymphödem betroffen waren, eher angesprochen fühlten als diejenigen, die bis zum Zeitpunkt der Studie nicht am Lymphödem litten. Das könnte dazu geführt haben, dass Frauen mit Lymphödem übermäßig häufig in unserem Patientinnenkollektiv vertreten waren. Andererseits war es möglich, dass das Lymphödem, speziell das Lymphödem der Brust nach brusterhaltender Therapie, häufiger vorkam als bisher gezeigt. Durch die spezielle lymphologische Schulung in der Földiklinik in Hinterzarten, sowie der erhöhten Aufmerksamkeit und der aufwendigen Diagnostik konnten auch Fälle identifiziert werden, die ansonsten diagnostisch nicht erfasst worden wären. Zudem war es wichtig zu betrachten, dass das Augenmerk in den zitierten Studien nur auf das Lymphödem des Armes und nicht auf das Lymphödem der Brust und/ oder Thoraxwand gelegt wurde. Somit war es plausibel, dass die angegebenen Inzidenzen weiterhin niedriger waren als die unserer Studie. Bei der Betrachtung der Inzidenzen musste die Diagnostik des Lymphödems beachtet werden, die abhängig von objektivierbaren Untersuchungen und der Anzahl der Messungen war. Durch ungenaue Diagnostik hätte ein Lymphödem übersehen werden können. Monleon et al. zeigten, dass Untersuchungen, die auf auf Fragebögen basierten und subjektive Lymphödem Symptome erfragten, eine deutlich höhere Inzidenz zeigten als Studien, die auf objektive Messungen basierten (Monleon et al., 2014).
64 52 In der vorliegenden Studie wurde auf zweifache Weise ein Lymphödem identifiziert. Zum einen wurde nach subjektiven Beschwerden gefragt, zum anderen wurden nach gründlicher körperlicher Untersuchung bei jeder Patientin beide Arme anhand der Truncated cone Methode ausgemessen und mit einem speziellen Programm der Földiklinik die Armvolumina ausgewertet. Hinzu kam, dass bei unsicheren Befunden ein Termin in der Földiklinik, Fachklinik für Lymphologie, zur genaueren Diagnostik vereinbart wurde. Auch in den aufgezeigten Artikeln wurde die Diagnose des Lymphödems durch Armumfangsmessungen gestellt, jedoch war die Umfangsmessung nicht einheitlich und es wurden weniger Messpunkte festgelegt als in der vorliegenden Arbeit. Zudem fehlte die gründliche körperliche Untersuchung mit lymphologischer Befunderhebung, sodass dies ebenfalls ein Grund dafür sein könnte, warum ein Lymphödem übersehen wurde. In dieser Arbeit werden Studien zitiert, in denen das Lymphödem nur durch subjektive Datenerhebung diagnostiziert wurde (wie etwa bei Paskett et al. oder Lucci et al.), während in der vorliegenden Studie sowohl die zielgerichtete Anamnese mit Erfassung der subjektiven Lymphödemsymptomen, die gründliche körperliche Untersuchung, als auch die genaue objektive Armumfangsmessung durchgeführt wurden. Zudem kam hinzu, dass die Studien lediglich die Inzidenz des unilateralen Lymphödems wiedergaben, während unsere Arbeit jedes nach Karzinomtherapie auftretende Lymphödem, also zum Beispiel auch das beim bilateralen Karzinom, erfasste. DiSipio et al. stellten in ihrer Metaanalyse verschiedene Analysen vor, welche die Inzidenz des sekundären Lymphödems des Armes nach Therapie des Mammakarzinoms untersucht hatten (DiSipio et al., 2013). Hierbei ergab die Auswertung von insgesamt 72 Studien, die zwischen dem 1. Januar 2000 und 30. Juni 2012 publiziert worden waren, eine Inzidenz des Lymphödems von 16,6%. Wichtig wäre hier zu nennen, dass die Metaanalyse nur Studien, die das Lymphödem des Armes untersuchten und das der Brust nicht berücksichtigten, erfasste. Da die Metaanalyse Studien verschiedener Designs wiederspiegelte, schwankten die angegebenen Inzidenzen sehr stark, je nach dem um welches Studiendesign es sich gehandelt hatte. Bei prospektiven Kohortenstudien wurde eine viel höhere Inzidenz als bei retrospektiven Studien angegeben (21.4% vs. 8,4%).
65 53 Vorliegende Hayes et al Ozcinar et al Shahpar et al Clark et al Studie Design retrospektiv prospektiv prospektiv retrospektiv prospektiv Patientenzahl Karzinome Inzidenz 35,6% 33% nach 18 24,8% nach 30% nach 34 20,7% Monaten postoperativ 12 Monaten, 7,3% nach 64 Monaten Monaten Diagnostik Anamnese, Bioimpedanz AU: 10 cm AU 5 Punkte AU prä-postop KpU, AU (alle 4 cm) Spektometrie unter- und oberhalb des Olecranon Lokalisation Arm, Brust, TW Arm Arm Arm Arm Tabelle 4.1: Studien zur Inzidenz des Lymphödems Inzidenz des Lymphödems der Brust In der vorliegenden Studie betrug die Inzidenz des Lymphödems der Brust 45,7% und die der Thoraxwand 48,3%. Das bedeutete, dass nahezu jede zweite Patientin, die am Mammakarzinom therapiert wurde, unabhängig von der Art der Therapie, unter Schwellung, Sensibilitätsstörungen oder Missempfindungen im Bereich der Brust litt. Diese hohe Inzidenz verdeutlichte die Relevanz des Lymphödems als chronische Nebenwirkung der Mammakarzinomtherapie, die jedoch gerade in Bezug auf das Ödem der Brust oder Thoraxwand häufig übersehen wird. Die vorliegende Studie untersuchte ebenfalls die Inzidenz des reinen Brustlymphödems. Diese lag bei 3,99% des Gesamtkollektivs. Lawenda et al. sagten aus, dass das Lymphödem der Brust eine häufig übersehene Lymphödem-Manifestation sei, und fassten die in verschiedenen Studien angegeben Inzidenzen mit 6-48% zusammen (Lawenda et al., 2009). Goffman et al. gaben eine Inzidenz des Brustlymphödems von 9,6% an. Hier wurden 240 Patientinnen, die postoperativ bestrahlt wurden, untersucht und nach Zunehmen der Schwellung, neu aufgetretener Rötung, Schweregefühl und Schmerzen in der betroffenen Brust befragt (Goffman et al., 2004). Rönkä et al. gaben eine Prävalenz des Brustlymphödems von 23% nach Sentinellymphonodektomie (SNL) und adjuvanter Radiatio der Brust nach brusterhaltender Operation an. Sie stellten die Diagnose des Lymphödems mittels Ultraschall der Brusthaut. Allerdings gingen auch Patientinnen in die SNL-Gruppe mit ein, bei denen 13 Lymphknoten entfernt wurden (median 3 Lymphknoten, min. 1, max. 13; Rönkä et al., 2004).
66 54 Lee et al. beschrieben in Ihrer Metaanalyse von 32 Studien eine Definition des Brustlymphödems als permanente Schwellung der betroffenen Brust mit oder ohne Symptome (wie zum Beispiel Schmerzen). Sie gaben eine Prävalenz des asymptomatischen Brustlymphödems mit 3-7% und die des symptomatischen Brustlymphödems mit 0,5-1% an. Allerdings wurden die symptomatischen Brustlymphödeme nicht genau beschrieben (Lee et al., 2008). Zudem wurde in diesen Studien die genaue Lokalisation des Lymphödems nicht angegeben, und es blieb die Frage offen, ob es sich um die Inzidenz des reinen Lymphödems der Brust, oder um das häufigere kombinierte Lymphödem des Armes mit Brust und Thoraxwand handelte. Zusammenfassend ließ sich sagen, dass die Inzidenz des sekundären Arm- Brust und Thoraxwandlymphödems der vorliegenden Untersuchung mit 35,6% auf den ersten Blick hoch erschien, sie jedoch bei genauerer Betrachtung höchstwahrscheinlich widerspiegelte, wie häufig das Lymphödem nach Mammakarzinomtherapie tatsächlich vorkam, ganz besonders im Hinblick auf das bisher kaum untersuchte Brust und Thoraxwandlymphödem. Weitere Studien zur Untersuchung der Inzidenz, sowie Ausmaß des Brust-/ und Thoraxwandlymphödems wären jedoch notwendig, vor allem hinsichtlich der Häufigkeit des reinen Brustlymphödes und dessen Risikofaktoren. 4.2 Latenzzeit DiSipio et al. beschrieben in ihrer Metaanalyse durchschnittlich eine Latenzzeit von bis zu zwei Jahren nach Mammakarzinomtherapie (DiSipio et al., 2013). In der vorliegenden Studie wurde die Latenzzeit zwischen der Therapie und dem Auftreten des Lymphödems nach den verschiedenen Aspekten der Therapie unterteilt. Sie betrug zwischen der Lymphonodektomie bis zum Auftreten des Lymphödems durchschnittlich 15 Monate. Nach einer Statistik von E. Földi betrug die Latenzzeit nach Mammakarzinomtherapie bis zum Auftreten des Lymphödems in 56% der Fälle weniger als ein Jahr. Allerdings wurde über einen sehr langen Zeitraum beobachtet, sodass auch beschrieben werden konnte, dass 36% der Patientinnen zwischen zwei und zehn Jahren, und 8% der Frauen zwischen zehn und zwanzig Jahren nach Mammakarzinomtherapie am Lymphödem erkrankten (Földi M. und E., 2010). Nesvold et al. gaben an, dass 80% der Patientinnen aus ihrer Studie ein Lymphödem im ersten Jahr entwickelt haben (Nesvold et al., 2008).
67 55 Monleon et al. zeigten, dass 83,4% der Patientinnen im ersten Jahr postoperativ am sekundären Lymphödem des Armes erkrankt waren und empfahlen daher eine engmaschige Überwachung der Patientinnen mit Risikofaktoren im ersten Jahr postoperativ im Hinblick auf die Entstehung des Lymphödems (Monleon et al., 2014). Helyer et al. beschrieben, dass dreiviertel aller Patientinnen Symptome des Lymphödems ein Jahr postoperativ entwickelten (Helyer et al., 2010) Zusammenfassend ließ sich bestätigen, dass die ersten zwei Jahren nach Mammakarzinomtherapie sicherlich eine vulnerable Zeit darstellten, in dem das Risiko eines Lymphödems am höchsten war. Jedoch könnte, wie aus der Statistik von E. Földi hervorgeht, die Latenzzeit Jahre dauern, sogar bis zu zwanzig Jahren nach Therapie. 4.3 Patientinnencharakteristika und Lymphödemrisiko BMI und Adipositas Viele Studien wiesen den Zusammenhang der Adipositas mit dem erhöhten Lymphödemrisiko nach. Clark beschrieb in seiner Studie in 2005, dass ein erhöhter BMI das Lymphödemrisiko verdoppelte (Clark, 2005). Allerdings wurde hier nicht gezeigt, welche Korrelation zwischen dem Ausmaß der Adipositas und der Erhöhung des Lymphödemrisikos bestand, da hier lediglich übergewichtige Patientinnen mit einem BMI >26 gesunden Patientinnen mit BMI-Werten von gegenübergestellt wurden. Zudem wurde der BMI Wert nicht zum Studienzeitpunkt erfragt, sondern präoperativ gemessen. Es stellte sich die Frage zu welchem Zeitpunkt der BMI eine Rolle auf die Ausbildung des Lymphödems spielte. Begünstigte eine bestehende Adipositas präoperativ das Ausmaß des Lymphödems postoperativ? Oder ging ein Lymphödem, das sich bei der normalgewichtigen Patientin postoperativ im Stadium der Latenz befand, eher in ein klinisch sichtbares Lymphödem über, wenn die Patientin postoperativ stark an Gewicht zunahm? Shahpar et al. gaben jeden Anstieg des BMI um 1 als signifikanten Risikofaktor an: OR 1.08 (95% CI , p-wert<0.001; Shahpar et al., 2013). Mc Laughlin et al. beschrieben 2008, dass ein höherer BMI-Wert mit häufigerem Auftreten des Lymphödems assoziiert war (p-wert<0,0001), fanden jedoch keinen statistisch signifikanten Zusammenhang zwischen einer Gewichtszunahme von über
68 56 zwei kg in einem Zeitraum von fünf Jahren postoperativ und einer erhöhten Lymphödemrate (p-wert=0,22; McLaughlin et al., 2008). Crosby et al. beschrieben für Patientinnen, die eine primäre Rekonstruktion erhielten, dass sie mit einem BMI>25 einen mehr als doppelt so hohes Risiko aufwiesen am Lymphödem zu erkranken als Patientinnen mit einem BMI<25 (OR 2,42, 95%CI 1,26-4,67, p-wert=0,008; Crosby et al., 2012). Helyer et al. beschrieben ein doppelt so hohes Risiko am Lymphödem zu erkranken bei Patientinnen mit BMI>30 als Patientinnen mit einem BMI>25 (p-wert=0,003). Die Erklärung hierfür gaben sie mit der Tatsache an, dass bei der Adipositas mehr Gewebe (Fettgewebe, subkutanes Gewebe) vorhanden sei, welches eine Reservoirfunktion habe und die lymphpflichtigen Lasten speichere. Andererseits könne es möglich sein, dass eine radikalere Chirurgie bei adipösen Patientinnen erforderlich gewesen sei und schon bei der Operation mehr Lymphgefäße zerstört werden würden (Helyer et al., 2010). Die vorliegende Studie konnte den Zusammenhang der Adipositas und dem Auftreten des Lymphödems bestätigen. Adipositas stellte ein Risikofaktor für das Auftreten des sekundären Lymphödems dar. Allerdings konnte hier auch deutlich gemacht werden, dass nicht nur die Adipositas an sich, sondern der Grad der Adipositas eine Rolle spielte. Hier konnte gezeigt werden, dass je höhergradig die Adipositas der Patientin war, umso höher ihr Risiko an Lymphödem zu erkranken. Genau konnte in der univariaten Analyse mittels der logistischen Regression gezeigt werden, dass Patientinnen mit einem BMI zwischen 30 und 35 (Adipositas Grad I) ein doppelt so hohes Risiko (p-wert=0,020), und Patientinnen mit einem BMI> 35 (Adipositas Grad II) ein fünffach höheres Risiko (p-wert<0,001) hatten am Lymphödem zu erkranken als Patientinnen mit einem BMI <30. Die univariate Cox Regressionsanalyse zeigte, dass mit einem BMI>35 die Wahrscheinlichkeit stieg früher am Lymphödem zu erkranken als normalgewichtige Patientinnen (HR 3,28, 95%CI 1,93-5,57, p-wert <0,001). Eine Erklärung für den Zusammenhang zwischen Adipositas und dem Ausbilden des Lymphödems könnte sein, dass sich durch die Adipositas die lymphpflichtigen Lasten einerseits durch eine Störung des Lymphabfluss und andererseits durch eine vermehrte Lymphbildung erhöht sind. Die Lymphabflussstörung kann lokal oder systemisch sein. Bei höhergradiger Adipositas entsteht eine lokale Obstruktion der Lymphgefäßdrainage, welche den
69 57 lokalen Lymphabfluss behindert. Systemisch wird der Lymphabfluss durch den Zwerchfellhochstand und damit einhergehende verminderte Atemexkursion behindert, da hier ein wichtiger Hilfsmechanismus des Lymphabfluss durch die Cisterna chyli beeinträchtigt wird (Földi M. und E., 2010). Es ist bekannt, dass mit einer Adipositas eine chronischen Inflammation einhergeht, bedingt durch inflammatorische Eigenschaften von Sekretionsprodukten des Fettgewebes (Liberopoulos et al., 2005). Eine Ursache für die vermehrte Lymphbildung könnte diese chronische Inflammation sein. Gleichzeitig haben mehrere Studien gezeigt wie eine Gewichtsreduktion >6 kg die Senkung einiger Entzündungsparameter wie TNFalpha oder IL6 bewirkt (Bastard et al., 2000; Esposito et al., 2003). Ein Symptom von entzündetem Gewebe ist das Ödem, sodass es gut möglich ist, dass die chronische Entzündung zusammen mit weiteren Faktoren das Lymphödem begünstigt. In einer weiterführenden Studie könnte prospektiv untersucht werden, ob bei übergewichtigen Frauen mit BMI >35, die an Lymphödem leiden, sich bei Gewichtsabnahme (mit dem Ziel BMI <35 oder >6kg) das Ödem deutlich verringert BMI als Risikofaktor für das Auftreten des alleinigen Brustlymphödems Goffmann et al. fanden in ihrer Studie, dass das Lymphödem der Brust signifikant häufiger bei übergewichtigen Patientinnen auftrat als bei normalgewichtigen (p- Wert=0,0058), während ein erhöhter BMI in ihrer Studie kein erhöhtes Lymphödemrisiko des Armes darstellte (Goffman et al., 2004). Daten zu Risikofaktoren für das Auftreten des alleinigen Lymphödems der Brust gab es bisher kaum. Weiterführende Studien diesbezüglich wären daher sinnvoll. 4.4 Tumorcharakteristika und Lymphödemrisiko Nodalstatus Die vorliegende Studie zeigte: Waren Lymphknoten befallen, so stellte dies sowohl in der univariaten Analyse der logistischen Regression als auch in der Cox- Regressionsanalyse einen doppelt so hohes Lymphödemrisikofaktor dar als nodalnegative Karzinome. Ähnliche Ergebnisse fanden sich in weiteren Studien: Crosby beschrieb, dass die Anzahl der positiven Lymphknoten ein starker Prädiktor für eine erhöhte Lymphödemrate ist (OR 2,78 mit 95%CI 1,40-5,54, p-wert=0,004;
70 58 Crosby et al., 2012). Yen et al. beschrieben ebenfalls, dass das Vorhandensein positiver Lymphknoten ein Prädiktor für eine erhöhte Lymphödemrate darstellte (Yen et al., 2009). Shahpar et al. beschrieben, dass die Anzahl der positiven Lymphknoten mit der Odds ratio von 1,132 (95%CI 1,07-1,9, p-wert<0,001) das Risiko des Lymphödems leicht erhöhte, während die Anzahl der exstirpierten Lymphknoten in ihrer Studie kein signifikantes Risiko darstellte (OR 1.04 mit 95%CI , p-wert= 0.062; Shahpar et al., 2013). Im Gegensatz hierzu gaben Meeske et al. nicht die Nodalpositivität (p-wert=0,81), sondern die Anzahl entnommener LK als Lymphödemrisikofaktor an. Hier wurden 494 Patientinnen mit DCIS sowie Mammakarzinom per Interview hinsichtlich des sekundären Lymphödems sowie möglichen Risikofaktoren befragt. Es zeigte sich, dass die Lymphknotenentnahme von über 10 Lymphknoten ein doppelt so hohes Lymphödemrisiko darstellte im Vergleich zu den Patientinnen ohne Lymphknotenentnahme (da hier auch Patientinnen mit DCIS eingeschlossen wurden) (p-wert<0,0001, Meeske et al., 2008). Dieses Ergebnis sprach für den unten diskutierten Zusammenhang zwischen der radikaleren Axillachirurgie und dem erhöhten Lymphödemrisiko. Aber warum die Nodalpositivität, die mit der radikaleren Axillachirurgie einhergeht, offenbar keinen Risikofaktor darstellte wurde hier nicht ausreichend geklärt. Ein ähnliches Ergebnis zeigten Paskett et al., bei dem die Anzahl der entnommenen Lymphknoten über 10 mit einem erhöhten Lymphödemrisiko assoziiert war, nicht jedoch die Nodalpositivität (Paskett et al., 2007). Dadurch, dass die Nodalpositivität meist mit einer aggressiveren Therapie einher ging (neben der Axilladissektion fand eventuell eine Bestrahlung der Axilla statt und häufig wurde eine Chemotherapie verabreicht) lag es nahe sich zu fragen, ob positive Lymphknoten an sich oder die weiteren therapeutischen Faktoren zum erhöhten Lymphödemrisiko führten. Dieser Frage kann in Zukunft selektiver nachgegangen werden, wenn immer häufiger trotz befallener axillärer Lymphknoten auf die Axilladissektion verzichtet wird. Zudem wurde in keinem dieser Studien der Zusammenhang des Lymphknotenbefalls mit dem Auftreten des alleinigen Brustlymphödems untersucht. In der vorliegenden Studie ergab sich bei der Betrachtung des reinen Brustlymphödems, dass Patientinnen mit nodalpositivem Karzinom häufiger am kombinierten Lymphödem der Arme und/oder Brust bzw. Thorax erkrankten als am
71 59 reinen Lymphödem der Brust, bzw. dass der Anteil der Patientinnen mit nodalnegativem Karzinom unter den Frauen mit reinem Brustlymphödem höher war als unter den Frauen mit kombiniertem Karzinom (Tabelle 3.8). Diese Beobachtung ließ sich durch die Art der Operation erklären, denn bei Patientinnen mit pn1 Stadien wurde eine Axilladissektion durchgeführt, welche häufiger zum kombinierten Lymphödem führte (Tabelle 3.9) Tumorstadium Die Tumorgröße hatte in unserer Studie sowohl mit der Analyse der logistischen als auch mit der Cox Regressionsanalyse keinen Einfluss auf die Ausbildung des Lymphödems. Paiva et al. fanden ebenfalls keinen statistisch signifikanten Zusammenhang zwischen einem fortgeschrittenen Tumorstadium und einem erhöhten Lymphödemrisiko (p-wert=0,216; Paiva et al., 2013) Bei Goffmann et al., die 240 postoperativ bestrahlte Patientinnen auf das Auftreten des Lymphödems untersucht hatten, war die Tumorgröße ein Risikofaktor für das Lymphödem (p-wert=0,0027; Goffman et al., 2004) Auch in der Arbeit von Monleon et al. war das Tumorstadium signifikant als Lymphödemrisikofaktor aufgeführt (p-wert<0,001; Monleon et al., 2014). Park et al. gaben an, dass bei Patientinnen mit Lymphödem signifikant höhere Tumorstadien diagnostiziert waren (p-wert=0,005; Park et al., 2008). Auch Herd-Smith et al. konnten ein höheres Lymphödemrisiko bei Patientinnen mit T2-Stadium im Vergleich zu T1 Stadien feststellen (HR 1,69, 95%CI 1,06-1,94; Herd- Smith et al., 2001). Ein erhöhtes Lymphödemrisiko bei größeren Tumoren war insofern denkbar, da diese eine radikalere Therapie (sowohl chirurgisch, als auch systemisch) nach sich zog. Nach Schünemann und Willich (1997) stellte eine radikalere Therapie ein erhöhtes Lymphödemrisikofaktor dar. In unserer Studie wurden hauptsächlich Patientinnen mit niedrigem T-Stadium eingeschlossen (bei 60,7% lag bei Erstdiagnose ein pt1-stadium, bei 31,6% ein pt2-stadium vor), sodass dies vielleicht der Grund dafür gewesen sein könnte, dass sich der Zusammenhang zwischen höhergradigen T-Stadien mit dem Auftreten des Lymphödems statistisch nicht erfassen ließ.
72 Tumorlokalisation Zunächst schien in der logistischen Regressionsanalyse die Tumorlokalisation keinen Einfluss auf das Lymphödem zu haben (p-wert=0,061). Aber in der univariaten Cox Regressionsanalyse war sie ein Risikofaktor für die Ausbildung des Lymphödems (HR 1,47, 95%CI 1,02-2,12, p-wert=0,04). Hier hatten Patientinnen mit Tumoren des oberen äußeren Quadranten ein höheres Risiko, dass sich zur Folge ein Lymphödem ausbildete. Goffman et al. beschrieben ebenfalls ein signifikant höheres Lympödemrisiko der Brust bei Patientinnen mit Tumor im oberen äußeren Quadranten (p-wert=0,0042; Goffman et al., 2004). Da bei einem Tumor im oberen äußeren Quadranten in der Nähe der Axilla operiert wurde, war ein potentiell höheres Lymphödemrisiko naheliegend. Hier laufen die Lymphgefäße der Brust zusammen, sodass die Wahrscheinlichkeit steigt intraoperativ Lymphgefäße zu beschädigen. Vor allem, wenn im oberen-äußeren Quadranten eine semizirkuläre Schnittführung gewählt wird, liegt aufgrund der Anatomie des Lymphabflusses der Brustdrüse nahe, dass zahlreiche Lymphkollektoren verletzt werden und durch diese Traumatisierung ein höheres Lymphödemrisiko denkbar war. Ein weiterer Grund warum ein höheres Lymphödemrisiko bei Tumoren im oberen äußeren Quadranten angenommen wurde, war die postperative Radiatio, wobei hier meist ein Boost im oberen äußeren Quadranten durchgeführt wurde. Somit wurden nicht nur durch die Operation, sondern auch die nachfolgende Bestrahlung Lymphgefäße nicht nur beschädigt, sondern auch an der Regeneration und Wiederaufnahme der Funktion gehindert. Die Tendenz, die sich durch die Cox Regressionsanalyse in der vorliegenden Studie zeigte ließe sich somit gut erklären. Es könnte jedoch gut möglich sein, dass sich dieser Zusammenhang deutlicher zeigt, wenn in Zukunft weiterführende Studien mit größeren Patientinnenzahlen und über einen längeren Zeitraum durchgeführt werden. 4.5 Therapie des Mammakarzinoms und Lymphödemrisiko OP-Verfahren Die Art der Operation zeigte einen Effekt auf das Lymphödemrisiko. Hier stellte die brusterhaltende Operation der Brust sowohl in der univariaten Analyse mittels der logistischen Regression, als auch in der uni- sowie im Finalmodell der multivariaten
73 61 Analyse mittels der Cox- Regression ein doppelt so hohes Lymphödemrisiko dar als die Mastektomie. In der Literatur fanden sich jedoch häufiger Daten über ein erhöhtes Lymphödemrisiko durch die Mastektomie im Vergleich zur Brusterhaltenden Operation. Clark beschrieb zum Beispiel eine Risikoerhöhung des Lymphödems um das Doppelte (RR 2,20 mit 95%CI 1,39-3,51) bei einer Mastektomie als bei anderen OP- Techniken, jedoch waren andere Verfahren nicht genauer definiert. Erschwerend kam hinzu, dass die Mastektomie zusammen mit Axilladissektion (Level I und II) durchgeführt wurde, weshalb hier nicht klar war, ob die Mastektomie oder die Axilladissektion die Risikoerhöhung bewirkte (Clark, 2005). Auch Nesvold et al. gaben ein doppelt so hohes Risiko an nach einer MRM am Lymphödem zu erkranken als nach einer BET (OR 2,75, p-wert=0,04; Nesvold et al., 2008). Allerdings waren auch in ihrer Studie nur Patientinnen mit einbezogen, die alle eine Axilladissektion erhielten. Zudem war hier signifikant, dass die Patientinnen mit MRM eine ausgedehntere adjuvante Radiatio erhielten. Außerdem waren in dieser Gruppe häufiger Patientinnen mit fortgeschrittenen Tumoren sowie einer erhöhten Rate an positiven axillären Lymphknoten. Daher war es fraglich, ob die erhöhte Lymphödemrate lediglich an der MRM oder etwa an der ausgedehnteren adjuvanten Radiatio oder anderen lymphödemagrravierenden Risikofaktoren lag. Andere Studien zeigten wiederum keinen signifikanten Unterschied zwischen MRM und BEO in Hinblick auf das Lymphödemrisiko. Wie zum Beispiel Monleon et al., Meeske et al., oder Paiva et al. Eine Erklärung warum ein Lymphödem so wie in der vorliegenden Studie häufiger nach BET als nach MRM aufgetreten war, könnte sein, dass nach anfänglicher Erholung des Gewebes und der Lymphbahnen, sich das Ödem dorthin verlagerte wo mehr Gewebe war, also in der erhaltenen Brust. Zudem wurde die Brust bei brusterhaltener Therapie nachbestrahlt. Es konnte gut möglich sein, dass die Lymphkollektoren durch die Nachbestrahlung beschädigt wurden. Nach einer Mastektomie fand viel seltener eine Nachbestrahlung statt. Dieses Ergebnis gilt es durch weitere Studien zu untermauern.
74 SNL vs. Axilla SNL vs. Axilla als Lymphödemrisikofaktoren des Armes, der Brust und/ oder Thoraxwand Es gab zahlreiche Studien, die das höhere Lymphödemrisiko des Armes nach Axilladissektion im Vergleich zur Sentinellymphonodektomie belegten. McLaughlin et al. führten in ihrer prospektiven Studie bei 936 Patientinnen sowohl präoperativ als auch 5 Jahre postoperativ Armumfangsmessungen durch. Zusätzlich fand die Evaluation im Follow-Up mittels Anamnese sowie standardisiertem Fragebogen statt. Gegenübergestellt wurden Patientinnen, bei denen eine alleinige Sentinellymphknotenbiopsie (SNL) durchgeführt wurde, mit Patientinnen, die bei positivem Sentinellymphknoten eine sekundäre Axilladissektion erhielten. Die subjektive Anamnese ergab eine Inzidenz des sekundären Lymphödem des Armes von 3% bei Patientinnen mit alleiniger SNL vs. 27,1% bei Patientinnen mit sekundärer Axilladissektion (p-wert<0,0001). Die Umfangsmessungen mit der Definition des Lymphödems als Umfangsvermehrung von >2 cm ergaben eine Inzidenz von 5% in der SNL Gruppe und 16% in der Gruppe mit sekundärer Axilladissektion (p-wert <0,0001; McLaughlin et al., 2008). Crosby et al. untersuchten Patientinnen mit primärer Rekonstruktion und bestätigten sowohl in der univariaten Analyse, dass Patientinnen mit Axilladissektion (unabhängig davon ob vorher eine Sentinellymphonodektomie durchgeführt wurde) ein 15 fach höheres Lymphödemrisiko haben als diejenigen mit alleiniger Sentinellymphonodektomie (OR 14,7 95%CI 5,90-36,8, p-wert=0,001), als auch in der multivariaten Regressionsanalyse, hier war die OR 6,69 mit 95%CI und p-wert<0,001 (Crosby et al., 2012). Monleon et al. zeigten eine signifikante Risikoerhöhung am Lymphödem nach Axilladissektion im Vergleich nach einer Sentinellymphondektomie zu erkranken (HR 13,83, p-wert<0,001; Monleon et al., 2014). Lucci et al. beschrieben ebenfalls die Axilladissektion als signifikanten Risikofaktor im Vergleich zur alleinigen SNL, jedoch wurden hier keine objektiven Daten erhoben (Lucci et al., 2007). Sowohl das Initialmodell der multivariaten Analyse mittels der logistischen Regression als auch Initial- und Finalmodell der multivariaten Analyse mittels der Cox- Regression zeigten in der vorliegenden Arbeit ein mindestens doppelt so hohes Risiko nach einer Axilladissektion am kombinierten Lymphödem des Armes, der
75 63 Brust und/oder der Thoraxwand zu erkranken als bei einer Sentinellymphonodektomie. Dies wurde durch die Risikoerhöhung mit steigender Anzahl der entnommenen Lymphknoten bestätigt. Wurden mehr als 10 Lymphknoten entfernt (so wie es bei der Axilladissektion der Fall war), stieg das Risiko um 3,37 fache an am Lymphödem zu erkranken verglichen mit der Entnahme von 1 bis 5 Lymphknoten (p-wert <0,001). Die Entnahme von 5-10 Lymphknoten ergab keine signifikante Risikoerhöhung (p- Wert=0,229). Dies zeigte sich in der Analyse mittels der logistischen Regression. Die Cox Regression zeigte auch einen deutlichen Zusammenhang mit der Anzahl der entfernten Lymphknoten in Abhängigkeit mit der Zeit. Wurden mehr als 10 Lymphknoten entfernt, stieg das Risiko früher am lymphödem zu erkranken (HR 2,16 mit 95%CI 1,44-3,23, p-wert<0,001) als bei Lymphknotenentnahme von 1 bis 5 Lymphknoten. Dieses Ergebnis unterstrich den signifikanten Unterschied des Lymphödemrisikos zwischen der Axilladissektion und der SNL, sagte jedoch gleichzeitig aus, dass die Anzahl der entnommenen Lymphknoten bei SNL keinen Einfluss auf das Risiko des Lymphödems hatten. In der Studie von Paskett et al. war die Anzahl der entnommenen Lymphknoten der größte ausschlaggebende Faktor auf das Lymphödemrisiko (p-wert=0,003; Paskett et al., 2007). Földi E. und M. erklärten, dass die Ausbildung des Lymphödems nach Axilladissektion von zwei Faktoren abhing: Von der persönlichen Anatomie der Patientin und von der Therapie. Bei der persönlichen Anatomie der Patientin spielte der Typ ihres Oberarmgefäßbündels eine Rolle. Hiervon wurden vier verschiedene Typen beschrieben. Lag der Typ vor, bei dem ausreichende präformierte Umgangswege der Lymphe vorlagen, dann war die Patientin viel eher vor der Ausbildung des Lymphödems geschützt. Zudem spielte die Dichte der axilloinguinalen und der interaxillären Anastomosen eine große Rolle, denn hierdurch konnte ein kollateraler Abfluss stattfinden, welche ebenfalls ein Schutz vor der Ausbildung des Lymphödems darstellte. Zudem existierte eine große Variabilität der axillären Lymphknoten (zwischen 8 und 50). Entscheidend war das Verhältnis der vorhandenen Lymphknoten zur Anzahl der entfernten (Földi M. und E., 2010). Deutlich war in der vorliegenden Studie jedoch auch, dass auch Patientinnen mit alleiniger SNL auch am Lymphödem erkrankten, wenn auch seltener. Földi E. und M.
76 64 beriefen sich auf eine Arbeit von Bonetti et al, der die Folgen der Sentinellymphonodektomie mit der Zerstörung von Armlymphgefäßen erklärte SNL als möglicher Risikofaktor für das Auftreten des alleinigen Brustlymphödems Wir berechneten den Zusammenhang zwischen der Lymphödemlokalisation und der Art der Lymphonodektomie. Hier zeigte sich, dass Patientinnen mit Axilladissektion häufiger am kombinierten Lymphödem der Arme als am reinen Brustlymphödem erkrankten. Gleichzeitig wurde deutlich, dass der Anteil der Patientinnen, die eine SNL erhielten unter den Patientinnen mit reinem Brustlymphödem höher war als unter diejenigen mit kombiniertem Lymphödem der Arme. Man könnte hieraus den Rückschluss ziehen, dass die SNL ein Risikofaktor für das Auftreten des reinen Brustlymphödems darstellte. Dies erschien auch aufgrund des Sentinellymphknotenkonzepts selbst naheliegend: Durch Detektion und Entfernung des/der Lymphknoten, die spezifisch für den Lymphabfluss der tumortragenden Region der Brust verantwortlich waren (und im Optimalfall nicht für den Lymphabfluss des Armes), könnte sich, im Gegensatz zur konventionellen Axilladissektion, das Lymphödemrisiko der Brust deutlicher erhöhen als dasjenige des Armes. In der vorliegenden Studie war die Patientenzahl zu klein um einen signifikanten Zusammenhang festzustellen, eine Tendenz war jedoch eindeutig. Um dies zu belegen sind weitere Studien mit größerer Patientinnenzahl notwendig Rekonstruktion Bisher gab es einige Studien, die den Zusammenhang der Brustrekonstruktion mit der Ausbildung des Lymphödems untersuchten. Crosby et al. untersuchten in ihrer Studie 1117 Patientinnen, die eine primäre Brustrekonstruktion nach Mastektomie erhielten und verglichen verschiedene Rekonstruktionsmethoden im Hinblick auf das Lymphödemrisiko (Crosby et al., 2012). Hierbei stellten sie keine signifikante Assoziation zwischen den verschiedenen Verfahrenstechniken und der Lymphödemrate fest. Auch Paskett et al. gaben kein signifikant erhöhtes Lymphödemrisiko bei Patientinnen mit Rekonstruktion an (p-wert=0,08; Paskett et al., 2007) In der Analyse von Avraham et al. wurden Patientinnen, die nach MRM eine primäre Rekonstruktion unter Zuhilfenahme eines Gewebeexpanders bekamen, mit Patientinnen, bei denen keine Rekonstruktion stattfand, hinsichtlich des
77 65 Lymphödemrisikos miteinander verglichen. Betrachtet wurde das Auftreten des Lymphödems nach Mammakarzinomtherapie mit und ohne Rekonstruktion zuerst unabhängig von der Axillachirurgie. Hier zeigte sich, dass Patientinnen mit Rekonstruktion seltener am Lymphödem erkrankten als Patientinnen ohne Rekonstruktion (p-wert<0,02). Bei näherer Betrachtung hinsichtlich der axillären Intervention wurde deutlich, dass bei Patientinnen mit SNL (wie sie erklärten, bei Patientinnen mit ohnehin schon geringem Lymphödemrisiko) die Rekonstruktion keine Auswirkung auf das Auftreten des Lymphödems hatte. Jedoch konnten sie zeigen, dass bei Patientinnen mit primärer oder sekundärer Axilladissektion die Lymphödemrate bei denen mit Rekonstruktion signifikant geringer war (p- Wert<0,001) (Avraham et al., 2010). Auffällig war zudem, dass die Patientinnen mit Rekonstruktion jünger und schlanker waren, als diejenigen ohne Rekonstruktion, sodass ggf. der niedrigere BMI den fraglich protektiven Effekt dargestellt haben könnte. Meeske et al. fanden kein erhöhtes Lymphödemrisiko bei Patientinnen, die eine Rekonstruktion erhielten (Meeske et al., 2008). In unserer Evaluation zeigte die univariate logistische Regressionsanalyse zunächst keinen signifikanten Zusammenhang zwischen der Rekonstruktion und der Ausbildung des Lymphödems (p-wert=0,075). Die univariate Cox Regressionsanalyse zeigte jedoch einen protektiven Effekt der primären Rekonstruktion hinsichtlich des Ausbildung des Lymphödems (HR 0,40 mit 95%CI 0,18-0,86, p-wert=0,019). Es könnte sein, dass diese Patientinnen durch die Rekonstruktion und der damit aufwendigeren Operation häufiger eine prophylaktische Lymphdrainage verschrieben bekommen haben und sie deshalb mit der Zeit eher geschützt waren. Auch stellte sich die Frage, ob Patientinnen mit Rekonstruktion, wie in der Studie von Avraham et al, jünger waren und die eigene Körperwahrnehmung eine größere Rolle spielte als bei Frauen, die keine Rekonstruktion bekamen. Eventuell waren dann diese Frauen figurbewusster und schlanker, was für das Lymphödemrisiko die größere Rolle gespielt haben könnte. Zusammenfassend ließ sich der Zusammenhang der Rekonstruktion mit der Ausbildung des Lymphödems weder eindeutig widerlegen noch sicher ein protektiver Effekt nachweisen. Jedoch wäre es sinnvoll mit diesem Ansatz weitere Studien durchzuführen, welche die Auswirkung der Rekonstruktion auf das Lymphödem genau unter die Lupe nehmen.
78 Rezidiv-/Zweitoperationen Viele Studien untersuchten lediglich Patientinnen mit primärem Mammakarzinom und schlossen von vornherein Patientinnen mit Mammakarzinom in der Vorgeschichte aus, so wie McLaughlin (McLaughlin et al., 2008) oder Clark (Clark 2005). In der vorliegenden Arbeit wurden auch Patientinnen mit eingeschlossen, die eine Rezidiv-/ oder eine Zweitoperation erhielten, sodass auch die Frage gestellt werden konnte, ob diese operativen Maßnahmen als mögliche Lymphödemrisikofaktoren zu identifizieren waren. Es war vorstellbar, dass durch einen erneuten Eingriff in das ohnehin geschädigte Gewebe ein Lymphödem, das sich im Stadium der Latenz befand, nun in ein höheres Stadium übergegangen sein könnte. Diese Annahme wurde jedoch am vorliegenden Kollektiv nicht bestätigt. Die univariate logistische Regressionsanalyse zeigte, dass eine Zweitoperation oder eine Rezidivoperation keinen Einfluss auf das Lymphödemrisiko der Patientinnen hatten (p-wert=0,671). Auch die univariate Cox-Analyse zeigte, dass eine Rezidivoperation das Lymphödemrisiko auch in Abhängigkeit der Zeit nicht signifikant erhöht (p-wert=0,829) Komplikationen In der vorliegenden Untersuchung wurde gezeigt, dass postoperative Komplikationen, vor allem Wundheilungsstörungen, das Lymphödemrisiko erhöhten. Wundheilungsstörungen sind gestörte und atypische Verläufe der physiologischen Wundheilung. Sie sind häufig bedingt durch Wundinfektionen, große Wundhämatome, Spannung der Wundränder, oder durch die Ausbildung von Seromen. Auch weitere Studien bestätigten den Einfluss von Wundheilungsstörungen auf das Lymphödem. In der Studie von McLaughlin et al klagten 41% der Patientinnen, die eine Infektion der oberen ipsilateralen Extremität hatten über das Auftreten des Lymphödems, während nur 10% der Patientinnen ohne Infektion am Lymphödem erkrankten (p- Wert<0,0001; McLaughlin et al., 2008) Soran et al. gaben ebenfalls Infektionen als Lymphödemrisikofaktor an (p<0,0001; Soran et al., 2006). Lucci et al. gaben ein erhöhtes Risiko für postoperative Wundinfektionen für Patientinnen mit erhöhtem BMI und Patientinnen bei denen eine Axilladissektion
79 67 durchgeführt wurde, an. Sowohl die Adipositas als auch die Axilladissektion könnten an sich erhöhtes Lymphödemrisiko darstellen (siehe oben). Es stellte sich nun die Frage, ob postoperative Wundinfektionen an sich ein Lymphödemrisikofaktor darstellten, oder ob sie dann, wenn ohnehin ein höheres Lymphödemrisiko bestand, lymphödemaggravierend waren (Lucci et al., 2007). Petrek et al. beschrieben in ihrer Studie, dass Infektionen signifikant mit der Ausbildung des Lymphödems assoziiert waren (p-wert<0,001). Allerdings wurden in dieser Studie auch lediglich Patientinnen mit Mastektomie und Axilladissektion eingeschlossen (Petrek et al., 2001). Hier wurde der Unterschied zur vorliegenden Arbeit, in Bezug auf die Zusammensetzung der Kollektive deutlich, denn in der vorliegenden Untersuchung wurden alle Patientinnen, die am Mammakarzinom therapiert wurden mit eingeschlossen. Auch bei Petrek. et al. kam deshalb nicht klar heraus, ob die Mastektomie bzw. Axilladissektion an sich oder die postoperativen Infektionen zur erhöhten Lymphödemrate führten. Ein Serom wird definiert als Ansammlung von Lymphe in nicht präformierten Gewebehohlräumen (Pschyrembel, 2004). Zu erwarten war somit, dass Serome bei der Ausbildung des sekundären Lymphödems eine Rolle spielten. In der vorliegenden Untersuchung konnte die Ausbildung eines Seroms nicht mit der logistischen Regressionsanalyse, jedoch mit der Cox Regressionsanalyse als ein Risikofaktor für das Auftreten des Lymphödems im Vergleich zu Patientinnen bei denen kein Serom aufgetreten war, identifiziert werden. Paiva et al. gaben ebenfalls die Ausbildung von Seromen als Lymphödemrisikofaktor an (Paiva et al., 2013). Auch Monleon et al. gaben Serome als Risikofaktor an (p- Wert=0,014; Monleon et al., 2014). Lucci et al. gaben die Axilladissektion als Risikofaktor für das Ausbilden postoperativer axillärer Serome an (Lucci et al., 2007). Hier könnte man den Schluss ziehen, dass die Ausbildung der axillären Serome ein Pathogeneseweg für die Entstehung vom Lymphödemen und somit für das erhöhte Auftreten des Lymphödems nach Axilladissektion darstellen könnte. Einerseits könnte die Wundheilungsstörung an sich das Lymphödem durch verschiedene pathophysiologische Mechanismen begünstigen. Földi E. und M. wiesen darauf hin, dass Wundheilungsstörungen die Entstehung von lympholymhatischen Anastomosen verhinderten und bereits vorhandene blockierten, und dass somit ein Lymphödem, das sich im Stadium der Latenz befand, nach kurzer Zeit in ein klinisches Stadium übergehen konnte (Földi M. und E., 2010).
80 68 Andererseits war nicht zu vergessen, dass Patientinnen mit Vorerkrankungen wie etwa Diabetes mellitus, Adipositas, oder auch weitere therapeutische Maßnahmen wie die Radiatio viel eher eine Wundheilungsstörung bekamen. Dann würde sich die Frage stellen, ob nicht diese Faktoren diejenigen waren, die das Ausbilden des Lymphödem begünstigten, oder zumindest eine Rolle spielten Radiatio Földi E. und M. beschrieben die Bestrahlung als Lymphödem- Risikofaktor, jedoch mit geringem Risiko. Sie erklärten die Folgen der Bestrahlung wie folgt: Eine Radiatio führte einerseits zur perilymphvaskulären Fibrosklerose, welche die Einengung von Lymphgefäßen zur Folge hatte, gleichzeitig wurde die lympholymphatische Anastomosenbildung sowie die Regeneration von Lymphgefäßen herabgesetzt, sodass diese Mechanismen das Lymphödemrisiko erhöhten (Abbildung 4.1). Es gab wiederum einige Studien, die keinen Effekt der Radiotherapie auf ein erhöhtes Lymphödemrisiko zeigten, wie etwa Meeske et al., Paiva et al. oder Paskett et al.
81 69 Abbildung 4.1: Strahlentherapie als Risikofaktor für ein Lymphödem (Földi et al., 2010) In der Studie von Mc Laughlin et al in 2008 zeigte sich zwar ein erhöhte Prävalenz des Lymphödems bei Patientinnen, die eine Radiatio der Brust oder Thoraxwand erhielten, dieser Zusammenhang war jedoch nicht statistisch signifikant (p- Wert=0,16; McLaughlin et al., 2008). Crosby et al. zeigten andererseits den Effekt der adjuvanten Bestrahlung auf das erhöhte Lymphödemrisiko bei Frauen mit primärer Brustrekonstruktion in ihrer multivariaten Regressionsanalyse mit einem Odds Ratio von 2,64 mit 95%CI 1,30-5,32, p-wert=0,007). Jedoch wurde in dieser Studie die Lokalisation der Bestrahlung nicht beschrieben (Crosby et al., 2012). Monleon et al. zeigten ebenfalls die adjuvante Radiatio als Risikofaktor für das Auftreten des Lymphödems auf. Wurden Patientinnen an der Restbrust /Brustwand sowie an supraklavikulär (HR 4,41, p-wert<0,01) oder an Restbrust /Brustwand, supraklavikulär und an den Lymphabflusswegen (HR 3,39 p-wert<0,01) bestrahlt, hatten die Patientinnen ein höheres Risiko am Lymphödem zu erkranken. Allerdings wurde in dieser Studie nicht differenziert, wo das Lymphödem aufgetreten war, ob am Arm oder in der bestrahlten Region (Monleon et al., 2014). Lee et al. zeigten in ihrer Metaanalyse von 32 Studien einen Zusammenhang zwischen dem Auftreten des sekundären Lymphödems bei bestrahlten Patientinnen (OR 1,46). Allerdings wurde hier nicht klar wo das Lymphödem festgestellt wurde (ob
82 70 an Arm, Brust und/ oder Thoraxwand), außerdem wurden mehrere Studien zusammengefasst, bei denen jeweils unterschiedlichen Angaben zum Bestrahlungsort gemacht wurden (Lee et al., 2008). Herd-Smith et al. beschrieben ebenfalls die adjuvante Radiatio als unabhängigen Lymphödemrisikofaktor (HR 1,38, 95%CI 1,02-1,86; Herd-Smith et al., 2001). Die vorliegende Arbeit untersuchte nicht allein den Zusammenhang zwischen der adjuvanten Radiatio mit dem Auftreten des Lymphödems, sondern untersuchte einerseits den Bestrahlungsort als Lymphödemrisikofaktor, und andererseits die Lokalisation des aufgetretenen Lymphödems in Abhängigkeit vom Bestrahlungsort. Sowohl die univariate Analyse der logistischen Regression als auch die univariate Analyse der Cox Regression zeigten den signifikanten Zusammenhang zwischen der Radiatio der Lymphabflusswege und der Erhöhung des Lymphödemrisikos (Lymphödem der Arme und/oder der Brust und/ oder der Thoraxwand). Wurde nach brusterhaltender Operation die Restbrust oder nach Mastektomie die Thoraxwand bestrahlt, so stieg das Lymphödemrisiko nicht. Auch bei der Betrachtung des alleinigen Brustlymphödem konnte kein Zusammenhang zwischen der Radiatio und einem erhöhten Lymphödemrisiko festgestellt werden, unabhängig vom Ort der Bestrahlung. Die Überlegung war, ob durch die Radiatio der Brust bei brusterhaltender Therapie oder der Thoraxwand nach Mastektomie die Lymphkollektoren beschädigt wurden und ein Lymphödem der Brust/ der Thoraxwand dadurch begünstigt werden würde. Es war vorstellbar, dass es durch die Bestrahlung zu einer Fibrose des Gewebes und damit auch der Lymphgefäße kam, die hierdurch eingeengt und in ihrer Transportfähigkeit gehindert wurden. Gleichzeitig war denkbar, dass durch die Bestrahlung eine Regeneration der durch die Operation durchtrennten Lymphgefäße verhindert wurde und ein rehabilitieren des Lymphsystems nicht möglich war. Pathogenetisch wäre ein erhöhtes Lymphödemrisiko bei Radiatio der Brust oder der Thoraxwand somit denkbar, sodass weitere Studien in diesem Zusammenhang sinnvoll sind Chemotherapie Die vorliegende Studie zeigte einen deutlichen Zusammenhang des Lymphödemrisiko mit der Verabreichung der Chemotherapie. Patientinnen, die eine Chemotherapie erhielten, hatten in der logistischen Regressionsanalyse fast doppelt
83 71 so hohes Risiko am Lymphödem zu erkranken, als Patientinnen die keine erhielten (OR 1,78 mit CI 1,09-2,92, p-wert=0,021). Entscheidend war welche Substanzen verabreicht wurden. War die Chemotherapie taxanhaltig, so hatten Patientinnen etwa ein dreifach hohes Risiko am Lymphödem zu erkranken (OR 2,86 mit CI 1,55-5,25, p-wert=0,001), als Patientinnen, bei denen keine taxanhaltige Chemotherapie verabreicht wurde. Auch in der Berechnung dieses Zusammenhangs mit der Zeit wurde dies deutlich. Hier war es für das Lymphödemrisiko ebenfalls ausschlaggebend, ob die Patientin Chemotherapie erhalten hat (HR 1,58 mit 95%CI 1,05-2,38, p-wert=0,029), und ob diese taxanhaltig war (HR 2,57 mit 95%CI 1,56-4,25, p-wert<0,001). Unter Docetaxel wurde ein Flüssigkeitsretentionssyndrom beschrieben. Patientinnen mit schweren Ödemen, Perikard- oder Pleuraergüssen müssen gesondert überwacht werden. Diese Tatsache korrelierte mit Daten der vorliegenden Studie, bei der taxanhaltige Substanzen als Lymphödemrisikofaktor identifiziert werden konnten. Bei der Betrachtung des reinen Brustlymphödem im Vergleich zum kombinierten Lymphödem der Arme mit/ohne Brust und/oder Thoraxwand zeigte sich zunächst ein signifikanter Zusammenhang der Gabe der systemischen Chemotherapie und einem häufigeren Auftreten des kombinierten Lymphödems der Arme (siehe Tabelle 3.10). Dieser Zusammenhang konnte durch eine multivariate Analyse widerlegt werden, in der sich zeigte, dass die Axilladissektion der relevante Faktor für das häufigere Auftreten des kombinierten Armlymphödems war und es keinen Zusammenhang zwischen der Chemotherapie und der Lymphödemlokalisation gab (siehe Tabelle 3.12). Der anfängliche Zusammenhang ließ sich therapeutisch erklären, denn Patientinnen mit positivem Nodalstatus hatten eine Axilladissektion sowie häufiger eine systemische Chemotherapie erhalten (siehe Tabelle 3.11), sodass diese Faktoren voneinander abhängige Faktoren waren. Ausschlaggebend war jedoch nur Lymphonodektomie. Shahpar et al. fanden keine signifikante Korrelation zwischen der systemischen Chemotherapie und einem erhöhtem Lymphödemrisiko. Sie untersuchten vorallem die Risikoerhöhung hinsichtlich der Therapie mit (p-wert=0,69) und ohne (p- Wert=0,42) Anthrazyklinen (Doxorubicin; Shahpar et al., 2013). Auch Paiva et al. konnten keinen statistisch signifikanten Zusammenhang zwischen der Gabe der Chemotherapie und einem erhöhtem Lymphödemrisiko feststellen (p- Wert=0,69; Paiva et al., 2013)
84 72 Meeske et al. beschrieben, dass Patientinnen mit Chemotherapie ein doppelt so hohes Lymphödemrisiko hatten als Patientinnen ohne Chemotherapie. In dieser Studie wurde jedoch nicht klar, welche Substanzen verabreicht wurden (Meeske et al., 2008). Auch Paskett et al. beschrieben eine Risikoerhöhung für das Lymphödem mit einem HR 1,76 (p-wert=0,02) für Patientinnen, die eine Chemotherapie erhalten hatten (Paskett et al., 2007) Auch hier wurde die Substanz der Chemotherapie nicht beschrieben. Sie erklärten diese Beobachtung damit, dass Chemotherapie häufig bei jungen Patientinnen mit hohem Risiko angewendet wird, und dass auch bei diesen Patientinnen die Therapie insgesamt aggressiver war, sodass die aggressivere Therapie ein Grund für das erhöhte Lymphödemrisiko gewesen sein könnte. Norman et al. gaben für Patientinnen, die eine auf Anthrazyklinen basierte Chemotherapie erhielten, ein höheres Lymphödemrisiko an: HR 1,46 (95% CI, ; Norman et al., 2010). Es wurde deutlich, dass weitere Studien fehlten, die das Risiko der Chemotherapie, vorallem jedoch die der taxanhaltigen Chemotherapie, hinsichtlich des Auftretens des Lymphödems weiter untersuchten. 4.6 Begleiterkrankungen und Lymphödemrisiko Földi E. und M. beschrieben, dass ein bereits bestehendes Lymphödem durch viele begleitende Erkrankungen verschlechtert werden konnte (Földi M. und E., 2010) Internistische Erkrankungen, die zur Mikroangiopathie führten, die Blutkapillarmembran beschädigten und somit die lymphpflichtigen Lasten erhöhten, könnten das Risiko erhöhen, dass sich nach Karzinomtherapie und damit einhergehender verminderter Lymphabtransportfähigkeit durch die Lymphonodektomie ein Lymphödem ausbildett. So wurden im folgenden Abschnitt Grunderkrankungen und der Zusammenhang zum Lymphödem einzeln betrachtet Adipositas Den Zusammenhang der Adipositas und Erhöhung des Lymphödemrisikos wurde im Abschnitt Patientinnencharakteristika und Lymphödemrisiko diskutiert.
85 Arterielle Hypertonie Die arterielle Hypertonie stellte in der Analyse der logistischen- sowie in der Cox- Regressionsanalyse ein Risikofaktor für das kombinierte Lymphödem des Armes, der Brust und/ oder der Thoraxwand dar. Geller et al. beschrieben zwar nicht die arterielle Hypertonie als Risikofaktor, sondern eine antihypertensive Therapie als projektiven Faktor. In ihrer Studie erkrankten 43,6% der Frauen ohne antihypertensiver Therapie am Lymphödem, während nur 14,3% der Frauen mit antihypertensiver Therapie am Lymphödem erkrankten. Für sie könnte die therapeutisch bedingte Senkung des kapillaren Drucks, und damit der geringere Austritt des Plasma ins Interstitium eine Rolle spielen, warum Patientinnen, deren Arterielle Hypertonie therapiert wurde seltener am Lymphödem erkrankten als Patientinnen ohne antihypertensiver Therapie (Geller et al., 2003). Hier stellte sich die Frage ob somit auch der Umkehrschluss möglich war, dass nämlich Patientinnen mit arterieller Hypertonie aufgrund der oben beschriebenen Pathogenese häufiger am Lymphödem erkrankten. Interessant wäre es jedoch auch die antihypertensive Therapie und ihr Nebenwirkungsprofil an sich im Hinblick auf ein erhöhtes Lymphödemrisiko genauer unter die Lupe zu nehmen. Üblicherweise werden zur antihypertensiven Therapie Diuretika, Betablocker, ACE- Inhibitoren, AT1-Antagonisten und Calciumkanalblocker gegeben. Betrachtete man nun das Nebenwirkungsprofil dieser Medikamente, so wurde deutlich, dass etwa unter den Dihydropyridin-Derivaten vermehrt Knöchelödeme auftraten (Aktories et al 2009). Und ein vermehrtes Auftreten von Ödemen könnte ein Lymphödemaggravierender Faktor darstellen. In unserer Untersuchung haben wir nicht differenziert, ob bei Patientinnen, die anamnestisch eine arterielle Hypertonie angaben, diese gleichzeitig therapiert wurde und, mit welchen Medikamenten die Therapie stattfand. So war es uns anhand der vorliegenden Daten nicht möglich zu differenzieren ob das vermehrte Auftreten des Lymphödems in dieser Subgruppe an der Erkrankung an sich, oder an der medikamentösen Einstellung und deren Nebenwirkungsprofil lag. Dies könnte jedoch Grundlage einer weiterführenden Studie sein. Auch Overgaard et al. beschrieben in ihrem Review die arterielle Hypertonie als einen patientinnenbedingten Risikofaktor für die Ausbildung des Lymphödems (Overgaard, 2000).
86 74 Meeske et al. beschrieben, dass Patientinnen mit einer Anamnese der arteriellen Hypertonie ein doppelt so hohes Risiko hatten am Lymphödem zu erkranken als Patientinnen bei denen keine arterielle Hypertonie festgestellt worden war (Meeske et al., 2008). Die arterielle Hypertonie war selten alleinige Grunderkrankung vieler Patientinnen, sondern ging häufig mit dem metabolischen Syndrom einher. Lag gleichzeitig eine Bauchfettleibigkeit, ein Diabetes mellitus oder eine Dyslipidämie vor, so war es kaum möglich zu eruieren, ob und welche dieser Faktoren der lymphödemaggravierende Faktor war. Bei der arteriellen Hypertonie war pathogenetisch wie oben beschrieben zum einen eine Erhöhung des kapillären Drucks denkbar, der zur Erhöhung der lymphpflichtigen Lasten geführt haben könnte. Gleichzeitig wäre auch eine multifaktoriell bedingte Gefäßwandverdickung mit Absonderung von atherosklerotischen Plaques im Lymphgefäßsystem denkbar, analog zum Blutgefäßsystem, welche die Lymphtransportfähigkeit gesenkt haben könnte Diabetes mellitus Földi M. und E. beschrieben einen direkten Zusammenhang des Lymphödems mit einem Diabetes mellitus. Pathophysiologisch ließ sich der Diabetes mellitus als Lymphödem aggravierende Erkrankung wie folgt erklären: Die lymphpflichtige Last wurde durch die erhöhte Kapillarpermeabilität, die durch die Mikroangiopathie bedingt war, erhöht. Gleichzeitig führte der Diabetes mellitus zur allgemeinen Immunschwäche, weil auch die Blutkapillaren der Lymphknoten betroffen waren. Die Immunschwäche bewirkte eine höhere Infektanfälligkeit, Hautpilzerkrankungen und bakterielle Infektionen traten häufiger auf und begünstigten das Auftreten des Lymphödems (Földi M. und E., 2010). In unserer Studie konnte der Diabetes mellitus nicht signifikant als Risikofaktor für das kombinierte Lymphödem des Armes, der Brust und/ oder der Thoraxwand identifiziert werden (p-wert=0,053). Dies konnte daran liegen, dass die Vorerkrankungen anamnestisch erfragt worden waren. Es könnte also gut sein, dass Patientinnen, gerade diejenigen mit Lymphödem, Diabetikerinnen waren, es aber nicht wussten und deshalb nicht angegeben hatten, sodass der Zusammenhang in unserer Evaluation nicht deutlich werden konnte.
87 75 In der Zusammenhangsanalyse des reinen Brustlymphödems mit Begleiterkrankungen zeigte sich, dass es einen signifikanten Zusammenhang zwischen der Lymphödemlokalisation und dem Diabetes mellitus gab. Es wurde deutlich, dass der Anteil der Patientinnen mit Diabetes mellitus unter den Patientinnen mit reinem Brustlymphödem höher war als der Anteil der an Diabetes mellitus erkrankten Patientinnen unter den Patientinnen mit kombiniertem Lymphödem (p-wert=0,006). Es war möglich, dass der Diabetes mellitus ein Risikofaktor für das Auftreten des reinen Brustlymphödems darstellte. Jedoch müssten weitere Studien hierzu durchgeführt werden, vor allem mit größerer Patientinnenzahl. Auch Paiva et al. konnten in ihrer Studie keinen Zusammenhang zwischen Diabetes mellitus und einem erhöhten Lymphödemrisiko feststellen (Paiva et al., 2013) Schilddrüsenerkrankungen Da hormonelle Dysbalancen eine Ödembildung zufolge haben können (wie zum Beispiel das Entstehen eines Myxödems bei Hypothyreose), war es möglich, dass diese das Entstehen des Lymphödems bei vorgeschädigtem Lymphgefäßsystem begünstigten. In unserer Arbeit konnte kein signifikanter Zusammenhang zwischen Schilddrüsenerkrankungen und dem Lymphödem gezeigt werden. Dies könnte daran gelegen haben, dass die Patientinnen, die anamnestisch eine Schilddrüsenfunktionsstörung angegeben hatten, deswegen lange in Behandlung waren und die Schilddrüsenwerte im Normbereich lagen, sodass sich zunächst kein Effekt gezeigt hat. Sinnvoll könnte es sein, bei Patientinnen mit Lymphödem und in einer Kontrollgruppe den TSH-Spiegel als möglichen Risikofaktor zu messen Erkrankungen des Bewegungsapparates Földi E. und M. beschrieben, dass sich das Lymphödem meist verschlechterte, wenn gleichzeitig orthopädische Erkrankungen vorlagen. Dies galt sicher für orthopädische Erkrankungen der unteren Extremität. Schwieriger war es, den Zusammenhang zwischen orthopädischen Erkrankungen der oberen Extremität wie etwa eine Omarthrose und dem Auftreten des Lymphödems herzustellen. Die Omarthrose hatte eine Bewegungseinschränkung und Schmerzen zur Folge, doch sie war meist nicht so stark ausgeprägt wie eine Cox- oder Gonarthrose, sodass essentielle Bewegungsabläufe des Alltags wie das Gehen gestört waren. Höchstwahrscheinlich
88 76 beeinträchtigten orthopädische Erkrankungen der oberen Extremität nicht so stark die alltäglichen Bewegungsausmaße wie Erkrankungen der unteren Extremitäten, sodass deshalb auch in unserer Studie zunächst kein Zusammenhang gefunden werden konnte (p-wert=0,078). Paiva et al. konnten in ihrer Untersuchung jedoch nachweisen, dass gestörte Bewegungsabläufe im Schulterbereich wie die gestörte Ab- oder Adduktion, sowie Innen-/oder Außenrotation signifikant mit einem höheren Lymphödemrisiko einhergingen (p-wert<0,001; Paiva et al., 2013). Es lag nahe, dass eingeschränkte Bewegungsmöglichkeiten, deren Ursache zumeist in einer schmerzhaften Omarthrose lag, zu Schonverhalten führten. Bewegung gehört in der Tetrade der KPE zur entstauenden Krankengymnastik und ist eine der Säulen, die für den Erfolg der konservativen Lymphödemtherapie verantwortlich ist. Im Umkehrschluss war vorstellbar, dass Schonverhalten, also die Bewegungsarmut, ein bestehendes Lymphödem verschlechtern konnte oder bei geschädigtem Lymphgefäßsystem ein erhöhtes Lymphödemrisiko darstellte. 4.7 Körperliche Beanspruchung und Lymphödemrisiko Beide Analyse-Methoden zeigten einen signifikanten Zusammenhang zwischen schwerer körperlicher Beanspruchung und der Erhöhung des Lymphödemrisikos. Vorstellbar war, dass es bei Überbeanspruchung zu Mikroverletzungen im Gewebe kam, und sich hierdurch entstehende Entzündungsreaktionen das Lymphödem verschlechtern konnten. Zudem würde das Gewebe bei zu hoher Belastung deutlich vermehrt durchblutet (aktive Hyperämie) und es hätte durch den erhöhten kapillären Druck vermehrt Flüssigkeitsaustritt in das Interstitium stattgefunden. Petrek et al. untersuchten unter anderem ebenfalls die körperliche Beanspruchung im Hinblick auf ein erhöhtes Lymphödemrisiko, konnten jedoch keinen signifikanten Zusammenhang darstellen (Petrek et al., 2001). Zusammenfassend wurde deutlich, wie bedeutsam ein sensibler Umgang mit Gewebe mit vorgeschädigtem Lymphsystem war, denn es war ein schmaler Grat zwischen der sich positiv auswirkenden Bewegung, welche den Lymphabfluss förderte und der Überlastung der betroffenen Extremität, welche das Lymphödem auslöste oder verschlechtern konnte.
89 77 5 ZUSAMMENFASSUNG Das sekundäre Lymphödem ist eine häufige Langzeitkomplikation der Mammakarzinom-Therapie. Pathophysiologisch entsteht das Lymphödem aufgrund der Beeinträchtigung des Lymphgefäßsystems durch die onkologische Therapie und der damit einhergehenden verminderten Transportkapazität. Übersteigt die Menge der lymphpflichtigen Lasten dauerhaft die Transportkapazität des Lymphgefäßsystems, wird ein Lymphödem klinisch manifest. Die vorliegende Arbeit untersuchte Häufigkeit, Latenzzeit zur Primärtherapie, sowie den Zusammenhang des Auftretens sekundärer Lymphödeme mit potentiellen Risikofaktoren (RF) an einem Patientinnenkollektiv der Universitäts-Frauenklinik Freiburg, die im Zeitraum vom bis an einem Mammakarzinom therapiert wurden. Insgesamt nahmen 305 Patientinnen an der Studie teil. Die Diagnose eines Lymphödems wurde anamnestisch sowie durch eine gründliche körperliche Untersuchung durch das lymphologisch geschulte Studienteam gestellt. In der vorliegenden Untersuchung betrug die Inzidenz des sekundären Lymphödems der Arme mit/ohne Brust und/oder Thoraxwand 35,6%, die des reinen Brustlymphödems 3,99%. Die Latenzzeit zwischen der Lymphonodektomie und der Erstmanifestation des Lymphödems betrug 15 Monate. Risikofaktoren für die Entwicklung eines Lymphödems waren abhängig von Patientinnen- und Tumorcharakteristika, der Therapie und Begleiterkrankungen. 1. Patientinnenbezogene RF: BMI>35 sowie Grad der Adipositas. 2. Tumorbedingte RF: positiver Nodalstatus, Tumoren im oberen äußeren Quadranten (Cox-Regressionsanalyse). 3. Therapiebedingte Faktoren: BET, Axilladissektion, Radiatio der LAW, systemische Chemotherapie, besonders die Therapie mit taxanhaltigen Substanzen, sowie eine Tendenz für die SNL als RF für das Auftreten des reinen Brustlymphödems. Ein protektiver Effekt zeigte sich für die Rekonstruktion (Cox- Regressionsanalyse). An postoperativen Komplikationen konnten Wundheilungsstörungen, sowie die Ausbildung von Seromen (Cox- Regressionsanalyse) als RF identifiziert werden. 4. Begleiterkrankungen: arterielle Hypertonie. Eine Tendenz zu einem erhöhten Risiko für das Auftreten des reinen Brustlymphödems konnte bei den Patientinnen mit einem Diabetes mellitus festgestellt werden. Die schwere körperliche Beanspruchung stellte ebenfalls einen Risikofaktor dar.
90 78 6 LITERATURVERZEICHNIS Aktories, K., Förstermann, U., Hofmann, F.B., und Starke, K. (2009). Allgemeine und spezielle Pharmakologie und Toxikologie: Begründet von W. Forth, D. Henschler, W. Rummel, Urban & Fischer Verlag/Elsevier GmbH, München, S Albert, U.-S., Altland, H., Duda, V., Engel, J., Geraedts, M., Heywang-Köbrunner, S., et al. (2008) update of the guideline: early detection of breast cancer in Germany. J. Cancer Res. Clin. Oncol. 135: Avraham, T., Daluvoy, S.V., Riedel, E.R., Cordeiro, P.G., Zee, K.J. Van, und Mehrara, B.J. (2010). Tissue Expander Breast Reconstruction is Not Associated with an Increased Risk of Lymphedema. Ann. Surg. Oncol. 17: Bastard, J.-P., Jardel, C., Bruckert, E., Blondy, P., Capeau, J., Laville, M., et al. (2000). Elevated Levels of Interleukin 6 Are Reduced in Serum and Subcutaneous Adipose Tissue of Obese Women after Weight Loss. J. Clin. Endocrinol. Metab. 85: Clark, B. (2005). Incidence and risk of arm oedema following treatment for breast cancer: a three-year follow-up study. QJM 98: Crosby, M.A., Card, A., Liu, J., Lindstrom, W.A., und Chang, D.W. (2012). Immediate Breast Reconstruction and Lymphedema Incidence: Plast. Reconstr. Surg. 129: 789e 795e. DiSipio, T., Rye, S., Newman, B., und Hayes, S. (2013). Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. Lancet Oncol. Esposito K, Pontillo A, Di Palo C, Giugliano, G., Masella, M., Marfella, R. und Giugliano, D. (2003). Effect of weight loss and lifestyle changes on vascular inflammatory markers in obese women: A randomized trial. JAMA 289: Földi, M., Földi, E., und Kubik, S. (2010). Lehrbuch Lymphologie: für Ärzte, Physiotherapeuten und Masseure/med. Bademeister 7. Aufl. Urban & Fischer Verlag/Elsevier GmbH, München, S: 176, S. 181, S. 182, S S.195, S.216, S.294. Geller, B.M., Vacek, P.M., O Brien, P., und Secker-Walker, R.H. (2003). Factors associated with arm swelling after breast cancer surgery. J. Womens Health 12: Goffman, T.E., Laronga, C., Wilson, L., und Elkins, D. (2004). Lymphedema of the arm and breast in irradiated breast cancer patients: risks in an era of dramatically changing axillary surgery. Breast J. 10: Hayes, S.C., Janda, M., Cornish, B., Battistutta, D., und Newman, B. (2008). Lymphedema After Breast Cancer: Incidence, Risk Factors, and Effect on Upper Body Function. J. Clin. Oncol. 26:
91 79 Helyer, L.K., Varnic, M., Le, L.W., Leong, W., und McCready, D. (2010). Obesity is a Risk Factor for Developing Postoperative Lymphedema in Breast Cancer Patients. Breast J. 16: Herd-Smith, A., Russo, A., Muraca, M.G., Turco, M.R. Del, und Cardona, G. (2001). Prognostic factors for lymphedema after primary treatment of breast carcinoma. Cancer 92: Kaatsch, P., Spix, C., Hentschel, S., Katalinic, A., Luttmann, S., Stegmaier, C., Caspritz, S.; Cernaj J.; Ernst, A.; Folkerts, J.; Hansmann, J., Kranzhöfer, K., Krieghoff-Henning, E., Kunz, B., Penzkofer, A., Treml, K., Wittenberg, K., Baras, N., Barnes, B., Bertz, J., Buttmann-Schweiger, N., Dahm, S., Franke, M., Haberland, J., Kraywinkel, K., Wienecke, A. und Wolf, U. (2013). Krebs in Deutschland 2009/ Ausgabe Robert Koch-Institut (Hrsg) und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.v. (Hrsg). Berlin URL: _2013/krebs_in_deutschland_2013.pdf? blob=publicationfile [abgerufen am ]. Kuhnke E (1976). Volumenbestimmung aus Umfangmessungen. Folia Angiologica;24: Kolemeyer, L, Shanley, K., Reul-Hirche, H., Piller N.B. (2004). Guidline for a national standard technique of measurement of lymphoedematous limbs. Australasian Lymphology Association. URL: f [abgerufen am ]. Lawenda, B.D., Mondry, T.E., und Johnstone, P.A.S. (2009). Lymphedema: A primer on the identification and management of a chronic condition in oncologic treatment. CA. Cancer J. Clin. 59: Lee, T.S., Kilbreath, S.L., Refshauge, K.M., Herbert, R.D., und Beith, J.M. (2008). Prognosis of the upper limb following surgery and radiation for breast cancer. Breast Cancer Res. Treat. 110: Liberopoulos, E.N., Mikhailidis, D.P., und Elisaf, M.S. (2005). Diagnosis and management of the metabolic syndrome in obesity. Obes. Rev. 6: Lucci, A., McCall, L.M., Beitsch, P.D., Whitworth, P.W., Reintgen, D.S., Blumencranz, P.W., et al. (2007). Surgical Complications Associated With Sentinel Lymph Node Dissection (SLND) Plus Axillary Lymph Node Dissection Compared With SLND Alone in the American College of Surgeons Oncology Group Trial Z0011. J. Clin. Oncol. 25: McGale, P., Darby, S.C., Hall, P., Adolfsson, J., Bengtsson, N.-O., Bennet, A.M., et al. (2011). Incidence of heart disease in 35,000 women treated with radiotherapy for breast cancer in Denmark and Sweden. Radiother. Oncol. 100:
92 80 McLaughlin, S.A., Wright, M.J., Morris, K.T., Sampson, M.R., Brockway, J.P., Hurley, K.E., et al. (2008). Prevalence of Lymphedema in Women With Breast Cancer 5 Years After Sentinel Lymph Node Biopsy or Axillary Dissection: Patient Perceptions and Precautionary Behaviors. J. Clin. Oncol. 26: Meeske, K.A., Sullivan-Halley, J., Smith, A.W., McTiernan, A., Baumgartner, K.B., Harlan, L.C., et al. (2008). Risk factors for arm lymphedema following breast cancer diagnosis in Black women and White women. Breast Cancer Res. Treat. 113: Monleon, S., Murta-Nascimento, C., Bascuas, I., Macià, F., Duarte, E., und Belmonte, R. (2014). Lymphedema Predictor Factors after Breast Cancer Surgery: A Survival Analysis. Lymphat. Res. Biol Nesvold, I.-L., Dahl, A.A., Løkkevik, E., Marit Mengshoel, A., und Fosså, S.D. (2008). Arm and shoulder morbidity in breast cancer patients after breast-conserving therapy versus mastectomy. Acta Oncol. 47: Norman, S.A., Localio, A.R., Kallan, M.J., Weber, A.L., Simoes Torpey, H.A., Potashnik, S.L., et al. (2010). Risk Factors for Lymphedema after Breast Cancer Treatment. Cancer Epidemiol. Biomarkers Prev. 19: Overgaard, J. (2000). Risk factors of arm lymphedema in breast cancer patients. Acta Oncol. 39: Ozcinar, B., Guler, S.A., Kocaman, N., Ozkan, M., Gulluoglu, B.M., und Ozmen, V. (2012). Breast cancer related lymphedema in patients with different loco-regional treatments. The Breast 21: Paiva, D.M., Rodrigues, V.O., Cesca, M.G., Palma, P.V., und Leite, I.C. (2013). Prevalence of lymphedema in women undergoing treatment for breast cancer in a referral center in southeastern Brazil. BMC Womens Health 13: 6. Park, J.H., Lee, W.H., und Chung, H.S. (2008). Incidence and risk factors of breast cancer lymphoedema. J. Clin. Nurs. 17: Paskett, E.D., Naughton, M.J., McCoy, T.P., Case, L.D., und Abbott, J.M. (2007). The epidemiology of arm and hand swelling in premenopausal breast cancer survivors. Cancer Epidemiol. Biomarkers Prev. 16: Petrek, J.A., Senie, R.T., Peters, M., und Rosen, P.P. (2001). Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis. Cancer 92: Pschyrembel, W. (2004). Pschyrembel Klinisches Wörterbuch 260. Aufl. de Gruyter, Berlin, S Rönkä, R.H., Pamilo, M.S., Smitten, K.A.J. von, und Leidenius, M.H.K. (2004). Breast lymphedema after breast conserving treatment. Acta Oncol. 43: Schünemann, H., und Willich, N. (1997). Lymphödeme nach Mammakarzinom: Eine Studie über 5868 Fälle. DMW - Dtsch. Med. Wochenschr. 122:
93 81 Schünke, M., Schulte, E., und Schumacher, U. (2005). PROMETHEUS Lernatlas der Anatomie. Allgemeine Anatomie und Bewegungssystem Thieme, Stuttgart, S Shahpar, H., Atieh, A., Maryam, A., Fatemeh, H.S., Massoome, N., Mandana, E., et al. (2013). Risk Factors of Lymph Edema in Breast Cancer Patients. Int. J. Breast Cancer 2013: 1 7. Soran, A., D Angelo, G., Begovic, M., Ardic, F., Harlak, A., Samuel Wieand, H., et al. (2006). Breast Cancer-Related Lymphedema What Are the Significant Predictors and How They Affect the Severity of Lymphedema? Breast J. 12: Yen, T.W.F., Fan, X., Sparapani, R., Laud, P.W., Walker, A.P., und Nattinger, A.B. (2009). A Contemporary, Population-Based Study of Lymphedema Risk Factors in Older Women with Breast Cancer. Ann. Surg. Oncol. 16:
94 82 7 DANKSAGUNG Für die Durchführung und Fertigstellung dieser Arbeit möchte ich mich von Herzen bei allen Menschen bedanken, die mich unterstützt haben, in menschlicher und in fachlicher Hinsicht. Mein großer Dank richtet sich an Frau Prof. Hasenburg für die Vergabe sowie Durchsicht dieser Arbeit, welche mich persönlich und fachlich sehr bereichert hat. Für die Erstellung des Zweitgutachtens danke ich ganz herzlich Frau Prof. Földi. Besonders möchte ich mich bei Ihnen auch für die große Bereitschaft uns in die Lehre der Lymphologie einzuführen bedanken. Danke auch an das ganze Team der Földiklinik: Das ganze Ärzteteam, alle Krankenschwestern und Pfleger, das Team der Volumenmessung und alle TherapeutInnen, die mir zu jeder Zeit hilfsbereit zur Seite standen, mir großes Engagement entgegengebracht haben die Lehre der Lymphologie nahe zu bringen. Vielen Dank dafür, dass Sie es uns möglich gemacht haben, während der zweimonatigen Hospitation so viel zu lernen! Ein sehr großer Dank richtet sich an Herrn Traut, der für die Statistik zuständig und bei Fragen jederzeit sehr hilfsbereit war! Bei Ihnen, Frau Tröndle und Frau Schütt-Klein, sowie dem Team der Kinderwunsch- Ambulanz und dem Team der Anmeldung der Frauenklinik möchte ich mich ganz herzlich bedanken. Sie haben mir in organisatorischen Fragen oft sehr viel weitergeholfen! Auch ein ganz herzliches Dankeschön geht an den Europäischen Forschungs- und Förderverein für Lymphologie (EFFL e.v.), für die Förderung der vorliegenden Studie. Von Herzen möchte ich mich bei der Projektleiterin und direkten Betreuerin, Frau Dr. Martha Földi, bedanken. Du hast dem Projekt Halt gegeben, warst Ansprechpartnerin zu jeder Zeit, sowohl in organisatorischen als auch in fachlichen Fragen. Du hast mich super betreut, und ich konnte mich jederzeit auf fachlich sehr kompetente Ratschläge, deine Anregungen und deine konstruktive Kritik verlassen. Gleichzeitig bist Du Freundin, Du warst für mich da, in den unterschiedlichsten Lebenslagen und ich bin so froh, dass ich Dich und Deine liebe Familie kennenlernen durfte. Danke!
95 83 Vielen lieben Dank, liebe Simone und liebe Daniela, für die tolle und freundschaftliche Zusammenarbeit während der Durchführung dieser Arbeit! Von Herzen danke ich meiner Familie für Eure Unterstützung! DANKE! Liebster Holger, es fällt mir sehr schwer auf Papier zu bringen, was ich empfinde. Aber ich weiß, dass Du es weißt. DANKE! Mein lieber Luis, du hast mir Kraft gegeben ohne die ich nicht nur diese Arbeit hätte nicht zu Ende bringen können. DANKE!
96 84 8 ANHANG 8.1 Anamnesebogen und Befund
97 85
98 86
99 87
100 Einverständniserklärung
101 89
102 90
Das sekundäre Lymphödem nach Brustkrebsbehandlung Diagnostik und Therapie. 24. Mai 2013 Brustzentrum Niederrhein Dr. U.
 Das sekundäre Lymphödem nach Brustkrebsbehandlung Diagnostik und Therapie 24. Mai 2013 Brustzentrum Niederrhein Dr. U. Walz-Eschenlohr Mammakarzinom Ca. 57 000 Neuerkrankungen / Jahr Jede 9. Frau erkrankt
Das sekundäre Lymphödem nach Brustkrebsbehandlung Diagnostik und Therapie 24. Mai 2013 Brustzentrum Niederrhein Dr. U. Walz-Eschenlohr Mammakarzinom Ca. 57 000 Neuerkrankungen / Jahr Jede 9. Frau erkrankt
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung
 Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.01.2006 bis 30.06.2006 Erstellungstag: 30.06.2006 Erstellungssoftware: Rückmeldesystem
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.01.2006 bis 30.06.2006 Erstellungstag: 30.06.2006 Erstellungssoftware: Rückmeldesystem
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung
 Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.07.2005 bis 31.12.2005 Erstellungstag: 15.05.2006 Erstellungssoftware: Rückmeldesystem
Indikationsspezifischer Bericht zum Mammakarzinom für die Gemeinsame Einrichtung Ausgabe für den Berichtszeitraum 01.07.2005 bis 31.12.2005 Erstellungstag: 15.05.2006 Erstellungssoftware: Rückmeldesystem
Ergebnisse. Klinische Charakteristik
 25 Ergebnisse 19 der 105 Patientinnen waren bis zum Zeitpunkt der Nachuntersuchung bereits verstorben, in 13 Fällen als Folge des Tumorleidens. Die durchschnittliche Überlebenszeit betrug 6,72 Jahren (95%
25 Ergebnisse 19 der 105 Patientinnen waren bis zum Zeitpunkt der Nachuntersuchung bereits verstorben, in 13 Fällen als Folge des Tumorleidens. Die durchschnittliche Überlebenszeit betrug 6,72 Jahren (95%
Lymphödem nach Lymphonodektomie beim Mammakarzinom. Kann ein Lymphödem vermieden werden?
 Lymphödem nach Lymphonodektomie beim Mammakarzinom Kann ein Lymphödem vermieden werden? Formen des Lymphödems (primär/sekund r/sekundär) r) Lebensqualität Kann ein Lymphödem vermieden werden? Was hat sich
Lymphödem nach Lymphonodektomie beim Mammakarzinom Kann ein Lymphödem vermieden werden? Formen des Lymphödems (primär/sekund r/sekundär) r) Lebensqualität Kann ein Lymphödem vermieden werden? Was hat sich
Brustkrebs Erstdokumentation
 1 DMP-Fallnummer vom Arzt zu vergeben Administrative Daten 2 Krankenkasse bzw. Kostenträger Name der Kasse Name der Kasse 3 Name, Vorname der Versicherten 4 5 6 7 8 9 Geb. am TT.MM.JJ(JJ) TT.MM.JJ(JJ)
1 DMP-Fallnummer vom Arzt zu vergeben Administrative Daten 2 Krankenkasse bzw. Kostenträger Name der Kasse Name der Kasse 3 Name, Vorname der Versicherten 4 5 6 7 8 9 Geb. am TT.MM.JJ(JJ) TT.MM.JJ(JJ)
Endokrine Therapie des Mammakarzinoms. Bernd Hanswille Klinikum Dortmund Frauenklinik
 Endokrine Therapie des Mammakarzinoms Bernd Hanswille Klinikum Dortmund Frauenklinik Grundlagen Stufe-3-Leitlinie Brustkrebs-Früherkennung in Deutschland www.senologie.org\leitlinien.html S2/S3-Leitlinie
Endokrine Therapie des Mammakarzinoms Bernd Hanswille Klinikum Dortmund Frauenklinik Grundlagen Stufe-3-Leitlinie Brustkrebs-Früherkennung in Deutschland www.senologie.org\leitlinien.html S2/S3-Leitlinie
Langzeit-follow-up Datenbanken bei Mammakarzinom unter besonderer Berücksichtigung der Therapiewahl
 Aus dem Robert-Bosch-Krankenhaus Stuttgart (Akademisches Lehrkrankenhaus der Universität Tübingen) Abteilung für Gynäkologie und Geburtshilfe Chefarzt Professor Dr. W. E. Simon Langzeit-follow-up Datenbanken
Aus dem Robert-Bosch-Krankenhaus Stuttgart (Akademisches Lehrkrankenhaus der Universität Tübingen) Abteilung für Gynäkologie und Geburtshilfe Chefarzt Professor Dr. W. E. Simon Langzeit-follow-up Datenbanken
Brustkrebs - Dokumentation
 Brustkrebs - Dokumentation Anlage 4 (zu 28b bis 28g) N r. 1 DMP-Fallnummer Von der Ärztin/vom Arzt zu vergeben Administrative Daten 2 Krankenkasse bzw. Kostenträger Name der Kasse 3 Name, Vorname der Versicherten
Brustkrebs - Dokumentation Anlage 4 (zu 28b bis 28g) N r. 1 DMP-Fallnummer Von der Ärztin/vom Arzt zu vergeben Administrative Daten 2 Krankenkasse bzw. Kostenträger Name der Kasse 3 Name, Vorname der Versicherten
1 Einleitung Das Mammakarzinom Epidemiologie Ätiologie Risikofaktoren Protektive Faktoren 3
 Inhaltsverzeichnis 1 Einleitung 1 1.1 Das Mammakarzinom 1 1.1.1 Epidemiologie 1 1.1.2 Ätiologie 2 1.1.2.1 Risikofaktoren 2 1.1.2.2 Protektive Faktoren 3 1.1.3 Prognosefaktoren 4 1.2 Rezeptorstatus 5 1.2.1
Inhaltsverzeichnis 1 Einleitung 1 1.1 Das Mammakarzinom 1 1.1.1 Epidemiologie 1 1.1.2 Ätiologie 2 1.1.2.1 Risikofaktoren 2 1.1.2.2 Protektive Faktoren 3 1.1.3 Prognosefaktoren 4 1.2 Rezeptorstatus 5 1.2.1
1 Wirkungsweise der manuellen Lymphdrainage 1
 Inhaltsverzeichnis Vorwort... XI Einleitung.... XV 1 Wirkungsweise der manuellen Lymphdrainage 1 1.1 Vegetatives Nervensystem... 1 1.1.1 Reflexbogen... 3 1.2 Immunsystem.... 4 1.2.1 Humorale Immunität...
Inhaltsverzeichnis Vorwort... XI Einleitung.... XV 1 Wirkungsweise der manuellen Lymphdrainage 1 1.1 Vegetatives Nervensystem... 1 1.1.1 Reflexbogen... 3 1.2 Immunsystem.... 4 1.2.1 Humorale Immunität...
Benchmarking Brustzentren WBC
 Benchmarking Brustzentren WBC sauswertung 2010 Ergebnisbericht Städtische Kliniken Frankfurt-Höchst Klinik ID: 137 Anonymcode: 2969 Erstellungsdatum: 09.05.2011 Auswertezeitraum: 01.01.2010-31.12.2010
Benchmarking Brustzentren WBC sauswertung 2010 Ergebnisbericht Städtische Kliniken Frankfurt-Höchst Klinik ID: 137 Anonymcode: 2969 Erstellungsdatum: 09.05.2011 Auswertezeitraum: 01.01.2010-31.12.2010
Dokumentation einschließlich der für die Durchführung der Programme erforderlichen personenbezogenen Daten ( 137f Abs. 2 Satz 2 Nr.
 Anlage 7 zum Vertrag ab 01.07.2013 zur Durchführung des strukturierten Behandlungsprogramms nach 137 f SGB V zur Verbesserung der Versorgungssituation von Brustkrebs-Patientinnen - entspricht wörtlich
Anlage 7 zum Vertrag ab 01.07.2013 zur Durchführung des strukturierten Behandlungsprogramms nach 137 f SGB V zur Verbesserung der Versorgungssituation von Brustkrebs-Patientinnen - entspricht wörtlich
Anlage 9 Qualitätssicherung Stand Version 3.2. Qualitätssicherung Brustkrebs auf Grundlage des Datensatzes gemäß DMP-RL Teil B I Ziffer 5
 Vertrag zum DMP-Brustkrebs vom 30.06.2013 für das Vertragsgebiet Thüringen Seite 1 von 8 Anlage 9 Qualitätssicherung Stand 2012-11-22 Version 3.2 Qualitätssicherung Brustkrebs auf Grundlage des Datensatzes
Vertrag zum DMP-Brustkrebs vom 30.06.2013 für das Vertragsgebiet Thüringen Seite 1 von 8 Anlage 9 Qualitätssicherung Stand 2012-11-22 Version 3.2 Qualitätssicherung Brustkrebs auf Grundlage des Datensatzes
Anlage 7. 2 Kostenträger Name der Krankenkasse. 3 Name des Versicherten Familienname, Vorname
 Anlage 7 zum Vertrag nach 73 a SGB V vom 09.04.2013 zwischen der KVS und den Kassen ( AOK, Knappschaft, IKK, SVLFG und den Ersatzkassen ) im Saarland zur Durchführung des DMP Brustkrebs entspricht wörtlich
Anlage 7 zum Vertrag nach 73 a SGB V vom 09.04.2013 zwischen der KVS und den Kassen ( AOK, Knappschaft, IKK, SVLFG und den Ersatzkassen ) im Saarland zur Durchführung des DMP Brustkrebs entspricht wörtlich
Anlage 8. Qualitätssicherung. zum Vertrag zur Durchführung des DMP Brustkrebs Berlin
 Anlage 8 Qualitätssicherung zum Vertrag zur Durchführung des DMP Brustkrebs Berlin QS-Ziel QS-Indikator Auslösealgorithmus Angemessener Anteil der Patientinnen Anteil mit brusterhaltender brusterhaltender
Anlage 8 Qualitätssicherung zum Vertrag zur Durchführung des DMP Brustkrebs Berlin QS-Ziel QS-Indikator Auslösealgorithmus Angemessener Anteil der Patientinnen Anteil mit brusterhaltender brusterhaltender
Das Mammakarzinom: Diagnostik und Therapie
 Medizin Martin Smollich Das Mammakarzinom: Diagnostik und Therapie Wissenschaftlicher Aufsatz Martin Smollich Das Mammakarzinoms: Diagnostik und Therapie 1. Inzidenz, Risikofaktoren, Prävention, Früherkennung
Medizin Martin Smollich Das Mammakarzinom: Diagnostik und Therapie Wissenschaftlicher Aufsatz Martin Smollich Das Mammakarzinoms: Diagnostik und Therapie 1. Inzidenz, Risikofaktoren, Prävention, Früherkennung
Anlage 6. Qualitätssicherung Stand , Version 3.2
 Anlage 6 zum Vertrag über ein strukturiertes Behandlungsprogramm (DMP) zur Verbesserung der Versorgungssituation von Brustkrebspatientinnen Qualitätssicherung Stand 22.11.2012, Version 3.2 Qualitätssicherung
Anlage 6 zum Vertrag über ein strukturiertes Behandlungsprogramm (DMP) zur Verbesserung der Versorgungssituation von Brustkrebspatientinnen Qualitätssicherung Stand 22.11.2012, Version 3.2 Qualitätssicherung
Anlage 8 - Qualitätssicherung. Qualitätssicherung Brustkrebs auf Grundlage des Datensatzes gemäß Teil B Ziffer I Nr.
 Anlage 8 - Qualitätssicherung Qualitätssicherung Brustkrebs auf Grlage des Datensatzes gemäß Teil B Ziffer I Nr. 5 DMP-RL der RSAV QS-Ziel (RSAV) QS-Indikator Auslösealgorithmus Auswertungsalgorithmus
Anlage 8 - Qualitätssicherung Qualitätssicherung Brustkrebs auf Grlage des Datensatzes gemäß Teil B Ziffer I Nr. 5 DMP-RL der RSAV QS-Ziel (RSAV) QS-Indikator Auslösealgorithmus Auswertungsalgorithmus
Anlage 6 zum Vertrag über ein strukturiertes Behandlungsprogramm (DMP) zur Verbesserung der Versorgungssituation von Brustkrebspatientinnen
 Anlage 6 zum Vertrag über ein strukturiertes Behandlungsprogramm (DMP) zur Verbesserung der Versorgungssituation von Brustkrebspatientinnen Die Dokumentation im Rahmen der Strukturierten Behandlungsprogramme
Anlage 6 zum Vertrag über ein strukturiertes Behandlungsprogramm (DMP) zur Verbesserung der Versorgungssituation von Brustkrebspatientinnen Die Dokumentation im Rahmen der Strukturierten Behandlungsprogramme
Jahresbilanz % 1: Sonographische Untersuchung der extremitätenver- und entsorgenden Gefäße mittels CW-Doppler
 Jahresbilanz 2013 Im Jahr 2013 haben wir 20.353 Patienten in unserer Praxis behandelt. Dabei wurden von diesen 29,9% an den Arterien und 70,1% an den Venen untersucht. Untersuchung der Patienten 1 2 1
Jahresbilanz 2013 Im Jahr 2013 haben wir 20.353 Patienten in unserer Praxis behandelt. Dabei wurden von diesen 29,9% an den Arterien und 70,1% an den Venen untersucht. Untersuchung der Patienten 1 2 1
MRT in der Mammadiagnostik Standard, Nützliches und Überflüssiges
 MRT in der Mammadiagnostik Standard, Nützliches und Überflüssiges Samstag 10. November 2007 7. Bremer MR-Workshop Dr. D. Wruk, OÄ Diagnostische Radiologie Universitätsspital Basel Technische Standards
MRT in der Mammadiagnostik Standard, Nützliches und Überflüssiges Samstag 10. November 2007 7. Bremer MR-Workshop Dr. D. Wruk, OÄ Diagnostische Radiologie Universitätsspital Basel Technische Standards
Kosmetisches Ergebnis, Spätnebenwirkungen und Lebensqualität nach brusterhaltender Operation und Strahlentherapie des Mammakarzinoms
 Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Komm. Direktorin: PD Dr. med. G. Hänsgen) Kosmetisches Ergebnis, Spätnebenwirkungen und
Aus der Universitätsklinik und Poliklinik für Strahlentherapie an der Martin-Luther-Universität Halle-Wittenberg (Komm. Direktorin: PD Dr. med. G. Hänsgen) Kosmetisches Ergebnis, Spätnebenwirkungen und
Brustkrebs Nachsorge. Diagnostik und Therapie primärer und metastasierter Mammakarzinome. AGO e.v. in der DGGG e.v. sowie in der DKG e.v.
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Brustkrebs Nachsorge Brustkrebs Nachsorge Versionen 2002 2011: Bauerfeind / Bischoff / Blohmer / Böhme / Costa / Diel / Gerber / Hanf
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Brustkrebs Nachsorge Brustkrebs Nachsorge Versionen 2002 2011: Bauerfeind / Bischoff / Blohmer / Böhme / Costa / Diel / Gerber / Hanf
1. Vorbemerkung Ziel der vorliegenden Arbeit Das Mammakarzinom Historischer Überblick 2
 INHALTSVERZEICHNIS Seite I. EINLEITUNG 1. Vorbemerkung 1 2. Ziel der vorliegenden Arbeit 1 3. Das Mammakarzinom 2 3.1. Historischer Überblick 2 3.2. Ätiologie 4 3.2.1. Genetische und familiäre Disposition
INHALTSVERZEICHNIS Seite I. EINLEITUNG 1. Vorbemerkung 1 2. Ziel der vorliegenden Arbeit 1 3. Das Mammakarzinom 2 3.1. Historischer Überblick 2 3.2. Ätiologie 4 3.2.1. Genetische und familiäre Disposition
Das Mammakarzinom des Mannes. Holm Eggemann. Universitätsfrauenklinik. tsfrauenklinik Direktor: Prof. Dr. Dr. S.-D. Costa.R.
 Das Mammakarzinom des Mannes Holm Eggemann Universitätsfrauenklinik tsfrauenklinik Direktor: Prof. Dr. Dr. S.-D. Costa Universitätsklinikum tsklinikum Magdeburg A.ö.R..R. Mammakarzinom des Mannes Inzidenz
Das Mammakarzinom des Mannes Holm Eggemann Universitätsfrauenklinik tsfrauenklinik Direktor: Prof. Dr. Dr. S.-D. Costa Universitätsklinikum tsklinikum Magdeburg A.ö.R..R. Mammakarzinom des Mannes Inzidenz
Stephanie Rieger Dr.med.
 Stephanie Rieger Dr.med. Maligne Tumoren am knöchernen Becken, einschließlich des Multiplen Myeloms Untersuchung am Patientengut der Orthopädischen Universitätsklinik Heidelberg von 1974 bis 1998 Geboren
Stephanie Rieger Dr.med. Maligne Tumoren am knöchernen Becken, einschließlich des Multiplen Myeloms Untersuchung am Patientengut der Orthopädischen Universitätsklinik Heidelberg von 1974 bis 1998 Geboren
Seite Diskussion
 Seite 99 4 Diskussion In der Behandlung lokal fortgeschrittener oder inflammatorischer Mammakarzinome gilt die neoadjuvante Chemotherapie schon lange als Standard. Dass diese Therapieform in Hinblick auf
Seite 99 4 Diskussion In der Behandlung lokal fortgeschrittener oder inflammatorischer Mammakarzinome gilt die neoadjuvante Chemotherapie schon lange als Standard. Dass diese Therapieform in Hinblick auf
Brustkrebs Nachsorge. Diagnostik und Therapie primärer und metastasierter Mammakarzinome. AGO e.v. in der DGGG e.v. sowie in der DKG e.v.
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Brustkrebs Nachsorge Brustkrebs Nachsorge Version 2002: Thomssen / Scharl Version 2003 2008: Bauerfeind / Bischoff / Blohmer / Böhme /
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Brustkrebs Nachsorge Brustkrebs Nachsorge Version 2002: Thomssen / Scharl Version 2003 2008: Bauerfeind / Bischoff / Blohmer / Böhme /
Brustkrebs im Kanton Freiburg. Aktualisierung der im 2012 realisierten und publizierten Statistikanalysen.
 Brustkrebs im Kanton Freiburg. Aktualisierung der im 2012 realisierten und publizierten Statistikanalysen. Dr. Bertrand Camey Krebsregister Freiburg Route St-Nicolas-de Flüe 2, PF 96 1705 Freiburg Tel.
Brustkrebs im Kanton Freiburg. Aktualisierung der im 2012 realisierten und publizierten Statistikanalysen. Dr. Bertrand Camey Krebsregister Freiburg Route St-Nicolas-de Flüe 2, PF 96 1705 Freiburg Tel.
Diagnostik und Therapie primärer und metastasierter Mammakarzinome
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Loko-regionäres Rezidiv Version 2002-2009: Brunnert / Simon/ Audretsch / Bauerfeind / Costa / Dall/ Gerber / Göhring / Lisboa / Rezai
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Loko-regionäres Rezidiv Version 2002-2009: Brunnert / Simon/ Audretsch / Bauerfeind / Costa / Dall/ Gerber / Göhring / Lisboa / Rezai
Operative Therapie des Mammakarzinoms unter onkologischen Aspekten
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Operative Therapie des Mammakarzinoms unter onkologischen Aspekten Operative Therapie des Mammakarzinoms unter onkologischen Aspekten
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Operative Therapie des Mammakarzinoms unter onkologischen Aspekten Operative Therapie des Mammakarzinoms unter onkologischen Aspekten
Aus der Klinik für Allgemein-, Viszeral- und Gefäßchirurgie der Martin-Luther-Universität Halle-Wittenberg Direktor: Prof. Dr. med. H.
 Aus der Klinik für Allgemein-, Viszeral- und Gefäßchirurgie der Martin-Luther-Universität Halle-Wittenberg Direktor: Prof. Dr. med. H. Dralle Gastric-banding als Operationsmethode bei morbider Adipositas
Aus der Klinik für Allgemein-, Viszeral- und Gefäßchirurgie der Martin-Luther-Universität Halle-Wittenberg Direktor: Prof. Dr. med. H. Dralle Gastric-banding als Operationsmethode bei morbider Adipositas
Brustkrebs. Patientenratgeber zu den AGO-Empfehlungen 2015 III
 II III Brustkrebs Patientenratgeber zu den AGO-Empfehlungen 2015 herausgegeben von Anton Scharl im Namen der Kommission Mamma der Arbeitsgemeinschaft Gynäkologische Onkologie e.v. (AGO) für Patientinnen,
II III Brustkrebs Patientenratgeber zu den AGO-Empfehlungen 2015 herausgegeben von Anton Scharl im Namen der Kommission Mamma der Arbeitsgemeinschaft Gynäkologische Onkologie e.v. (AGO) für Patientinnen,
NON-HODGKIN-LYMPHOME (C82-C85)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN NON-HODGKIN-LYMPHOME (C82-C85) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
3 Ergebnisse zur Prävalenz nach ICD-10
 ICD-C10 C00 C14 Ergebnisse zur 13 3 Ergebnisse zur nach ICD-10 3.1 Mundhöhle und Rachen Kernaussagen Inzidenz und Mortalität: Seit der tausendwende erkrankten jährlich etwa 2.800 und etwa 7.600 an bösartigen
ICD-C10 C00 C14 Ergebnisse zur 13 3 Ergebnisse zur nach ICD-10 3.1 Mundhöhle und Rachen Kernaussagen Inzidenz und Mortalität: Seit der tausendwende erkrankten jährlich etwa 2.800 und etwa 7.600 an bösartigen
4.13 Anzahl Primärfälle
 4.13 Anzahl Primärfälle 120 111 100 80 Primärfälle 60 40 20 15 0 Carcinoma in situ Invasives CA 25.09.2007 1 4.14a Anzahl der Eingriffe pro Jahr insgesamt Eingriffe insgesamt (gezählt werden alle OPS-Code):
4.13 Anzahl Primärfälle 120 111 100 80 Primärfälle 60 40 20 15 0 Carcinoma in situ Invasives CA 25.09.2007 1 4.14a Anzahl der Eingriffe pro Jahr insgesamt Eingriffe insgesamt (gezählt werden alle OPS-Code):
Mammakarzinom II. Diagnostik und Therapie
 Mammakarzinom II Diagnostik und Therapie MR - Mammographie Empfehlung einer MRT: lokales Staging (Exzisionsgrenzen) beim lobulären Mammakarzinom Multizentrizität? okkultes Mammakarzinom? MR - Mammographie
Mammakarzinom II Diagnostik und Therapie MR - Mammographie Empfehlung einer MRT: lokales Staging (Exzisionsgrenzen) beim lobulären Mammakarzinom Multizentrizität? okkultes Mammakarzinom? MR - Mammographie
Was ist die beste Nachsorge? 2. Berliner Tag des Eierstock- und Bauchfellkrebses am 11. September 2010
 Was ist die beste Nachsorge? 2. Berliner Tag des Eierstock- und Bauchfellkrebses am 11. September 2010 Jochem Potenberg Ev. Waldkrankenhaus Berlin Einführung 8500 Neuerkrankungen in Deutschland pro Jahr
Was ist die beste Nachsorge? 2. Berliner Tag des Eierstock- und Bauchfellkrebses am 11. September 2010 Jochem Potenberg Ev. Waldkrankenhaus Berlin Einführung 8500 Neuerkrankungen in Deutschland pro Jahr
Ergebnisbericht. Interdisziplinäres Brustzentrum der Frankfurter Diakonie-Kliniken am Markus-Krankenhaus Frankfurt
 Interdisziplinäres Brustzentrum der Frankfurter Diakonie-Kliniken am Markus-Krankenhaus Frankfurt Klinik-ID: 6003 Anonymcode: 7894 Auswertungszeitraum: 01.01.2015-31.12.2015 1 Ergebnisübersicht Fallzahlen
Interdisziplinäres Brustzentrum der Frankfurter Diakonie-Kliniken am Markus-Krankenhaus Frankfurt Klinik-ID: 6003 Anonymcode: 7894 Auswertungszeitraum: 01.01.2015-31.12.2015 1 Ergebnisübersicht Fallzahlen
Darum liegt in mehr als der Hälfte der Fälle bereits bei Diagnosestellung ein fortgeschritteneres Stadium der Erkrankung vor.
 OVARIALKARZINOM EPIDEMIOLOGIE Das Ovarialkarzinom (Eierstockkrebs) stellt die häufigste Todesursache durch ein Malignom bei der Frau dar. In Österreich erkranken jährlich rund 936 Frauen an einem Eierstockkrebs.
OVARIALKARZINOM EPIDEMIOLOGIE Das Ovarialkarzinom (Eierstockkrebs) stellt die häufigste Todesursache durch ein Malignom bei der Frau dar. In Österreich erkranken jährlich rund 936 Frauen an einem Eierstockkrebs.
Medizin im Vortrag. Herausgeber: Prof. Dr. med. Christoph Frank Dietrich. Periphere arterielle Verschlusskrankheit (pavk)
 Medizin im Vortrag Herausgeber: Prof. Dr. med. Christoph Frank Dietrich Periphere arterielle Verschlusskrankheit (pavk) Autoren: Priv.-Doz. Dr. med. Christoph Frank Dietrich Prof. Dr. med. Rupert Martin
Medizin im Vortrag Herausgeber: Prof. Dr. med. Christoph Frank Dietrich Periphere arterielle Verschlusskrankheit (pavk) Autoren: Priv.-Doz. Dr. med. Christoph Frank Dietrich Prof. Dr. med. Rupert Martin
Duktales Carcinoma in situ (DCIS)
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Duktales Carcinoma in situ (DCIS) Duktales Carcinoma in situ (DCIS) Version 2002: Gerber Versionen 2003 2012: Audretsch / Brunnert / Costa
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Duktales Carcinoma in situ (DCIS) Duktales Carcinoma in situ (DCIS) Version 2002: Gerber Versionen 2003 2012: Audretsch / Brunnert / Costa
BRUSTKREBS. Patientenratgeber zu den AGO-Empfehlungen 2016
 BRUSTKREBS Patientenratgeber zu den AGO-Empfehlungen 2016 herausgegeben von Anton Scharl, Volkmar Müller und Wolfgang Janni im Namen der Kommission Mamma der Arbeitsgemeinschaft Gynäkologische Onkologie
BRUSTKREBS Patientenratgeber zu den AGO-Empfehlungen 2016 herausgegeben von Anton Scharl, Volkmar Müller und Wolfgang Janni im Namen der Kommission Mamma der Arbeitsgemeinschaft Gynäkologische Onkologie
Ergebnisse der Versorgungsstudie LEOS
 Ergebnisse der Versorgungsstudie LEOS Lymphödeme im Großraum Hamburg Christine Blome, Kristina Heyer, Matthias Augustin CVderm, Institut für Versorgungsforschung in der Dermatologie und bei Pflegeberufen
Ergebnisse der Versorgungsstudie LEOS Lymphödeme im Großraum Hamburg Christine Blome, Kristina Heyer, Matthias Augustin CVderm, Institut für Versorgungsforschung in der Dermatologie und bei Pflegeberufen
Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie
 Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie Abschlussarbeit zur Erlangung des Titels: Bachelor of Science vorgelegt
Einfluss viszeraler osteopathischer Interventionen bei Kindern mit funktionellen Bauchschmerzen : Eine experimentelle Pilotstudie Abschlussarbeit zur Erlangung des Titels: Bachelor of Science vorgelegt
Uterine Sarkome. S2k Leitlinie AWMF-Nummer 015/074
 S2k Leitlinie AWMF-Nummer 015/074 Version 1 Gültig 08/15 07/18 Federführende Autoren: Dominik Denschlag Falk C. Thiel Matthias W. Beckmann Mitglieder der Arbeitsgruppe: Sven Ackermann Lars Christian Horn
S2k Leitlinie AWMF-Nummer 015/074 Version 1 Gültig 08/15 07/18 Federführende Autoren: Dominik Denschlag Falk C. Thiel Matthias W. Beckmann Mitglieder der Arbeitsgruppe: Sven Ackermann Lars Christian Horn
Universität zu Lübeck Institut für Krebsepidemiologie e.v.
 Universität zu Lübeck Institut für Krebsepidemiologie e.v. Gibt es Unterschiede in der medizinischen Versorgung von Patientinnen und Patienten mit Brustkrebs, Malignem Melanom der Haut oder Prostatakrebs
Universität zu Lübeck Institut für Krebsepidemiologie e.v. Gibt es Unterschiede in der medizinischen Versorgung von Patientinnen und Patienten mit Brustkrebs, Malignem Melanom der Haut oder Prostatakrebs
2 Jahren. Nachfolgende Chemo- und Strahlentherapie. Vor 10 Monaten Lokalrezidiv im Narbenbereich mit operativer
 378 Kapitel 7 Gynäkologie 7 7.5 Fallbeispiele 7.5.1 Patient 1 Mammakarzinom mit Lebermetastase Anamnese 45-jährige Patientin mit Zustand nach Mammakarzinom rechts mit brusterhaltender Therapie, Sentinellymphknotenentfernung
378 Kapitel 7 Gynäkologie 7 7.5 Fallbeispiele 7.5.1 Patient 1 Mammakarzinom mit Lebermetastase Anamnese 45-jährige Patientin mit Zustand nach Mammakarzinom rechts mit brusterhaltender Therapie, Sentinellymphknotenentfernung
Bestrahlung der parasternalen LK beim Mamma-Ca Aktuelle Daten der dänischen Studiengruppe
 seit 350 Jahren ganz weit oben Bestrahlung der parasternalen LK beim Mamma-Ca Aktuelle Daten der dänischen Studiengruppe Jürgen Dunst Professor für Strahlentherapie, Christian-Albrechts-Universität zu
seit 350 Jahren ganz weit oben Bestrahlung der parasternalen LK beim Mamma-Ca Aktuelle Daten der dänischen Studiengruppe Jürgen Dunst Professor für Strahlentherapie, Christian-Albrechts-Universität zu
Monate Präop Tabelle 20: Verteilung der NYHA-Klassen in Gruppe 1 (alle Patienten)
 Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Parameter zur Beschreibung der Leistungsfähigkeit Klassifikation der New-York-Heart-Association (NYHA) Gruppe 1 (alle Patienten): Die Eingruppierung der Patienten in NYHA-Klassen als Abbild der Schwere
Herr Dr. med. Mark Muster Musterarzt Musterstr Musterort. Feedbackbericht DMP Brustkrebs - 2. Halbjahr 2004
 Gemeinsame Einrichtung DMP Bayern, Elsenheimerstraße 39, 80687 München Herr Dr. med. Mark Muster Musterarzt Musterstr. 1 88888 Musterort Feedbackbericht DMP Brustkrebs - 2. Halbjahr 2004 Sehr geehrter
Gemeinsame Einrichtung DMP Bayern, Elsenheimerstraße 39, 80687 München Herr Dr. med. Mark Muster Musterarzt Musterstr. 1 88888 Musterort Feedbackbericht DMP Brustkrebs - 2. Halbjahr 2004 Sehr geehrter
Jahresauswertung 2012
 Modul 18/1 Mammachirurgie Jahresauswertung 2012 Baden-Württemberg Externe vergleichende Qualitätssicherung nach 137 SGB V Jahresauswertung 2012 Modul 18/1 Mammachirurgie Gesamtstatistik Baden-Württemberg
Modul 18/1 Mammachirurgie Jahresauswertung 2012 Baden-Württemberg Externe vergleichende Qualitätssicherung nach 137 SGB V Jahresauswertung 2012 Modul 18/1 Mammachirurgie Gesamtstatistik Baden-Württemberg
Mammakarzinom Analysekollektiv
 Ausgewertet wurden: Mammakarzinom Analysekollektiv 376.998 Erstdiagnosen (364.86 Patientinnen) Mammakarzinom aus den Jahren bis 14 von 35 Krebsregistern (KKR) aus 9 Bundesländern Neuerkrankungen in Deutschland
Ausgewertet wurden: Mammakarzinom Analysekollektiv 376.998 Erstdiagnosen (364.86 Patientinnen) Mammakarzinom aus den Jahren bis 14 von 35 Krebsregistern (KKR) aus 9 Bundesländern Neuerkrankungen in Deutschland
Die Massnahmen der komplexen physikalischen Entstauungstherapie (KPE) Zweiphasentherapie
 Entstauungstherapie in der Rehaklinik Bellikon Seit ca. 15 Jahren setzen wir in der Rehaklinik Bellikon die komplexe physikalische Entstauungstherapie (KPE) erfolgreich bei Patienten mit postoperativen
Entstauungstherapie in der Rehaklinik Bellikon Seit ca. 15 Jahren setzen wir in der Rehaklinik Bellikon die komplexe physikalische Entstauungstherapie (KPE) erfolgreich bei Patienten mit postoperativen
Pathophysiologie 3 Möglichkeiten werden diskutiert: 1. Entzündung Dolor Rubor Tumor Calor Schmerz Rötung Schwellung Wärme 2. Sympathische Störungen
 Pathophysiologie 3 Möglichkeiten werden diskutiert: 1. Entzündung Dolor Rubor Tumor Calor Schmerz Rötung Schwellung Wärme 2. Sympathische Störungen ausgeprägte autonome Störungen beim CRPS 3. Maladaptive
Pathophysiologie 3 Möglichkeiten werden diskutiert: 1. Entzündung Dolor Rubor Tumor Calor Schmerz Rötung Schwellung Wärme 2. Sympathische Störungen ausgeprägte autonome Störungen beim CRPS 3. Maladaptive
qs-nrw Jahresauswertung 2011 Mammachirurgie 18/1 Universitätsklinikum Aachen Aachen und Nordrhein-Westfalen Gesamt
 qs-nrw Geschäftsstelle Qualitätssicherung NRW Krankenhausgesellschaft Nordrhein-Westfalen Verbände der Kostenträger Nordrhein-Westfalen Ärztekammern in Nordrhein-Westfalen 18/1 Universitätsklinikum Aachen
qs-nrw Geschäftsstelle Qualitätssicherung NRW Krankenhausgesellschaft Nordrhein-Westfalen Verbände der Kostenträger Nordrhein-Westfalen Ärztekammern in Nordrhein-Westfalen 18/1 Universitätsklinikum Aachen
Medizin im Vortrag. Herausgeber: Prof. Dr. med. Christoph Frank Dietrich. Kolorektales Karzinom
 Medizin im Vortrag Herausgeber: Prof. Dr. med. Christoph Frank Dietrich Kolorektales Karzinom Autoren: Dr. med. Stefan Krüger Dr. med. Edgar Hartung Kerstin Siehr Prof. Dr. med. Christoph Frank Dietrich
Medizin im Vortrag Herausgeber: Prof. Dr. med. Christoph Frank Dietrich Kolorektales Karzinom Autoren: Dr. med. Stefan Krüger Dr. med. Edgar Hartung Kerstin Siehr Prof. Dr. med. Christoph Frank Dietrich
Intraoperative Strahlentherapie bei Brustkrebs. Patienteninformation zur intraoperativen Strahlentherapie des Tumorbettes (Boost)
 Intraoperative Strahlentherapie bei Brustkrebs Patienteninformation zur intraoperativen Strahlentherapie des Tumorbettes (Boost) 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt
Intraoperative Strahlentherapie bei Brustkrebs Patienteninformation zur intraoperativen Strahlentherapie des Tumorbettes (Boost) 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt
4. Ergebnisse. Neuerkrankungen nach Diagnosejahr
 4. Ergebnisse Im folgenden Abschnitt sind die Ergebnisse der retrospektiven Analyse der Jahre 1995 2 für das Auftreten und die histopathologische Diagnostik des Mammakarzinoms im Klinikum Bad Saarow aufgeführt.
4. Ergebnisse Im folgenden Abschnitt sind die Ergebnisse der retrospektiven Analyse der Jahre 1995 2 für das Auftreten und die histopathologische Diagnostik des Mammakarzinoms im Klinikum Bad Saarow aufgeführt.
DEUTSCHE GESELLSCHAFT FÜR KARDIOLOGIE HERZ- UND KREISLAUFFORSCHUNG e.v. German Cardiac Society
 Die Herz-Magnet-Resonanz-Tomographie kann Kosten um 50% senken gegenüber invasiven Tests im Rahmen der Abklärung und Behandlung von Patienten mit Verdacht auf eine koronare Herzkrankheit: Resultate von
Die Herz-Magnet-Resonanz-Tomographie kann Kosten um 50% senken gegenüber invasiven Tests im Rahmen der Abklärung und Behandlung von Patienten mit Verdacht auf eine koronare Herzkrankheit: Resultate von
Die Prostata Erkrankungen und Behandlungsmoglichkeiten
 Die Prostata Erkrankungen und Behandlungsmoglichkeiten von Prof. Dr. med. Hubert Frohmuller Direktor der Urologischen Klinik und Poliklinik der Universitat Wurzburg Dr. med. Matthias Theifl Oberarzt der
Die Prostata Erkrankungen und Behandlungsmoglichkeiten von Prof. Dr. med. Hubert Frohmuller Direktor der Urologischen Klinik und Poliklinik der Universitat Wurzburg Dr. med. Matthias Theifl Oberarzt der
Duktales Carcinoma in situ (DCIS)
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Duktales Carcinoma in situ (DCIS) Duktales Carcinoma In Situ (DCIS) Version 2002: Gerber Version 2003 2011: Audretsch / Brunnert / Costa
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Duktales Carcinoma in situ (DCIS) Duktales Carcinoma In Situ (DCIS) Version 2002: Gerber Version 2003 2011: Audretsch / Brunnert / Costa
3.20 Leukämien. Kernaussagen
 148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
148 Ergebnisse zur Leukämien 3.20 Leukämien Kernaussagen Inzidenz und Mortalität: Um die tausendwende traten in Deutschland jährlich ca. 4.800 Leukämien bei n und 4.300 bei auf, 7 % bis 10 % davon bei
Brustkrebserkrankung. Definition verschiedener Situationen
 Brustkrebserkrankung 3 Brustkrebserkrankung Definition verschiedener Situationen Frühe Brustkrebserkrankung Erstmals wird die Diagnose Brustkrebs gestellt. Im Allgemeinen ist die Erkrankung auf die Brust
Brustkrebserkrankung 3 Brustkrebserkrankung Definition verschiedener Situationen Frühe Brustkrebserkrankung Erstmals wird die Diagnose Brustkrebs gestellt. Im Allgemeinen ist die Erkrankung auf die Brust
BRUST (C50) SITUATION IN DEUTSCHLAND SITUATION IN RHEINLAND-PFALZ
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN BRUST (C5) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 121,5 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN BRUST (C5) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 121,5 Mortalität
Lymphödem. Dr. Hoffmann Praxis. Haut und Venen
 Aufbau und Funktion des Lymphgefäßsystems Einteilung der e Stadien des s Therapie des s : Empfehlungen und Tipps Aufbau und Funktion des Lymphgefäßsystems Das Lymphgefäßsystem ist ein Transportsystem,
Aufbau und Funktion des Lymphgefäßsystems Einteilung der e Stadien des s Therapie des s : Empfehlungen und Tipps Aufbau und Funktion des Lymphgefäßsystems Das Lymphgefäßsystem ist ein Transportsystem,
Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie
 Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
Neue Studie zu Iscador Verbesserte Lebensqualität für Brustkrebspatientinnen unter Chemotherapie Schwäbisch-Gmünd (2. Dezember 2009) - Eine prospektive randomisierte offene Pilotstudie ergab eine Verbesserung
1. Zusammenfassung Einleitung Historie der Bisphosphonate Das Bisphosphonat - ein Medikament 4
 Inhaltsverzeichnis 1. Zusammenfassung 1 2. Einleitung 3 2.1 Historie der Bisphosphonate 3 2.2 Das Bisphosphonat - ein Medikament 4 2.2.1 Struktur der Bisphosphonate 4 2.2.2 Einteilung der Bisphosphonate
Inhaltsverzeichnis 1. Zusammenfassung 1 2. Einleitung 3 2.1 Historie der Bisphosphonate 3 2.2 Das Bisphosphonat - ein Medikament 4 2.2.1 Struktur der Bisphosphonate 4 2.2.2 Einteilung der Bisphosphonate
3.21 Krebs gesamt. Hintergrund. Kernaussagen
 156 Ergebnisse zur Krebs gesamt 3.21 Krebs gesamt Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten in Deutschland ca. 230.500 und ca. 206.000 an einer Krebserkrankung (ohne nicht melanotische Hauttumoren).
156 Ergebnisse zur Krebs gesamt 3.21 Krebs gesamt Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten in Deutschland ca. 230.500 und ca. 206.000 an einer Krebserkrankung (ohne nicht melanotische Hauttumoren).
Die periphere arterielle Verschlusskrankheit im höheren Lebensalter
 Aus der Universitätsklinik und Poliklinik für Innere Medizin III an der Martin Luther - Universität Halle - Wittenberg (Direktor: Prof. Dr. med. K. Werdan) Die periphere arterielle Verschlusskrankheit
Aus der Universitätsklinik und Poliklinik für Innere Medizin III an der Martin Luther - Universität Halle - Wittenberg (Direktor: Prof. Dr. med. K. Werdan) Die periphere arterielle Verschlusskrankheit
Intraoperative Strahlentherapie bei Brustkrebs
 Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Intraoperative Strahlentherapie bei Brustkrebs Uniklinik Köln 1 Kein Grund für Verzweiflung Wenn die Diagnose Brustkrebs festgestellt wird, ist erst einmal die Sorge groß. Beruhigend zu wissen, dass es
Das Mamma Carcinom. Beate Stocker
 Das Mamma Carcinom Beate Stocker Brusterhaltung? Tumorgröße Tumorsitz Singulärer Knoten / Multizentrizität Wunsch der Patientin Sonderform: inflammatorisches Mamma Ca Morbus Paget Diagnostik Mammographie
Das Mamma Carcinom Beate Stocker Brusterhaltung? Tumorgröße Tumorsitz Singulärer Knoten / Multizentrizität Wunsch der Patientin Sonderform: inflammatorisches Mamma Ca Morbus Paget Diagnostik Mammographie
PROSTATA (C61) SITUATION IN DEUTSCHLAND SITUATION IN RHEINLAND-PFALZ
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PROSTATA (C61) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 86,6 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PROSTATA (C61) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 86,6 Mortalität
Vorläuferläsionen FEA, LN, ADH
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Version 2009 1.0D Vorläuferläsionen FEA, LN, ADH Vorläuferläsionen LN, ADH Version 2005: Audretsch / Thomssen Version 2006-2008: Brunnert
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Version 2009 1.0D Vorläuferläsionen FEA, LN, ADH Vorläuferläsionen LN, ADH Version 2005: Audretsch / Thomssen Version 2006-2008: Brunnert
Auslegungshinweise Kennzahlenbogen Darm (Stand ) - basierend auf dem Erhebungsbogen vom
 Allgemeine Anmerkungen In dem Dokument Auslegungshinweise Kennzahlenbogen Darm werden weitergehende ErlÄuterungen zu den einzelnen Kennzahlen gemacht. Dieses Dokument befindet sich im Moment in Diskussion
Allgemeine Anmerkungen In dem Dokument Auslegungshinweise Kennzahlenbogen Darm werden weitergehende ErlÄuterungen zu den einzelnen Kennzahlen gemacht. Dieses Dokument befindet sich im Moment in Diskussion
B0200 Bösartige Neubildungen (C00 C97)
 B0200 Ambulante Kodierrichtlinien Version 2010 B02 NEUBILDUNGEN B0200 Bösartige Neubildungen (C00 C97) Die Schlüsselnummer(n) für den Primärtumor, den Rezidivtumor und/oder die Metastase(n) sind immer
B0200 Ambulante Kodierrichtlinien Version 2010 B02 NEUBILDUNGEN B0200 Bösartige Neubildungen (C00 C97) Die Schlüsselnummer(n) für den Primärtumor, den Rezidivtumor und/oder die Metastase(n) sind immer
Eine Analyse des Münchner Schlaganfallregisters: Diagnostik und Therapie bei Patienten mit Diabetes mellitus"
 Aus der Forschergruppe Diabetes e.v. am Helmholtz Zentrum München Vorstand: Professor Dr. med. Oliver Schnell Eine Analyse des Münchner Schlaganfallregisters: Diagnostik und Therapie bei Patienten mit
Aus der Forschergruppe Diabetes e.v. am Helmholtz Zentrum München Vorstand: Professor Dr. med. Oliver Schnell Eine Analyse des Münchner Schlaganfallregisters: Diagnostik und Therapie bei Patienten mit
Individuelle Therapieentscheidungen im Brustzentrum - zwischen Erfahrung und Laboranalyse -
 Individuelle Therapieentscheidungen im Brustzentrum - zwischen Erfahrung und Laboranalyse - Franz Edler von Koch Klinikum Dritter Orden Klinik für Gynäkologie und Geburtshilfe Brustzentrum Gynäkologisches
Individuelle Therapieentscheidungen im Brustzentrum - zwischen Erfahrung und Laboranalyse - Franz Edler von Koch Klinikum Dritter Orden Klinik für Gynäkologie und Geburtshilfe Brustzentrum Gynäkologisches
Auszug (Seite 16 bis 20)
 Auszug (Seite 16 bis 20) aus der Richtlinie des Gemeinsamen Bundesauschusses zur Regelung von Anforderungen an die Ausgestaltung von Strukturierten Behandlungsprogrammen nach 137f Abs. 2 SGB V (DMP-Richtlinie/DMP-RL)
Auszug (Seite 16 bis 20) aus der Richtlinie des Gemeinsamen Bundesauschusses zur Regelung von Anforderungen an die Ausgestaltung von Strukturierten Behandlungsprogrammen nach 137f Abs. 2 SGB V (DMP-Richtlinie/DMP-RL)
Tabelle 1: Altersverteilung der Patienten (n = 42) in Jahren
 3. Ergebnisse Die 42 Patienten (w= 16, m= 26) hatten ein Durchschnittsalter von 53,5 Jahren mit einem Minimum von und einem Maximum von 79 Jahren. Die 3 Patientengruppen zeigten hinsichtlich Alters- und
3. Ergebnisse Die 42 Patienten (w= 16, m= 26) hatten ein Durchschnittsalter von 53,5 Jahren mit einem Minimum von und einem Maximum von 79 Jahren. Die 3 Patientengruppen zeigten hinsichtlich Alters- und
Qualitätssicherung Brustkrebs auf Grundlage des Datensatzes gemäß der DMP-Richtlinie, Teil B I. Ziffer 5
 Anlage 8 zur Vereinbarung über die Durchführung strukturierter Behandlungsprogramme nach 137f SGB V zur Verbesserung der Versorgungssituation von Brustkrebs-Patientinnen Qualitätssicherung Brustkrebs auf
Anlage 8 zur Vereinbarung über die Durchführung strukturierter Behandlungsprogramme nach 137f SGB V zur Verbesserung der Versorgungssituation von Brustkrebs-Patientinnen Qualitätssicherung Brustkrebs auf
Anlage 1 DMP Brustkrebs. Qualitätsanforderungen an den betreuenden DMP- Arzt und beauftragte Ärzte
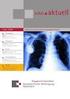 DMP Brustkrebs Qualitätsanforderungen an den betreuenden DMP- Arzt und beauftragte Ärzte Allgemeine Anforderungen Teilnahmeberechtigt für den koordinierenden Versorgungssektor sind die als Vertragsärzte
DMP Brustkrebs Qualitätsanforderungen an den betreuenden DMP- Arzt und beauftragte Ärzte Allgemeine Anforderungen Teilnahmeberechtigt für den koordinierenden Versorgungssektor sind die als Vertragsärzte
Lebensqualität von Patienten mit Oropharynxkarzinom
 Lebensqualität von Patienten mit Oropharynxkarzinom Mike Schimmer 1 Oropharynxkarzinom: Einleitung Gemeinsam mit Mundhöhle häufigste Lokalisation bei Kopf-Hals-Tumoren Weltweit an siebter bzw. sechzehnter
Lebensqualität von Patienten mit Oropharynxkarzinom Mike Schimmer 1 Oropharynxkarzinom: Einleitung Gemeinsam mit Mundhöhle häufigste Lokalisation bei Kopf-Hals-Tumoren Weltweit an siebter bzw. sechzehnter
Unverändert höheres Risikoprofil von Frauen in der Sekundärprävention der KHK Sechs-Jahres-Verlauf an Patienten
 Deutsche Gesellschaft für Kardiologie Herz- und Kreislaufforschung e.v. (DGK) Achenbachstr. 43, 40237 Düsseldorf Geschäftsstelle: Tel: 0211 6006920 Fax: 0211 60069267 mail : info@dgk.org Pressestelle:
Deutsche Gesellschaft für Kardiologie Herz- und Kreislaufforschung e.v. (DGK) Achenbachstr. 43, 40237 Düsseldorf Geschäftsstelle: Tel: 0211 6006920 Fax: 0211 60069267 mail : info@dgk.org Pressestelle:
Brustkrebs Daten und Fakten aus dem Tumorzentrum Land Brandenburg. A. Tillack, A. Naas, M. Budner Brandenburger Krebskongress
 Brustkrebs Daten und Fakten aus dem Tumorzentrum Land Brandenburg A. Tillack, A. Naas, M. Budner Gliederung (1) Informationen zur Arbeitsgruppe Brustkrebs (2) Datenbasis (3) Strukturqualität (4) Prozessqualität
Brustkrebs Daten und Fakten aus dem Tumorzentrum Land Brandenburg A. Tillack, A. Naas, M. Budner Gliederung (1) Informationen zur Arbeitsgruppe Brustkrebs (2) Datenbasis (3) Strukturqualität (4) Prozessqualität
3.1. Überlebenszeiten Zum Ende der Nachuntersuchung waren 19 Patienten (17,8%) am Leben und 88 (82,2%) verstorben (Tab. 3.1.).
 18 3. Ergebnisse 3.1. Überlebenszeiten Zum Ende der Nachuntersuchung waren 19 Patienten (17%) am Leben und 88 (82%) verstorben (Tab. 3.1.). Tabelle 3.1. Häufigkeit der lebenden und verstorbenen Patienten
18 3. Ergebnisse 3.1. Überlebenszeiten Zum Ende der Nachuntersuchung waren 19 Patienten (17%) am Leben und 88 (82%) verstorben (Tab. 3.1.). Tabelle 3.1. Häufigkeit der lebenden und verstorbenen Patienten
Duktales Carcinoma in situ (DCIS)
 Diagnostik und Therapie primärer und metastasierter Mammakarzinome Duktales Carcinoma in situ (DCIS) Duktales Carcinoma in situ (DCIS) Version 2002: Gerber Versionen 2003 2014: Audretsch / Brunnert / Costa
Diagnostik und Therapie primärer und metastasierter Mammakarzinome Duktales Carcinoma in situ (DCIS) Duktales Carcinoma in situ (DCIS) Version 2002: Gerber Versionen 2003 2014: Audretsch / Brunnert / Costa
2. Material und Methoden
 9 2. Material und Methoden 2.1. Auswahlkriterien und Untersuchungsvorgang Dieser Arbeit liegen die Daten von 107 Patienten zugrunde, die im Zeitraum vom 01.01.1993 bis 31.12.1998 an der Klinik für Orthopädie
9 2. Material und Methoden 2.1. Auswahlkriterien und Untersuchungsvorgang Dieser Arbeit liegen die Daten von 107 Patienten zugrunde, die im Zeitraum vom 01.01.1993 bis 31.12.1998 an der Klinik für Orthopädie
Erfolgreiche Rückmeldeinstrumente des OSP Stuttgart
 06.10.2010 Workshop Entwicklung von Rückmeldeinstrumenten Erfolgreiche Rückmeldeinstrumente des OSP Stuttgart C Junack, S Faißt, F. Brinkmann Onkologischer Schwerpunkt Stuttgart e.v. Rückmeldeinstrumente
06.10.2010 Workshop Entwicklung von Rückmeldeinstrumenten Erfolgreiche Rückmeldeinstrumente des OSP Stuttgart C Junack, S Faißt, F. Brinkmann Onkologischer Schwerpunkt Stuttgart e.v. Rückmeldeinstrumente
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN LEBER (C22) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN LEBER (C22) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
Voruntersuchungen. Klinik für Anästhesiologie und Intensivmedizin
 Voruntersuchungen ASA Klassifikation Grundlagen für apparative, technische Untersuchungen entscheidende Grundlagen zur Indikation jeder präoperativen technischen Untersuchung: - Erhebung einer sorgfältigen
Voruntersuchungen ASA Klassifikation Grundlagen für apparative, technische Untersuchungen entscheidende Grundlagen zur Indikation jeder präoperativen technischen Untersuchung: - Erhebung einer sorgfältigen
Klinische Psychologie: Körperliche Erkrankungen kompakt
 Klinische Psychologie: Körperliche Erkrankungen kompakt Mit Online-Materialien Bearbeitet von Claus Vögele 1. Auflage 2012. Taschenbuch. 170 S. Paperback ISBN 978 3 621 27754 9 Format (B x L): 19,4 x 25
Klinische Psychologie: Körperliche Erkrankungen kompakt Mit Online-Materialien Bearbeitet von Claus Vögele 1. Auflage 2012. Taschenbuch. 170 S. Paperback ISBN 978 3 621 27754 9 Format (B x L): 19,4 x 25
Kennzahlenbogen für Brustkrebszentren (EB Stand: 21.08.2012) Auslegungshinweise (Letzte Aktualisierung: 22.11.2012)
 Nr. EB Kennzahldefinition Kennzahlenziel 2 1.2.3 Prätherapeutische Fallbesprechung Adäquate Rate an prätherapeutischen Fallbesprechungen Anzahl Primärfälle, die in der prätherapeutischen Tumorkonferenz
Nr. EB Kennzahldefinition Kennzahlenziel 2 1.2.3 Prätherapeutische Fallbesprechung Adäquate Rate an prätherapeutischen Fallbesprechungen Anzahl Primärfälle, die in der prätherapeutischen Tumorkonferenz
Mammakarzinom. Universitätsklinikum tsklinikum Ulm. Abteilung Strahlentherapie
 Mammakarzinom Universitätsklinikum tsklinikum Ulm Abteilung Strahlentherapie Einleitung Mammakarzinom häufigster maligner Tumor der Frau Einleitung 47.500 Frauen erkranken pro Jahr in Deutschland an Brustkrebs.
Mammakarzinom Universitätsklinikum tsklinikum Ulm Abteilung Strahlentherapie Einleitung Mammakarzinom häufigster maligner Tumor der Frau Einleitung 47.500 Frauen erkranken pro Jahr in Deutschland an Brustkrebs.
Die Thrombin-Therapie beim Aneurysma spurium nach arterieller Punktion
 Aus der Universitätsklinik und Poliklinik für Innere Medizin III der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. K. Werdan) und dem Herzzentrum Coswig Klinik für Kardiologie und
Aus der Universitätsklinik und Poliklinik für Innere Medizin III der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. K. Werdan) und dem Herzzentrum Coswig Klinik für Kardiologie und
Anwenderinformation QS-Filter. Datensatz Mammachirurgie (18/1)
 Seite 1 von 5 Anwenderinformation QS-Filter Datensatz Mammachirurgie (18/1) Stand: 30. September 2015 (QS-Spezifikation 2016 V02) Copyright AQUA-Institut, Göttingen Textdefinition Alle offenen Biopsien,
Seite 1 von 5 Anwenderinformation QS-Filter Datensatz Mammachirurgie (18/1) Stand: 30. September 2015 (QS-Spezifikation 2016 V02) Copyright AQUA-Institut, Göttingen Textdefinition Alle offenen Biopsien,
Neoadjuvante (Primäre) systemische Therapie
 Diagnosis Diagnostik and und Treatment Therapie of primärer Patients with und Primary metastasierter and Metastatic Mammakarzinome Breast Cancer in der DGGG e.v. sowie Version 2009.1.0 2010.1.0D Neoadjuvante
Diagnosis Diagnostik and und Treatment Therapie of primärer Patients with und Primary metastasierter and Metastatic Mammakarzinome Breast Cancer in der DGGG e.v. sowie Version 2009.1.0 2010.1.0D Neoadjuvante
