Um bei p = const. und T = const. ein Mol der Substanz vom Ort x zum Ort x + dx zu transportieren, (3)
|
|
|
- Jobst Ackermann
- vor 7 Jahren
- Abrufe
Transkript
1 Stand: 9/7 II7 Diffusion von Gasen Ziel des Versuches Es ist die Druckabhängigkeit der Diffusionskonstanten D von NO in Luft eperimentell zu ermitteln Unter Benutzung der Zusammenhänge der kinetischen Gastheorie sind daraus die freie Weglänge, der Stoßquerschnitt σ = π (r +r ) und damit der Moleküldurchmesser zu ermitteln Theoretische Grundlagen Im thermodynamischen Gleichgewicht eines aus mehreren Komponenten bestehenden Systems sind die chemischen Potentiale aller Komponenten (in jeder Phase) gleich Gleichheit der chemischen Potentiale bedeutet wegen θ μ = μ + RT ln a () i i i dass im Gleichgewicht der Stoff i überall die gleiche Aktivität a i hat Wir betrachten jetzt Nichtgleichgewichtszustände, bei denen das chemische Potential vom Ort abhängt Zur Vereinfachung nehmen wir die Abhängigkeit von nur einer Raumkoordinate an: μ i = μi ( ) Um bei p = const und T = const ein Mol der Substanz vom Ort zum Ort + d zu transportieren, muss die molare Arbeit ( ) μ( ) dw = μ + d () geleistet werden Nach Entwicklung von μ( + d) in eine Taylorreihe dμ μ( + d) = μ( ) + d+ d (3) ergibt sich für die differentielle molare Arbeit dμ dw = d d (4) In der Mechanik ist die Arbeit, die gegen eine in -Richtung wirkende Kraft F zu leisten ist dw = F d (5) Ein Vergleich von (4) und (5) ergibt für die "thermodynamische Kraft", die den Unterschied des chemischen Potentials auszugleichen trachtet, folgenden Ausdruck: F dμ = d Mit Gleichung () ergibt sich (6)
2 II7 Stand: 9/7 F d ln a = RT d (7) Bei idealen Systemen kann die Aktivität durch die Konzentration ersetzt werden: dc F = RT c d (7a) Die thermodynamische Kraft treibt also die Teilchen ia in Richtung kleiner Konzentrationen (F ist positiv, wenn dc/d < ist) Da die Teilchen dabei mit anderen Teilchen zusammenstoßen und abgebremst werden, stellt sich im stationären Zustand eine konstante Wanderungsgeschwindigkeit u ein, die zur thermodynamischen Kraft F proportional ist Wird für die Proportionalitätskonstante (ohne Einschränkung der Allgemeinheit) D/RT gesetzt, ergibt sich für die Wanderungsgeschwindigkeit D u = F, bzw mit Gl (7a) (8) RT dc u = D c d pt (9) Die Konstante D ist der "Diffusionskoeffizient" Aus der Diffusionsgeschwindigkeit u kann die Stoffmenge dn berechnet werden, die in der Zeiteinheit dt eine Fläche A senkrecht zur Diffusionsrichtung durchquert: dn cua, dt = () woraus mit Gl(9) die übliche Form des Fick'schen Gesetzes erhalten wird: dn dc = D A dt d () Das Fick'sche Gesetz kann besonders einfach zur Bestimmung des Diffusionskoeffizienten D herangezogen werden, wenn ein zeitlich konstanter Konzentrationsgradient (dc/d) aufrechterhalten werden kann (stationäre Diffusion) Im vorliegenden Versuch hängt die Konzentration jedoch von der Zeit und vom Ort ab (nichtstationäre Diffusion) Die zeitliche Änderung der Molekülkonzentration in einer Schicht zwischen den Koordinaten und + d ergibt sich nach Gl() aus der Differenz der je Zeiteinheit hinein- und herausdiffundierenden Moleküle: ( ) ( ) n c c + d = D A t () Unter Verwendung einer Reihenentwicklung analog zu Gl(3) und der Beziehung dn = c A d ergibt sich daraus das Fick'sche Gesetz, die "Diffusionsgleichung" für die eindimensionale
3 Stand: 9/7 II73 nichtstationäre Diffusion: c c = D t (3) Die Diffusionsgleichung ist eine partielle Differentialgleichung Ordnung, deren Lösungen von den Anfangs- und Randbedingungen abhängen Für den einfachen Fall, dass sich ein Stoff zur Zeit t= in einer sehr dünnen Schicht an der Stelle = befindet und seine Konzentration sonst überall verschwindet, ergibt sich für die Zeit- und Ortsabhängigkeit der Konzentration, wie durch Einsetzen in Gl(3)verifiziert werden kann: d c( t, ) = ep /4 D t, π t D (4) d = Stoffmenge / Flächeneinheit (d ist die anfängliche Flächendichte in der Ebene =) a An einem festen Beobachtungsort steigt nach Gl(4) die Konzentration im Laufe der Zeit an und fällt nach Durchlaufen eines breiten Maimums wieder langsam ab Die Zeit, zu der am Beobachtungsort die maimale Konzentration gemessen wird, folgt der wichtigen Beziehung = D t (5) ma Umgekehrt kann man sagen, dass nach Ablauf einer Zeit t ma die "Diffusionsfront" (das ist das Maimum der Konzentration des diffundierenden Stoffes) um die Strecke = Dt fortgeschritten ist ("Wurzel-t-Gesetz") (6) ma Das Konzept der thermodynamischen Kraft ist hilfreich bei der Ableitung von Ausdrücken für den Diffusionskoeffizienten In Flüssigkeiten der Viskosität η wirkt auf ein Mol mit der Geschwindigkeit u bewegte Moleküle (oder wie bei der Brown'schen Bewegung, makroskopische Teilchen) vom Radius r eine Reibungskraft (Stokes): F R = 6 π η r u N, A die im stationären Zustand gleich der thermodynamischen Kraft F ist Mit Gl(8) ergibt sich aus F R = F sofort die wichtige Beziehung von Einstein und Smoluchowski für den Diffusionskoeffizienten in Flüssigkeiten: RT kb T D = = 6π η r N 6π η r A Für den Diffusionskoeffizienten D in Gasen gilt folgender einfacher Zusammenhang zwischen
4 II74 Stand: 9/7 der mittleren freien Weglänge λ zwischen zwei Stößen der Moleküle und ihrer mittleren Geschwindigkeit v : D = v λ (7) 3 Dieser Diffusionskoeffizient beschreibt die Selbstdiffusion von Gasmolekülen im gleichen Gas Bei der (hier vorliegenden) Diffusion einer Gasart in einer anderen ist zu berücksichtigen, dass jedes Gas eine andere mittlere Geschwindigkeit v i hat, die aus dem Gleichverteilungssatz berechnet werden kann: 3 M i v i = RT Der Diffusionskoeffizient wird dann (8) D ( ) = v + v λ, (9) 3 wobei die freie Weglänge λ aus den Konzentrationen c i und Molekülradien r i berechnet werden kann (siehe Stoßtheorie im Abschnitt Kinetik): λ = ( ) ( ) π NA c+ c r+ r () Nach der Zustandsgleichung idealer Gase gilt ges ( ) p = R T c + c (), so dass für den Diffusionskoeffizienten gilt: D = 3 (( RT ) ( / M+ / M ) ) π ( r + r ) p N 6 ges A () Der Diffusionskoeffizient von Gasen ist dem Druck umgekehrt proportional Aus D kann der Stoßquerschnitt σ = π (r + r ) bestimmt werden Damit ist eine Abschätzung der Molekülgröße aus einfachen Diffusionsmessungen möglich Messprinzip Im vorliegenden Versuch befindet sich zu Beginn NO in einem kurzen Rohrstück der Länge a (siehe Abbildung) Nach Öffnen des Hahnes H diffundiert das Gas in das eigentliche (mit Luft unter dem gleichen Druck gefüllte) Glasrohr Der Konzentrationsverlauf kann aus der Lösung Gl(4) berechnet werden, indem über die Länge des NO -Vorratsrohres integriert wird: a d ct (, ) = ep ( + s) /4 Dt ds π Dt (3)
5 Stand: 9/7 II75 Gl(3) wird zur Bestimmung der Diffusionskoeffizienten D aus eperimentellen Konzentrations-Zeit-Kurven (für einen festen Messort m ) verwendet An der Position m des Diffusionsrohres ist eine Lichtschranke angebracht, deren Licht (λ= 48 nm)von NO absorbiert wird Die Intensität des durchgehenden Lichtes wird gemessen und gespeichert, sie hängt von der NO - Konzentration wie folgt ab: I ε dc NO = I (Lambert- Beersches Gesetz) (wobei I die Anfangsintensität bei Abwesenheit von NO, ε der wellenlängenabhängige Etinktionskoeffizient und d die Dicke der durchstrahlten Schicht ist Aus dem abgespeicherten Intensitätsverlauf I(t) wird mittels Tabellenkalkulation die zur NO - Konzentration proportionale Absorbanz I At d c t It () () = lg = ε NO () berechnet Der Diffusionskoeffizient D wird durch nichtlineare Regression ermittelt (zb ORIGIN, Fitfunktion diffus3 oder MATHCAD, diffus ) a trennbare Verbindung H H Diffusionsrohr Vorratsrohr H5 Manometer H3 H4 Belüftungshahn NO zur Pumpe
6 II76 Stand: 9/7 Durchführung ) Füllen des Diffusionsrohres mit Luft Zu Beginn des Versuches wird das Diffusionsrohr vorsichtig aus der Apparatur ausgebaut und an die Dosiervorrichtung angeschlossen Zunächst wird das gesamte Rohr evakuiert (p < mbar) und nach Schließen von Hahn 3 zur Pumpe vorsichtig auf den gewünschten Arbeitsdruck (siehe Aufgaben) mit Luft gefüllt (Belüftungshahn H4) Hahn am Diffusionsrohr wird geschlossen, der Rest der Apparatur wird wieder evakuiert ) Füllen des Vorratsrohres mit NO /N O 4 Nach Schließen von Hahn 3 zur Pumpe wird vorsichtig NO /N O 4 auf eakt den gleichen Druck eingelassen, der im Diffusionsrohr eingestellt ist Hahn und das NO /N O 4 -Dosierventil werden geschlossen, der Rest der Apparatur wird einige Minuten lang evakuiert (wichtig, da NO Manometer und Schlauchmaterial angreift und in merklichen Mengen in den Plastikteilen absorbiert ist) 3) Einbau des Diffusionsrohres in die Meßapparatur Die Dosiereinrichtung wird belüftet (Hahn 4), das Diffusionsrohr wird abgenommen und mit größter Vorsicht in die Apparatur eingebaut Der Abstand m von H zur Lichtschranke ist beim Einbau zu messen Nach Einbau des Diffusionsrohres ( aber vor dem Öffnen des Hahnes!)ist die Intensität I zu notieren 4) Messung der Konzentrations-Zeit-Kurven Rechnereinstellung: Meßdatei: messee im Verzeichnis: C:\PRAKT\DIFFUS Allgemeine Multimetermessung Dateiname eingeben Meßpunktintervall: s Meßdauer: s Hahn am Diffusionsrohr wird rasch (aber vorsichtig) geöffnet (etwa Umdrehungen), gleichzeitig wird das Messprogramm am Rechner gestartet Es wird der Photostrom als Funktion der Zeit gemessen Der Versuch kann abgebrochen werden, wenn die Intensität nach Durchlaufen eines Minimums wieder ansteigt Auswertung Die Messdatei wird in ORIGIN importiert, ein Plot der Absorbanz als Funktion der Zeit wird erstellt Die Diffusionskonstante D wird durch eine nichtlineare Regression mit dem ORIGIN- Programm "diffus3" oder dem Mathcad-Programm "diffus" ermittelt Dazu müssen die Längen a und m (in cm) in das Regressionsprogramm eingeschrieben werden Das Programm berechnet die Diffusionskonstante D (Einheit cm /s) und den Vorfaktor d o in Gl(3) so, dass die Fehlerquadratsumme zwischen den Messwerten und der theoretischen Abhängigkeit (Gl(3)) minimal wird Dazu müssen allerdings Startwerte für D und den Vorfaktor d eingegeben werden, die in der Größenordnung der wahren Werte liegen Ein Schätzwert für D kann aus der Gleichung (5) gewonnen werden Für den eigentlich uninteressanten Vorfaktor d ist ein beliebiger Startwert zwischen und brauchbar
7 Stand: 9/7 II77 Aufgaben ) Messung der Konzentrations-Zeit-Kurven bei 5 verschiedenen Arbeitsdrücken im Bereich bis 6 mbar ) Bestimmung des Diffusionskoeffizienten D als Funktion des Druckes Daraus ist durch eine Ausgleichrechnung der Stoßquerschnitt σ für NO in Luft zu bestimmen Verwenden Sie dazu den linearen Zusammenhang zwischen D und /p entsprechend Gl() 3) Berechnen Sie aus dem Stoßquerschnitt die mittlere freie Weglänge für folgende Drücke: -6 mbar, mbar, mbar, mbar 4) Berechnung des mittleren Molekülradius 5) Berechnen Sie für die angegebenen Drücke die Zeiten, die für das Fortschreiten der Diffusionsfront um = m erforderlich sind (Gl 6) Welche Zeit benötigt ein Molekül für die gleiche Strecke, wenn keine Stöße stattfinden (T = 3 K)? Diskussion der Ergebnisse! r = σ π
Vakuum und Gastheorie
 Vakuum und Gastheorie Jan Krieger 9. März 2005 1 INHALTSVERZEICHNIS 0.1 Formelsammlung.................................... 2 0.1.1 mittlere freie Weglänge in idealen Gasen................... 3 0.1.2 Strömungsleitwerte
Vakuum und Gastheorie Jan Krieger 9. März 2005 1 INHALTSVERZEICHNIS 0.1 Formelsammlung.................................... 2 0.1.1 mittlere freie Weglänge in idealen Gasen................... 3 0.1.2 Strömungsleitwerte
8.6.3 Wärmeleitung von Gasen ****** 1 Motivation. 2 Experiment. Wärmeleitung von Gasen V080603
 8.6.3 ****** 1 Motivation Dieser Versuch zeigt qualitativ anhand der unterschiedlichem Abkühlung eines glühenden Drahtes, dass die umgekehrt proportional zur Wurzel aus der Molekularmasse und für nicht
8.6.3 ****** 1 Motivation Dieser Versuch zeigt qualitativ anhand der unterschiedlichem Abkühlung eines glühenden Drahtes, dass die umgekehrt proportional zur Wurzel aus der Molekularmasse und für nicht
Diffusion. Prüfungsfrage
 Prüfungsfrage Diffusion Die Diffusion. Erstes Fick sches Gesetz. Der Diffusionskoeffizient. Die Stokes-Einstein Beziehung. Diffusion durch die Zellmembrane: passive, aktive und erleichterte Diffusion Lehrbuch
Prüfungsfrage Diffusion Die Diffusion. Erstes Fick sches Gesetz. Der Diffusionskoeffizient. Die Stokes-Einstein Beziehung. Diffusion durch die Zellmembrane: passive, aktive und erleichterte Diffusion Lehrbuch
Physikalische Chemie Praktikum. Gase: Wärmeleitfähigkeit
 Hochschule Emden / Leer Physikalische Chemie Praktikum Gase: Wärmeleitfähigkeit Vers.Nr. 20 Mai 2017 Allgemeine Grundlagen Kinetische Gastheorie, Abhängigkeit der Wärmeleitfähigkeit von Druck (Gasdichte),
Hochschule Emden / Leer Physikalische Chemie Praktikum Gase: Wärmeleitfähigkeit Vers.Nr. 20 Mai 2017 Allgemeine Grundlagen Kinetische Gastheorie, Abhängigkeit der Wärmeleitfähigkeit von Druck (Gasdichte),
Skript zum Versuch A46. Innere Reibung von Gasen: Gasviskosität. Dez Herausgeber: Institut für Physikalische Chemie
 Physikalische-Chemisches Praktikum für Anfänger Skript zum Versuch A46 Innere Reibung von Gasen: Gasviskosität Dez. 2018 Herausgeber: Institut für Physikalische Chemie 1 Aufgabe Man messe die Viskosität
Physikalische-Chemisches Praktikum für Anfänger Skript zum Versuch A46 Innere Reibung von Gasen: Gasviskosität Dez. 2018 Herausgeber: Institut für Physikalische Chemie 1 Aufgabe Man messe die Viskosität
3. Diffusion und Brechungsindex
 3. Diffusion und Brechungsinde Die Diffusion in und aus einer Schicht ist die Grundlage vieler Sensoreffekte, wobei sich die einzelnen Sensoren dann nur noch in der Art der Übersetzung in ein meßbares
3. Diffusion und Brechungsinde Die Diffusion in und aus einer Schicht ist die Grundlage vieler Sensoreffekte, wobei sich die einzelnen Sensoren dann nur noch in der Art der Übersetzung in ein meßbares
Lösungen 10 (Kinetik)
 Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
201 Wärmeleitfähigkeit von Gasen
 01 Wärmeleitfähigkeit von Gasen 1. Aufgaben 1.1 Messen Sie die relative Wärmeleitfähigkeit x / 0 (bezogen auf Luft bei äußerem Luftdruck) für Luft und CO in Abhängigkeit vom Druck p. Stellen Sie x / 0
01 Wärmeleitfähigkeit von Gasen 1. Aufgaben 1.1 Messen Sie die relative Wärmeleitfähigkeit x / 0 (bezogen auf Luft bei äußerem Luftdruck) für Luft und CO in Abhängigkeit vom Druck p. Stellen Sie x / 0
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1. Lambert Beer sches Gesetz - Zerfall des Manganoxalations
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Moderne Theoretische Physik III (Theorie F Statistische Mechanik) SS 17
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik III (heorie F Statistische Mechanik) SS 17 Prof. Dr. Alexander Mirlin Blatt 2 PD Dr. Igor Gornyi,
Kinetische Gastheorie
 Prof. Dr. Norbert Hampp /4. Kinetische Gastheorie Kinetische Gastheorie In der kinetischen Gastheorie sind die Gasteilchen - massebehaftet - kugelförmig mit Durchmesser d (mit Ausdehnung) - haben keine
Prof. Dr. Norbert Hampp /4. Kinetische Gastheorie Kinetische Gastheorie In der kinetischen Gastheorie sind die Gasteilchen - massebehaftet - kugelförmig mit Durchmesser d (mit Ausdehnung) - haben keine
Verseifungsgeschwindigkeit eines Esters
 A 32 Verseifungsgeschwindigkeit eines Esters Aufgabe: Man bestimme die Geschwindigkeitskonstante k der Methylacetatverseifung bei 2 verschiedenen Temperaturen und berechne daraus den Vorfaktor sowie die
A 32 Verseifungsgeschwindigkeit eines Esters Aufgabe: Man bestimme die Geschwindigkeitskonstante k der Methylacetatverseifung bei 2 verschiedenen Temperaturen und berechne daraus den Vorfaktor sowie die
3.5.6 Geschwindigkeitsprofil (Hagen-Poiseuille) ******
 3.5.6 ****** 1 Motivation Bei der Strömung einer viskosen Flüssigkeit durch ein Rohr ergibt sich ein parabolisches Geschwindigkeitsprofil. 2 Experiment Abbildung 1: Versuchsaufbau zum Der Versuchsaufbau
3.5.6 ****** 1 Motivation Bei der Strömung einer viskosen Flüssigkeit durch ein Rohr ergibt sich ein parabolisches Geschwindigkeitsprofil. 2 Experiment Abbildung 1: Versuchsaufbau zum Der Versuchsaufbau
Technische Universität Dresden Fachrichtung Physik K.Prokert 09/2001 M. Lange 12/2008. Diffusion. Physikalisches Praktikum. Inhaltsverzeichnis
 Technische Universität Dresden Fachrichtung Physik K.Prokert 9/ M. Lange /8 Physikalisches Praktikum Versuch: DI Diffusion Inhaltsverzeichnis. Aufgabenstellung. Grundlagen 3. Versuchsdurchführung 4. Hinweise
Technische Universität Dresden Fachrichtung Physik K.Prokert 9/ M. Lange /8 Physikalisches Praktikum Versuch: DI Diffusion Inhaltsverzeichnis. Aufgabenstellung. Grundlagen 3. Versuchsdurchführung 4. Hinweise
Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10
 Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10 1. Berechnen Sie die Viskosität von Benzoldampf bei 0 C, 0 C und 900 C, verwenden sie dabei einen mittleren Stoßquerschnitt von σ 0,88 nm.
Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10 1. Berechnen Sie die Viskosität von Benzoldampf bei 0 C, 0 C und 900 C, verwenden sie dabei einen mittleren Stoßquerschnitt von σ 0,88 nm.
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Physikalisches Praktikum I
 Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Fachbereich Physik Physikalisches Praktikum I W21 Name: Verdampfungswärme von Wasser Matrikelnummer: Fachrichtung: Mitarbeiter/in: Assistent/in: Versuchsdatum: Gruppennummer: Endtestat: Folgende Fragen
Dynamische Viskosität von Gasen (Hagen-Poiseuille' sches Gesetz)
 Versuch Nr. 58 Dynamische Viskosität von Gasen (Hagen-Poiseuille' sches Gesetz) Stichworte: Kinetische Gastheorie, ideales Gas, charakteristische Größen zur Beschreibung von Gasen (s.u.), Hagen-Poiseuille'sches
Versuch Nr. 58 Dynamische Viskosität von Gasen (Hagen-Poiseuille' sches Gesetz) Stichworte: Kinetische Gastheorie, ideales Gas, charakteristische Größen zur Beschreibung von Gasen (s.u.), Hagen-Poiseuille'sches
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 09. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 09. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 09. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 09. 07. 2007 Klausur Die Klausur
An welche Stichwörter von der letzten Vorlesung können Sie sich noch erinnern?
 An welche Stichwörter von der letzten orlesung können Sie sich noch erinnern? Elektrische Feldlinien Das elektrische Feld einer Punktladung Das Feld eines elektrischen Dipols E = Elektrische Felder von
An welche Stichwörter von der letzten orlesung können Sie sich noch erinnern? Elektrische Feldlinien Das elektrische Feld einer Punktladung Das Feld eines elektrischen Dipols E = Elektrische Felder von
1 Innere Rotation von Alkanen
 1 Innere Rotation von Alkanen a Unter Verwendung der Energieniveaus des harmonischen Oszillators schreibt sich die Zustandssumme Q = g n e εn/kbt = = e hω/2k BT = a 0 x n e hωn+ 1 2 /k BT e hωn/kbt = e
1 Innere Rotation von Alkanen a Unter Verwendung der Energieniveaus des harmonischen Oszillators schreibt sich die Zustandssumme Q = g n e εn/kbt = = e hω/2k BT = a 0 x n e hωn+ 1 2 /k BT e hωn/kbt = e
Klassische Theoretische Physik I WS 2013/2014
 Karlsruher Institut für Technologie www.tkm.kit.edu/lehre/ Klassische Theoretische Physik I WS 213/214 Prof. Dr. J. Schmalian Blatt 6 Dr. P. P. Orth bgabe und Besprechung 6.12.213 1. Vektoranalysis I (2
Karlsruher Institut für Technologie www.tkm.kit.edu/lehre/ Klassische Theoretische Physik I WS 213/214 Prof. Dr. J. Schmalian Blatt 6 Dr. P. P. Orth bgabe und Besprechung 6.12.213 1. Vektoranalysis I (2
Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik
 Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodynamik:
Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodynamik:
= n + + Thermodynamik von Elektrolytlösungen. Wdhlg: Chemisches Potential einer Teilchenart: Für Elektrolytlösungen gilt: wobei : und
 Elektrolyte Teil III Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Thermodynamik von Elektrolytlösungen
Elektrolyte Teil III Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Thermodynamik von Elektrolytlösungen
(1) und ist bei unserem Versuch eine Funktion der Temperatur, nicht aber der Konzentration.
 Praktikum Teil A und B 15. AUFLÖSUNGSGESCHWINDIGKEIT Stand 11/4/1 AUFLÖSUNGSGESCHWINDIGKEIT EINES SALZES 1. ersuchsplatz Komponenten: - Thermostat - Reaktionsgefäß mit Rührer - Leitfähigkeitsmessgerät
Praktikum Teil A und B 15. AUFLÖSUNGSGESCHWINDIGKEIT Stand 11/4/1 AUFLÖSUNGSGESCHWINDIGKEIT EINES SALZES 1. ersuchsplatz Komponenten: - Thermostat - Reaktionsgefäß mit Rührer - Leitfähigkeitsmessgerät
Versuch: Reaktionskinetik
 Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen!
 1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
1. Klausur ist am 5.12.! Jetzt lernen! Klausuranmeldung: Bitte heute in Listen eintragen! Aggregatzustände Fest, flüssig, gasförmig Schmelz -wärme Kondensations -wärme Die Umwandlung von Aggregatzuständen
2. Musterklausur in K1
 Name: Punkte: Note: Ø: Physik Kursstufe Abzüge für Darstellung: Rundung:. Musterklausur in K Die Klausur stellt nur eine kleine Auswahl der möglichen Themen dar. Inhalt der Klausur kann aber der gesamte
Name: Punkte: Note: Ø: Physik Kursstufe Abzüge für Darstellung: Rundung:. Musterklausur in K Die Klausur stellt nur eine kleine Auswahl der möglichen Themen dar. Inhalt der Klausur kann aber der gesamte
TP2: Elektrodynamik WS Arbeitsblatt 10 21/ Dipole und Multipole in stationären Feldern
 TP2: Elektrodynamik WS 2017-2018 Arbeitsblatt 10 21/22.12. 2017 Dipole und Multipole in stationären Feldern Die Multipolentwicklung ist eine hilfreiche Näherung zur Lösung der Poisson Gleichung, wenn eine
TP2: Elektrodynamik WS 2017-2018 Arbeitsblatt 10 21/22.12. 2017 Dipole und Multipole in stationären Feldern Die Multipolentwicklung ist eine hilfreiche Näherung zur Lösung der Poisson Gleichung, wenn eine
Allgemeine Chemie Computer Praktikum Frühjahrssemester Regressions-Tutorial Lineare und nicht-lineare Regression
 1 Einführung Allgemeine Chemie Computer Praktikum Frühjahrssemester Regressions-Tutorial Lineare und nicht-lineare Regression Datenauswertung In einem naturwissenschaftlichen Experiment werden Sie meist
1 Einführung Allgemeine Chemie Computer Praktikum Frühjahrssemester Regressions-Tutorial Lineare und nicht-lineare Regression Datenauswertung In einem naturwissenschaftlichen Experiment werden Sie meist
Oberflächenspannung. Abstract. 1 Theoretische Grundlagen. Phasen und Grenzflächen
 Phasen und Grenzflächen Oberflächenspannung Abstract Die Oberflächenspannung verschiedener Flüssigkeit soll mit Hilfe der Kapillarmethode gemessen werden. Es sollen die mittlere Abstand der einzelnen Moleküle
Phasen und Grenzflächen Oberflächenspannung Abstract Die Oberflächenspannung verschiedener Flüssigkeit soll mit Hilfe der Kapillarmethode gemessen werden. Es sollen die mittlere Abstand der einzelnen Moleküle
I.1.3 b. (I.7a) I.1 Grundbegriffe der Newton schen Mechanik 9
 I. Grundbegriffe der Newton schen Mechanik 9 I..3 b Arbeit einer Kraft Wird die Wirkung einer Kraft über ein Zeitintervall oder genauer über die Strecke, welche das mechanische System in diesem Zeitintervall
I. Grundbegriffe der Newton schen Mechanik 9 I..3 b Arbeit einer Kraft Wird die Wirkung einer Kraft über ein Zeitintervall oder genauer über die Strecke, welche das mechanische System in diesem Zeitintervall
Abbildung 1: Diffusionsverbreiterung im zeitlichen Verlauf eines Sedimentationsgeschwindigkeitsexperiments
 Diffusion Einführung Zusätzlich zu den Sedimentations-, Auftriebs- und Reibungskräften unterliegt ein Partikel im Zentrifugalfeld der ungerichteten und der gerichteten (wechselseitigen) Diffusion. Dabei
Diffusion Einführung Zusätzlich zu den Sedimentations-, Auftriebs- und Reibungskräften unterliegt ein Partikel im Zentrifugalfeld der ungerichteten und der gerichteten (wechselseitigen) Diffusion. Dabei
2. Fluide Phasen. 2.1 Die thermischen Zustandsgrößen Masse m [m] = kg
![2. Fluide Phasen. 2.1 Die thermischen Zustandsgrößen Masse m [m] = kg 2. Fluide Phasen. 2.1 Die thermischen Zustandsgrößen Masse m [m] = kg](/thumbs/75/72774995.jpg) 2. Fluide Phasen 2.1 Die thermischen Zustandsgrößen 2.1.1 Masse m [m] = kg bestimmbar aus: Newtonscher Bewegungsgleichung (träge Masse): Kraft = träge Masse x Beschleunigung oder (schwere Masse) Gewichtskraft
2. Fluide Phasen 2.1 Die thermischen Zustandsgrößen 2.1.1 Masse m [m] = kg bestimmbar aus: Newtonscher Bewegungsgleichung (träge Masse): Kraft = träge Masse x Beschleunigung oder (schwere Masse) Gewichtskraft
Grundlagen: Die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure verläuft nach folgendem Mechanismus:
 A 35: Zersetzung von Ameisensäure Aufgabe: Für die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure sind die Geschwindigkeitskonstante bei 30 und 40 C sowie der präexponentielle Faktor und die
A 35: Zersetzung von Ameisensäure Aufgabe: Für die Zersetzung von Ameisensäure in konzentrierter Schwefelsäure sind die Geschwindigkeitskonstante bei 30 und 40 C sowie der präexponentielle Faktor und die
V Diffusion von H 2
 V080604 Diffusion von H 8.6.4 Diffusion von H ****** Motivation Dieser Versuch zeigt, dass Wasserstoff schneller als Luft diffundiert. Deshalb entsteht beim Einbzw. Ausströmen von Wasserstoff in einen
V080604 Diffusion von H 8.6.4 Diffusion von H ****** Motivation Dieser Versuch zeigt, dass Wasserstoff schneller als Luft diffundiert. Deshalb entsteht beim Einbzw. Ausströmen von Wasserstoff in einen
Elastizität und Torsion
 INSTITUT FÜR ANGEWANDTE PHYSIK Physikalisches Praktikum für Studierende der Ingenieurswissenschaften Universität Hamburg, Jungiusstraße 11 Elastizität und Torsion 1 Einleitung Ein Flachstab, der an den
INSTITUT FÜR ANGEWANDTE PHYSIK Physikalisches Praktikum für Studierende der Ingenieurswissenschaften Universität Hamburg, Jungiusstraße 11 Elastizität und Torsion 1 Einleitung Ein Flachstab, der an den
1 I. Thermodynamik. 1.1 Ideales Gasgesetz. 1.2 Vereinfachte kinetische Gastheorie. 1.3 Erster Hauptsatz der Thermodynamik.
 1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
Kinetische Gastheorie - Die Gauss sche Normalverteilung
 Kinetische Gastheorie - Die Gauss sche Normalverteilung Die Gauss sche Normalverteilung Die Geschwindigkeitskomponenten eines Moleküls im idealen Gas sind normalverteilt mit dem Mittelwert Null. Es ist
Kinetische Gastheorie - Die Gauss sche Normalverteilung Die Gauss sche Normalverteilung Die Geschwindigkeitskomponenten eines Moleküls im idealen Gas sind normalverteilt mit dem Mittelwert Null. Es ist
(a) Λ ist eine Erhaltungsgröße. (b) Λ ist gleich der Exzentrizität ε der Bahnkurve.
 PD Dr. S. Mertens S. Falkner, S. Mingramm Theoretische Physik I Mechanik Blatt 7 WS 007/008 0.. 007. Lenz scher Vektor. Für die Bahn eines Teilchens der Masse m im Potential U(r) = α/r definieren wir mit
PD Dr. S. Mertens S. Falkner, S. Mingramm Theoretische Physik I Mechanik Blatt 7 WS 007/008 0.. 007. Lenz scher Vektor. Für die Bahn eines Teilchens der Masse m im Potential U(r) = α/r definieren wir mit
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 31. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 31. 05.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 31. 05. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 31. 05.
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
Moderne Theoretische Physik IIIa WS 18/19
 Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Moderne Theoretische Physik IIIa WS 8/9 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 7 Dr. Stefan Rex Besprechung: 9..9.
Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Moderne Theoretische Physik IIIa WS 8/9 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 7 Dr. Stefan Rex Besprechung: 9..9.
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Vakuum (VAK)
 Inhaltsverzeichnis TUM Anfängerpraktikum für Physiker Vakuum (VAK) 25.2.26. Einleitung...2 2. Ideale Gase...2 3. Verwendetes Material...2 4. Versuchsdurchführung...2 4.. Eichung der Pirani-Manometer...2
Inhaltsverzeichnis TUM Anfängerpraktikum für Physiker Vakuum (VAK) 25.2.26. Einleitung...2 2. Ideale Gase...2 3. Verwendetes Material...2 4. Versuchsdurchführung...2 4.. Eichung der Pirani-Manometer...2
1 Michaelis-Menten-Kinetik
 Physikalische Chemie II Lösung 2 9. Dezember 206 Michaelis-Menten-Kinetik. Das Geschwindigkeitsgesetz für die zeitliche Änderung der ES-Konzentration ist durch folgendes Geschwindigkeitsgesetz beschrieben:
Physikalische Chemie II Lösung 2 9. Dezember 206 Michaelis-Menten-Kinetik. Das Geschwindigkeitsgesetz für die zeitliche Änderung der ES-Konzentration ist durch folgendes Geschwindigkeitsgesetz beschrieben:
f) Ideales Gas - mikroskopisch
 f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion:
 Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
A 1. + r 2 ) 2. Stoßquerschnitt und mittlere freie Weglänge
 Stoßquerschnitt und mittlere freie Weglänge Im idealen Gas findet zwischen zwei Teilchen ein Stoß statt, wenn der Abstand der Fluggeraden den beiden Teilchen, der Stoßparameter b, kleiner ist als die Summe
Stoßquerschnitt und mittlere freie Weglänge Im idealen Gas findet zwischen zwei Teilchen ein Stoß statt, wenn der Abstand der Fluggeraden den beiden Teilchen, der Stoßparameter b, kleiner ist als die Summe
7.5 Transportprozesse in Gasen
 7.5 Transportprozesse in Gasen Transport von: Gasvolumina Verteilung einer Molekülsorte in einer anderen Energie Impuls Gasströmung Diffusion Wärmeleitung Viskosität Auftreten bei räumlichem Unterschied
7.5 Transportprozesse in Gasen Transport von: Gasvolumina Verteilung einer Molekülsorte in einer anderen Energie Impuls Gasströmung Diffusion Wärmeleitung Viskosität Auftreten bei räumlichem Unterschied
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
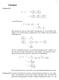 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Modul Chemische Kinetik und Reaktionsdynamik: Modellversuch zur Diffusion
 Modul Chemische Kinetik und Reaktionsdynamik: Modellversuch zur Diffusion Erste Version H.D. Försterling Fortgeführt von H. Meyer 6 Überarbeitet und ergänzt von D. Rhinow 7 Ergänzt von M. Schäfer 1 Korrigiert
Modul Chemische Kinetik und Reaktionsdynamik: Modellversuch zur Diffusion Erste Version H.D. Försterling Fortgeführt von H. Meyer 6 Überarbeitet und ergänzt von D. Rhinow 7 Ergänzt von M. Schäfer 1 Korrigiert
D-HEST, Mathematik III HS 2017 Prof. Dr. E. W. Farkas M. Nitzschner. Serie 12. Erinnerung: Der Laplace-Operator in n 1 Dimensionen ist definiert durch
 D-HEST, Mathematik III HS 2017 Prof. Dr. E. W. Farkas M. Nitzschner Serie 12 1. Laplace-Operator in ebenen Polarkoordinaten Erinnerung: Der Laplace-Operator in n 1 Dimensionen ist definiert durch ( ) 2
D-HEST, Mathematik III HS 2017 Prof. Dr. E. W. Farkas M. Nitzschner Serie 12 1. Laplace-Operator in ebenen Polarkoordinaten Erinnerung: Der Laplace-Operator in n 1 Dimensionen ist definiert durch ( ) 2
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
für jede Gasart x (analog für Flüssigkeiten, sogar Festkörper)...Dichte, z-richtung.. auf A
 6.5 Diffusion, Osmose und Dampfdruck: Z7/vo/mewae/Kap6_5DiffosmDampfdr_s3_040118 Diffusion: Eindringen eines Stoffes in einen anderen auf Grund der Wärmebewegung. Experiment: ruhende, verschieden gefärbte
6.5 Diffusion, Osmose und Dampfdruck: Z7/vo/mewae/Kap6_5DiffosmDampfdr_s3_040118 Diffusion: Eindringen eines Stoffes in einen anderen auf Grund der Wärmebewegung. Experiment: ruhende, verschieden gefärbte
Federkraft: F 1 = -bx (b = 50 N/m) Gravitationskraft: F 2 = mg (g = 9,8 m/s 2 )
 Aufgabe: Schwingung An eine Stahlfeder wird eine Kugel mit der Masse 500g gehängt. Federkraft: F 1 -b (b 50 N/m) Gravitationskraft: F mg (g 9,8 m/s ) m 500g F ma W 1 F( ) d W kin 1 mv b ( t + ϕ ) Acos(
Aufgabe: Schwingung An eine Stahlfeder wird eine Kugel mit der Masse 500g gehängt. Federkraft: F 1 -b (b 50 N/m) Gravitationskraft: F mg (g 9,8 m/s ) m 500g F ma W 1 F( ) d W kin 1 mv b ( t + ϕ ) Acos(
Klausur-Musterlösungen
 Klausur-Musterlösungen 9.7.4 Theoretische Physik IV: Statistische Physik Prof. Dr. G. Alber Dr. O. Zobay. Der in Abb. dargestellte Kreisprozess wird mit einem elektromagnetischen Feld ausgeführt. Abb..
Klausur-Musterlösungen 9.7.4 Theoretische Physik IV: Statistische Physik Prof. Dr. G. Alber Dr. O. Zobay. Der in Abb. dargestellte Kreisprozess wird mit einem elektromagnetischen Feld ausgeführt. Abb..
Physikalische Chemie II (für Biol./Pharm. Wiss.) FS Lösung 7. Musterlösung zum Übungsblatt 7 vom
 Physikalische Chemie II (für Biol./Pharm. Wiss.) S 207 Lösung 7 Musterlösung zum Übungsblatt 7 vom 0.04.207 Diffusionspotential. Zu dieser Teilaufgabe vgl. Adam, Läuger, Stark, S. 326/327 und Skript I.3.3.
Physikalische Chemie II (für Biol./Pharm. Wiss.) S 207 Lösung 7 Musterlösung zum Übungsblatt 7 vom 0.04.207 Diffusionspotential. Zu dieser Teilaufgabe vgl. Adam, Läuger, Stark, S. 326/327 und Skript I.3.3.
d. h. die Summe der positiven und negativen Ladungsträger, welche in einer Zeit t durch eine senkrecht stehende Fläche A treten: I = I +
 Elektrolyte Teil II Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Wie hängt der Strom von der Geschwindigkeit
Elektrolyte Teil II Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Wie hängt der Strom von der Geschwindigkeit
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 11. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 11. 06.
Innere Reibung von Gasen
 Blatt: 1 Aufgabe Bestimmen Sie die Viskosität η von Gasen aus der Messung der Strömung durch Kapillaren. Berechnen Sie aus den Messergebnissen für jedes Gas die Sutherland-Konstante C, die effektiven Moleküldurchmesser
Blatt: 1 Aufgabe Bestimmen Sie die Viskosität η von Gasen aus der Messung der Strömung durch Kapillaren. Berechnen Sie aus den Messergebnissen für jedes Gas die Sutherland-Konstante C, die effektiven Moleküldurchmesser
Wechselwirkung Umwelt, Packmittel und Füllgut: Stofftransporte
 Wechselwirkung Umwelt, Packmittel und Füllgut: Stofftransporte Diffusion, Strömung (Strahlung) Desorption Permeation: Adsorption, Lösung Diffusion Füllgut Migration Packstoff, Packmittel Stofftransport
Wechselwirkung Umwelt, Packmittel und Füllgut: Stofftransporte Diffusion, Strömung (Strahlung) Desorption Permeation: Adsorption, Lösung Diffusion Füllgut Migration Packstoff, Packmittel Stofftransport
V 1. pdv mit p = = p 0 V 0 ln p 1. m = C H2 O T ln p 1. = P a 150m J 8K ln P a
 2 Lösungen Lösung zu 46. Nutze den 1. Hauptsatz du = Q + W = Q pdv. Bei einem isothermen Prozess ändert sich die innere Energie nicht: du = 0, was wir schon in mehreren Aufgaben zuvor benutzt haben. Also
2 Lösungen Lösung zu 46. Nutze den 1. Hauptsatz du = Q + W = Q pdv. Bei einem isothermen Prozess ändert sich die innere Energie nicht: du = 0, was wir schon in mehreren Aufgaben zuvor benutzt haben. Also
Versuch 6. Zähigkeit (Viskosität) Abbildung 1. v τ=η (1) y
 Versuch 6 Zähigkeit (Viskosität) Gesetz von Stokes Wenn zwei feste Körper aufeinander gleiten, so wird ihre Bewegung dadurch gehet, dass zwischen den Körpern ein Reibungswiderstand herrscht. in ähnliches
Versuch 6 Zähigkeit (Viskosität) Gesetz von Stokes Wenn zwei feste Körper aufeinander gleiten, so wird ihre Bewegung dadurch gehet, dass zwischen den Körpern ein Reibungswiderstand herrscht. in ähnliches
Die Brownsche Molekularbewegung
 Die Brownsche Molekularbewegung Ziel des Versuches ist es, aus der Untersuchung der Brownschen Molekularbewegung die vogadro Konstante N zu bestimmen. Vorbereitung: Brownsche Molekularbewegung Diffusion,
Die Brownsche Molekularbewegung Ziel des Versuches ist es, aus der Untersuchung der Brownschen Molekularbewegung die vogadro Konstante N zu bestimmen. Vorbereitung: Brownsche Molekularbewegung Diffusion,
Probestudium der Physik 2011/12
 Probestudium der Physik 2011/12 1 Schwingungen und Wellen: Einführung in die mathematischen Grundlagen 1.1 Die Sinus- und die Kosinusfunktion Die Sinusfunktion lässt sich genauso wie die Kosinusfunktion
Probestudium der Physik 2011/12 1 Schwingungen und Wellen: Einführung in die mathematischen Grundlagen 1.1 Die Sinus- und die Kosinusfunktion Die Sinusfunktion lässt sich genauso wie die Kosinusfunktion
Interferenzrefraktor von Jamin
 Technische Universität Darmstadt Fachbereich Physik Institut für Angewandte Physik Versuch 4.1: Interferenzrefraktor von Jamin Praktikum für Fortgeschrittene Von Daniel Rieländer (1206706) & Mischa Hildebrand
Technische Universität Darmstadt Fachbereich Physik Institut für Angewandte Physik Versuch 4.1: Interferenzrefraktor von Jamin Praktikum für Fortgeschrittene Von Daniel Rieländer (1206706) & Mischa Hildebrand
TU Dresden Fachrichtung Mathematik Institut für Numerische Mathematik 1. Dr. M. Herrich SS 2017
 TU Dresden Fachrichtung Mathematik Institut für Numerische Mathematik 1 Prof. Dr. K. Eppler Institut für Numerische Mathematik Dr. M. Herrich SS 2017 Aufgabe 1 Übungen zur Vorlesung Mathematik II 4. Übung,
TU Dresden Fachrichtung Mathematik Institut für Numerische Mathematik 1 Prof. Dr. K. Eppler Institut für Numerische Mathematik Dr. M. Herrich SS 2017 Aufgabe 1 Übungen zur Vorlesung Mathematik II 4. Übung,
1. Thermodynamische Potentiale, Maxwellgleichungen
 69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
69 KAPIEL G hermodynamische Potentiale 1. hermodynamische Potentiale, Maxwellgleichungen hermodynamische Potentiale sind Funktionen von den Zustandsvariablen. Wir haben schon die innere Energie kennengelernt,
Hilfsmittel sind nicht zugelassen, auch keine Taschenrechner! Heftung nicht lösen! Kein zusätzliches Papier zugelassen!
 Physik 1 / Klausur Anfang SS 0 Heift / Kurtz Name: Vorname: Matrikel-Nr.: Unterschrift: Formeln siehe letzte Rückseite! Hilfsmittel sind nicht zugelassen, auch keine Taschenrechner! Heftung nicht lösen!
Physik 1 / Klausur Anfang SS 0 Heift / Kurtz Name: Vorname: Matrikel-Nr.: Unterschrift: Formeln siehe letzte Rückseite! Hilfsmittel sind nicht zugelassen, auch keine Taschenrechner! Heftung nicht lösen!
2.4 Kinetische Gastheorie - Druck und Temperatur im Teilchenmodell
 2.4 Kinetische Gastheorie - Druck und Temperatur im Teilchenmodell Mit den drei Zustandsgrößen Druck, Temperatur und Volumen konnte der Zustand von Gasen makroskopisch beschrieben werden. So kann zum Beispiel
2.4 Kinetische Gastheorie - Druck und Temperatur im Teilchenmodell Mit den drei Zustandsgrößen Druck, Temperatur und Volumen konnte der Zustand von Gasen makroskopisch beschrieben werden. So kann zum Beispiel
Protokoll Dampfdruck. Punkte: /10
 Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
Protokoll Dampfdruck Gruppe Biologie Assistent: Olivier Evelyn Jähne, Eva Eickmeier, Claudia Keller Kontakt: claudiakeller@teleport.ch Sommersemester 2006 6. Juni 2006 Punkte: /0 . Einleitung Wenn eine
Vorbemerkung. [disclaimer]
![Vorbemerkung. [disclaimer] Vorbemerkung. [disclaimer]](/thumbs/97/130802699.jpg) orbemerkung Dies ist ein abgegebener Übungszettel aus dem Modul physik2. Dieser Übungszettel wurde nicht korrigiert. Es handelt sich lediglich um meine Abgabe und keine Musterlösung. Alle Übungszettel
orbemerkung Dies ist ein abgegebener Übungszettel aus dem Modul physik2. Dieser Übungszettel wurde nicht korrigiert. Es handelt sich lediglich um meine Abgabe und keine Musterlösung. Alle Übungszettel
2 Grundbegriffe der Thermodynamik
 2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
1. Ziel des Versuchs. 2. Theorie. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
Allgemeines Gasgesetz. PV = K o T
 Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Seminar: Photometrie
 Seminar: Photometrie G. Reibnegger und W. Windischhofer (Teil II zum Thema Hauptgruppenelemente) Ziel des Seminars: Theoretische Basis der Photometrie Lambert-Beer sches Gesetz Rechenbeispiele Literatur:
Seminar: Photometrie G. Reibnegger und W. Windischhofer (Teil II zum Thema Hauptgruppenelemente) Ziel des Seminars: Theoretische Basis der Photometrie Lambert-Beer sches Gesetz Rechenbeispiele Literatur:
Physikalische Chemie Praktikum. Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung
 Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
Messung der Leitfähigkeit wässriger Elektrolytlösungen
 Versuch Nr. 10: Messung der Leitfähigkeit wässriger Elektrolytlösungen 1. Ziel des Versuchs In diesem Versuch sollen die Leitfähigkeiten von verschiedenen Elektrolyten in verschiedenen Konzentrationen
Versuch Nr. 10: Messung der Leitfähigkeit wässriger Elektrolytlösungen 1. Ziel des Versuchs In diesem Versuch sollen die Leitfähigkeiten von verschiedenen Elektrolyten in verschiedenen Konzentrationen
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
Themenschwerpunkt A. Mechanik
 Herbst 2011 Einzelprüfungsnummer: 64013 Seite: 1 Themenschwerpunkt A Mechanik Aufgabe 1: Reibung Ein Teilchen der Masse m bewege sich mit der Anfangsgeschwindigkeit v 0 > 0 in x-richtung und soll durch
Herbst 2011 Einzelprüfungsnummer: 64013 Seite: 1 Themenschwerpunkt A Mechanik Aufgabe 1: Reibung Ein Teilchen der Masse m bewege sich mit der Anfangsgeschwindigkeit v 0 > 0 in x-richtung und soll durch
a) Stellen Sie das Diagramm Geschwindigkeits Zeit Diagramm für eine geeignete Kombination von Massen und dar.
 Atwood sche Fallmaschine Die kann zum Bestimmen der Erdbeschleunigung und zum Darstellen der Zusammenhänge zwischen Weg, Geschwindigkeit und Beschleunigung verwendet werden. 1) Aufgaben a) Stellen Sie
Atwood sche Fallmaschine Die kann zum Bestimmen der Erdbeschleunigung und zum Darstellen der Zusammenhänge zwischen Weg, Geschwindigkeit und Beschleunigung verwendet werden. 1) Aufgaben a) Stellen Sie
df (r) A(r) = dm(r)ω2 r Dabei wurde nur m(r) = ρ(r) V eingesetzt. Für das ideale Gas gilt pv = nrt mit m(r) = n M. Also weiter mit nrt = m(r) V
 3 Lösungen Lösung zu 53. ie Lösung ist ganz einfach: E kin = 1 mv und p = mv folgt m = 1.391 10 5 kg. araus folgt dann eine olmasse von m mol = 1.391 10 g 6.0 10 3 mol 1 = 83.77 g. Also handelt es sich
3 Lösungen Lösung zu 53. ie Lösung ist ganz einfach: E kin = 1 mv und p = mv folgt m = 1.391 10 5 kg. araus folgt dann eine olmasse von m mol = 1.391 10 g 6.0 10 3 mol 1 = 83.77 g. Also handelt es sich
Protokoll Physikalisch-Chemisches Praktikum für Fortgeschrittene
 K. B. Datum des Praktikumstags: 6.11.7 Matthias Ernst Protokoll-Datum: 11.11.7 Gruppe 11 Assistent: A. Busch estat: 4. Versuch (F 44) - Auflösungsgeschwindigkeit von Gips (CaSO 4 ) Aufgabenstellung - Messung
K. B. Datum des Praktikumstags: 6.11.7 Matthias Ernst Protokoll-Datum: 11.11.7 Gruppe 11 Assistent: A. Busch estat: 4. Versuch (F 44) - Auflösungsgeschwindigkeit von Gips (CaSO 4 ) Aufgabenstellung - Messung
IV. Strömungen eines idealen Fluids
 IV. Strömungen eines idealen Fluids Dieses Kapitel befasst sich mit einigen Lösungen des Systems von Gleichungen (III.8), (III.18) und (III.4) für die Bewegung eines idealen Fluids. Dabei wird angenommen,
IV. Strömungen eines idealen Fluids Dieses Kapitel befasst sich mit einigen Lösungen des Systems von Gleichungen (III.8), (III.18) und (III.4) für die Bewegung eines idealen Fluids. Dabei wird angenommen,
Versuch Nr.53. Messung kalorischer Größen (Spezifische Wärmen)
 Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
Versuch Nr.53 Messung kalorischer Größen (Spezifische Wärmen) Stichworte: Wärme, innere Energie und Enthalpie als Zustandsfunktion, Wärmekapazität, spezifische Wärme, Molwärme, Regel von Dulong-Petit,
Die kinetische Gastheorie beruht auf den folgenden drei Annahmen:
 Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
3. Polarographie. Hamann / Vielstich Prinzip: Voltammetrische Messungen an einer tropfenden Quecksilberelektrode (Heyrowsky 1925)
 3. Polarographie Hamann / Vielstich 1.2.1 Prinzip: Voltammetrische Messungen an einer tropfenden Quecksilberelektrode (Heyrowsky 1925) Warum Quecksilber? Flüssiges Metall: jeder Tropfen hat eine neue reine
3. Polarographie Hamann / Vielstich 1.2.1 Prinzip: Voltammetrische Messungen an einer tropfenden Quecksilberelektrode (Heyrowsky 1925) Warum Quecksilber? Flüssiges Metall: jeder Tropfen hat eine neue reine
Physikalische Chemie II
 Physikalische Chemie II Molekulare Quantenmechanik Kondensierte Materie S. Willitsch + W. Meier Quantentheorie, Molekülstruktur Makroskopische Eigenschaften der Materie auf Basis der Thermodynamik Physikalische
Physikalische Chemie II Molekulare Quantenmechanik Kondensierte Materie S. Willitsch + W. Meier Quantentheorie, Molekülstruktur Makroskopische Eigenschaften der Materie auf Basis der Thermodynamik Physikalische
LK Lorentzkraft. Inhaltsverzeichnis. Moritz Stoll, Marcel Schmittfull (Gruppe 2) 25. April Einführung 2
 LK Lorentzkraft Blockpraktikum Frühjahr 2007 (Gruppe 2) 25. April 2007 Inhaltsverzeichnis 1 Einführung 2 2 Theoretische Grundlagen 2 2.1 Magnetfeld dünner Leiter und Spulen......... 2 2.2 Lorentzkraft........................
LK Lorentzkraft Blockpraktikum Frühjahr 2007 (Gruppe 2) 25. April 2007 Inhaltsverzeichnis 1 Einführung 2 2 Theoretische Grundlagen 2 2.1 Magnetfeld dünner Leiter und Spulen......... 2 2.2 Lorentzkraft........................
ETH-Aufnahmeprüfung Herbst Physik U 1. Aufgabe 1 [4 pt + 4 pt]: zwei unabhängige Teilaufgaben
![ETH-Aufnahmeprüfung Herbst Physik U 1. Aufgabe 1 [4 pt + 4 pt]: zwei unabhängige Teilaufgaben ETH-Aufnahmeprüfung Herbst Physik U 1. Aufgabe 1 [4 pt + 4 pt]: zwei unabhängige Teilaufgaben](/thumbs/64/51931310.jpg) ETH-Aufnahmeprüfung Herbst 2015 Physik Aufgabe 1 [4 pt + 4 pt]: zwei unabhängige Teilaufgaben U 1 V a) Betrachten Sie den angegebenen Stromkreis: berechnen Sie die Werte, die von den Messgeräten (Ampere-
ETH-Aufnahmeprüfung Herbst 2015 Physik Aufgabe 1 [4 pt + 4 pt]: zwei unabhängige Teilaufgaben U 1 V a) Betrachten Sie den angegebenen Stromkreis: berechnen Sie die Werte, die von den Messgeräten (Ampere-
Grundpraktikum M6 innere Reibung
 Grundpraktikum M6 innere Reibung Julien Kluge 1. Juni 2015 Student: Julien Kluge (564513) Partner: Emily Albert (564536) Betreuer: Pascal Rustige Raum: 215 Messplatz: 2 INHALTSVERZEICHNIS 1 ABSTRACT Inhaltsverzeichnis
Grundpraktikum M6 innere Reibung Julien Kluge 1. Juni 2015 Student: Julien Kluge (564513) Partner: Emily Albert (564536) Betreuer: Pascal Rustige Raum: 215 Messplatz: 2 INHALTSVERZEICHNIS 1 ABSTRACT Inhaltsverzeichnis
Hydrodynamik: bewegte Flüssigkeiten
 Hydrodynamik: bewegte Flüssigkeiten Wir betrachten eine stationäre Strömung, d.h. die Geschwindigkeit der Strömung an einem gegebenen Punkt bleibt konstant im Laufe der Zeit. Außerdem betrachten wir zunächst
Hydrodynamik: bewegte Flüssigkeiten Wir betrachten eine stationäre Strömung, d.h. die Geschwindigkeit der Strömung an einem gegebenen Punkt bleibt konstant im Laufe der Zeit. Außerdem betrachten wir zunächst
Molekulare Maschinen als Brownsche Motoren
 Molekulare Maschinen als Brownsche Motoren Gernot Faulseit 10. Juli 2003 Power Stroke vs. Brownsche Ratsche 10. Juli 2003 Power Stroke vs. Brownsche Ratsche gängige Vorstellung bei der Muskelkontraktion:
Molekulare Maschinen als Brownsche Motoren Gernot Faulseit 10. Juli 2003 Power Stroke vs. Brownsche Ratsche 10. Juli 2003 Power Stroke vs. Brownsche Ratsche gängige Vorstellung bei der Muskelkontraktion:
