Medienmitteilung. FDA erteilt Zulassung für Lucentis (Ranibizumab Injektionslösung) zur Behandlung des diabetischen Makulaödems
|
|
|
- Jürgen Ursler
- vor 7 Jahren
- Abrufe
Transkript
1 Medienmitteilung Basel, den 13. August 2012 FDA erteilt Zulassung für Lucentis (Ranibizumab Injektionslösung) zur Behandlung des diabetischen Makulaödems Erster grosser Therapiefortschritt seit über 25 Jahren bei die Sehkraft bedrohender Erkrankung Roche (SIX: RO, ROG; OTCQX: RHHBY) gab heute bekannt, dass Lucentis (Ranibizumab Injektionslösung) von der amerikanischen Lebens- und Arzneimittelbehörde FDA (Food and Drug Administration) für die Behandlung des diabetischen Makulaödems (DME) zugelassen wurde. Beim DME handelt es sich um eine Augenerkrankung bei Patienten mit Diabetes, die zu verschwommenem Sehen, schwerem Sehkraftverlust bis hin zur Erblindung führen kann. Diabetes ist heutzutage die häufigste Ursache neuer Fälle von Erblindung bei Erwachsenen in den USA, 1 und ein diabetisches Makulaödem tritt bei schätzungsweise über 560'000 Amerikanern mit Diabetes auf. 2 Lucentis ist das erste und einzige von der FDA zugelassene Medikament gegen das diabetische Makulaödem, dessen Standardbehandlung sich seit über 25 Jahren nicht wesentlich weiterentwickelt hat. Diese Standardtherapie des diabetischen Makulaödems ist in den USA bis heute die Laserchirurgie, die den zunehmenden Sehkraftverlust verlangsamt und das Sehvermögen stabilisiert, jedoch die bereits eingebüsste Sehschärfe nur begrenzt wiederherstellen kann. 3 Zum ersten Mal erhalten amerikanische Patienten mit diabetischem Makulaödem jetzt Zugang zu einem von der FDA zugelassenen Medikament, das nachweislich vielen Patienten hilft, einen beträchtlichen Teil ihrer verlorenen Sehkraft wiederherzustellen, so Dr. Hal Barron, Chief Medical Officer und Leiter der globalen Produktentwicklung. Wir haben Lucentis entwickelt, um Augenerkrankungen zu behandeln, und freuen uns über diese dritte genehmigte Indikation in den USA für eine neue Gruppe von Patienten, deren Augenlicht durch Diabetes bedroht ist. Diese Zulassung ist ein wichtiger Fortschritt im Kampf gegen Erblindung bei Patienten mit Diabetes, so Dr. David M. Brown, Netzhautspezialist am Methodist Hospital, Houston, Texas, und Prüfarzt der klinischen Studie. Die jetzt verfügbare Therapie mit Lucentis kann eine spürbare Verbesserung im Leben unserer Patienten mit diabetischem Makulaödem bedeuten. F. Hoffmann-La Roche Ltd 4070 Basel Switzerland Group Communications Roche Group Media Relations Tel Fax /6
2 Lucentis wurde 2006 von der FDA zuerst für die Behandlung der feuchten altersbedingten Makuladegeneration (AMD) und 2010 für das Makulaödem infolge eines Netzhautvenenverschlusses (in einer Dosis von 0,5 mg einmal monatlich) zugelassen. Für das diabetische Makulaödem wurde Lucentis in einer Dosis von 0,3 mg zugelassen, die von Ärzten ab sofort verordnet werden kann. Die Lieferungen beginnen voraussichtlich ab 15. August. Wirksamkeit von Lucentis bei diabetischem Makulaödem Die Zulassung von Lucentis für diabetisches Makulaödem stützte sich auf die von Genentech durchgeführten Phase-III-Studien RIDE und RISE, zwei identisch konzipierte, parallele, doppelt maskierte, mit Scheinbehandlung kontrollierte klinische Studien an insgesamt 759 Patienten, die nach dem Zufallsprinzip einer von drei Gruppen zugewiesen (randomisiert) wurden. Die Patienten erhielten einmal monatlich 0,3 mg Lucentis (250 Patienten), 0,5 mg Lucentis (252Patienten) oder eine Scheininjektion (Kontrollgruppe, 257 Patienten). Die primären Endpunkte wurden nach 24 Monaten beurteilt. Die Resultate wurden im Fachjournal Ophthalmology veröffentlicht. 4 In den Studien führte die Behandlung mit Lucentis zu einer erheblichen Verbesserung der Sehkraft bei vielen Patienten mit diabetischem Makulaödem. Die Resultate zeigten, dass bei den Patienten unter der Therapie mit 0,3 mg Lucentis eine signifikante frühzeitige (Tag 7) und anhaltende (24 Monate) Verbesserung der Sehschärfe eintrat: Unter Lucentis konnten nach 24 Monaten mehr Patienten mindestens drei zusätzliche Zeilen (15 Buchstaben) auf der Sehtafel lesen: RIDE: 34 Prozent für 0,3 Lucentis mg versus 12 Prozent für die Kontrolle; RISE: 45 Prozent für 0,3 mg Lucentis versus 18,1 Prozent für die Kontrolle (primärer Endpunkt). Die Patienten, die Lucentis erhielten, hatten nach 24 Monaten eine durchschnittliche Verbesserung ihrer Sehschärfe von mehr als zwei Zeilen (10 Buchstaben) auf der Sehtafel: RIDE: 10,9 Buchstaben für 0,3 mg Lucentis versus 2,3 Buchstaben für die Kontrolle; RISE: 12,5 Buchstaben für 0,3 mg Lucentis versus 2,6 Buchstaben für die Kontrolle. Eine signifikante Verbesserung der durchschnittlichen Sehschärfe wurde bereits 7 Tage nach der ersten Behandlung beobachtet. Bei den mit Lucentis behandelten Patienten war die Wahrscheinlichkeit einer Erhaltung ihrer Sehkraft (Verlust von weniger als 15 Buchstaben auf der Sehtafel) signifikant höher: RIDE: 98 Prozent für 0,3 mg 2/6
3 Lucentis versus 92 Prozent für die Kontrolle; RISE: 98 Prozent für 0,3 mg Lucentis versus 90 Prozent für die Kontrolle. Der Vergleich zwischen 0,3 mg Lucentis und der Kontrolle war für alle Zeitpunkte bis zum Monat 24 signifikant (p < 0,01). Die Verbesserungen der Sehschärfe, die in den Lucentis-Gruppen nach 24 Monaten beobachtet wurden, hielten bei fortgesetzter Behandlung mit Lucentis durchschnittlich über 36 Monate an. Sicherheit von Lucentis bei diabetischem Makulaödem In den klinischen Studien war das Nutzen-Risiko-Profil von Lucentis bei Patienten mit diabetischem Makulaödem über 36 Monate hinweg positiv. Die gepoolte Sicherheitsanalyse der Studien RIDE und RISE ergab nach 24 Monaten: Die okuläre Sicherheit von Lucentis bei Patienten mit diabetischem Makulaödem entsprach im Allgemeinen der bei Patienten mit feuchter altersbedingter Makuladegeneration und Netzhautvenenverschluss (nach 36 Monaten). Die häufigsten Nebenwirkungen am Auge, die bei Patienten unter 0,3 mg Lucentis häufiger auftraten als in den Kontrollgruppen, waren Bindehautblutungen (47 Prozent für 0,3 mg Lucentis versus 30 Prozent für die Kontrolle), Augenschmerzen (17 Prozent für 0,3 mg Lucentis versus 13 Prozent für die Kontrollen), Fremdkörpergefühl in den Augen (10 Prozent für 0,3 mg Lucentis versus 5 Prozent für die Kontrollen), Mouches volantes (10 Prozent für 0,3 mg Lucentis versus 4 Prozent für die Kontrollen) und erhöhter Augendruck (18 Prozent für 0,3 mg Lucentis versus 7 Prozent für die Kontrollen). In früheren Studien mit Lucentis bei anderen Erkrankungen wurden, wenn auch selten, Tendenzen zu einer erhöhten Inzidenz von arteriellen thromboembolischen Ereignissen (ATE), wie z. B. Gefässtod, Tod durch unbekannte Ursache, nichttödlicher Herzinfarkt und nichttödlicher Schlaganfall, beobachtet. Die Häufigkeit dieser Ereignisse war bei Patienten mit diabetischem Makulaödem unter 0,3 mg Lucentis und in den Kontrollgruppen nach 24 Monaten vergleichbar (5,6 Prozent für 0,3 mg Lucentis versus 5,2 Prozent für die Kontrollen). 3/6
4 Die Schlaganfallraten waren bei Patienten mit diabetischem Makulaödem 1,2 Prozent für 0,3 mg Lucentis, 1,6 Prozent für die Kontrollen. Die Raten der Gesamtsterblichkeit waren 2,8 Prozent für 0,3 mg Lucentis, 1,2 Prozent für die Kontrollen. Zusammengefasste Analysen zeigten zudem, dass die Rate fataler Nebenwirkungen (Tod unabhängig der Ursache) bei Patienten in den Studien zu diabetischem Makulaödem niedrig war und viele Todesursachen waren für Patienten mit fortgeschrittenen Diabetes-Komplikationen nicht unüblick. Allerdings kann ein möglicher Zusammenhang zwischen den Ereignissen und den Einsatz von VEGF-Inhibtoren im Auge nicht ausgeschlossen werden. Die Todesrate nach 24 Monaten war 2.8 Prozent für 0,3 mg Lucentis und 1,2 Prozent für die Kontrollen, 4,4 Prozent für 0,3 mg Lucentis nach 36 Monaten. Über diabetisches Makulaödem Das diabetische Makulaödem (DME) ist eine Schwellung der Makula im Bereich der Netzhautmitte. In der auch als gelber Fleck bezeichneten Makula befindet sich die Stelle des schärfsten zentralen Sehens. 5 Das diabetische Makulaödem entsteht, wenn bei Diabetes im Laufe der Zeit die Blutgefässe im Auge geschädigt werden. Der Patient leidet dann an der sogenannten diabetischen Retinopathie, der häufigsten diabetischen Augenerkrankung. Aus den geschädigten Blutgefässen kann Blut und Flüssigkeit austreten und zu Schwellungen und Verschwommensehen, schwerem Sehkraftverlust bis hin zur Erblindung führen. 5 Laut National Health and Nutrition Examination Survey (NHANES) der Jahre leiden über 4,2 Millionen Amerikaner ab 40 Jahren an diabetischer Retinopathie. 6 Eine nachfolgende Analyse schätzt, dass 560'500 von ihnen ein diabetisches Makulaödem haben. 2 Ausserdem erkranken Schätzungen zufolge bis zu 10 Prozent aller Patienten mit Diabetes irgendwann in ihrem Leben an einem diabetischen Makulaödem. 7 Fast 26 Millionen Menschen in Amerika haben Diabetes, und diese Erkrankung ist mittlerweile die Hauptursache neuer Fälle von Erblindung bei Erwachsenen im Alter von Jahren. 1 Über Lucentis Lucentis ist ein verschreibungspflichtiges Medikament zur Behandlung von Patienten mit feuchter altersbedingter Makuladegeneration, Makulaödem infolge Netzhautvenenverschluss und diabetischem Makulaödem. 4/6
5 Lucentis ist ein rekombinantes humanisiertes monoklonales Antikörperfragment (ohne eine Fc-Region). Lucentis ist der erste VEGF-Inhibitor, der spezifisch für die Anwendung am Auge entwickelt wurde, um den Wachstumsfaktor VEGF-A zu binden und dadurch zu hemmen. Dem Protein VEGF-A wird eine entscheidende Rolle bei der Bildung neuer Blutgefässe (Angiogenese) und der übermässigen Durchlässigkeit (Hyperpermeabilität) der Gefässe zugeschrieben. Bei feuchter altersbedingter Makuladegeneration tritt aus den unter der Netzhaut wachsenden neuen Blutgefässen Blut und Flüssigkeit aus, was zu beschleunigter Schädigung der Makula führt. In den klinischen Studien bei feuchter AMD zeigte Lucentis einmal monatlich nach zwei Jahren bei bis zu 41 % der Patienten eine Verbesserung der Sehschärfe um mindestens drei Zeilen auf der in den Studien eingesetzten Sehtafel. Bei fast allen Patienten (90 %) konnte in diesen Studien die Sehkraft unter monatlicher Behandlung mit Lucentis zumindest erhalten werden (definiert als Verlust von weniger als 15 Buchstaben auf der Sehtafel). Bei Netzhautvenenverschluss können Angiogenese und Hyperpermeabilität zum Makulaödem, einer Schwellung und Verdickung der Makula, führen. In klinischen Studien bei Netzhautvenenverschluss führte Lucentis 0,5 mg einmal monatlich zu den folgenden durchschnittlichen Verbesserungen der Sehkraft nach sechs Monaten: Patienten mit retinalem Venenastverschluss erreichten eine durchschnittliche Verbesserung von 18,3 Buchstaben auf der Sehtafel (verglichen mit 7,3 Buchstaben für die Kontrollgruppe), und Patienten mit zentralem Netzhautvenenverschluss erreichten eine durchschnittliche Verbesserung von 14,9 Buchstaben auf der Sehtafel (verglichen mit 0,8 Buchstaben für die Kontrollgruppe). Lucentis wurde bisher in 27 klinischen Studien mit mehr als 10'500 Patienten weltweit bei verschiedenen Netzhauterkrankungen nach strengen Kriterien untersucht. Ausserhalb der USA wurde Lucentis in über 70 Ländern für die Behandlung einer Sehverschlechterung infolge von diabetischem Makulaödem, in über 100 Ländern für die Behandlung von feuchter altersbedingter Makuladegeneration und in über 70 Ländern für die Behandlung von Netzhautvenenverschluss zugelassen. Lucentis wurde von Genentech entdeckt und wird gemeinsam von Genentech und Novartis für die Therapie von Augenerkrankungen entwickelt. Genentech hält die Vertriebsrechte in den USA, und Novartis hat die Alleinvertriebsrechte für den Rest der Welt. 5/6
6 Über Roche Roche mit Hauptsitz in Basel, Schweiz, ein führendes, forschungsorientiertes Unternehmen, ist spezialisiert auf die beiden Geschäfte Pharma und Diagnostics. Als weltweit grösstes Biotech-Unternehmen entwickelt Roche klinisch differenzierte Medikamente für die Onkologie, Virologie, Entzündungs- und Stoffwechselkrankheiten und Erkrankungen des Zentralnervensystems. Roche, ein Pionier im Diabetesmanagement, ist auch der weltweit bedeutendste Anbieter von In-vitro-Diagnostik und gewebebasierten Krebstests. Medikamente und Diagnostika, welche die Gesundheit, die Lebensqualität und die Überlebenschancen von Patienten entscheidend verbessern, sind das strategische Ziel der personalisierten Medizin von Roche beschäftigte Roche weltweit über Mitarbeitende und investierte mehr als 8 Milliarden Franken in die Forschung und Entwicklung. Der Konzern erzielte einen Umsatz von 42,5 Milliarden Franken. Genentech, USA, gehört vollständig zur Roche-Gruppe. An Chugai Pharmaceutical, Japan, hält Roche die Mehrheitsbeteiligung. Für weitere Informationen: Alle erwähnten Markennamen sind gesetzlich geschützt. Medienstelle Roche-Gruppe Telefon: / basel.mediaoffice@roche.com - Alexander Klauser (Leiter) - Silvia Dobry - Daniel Grotzky Literatur: 1 [CDC] Centers for Disease Control and Prevention. National diabetes fact sheet: national estimates and general information on diabetes and prediabetes in the United States, Atlanta, GA: U.S. Department of Health and Human Services, Centers for Disease Sham and Prevention [verfügbar im Internet, aktualisiert 2011, zitiert 25. Mai 2012]. Verfügbar unter: 2 Bressler NM, Varma R, Doan Q, et al. Prevalence of Visual Impairment from Diabetic Macular Edema and Relationship to Eye Care from the National Health and Nutrition Examination Survey (NHANES) [Abstract]. The Retina Society 45th Annual Scientific Meetings, Washington, DC; 4 7. Oktober 2012 (zur Präsentation angenommen). NHANES-Datenbankrecherche durch Genentech, Data on file. 3 Early Treatment Diabetic Retinopathy Study (ETDRS) Research Group. Photocoagulation for diabetic macular edema: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103: Nguyen QD, Shah SM, Khwaja AA, et al. Two-year outcomes of the Ranibizumab for Edema of the Macula in Diabetes (READ-2) Study. Ophthalmology 2010; 117: National Eye Institute. Facts about Diabetic Retinopathy [resource on the internet [updated 2012 Jun; cited 2012 Jun 11]. Available at: 6 Zhang X, Saaddine JB, Chou CF, et al. Prevalence of diabetic retinopathy in the United States, JAMA 2010; 304: Ali, F.A. A review of diabetic macular edema. Digital Journal of Ophthalmology, vol. 3, no. 6, Verfügbar unter: 6/6
Avastin von Roche erhält erweiterte EU-Zulassung für Frauen mit metastasierendem Brustkrebs
 Medienmitteilung Basel, den 30. Juni 2011 Avastin von Roche erhält erweiterte EU-Zulassung für Frauen mit metastasierendem Brustkrebs Erweiterte Indikation ermöglicht Erstlinientherapie in Kombination
Medienmitteilung Basel, den 30. Juni 2011 Avastin von Roche erhält erweiterte EU-Zulassung für Frauen mit metastasierendem Brustkrebs Erweiterte Indikation ermöglicht Erstlinientherapie in Kombination
Medienmitteilung. FDA-Zulassung für neue Anwendung von Avastin plus Chemotherapie bei metastasierendem Dickdarm-/Enddarmkrebs. Basel, 24.
 Medienmitteilung Basel, 24. Januar 2013 FDA-Zulassung für neue Anwendung von Avastin plus Chemotherapie bei metastasierendem Dickdarm-/Enddarmkrebs Roche (SIX: RO, ROG; OTCQX: RHHBY) gab heute bekannt,
Medienmitteilung Basel, 24. Januar 2013 FDA-Zulassung für neue Anwendung von Avastin plus Chemotherapie bei metastasierendem Dickdarm-/Enddarmkrebs Roche (SIX: RO, ROG; OTCQX: RHHBY) gab heute bekannt,
Medienmitteilung. Basel, 22. Oktober 2013
 Medienmitteilung Basel, 22. Oktober 2013 Roche erhält FDA-Zulassung der neuen subkutanen Darreichungsform von ACTEMRA für erwachsene Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis
Medienmitteilung Basel, 22. Oktober 2013 Roche erhält FDA-Zulassung der neuen subkutanen Darreichungsform von ACTEMRA für erwachsene Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis
Medienmitteilung. Basel, den 28. September 2013
 Medienmitteilung Basel, den 28. September 2013 Kadcyla von Roche zeigt in neuer Phase-III-Studie, dass Patienten mit fortgeschrittenem HER2-positivem Brustkrebs länger ohne Fortschreiten ihrer Erkrankung
Medienmitteilung Basel, den 28. September 2013 Kadcyla von Roche zeigt in neuer Phase-III-Studie, dass Patienten mit fortgeschrittenem HER2-positivem Brustkrebs länger ohne Fortschreiten ihrer Erkrankung
Medienmitteilung. Basel, den 17. August 2011
 Medienmitteilung Basel, den 17. August 2011 FDA erteilt Zulassung für Zelboraf (Vemurafenib) und Begleittest für BRAF- Mutation-positives metastasierendes Melanom, einer tödlichen Form von Hautkrebs Erstes
Medienmitteilung Basel, den 17. August 2011 FDA erteilt Zulassung für Zelboraf (Vemurafenib) und Begleittest für BRAF- Mutation-positives metastasierendes Melanom, einer tödlichen Form von Hautkrebs Erstes
Mitteilung an die Medien
 Mitteilung an die Medien Basel, 15. April 2011 Roche erhält positive Stellungnahme des CHMP für Kombination von Avastin mit Xeloda als Ersttherapie für fortgeschrittenen Brustkrebs in Europa Zulassung
Mitteilung an die Medien Basel, 15. April 2011 Roche erhält positive Stellungnahme des CHMP für Kombination von Avastin mit Xeloda als Ersttherapie für fortgeschrittenen Brustkrebs in Europa Zulassung
Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom
 Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom Hamburg (12. September 2013) - Seit Ende August 2013 ist der Antikörper Herceptin (Trastuzumab, Roche) als subkutane
Zulassung für Herceptin SC Mehr Freiraum für Frauen mit HER2-positivem Mammakarzinom Hamburg (12. September 2013) - Seit Ende August 2013 ist der Antikörper Herceptin (Trastuzumab, Roche) als subkutane
Medienmitteilung. Beschleunigtes FDA-Zulassungsverfahren für Perjeta von Roche zur Anwendung vor Operation bei frühem HER2-positivem Brustkrebs
 Medienmitteilung Basel, den 02. Juli 2013 Beschleunigtes FDA-Zulassungsverfahren für Perjeta von Roche zur Anwendung vor Operation bei frühem HER2-positivem Brustkrebs Zulassungsgesuch wird durch neues
Medienmitteilung Basel, den 02. Juli 2013 Beschleunigtes FDA-Zulassungsverfahren für Perjeta von Roche zur Anwendung vor Operation bei frühem HER2-positivem Brustkrebs Zulassungsgesuch wird durch neues
Perjeta für die neoadjuvante Therapie zugelassen
 HER2-positives Mammakarzinom Perjeta für die neoadjuvante Therapie zugelassen Grenzach-Wyhlen (31. Juli 2015) - Die Europäische Arzneimittel-Agentur (EMA) hat Perjeta (Pertuzumab) in Kombination mit Herceptin
HER2-positives Mammakarzinom Perjeta für die neoadjuvante Therapie zugelassen Grenzach-Wyhlen (31. Juli 2015) - Die Europäische Arzneimittel-Agentur (EMA) hat Perjeta (Pertuzumab) in Kombination mit Herceptin
Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
 Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
Refraktäres indolentes Non-Hodgkin-Lymphom: Gazyvaro erzielt deutlich längeres progressionsfreies Üb Refraktäres indolentes Non-Hodgkin-Lymphom Gazyvaro erzielt deutlich längeres progressionsfreies Überleben
Ein Überlebensvorteil wurde auch bei vorbehandelten Patienten in der Phase-II-Studie BRIM2 nachgewiesen, deren Daten demnächst publiziert werden.
 Medienmitteilung Basel, den 20. Februar 2012 Zelboraf von Roche erhält EU-Zulassung für die Behandlung von Patienten mit tödlicher Form von Hautkrebs Erstes und einziges personalisiertes Hautkrebsmedikament
Medienmitteilung Basel, den 20. Februar 2012 Zelboraf von Roche erhält EU-Zulassung für die Behandlung von Patienten mit tödlicher Form von Hautkrebs Erstes und einziges personalisiertes Hautkrebsmedikament
Roche-Studie: Patienten mit metastasierendem Dickdarmkrebs lebten länger mit anhaltender Behandlung mit Avastin plus Chemotherapie
 Medienmitteilung Basel, 3. Juni 2012 Roche-Studie: Patienten mit metastasierendem Dickdarmkrebs lebten länger mit anhaltender Behandlung mit Avastin plus Chemotherapie Phase-III-Studie beurteilt erstmals
Medienmitteilung Basel, 3. Juni 2012 Roche-Studie: Patienten mit metastasierendem Dickdarmkrebs lebten länger mit anhaltender Behandlung mit Avastin plus Chemotherapie Phase-III-Studie beurteilt erstmals
Behandlung des Sehschärfenverlustes infolge eines diabetischen Makulaödems in der EU
 Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehsc Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Medienmitteilung. Roche informiert über Phase-III-Studie MARIANNE bei nicht vorbehandeltem, HER2-positivem fortgeschrittenem Brustkrebs
 Medienmitteilung Basel, 19. Dezember 2014 Roche informiert über Phase-III-Studie MARIANNE bei nicht vorbehandeltem, HER2-positivem fortgeschrittenem Brustkrebs Die MARIANNE-Studie wurde konzipiert, um
Medienmitteilung Basel, 19. Dezember 2014 Roche informiert über Phase-III-Studie MARIANNE bei nicht vorbehandeltem, HER2-positivem fortgeschrittenem Brustkrebs Die MARIANNE-Studie wurde konzipiert, um
RoACTEMRA von Roche verbessert als Einzeltherapie Symptome in Rheumatoider Arthritis signifikant im Vergleich zu Adalimumab
 Medienmitteilung Basel, 6. Juni 2012 RoACTEMRA von Roche verbessert als Einzeltherapie Symptome in Rheumatoider Arthritis signifikant im Vergleich zu Adalimumab Roche (SIX: RO, ROG; OTCQX: RHHBY) hat heute
Medienmitteilung Basel, 6. Juni 2012 RoACTEMRA von Roche verbessert als Einzeltherapie Symptome in Rheumatoider Arthritis signifikant im Vergleich zu Adalimumab Roche (SIX: RO, ROG; OTCQX: RHHBY) hat heute
Alectinib wirksam bei ALK-positivem NSCLC
 Erste Ergebnisse der J-ALEX-Studie auf ASCO 2016 präsentiert Alectinib wirksam bei ALK-positivem NSCLC Hamburg (22. Juni 2016) Alectinib führt im Vergleich zu Crizotinib zu einer signifikanten Verlängerung
Erste Ergebnisse der J-ALEX-Studie auf ASCO 2016 präsentiert Alectinib wirksam bei ALK-positivem NSCLC Hamburg (22. Juni 2016) Alectinib führt im Vergleich zu Crizotinib zu einer signifikanten Verlängerung
Medienmitteilung. Basel, 27. August Zulassungsrelevante Studie erfüllte Kriterien für co-primären Wirksamkeitsendpunkt Gesamtüberleben
 Medienmitteilung Basel, 27. August 2012 Neue Daten der Phase-III-Studie EMILIA mit Trastuzumab-Emtansin (T-DM1) von Roche zeigen signifikant verlängertes Überleben von Patientinnen mit HER2-positivem metastasierendem
Medienmitteilung Basel, 27. August 2012 Neue Daten der Phase-III-Studie EMILIA mit Trastuzumab-Emtansin (T-DM1) von Roche zeigen signifikant verlängertes Überleben von Patientinnen mit HER2-positivem metastasierendem
Medienmitteilung. Basel, den 3. Juni 2011
 Medienmitteilung Basel, den 3. Juni 2011 Tarceva verdoppelt nahezu für Patienten mit einem bestimmten genetischen Typ von Lungenkrebs die Zeit, in der sich ihre Erkrankung nicht verschlechtert Roche (SIX:
Medienmitteilung Basel, den 3. Juni 2011 Tarceva verdoppelt nahezu für Patienten mit einem bestimmten genetischen Typ von Lungenkrebs die Zeit, in der sich ihre Erkrankung nicht verschlechtert Roche (SIX:
Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Empfehlung für neue Behandlungsoption mit Aflibercept-Injektionslösung in der EU CHMP empfiehlt
Medienmitteilung. Basel, den 07. November 2013
 Medienmitteilung Basel, den 0. November 2013 Roche-Medikament Gazyva verzögert bei Patienten mit einer der häufigsten Formen von Blutkrebs das Fortschreiten der Erkrankung signifikant länger als MabThera/Rituxan
Medienmitteilung Basel, den 0. November 2013 Roche-Medikament Gazyva verzögert bei Patienten mit einer der häufigsten Formen von Blutkrebs das Fortschreiten der Erkrankung signifikant länger als MabThera/Rituxan
FDA erteilt Zulassung für Rituxan/MabThera zur Erstlinien-Erhaltungstherapie bei Patienten mit follikulärem Lymphom
 Medienmitteilung Basel, 31. Januar 2011 FDA erteilt Zulassung für Rituxan/MabThera zur Erstlinien-Erhaltungstherapie bei Patienten mit follikulärem Lymphom Dank neuer Behandlungsoption leben Patienten
Medienmitteilung Basel, 31. Januar 2011 FDA erteilt Zulassung für Rituxan/MabThera zur Erstlinien-Erhaltungstherapie bei Patienten mit follikulärem Lymphom Dank neuer Behandlungsoption leben Patienten
Medienmitteilung. Basel, den 9. Januar 2017
 Medienmitteilung Basel, den 9. Januar 2017 FDA gewährt beschleunigte Zulassungsprüfung für die Behandlung einer weiteren Form von fortgeschrittenem Blasenkrebs mit dem Krebsimmuntherapeutikum TECENTRIQ
Medienmitteilung Basel, den 9. Januar 2017 FDA gewährt beschleunigte Zulassungsprüfung für die Behandlung einer weiteren Form von fortgeschrittenem Blasenkrebs mit dem Krebsimmuntherapeutikum TECENTRIQ
Mitteilung an die Medien
 Mitteilung an die Medien Basel, 17 November 2014 FDA erteilt Zulassung für Roche-Medikament Avastin plus Chemotherapie für Frauen mit platinresistentem, rezidivierendem Eierstockkrebs Avastin plus Chemotherapie
Mitteilung an die Medien Basel, 17 November 2014 FDA erteilt Zulassung für Roche-Medikament Avastin plus Chemotherapie für Frauen mit platinresistentem, rezidivierendem Eierstockkrebs Avastin plus Chemotherapie
Medienmitteilung. Basel, den 1. Juni 2013
 Medienmitteilung Basel, den 1. Juni 2013 Roche gibt endgültige Resultate der Phase-III-Studie mit Avastin plus Strahlenund Chemotherapie bei Patienten mit aggressiver Form von Hirntumor bekannt Roche (SIX:
Medienmitteilung Basel, den 1. Juni 2013 Roche gibt endgültige Resultate der Phase-III-Studie mit Avastin plus Strahlenund Chemotherapie bei Patienten mit aggressiver Form von Hirntumor bekannt Roche (SIX:
EU erteilt Zulassung für Roche-Medikament Avastin kombiniert mit Chemotherapie für Frauen mit fortgeschrittenem Gebärmutterhalskrebs
 Medienmitteilung Basel, 8. April 2015 EU erteilt Zulassung für Roche-Medikament Avastin kombiniert mit Chemotherapie für Frauen mit fortgeschrittenem Gebärmutterhalskrebs Avastin ist seit fast zehn Jahren
Medienmitteilung Basel, 8. April 2015 EU erteilt Zulassung für Roche-Medikament Avastin kombiniert mit Chemotherapie für Frauen mit fortgeschrittenem Gebärmutterhalskrebs Avastin ist seit fast zehn Jahren
Medienmitteilung. Basel, den 17. November 2012
 Medienmitteilung Basel, den 17. November 2012 Roche-Studie: Avastin als Zusatz zu Bestrahlung und Chemotherapie verlängerte die Überlebenszeit ohne Fortschreiten der Erkrankung bei Patienten mit neu diagnostiziertem
Medienmitteilung Basel, den 17. November 2012 Roche-Studie: Avastin als Zusatz zu Bestrahlung und Chemotherapie verlängerte die Überlebenszeit ohne Fortschreiten der Erkrankung bei Patienten mit neu diagnostiziertem
Mitteilung an die Medien
 Mitteilung an die Medien Basel, 24. September 2012 ESMO 2012: Roche unterstreicht führende Rolle in der Onkologie mit neuen Daten bei HER2-positivem Brustkrebs und bei Hautkrebs Roche (SIX: RO, ROG; OTCQX:
Mitteilung an die Medien Basel, 24. September 2012 ESMO 2012: Roche unterstreicht führende Rolle in der Onkologie mit neuen Daten bei HER2-positivem Brustkrebs und bei Hautkrebs Roche (SIX: RO, ROG; OTCQX:
Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes infolge eines diabetischen Makulaödems in der EU
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Aflibercept zur Injektion ins Auge: Bayer erhält Empfehlung zur Zulassung für die Behandlung des Sehschärfenverlustes
Roche gibt positive Resultate der zulassungsrelevanten Phase-III-Studie mit Pertuzumab bei HER2-positivem metastasierendem Brustkrebs bekannt
 Medienmitteilung Basel, 8. Dezember 2011 Roche gibt positive Resultate der zulassungsrelevanten Phase-III-Studie mit Pertuzumab bei HER2-positivem metastasierendem Brustkrebs bekannt Medianes progressionsfreies
Medienmitteilung Basel, 8. Dezember 2011 Roche gibt positive Resultate der zulassungsrelevanten Phase-III-Studie mit Pertuzumab bei HER2-positivem metastasierendem Brustkrebs bekannt Medianes progressionsfreies
Mitteilung an die Medien
 Mitteilung an die Medien Basel, den 20. Juni 2011 Entscheidende Studie zeigt: Vismodegib liess Tumore schrumpfen oder heilte Läsionen bei seltener Form von fortgeschrittenem Hautkrebs Wie Roche (SIX: RO,
Mitteilung an die Medien Basel, den 20. Juni 2011 Entscheidende Studie zeigt: Vismodegib liess Tumore schrumpfen oder heilte Läsionen bei seltener Form von fortgeschrittenem Hautkrebs Wie Roche (SIX: RO,
Roche s Avastin für die Behandlung der aggressivsten Art von Hirntumoren in Japan zugelassen
 Medienmitteilung Basel, 17. Juni 2013 Roche s Avastin für die Behandlung der aggressivsten Art von Hirntumoren in Japan zugelassen Erste Zulassung von Avastin für die Behandlung von neu diagnostiziertem
Medienmitteilung Basel, 17. Juni 2013 Roche s Avastin für die Behandlung der aggressivsten Art von Hirntumoren in Japan zugelassen Erste Zulassung von Avastin für die Behandlung von neu diagnostiziertem
Roche-Studie mit Avastin und Chemotherapie in schwer zu behandelndem rezidivierendem Eierstockkrebs: Progressionsrisiko der Krankheit halbiert
 Medienmitteilung Basel, den 2. Juni 2012 Roche-Studie mit Avastin und Chemotherapie in schwer zu behandelndem rezidivierendem Eierstockkrebs: Progressionsrisiko der Krankheit halbiert Erste Phase-III-Studie
Medienmitteilung Basel, den 2. Juni 2012 Roche-Studie mit Avastin und Chemotherapie in schwer zu behandelndem rezidivierendem Eierstockkrebs: Progressionsrisiko der Krankheit halbiert Erste Phase-III-Studie
Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in neu. IA-Empfehlung bewertet
 Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in neu Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in
Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in neu Bevacizumab-haltige Therapie beim fortgeschrittenen NSCLC als First-Line-Standard bestätigt und in
Investor News. Bayer erhält Zulassung für Eylea in China
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Zulassung für Eylea in China Eylea erhält in China die Zulassung zur Behandlung des Sehschärfenverlusts
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Bayer erhält Zulassung für Eylea in China Eylea erhält in China die Zulassung zur Behandlung des Sehschärfenverlusts
Roche-Medikament Avastin als Zusatz zur Chemotherapie erhält positive Empfehlung für EU-Zulassung bei fortgeschrittenem Gebärmutterhalskrebs
 Medienmitteilung Basel, 27. Februar 2015 Roche-Medikament Avastin als Zusatz zur Chemotherapie erhält positive Empfehlung für EU-Zulassung bei fortgeschrittenem Gebärmutterhalskrebs Die Kombination von
Medienmitteilung Basel, 27. Februar 2015 Roche-Medikament Avastin als Zusatz zur Chemotherapie erhält positive Empfehlung für EU-Zulassung bei fortgeschrittenem Gebärmutterhalskrebs Die Kombination von
Medienmitteilung. Basel, den 20. Oktober Ocrelizumab wird in den laufenden Phase-III-Studien in zwei Formen von MS untersucht
 Medienmitteilung Basel, den 20. Oktober 2011 Phase-II-Studie mit ocrelizumab zeigt eine fast zwei Jahre anhaltende deutliche Reduktion der Krankheitsaktivität bei Patienten mit multipler Sklerose Ocrelizumab
Medienmitteilung Basel, den 20. Oktober 2011 Phase-II-Studie mit ocrelizumab zeigt eine fast zwei Jahre anhaltende deutliche Reduktion der Krankheitsaktivität bei Patienten mit multipler Sklerose Ocrelizumab
Obinutuzumab (GA101) von Roche reduziert signifikant Progressions- und Sterberisiko bei Patienten mit einer der häufigsten Formen von Blutkrebs
 Medienmitteilung Basel, 16. Mai 2013 Obinutuzumab (GA101) von Roche reduziert signifikant Progressions- und Sterberisiko bei Patienten mit einer der häufigsten Formen von Blutkrebs Phase-III-Daten der
Medienmitteilung Basel, 16. Mai 2013 Obinutuzumab (GA101) von Roche reduziert signifikant Progressions- und Sterberisiko bei Patienten mit einer der häufigsten Formen von Blutkrebs Phase-III-Daten der
Medienmitteilung. Basel, den 3. Juni 2012
 Medienmitteilung Basel, den 3. Juni 2012 Trastuzumab-Emtansine (T-DM1) von Roche, ein zielgerichtetes Prüfmedikament für Brustkrebs, reduzierte in Phase-III-Studie das Risiko des Krankheitsfortschritts
Medienmitteilung Basel, den 3. Juni 2012 Trastuzumab-Emtansine (T-DM1) von Roche, ein zielgerichtetes Prüfmedikament für Brustkrebs, reduzierte in Phase-III-Studie das Risiko des Krankheitsfortschritts
Patientengerechte Therapiewahl bei oraler Antikoagulation: Gerinnungs-Selbstmanagement verbessert Th. Therapie-Outcome
 Patientengerechte Therapiewahl bei oraler Antikoagulation Gerinnungs-Selbstmanagement verbessert Therapie-Outcome Mannheim (6. Mai 2013) - Die Wahl eines oralen Antikoagulans zur Vorbeugung thromboembolischer
Patientengerechte Therapiewahl bei oraler Antikoagulation Gerinnungs-Selbstmanagement verbessert Therapie-Outcome Mannheim (6. Mai 2013) - Die Wahl eines oralen Antikoagulans zur Vorbeugung thromboembolischer
Mitteilung an die Medien
 Mitteilung an die Medien Basel, 8. Dezember 2012 Roche-Medikament Perjeta verlängert signifikant das Überleben von Patientinnen mit HER2-positivem metastasierendem Brustkrebs Roche (SIX: RO, ROG; OTCQX:
Mitteilung an die Medien Basel, 8. Dezember 2012 Roche-Medikament Perjeta verlängert signifikant das Überleben von Patientinnen mit HER2-positivem metastasierendem Brustkrebs Roche (SIX: RO, ROG; OTCQX:
Neue Perspektiven für Frauen mit Brustkrebs Perjeta und Kadcyla in der Behandlung des HER2-positiven Mammakarzinoms
 Neue Perspektiven für Frauen mit Brustkrebs Perjeta und Kadcyla in der Behandlung des HER2-positiven Mammakarzinoms Berlin (19. Juni 2014) - Die Überlebensperspektiven für Frauen mit metastasiertem HER2-positivem
Neue Perspektiven für Frauen mit Brustkrebs Perjeta und Kadcyla in der Behandlung des HER2-positiven Mammakarzinoms Berlin (19. Juni 2014) - Die Überlebensperspektiven für Frauen mit metastasiertem HER2-positivem
Mitteilung an die Medien
 Mitteilung an die Medien Neue Daten der STAIRWAY-Studie zeigen mögliche längere Wirkdauer für Faricimab von Roche bei neovaskulärer altersbedingter Makuladegeneration (namd) Faricimab der erste für das
Mitteilung an die Medien Neue Daten der STAIRWAY-Studie zeigen mögliche längere Wirkdauer für Faricimab von Roche bei neovaskulärer altersbedingter Makuladegeneration (namd) Faricimab der erste für das
Medienmitteilung. Basel, 14. Mai 2015
 Medienmitteilung Basel, 14. Mai 2015 Roche-Prüfmedikament alectinib liess bei fast der Hälfte der Patienten mit einer bestimmten Art von Lungenkrebs die Tumoren schrumpfen Alectinib zeigte Ansprechraten
Medienmitteilung Basel, 14. Mai 2015 Roche-Prüfmedikament alectinib liess bei fast der Hälfte der Patienten mit einer bestimmten Art von Lungenkrebs die Tumoren schrumpfen Alectinib zeigte Ansprechraten
Cobimetinib und Vemurafenib: Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom
 Cobimetinib und Vemurafenib Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom Bonn (16. Juni 2015) - Kombinationstherapien zählen zu den wirksamsten Strategien, um die Prognose von
Cobimetinib und Vemurafenib Prüfkombination überzeugt bei Patienten mit fortgeschrittenem Melanom Bonn (16. Juni 2015) - Kombinationstherapien zählen zu den wirksamsten Strategien, um die Prognose von
weitere Störungen des Sehvermögens, die auf eine choroidale Neovaskularisation zurückzuführen sind;
 EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
EMA/704742/2016 EMEA/H/C/000715 Zusammenfassung des EPAR für die Öffentlichkeit Ranibizumab Dies ist eine Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für. Hierin wird erläutert,
Mitteilung an die Medien
 Mitteilung an die Medien Basel, 18. Mai 2011 Roche präsentiert auf dem ASCO-Kongress massgebliche Ergebnisse aus Studien zu fortgeschrittenem Haut-, Lungen-, und Eierstockkrebs -Personalisierte Medizin
Mitteilung an die Medien Basel, 18. Mai 2011 Roche präsentiert auf dem ASCO-Kongress massgebliche Ergebnisse aus Studien zu fortgeschrittenem Haut-, Lungen-, und Eierstockkrebs -Personalisierte Medizin
Erneut positive Studien-Ergebnisse in Phase III für VEGF Trap-Eye bei Zentralvenenverschluss der Netzhaut
 Investor News Nicht für US-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Erneut positive Studien-Ergebnisse in Phase III für VEGF Trap-Eye bei Zentralvenenverschluss
Investor News Nicht für US-Medien bestimmt Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Erneut positive Studien-Ergebnisse in Phase III für VEGF Trap-Eye bei Zentralvenenverschluss
Esbriet kann Husten bei IPF-Patienten verringern
 DGP 2017: Update Idiopathische Lungenfibrose (IPF) Esbriet kann Husten bei IPF-Patienten verringern Stuttgart (23. März 2017) - Esbriet (Pirfenidon) kann Husten ein Leitsymptom der IPF verringern. Das
DGP 2017: Update Idiopathische Lungenfibrose (IPF) Esbriet kann Husten bei IPF-Patienten verringern Stuttgart (23. März 2017) - Esbriet (Pirfenidon) kann Husten ein Leitsymptom der IPF verringern. Das
FDA erteilt beschleunigte vorläufige Zulassung für Perjeta von Roche zur Anwendung vor Operation bei HER2-positivem Brustkrebs im Frühstadium
 Medienmitteilung Basel, 1. Oktober 2013 FDA erteilt beschleunigte vorläufige Zulassung für Perjeta von Roche zur Anwendung vor Operation bei HER2-positivem Brustkrebs im Frühstadium Das Therapieschema
Medienmitteilung Basel, 1. Oktober 2013 FDA erteilt beschleunigte vorläufige Zulassung für Perjeta von Roche zur Anwendung vor Operation bei HER2-positivem Brustkrebs im Frühstadium Das Therapieschema
Gazyvaro von Roche in Europa für Patienten mit der häufigsten Form von Leukämie zugelassen
 Medienmitteilung Basel, 29. Juli 2014 Gazyvaro von Roche in Europa für Patienten mit der häufigsten Form von Leukämie zugelassen Gazyvaro, der erste mittels Glycoengineering hergestellte monoklonale Typ-II-CD20-
Medienmitteilung Basel, 29. Juli 2014 Gazyvaro von Roche in Europa für Patienten mit der häufigsten Form von Leukämie zugelassen Gazyvaro, der erste mittels Glycoengineering hergestellte monoklonale Typ-II-CD20-
Übersicht über Eylea und Begründung für die Zulassung in der EU
 EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
EMA/481361/2018 EMEA/H/C/002392 Übersicht über Eylea und Begründung für die Zulassung in der EU Was ist Eylea und wofür wird es angewendet? Eylea ist ein Arzneimittel für Erwachsene zur Behandlung: der
VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration. Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie
 Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über
Investor News Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über
Roche erhält EU-Zulassung für Avastin in Kombination mit Tarceva bei Patienten mit einer bestimmten Form von fortgeschrittenem Lungenkrebs
 Medienmitteilung Basel, 8 Juni 2016 Roche erhält EU-Zulassung für Avastin in Kombination mit Tarceva bei Patienten mit einer bestimmten Form von fortgeschrittenem Lungenkrebs Dies ist die erste Zulassung
Medienmitteilung Basel, 8 Juni 2016 Roche erhält EU-Zulassung für Avastin in Kombination mit Tarceva bei Patienten mit einer bestimmten Form von fortgeschrittenem Lungenkrebs Dies ist die erste Zulassung
Mitteilung an die Medien
 Mitteilung an die Medien 28. November 2012 Roche meldet CE-Kennzeichnung des cobas 4800 HPV-Tests für erweiterte klinische Indikationsbereiche: Nutzung als primäres Screening-Instrument für Gebärmutterhalskrebs
Mitteilung an die Medien 28. November 2012 Roche meldet CE-Kennzeichnung des cobas 4800 HPV-Tests für erweiterte klinische Indikationsbereiche: Nutzung als primäres Screening-Instrument für Gebärmutterhalskrebs
FDA erteilt beschleunigte Zulassung für Alecensa (Alectinib) von Roche fuer Patienten mit einer bestimmten Form von Lungenkrebs
 Medienmitteilung Basel, 14. Dezember 2015 FDA erteilt beschleunigte Zulassung für Alecensa (Alectinib) von Roche fuer Patienten mit einer bestimmten Form von Lungenkrebs Roche (SIX: RO, ROG; OTCQX: RHHBY)
Medienmitteilung Basel, 14. Dezember 2015 FDA erteilt beschleunigte Zulassung für Alecensa (Alectinib) von Roche fuer Patienten mit einer bestimmten Form von Lungenkrebs Roche (SIX: RO, ROG; OTCQX: RHHBY)
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom
 Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Meilenstein in der personalisierten Medizin FDA-Zulassung für Pertuzumab beim HER2-positiven metastasierten Mammakarzinom Frankfurt am Main (15. Juni 2012) - Die US-amerikanische Arzneimittelzulassungsbehörde
Positive Studien-Ergebnisse mit VEGF Trap-Eye bei Zentralvenen- Verschluss des Auges und bei diabetischem Makulaödem
 Investor News Nur zur Verwendung außerhalb der USA Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Positive Studien-Ergebnisse mit VEGF Trap-Eye bei Zentralvenen- Verschluss
Investor News Nur zur Verwendung außerhalb der USA Bayer AG Investor Relations 51368 Leverkusen Deutschland www.investor.bayer.de Positive Studien-Ergebnisse mit VEGF Trap-Eye bei Zentralvenen- Verschluss
Medienmitteilung. Basel, 1. September 2016
 Medienmitteilung Basel, 1. September 2016 Phase-III-Studie zeigte, dass das Krebsimmuntherapeutikum Tecentriq (Atezolizumab) von Roche verglichen mit Chemotherapie das Überleben von Patienten mit einer
Medienmitteilung Basel, 1. September 2016 Phase-III-Studie zeigte, dass das Krebsimmuntherapeutikum Tecentriq (Atezolizumab) von Roche verglichen mit Chemotherapie das Überleben von Patienten mit einer
kolorektalen Karzinoms
 Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
Signifikante Lebensverlängerung durch Angiogenese-Hemmung Avastin in der First-Line-Therapie des metastasierten kolorektalen Karzinoms Berlin (24. März 2006) - Erhalten Patienten mit metastasiertem kolorektalen
RoACTEMRA von Roche zeigt Langzeitwirksamkeit als Monotherapie und Nutzen bei früher rheumatoider Arthritis
 Medienmitteilung Basel, den 13. Juni 2013 RoACTEMRA von Roche zeigt Langzeitwirksamkeit als Monotherapie und Nutzen bei früher rheumatoider Arthritis Mehr als 35 Abstracts erbringen am EULAR-Kongress den
Medienmitteilung Basel, den 13. Juni 2013 RoACTEMRA von Roche zeigt Langzeitwirksamkeit als Monotherapie und Nutzen bei früher rheumatoider Arthritis Mehr als 35 Abstracts erbringen am EULAR-Kongress den
Positive Ergebnisse von zwei Phase-III-Studien mit VEGF Trap-Eye bei feuchter altersbedingter Makula-Degeneration
 Positive Ergebnisse von zwei Phase-III-Studien mit VEGF Trap-Eye bei feuchter altersbedingter Makula-Degeneration - Präparat erreicht in allen Studienarmen inklusive der Dosierung von 2 mg alle zwei Monate
Positive Ergebnisse von zwei Phase-III-Studien mit VEGF Trap-Eye bei feuchter altersbedingter Makula-Degeneration - Präparat erreicht in allen Studienarmen inklusive der Dosierung von 2 mg alle zwei Monate
Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star. Patienteninformation
 Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star Patienteninformation Die Augen sind die wichtigsten Sinnesorgane. Mit ihrer Hilfe orientieren wir uns und nehmen
Früherkennung mit dem OCT schützen Sie Ihr Augenlicht Netzhauterkrankungen & Grüner Star Patienteninformation Die Augen sind die wichtigsten Sinnesorgane. Mit ihrer Hilfe orientieren wir uns und nehmen
Roche-Medikament Perjeta verlängert das Leben von Patientinnen mit einer aggressiven Form von metas
 Roche-Medikament Perjeta verlängert das Leben von Patientinnen mit einer aggressiven Form von metas Roche-Medikament Perjeta verlängert das Leben von Patientinnen mit einer aggressiven Form von metastasierendem
Roche-Medikament Perjeta verlängert das Leben von Patientinnen mit einer aggressiven Form von metas Roche-Medikament Perjeta verlängert das Leben von Patientinnen mit einer aggressiven Form von metastasierendem
Medienmitteilung. ddddddd. Basel, 1. Oktober 2012
 Medienmitteilung ddddddd Basel, 1. Oktober 2012 Endergebnisse der Phase-III-Studie HERA bestätigen einjährige Behandlung mit Herceptin als Standardtherapie bei HER2-positivem Brustkrebs im Frühstadium
Medienmitteilung ddddddd Basel, 1. Oktober 2012 Endergebnisse der Phase-III-Studie HERA bestätigen einjährige Behandlung mit Herceptin als Standardtherapie bei HER2-positivem Brustkrebs im Frühstadium
CHMP empfiehlt bedingte EU-Zulassung für Alecensa (Alectinib) von Roche für Patienten mit zuvor behandeltem ALK-positivem NSCLC
 Medienmitteilung Basel, 16. Dezember 2016 CHMP empfiehlt bedingte EU-Zulassung für Alecensa (Alectinib) von Roche für Patienten mit zuvor behandeltem ALK-positivem NSCLC Wie Roche (SIX: RO, ROG; OTCQX:
Medienmitteilung Basel, 16. Dezember 2016 CHMP empfiehlt bedingte EU-Zulassung für Alecensa (Alectinib) von Roche für Patienten mit zuvor behandeltem ALK-positivem NSCLC Wie Roche (SIX: RO, ROG; OTCQX:
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration
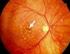 Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antiangiogenetische Therapie bei neovaskulärer altersabhängiger Makuladegeneration VEGF Vascular Endothelial growth factor ist ein Protein, welches selektiv an Rezeptoren auf der Oberfläche von Gefäßendothelzellen
Antikoagulation ist eine patientenindividuelle Entscheidung
 121. Kongress der Deutschen Gesellschaft für Innere Medizin (DGIM) DOAK oder Vitamin-K-Antagonisten: Wahl oraler Antikoagulation ist eine patientenindividuelle Entscheidung Mannheim (18. April 2015) -
121. Kongress der Deutschen Gesellschaft für Innere Medizin (DGIM) DOAK oder Vitamin-K-Antagonisten: Wahl oraler Antikoagulation ist eine patientenindividuelle Entscheidung Mannheim (18. April 2015) -
Jahrestagung der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO)2016: Positive Daten zu
 Jahrestagung der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO)2016 Positive Daten zur PD-L1-Inhibition mit Atezolizumab Leipzig (15. Oktober 2016) - Der Anti-PD-L1-Antikörper Atezolizumab
Jahrestagung der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO)2016 Positive Daten zur PD-L1-Inhibition mit Atezolizumab Leipzig (15. Oktober 2016) - Der Anti-PD-L1-Antikörper Atezolizumab
Mitteilung an die Medien
 Mitteilung an die Medien Basel, 13. Oktober 2017 CHMP empfiehlt EU-Zulassung für Alecensa (Alectinib) von Roche als Erstlinientherapie für Patienten mit ALK-positivem NSCLC Das positive Gutachten ist gestützt
Mitteilung an die Medien Basel, 13. Oktober 2017 CHMP empfiehlt EU-Zulassung für Alecensa (Alectinib) von Roche als Erstlinientherapie für Patienten mit ALK-positivem NSCLC Das positive Gutachten ist gestützt
Neue Resultate der Studie CLL11 zur unbehandelten chronisch lymphatischen Leukämie (CLL)
 Neue Resultate der Studie CLL11 zur unbehandelten chronisch lymphatischen Leukämie (CLL) Beigesteuert von Simone Pareigis 07.12.2015 Letzte Aktualisierung 07.12.2015 SHG-Halle Neue Resultate der Studie
Neue Resultate der Studie CLL11 zur unbehandelten chronisch lymphatischen Leukämie (CLL) Beigesteuert von Simone Pareigis 07.12.2015 Letzte Aktualisierung 07.12.2015 SHG-Halle Neue Resultate der Studie
Medienmitteilung. Basel, 19. Mai 2016
 Medienmitteilung Basel, 19. Mai 2016 FDA erteilt beschleunigte vorläufige Zulassung für Krebsimmuntherapeutikum Tecentriq (Atezolizumab) von Roche für Patienten mit bestimmter Form von fortgeschrittenem
Medienmitteilung Basel, 19. Mai 2016 FDA erteilt beschleunigte vorläufige Zulassung für Krebsimmuntherapeutikum Tecentriq (Atezolizumab) von Roche für Patienten mit bestimmter Form von fortgeschrittenem
IVOM welches Medikament bei welcher Erkrankung
 IVOM welches Medikament bei welcher Erkrankung GIO IVOM - KURS 2016 Neumünster Arnd Bunse F.E.B.O. Augenärzte BEP Schwerpunktpraxis für Netzhaut- und Makulaerkrankungen 21029 Hamburg www.augenaerzte-bep-bergedorf.de
IVOM welches Medikament bei welcher Erkrankung GIO IVOM - KURS 2016 Neumünster Arnd Bunse F.E.B.O. Augenärzte BEP Schwerpunktpraxis für Netzhaut- und Makulaerkrankungen 21029 Hamburg www.augenaerzte-bep-bergedorf.de
Medienmitteilung. Basel, 5. Juni 2016
 Medienmitteilung Basel, 5. Juni 2016 Roche-Krebsimmuntherapeutikum Tecentriq (Atezolizumab) liess Tumoren bei Patienten mit zuvor unbehandeltem fortgeschrittenen Blasenkrebs schrumpfen Neue Überlebensdaten
Medienmitteilung Basel, 5. Juni 2016 Roche-Krebsimmuntherapeutikum Tecentriq (Atezolizumab) liess Tumoren bei Patienten mit zuvor unbehandeltem fortgeschrittenen Blasenkrebs schrumpfen Neue Überlebensdaten
Avastin (Bevacizumab) Zelboraf (Vemurafenib):
 Medienmitteilung Basel, den 16. Mai 2012 Roche präsentiert beim ASCO-Kongress 2012 neue Daten zu wichtigen Entwicklungen für Patienten mit fortgeschrittenen Krebserkrankungen Erste zulassungsrelevanten
Medienmitteilung Basel, den 16. Mai 2012 Roche präsentiert beim ASCO-Kongress 2012 neue Daten zu wichtigen Entwicklungen für Patienten mit fortgeschrittenen Krebserkrankungen Erste zulassungsrelevanten
zielgerichtete Therapie beim CUP-Syndrom
 14. Herbstkongress der Arbeitsgemeinschaft Internistische Onkologie (AIO): Molekulares Tumorprofiling 14. Herbstkongress der Arbeitsgemeinschaft Internistische Onkologie (AIO) Molekulares Tumorprofiling
14. Herbstkongress der Arbeitsgemeinschaft Internistische Onkologie (AIO): Molekulares Tumorprofiling 14. Herbstkongress der Arbeitsgemeinschaft Internistische Onkologie (AIO) Molekulares Tumorprofiling
Vitamin-K-Antagonisten und Gerinnungs-Selbstmanagement: Monitoring gibt Sicherheit bei oraler Antiko
 Vitamin-K-Antagonisten und Gerinnungs-Selbstmanagement: Monitoring gibt Sicherheit bei oraler Antiko Vitamin-K-Antagonisten und Gerinnungs-Selbstmanagement Monitoring gibt Sicherheit bei oraler Antikoagulation
Vitamin-K-Antagonisten und Gerinnungs-Selbstmanagement: Monitoring gibt Sicherheit bei oraler Antiko Vitamin-K-Antagonisten und Gerinnungs-Selbstmanagement Monitoring gibt Sicherheit bei oraler Antikoagulation
Medienmitteilung. Basel, 2. Juni Erste Phase-III-Studie mit Avastin bei dieser schwer zu behandelnden Krebsart
 Medienmitteilung Basel, 2. Juni 2013 Roche-Medikament Avastin plus Chemotherapie verlängerte das Überleben bei Frauen mit fortgeschrittenem Gebärmutterhalskrebs verglichen mit Chemotherapie allein Erste
Medienmitteilung Basel, 2. Juni 2013 Roche-Medikament Avastin plus Chemotherapie verlängerte das Überleben bei Frauen mit fortgeschrittenem Gebärmutterhalskrebs verglichen mit Chemotherapie allein Erste
Alter Kosten fehlende Arzt-Patienten-Bindung: Mythen zum Gerinnungs-Selbstmanagement
 Alter Kosten fehlende Arzt-Patienten-Bindung Mythen zum Gerinnungs-Selbstmanagement Mannheim (26. März 2013) - Derzeit leben in Deutschland etwa 900.000 Menschen, die zur Prophylaxe thromboembolischer
Alter Kosten fehlende Arzt-Patienten-Bindung Mythen zum Gerinnungs-Selbstmanagement Mannheim (26. März 2013) - Derzeit leben in Deutschland etwa 900.000 Menschen, die zur Prophylaxe thromboembolischer
ASCO 2015 Neues zur Therapie des HER2-positiven Mammakarzinoms
 ASCO 2015 Neues zur Therapie des HER2-positiven Mammakarzinoms Bonn (16. Juni 2015) - Ein Schwerpunkt des weltweit größten Krebskongresses, der 51. Jahrestagung der American Society of Clinical Oncology
ASCO 2015 Neues zur Therapie des HER2-positiven Mammakarzinoms Bonn (16. Juni 2015) - Ein Schwerpunkt des weltweit größten Krebskongresses, der 51. Jahrestagung der American Society of Clinical Oncology
Mitteilung an die Medien
 Mitteilung an die Medien 6h Basel, 30. Mai 2009 Vollständige Ergebnisse aus der ersten Phase-III-Studie mit Avastin in der adjuvanten Therapie des Dickdarmkrebses Resultate geben Hoffnung, dass in künftigen
Mitteilung an die Medien 6h Basel, 30. Mai 2009 Vollständige Ergebnisse aus der ersten Phase-III-Studie mit Avastin in der adjuvanten Therapie des Dickdarmkrebses Resultate geben Hoffnung, dass in künftigen
Phase-II-Studie. VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration: Nachhaltige Sehkraftverbes
 VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
VEGF Trap-Eye verbessert Sehkraft bei altersbedingter Makula-Degeneration Nachhaltige Sehkraftverbesserung über 52 Wochen in Phase-II-Studie Leverkusen und Tarrytown, NY, USA, (19. August 2008) Patienten
Roche informiert über die ersten zwei von sechs Phase-III-Studien mit Bitopertin bei Schizophrenie
 Roche informiert über die ersten zwei von sechs Phase-III-Studien mit Bitopertin bei Schizophrenie - Zwei Phase-III-Studien zur Prüfung von Bitopertin bei anhaltenden, überwiegend negativen Symptomen der
Roche informiert über die ersten zwei von sechs Phase-III-Studien mit Bitopertin bei Schizophrenie - Zwei Phase-III-Studien zur Prüfung von Bitopertin bei anhaltenden, überwiegend negativen Symptomen der
Roche-Prüfmedikament T-DM1 zeigt Verbesserung des progressionsfreien Überlebens als Standardtherapie bei HER2-positivem metastasierendem Brustkrebs
 Medienmitteilung Basel, den 25. September 2011 Roche-Prüfmedikament T-DM1 zeigt Verbesserung des progressionsfreien Überlebens als Standardtherapie bei HER2-positivem metastasierendem Brustkrebs Erste
Medienmitteilung Basel, den 25. September 2011 Roche-Prüfmedikament T-DM1 zeigt Verbesserung des progressionsfreien Überlebens als Standardtherapie bei HER2-positivem metastasierendem Brustkrebs Erste
Mitteilung an die Medien
 Mitteilung an die Medien Basel, 3. August 2011 RoACTEMRA von Roche in Europa für Kinder mit seltener und schwerer Form von Arthritis zugelassen Medikament bietet neue Behandlungsoption für systemische
Mitteilung an die Medien Basel, 3. August 2011 RoACTEMRA von Roche in Europa für Kinder mit seltener und schwerer Form von Arthritis zugelassen Medikament bietet neue Behandlungsoption für systemische
Medienmitteilung. Basel, 28. September 2015
 Medienmitteilung Basel, 28. September 2015 Ocrelizumab von Roche zeigt als erstes Prüfmedikament Wirkung bei Menschen mit primär progredienter multipler Sklerose in einer grossen Phase-III-Studie Phase-III-Studie
Medienmitteilung Basel, 28. September 2015 Ocrelizumab von Roche zeigt als erstes Prüfmedikament Wirkung bei Menschen mit primär progredienter multipler Sklerose in einer grossen Phase-III-Studie Phase-III-Studie
FDA erteilt Zulassung für Actemra zur Behandlung der systemischen juvenilen idiopathischen Arthritis (SJIA)
 Medienmitteilung Basel, den 18. April 2011 FDA erteilt Zulassung für Actemra zur Behandlung der systemischen juvenilen idiopathischen Arthritis (SJIA) Medikament bietet neue Option für Kinder mit seltener
Medienmitteilung Basel, den 18. April 2011 FDA erteilt Zulassung für Actemra zur Behandlung der systemischen juvenilen idiopathischen Arthritis (SJIA) Medikament bietet neue Option für Kinder mit seltener
Medienmitteilung. Basel, 28. September 2014
 Medienmitteilung Basel, 28. September 2014 Roche-Medikament Perjeta verlängert das Leben von Patientinnen mit einer aggressiven Form von metastasierendem Brustkrebs um 15,7 Monate im Vergleich zu einer
Medienmitteilung Basel, 28. September 2014 Roche-Medikament Perjeta verlängert das Leben von Patientinnen mit einer aggressiven Form von metastasierendem Brustkrebs um 15,7 Monate im Vergleich zu einer
Medienmitteilung. Basel, 27. September 2015
 Medienmitteilung Basel, 27. September 2015 Roche stellt auf dem Europäischen Krebskongress 2015 positive Resultate einer zulassungsrelevanten Studie mit dem Immuntherapeutikum Atezolizumab bei einer Form
Medienmitteilung Basel, 27. September 2015 Roche stellt auf dem Europäischen Krebskongress 2015 positive Resultate einer zulassungsrelevanten Studie mit dem Immuntherapeutikum Atezolizumab bei einer Form
Die altersabhängige Makuladegeneration
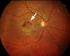 Die altersabhängige Makuladegeneration Die Makuladegeneration ist eine bei älteren Menschen sehr häufige Erkrankung der Netzhautmitte (Makula) und ist in den Industrieländern die häufigste Erblindungsursache
Die altersabhängige Makuladegeneration Die Makuladegeneration ist eine bei älteren Menschen sehr häufige Erkrankung der Netzhautmitte (Makula) und ist in den Industrieländern die häufigste Erblindungsursache
Medienmitteilung. Basel, 1. Juni 2015
 Medienmitteilung Basel, 1. Juni 2015 Therapieschema mit Perjeta von Roche verlängerte bei Patientinnen mit HER2- positivem Brustkrebs im Frühstadium das Überleben, ohne dass die Erkrankung wieder auftrat
Medienmitteilung Basel, 1. Juni 2015 Therapieschema mit Perjeta von Roche verlängerte bei Patientinnen mit HER2- positivem Brustkrebs im Frühstadium das Überleben, ohne dass die Erkrankung wieder auftrat
Roche gibt bekannt, dass Vemurafenib das Überleben bei Patienten mit metastasierendem Melanom verlängerte, die eine BRAF-V600-Mutation aufwiesen
 Medienmitteilung Basel, den 5. Juni 2011 Roche gibt bekannt, dass Vemurafenib das Überleben bei Patienten mit metastasierendem Melanom verlängerte, die eine BRAF-V600-Mutation aufwiesen Ergebnis der Roche-Strategie
Medienmitteilung Basel, den 5. Juni 2011 Roche gibt bekannt, dass Vemurafenib das Überleben bei Patienten mit metastasierendem Melanom verlängerte, die eine BRAF-V600-Mutation aufwiesen Ergebnis der Roche-Strategie
Medienmitteilung. Basel, den 30. September 2013
 Medienmitteilung Basel, den 30. September 2013 Daten zeigen, dass neue subkutane Form des Medikaments Herceptin von Roche von Patienten bevorzugt wird und Ressourcen in Europas Krankenhäusern einsparen
Medienmitteilung Basel, den 30. September 2013 Daten zeigen, dass neue subkutane Form des Medikaments Herceptin von Roche von Patienten bevorzugt wird und Ressourcen in Europas Krankenhäusern einsparen
Einheitlichere Diagnose bei Vorstufen des Gebärmutterhalskrebses: FDA erteilt Freigabe für CINtec-Histology-Test von Roche
 Medienmitteilung Basel, 5. April 2017 Einheitlichere Diagnose bei Vorstufen des Gebärmutterhalskrebses: FDA erteilt Freigabe für CINtec-Histology-Test von Roche Etwa 50 Millionen Frauen werden in den USA
Medienmitteilung Basel, 5. April 2017 Einheitlichere Diagnose bei Vorstufen des Gebärmutterhalskrebses: FDA erteilt Freigabe für CINtec-Histology-Test von Roche Etwa 50 Millionen Frauen werden in den USA
Medienmitteilung. Basel, den 23. März 2012
 Medienmitteilung Basel, den 23. März 2012 Herceptin von Roche als subkutane Injektion ist patientenfreundlicher und reduziert Gesundheitskosten im Vergleich zur gängigen intravenösen Infusion Subkutane
Medienmitteilung Basel, den 23. März 2012 Herceptin von Roche als subkutane Injektion ist patientenfreundlicher und reduziert Gesundheitskosten im Vergleich zur gängigen intravenösen Infusion Subkutane
Schulungsverein Ohrekreis e.v. ZUCKERSÜSS - FOLGENSCHWER Diabetes mellitus und seine Folgeschäden. Haldensleben, den (Welt-Diabetestag)
 ZUCKERSÜSS - FOLGENSCHWER Diabetes mellitus und seine Folgeschäden Haldensleben, den 14.11.2009 (Welt-Diabetestag) Diabetes in Zahlen Rund 50 Millionen Menschen mit Diabetes leben in Europa. Etwa 246 Millionen
ZUCKERSÜSS - FOLGENSCHWER Diabetes mellitus und seine Folgeschäden Haldensleben, den 14.11.2009 (Welt-Diabetestag) Diabetes in Zahlen Rund 50 Millionen Menschen mit Diabetes leben in Europa. Etwa 246 Millionen
