Stabilitätsuntersuchungen
|
|
|
- Katrin Giese
- vor 6 Jahren
- Abrufe
Transkript
1 Stabilitätsuntersuchungen
2 52 3 Stabilitätsuntersuchungen 3 Stabilitätsuntersuchungen 3.1 Hydrolyse von 2-Imidazolinen 2-Imidazoline hydrolysieren im wässrigen Milieu unter Ringöffnung zu Formamiden (Abb. 3.1). Die Hydrolyse ist temperatur- und ph-abhängig, wobei die Reaktion durch Temperaturerhöhung bzw. ph-erhöhung beschleunigt wird [Watts, 140]. H H 2 H H 2 H H 2-Imidazolin -(2-Aminoethyl)formamid Abb. 3.1: Hydrolyse des 2-Imidazolins Hydrolyse von 2-Imidazolinen im Sauren Die Geschwindigkeit und der Mechanismus der Hydrolyse von 2-Methylimidazolin im Sauren wurden von Watson [161, 162] und de Savignac [163] untersucht. H + H H + schnell H + + H 2 H 2 /H + langsam + H H 3 CH 3 CH 3 CH 3 2-Methylimidazolin Dikation -(2-Aminoethyl)acetamid H 2 /H + + H 3 H CH 3 Abb. 3.2: Hydrolyse von 2-Methylimidazolin im Sauren nach Watson [161]. Ethylendiamin Essigsäure
3 3 Stabilitätsuntersuchungen 53 Der geschwindigkeitsbestimmende Schritt ist hierbei ein nukleophiler Angriff von Wasser am C2-Atom des Dikations des Imidazolins, das im Sauren schnell gebildet wird (Abb. 3.2). Hydrolyse wurde nur im stark Sauren (ph < 1) und bei hohen Temperaturen (> 100 C) beobachtet. Im Sauren sind die gebildeten Amide nicht stabil; sie hydrolysieren weiter, wobei im Falle des 2-Methylimidazolins Ethylendiamin und Essigsäure entsteht Hydrolyse von 2-Imidazolinen im Alkalischen Die Hydrolyse von 2-Imidazolinen verläuft im Alkalischen schneller als unter sauren Bedingungen. Dabei kommt es im Gegensatz zur Hydrolyse im Sauren nicht zur weiteren Zersetzung der entstandenen Amide. Über den Mechanismus der alkalischen Hydrolyse gibt es in der Literatur verschiedene Meinungen. b die freie Base oder die protonierte Form des Imidazolins an der Hydrolyse beteiligt ist, wird unterschiedlich diskutiert [Watts, 140]. Harnsberger und Riebsomer [164] gehen von einer Beteiligung der freien Base aus. Sie postulieren die Bildung eines Intermediats durch einen schnellen, reversiblen Angriff von am C2-Atom des Imidazolinrings. Diese Intermediat reagiert dann im geschwindigkeitsbestimmenden Schritt mit Wasser zum ringoffenen Amid. - R R R R + H 2 - langsam H R HR Imidazolin Intermediat Hydrolyseprodukt Abb. 3.3: Hydrolyse von Imidazolinen im Alkalischen nach Harnsberger und Riebsomer [164]. Untersuchungen zur Stabilität des Antiarrhytmikums Cibenzolin (2-(2,2-Diphenylcyclopropyl)-4,5-dihydro-1H-imidazol) lassen auf einen anderen Mechanismus unter Beteiligung der protonierten Form des Imidazolins schließen, da sich die Ergebnisse nicht mit dem Geschwindigkeitsgesetz von Harnsberger und Riebsomer in Einklang bringen lassen [Ross, 165].
4 54 3 Stabilitätsuntersuchungen H H + H + R H langsam H H R schnell H H 2 R Cibenzolin protoniertes Cibenzolin Hydrolyseprodukt Abb. 3.4: Hydrolyse von Cibenzolin im Alkalischen nach Ross [165]. Als geschwindigkeitsbestimmend wird hier der Angriff von am C2-Atom der protonierten Form des Imidazolins angesehen. Danach kommt es zu einer schnellen Öffnung des Imidazolinrings zum entsprechenden Amid (Abb. 3.4). 3.2 HPLC-Methode zur Untersuchung der Hydrolyse von 4,5-Diaryl-2-imidazolinen Um eine mögliche Hydrolyse der 4,5-Diaryl-2-imidazoline zu verfolgen, wurde eine HPLC-Methode entwickelt. Die Bedingungen wurden so gewählt werden, dass es zu einer guten Auftrennung zwischen den Imidazolinen und den Hydrolyseprodukten kommt. Außerdem sollten eine gute Reproduzierbarkeit und geringe Analysenzeiten erreicht werden. Eine quantitative Bestimmung der nicht hydrolysierten Imidazoline musste ebenfalls durchführbar sein. Allgemein wird die Eignung und Leistungsfähigkeit einer HPLC-Methode durch die stationäre Phase, die Fliessmittelzusammensetzung und die Fliessmittelgeschwindigkeit bestimmt Reversed-Phase Chromatographie Im Gegensatz zur klassischen Säulenchromatographie ist bei der reversed-phase Chromatographie die mobile Phase polarer als die stationäre Phase. Die Trennung beruht auf einer unterschiedlichen Adsorption der zu trennenden Verbindungen an das Trägermaterial [Meyer, 166]. Lipophilere Substanzen werden hier stärker zurückgehalten als hydrophile und damit später eluiert.
5 3 Stabilitätsuntersuchungen Stationäre Phase Zur Auftrennung der Verbindungen wird eine Vor- und Hauptsäule mit RP-Packungsmaterial verwendet. Durch den Einsatz einer Vorsäule kann die Lebensdauer der Hauptsäule deutlich verlängert werden, da sich in jedem Lösungsmittel geringe Mengen Packungsmaterial in Form von modifizierter Kieselsäure anlösen [Meyer, 166]. Säulenmaterial ist ukleosil C 18 (Kapitel , Seite 195). Dies ist ein chemisch stabiles, apolares Säulenmaterial, bei dem an die Silanol-Gruppen des Silicagels ctadecyl- Gruppen kovalent gebunden sind Mobile Phase Als mobile Phase wird ein polares Zweikomponenten-Gemisch aus Methanol und a 2 S 4 -Lösung ph 3 (Kapitel , Seite 195) verwendet. Mit einer solchen Mischung ist eine vollständige Elution der Imidazoline und der Hydrolyseprodukte unter Vermeidung eines starken Peaktailings möglich. Die prozentuale Zusammensetzung des Gemisches beeinflusst die Retentionszeit der zu eluierenden Substanzen und wurde so gewählt, dass die Substanzen ausreichend voneinander getrennt werden und trotzdem möglichst kurze Retentionszeiten erreicht werden Detektion Die untersuchten Substanzen lassen sich wegen ihrer Benzolringe durch UV-Messung bei 254 nm detektieren. Bei diesen Wellenlängen zeigt das intakte Imidazolin stärkere UV-Absorption als das Hydrolyseprodukt. Dadurch nimmt die Gesamtpeakfläche aller Peaks im Chromatogramm mit fortschreitender Hydrolyse ab. Deshalb werden die Peakflächen der Hydrolyseprodukte mit einem Faktor korrigiert, der den geringeren Extinktionskoeffizienten der Hydrolyseprodukte ausgleicht. Die korrigierte Gesamtpeakfläche wird dadurch für alle Zeitpunkte konstant und entspricht der Peakfläche des 2-Imidazolins am Anfang der Hydrolyse [Krauser, 167].
6 56 3 Stabilitätsuntersuchungen 3.3 HPLC-Untersuchungen von 4,5-Diaryl-2-imidazolinen Im Rahmen dieser Arbeit wurde untersucht, inwieweit die oben beschriebene Hydrolyse auch bei 4,5-Diaryl-2-imidazolinen stattfindet. Bei den unsymmetrisch substituierten Verbindungen 72, 86, 90 und 96 sind dabei verschiedene Hydrolyseprodukte möglich. Je nach dem, welche der beiden C--Bindungen des Rings gespalten, wird entstehen zwei Amide, die bei geeigneten HPLC-Bedingungen getrennt werden können. Der Einfluss verschiedener Substituenten des Imidazolinrings und der beiden Aromaten, sowie der Einfluss der Konfiguration an den beiden Stereozentren sollte untersucht werden. H 3 C CH 3 H H H H H H Br CH 3 H 3 C CH H 96 Abb. 3.5: Mit HPLC auf ihre Stabilität untersuchte Verbindungen.
7 3 Stabilitätsuntersuchungen 57 Die untersuchten Verbindungen sind in Abb. 3.5 zusammengefasst. Die dabei verwendete Fliessmittelzusammensetzung und die Retentionszeiten der Verbindungen und der entstandenen Amide sind in Tab. 3.1 dargestellt. Alle Substanzen wurden sowohl unter den Bedingungen der Zellversuche (PBS, ph 7.4, 37 C) als auch in destilliertem Wasser (ph , 37 C) untersucht. Der Verlauf der Hydrolyse der Verbindungen wurde in Doppelbestimmungen über ca. 65 Stunden verfolgt. Dazu wurden in regelmäßigen Abständen (alle 4 h) 20 µl der auf 37 Celsius temperierten Lösungen analysiert. Verbindung Puffer [%] Methanol [%] t R Imidazolin [min] t R Amid 1 [min] t R Amid 2 [min] * * * * n.d. * n.d n.d. * n.d. n.d Tab. 3.1: Fliessmittelzusammensetzung und Retentionszeiten (t R ) der Imidazoline und deren Hydrolyseprodukte (n.d.: nicht detektiert, die Bildung eines Hydrolyseproduktes konnte über den gesamten Messzeitraum nicht nachgewiesen werden; * : bei symmetrisch substituierten Imidazolinen entsteht nur ein Hydrolyseprodukt). Zum Vergleich mit den Imidazolinen 70 und 86 ist die am C2 ethylierte Verbindung 81 gut geeignet. Sie konnte aber wegen schlechter Löslichkeit in PBS nicht untersucht werden. Um trotzdem Aussagen über den Einfluss der C-Alkylierung machen zu können, wurde stattdessen die 2-hydroxyethylierte Verbindung 83 untersucht HPLC-Untersuchungen von 4,5-Diaryl-2-imidazolinen in PBS In Abb. 3.6 sind zwei Chromatogramme von 70 unter den Messbedingungen nach Tab. 3.1 dargestellt. Zum Startzeitpunkt der Untersuchung ist neben dem Injektionspeak nur ein Peak des 2-Imidazolins (t R = 7.2 min) zu sehen. ach 56 h ist dieser Peak bei 7.2 min immer noch vorhanden, aber die Peakfläche ist um ca. 90 Prozent reduziert. Zusätzlich wird ein weiterer Peak eines Abbauproduktes bei 5.1 min detektiert.
8 58 3 Stabilitätsuntersuchungen 400 mv : min mv : :2 0 min Abb. 3.6: Chromatogramme von 70, gelöst in PBS, direkt nach dem Verdünnen (oben) und nach 56 h bei 37 C. In Abb. 3.7 ist der zeitliche Verlauf der Hydrolyse des Imidazolins 70 in PBS (ph 7.4, 37 C) über 65 Stunden dargestellt. Deutlich erkennt man die Abnahme der Ausgangsverbindung 70 in den ersten 25 h der Messung. Danach ist nur eine sehr geringe Verringerung der Imidazolinkonzentration zu beobachten. Eine zeitabhängige Zunahme eines Hydrolyseprodukts ist ebenfalls zu erkennen. Koinjektion des synthetisierten Formamids 100 (Kapitel 2.8, Seite 49 und Kapitel , Seite 78) und einer Lösung des unter HPLC-Bedingungen hydrolysierten Imidazolins 70 führt zu einer Erhöhung des Peaks bei 5.1 Minuten. Außer dem Peak des Imidazolins 70 werden keine weiteren Peaks detektiert. Damit steht fest, dass 4,5-Diaryl-2-imidazoline unter den HPLC- Bedingungen ausschließlich zu Amiden hydrolysieren.
9 3 Stabilitätsuntersuchungen Molprozent [%] Zeit [h] 70 Hydrolyseprodukt 100 Abb. 3.7: Hydrolyseverlauf von 70 in PBS. Weitere am Imidazolinring unsubstituierte Verbindungen (40, 68, 71 und 96) zeigen einen ähnlichen Kurvenverlauf (Kapitel 9.1, Seite 210). 72 zeigt dagegen einen deutlich langsameren Hydrolyseverlauf. Wie man in Abb. 3.8 erkennen kann, entstehen aus dieser unsymmetrisch substituierten Verbindung zwei Hydrolyseprodukte im Verhältnis 1:1 (Strukturen siehe Abb. 3.12). 100 Molprozent [%] Zeit [h] 72 Hydrolyseprodukt 1 Hydrolyseprodukt 2 Abb. 3.8: Hydrolyseverlauf von 72 in PBS.
10 60 3 Stabilitätsuntersuchungen Alle am Imidazolinring substituierten Verbindungen sind deutlich stabiler. Bei den Untersuchungen der C-alkylierten Verbindung 83, des Imidazoliniumbromids 88 und des Tetrahydropyrroloimidazols 90 wird auch nach 65 Stunden kein Abbauprodukt gefunden (Kapitel 9.1, Seite 210). Einzig beim an 1 ethylierten Imidazolin 86 wird ein Hydrolyseprodukt detektiert (Tab. 3.1). Die Hydrolyse verläuft aber viel langsamer ab, als bei den am Imidazolinring unsubstituierten Verbindungen (Abb. 3.9). 100 Molprozent [%] Zeit [h] 86 Hydrolyseprodukt Abb. 3.9: Hydrolyseverlauf von 86 in PBS. ach Harnsberger und Riebsomer [164] verläuft die Hydrolyse von Imidazolinen nach einem Mechanismus pseudoerster rdnung. Trägt man den natürlichen Logarithmus der Konzentration des Edukts gegen die Zeit auf, erhält man nach ln[a] = ln[a 0 ] + (-k obs ) t die Geschwindigkeitskonstante k obs. Statt der Konzentration kann auch eine dazu proportionale Größe wie der prozentuale Stoffmengenanteil eingesetzt werden [Lang, 168]. Die Steigung der Regressionsgeraden entspricht k obs. In Abb ist der semilogarithmische Hydrolyseverlauf von 70 und 72 abgebildet. Dabei zeigt sich nur für 72 über den gesamten Zeitraum ein linearer Zusammenhang. Da die restlichen, instabilen Verbindungen (40, 68, 71, 86 und 96) in der semilogarithmischen Darstellung einen ähnlichen Verlauf wie 70 zeigen, ist 72 die einzige Verbindung, deren Hydrolyse nach einem Mechanismus pseudoerster rdnung abläuft. Die Geschwindigkeitskonstante k obs beträgt dabei h -1.
11 3 Stabilitätsuntersuchungen ln (Molprozent) Zeit [h] 5 4 ln (Molprozent) Zeit [h] Abb. 3.10: Semilogarithmische Darstellung des Hydrolyseverlauf von 70 (oben) und 72 (unten) in PBS. Der Mechanismus der Hydrolyse von 40, 68, 70, 71, 86 und 96 verläuft nach einem komplexeren Mechanismus. Die in Abb. 3.7 beobachtete geringe Abnahme der Imidazolinkonzentration ab ca. 25 h lässt auf eine Rückreaktion des gebildeten Formamids zum Imidazolin 70 schließen. Diese Rückreaktion des synthetisierten Formamids 100 zum Imidazolin könnte unter den Messbedingungen nicht nachgewiesen werden, da 100 in PBS über 65 h konstante Peakflächen zeigte. Wahrscheinlich war dazu die Messdauer von 65 h zu gering, um eine detektierbare Imidazolinkonzentration zu erreichen. Da es sich bei 2-Imidazolinen, um schwache Basen handelt, ist anzunehmen, dass der pk S -Wert der Verbindungen die Hydrolysegeschwindigkeit beeinflusst. Unterschiedliche pk S -Werte führen zu anderen Konzentrationsverhältnissen zwischen der freien Base
12 62 3 Stabilitätsuntersuchungen und der protonierten Form des Imidazolins bei dem hier vorliegenden ph-wert. Die pks-werte einiger untersuchter Verbindungen wurden mit einer Software (Advanced Chemistry Development Software Solaris V4.67 der Fa. ACD) berechnet. Wie aus Tab. 3.2 liegt der pk s -Wert der Verbindungen bei ca. 9. Damit sind die Imidazoline bei einem ph-wert von 7.4 größtenteils protoniert. Verbindung pk s ± Tab. 3.2: Berechnete pk s -Werte einiger 2-Imidazoline. Aufgrund dieser Überlegungen wurde für die Hydrolyse der Verbindungen ein Reaktionsmechanismus vermutet, bei dem zwei Gleichgewichtsreaktionen aufeinander folgen (Abb. 3.11). R R R R R k 1 H R k 2 H + R H H R HR Abb. 3.11: Reaktionsmechanismus der zur Kinetiksimulation verwendet wurde. Die Geschwindigkeitskonstante k 1 beschreibt dabei, die von den pk s -Werten der Verbindungen abhängige Einstellung eines Gleichgewichts zwischen protonierter und unprotonierter Form des Imidazolins. Geschwindigkeitsbestimmend ist ein nukleophiler Angriff von an C2 des protonierten Imidazolins, der zur Ringöffnung zum Amid führt. Der einzige Unterschied dieses Mechanismus zum von Ross postulierten Mechanismus (Abb. 3.4) ist die Rückreaktion des Amids zum Imidazolin. Die Berechnung der Geschwindigkeitskonstanten solcher Reaktionen ist erheblich aufwendiger als die Ermittlung der Geschwindigkeitskonstante von Reaktionen pseudoerster rdnung. Deshalb wurde der Hydrolyseverlauf der Verbindungen mit Hilfe des Kinetiksimulationsprogramms KSIM (Version 2.0), das von Miller [169] im Internet zur Verfügung gestellt wird, simuliert.
13 3 Stabilitätsuntersuchungen 63 Das Programm ermöglicht die Eingabe der prozentualen Stoffmengenanteile in Abhängigkeit von der Reaktionsdauer aller beteiligten Reaktionspartner. Da aus den HPLC-Messungen nur experimentelle Daten der Gesamtimidazolinkonzentrationen und der Konzentrationen der Hydrolyseprodukte zur Verfügung stehen, ist die Berechnungen der einzelnen Geschwindigkeitskonstanten der beiden Reaktionsschritte (k 1 und k 2 ) nicht möglich. Die Geschwindigkeitskonstante k obs der Gesamtreaktion kann mit KSIM aber trotzdem ermittelt werden. ach Vorgabe des Reaktionsmechanismus wurden die vom Programm berechneten Kurven durch die Veränderung theoretischer Reaktionsparameter an die experimentell ermittelten Datenpunkte solange angepasst, bis eine optimale Übereinstimmung für die Edukte und Produkte erreicht war. Die Hydrolyseverläufe wurden nach Runge-Kutta berechnet [Barshop, 170, Crossley, 171]. Dabei orientiert sich die Größe der Zeitintervalle zwischen den berechneten Punkten an der Konzentrationsänderung. Je größer die Konzentrationsänderung ist, desto kleiner ist das Zeitintervall zwischen den berechneten Punkten, wodurch am Anfang einer Reaktion besonders viele Punkte errechnet werden. Mit steigender Reaktionsdauer sinkt die Konzentrationsänderung der Reaktionspartner. Für eine ausreichend genaue Berechnung sind viel weniger Werte notwendig und die Berechnungsdauer kann durch Erhöhung der Zeitintervalle erheblich gesenkt werden. Die experimentell erhaltenen Hydrolyseverläufe in PBS aller Verbindungen ließen sich mit dem Reaktionsschema aus Abb und KSIM simulieren. Für diese simulierten Molprozent-Zeit-Verläufe konnte mit dem Gleichungstyp ne Exponential die Geschwindigkeitskonstante k obs berechnet werden (Tab. 3.3). Die Hydrolyse von 72 wurde ebenfalls mit KSIM simuliert. Die dabei ermittelte Geschwindigkeitskonstante von h -1 stimmt mit der Geschwindigkeitskonstante überein, die für diese Verbindung nach dem Mechanismus pseudoerster rdnung (k obs = h -1 ) erhalten wurde und zeigt, dass KSIM für eine Vorhersage der Geschwindigkeitskonstanten geeignet ist. Entscheidend für die Hydrolysegeschwindigkeit ist bei beiden in der Literatur diskutierten Mechanismen im Alkalischen (Kapitel 3.1.2) und beim zur Berechnung von k obs angenommen Mechanismus ein nukleophiler Angriff am C2-Atom des Imidazolinrings. ach Ross [165] ist das nukleophile Agens. Da der Hydrolysemechanismus der 4,5-Diarylimidazoline dem Mechanismus von Ross sehr ähnlich ist, kann auch hier von als ukleophil ausgegangen werden. Eine Beteiligung von H 2 als ukleophil
14 64 3 Stabilitätsuntersuchungen wurde von Ross nur bei ph 7 und 80 C beobachtet. Bei niedrigeren Temperaturen und höheren ph-werte könnte dies nicht nachgewiesen werden. C2 trägt dabei eine positive Partialladung, die durch weitere Substituenten am Ring beeinflusst wird. Durch elektronenschiebende Reste wird die Elektronendichte im Imidazolinring erhöht, die positive Ladung dadurch abgeschwächt und ein nukleophiler Angriff unwahrscheinlicher. Auch sterische Effekte können die Hydrolysegeschwindigkeit beeinflussen, da durch Substituenten der nukleophile Angriff behindert werden kann. R 1 R 2 R3 Verbindung R 1 R 2 R 3 Konfiguration k obs [h -1 ] 40 2-, 4-CH 3 2-, 4-CH 3 H (4R,5S)/(4S,5R) H (4R,5S)/(4S,5R) , 4-2-, 4- H (4R,5S)/(4S,5R) , 4-2-, 4- H (4R,5R)/(4S,5S) ,6-2, 4-2-, 4- H (4R,5S) (4S,5R) , 4-2-, 4- Ethyl (4R,5S)/(4S,5R) , 4-2-, 4- Tab. 3.3: Geschwindigkeitskonstanten der untersuchten Verbindungen in PBS. H (4R,5S)/(4S,5R) Innerhalb der Gruppe der am Imidazolinring unsubstituierten Verbindungen treten unterschiedliche Hydrolysegeschwindigkeiten auf (Tab. 3.3), die auf unterschiedlicher Substitution der Aromaten beruhen. Die pk s -Werte dieser Verbindungen unterscheiden sich nur geringfügig (Tab. 3.2) und kommen daher nicht als Ursache für die teilweise deutlichen Unterschiede in Frage. Die Imidazoline 40 und 96 sind mit Geschwindigkeitskonstanten von ca. 0.2 h -1 die instabilsten Verbindungen, die untersucht wurden. Sie unterscheiden sich vom Imidazolin 70, das etwas langsamer hydrolysiert (k obs = h -1 ), durch Etherfunktionen in para- Position des Aromaten. Eine sterische Behinderung des nukleophilen Angriffs kommt als Ursache dieses Unterschiedes nicht in Frage, da eine große räumliche Entfernung zum C2-Atom vorliegt.
15 3 Stabilitätsuntersuchungen 65 Denkbar ist aber, dass die unterschiedlichen Substituenten in para-position die Elektronendichte im Imidazolinring verändern, was die Partialladung an C2 beeinflusst. In den Chemical Abstract ist der pk s -Wert der phenolischen -Gruppen von 70 mit 8.30 angegeben. Bei ph 7.4 liegen somit ca. 10 % der Phenole als Phenolate vor. Möglicherweise können diese Phenolate die Elektronendichte im 2-Imidazolinring durch Mesomerieeffekte stärker erhöhen als die Phenole bzw. Ether und die erhöhte Stabilität von 70 gegenüber der Methoxyverbindung 40 verursachen. Das Imidazolin 96 mit einer -Funktion und einer Etherstruktur müsste dann allerdings eine Geschwindigkeitskonstante besitzen, die zwischen denen der Verbindungen 40 und 70 liegt. Dies wurde jedoch nicht beobachtet. Hinweise auf die Elektronendichte am C2 ergeben sich auch aus den chemischen Verschiebungen des Protons an C2 in 1 H-MR-Spektren. Je positiver das C2-Atom ist, desto höhere chemische Verschiebungen sind für das entsprechende Proton zu erwarten [Hesse, 172]. Tatsächlich zeigt sich bei Verbindung 40 mit 9.04 ppm für das Proton an C2 die höchste chemische Verschiebung dieses Protons dieser drei Verbindungen (40: 9.04 ppm > 96: 9.00 ppm > 70: 8.97 ppm). Die Unterschiede sind allerdings sehr gering. Die Verbindungen 68 und 70 unterscheiden sich durch die beiden 2-Chlorsubstituenten in den Aromaten. Auch dies sollte die Elektronendichte im Imidazolinring beeinflussen. Durch die I und +M-Effekte der Chlorsubstituenten in 70 könnte auch die Elektronendichte an C2 verändert sein. Dies zeigt sich wiederum bei den chemischen Verschiebungen der Protonen an C2. Dort hat das Proton von 70 die höhere Verschiebung als das Proton von 68 (70: 8.97 ppm > 68: 8.92 ppm). In der Tat ist 70 mit einer Geschwindigkeitskonstante von h -1 die etwas instabilere Verbindung dieser beiden Imidazoline. Eine andere Beeinflussung der Hydrolysegeschwindigkeit durch Halogensubstituenten wird bei der Einführung eines dritten Chloratoms beobachtet (Abb. 3.8). Die Hydrolyse verläuft deutlich langsamer. Die veränderte Elektronendichte durch die Halogene kann dafür nicht verantwortlich sein und es müssen andere Ursachen für die langsamere Hydrolyse von 72 vorliegen. In Kapitel (Seite 85) konnte mit MR-Untersuchungen nachgewiesen werden, dass die drei geräumigen Chloratome hier zu Rotationseinschränkungen der Aromaten führen. Bei 72 steht im Energieminimum ein Chloratom über dem Imidazolinring. Dadurch ist ein nukleophiler Angriff an C2 eventuell nicht mehr so leicht möglich.
16 66 3 Stabilitätsuntersuchungen Die einzige untersuchte (4R,5R)/(4S,4S)-konfigurierte Verbindung 71 hydrolysiert etwas langsamer als das Diastereomer 70. Durch die bei 71 vorliegende Anordnung der Aromaten auf beiden Seiten der Imidazolinringebene (Kapitel 4.2.2, Seite 80) ist der Angriff eines ukleophils im Vergleich zu 70, bei dem die Aromaten auf der gleichen Seite des Imidazolinrings angeordnet sind, erschwert. Durch die Einführung von Substituenten in den Imidazolinring wird die Stabilität der Verbindungen stark erhöht. ur bei der -ethylierten Verbindung 86 ist Hydrolyse zu beobachten. Die Hydrolyse verläuft insgesamt deutlich langsamer als bei der nicht ethylierten Verbindung 70. Bei den Verbindungen 83, 88 und 90 wird über den gesamten Messzeitraum kein Abbauprodukt detektiert. Eine Hydrolyse zu unter den gewählten Bedingungen nicht detektierten Abbauprodukten kann ausgeschlossen werden, da die Peakfläche der Ausgangsverbindungen über den gesamten Messzeitraum konstant ist. Alle eingeführten Substituenten sind stärkere Elektronendonatoren als Wasserstoff und erhöhen die Elektronendichte im Imidazolinring. Dadurch wird die positive Partialladung an C2 abgeschwächt. Ein nukleophiler Angriff an C2 findet nicht mehr so leicht statt. Die Einführung des Alkylrestes an 1 erhöht die Elektronendichte an C2 weniger stark als die Einführung der Alkylgruppe direkt an C2. Daher sind bei 86 noch (langsame) Hydrolysevorgänge zu beobachten (k obs = h -1 ). Die chemische Verschiebung des Protons an C2 im 1 H-MR beträgt bei ppm und ist fast identisch zur Verschiebung des entsprechenden Protons von 70 (8.97 ppm). Auch wenn dies auf eine verringerte Elektronendichte an C2 bei 86 hinweist, reicht dieser Unterschied nicht aus um die deutlich erhöhte Stabilität von 86 zu erklären. Die C-alkylierte Verbindung 83 ist unter den gewählten Bedingungen dagegen stabil. Auch bei der, -dialkylierten Verbindung 88 und C,-alkylierten Verbindung 90 ist die positive Partialladung an C2 so stark abgeschwächt, dass keine Hydrolyse stattfindet. Eine derartige Verringerung der Hydrolysegeschwindigkeit durch elektronenschiebende Substituenten am Imidazolinring wurde auch von anderen Arbeitsgruppen beschrieben [Harnsberger und Riebsomer, 173]. Zusätzlich ist eine Verringerung der Hydrolysegeschwindigkeit aufgrund einer sterischen Behinderung des nukleophilen Angriffs an C2 durch die Alkylreste denkbar. Bei den in den Aromaten verschieden substituierten Verbindungen 72 und 96 können, je nachdem welche der beiden C--Bindungen gespalten wird, zwei verschiedene Hydrolyseprodukte entstehen (Abb. 3.12). Da die beiden aus 72 bzw. 96 entstanden Amide jeweils ein fast identisches chromophores System besitzen, sollten sie auch nahezu glei-
17 3 Stabilitätsuntersuchungen 67 che UV-Absorptionskoeffizienten haben. Bei gleicher Peakfläche der beiden Amide sollten somit auch die Konzentrationen gleich sein. H H 2 H 2 H H H Abb. 3.12: Hydrolyseprodukte von 72. Eine bevorzugte Bildung eines der beiden Amide ist bei 72 (Abb. 3.8) wie auch bei 96 nicht zu beobachten. Zu jedem Zeitpunkt erhält man nahezu identische Peakflächen der beiden Abbauprodukte. Auch beim -ethylierten 86 sind zwei Hydrolyseprodukte, ein sekundäres und ein tertiäres Amid, zu erwarten (Abb. 3.13). Es wird aber nur ein Hydrolyseprodukt detektiert. H H H 2 H H Abb. 3.13: Mögliche Hydrolyseprodukte von 86. sekundäres Amid tertiäres Amid De Savignac et al. [163] konnten durch MR-Untersuchungen zeigen, dass aus -(2- Aminoethyl)-2-decyl-imidazolin nur das sekundäre Amid entsteht. Die Bildung des tertiären Amids wurde nicht beobachtet. Watts [140] konnte unter sehr milden Bedingungen die Bildung eines sekundären und eines tertiären Amids nachweisen, wobei Temperaturerhöhung zu einer verstärkten Bildung des sekundären Amids führte. b es sich beim detektierten Hydrolyseprodukt von 86, um ein sekundäres oder tertiäres Amide handelt, wurde nicht näher untersucht. Die Bildung des sekundären Amids ist aber aufgrund der Ergebnisse von de Savignac und Watts wahrscheinlicher. Es wurde auch nicht geprüft, ob aus 86 bei längerer Messdauer oder unter anderen Hydrolysebedingungen ein weiteres Hydrolyseprodukt entsteht.
18 68 3 Stabilitätsuntersuchungen HPLC-Untersuchungen von 4,5-Diaryl-2-imidazolinen in Wasser Die Hydrochloride bzw. Hydrobromide der in Abb. 3.5 aufgeführten Verbindungen wurden auch in destilliertem Wasser als Lösungsmittel untersucht. Der ph-wert der vermessenen Lösungen liegt dabei zwischen 5 und 6. In Abb ist der zeitliche Verlauf der Hydrolyse von 70 in Wasser abgebildet. Im Vergleich zur Hydrolyse in PBS (Abb. 3.7) verläuft die Hydrolyse in H 2 deutlich langsamer. Die Einstellung eines Gleichgewichtes nach ca. 25 h ist nicht zu beobachten. 100 Molprozent [%] Zeit [h] 70 Hydrolyseprodukt 100 Abb. 3.14: Hydrolyseverlauf von 70 in H 2. Auch alle übrigen Verbindungen sind als Hydrochloride bzw. Hydrobromide in Wasser stabiler als in PBS (Kapitel 9.1, Seite 210) und zeigen einen ähnlichen Kurvenverlauf. Die in der Literatur [Watts, 140] beschriebene Abnahme der Hydrolyserate bei niedrigerem ph-wert zeigt sich auch bei 4,5-Diarylimidazolinen. Des Weiteren konnten für die in PBS stabilen Verbindungen 83, 88 und 90 auch in H 2 keine Hydrolyseprodukte detektiert werden. Auf Grund des unterschiedlichen Verlaufs der Hydrolyse in Wasser und PBS ist es wahrscheinlich, dass die Hydrolyse in Wasser nach einem anderen Mechanismus abläuft. Der ph-wert der Verbindungen in Wasser (ph = 5 6) ist niedriger als der ph der PBS-Lösungen (ph = 7.4). Das Gleichgewicht zwischen freier Base und protonierter Form des Imidazolins ist dadurch noch stärker zur protonierten Form hin verschoben. Die pk s -Werte der Verbindungen üben daher fast keinen Einfluss auf die Hydro-
19 3 Stabilitätsuntersuchungen 69 lysegeschwindigkeit aus. Die Konzentration des ukleophils ist ca. 100-mal niedriger als bei ph 7.4 in PBS. Wahrscheinlicher ist es daher, dass Wasser das nukleophile Agens der Reaktion darstellt. Die nicht zu beobachtende Rückreaktion des gebildeten Amids zum Imidazolin, lässt auf eine irreversible Reaktion schließen. Der vermutliche Reaktionsmechanismus der Hydrolyse in Wasser ist in Abb dargestellt. R R R R H + R + H 2 k H HR + H + H Abb. 3.15: Reaktionsmechanismus der Hydrolyse in Wasser. ln (Molprozent) Zeit [h] 70 Abb. 3.16: Semilogarithmische Darstellung des Hydrolyseverlauf von 70 in H 2. Derartige Reaktionen sind pseudoerster rdnung, wenn ein Reaktionspartner in großem Überschuss vorhanden ist. Dies ist in diesem Fall H 2, das als ukleophil am C2 des Imidazolins angreift. Die Hydrolyse des Imidazolins 70 und der weiteren instabilen Verbindungen verläuft während des Beobachtungszeitraums in Wasser linear (Abb. 3.16). Die Geschwindigkeitskonstanten von 70 und der übrigen Verbindungen lassen sich somit nach pseudoerster rdnung ermitteln. Sie sind in Tab. 3.4 zusammengefasst.
20 70 3 Stabilitätsuntersuchungen R 1 R 2 R3 Verbindung R 1 R 2 R 3 Konfiguration k obs [h -1 ] 40 2-, 4-CH 3 2-, 4-CH 3 H (4R,5S)/(4S,5R) H (4R,5S)/(4S,5R) , 4-2-, 4- H (4R,5S)/(4S,5R) , 4-2-, 4- H (4R,5R)/(4S,5S) ,6-2, 4-2-, 4- H (4R,5S)/(4S,5R) , 4-2-, 4- Ethyl (4R,5S)/(4S,5R) , 4-2-, 4- Tab. 3.4: Geschwindigkeitskonstanten der untersuchten Verbindungen in H 2. H (4R,5S)/(4S,5R) Erwartungsgemäß sind am Imidazolinring substituierte Verbindungen (83, 86, 88 und 90) auch in Wasser stabiler als die entsprechende am Ring nicht substituierte Verbindung 70, wobei wiederum nur bei der -ethylierten Verbindung 86 Hydrolysevorgänge beobachtet wurden. Die Gründe hierfür wurden bereits in Kapitel dargestellt. Verbindung Verhältnis k obs (PBS) / k obs (H 2 ) Tab. 3.5: Vergleich der Geschwindigkeitskonstanten k obs in H 2 und PBS Betrachtet man die Verhältnisse der Geschwindigkeitskonstanten k obs in PBS und der Geschwindigkeitskonstanten k obs in Wasser der Verbindungen (Tab. 3.5) zeigt sich, dass die Hydrolyse in Wasser bei 68, 71, 72 und 86 ca. zehnmal langsamer stattfindet. Deutlich höhere Verhältnisse ergeben sich für die Verbindungen 40, 70 und 96 (Faktor > 25). Diese drei Verbindungen haben in den Aromaten ortho-chlorsubstituenten und sind am Imidazolinring nicht weiter substituiert.
21 3 Stabilitätsuntersuchungen 71 Wie gezeigt werden konnte, verläuft die Hydrolyse der Verbindungen in PBS und Wasser nach unterschiedlichen Mechanismen. In PBS sind zwei, aufeinander folgende Gleichgewichtreaktionen an der Hydrolyse beteiligt. Der erste Reaktionsschritt stellt dabei die Einstellung eines Gleichgewichts zwischen protonierter und nicht protonierter Form der Verbindungen dar. Im zweiten, geschwindigkeitsbestimmenden Schritt findet ein nukleophiler Angriff von an der protonierten Form statt. Die Hydrolyse in Wasser ist im Gegensatz dazu eine irreversible Reaktion, die nach einem Mechanismus pseudoerster rdnung abläuft. Da bei ph 5 6 nicht in ausreichender Menge vorhanden ist, ist Wasser das nukleophile Agens, das wiederum die protonierten Verbindungen angreift. Da Wasser ein schlechteres ukleophil als ist, sind alle untersuchten Verbindungen in H 2 wesentlich stabiler als in PBS.
22
5 HPLC-Methodenentwicklung zur Isomerentrennung
 HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
5. Kinetische Untersuchungen zur Hydrolyse der 1,3,2-Dioxaborine
 54 5. Kinetische Untersuchungen zur ydrolyse der 1,3,2Dioxaborine 1,3,2Dioxaborine sind in basisch wässrigen dien größtenteils hydrolyseempfindlich. Durch die kinetische Untersuchung der ydrolyse sind
54 5. Kinetische Untersuchungen zur ydrolyse der 1,3,2Dioxaborine 1,3,2Dioxaborine sind in basisch wässrigen dien größtenteils hydrolyseempfindlich. Durch die kinetische Untersuchung der ydrolyse sind
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
7 Kernresonanz-Spektroskopische Untersuchungen
 7 Kernresonanz-Spektroskopische Untersuchungen 79 7 Kernresonanz-Spektroskopische Untersuchungen 7.1 1 H-MR-Signale Die 1 H-MR-Spektroskopie liefert aufgrund der charakteristischen chemischen Verschiebung
7 Kernresonanz-Spektroskopische Untersuchungen 79 7 Kernresonanz-Spektroskopische Untersuchungen 7.1 1 H-MR-Signale Die 1 H-MR-Spektroskopie liefert aufgrund der charakteristischen chemischen Verschiebung
lg k ph Profil Versuchsprotokoll Versuch Flüssig D2 1. Stichworte
 Paul Elsinghorst, Jürgen Gäb, Carina Mönig, Iris Korte Versuchsprotokoll Versuch Flüssig D2 lg k ph Profil 1. Stichworte Reaktionskinetik, Reaktionsordnung, Reaktionsmolekularität Stabilität von wässrigen
Paul Elsinghorst, Jürgen Gäb, Carina Mönig, Iris Korte Versuchsprotokoll Versuch Flüssig D2 lg k ph Profil 1. Stichworte Reaktionskinetik, Reaktionsordnung, Reaktionsmolekularität Stabilität von wässrigen
ATTO 565 und ATTO 590
 ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
ATTO 565 und ATTO 590 Allgemeine Informationen ATTO 565 und ATTO 590 sind Fluoreszenzmarker aus der Familie der Rhodamin-Farbstoffe. Diese Farbstoffe besitzen als gemeinsames Strukturelement einen Carboxyphenyl-
Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl -
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen in Bezug auf nachfolgende Reaktionsgleichung ist falsch? HCl + NH3 NH4 + + Cl - A) Salzsäure ist eine stärkere
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 13.02.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 13.02.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
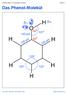 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Fragen zum Versuch Kinetik:
 Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Übungsblatt 9: Reaktionsdiversität
 1 Übungsblatt 9: Reaktionsdiversität Warm Up Benennen Sie die folgenden (Thio )Ether: Aufgaben 1) Alkohole und Thiole i. Während das 1,2 Dibromethan bevorzugt in der fully staggered Konformation vorliegt,
1 Übungsblatt 9: Reaktionsdiversität Warm Up Benennen Sie die folgenden (Thio )Ether: Aufgaben 1) Alkohole und Thiole i. Während das 1,2 Dibromethan bevorzugt in der fully staggered Konformation vorliegt,
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Grundlagen der Kinetik
 Kapitel 1 Grundlagen der Kinetik In diesem Kapitel werden die folgenden Themen kurz wiederholt: Die differenziellen und integralen Geschwindigkeitsgesetze von irreversiblen Reaktionen., 1., und. Ordnung
Kapitel 1 Grundlagen der Kinetik In diesem Kapitel werden die folgenden Themen kurz wiederholt: Die differenziellen und integralen Geschwindigkeitsgesetze von irreversiblen Reaktionen., 1., und. Ordnung
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Mehrprotonige Säuren haben ihren ersten EP ebenfalls bei τ = 1. Links: Gleichgewicht bei Produkten, Rechts: Gleichgewicht zw. Edukten/ Produkten
 AnChe2 Kapitel 8: Titrimetrie Voraussetzungen für eine Titration: Quantitative Umsetzung (k >> 1) Eindeutige Stöchiometrie Hohe Reaktionsgeschwindigkeit Präzise Ermittlung des EP Präzise Einstellung der
AnChe2 Kapitel 8: Titrimetrie Voraussetzungen für eine Titration: Quantitative Umsetzung (k >> 1) Eindeutige Stöchiometrie Hohe Reaktionsgeschwindigkeit Präzise Ermittlung des EP Präzise Einstellung der
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion:
 Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]
![= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s] = Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]](/thumbs/94/122358469.jpg) Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
Grundlagen der Chromatographie
 Grundlagen der Chromatographie Was ist Chromatographie? Trennung ähnlicher Moleküle aus komplexen Gemischen o Die Analyte werden in einer mobilen Phase gelöst und darin durch eine stationäre Phase transportiert.
Grundlagen der Chromatographie Was ist Chromatographie? Trennung ähnlicher Moleküle aus komplexen Gemischen o Die Analyte werden in einer mobilen Phase gelöst und darin durch eine stationäre Phase transportiert.
Schriftliche Prüfung BSc Frühling 2014
 Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease.
 A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006
 Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
Vorlesung Organische Chemie II, Teil 2, WS 2008/09. Trainings-Aufgabenset Nr. 3: Eliminierungsreaktionen
 Vorlesung rganische Chemie II, Teil 2, WS 2008/09 rof. r. Christoph A. Schalley Trainings-Aufgabenset r. 3: Eliminierungsreaktionen Aufgabe 1 a) Welche drei prototypische Eliminierungsmechanismen kennen
Vorlesung rganische Chemie II, Teil 2, WS 2008/09 rof. r. Christoph A. Schalley Trainings-Aufgabenset r. 3: Eliminierungsreaktionen Aufgabe 1 a) Welche drei prototypische Eliminierungsmechanismen kennen
Übungsaufgaben zur HPLC für Biolaboranten
 Übungsaufgaben zur HPLC für Biolaboranten 1.1 Trennung von Paracetamol und HPLC Im LTC-Praktikum wurde in einer Kalibrierlösung Paracetamol und Coffein über eine HPLC getrennt. Bedingungen: β(cof) = 12,5
Übungsaufgaben zur HPLC für Biolaboranten 1.1 Trennung von Paracetamol und HPLC Im LTC-Praktikum wurde in einer Kalibrierlösung Paracetamol und Coffein über eine HPLC getrennt. Bedingungen: β(cof) = 12,5
E. Zusammenfassung. E. Zusammenfassung
 E. Zusammenfassung Seit den 1960er Jahren wird die Frage untersucht, ob elektronenreiche (insbesondere tetraaminosubstituierte) Alkene, an ihrer Doppelbindung dissoziieren können [99][100]. Spaltungsprodukte
E. Zusammenfassung Seit den 1960er Jahren wird die Frage untersucht, ob elektronenreiche (insbesondere tetraaminosubstituierte) Alkene, an ihrer Doppelbindung dissoziieren können [99][100]. Spaltungsprodukte
Seminar HPLC. Seminar HPLC / WS 2003/04. Dr. R. Vasold
 Seminar HPLC 1 2 Analytik - Abteilung Institut für Organische Chemie Prof. B. König Kapitel I Theoretischer Teil 3 I.1 Einleitung I.2 Zielsetzung I.3 Die stationäre Phase I.4 Die mobile Phase I.5 Die Pumpe
Seminar HPLC 1 2 Analytik - Abteilung Institut für Organische Chemie Prof. B. König Kapitel I Theoretischer Teil 3 I.1 Einleitung I.2 Zielsetzung I.3 Die stationäre Phase I.4 Die mobile Phase I.5 Die Pumpe
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 3. Klausur zum Praktikum rganische hemie I für Studierende der hemie und der Biochemie im SS 2002 am Dienstag, dem 16. Juli 2002 ame:... Vorname:... Matrikelnummer:...
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k
![Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k Reaktionskinetik. bimolekularen Reaktion. Für die Konzentraton des Dinitrochlorbenzols [a] gilt: = k](/thumbs/42/22840880.jpg) Versuche des Kapitel 7 Reaktionskinetik Einleitung Die Reaktion von Piperidin mit Dinitrochlorbenzol zum gelben Dinitrophenylpiperidin soll auf die Geschwindigkeitskonstante und die Arrheniusparameter
Versuche des Kapitel 7 Reaktionskinetik Einleitung Die Reaktion von Piperidin mit Dinitrochlorbenzol zum gelben Dinitrophenylpiperidin soll auf die Geschwindigkeitskonstante und die Arrheniusparameter
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Analytische Chemie (für Biol. / Pharm. Wiss.)
 Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst Laboratory of Organic Chemistry HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/
Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst Laboratory of Organic Chemistry HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Kapitel 3. Nucleophile Substitution
 Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
C Säure-Base-Reaktionen
 -V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
-V.C1- C Säure-Base-Reaktionen 1 Autoprotolyse des Wassers und ph-wert 1.1 Stoffmengenkonzentration Die Stoffmengenkonzentration eines gelösten Stoffes ist der Quotient aus der Stoffmenge und dem Volumen
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 03.02.2016 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 03.02.2016 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Schriftliche Prüfung BSc Herbst 2013
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Die Kleinen im Juni 2014 von Dr. Stavros Kromidas, Saarbrücken
 Die Kleinen im Juni 2014 von Dr. Stavros Kromidas, Saarbrücken Liebe HPLC-Anwenderinnen, liebe HPLC-Anwender, wie in jedem Jahr wollen wir uns in den Monaten Juni-August mit kleinen Tipps beschäftigen,
Die Kleinen im Juni 2014 von Dr. Stavros Kromidas, Saarbrücken Liebe HPLC-Anwenderinnen, liebe HPLC-Anwender, wie in jedem Jahr wollen wir uns in den Monaten Juni-August mit kleinen Tipps beschäftigen,
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Herstellung und Oxidation von 2,4,6-Tri-tert-butylphenol
 2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
Lösungen 10 (Kinetik)
 Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
4 Synthesen antiprionen-aktiver Verbindungen
 4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
4 Synthesen antiprionen-aktiver Verbindungen Quinacrinanaloga (Grundstruktur C) 77 4 Synthesen antiprionen-aktiver Verbindungen 4.1 Synthesen der Quinacrinanaloga (Grundstruktur C) Die Synthesen der Quinacrinanaloga
9 Aromaten. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
EinFaCh 2. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik. tu-freiberg.
 Studienvorbereitung Chemie EinFaCh 2 Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was bedeutet Chemische Reaktionskinetik?
Studienvorbereitung Chemie EinFaCh 2 Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was bedeutet Chemische Reaktionskinetik?
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
Peaky und Chromy in Frankfurt - die richtigen Antworten
 Der HPLC-Tipp im Januar 2013 Peaky und Chromy in Frankfurt - die richtigen Antworten von Dr. Stavros Kromidas, Saarbrücken Liebe Leser, im Dezember-Tipp hatte ich Ihnen vom Gespräch zwischen Peaky und
Der HPLC-Tipp im Januar 2013 Peaky und Chromy in Frankfurt - die richtigen Antworten von Dr. Stavros Kromidas, Saarbrücken Liebe Leser, im Dezember-Tipp hatte ich Ihnen vom Gespräch zwischen Peaky und
Übung Nr. 13. Vorlesung Allgemeine Chemie II Teil Organische Chemie Frühjahrssemester Mi bzw. Fr
 Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
Übung Nr. 13 Mi. 30.05.2012 bzw. Fr. 01.06.2012 1. Eliminierungen I Geben Sie für die untenstehenden Reaktionen die jeweiligen Produkte an! Um welche Namensreaktion handelt es sich? Welcher Typ Eliminierung
Versuchsprotokoll Kapitel 6
 Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Zusammenfassung 101 L 2 H 3
 Zusammenfassung 101 6. Zusammenfassung In dieser Arbeit gelang zum ersten Mal die Synthese und Charakterisierung von Übergangsmetall koordinierten Anilinoradikalen. Die Eigenschaften der koordinierten
Zusammenfassung 101 6. Zusammenfassung In dieser Arbeit gelang zum ersten Mal die Synthese und Charakterisierung von Übergangsmetall koordinierten Anilinoradikalen. Die Eigenschaften der koordinierten
Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Dienstag, 13. August 2013 Schriftliche Prüfung BSc Herbst 2013 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Grundwissen Chemie 9. Jahrgangsstufe G8
 Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Grundwissen Chemie 9. Jahrgangsstufe G8 Ionennachweise Man nutzt die Schwerlöslichkeit vieler Salze (z. B. AgCl) zum Nachweis und zur quantitativen Bestimmung der Ionen. Nachweis molekular gebauter Stoffe
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2
 Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen. c(a) t. v = -
 REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
6 Zusammenfassung und Ausblick
 6. Zusammenfassung und Ausblick 117 6 Zusammenfassung und Ausblick Der Schwerpunkt dieser Arbeit lag in stationären und instationären Untersuchungen zur Methanolsynthese. Ein Ziel war, den Einfluss der
6. Zusammenfassung und Ausblick 117 6 Zusammenfassung und Ausblick Der Schwerpunkt dieser Arbeit lag in stationären und instationären Untersuchungen zur Methanolsynthese. Ein Ziel war, den Einfluss der
2. Wiederholungsklausur OC1 (BA-Studiengang) :00 16:00 Uhr M1 C-Bau. Name: Punkte: Matrikel Nr. Note:
 2. Wiederholungsklausur C1 (BA-Studiengang) PI: 07.04.2011 13:00 16:00 Uhr M1 C-Bau ame: Punkte: Matrikel r. ote: otenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7
2. Wiederholungsklausur C1 (BA-Studiengang) PI: 07.04.2011 13:00 16:00 Uhr M1 C-Bau ame: Punkte: Matrikel r. ote: otenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7
Beispielaufgaben IChO 2. Runde 2019 Säurederivate. H2, Pd/C
 Beispielaufgaben Ih 2. Runde 2019 Säurederivate Beispiel 1 ligocarbonsäuren Gegeben sei folgendes Reaktionsschema: A H2, Pd/ H 2, Lindlar Na/NH 3(l) B D Base E A hat eine molare Masse von 118,09 g mol
Beispielaufgaben Ih 2. Runde 2019 Säurederivate Beispiel 1 ligocarbonsäuren Gegeben sei folgendes Reaktionsschema: A H2, Pd/ H 2, Lindlar Na/NH 3(l) B D Base E A hat eine molare Masse von 118,09 g mol
1. a) Geben sie den Reaktionsmechanismus für die Nitrierung und die Sulfonierung von Benzol an. Beginnen sie mit der Erzeugung des Elektrophils.
 Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Vorlesung Allgemeine Chemie Teil Physikalische Chemie WS 2009/10
 Vorlesung Allgemeine Chemie Teil Physikalische Chemie WS 2009/10 Dr. Lars Birlenbach Physikalische Chemie, Universität Siegen Raum AR-F0102 Tel.: 0271 740 2817 email: birlenbach@chemie.uni-siegen.de Lars
Vorlesung Allgemeine Chemie Teil Physikalische Chemie WS 2009/10 Dr. Lars Birlenbach Physikalische Chemie, Universität Siegen Raum AR-F0102 Tel.: 0271 740 2817 email: birlenbach@chemie.uni-siegen.de Lars
Das Chemische Gleichgewicht
 Das Chemische Gleichgewicht 2 Ein chemisches Gleichgewicht herrscht dann, wenn Hin- sowie Rückreaktion gleich schnell ablaufen. Die Reaktionsgeschwindigkeit der Gesamtreaktion erscheint daher gleich null,
Das Chemische Gleichgewicht 2 Ein chemisches Gleichgewicht herrscht dann, wenn Hin- sowie Rückreaktion gleich schnell ablaufen. Die Reaktionsgeschwindigkeit der Gesamtreaktion erscheint daher gleich null,
ALDEHYDE & KETONE. Referat über die Carbonylverbindungen: Aldehyde und Ketone Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium
 ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
Vorbemerkung: In den Abbildungen weiter unten werden Chromatogramm-Ausschnitte aus längeren Läufen gezeigt.
 Der HPLC-Tipp im Mai Die Vorsäule nicht nur als Vorsäule zu nutzen von Dr. Stavros Kromidas, Saarbrücken Der Fall Mit einigen Anwendern habe ich vor Ort ein Paar einfache Optimierungsexperimente durchgeführt.
Der HPLC-Tipp im Mai Die Vorsäule nicht nur als Vorsäule zu nutzen von Dr. Stavros Kromidas, Saarbrücken Der Fall Mit einigen Anwendern habe ich vor Ort ein Paar einfache Optimierungsexperimente durchgeführt.
[A] = c(a) in den Einheiten mol/l (1) Eine tiefgestellte Null wie bei [A] 0 zeigt an, dass es sich um eine Anfangskonzentration
![[A] = c(a) in den Einheiten mol/l (1) Eine tiefgestellte Null wie bei [A] 0 zeigt an, dass es sich um eine Anfangskonzentration [A] = c(a) in den Einheiten mol/l (1) Eine tiefgestellte Null wie bei [A] 0 zeigt an, dass es sich um eine Anfangskonzentration](/thumbs/66/55829074.jpg) 1 Ableitung des Massenwirkungsgesetzes Mit dem Umfüllexperiment haben wir herausgefunden, dass die Stoffmengen oder die Stoffmengenkonzentrationen im Gleichgewicht auf einen Grenzwert zulaufen. Außerdem
1 Ableitung des Massenwirkungsgesetzes Mit dem Umfüllexperiment haben wir herausgefunden, dass die Stoffmengen oder die Stoffmengenkonzentrationen im Gleichgewicht auf einen Grenzwert zulaufen. Außerdem
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Bestimmung ausgewählter Aminosäuren in Fruchtsäften mit HPLC
 Bioanalytik Praktikum HPLC 1 Bestimmung ausgewählter Aminosäuren in Fruchtsäften mit HPLC 1 Theorie 1.1 Hochleistungsflüssigkeitschromatographie Die Chromatographie ermöglicht es Substanzgemische in die
Bioanalytik Praktikum HPLC 1 Bestimmung ausgewählter Aminosäuren in Fruchtsäften mit HPLC 1 Theorie 1.1 Hochleistungsflüssigkeitschromatographie Die Chromatographie ermöglicht es Substanzgemische in die
Schriftliche Prüfung BSc Frühling 2008
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 05: Darstellung von 2-Chlor-2 Methylpropan Reaktion: Chemikalien:
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
DIE PARAMETER DES DAD WIE UNTERSCHIEDLICHE PARAMETEREINSTELLUNGEN DAS CHROMATOGRAMM BEEINFLUSSEN KÖNNEN.
 DIE PARAMETER DES DAD WIE UNTERSCHIEDLICHE PARAMETEREINSTELLUNGEN DAS CHROMATOGRAMM BEEINFLUSSEN KÖNNEN. PARAMETER 1: DIE BANDBREITE Die Bandbreite der Messwellenlänge ist ein Parameter, durch den die
DIE PARAMETER DES DAD WIE UNTERSCHIEDLICHE PARAMETEREINSTELLUNGEN DAS CHROMATOGRAMM BEEINFLUSSEN KÖNNEN. PARAMETER 1: DIE BANDBREITE Die Bandbreite der Messwellenlänge ist ein Parameter, durch den die
Die Freie Aktivierungsenthalpie
 Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Pharmakologische Untersuchungen am Estrogenrezeptor
 Pharmakologische Untersuchungen am Estrogenrezeptor 94 5 Pharmakologische Untersuchungen am Estrogenrezeptor 5 Pharmakologische Untersuchungen am Estrogenrezeptor Die synthetisierten Verbindungen wurden
Pharmakologische Untersuchungen am Estrogenrezeptor 94 5 Pharmakologische Untersuchungen am Estrogenrezeptor 5 Pharmakologische Untersuchungen am Estrogenrezeptor Die synthetisierten Verbindungen wurden
Protokoll Kurstag 7. Blatt & Blattpigmente. 1) Einleitung
 Datum: 10.12.09 Protokoll Kurstag 7 Blatt & Blattpigmente 1) Einleitung Einige Pflanzenzellen enthalten spezielle Farbstoffe (Pigmente), um Fotosynthese betreiben zu können, zum Schutz vor UV-Strahlung
Datum: 10.12.09 Protokoll Kurstag 7 Blatt & Blattpigmente 1) Einleitung Einige Pflanzenzellen enthalten spezielle Farbstoffe (Pigmente), um Fotosynthese betreiben zu können, zum Schutz vor UV-Strahlung
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
6011 Hippursäure aus Glycin und Benzoylchlorid
 P 6011 Hippursäure aus Glycin und Benzoylchlorid Cl + H 2 H H H C 7 H 5 Cl C 2 H 5 2 C 9 H 9 3 (140.6) (75.1) (179.2) Klassifizierung Reaktionstypen und Stoffklassen Benzoylierung, Reaktion der Carbonylgruppe
P 6011 Hippursäure aus Glycin und Benzoylchlorid Cl + H 2 H H H C 7 H 5 Cl C 2 H 5 2 C 9 H 9 3 (140.6) (75.1) (179.2) Klassifizierung Reaktionstypen und Stoffklassen Benzoylierung, Reaktion der Carbonylgruppe
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Übungen PC - Kinetik - Seite 1 (von 5)
 Übungsaufgaben PC: Kinetik 1) Für die Umlagerung von cis- in trans-dichlorethylen wurde die Halbwertszeit 245 min gefunden; die Reaktion gehorcht einem Geschwindigkeitsgesetz erster Ordnung. Wie viel g
Übungsaufgaben PC: Kinetik 1) Für die Umlagerung von cis- in trans-dichlorethylen wurde die Halbwertszeit 245 min gefunden; die Reaktion gehorcht einem Geschwindigkeitsgesetz erster Ordnung. Wie viel g
Organische Chemie für Mediziner WS 2016/2017. Übungsblatt 3: Ausgewählte Substanzklassen
 1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie)
 Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie) Nachklausur 18.03.2016 Zeit: 120 min Seite 1 Seite 2 Seite 3 Seite 4 Seite 5 Seite 6 Seite 7 / 18 / 18 / 10 / 10 / 19 / 15 / 10 Gesamt: Note:
Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie) Nachklausur 18.03.2016 Zeit: 120 min Seite 1 Seite 2 Seite 3 Seite 4 Seite 5 Seite 6 Seite 7 / 18 / 18 / 10 / 10 / 19 / 15 / 10 Gesamt: Note:
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Übungen zur Vorlesung Organische Chemie (Teil 2)
 Übungen zur Vorlesung rganische Chemie (Teil 2) K. Hohmann/ J. Massoth/ F. Lehner/ H. Schwalbe Blatt 5 1) Enolat und Enamin Geben Sie das bevorzugte Deprotonierungsprodukt an a) Thermodynamisch kontrolliert
Übungen zur Vorlesung rganische Chemie (Teil 2) K. Hohmann/ J. Massoth/ F. Lehner/ H. Schwalbe Blatt 5 1) Enolat und Enamin Geben Sie das bevorzugte Deprotonierungsprodukt an a) Thermodynamisch kontrolliert
Die Strukturabhängigkeit der chemischen Verschiebung
 Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Die Strukturabhängigkeit der chemischen Verschiebung. Abschirmung in einem Atom (wie bisher geschildert) Die Elektronenverteilung in einem Wasserstoffatom ist sphärisch. B 0 0 0000000 000000000 000000000
Name, Vorname: Matrikelnummer: Studienrichtung: Fragen auf den folgenden Seiten: Musterlösung zur Klausur zur Experimentalvorlesung Organische Chemie
 rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
LUNA HILIC Methodenentwicklungsansatz
 LUA HILIC Polare, hydrophile Substanzen, die im Reversed Phase Modus nicht oder kaum zurückgehalten werden, erfahren im HILIC Modus eine maximale Retention. Dabei beobachtet man häufig eine Umkehr der
LUA HILIC Polare, hydrophile Substanzen, die im Reversed Phase Modus nicht oder kaum zurückgehalten werden, erfahren im HILIC Modus eine maximale Retention. Dabei beobachtet man häufig eine Umkehr der
