ANALYTIK VON KOSMETISCHEN MITTELN UND BEDARFSGEGENSTÄNDEN LMC. Technische Universität Berlin. Skript zum Praktikum V
|
|
|
- Jörn Neumann
- vor 8 Jahren
- Abrufe
Transkript
1 Technische Universität Berlin LMC Lebensmittelchemie Skript zum Praktikum V ANALYTIK VON KOSMETISCHEN MITTELN UND BEDARFSGEGENSTÄNDEN Prof. Dr. L. W. Kroh Dr. B. Cämmerer A. Berghäuser C. Richter Juni 2013
2 INHALTSVERZEICHNIS 1 Allgemeine Analysenverfahren Bestimmung des Trocknungsrückstands Wasserbestimmung (Destillationsmethode) Bestimmung des Glührückstandes (Asche) Bestimmung des Fettgehalts von Cremes durch direkte Extraktion Bestimmung der unverseifbaren Anteile Bestimmung des ph-wertes in kosmetischen Mitteln Fluorid Vortests Quantitative Bestimmung Formaldehyd Vortests Quantitative Bestimmung von Formaldehyd als Dihydrolutidin ( 64 LFGB) Bestimmung der Formaldehydabgabe aus unbeschichteten und beschichteten Spanplatten (WKI-Methode) Tenside Identifizierung von Tensiden mit Dünnschichtchromatografie Quantitative Bestimmung von Tensiden durch Zweiphasentitration Quantitative Bestimmung von Waschmittelrückständen Organische Lösungsmittel Vortests für verschiedene Inhaltsstoffe Methanol 24 Ethanol 24 Propan-2-ol Identifizierung und quantitative Bestimmung von Alkoholen mit Gaschromatografie Konservierungsstoffe und antimikrobiell wirksame Substanzen Vortests auf phenolische Verbindungen Identifizierung mittels DC Quantitative Bestimmung von Benzoe-, Sorbin- und Salicylsäure bzw. Phenoxy ethanol mit HPLC Quantifizierung phenolischer Substanzen (photometrisch) Untersuchung von Textilien auf antimikrobielle Ausrüstung Süßstoffe Identifizierung mit Dünnschichtchromatografie Quantitative Bestimmung von Süßstoffen mit HPLC Identifizierungen weiterer Inhaltsstoffe mit DC Feuchthaltemittel Organische Säuren Farbstoffe quantitative Bestimmung anorganischer Bestandteile Chlorid Phosphat (photometrisch) Silikat Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
3 10 Kunststoffe Identifizierung von Kunststoffen mittels IR-Spektroskopie Migrationsuntersuchungen Gefahrenhinweise für häufig genutzte Chemikalien und Lösungsmittel Allgemeine Entsorgungshinweise 54 Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
4 1 Allgemeine Analysenverfahren Literatur: K. Rauscher, R. Engst, U. Freimuth, Untersuchung von Lebensmitteln, Fachbuchverlag Leipzig R. Matissek, G. Steiner, Lebensmittelanalytik, Springer Verlag Berlin, Bestimmung des Trocknungsrückstands Die Aluschalen werden zusammen mit dem der Oberflächenvergrößerung der Probe dienendem Seesand (max. 5 g) bei 105 C im Trockenschrank konditioniert. 2-3 g Probe werden in eine konditionierte Schale auf 0,5 mg genau eingewogen und drei Stunden bei 105 C getrocknet. Nach dem Abkühlen im Exsikkator wird der Rückstand gewogen. Unter den gleichen Bedingungen schließt sich eine Nachtrocknung von einer halben Stunde an, um eine eventuell unvollständige Trocknung feststellen zu können. Bei stark lösungsmittelhaltigen Proben ist darauf zu achten, dass diese vorher im Abzug abgedampft werden. Probleme bereiten vor allem Proben, die Feuchthaltemittel enthalten, da diese teilweise flüchtig sind. Bei Nichteinhaltung von Trocknungstemperatur und zeit kann dadurch das Ergebnis verfälscht werden. ENTSORGUNG Behälter für kontaminierte Betriebsabfälle 1.2 Wasserbestimmung (Destillationsmethode) PRINZIP Die Bestimmung des Wassergehalts in kosmetischen Mitteln sowie Reinigungs- und Pflegemitteln erfolgt durch azeotrope Destillation unter Verwendung eines mit Wasser nicht mischbaren organischen Lösungsmittels (Toluen). Nach Auftrennung des azeotropen Gemischs kann das Volumen des wieder kondensierten Wassers im graduierten Messrohr der Apparatur (siehe Abb.) direkt abgelesen werden und ergibt bezogen auf die Einwaage den Wassergehalt der Probe. Diese Art der Wasserbestimmung ist für lösungsmittelhaltige Proben (> ca. 5 %) nicht geeignet. REAGENZIEN Toluen Natriumoleat oder -stearat Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
5 AUSFÜHRUNG Je nach zu erwartendem Wassergehalt werden g der zu untersuchenden Probe genau in einen Rundkolben eingewogen. Dann werden (je nach Probenmenge) ml Toluen, einige Siedesteinchen und ca. 1-2 g Natriumoleat (Antischaummittel) hinzu gegeben. Nach Aufbau der Apparatur (siehe Abb. 1) wird, besonders bei stark schäumenden Proben, langsam bis zum Sieden erhitzt. Das Destillat sammelt sich nach Kondensation in dem graduierten Rohr, das vorher bis zur Nullmarke mit Wasser aufgefüllt wurde. Dort trennen sich die Phasen wieder. Wenn sich kein Wasser mehr absetzt und das Toluen klar kondensiert, wird die Destillation beendet. Falls Wassertropfen an der Wand des Destillieraufsatzes haften geblieben sind, sollten diese z. B. durch Klopfen oder Abstreifen mit einem Draht zum Abfließen gebracht werden. Als Antischaummittel kann statt Natriumoleat auch trockenes Paraffin verwendet werden. Silikonhaltige Antischaummittel sind ungeeignet, da das einwandfreie Abtropfen des Wassers beeinträchtigt wird. Besonders wichtig ist die sorgfältige Reinigung der Apparatur vor dem Gebrauch. Insbesondere das Zwischenstück und der Rückflusskühler müssen fettfrei sein. Abb.1: Versuchsaufbau zur azeotropen Wasserdestillation GEFAHRENHINWEISE Toluen: gesundheitsgefährlich, leicht entzündlich R 11-20/ ENTSORGUNG wässrige halogenhaltige Lösungsmittelabfälle Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
6 1.3 Bestimmung des Glührückstandes (Asche) AUSFÜHRUNG 2-3 g Probe werden in einen bei 550 C oder 600 C konditionierten Porzellantiegel genau eingewogen und auf der Bunsenbrennerflamme vorverascht. Bei lösungsmittelhaltigen Proben muss das Lösungsmittel vorher auf geeignete Weise (Abzug, Trockenschrank) weitgehend entfernt werden. Die vorveraschten Proben werden bei 550 C im Muffelofen bis zur Gewichtskonstanz geglüht. Falls die Asche nicht reinweiß ist, wird der Vorgang nach Zugabe von ca. 2 ml 30 %igem H 2 O 2 wiederholt. (! Vorsicht bei heißem Tiegel!) Der Porzellantiegel mit der Asche wird im Exsikkator abgekühlt und anschließend gewogen. 1.4 Bestimmung des Fettgehalts von Cremes durch direkte Extraktion PRINZIP Die wasserfreie Probe wird mit Diethylether oder Petroleumbenzin extrahiert und anschließend der lösungsmittelfreie, trockene Extraktionsrückstand gravimetrisch bestimmt. AUSFÜHRUNG Etwa 5-10 g der Cremeprobe werden wie unter 1.1 beschrieben getrocknet, genau in eine Extraktionshülse eingewogen und in die Soxhletapparatur eingesetzt. Ein mit Siedesteinen versehener, vorgetrockneter und genau ausgewogener Rundkolben wird mit einer ausreichenden Menge Lösungsmittel befüllt und an die Apparatur angeschlossen. Die Extraktion auf dem siedenden Wasserbad dauert etwa 4-6 Stunden. Nach Beendigung wird das Lösungsmittel weitgehend abdestilliert und das im Kolben verbliebene Fett im Trockenschrank bei 103 C getrocknet. Nach dem Abkühlen im Exsikkator wird ausgewogen. 1.5 Bestimmung der unverseifbaren Anteile PRINZIP Das Unverseifbare umfasst die natürlichen unverseifbaren Begleitstoffe der Fette sowie die häufig als Cremebasis verwendeten Paraffinöle. Sie sind nach alkalischer Hydrolyse des Fettes aus der wässrigen Lösung mit Diethylether oder Petrolether extrahierbar. AUSFÜHRUNG Etwa 5 g des Fettes werden genau in einen Rundkolben eingewogen, mit 50 ml 1 N ethanolischer KOH versetzt und 1 Stunde im Wasserbad am Rückfluss gekocht. Die warme Lösung wird in einen Scheidetrichter überführt, der Kolben mit Wasser nachgespült und nach dem Abkühlen mehrfach mit Petroleumbenzin (in Summe ca. 100 ml) ausgeschüttelt. Die vereinigten Petroletherphasen werden mit ca. 40 ml Wasser gewaschen, und anschließend mit 50 %igem Ethanol ausgeschüttelt bis der Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
7 Petrolether neutral reagiert. Der Petrolether wird durch Zugabe von 1-2 g Natriumsulfat getrocknet und in einen vorher getrockneten und gewogenen Rundkolben filtriert. Nach Entfernen des Lösungsmittels wird die im Kolben verbliebene Probe im Trockenschrank bei 103 C getrocknet. Nach dem Abkühlen im Exsikkator wird ausgewogen. 1.6 Bestimmung des ph-wertes in kosmetischen Mitteln Literatur: J. Hild, Dt. Lebensm. Rundschau 80 (1983) Mit Ausnahme von wässrigen Zubereitungen kann der ph-wert in kosmetischen Mitteln nicht direkt gemessen werden, sie müssen zur Bestimmung verdünnt und/oder homogenisiert werden. Emulsionen (W/O und O/W) und tensidhaltige Zubereitungen (Shampoo..) 1 Teil Probe mit 9 Teilen Wasser homogenisieren und vermessen Zahnpasten 1 Teil Probe mit 3 Teilen Wasser homogenisieren und vermessen alkoholische Proben 1 Teil Probe mit 3 Teilen Wasser verdünnen Die Bestimmung des ph-wertes erfolgt elektrochemisch mit Hilfe einer ph-messelektrode. Da der leicht saure ph-wert des dest. Wassers die Messung verfälscht, wird hierfür Leitungswasser genommen. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
8 2 Fluorid 2.1 Vortests Für Vortests auf Fluorid siehe entsprechende Lehrbücher der anorganischen Chemie 2.2 Quantitative Bestimmung PRINZIP Das Fluorid wird durch Isothermdestillation (Mikrodiffusion) von der Probenmatrix abgetrennt und spektralphotometrisch nach der Alizarin-Komplexon-Methode bestimmt. Literatur: J. Bäumler, E. Glinz; Mitt. Lebensmittel-Unters. Hyg (1964) REAGENZIEN NaF methanolische NaOH 60 %ige Perchlorsäure 1 N NaOH 1 N HCl Natriumacetat Eisessig Aceton 0,0005 M Alizarinkomplexon-Lösung (3,4-Dihydroanthrachinon-2-yl-methylimino-diessigsäure) 192,4 mg Alizarinkomplexon werden in 50 ml H 2 O suspendiert und so lange frisch angesetzte 1 N NaOH hinzugetropft, bis sich das Komplexon gelöst hat (etwa 4 ml). Nach Zufügen von 900 ml H 2 O wird durch vorsichtige Zugabe von ca. 4 ml 1 N HCl ein ph-wert von 5,0 eingestellt. Nach Überspülen in einen 1000 ml Messkolben wird aufgefüllt und die Lösung in einer braunen Flasche im Dunkeln aufbewahrt. (3-4 Wochen haltbar) 0,0005 M Cer-(III)-nitrat-Lösung 216 mg Cer-(III)-nitrat x 6 H 2 O werden mit H 2 O auf 1 Liter aufgefüllt. Acetatpuffer (ph = 4,3): 105 g Natriumacetat (CH 3 COONa x 3 H 2 O) und 100 ml Eisessig werden mit H 2 O auf 1 L verdünnt und auf ph 4,3 eingestellt. Reagenzienmischung für 12 Bestimmungen 100 ml Alizarin-Komplexon-Lösung 20 ml Pufferlösung 100 ml Cer(III)nitratlösung 200 ml Aceton werden in einen 500 ml Messkolben gegeben, die Mischung auf 20 C gebracht und mit Wasser zur Marke aufgefüllt. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
9 Diese Mischung muss immer frisch hergestellt werden. AUSFÜHRUNG Isolierung aus der Probenmatrix Die Deckelinnenseiten einer entsprechenden Anzahl von Petrischalen werden mit 0,5 ml 0,1 N methanolischer NaOH vollständig benetzt und bei 60 C kurz getrocknet. Ca. 200 mg Zahnpasta werden in einen 100 ml Messkolben genau eingewogen, mit ca. 50 ml dest. Wasser versetzt, gut gerührt und evtl. im Ultraschallbad behandelt. Anschließend wird bis zur Marke aufgefüllt. 2 ml dieser Suspension (entspricht ca. 5-8 µg F - ) werden auf einen Petrischalenboden pipettiert und mit 4 ml 60 %iger Perchlorsäure versetzt. Anschließend wird sofort mit dem vorbehandelten Deckel verschlossen. Die Schalen werden gestapelt, beschwert und über Nacht (ca. 16 h) bei 60 C in den Trockenschrank gestellt. Bei flüssigen Proben (Mundwasser) werden 2 ml (ca. 2 g - Dichte bestimmen!!) in einem 250 ml Messkolben pipettiert und mit dest. Wasser bis zur Marke aufgefüllt. 2 ml davon (entspricht bei 0.05% Gehalt ca. 8µg F-) werden auf den Petrischalenboden pipettiert und mit 4 ml Perchlorsäure versetzt. Die Probe wird wie oben beschrieben weiterbehandelt. Bildung des Farbkomplexes Nach 16 h werden die Petrischalen vorsichtig aus dem Trockenschrank genommen und abkühlen gelassen. Das sich auf den Deckelinnenseiten abgesetzte NaF wird vollständig mit insgesamt ca. 40 ml Wasser gründlich eluiert. Das Eluat wird in einen 100 ml Messkolben überführt, mit genau 40 ml Reagenzienmischung versetzt und 1 h im Dunkeln stehengelassen. Nach Auffüllen der Messkolben mit Wasser wird die Extinktion bei 620 nm gegen einen gleich behandelten Reagenzienblindwert gemessen. Aufstellung der Kalibriergeraden Die in der Probe enthaltene Fluoridmenge wird über eine Kalibriergerade berechnet. Dazu wird eine Standardlösung von 221 mg NaF/1 L Wasser hergestellt und diese entsprechend verdünnt. Es sollten in den für die Kalibriergerade verwendeten Lösungen 1 bis maximal 5 µg F - /ml (bei Auftragen von 2 ml bedeutet das 2 bis 10µg F- im Ansatz zur Bildung des Farbkomplexes) enthalten sein. Zum Ausschließen von systematischen Fehlern werden die Standards für die Kalibrierung genauso wie die Probe der Mikrodiffusion unterworfen. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
10 GEFAHRENHINWEISE Cer-III-nitrat: brandfördernd, gesundheitsschädlich R 8-41 Natriumfluorid: giftig R /38 Perchlorsäure: brandfördernd, ätzend R ENTSORGUNGSHINWEISE Proben und Kalibrierlösungen einschließlich nicht benötigter Reagenzienlösung in den Behälter für Schwermetallabfälle Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
11 3 Formaldehyd 3.1 Vortests Reaktion mit Chromotropsäure PRINZIP HCHO addiert elektrophil an Chromotropsäure. Nach Oxidation des Zwischenprodukts reagiert dieses mit einem weiteren Molekül Chromotropsäure zu einer intensiv violett gefärbten Substanz. REAGENZIEN konz. H 2 SO 4 Chromotropsäure AUSFÜHRUNG Etwas Probe wird mit 2 ml konz. H 2 SO 4 und einigen Kristallen Chromotropsäure 10 min im Wasserbad auf C erhitzt. GEFAHRENHINWEISE Chromotropsäure: gesundheitsschädlich R 36/37/38 Reaktion mit 4-Amino-3-hydrazino-5-mercapto-1,2,4-triazol Literatur: Liem, D.H., Analysis of cosmetics with regard to legislation, PhD 1976, Wageningen PRINZIP Das Triazols bildet mit dem HCHO in einer Carbonylreaktion mit anschließendem Ringschluss eine rotviolett gefärbte Verbindung. REAGENZIEN 4-Amino-3-hydrazino-5-mercapto-1,2,4-triazol 1 %ig gelöst in 1 N NaOH, frisch hergestellt AUSFÜHRUNG Die Probe wird in einer dünnen Schicht auf eine Glasplatte aufgetragen, die mit weißem Papier unterlegt ist. Ein Tropfen des Reagenz wird auf die Probe gegeben. Bei Anwesenheit von Formaldehyd erscheint nach ca. 3 min eine intensive rotviolette Färbung. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
12 3.2 Quantitative Bestimmung von Formaldehyd als Dihydrolutidin ( 64 LFGB) Literatur: Amtliche Sammlung von Untersuchungsverfahren nach 64 LFGB (vormals 35 LMBG), Band III (K), K (EG), Bestimmung der Gesamtmenge an Formaldehyd durch Kolorimetrie PRINZIP In Gegenwart von Ammoniumacetat kondensiert Formaldehyd mit Pentan-2,4-dion zum gelben 3,5- Diacetyl-1,4-dihydrolutidin, das mit Butanol extrahiert und dessen Extinktion photometrisch bei 410nm gemessen wird. Formaldehydabspalter werden durch die Derivatisierung gespalten und mitbestimmt. REAGENZIEN Formaldehyd 0,1 N Iodlösung 1 N NaOH 1 N HCl 0,1 N Natriumthiosulfatlösung Stärkelösung Eisessig Butan-1-ol Acetylaceton für 1 Messreihe (bestehend aus Kalibrierung, Blindwert und Proben) 25 g Ammoniumacetat, 0,2 ml Pentan-2,4-dion (Acetylaceton) und 0,3 ml Eisessig werden in einem 100 ml Messkolben mit dest. H 2 O gelöst und zur Marke aufgefüllt (ph 6,4). Falls der ph- Wert höher liegt, wird er mit ca. 0,1 M HCl eingestellt. Die Lösung sollte stets frisch hergestellt werden. Pufferlösung (1 x pro Praktikum) 75 g Ammoniumacetat und 1 ml Eisessig werden in einem 500 ml-messkolben mit dest. H 2 O gelöst und zur Marke aufgefüllt. AUSFÜHRUNG Bestimmung des Formaldehydgehalts der Stammlösung Zur Herstellung der Stammlösung werden etwa 500 mg Formaldehydlösung genau in einen 100 ml - Messkolben eingewogen und bis zur Marke mit dest. H 2 O aufgefüllt. Der Formaldehydgehalt der Stammlösung wird iodometrisch bestimmt. Hierzu werden 10 ml der hergestellten Stammlösung nach Zugabe von genau 25 ml 0,1 N Iodlösung und 10 ml 1 N NaOH 5 min lang stehengelassen, mit 11 ml 1 N HCl angesäuert und das ausgeschiedene Iod mit 0,1 N Natriumthiosulfatlösung zunächst bis zur Gelbfärbung und nach Zugabe von Stärkelösung bis zum Farbumschlag von violett nach rahm-weiß titriert. 1 ml 0,1 N Iodlösung = 1,501 mg Formaldehyd Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
13 Aufstellung der Kalibrierungsgeraden Aus der Stammlösung wird durch weiteres Verdünnen (z. B. 1:500) eine Formaldehydlösung von ca. 5 mg/l hergestellt. Von dieser Lösung wird 0,1 bis 4 ml (entspricht ca. 0,5-20 µg HCHO absolut) in ein 25 ml graduiertes Reagenzglas mit Stopfen gegeben. Die Lösungen werden mit dest. H 2 O auf ein Gesamtvolumen von 15 ml gebracht, jeweils mit 5 ml Acetylaceton-Reagenz versetzt, geschüttelt und genau 10 min im Thermostaten bei 60 C erhitzt. Anschließend werden die Lösungen rasch abgekühlt (ca. 2 min im Eisbad), mit genau 5 ml Butan-1-ol versetzt und 30 Sekunden lang kräftig geschüttelt. Nach Phasentrennung wird die gelb gefärbte Butanolphase mit einer Pipette vorsichtig abgehebert, in eine Küvette (! keine Kunststoffküvetten verwenden!) überführt und bei 410 nm im Photometer gegen den Reagenzienblindwert gemessen. Sämtliche Arbeitsschritte sind innerhalb von 25 min nach dem Einstellen der Reagenzgläser in das Wasserbad durchzuführen. Bei der Herstellung der Lösungen für die Kalibrierungsgerade sollte unbedingt der in der Probe erwartete Formaldehydgehalt beachtet und die angegebenen Richtwerte für die Kalibriergerade gegebenenfalls angepasst werden. In mit Formaldehydabspaltern konservierten kosmetischen Mitteln ist ein Gehalt von ca. 0,02 % Formaldehyd zu erwarten. Bestimmung des Gehalts der Probe Es wird soviel Probe eingewogen (mindestens 2 verschiedene Einwaagen), dass sie 100 bis 150 µg HCHO enthält und auf 100 ml aufgefüllt (z. B. etwa 500 mg von mit Formaldehydabspaltern konserviertem Kosmetischem Mittel). Der ph-wert der Lösung sollte einen nicht über 6,0 liegen und muss ggf. eingestellt werden. Mit einem aliquoten Teil der Lösung z. B. 5 oder 10 ml (jeweils Doppelbestimmung) wird wie bei der Aufstellung der Kalibrierungsgerade verfahren. Das Gesamtvolumen im Reagenzglas ist vor der Reagenzzugabe mit dest. H 2 O auf 15 ml aufzufüllen. Die Probe wird gegen einen Probenblindwert vermessen. Der Probenblindwert soll die unter Umständen störende Eigenfärbung der Probensubstanz kompensieren. Daraus ergibt sich, dass je nach verwendetem Ausgangsvolumen an Probe entsprechende Blindwerte anzusetzen sind, bei denen das Acetylaceton-Reagenz durch 5 ml Pufferlösung ersetzt wird. GEFAHRENHINWEISE Formaldehyd: giftig R 23/24/ Butan-1-ol: entzündlich, gesundheitsschädlich, reizend R ENTSORGUNG organische Phase in wässrige halogenfreie Lösungsmittelabfälle Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
14 3.3 Bestimmung der Formaldehydabgabe aus unbeschichteten und beschichteten Spanplatten (WKI-Methode) Literatur: EN (1996), Bestimmung der Formaldehydabgabe, Teil 3, Formaldehydabgabe nach der Flaschen-Methode Formaldehydbestimmung nach der WKI-Flaschen-Methode und hiervon abgeleiteten Verfahren, E. Roffael, Holz als Roh- und Werkstoff 46 (1988) PRINZIP Spanplattenklötzchen werden über destilliertem Wasser in einer geschlossenen Polyethylenflasche befestigt und bei konstanter Temperatur stehen gelassen. Anschließend wird der im destillierten Wasser absorbierte Formaldehyd analytisch bestimmt. Zur Wahl stehen die iodometrische Titration und der spektrophotometrische Nachweis als Dihydrolutedin. AUSFÜHRUNG Aus den Platten werden Klötzchen mit den ungefähren Maßen 25 mm x 25 mm x Dicke geschnitten. Die Versuchsmuster (etwa g) werden genau gewogen und mit Gummibändern über genau 50 ml dest. Wasser in einer 500 ml fassenden Polyethylenflasche befestigt (siehe Abb. 2) Doppelbestimmung!!. Die fest verschlossenen Flaschen werden bei der gewünschten Temperatur (in der Regel 40 C) im Trockenschrank für unterschiedlich lange Zeiten (üblicherweise 24 h) stehen gelassen. Danach werden die geschlossenen Flaschen 30 min bis 60 min abgekühlt (in kaltem Wasser oder im Kühlschrank), um eine vollständige Absorption des Formaldehyds zu erreichen. Der Formaldehyd wird danach iodometrisch oder photometrisch (siehe Kap. 3.2) bestimmt und auf das Plattengewicht [mg/kg] bezogen. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
15 Abb.2 : Versuchsanordnung der WKI-Flaschenmethode Die mit Hilfe der WKI-Flaschen-Methode ermittelten Formaldehydabgabewerte sind weitgehend unabhängig von der Plattenfeuchte, da die eingebrachten, vergleichsweise kleinen, Probekörper während der Prüfung in den WKI-Flaschen Feuchte aufnehmen und mit dem Umgebungsklima annähernd ins Gleichgewicht kommen. Erst bei hoher Temperatur wirkt sich die relative Feuchte stark auf die Formaldehydabgabe aus. Unter fixierten Randbedingungen (Fassungsvermögen der Flaschen, Temperatur, relative Luftfeuchte) spielt nur das Gewicht der Proben eine Rolle. Iodometrische Formaldehydbestimmung PRINZIP Der in der Lösung enthaltene Formaldehyd reduziert das zugegebene Iod zu Iodid. Durch Redoxtitration mit Thiosulfat kann das unverbrauchte Iod und daraus der Gehalt an Formaldehyd bestimmt werden. REAGENZIEN 0,01 N Iodlösung 0,01 N Thiosulfatlösung 1 N NaOH 1 M H 2 SO 4 Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
16 AUSFÜHRUNG 10 ml der auf ihren Formaldehydgehalt zu untersuchenden Lösung werden in einen 300 ml Erlenmeyerkolben mit Schliff überführt. Nacheinander werden 25 ml 0,01 N Iodlösung und 10 ml 1 N NaOH zugegeben. Der verschlossenen Kolben wird 15 Minuten im Dunkeln stehen gelassen. Danach gibt man 10 ml 1 M H 2 SO 4, wobei Braunfärbung auftritt. Das überschüssige Iod wird mit 0,01 N Thiosulfatlösung in Gegenwart von Stärkelösung als Indikator auf rahmweiß (farblos) titriert. Der Blindwert wird auf die gleiche Art bestimmt. 1 ml 0,01 N Iodlösung = 0,1501 mg Formaldehyd Das Ergebnis wird als mg Formaldehyd je 100 g Platte angegeben. ENTSORGUNGSHINWEISE Analysenlösungen können in den Ausguss gegossen werden Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
17 4 Tenside Literatur: E. Kratz und H. Waldhoff, Nachweis von Tensiden in: Analytik von Bedarfsgegenständen, ed. L. W. Kroh, B. Behr s Verlag GmbH & Co. KG, Hamburg 2007 S. 290 ff 4.1 Identifizierung von Tensiden mit Dünnschichtchromatografie Literatur: Umweltbundesamt, Leitfaden für analytische Untersuchungen, Qualitative Unterscheidung von anionischen Tensiden nach Alkylsulfaten und Alkylsulfonaten ANT 2 R. Matissek, Tenside Detergents 19 (1982) 57 System V Probenvorbereitung Mit einer Ethanol-Wasser-Mischung (1:1 v/v) lassen sich alle Tenside aus einer Formulierung extrahieren. REAGENZIEN Pinakryptolgelb-Reagenz 100 mg Pinakryptolgelb wird in 90 ml kochendem Wasser gelöst und nach dem Abkühlen auf 100 ml aufgefüllt. Das Reagenz ist unter Lichtausschluss monatelang haltbar. Vergleiche: 1 %ige Lösungen in Ethanol/Wasser 1:1 (v/v) Trennsysteme: Trennsystem 1 Kationische Tenside sind mit dieser Methode nicht nachweisbar. Sorbens: Kieselgel 60 Laufmittel: Aceton/Tetrahydrofuran 9 : 1 (v/v), frisch ansetzen Detektion: Pinakryptolgelb Entwicklung: doppelt 30 ml Fließmittel werden in eine der Bodenhälften einer Doppeltrogkammer eingefüllt. Die vorbereitete DC-Platte wird in die zweite, nicht mit Fließmittel benetzte Bodenhälfte gestellt und die Kammer mit dem Deckel geschlossen. Nach 30 min Aktivierungszeit wird die Kammer auf ca. 45 gekippt, so dass die DC-Platte mit dem Fließmittel direkt in Berührung kommt. Dabei sollte der Deckel nicht geöffnet werden, damit die Raumsättigung gewährleistet bleibt. Nach einer Laufstrecke von ca. 15 cm (etwa 1 h) wird die DC-Platte aus der Kammer entfernt und die Laufhöhe markiert. Nachdem die DC-Platte an der Luft getrocknet ist, wird die Entwicklung auf die oben beschriebene Weise wiederholt. Es ist exakt die gleiche Laufhöhe einzuhalten. Die nach der 2. Entwicklung getrocknete Platte wird kräftig mit Pinakryptol-Reagenz besprüht und noch feucht im langwelligen UV-Licht (366 nm) betrachtet. Nach 2-3 min sind die Flecken gut sichtbar (gelb). Sie werden mit Bleistift markiert, da sie nach kurzer Zeit ausfransen. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
18 Abb. 3: Tensid DC (Trennsystem 1) Na laurylsulfat (NLS) 2 Na laurylethersulfat (NLES) 3 Na alkylbenzolsulfonat (ABS) 4 Na laurat (Seife) 5 Na sarkosid 6 Cetyltrimethylammoniumchlorid 7 Cocamidopropylbetain (CAPB) Trennsystem 2 Seifen sind mit dieser Methode nicht nachweisbar. Sorbens: Kieselgel 60 F 254 Laufmittel: A: Essigsäureethylester/Methanol/10 N NH 3 4 : 1 : 1 (v/v/v) nach trocknen B: 1-Propanol/Chloroform/Methanol/10 N NH 3 4 : 4 : 2 : 1 (v/v/v/v) Detektion: Pinakryptolgelb, 366 m Entwicklung: Laufmittel A und B nacheinander Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
19 Ca. 30mL Laufmittel A wird in eine Dünnschichtkammer gefüllt, die vorbereitete Platte hinein gegeben und entwickelt. Nach einer Laufstrecke von mindestens 15 cm wird die DC-Platte aus der Kammer entfernt, die Laufhöhe markiert und die Platte getrocknet. Anschließend wird die Entwicklung auf gleiche Art mit Laufmittel B wiederholt. Die Laufhöhe sollte für beiden Laufmittel gleich sein. Die Detektion erfolgt wie bei Trennsystem 1 beschrieben. Abb. 4.: Tensid DC (Trennsystem 2) Natriumlaurylsulfat (NLS) 2 Natriumlaurylethersulfat (NLES) 3 Natriumalkylbenzoat (ABS) 4 Natriumlaurat 5 Natriumsarkosinat 6 Cetyltrimethylammoniumchlorid 7 Cocamidopropylbetain (CAPB) Rewoquat GEFAHRENHINWEISE Pinakryptolgelb: reizend R 36-37/38/R 36 Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
20 4.2 Quantitative Bestimmung von Tensiden durch Zweiphasentitration Literatur: DIN ISO 2271 (1982) Tenside/Waschmittel, Umweltbundesamt, Leitfaden für analytische Untersuchungen Bestimmung der Summe anionenaktiver Substanzen (Zweiphasentitration mit visueller Endpunkterkennung) ANT 1-2, Bestimmung von Seifen mit Zweiphasentitration ANT 4 PRINZIP Die wässrige Lösung eines Tensids wird mit der Mischindikatorlösung nach Herring versetzt, die einen kationischen und einen anionischen Farbstoff enthält und mit Methylenchlorid unterschichtet. Als Titrans dient ein entgegengesetzt geladenes Tensid. a) Aus anionischem Tensid (z.b. AT - Na + ) und kationischem Indikatorfarbstoff (I + ) bildet sich zunächst ein Salz (AT - I + ), das sich in Methylenchlorid mit rosaroter Farbe löst (siehe Schema). a) b) c) d) Titration (+Hyamine (KT + Cl - )) Äquivalenzpunkt H 2 O (AT - Na + ) (I - ) (AT - KT + ) (AT - Na + ) (Na + ) (Cl - ) (I - ) (AT - KT + ) (Na + ) (Cl - ) (I + I - ) (AT - KT + ) (I + ) (Na + ) (Cl - ) CH 2 Cl 2 (A - I + ) (A - I + ) (KT + I - ) rosa rosa farblos graublau b) Bei der Titration reagieren das anionische Tensid (AT - Na + ) und das Titrans Hyamine (kationisches Tensid) (KT + Cl - ) zu einem farblosen, wasserlöslichen Salz (AT - KT + ). c) Durch weiterer Zugabe von Hyamine (KT + Cl - ) wird ein immer höherer Anteil des anionische Tensids (AT - Na + ) gebunden. Der Endpunkt der Titration (Äquivalenzpunkt) ist erreicht, wenn das anionische Tensid (AT - Na + ) vollständig mit dem kationischen Titrans (KT + Cl - ) reagiert hat und auch der kationische Indikatorfarbstoff (I + ) aus seinem Salz mit dem anionischen Tensid (AT - I + ) verdrängt wurde. d) Das entstandene Salz (AT - KT + ) ist farblos, deshalb wird zur besseren optischen Endpunktbestimmung leicht übertitriert. Dabei bildet überschüssige Hyamine (KT + Cl - ) mit dem anionischem Indikatorfarbstoff (I - ) ein Salz (KT + I - ), das sich in Methylenchlorid mit blauer Farbe löst. Der Umschlag erfolgt von rosa nach graublau und ist am besten in verdünnten Lösungen zu erkennen. Zur Bestimmung von kationischen Tensiden wird entsprechend verfahren, als Titrans aber ein anionisches Tensid (Natriumdodecylsulfat) verwendet. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
21 REAGENZIEN 0,004 M Hyamine (N-Alkyldimethyl-benzylammonium-chlorid) M Natriumdodecylsulfat In ein Becherglas werden 1,14 bis 1,16 g Natriumdodecylsulfat genau eingewogen und in ca. 200 ml H 2 O gelöst. Anschließend wird die Lösung in einen 1 l - Messkolben überführt und bis zur Marke aufgefüllt. NaOH H 2 SO 4 CH 2 Cl 2 Herring-Indikator Stammlösung 0,1 g Dimidiumbromid und 0,05 g Disulfinblau VN 150 werden getrennt jeweils in 10 ml heißem 10 %igem Ethanol gelöst. Anschließend werden beide Lösungen vereinigt und auf 50 ml aufgefüllt. Diese Stammlösung wird in einer dunklen Flasche aufbewahrt Indikatorlösung: Zur Herstellung der gebrauchsfertigen Indikatorlösung werden 20 ml Stammlösung nach Zugabe von 20 ml 2,5 M H 2 SO 4 mit H 2 O auf 500 ml verdünnt. AUSFÜHRUNG Quantitative Bestimmung eines anionischen Tensids Ca. 2 g Probe (Richtwert bei einem Gehalt von ca. 10 % Tensid in der Probe z. B. Shampoo oder Duschbad) wird genau eingewogen, in dest. H 2 O gelöst und anschließend quantitativ in einen 250 ml Messkolben überführt und bis zur Marke aufgefüllt. Für Proben mit geringerem Tensidgehalt (z. B. Zahnpasta) muss die Einwaage entsprechend erhöht werden. Ein aliquoter Teil (günstig: 10 ml) der verdünnten Probelösung wird in einen Messzylinder mit Schliffstopfen pipettiert und nach Zugabe von ca. 10 ml dest. H 2 O, ca. 5 ml CH 2 Cl 2 und ca. 3 ml Herring-Indikator-Lösung mit der 0,004 M Hyamine Lösung titriert. Nach jeder Titrans-Zugabe wird das Gefäß verschlossen und kräftig geschüttelt. Je näher der Endpunkt der Titration kommt, umso schneller trennt sich die Emulsion nach dem Schütteln. Der Endpunkt der Titration ist daran zu erkennen, dass in der organischen Phase kein rosa Farbton mehr zu erkennen ist und bei geringfügigem Übertitrieren der Farbton nach graublau umschlägt. Quantitative Bestimmung eines kationischen Tensids Zur quantitativen Bestimmung kationischer Tenside muss das Titrans (0,004 M Natriumdodecylsulfat) selbst hergestellt und der Normalitätsfaktor durch Titration gegen Hyamine bestimmt werden. Die Titration des kationischen Tensids mit Natriumdodecylsulfat erfolgt entsprechend dem für anionische Tenside beschriebenen Verfahren. Der Farbumschlag erfolgt von blau nach hellrosa. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
22 Besonderheiten Betaine (z. B. Cocamidopropylbetain) können quantitativ nur in stark saurer Lösung bestimmt werden. Hier liegen sie quantitativ in kationischer Form vor. Betaine und Anionische Tenside Liegen Betaine als kationische Tenside vor (saurer ph), reagieren sie mit den in der Probe vorhandenen anionischen Tensiden stöchiometrisch ab. Zur quantitativen Bestimmung muss deshalb sowohl in alkalischer Lösung (anionisches Tensid allein) als auch im stark Sauren (anionisches Tensid minus Aminoxid) titriert werden. Aus den beiden erhaltenen unterschiedlichen Ergebnissen können die Mengen der nebeneinander vorliegenden Tenside berechnet werden. Die ph-einstellung sollte, bedingt durch die chemische Struktur der Betaine, mit H 2 SO 4 erfolgen. Carboxylierte Tenside (z. B. Seifen) liegen nur bei basischem ph-wert geladen vor und können nur so quantitativ bestimmt werden. In saurer Lösung liegen die Fettsäuren undissoziiert vor. Anionische Tenside und Seifen Zur quantitativen Bestimmung muss sowohl in alkalischer Lösung (anionisches Tensid und Seife gemeinsam) als auch im Sauren (anionisches Tensid allein) titriert werden. Aus den beiden erhaltenen unterschiedlichen Ergebnissen können die Mengen der nebeneinander vorliegenden Tenside berechnet werden. Berechnung WAS [g] = m Hy x V x MW WAS - waschaktive Substanz: V m Hy MW = Verbrauch an Hyamine bzw. NLS = Molarität der Hyamine- bzw. NLS-Lösung = Molgewicht der WAS Angabe des Endergebnisses in % der Probe GEFAHRENHINWEISE Dimidiumbromid: gesundheitsschädlich R 36/37/38 Hyamine 1622: gesundheitsschädlich R 22-37/38-41 Natriumdodecylsulfat: gesundheitsschädlich, umweltgefährdend R /38-37/ Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
23 ENTSORGUNG nach Phasentrennung (evtl. Schütteltrichter) organische Phase in wässrige halogenhaltige Lösungsmittelabfälle 4.3 Quantitative Bestimmung von Waschmittelrückständen Literatur: Wissenschaftliche Abschlussarbeit, A. Mzebaze Sokeng, TU Berlin 2011 PRINZIP Die Waschmittelrückstände werden mit Hilfe eines geeigneten Lösungsmittels aus dem Wäschestück extrahiert, die Extraktionslösung wird UV-spektroskopisch vermessen und der Gehalt an Tensiden (+ TAED) über eine Kalibriergerade berechnet. REAGENZIEN Dodecylbenzolsulfonsäure Natriumsalz ca. 1 N NaOH AUSFÜHRUNG Es werden Stoffstücke in den Maßen von ca. 10 cm x 10 cm ausgeschnitten (Dreifach- Bestimmung) und ausgewogen (es sollten pro Probe mindestens 3g sein). Die Proben kommen zusammen mit 100 ml Aqua dest, das mit NaOH auf ph 9 eingestellt wurde, in jeweils eine Schraubdeckelflasche und werden 3 h bei Zimmertemperatur geschüttelt. Der Stoff wird mit Hilfe einer Pinzette entfernt und die Lösung 30 min stehen gelassen. Trübungen bzw. eventuell vorhandene Fusseln müssen sich absetzen. Die Extinktion der klaren Lösung wird bei 223 nm am Spektophotometer gemessen Mit Dodecylbenzolsulfonsäure Natriumsalz (LABS) wird im Konzentrationsbereich von mg/l eine Kalibriergerade erstellt. Das Ergebnis wird in mg/100g Stoff (%) angegeben. GEFAHRENHINWEISE Dodecylbenzolsulfonsäure Natriumsalz: gesundheitsschädlich R 22-37/38-41 Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
24 5 Organische Lösungsmittel 5.1 Vortests für verschiedene Inhaltsstoffe Methanol PRINZIP In saurer Lösung wird Methanol durch KMnO 4 zu Formaldehyd oxidiert und kann als solcher mit verschiedenen Farbreaktionen nachgewiesen werden. Da Methanol als Formaldehyd nachgewiesen wird, ist vor der Oxidation auf vorhandenen Formaldehyd zu prüfen. Nachweis mit Chromotropsäure Literatur: Pohloudek-Fabini, R. u. Th. Beyrich, Organische Analyse unter besonderer Berücksichtigung von Arzneistoffen, Akademische Verlagsgesellschaft Geest & Portig KG, Leipzig 1975 REAGENZIEN Chromotropsäurelösung: 50 mg Dihydroxynaphthalin-3,6-disulfonsäure (Chromotropsäure) in 100 ml 75%iger H 2 SO 4 gelöst 5 %ige wässrige KMnO 4 -Lösung verdünnte H 3 PO 4 konz. H 2 SO 4 Oxalsäurelösung: 6,3 g Oxalsäure werden nach Zugabe von 10 g konz. H 2 SO 4 mit H 2 O dest auf 100 ml aufgefüllt AUSFÜHRUNG Etwas Probelösung wird mit einigen Tropfen H 2 O, ca. 0,5 ml verdünnter H 3 PO 4 und ca. 4 ml 5 %iger KMnO 4 -lösung versetzt. Es wird geschüttelt (Handschuhe) und mindestens 15 min stehengelassen. Nach Zugabe von ca. 2 ml Oxalsäurelösung wird weitere 10 min gewartet, bis die Farbe des KMnO 4 verschwunden ist. Die farblose Lösung wird mit Wasser auf 10 ml aufgefüllt und 1 ml davon mit 1 ml frisch zubereiteter Chromotropsäurelösung und 10 ml konz. H 2 SO 4 10 min auf dem Wasserbad auf 60 C erwärmt. Bei Anwesenheit von Methanol tritt Violettfärbung auf. Ethanol PRINZIP Ethanol wird in saurer Kaliumpermanganatlösung zu Acetaldehyd oxidiert. Dieser gibt mit Nitroprussidnatrium und einem sekundären Amin (z.b. Piperazin, Piperidin oder Diethylamin) eine blaue Färbung. Diese Methode ist allgemein als Nachweis für Aldehyde und Ketone geeignet. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
25 Reaktion mit Nitroprussidnatriumlösung (nach Simon) Literatur: Pohloudek-Fabini, R. u. Th. Beyrich, Organische Analyse unter besonderer Berücksichtigung von Arzneistoffen, Akademische Verlagsgesellschaft Geest & Portig KG, Leipzig 1975 REAGENZIEN 1 %ige wässrige Nitroprussidnatriumlösung Reagenzpapier: Filterpapier getränkt mit Piperidin und l %iger Nitroprussidnatriumlösung 5 %ige wässrige KMnO 4 -Lösung verdünnte H 3 PO 4 AUSFÜHRUNG Etwas Probelösung wird im Reagenzglas mit einigen Tropfen H 2 O, verdünnter H 3 PO 4 und 5 %iger KMnO 4 -lösung versetzt. Anschließend wird das Reagenzglas mit einem Wattebausch lose verschlossen, mit dem Reagenzpapier abgedeckt und längere Zeit zum Sieden erhitzt. Eine blauviolette Färbung des Reagenzpapieres zeigt Ethanol (als Acetaldehyd) an. Diese Reaktion kann auch in Lösung durchgeführt werden, wobei zweckmäßigerweise einige Tropfen des Destillats eingesetzt werden. Dazu wird die Probe mit Kaliumpermanganat und der verdünnten H 3 PO 4 erhitzt und mit 1 ml 1 %iger Piperidin- und 1 ml 1 %iger Nitroprussidnatriumlösung versetzt. Propan-2-ol Nachweis mit p-dimethylaminobenzaldehyd (nach Auterhoff) Literatur: Pohloudek-Fabini, R. u. Th. Beyrich, Organische Analyse unter besonderer Berücksichtigung von Arzneistoffen, Akademische Verlagsgesellschaft Geest & Portig KG, Leipzig 1975 PRINZIP Propan-2-ol gibt beim Unterschichten mit einer Lösung von 4-Dimethylaminobenzaldehyd in konz. H 2 SO 4 einen rotvioletten Ring. REAGENZIEN 4-Dimethylaminobenzaldehydlösung: etwa 1 % ige Lösung von 4-Dimethylaminobenzaldehyd in konz. H 2 SO 4 Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
26 AUSFÜHRUNG Einige ml des Filtrats bzw. der Probe werden mit einigen ml der Reagenzlösung unterschichtet. Bei Anwesenheit von Propan-2-ol entsteht ein leuchtend rotvioletter Ring, allmählich färbt sich die gesamte Schwefelsäureschicht rot. Maßgebend ist eine reine Rotviolett-Färbung, die sofort oder innerhalb von 2 bis 5 min auftreten muss. Nach längerem Stehen (15-20 min) tritt mit Propan-1-ol eine braune Färbung auf. Höhere Alkohole geben sofort braunrote Färbungen. GEFAHRENHINWEISE Nitroprussidnatrium: Piperidin: KMnO 4: Chromotropsäure: 4-Dimethylaminobenzaldehyd: giftig R 20/21-25 leichtentzündlich. giftig R11; R23/24; R34 brandfördernd, gesundheitsschädlich, umweltgefährlich R 8, R22; R50/53 reizend R36/37/38 gesundheitsschädlich R 21; R36/37/38 ENTSORGUNG in wässrige halogenfreie Lösungsmittelabfälle ggf. vorher neutralisieren 5.2 Identifizierung und quantitative Bestimmung von Alkoholen mit Gaschromatografie Literatur: Amtliche Sammlung von Untersuchungsverfahren nach 35 LMBG (EG) Bestimmung von Methanol im Verhältnis zu Äthanol oder Propanol-2 Zur Isolierung der Alkohole werden je nach erwartetem Gehalt ml Probe mit etwa der gleichen Menge Wasser versetzt und bei langsam ansteigender Temperatur destilliert. Dabei sollte der Siedeverlauf genau beobachtet werden, da daraus Hinweise auf bestimmte Lösungsmittel gewonnen werden können. Für quantitative Zwecke wird das Destillat in einem mit wenig Wasser beschickten 50 ml Messkolben aufgefangen. Nach Abschluss der Destillation wird mit Wasser bis zur Marke aufgefüllt. Das aus den Proben erhaltene alkoholische Destillat wird definiert verdünnt und direkt für die GC eingesetzt. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
27 Die quantitative Bestimmung kann mit Hilfe einer Kalibrierungsgeraden, durch Standardaddition oder durch Zusatz eines internen Standards erfolgen. Die Standards für die Kalibriergerade sollten ca. 0,05-0,5% (m/m) Alkohol enthalten. GC-Parameter: Säule: Agilent,. FFAP 30m x 0,25mm ID; 0,25µm Filmdicke Injektor: 250 C Detektor (FID): 270 C Temperaturprogramm 20 C/min auf 70 C - 4min isotherm 180 C Vergleiche: Methanol Ethanol Propan-2-ol Propan-1-ol ENTSORGUNG Destillate und Kalibrierlösungen: in den Ausguss Destillationsrückstand: (je nach Probe) meist in halogenhaltige Lösungsmittelabfälle Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
28 6 Konservierungsstoffe und antimikrobiell wirksame Substanzen 6.1 Vortests auf phenolische Verbindungen Reaktion mit Aminoantipyrin Literatur: K. F. Brown, et al., J. Pharmac. Soc. 58, (1969) PRINZIP Phenolische Verbindungen reagieren unter oxidativer Kondensation mit 4-Aminoantipyrin zu intensiv gefärbten (orange bis rot) Pyrazolonen. Diese Reaktion ist sehr empfindlich, Salicylsäure reagiert nur sehr langsam. REAGENZIEN 2 %ige wässrige Lösung von Aminoantipyrin 2 N NH 3 -Lösung 2 %ige wässrige Kaliumhexacyanoferrat-(III)-Lösung AUSFÜHRUNG Zu ca. 5 ml der ethanolischen Probelösung bzw. des ethanolischen Probenextrakts werden wenige Tropfen einer 2 %igen wässrigen Aminoantipyrin-Lösung sowie ca. 1 ml 2 N NH 3 -Lösung gegeben, umgeschüttelt und die Lösung anschließend mit ca. 1 ml einer 2 %igen Kaliumhexacyanoferrat-(III)- Lösung versetzt. Bei Anwesenheit von Phenolen bildet sich eine intensive Rotfärbung. GEFAHRENHINWEISE Aminoantipyrin: gesundheitsschädlich, reizend R 22-36/37/38 Kaliumhexacyanoferrat: reizend R /38/R 32 ENTSORGUNG wässrige halogenhaltige organische Abfälle 6.2 Identifizierung mittels DC Literatur: H.-J. Schmahl, E. Hieke, Fresenius Z. anal. Chem. 304 (1980) H. König, Fresenius Z. Anal. Chem. 246 (1969) Die Identifizierung von Konservierungssäuren und antimikrobiell wirksamen Substanzen kann durch übliche DC nach Auftragung von Vergleichen bzw. Mischspots erfolgen. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
29 allgemeine DC Sorbens: Kieselgel 60 F 254 Laufmittel 1: n-butanol/25%iger Ammoniak/Wasser (35:10:5 v/v/v) - obere Phase verwenden! Detektion: UV (254 nm) Laufzeit ca. 4-5 h Vergleichssubstanzen 1 %ig in Aceton oder Ethanol (ca. 3 µl auftragen) Tab. 1: Rf-Werte der antimikrobiell wirksamen Substanzen (Laufmittel 1) Substanz Rf-Wert Triclosan 0,88 Bromchlorophen 0,76 Dichlorophen 0,69 Benzoesäure 0,25 Sorbinsäure 0,20 Salicylsäure 0,30 Phenylsalicylat 0,47 Benzylsalicylat 0,94 Phenoxyethanol 0,38 DC besonders geeignet für polychlorierte Phenole Sorbens: Kieselgel 60 F 254 Laufmittel 2: Toluen/Aceton (40 : 1 v/v) Detektion: UV (254 nm) Vergleichssubstanzen 1 %ig in Aceton oder Ethanol (ca. 3 µl auftragen) Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
30 Tab. 2: Rf-Werte der antimikrobiell wirksamen Substanzen (Laufmittel 2) Substanz Rf-Wert Triclosan 0,60 Bromchlorophen 0,35 Dichlorophen Phenylsalicylat Benzylsalicylat Benzoesäure 0,05 Sorbinsäure 0,05 Salicylsäure 0,06 Phenoxyethanol 0,10 ENTSORGUNG gebrauchte DC-Platten: Behälter für kontaminierte Betriebsmittel Laufmittel: halogenfreie Lösungsmittel, Laufmittel 1 ggf. neutralisieren 6.3 Quantitative Bestimmung von Benzoe-, Sorbin- und Salicylsäure bzw. Phenoxyethanol mit HPLC Literatur: - Amtliche Sammlung von Untersuchungsverfahren nach 35 LMBG (EG) Nachweis und Bestimmung von Benzoesäure, 4-Hydroxybenzoesäure, Sorbinsäure, Salicylsäure und Propionsäure in kosmetischen Mitteln - Amtliche Sammlung von Untersuchungsverfahren nach 64 LFGB (EG) Nachweis und Bestimmung von 2-Phenoxyethanol, 1-Phenoxypropan-2-ol, Methyl-, Ethyl-, Propyl-, Butyl- und Benzylhydroxybenzoesäure - E. Kratz und H. Waldhoff, Konservierungsstoffe in: Analytik von Bedarfsgegenständen, ed. L. W. Kroh, B. Behr s Verlag GmbH & Co. KG, Hamburg 2007 S. 304 ff PRINZIP Nach dem Ansäuern (! ph-wert prüfen!) wird die Probe mit einer Mischung aus Methanol und Wasser extrahiert und der Gehalt an Konservierungsstoffen entweder über einen internen Standard oder über Kalibriergeraden mittels HPLC bestimmt. REAGENZIEN Acetatpuffer : 6,35 g Natriumacetat und 20 ml Essigsäure werden in 1 l H 2 O bidest gelöst Methoxybenzoesäure Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
31 AUSFÜHRUNG 0,5-1 g der Probe wird mit ca. 20 ml Methanol angelöst, mit 1 ml 1 N H 2 SO 4 versetzt und auf 100 ml mit dest. Wasser aufgefüllt. Anschließend wird mindestens 1 min kräftig geschüttelt, Cremes sollten im Ultraschallbad behandelt werden. Der Extrakt wird filtriert, mit Wasser 1:5 verdünnt und zur HPLC-Bestimmung verwendet. Die optimale Konzentration der Stammlösung zur Aufstellung der Kalibriergeraden liegt bei 0,1-1 mg/100 ml für die Konservierungssäuren und bei 0,5-2 mg/100 ml für Phenoxyethanol. Dazu wird die entsprechende Menge der Standards in wenig Methanol angelöst und mit Wasser auf 100 ml aufgefüllt. Anschließend wird auf die gewünschte Konzentration weiter verdünnt. Benzoe-, Salicyl- und Sorbinsäure können im Gemisch bei 240 nm detektiert werden, Sorbinsäure und Phenoxyethanol gemeinsam bei 270 nm. HPLC-Bedingungen mobile Phase: Acetatpuffer/Acetonitril (450 ml/125 ml) entgast (Ultraschall) 2,0 ml/min Säule: Nucloesil 5 C18, 12,5-25 cm x 4,6 mm Detektor: UV 240 nm oder 270 nm bei Anwesenheit von Phenoxyethanol als interner Standard eignet sich Methoxybenzoesäure (ca. 0,5 %ig im Extraktionsmittel) ENTSORGUNGSHINWEISE Proben und Kalibrierlösungen in wässrige halogenfreie Lösungsmittelabfälle 6.4 Quantifizierung phenolischer Substanzen (photometrisch) Literatur: F. Will, C. Varsel, J.A.0.A.C. 49 (1966) 5 PRINZIP Nach Abtrennung der antimikrobiell wirksamen Substanzen aus der Probenmatrix mittels Säulenchromatografie können diese über die spezifische Extinktion bei max (Tab. 3) mit Hilfe einer Kalibriergeraden UV-spektroskopisch quantifiziert werden Säulenchromatographische Matrixabtrennung REAGENZIEN getrocknetes Kieselgel 40 oder 60 Aceton Chloroform 0,1 N KOH Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
32 AUSFÜHRUNG Ca. 5 g Kieselgel werden mit Aceton in die Säule eingeschlemmt (bei Säulendurchmesser von ca.15 mm etwa 15 cm hoch füllen, bei ca. 20 mm Durchmesser etwa 8 cm). Etwa 0,5 g der Probe (bei Phenylsalicylat bis 1 g) werden in ein kleines Becherglas eingewogen, mit ca. 1 g Kieselgel versetzt und solange verrührt, bis das entstandene Gemenge homogen und rieselfähig ist und auf die vorbereitete Trennsäule gegeben. Reste von Probe/Kieselgel werden mit Aceton aus dem Becherglas auf die Säule gespült und mit ca. 25 ml Aceton die acetonlöslichen, in diesem System abtrennbaren, antimikrobiellen Substanzen eluiert. Für eine ausreichend gute Trennung sollte die Tropfgeschwindigkeit nicht höher als 1 Tropfen/s sein. Bei alkoholisch-wässrigen Probelösungen werden ca. 5 ml der Probe direkt auf die vorbereitete Säule pipettiert. Das erhaltene Eluat wird am Vakuumrotationsverdampfer vollständig eingeengt. Nicht entfernte Feuchthaltemittel erschweren die Phasentrennung bei der weiteren Aufarbeitung beträchtlich und können das quantitative Ergebnis verfälschen. Der verbleibende Rückstand wird in Chloroform aufgenommen, in einen 10 ml Messkolben überführt und aufgefüllt. Daraus wird ein aliquoter Teil (mindestens 5 ml, aber auch alle 10 ml möglich) abgenommen und im Mixxor-Trennkolben (siehe Abb. 4) mit Wasser durchmischt, um störende wasserlösliche Bestandteile auszuwaschen. Nach Phasentrennung wird die gesamte organische Phase in einen Scheidetrichter pipettiert und mit genau 25 ml 0,1 N KOH ausgeschüttelt, die phenolischen Verbindungen gehen dabei in die wässrige Phase über. Von der wässrigen (KOH-) Phase wird ein UV-Spektrum im Bereich von 250 bis 400 nm gegen 0,1 N KOH aufgenommen und die maximale Absorptionswellenlänge ( max ) mit der der erwarteten antimikrobiell wirksamen Substanz (Tab.: 3 verglichen. Die quantitative Auswertung erfolgt dann über eine Kalibrierungsgerade. Dazu werden Vergleichslösungen der identifizierten phenolischen Verbindung (etwa im Bereich von µg/ml) gegen KOH vermessen. GEFAHRENHINWEISE Chloroform: gesundheitsschädigend R 20/22/ Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
33 ENTSORGUNG: wässrige, halogenhaltige Lösungsmittelabfälle Abb. 4 Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
34 Tabelle 3: max der antimikrobiell wirksame Substanzen gelöst in KOH antimikrobiell wirksame Substanz max [nm] in KOH 2,4,4 -Trichlor-2-hydroxy-diphenylether 292 (Triclosan) 3,3 -Dibrom-4,4 dichlor-2,2 methylendiphenol 312 (Bromchlorophen) Chlorophen Chlor3-methylphenol 297 Benzoesäure 230 Sorbinsäure 262 Salicylsäure 302 Phenylsalicylat 341 Benzylsalicylat 333 Phenoxyethanol 270 (Parabene ca. 290) max der antimikrobiell wirksamen Verbindungen in Schweisssimulanz bzw. Ethanol sind ca. 10 nm zu niedrigeren Wellenlängen verschoben. 6.5 Untersuchung von Textilien auf antimikrobielle Ausrüstung PRINZIP Die in den zu untersuchenden Textilien enthaltenen antimikrobiell wirksamen Verbindungen werden mit geeigneten Lösungsmitteln oder Schweisssimulanz extrahiert und UV/VIS-spektrophotometrisch über eine Kalibriergerade quantifiziert. REAGENZIEN 0,1 N KOH Schweisssimulanz: 5 g NaCl, 1 g Harnstoff und 1 g Milchsäure (98 %) werden in ca. 900 ml dest. Wasser gelöst und mit 1 %iger Ammoniaklösung auf einen ph-wert von 6,5 eingestellt. Anschließend wird mit Wasser auf 1 L aufgefüllt Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
35 AUSFÜHRUNG Extraktion Die zu untersuchende Textile wird genau ausgewogen und klein geschnitten. Die Stücke werden in ein Becherglas gegeben, das genau 50 ml 0,1 N KOH oder Schweisssimulanz enthält. Es ist darauf zu achten, dass alle Teile mit Flüssigkeit bedeckt sind, ggf. muss noch weitere Flüssigkeit genau zugegeben werden. Zur Extraktion lässt man zugedeckt mindestens 1 h bei Körpertemperatur (Schweisssimulanz) bzw. bei 60 C (KOH, simulierte Wäsche) stehen, durchmischt noch einmal gut und filtriert einen Teil der Flüssigkeit ab. Für die quantitative Bestimmung mittels UV/VIS- Spektroskopie (siehe Kap. 6.4) muss gegebenenfalls verdünnt werden. Ein nicht antimikrobiell ausgerüstetes, aber ähnliches Stück Stoff des gleichen Materials ist ebenso zu behandeln und als Nullprobe zu vermessen. Es ist darauf zu achten, dass die Probe immer gegen das jeweilige Simulanzlösemittel vermessen wird. ERGEBNIS Das Ergebnis ist als mg migrierte Substanz pro 100 g Probe anzugeben. Bei einer Angabe in mg pro dm 2 Stoff ist das entsprechend Flächengewicht der Textile anzugeben. ENTSORGUNG untersuchte Textilien: in den Behälter für kontaminierte Betriebsmittel benutztes Schweisssimulanz: halogenhaltige wässrige Lösungsmittelabfälle Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
36 7 Süßstoffe 7.1 Identifizierung mit Dünnschichtchromatografie Literatur: G. W. v. Rymon-Lipinski, H.-C. Brixius, Dünnschichtchromatografischer Nachweis von Acesulfam, Saccharin und Cyclamat, Z. Lebensm. Unters. Forsch. 168 (1979) Isolierung aus der Matrix REAGENZIEN Ionenaustauscher Amberlite La-2 Vorbereitung des Ionenaustauschers: 5 ml Ionenaustauscher Amberlite La-2 werden im Schütteltrichter mit 95 ml Petrolether und 20 ml 20 %iger Essigsäure kräftig geschüttelt. Die obere Phase wird zur Identifizierung der Süßstoffe verwandt. Essigsäure 25 %iger NH 3 Methanol AUSFÜHRUNG g der Probe werden auf ca ml mit H 2 O verdünnt und mit Essigsäure angesäuert. Die Probelösung wird zweimal mit 25 ml vorbehandelter Ionenaustauscherlösung ausgeschüttelt, die vereinigten Ionenaustauscherlösungen dreimal mit dest. H 2 O gewaschen und dreimal mit je 15 ml 25 %iger NH 3 -Lösung geschüttelt. Die vereinigten ammoniakalischen Lösungen werden auf dem Wasserbad bis zur Trockne eingeengt und der Rückstand für die DC in wenig Methanol/H 2 O aufgenommen. Dünnschichtchromatographie Sorbens: Polyamid 11 F 254 Laufmittel : Xylen/ Propan-1-ol/ Ameisensäure (50 : 50 : 10 v/v) Detektion: UV 254 Sprühreagenz: 0,2 %ige methanolische 2,7 -Dichlorfluoreszinlösung zur Farbentwicklung Erhitzen der Platte 10 min bei 105 C Im UV erscheint Cyclamat hellgelb und Saccharin grün auf gelbem Untergrund, nach Besprühen mit Fluoreszin erhält man helle Flecken auf orangefarbenem Untergrund. Analytik von Kosmetischen Mitteln und Bedarfsgegenständen SS
Bestimmung des Stickstoffgehalts von Erde
 Bestimmung des Stickstoffgehalts von Erde Schülerversuch, ca. 25 Minuten Experiment Teil 1 Material und Chemikalien: Ofentrockene Erde Kaliumchloridlösung (c = 2 mol/l) Flasche (250 ml) Trichter Filterpapier
Bestimmung des Stickstoffgehalts von Erde Schülerversuch, ca. 25 Minuten Experiment Teil 1 Material und Chemikalien: Ofentrockene Erde Kaliumchloridlösung (c = 2 mol/l) Flasche (250 ml) Trichter Filterpapier
Anorganisches Praktikum 1. Semester. FB Chemieingenieurwesen. Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften
 Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Anorganisches Praktikum 1. Semester FB Chemieingenieurwesen Labor für Anorg. Chemie Angew. Materialwiss. Versuchsvorschriften 1 Gravimetrie Bestimmung von Nickel Sie erhalten eine Lösung, die 0.1-0.2g
Inhaltsstoffe von Kosmetika
 Inhaltsstoffe von Kosmetika Löslichkeit Konzentration andling in Wasser, in organischen Lösungsmitteln vollständige Extraktion Lambert-Beersches-Gesetz Kalibriergerade Ergebnis Vortests -VT Titration p-wert
Inhaltsstoffe von Kosmetika Löslichkeit Konzentration andling in Wasser, in organischen Lösungsmitteln vollständige Extraktion Lambert-Beersches-Gesetz Kalibriergerade Ergebnis Vortests -VT Titration p-wert
Säure-Base Titrationen. (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen)
 Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Säure-Base Titrationen (Seminar zu den Übungen zur quantitativen Bestimmung von Arznei-, Hilfs- und Schadstoffen) 1. Gehaltsbestimmung von Salzsäure HCl ist eine starke Säure (fast zu 100% dissoziiert)
Laborprotokoll. Trennung von Chlorophyll a und Chlorophyll b mittels Säulenchromatographie
 Laborprotokoll Trennung von Chlorophyll a und Chlorophyll b mittels Säulenchromatographie Cédric Birrer (E46) Michel Rickhaus (E45) Anna-Caterina Senn (E44) Juni 2007 Inhaltsverzeichnis 1 Versuchsziel...
Laborprotokoll Trennung von Chlorophyll a und Chlorophyll b mittels Säulenchromatographie Cédric Birrer (E46) Michel Rickhaus (E45) Anna-Caterina Senn (E44) Juni 2007 Inhaltsverzeichnis 1 Versuchsziel...
3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14
 3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg 20.01.14 Titrimetrie (Volumetrie) Prinzip: Messung des Volumenverbrauchs einer Reagenslösung
3. Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg 20.01.14 Titrimetrie (Volumetrie) Prinzip: Messung des Volumenverbrauchs einer Reagenslösung
Technische Universität Chemnitz Chemisches Grundpraktikum
 Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Technische Universität Chemnitz Chemisches Grundpraktikum Protokoll «CfP5 - Massanalytische Bestimmungsverfahren (Volumetrie)» Martin Wolf Betreuerin: Frau Sachse Datum:
Application Bulletin
 Nr. 275/1 d Application Bulletin Von Interesse für: Waschmittelanalyse A 1, 3, 12 Potentiometrische Zweiphasen-Titration anionischer Tenside in Waschpulvern und Flüssigwaschmitteln Zusammenfassung Die
Nr. 275/1 d Application Bulletin Von Interesse für: Waschmittelanalyse A 1, 3, 12 Potentiometrische Zweiphasen-Titration anionischer Tenside in Waschpulvern und Flüssigwaschmitteln Zusammenfassung Die
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH)
 Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Titrationskurve einer starken Säure (HCl) mit einer starken Base (NaOH) Material 250 mlbecherglas 100 ml Messzylinder 50 mlbürette, Magnetrührer, Magnetfisch, Stativmaterial phmeter Chemikalien Natronlauge
Als Grundlage für die Revision wird die Monographie gemäß HELV. mit folgendem Änderungsvorschlag herangezogen:
 !!! NEE ÖAB-MONOGAPHIE!!! Die folgende revidierte Monographie ist für die Aufnahme in das ÖAB (Österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2008
!!! NEE ÖAB-MONOGAPHIE!!! Die folgende revidierte Monographie ist für die Aufnahme in das ÖAB (Österreichisches Arzneibuch) vorgesehen. Stellungnahmen zu diesem Gesetzesentwurf sind bis zum 31.01.2008
4. Quantitative Bestimmung von Eisen(II) durch Redoxtitration mit Kaliumpermanganat
 Redoxtitration 29. Quantitative Bestimmung von Eisen(II) durch Redoxtitration mit Kaliumpermanganat Einleitung Eisen ist das mit Abstand wichtigste Gebrauchsmetall. Aufgrund seines elektrochemisch sehr
Redoxtitration 29. Quantitative Bestimmung von Eisen(II) durch Redoxtitration mit Kaliumpermanganat Einleitung Eisen ist das mit Abstand wichtigste Gebrauchsmetall. Aufgrund seines elektrochemisch sehr
Titration von Speise-Essig
 Titration von Speise-Essig Wir werden in diesem Versuch die Titration [frz.titer = Feingehalt] Konzentration der Essigsäure in Analytisches Verfahren, bei dem die Reagenzlösung tropfenweise zugesetzt wird,
Titration von Speise-Essig Wir werden in diesem Versuch die Titration [frz.titer = Feingehalt] Konzentration der Essigsäure in Analytisches Verfahren, bei dem die Reagenzlösung tropfenweise zugesetzt wird,
Skript zum Praktikum Instrumentelle Analytik der Universität Heidelberg im 4. Fachsemester Pharmazie
 HPLC 1 Skript zum Praktikum Instrumentelle Analytik der Universität Heidelberg im 4. Fachsemester Pharmazie 1. Aufgabe In diesem Versuch werden die Retentionszeiten der Substanzen Acetylsalicylsäure (ASS)
HPLC 1 Skript zum Praktikum Instrumentelle Analytik der Universität Heidelberg im 4. Fachsemester Pharmazie 1. Aufgabe In diesem Versuch werden die Retentionszeiten der Substanzen Acetylsalicylsäure (ASS)
Säure-Base-Reaktionen
 Säure-Base-Reaktionen Versuch 1: Wir schmecken Lebensmittel! Material: Kleine Trinkbecher Getränkeproben Füllt von jeder bereitstehenden Probe zunächst etwas in einen Trinkbecher und probiert einen kleinen
Säure-Base-Reaktionen Versuch 1: Wir schmecken Lebensmittel! Material: Kleine Trinkbecher Getränkeproben Füllt von jeder bereitstehenden Probe zunächst etwas in einen Trinkbecher und probiert einen kleinen
Chlorwasserstoffgas wirkt stark reizend bis ätzend auf die Haut, insbesondere auf die Augen und die oberen Atemwege.
 5.1 Gas-Flüssig-Extraktion mit der Chromatomembran-Methode 97 5.1.4 Bestimmung von Chlorwasserstoff 5.1.4.1 Einführung Chlorwasserstoffgas wirkt stark reizend bis ätzend auf die Haut, insbesondere auf
5.1 Gas-Flüssig-Extraktion mit der Chromatomembran-Methode 97 5.1.4 Bestimmung von Chlorwasserstoff 5.1.4.1 Einführung Chlorwasserstoffgas wirkt stark reizend bis ätzend auf die Haut, insbesondere auf
Titration. Weiterbildung für fachfremd unterrichtende Lehrkräfte
 Titration Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Herstellung von Natronlauge Öltröpfchen versuch
Titration Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Herstellung von Natronlauge Öltröpfchen versuch
Kapitel 13: Laugen und Neutralisation
 Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Kapitel 13: Laugen und Neutralisation Alkalimetalle sind Natrium, Kalium, Lithium (und Rubidium, Caesium und Francium). - Welche besonderen Eigenschaften haben die Elemente Natrium, Kalium und Lithium?
Biochemisches Grundpraktikum
 Biochemisches Grundpraktikum Versuch Nummer G-01 01: Potentiometrische und spektrophotometrische Bestim- mung von Ionisationskonstanten Gliederung: I. Titrationskurve von Histidin und Bestimmung der pk-werte...
Biochemisches Grundpraktikum Versuch Nummer G-01 01: Potentiometrische und spektrophotometrische Bestim- mung von Ionisationskonstanten Gliederung: I. Titrationskurve von Histidin und Bestimmung der pk-werte...
Säure-Base-Titrationen
 Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
Säure-Base-Titrationen Dieses Skript gehört: Säure Base - Titrationen Seite 2 Hinweis: Mit den Säuren und Basen ist vorsichtig umzugehen, um Verätzungen zu vermeiden! Versuch 1: Herstellen einer Natronlauge
In welchen Stoffen befinden sich Laugen, wozu werden sie verwendet?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7158700) 2.2 Laugen - Bestandteil von Haushaltsreinigern Experiment von: Phywe Gedruckt: 15.10.2013 11:55:39 intertess (Version 13.06 B200,
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7158700) 2.2 Laugen - Bestandteil von Haushaltsreinigern Experiment von: Phywe Gedruckt: 15.10.2013 11:55:39 intertess (Version 13.06 B200,
Protokoll zur Übung Ölanalyse
 Protokoll zur Übung Ölanalyse im Rahmen des Praktikums Betreuender Assistent Univ.Ass. Dipl.-Ing. Martin Schwentenwein Verfasser des Protokolls: Daniel Bomze 0726183 1 Theoretischer Hintergrund 1.1 Aufgabenstellung
Protokoll zur Übung Ölanalyse im Rahmen des Praktikums Betreuender Assistent Univ.Ass. Dipl.-Ing. Martin Schwentenwein Verfasser des Protokolls: Daniel Bomze 0726183 1 Theoretischer Hintergrund 1.1 Aufgabenstellung
Extraktion. Arbeitstechnik der Extraktion
 1 Extraktion Die heute vielfach angewandte Trennung durch Extraktion basiert auf der unterschiedlichen Löslichkeit bestimmter Verbindungen in zwei nicht (od. begrenzt) mischbaren Lösungsmittel. (Das Lösungsmittesystem
1 Extraktion Die heute vielfach angewandte Trennung durch Extraktion basiert auf der unterschiedlichen Löslichkeit bestimmter Verbindungen in zwei nicht (od. begrenzt) mischbaren Lösungsmittel. (Das Lösungsmittesystem
Station 1: Säuren in Lebensmitteln (1)
 Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Station 1: Säuren in Lebensmitteln (1) An dieser Station testet ihr, welche Lebensmittel Säuren enthalten. Für den Säurenachweis benutzt man im Labor bestimmte chemische Stoffe, die man Indikatoren (Zeigerstoffe)
Arbeitsanleitung. Ermittlung der Fettsäurezusammensetzung von Fetten
 Arbeitsanleitung Ermittlung der Fettsäurezusammensetzung von Fetten Zielsetzung: Es soll festgestellt werden welche Fettsäuren im vorliegenden Fett vorhanden sind und in welchem Verhältnis sie zueinander
Arbeitsanleitung Ermittlung der Fettsäurezusammensetzung von Fetten Zielsetzung: Es soll festgestellt werden welche Fettsäuren im vorliegenden Fett vorhanden sind und in welchem Verhältnis sie zueinander
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008
 Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Versuch 3: Säure-Base Titrationen Chemieteil, Herbstsemester 2008 Verfasser: Zihlmann Claudio Teammitglied: Knüsel Philippe Datum: 29.10.08 Assistent: David Weibel E-Mail: zclaudio@student.ethz.ch 1. Abstract
Es soll eine schriftliche Ausarbeitung abgegeben werden (1 Exemplar pro Gruppe).
 Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Gruppe 1 Thema: Wissenswertes über Essig 1. Bestimme den ph-wert von Haushaltsessig. 2. Wie viel Essigsäure (in mol/l und in g/l) ist in Haushaltsessig enthalten? 3. Wie wird Essigsäure hergestellt (Ausgangsstoffe,
Abflussreiniger. Eine chemische Untersuchung. 1. Die Bestandteile des Abflussreinigers. Material: Chemikalien: Durchführung:
 Abflussreiniger Eine chemische Untersuchung 1. Die Bestandteile des Abflussreinigers 8 Uhrgläser (mind. 5 cm) Abflussreiniger 3 Spatel Indikatorpapier 3 Pinzetten Haare, Wollreste, etc. 2 Reagenzgläser,
Abflussreiniger Eine chemische Untersuchung 1. Die Bestandteile des Abflussreinigers 8 Uhrgläser (mind. 5 cm) Abflussreiniger 3 Spatel Indikatorpapier 3 Pinzetten Haare, Wollreste, etc. 2 Reagenzgläser,
Ein Puffer ist eine Mischung aus einer schwachen Säure/Base und ihrer Korrespondierenden Base/Säure.
 2.8 Chemische Stoßdämpfer Puffersysteme V: ph- Messung eines Gemisches aus HAc - /AC - nach Säure- bzw Basen Zugabe; n(naac) = n(hac) > Acetat-Puffer. H2O Acetat- Puffer H2O Acetat- Puffer Die ersten beiden
2.8 Chemische Stoßdämpfer Puffersysteme V: ph- Messung eines Gemisches aus HAc - /AC - nach Säure- bzw Basen Zugabe; n(naac) = n(hac) > Acetat-Puffer. H2O Acetat- Puffer H2O Acetat- Puffer Die ersten beiden
Kap.7 ph-wert und ph-indikatoren
 Der ph-wert und ph-indikatoren Kapitel 7 Übung 6.1: Berechnung der Konzentration von Wasser in Wasser Wieviel mol H2O sind in 1 L H2O? M(H2O)= 18.01528 g/mol 1 L(H2O)= 00g H2O n= m/m= 00g/ 18.01528 g/mol
Der ph-wert und ph-indikatoren Kapitel 7 Übung 6.1: Berechnung der Konzentration von Wasser in Wasser Wieviel mol H2O sind in 1 L H2O? M(H2O)= 18.01528 g/mol 1 L(H2O)= 00g H2O n= m/m= 00g/ 18.01528 g/mol
3.3 Entparaffinierung durch Extraktion. Aufbau. Gefahren. Aufbau. Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl
 Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl (P77400) 3.3 Entparaffinierung durch Extraktion Experiment von: seb Gedruckt: 7.03.204 4:55:40 intertess (Version 3.2 B24, Export 2000) Aufbau
Naturwissenschaften - Chemie - Organische Chemie - 3 Erdöl (P77400) 3.3 Entparaffinierung durch Extraktion Experiment von: seb Gedruckt: 7.03.204 4:55:40 intertess (Version 3.2 B24, Export 2000) Aufbau
Fettanalytik. Anna Ertl
 Fettanalytik Anna Ertl Allgemeines Aufbau: Eigenschaften (wie Schmelzpunkt) variieren und hängen von Fettsäuremuster ab Allgemeines Gesättigte Fettsäure Ungesättigte Fettsäure Stearinsäure (C 18 ) Ölsäure
Fettanalytik Anna Ertl Allgemeines Aufbau: Eigenschaften (wie Schmelzpunkt) variieren und hängen von Fettsäuremuster ab Allgemeines Gesättigte Fettsäure Ungesättigte Fettsäure Stearinsäure (C 18 ) Ölsäure
1. HPLC-Pumpe (2-Kanal Gradient) Überprüfung der Flussrate und der Gradientenzusammensetzung. Einstellungen Mobile Phase entgastes Wasser
 Geräte im Labor Pharmafirma Qualifizierungsplan (OQ) Seite 1 von 7 Inhalt 1. HPLC-Pumpe (2-Kanal Gradient) 1.a Überprüfung der 1.b Überprüfung der Gradientenzusammensetzung und des Rauschens des Gradientenmischers
Geräte im Labor Pharmafirma Qualifizierungsplan (OQ) Seite 1 von 7 Inhalt 1. HPLC-Pumpe (2-Kanal Gradient) 1.a Überprüfung der 1.b Überprüfung der Gradientenzusammensetzung und des Rauschens des Gradientenmischers
RIAG Zn 230. Cyanidisches Glanzzinkverfahren
 Postfach 169 CH-9545 Wängi TG 20.08.2009 RIAG Zn 230 Cyanidisches Glanzzinkverfahren Eigenschaften Das cyanidische Glanzzinkverfahren RIAG Zn 230 erzeugt glänzende Niederschläge über einen weiten Stromdichtebereich.
Postfach 169 CH-9545 Wängi TG 20.08.2009 RIAG Zn 230 Cyanidisches Glanzzinkverfahren Eigenschaften Das cyanidische Glanzzinkverfahren RIAG Zn 230 erzeugt glänzende Niederschläge über einen weiten Stromdichtebereich.
SCHÜEX RHEINLAND-PFALZ
 DEUTSCHE GESELLSCHAFT FÜR ZERSTÖRUNGSFREIE PRÜFUNG E.V. ZfP-Sonderpreis der DGZfP beim Landeswettbewerb Jugend forscht SCHÜEX RHEINLAND-PFALZ Die Lebensmittelampel: Verdorben oder noch essbar? Florian
DEUTSCHE GESELLSCHAFT FÜR ZERSTÖRUNGSFREIE PRÜFUNG E.V. ZfP-Sonderpreis der DGZfP beim Landeswettbewerb Jugend forscht SCHÜEX RHEINLAND-PFALZ Die Lebensmittelampel: Verdorben oder noch essbar? Florian
Wie bestimmt ein Chemiker Säuren und Laugen?
 Wie bestimmt ein Chemiker Säuren und Laugen? Mit den Zahlen von 0 14 wird der ph Wert angegeben. 1 ist eine sehr starke Säure, 14 ist eine sehr starke Lauge. Aus: onlineenzyklopaedie.de Das Forscherlabor
Wie bestimmt ein Chemiker Säuren und Laugen? Mit den Zahlen von 0 14 wird der ph Wert angegeben. 1 ist eine sehr starke Säure, 14 ist eine sehr starke Lauge. Aus: onlineenzyklopaedie.de Das Forscherlabor
Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen
 Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen verzichtet; Reaktionsgleichungen sollten den üblichen
Lösungen zu den Übungsaufgaben zur Thematik Säure/Base (Zwei allgemeine Hinweise: aus Zeitgründen habe ich auf das Kursivsetzen bestimmter Zeichen verzichtet; Reaktionsgleichungen sollten den üblichen
Baldriantinktur, etherische Valerianae tinctura aetherea
 Baldriantinktur, etherische Valerianae tinctura aetherea ÖAB 2009/048 Definition Baldriantinktur, etherische, wird aus Etheralkohol (Ether + Ethanol: 1 + 3 V/V) und Baldrianwurzel (Valerianae radix) hergestellt.
Baldriantinktur, etherische Valerianae tinctura aetherea ÖAB 2009/048 Definition Baldriantinktur, etherische, wird aus Etheralkohol (Ether + Ethanol: 1 + 3 V/V) und Baldrianwurzel (Valerianae radix) hergestellt.
Isolierung von Pflanzenfarbstoffen und Untersuchung auf ihre Verwendung als Säure- Base-Indikatoren
 Bodensee-Gymnasium Lindau Januar 2009 Isolierung von Pflanzenfarbstoffen und Untersuchung auf ihre Verwendung als Säure- Base-Indikatoren von Marc Bradenbrink und Florian Gerner Betreuungslehrkraft: StR
Bodensee-Gymnasium Lindau Januar 2009 Isolierung von Pflanzenfarbstoffen und Untersuchung auf ihre Verwendung als Säure- Base-Indikatoren von Marc Bradenbrink und Florian Gerner Betreuungslehrkraft: StR
Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren
 Carbonsäuren (=> 6-8 Std.) Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren Quellen: CD-Römpp http://www.chemieunterricht.de/dc2/facharbeit/alkansau.html
Carbonsäuren (=> 6-8 Std.) Beispiele: Monocarbonsäuren, Di- und Tricarbonsäuren, gesättigte und ungesättigte Säuren, Hydroxycarbonsäuren Quellen: CD-Römpp http://www.chemieunterricht.de/dc2/facharbeit/alkansau.html
Praktikum Analytische Chemie SS 2008
 Praktikum Analytische Chemie SS 2008 Antworten zu den Zusatzaufgaben Frage 2 5,3 ml einer Schwefelsäure, konz.,w=96%, Dichte δ=1,84kg/l, werden auf 1l verdünnt. Von dieser Lösung werden 25ml auf 200ml
Praktikum Analytische Chemie SS 2008 Antworten zu den Zusatzaufgaben Frage 2 5,3 ml einer Schwefelsäure, konz.,w=96%, Dichte δ=1,84kg/l, werden auf 1l verdünnt. Von dieser Lösung werden 25ml auf 200ml
1.6 Wirkung von Säuren auf Metalle. Aufgabe. Wie wirken Säuren auf Metalle? Naturwissenschaften - Chemie - Säuren, Basen, Salze - 1 Säuren
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757500).6 Wirkung von Säuren auf Metalle Experiment von: Phywe Gedruckt: 5.0.203 :39:04 intertess (Version 3.06 B200, Export 2000) Aufgabe
Naturwissenschaften - Chemie - Säuren, Basen, Salze - Säuren (P757500).6 Wirkung von Säuren auf Metalle Experiment von: Phywe Gedruckt: 5.0.203 :39:04 intertess (Version 3.06 B200, Export 2000) Aufgabe
Versuch: Siedediagramm eines binären Gemisches
 Versuch: Siedediagramm eines binären Gemisches Aufgaben - Kalibriermessungen Bestimmen Sie experimentell den Brechungsindex einer gegebenen Mischung bei unterschiedlicher Zusammensetzung. - Theoretische
Versuch: Siedediagramm eines binären Gemisches Aufgaben - Kalibriermessungen Bestimmen Sie experimentell den Brechungsindex einer gegebenen Mischung bei unterschiedlicher Zusammensetzung. - Theoretische
PCD Europe, Krefeld, Jan 2007. Auswertung von Haemoccult
 Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
Auswertung von Haemoccult Ist das positiv? Nein! Ja! Im deutschen Krebsfrüherkennungsprogramm haben nur etwa 1 % der Frauen und 1,5 % der Männer ein positives Haemoccult -Ergebnis, da dieser Test eine
2.9 Aufbau und Funktion eines Bunsenbrenners. Aufgabe. Wie ist der Bunsenbrenner aufgebaut?
 Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P75400) 2.9 Aufbau und Funktion eines Bunsenbrenners Experiment von: Seb Gedruckt: 24.03.204 ::49 intertess (Version 3.2 B24,
Naturwissenschaften - Chemie - Anorganische Chemie - 2 Luft und andere Gase (P75400) 2.9 Aufbau und Funktion eines Bunsenbrenners Experiment von: Seb Gedruckt: 24.03.204 ::49 intertess (Version 3.2 B24,
Protokoll 2. Labor für Physikalische Chemie. Modul IV. Versuch 8
 Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 8 Bestimmung des Schwefelsäuregehaltes einer Schwefelsäurelösung mit unbekannter Massekonzentration und Herstellung einer Lösung mit c(h2 S04)
Protokoll 2 Labor für Physikalische Chemie Modul IV Versuch 8 Bestimmung des Schwefelsäuregehaltes einer Schwefelsäurelösung mit unbekannter Massekonzentration und Herstellung einer Lösung mit c(h2 S04)
Übungsblatt zu Säuren und Basen
 1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
1 Übungsblatt zu Säuren und Basen 1. In einer wässrigen Lösung misst die Konzentration der Oxoniumionen (H 3 O + ) 10 5 M. a) Wie gross ist der ph Wert? b) Ist die Konzentration der OH Ionen grösser oder
Protokoll 2. Labor für Physikalische Chemie. Modul IV. Säure-Base-Reaktion. Versuch 5.1 5.2. Neutralisation, Gehaltsbestimmungen und Titrationskurven
 Protokoll 2 Labor für Physikalische Chemie Modul IV Säure-Base-Reaktion Versuch 5.1 5.2 Neutralisation, Gehaltsbestimmungen und Titrationskurven Fachbereich MT 1 Wintersemester 2005/2006 Thorsten Huber,
Protokoll 2 Labor für Physikalische Chemie Modul IV Säure-Base-Reaktion Versuch 5.1 5.2 Neutralisation, Gehaltsbestimmungen und Titrationskurven Fachbereich MT 1 Wintersemester 2005/2006 Thorsten Huber,
Titration von Metallorganylen und Darstellung der dazu benötigten
 Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Einführung. KLASSE: 9TE NAME: Vorname: Datum: LTAM Naturwissenschaften 9e Chemische Gleichungen 1 -
 Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
Einführung Ein Gärtner bestellt beim Großhändler Blumen. Dort werden Tulpen in Dreier-Sträußen und Vergissmeinnichtchen in Zweier-Sträußen angeboten. Für Valentinstag, möchte der Gärtner ein Sonderangebot
2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände
 2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände Als Fettsäuren wird die Gruppe aliphatischer Monocarbonsäuren bezeichnet. Der Name Fettsäuren geht darauf
2 Physikalische Eigenschaften von Fettsäuren: Löslichkeit, Dissoziationsverhalten, Phasenzustände Als Fettsäuren wird die Gruppe aliphatischer Monocarbonsäuren bezeichnet. Der Name Fettsäuren geht darauf
Herstellung von Natronlauge. Weiterbildung für fachfremd unterrichtende Lehrkräfte
 Herstellung von Natronlauge Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Titration Öltröpfchen versuch
Herstellung von Natronlauge Weiterbildung für fachfremd unterrichtende Lehrkräfte Chromatografi e von Blattfarbstoffen Destillation von Rotwein Zerlegung der Verbindung Wasser Titration Öltröpfchen versuch
Oxidation und Reduktion Redoxreaktionen Blatt 1/5
 Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Oxidation und Reduktion Redoxreaktionen Blatt 1/5 1 Elektronenübertragung, Oxidation und Reduktion Gibt Natrium sein einziges Außenelektron an ein Chloratom (7 Außenelektronen) ab, so entsteht durch diese
Biochemisches Grundpraktikum. Elektrophoretische Trennung von Proteinen
 Biochemisches Grundpraktikum Versuch Nummer G-05 05: Elektrophoretische Trennung von Proteinen Gliederung: I. SDS-Polyacrylamid-Gelelektrophorese... 2 a) Versuchsziele, Aufgaben... 2 b) Versuchsdurchführung...
Biochemisches Grundpraktikum Versuch Nummer G-05 05: Elektrophoretische Trennung von Proteinen Gliederung: I. SDS-Polyacrylamid-Gelelektrophorese... 2 a) Versuchsziele, Aufgaben... 2 b) Versuchsdurchführung...
Abgestufte Lernhilfen
 Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Abgestufte Lernhilfen Checkliste für die Beobachtungen: o o o o o Farbe des Indikators bei bei Zugabe zu Natronlauge Temperatur vor Zugabe der Salzsäure Farbveränderungen bei Zugabe der Salzsäure Temperaturveränderungen
Kapiteltest 1.1. Kapiteltest 1.2
 Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
Kapiteltest 1.1 a) Perchlorsäure hat die Formel HClO 4. Was geschieht bei der Reaktion von Perchlorsäure mit Wasser? Geben Sie zuerst die Antwort in einem Satz. Dann notieren Sie die Reaktionsgleichung.
3.4 Gemischtrennungen - Chromatographie. Aufgabe. Lässt sich der hergestellte Blattfarbstoff weiter zerlegen?
 Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P7151100) 3.4 Gemischtrennungen - Chromatographie Experiment von: Phywe Gedruckt: 11.10.2013 12:57:21 intertess (Version 13.06 B200,
Naturwissenschaften - Chemie - Allgemeine Chemie - 3 Trennverfahren (P7151100) 3.4 Gemischtrennungen - Chromatographie Experiment von: Phywe Gedruckt: 11.10.2013 12:57:21 intertess (Version 13.06 B200,
XHJmtl~!GUI AH.AJUl.:, l CHEMICAL ANALYSI~ CHJIHKATH!iX!IOP01
 OK 552.543.6:622.24 Fachbereichstandurf:I Februar 970 CHEMISCHE ANALYSE VON SILIKATGESTEINEN Photometrische Bestimmung von Mangan(II)-oxid TG\. 68-2000 Bla-:.t 0 Gruppe-2f J' XHJmtl~!GUI AH.AJUl.:, l CHEMICAL
OK 552.543.6:622.24 Fachbereichstandurf:I Februar 970 CHEMISCHE ANALYSE VON SILIKATGESTEINEN Photometrische Bestimmung von Mangan(II)-oxid TG\. 68-2000 Bla-:.t 0 Gruppe-2f J' XHJmtl~!GUI AH.AJUl.:, l CHEMICAL
Licht und Farbe - Dank Chemie!
 Licht und Farbe - Dank Chemie! Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Licht und Farbe - Dank Chemie! Folie 1 Was verstehen wir eigentlich unter Licht? Licht nehmen wir mit unseren Augen wahr Helligkeit: Farbe: Schwarz - Grau - Weiß Blau - Grün - Rot UV-Strahlung Blau Türkis
Selbst-Test zur Vorab-Einschätzung zum Vorkurs Chemie für Mediziner
 Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Liebe Studierende der Human- und Zahnmedizin, mithilfe dieses Tests können Sie selbst einschätzen, ob Sie den Vorkurs besuchen sollten. Die kleine Auswahl an Aufgaben spiegelt in etwa das Niveau des Vorkurses
Universität der Pharmazie
 Universität der Pharmazie Institut für Pharmazie Pharmazie-Straße 1 12345 Pharmastadt Identitäts-, Gehalts- und Reinheitsbestimmung von Substanzen in Anlehnung an Methoden des Europäischen Arzneibuchs
Universität der Pharmazie Institut für Pharmazie Pharmazie-Straße 1 12345 Pharmastadt Identitäts-, Gehalts- und Reinheitsbestimmung von Substanzen in Anlehnung an Methoden des Europäischen Arzneibuchs
Besitzen andere Kohlenwasserstoffe ähnliche Eigenschaften wie Methan?
 Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P770800) 2.2 Homologe Reihe der Alkane Experiment von: Anouch Gedruckt: 20.02.204 08:58:7 intertess (Version 3.2 B24, Export 2000)
Naturwissenschaften - Chemie - Organische Chemie - 2 Kohlenwasserstoffe (P770800) 2.2 Homologe Reihe der Alkane Experiment von: Anouch Gedruckt: 20.02.204 08:58:7 intertess (Version 3.2 B24, Export 2000)
Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010
 1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
1 Musterprüfung Chemie Klassen: MPL 09 Datum: 14. 16. April 2010 Themen: Metallische Bindungen (Skript S. 51 53, inkl. Arbeitsblatt) Reaktionsverlauf (Skript S. 54 59, inkl. Arbeitsblatt, Merke, Fig. 7.2.1
Kleines Wasserlexikon
 Kleines Wasserlexikon Lösung von Kohlenstoffdioxid. Kohlenstoffdioxid CO 2 ist leicht wasserlöslich und geht mit manchen Inhaltsstoffen des Wassers auch chemische Reaktionen ein. In einem ersten Schritt
Kleines Wasserlexikon Lösung von Kohlenstoffdioxid. Kohlenstoffdioxid CO 2 ist leicht wasserlöslich und geht mit manchen Inhaltsstoffen des Wassers auch chemische Reaktionen ein. In einem ersten Schritt
2.8 Grenzflächeneffekte
 - 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
- 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
Messung des Vitamin C Gehaltes in Orangen mit und ohne Schalen written by Cyril Hertz, 3dMN, 25.11.2004
 1. Fragestellung: Das Ziel des Versuches war, herauszufinden, ob sich die Ascorbinsäure 1 eher im Fruchtfleisch oder in der Schale von Orangen befindet. Zu diesem Zweck wurden Orangen mit und ohne Schale
1. Fragestellung: Das Ziel des Versuches war, herauszufinden, ob sich die Ascorbinsäure 1 eher im Fruchtfleisch oder in der Schale von Orangen befindet. Zu diesem Zweck wurden Orangen mit und ohne Schale
Protokoll: Hochdruck-Flüssigkeits-Chromatographie (HPLC)
 Protokoll: Hochdruck-Flüssigkeits-Chromatographie (HPLC) Zielstellung: - Bestimmung der Retentionszeiten von Theobromin, Theophyllin und Coffein! - Ermittlung des Coffeingehalts verschiedener ahrungs-
Protokoll: Hochdruck-Flüssigkeits-Chromatographie (HPLC) Zielstellung: - Bestimmung der Retentionszeiten von Theobromin, Theophyllin und Coffein! - Ermittlung des Coffeingehalts verschiedener ahrungs-
Versuchsanleitung. Chemie: Öle-Fette 01
 Klassenstufe Oberthemen Unterthemen Anforderungsniveau S1-2 Lebensmittelchemie Durchführungs niveau Öle Fette Vorlauf Vorbereitung Durchführung - ca. 10 min. ca. 10 min. Kurze Sachanalyse: Speisefette
Klassenstufe Oberthemen Unterthemen Anforderungsniveau S1-2 Lebensmittelchemie Durchführungs niveau Öle Fette Vorlauf Vorbereitung Durchführung - ca. 10 min. ca. 10 min. Kurze Sachanalyse: Speisefette
Ein süsses Experiment
 Ein süsses Experiment Zuckerkristalle am Stiel Das brauchst du: 250 Milliliter Wasser (entspricht etwa einer Tasse). Das reicht für 4-5 kleine Marmeladengläser und 4-5 Zuckerstäbchen 650 Gramm Zucker (den
Ein süsses Experiment Zuckerkristalle am Stiel Das brauchst du: 250 Milliliter Wasser (entspricht etwa einer Tasse). Das reicht für 4-5 kleine Marmeladengläser und 4-5 Zuckerstäbchen 650 Gramm Zucker (den
Verklebehinweise Kleine Aufkleber Trockenverklebung
 Verklebehinweise Kleine Aufkleber Trockenverklebung Reinigen Sie den vorgesehenen Platz für Ihren Aufkleber gründlich. Zu vermeiden sind Seifen, Öle und Reinigungsmittel, die Wachs oder Silikon enthalten.
Verklebehinweise Kleine Aufkleber Trockenverklebung Reinigen Sie den vorgesehenen Platz für Ihren Aufkleber gründlich. Zu vermeiden sind Seifen, Öle und Reinigungsmittel, die Wachs oder Silikon enthalten.
Analytische Chemie. B. Sc. Chemieingenieurwesen. 03. Februar 2010. Prof. Dr. T. Jüstel. Name: Matrikelnummer: Geburtsdatum:
 Analytische Chemie B. Sc. Chemieingenieurwesen 03. Februar 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Analytische Chemie B. Sc. Chemieingenieurwesen 03. Februar 2010 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Veranstaltung 3: Was gleich aussieht, muss nicht das Gleiche sein!
 Veranstaltung 3: Was gleich aussieht, muss nicht das Gleiche sein! Station 1: Gase im Vergleich E1 Auffangen von Luft durch Wasserverdrängung E2 Ein Gas aus Brausetabletten und Backpulver E3 Spanprobe
Veranstaltung 3: Was gleich aussieht, muss nicht das Gleiche sein! Station 1: Gase im Vergleich E1 Auffangen von Luft durch Wasserverdrängung E2 Ein Gas aus Brausetabletten und Backpulver E3 Spanprobe
Chem. Grundlagen. ure-base Begriff. Das Protonen-Donator-Akzeptor-Konzept. Wasserstoff, Proton und Säure-Basen. Basen-Definition nach Brønsted
 Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
Der SäureS ure-base Begriff Chem. Grundlagen Das Protonen-Donator-Akzeptor-Konzept Wasserstoff, Proton und Säure-Basen Basen-Definition nach Brønsted Wasserstoff (H 2 ) Proton H + Anion (-) H + = Säure
2.9 Reaktion von Laugen mit Aluminium - Laugenstärke. Aufgabe. Gibt es verschieden starke Laugen?
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7159300) 2.9 Reaktion von Laugen mit Aluminium - Laugenstärke Experiment von: Phywe Gedruckt: 15.10.2013 12:17:12 intertess (Version 13.06
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P7159300) 2.9 Reaktion von Laugen mit Aluminium - Laugenstärke Experiment von: Phywe Gedruckt: 15.10.2013 12:17:12 intertess (Version 13.06
Einführung in die optische Nachrichtentechnik. Herstellung von Lichtwellenleitern (TECH)
 TECH/1 Herstellung von Lichtwellenleitern (TECH) Dieses Kapitel behandelt drei verschiedenen Verfahren zur Herstellung von Vorformen für Glasfasern: das OVD-Verfahren (outside vapour deposition), das VAD-Verfahren
TECH/1 Herstellung von Lichtwellenleitern (TECH) Dieses Kapitel behandelt drei verschiedenen Verfahren zur Herstellung von Vorformen für Glasfasern: das OVD-Verfahren (outside vapour deposition), das VAD-Verfahren
Chlorwasserstoff und Salzsäure
 Chlorwasserstoff und Salzsäure 1. Reaktionsgleichung Chlorwasserstoff entsteht, wenn Natriumchlorid mit Schwefelsäure H 2 SO 4 in Kontakt kommt. Die Reaktionsgleichung lässt sich folgendermassen formulieren:...
Chlorwasserstoff und Salzsäure 1. Reaktionsgleichung Chlorwasserstoff entsteht, wenn Natriumchlorid mit Schwefelsäure H 2 SO 4 in Kontakt kommt. Die Reaktionsgleichung lässt sich folgendermassen formulieren:...
Offset, Buffer, Nullpunkt, DpH, Asymmetrie oder ph = 7.
 Arbeitskreis Allgemeine Anleitung zur Kalibrierung F 01 Kappenberg und Messung von ph -Werten ph- Wert Vorinformation Die ph- Elektrode ist Umwelt- und Alterungsprozessen unterworfen. Aus diesem Grunde
Arbeitskreis Allgemeine Anleitung zur Kalibrierung F 01 Kappenberg und Messung von ph -Werten ph- Wert Vorinformation Die ph- Elektrode ist Umwelt- und Alterungsprozessen unterworfen. Aus diesem Grunde
2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser. Aufgabe. Woraus lassen sich Laugen herstellen? (2)
 Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759200) 2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser Experiment von: Phywe Gedruckt: 5.0.203 2:6:25 intertess (Version 3.06
Naturwissenschaften - Chemie - Säuren, Basen, Salze - 2 Basen (P759200) 2.8 Laugenbildung durch Reaktion von Metalloxiden mit Wasser Experiment von: Phywe Gedruckt: 5.0.203 2:6:25 intertess (Version 3.06
Titration einer Säure mit einer Base
 Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
Titration einer Säure mit einer Base Peter Bützer Inhalt 1 Einleitung... 1 2 Modellannahmen (Systemdynamik)... 2 3 Simulationsdiagramm (Typ 1)... 2 4 Dokumentation (Gleichungen, Parameter)... 3 5 Simulation...
WUFI How to. Tauwasserauswertung
 WUFI How to Tauwasserauswertung Inhalt 1.Grundlagen 2.Vorgehen in WUFI 3.Beispiel 4.Grenzwert Sammlung Grundlagen Die Normen DIN 4108-3 und DIN EN ISO 13788 schreiben eine Feuchteschutznachweis vor. Dies
WUFI How to Tauwasserauswertung Inhalt 1.Grundlagen 2.Vorgehen in WUFI 3.Beispiel 4.Grenzwert Sammlung Grundlagen Die Normen DIN 4108-3 und DIN EN ISO 13788 schreiben eine Feuchteschutznachweis vor. Dies
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Flecken ABC. Eiscreme Zunächst hilft etwas Spiritus oder Salmiakgeist, den Rest einfach mit lauwarmem, klarem Wasser ausspülen.
 Flecken ABC Bevor Sie allerdings selbst behandeln, bedenken Sie: - nicht jede Faser verträgt jedes Fleckenmittel - nicht jede Farbe verträgt jedes Fleckenmittel - nicht jedes Gewebe verträgt die zur Fleckentfernung
Flecken ABC Bevor Sie allerdings selbst behandeln, bedenken Sie: - nicht jede Faser verträgt jedes Fleckenmittel - nicht jede Farbe verträgt jedes Fleckenmittel - nicht jedes Gewebe verträgt die zur Fleckentfernung
c C 2 K = c A 2 c B 2mol /l 2 0,5mol /l 2 4 mol /l K =4l /mol
 Berechnungen zum Massenwirkungsgesetz 1/13 Jakob 2010 Fall 1a: Gegeben: Gleichgewichtskonzentrationen aller Stoffe; Gesucht: Gleichgewichtskonstante Die Reaktion 2A + B 2C befindet sich im Gleichgewicht.
Berechnungen zum Massenwirkungsgesetz 1/13 Jakob 2010 Fall 1a: Gegeben: Gleichgewichtskonzentrationen aller Stoffe; Gesucht: Gleichgewichtskonstante Die Reaktion 2A + B 2C befindet sich im Gleichgewicht.
Bauhinweise Dampfbad Selbstbau:
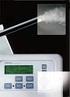 Bauhinweise Dampfbad Selbstbau: Kaiser Wellness +43 660 68 60 599 www.dampfgenerator.at office@kaiser-wellness.at Dampfbad Selbstbau Bauhinweise - Dampfbad Selbstbau: Das eigene Dampfbad, einfach selbst
Bauhinweise Dampfbad Selbstbau: Kaiser Wellness +43 660 68 60 599 www.dampfgenerator.at office@kaiser-wellness.at Dampfbad Selbstbau Bauhinweise - Dampfbad Selbstbau: Das eigene Dampfbad, einfach selbst
Info zum Zusammenhang von Auflösung und Genauigkeit
 Da es oft Nachfragen und Verständnisprobleme mit den oben genannten Begriffen gibt, möchten wir hier versuchen etwas Licht ins Dunkel zu bringen. Nehmen wir mal an, Sie haben ein Stück Wasserrohr mit der
Da es oft Nachfragen und Verständnisprobleme mit den oben genannten Begriffen gibt, möchten wir hier versuchen etwas Licht ins Dunkel zu bringen. Nehmen wir mal an, Sie haben ein Stück Wasserrohr mit der
Deoxidizer 6 Dekapierungsmittel für Aluminium - flüssiges, chromsäurehaltiges Produkt -
 18.02.2004 Gebrauchsanleitung Deoxidizer 6 Dekapierungsmittel für Aluminium - flüssiges, chromsäurehaltiges Produkt - Eigenschaften und Anwendungsgebiete: Deoxidizer 6 ist ein flüssiges Dekapierungsmittel.
18.02.2004 Gebrauchsanleitung Deoxidizer 6 Dekapierungsmittel für Aluminium - flüssiges, chromsäurehaltiges Produkt - Eigenschaften und Anwendungsgebiete: Deoxidizer 6 ist ein flüssiges Dekapierungsmittel.
Dem Schimmel Keine Chance
 Dem Schimmel Keine Chance Die Einsparung von Heizenergie ist heute von größter Bedeutung. Allerdings heizen viele Menschen aus falsch verstandener Sparsamkeit zu wenig oder falsch. Die unangenehme Folge:
Dem Schimmel Keine Chance Die Einsparung von Heizenergie ist heute von größter Bedeutung. Allerdings heizen viele Menschen aus falsch verstandener Sparsamkeit zu wenig oder falsch. Die unangenehme Folge:
Färbung mit AzurGel-K
 Arbeitsanleitung zur Färbung mit AzurGel-K für Gele im Format 10 x 10 x 0,1 cm Kat. Nr.: GF 10002 Ringstr. 4 64401 Gross-Bieberau Tel. ++49-6162-809840 Fax ++49-6162-8098420 www.anamed-gele.com Grundlage
Arbeitsanleitung zur Färbung mit AzurGel-K für Gele im Format 10 x 10 x 0,1 cm Kat. Nr.: GF 10002 Ringstr. 4 64401 Gross-Bieberau Tel. ++49-6162-809840 Fax ++49-6162-8098420 www.anamed-gele.com Grundlage
Die. Hersteller von Waschmitteln empfehlen die Verwendung einer gewissen Menge an Waschmittel. Damit die Wäsche auch wirklich sauber wird, sollte man
 Bei wie viel Grad wird normal verschmutzte Wäsche in der Waschmaschine wieder sauber? Die Hersteller von Waschmitteln empfehlen die Verwendung einer gewissen Menge an Waschmittel. Damit die Wäsche auch
Bei wie viel Grad wird normal verschmutzte Wäsche in der Waschmaschine wieder sauber? Die Hersteller von Waschmitteln empfehlen die Verwendung einer gewissen Menge an Waschmittel. Damit die Wäsche auch
Organisch-Chemisches Grundpraktikum. trans-1,2-cyclohexandiol
 rganischhemisches Grundpraktikum Präparat 06: trans1,2yclohexandiol Gliederung: I. Literatur... 1 II. Präparateigenschaften... 1 III. Stöchiometrische Reaktionsgleichung... 1 IV. Reaktionsmechanismus...
rganischhemisches Grundpraktikum Präparat 06: trans1,2yclohexandiol Gliederung: I. Literatur... 1 II. Präparateigenschaften... 1 III. Stöchiometrische Reaktionsgleichung... 1 IV. Reaktionsmechanismus...
Stationsunterricht im Physikunterricht der Klasse 10
 Oranke-Oberschule Berlin (Gymnasium) Konrad-Wolf-Straße 11 13055 Berlin Frau Dr. D. Meyerhöfer Stationsunterricht im Physikunterricht der Klasse 10 Experimente zur spezifischen Wärmekapazität von Körpern
Oranke-Oberschule Berlin (Gymnasium) Konrad-Wolf-Straße 11 13055 Berlin Frau Dr. D. Meyerhöfer Stationsunterricht im Physikunterricht der Klasse 10 Experimente zur spezifischen Wärmekapazität von Körpern
1.1 Auflösungsvermögen von Spektralapparaten
 Physikalisches Praktikum für Anfänger - Teil Gruppe Optik. Auflösungsvermögen von Spektralapparaten Einleitung - Motivation Die Untersuchung der Lichtemission bzw. Lichtabsorption von Molekülen und Atomen
Physikalisches Praktikum für Anfänger - Teil Gruppe Optik. Auflösungsvermögen von Spektralapparaten Einleitung - Motivation Die Untersuchung der Lichtemission bzw. Lichtabsorption von Molekülen und Atomen
Praktikum: Nachweis einer gentechnischen Veränderung in Lebensmitteln durch PCR
 Praktikum: Nachweis einer gentechnischen Veränderung in Lebensmitteln durch PCR Vorbereitung Lehrer Für jede Arbeitsgruppe werden 550 µl InstaGene-Matrix aliquotiert! Das Tube wird mit IG beschriftet!
Praktikum: Nachweis einer gentechnischen Veränderung in Lebensmitteln durch PCR Vorbereitung Lehrer Für jede Arbeitsgruppe werden 550 µl InstaGene-Matrix aliquotiert! Das Tube wird mit IG beschriftet!
Methoden zur Untersuchung von Papier, Karton und Pappe für Lebensmittelverpackungen und sonstige Bedarfsgegenstände
 Methoden zur Untersuchung von Papier, Karton und Pappe für Lebensmittelverpackungen und sonstige Bedarfsgegenstände 5. Bestimmung von Einzelsubstanzen 5.19 Levanase 1. Allgemeine Angaben Bezeichnung in
Methoden zur Untersuchung von Papier, Karton und Pappe für Lebensmittelverpackungen und sonstige Bedarfsgegenstände 5. Bestimmung von Einzelsubstanzen 5.19 Levanase 1. Allgemeine Angaben Bezeichnung in
STATION Gewässeruntersuchung
 STATION und Temperatur Material Stationen-Karte digitale ph-elektrode Flasche mit Leitungswasser Lagerungsflüssigkeit Präsenzmaterial Auswertung STATION der Geis Der gibt Auskunft darüber, ob das Gewässer
STATION und Temperatur Material Stationen-Karte digitale ph-elektrode Flasche mit Leitungswasser Lagerungsflüssigkeit Präsenzmaterial Auswertung STATION der Geis Der gibt Auskunft darüber, ob das Gewässer
Alle Schlüssel-Karten (blaue Rückseite) werden den Schlüssel-Farben nach sortiert und in vier getrennte Stapel mit der Bildseite nach oben gelegt.
 Gentlemen", bitte zur Kasse! Ravensburger Spiele Nr. 01 264 0 Autoren: Wolfgang Kramer und Jürgen P. K. Grunau Grafik: Erhard Dietl Ein Gaunerspiel für 3-6 Gentlemen" ab 10 Jahren Inhalt: 35 Tresor-Karten
Gentlemen", bitte zur Kasse! Ravensburger Spiele Nr. 01 264 0 Autoren: Wolfgang Kramer und Jürgen P. K. Grunau Grafik: Erhard Dietl Ein Gaunerspiel für 3-6 Gentlemen" ab 10 Jahren Inhalt: 35 Tresor-Karten
Löschen. 1. einen : Das Material muss sein. kein Feuer entstehen oder unterhalten werden. Zündtemperatur erreicht, kann ebenfalls kein Feuer
 Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Löschen 1. Was braucht man, damit ein Feuer brennt? Zum Entfachen eines Feuers braucht man: 1. einen : Das Material muss sein 2. : Ohne den notwendigen kann kein Feuer entstehen oder unterhalten werden
Mischungsrechnen. 2006 Berufskolleg Werther Brücke Wuppertal Autor: Hedwig Bäumer
 Seite 1 Beim gibt es zwei Aufgabengruppen. Die erste umfasst Aufgaben, die mit Hilfe der wirksamen Substanz ( = 100 % ) innerhalb einer Lösung oder mit der Mischungsformel errechnet werden können. Bei
Seite 1 Beim gibt es zwei Aufgabengruppen. Die erste umfasst Aufgaben, die mit Hilfe der wirksamen Substanz ( = 100 % ) innerhalb einer Lösung oder mit der Mischungsformel errechnet werden können. Bei
Protokoll des Versuches 7: Umwandlung von elektrischer Energie in Wärmeenergie
 Name: Matrikelnummer: Bachelor Biowissenschaften E-Mail: Physikalisches Anfängerpraktikum II Dozenten: Assistenten: Protokoll des Versuches 7: Umwandlung von elektrischer Energie in ärmeenergie Verantwortlicher
Name: Matrikelnummer: Bachelor Biowissenschaften E-Mail: Physikalisches Anfängerpraktikum II Dozenten: Assistenten: Protokoll des Versuches 7: Umwandlung von elektrischer Energie in ärmeenergie Verantwortlicher
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14
 Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
Seminar zum Quantitativen Anorganischen Praktikum WS 2013/14 Teil des Moduls MN-C-AlC S. Sahler, M. Wolberg Inhalt Mittwoch, 08.01.2014, Allgemeine Einführung in die Quantitative Analyse Glasgeräte und
Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse
 Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
Trennen von Farben Was Du brauchst: schwarzfarbige Filzstifte Wasser Kaffeefilter ein Streifen Filterpapier als Docht Schere Tasse Wie Du vorgehst: Schneide einen Kreis aus dem Kaffeefilter. Steche mit
