Massenspektrometrie. (Bilder aus Hesse, Meier, Zeeh: Spektroskopische Methoden in der Organischen Chemie)
|
|
|
- Ingelore Salzmann
- vor 7 Jahren
- Abrufe
Transkript
1 Massenspektrometrie (Bilder aus Hesse, Meier, Zeeh: Spektroskopische Methoden in der Organischen Chemie) Die Massenspektrometrie erlaubt die genaue Bestimmung der relativen Molekülmasse einer Verbindung und gibt durch charakteristische Bruchstücke (Framentionen) Hinweise auf ihre Struktur. Prinzip: Ein Massenspektometer besteht aus 4 Teilen: Probenzuführung, Ionen Erzeugung, Massentrennung und Ionen Nachweis. Alle Vorgänge ab der Ionenerzeugung finden im Hochvakuum statt, um unerwünschte Zusammenstöße zwischen Ionen und Molekülen zu vermeiden. Über Gas oder Direkteinlass (oft gekoppelt mit GC oder LC) wird die Probe als feiner Molekülstrahl über eine Schleuse (Leak) in den Raum zur Ionenerzeugung geführt. Hier findet die Ionisation statt, im einfachsten Fall durch einen senkrecht eintreffenden Elektronenstrahl. Zwischen Glühkathode und Anode herrscht eine Spanung von V, meist von 70 V, d.h., die Energie der Elektronen beträgt normalerweise 70eV (1 ev = 23 kcal/mol). Die beschleunigten Elektronen schlagen ihrerseits Elektronen aus der Probe heraus und bilden Molekülionen M +. In jüngerer Zeit sind viele mildere Ionisationsverfahren entwickelt worden, die im 2. Teil des Seminars behandelt werden. Abb. 1. Schematische Darstellung eines Massenspektrometers Die in der Ionenquelle entstandenen Molekülionen werden nun beschleunigt und fokussiert. Das geschieht durch Anlegen einer Spannung von V an die Ionenquelle, die die Teilchen durch einen Austrittsspalt beschleunigt. Im Analysatorteil wird nun ein Magnetfeld senkrecht zur Flugrichtung der Teilchen angelegt (Elektromagnet mit ~ 1 Tesla). Dadurch werden die leichteren Teilchen auf ihrer Flugbahn 1
2 stärker abgelenkt als die schwereren, d.h. sie fliegen auf masseabhängigen Ablenkradien. Es gilt die massenspektrometrische Grundgleichung: m/z = r 2 B 2 / 2 U Ablenkradius, Magnetfeldstärke und Beschleunigungsspannung bestimmen das Masse/Ladungs Verhältnis. Bei konstanter Beschleunigungsspannung und Magnetfeld gilt m/z = k r 2 Mit anderen Worten: Die Masse läßt sich direkt aus dem Quadrat des Ablenkradius berechnen. Hier erfolgt die Detektion durch viele Kollektoren oder eine Photoplatte. Werden die Beschleunigungsspannung und der Ablenkradius konstant gehalten, so gilt: m/z = k B 2 Mit anderen Worten: Die Masse läßt sich direkt aus dem Quadrat der variierenden Magnetfeldstärke berechnen. Hier wird zur Detektion nur ein Ionenauffänger verwendet (Spiegelgalvanometer), dessen Signal durch einen Sekundärelektronenvervielfacher verstärkt wird. Die elektrischen Signale werden als Massenspektrum aufgezeichnet. Bei doppelt geladenen Teilchen erhält man eine doppelt so starke Ablenkung, so dass ohne die m/z Korrektur im MS Spektrum nur die halbe Masse angezeigt wird. Das erkennt man aber leicht am Abstand der 13 C Isotopenlinien, der bei doppelt geladenen Teilchen M 2+ nur eine halbe Masseneinheit betragen darf. Abb. 2. Links: Spektren Darstellung schematisch am Beispiel von 1 Nitropropan. Rechts: Molekülregion des Massenspektrums von C 7 H 6 ClNO. Massenspektren tragen die Signalintensität gegen das Masse Ladungsverhältnis (m/z) auf, wobei die Intensität in % zum stärksten Peak wiedergegeben wird, der willkürlich als 100% gesetzt wird. Das Molekülion ist im allgemeinen der Peak der höchsten Masse, falls nicht weitere Protonen angelagert werden (oft bei Aminen und Alkoholen oder Carboxylaten: 2
3 M + +H) oder eine vollständige Fragmentierung zu leichteren Ionen stattfindet. Da es nur wenige Reinelemente gibt ( 19 F, 31 P), bilden die meisten organischen Verbindungen neben dem M + Peak kleinere Isotopenpeaks bei den nächsthöheren Massen aus. Die Höhe dieser Isotopenpeaks wird von der natürlichen Häufigkeit der Isotope und der Anzahl dieser Atome im betreffenden Molekül bestimmt. Besonders typisch sind Molekülionen von Verbindungen mit Elementen zweier häufiger Isotope wie S (32/34), Cl(35/37) oder Br(79/81). Als Faustregel hat sich außerdem der Zusammenhang zwischen einer geradzahligen Molekülmasse und einer geraden Anzahl an Stickstoffatomen (und umgekehrt) bewährt. Besonders genaue Massenspektrometer erlauben die Bestimmung der Massenzahl mit einer Auflösung von und darüber: A = m / Δm. Dadurch kann die Elementzusammensetzung berechnet werden, denn jedes Element trägt eine charakteristische Atommasse bei. So lassen sich leicht drei Ionen der Masse m/z = 28 voneinander unterscheiden: 12 C 16 O: vs. 1 H 12 2 C 12 C 1 H 2 = vs. 14 N 14 N = Achtung: Bei der Hochauflösung rechnet man immer mit den Absolutmassen der reinen Isotope und nicht mit den relativen Atommassen der natürlichen Mischung; letztere wird nur bei der Elementaranalyse benötigt! Die hochaufgelöste Masse (HRMS) dient auch zum Nachweis für neue Verbindungen, sie muss bei Molekülen mittlerer Größe mindestens bis zur dritten Nachkommastelle mit der berechneten Masse übereinstimmen. Fragmentierung: Bei den klassischen Ionisationsmethoden führt die hohe Energie von Elektronenstrahlen (Elektronenstoßionisation EI) oder schnellen Molekülen (chemische Ionisation CI) meist zum Zerfall des primär gebildeten Molekülions M +. Dabei bildet sich immer ein Radikal und ein kationisches Fragment, von denen nur letzteres im MS Spektrum auftaucht. Auch das Tochterion kann weiter fragmentieren und führt evtl. zu einem weiteren Ion zweiter Generation. Die häufigsten Zerfallsprozesse im Massenspektrometer sind gut bekannt und folgen einigen wenigen Pfaden, die interessanterweise den Zerfallsreaktionen elektronisch angeregter Moleküle in der Photochemie stark ähneln. Sie können ebenfalls wichtige Strukturhinweise liefern und sollen im folgenden dargestellt werden. α Spaltung (Norrish Typ I Reaktion): Besonders leicht lassen sich Elektronen aus den nichtbindenden Elektronenpaaren von Heteroatomen herauslösen (vgl. n π* Anregung in der Photochemie). Daher bilden sich leicht Mokekülionen mit positiver Ladung und einsamem Elektron am Heteroatom (Alkohole, Ether, Carbonylverbindungen). Hier kann durch Spaltung der α Bindung zum Heteroatom (nicht zur Carbonylgruppe!) eine Elektronenpaarung stattfinden und es entsteht ein 3
4 Oxoniumkation plus ein abgespaltenes Alkylradikal, welches natürlich im MS Spektrum unsichtbar bleibt. Abb. 3. Massenspektrum von 2 Butanon und seine Hauptfragmentierung durch α Spaltung. Bei Cycloalkanonen ändert sich die nach α Spaltung gebildete Masse nicht. Hier findet eine Stabilisierung des gebildeten primären Radikals durch H Übertragung aus der aktivierten C 2 Position zur Carbonylgruppe statt. Das dabei gebildete mesomeriestabilisierte Radikalkation fragmentiert weiter zum Alkylradikal und zum Acrolein Kation mit der typischen Masse m/z = 55. Abb. 4. Massenspektrum und Fragmentierung von Cyclohexanon. An alle α Spaltungen kann sich nachfolgend ein CO Verlust (28 amu) anschließen. Benzyl und Allylspaltung Auch Aromaten und Doppelbindungen können die benachbarten benzylischen oder allylischen Positionen aktivieren. Alkylbenzole tragen deshalb zunächst die positive Ladung im Benzolaromaten, fragmentieren dann zu Alkylradikalen und dem Benzylkation, welches erstens mesomeriestabilisiert ist und zusätzlich zum besonders stabilen aromatischen 4
5 Tropyliumkation umlagern kann (m/z = 91). Die Phenylspaltung dagegen führt zum energiereicheren Phenylkation (m/z = 77) und ist viel ungünstiger. Terminale Alkene tragen die positive Ladung an der Doppelbindung und spalten gerne zum Alkylradikal und Allylkation (m/z = 41), das oft sogar den Basispeak bildet. Abb. 5. Massenspektrum von n Butylbenzol und seine Fragmentierungspfade unter Benzylspaltung. Spaltung nichtaktivierter Bindungen Einfache Alkane haben keine Achillesferse also keine Molekülgruppe, die wie Heteroatome, Aromaten oder Doppelbindungen eine zu spaltende Bindung aktivieren. Hier ist die Wahrscheinlichkeit zur Spaltung für jede C C Bindung gleich. Statistisch gesehen ist die Bildung von Fragmenten aus drei oder vier C Atomen am günstigsten und nimmt zu größeren Ionen gleichmäßig asymptotisch ab. Ausnahme ist die Spaltung ganz außen, die zum energiereichen Methylkation bzw. Methylradikal führen würde und vermieden wird. Dafür bleibt der Molekülionenpeak relativ groß und deutlich erkennbar. Dieses typische Muster geradkettiger Alkane sollte man sich einprägen. Verzweigte Alkane fragmentieren bevorzugt an den Verzweigungsstellen, weil dort sekundäre stabilere Carbeniumionen gebildet werden können, die oft typische Fragmentionen bilden. 5
6 Abb. 6. Massenspektrum von Hexadecan (unverzweigt) und von 7 Propyltridecan (verzweigt). Retro Diels Alder Reaktion Sechsliedrige cyclische Ringe mit einer Doppelbindung (Cyclohexene) können durch eine Cycloreversion in zwei Bruchstücke zerfallen. Die Ringe können auch N bzw. O Heteroatome enthalten wie z. B. Chinoline, Isochinoline (Basispeak m/z = 104) und Flavone. Die RDA Fragmentiering ist eine Neutralreaktion, denn es wird ein Neutralteilchen mit Doppelbindung (z. B. ein Alken) ausgeschnitten. Am Beispiel des Tetrahydrocarbazols wird deutlich, wie aus einem Radikalkation (M +. ) durch Ethenabspaltung konzertiert oder auch nichtkonzertiert das Fragmention m/z = 143 entsteht, welches wieder ein Radikalkation darstellt. Abb. 7. Massenspektrum von 1,2,3,4 Tetrahydrocarbazol und der konzertierte oder nichtkonzertierte Mechanismus seiner RDA Reaktion im Massenspektrometer. 6
7 McLafferty Umlagerung (Norrish Typ II Reaktion) Statt der eingangs behandelten α Spaltung können Moleküle mit Akzeptor Doppelbindungen (Carbonylverbindungen, Imine) auch eine β Spaltung mit H Verschiebung eingehen. Dabei übernimmt das Heteroatom der Doppelbindung den γ ständigen Wasserstoff, es bildet sich eine neue Doppelbindung zwischen β und γ C Atom und die Bindung zwischen α und β C Atom wird gebrochen. So entstehen charakteristische Bruchstücke, z. B. für Methylester das Radikalkation m/z = 74, für freie aliphatische Carbonsäuren m/z = 60 oder für Benzoesäureester das Radikalkation m/z = 122. Abb. 8. Massenspektrum von Butansäure methylester und seine Fragmentierung mit McLafferty Umlagerung. Onium Reaktion Kationische Heteroatome tragen in Fragmentionen oft die positive Ladung, wie besonders in Ammonium, aber auch in Oxonium, Phosphonium und Sulfoniumionen. Hier kann ein besonderer Typ von Umlagerung eintreten, bei dem ein H Atom aus einem Alkylrest auf den Stickstoff (bzw. O, P, S) übertragen wird. Besonders häufig findet man solche Reaktionen bei Aminen wie z. B. Alkaloiden. In einem typischen Fall wird aus dem Radikalkation von N Isopropyl N butyl N methylamin durch α Spaltung das Iminiumion ab oder ac gebildet. Hier kann nun jeweils ein ganzer Alkylrest unter H Transfer auf das N Atom abgespalten werden. Der Alkylrest kann das H Atom aus unterschiedlichen Positionen liefern und bildet dabei folglich entweder ein terminales Alken oder ein Cycloalkan. 7
8 Abb. 9. Massenspektrum von N Isopropyl N butyl N methylamin und seine Fragmentierungspfade durch α Spaltung und Onium Reaktion. Ähnlich können Ether und Thioether aus dem Radikalkation nach α Spaltung zu Oxoniumkationen unter H Transfer aus dem Alkylrest kleinere Oxoniumionen bilden, z. B. das minimale m/z = 31. Abb. 10. Massenspektrum von n Butylethylether und seine Fragmentierung durch α Spaltung und Onium Reaktion. 8
Spektroskopie-Seminar SS 18 8 Massenspektrometrie Massenspektrometrie
 SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
Fragmentierungs-Reaktionen - 1
 Spektroskopie in der rganischen hemie Fragmentierungs-Reaktionen - 1 Weil nicht alle Bindungen in einem Molekül gleich fest sind, verlaufen Fragmentierungen nicht regellos und zufällig, sondern meist nach
Spektroskopie in der rganischen hemie Fragmentierungs-Reaktionen - 1 Weil nicht alle Bindungen in einem Molekül gleich fest sind, verlaufen Fragmentierungen nicht regellos und zufällig, sondern meist nach
Was bedeutet CH 3 OH?
 Was bedeutet CH 3 OH? 1 C 1 H H 17 O MS Einleitung 1 Worin unterscheiden sich diese Moleküle? MS Einleitung Richtig, sie unterscheiden sich in der Masse! MS Einleitung 3 Aber woher kommt unser Wissen über
Was bedeutet CH 3 OH? 1 C 1 H H 17 O MS Einleitung 1 Worin unterscheiden sich diese Moleküle? MS Einleitung Richtig, sie unterscheiden sich in der Masse! MS Einleitung 3 Aber woher kommt unser Wissen über
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Teil 4 Massenspektrometrie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Funktionseinheiten eines Massenspektrometers Grundprinzip der MS: Trennung von Ionen nach
Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality 1 Funktionseinheiten eines Massenspektrometers Grundprinzip der MS: Trennung von Ionen nach
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Übungen zur Massenspektrometrie
 Übungen zur Massenspektrometrie T.Lehmann, SS97 / WS2013 1 Sie sehen nachfolgend das erste Massenspektrum, das Sie auswerten sollen. Die Ordinate ist eine Prozentskala, die dem intensivsten Peak die Intensität
Übungen zur Massenspektrometrie T.Lehmann, SS97 / WS2013 1 Sie sehen nachfolgend das erste Massenspektrum, das Sie auswerten sollen. Die Ordinate ist eine Prozentskala, die dem intensivsten Peak die Intensität
2 Massenspektrometrie
 2 Massenspektrometrie 2.1 Grundlagen relative Atommasse Massenzahl Summe relative Molekülmasse M Isotope ein Element gleiche Protonenzahl, aber verschiedene Neutronenzahl Isobare Teilchen gleicher Masse,
2 Massenspektrometrie 2.1 Grundlagen relative Atommasse Massenzahl Summe relative Molekülmasse M Isotope ein Element gleiche Protonenzahl, aber verschiedene Neutronenzahl Isobare Teilchen gleicher Masse,
Seminar WiSe 2015/2016
 Massenspektrometrie Seminar WiSe 2015/2016 PD Dr. Markus Nett Nachwuchsgruppenleiter Libi Leibniz Institut i für Naturstoff Forschung und Infektionsbiologie i E mail: markus.nett@hki jena.de Grundvorgänge
Massenspektrometrie Seminar WiSe 2015/2016 PD Dr. Markus Nett Nachwuchsgruppenleiter Libi Leibniz Institut i für Naturstoff Forschung und Infektionsbiologie i E mail: markus.nett@hki jena.de Grundvorgänge
1 Terminologie. 1) Die Bezeichnung Massenspektroskop wird praktisch nicht mehr verwendet; für Massenspektrograph siehe Abschnitt
 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 Teil I Grundlagen O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 O:/Wiley/Budzikiewicz/3d/c01.3d from 13.06.2012 13:11:03 3 1 Terminologie
Terminologie. Die Ausdrücke Massenspektrometer
 I Grundlagen Massenspektrometrie, Fünfte Auflage. H. Budzikiewicz, M. Schäfer Copyright 2005 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN: 3-527-30822-9 7 1 Terminologie Ein Massenspektrometer ist
I Grundlagen Massenspektrometrie, Fünfte Auflage. H. Budzikiewicz, M. Schäfer Copyright 2005 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN: 3-527-30822-9 7 1 Terminologie Ein Massenspektrometer ist
Spektroskopie in der Organischen Chemie. Massenspektren
 Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
Massenspektren In der Frühzeit der MS wurden Spektren auf Fotopapier registriert, wobei das Spektrum mehrfach mit unterschiedlicher Ordinatenauslenkung ausgeschrieben wurde, um sehr schwache neben sehr
ZHAW / N / CH / Analytische Chemie
 Analytische Chemie Kurztest 3 Dauer: Minuten Erlaubte Hilfsmittel: Vorlesungsunterlagen, Lehrbücher, Taschenrechner und eigene Formelsammlungen Alle Berechnungen sind am Schluss zusammen mit diesen Aufgabenblättern
Analytische Chemie Kurztest 3 Dauer: Minuten Erlaubte Hilfsmittel: Vorlesungsunterlagen, Lehrbücher, Taschenrechner und eigene Formelsammlungen Alle Berechnungen sind am Schluss zusammen mit diesen Aufgabenblättern
Literatur zur Massenspektrometrie
 Literatur zur Massenspektrometrie 1. M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie. Georg Thieme Verlag, Stuttgart, 8. Auflage 2012, 79.95; ISBN 9783135761084 Behandelt
Literatur zur Massenspektrometrie 1. M. Hesse, H. Meier, B. Zeeh: Spektroskopische Methoden in der organischen Chemie. Georg Thieme Verlag, Stuttgart, 8. Auflage 2012, 79.95; ISBN 9783135761084 Behandelt
1. Isotopie und Präzisionsmasse 2. Erkennung/Eigenschaften des Molekülions 3. Fragmentierung (ungeradelektronischer Ionen)
 Interpretation von Massenspektren 1. Isotopie und Präzisionsmasse 2. Erkennung/Eigenschaften des Molekülions 3. Fragmentierung (ungeradelektronischer Ionen) 1 EI-Massenspektrum (Acetophenon, M = 120):
Interpretation von Massenspektren 1. Isotopie und Präzisionsmasse 2. Erkennung/Eigenschaften des Molekülions 3. Fragmentierung (ungeradelektronischer Ionen) 1 EI-Massenspektrum (Acetophenon, M = 120):
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
Autor: Cornelia Spee Tag der Versuchdurchführung: 31.3.2008. Versuch I2. Massenspektrometrie
 Autor: Tag der Versuchdurchführung: 31.3.2008 Versuch I2 Massenspektrometrie 1. Zusammenfassung Die Massenspektrometrie stellt eine wichtige Methode zur Strukturanalyse, sowie zur Bestimmung von Massen
Autor: Tag der Versuchdurchführung: 31.3.2008 Versuch I2 Massenspektrometrie 1. Zusammenfassung Die Massenspektrometrie stellt eine wichtige Methode zur Strukturanalyse, sowie zur Bestimmung von Massen
Teil 4 Massenspektrometrie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick auf die letzte Vorlesung Grundprinzip der MS: Trennung nach Ladung und Masse
Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality 1 Rückblick auf die letzte Vorlesung Grundprinzip der MS: Trennung nach Ladung und Masse
Aufbau und Funktionsweise eines Massenspektrometers
 Aufbau und Funktionsweise eines Massenspektrometers Anwendung von elektrischen und magnetischen Feldern in der Massenspektrometrie Facharbeit von Patrick Robrecht im Grundkurs Physik am Reismann-Gymnasium
Aufbau und Funktionsweise eines Massenspektrometers Anwendung von elektrischen und magnetischen Feldern in der Massenspektrometrie Facharbeit von Patrick Robrecht im Grundkurs Physik am Reismann-Gymnasium
Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden:
 Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
Cusanus-Gymnasium Wittlich W. Zimmer 1/5 Die Einheit Mol Stoffmengen können in verschiedenen Einheiten gemessen werden: a) durch die Angabe ihrer Masse b) durch die Angabe ihres Volumens c) durch die Anzahl
38. Lektion Wie alt ist Ötzi wirklich, oder wie wird eine Altersbestimmung durchgeführt?
 38. Lektion Wie alt ist Ötzi wirklich, oder wie wird eine Altersbestimmung durchgeführt? Lernziel: Radioaktive Isotope geben Auskunft über das Alter von organischen Materialien, von Gesteinen und von der
38. Lektion Wie alt ist Ötzi wirklich, oder wie wird eine Altersbestimmung durchgeführt? Lernziel: Radioaktive Isotope geben Auskunft über das Alter von organischen Materialien, von Gesteinen und von der
Aufgaben zu elektrischen und magnetischen Feldern (aus dem WWW) a) Feldstärke E b) magnetische Flussdichte B
 Aufgabe 73 (Elektrizitätslehre, Lorentzkraft) Elektronen treten mit der Geschwindigkeit 2,0 10 5 m in ein homogenes elektrisches Feld ein s und durchlaufen es auf einer Strecke von s = 20 cm. Die Polung
Aufgabe 73 (Elektrizitätslehre, Lorentzkraft) Elektronen treten mit der Geschwindigkeit 2,0 10 5 m in ein homogenes elektrisches Feld ein s und durchlaufen es auf einer Strecke von s = 20 cm. Die Polung
Fragmentierung geradelektronischer Ionen
 Fragmentierung geradelektronischer Ionen Problem: unterschiedliche Fragmentierungswege für geradelektronische Ionen [M+H] +, [M-H] - und Radikalionen [M] + umfangreiche Kenntnisse über die Fragmentierung
Fragmentierung geradelektronischer Ionen Problem: unterschiedliche Fragmentierungswege für geradelektronische Ionen [M+H] +, [M-H] - und Radikalionen [M] + umfangreiche Kenntnisse über die Fragmentierung
Massenspektrometrie II
 Massenspektrometrie II (Bilder aus Hesse, Meier, Zeeh: Spektroskopische Methoden in der Organischen Chemie) Moderne Ionisationsmethoden Neuentwicklungen in der Massenspektrometrie erfolgten in den letzten
Massenspektrometrie II (Bilder aus Hesse, Meier, Zeeh: Spektroskopische Methoden in der Organischen Chemie) Moderne Ionisationsmethoden Neuentwicklungen in der Massenspektrometrie erfolgten in den letzten
Kombinierte Übungen zur Spektroskopie Beispiele für die Bearbeitung
 Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
III. Strukturbestimmung organischer Moleküle
 III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
Inhaltsverzeichnis. Vorwort zur 6. Auflage XI Aus dem Vorwort zur 1. Auflage XIII. Einleitung. Teil I Grundlagen 1.
 O:/Wiley/Budzikiewicz/3d/ftoc.3d from 13.06.2012 13:10:49 V Vorwort zur 6. Auflage XI Aus dem Vorwort zur 1. Auflage XIII Einleitung XV Teil I Grundlagen 1 1 Terminologie 3 2 Apparative Grundlagen 9 2.1
O:/Wiley/Budzikiewicz/3d/ftoc.3d from 13.06.2012 13:10:49 V Vorwort zur 6. Auflage XI Aus dem Vorwort zur 1. Auflage XIII Einleitung XV Teil I Grundlagen 1 1 Terminologie 3 2 Apparative Grundlagen 9 2.1
Bioanalytik Zusatzinformation: Massenspektrometrie 012_001. BioAnalytik
 Bioanalytik 11.01.16 Zusatzinformation: Massenspektrometrie 012_001 Rev. 1.5 091206 - Standort Recklinghausen- Wintersemester 2015-16 2015-2016 : 1 Folienbasis: Prof. Beyer Massenspektrometrie Einführung
Bioanalytik 11.01.16 Zusatzinformation: Massenspektrometrie 012_001 Rev. 1.5 091206 - Standort Recklinghausen- Wintersemester 2015-16 2015-2016 : 1 Folienbasis: Prof. Beyer Massenspektrometrie Einführung
Schema eines Massenspektrometer-Systems
 Vakuumsystem Probe - 8-5 Druck 10... 10 hpa Einlaßsystem Ionenquelle Massenanalysator Detektor Signalverarbeitung Ausgabe Schema eines Massenspektrometer-Systems Einlasssystem für direkte Probenaufgabe
Vakuumsystem Probe - 8-5 Druck 10... 10 hpa Einlaßsystem Ionenquelle Massenanalysator Detektor Signalverarbeitung Ausgabe Schema eines Massenspektrometer-Systems Einlasssystem für direkte Probenaufgabe
Chemie-Grundwissen der 9.Klasse
 Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
Chemie-Grundwissen der 9.Klasse Stoffebene = Makroskopische (sichtbare) Ebene Betrachtung einer Stoffportion mit den erkennbaren und messbaren Eigenschaften Teilchenebene = Submikroskopische Ebene Betrachtung
~WILEY. Massenspektrometrie YCH. Herbert Budzikiewicz und Mathias Schäfer. Eine Einführung. 6., vollständig überarbeitete und aktualisierte Auflage
 Herbert Budzikiewicz und Mathias Schäfer Massenspektrometrie Eine Einführung 6., vollständig überarbeitete und aktualisierte Auflage ~WILEY YCH WILEY-VCH Verlag GmbH & Co. KGaA Vorwort zur 6. Auflage XI
Herbert Budzikiewicz und Mathias Schäfer Massenspektrometrie Eine Einführung 6., vollständig überarbeitete und aktualisierte Auflage ~WILEY YCH WILEY-VCH Verlag GmbH & Co. KGaA Vorwort zur 6. Auflage XI
Strukturanalytik organischer und anorganischer Verbindungen
 Manfred Reichenbächer, Jürgen Popp Strukturanalytik organischer und anorganischer Verbindungen Ein Übungsbuch Teubner Vorwort V VII 1 Massenspektrometrie 1 1.1 Einführung 1 Übung 1.1 7 1.2 Das Molekülion
Manfred Reichenbächer, Jürgen Popp Strukturanalytik organischer und anorganischer Verbindungen Ein Übungsbuch Teubner Vorwort V VII 1 Massenspektrometrie 1 1.1 Einführung 1 Übung 1.1 7 1.2 Das Molekülion
Massenspektrometrie Eine Einführung
 Herbert Budzikiewicz, Mathias Schäfer Massenspektrometrie Eine Einführung Fünfte, vollständig überarbeitete und aktualisierte Auflage WILEY- VCH WILEY-VCH Verlag GmbH & Co. KGaA Inhaltsverzeichnis Vorwort
Herbert Budzikiewicz, Mathias Schäfer Massenspektrometrie Eine Einführung Fünfte, vollständig überarbeitete und aktualisierte Auflage WILEY- VCH WILEY-VCH Verlag GmbH & Co. KGaA Inhaltsverzeichnis Vorwort
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Thema heute: Aufbau der Materie, Atommodelle Teil 2
 Wiederholung der letzten Vorlesungsstunde: Atomistischer Aufbau der Materie, historische Entwicklung des Atombegriffes Atome Thema heute: Aufbau der Materie, Atommodelle Teil 2 Vorlesung Allgemeine Chemie,
Wiederholung der letzten Vorlesungsstunde: Atomistischer Aufbau der Materie, historische Entwicklung des Atombegriffes Atome Thema heute: Aufbau der Materie, Atommodelle Teil 2 Vorlesung Allgemeine Chemie,
Teil 4 Massenspektrometrie. Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2015/16
 Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2015/16 www.ruhr-uni-bochum.de/chirality 1 Rückblick auf die letzte Vorlesung Grundprinzip der MS: Trennung nach Ladung und Masse
Teil 4 Massenspektrometrie Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2015/16 www.ruhr-uni-bochum.de/chirality 1 Rückblick auf die letzte Vorlesung Grundprinzip der MS: Trennung nach Ladung und Masse
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
2.3 Photoionisation. 2.3 Photoionisation -25-
 2.3 Photoionisation -25-2.3 Photoionisation Da die resonante Mehrphotonenionisierung ein Spezialfall der Photoionisation ist, soll im Folgenden zunächst ein allgemeiner Überblick über die Photoelektronenspektroskopie,
2.3 Photoionisation -25-2.3 Photoionisation Da die resonante Mehrphotonenionisierung ein Spezialfall der Photoionisation ist, soll im Folgenden zunächst ein allgemeiner Überblick über die Photoelektronenspektroskopie,
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Physik Kursstufe Aufgaben / ÜA 03 Elektromagnete, Kraft auf Leiter B. Kopetschke 2010 Aufgaben zu Elektromagneten, Kraft auf Leiter
 Aufgaben zu Elektromagneten, Kraft auf Leiter Aufgabe 1) Der Lehrer hat hnen die Funktionsweise eines Drehspulinstrumentes erklärt. Welche Kraft erfahren die 100 Drahtstücke der Länge s = 3,0 cm die sich
Aufgaben zu Elektromagneten, Kraft auf Leiter Aufgabe 1) Der Lehrer hat hnen die Funktionsweise eines Drehspulinstrumentes erklärt. Welche Kraft erfahren die 100 Drahtstücke der Länge s = 3,0 cm die sich
P105. Konstitution. Massenspektrum 100 % m/z
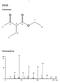 1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
v q,m Aufgabensammlung Experimentalphysik für ET
 Experimentalphysik für ET Aufgabensammlung 1. E-Felder Auf einen Plattenkondensator mit quadratischen Platten der Kantenlänge a und dem Plattenabstand d werde die Ladung Q aufgebracht, bevor er vom Netz
Experimentalphysik für ET Aufgabensammlung 1. E-Felder Auf einen Plattenkondensator mit quadratischen Platten der Kantenlänge a und dem Plattenabstand d werde die Ladung Q aufgebracht, bevor er vom Netz
Das Magnetfeld. Das elektrische Feld
 Seite 1 von 5 Magnetisches und elektrisches Feld Das Magnetfeld beschreibt Eigenschaften der Umgebung eines Magneten. Auch bewegte Ladungen rufen Magnetfelder hervor. Mithilfe von Feldlinienbilder können
Seite 1 von 5 Magnetisches und elektrisches Feld Das Magnetfeld beschreibt Eigenschaften der Umgebung eines Magneten. Auch bewegte Ladungen rufen Magnetfelder hervor. Mithilfe von Feldlinienbilder können
4 Die Atombindung im Wasserstoff-Molekül
 4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Massenspektrometrie organischer Moleküle. 1. Apparativer Aufbau
 Ein Massenspektrometer ist ein Instrument, das aus einer Substanzprobe einen Strahl gasförmiger Ionen erzeugt, diese nach Masse und Ladung trennt und schließlich ein Massenspektrum liefert, aus dem abgelesen
Ein Massenspektrometer ist ein Instrument, das aus einer Substanzprobe einen Strahl gasförmiger Ionen erzeugt, diese nach Masse und Ladung trennt und schließlich ein Massenspektrum liefert, aus dem abgelesen
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Lösungen der Kontrollaufgaben
 Lösungen der Kontrollaufgaben Lösungen zu den Kontrollaufgaben 1.1 1.) 1000 2.) Glas und PVC ziehen einander an. - Begründung: Da offenbar Hartgummi und PVC gleichartig geladen sind (Abstossung), Glas
Lösungen der Kontrollaufgaben Lösungen zu den Kontrollaufgaben 1.1 1.) 1000 2.) Glas und PVC ziehen einander an. - Begründung: Da offenbar Hartgummi und PVC gleichartig geladen sind (Abstossung), Glas
d = 1, 5cm ) liegt eine Spannung von
 Aufgabe E-Feld Blau 1: Elektronen werden in einem Plattenkondensator von der Geschwindigkeit m v 0 s 0 auf die Geschwindigkeit beschleunigt. An den Platten (Abstand U 120V an. Wie groß ist v? = 1 d = 1,
Aufgabe E-Feld Blau 1: Elektronen werden in einem Plattenkondensator von der Geschwindigkeit m v 0 s 0 auf die Geschwindigkeit beschleunigt. An den Platten (Abstand U 120V an. Wie groß ist v? = 1 d = 1,
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Reizleitung in Nervenzellen. Nervenzelle unter einem Rasterelektronenmikroskop
 Reizleitung in Nervenzellen Nervenzelle unter einem Rasterelektronenmikroskop Gliederung: 1. Aufbau von Nervenzellen 2. Das Ruhepotential 3. Das Aktionspotential 4. Das Membranpotential 5. Reizweiterleitung
Reizleitung in Nervenzellen Nervenzelle unter einem Rasterelektronenmikroskop Gliederung: 1. Aufbau von Nervenzellen 2. Das Ruhepotential 3. Das Aktionspotential 4. Das Membranpotential 5. Reizweiterleitung
Grundwissen Chemie 9. Jahrgangsstufe
 Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Grundwissen Chemie 9. Jahrgangsstufe 1. Stoffe und Reaktionen Gemisch: Stoff, der aus mindestens zwei Reinstoffen besteht. Homogen: einzelne Bestandteile nicht erkennbar Gasgemisch z.b. Legierung Reinstoff
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006
 Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Mittwoch, 27. September 2006 Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2006 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Robert-Koch-Gymnasium Deggendorf. Grundwissen Chemie. 8. Jahrgangsstufe
 Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Robert-Koch-Gymnasium Deggendorf Grundwissen Chemie 8. Jahrgangsstufe Teilchenmodell und Stoffeigenschaften Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, vereinfacht dargestellt als Kugeln.
Protokoll. Kombinierte Anwendung verschiedener Spektroskopischer Methoden
 Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Aufbau des Atomkerns a) Gib an, aus wie vielen Protonen und Neutronen die
 Aufbau des Atomkerns a) Gib an, aus wie vielen Protonen und Neutronen die Atomkerne von Cl bestehen. b) Erkläre, was man unter Isotopen versteht. Gib ein Beispiel an. 3, Cl c) Im Periodensystem wird die
Aufbau des Atomkerns a) Gib an, aus wie vielen Protonen und Neutronen die Atomkerne von Cl bestehen. b) Erkläre, was man unter Isotopen versteht. Gib ein Beispiel an. 3, Cl c) Im Periodensystem wird die
1. Bedeutung der Oxidationszahlen
 1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
1. Bedeutung der Oxidationszahlen Unterschiedliche Atome geben eine unterschiedliche Zahl an Elektronen ab: Dann hat das Atom eine positive Oxidationsstufe; das Atom ist mit weniger Elektronen als Protonen
Schriftliche Prüfung BSc Frühling 2006 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden
 Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Kernmagnetische Resonanzspektroskopie (NMR) Spektroskopische Methoden Grundlagen Die meisten Atomkerne führen eine Drehbewegung um die eigene Achse aus ("Spin"). Da sie geladene Teilchen (Protonen) enthalten,
Versuch P4: Ladungen in elektrischen und magnetischen Feldern
 Physikalisches Praktikum für Pharmazeuten Gruppennummer Name Vortestat Endtestat Name Versuch A. Vorbereitungsteil (VOR der Versuchsdurchführung lesen!) 1. Kurzbeschreibung In diesem Versuch werden die
Physikalisches Praktikum für Pharmazeuten Gruppennummer Name Vortestat Endtestat Name Versuch A. Vorbereitungsteil (VOR der Versuchsdurchführung lesen!) 1. Kurzbeschreibung In diesem Versuch werden die
27. Vorlesung EP V. STRAHLUNG, ATOME, KERNE
 27. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 28. Atomphysik, Röntgenstrahlung (Fortsetzung: Röntgenröhre, Röntgenabsorption) 29. Atomkerne, Radioaktivität (Nuklidkarte, α-, β-, γ-aktivität, Dosimetrie)
27. Vorlesung EP V. STRAHLUNG, ATOME, KERNE 28. Atomphysik, Röntgenstrahlung (Fortsetzung: Röntgenröhre, Röntgenabsorption) 29. Atomkerne, Radioaktivität (Nuklidkarte, α-, β-, γ-aktivität, Dosimetrie)
Beispiele für Ladungstrennung
 Nennen und erläutern Sie Beispiele für Vorgänge aus Natur, Technik und Alltag, bei denen Ladungstrennung auftritt! Welche Effekte können damit verbunden sein? Beispiele für Ladungstrennung Eine Ladungstrennung
Nennen und erläutern Sie Beispiele für Vorgänge aus Natur, Technik und Alltag, bei denen Ladungstrennung auftritt! Welche Effekte können damit verbunden sein? Beispiele für Ladungstrennung Eine Ladungstrennung
Bestimmung der Struktur einer (un)bekannten Verbindung
 Bestimmung der Struktur einer (un)bekannten Verbindung Elementaranalyse Massenspektroskopie andere spektroskopische Methoden Röntgen- Strukturanalyse Kernmagnetische Resonanz - Spektroskopie neue Produktlinie,
Bestimmung der Struktur einer (un)bekannten Verbindung Elementaranalyse Massenspektroskopie andere spektroskopische Methoden Röntgen- Strukturanalyse Kernmagnetische Resonanz - Spektroskopie neue Produktlinie,
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
13. Amine und ihre Derivate
 Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
10. Spezielle Relativitätstheorie
 10. Spezielle Relativitätstheorie Die Masse eines Teilchens ist abhängig von seiner Geschwindigkeit. m = m = γ m γ = 1, 1 v c 0 = 1 1 β 1 m 0 v β = c v c c: Lichtgeschwindigkeit im Vakuum mo: Ruhemasse
10. Spezielle Relativitätstheorie Die Masse eines Teilchens ist abhängig von seiner Geschwindigkeit. m = m = γ m γ = 1, 1 v c 0 = 1 1 β 1 m 0 v β = c v c c: Lichtgeschwindigkeit im Vakuum mo: Ruhemasse
Absorption von Röntgenstrahlung (Wellenlängen-Abhängigkeit)
 Elektromagnetische Strahlung Absorption von Röntgenstrahlung (Wellenlängen-Abhängigkeit) Röntgenstrahlung besteht aus elektromagnetischen Wellen. Der Wellenlängenbereich erstreckt sich von etwa 10 nm bis
Elektromagnetische Strahlung Absorption von Röntgenstrahlung (Wellenlängen-Abhängigkeit) Röntgenstrahlung besteht aus elektromagnetischen Wellen. Der Wellenlängenbereich erstreckt sich von etwa 10 nm bis
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14
 Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 4: Isomerie, Gibbs-Helmholtz-Gleichung, Katalysator, Addition an Alkene, funktionelle Gruppen, Säure/Base 1) Ordnen Sie die folgenden
Chemie für Studierende der Human- und Zahnmedizin WS 2013/14 Übungsblatt 4: Isomerie, Gibbs-Helmholtz-Gleichung, Katalysator, Addition an Alkene, funktionelle Gruppen, Säure/Base 1) Ordnen Sie die folgenden
Schriftliche Prüfung BSc Frühling 2014
 Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 1. Februar 2014 Schriftliche Prüfung BSc Frühling 2014 D CHAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Kernphysik I. Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel
 Kernphysik I Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel Massendefekt und Bindungsenergie Kerne sind die einzigen gebundenen Systeme,
Kernphysik I Grundlegende Eigenschaften der Atomkerne: Bindungs-, Separationsenergie Massenmessungen Weizsäcker Massenformel Massendefekt und Bindungsenergie Kerne sind die einzigen gebundenen Systeme,
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
2. Radikalische Substitution 2.1
 2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
2. Radikalische Substitution 2.1 Die Radikalische Substitution Alkane sind im Vergleich zu den Alkenen sehr reaktionsträge. Alkane zählen zu den gesättigten, Alkene zu den ungesättigten Kohlenwasserstoffen.
Vorlesung OC-V. Carbeniumionen
 Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Radioaktivität. den 7 Oktober Dr. Emőke Bódis
 Radioaktivität den 7 Oktober 2016 Dr. Emőke Bódis Prüfungsfrage Die Eigenschaften und Entstehung der radioaktiver Strahlungen: Alpha- Beta- und Gamma- Strahlungen. Aktivität. Zerfallgesetz. Halbwertzeit.
Radioaktivität den 7 Oktober 2016 Dr. Emőke Bódis Prüfungsfrage Die Eigenschaften und Entstehung der radioaktiver Strahlungen: Alpha- Beta- und Gamma- Strahlungen. Aktivität. Zerfallgesetz. Halbwertzeit.
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
2D-NMR- Spektroskopie
 2. 2D-NMR-Spektroskopie 2D-NMR- Spektroskopie Organische Chemie Dr. I. Kempter - 28 - 2. 2D-NMR-Spektroskopie Überblick Der Einsatz von zweidimensionalen ermöglicht es die Nachteile eines eindimensionalen
2. 2D-NMR-Spektroskopie 2D-NMR- Spektroskopie Organische Chemie Dr. I. Kempter - 28 - 2. 2D-NMR-Spektroskopie Überblick Der Einsatz von zweidimensionalen ermöglicht es die Nachteile eines eindimensionalen
Vorlesung OC-V. Carbeniumionen
 Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Carbeniumionen Woher kennen wir bereits Carbeniumionen? 1. Triphenylmethanfarbstoffe Adolf von Bayer erzeugte 1902 die ersten stabilen intensiv farbigen Triarylmethylkationen Lebensdauer in Wasser > 1h
Eine Auswahl typischer Carbonylreaktionen
 Eine Auswahl typischer Carbonylreaktionen Aldol-eaktion ( anschließende Aldol-Kondensation) Kondensation = Abspaltung von Wasser Aldol-eaktion kann basenkatalysiert oder säurekatalysiert durchgeführt werden.
Eine Auswahl typischer Carbonylreaktionen Aldol-eaktion ( anschließende Aldol-Kondensation) Kondensation = Abspaltung von Wasser Aldol-eaktion kann basenkatalysiert oder säurekatalysiert durchgeführt werden.
Sofern der Stromdurchflossene Leiter Senkrecht zu den Feldlinien steht gilt: B ist die magnetische Flussdichte, sie hat die Einheit Tesla
 Magnetfelder und orentz-kraft Magnetfelder & magnetische Flussdichte a. Jeder stromdurchflossene eiter erzeugt ein Magnetfeld, die Richtung dieses Magnetfeldes hängt von der Fließrichtung des Stromes ab.
Magnetfelder und orentz-kraft Magnetfelder & magnetische Flussdichte a. Jeder stromdurchflossene eiter erzeugt ein Magnetfeld, die Richtung dieses Magnetfeldes hängt von der Fließrichtung des Stromes ab.
Grundgrößen der Elektrotechnik
 Grundgrößen der Elektrotechnik Theorie ALMM AUTONOMES LERNEN MIT MOODLE Verfasst von: Manuel Leitner Der elektrische Stromkreis Schematische Darstellung eines Stromkreises: I elektrischer Strom U Spannung
Grundgrößen der Elektrotechnik Theorie ALMM AUTONOMES LERNEN MIT MOODLE Verfasst von: Manuel Leitner Der elektrische Stromkreis Schematische Darstellung eines Stromkreises: I elektrischer Strom U Spannung
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Die Anzahl der Protonen und Neutronen entspricht der Atommassenzahl.
 Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
Atom Der Begriff Atom leitet sich von atomos her, was unteilbar heisst. Diese Definition ist alt, da man heutzutage fähig ist, Atome zu teilen. Atommassenzahl Die Anzahl der Protonen und Neutronen entspricht
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
1. Klausur zur Vorlesung. Einführung in die organische Chemie WS 03/04 11.12.2003
 1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
1. Klausur zur Vorlesung Einführung in die organische Chemie WS 03/04 11.12.2003 Vorname (bitte deutlich schreiben): Nachname (bitte deutlich schreiben): Matrikelnummer: Studiengang: o Chemie (Diplom)
Klausur OC1 (BA-Studiengang) PIN: :00 16:00 Uhr N10. Name: Punkte: Matrikel Nr. Note:
 Klausur OC1 (BA-Studiengang) PIN: 10.02.2011 13:00 16:00 Uhr N10 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0 49-48=3.3
Klausur OC1 (BA-Studiengang) PIN: 10.02.2011 13:00 16:00 Uhr N10 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0 49-48=3.3
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
2 Die Atombindung im Wasserstoff-Molekül
 2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie)
 Übungen 24.01.2012 Teil 1 Aufgaben zum Stoff der Vorlesung C1a (Grundvorlesung rganische Chemie) Aufgabe 1.1 Zeichnen Sie die Strukturformeln der folgenden Verbindungen (jeweils 1 Punkt pro Teilaufgabe).
Übungen 24.01.2012 Teil 1 Aufgaben zum Stoff der Vorlesung C1a (Grundvorlesung rganische Chemie) Aufgabe 1.1 Zeichnen Sie die Strukturformeln der folgenden Verbindungen (jeweils 1 Punkt pro Teilaufgabe).
Gliederung der Vorlesung im SS
 Gliederung der Vorlesung im SS A. Struktureller Aufbau von Werkstoffen. Atomare Struktur.. Atomaufbau und Periodensystem der Elemente.2. Interatomare Bindungen.3. Aggregatzustände 2. Struktur des Festkörpers
Gliederung der Vorlesung im SS A. Struktureller Aufbau von Werkstoffen. Atomare Struktur.. Atomaufbau und Periodensystem der Elemente.2. Interatomare Bindungen.3. Aggregatzustände 2. Struktur des Festkörpers
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Lernzielkatalog. Vorlesung: Allgemeine und Anorganische Chemie, Karsten Meyer
 Lernzielkatalog Vorlesung: Allgemeine und Anorganische Chemie, Karsten Meyer Vorlesungen 1-5: 1. Welche vier Elemente findet man am häufigsten im Bereich der Erdkruste, Ozeane und Atmosphäre? 2. Welche
Lernzielkatalog Vorlesung: Allgemeine und Anorganische Chemie, Karsten Meyer Vorlesungen 1-5: 1. Welche vier Elemente findet man am häufigsten im Bereich der Erdkruste, Ozeane und Atmosphäre? 2. Welche
Infrarot Spektroskopie organischer Verbindungen
 Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
Infrarot Spektroskopie organischer Verbindungen Praktikum (B.C. 3.4) Lehrstuhl für Instrumentelle Analytik Michael Deicke Michael.Deicke@uni-jena.de Ziele des Praktikums IR-Spektren organischer Verbindungen
Inhaltsverzeichnis. 3 Organische Chemie. Vorwort Chemische Bindung Chemische Reaktionstypen Bindungen...
 VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
