Praktikum. Enzymkinetik am Beispiel der Protease Trypsin
|
|
|
- Daniel Breiner
- vor 7 Jahren
- Abrufe
Transkript
1 Praktikum Methoden der molekularen Biowissenschaften Teil 1: Biochemie Enzymkinetik am Beispiel der Protease Trypsin Prof. Walter Nickel Biochemie-Zentrum der Universität Heidelberg
2 Thermodynamische Eigenschaften einer chemischen Reaktion 1. Spontanität einer Reaktion Änderung der freien Energie ΔG (ΔG = ΔH - TΔS) zwischen Edukten und Produkten während einer chemischen Reaktion: ΔG = 0 => Reaktion im Gleichgewicht ΔG < 0 => Reaktion verläuft spontan (exergonische Reaktion) ΔG > 0 => Reaktion kann nicht spontan verlaufen (endergonische Reaktion) ΔG errechnet sich aus der freien Energie der Produkte minus der freien Energie der Edukte ΔG ist unabhängig vom Reaktionsweg (Reaktionsmechanismus) (Bsp. Glucose-Umwandlung zu CO 2 + H 2 O in vitro und in vivo) ΔG enthält keine Information über die Geschwindigkeit, mit der eine Reaktion abläuft 2. Reaktionsgeschwindigkeit Abhängig von der Energiemenge, die benötigt wird, um die Reaktion der Edukte zu den Produkten zu initiieren (Aktivierungsenergie)
3 Mathematische Definition der Änderung der freien Energie ΔG ΔG hängt vom chemischen Gleichgewicht von Edukten und Produkten sowie von deren Konzentrationen zu Beginn der chemischen Reaktion ab Mit ΔG 0 = Änderung der freien Energie bei einer Ausgangskonzentration von 1M für Edukte und Produkte R T = Gaskonstante = Temperatur
4 Beziehung zwischen der Änderung der freien Energie ΔG und der Gleichgewichtskonstante K eq einer chemischen Reaktion ΔG = ΔG 0 + RT x ln [C] [D] [A] [B] Reaktion im Gleichgewicht: => ΔG = 0 => ΔG 0 = - RT x ln [C] [D] [A] [B] Definition der Gleichgewichtskonstante K eq : K eq = [C] [D] [A] [B] ΔG 0 = - RT x ln K eq K eq = 10 -ΔG 0 /1,36 Das Gleichgewicht (K eq ) einer chemischen Reaktion lässt sich unmittelbar aus ΔG 0 berechnen bzw. aus der experimentellen Bestimmung des Gleichgewichts einer chemischen Reaktion lässt sich ΔG 0 berechnen
5 Ich denke, dass es sich bei den Enzymen um Moleküle handelt, die zu den aktivierten Komplexen der Reaktionen, die sie katalysieren, komplementär sind, das heisst, zu einer molekularen Konfiguration, die eine Zwischenstufe zwischen den reagierenden Substanzen und den Produkten einer Reaktion bildet. Die Anziehung, die die Enzymmoleküle auf den aktivierten Komplex ausüben, führt so zu einer Verminderung seiner Energie und damit zu einer Verringerung der Aktivierungsenergie der Reaktion und somit auch zu einer Erhöhung der Reaktionsgeschwindigkeit Linus Pauling, Nature 161 (1948), S. 707 The Nature of the Chemical Bond and the Structure of Molecules and Crystals Nobelpreis für Chemie in 1954 Friedensnobelpreis 1962
6 Enzyme erniedrigen die benötigte Aktivierungsenergie durch die Stabilisierung des Übergangszustandes einer chemischen Reaktion Durch die Bindung des Enzyms an den Übergangszustand wird dieser stabilisiert und demzufolge die für die Reaktion aufzubringende freie Energie gesenkt
7 Zusammenfassung => Enzyme erhöhen die Reaktionsgeschwindigkeit durch das Herabsetzen der für die Initiation der chemischen Reaktion notwendigen freien Aktivierungsenergie => Enzyme beschleunigen die Einstellung des durch die Edukte und Produkte vorgebenen chemischen Gleichgewichts => Enzyme haben keinen Einfluss auf das Equilibrium einer Reaktion und können somit beide Reaktionsrichtungen gleichermassen beschleunigen
8 Durch Enzyme katalysierte chemische Reaktionen: => Enzyme sind substrat- und reaktions-spezifisch
9 Die Bildung eines Enzym-Substrat-Komplexes stellt den ersten Schritt der enzymatischen Katalyse dar k 1 E + S ES Pre-steady state k 1 k E + S ES 2 E + P Steady state k -1 (Fließgleichgewicht) k 1 k 2 E + S ES E + P Equilibrium k -1 k -2 (Thermodynamisches Gleichgewicht)
10 Kinetik der Konzentrationsänderung von Substrat, Produkt, Enzym und Enzym-Substrat-Komplex [mm] [min]
11 Bestimmung der initialen Reaktionsgeschwindigkeit v 0 bei verschiedenen Substratkonzentrationen [µmol] [min] Konstant: [E], T, ph, [Salz]
12 Michaelis-Menten Modell: ein spezifischer ES-Komplex ist ein obligatorisches Intermediat der katalysierten Reaktion [µmol x min -1 ] Enzymkonzentration konstant Bei niedrigen Substratkonzentrationen ist die initiale Reaktionsgeschwindigkeit v 0 proportional zur Substratkonzentration Bei hohen Substratkonzentrationen ist die initiale Reaktionsgeschwindigkeit v 0 unabhängig von der Substratkonzentration [mm] k 1 k E + S ES 2 E + P k -1
13 Die Michaelis-Menten Gleichung [S] v 0 = v max [S] + K m mit K m als die Substratkonzentration, bei der eine halb-maximale Geschwindigkeit erreicht wird => bei [S] << K m => v 0 ist proportional zu [S] [µmol x min -1 ] => bei [S] >> K m => v 0 ist unabhängig von [S] => bei [S] = K m => v 0 ist halbmaximal => K m ist unabhängig von [E] v max [mm] => K m ist ein Maß für die Affinität des Substrates zum Enzym
14 Experimentelle Bestimmung von v max und K m : 1 v 0 = 1 v max + K m v max x 1 [S] [min x µmol -1 ] [mm -1 ] Doppeltreziproker Lineweaver-Burk-Plot: lineare Darstellung => Extrapolation
15 Kompetitive und nicht-kompetitive Hemmung von Enzymen
16 Veränderung kinetischer Konstanten in Gegenwart eines kompetitiven Inhibitors [min x µmol -1 ] [min x µmol -1 ] [mm -1 ] [mm -1 ] V max bleibt unverändert, K m wird grösser die Affinität zum Substrat nimmt ab
17 Veränderung kinetischer Konstanten in Gegenwart eines nicht-kompetitiven Inhibitors [min x µmol -1 ] [min x µmol -1 ] [mm -1 ] [mm -1 ] V max wird kleiner, K m bleibt unverändert die Affinität zum Substrat bleibt unverändert
18 Struktur des Chymotrypsins Katalytische Triade
19 Katalysemechanismus des Trypsins (gemischte Katalyse) Oxyanion Acylenzym
20 N-Benzoyl-L-arginin-p-nitroanilid (BAPNA) als artifizielles Substrat für die Bestimmung der Trypsinaktivität Trypsin + H 2 O
21 Definitionen der Enzymaktivität Reaktionsgeschwindigkeit: Stoffumsatz pro Zeiteinheit 1 Unit (1 U) = 1 µmol Substratumsatz / min Volumenaktivität: Reaktionsgeschwindigkeit relativ zur eingesetzten Enzymmenge in Volumeneinheiten => U/ml Spezifische Aktivität: Reaktionsgeschwindigkeit relativ zur eingesetzten Enzymmenge in Proteinmasse => U/mg
22 Prinzip der Absorptionsphotometrie Definition: Indirekte Bestimmung der Absorption durch Messung der Transmission S = Lichtstreuung T = Transmission A = Absorption Voraussetzung: transparente Lösung mit vollständig gelösten Teilchen Es gilt: die Absorption ist proportional zur Konzentration der gelösten Teilchen => Lambert Beer Gesetz
23 Grundlagen zum Lambert-Beer Gesetz Transmission T = I I 0 Ausfallende Strahlungsintensität Einfallende Strahlungsintensität Bouguer-Experiment (1729): => die Transmission nimmt beim Passieren der Lösung exponentiell ab
24 Das Lambert-Beer Gesetz Beer: die Transmission ist umgekehrt proportional zur Konzentration der gelösten Substanz: T = 10 -a x c x d Beziehung zwischen Absorption und Transmission: A = - log T (=> 10% Transmission entspricht einer Absorption von 1; 1% Transmission entspricht einer Absorption von 2) = - log (10 -a x c x d ) = a x c x d a = Absorptionskoeffizient c = Konzentration des gelösten Stoffes d = Schichtdicke I 0 => E = log = ε [mm -1 x cm -1 ] x c [mm] x d [cm] I => die Absorption (= Extinktion) ist dimensionslos => Der molare Extinktionskoeffizient ε ist eine Substanz-spezifische Grösse, die darüber hinaus von Lösungsmittel, Temperatur und Wellenlänge des eingestrahlten Lichtes abhängt
25 Schritt 1: Proteingehaltsbestimmung der Trypsin-Stammlösung: - Eichgerade mit Rinderserumalbumin (6 Werte) erstellen - 3 Verdünnungen der Trypsin-Stammlösung; Reaktionsansätze gemäß Script herstellen - Extinktion ΔE546 (Leerwert!!) bestimmen und aus Eichgerade die Proteinkonzentration der Stammlösung bestimmen => Ergebnis: X mg Gesamtprotein/ml Versuchsdurchführung Schritt 2: Bestimmung einer Trypsin-Konzentration, die für die Aufnahme der Enzymkinetiken geeignet ist: - bei einer BAPNA-Konzentration von 0,5 mm wird ΔE/min für verschiedene Trypsin-Verdünnungen bestimmt. Verdünnung auswählen, die ein ΔE/min von 0,05 bis 0,1 ergibt Schritt 3: Aufnahme der Enzymkinetiken - 5 verschiedenen BAPNA-Konzentrationen (0,2 bis 1 mm) und geeignete Trypsin-Verdünnung zur kinetischen Bestimmung von ΔE benutzen (alle 30 sec über insg. 5 min) - Graphische Auftragung von ΔE (Ordinate) gegen t (min, Abszisse) - Bestimmung der Reaktionsgeschwindigkeit v 0 aus der Anfangssteigung der Kurve => für jede Substratkonzentration wird v 0 (= ΔE/min) bestimmt Schritt 4: Erstellung des Lineweaver-Burk-Plots zur Bestimmung von v max und K m - Berechnung von 1/v 0 [min] und 1/[BAPNA] [mm -1 ] - Graphische Auftragung von 1/v 0 (Ordinate) gegen 1/[BAPNA] (Abszisse) - Bestimmung von v max [1/min] und K m [mm] aus den Achsenschnittpunkten - Umrechnung von v max in [µmol/min]: ε kann aus Abb. 10 (Skript, Seite 54) berechnet werden Schritt 5: Berechnung der Volumenaktivität und der spezifischen Aktivität - Volumenaktivität: v max / Vol. der eingesetzten Trypsin-Stammlösung (ml) => µmol x min -1 x ml -1 (= U/ml) - Spezifische Aktivität: Volumenaktivität (U/ml) / Proteinkonzentration (mg/ml) => µmol x min -1 x mg -1 (= U/mg) Schritt 6: Hemmung der Trypsinaktivität durch AEBSF und Benzamidin => handelt es sich bei AEBSF und Benzamidin um kompetitive oder nicht-kompetitive Hemmstoffe?
Enzyme: Grundlegende Konzepte und Kinetik
 Enzyme: Grundlegende Konzepte und Kinetik Enzyme sind Katalysatoren biologischer Systeme Wichtigste Eigenschaften: katalytische Stärke und Spezifität Nahezu alle bekannten Enzyme sind Proteine, es gibt
Enzyme: Grundlegende Konzepte und Kinetik Enzyme sind Katalysatoren biologischer Systeme Wichtigste Eigenschaften: katalytische Stärke und Spezifität Nahezu alle bekannten Enzyme sind Proteine, es gibt
Katalyse. höhere Reaktionsgeschwindigkeit bei derselben Temperatur! Achtung: Gleichgewicht der chemischen Reaktion wird nicht verschoben
 Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Versuch 03: Enzyme. Bestimmung der Serum-Acetylcholinesterase Aktivität: 1. Bestimmung der Acetylcholinesterase-Aktivität
 Versuch 03: Enzyme Lactatdehydrogenase I. Der optische Test: Bestimmung von Pyruvat Acetylcholinesterase II. Bestimmung der Serum-Acetylcholinesterase Aktivität: 1. Bestimmung der Acetylcholinesterase-Aktivität
Versuch 03: Enzyme Lactatdehydrogenase I. Der optische Test: Bestimmung von Pyruvat Acetylcholinesterase II. Bestimmung der Serum-Acetylcholinesterase Aktivität: 1. Bestimmung der Acetylcholinesterase-Aktivität
1.1. Grundlage aller enzymkinetischen Untersuchungen ist die Michaelis-Menten- Gleichung: V 0 = V max x [S] K m + [S]
![1.1. Grundlage aller enzymkinetischen Untersuchungen ist die Michaelis-Menten- Gleichung: V 0 = V max x [S] K m + [S] 1.1. Grundlage aller enzymkinetischen Untersuchungen ist die Michaelis-Menten- Gleichung: V 0 = V max x [S] K m + [S]](/thumbs/58/42178387.jpg) 1.1 ABSHNITT 1: ENZYME Einführung Enzyme sind informationelle Makromoleküle und als solche Instrumente gezielter Prozeßsteuerung. Sie haben eine katalytische und eine kognitive Funktion. Die katalytische
1.1 ABSHNITT 1: ENZYME Einführung Enzyme sind informationelle Makromoleküle und als solche Instrumente gezielter Prozeßsteuerung. Sie haben eine katalytische und eine kognitive Funktion. Die katalytische
ENZYMREAKTIONEN. Die Geschwindigkeit einer enzymatischen Reaktion hängt von folgenden Reaktionsbedingungen ab.
 34 3. Probe in den Lichtweg bringen und E ablesen. Wird die Wellenlänge verändert, so muss das Photometer wieder neu geeicht werden, weil die Intensität der Lichtquelle und die Empfindlichkeit der Photozelle
34 3. Probe in den Lichtweg bringen und E ablesen. Wird die Wellenlänge verändert, so muss das Photometer wieder neu geeicht werden, weil die Intensität der Lichtquelle und die Empfindlichkeit der Photozelle
Fachbereich Mathematik und Informatik Wintersemester 2013/14 der Universität Marburg Dr. Helga Lohöfer
 Fachbereich Mathematik und nformatik Wintersemester 23/4 der Universität Marburg Dr. Helga Lohöfer Grundlagen der Mathematik für Biologen - Blatt - Abgabe: Montag, den 2..23, vor der Vorlesung, spätestens4:5
Fachbereich Mathematik und nformatik Wintersemester 23/4 der Universität Marburg Dr. Helga Lohöfer Grundlagen der Mathematik für Biologen - Blatt - Abgabe: Montag, den 2..23, vor der Vorlesung, spätestens4:5
Biochemische UE Alkaline Phosphatase.
 Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Versuch: Enzyme (LDH)
 Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Praktikum Biochemie Einführung in die Molekularbiologie. Bettina Siebers
 Praktikum Biochemie Einführung in die Molekularbiologie Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein Aktivitätstest Platte in 9 Teile
Praktikum Biochemie Einführung in die Molekularbiologie Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein Aktivitätstest Platte in 9 Teile
GRUNDLAGEN DER ENZYMKINETIK: MICHAELIS-MENTEN-GLEICHUNG, HEMMTYPEN
 45 GRUNDLAGEN DER ENZYMKINETIK: MICHAELIS-MENTEN-GLEICHUNG, HEMMTYPEN A. BIOCHEMISCHE GRUNDLAGEN Die katalytischen Eigenschaften eines Enzyms können durch verschiedene Faktoren beeinflusst werden. Dazu
45 GRUNDLAGEN DER ENZYMKINETIK: MICHAELIS-MENTEN-GLEICHUNG, HEMMTYPEN A. BIOCHEMISCHE GRUNDLAGEN Die katalytischen Eigenschaften eines Enzyms können durch verschiedene Faktoren beeinflusst werden. Dazu
Lösungen zu den Übungen zur Einführung in die Spektroskopie für Studenten der Biologie (SS 2011)
 Universität Konstanz Fachbereich Biologie Priv.-Doz. Dr. Jörg H. Kleinschmidt http://www.biologie.uni-konstanz.de/folding/home.html Datum: 26.5.211 Lösungen zu den Übungen zur Einführung in die Spektroskopie
Universität Konstanz Fachbereich Biologie Priv.-Doz. Dr. Jörg H. Kleinschmidt http://www.biologie.uni-konstanz.de/folding/home.html Datum: 26.5.211 Lösungen zu den Übungen zur Einführung in die Spektroskopie
4.1. Eigenschaften von Enzymen
 4. Enzyme 106 107 4.1. Eigenschaften von Enzymen Enzyme sind Proteine, die chemische Reaktionen beschleunigen (Biokatalysatoren) Herausragende Merkmale verglichen mit anderen Katalysatoren: drastische
4. Enzyme 106 107 4.1. Eigenschaften von Enzymen Enzyme sind Proteine, die chemische Reaktionen beschleunigen (Biokatalysatoren) Herausragende Merkmale verglichen mit anderen Katalysatoren: drastische
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail. Mag. Gerald Trutschl
 Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
6. Fragentyp A Wie berechnet man die ph-werte wässriger Lösungen starker Basen? A) ph = pks - log [HA] / 2 B) ph = 14 + log [OH-] C) ph = 7+ 1/2 pkb +
![6. Fragentyp A Wie berechnet man die ph-werte wässriger Lösungen starker Basen? A) ph = pks - log [HA] / 2 B) ph = 14 + log [OH-] C) ph = 7+ 1/2 pkb + 6. Fragentyp A Wie berechnet man die ph-werte wässriger Lösungen starker Basen? A) ph = pks - log [HA] / 2 B) ph = 14 + log [OH-] C) ph = 7+ 1/2 pkb +](/thumbs/77/74984433.jpg) 1. Fragentyp D Welche der folgenden Einheiten für den molaren Extinktionskoeffizienten ist/sind korrekt? 1) liter I mol x cm 2) liter I mol 3) cm2 / mmol 4) cm2 / mmol x m1 2. Wie lautet die Henderson-Hasselbalch-Gleichung?
1. Fragentyp D Welche der folgenden Einheiten für den molaren Extinktionskoeffizienten ist/sind korrekt? 1) liter I mol x cm 2) liter I mol 3) cm2 / mmol 4) cm2 / mmol x m1 2. Wie lautet die Henderson-Hasselbalch-Gleichung?
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1. Lambert Beer sches Gesetz - Zerfall des Manganoxalations
 Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
Versuchsanleitungen zum Praktikum Physikalische Chemie für Anfänger 1 A 34 Lambert Beer sches Gesetz - Zerfall des Manganoxalations Aufgabe: 1. Bestimmen Sie die Wellenlänge maximaler Absorbanz λ max eines
Gegenstand der letzten Vorlesung
 Gegenstand der letzten Vorlesung Reaktionsgeschwindigkeit Reaktionsordnung Molekularität Reaktion 0., 1.,. Ordnung Reaktion pseudo-erster Ordnung Aktivierungsenergie Temperaturabhängigkeit der Geschwindigkeitskonstanten
Gegenstand der letzten Vorlesung Reaktionsgeschwindigkeit Reaktionsordnung Molekularität Reaktion 0., 1.,. Ordnung Reaktion pseudo-erster Ordnung Aktivierungsenergie Temperaturabhängigkeit der Geschwindigkeitskonstanten
Enzymkinetik: Kinetik der alkalischen Phosphatase mit dem Substrat p-nitrophenylphosphat
 Biophysikalisches Praktikum Institut für Biophysik Johann Wolfgang Goethe-Universität Frankfurt am Main Enzymkinetik: Kinetik der alkalischen Phosphatase mit dem Substrat p-nitrophenylphosphat (letzte
Biophysikalisches Praktikum Institut für Biophysik Johann Wolfgang Goethe-Universität Frankfurt am Main Enzymkinetik: Kinetik der alkalischen Phosphatase mit dem Substrat p-nitrophenylphosphat (letzte
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Bioorganische Chemie Enzymatische Katalyse 2011
 Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Versuch 5: Enzyme (Alkalische Phosphatase) (V )
 Versuch 5: Enzyme (Alkalische Phosphatase) (V10 6.03.2012) Lernziele: 1) Reaktionsgeschwindigkeit, Aktivierungsenergie, chemisches Gleichgewicht; 2) Was tun Katalysatoren und Enzyme, 3) Michaelis-Menten
Versuch 5: Enzyme (Alkalische Phosphatase) (V10 6.03.2012) Lernziele: 1) Reaktionsgeschwindigkeit, Aktivierungsenergie, chemisches Gleichgewicht; 2) Was tun Katalysatoren und Enzyme, 3) Michaelis-Menten
EinFaCh 2. Studienvorbereitung Chemie. Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik. tu-freiberg.
 Studienvorbereitung Chemie EinFaCh 2 Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was bedeutet Chemische Reaktionskinetik?
Studienvorbereitung Chemie EinFaCh 2 Einstieg in Freibergs anschauliches Chemiewissen Teil 2: Chemische Reaktionskinetik tu-freiberg.de tu-freiberg.de/fakultaet2/einfach Was bedeutet Chemische Reaktionskinetik?
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Vertiefendes Seminar zur Vorlesung Biochemie I. Bearbeitung Übungsblatt 6
 Vertiefendes Seminar zur Vorlesung Biochemie I 04.12.2015 Bearbeitung Übungsblatt 6 Gerhild van Echten-Deckert Fon. +49-228-732703 Homepage: http://www.limes-institut-bonn.de/forschung/arbeitsgruppen/unit-3/
Vertiefendes Seminar zur Vorlesung Biochemie I 04.12.2015 Bearbeitung Übungsblatt 6 Gerhild van Echten-Deckert Fon. +49-228-732703 Homepage: http://www.limes-institut-bonn.de/forschung/arbeitsgruppen/unit-3/
GRUNDLAGEN DER ENZYMKINETIK: MICHAELIS-MENTEN-GLEICHUNG, HEMMTYPEN
 53 GRUNDLAGEN DER ENZYMKINETIK: MICHAELIS-MENTEN-GLEICHUNG, HEMMTYPEN BIOCHEMISCHE GRUNDLAGEN Die katalytischen Eigenschaften eines Enzyms können durch verschiedene Faktoren beeinflusst werden. Dazu gehören
53 GRUNDLAGEN DER ENZYMKINETIK: MICHAELIS-MENTEN-GLEICHUNG, HEMMTYPEN BIOCHEMISCHE GRUNDLAGEN Die katalytischen Eigenschaften eines Enzyms können durch verschiedene Faktoren beeinflusst werden. Dazu gehören
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion:
 Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Fragen zum Versuch 11a Kinetik Rohrzuckerinversion: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen
Fragen zum Versuch Kinetik:
 Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
Fragen zum Versuch Kinetik: 1. Die Inversion von Rohrzucker ist: a. Die Umwandlung von Rohrzucker in Saccharose b. Die katalytische Spaltung in Glucose und Fructose c. Das Auflösen von Rohrzucker im Wasser
K1: Lambert-Beer`sches Gesetz
 K1: Lambert-Beer`sches Gesetz Einleitung In diesem Versuch soll die Entfärbung von Kristallviolett durch atronlauge mittels der Absorptionsspektroskopie untersucht werden. Sowohl die Reaktionskinetik als
K1: Lambert-Beer`sches Gesetz Einleitung In diesem Versuch soll die Entfärbung von Kristallviolett durch atronlauge mittels der Absorptionsspektroskopie untersucht werden. Sowohl die Reaktionskinetik als
Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen. c(a) t. v = -
 REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
Einführung in die Biochemie Wirkungsweise von Enzymen
 Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Nutzung von Origin in der Enzym-Kinetik
 Nutzung von Origin in der Enzym-Kinetik Ausgangssituation Die Geschwindigkeit einer enzymatischen Reaktionen bei vorgegebener Enzymkonzentration aber verschiedener Substratkonzentration berechnen und grafisch
Nutzung von Origin in der Enzym-Kinetik Ausgangssituation Die Geschwindigkeit einer enzymatischen Reaktionen bei vorgegebener Enzymkonzentration aber verschiedener Substratkonzentration berechnen und grafisch
Praktikum Physikalische Chemie I 30. Januar Aktivierungsenergie. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Praktikum Physikalische Chemie I 30. Januar 2016 Aktivierungsenergie Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1 Aufgabenstellung Für die Reaktion von Saccharose mit Wasser zu Glucose und Fructose
Lehrstuhl für Physiologische Chemie, Tierärztliche Fakultät, LMU München
 ENZYME II Beispiele für Stoffinhalte aus der Chemie als Grundlage für das Verständnis dieses Teiles: Säurestärke (pk s Wert), Begriff der Katalyse, Massenwirkungsgesetz und Gleichgewichtsverschiebung,
ENZYME II Beispiele für Stoffinhalte aus der Chemie als Grundlage für das Verständnis dieses Teiles: Säurestärke (pk s Wert), Begriff der Katalyse, Massenwirkungsgesetz und Gleichgewichtsverschiebung,
Enzyme. Prof. Dr. Albert Duschl
 Enzyme Prof. Dr. Albert Duschl Katalyse Reaktionen laufen normalerweise nicht spontan ab, auch wenn insgesamt dabei Energie gewonnen werden sollte. Es muß zunächst eine Aktivierungsenergie aufgebracht
Enzyme Prof. Dr. Albert Duschl Katalyse Reaktionen laufen normalerweise nicht spontan ab, auch wenn insgesamt dabei Energie gewonnen werden sollte. Es muß zunächst eine Aktivierungsenergie aufgebracht
Versuch: Reaktionskinetik
 Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
Versuch: Reaktionskinetik Befindet sich eine chemische Reaktion im thermodynamischen Gleichgewicht, so lassen sich die Bedingungen für diesen Zustand durch eine energetische Betrachtungsweise mithilfe
ENZYME. Teil 1: Grundlagen und Substratbestimmungen
 ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
Versuch 4. Enzymkinetik
 Versuch 4 Enzymkinetik Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@mustermann.de X X X Dr. Postina Wird benotet?: Aufgabenstellung Ermittlung der maximalen Reaktionsgeschwindigkeit
Versuch 4 Enzymkinetik Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@mustermann.de X X X Dr. Postina Wird benotet?: Aufgabenstellung Ermittlung der maximalen Reaktionsgeschwindigkeit
Homogenes Gleichgewicht
 Knoch, Anastasiya Datum der Durchführung: Petri, Guido 08.12.2015 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Homogenes Gleichgewicht 1. Aufgabenstellung
Knoch, Anastasiya Datum der Durchführung: Petri, Guido 08.12.2015 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Homogenes Gleichgewicht 1. Aufgabenstellung
Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus)
 Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Versuch K2 Photometrische Messung
 Versuch K2 Photometrische Messung Aufgaben: 1. Messung der Extinktion von Mangan(III)-oxalat bei verschiedenen Wellenlängen. 2. Bestimmung der Geschwindigkeitskonstanten des Zerfalls des komplexen Mangan(III)-oxalations
Versuch K2 Photometrische Messung Aufgaben: 1. Messung der Extinktion von Mangan(III)-oxalat bei verschiedenen Wellenlängen. 2. Bestimmung der Geschwindigkeitskonstanten des Zerfalls des komplexen Mangan(III)-oxalations
Vom Molekül zur Zelle Block 3 Seminar / Praktikum 2
 Vom Molekül zur Zelle Block 3 Seminar / Praktikum 2 Diese Präsentation befindet sich auf der Lehr-Inhalts Seite des Inst f. unter www.meduniwien.ac.at/hp/medizinische-genetik/lehre Helmut Dolznig Inst.
Vom Molekül zur Zelle Block 3 Seminar / Praktikum 2 Diese Präsentation befindet sich auf der Lehr-Inhalts Seite des Inst f. unter www.meduniwien.ac.at/hp/medizinische-genetik/lehre Helmut Dolznig Inst.
Seminar: Photometrie
 Seminar: Photometrie G. Reibnegger und W. Windischhofer (Teil II zum Thema Hauptgruppenelemente) Ziel des Seminars: Theoretische Basis der Photometrie Lambert-Beer sches Gesetz Rechenbeispiele Literatur:
Seminar: Photometrie G. Reibnegger und W. Windischhofer (Teil II zum Thema Hauptgruppenelemente) Ziel des Seminars: Theoretische Basis der Photometrie Lambert-Beer sches Gesetz Rechenbeispiele Literatur:
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/
 Nachklausur zum Anorganisch-Chemischen Grundpraktikum vom 21.04.06 Seite 1 von 10 Punkte: von 98 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 21.04.2006 Matrikelnummer:
Nachklausur zum Anorganisch-Chemischen Grundpraktikum vom 21.04.06 Seite 1 von 10 Punkte: von 98 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2005/2006 21.04.2006 Matrikelnummer:
Aktivitätsbestimmung der Laktatdehydrogenase
 Aktivitätsbestimmung der Laktatdehydrogenase Für das Verständnis des Aufbaus von Enzymen und ihrer Wirkung sind Kenntnisse in der Biochemie der Proteine Voraussetzung. Folgende Begriffe sind von Bedeutung:
Aktivitätsbestimmung der Laktatdehydrogenase Für das Verständnis des Aufbaus von Enzymen und ihrer Wirkung sind Kenntnisse in der Biochemie der Proteine Voraussetzung. Folgende Begriffe sind von Bedeutung:
Versuchsprotokoll: Aminosäure- und Proteinbestimmung
 Versuchsprotokoll: Aminosäure- und Proteinbestimmung a) Proteinbestimmung mit Biuret-Reagenz 1.1. Einleitung Das Ziel des Versuchs ist es nach Aufstellen einer Eichgerade mit gegeben Konzentrationen, die
Versuchsprotokoll: Aminosäure- und Proteinbestimmung a) Proteinbestimmung mit Biuret-Reagenz 1.1. Einleitung Das Ziel des Versuchs ist es nach Aufstellen einer Eichgerade mit gegeben Konzentrationen, die
Enzymatische Katalyse
 VERSUCHSZIEL Die natürliche Braunfärbung einer aufgeschnittenen Kartoffel ist nichts anderes, als die enzymatisch oxydative Umsetzung der darin anwesenden Phenolverbindungen mit Sauerstoff zu Chinonverbindungen.
VERSUCHSZIEL Die natürliche Braunfärbung einer aufgeschnittenen Kartoffel ist nichts anderes, als die enzymatisch oxydative Umsetzung der darin anwesenden Phenolverbindungen mit Sauerstoff zu Chinonverbindungen.
Enzymologie 10. Kurs
 Arbeitsgruppe D Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Kurs : Enzymologie Einleitung Enzyme ermöglichen durch ihre katalytische Wirkung viele Reaktionen im Stoffwechsel von Lebewesen.
Arbeitsgruppe D Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Kurs : Enzymologie Einleitung Enzyme ermöglichen durch ihre katalytische Wirkung viele Reaktionen im Stoffwechsel von Lebewesen.
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Klausur zum Anorganisch-Chemischen Grundpraktikum vom 08.04.05 Seite 1 von 10 Punkte: von 84 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 08.04.2005 Matrikelnummer: Name:
Mechanismus der Enzymkatalyse
 Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
7 ENZYMKINETIK 7.5 Pre-steady State Kinetik bei schnellen Reaktionen. (t 1 e (k 1[S] 0 +k 2 +k 1. k 1 [S] 0 + k 2 + k 1. t/ms
![7 ENZYMKINETIK 7.5 Pre-steady State Kinetik bei schnellen Reaktionen. (t 1 e (k 1[S] 0 +k 2 +k 1. k 1 [S] 0 + k 2 + k 1. t/ms 7 ENZYMKINETIK 7.5 Pre-steady State Kinetik bei schnellen Reaktionen. (t 1 e (k 1[S] 0 +k 2 +k 1. k 1 [S] 0 + k 2 + k 1. t/ms](/thumbs/97/132715863.jpg) v0(t) [P](t) " & $ " & $ " [P] = v max τ k 2 [S] 0 [E] 0 [S] 0 +(k + k 2 )/k " & " % " $ " # v max " $ & (t e (k [S] 0 +k 2 +k ) )t & # ' ' # " $ & k [S] 0 + k 2 + k t/ms t/ms Bild 5: Allmähliche Annäherung
v0(t) [P](t) " & $ " & $ " [P] = v max τ k 2 [S] 0 [E] 0 [S] 0 +(k + k 2 )/k " & " % " $ " # v max " $ & (t e (k [S] 0 +k 2 +k ) )t & # ' ' # " $ & k [S] 0 + k 2 + k t/ms t/ms Bild 5: Allmähliche Annäherung
Enzyme SPF BCH am
 Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
(a) Lösen Sie die Differentialgleichung unter Verwendung der Mathematica-Funktion DSolve.
 Institut für Physikalische Chemie Methodenkurs Anwendungen von Mathematica und Matlab in der Physikalischen Chemie im WS 205/206 Prof Dr Stefan Weber, Dr Till Biskup Aufgabenblatt zum Teil (Mathematica)
Institut für Physikalische Chemie Methodenkurs Anwendungen von Mathematica und Matlab in der Physikalischen Chemie im WS 205/206 Prof Dr Stefan Weber, Dr Till Biskup Aufgabenblatt zum Teil (Mathematica)
4.3 Reaktionsgeschwindigkeit und Katalysator
 4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
4.3 Reaktionsgeschwindigkeit und Katalysator - Neben der thermodynamischen Lage des chemischen Gleichgewichts ist der zeitliche Ablauf der Reaktion, also die Geschwindigkeit der Ein- Einstellung des Gleichgewichts,
Enzym-Kinetik (Abb. 1) Das Thema der heutigen Vorlesung ist die Kinetik isolierter und gereinigter Enzyme zum Verständnis ihrer Reaktionsmechanismen.
 1 Enzym-Kinetik (Abb. 1) Das Thema der heutigen Vorlesung ist die Kinetik isolierter und gereinigter Enzyme zum Verständnis ihrer Reaktionsmechanismen. Wie ich schon erwähnte, ist die Geschwindigkeit (V)
1 Enzym-Kinetik (Abb. 1) Das Thema der heutigen Vorlesung ist die Kinetik isolierter und gereinigter Enzyme zum Verständnis ihrer Reaktionsmechanismen. Wie ich schon erwähnte, ist die Geschwindigkeit (V)
Michaelis-Menten-Kinetik
 Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
Michaelis-Menten-Kinetik Peter Bützer Inhalt 1 Einführung... 1 2 Modell... 2 2.1 Modellannahmen... 2 2.2 Drei Fälle... 2. Simulationsdiagramm (Typ ), Systemdynamik... 2.4 Dokumentation (Gleichungen, Parameter)...
K3: Bestimmung der Michaelis-Menten-Kinetik von Urease
 K3: Bestimmung der Michaelis-Menten-Kinetik von Urease Einleitung: In diesem Versuch soll die Umsetzung von Harnstoff durch das Enzym Urease beobachtet werden. Fast alle Enzyme sind Proteine, manche bestehen
K3: Bestimmung der Michaelis-Menten-Kinetik von Urease Einleitung: In diesem Versuch soll die Umsetzung von Harnstoff durch das Enzym Urease beobachtet werden. Fast alle Enzyme sind Proteine, manche bestehen
Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease.
 A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
Reaktionskinetik. Geschwindigkeitsgesetze
 Reaktionskinetik Geschwindigkeitsgesetze Lernziele: Thermodynamische Beschreibung chemischer Reaktionen Berechnen und Beschreiben von Reaktionsordnungen Kinetische Beschreibung von Reaktionsmechanismen
Reaktionskinetik Geschwindigkeitsgesetze Lernziele: Thermodynamische Beschreibung chemischer Reaktionen Berechnen und Beschreiben von Reaktionsordnungen Kinetische Beschreibung von Reaktionsmechanismen
1 Michaelis-Menten-Kinetik
 Physikalische Chemie II Lösung 2 9. Dezember 206 Michaelis-Menten-Kinetik. Das Geschwindigkeitsgesetz für die zeitliche Änderung der ES-Konzentration ist durch folgendes Geschwindigkeitsgesetz beschrieben:
Physikalische Chemie II Lösung 2 9. Dezember 206 Michaelis-Menten-Kinetik. Das Geschwindigkeitsgesetz für die zeitliche Änderung der ES-Konzentration ist durch folgendes Geschwindigkeitsgesetz beschrieben:
Lösungen 10 (Kinetik)
 Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2
 Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 10. Temperaturabhängigkeit der Reaktionsgeschwindigkeit: Arrhenius-Beziehung Thema In diesem Versuch
Enzyme als Biokatalysatoren
 1 Enzymwirkung Enzyme als Biokatalysatoren Versuch: Wasserstoffperoxid wird bei RT mit a) Mn(IV)-oxid und b) Katalase versetzt. Beobachtung: a) Gasentwicklung Glimmspanprobe positiv b) Gasentwicklung Glimmspanprobe
1 Enzymwirkung Enzyme als Biokatalysatoren Versuch: Wasserstoffperoxid wird bei RT mit a) Mn(IV)-oxid und b) Katalase versetzt. Beobachtung: a) Gasentwicklung Glimmspanprobe positiv b) Gasentwicklung Glimmspanprobe
Richtung chemischer Reaktionen, Chemisches Gleichgewicht. Massenwirkungsgesetz
 Richtung chemischer Reaktionen, Chemisches Gleichgewicht a A + b B K = [C] [A] c a [D] [B] c C + d D d b Massenwirkungsgesetz K = Gleichgewichtskonstante [ ] = in Lösung: Konzentration (in mol L -1 ),
Richtung chemischer Reaktionen, Chemisches Gleichgewicht a A + b B K = [C] [A] c a [D] [B] c C + d D d b Massenwirkungsgesetz K = Gleichgewichtskonstante [ ] = in Lösung: Konzentration (in mol L -1 ),
0.1 Geschwindigkeit bei Reaktionen
 1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
1 0.1 Geschwindigkeit bei Reaktionen Salzsäure reagiert mit Magnesium Erklärung 2HCl + Mg MgCl 2 + H 2 Das M g-pulver reagiert schneller mit der Salzsäure als die Mg-Späne. Definition: Reaktionsgeschwindigkeit
 Die Farbstofflösung in einer Küvette absorbiert 90% des einfallenden Lichtes. Welche Extinktion hat diese Lösung? 0 0,9 1,9 keine der Aussagen ist richtig Eine Küvette mit einer wässrigen Farbstofflösung
Die Farbstofflösung in einer Küvette absorbiert 90% des einfallenden Lichtes. Welche Extinktion hat diese Lösung? 0 0,9 1,9 keine der Aussagen ist richtig Eine Küvette mit einer wässrigen Farbstofflösung
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2
 Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 9. Spektralphotometrische Bestimmung einer Gleichgewichtskonstanten: Lambert-Beer und Massenwirkungsgesetz
Institut für Physikalische und Theoretische Chemie Physikalisch-Chemisches Praktikum für Studenten L2 9. Spektralphotometrische Bestimmung einer Gleichgewichtskonstanten: Lambert-Beer und Massenwirkungsgesetz
Enzymkinetik Seite 1. Enzyme. Einführung
 Enzymkinetik Seite 1 Enzyme Einführung In jeder Zelle laufen Hunderte chemischer Reaktionen ab, die (mit wenigen Ausnahmen) alle von hochwirksamen Biokatalysatoren (Enzymen ) beschleunigt und gesteuert
Enzymkinetik Seite 1 Enzyme Einführung In jeder Zelle laufen Hunderte chemischer Reaktionen ab, die (mit wenigen Ausnahmen) alle von hochwirksamen Biokatalysatoren (Enzymen ) beschleunigt und gesteuert
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Klausur zur Vorlesung Biochemie I im WS 1993/1994. am 18. Februar Nachklausur zur Vorlesung Biochemie I im WS 1993/1994. am 30. Mai 1994.
 Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Prof. Dr. J. Gmehling Universität Oldenburg, Institut für Reine und Angewandte Chemie, Technische Chemie, D Oldenburg
 Abschlussbericht an die Max-Buchner-Forschungsstiftung (FKZ: 277) Messung der Gleichgewichtslage und der Kinetik ausgewählter Veretherungsreaktionen und Überprüfung der Vorhersagbarkeit der Lösungsmitteleffekte
Abschlussbericht an die Max-Buchner-Forschungsstiftung (FKZ: 277) Messung der Gleichgewichtslage und der Kinetik ausgewählter Veretherungsreaktionen und Überprüfung der Vorhersagbarkeit der Lösungsmitteleffekte
Richtung chemischer Reaktionen, chemisches Gleichgewicht. Massenwirkungsgesetz
 Richtung chemischer Reaktionen, chemisches Gleichgewicht a A + b B K [C] [A] c a [D] [B] c C + d D d b K = Gleichgewichtskonstante Massenwirkungsgesetz [ ] = in Lösung: Konzentration (in mol L -1 ), für
Richtung chemischer Reaktionen, chemisches Gleichgewicht a A + b B K [C] [A] c a [D] [B] c C + d D d b K = Gleichgewichtskonstante Massenwirkungsgesetz [ ] = in Lösung: Konzentration (in mol L -1 ), für
9 ENZYMKINETIK 9.5 Pre-steady State Kinetik bei schnellen Reaktionen. 9.5 Pre-steady State Kinetik bei schnellen Reaktionen
 9.5 Pre-steady State Kinetik bei schnellen Reaktionen Die bisherige Diskussion der enzymkatalytischen Mechanismen hat sich auf stationäre Zustände beschränkt. Dies wurde dazu benutzt, die Parameter v max,k
9.5 Pre-steady State Kinetik bei schnellen Reaktionen Die bisherige Diskussion der enzymkatalytischen Mechanismen hat sich auf stationäre Zustände beschränkt. Dies wurde dazu benutzt, die Parameter v max,k
Allgemeine Chemie für r Studierende der Zahnmedizin
 Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 3 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Allgemeine Chemie für r Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 3 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Gefrierpunktserniedrigung
 Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
K3: Bestimmung der Michaelis-Menten-Kinetik von Urease
 K3: Bestimmung der Michaelis-Menten-Kinetik von Urease Einleitung: In diesem Versuch soll die Umsetzung von Harnstoff durch das Enzym Urease beobachtet werden. Fast alle Enzyme sind Proteine, manche bestehen
K3: Bestimmung der Michaelis-Menten-Kinetik von Urease Einleitung: In diesem Versuch soll die Umsetzung von Harnstoff durch das Enzym Urease beobachtet werden. Fast alle Enzyme sind Proteine, manche bestehen
Die Freie Aktivierungsenthalpie
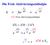 Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Die Freie Aktivierungsenthalpie E A G k Ae RT e = = RT G: Freie Aktivierungsenthalpie G = H T S e G RT = e S R e H RT e S R A H E A Katalyse: der aktivierte Übergangskomplex H E A Katalysatoren beeinflussen
Physikalische Chemie: Kinetik
 Physikalische Chemie: Kinetik Prof. Thiemann SS 2002 Protokoll Versuch 2 «Die ph-abhängigkeit der Solvolysegeschwindigkeit von Malachitgrün» 1 Inhalt: 1. Theorie 2. Zusatzfragen Bau eines UV-Spektralphotometers
Physikalische Chemie: Kinetik Prof. Thiemann SS 2002 Protokoll Versuch 2 «Die ph-abhängigkeit der Solvolysegeschwindigkeit von Malachitgrün» 1 Inhalt: 1. Theorie 2. Zusatzfragen Bau eines UV-Spektralphotometers
11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II
 Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Fachgruppe Chemie Kurshalbjahr 11/2 Alles im Gleichgewicht Stand SJ 2010/2011 11/2 Alles im Gleichgewicht Zuordnung der Kompetenzen aus dem KC Sek II Basiskonzept Stoff-Teilchen / unterscheiden anorganische
Aufgaben zur Enzymatik
 Aufgaben zur Enzymatik Viele dieser Aufgaben wurden in den vergangenen Jahren im Rahmen von Klassenarbeiten und/oder Prüfungen gestellt. 1. Grundlagen 1.1. Die Temperatur wird in einem Enzymversuch mit
Aufgaben zur Enzymatik Viele dieser Aufgaben wurden in den vergangenen Jahren im Rahmen von Klassenarbeiten und/oder Prüfungen gestellt. 1. Grundlagen 1.1. Die Temperatur wird in einem Enzymversuch mit
Versuchsprotokoll Kapitel 6
 Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Versuchsprotokoll Kapitel 6 Felix, Sebastian, Tobias, Raphael, Joel 1. Semester 21 Inhaltsverzeichnis Einleitung...3 Versuch 6.1...3 Einwaagen und Herstellung der Verdünnungen...3 Photospektrometrisches
Versuch. Übungswoche: Enzyme. Kinetik der Lactat - Dehydrogenase. Enzymkinetik der Lactat Dehydrogenase Peroxidase Nachweis
 Labormethoden der Biologie Vorlesung zur Übung Zellbiologie und Physiologie Übungswoche: Enzyme AG Kudla Leiter: Oliver Batistič Enzymkinetik der Lactat Dehydrogenase Peroxidase Nachweis Versuch Kinetik
Labormethoden der Biologie Vorlesung zur Übung Zellbiologie und Physiologie Übungswoche: Enzyme AG Kudla Leiter: Oliver Batistič Enzymkinetik der Lactat Dehydrogenase Peroxidase Nachweis Versuch Kinetik
Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie)
 Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie) Nachklausur 18.03.2016 Zeit: 120 min Seite 1 Seite 2 Seite 3 Seite 4 Seite 5 Seite 6 Seite 7 / 18 / 18 / 10 / 10 / 19 / 15 / 10 Gesamt: Note:
Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie) Nachklausur 18.03.2016 Zeit: 120 min Seite 1 Seite 2 Seite 3 Seite 4 Seite 5 Seite 6 Seite 7 / 18 / 18 / 10 / 10 / 19 / 15 / 10 Gesamt: Note:
Modul 1 Dynamik multidsziplinär
 Dynamik multidisziplinär Diese Lerneinheit befasst sich mit den Grundlagen der Kinetik am Beispiel des enzymatischen Abbaus von Alkohol Zum Verständnis für die Abbaukinetik pseudo-nullter Ordnung! Zur
Dynamik multidisziplinär Diese Lerneinheit befasst sich mit den Grundlagen der Kinetik am Beispiel des enzymatischen Abbaus von Alkohol Zum Verständnis für die Abbaukinetik pseudo-nullter Ordnung! Zur
Energetik und Kinetik chemischer Reaktionen
 Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
Energetik und Kinetik chemischer Reaktionen Reaktionsenergetik als Teil der Thermodynamik - wann läuft eine chemische Reaktion freiwillig ab? - in welchem Umfang läuft eine Reaktion ab? - wie viel Energie
Inhaltsverzeichnis.
 Inhaltsverzeichnis Kommentar für den Lehrer 185 Vorwort an den Lehrer IX - Einleitung IX - Didaktische Bemerkungen IX - Integrative oder graphisch differentielle Methode? XIII - Einige Hinweise zur praktischen
Inhaltsverzeichnis Kommentar für den Lehrer 185 Vorwort an den Lehrer IX - Einleitung IX - Didaktische Bemerkungen IX - Integrative oder graphisch differentielle Methode? XIII - Einige Hinweise zur praktischen
= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]
![= Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s] = Durchschnittliche Bildungs- Geschwindigkeit [mol/s] = Durchschnittliche Verbrauchs- Geschwindigkeit [mol/s]](/thumbs/94/122358469.jpg) Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
Ache2 Kapitel 14: Chemische Kinetik (Geschwindigkeit) Reaktionsgeschwindigkeit Beeinflussung: 1. Aggregatszustände der Reaktanten: Je öfters Moleküle zusammenstossen, desto schneller reagieren sie. (Oberflächenvergrösserung
5 Teilchen treffen Teilchen: Reaktionskinetik
 5 Teilchen treffen Teilchen: Reaktionskinetik 5.1 Elementarreaktionen und Mehrschritt-Reaktionen Wassergasreaktion: H 2 O + CO CO 2 + H 2 Dies ist lediglich der makroskopisch sichtbare Ablauf der Reaktion.
5 Teilchen treffen Teilchen: Reaktionskinetik 5.1 Elementarreaktionen und Mehrschritt-Reaktionen Wassergasreaktion: H 2 O + CO CO 2 + H 2 Dies ist lediglich der makroskopisch sichtbare Ablauf der Reaktion.
1. Ziel des Versuchs. 2. Versuchsaufbau und Durchführung. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 7: Lambert-Beersches Gesetz 1. Ziel des Versuchs Ziel des Versuches ist es, die Abhängigkeiten der Absorption eines Stoffes von der Konzentration, der Schichtdicke und der Wellenlänge zu ermitteln.
Versuch Nr. 7: Lambert-Beersches Gesetz 1. Ziel des Versuchs Ziel des Versuches ist es, die Abhängigkeiten der Absorption eines Stoffes von der Konzentration, der Schichtdicke und der Wellenlänge zu ermitteln.
K2: Acetonjodierung. Theoretische Grundlagen. Absorptionsspektroskopie. Physikalische Chemie für Pharmazeuten
 In diesem Versuch wird die Konzentrationsänderung von Iod während einer Reaktion erster Ordnung (Acetonjodierung) mittels quantitativer Absorptionsspektroskopie untersucht. Die Geschwindigkeitskonstanten
In diesem Versuch wird die Konzentrationsänderung von Iod während einer Reaktion erster Ordnung (Acetonjodierung) mittels quantitativer Absorptionsspektroskopie untersucht. Die Geschwindigkeitskonstanten
Allgemeine Chemie für r Studierende der Medizin
 Allgemeine Chemie für r Studierende der Medizin Allgemeine und Anorganische Chemie Teil 4+5 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Allgemeine Chemie für r Studierende der Medizin Allgemeine und Anorganische Chemie Teil 4+5 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für
Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/
 Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
Nachklausur zum Anorganisch-Chemischen Grundpraktikum, 28.04.05 Seite 1 von 10 Punkte: von 90 Studienbegleitende Prüfung Anorganisch-Chemisches Grundpraktikum WS 2004/2005 28.04.2005 Matrikelnummer: Name:
V 23 Dilatometrische Bestimmung reaktionskinetischer Größen
 Grundpraktikum Physikalische Chemie V 23 Dilatometrische Bestimmung reaktionskinetischer Größen Überarbeitetes Versuchsskript, L. Kibler, 19.11.2007 1 1. Vorkenntnisse Vor Durchführung des Versuches sollten
Grundpraktikum Physikalische Chemie V 23 Dilatometrische Bestimmung reaktionskinetischer Größen Überarbeitetes Versuchsskript, L. Kibler, 19.11.2007 1 1. Vorkenntnisse Vor Durchführung des Versuches sollten
PC I Thermodynamik und Transportprozesse. Kapitel 7. Kinetik. PC I-Kap :27 1
 20.07.2006 11:27 1 PC I Thermodynamik und Transportprozesse Kapitel 7 Kinetik Reaktionsgeschwindigkeit 20.07.2006 11:27 2 Messung der Reaktionsgeschwindigkeit. Die Konzentration des Edukts A ist als Funktion
20.07.2006 11:27 1 PC I Thermodynamik und Transportprozesse Kapitel 7 Kinetik Reaktionsgeschwindigkeit 20.07.2006 11:27 2 Messung der Reaktionsgeschwindigkeit. Die Konzentration des Edukts A ist als Funktion
Praktikum - Physikalische Chemie I 14. Januar Reaktion 2. Ordnung. Guido Petri Anastasiya Knoch PC111/112, Gruppe 11
 Praktikum - Physikalische Chemie I 14. Januar 2016 Reaktion 2. Ordnung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Reaktionsgeschwindigkeit von der Hydrolyse von Essigsäureacetatester
Praktikum - Physikalische Chemie I 14. Januar 2016 Reaktion 2. Ordnung Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 Aufgabenstellung Die Reaktionsgeschwindigkeit von der Hydrolyse von Essigsäureacetatester
Fachbereich Ökotrophologie Prof. Häusler SoSe 2005 Biochemie Definition und Fachgebiete
 Biochemie Definition und Fachgebiete Grenzwissenschaft zwischen Chemie, Biologie, Agrarwissenschaften und Medizin Spezialgebiete wie Immunchemie, Neurochemie, Pathobiologie, Genetik, Molekularbiologie,
Biochemie Definition und Fachgebiete Grenzwissenschaft zwischen Chemie, Biologie, Agrarwissenschaften und Medizin Spezialgebiete wie Immunchemie, Neurochemie, Pathobiologie, Genetik, Molekularbiologie,
Blitzlichtphotolyse 1
 Blitzlichtphotolyse 1 Reaktionskinetik einer Spiropyranbildung WICHTIG: 1. Sie sollten einen USB-Speicherstick o.ä. mitbringen! 2. Lesen Sie sich diese Anleitung VOR dem Tag des Praktikums gut durch. 3.
Blitzlichtphotolyse 1 Reaktionskinetik einer Spiropyranbildung WICHTIG: 1. Sie sollten einen USB-Speicherstick o.ä. mitbringen! 2. Lesen Sie sich diese Anleitung VOR dem Tag des Praktikums gut durch. 3.
Versuch 5. Isocitrat-Dehydrogenase
 Versuch 5 Isocitrat-Dehydrogenase Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X PD Dr. Gimpl Einleitung Ziel des Versuches ist es, die Abhängigkeit
Versuch 5 Isocitrat-Dehydrogenase Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X PD Dr. Gimpl Einleitung Ziel des Versuches ist es, die Abhängigkeit
Physikalisch-Chemisches Grundpraktikum Kinetik und Transportphänomene. Reaktionskinetik
 Physikalisch-Chemisches Grundpraktikum Kinetik und Transportphänomene Reaktionskinetik verantwortlich: Prof. Dr. R. Strey Lehrstuhl für Physikalische Chemie I der Universität Köln 2009 1 1. Reaktionskinetik
Physikalisch-Chemisches Grundpraktikum Kinetik und Transportphänomene Reaktionskinetik verantwortlich: Prof. Dr. R. Strey Lehrstuhl für Physikalische Chemie I der Universität Köln 2009 1 1. Reaktionskinetik
