Dendrit-substituierte Kupfer(I)-Komplexe: Vom einkernigen Modellkomplex zum Metallopolymer
|
|
|
- Claudia Thomas
- vor 7 Jahren
- Abrufe
Transkript
1 Dendrit-substituierte Kupfer(I)-Komplexe: Vom einkernigen Modellkomplex zum Metallopolymer Vom Fachbereich Chemie der Technischen Universität Darmstadt zur Erlangung des akademischen Grades eines Doctor rerum naturalium (Dr. rer. nat.) genehmigte DISSETATI vorgelegt von Dipl.-Chem. Julia Kubasch aus Karlsruhe Berichterstatter: Prof. Dr. M. ehahn Mitberichterstatter: Prof. Dr. M. eggelin Tag der Einreichung: 25. ktober 2004 Tag der mündlichen Prüfung: 6. Dezember 2004 Darmstadt 2004 D17
2
3 Meinem Vater Wissenschaftliche Fragestellungen verhalten sich wie Dendrite: Mit jeder neuen Erkenntnis ergibt sich eine Generation neuer Probleme.
4
5 Die vorliegende Arbeit wurde unter der Leitung von Prof. Dr. M. ehahn von September 1998 bis September 1999 am Polymer-Institut der Universität Karlsruhe (TH) und von ktober 1999 bis ktober 2004 am Ernst-Berl-Institut für Technische und Makromolekulare Chemie der Technischen Universität Darmstadt durchgeführt.
6
7 Bei Herrn Prof. Dr. M. ehahn möchte ich mich für die interessante Themenstellung, die gute Betreuung und sein stetes Interesse an dieser Arbeit bedanken. Meinen ehemaligen Kolleginnen und Kollegen im Polymer-Institut möchte ich für die tolle Zeit in Karlsruhe und die zahlreichen Unternehmungen und die andauernde Freundschaft bedanken. Und natürlich auch für die angenehme Arbeitsatmosphäre sowie zahlreiche Hilfestellungen: Bei Brigi Velten, Bettina Laube, Matthias Wittemann, Steffen Kelch und Jürgen Blaul bedanke ich mich für die Aufnahme zahlreicher M-Spektren an Wochenenden. Susanne Wehrle gilt mein Dank für die Durchführung der osmometrischen Messungen und der Einführung in die Messtechnik der Dampfdruckosmometrie. Für die durchgeführten UV-Vis-Messungen bedanke ich mich bei Ines Pietsch. Meinen Umzugsbegleitern Bettina Laube und Jens Wiesecke danke ich ganz herzlich für badische Unterstützung im anfangs so fremdartigen Hessen und für stete Hilfs- und Ausleihbereitschaft und die gute Freundschaft. Bei allen ehemaligen und aktuellen Kolleginnen und Kollegen in der Makromolekularen Chemie an der Lichtwiese und im DKI will mich für freundliche Aufnahme von badischen Doktorandinnen bedanken, die den neuen Chef begleiten. Aus anfänglichen Schwierigkeiten hat sich ein tolles Arbeitsklima entwickelt. Auch wenn Ihr es mir manchmal nicht gerade leicht gemacht habt! Für ständige Hilfestellungen im DKI bedanke ich mich ganz herzlich bei Ulf Schroer und Till uhl, bei letzterem auch für viele gemeinsame Woog- und Biergarten-Besuche. Für viele MALDI-Messungen - vor allem die allerletzten - möchte ich mich ganz herzlich bei Karsten ode bedanken, der immer bereit war, auch zwischendrin wichtige Proben zu messen. Für die Messung unzähliger 500 MHz M-Spektren möchte ich mich besonders bei Herrn unzheimer bedanken, ohne dessen Messungen meine Arbeit keinen Sinn gehabt hätte. Vielen Dank auch für die unmittelbare Unterstützung bei der Aufbereitung einiger Spektren zum Einbinden in diese Arbeit.
8 Für das Korrekturlesen meiner Arbeit möchte ich mich bei Stefan Tockner, Michael Preuss, Jens Wiesecke und besonders bei Patrick Wittmeyer bedanken, der sich gleich zweimal durch die vielen Seiten quälte. Für die Unterstützung in den Wochen vor meiner Abgabe möchte ich allen im Arbeitskreis danken, die meine schlechte Laune ertragen, mir Mut zugesprochen, Schokolade vorbeigebracht oder mich einfach nur abgelenkt haben. Besonders bedanke ich mich dabei bei Sascha exroth für den otebook-support und bei Bettina Schätzler, die mir heldenhaft zur Seite stand, als mein echner beim Drucken endgültig den Geist aufgab. Und bei beiden für den motivierenden Wettstreit, wer von uns als Erster seinen Doktor hat. Den Mitgliedern des ehemaligen Kochzirkels - Brigi Velten, Bettina Laube, Thomas Wannemacher und Ulf Schroer - gilt mein Dank für viele leckere Essen, nette Unterhaltungen und lustige Abende. Die Dienstagsaktivitäten mit gemeinsamer Qual bei der ückengymnastik und dem anschließenden wohlverdienten Kino- oder Kneipenbesuch haben schon fast Kultstatus erreicht. In diesem Sinne vielen Dank für unzählige lustige Abende an Bettina Schätzler, Patrick Wittmeyer, Sascha exroth, Peter Schmidt, Daniela Knecht, Helena Schwaßmann, icole eifschneider und Stefan Tockner. Mein Dank gilt allen Fußballern, die mich und meine Fehler auf dem Platz erdulden und die von mir verteilten blauen Flecken einstecken. Meinen Kommilitonen Michael Jörger, laf Hässler, Elke Willam-Thisted, Carmen Gruber-Traub und Timo Krämer will ich für die gute Freundschaft auch über längere Distanzen danken, für die tolle gemeinsame Studienzeit und Unterstützung bei Problemen aller Art. Verena Stumpf und Andi Mayr danke ich für eine wunderbare Freundschaft während schlechter und guter Zeiten und die tolle gemeinsame Zeit in Triberg. Ines Pietsch, Carmen Gruber-Traub und Bettina Schätzler will ich ein riesengroßes Dankeschön für aufbauende Diskussionen, andauernde Unterstützung, Verständnis, Freundschaft und viele lustige gemeinsame Aktivitäten aussprechen.
9 Inhaltsverzeichnis I 1 Einleitung 1 2 Grundlagen Metallkomplex-haltige Polymere Klassifizierung Grundlagen und Anforderungen zur Bildung von Metallkomplexen und Metallkomplex-haltigen Polymeren Kupfer(I)-Komplexe in der atur Typ I-Kupfer-Proteine Typ II-Kupfer-Proteine Typ III-Kupfer-Proteine Gemischte Typen Kupfer(I)-Komplexe als Katalysatoren adikalische Polymerisation unter Atomtransfer (ATP) Lebende radikalische Polymerisationen Mechanismus und Kinetik der Kupfer-katalysierten ATP Kupfer(I)-Komplexe in der Supramolekularen Chemie Catenane und otaxane Definitionen Catenane otaxane Molekulare Schalter, Motoren und Maschinen Polyrotaxane Kupfer(I)-Komplex-haltige Polymere Kupfer(I)-Koordinationspolymere Kupfer(I)-Komplexpolymere Kupfer(I)-Komplexpolymere mit Bi- und Terpyridin als Liganden Kupfer(I)-Komplexpolymere mit o-phenanthrolin als Liganden 41 3 Aufgabenstellung 47
10 II Inhaltsverzeichnis 4 Strategie und das Konzept sterischer Hinderung Strategie I Konzept der sterischen Hinderung Strategie II 52 5 Ergebnisse Darstellung der Monomere Synthese der 2,5-Di-n-hexylbenzol-1,4-diboronsäure (14) Synthese des 2,9-Bis(4-bromphenyl)- bzw. 2,9-Bis- (4-methoxyphenyl)-o-phenanthrolins (13) bzw. (18) Synthese des 2,9-Bis(4-hydroxyphenyl)-o-phenanthrolins (1) Darstellung und Charakterisierung der Polymere Allgemeines zur Polykondensations-eaktion Aryl-Aryl-Bindungsknüpfung mittels der Pd-katalysierten Suzuki-Kupplung Synthese der Precursor-Polymere Charakterisierung der Precursor-Polymere H- und 13 C-M-Spektroskopie Membran- und Dampfdruck-smometrie Viskosimetrie Darstellung und Charakterisierung einkerniger Kupfer(I)- Modellkomplexe Synthese und Charakterisierung des Bis[2,9-bis- (4-methoxyphenyl)-o-phenanthrolin]-Kupfer(I)- Hexafluorophosphats (30b) Synthese und Charakterisierung des Bis[2,9-bis- (4-hydroxyphenyl)-o-phenanthrolin]-Kupfer(I)- Hexafluorophosphats (3b) Polymeranaloge Komplexierung I Zugabe von Kupfer(I)-Chlorid zu Precursor-Polymer
11 Inhaltsverzeichnis III Zugabe von Tetrakis(acetonitrilo)-Kupfer(I)-Hexafluorophosphat (2b) zu Precursor-Polymer Tieftemperatur-Experiment am Kupfer(I)-Komplexpolymer UV-Vis-Spektroskopie Ligandenaustausch am Kupfer(I)-Komplexpolymer 16 durch Zugabe des zweizähnigen Hilfsliganden 2,9-Bis(4-hydroxyphenyl)-o-phenanthrolin (1) Darstellung Brommethylen-funktionalisierter Dendrite Fréchet-Dendrite Synthese der Fréchet-Dendrite Charakterisierung der Fréchet-Dendrite mit Hilfe der zweidimensionalen M-Spektroskopie Dendrite mit 1 3 Verästelungsstelle Synthese der Dendrite mit 1 3 Verästelungsstelle Charakterisierung der Dendrite mit 1 3 Verästelung mittels zweidimensionaler M-Spektroskopie und Massen- Spektrometrie Darstellung Dendrit-substituierter Phenanthroline und ihrer einkernigen Kupfer(I)-Komplexe Anbindung der Dendrite an 2,9-Bis(4-hydroxyphenyl)- o-phenanthrolin (1) Allgemeine Vorgehensweise Charakterisierung der Dendrit-substituierten o-phenanthrolin- Derivate mittels zweidimensionaler M-Spektroskopie und Massen-Spektrometrie Komplexierung der Dendrit-substituierten Phenanthroline mit dem Kupfer(I)-Spender [Cu(CH 3 C) 4 ]PF 6 (2b) Allgemeine Vorgehensweise Charakterisierung der Bis(dendrit-substituierten o-phenanthrolin)-kupfer(i)-komplexe mittels zweidimensionaler M- Spektroskopie und der MALDI-TF-Massenspektrometrie Anbindung der Dendrite an [Cu(Phen(H) 2 ) 2 ]PF 6 B-3b 187
12 IV Inhaltsverzeichnis Allgemeine Vorgehensweise Charakterisierung der Bis(dendrit-substituierten o-phenanthrolin)-kupfer(i)-komplexe mittels M-Spektroskopie Ligandenaustausch-Experimente an einkernigen Kupfer- Komplexen (Gleichgewichts-Lage) Allgemeine Vorgehensweise Titration des Kupfer(I)-Komplexes B-36 mit 2,9-Bis(4-methoxyphenyl)-o-phenanthrolin (18) Polymeranaloge Komplexierung II Allgemeine Vorgehensweise Titration des Kupfer(I)-Komplexpolymers 16 mit Phen(-4-G1) Ligandenaustausch-Experimente an Bis(chelat)-Kupfer(I)- Komplexen durch Zugabe von Precursor-Polymer Allgemeine Vorgehensweise Titration des Kupfer(I)-Komplexes B-34 mit Precursor- Polymer Titration des Kupfer(I)-Komplexes B-36 mit Precursor- Polymer Synthese von Kupfer(I)-Koordinationspolymer 10e Synthese des 4,4 -Bis[9-(4-hydroxyphenyl)-2- o-phenanthrolin]-2,5 -di-n-hexyl-p-terphenylens (9d) Synthese des 4,4 -Bis{9-[4-[3,4,5-tri(benzyloxy)benzyloxy]phenyl]-2-o-phenanthrolin}-2,5 -di-n-hexyl-p-terphenylens (9e) Komplexierung zum Kupfer(I)-Koordinationspolymer 10e Zusammenfassung und Ausblick Experimenteller Teil Allgemeines Chemikalien und Lösungsmittel 225
13 Inhaltsverzeichnis V Geräte Synthese der Monomere Darstellung der 2,5-Di-n-hexylbenzol-1,4-diboronsäure (14) ,4-Di-n-hexylbenzol (22) ,4-Dibrom-2,5-di-n-hexylbenzol (23) ,5-Di-n-hexylbenzol-1,4-diboronsäure (14) Darstellung der o-phenanthrolin-derivate (4-Bromphenyl)-o-phenanthrolin (27) ,9-Bis(4-bromphenyl)-o-phenanthrolin (13) ,9-Bis(4-methoxyphenyl)-o-phenanthrolin (18) ,9-Bis(4-hydroxyphenyl)-o-phenanthrolin (1) ,4 -Bis[9-(4 hydroxyphenyl)-2-o-phenanthrolin]- 2,5 -di-n-hexyl-p-terphenylen (9d) Tetrakis(triphenylphosphan)palladium(0) Synthese der Brommethylen-funktionalisierten Dendrite Darstellung der Fréchet-Dendrite ,5-Bis(benzyloxy)benzylalkohol (G1-H) ,5-Bis(benzyloxy)benzylbromid (G1-Br) ,5-Bis[3,5-bis(benzyloxy)benzyloxy]benzylalkohol (G2-H) ,5-Bis[3,5-bis(benzyloxy)benzyloxy]benzylbromid (G2-Br) ,5-Bis{3,5-bis[3,5-bis(benzyloxy)benzyloxy]benzyloxy}- benzylalkohol (G3-H) ,5-Bis{3,5-bis[3,5-bis(benzyloxy)benzyloxy]benzyloxy}- benzylbromid (G3-Br) Darstellung der 1. Generation an Dendriten mit 1 3 Verästelungsstelle ,4,5-Tri(benzyloxy)benzoesäuremethylester (G1-4-CH 3 ) ,4,5-Tri(benzyloxy)benzylalkohol (G1-4-H) ,4,5-Tri(benzyloxy)benzylbromid (G1-4-Br) Darstellung der 2. Generation an Dendriten mit 1 3 Verästelungsstelle in der 1. Generation 245
14 VI Inhaltsverzeichnis ,4,5-Tri[3,5-bis(benzyloxy)benzyloxy]benzoesäuremethylester (G2-4-CH 3 ) ,4,5-Tri[3,5-bis(benzyloxy)benzyloxy]benzylalkohol (G2-4-H) ,4,5-Tri[3,5-bis(benzyloxy)benzyloxy]benzylbromid (G2 4 Br) Darstellung der 3. Generation an Dendriten mit 1 3 Verästelungsstelle in der 1. Generation ,4,5-Tri{3,5-bis[3,5-bis(benzyloxy)benzyloxy]benzyloxy}- benzoesäuremethylester (G3-4-CH 3 ) ,4,5-Tri{3,5-bis[3,5-bis(benzyloxy)benzyloxy]benzyloxy}- benzylalkohol (G3-4-H) ,4,5-Tri{3,5-bis[3,5-bis(benzyloxy)benzyloxy]benzyloxy}- benzylbromid (G3-4-Br) Synthese der Dendrit-substituierten o-phenanthrolin- Derivate ,9-Bis[4-(benzyloxy)phenyl]-o-phenanthrolin (Phen(-Bz) 2 ) ,9-Bis{4-[3,5-bis(benzyloxy)benzyloxy]phenyl}- o-phenanthrolin (Phen(-G1) 2 ) ,9-Bis{4-[3,5-bis(3,5-bis(benzyloxy)benzyloxy) benzyloxy]phenyl}-o-phenanthrolin (Phen(-G2) 2 ) ,9-Bis{4-[3,4,5-tri(benzyloxy)benzyloxy]phenyl}- o-phenanthrolin (Phen(-4-G1) 2 ) ,4 -Bis{9-[4-[3,4,5-tri(benzyloxy)benzyloxy]phenyl]-2- o-phenanthrolin}-2,5 -di-n-hexyl-p-terphenylen (9e) Synthese der Modellkomplexe Bis[2,9-bis(4-hydroxyphenyl)-o-phenanthrolin]-Kupfer(I)- Hexafluorophosphat (B-3b) Bis[2,9-bis(4-methoxyphenyl)-o-phenanthrolin]-Kupfer(I)- Hexafluorophosphat (B-30b) Bis[2,9-bis[4-(benzyloxy)phenyl]-o-phenanthrolin]- Kupfer(I)-Hexafluorophosphat (B-34b) 262
15 Inhaltsverzeichnis VII Bis[2,9-bis{4-[3,5-bis(benzyloxy)benzyloxy]phenyl}- o-phenanthrolin]-kupfer(i)-hexafluorophosphat (B-35b) Bis[2,9-bis{4-[3,5-bis(3,5-bis(benzyloxy)benzyloxy)- benzyloxy]phenyl}-o-phenanthrolin]-kupfer(i)- Hexafluorophosphat (B-37b) Bis[2,9-bis{4-[3,4,5-tri(benzyloxy)benzyloxy]phenyl}- o-phenanthrolin]-kupfer(i)-hexafluorophosphat (B-36b) Ligandenaustausch-Experimente an einkernigen Kupfer(I)-Komplexen Titration von B-34 mit Chelat-Ligand Titration von B-35 mit Chelat-Ligand Titration von B-37 mit Chelat-Ligand Titration von B-36 mit Chelat-Ligand Synthese der Polymere Darstellung des Precursor-Polymers Poly(2,9-o-phenanthrolin-alt-2,5 -di-n hexyl-4,4 -p-terphenylen) (15) Darstellung des Kupfer(I)-Komplexpolymers Darstellung des Kupfer(I)-Komplexpolymers M-Titrationen zur Darstellung Dendrit-substituierter Kupfer(I)-Komplexpolymere Titration von 16 mit Phen(-Bz) Titration von 16 mit Phen(-G1) Titration von 16 mit Phen(-G2) Titration von 16 mit Phen(-4-G1) Titration von B-30 mit Precursor-Polymer Titration von B-34 mit Precursor-Polymer Titration von B-35 mit Precursor-Polymer Titration von B-37 mit Precursor-Polymer Titration von B-36 mit Precursor-Polymer M-Titrationen zu dem Kupfer(I)-Koordinationspolymer 10e Abkürzungsverzeichnis Literaturverzeichnis 291
16
17 1 1 Einleitung Konventionelle Polymere zeichnen sich dadurch aus, dass alle darin enthaltenen Atome und Atomgruppen ausschließlich durch kovalente Bindungen miteinander verknüpft sind. In der atur dagegen treten in vielen hochmolekularen biologischen Systemen zusätzlich koordinative Bindungen und damit Metallkomplexe auf. Diese stellen häufig das Wirkungszentrum dar und spielen bei verschiedensten Prozessen eine entscheidende olle, wie z. B. bei der Strukturbildung (rganisation der Tertiär- oder Quartärstruktur der Makromoleküle), dem Elektronentransfer (Elektronentransferkette bei der Photosynthese und Atmung), der Bindung von Sauerstoff oder auch der Katalyse (Metalloenzyme) [1]. Das herausragende Eigenschaftsprofil der Metallkomplexe in solchen natürlichen Verbindungen gab den Ausschlag zur Erforschung von synthetischen Polymeren, die Metallkomplexe als zusätzliche Strukturelemente in ihren Molekülen aufweisen [2] : Ihre besonderen chemischen und physikalischen Eigenschaften [3], insbesondere das edoxverhalten und die in einigen Systemen vorliegende kinetische Labilität, sind äußerst vielversprechend für spätere Anwendungen wie z. B. den Einsatz dieser Polymere in der Katalyse oder Photovoltaik [2, 4-14]. Zunächst muss allerdings ein grundlegendes Verständnis für diese Polymere erhalten werden, das nur durch umfassende Untersuchungen in Bezug auf Darstellung, Beständigkeit und Lösungsverhalten erreicht werden kann. Die Supramolekulare Chemie, die sich bislang hauptsächlich mit diesen letzteren Fragen befasst hat, zeigt auf niedermolekularem Gebiet zahlreiche Synthesestrategien, die sich Metallkomplex-haltiger Intermediate [15] bedienen. Deren Präorganisation führt zur später gewünschten topologischen Verknüpfung [16] der Einzelkomponenten. Analog zu so erhaltenen Catenanen und otaxanen sollten sich auf Basis Metallkomplexhaltiger Polymere beispielsweise auch deren hochmolekulare Vertreter, die Polyrotaxane [17-21] und Polycatenane, darstellen lassen. Daneben sollte aber auch die Synthese vieler anderer makromolekularer Systeme möglich sein, die auf verschiedenste Art eingebundene Metallkomplexe enthalten.
18 2
19 3 2 Grundlagen 2.1 Metallkomplex-haltige Polymere Klassifizierung Da der Einbau von Metallkomplexen in ein Polymer auf verschiedene Arten erfolgen kann, unterscheidet man ganz allgemein zwischen Metallkoordinations- und Metallkomplexpolymeren. Sind die Metallkomplexe selbst ein integraler Bestandteil der Polymerhauptkette, so spricht man von Metallkoordinationspolymeren. In diesem Fall werden die kovalent aufgebauten Ligandmonomere (Monomere mit zwei endständigen Ligand-Einheiten) ausschließlich durch die koordinativen Bindungen der Metallkomplexe zusammengehalten (Abb. 1, Struktur A). In Metallkomplexpolymeren sind dagegen die Metallkomplexe lateral an ein kovalentes Polymerrückgrat angebunden (Abb. 1, Struktur B). A L L L L L L L L B : Chelatligand-Einheit : Übergangsmetall L : Hilfsligand : organischer est Abb. 1: Schematische Darstellung eines Metallkoordinationspolymers A und eines Metallkomplexpolymers B. Die Komplexpolymere B haben gegenüber den Koordinationspolymeren A den Vorteil, über ein beständiges Polymerrückgrat zu verfügen, weshalb hier Kettenabbau- ( Depolymerisations -) Prozesse unter den üblichen Analyse- und Verarbeitungsbedingungen weitestgehend ausgeschlossen werden können. Im Gegensatz dazu ist die Existenz eines Koordinationspolymers A stets an die Beständigkeit der Metallkomplexe [22-24] gekoppelt, durch die es zusammengehalten wird. Ein weiterer Vorteil des Systems B besteht in der Möglichkeit, während der Synthese zunächst Metall-
20 4 2 Grundlagen komplex-freie Precursor-Polymere darzustellen, die sich problemlos mit den gängigen Methoden der Polymeranalytik charakterisieren lassen. Die im Anschluss daran erfolgende, polymeranaloge Umsetzung des Precursor-Polymers zum Metallkomplexpolymer B verändert dann zwar beispielsweise die spektroskopischen, elektrochemischen oder magnetischen Eigenschaften des Polymers, hat jedoch keinen Einfluss mehr auf Größen wie den Polymerisationsgrad oder die Uneinheitlichkeit des Systems. Dieses bleibt somit in dieser Hinsicht wohldefiniert. Koordinationspolymere A ähnlich umfassend zu charakterisieren ist hingegen ungleich schwieriger, da es sich bei diesen, aufgrund der meist geladenen Metallkomplexe in der Hauptkette, fast immer um Polyelektrolyte mit ihren spezifischen Problemen bei der Analytik handelt Grundlagen und Anforderungen zur Bildung von Metallkomplexen und Metallkomplex-haltigen Polymeren Das verwendete Metallion legt das Eigenschaftsprofil des resultierenden Metallkomplex-haltigen Polymers weitestgehend fest. Es gibt z. B. die möglichen xidationsstufen, Koordinationszahlen und -geometrien sowie die bevorzugten Ligandtypen vor. Auch die thermodynamische Stabilität, die kinetische Beständigkeit und die edoxpotentiale der entsprechenden Komplexe werden durch die Wahl des Metallions entscheidend beeinflusst. Daneben hat allerdings auch die Kettenarchitektur (Konstitution, Konfiguration und Konformation des Polymer-Grundgerüstes) einen signifikanten Einfluss auf das Eigenschaftsprofil des Produktes, die z. B. die mittleren Metall-Metall- Abstände oder die jeweilige Mikroumgebung der Metallzentren vorgibt. Um die Bildung von Metallkomplex-haltigen Polymeren zu ermöglichen, müssen die gewählten Metallkomplexe eine ausreichend hohe thermodynamische Stabilität besitzen. Betrachtet man die eaktion des solvatisierten Metallions MS 4 mit dem Liganden L zum gewünschten Metallkomplex S 3 ML, so muss diese als Gleichgewichts- eaktion betrachtet werden: MS 4 + L S 3 ML + S Abb. 2: Gleichgewichts-eaktion des solvatisierten Metallions MS 4 mit einem einzähnigen Liganden L zu dem Metallkomplex S 3 ML unter Verdrängung des Solvensmoleküls S.
21 2 Grundlagen 5 ach dem Massenwirkungsgesetz (Gl. 1) erhält man als Maß für die thermodynamische Stabilität des resultierenden Komplexes die Gleichgewichts-Konstante oder auch Komplexbildungs-Konstante K für dieses Gleichgewicht (Abb. 2): Gl. 1: [S3ML] [S] K = [MS4] [L] Eine große Komplexbildungs-Konstante K bedeutet hierbei, dass das vorliegende Gleichgewicht aus Abb. 2 auf der Seite der Produkte liegt und damit die Konzentration an dem gewünschten Komplex groß ist. Liganden, die über mehr als eine Koordinationsstelle verfügen, werden als Chelat-Liganden bezeichnet. Die Bildung eines Chelat-Komplexes aus einem solvatisierten Metallion MS 4 verläuft bei einem zweizähnigen Chelat-Liganden unter Verdrängung zweier Solvensmoleküle S: MS 4 + L L S 2 M L L + 2 S Abb. 3: Gleichgewichts-eaktion des solvatisierten Metallions MS 4 mit einem zweizähnigen Chelat-Liganden unter Verdrängung zweier Solvensmoleküle S. Bei der Ausbildung der Chelat-Komplexe kommt es im Gegensatz zu einzähnigen Liganden gemäß Abb. 3 zu einem Anstieg der Anzahl freier Teilchen im System. Der hiermit verbundene Entropiegewinn Komplexbildungs-Enthalpie Konstante K. 0 G 0 S führt nach Gl. 2 zu einer kleineren freien und somit zu einer großen Komplexbildungs- Gl. 2: G 0 = H 0 T S 0 = T lnk Diese vereinfachende Darstellung gilt jedoch nur, wenn davon ausgegangen werden kann, dass sich bei der Komplexierung des Chelat-Liganden keine ingspannung auf- 0 baut und sich der Enthalpiegewinn H bei der Ausbildung der beiden koordinativen Bindungen im Vergleich zu der bei der Koordination zweier einzähniger Liganden L nicht nennenswert ändert. Betrachtet man die Kinetik der Chelat-Komplexbildung, so kann der Prozess sowohl konzertiert als auch schrittweise erfolgen. Bei den meisten Chelat-Liganden verläuft der Prozess in mehreren Stufen, und als geschwindigkeitsbestimmender Schritt wird je nach System entweder die Bildung der ersten Bindung oder der Chelat-ingschluss
22 6 2 Grundlagen diskutiert [25]. Da jedoch ein Gleichgewicht vorliegt, dürfen neben den Hin-eaktionen auch die ück-eaktionen nicht vernachlässigt werden. So lässt sich für den mehrstufigen Chelat-Bildungsprozess folgendes Schema (Abb. 4) aufstellen: MS 4 + L L k 12 k 21 S 3 M L L + S k 23 k 32 S 2 M L L + 2 S Abb. 4: eaktionsschema für den mehrstufigen Bildungsprozess eines Metall-Chelats [25]. Die Bildungskonstante K der Chelat-Komplexe ist nach diesem Schema als Quotient des Produktes der Geschwindigkeits-Konstanten der Hin-eaktionen und dem Produkt der Geschwindigkeits-Konstanten der ück-eaktionen definiert: Gl. 3: k K = k k k Lange Zeit wurde angenommen, dass ein sehr hoher Wert für eine der Geschwindigkeits-Konstanten der Hin-eaktionen der Grund für die große Chelat-Bildungskonstante K (Gl. 3) ist. Jordan et al. konnten jedoch im Jahre 1980 aus direkten Messungen der Dissoziationskinetik zeigen, dass die Chelat-ingöffnung ein unerwartet langsamer Prozess ist und somit der sehr kleine Wert für die Geschwindigkeits-Konstante k 32 für den großen Wert von K verantwortlich ist [26]. icht unerheblich für die Stabilität des Chelat-Komplexes ist auch die ausgebildete Chelat-inggröße [27]. So weisen sechsgliedrige Chelat-inge ungefähr zehnmal größere Geschwindigkeits-Konstanten der ingöffnung auf als analoge fünfgliedrige [26, 28]. Größere (> 6 ingatome) und kleinere inge (< 5 ingatome) zeigen deutlich größere Geschwindigkeits-Konstanten für die ingöffnung. Dies ist die Folge der steigenden Spannung durch Abweichungen von idealen Bindungslängen und -winkeln, auftretende Torsionsspannungen innerhalb des Liganden und nichtbindende Wechselwirkungen zwischen den Donoratomen eines oder mehrerer Chelat-Liganden in den ausgebildeten Chelat-ingen [1]. Kommt es dennoch zu einer Bindungsdissoziation zwischen dem Metallion und einem Donoratom des Chelat- Liganden, so kann sich dieses aufgrund der Fixierung des Chelat-Liganden an das Metallion über das zweite Donoratom nur sehr begrenzt von der nun freien Koordinationsstelle des Zentralatoms entfernen. Die Wahrscheinlichkeit der erneuten Bildung einer koordinativen Bindung ist durch die räumliche ähe der beiden Bindungspartner sehr groß. Die geringe Wahrscheinlichkeit, dass sich beide Donoratome gleichzeitig aus ihrer Koordination befreien und sich dann frei vom Metallion
23 2 Grundlagen 7 fortbewegen können, trägt somit ebenfalls zur hohen Beständigkeit der Chelat- Komplexe bei [1]. Ein vielfach verwendeter und hinsichtlich seiner Koordinationschemie bereits gut untersuchter zweizähniger Chelat-Ligand ist das o-phenanthrolin. Die Chelatisierung von Metallionen mit o-phenanthrolin läuft im Gegensatz zur schrittweise erfolgenden Bildung von anderen Chelat-Komplexen (Abb. 4) in einem konzertierten Prozess ab. Dies konnten Moore et al für die Komplexierung von [Al(DMS) 6 ] 3+ mit dem zweizähnigen o-phenanthrolin zeigen [29]. +MS 6 MS S o-phenanthrolin Abb. 5: eaktionsschema für den konzertierten Bildungsprozess eines o-phenanthrolin- Metallkomplexes aus o-phenanthrolin und dem solvatisierten Metallion MS 6. Die rigide planare Struktur des o-phenanthrolin-ingsystems fixiert die beiden Stickstoff-Donoratome in einer für die Chelat-Bildung günstigen Position, so dass es zu einer simultanen Verdrängung der beiden ursprünglich koordinierten Solvensmoleküle S von dem Metallion kommt (Abb. 5). Die Chelat-ingbildung kann in diesem Fall mit einem Geschwindigkeitsgesetz 2. rdnung beschrieben werden. Bei konformativ flexibleren Chelat-Liganden, z. B. 2,2 -Bipyridin, liegt bei dem Chelat-ingschluss dagegen eine eaktion mit einem Geschwindigkeitsgesetz 1. rdnung vor, was auf eine schrittweise erfolgende Bildung des Chelat-Komplexes zurückzuführen ist [29]. Abschließend soll der Unterschied zwischen thermodynamischer Stabilität und kinetischer Beständigkeit angesprochen werden, da diese Unterscheidung für die vorliegende Arbeit von großer Bedeutung ist. Die thermodynamische Stabilität wird durch die freie Komplexbildungs-Enthalpie G 0 ausgedrückt, wobei G 0 < 0 gemäß den Gesetzen der Thermodynamik die Grundvoraussetzung für die spontane Bildung eines Komplexes darstellt. Die kinetische Beständigkeit dagegen liefert eine Aussage über die eaktivität des vorliegenden Komplexes und wird durch die Aktivierungsenergie für die
24 8 2 Grundlagen Komplexdissoziation beschrieben. Je geringer diese Aktivierungsenergie ist, desto leichter finden Substitutions-eaktionen an dem vorliegenden Komplex statt und der Komplex wird als kinetisch labil bezeichnet. Von Taube wurde als Grenze zwischen labilen und inerten Komplexen die vollständige Substitution aller Liganden bei 25 C innerhalb von 1 Minute festgelegt [30]. Eine theoretische, allerdings nur qualitative Deutung dieser sehr praxisnahen Definition basiert auf der Ligandenfeld-Theorie. Danach besitzen labile Komplex-Ionen entweder ein unbesetztes, energetisch tiefliegendes nichtbindendes rbital (t 2g im ktaederfeld) oder mindestens ein Elektron in einem energetisch hochliegenden antibindenden rbital (e g im ktaederfeld). Inerte Komplex-Ionen weisen mindestens ein Elektron in jedem nichtbindenden rbital (t 2g im ktaederfeld) auf, jedoch keine Elektronen in antibindenden rbitalen (e g im ktaederfeld) [23]. Bei der Auswahl der Zielstrukturen, insbesonders hinsichtlich des Metallions, gibt es demnach einige Dinge zu beachten, um die gewünschten Eigenschaften in den neuen Metall-haltigen Polymeren zu erhalten. Die bereits in der Einleitung erwähnten Anwendungen in der Katalyse und Photovoltaik sprechen für ein Metallion, dessen edoxpotentiale sich in einem zugänglichen Bereich befinden und dabei einen Wechsel der Koordinationszahl im edoxpaar aufweisen. Die freie Koordinationsstelle steht somit für eine katalytische Funktion des Systems zur Verfügung. Desweiteren sollte das Metallion kinetisch labile Komplexe aufbauen können, die jedoch eine hohe negative freie Komplexbildungs-Enthalpie aufweisen. Diese ist eine zwingende Voraussetzung für die hohe thermodynamische Stabilität der Komplexe in Lösung und damit auch für eine konstitutionell wohldefinierte Polymerstruktur sowohl im festen als auch im gelösten Zustand. ur an einer solchen ist eine umfassende Polymeranalytik möglich. Die xidationsstufe des betreffenden Metallions sollte außerdem so gewählt sein, dass einerseits eine festgelegte Koordinationsgeometrie, andererseits diamagnetische Metallzentren vorliegen. Denn nur in diesem Fall ist eine Charakterisierung der erhaltenen Strukturen mittels der M-Spektroskopie einfach möglich, die für die Verifizierung der Strukturen und das Verfolgen der ablaufenden Ligandenaustausch-Prozesse unbedingt erforderlich ist. Mit diesen Anforderungen schränkt sich die Auswahl an Metallen, die für solche Zielstrukturen in Frage kommen, auf eine relativ geringe Anzahl ein. Es handelt sich dabei
25 2 Grundlagen 9 vor allem um die Metalle der Kupfer-Gruppe. So haben Kupfer(I) und Silber(I) mit ihrer d 10 -Elektronenkonfiguration eine vollständig gefüllte d-rbitalschale mit ausschließlich gepaarten Elektronen vorliegen, so dass es sich um diamagnetische Metallzentren handelt [22]. Auch bilden beide Metallionen thermodynamisch stabile Komplexe mit vier Donorzentren aus, die dadurch die energetisch günstige Edelgaskonfiguration erlangen. Aufgrund des kleinen Ionenradius der Metallionen und der daraus resultierenden stärkeren Ligand-Ligand-Abstoßung sind Kupfer(I)- und Silber(I)- Komplexe in der egel tetraedrisch koordiniert, auch wenn diese Koordinationsgeometrie nicht durch Ligandenfeld-Effekte stabilisiert wird. Die hohe Anzahl an d-elektronen steht besonders in niedrigen xidationsstufen für eine gute ückbindung über π-rbitale zur Verfügung. Dadurch liegen weiche Metallionen, d. h. Metallionen mit hoher Deformierbarkeit ihrer Elektronenwolken, vor und so werden mit weichen Liganden (Stickstoff-Donoren) durch π-bindungen zwischen Metall-d- rbitalen und Ligandorbitalen hohe Bindungsstabilitäten erreicht [22]. Die Komplexe zeichnen sich desweiteren durch eine hohe kinetische Labilität aus, so dass die Ligandenaustausch-Prozesse sehr schnell verlaufen [1, 31, 32]. Bei dem direkten Vergleich von Kupfer(I) und Silber(I) fällt auf, dass zwischen den beiden Metallionen auch einige Unterschiede vorhanden sind. Ein gravierender achteil der Silber(I)-Komplexe ist deren hohe Lichtempfindlichkeit: Sie tendieren besonders in Lösung zur Disproportionierung in Silber(0) und Silber(II). Der ausfallende Silber(0)- iederschlag verändert die Stöchiometrie der einzelnen Komponenten zueinander und damit die Lage des bestehenden Gleichgewichtes. Das Vorliegen von paramagnetischen Silber(II)-Ionen in Lösung lässt gleichzeitig auch keine sinnvolle M-Analytik mehr zu. Diese achteile des Silber(I)-Ions sind beim Kupfer(I)-Ion und seinen Komplexen lediglich in sehr geringem Ausmaß vorhanden. Dazu kommt der geringere Preis der Kupfer(I)-Salze durch das häufigere Vorkommen von Kupfererzen, Kupfersalzen und elementarem Kupfer in der atur. Betrachtet man hingegen Kupfer in seiner xidationsstufe +II, so findet sich dort mit der d 9 -Elektronenkonfiguration ein Lehrbuch-Beispiel für den Jahn-Teller-Effekt. In Kupfer(II)-Komplexen liegt eine oktaedrische Koordination mit starker axialer Elongation vor, d. h. die äquatorialen Liganden in quadratisch planarer Koordination liegen deutlich näher am Zentralion als die axialen Liganden [22, 31]. Dieser Wechsel in
26 10 2 Grundlagen der Koordinationsgeometrie des Kupfers bzw. der Anzahl seiner Koordinationsstellen in Abhängigkeit von der xidationsstufe lässt sich in Hinblick auf katalytische Prozesse recht gut mit seiner Fähigkeit zur Bindung von lefinen oder zur Aktivierung von 2 im Triplett Grundzustand in Zusammenhang bringen [33]. Das Cu(II)/Cu(I)-edoxsystem ist besonders deshalb interessant, weil die edoxpotentiale von Cu(II)/Cu(I) und Cu(I)/Cu(0) nahe beieinander und beide zwischen 0,0 V und +1,0 V liegen. Die Einelektronen-edoxreaktivität in diesem Potential-Bereich führt zur Kompatibilität mit mäßig oxidierenden organischen und anorganischen adikalen, die als Bestandteile biologisch relevanter edoxsysteme erkannt worden sind. Im folgenden Kapitel sollen nun exemplarisch einige Beispiele der Wirkungsweise von Kupfer(I)-Komplexen in der atur dargestellt werden. 2.2 Kupfer(I)-Komplexe in der atur Kupfer-haltige biologische Systeme basieren auf dem edoxpaar Cu(II)/Cu(I), das ein edoxpotential im physiologisch relevanten Bereich von 0,0 1,0 V aufweist. Sie sind in Elektronentransfer-Prozesse, edoxreaktionen und in den Transport und die Aktivierung von Sauerstoff involviert und werden nach ihrer genauen Funktion und analytischen Merkmalen in drei Typ-Klassen eingeteilt [34] : Typ I: Die sogenannten blauen Kupfer-Proteine weisen pro Untereinheit genau ein Kupfer-Ion auf, das eine intensive Ligand-Metall-Charge- Transfer (LMCT)-Bande bei ca. 600 nm zeigt und für die blaue Farbe dieser für die Elektronenübertragung zuständigen Komplexe verantwortlich ist (Beispiel: Plastocyanin). Typ II: Diese einkernigen Kupfer-Proteine zeigen analog zu normalen Kupfer- Komplexen keine intensiven Absorptionen und werden deshalb oft auch als nichtblaue Kupfer-Proteine bezeichnet. Hier spielen Katalyse und edoxreaktivität eine zentrale olle. Dabei liegt eine funktionale Kopplung zwischen einem Kupfer-Zentrum und einem organischen edoxsystem vor, das in seiner Gesamtheit ein Metalloenzym darstellt (Beispiele: Galactose-xidase, Amin-xidase). Typ III: Die vorliegenden Kupfer-Dimere zeigen eine starke antiferro-
27 2 Grundlagen 11 magnetische Wechselwirkung und eine intensive LMCT-Bande bei ca. 300 nm. Sie dienen zur 2 -Aktivierung für den Transport und die xygenierung (Beispiele: Hämocyanin, Tyrosinase). Im Folgenden wird auf je eines dieser Beispiele und einen Mischtyp genauer eingegangen und ihre Wirkungsweise demonstriert Typ I-Kupfer-Proteine In Typ I-Kupfer-Proteinen wie dem Plastocyanin liegt das Kupfer(II)-Zentrum nicht in der üblichen Jahn-Teller-verzerrten oktaedrischen oder der quadratisch planaren Koordination vor, sondern weist eine der tetraedrischen Koordinationsgeometrie des Kupfer(I)-Ions ähnliche Anordnung der Liganden auf. Dabei wird das Kupfer(II)- Zentrum trigonal planar durch zwei Histidin-este und ein Cysteinat-Ion koordiniert, wobei letzteres durch eine starke π-wechselwirkung zwischen dem elektronenarmen Kupfer(II)-Ion und dem Schwefel-Atom des negativ geladenen Cysteinat-Ions gebunden wird. Diese kurze Cu S-Bindung zeigt Ligand-Metall-Charge-Transfer-Übergänge, die für die intensive blaue Farbe dieser Proteine verantwortlich sind. Außerdem weist das Kupfer(II)-Zentrum eine lange axiale Bindung zu dem π-akzeptorliganden Methionin auf, der den Kupfer(II)-Zustand destabilisiert (Abb. 6). Methionin S Histidin H Cu H S Histidin e - Cytochrom f H Cystein 84 Chlorophyll P 700 Abb. 6: Plastocyanin als Glied der Elektronentransferkette im Photosystem I. Die oben beschriebenen Abweichungen von der energetisch günstigsten Koordinationsgeometrie werden durch das Proteingerüst erzwungen, was als Verwirklichung eines
28 12 2 Grundlagen entatischen Zustands bezeichnet wird. Die so fixierte energiereiche Koordinationsgeometrie am Metallzentrum ist für die Enzymkatalyse von grundlegender Bedeutung, da während des Cu(II)/Cu(I)-Elektronenübertragungsschrittes keine Umlagerung zu der tetraedrischen Koordination des Kupfer(I)-Zentrums mehr notwendig und somit die Aktivierungsenergie dieses Schrittes stark herabgesetzt ist. Im Photosystem I grüner Pflanzen fungiert Plastocyanin als Elektronenüberträger zwischen dem Cytochrom f in der photosynthetisierenden Membran und dem photooxidierten Chlorophyll P 700 [33]. Für die anderen Glieder der Elektronentransferkette weist es zwei Bindungsstellen auf, die sich durch verschiedene Proteinseitenketten in ihren Eigenschaften unterscheiden. So liegt eine hydrophobe Bindungsstelle für das Cytochrom f und eine saure Bindungsstelle für das Chlorophyll P 700 vor, die jeweils an die komplementären egionen der beiden anderen Metalloproteine binden und damit ein gerichtetes Aggregat bilden, das die ichtung des Elektronentransfers mitbestimmt [1] Typ II-Kupfer-Proteine Bei Kupfer-Proteinen vom Typ II handelt es sich um Metalloenzyme, die die xidation von Aminen oder Alkoholen katalysieren. + Amin-xidase + -CH 2 -H H 2 + H H 4 H Abb. 7: Enzymatische xidation von Aminen zu Aldehyden durch die Amin-xidase. Die Amin-xidase besitzt ein Typ II-Kupfer-Zentrum pro Untereinheit, das zur Bewältigung des Zweielektronen-Prozesses nach der eaktionsgleichung in Abb. 7 mit dem organischen edoxsystem Topachinon / Topasemichinon / Topahydrochinon (organische Cofaktoren) strukturell und funktionell verbunden ist (Abb. 8). Die organischen Cofaktoren dienen vor allem der Amin-Bindung und -xidation, während an der Bindung und Aktivierung von 2 das hauptsächlich mit Histidin koordinierte Metallzentrum beteiligt ist. Dabei wird eine intraenzymatische Elektronenübertragung durch das Valenztautomerie-Gleichgewicht zwischen Cu(II) / Catecholat und Cu(I) / Semichinon diskutiert, das erst die Bindung von 2 an das Kupfer(I)-Zentrum ermöglicht [35].
29 2 Grundlagen 13 + H H 4 H 2 E Q 0 Cu(II) + -CH 2 -H 3 H E: Enzym * E Q 2- Q: Topachinon Cu(II) H H * E Q.- Cu(II)- 2 2 * E Q Cu(I).- Q Q * Q.- 2- n- : Topasemichinon : Catecholat : Imin-/Amin-Form Abb. 8: Katalysezyklus der Aminoxidation durch das Metalloenzym Amin-xidase [35]. Amin-xidasen besitzen zahlreiche metabolische Funktionen. So sind sie z. B. für den Aufbau von Bindegewebe (Collagen) durch vernetzende Polykondensations-eaktionen zwischen Aminen und Carbonyl-Verbindungen bedeutsam [36] Typ III-Kupfer-Proteine Eines der bekanntesten Beispiele für ein Typ III-Kupfer-Protein stellt das Hämocyanin dar, das in der Hämolymphe dem Blut von Arthropoden (z. B. Krebse, Spinnen) und Mollusken (z. B. Muscheln, Tintenfische) für den Sauerstoff-Transport verantwortlich ist. Dieses hochmolekulare Sauerstoff-Protein enthält pro Untereinheit zwei kooperativ agierende Kupfer-Zentren, die wie in Abb. 9 dargestellt entweder in dem farblosen Desoxy-Zustand oder als blaue xy-form mit antiferromagnetisch gekoppelten d 9 -Metallzentren vorliegen [33]. His His Cu(I) His Cu(I) His His His Cu(II) His Cu(II) His His His His His Abb. 9: eversibles Gleichgewicht zwischen Desoxy-Hämocyanin und xy-hämocyanin. Dabei zeigt das Desoxy-Hämocyanin zwei benachbarte, koordinativ ungesättigte Kupfer(I)-Zentren, die jeweils durch einen schwach und zwei stark gebundene Histidin- este am Proteingerüst verankert sind [36, 37]. Durch die Aufnahme eines Triplett-Sauer-
30 14 2 Grundlagen stoff-moleküls geht das Desoxy-Hämocyanin reversibel in seine xy-form über, in der eine Verbrückung der beiden Kupfer(II)-Zentren durch das doppelt (µ-η 2 :η 2 )-side-onkoordinierte Peroxid-Anion und damit eine stark geschwächte -Bindung vorliegt [38]. Die hochgradige Assoziation der Hämocyanin-Untereinheiten zu hochmolekularen Gebilden und die damit vorliegende allosterische Wechselwirkung muss als Ursache für die angestrebte und z. T. erreichte Kooperativität angesehen werden [1, 36] Gemischte Typen eben den genannten Kupfer-Proteinen, die sich eindeutig in eine der drei Typ-Klassen einordnen lassen, gibt es auch einige, bei denen eine Mischung der reinen Typen vorkommt. Ein gutes Beispiel hierfür ist die Ascorbat-xidase, bei der eine strukturelle Fixierung zweier reaktiver Zentren relativ zueinander die Vierelektronen-eduktion von 2 zu zwei H 2 katalysiert (Abb. 10) und dabei Ascorbat zum Dehydroascorbat oxidiert [1] Ascorbat-xidase 2 H H H Ascorbinsäure = CH(H)CH 2 H Dehydroascorbinsäure Abb. 10: Enzymatische xidation vom Ascorbat zum Dehydroascorbat durch die Ascorbat- xidase. Das Enzym weist ein Typ I-Kupfer-Zentrum mit Elektronentransfer-Funktion vom gebundenen Ascorbat und einen katalytisch aktiven, trimeren Kupfer-Cluster auf. Das Kupfer-Trimer wird als eine Mischung aus einem Typ II- und zwei Typ III-Zentren angesehen [34] und stellt das Katalyse-Zentrum für die 2 -eduktion dar. Dabei wird das Sauerstoff-Molekül als end-on gebundenes Hydroperoxid an eines der Typ III-Kupfer- Zentren koordiniert. Über einen intramolekularen Elektronentransfer findet die - Bindungsspaltung und die Freisetzung der beiden Wasser-Moleküle statt [33].
31 2 Grundlagen Kupfer(I)-Komplexe als Katalysatoren achdem im vorigen Kapitel anhand einiger Beispiele die Wirkungsweise von Kupfer- Komplexen in der atur und unter anderem ihre Eignung als Katalysatorsystem aufgezeigt wurde, soll nun auf den Einsatz von Kupfer-Komplexen als Katalysatoren zur Darstellung von synthetischen Polymeren eingegangen werden adikalische Polymerisation unter Atomtransfer (ATP) Lebende radikalische Polymerisationen Die Kupfer-katalysierte Atom Transfer adical Polymerization (ATP) stellt einen Polymerisationstyp dar, der dem Konzept der lebenden Polymerisation entspricht. Eine lebende Polymerisation ist definiert als eine Kettenreaktion, die zu Polymeren führt, ohne dass irreversible Übertragungs- oder Abbruch-eaktionen auftreten [39, 40]. ach der vollständigen Umsetzung des Monomers zu Makromolekülen mit definiertem Molekulargewicht liegen die Kettenenden weiterhin aktiv vor. Durch den gezielten Einsatz von Abbruchreagenzien lassen sich so Homopolymere [41] funktionalisieren oder durch die Zugabe von anderen Monomeren zu Blockcopolymeren [42] umsetzen. Auf dem Gebiet der lebenden Polymerisationsverfahren dominiert die anionische Polymerisation [39, 40], jedoch stellen kationische [43, 44] und Metallocen-katalysierte [45] Polymerisationen bekannte Alternativen dar. Mit diesen lebenden Polymerisationsmethoden ist eine gezielte Einstellung von Produktparametern, wie z. B. der Konstitution und der Molekulargewichts-Verteilung, möglich. Allerdings sind diese Methoden sehr empfindlich gegenüber Verunreinigungen und Luftsauerstoff, die zu irreversiblem Kettenabbruch führen. Deutlich unempfindlicher dagegen ist die Klasse der kontrollierten radikalischen Polymerisationen [46, 47], zu der unter anderen auch die bereits erwähnte ATP gehört [48-54]. Das Prinzip dieser kontrollierten radikalischen eaktionsführung besteht im Vorliegen eines dynamischen Gleichgewichtes zwischen einer relativ kleinen Anzahl an wachsenden freien adikalen und einer großen Anzahl an deaktivierten schlafenden Spezies [55]. Irreversible Kettenübertragungs- und Kettenabbruch-eaktionen lassen sich durch die starke Absenkung der stationären adikal-konzentration zwar nicht vollständig unterbinden, können aber erheblich zurückgedrängt werden. So lassen sich mit vergleichsweise geringem Aufwand Produkte herstellen, die vielen technischen Anforderungen vollauf genügen. Die hierfür notwendige Verringerung der Konzen-
32 16 2 Grundlagen tration an freien adikalen lässt sich auf unterschiedliche Weise erreichen: Bei der itroxide Mediated Polymerization (MP) werden stabile adikale auf Basis von itroxiden wie dem 2,2,6,6-Tetramethylpiperidin-1-oxid (TEMP) gebildet [56]. Im Fall des eversible Addition Fragmentation Chain Transfer Process (AFT) werden Thioester zur Erzeugung der deaktivierten Spezies eingesetzt [57, 58]. Die Atom Transfer adical Polymerization (ATP) basiert auf dem Übergangsmetall-katalysierten Atomtransfer eines Halogenatoms von einem Kupfer(II)- Komplex [CuL 4 ]X 2 zu einem freien Alkylradikal, wobei sich ein Alkylhalogenid -X (deaktivierte Spezies) und ein Kupfer(I)-Komplex [CuL 4 ]X bildet. Der genaue Mechanismus und die dabei eingesetzten Katalysatorsysteme werden in dem folgenden Abschnitt beschrieben Mechanismus und Kinetik der Kupfer-katalysierten ATP Der Mechanismus der Kupfer-katalysierten ATP [49, 59] besteht wie jede radikalische Polymerisation aus den Schritten Initiierung, Kettenwachstum und Kettenabbruch. Dabei liegt allerdings neben der bekannten Initiierungs- und Kettenwachstums-eaktion ein dynamisches Gleichgewicht zwischen wachsenden freien adikalen und deaktivierten schlafenden Spezies vor (Abb. 11), das stark auf die Seite der deaktivierten Spezies verschoben ist: X + deaktivierte Spezies X - Cu+ Katalysator k a k d k t aktivierte Spezies + k p + M X Cu+ X - Abb. 11: Dynamisches Gleichgewicht zwischen deaktivierten und aktivierten Spezies bei der Kupfer-katalysierten ATP. Der Kupfer(I)-Komplex [CuL 4 ]X wird durch einen reversiblen edoxprozess zu dem
33 2 Grundlagen 17 Kupfer(II)-Komplex [CuL 4 ]X 2 oxidiert. Gleichzeitig erfolgt eine Übertragung des Elektrons auf das Alkylhalogenid X, das dabei in ein freies Alkylradikal und ein Kupfer(II)-koordinierendes Halogenid zerfällt (Abb. 11). Dabei haben die Liganden L einen großen Einfluss auf die Lage des Aktivierungs- und Deaktivierungs-Gleichgewichtes sowie auf die Löslichkeit des Katalysators im System [60, 61]. Besonders gut eignen sich Stickstoff-haltige Chelat-Liganden [62], wie z. B. Bipyridine [60], Phenanthroline [63-65] und mehrzähnige aliphatische Amine [62, 66-68], die zur Löslichkeitsvermittlung häufig mit aliphatischen Seitenketten versehen sind. Da bei der edoxreaktion eine homolytische Spaltung [69] der Kohlenstoff-Halogen- Bindung im Alkylhalogenid erfolgt, darf die Stärke dieser Bindung nicht zu hoch, gleichzeitig aber auch diese Bindung nicht zu stark polarisiert sein. Aus diesem Grund werden als Initiatoren meist Alkylbromide und -chloride verwendet. Besitzen diese eine ähnliche chemische Konstitution wie die makromolekularen deaktivierten Spezies, so entspricht die Konstante der Initiierung (k i ) ungefähr der Kettenwachstums-Konstante (k p ). Damit kann gewährleistet werden, dass der Initiierungsschritt schnell und quantitativ erfolgt und so alle Ketten nahezu zeitgleich und bereits bei sehr niedrigem Monomerumsatz gestartet werden [70]. Auf diese Weise kann eine breite Molekulargewichts-Verteilung aufgrund langsamer Initiierung vermieden werden. Initiierung: -X + [Cu L 4 ]X I + II [Cu L 4 ]X 2 k i + M I P 1 1 P-X + [Cu L 4 ]X + II [Cu L 4 ]X 2 Kettenwachstum: k p + M P-X + [Cu L 4 ]X n I k d k a P n + II [Cu L 4 ]X 2 Kettenabbruch: k p + M k t P m + P n P n+m oder P n- 1 -CH 2 -CH 3 + P m-1 -CH=CH 2 Abb. 12: Schematische und stark vereinfachte Darstellung des Mechanismus der ATP mit Initiierung, Kettenwachstum und Kettenabbruch.
34 18 2 Grundlagen Der Initiierungsschritt besteht aus einem vorgelagerten Gleichgewicht (Abb. 12), in dem der Initiator das Alkylhalogenid X durch den reversiblen edoxprozess laut Abb. 11 in das Initiatorradikal gespalten wird und der nachgestellten schnellen Initiierungs-eaktion. In letzterer reagiert das gebildete Initiatorradikal mit dem vorhandenen Monomer M zu dem freien adikal P 1. Auch dieses adikal P 1 steht im dynamischen Gleichgewicht mit seiner deaktivierten Spezies P 1 X (Abb. 12). Im nachfolgenden Wachstumsschritt erfolgt die Anlagerung von Monomeren an die aktive Spezies P n, die erneut reversibel durch Halogen-Übertragung vom Kupfer(II)- Komplex zu seiner deaktivierten Form P n X oxidiert wird (Abb. 12). Kettenabbruch kann hier analog zur konventionellen radikalischen Polymerisation durch ekombination (P n+m ) oder Disproportionierung (P n-1 CH 2 CH 3 + P m-1 CH=CH 2 ) von zwei adikalen (P n + P m ) hervorgerufen werden (Abb. 12). Dies ist aber aufgrund der geringen Konzentration an freien adikalen sehr viel weniger wahrscheinlich als bei der konventionellen radikalischen Polymerisation, so dass der quasi-lebende Charakter der ATP resultiert [71]. Betrachtet man eine ideale ATP, d. h. einen Polymerisationsprozess mit schneller und vollständiger Initiierung, konstanter Konzentration an aktiven Spezies und vernachlässigbarem Anteil an Übertragungs- und Abbruch-eaktionen, so ergibt sich ein linearer Zusammenhang zwischen Umsatz und eaktionszeit sowie ein linearer Anstieg der Molekulargewichte mit steigendem Umsatz [70]. Damit wird eine sehr einfache Kontrolle der Kettenarchitekturen unter Bedingungen, die auch für technische Polymerisationen interessant sind, möglich. achteile sind die insgesamt geringe Polymerisationsgeschwindigkeit, die auf Kosten der aum-zeit-ausbeute geht, und die otwendigkeit der Abtrennung des Katalysatorsystems. Dessen Abtrennung von den erhaltenen Polymeren nach Abschluss der eaktion erfolgt normalerweise durch Filtration des eaktionsgemisches über Aluminiumoxid. Dabei können jedoch Katalysatorreste im Polymer verbleiben, die zu einer Verschlechterung der Produkteigenschaften (Alterung, Vergilbung, Toxizität, usw.) führen. Außerdem sind solche nachträglichen einigungsschritte verfahrenstechnisch aufwändig und teuer. Diese Probleme könnten durch den Einsatz von geträgerten (immobilisierten) Katalysatorsystemen [72-76] weitestgehend umgangen werden. Dies setzt allerdings voraus, dass die mit polymeren [77, 78] Liganden versehenen Kupfer-Komplexe unter vergleichbaren Polymerisationsgeschwindigkeiten ebenfalls die gezielte Einstellung der Molekulargewichte und ihrer
35 2 Grundlagen 19 Verteilungen ermöglichen. Auch müssten die Kupfer-Komplexe fest an den Träger gebunden sein und dieser sich leicht vom Produkt abtrennen lassen. Die Entwicklung solcher Kupfer-Komplexpolymere wäre für die großtechnische utzung der ATP von großem Vorteil und offenbart damit einen Grund für die otwendigkeit einer grundlegenden Erforschung dieser Systeme. Alternativ zur kontrollierten radikalischen Polymerisation in Masse oder in Lösung wurde die Durchführung der ATP in (Mini-)Emulsion sowie in Suspension untersucht [79, 80]. In diesen Fällen ist eine leichte Abtrennung des Katalysators möglich, da sich dieser nach der Phasentrennung in einer anderen Phase befindet als das hergestellte Polymer. Dabei wurde auch der Einsatz von polymeren Makroliganden mit amphiphilen Eigenschaften getestet und deren spätere Abtrennbarkeit für sehr gut befunden [81]. Leider beschränkt sich diese Anwendung noch auf einige wenige Monomere, so dass auch hier eine Weiterentwicklung der eingesetzten Kupfer-Komplexpolymere dringend notwendig ist. 2.4 Kupfer(I)-Komplexe in der Supramolekularen Chemie Die Supramolekulare Chemie beschäftigt sich mit Strukturen und Funktionen von Einheiten, die durch Assoziation von zwei oder mehr Einzelkomponenten gebildet werden [10]. Die Partner einer supramolekularen Spezies werden oft als molekularer ezeptor und Substrat bezeichnet, wobei diese Terminologie noch den ursprünglichen Bezug zu biologischen ezeptoren und Substraten vermittelt. Von der Beschränkung auf biologische Systeme hat sich die Supramolekulare Chemie allerdings lange befreit. Die molekulare Wechselwirkung zwischen den Komponenten einer supramolekularen Spezies basiert auf dem Prinzip der molekularen Erkennung (Abb. 13) und fordert die Komplementarität ihrer nichtkovalenten Bindungsstellen [82]. Dabei kann die atur dieser selektiven Bindungen sehr unterschiedlich sein: Sämtliche nichtkovalenten Wechselwirkungen wie z. B. Wasserstoffbrückenbindungen, koordinative Bindungen, elektrostatische Wechselwirkungen oder van-der-waals-kräfte sind möglich. Ist neben der elektronischen zusätzlich auch eine sterische (Gestalt und Größe) Komplementarität der Partner gegeben, so spricht man von präorganisierten Komponenten, die sich durch self assembly zur supramolekularen Spezies zusammenlagern (Schlüssel-Schloss- Prinzip).
1 Einleitung. Einleitung 1
 Einleitung 1 1 Einleitung Die Supramolekulare Chemie ist die Chemie der intermolekularen Bindung. Sie beschäftigt sich mit Strukturen und Funktionen von Einheiten, die durch Assoziation zweier oder mehrerer
Einleitung 1 1 Einleitung Die Supramolekulare Chemie ist die Chemie der intermolekularen Bindung. Sie beschäftigt sich mit Strukturen und Funktionen von Einheiten, die durch Assoziation zweier oder mehrerer
Komplexchemie und Molekülgeometrie. Aufbau und Nomenklatur von Komplexverbindungen
 Aufbau und Nomenklatur von Komplexverbindungen Komplexverbindungen sind chemische Verbindungen, die aus einem Zentralatom und Molekülen bzw. Ionen gebildet werden. Aufbau von Komplexverbindungen Zentralatom
Aufbau und Nomenklatur von Komplexverbindungen Komplexverbindungen sind chemische Verbindungen, die aus einem Zentralatom und Molekülen bzw. Ionen gebildet werden. Aufbau von Komplexverbindungen Zentralatom
Zusammenfassung 101 L 2 H 3
 Zusammenfassung 101 6. Zusammenfassung In dieser Arbeit gelang zum ersten Mal die Synthese und Charakterisierung von Übergangsmetall koordinierten Anilinoradikalen. Die Eigenschaften der koordinierten
Zusammenfassung 101 6. Zusammenfassung In dieser Arbeit gelang zum ersten Mal die Synthese und Charakterisierung von Übergangsmetall koordinierten Anilinoradikalen. Die Eigenschaften der koordinierten
5.6 Darstellung Dendrit-substituierter Phenanthroline und ihrer einkernigen Kupfer(I)-Komplexe
 5 Ergebnisse 173 5.6 Darstellung Dendrit-substituierter Phenanthroline und ihrer einkernigen Kupfer(I)-Komplexe 5.6.1 Anbindung der Dendrite an 2,9-Bis(4-hydroxyphenyl)- o-phenanthrolin (1) Zur Anbindung
5 Ergebnisse 173 5.6 Darstellung Dendrit-substituierter Phenanthroline und ihrer einkernigen Kupfer(I)-Komplexe 5.6.1 Anbindung der Dendrite an 2,9-Bis(4-hydroxyphenyl)- o-phenanthrolin (1) Zur Anbindung
4. Zusammenfassung 100 H P P H
 4. Zusammenfassung 100 =XVDQIDVVXQJ Die vorliegende Arbeit beschreibt sowohl die Synthese und Komplexchemie von Zirkoniumphosphaniden sowie der homologen Systeme des Arsens, als auch die erstellung von
4. Zusammenfassung 100 =XVDQIDVVXQJ Die vorliegende Arbeit beschreibt sowohl die Synthese und Komplexchemie von Zirkoniumphosphaniden sowie der homologen Systeme des Arsens, als auch die erstellung von
Katalyse. Martin Babilon 14/07/2011. Katalyse. Martin Babilon Universität Paderborn. 14 Juli Montag, 18. Juli 2011
 Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
Katalyse Universität Paderborn 14 Juli 2011 1 Übersicht Motivation & Einleitung Katalyse-Zyklus homogene Katalyse heterogene Katalyse 2 Motivation 3 Geschichte der Katalyse 6000 v. Christus: Alkoholvergärung
Komplexe SPF BCH am Inhaltsverzeichnis Ihr könnt die Formeln von Komplexsalzen korrekt aufschreiben... 2
 Komplexe Inhaltsverzeichnis Ihr könnt die Formeln von Komplexsalzen korrekt aufschreiben... 2 Ihr könnt die Namen von Komplexsalzen aus den Formeln herleiten... 2 Ihr könnt aus der Beschreibung einer Komplexreaktion
Komplexe Inhaltsverzeichnis Ihr könnt die Formeln von Komplexsalzen korrekt aufschreiben... 2 Ihr könnt die Namen von Komplexsalzen aus den Formeln herleiten... 2 Ihr könnt aus der Beschreibung einer Komplexreaktion
Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen:
 Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen: Palladium (Pd) hat die Elektronenkonfiguration [Kr] 4d 10 Gruppe VIIIc, spätes Übergangsmetall, xidationsstufen 0 und 2 typische Verwendung: wegen
Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen: Palladium (Pd) hat die Elektronenkonfiguration [Kr] 4d 10 Gruppe VIIIc, spätes Übergangsmetall, xidationsstufen 0 und 2 typische Verwendung: wegen
Beispielaufgaben IChO 2. Runde 2019 Koordinationschemie
 Beispiel 1 Metalle und Elektronen Bei der Besetzung von Atomorbitalen werden die Elektronen ausgehend vom energetisch am tiefsten liegenden Atomorbital in Richtung ansteigender Energie mit den Elektronen
Beispiel 1 Metalle und Elektronen Bei der Besetzung von Atomorbitalen werden die Elektronen ausgehend vom energetisch am tiefsten liegenden Atomorbital in Richtung ansteigender Energie mit den Elektronen
Vorname: Frage 1. Nennen Sie drei Metalle, die :für den Menschen essentiell sind und als Mengenelemente Körper vorkommen (3 P) Frage 2
 1\.1 Matrikelnummer: Name: Vorname: Bitte eintragen Bitte ankreuzen: Fachsemester: Fachrichtung: Chemie Sonstige Bitte prüfen Sie Ihre Klausur sofort auf Vollständigkeit (Seiten fortlaufend nummeriert
1\.1 Matrikelnummer: Name: Vorname: Bitte eintragen Bitte ankreuzen: Fachsemester: Fachrichtung: Chemie Sonstige Bitte prüfen Sie Ihre Klausur sofort auf Vollständigkeit (Seiten fortlaufend nummeriert
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Mechanismus der Enzymkatalyse
 Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Komplexbildung. CoCl 3 5 NH 3. CoCl 3 6 NH 3. CoCl 3 4 NH 3 Alfred Werner The Nobel Prize in Chemistry 1913
 Komplexbildung CoCl 3 6 NH 3 CoCl 3 5 NH 3 CoCl 3 4 NH 3 CoCl 3 4 NH 3 Alfred Werner 1866-1919 The Nobel Prize in Chemistry 1913 Komplexbildung Beispiel wässrige Lösungen von Aluminium(III) Al 3+ + 3 OH
Komplexbildung CoCl 3 6 NH 3 CoCl 3 5 NH 3 CoCl 3 4 NH 3 CoCl 3 4 NH 3 Alfred Werner 1866-1919 The Nobel Prize in Chemistry 1913 Komplexbildung Beispiel wässrige Lösungen von Aluminium(III) Al 3+ + 3 OH
AC I (AC) HS 2011 Übungen + Lösungen Serie 10
 rof. A. Togni, D-CHAB, HCI H 239 AC I (AC) HS 2011 Übungen ösungen Serie 10 Koordinationschemie A 1. rinzipiell liessen sich sechs iganden () in einem Metallkomplex M 6 nicht nur oktaedrisch sondern auch
rof. A. Togni, D-CHAB, HCI H 239 AC I (AC) HS 2011 Übungen ösungen Serie 10 Koordinationschemie A 1. rinzipiell liessen sich sechs iganden () in einem Metallkomplex M 6 nicht nur oktaedrisch sondern auch
1 Der Elektronentransfer: Theorie nach Marcus und Hush
 1 Der Elektronentransfer: Theorie nach Marcus und Hush Betrachtet wird der Elektronentransfer zwischen zwei solvatisierten Spezies in einer Lösung. Es gibt zwei Arten von Elektronentransfer, Reaktionen
1 Der Elektronentransfer: Theorie nach Marcus und Hush Betrachtet wird der Elektronentransfer zwischen zwei solvatisierten Spezies in einer Lösung. Es gibt zwei Arten von Elektronentransfer, Reaktionen
Bioorganische Chemie Enzymatische Katalyse 2011
 Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Anorganische Chemie II
 Anorganische Chemie II B. Sc. Chemieingenieurwesen 13. Juli 2017 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Anorganische Chemie II B. Sc. Chemieingenieurwesen 13. Juli 2017 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Spezielle Methoden der pharmazeutischen Chemie 1
 Spezielle thoden der pharmazeutischen Chemie 1 andhabung von tallorganika (für Diplomanden und Dissertanten im Fach armazeutischen Chemie/Synthese) Kapiteleinteilung: 1. Geräte und Arbeitstechniken 2.
Spezielle thoden der pharmazeutischen Chemie 1 andhabung von tallorganika (für Diplomanden und Dissertanten im Fach armazeutischen Chemie/Synthese) Kapiteleinteilung: 1. Geräte und Arbeitstechniken 2.
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Mechanismen in der anorganischen Chemie
 Mechanismen in der anorganischen Chemie Eine Untersuchung von Metall-Komplexen in Lösungen Yon Fred Basolo und Ralph G. Pearson Übersetzt von Eckart Eich und Norbert Sütterlin 143 Abbildungen, 144 Tabellen
Mechanismen in der anorganischen Chemie Eine Untersuchung von Metall-Komplexen in Lösungen Yon Fred Basolo und Ralph G. Pearson Übersetzt von Eckart Eich und Norbert Sütterlin 143 Abbildungen, 144 Tabellen
Versuch: Enzyme (LDH)
 Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Elektronenspektrum von [Ti(H 2 O) 6 ] 3+
![Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ Elektronenspektrum von [Ti(H 2 O) 6 ] 3+](/thumbs/66/55543366.jpg) Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ 3 2 1 15 20 25 30 1000 cm -1 e g hv t 2g Deutung der Elektronenspektren Absorption bestimmter Frequenzen des eingestrahlten Lichts durch: Elektronenübergang zwischen
Elektronenspektrum von [Ti(H 2 O) 6 ] 3+ 3 2 1 15 20 25 30 1000 cm -1 e g hv t 2g Deutung der Elektronenspektren Absorption bestimmter Frequenzen des eingestrahlten Lichts durch: Elektronenübergang zwischen
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
A. Mezzetti Fragenkatalog X
 Anorganische Chemie I Elektronenespektren A. Mezzetti ragenkatalog X 1. K n [V 6 ] (n muss bestimmt werden) (B) hat µ eff = 2.66 BM. Sein UV-VIS-Spektrum enthält eine sehr schwache Bande (10'000 cm 1 )
Anorganische Chemie I Elektronenespektren A. Mezzetti ragenkatalog X 1. K n [V 6 ] (n muss bestimmt werden) (B) hat µ eff = 2.66 BM. Sein UV-VIS-Spektrum enthält eine sehr schwache Bande (10'000 cm 1 )
Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne
 Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne Kennzeichen einer lebenden Zelle Zellen entstehen aus Zellen jede Zelle hat einen kompletten Satz Erbanlagen
Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne Kennzeichen einer lebenden Zelle Zellen entstehen aus Zellen jede Zelle hat einen kompletten Satz Erbanlagen
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne
 Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne Kennzeichen einer lebenden Zelle Zellen entstehen aus Zellen jede Zelle hat einen kompletten Satz Erbanlagen
Entstehung der Erde und Lebewesen Entwicklung der Zellforschung Kennzeichen des Lebens Grundbaupläne Kennzeichen einer lebenden Zelle Zellen entstehen aus Zellen jede Zelle hat einen kompletten Satz Erbanlagen
Bernd Tieke. Makromolekulare Chemie. Eine Einführung. Dritte Auflage. 0 0 l-u: U. WlLEY-VCH Verlag GmbH & Co. KGaA
 Bernd Tieke Makromolekulare Chemie Eine Einführung Dritte Auflage 0 0 l-u: U WlLEY-VCH Verlag GmbH & Co. KGaA Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur zweiten Auflage Vorwort zur dritten
Bernd Tieke Makromolekulare Chemie Eine Einführung Dritte Auflage 0 0 l-u: U WlLEY-VCH Verlag GmbH & Co. KGaA Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur zweiten Auflage Vorwort zur dritten
8 Zusammenfassung der Ergebnisse
 Zusammenfassung der Ergebnisse und Ausblick 131 8 Zusammenfassung der Ergebnisse Die vorliegende Arbeit beschreibt die Synthese, Charakterisierung und beschichtungstechnische Anwendung von Übergangsmetall-substituierten
Zusammenfassung der Ergebnisse und Ausblick 131 8 Zusammenfassung der Ergebnisse Die vorliegende Arbeit beschreibt die Synthese, Charakterisierung und beschichtungstechnische Anwendung von Übergangsmetall-substituierten
Diels-Alder-Reaktionen in Theorie und Praxis
 Diels-Alder-Reaktionen in Theorie und Praxis 04.02.2015 Tobias Wiehn Seminar zur Vorlesung OC07 Gliederung Einführung Genauere mechanistische Betrachtungen Grenzorbitaltheorie Katalysierte Diels-Alder-Reaktionen
Diels-Alder-Reaktionen in Theorie und Praxis 04.02.2015 Tobias Wiehn Seminar zur Vorlesung OC07 Gliederung Einführung Genauere mechanistische Betrachtungen Grenzorbitaltheorie Katalysierte Diels-Alder-Reaktionen
Uni Konstanz - Kristallinität als Schlüsselfunktion
 Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/uni-konstanz-kristallinitaetals-schluesselfunktion/ Uni Konstanz - Kristallinität als Schlüsselfunktion Nachwachsende
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/uni-konstanz-kristallinitaetals-schluesselfunktion/ Uni Konstanz - Kristallinität als Schlüsselfunktion Nachwachsende
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 3: Kovalente Bindungen)
 Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
Chemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische Chemie Universität Duisburg Essen (Teil 3: Kovalente Bindungen) (3) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung
4.2 Kovalente Bindung. Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916)
 4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
4.2 Kovalente Bindung Theorie der kovalenten Bindung, Gilbert Newton Lewis (1916) Treten Atome von Nichtmetallen miteinander in Wechselwirkung, kommt es nicht zu einer Übertragung von Elektronen. Nichtmetallatome
Bioadditive für radikalische Polymerisationstechniken
 OC 07 eminarvortrag W 2014/2015 Bioadditive für radikalische Polymerisationstechniken Caroline Wern Bioadditive für radikalische Polymerisationstechniken 1 > Gliederung Freie radikalische Polymerisation
OC 07 eminarvortrag W 2014/2015 Bioadditive für radikalische Polymerisationstechniken Caroline Wern Bioadditive für radikalische Polymerisationstechniken 1 > Gliederung Freie radikalische Polymerisation
Ruthenium-katalysierte Reaktionen eine Schatzkiste der Atomökonomie. B.M. Trost, M.U. Frederiksen, M.T. Rudd, Angew. Chem. 2005, 117,
 uthenium-katalysierte eaktionen eine Schatzkiste der Atomökonomie B.M. Trost, M.U. Frederiksen, M.T. udd, Angew. Chem. 2005, 117, 6788-6825 1 Motivation steigender Bedarf an neuen Chemikalien steigender
uthenium-katalysierte eaktionen eine Schatzkiste der Atomökonomie B.M. Trost, M.U. Frederiksen, M.T. udd, Angew. Chem. 2005, 117, 6788-6825 1 Motivation steigender Bedarf an neuen Chemikalien steigender
O H H 3 C. Methanol. Molekulargewicht Siedepunkt Löslichkeit in Wasser H 3 C-OH. unbegrenzt H 3 C-Cl. 7.4 g/l H 3 C-CH 3 -24/C -88/C
 Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
Enzyme (Teil 1) Aminosäuren, Aufbau, Eigenschaften & Funktion. Mag. Gerald Trutschl
 Enzyme (Teil 1) Aminosäuren, Aufbau, Eigenschaften & Funktion Mag. Gerald Trutschl 1 Inhalt 1. Einführung 2. Aufbau: - Aminosäuren - Peptidbindung - Primärstruktur - Sekundärstruktur - Tertiär- und Quatärstrukturen
Enzyme (Teil 1) Aminosäuren, Aufbau, Eigenschaften & Funktion Mag. Gerald Trutschl 1 Inhalt 1. Einführung 2. Aufbau: - Aminosäuren - Peptidbindung - Primärstruktur - Sekundärstruktur - Tertiär- und Quatärstrukturen
5. Schwingungsspektroskopische Untersuchungen
 5. Schwingungsspektroskopische Untersuchungen Die Cyanid- und Thiocyanatliganden gehören als lineare Moleküle ohne Symmetriezentrum zu der Punktgruppe C v. 117 Für das zweiatomige CN - -Molekül gibt es
5. Schwingungsspektroskopische Untersuchungen Die Cyanid- und Thiocyanatliganden gehören als lineare Moleküle ohne Symmetriezentrum zu der Punktgruppe C v. 117 Für das zweiatomige CN - -Molekül gibt es
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Leseprobe. Georg Abts. Kunststoff-Wissen für Einsteiger ISBN: Weitere Informationen oder Bestellungen unter
 Leseprobe Georg Abts Kunststoff-Wissen für Einsteiger ISBN: 978-3-446-42009-0 Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-42009-0 sowie im Buchhandel. Carl Hanser Verlag,
Leseprobe Georg Abts Kunststoff-Wissen für Einsteiger ISBN: 978-3-446-42009-0 Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-42009-0 sowie im Buchhandel. Carl Hanser Verlag,
2. Teilen Sie die folgenden organischen Substanzen ein. Sind sie hydrophil, lipophil oder amphiphil?
 Übungen zur VL Chemie für Biologen und Humanbiologen 02.12.2011 Lösung Übung 5 Teil 1: Stoffgemische 1. Was bedeutet hydrophil, lipophil, hydrophob und amphiphil? altgriechisch: Hydor = Wasser Lipos =
Übungen zur VL Chemie für Biologen und Humanbiologen 02.12.2011 Lösung Übung 5 Teil 1: Stoffgemische 1. Was bedeutet hydrophil, lipophil, hydrophob und amphiphil? altgriechisch: Hydor = Wasser Lipos =
0.6 Einfache Modelle der chemischen Bindung
 0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
0.6 Einfache Modelle der chemischen Bindung Ionenbindung Ionenbindungen entstehen durch Reaktion von ausgeprägt metallischen Elementen (Alkalimetalle und Erdalkalimetalle mit geringer Ionisierungsenergie)
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Die Bindung in Übergangsmetallkomplexenn. Klassische Koordinationschemie (Alfred Wernersche) Valenzstruktur-Theorie (Valenzbindungsth
 Die Bindung in Übergangsmetallkomplexenn Klassische Koordinationschemie (Alfred Wernersche) Valenzstruktur-Theorie (Valenzbindungsth heorie) Ligandenfeld-Theorie H 3 3+ H 3 H 3 Cr H 3 H 3 H 3 Molekülorbital-Theorie
Die Bindung in Übergangsmetallkomplexenn Klassische Koordinationschemie (Alfred Wernersche) Valenzstruktur-Theorie (Valenzbindungsth heorie) Ligandenfeld-Theorie H 3 3+ H 3 H 3 Cr H 3 H 3 H 3 Molekülorbital-Theorie
Selbstorganisation und Strukturbildung
 04.02.2013 Einleitung Gliederung Das Leben [ist] ein sich selbst organisierendes, dissipatives Nichtgleichgewichtssystem (Harald Lesch) Gliederung 1 2 3 4 Selbstorganisation Begriffsbestimmung Beispiel
04.02.2013 Einleitung Gliederung Das Leben [ist] ein sich selbst organisierendes, dissipatives Nichtgleichgewichtssystem (Harald Lesch) Gliederung 1 2 3 4 Selbstorganisation Begriffsbestimmung Beispiel
Lebewesen enthalten weitaus mehr Molekülarten und beherbergen weitaus mehr chemische Reaktionsarten als die ganze anorganische Welt.
 Lebewesen enthalten weitaus mehr Molekülarten und beherbergen weitaus mehr chemische Reaktionsarten als die ganze anorganische Welt. Die aus Biomolekülen aufgebauten biologischen Strukturen sind äußerst
Lebewesen enthalten weitaus mehr Molekülarten und beherbergen weitaus mehr chemische Reaktionsarten als die ganze anorganische Welt. Die aus Biomolekülen aufgebauten biologischen Strukturen sind äußerst
mit Metall-Metall-Bindungen
 HARALD SCHÄFER Verbindungen der schweren Übergangsmetalle mit Metall-Metall-Bindungen HANS MUSSO über die Struktur organischer Metallkomplexe WESTDEUTSCHER VERLAG KÖLN UND OPLADEN 1 1969 by Westdeutscher
HARALD SCHÄFER Verbindungen der schweren Übergangsmetalle mit Metall-Metall-Bindungen HANS MUSSO über die Struktur organischer Metallkomplexe WESTDEUTSCHER VERLAG KÖLN UND OPLADEN 1 1969 by Westdeutscher
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Kettenreaktionen. Kapitel 2. In diesem Kapitel sollen die folgenden Fragen beantwortet werden:
 Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Kapitel 2 Kettenreaktionen In diesem Kapitel sollen die folgenden Fragen beantwortet werden: Was versteht man unter einer Kettenreaktion? Welches sind die verschiedenen Typen von Reaktionsschritten, die
Versuch VI.2: Komplexchemie des Nickels Auswertung von Lars Müller
 Name: Lars Müller Gruppe: Donati (HCI J196/168) Datum: 15. Jan. 2004 Versuch VI.2: Komplexchemie des ckels Auswertung von Lars Müller Ziel ckel(ii) kann sehr verschiedene Metallkomplexe bilden, die meist
Name: Lars Müller Gruppe: Donati (HCI J196/168) Datum: 15. Jan. 2004 Versuch VI.2: Komplexchemie des ckels Auswertung von Lars Müller Ziel ckel(ii) kann sehr verschiedene Metallkomplexe bilden, die meist
Thermische und photochemische Charakterisierung der Produkte einer Photo-Diels-Alder-Reaktion
 Thermische und photochemische Charakterisierung der Produkte einer Photo-Diels-Alder-Reaktion Von der Fakultät für Naturwissenschaften der Gerhard-Mercator-Universität Gesamthochschule Duisburg zur Erlangung
Thermische und photochemische Charakterisierung der Produkte einer Photo-Diels-Alder-Reaktion Von der Fakultät für Naturwissenschaften der Gerhard-Mercator-Universität Gesamthochschule Duisburg zur Erlangung
Struktur von Komplexverbindungen
 Struktur von Komplexverbindungen 23.2.99 Alexander Slomian Wenn Du sie nicht überzeugen kannst, dann verwirre sie Alexander Slomian Seite 1 29.09.2000 Einleitung Im Dezember 1892 wachte Alfred Werner,
Struktur von Komplexverbindungen 23.2.99 Alexander Slomian Wenn Du sie nicht überzeugen kannst, dann verwirre sie Alexander Slomian Seite 1 29.09.2000 Einleitung Im Dezember 1892 wachte Alfred Werner,
Wirkungsmechanismen regulatorischer Enzyme
 Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Stundenübersicht über das IHF Organische Produkte Werkstoffe und Farbstoffe
 Stundenübersicht über das IHF Organische Produkte Werkstoffe und Farbstoffe Unterrichtsvorhaben I Inhaltlicher Schwerpunkt Organische Verbindungen und Reaktionswege Kontext Vom fossilen Rohstoff zum Anwendungsprodukt
Stundenübersicht über das IHF Organische Produkte Werkstoffe und Farbstoffe Unterrichtsvorhaben I Inhaltlicher Schwerpunkt Organische Verbindungen und Reaktionswege Kontext Vom fossilen Rohstoff zum Anwendungsprodukt
Extraktion/Komplexbildung
 Extraktion/Komplexbildung Inhalte dieser Lerneinheit: Quantitativer Nachweis von Eisen mit o-phenanthrolin Quantitativer Nachweis von Kupfer mit Bichinolin Dabei werden Grundlagen der: Komplexbildung und
Extraktion/Komplexbildung Inhalte dieser Lerneinheit: Quantitativer Nachweis von Eisen mit o-phenanthrolin Quantitativer Nachweis von Kupfer mit Bichinolin Dabei werden Grundlagen der: Komplexbildung und
UAufgabe 12: (evolutiv konservierte Aminosäuren)
 UAufgabe 12: (evolutiv konservierte Aminosäuren) Aufgabenstellung Wählen Sie zur Darstellung evolutiv konservierter Aminosäure-Positionen in "1lla" eine ihnen sinnvoll erscheinende Anfärbung. Exportieren
UAufgabe 12: (evolutiv konservierte Aminosäuren) Aufgabenstellung Wählen Sie zur Darstellung evolutiv konservierter Aminosäure-Positionen in "1lla" eine ihnen sinnvoll erscheinende Anfärbung. Exportieren
Basiskenntnistest - Chemie
 Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
Basiskenntnistest - Chemie 1.) Welche Aussage trifft auf Alkohole zu? a. ) Die funktionelle Gruppe der Alkohole ist die Hydroxygruppe. b. ) Alle Alkohole sind ungiftig. c. ) Mehrwertige Alkohole werden
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Anorganische Chemie II
 Anorganische Chemie II B. Sc. Chemieingenieurwesen 18. Juli 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Anorganische Chemie II B. Sc. Chemieingenieurwesen 18. Juli 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
 Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Wiederholung der letzten Vorlesungsstunde: Ionenbindung, Coulomb-Gesetz, Ionen- (Kristall-)strukturen, NaCl, CsCl, ZnS, Elementarzelle, 7 Kristallsysteme Themen heute: Reaktionsgleichungen, chemische Gleichgewichte
Komplexometrie. Bleiben auch in Lösung als Komplexverbindung erhalten NH 3 + BF 3 [H 3 NBF 3 ] H 3 N BF 3. Fe CN - [Fe(CN) 6 ] 3-
![Komplexometrie. Bleiben auch in Lösung als Komplexverbindung erhalten NH 3 + BF 3 [H 3 NBF 3 ] H 3 N BF 3. Fe CN - [Fe(CN) 6 ] 3- Komplexometrie. Bleiben auch in Lösung als Komplexverbindung erhalten NH 3 + BF 3 [H 3 NBF 3 ] H 3 N BF 3. Fe CN - [Fe(CN) 6 ] 3-](/thumbs/65/52575130.jpg) Komplexometrie Komplexe: Zusammengesetztes Teilchen (Ion oder Molekül) das durch Vereinigung von einfachen, selbständig und unabhängig voneinander existenzfähigen Molekülen oder Ionen entstanden ist H
Komplexometrie Komplexe: Zusammengesetztes Teilchen (Ion oder Molekül) das durch Vereinigung von einfachen, selbständig und unabhängig voneinander existenzfähigen Molekülen oder Ionen entstanden ist H
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
Anorganische Chemie I A. Mezzetti Musterlösung VI
 Anorganische Chemie I O-LCAO A. ezzetti usterlösung VI π-bindungen in quadratisch-planaren Kompleen (a) Schreiben Sie die reduzible Darstellung Γπ für die π-ligandengruppenorbitale auf und bestimmen Sie
Anorganische Chemie I O-LCAO A. ezzetti usterlösung VI π-bindungen in quadratisch-planaren Kompleen (a) Schreiben Sie die reduzible Darstellung Γπ für die π-ligandengruppenorbitale auf und bestimmen Sie
Funktion von Proteinen:
 Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
Zusammenfassung. Summary
 Radikalhaltige Komplexe als funktionelle Modelle für metalloenzymatische Katalyse Radical Complexes as functional models for metalloenzymatic catalysis Chaudhuri, Phalguni; Wieghardt, Karl; Weyhermüller,
Radikalhaltige Komplexe als funktionelle Modelle für metalloenzymatische Katalyse Radical Complexes as functional models for metalloenzymatic catalysis Chaudhuri, Phalguni; Wieghardt, Karl; Weyhermüller,
Chemie für Mediziner. Norbert Sträter
 Chemie für Mediziner Norbert Sträter Verlag Wissenschaftliche Scripten 2012 Inhaltsverzeichnis Allgemeine und Anorganische Chemie... 1 1 Atombau... 1 1.1 Fundamentale Begriffe... 1 1.2 Atome und Elemente...
Chemie für Mediziner Norbert Sträter Verlag Wissenschaftliche Scripten 2012 Inhaltsverzeichnis Allgemeine und Anorganische Chemie... 1 1 Atombau... 1 1.1 Fundamentale Begriffe... 1 1.2 Atome und Elemente...
Welcher Indikator ist für die Titration von Essigsäure (pks =4.76) mit Natronlauge am besten geeignet?
 1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
1. Aufgaben zu Versuchstag 1: Säure-Base-Titration Aufgabe 1.1 Welche der folgenden Aussagen ist falsch? A) Säuren erhöhen durch Abgabe eines Protons an Wasser die H3O + -Konzentration einer Lösung. B)
Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 Carbonylgruppen und eine C=C Doppelbindung.
 rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
Übung: Alkene & Alkohole HS-07
 kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease.
 A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
A 36 Michaelis-Menten-Kinetik: Hydrolyse von Harnstoff Aufgabe: Untersuchung der Kinetik der Zersetzung von Harnstoff durch Urease. Grundlagen: a) Michaelis-Menten-Kinetik Im Bereich der Biochemie spielen
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Blockcopolymere. Hanqiong Hu, Soft Matter 2014,10 Ward A. Lopes and Heinrich M. Jaeger, Nature von J. Slowik 1
 Blockcopolymere Hanqiong Hu, Soft Matter 2014,10 Ward A. Lopes and Heinrich M. Jaeger, Nature 414 08.12.2014 von J. Slowik 1 Gliederung 1.Definition Blockcopolymere (BCP's) 2. Polymerisation von Blockcopolymeren
Blockcopolymere Hanqiong Hu, Soft Matter 2014,10 Ward A. Lopes and Heinrich M. Jaeger, Nature 414 08.12.2014 von J. Slowik 1 Gliederung 1.Definition Blockcopolymere (BCP's) 2. Polymerisation von Blockcopolymeren
Untersuchungen zur heterogen-katalysierten Fries-Umlagerung in der flüssigen Phase
 Untersuchungen zur heterogen-katalysierten Fries-Umlagerung in der flüssigen Phase Von der Fakultät für Mathematik und Naturwissenschaften der zur Erlangung des Grades eines Doktors der Naturwissenschaften
Untersuchungen zur heterogen-katalysierten Fries-Umlagerung in der flüssigen Phase Von der Fakultät für Mathematik und Naturwissenschaften der zur Erlangung des Grades eines Doktors der Naturwissenschaften
1.2 Ziel des Praktikums Experimente / Versuche korrekt durchführen
 Vorwort XI Kapitel 1 Einleitung 1 1.1 Herzlich willkommen im chemischen Praktikum... 1.1 2 1.2 Ziel des Praktikums... 1.2 3 1.3 Experimente... 1.3 4 1.4 Experimente / Versuche korrekt durchführen... 1.4
Vorwort XI Kapitel 1 Einleitung 1 1.1 Herzlich willkommen im chemischen Praktikum... 1.1 2 1.2 Ziel des Praktikums... 1.2 3 1.3 Experimente... 1.3 4 1.4 Experimente / Versuche korrekt durchführen... 1.4
Anorganische Chemie II
 Anorganische Chemie II B. Sc. Chemieingenieurwesen 16. Juli 2015 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Anorganische Chemie II B. Sc. Chemieingenieurwesen 16. Juli 2015 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse. Versehen
Klausuraufgaben Grundpraktikum Testat vom Seite- 1 - Punkte. Bitte eintragen: Bitte ankreuzen: Frage 1
 Klausuraufgaben Grundpraktikum Testat vom 6.6.02 Seite- 1 - Punkte Matrikelnummer: ame: Bitte eintragen: Vorname: Bitte ankreuzen: Fachrichtung: Chemie Biotechnologie Pharmazie Frage 1 Schreiben Sie die
Klausuraufgaben Grundpraktikum Testat vom 6.6.02 Seite- 1 - Punkte Matrikelnummer: ame: Bitte eintragen: Vorname: Bitte ankreuzen: Fachrichtung: Chemie Biotechnologie Pharmazie Frage 1 Schreiben Sie die
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie Das komplette Material finden Sie hier: Download bei School-Scout.de B201 LÖSUNG:
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Biologie Arbeitsblätter mit Lösungen - Biochemie Das komplette Material finden Sie hier: Download bei School-Scout.de B201 LÖSUNG:
Inhaltsverzeichnis. Vorwort. xvii. Kapitel 1 Aufbau der Materie 1. Kapitel 2 Die chemische Bindung 39
 Vorwort xvii Kapitel 1 Aufbau der Materie 1 1.1 MateriebestehtausAtomen... 3 1.2 Elementarteilchen... 3 1.3 AufbaueinesAtoms... 4 1.4 AtommassenundStoffmengen... 5 1.5 Isotope... 7 1.6 Radioaktivität und
Vorwort xvii Kapitel 1 Aufbau der Materie 1 1.1 MateriebestehtausAtomen... 3 1.2 Elementarteilchen... 3 1.3 AufbaueinesAtoms... 4 1.4 AtommassenundStoffmengen... 5 1.5 Isotope... 7 1.6 Radioaktivität und
Thema: Komplexverbindungen, die koordinative Bindung. Koordinationszahl, 18-Elektronen-Schale, ein- mehrzähnige Liganden, EDTA,
 Wiederholung der letzten Vorlesungsstunde: Thema: Komplexverbindungen, die koordinative Bindung Koordinationschemie nach A. Werner, Zentralteilchen, Liganden, Koordinationszahl, 18-Elektronen-Schale, ein-
Wiederholung der letzten Vorlesungsstunde: Thema: Komplexverbindungen, die koordinative Bindung Koordinationschemie nach A. Werner, Zentralteilchen, Liganden, Koordinationszahl, 18-Elektronen-Schale, ein-
Alkylwanderungen. Mechanismus: HCl. HCl. Cl β-pinen. Bornylchlorid. OC4_folie185
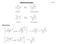 Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
ALDEHYDE & KETONE. Referat über die Carbonylverbindungen: Aldehyde und Ketone Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium
 ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
Anorganische-Chemie. Dr. Stefan Wuttke Butenandstr. 11, Haus E, E
 Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2014/2015 Inhaltliche Schwerpunkte Stöchiometrie
Dr. Stefan Wuttke Butenandstr. 11, Haus E, E 3.039 stefan.wuttke@cup.uni-muenchen.de www.wuttkegroup.de Anorganische-Chemie Grundpraktikum für Biologen 2014/2015 Inhaltliche Schwerpunkte Stöchiometrie
Biologie. Anorganische Chemie. Bioanorganische Chemie
 Eine kleine Einführung in die Bioanorganische Chemie illustriert am Sauerstofftransport Jorge Ferreiro Montag, 8.12.2008 OACP II, ETH Zürich Wie lässt sich die Anorganische Chemie mit der Biologie verbinden,
Eine kleine Einführung in die Bioanorganische Chemie illustriert am Sauerstofftransport Jorge Ferreiro Montag, 8.12.2008 OACP II, ETH Zürich Wie lässt sich die Anorganische Chemie mit der Biologie verbinden,
Exotische organische. Alexander Zech Tobias Setzer. 5. November 2009
 Exotische organische Verbindungen Alexander Zech Tobias Setzer 5. November 2009 Abb1: http://upload.wikimedia.org/wikipedia/en/1/13/catenane_crystal_structure_chemcomm_page634_1991.jpg (Stand: 04.11.2009)
Exotische organische Verbindungen Alexander Zech Tobias Setzer 5. November 2009 Abb1: http://upload.wikimedia.org/wikipedia/en/1/13/catenane_crystal_structure_chemcomm_page634_1991.jpg (Stand: 04.11.2009)
Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff zu Wasser, Energieinhalt,
 Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Wiederholung der letzten Vorlesungsstunde: Das Element Wasserstoff und seine Verbindungen Wasserstoffbrückenbindung, H 2 O, NH 3, HF, Wasserstoff im PSE, Isotope, Vorkommen, exotherme Reaktion mit Sauerstoff
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Oxidation und Reduktion. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse März
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse März
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann
 Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Anorganische Chemie II
 Anorganische Chemie II B. Sc. Chemieingenieurwesen 24. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse.
Anorganische Chemie II B. Sc. Chemieingenieurwesen 24. September 2013 Prof. Dr. T. Jüstel Name: Matrikelnummer: Geburtsdatum: Denken Sie an eine korrekte Angabe des Lösungsweges und der Endergebnisse.
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
Chemie und Physik der Polymeren
 Jan M. G. Cowie Chemie und Physik der Polymeren Eine Einführung Übersetzt von Gabriele Disselhoff Verlag Chemie Weinheim New York 1976 Inhalt 1. Einleitung 1 1.1. Historische Entwicklung 1 1.2. Klassifizierung
Jan M. G. Cowie Chemie und Physik der Polymeren Eine Einführung Übersetzt von Gabriele Disselhoff Verlag Chemie Weinheim New York 1976 Inhalt 1. Einleitung 1 1.1. Historische Entwicklung 1 1.2. Klassifizierung
Katalyse. höhere Reaktionsgeschwindigkeit bei derselben Temperatur! Achtung: Gleichgewicht der chemischen Reaktion wird nicht verschoben
 Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Probeklausur zur Vorlesung Einführung in die Supramolekulare Chemie
 Klausur zur Vorlesung Supramolekulare Chemie WiSe 2017/2018 Probeklausur zur Vorlesung Einführung in die Supramolekulare Chemie ame:... Vorname:... Matrikelnummer:... Semesterzahl:... Bitte beachten Sie:
Klausur zur Vorlesung Supramolekulare Chemie WiSe 2017/2018 Probeklausur zur Vorlesung Einführung in die Supramolekulare Chemie ame:... Vorname:... Matrikelnummer:... Semesterzahl:... Bitte beachten Sie:
