Serum, heparinisiertes Plasma, EDTA-Plasma Probenvolumen 100 µl Kalibrator
|
|
|
- Leopold Eberhardt
- vor 6 Jahren
- Abrufe
Transkript
1 ADVIA Centaur ADVIA Centaur XP Immunoassay Systems Testzusammenfassung Inhalt Probentyp Serum, heparinisiertes Plasma, EDTA-Plasma Probenvolumen 100 µl Kalibrator UL Sensitivität und Messbereich 0, ng/ml (µg/l) REF Inhalt Testanzahl ReadyPack -Testreagenzpackungen mit ADVIA Centaur 500 Binary Lite-Reagenz, Festphase und Zusatzreagenz ADVIA Centaur Basiskurvenkarte 2 Fläschchen mit lyophilisiertem niedrigem Kalibrator UL 2 Fläschchen mit lyophilisiertem hohem Kalibrator UL Barcodeetiketten für die Kalibratoren Kalibrator UL-Sollwertekarte oder ReadyPack -Testreagenzpackung enthält ADVIA Centaur Binary Lite-Reagenz, Festphase und Zusatzreagenz ADVIA Centaur Basiskurvenkarte 1 Fläschchen mit lyophilisiertem niedrigem Kalibrator UL 1 Fläschchen mit lyophilisiertem hohem Kalibrator UL Barcodeetiketten für die Kalibratoren Kalibrator UL-Sollwertekarte Verwendungszweck In-vitro-Diagnostikum für die quantitative Bestimmung von kardialem Troponin I (ctni) in Serum, heparinisiertem oder EDTA-Plasma mit den ADVIA Centaur - und ADVIA Centaur XP-Systemen. Die Bestimmung von kardialem Troponin I hilft bei der Diagnose akuter Myokardinfarkte sowie der Risikostratifizierung von Patienten mit akuten Koronarsyndromen ohne ST- Segment-Erhöhung hinsichtlich der Beurteilung des relativen Mortalitätsrisikos, des Risikos eines Myokardinfarkts (MI) oder der erhöhten Wahrscheinlichkeit ischämischer Ereignisse, die Maßnahmen zur sofortigen Reperfusion erforderlich machen. Erforderliche, aber nicht enthaltene Materialien REF Description Contents ADVIA Centaur Wasch-lösung 1 2 x 1500 ml/pack (112351) or ADVIA Centaur Wasch-lösung 1 * 2 x 2500 ml/pack * zur Verwendung auf Systemen mit einer Kapazität von 2500 ml _DE Rev. K, /
2 ADVIA Centaur- und ADVIA Centaur XP-Systeme Zusätzliche Reagenzien REF Beschreibung Inhalt (117228) ADVIA Centaur Multi-Diluent 11 2 ReadyPack-Zusatzreagenzpackungen mit 5 ml/packung Multi-Diluent ml/fläschchen (111088) Basiskurvenmaterial 5 x 1 ml ADVIA Centaur Nadelwaschlösung 4 1 ReadyPack-Primärreagenzpackung mit 25,0 ml/packung Zusammenfassung und Erläuterung des Tests Troponin ist ein Proteinkomplex, der maßgeblich an der Regulation der Kontraktion der quergestreiften Muskulatur beteiligt ist. Der Troponinkomplex, der in regelmäßigen Abständen entlang des dünnen Filaments angeordnet ist, besteht aus drei Untereinheiten, Troponin I (TnI), Troponin C (TnC) und Troponin T (TnT). Troponin C bindet Kalzium, Troponin T bindet an Tropomyosin über das dünne Filament und Troponin I hemmt abhängig von der Kalziumbesetzung des TnC die Actomyosin-ATPase. 1-3 Troponin I (TnI), ein Inhibitorprotein aus dem Troponin-Tropomyosin-Komplex, existiert in drei unterschiedlichen Isoformen: des Herzmuskels, der langsam-kontrahierenden und der schnell-kontrahierenden Skelettmuskulatur. 4 Jede Isoform wird durch ein definiertes Gen kodiert und besitzt eine unverwechselbare Aminosäuresequenz, wodurch eine klare immunologische Unterscheidung möglich ist. 2-5 Die Isoform von Troponin I der Herzmuskulatur z. B. besitzt einen N-terminalen Rest aus 31 Aminosäuren, der bei den Isoformen der Skelettmuskulatur nicht vorhanden ist. Dieser spezifische Rest erlaubt die Entwicklung spezifischer mono- und polyklonaler Antikörper zur immunologischen Identifizierung. 6 Die hohe kardiale Spezifität dieses Parameters erlaubt die eindeutige Diagnose einer Verletzung des Myokards bei Patienten mit akuten oder chronischen Skelettmuskelschäden. Daher ist dieser Parameter hervorragend zur Diagnose eines akuten Myokardinfarktes (AMI) geeignet. 1,7 ctni der Herzmuskulatur ist für das Myokard hochspezifisch und wird in keiner Phase der Muskelentwicklung in der Skelettmuskulatur exprimiert. 2,7,8 ctni hat ein Molekulargewicht von Dalton. 6 Klinische Studien haben gezeigt, dass ctni im Blut innerhalb von Stunden nach Einsetzen der Symptome eines Myokardinfarktes oder ischämischen Schadens freigesetzt wird. Es lässt sich 3 bis 6 Stunden nach Einsetzen von Brustschmerzen nachweisen, erreicht nach 12 bis 16 Stunden Spitzenkonzentrationen und bleibt noch weitere 5 bis 9 Tage erhöht, 9-11 damit bietet es größere Chancen für die Erkennung eines Myokardinfarkts oder den Ausschluss dieser Diagnose. ctni-ergebnisse sollten stets unter Berücksichtigung der Zeit analysiert werden, die seit Aufnahme des Patienten im Krankenhaus verstrichen ist. Serienmäßige Probenentnahmen werden für die Erkennung von zeitlichem Anstieg und Abfall von Troponin-Konzentrationen, die für Myokardinfarkt charakteristisch sind, empfohlen. 15,21 In Übereinstimmung mit den entsprechenden Publikationen ist das regelmäßige Testen von ctni alle 2 bis 4 Stunden über einen Zeitraum von 12 bis 24 Stunden vorgeschlagen, um ein einzelnes ctni-ergebnis zu bestätigen. Erhöhte Troponin-Werte allein sind für die Diagnose eines Myokardinfarkts nicht ausreichend. Andere Marker wie CK-MB und Myoglobin können zusammen mit den ctni-ergebnissen für die Diagnose von Myokardinfarkt verwendet werden. Ein positives Troponin-Ergebnis weist nicht auf einen Myokardinfarkt hin. Andere Erkrankungen, die zu Myokardzellschäden führen, können zu erhöhten Konzentrationen von kardialem Troponin I führen. Zu diesen Erkrankungen gehören u.a. Myocarditis, Herzchirurgie, Angina pectoris, instabiler Angina pectoris, kongestive Herzinsuffzienz und nicht kardiale Erkrankungen wie Nierenversagen und Lungenembolie. 12,13,14 2 / _DE Rev. K,
3 ADVIA Centaur- und ADVIA Centaur XP-Systeme Definition akuter Myokardinfarkt Zu den Kriterien der Weltgesundheitsorganisation (WHO) für die Definition eines akuten Myokardinfarkts gehört das Vorhandensein von zwei der drei folgenden Elemente: 15 kontinuierlicher Brustschmerz über 20 Minuten hinaus EKG-Abweichungen mit ST-Segmenterhöhung erhöhte Herzmarker Aufgrund der hohen klinischen Spezifizität und Sensitivität von Troponin hat das Joint European Society of Cardiology/American College of Cardiology Committee Troponin als den bevorzugten biochemischen Marker für Myokardschäden anerkannt. 16 Das Komitee schlägt darüber hinaus vor, Myokardnekrose, die durch Ischämie verursacht wird, als Infarkt zu bezeichnen. Personen, bei denen bereits eine schwere, stabile oder instabile Angina pectoris diagnostiziert wurde, werden daher heutzutage unter Umständen mit einem leichten Myokardinfarkt diagnostiziert. Das ESC/ACC Committee empfiehlt darüber hinaus einen Ungenauigkeitswert (Variationskoeffizient oder VK) für Troponin-Tests von 10 % VK des 99. Perzentils des Normalswerts. Basierend auf der Ungenauigkeit und anderen Leistungskriterien, handelt es sich bei dem ADVIA Centaur -Test um eine hochsensitive ctni-methode. Wie bei allen in-vitro diagnostischen Tests sollte jedes Labor seinen eigenen diagnostischen Cut-Off bestimmen, der die Kriterien für eine AMI-Diagnose im jeweiligen Labor wiederspiegelt und repräsentativ für die jeweilige Population ist. 25 Risikostratifizierungsanalyse für akutes Koronarsyndrom Aufgrund der kardialen Spezifität und Sensitivität wurde ctni bisher als verlässlicher Marker für die Evaluierung von Patienten mit instabiler Angina pectoris eingesetzt, ein Krankheitsbild, das erhöhtes Infarktrisiko und die Möglichkeit eines plötzlichen Todes beinhaltet. Patienten mit instabiler Angina pectoris und minimal erhöhten ctni -I-Werten haben allgemein eines höheres Risiko bezüglich der Kurzzeitmortalität. In dem Maße, wie der ctni-spiegel allmählich ansteigt, steigt auch das Mortalitätsrisiko, wahrscheinlich weil auch das Ausmaß der Myokardschäden steigt. 17,18 In einer klinischen Multicenter-Studie, bei der die Wirksamkeit niedermolekularen Heparins für die Behandlung der instabilen Angina pectoris und von Non-Q-Wellen - Myokardinfarkten bewertet werden sollte, wurden Blutproben von 681 Patienten auf ctni mit der ACS:180 ctni-methode untersucht. Die 444 Patienten mit ctni-konzentrationen ab 0,10 ng/ml ( g/l) hatten ein höheres Morbiditäts- und Mortalitätsrisiko als die 237 Patienten mit Konzentrationen unter 0,10 ng/ml ( g/l). 19 ctni-ergebnisse sollten stets in Hinblick auf die Zeit, die vergangen ist, seit der Patient im Krankenhaus aufgenommen wurde, analysiert werden. Serienmäßige Probenentnahmen werden für die Erkennung von zeitlichem Anstieg und Abfall von Troponin-Konzentrationen, die für Myokardinfarkt charakteristische sind, empfohlen. 16,20 In Übereinstimmung mit den entsprechenden Publikationen ist das regelmäßige Testen von ctni alle 2 bis 4 Stunden über einen Zeitraum von 12 bis 24 Stunden vorgeschlagen, um ein einzelnes ctni-ergebnis zu bestätigen. Erhöhte Troponin-Werte allein sind für die Diagnose eines Myokardinfarkts nicht ausreichend. Andere Marker wie CK-MB und Myoglobin können zusammen mit den ctni-ergebnissen für die Diagnose von Myokardinfarkt verwendet werden _DE Rev. K, / 20
4 ADVIA Centaur- und ADVIA Centaur XP-Systeme Testprinzip Bei dem ADVIA Centaur -Test handelt es sich um einen an drei Stellen ansetzenden Sandwich-Immunoassay, der mit direkter Chemilumineszenz arbeitet. Eine Zusatzreagenz reduziert nicht-spezifische Bindungen. Die Binary Lite-Reagenz enthält einen polyklonalen Ziege-Anti-Troponin I-Antikörper, der mit Acridiniumester markiert ist sowie 2 biotinylierte monoklonale Maus-Anti-Troponin I-Antikörper. Bei der Festphasenreagenz handelt es sich um mit Streptavidin konjugierte magnetische Latexpartikel. Alle Reagenzien befinden sich in dem ReadyPack. Die Antikörper in dem Binary Lite-Reagenz binden sich an Troponin I in der Probe. Biotin des Immunkomplexes bindet sich dann an die mit Streptavidin markierten magnetischen Partikel. Das System führt automatisch die folgenden Aktionen durch: dispensiert 100 l Probe in eine Küvette dispensiert 100 l Binary Lite-Reagenz plus 50 l Zusatzreagenz und inkubiert 2,75 Minuten bei 37 C dispensiert 150 l Festphase und inkubiert 5,0 Minuten lang bei 37 C trennt, aspiriert und reinigt die Küvetten mit Waschlösung 1 dispensiert jeweils 300 l Reagenz A und Reagenz B, um die Chemilumineszenz- Reaktion auszulösen druckt die Ergebnisse entsprechend der gewählten Option aus (siehe Erläuterung in der Bedienungsanleitung oder Online-Hilfe). Zwischen der in der Patientenprobe enthaltenen Troponin I-Menge und der Menge der relativen Lichteinheiten (RLU), die vom System erfasst wird, besteht ein direktes Verhältnis. Probenentnahme und -handhabung Für diesen Test werden Serum-, heparinisierte Plasma- und EDTA-Plasmaproben empfohlen. Die Messung heparinisierter und EDTA-Plasmaproben ergab gegenüber Serum um 1 % und 4 % niedrigere Werte. Ein Vergleich der Werte von jeweils zusammengehörigen Serum- und Plasmaproben ergab folgende Passing & Bablok-Gleichungen: Heparinisiertes Plasma-Troponin I = 0,99 (Serum-Troponin I) + 0,03 ng/ml ( g/l), n = 53 EDTA-Troponin I = 0,96 (Serum-Troponin I) + 0,02 ng/ml ( g/l), n = 31 Es wird nicht empfohlen, in diesem Test Serum- oder Plasmaproben eines Patienten gleichzeitig zu analysieren. Für die Bewertung von Serumproben, heparinisierten Plasmaproben und EDTA-Plasmaproben sollten Referenzbereiche ermittelt werden. Folgende Empfehlungen wurden von CLSI (Clinical und Laboratory Standards Institute, früher NCCLS) zur Handhabung und Lagerung von Blutproben ausgegeben: 21 Alle Blutproben sind unter Beachtung der üblichen Vorsichtsmaßnahmen für Venenpunktionen zu entnehmen. Proben vor dem Zentrifugieren ausreichend gerinnen lassen. Röhrchen stets verschlossen und aufrecht aufbewahren. Keine Proben verarbeiten, die länger als 4 Stunden bei Raumtemperatur gelagert wurden. Sollte der Test nicht innerhalb von 4 Stunden abgearbeitet sein, sind die Proben fest zu verschließen und bei 2 C bis 8 C zu kühlen. Proben, die nicht innerhalb von 24 Stunden getestet werden, bei mindestens -20 C einfrieren. Proben nur einmal einfrieren und nach dem Auftauen gut mischen. Tiefgefrorene Proben können bis zu 1 Monat in Tiefkühlschränken ohne Abtauautomatik aufbewahrt werden. Gefrorene Proben müssen vor Analyse bei 2200 xg für 10 Minuten zentrifugiert werden. 4 / _DE Rev. K,
5 ADVIA Centaur- und ADVIA Centaur XP-Systeme Reagenzien Bevor Proben in das System geladen werden, vergewissern Sie sich, dass die Proben über folgende Eigenschaften verfügen: die Proben frei von Fibrin und anderen Partikeln sind. die Proben keine Luftbläschen enthalten. Reagenzien aufrecht stehend bei 2 8 C lagern. Vor dem Laden in das System alle Testreagenzpackungen von Hand durchmischen. Den Boden der Reagenzpackung in Augenschein nehmen, um sicherzustellen, dass alle Partikel dispergiert und resuspendiert sind. Detaillierte Informationen zur Vorbereitung der Reagenzien finden Sie im Systembedienerhandbuch. Reagenzpackung Reagenz Volumen Bestandteile Lagerung Stabilität ADVIA Centaur ReadyPack- Primärreagenzpackung Kalibrator UL Fläschchen ADVIA Centaur 5,0 ml/ Reagenzpackung ReadyPack- Zusatzreagenzpackung ADVIA Centaur Binary Lite- Reagenz Solid Phase Zusatzreagenz Kalibratoren Multi-Diluent 11 5,0 ml/ Reagenzpackung ReadyPack- Testreagenzpackung Nadelwaschlösung 4 10,0 ml/ Reagenzpackung 15,0 ml/ Reagenzpackung 2,0 ml/ Fläschchen 25,0 ml/ Reagenzpackung polyklonaler Ziege-AnticTnI-Antikörper 2 8 C (0,15 µg/ml) mit Acridiniumester markiert, 2 monoklonale Maus- Anti-cTnI-Antikörper mit Biotin markiert (2,0 µg/ml), im Puffer mit Stabilisatoren und Konservierungsstoffen magnetische 2 8 C Latexpartikel im Puffer mit Stabilisatoren und Konservierungsstoffen nicht magnetische Latexpartikel mit Natriumazid gepuffert (< 0,1 %) nach Rekonstitution niedrige oder hohe Konzentrationen an Rinder-cTnI in Ziegenserum mit Konservierungsstoffen und Stabilisatoren 2 8 C 2 8 C 2 8 C -20 C Tris-Puffer und 2 8 C Ziegenserum mit Proteinstabilisatoren und Konservierungsstoffen Bis zum Verfallsdatum auf dem Packungsetikett. Hinsichtlich der Stabilität im System (Onboard Stabilität) siehe Stabilität im System (Onboard Stabilität) und Kalibrationsintervall. Bis zum Verfallsdatum auf dem Packungsetikett. Hinsichtlich der Stabilität im System (Onboard Stabilität) siehe Stabilität im System (Onboard Stabilität) und Kalibrationsintervall. Bis zum Verfallsdatum auf dem Packungsetikett. Hinsichtlich der Stabilität im System (Onboard Stabilität) siehe Stabilität im System (Onboard Stabilität) und Kalibrationsintervall. lyophilisiert: bis zum Verfallsdatum auf dem Fläschchenetikett oder rekonstituiert: 1 Tag oder rekonstituiert - 30 Tage oder im System: 4 Stunden Bis zum Verfallsdatum auf dem Packungsetikett oder bis 28 Tage nach Öffnen der Zusatzreagenzpackung. 0,25 N Natriumhydroxid 2 8 C bis zum Verfallsdatum auf dem Packungsetikett oder Im System - 1 Monat _DE Rev. K, / 20
6 ADVIA Centaur- und ADVIA Centaur XP-Systeme Reagenzpackung Reagenz Volumen Bestandteile Lagerung Stabilität ADVIA Centaur Wasch-lösung ml/ 2 25 C * Packung ADVIA Centaur * * Siehe Erforderliche, aber nicht enthaltene Materialien. Sicherheitsdatenblätter (MSDS/SDS) verfügbar auf VORSICHT: Dieses Produkt enthält Material tierischen Ursprungs und muss als potenziell infektiös behandelt werden. HINWEIS: Natriumazid kann mit Kupfer- und Bleiohren reagieren und explosive Metallazide bilden. Sollte die Entsorgung von Reagenzien über die Kanalisation gemäß den jeweils geltenden gesetzlichen Bestimmungen gestattet sein, spülen Sie die Leitungen mit reichlich Wasser nach, um der Bildung hoher Azidkonzentrationen vorzubeugen. In-vitro-Diagnostikum. Laden von Reagenzien Wasch-lösung ml/ Packung Phosphat-gepufferte Kochsalzlösung mit Natriumazid (< 0,1 %) und Detergenz Phosphat-gepufferte Kochsalzlösung mit Natriumazid (< 0,1 %) und Detergenz Vergewissern Sie sich, dass genügend Primär- und Zusatzreagenzpackungen im System sind. Detaillierte Informationen über die Vorbereitung des Systems finden Sie in der Bedienungsanleitung oder in der Online-Hilfe. Vor dem Laden in das System alle Testreagenzpackungen von Hand durchmischen. Den Boden der Reagenzpackung in Augenschein nehmen, um sicherzustellen, dass alle Partikel dispergiert und resuspendiert sind. Detaillierte Informationen zur Vorbereitung der Reagenzien finden Sie im Systembedienerhandbuch. Beim Laden der ReadyPack-Reagenzpackungen in den Testreagenzienbereich dienen die Pfeile als Ladehilfe. Das System mischt die Testreagenzien automatisch so, dass sie in homogener Suspension bleiben. Detaillierte Informationen zum Laden von Reagenzien finden Sie in der Bedienungsanleitung oder in der Online-Hilfe. Zur automatischen Verdünnung einer Probe stellen Sie ADVIA Centaur Multi-Diluent 11 in den Ladebereich für Hilfsreagenzien. HINWEIS: Die Kalibratoren UL in diesem Kit sind genau auf die Festphase und das Binary Lite- Reagenz abgestimmt. Chargen des Kalibrators UL dürfen nicht mit anderen Chargen für Festphase und Binary Lite-Reagenz verwendet werden. Stabilität im System (Onboard Stabilität) und Kalibrationsintervall Stabilität im System (Onboard Stabilität) Kalibrationsintervall 28 Tage 28 Tage 2 25 C Zusätzlich benötigt der ADVIA Centaur -Test eine 2-Punkt-Kalibration: wenn Testreagenzpackungen einer anderen Charge verwendet werden wenn Teile des Systems ausgewechselt wurden wenn Qualitätskontrollen wiederholt außerhalb des zulässigen Bereichs liegen. Bis zum Verfalldatum auf dem Fläschchen oder 1 Monat im System Bis zum Verfalldatum auf dem Fläschchen oder 1 Monate im System HINWEIS: Nach Ablauf der Stabilität im System (Onboard Stabilität) die Testreagenzpackungen entsorgen. Die Reagenzien dürfen nach Ablauf des Verfallsdatums nicht mehr verwendet werden. 6 / _DE Rev. K,
7 ADVIA Centaur- und ADVIA Centaur XP-Systeme Basiskurvenkalibration Kalibration Der ADVIA Centaur -Test benötigt eine Basiskurvenkalibration, sobald Binary Lite-Reagenz und Solid Phase einer neuen Charge verwendet werden. Verwenden Sie zum Einlesen der Basiskurvenangaben für jede neue Charge Binary Lite-Reagenz und Festphase den Barcodeleser oder die Tastatur. Die Basiskurvenkarte enthält die Basiskurvenangaben. Detaillierte Informationen zur Eingabe von Kalibrationsdaten finden Sie in der Bedienungsanleitung oder in der Online-Hilfe. Zur Kalibration des ADVIA Centaur -Tests verwenden Sie die mit dem Kit gelieferten ADVIA Centaur-Kalibratoren UL. Diese Kalibratoren sind auf die ReadyPack- Primärreagenzpackungen abgestimmt. Verwendung der Kalibrator-Sollwertekarte Jede Reagenzcharge enthält eine Sollwertekarte, um die Eingabe der Kalibrationsdaten in das System zu erleichtern. Geben Sie die Werte über den Barcodeleser oder die Tastatur ein. Detaillierte Informationen zur Eingabe von Kalibrationsdaten finden Sie in der Bedienungsanleitung oder in der Online-Hilfe. Verwendung von Barcodeetiketten HINWEIS: Die Barcodeetiketten für den Kalibrator sind chargenspezifisch. Die Barcodeetiketten einer Kalibratorcharge dürfen nicht für eine andere Charge verwendet werden. Verwenden Sie die Kalibrator UL-Barcodeetiketten zur Kennzeichnung der niedrigen und hohen Kalibrator-Probengefäße, wenn Sie den -Test durchführen. Kleben Sie das Barcodeetikett so auf das Probengefäß, dass die Buchstaben an der Seite des Etiketts senkrecht zum Probengefäß sind. Vorbereitung der Kalibratoren Bereiten Sie die Kalibratoren folgendermaßen vor: 1. Geben Sie mit einer volumetrischen bzw. Präzisionspipette 2,0 ml entionisiertes Wasser 22 in jedes Kalibrator-Fläschchen. 2. Lassen Sie die Kalibratoren 15 bis 20 Minuten lang ungestört bei Raumtemperatur (20 bis 30 C) stehen, damit sich das lyophilisierte Material auflösen kann. Schütteln und invertieren Sie die Fläschchen vorsichtig, bis die Lösung homogen ist. Aliquote Teile der Kalibratorlösung können in dicht schließende Probengefäße gefüllt werden. Die Lösung kann bis zu 30 Tage tiefgefroren aufbewahrt und darf nur einmal aufgetaut werden. Aufgetaute Kalibratoren müssen vorsichtig durchmischt und umgedreht werden, um vollständige Homogenität zu gewährleisten. Anfordern von Kalibratoren Das Kalibrationsintervall für den ADVIA Centaur -Test beträgt 28 Tage. 1. So fordern Sie Kalibratoren in der Arbeitsliste an: a. Wählen Sie den Kalibrator UL für die gewünschten Tests aus. b. Fordern Sie anschließend die Qualitätskontrollen und Patientenproben für die gewünschten Tests an. 2. Kennzeichnen Sie ein Probengefäß mit dem Barcodeetikett für den hochkonzentrierten Kalibrator und das andere Probengefäß mit dem Barcodeetikett für den niedrigkonzentrierten Kalibrator. Da die Kalibrator-Barcodeetiketten chargenspezifisch sind, dürfen nur die Barcodeetiketten der verwendeten Kalibratorcharge benutzt werden _DE Rev. K, / 20
8 ADVIA Centaur- und ADVIA Centaur XP-Systeme 3. Mischen Sie sorgfältig den Kalibrator niedriger und hoher Konzentration. 4. Geben Sie mindestens 1,0 ml des niedrig- und des hochkonzentrierten Kalibrators in die entsprechend etikettierten Probengefäße. Um das Befüllen zu erleichtern, sind die Probengefäße mit einer 1-ml-Einteilung markiert. Das erforderliche Kalibratorvolumen ist abhängig von der Anzahl der mit diesen Kalibratoren zu kalibrierenden Tests und von der Anzahl der damit durchgeführten Wiederholungsbestimmungen. 5. Laden Sie die Kalibrator-Probengefäße in das System. Das Probengefäß mit dem niedrigkonzentrierten Kalibrator muss vor dem Probengefäß mit dem hochkonzentrierten Kalibrator stehen. Stellen Sie sicher, dass die entsprechenden Reagenzien im System geladen sind. 6. Laden Sie die Qualitätskontroll- und die Patientenproben in das System. 7. Starten Sie ggf. das System. Qualitätskontrollen Probenvolumen Richten Sie sich bei der Häufigkeit der Qualitätskontrollen nach behördlichen Vorschriften oder den Zulassungsbestimmungen. Detaillierte Informationen zur Eingabe von Qualitätskontrolldaten finden Sie in der Bedienungsanleitung oder in der Online-Hilfe. Zur Überwachung der Systemleistung und der Kurventrends sollte an jedem Tag, an dem Proben analysiert werden, Qualitätskontrollmaterial in mindestens zwei Konzentrationen getestet werden. Qualitätskontrollproben sollten auch nach jeder 2-Punkt-Kalibration analysiert werden. Das Qualitätskontrollmaterial ist dabei genauso wie Patientenproben zu behandeln. Siemens Healthcare Diagnostics empfiehlt die Verwendung von handelsüblichem Qualitätskontrollmaterial mit mindestens zwei Konzentrationen (niedrig und hoch). Der Systembetrieb gilt dann als zufriedenstellend, wenn die Analytwerte innerhalb des für das System zulässigen Kontrollbereichs oder des für die laborinternen Qualitätskontrollverfahren festgelegten zulässigen Bereichs liegen. Wenn die Ergebnisse der Qualitätskontrolle nicht im empfohlenen Kontrollbereich oder innerhalb der laborinternen Wertebereiche liegen, zeichnen Sie die Ergebnisse nicht auf. Gehen Sie folgendermaßen vor: Überprüfen Sie das Verfallsdatum der verwendeten Materialien. Vergewissern Sie sich, dass die erforderlichen Wartungsarbeiten durchgeführt wurden. Prüfen Sie, ob der Test entsprechend der Anleitung durchgeführt wurde. Wiederholen Sie den Test mit frischen Qualitätskontrollproben. Wenden Sie sich diesbezüglich an den Kundendienst oder Distributor vor Ort, sofern erforderlich. Für eine Einzelbestimmung mit diesem Test sind 100 l Probenvolumen erforderlich. Darin sind weder das Totvolumen im Probengefäß noch das für Replikate oder andere Tests der gleichen Probe benötigte Volumen enthalten. Detaillierte Informationen zur Ermittlung des erforderlichen Mindestvolumens enthält die Bedienungsanleitung und die Online-Hilfe. 8 / _DE Rev. K,
9 ADVIA Centaur- und ADVIA Centaur XP-Systeme Testverfahren HINWEIS: Das für eine Verdünnung im System benötigte Probenvolumen ist nicht das gleiche wie für eine Einfachbestimmung. Nachstehend finden Sie Angaben über das für die Verdünnung im System erforderliche Probenvolumen. Verdünnung Probenvolumen (µl) 1: :5 60 1:10 30 Detaillierte Informationen zum Verfahren finden Sie in der Bedienungsanleitung oder in der Online-Hilfe. Hinweise zum Verfahren Ergebnisberechnung Detaillierte Informationen darüber, wie das System die Ergebnisse ermittelt, finden Sie in der Bedienungsanleitung und in der Online-Hilfe. Das System gibt die Troponin-Serumergebnisse in ng/ml (herkömmlichen Einheiten) oder g/l (SI-Einheiten) an, je nachdem welche Einheiten in den Testdefinitionen angewählt wurden. Die Umrechnungsformel lautet 1,0 ng/ml = 1,0 g/l. Verdünnungen Die folgenden Informationen beziehen sich auf Verdünnungen: Der Testbereich ist 0,006 bis 50 ng/ml ( g/l). Patientenproben mit einer Troponin I- Konzentration von mehr als 50 ng/ml ( g/l) müssen verdünnt und erneut getestet werden, um ein quantitatives Ergebnis zu erhalten. Patientenproben können automatisch vom System verdünnt oder manuell vorbereitet werden. Falls eine automatische Verdünnung erwünscht ist, vergewissern Sie sich, dass ADVIA Centaur Multi-Diluent 11 geladen ist und stellen Sie die Systemparameter wie folgt ein: Verdünnungsgrenze: 50 ng/ml ( g/l) Verdünnungsfaktor: 2, 5, 10 Detaillierte Informationen zur automatischen Verdünnung finden Sie in der Bedienungsanleitung oder der Online-Hilfe. Falls Patientenproben auch nach automatischer Verdünnung den Messbereich übersteigen oder falls ein betreffendes Laborprotokoll eine manuelle Verdünnung vorschreibt, sind die Proben manuell zu verdünnen. Verwenden Sie Multi-Diluent 11 für die manuelle Verdünnung von Patientenproben und stellen Sie danach die verdünnte Patientenprobe als Ersatz für die unverdünnte Probe in das Probenrack. Vergewissern Sie sich, dass bei der Berechnung der Ergebnisse eine Korrektur für die Verdünnung erfolgt. Wenn bei der Festlegung des Tests ein Verdünnungsfaktor eingegeben wird, berechnet das System automatisch das Ergebnis. High-Dose-Hook-Effekt Patientenproben mit hohen Troponin I-Werten können einen unerwarteten Abfall der RLU bewirken (High-Dose-Hook-Effekt). Patientenproben mit Troponin I-Werten bis zu 1000 ng/ml ( g/l) werden in diesem Test als über 50 ng/ml ( g/l) gewertet _DE Rev. K, / 20
10 ADVIA Centaur- und ADVIA Centaur XP-Systeme Entsorgung Einschränkungen Gefährliches oder biologisch kontaminiertes Material ist gemäß der in Ihrer Einrichtung üblichen Praxis zu entsorgen. Entsorgen Sie alle Materialien auf sichere und angemessene Weise unter Einhaltung der jeweils geltenden gesetzlichen Vorschriften. Die folgenden Informationen beziehen sich auf Testeinschränkungen: Die Kalibratoren dürfen nach Gebrauch nicht in die Originalfläschchen zurückgegeben werden, da mögliche Verdunstungen die Konzentration verändern. Kalibratoren, die über 4 Stunden im Probengefäß verbleiben, sind zu verwerfen. Geleerte Kalibrator-Probengefäße nicht wieder auffüllen. Falls erforderlich, frische Kalibratoren verwenden. Wenn Allergie-Screen- oder sige-reagenzien auf dem gleichen ADVIA Centaur-System verwendet werden, wie ADVIA Centaur -Reagenzien, stellen Sie sicher, dass ausreichend Nadelwaschlösung 4 vorhanden ist, um mögliche Interferenzen zu eliminieren. Heterophile Antikörper im menschlichen Serum können mit Immunglobulinen in Reagenzien reagieren und in-vitro-immunoassays beeinträchtigen. 24 Bei Patienten, die häufig mit Tieren oder Serumpräparaten tierischen Ursprungs in Kontakt kommen und deshalb besonders anfällig für diese Störungen sind, kann es zu abnormen Werten kommen. Für eine Diagnose sind deshalb ggf. weitere Informationen erforderlich. Proben von Patienten, die mit monoklonalen Maus-Antikörpern zu Therapie oder Diagnose behandelt werden, können humane Anti-Maus-Antikörper (HAMA) enthalten. Solche Proben können mit dieser Testmethode falsch erhöhte oder falsch niedrige Werte liefern. 24 Folgende endogene Substanzen wurden Humanproben in den angegebenen Konzentrationen zugegeben und auf potenzielle Interferenz im ADVIA Centaur -Test bewertet. Die Ergebnisse zeigen eine 10 % Interferenz durch jede der Substanzen: Folgende Proben... zeigen eine 10 %-ige Veränderung bei Ergebnissen bis zu... hämolytisch 500 mg/dl Hämoglobin lipämisch 1000 mg/dl Triglyceride ikterisch 20 mg/dl konjugiertes Bilirubin 20 mg/dl unkonjugiertes Bilirubin humanes IgG 12 g/dl Protein Biotin 10 ng/ml an Biotin Die Biotin-Konzentration in einer normalen Population beträgt ungefähr 0,3 bis 1,0 ng/ml (1,2 bis 4,3 nmol/l). 25 Bei Verwendung eines Biotin- Präparats kann die Konzentration höher sein, insbesondere bei Dialysepatienten, denen mehrere Vitamindosen verabreicht werden. Bei Proben mit Biotin-Konzentrationen von mehr als 10 ng/ml (41 nmol/l) können die Ergebnisse des Troponin-I-Tests um 10 % erniedrigt sein. Um die klinische Spezifität zu bewerten, wurden zwei Gruppen an Patienten mit chronischem Nierenversagen vor und nach Dialyse untersucht. Von jedem Patienten wurden Einzelproben bewertet. Chronisches Nierenversagen Ergebnisse vor Dialyse Ergebnisse nach Dialyse Anzahl Patienten Bereich: ng/ml ( g/l) < 0,006 0,12 < 0,006 0,354 Median: ng/ml ( g/l) 0,008 0, / _DE Rev. K,
11 ADVIA Centaur- und ADVIA Centaur XP-Systeme Erwartungswerte Die folgenden Medikamente wurden humanen Serumproben in den angegebenen Konzentrationen zugegeben und auf potentielle Interferenz im ADVIA Centaur -Test bewertet. Die Ergebnisse zeigten eine 10 % Interferenz durch jedes der Medikamente. Medikament Medikamentenkonzentration Medikament Medikamentenkonzentration Ampicillin 53 g/ml Theophyllin 40 g/ml Quinidin 12 g/ml Erythromycin 60 g/ml Propanolol 10 ng/ml Acetaminophen 250 ng/ml Captotril 5 g/ml Dicloflenac 50 g/ml Atenolol 10 g/ml Aspirin 600 g/ml Digoxin 200 ng/ml Nitrofurantoin 4 g/ml Allopurinol 400 g/ml Cinnarizin 400 g/ml Verapamil 2 g/ml L-Ascorbinsäure 40 g/ml Oxytetracyclin 15 g/ml Methyl-DOPA 15 g/ml Nifedipin 400 ng/ml Nystatin 6,25 g/ml Eine Studie zum Referenzbereich wurde unter Verwendung des ADVIA Centaur - Tests basierend auf den Richtlinien des Clinical and Laboratory Standards Institute (CLSI) Protocol C28-A2 durchgeführt. 26 Für die ADVIA Centaur-Studie wurden 1845 frische Serumproben, Lithiumheparinproben und EDTA-Plasmaproben von 648 offensichtlich gesunden Personen im Alter von Jahren untersucht und ergaben ein 99. Perzentil von 0,04 ng/ml ( g/l). Der mögliche Ergebnisbereich für das 99. Perzentil reicht von 0,02 bis 0,06 ng/ml ( g/l) für die ADVIA Centaur-Systemfamilie, abhängig von Probentyp, Gerät und Reagenzcharge. Wie bei allen in-vitro diagnostischen Tests sollte jedes Labor seinen eigenen diagnostischen Cut-Off bestimmen, der die Kriterien für eine AMI-Diagnose im jeweiligen Labor wiederspiegelt und repräsentativ für die jeweilige Population ist. 26 Die Präzisionskurve für den ADVIA Centaur -Test zeigt einen gesamten Variationskoeffizienten von 10 % bei einer Konzentration von 0.03 ng/ml ( g/l). Dieser Ungenauigkeitswert zeigt einen VK von 10 % des 99. Perzentil der Referenzpersonen und zeigt somit, dass der -Test der Definition für eine Troponin-Methode mit hoher Sensitivität laut der Empfehlungen von ESC/ACC entspricht. Siehe Präzision. Risikostratifizierung Statistisch signifikanter Anstieg der Mortalität wurde als Funktion ansteigender Konzentrationen von kardialem Troponin I beobachtet. Bei Patienten mit akutem Koronarsyndrom wie instabiler Angina pectoris oder Non-Q-Wellen-Myokardinfarkten stellen kardiale Troponin I-Konzentrationen nützliche prognostische Informationen dar und unterstützen bei der frühen Erkennung von Patienten mit erhöhtem Mortalitätsrisiko. Der Risikostratifizierungs-Cutpoint wurde zuvor mit dem ACS:180 ctni-test mit einer Konzentration von 0,1 ng/ml ( g/l) festgelegt _DE Rev. K, / 20
12 ADVIA Centaur- und ADVIA Centaur XP-Systeme Spezifische Leistungsmerkmale Klinische Bewertung Definition der Weltgesundheitsorganisation für die Diagnose von Myokardinfarkt Unter Verwendung der eingeführten Definition für Myokardinfarkt wie sie von der Weltgesundheitsorganisation beschrieben wird, wurde die Auswertung einer Population mit Patienten von mehreren klinischen Standardorten zuvor mit dem ACS:180 ctni-test durchgeführt. Für 278 Patienten wurde die klinische Sensitivität und Spezifität mit Serumproben gegenüber der klinischen Diagnose bestimmt. Die aus männlichen und weiblichen Patienten zusammengesetzte Population bestand aus 112 Personen mit und 166 Personen ohne AMI. Mindestens zwei der folgenden Befunde lagen für die klinische Diagnose vor: Brustkorbbeschwerden 20 Minuten abnormales EKG erhöhte Herzmarker Die Ergebnisse klinischer Daten wurde basierend auf Receiver Operating Characteristics (ROC) analysiert, wobei die Richtlinien des CLSI-Dokuments GP10-A 27 berücksichtigt wurden. Ein diagnostischer Cut-off von 0,9 ng/ml ( g/l) wurde für den ACS:180 ctni-test bestimmt. Die ROC-Analyse für den ACS:180-Test wird in folgender Abbildung dargestellt. Sensitivität (echte positive Werte) 1 - Spezifizität (falsche positive Werte) In der folgenden Tabelle sind die ACS:180-Ergebnisse für Sensitivität und Spezifität zusammengefasst. Methode % Sensitivität % Spezifität ACS:180 ctni 97,3 97,0 Anz. d. Patienten (n) % Konfidenzintervall (KI) 92,4 99,4 93,1 99,0 12 / _DE Rev. K,
13 ADVIA Centaur- und ADVIA Centaur XP-Systeme Die Übereinstimmung zwischen dem ACS:180 ctni-test und dem ADVIA Centaur TnI- Ultra-Test wird unter Methodenvergleich angegeben. Unter Verwendung der Beziehung zwischen den zwei Tests beträgt der von WHO defineirte Cut-off für die ADVIA Centaur TnI- Ultra-Methode 0,78 ng/ml ( g/l). Die genannten Werte für Cut-off, Sensitivität/Spezifität dienen nur als Richtwerte für die Bestimmung des geeigneten Cut-off-Werts für Ihr Labor. Da der Cut-off-Wert Einfluss auf Sensitivität und Spezifität hat, sollten Labore einen Cut-off basierend auf den Anforderungen an bestimmte Sensitivität und Spezifität auswählen. Der von WHO definierte Cut-off reflektiert eine höhere Stufe an Myokardschäden als die Werte der ESC/ACC-Empfehlung. ESC/ACC-Empfehlung Das gemeinsame Komitee der European Society of Cardiology und American College of Cardiology hat eine Neudefinition für Myokardinfarkt vorgeschlagen. Das Komitee schlägt im Rahmen der Neudefinition vor, dass erhöhte Troponin-Konzentrationen zu Messung geeignet sind, wenn sie das 99. Perzentil des Referenzintervalls überschreiten und dass die akzeptable Ungenauigkeit (VK) für die Messung des 99. Perzentil 10 % beträgt. Das gesamte 99. Perzentil für den ADVIA Centaur -Test beträgt 0,04 ng/ml ( g/l). Der mögliche Ergebnisbereich für das 99. Perzentil reicht von 0,02 bis 0,06 ng/ml ( g/l) für die ADVIA Centaur-Systemfamilie, abhängig von Probentyp, Gerät und Reagenzcharge. Dies wurde mit 1845 frischen Proben von 648 offensichtlich gesunden Personen ermittelt. Spezifität Der ADVIA Centaur -Test zeigt hohe Spezifität für ctni. Die folgenden Substanzen wurden in den angegebenen Konzentrationen Proben mit bekannten ctni-konzentrationen zugegeben. Die Messergebnisse der ADVIA Centaur -Tests mit diesen Proben wurden mit den Testergebnissen unbehandelter Kontrollproben verglichen. Die prozentuale Kreuzreaktivität wird berechnet nach der Formel: % Kreuzreaktivität = (Konzentration der behandelten Probe - Konzentration der unbehandelten Probe) x 100 Konzentration der Substanz Kreuzreagierende Substanz Zugabemenge (ng/ml) (µg/l) % Kreuzreaktivität Kardial-Troponin T 1000 NN Skelettal-Troponin I 1000 < 0,007 Tropomyosin 1000 NN Actin 1000 < 0,005 Troponin C 1000 < 0,005 Myosin Light Chain 1000 NN Myoglobin 1000 NN CK-MB 1000 NN * NN = nicht nachweisbar. Interferenztests wurden nach CLSI Document EP7-A2 durchgeführt. 28 Untere Nachweisgrenze und Testbereich Der ADVIA Centaur -Test misst Troponin I-Konzentrationen von bis zu 50 ng/ml ( g/l), wobei die untere Nachweisgrenze (analytische Sensitivität) bei 0,006 ng/ml ( g/l) liegt. Die analytische Sensitivität ist definiert als die Troponin I-Konzentration, die den relativen Lichteinheiten (RLU) entsprichen, die zwei Standardabweichungen größer sind als die mittleren RLUs von 20 wiederholten Bestimmungen des -Nullstandards. Funktionelle Sensitivität Die funktionelle Sensitivität ist als niedrigste ctni-konzentration definiert, die als Koeffizient der Variation von 20 % bestimmt wird. Die funktionale Sensitivität für den ADVIA Centaur -Test wurde mit ng/ml ( g/l) bestimmt. Das vollständige % VK-Profil im Messbereich von bis ng/ml ( g/l) wird unter Präzision aufgeführt _DE Rev. K, / 20
14 ADVIA Centaur- und ADVIA Centaur XP-Systeme Vergleich der Methoden Das Verhältnis zwischen dem ADVIA Centaur -Test, ACS:180 ctni-test, ADVIA Centaur ctni-test und dem Beckman Coulter Access AccuTnI-Test wird mit Hilfe der Passing & Bablok-Statistiken für den Vergleich der Methoden beschrieben: ADVIA Centaur = 0,87 (ACS:180 ctni) - 0,02 ng/ml ( g/l), r = 0,97; 334 Serumproben von 0,1 bis 30,9 ng/ml ( g/l) ADVIA Centaur = 0,94 (ADVIA Centaur ctni) + 0,01 ng/ml ( g/l), r = 0.98; 1039 Lithiumheparinproben von 0,1 bis 46.0 ng/ml ( g/l) ADVIA Centaur = 1,66 (Access AccuTnI) +0,005 ng/ml ( g/l), r = 0,98; 542 Lithiumheparinproben von 0,0 bis 37,4 ng/ml ( g/l) Wiederfindung nach Verdünnung Zehn Humanserumproben mit ctni-konzentrationen im Bereich von 9,55 bis 45,02 ng/ml ( g/l) ctni wurden 1:2, 1:5, und 1:10: mit Multi-Diluent 11 verdünnt und auf Wiederfindung und Reproduzierbarkeit untersucht. Die Wiederfindung lag zwischen 60 % und 118 % mit einem Mittelwert von 93 %. Probe Verdünnung Gemessen (ng/ml) (µg/l) Erwartungswert (ng/ml) (µg/l) % Wiederfindung 1 9,55 1:2 4,67 4, :5 1,91 1, :10 0,89 0,95 93 Mittelwert ,59 1:2 6,02 6, :5 2,25 2, :10 1,02 1,36 75 Mittelwert ,19 1:2 6,00 6, :5 2,33 2, :10 0,79 1,32 60 Mittelwert ,02 1:2 21,45 22, :5 8,02 9, :10 3,93 4,50 87 Mittelwert ,43 1:2 13,54 13, :5 5,34 5, :10 2,58 2,74 94 Mittelwert ,63 1:2 13,15 13, :5 5,12 5, :10 2,54 2,76 92 Mittelwert ,80 1:2 5,69 6, :5 2,21 2, :10 1,05 1,28 82 Mittelwert / _DE Rev. K,
15 ADVIA Centaur- und ADVIA Centaur XP-Systeme Probe Verdünnung Gemessen (ng/ml) (µg/l) Erwartungswert (ng/ml) (µg/l) % Wiederfindung 8 35,88 1:2 19,40 17, :5 8,27 7, :10 4,24 3, Mittelwert ,80 1:2 14,49 14, :5 5,91 5, :10 3,00 2, Mittelwert ,29 1:2 9,16 9, :5 3,52 3, :10 1,71 1,93 89 Mittelwert 92 Mittelwert 93 Linearität Sechs Humanserumproben im Bereich von 2,05 bis 27,80 ng/ml ( g/l) wurden mit Negativserum verdünnt und auf Wiederfindung und Linearität getestet. Die Wiederfindung reichte von 92,5 % bis 105,5 %. Probe % Probe Gemessen (ng/ml) (µg/l) Erwartungswert (ng/ml) (µg/l) % Wiederfindung , ,67 20,85 99, ,21 13,90 95,0 25 6,43 6,95 92,5 Mittelwert 95, , ,87 3,85 100,5 50 2,53 2,57 98,4 25 1,35 1,28 105,5 Mittelwert 101, , ,37 6,61 96,4 50 4,26 4,40 96,8 25 2,08 2,21 94,1 Mittelwert 95, , ,25 3,37 96,4 50 2,19 2,24 97,8 25 1,09 1,12 97,3 Mittelwert 97, , ,53 1,54 99,3 50 1,05 1,03 101,2 25 0,52 0,51 102,0 Mittelwert 100, , ,71 5,84 97,8 50 3,76 3,89 96,7 25 1,91 1,94 98,5 Mittelwert 97,7 Mittelwert 98, _DE Rev. K, / 20
16 ADVIA Centaur- und ADVIA Centaur XP-Systeme Präzision Sechs Kontrollprodukte wurden 2 mal in 20 Ansätzen über einen Zeitraum von 20 Tagen auf 2 Systemen untersucht. Dabei wurden folgende Ergebnisse ermittelt: Mittelwert (ng/ml) (µg/l) Intra-Assay % VK Gesamt % VK 0,08 5,1 5,3 0,18 3,4 4,1 0,64 2,1 2,9 2,94 1,3 2,7 10,7 1,7 2,9 27,2 1,9 3,0 Zur Untersuchung der niedrigen Präzision wurden Kontrollen und Serumpanels mit niedrigen ctni-konzentrationen dreimal in 20 Ansätzen über einen Zeitraum von 20 Tagen untersucht. Die folgende Darstellung zeigt die mittlere TnI-Konzentration im Vergleich zum Gesamt-VK. Die Ergebnisse ergeben einen Gesamt-VK von 10 % bei 0,03 ng/ml ( g/l). Präzisionskurve Gesamt % VK Mittlere ctni-konzentration ng/ml ( g/l) 16 / _DE Rev. K,
17 ADVIA Centaur- und ADVIA Centaur XP-Systeme Messtechnische Rückführbarkeit Technische Hilfe Der ADVIA Centaur -Test ist an einem internen Standardmaterial kalibriert, das unter Verwendung von hochgereinigtem Material hergestellt wurde. Die Sollwerte für die Kalibratoren sind an diesem Standard kalibriert. Der ADVIA Centaur -Test entspricht NIST SRM Bei technischen Fragen wenden Sie sich bitte an Ihren örtlichen Kundendienst. Literaturnachweise 1. Apple F. Acute myocardial infarction and coronary reperfusion: serum cardiac markers for the 1990s. Am J Clin Pathol 1992;97: Adams J, Bodor G, Davila-Romain V, et al. Cardiac troponin I: A marker for cardiac injury. Circulation 1993;88: Corin S, Juhasz O, Zhul, et al. Structure and expression of the human slow twitch skeletal muscle troponin I gene. J Biol Chem 1994;269: Mair J, Wagner I, Puschendorf B, et al. Cardiac troponin I to diagnose myocardial injury. Lancet 1993;341: Mair J, Larue C, Mair P, et al. Use of cardiac troponin I to diagnose perioperative myocardial infarction in coronary artery bypass grafting. Clin Chem 1994;40: Bodor G, Porter S, Landt Y, et al. Development of monoclonal antibodies for an assay of cardiac troponin I and preliminary results in suspected cases of myocardial infarction. Clin Chem 1992;38: Adams J, Sicard G, Allen B, et al. Diagnosis of perioperative myocardial infarction with measurement of cardiac troponin I. New Engl J Med 1994;330: Adams J, Schechtman K, Landt Y, et al. Comparable detection of acute myocardial infarction by creatine kinase MB isoenzyme and cardiac Troponin I. Clin Chem 1994;40: Cummins B, Auckland ML, Cummins P. Cardiac-specific troponin radioimmunoassay in the diagnosis of acute myocardial infarction. Am Heart J 1987;113: Larue C, Calzolari C, Bertinchant J, et al. Cardiac-specific immunoenzymometric assay of troponin I in the early phase of acute myocardial infarction. Clin Chem 1993;39: Bodor GS, Porter S, Landt Y, et al. Development of monoclonal antibodies for an assay of cardiac troponin I and preliminary results in suspected cases of myocardial infarction. Clin Chem 1992;38: Antman EM, Tanasijevic MJ, Thompson B, et al. Cardiac-specific troponin I levels to predict the risk of mortality in patients with acute coronary syndromes. N Eng J Med. 1996;335: Galvani M, Ottani F, Ferrini D, et al. Prognostic influence of elevated values of cardiac troponin I in patients with unstable angina. Circulation. 1997;95: Jaffe AS. Elevations in cardiac troponin measurements: false false-positives. Cardio Tox. 2001;1: The Joint International Society and Federation of Cardiology/World Health Organization Task Force on Standardization of Clinical Nomenclature. Nomenclature and criteria for diagnosis of ischemic heart disease. Circulation 1979;59: The Joint European Society of Cardiology/American College of Cardiology Committee. Myocardial infarction redefined a concensus document of the Joint European Society of Cardiology/American College of Cardiology committee for the redefinition of myocardial infarction. J Am Coll Cardiol 2000;36: Bertinchant J-P, Larue G, Pernel I, et al. Release kinetics of serum cardiac troponin I in ischemic myocardial injury. Clin Biochem 1996;29: Galvani M, Ottani F, Ferrini D, et al. Prognostic influence of elevated values of cardiac troponin I in patients with unstable angina, Circulation 1997;95: Morrow DA, Rifai N, Tanasijevic MJ, et al. Clinical efficacy of three assays for cardiac troponin I for risk stratification in acute coronary syndromes- a TIMI 11b substudy. Clin Chem 2000;46: Keffer JH. The cardiac profile and proposed practice guideline for acute ischemic heart disease. Am J Clin Pathol 1997;107: Clinical and Laboratory Standards Institute (formerly NCCLS). Procedures for Handling and Processing of Blood Specimens; Approved Guideline - Third Edition. Wayne, PA: Clinical and Laboratory Standards Institute; NCCLS Document H18-A Reagent Water Technical Bulletin. Siemens Healthcare Diagnostics, Boscato LM, Stuart MC. Heterophilic antibodies: a problem for all immunoassays. Clin Chem 1988;34: Schroff RW, Foon KA, Beatty SM, et al. Human anti-murine immunoglobulin responses in patients receiving monoclonal antibody therapy. Clin Chem 1988;34: _DE Rev. K, / 20
18 ADVIA Centaur- und ADVIA Centaur XP-Systeme 25. Williams EJ, Campbell AK. A homogeneous assay for biotin based on chemiluminescence energy transfer. Anal Biochem 1986; 155: Clinical and Laboratory Standards Institute (formerly NCCLS). How to Define, Determine, and Utilize Reference Intervals in the Clinical Laboratory; Approved Guideline - Second Edition. Wayne, PA: Clinical and Laboratory Standards Institute; NCCLS Document C28-A Clinical and Laboratory Standards Institute (formerly NCCLS). Assessment of the Clinical Accuracy of Laboratory Tests Using Receiver Operating Characteristic (ROC) Plots; Approved Guideline. Wayne, PA: Clinical and Laboratory Standards Institute; NCCLS Document GP10-A. 28. Clinical and Laboratory Standards Institute (formerly NCCLS). Interference Testing in Clinical Chemistry; Approved Guideline. Wayne, PA: Clinical and Laboratory Standards Institute; NCCLS document EP7-A2., ADVIA Centaur, ReadyPack und ACS:180 sind Warenzeichen von Siemens Healthcare Diagnostics. Beckman Coulter, Access und AccuTnI sind Warenzeichen von Beckman Coulter, Inc Siemens Healthcare Diagnostics. Alle Rechte vorbehalten. US Pats 5,656,426; 5,609,822; 5,788, / _DE Rev. K,
19 ADVIA Centaur- und ADVIA Centaur XP-Systeme Zeichenerklärung Die folgenden Symbole können auf dem Produktetikett verwendet werden: Symbol Erläuterung Symbol Erläuterung Medizinisches Gerät zur In-vitro-Diagnose Katalog-Nummer Rechtmäßiger Hersteller Autorisierte Vertretung in der Europäischen Union CE-Kennzeichen CE-Kennzeichen Identifikationsnummer der benannten Stelle Bedienungshinweise beachten Biologisches Risiko Nicht einfrieren (> 0 C) Temperaturgrenze (2 8 C) Mindesttemperatur ( 2 C) Obere Temperaturgrenze ( -10 C) Vor Sonneneinstrahlung und Hitze schützen Oben Verwendbar bis Es reicht für (n) tests Chargenbezeichnung Reagenzpack kräftig schütteln. Ausführliche Informationen sind im entsprechenden Abschnitt zum Laden von Reagenzien in den testspezifischen Anweisungen zu ADVIA Centaur enthalten. YYYY-MM-DD Datumsformat (Jahr-Monat-Tag) Rev. Überarbeitung Grüner Punkt Gedruckt mit Sojatinte Recyclen _DE Rev. K, / 20
20 ADVIA Centaur- und ADVIA Centaur XP-Systeme 20 / _DE Rev. K,
Troponin-T T high sensitive. Benjamin Dieplinger
 Troponin-T T high sensitive Benjamin Dieplinger Entwicklung des Troponin-T hs Assays Erhöhung des Probenvolumens von 15 µl auf 50 µl Signalverstärkung durch den Einsatz hochoptimierter Antikörper-Ru Konjugaten
Troponin-T T high sensitive Benjamin Dieplinger Entwicklung des Troponin-T hs Assays Erhöhung des Probenvolumens von 15 µl auf 50 µl Signalverstärkung durch den Einsatz hochoptimierter Antikörper-Ru Konjugaten
ADVIA Centaur- und ADVIA Centaur XP-Testanleitung CEA 1 / 14
 ADVIA Centaur- und ADVIA Centaur XP-Testanleitung CEA 1 / 14 CEA Testzusammenfassung Probentyp Serum Probenvolumen 50 µl Kalibrator D Sensitivität und Meßbereich 0,5 100 ng/ml (µg/l) Inhalt REF Inhalt
ADVIA Centaur- und ADVIA Centaur XP-Testanleitung CEA 1 / 14 CEA Testzusammenfassung Probentyp Serum Probenvolumen 50 µl Kalibrator D Sensitivität und Meßbereich 0,5 100 ng/ml (µg/l) Inhalt REF Inhalt
Weiterführende Informationen zur Progesteron Restandardisierung
 Siemens Healthcare Diagnostics Inc. Kundeninformation 21-4 Weiterführende Informationen zur Restandardisierung Mit diesem Schreiben möchte Siemens Ihnen weiterführende Informationen zur Restandardisierung
Siemens Healthcare Diagnostics Inc. Kundeninformation 21-4 Weiterführende Informationen zur Restandardisierung Mit diesem Schreiben möchte Siemens Ihnen weiterführende Informationen zur Restandardisierung
Creatinin Enzymatisch (CREA_E)
 04054693 Rev. A 2006-10 Creatinin Enzymatisch (CREA_E) System ADVIA 1200 ADVIA 1650/1800 ADVIA 2400 Neue Informationen Erste Version mit kombinierten Methoden Erste Version mit kombinierten Methoden Erste
04054693 Rev. A 2006-10 Creatinin Enzymatisch (CREA_E) System ADVIA 1200 ADVIA 1650/1800 ADVIA 2400 Neue Informationen Erste Version mit kombinierten Methoden Erste Version mit kombinierten Methoden Erste
Troponin T. Wenn jede Minute zählt
 Troponin T Wenn jede Minute zählt Keine Zeit zu verlieren Verdachtsdiagnose akuter Myokardinfarkt Die Überlebenschancen von Herzinfarkt-Patienten sind umso höher, je schneller sie richtig therapiert werden.
Troponin T Wenn jede Minute zählt Keine Zeit zu verlieren Verdachtsdiagnose akuter Myokardinfarkt Die Überlebenschancen von Herzinfarkt-Patienten sind umso höher, je schneller sie richtig therapiert werden.
ADVIA Centaur- und ADVIA Centaur XP-Testanleitung CA 19-9 1 / 12
 ADVIA Centaur- und ADVIA Centaur XP-Testanleitung CA 19-9 1 / 12 CA 19-9 Testzusammenfassung Inhalt Probentyp Serum Probenvolumen 75 µl Kalibrator 9 Sensitivität und Meßbereich 1,2 700 U/ml REF Inhalt
ADVIA Centaur- und ADVIA Centaur XP-Testanleitung CA 19-9 1 / 12 CA 19-9 Testzusammenfassung Inhalt Probentyp Serum Probenvolumen 75 µl Kalibrator 9 Sensitivität und Meßbereich 1,2 700 U/ml REF Inhalt
Cortisol Restandardisierung
 Siemens Healthcare Diagnostics Kundeninformation 2009-12 Restandardisierung Im Rahmen der ständigen Produktverbesserung hat Siemens Healthcare Diagnostics die, XP und CP ( Systeme) Assays restandardisiert
Siemens Healthcare Diagnostics Kundeninformation 2009-12 Restandardisierung Im Rahmen der ständigen Produktverbesserung hat Siemens Healthcare Diagnostics die, XP und CP ( Systeme) Assays restandardisiert
Ein neuer Algorithmus für die Diagnose des Herzinfarktes mit hochsensitivem Troponin. Diagnostik schnell gehört, schnell gewusst
 Ein neuer Algorithmus für die Diagnose des Herzinfarktes mit hochsensitivem Troponin Diagnostik schnell gehört, schnell gewusst Entwicklung des Cut-offs bei Elecsys Troponin T WHO Criteria > 0.1 μg/l cut-off
Ein neuer Algorithmus für die Diagnose des Herzinfarktes mit hochsensitivem Troponin Diagnostik schnell gehört, schnell gewusst Entwicklung des Cut-offs bei Elecsys Troponin T WHO Criteria > 0.1 μg/l cut-off
Kalibrator C Bestellnummern und Chargennummern 19JAN JAN JAN JAN JAN JAN JAN JAN JAN2013
 Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 4, CH-847 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( ) 585 581 66 Telefax +41 () 585 581 151 Mobil E-mail robert.schlatter@siemens.com
Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 4, CH-847 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( ) 585 581 66 Telefax +41 () 585 581 151 Mobil E-mail robert.schlatter@siemens.com
Wichtiger Produkthinweis
 ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Wichtiger Produkthinweis CC 16-02.A.OUS Oktober 2016 CA 19-9 Abweichung zwischen ADVIA Centaur CP und ADVIA Centaur/XP/XPT Laut unseren
ADVIA Centaur ADVIA Centaur XP ADVIA Centaur XPT ADVIA Centaur CP Wichtiger Produkthinweis CC 16-02.A.OUS Oktober 2016 CA 19-9 Abweichung zwischen ADVIA Centaur CP und ADVIA Centaur/XP/XPT Laut unseren
Rev. A, Produktname Myoglobin (MYO)-Reagenz (2 x 100 Tests) REF
 Myoglobin () Aktuelle Version und Datum * Rev. A, 2012-10 Produktname Myoglobin ()-Reagenz (2 x 100 Tests) REF 04862455 Systeme ADVIA 1200 ADVIA 2400 Erforderliche, aber nicht enthaltene Materialien Probentypen
Myoglobin () Aktuelle Version und Datum * Rev. A, 2012-10 Produktname Myoglobin ()-Reagenz (2 x 100 Tests) REF 04862455 Systeme ADVIA 1200 ADVIA 2400 Erforderliche, aber nicht enthaltene Materialien Probentypen
REAGENZIEN UND MATERIALIEN Positivkontrolle (1) Negativkontrolle (1) Verdünnungslösung (1) Packungsbeilage (1)
 Nur zur Verwendung in der In-vitro-Diagnostik VERWENDUNGSZWECK InflammaDry externe Kontrollen sind nur für die Verwendung mit dem InflammaDry Test. Sie dienen der Überprüfung, ob die Testreagenzien funktionieren
Nur zur Verwendung in der In-vitro-Diagnostik VERWENDUNGSZWECK InflammaDry externe Kontrollen sind nur für die Verwendung mit dem InflammaDry Test. Sie dienen der Überprüfung, ob die Testreagenzien funktionieren
Troponin I (hochsensitiv)
 Probenmaterial (BD Vacutainer): Probenmaterial (Sarstedt Monovetten): Präanalytik: Einheit: Transport: Methodik: Erläuterungen ng/ml Chemilumineszenz- LOCI Mindestprobenmenge: 3 ml erhöht: ------- akuter
Probenmaterial (BD Vacutainer): Probenmaterial (Sarstedt Monovetten): Präanalytik: Einheit: Transport: Methodik: Erläuterungen ng/ml Chemilumineszenz- LOCI Mindestprobenmenge: 3 ml erhöht: ------- akuter
Herz-Kreislauf-Erkrankungen
 Herz-Kreislauf-Erkrankungen Diagnose und Beurteilung in der Praxis Roche cobas h 232 Jetzt kostenlos testen Point-of-Care-Analysesysteme im Praxisalltag unerlässlich Bei Verdacht auf Herzinsuffizienz (HI),
Herz-Kreislauf-Erkrankungen Diagnose und Beurteilung in der Praxis Roche cobas h 232 Jetzt kostenlos testen Point-of-Care-Analysesysteme im Praxisalltag unerlässlich Bei Verdacht auf Herzinsuffizienz (HI),
Fall 1: Willkommen in der Notaufnahme!
 Fall 1: Willkommen in der Notaufnahme! 7.10.2012 13:34h 7.10.2012 20:10h 8.10.2012 5:44h CK < 171 U/l 86 1418 1683 631 CK MB 7 25 U/l 244 224 49 CK MB (%) < 6% 17 13 8 Trop T < 14 ng/l 13 4507 3919 9.10.2012
Fall 1: Willkommen in der Notaufnahme! 7.10.2012 13:34h 7.10.2012 20:10h 8.10.2012 5:44h CK < 171 U/l 86 1418 1683 631 CK MB 7 25 U/l 244 224 49 CK MB (%) < 6% 17 13 8 Trop T < 14 ng/l 13 4507 3919 9.10.2012
Healthcare. Sehr geehrte Kundin, sehr geehrter Kunde,
 Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 40, CH-8047 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( 0) 585 581 066 Telefax +41 (0) 585 581 151 Mobil E-mail robert.schlatter@siemens.com
Healthcare Siemens Healthcare Diagnostics AG, Freilagerstrasse 40, CH-8047 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( 0) 585 581 066 Telefax +41 (0) 585 581 151 Mobil E-mail robert.schlatter@siemens.com
EG-Sicherheitsdatenblatt (91/155 EWG)
 Druckdatum: 14.08.2012 Seite 1/5 1. Stoff-/Zubereitungs- und Firmenbezeichnung Angaben zum Produkt Handelsname: Artikelnr: Packungsinhalt: HemosIL AcuStar 98020-12 Verwendungszweck: Automatisierter Chemilumeneszenzimmunoassay
Druckdatum: 14.08.2012 Seite 1/5 1. Stoff-/Zubereitungs- und Firmenbezeichnung Angaben zum Produkt Handelsname: Artikelnr: Packungsinhalt: HemosIL AcuStar 98020-12 Verwendungszweck: Automatisierter Chemilumeneszenzimmunoassay
Von Microgenics lieferbare Materialien:
 Microgenics Corporation Part of Thermo Fisher Scientific CEDIA Mycophenolsäure Anwendung Ortho Clinical Diagnostics VITROS 5600 Integrated System und VITROS 5,1 FS und 4600 Chemistry Systeme Bestellnummer
Microgenics Corporation Part of Thermo Fisher Scientific CEDIA Mycophenolsäure Anwendung Ortho Clinical Diagnostics VITROS 5600 Integrated System und VITROS 5,1 FS und 4600 Chemistry Systeme Bestellnummer
ARCHITECT CMV Assays. ARCHITECT CMV IgG Avidity Assay Information
 ARCHITECT CMV Assays Assay Information Assay ist ein Chemilumineszenz Mikropartikelimmunoassay (CMIA) zur Bestimmung der Avidität von IgG Antikörpern gegen das Cytomegalievirus in Humanserum und -plasma.
ARCHITECT CMV Assays Assay Information Assay ist ein Chemilumineszenz Mikropartikelimmunoassay (CMIA) zur Bestimmung der Avidität von IgG Antikörpern gegen das Cytomegalievirus in Humanserum und -plasma.
Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen
 Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen 1 Nürnberg, Köln, Hamburg, 2018 Ilka Richert, Bio-Rad Laboratories FAQ s Rili-BÄK Wie sind hinsichtlich der Zuordnung
Reicht positiv und negativ aus? Qualitätskontrolle bei qualitativen Untersuchungen 1 Nürnberg, Köln, Hamburg, 2018 Ilka Richert, Bio-Rad Laboratories FAQ s Rili-BÄK Wie sind hinsichtlich der Zuordnung
QUANTA Chek Celiac Panel
 QUANTA Chek Celiac Panel 708113 Verwendungszweck Die QUANTA Chek TM Celiac Probereihe wird für die Qualitätskontrolle bei IFA und ELISA Autoantikörper verfahren verwendet. Jedes Serum dient sowohl als
QUANTA Chek Celiac Panel 708113 Verwendungszweck Die QUANTA Chek TM Celiac Probereihe wird für die Qualitätskontrolle bei IFA und ELISA Autoantikörper verfahren verwendet. Jedes Serum dient sowohl als
RUNDSCHREIBEN 02/2011
 Institut für Klinische Biochemie und Pathobiochemie Klinische Chemie und Laboratoriumsmedizin Direktor: Prof. Dr. U. Walter Medizinischen Klinik und Poliklinik I Kardiologie Direktor: Prof. Dr. G. Ertl
Institut für Klinische Biochemie und Pathobiochemie Klinische Chemie und Laboratoriumsmedizin Direktor: Prof. Dr. U. Walter Medizinischen Klinik und Poliklinik I Kardiologie Direktor: Prof. Dr. G. Ertl
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Verwendungszweck Die QUANTA Chek TM ANA Probereihe wird für die Qualitätskontrolle bei IFA und ELISA antinukleären Antikörperverfahren verwendet. Jedes Serum dient sowohl als
QUANTA Chek ANA Panel 708111 Verwendungszweck Die QUANTA Chek TM ANA Probereihe wird für die Qualitätskontrolle bei IFA und ELISA antinukleären Antikörperverfahren verwendet. Jedes Serum dient sowohl als
POC ctnt 50. Gefahr erkennen. Sofort handeln.
 Früh testen. Richtig behandeln. Leben retten. POC ctnt 50. Gefahr erkennen. Sofort handeln. Verbesserung der Versorgung durch früheres Erkennen und Behandeln von Patienten mit Verdacht auf AMI und hohem
Früh testen. Richtig behandeln. Leben retten. POC ctnt 50. Gefahr erkennen. Sofort handeln. Verbesserung der Versorgung durch früheres Erkennen und Behandeln von Patienten mit Verdacht auf AMI und hohem
CEDIA MYCOPHENOLSÄURE-ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800
 CEDIA MYCOPHENOLSÄURE-ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF B01460 Der CEDIA Mycophenolsäure-Assay (MPA) ist ein In-vitro-Diagnostikum für die quantitative Bestimmung
CEDIA MYCOPHENOLSÄURE-ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF B01460 Der CEDIA Mycophenolsäure-Assay (MPA) ist ein In-vitro-Diagnostikum für die quantitative Bestimmung
Wichtige Feldkorrekturmassnahme
 Wichtige Feldkorrekturmassnahme 11220075, Rev. A März 2015 ADVIA Klinisch - chemische Analysesysteme Empfohlene Wiederholungsbestimmungen für Lipase Gemäss unserer Dokumentation haben Sie folgendes Produkt
Wichtige Feldkorrekturmassnahme 11220075, Rev. A März 2015 ADVIA Klinisch - chemische Analysesysteme Empfohlene Wiederholungsbestimmungen für Lipase Gemäss unserer Dokumentation haben Sie folgendes Produkt
Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement
 Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement 1 Nürnberg, Köln, Hamburg, 2018 Wolfgang Riedl, Bio-Rad Laboratories Unity Real Time 2.0 & ISO 15189 Anforderungen
Messunsicherheit, Gerätevergleich & Co - einfach umgesetzt mittels QC-Datenmanagement 1 Nürnberg, Köln, Hamburg, 2018 Wolfgang Riedl, Bio-Rad Laboratories Unity Real Time 2.0 & ISO 15189 Anforderungen
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie. Ilka Richert, Bio-Rad Laboratories GmbH
 Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
Wichtige Aspekte der Qualitätskontrolle in der Infektionsserologie Ilka Richert, Bio-Rad Laboratories GmbH Hepatitis B Serokonversion Infektionsserologische Tests Sensitivität Spezifität Richtig pos. Ergebnisse
Benutzerhandbuch Version PathoTrack EDIM ELISA. Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM)
 Benutzerhandbuch Version 2016-05 PathoTrack EDIM ELISA Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM) 2 Inhaltsverzeichnis Auf einen Blick Produktbeschreibung Inhalt des Kits Versand
Benutzerhandbuch Version 2016-05 PathoTrack EDIM ELISA Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM) 2 Inhaltsverzeichnis Auf einen Blick Produktbeschreibung Inhalt des Kits Versand
Erhöhte Ergebnisse bei Patientenproben durch Kreuzreaktivität von DHEA-S bei Progesteron Assays
 , Ludwig-Erhard-Str. 12, 65760 Eschborn Name Abteilung QM Deutschld Telefon +49 800 5 806 910 50 Telefax +49 6196 7713-8899 E-Mail Internet Unser Zeichen Datum 18.01.2017 www.healthcare.siemens.de/ laboratory-diagnostics
, Ludwig-Erhard-Str. 12, 65760 Eschborn Name Abteilung QM Deutschld Telefon +49 800 5 806 910 50 Telefax +49 6196 7713-8899 E-Mail Internet Unser Zeichen Datum 18.01.2017 www.healthcare.siemens.de/ laboratory-diagnostics
Antikörper-Index-Kontrolle Kontrolle zur Bestimmung des Antikörperindex in der Liquordiagnostik
 Antikörper-Index-Kontrolle Kontrolle zur Bestimmung des Antikörperindex in der Liquordiagnostik Bestell-Nr.: Borrelia afzelii+vlse IgG EBV HSV Screen Masern Rubella Virus VZV FSME/TBE IgG EN022L65 IgG
Antikörper-Index-Kontrolle Kontrolle zur Bestimmung des Antikörperindex in der Liquordiagnostik Bestell-Nr.: Borrelia afzelii+vlse IgG EBV HSV Screen Masern Rubella Virus VZV FSME/TBE IgG EN022L65 IgG
Samsung LABGEO IB Troponin I Test
 Samsung LABGEO IB Troponin I Test Erklärung der Symbole CE-Konformitätskennzeichnung Hersteller Katalognummer Samsung LABGEO IB Troponin I Test In-vitro-Diagnostikum VERWENDUNGSZWECK Der Samsung LABGEO
Samsung LABGEO IB Troponin I Test Erklärung der Symbole CE-Konformitätskennzeichnung Hersteller Katalognummer Samsung LABGEO IB Troponin I Test In-vitro-Diagnostikum VERWENDUNGSZWECK Der Samsung LABGEO
Präzision in der Analytik Ein unentbehrlicher Teil der Methodenvalidierung
 Abacus Validation Systems Präzision in der Analytik Ein unentbehrlicher Teil der Methodenvalidierung Joachim Pum, MMed (Univ. Pretoria) 2008 Definition Präzision ist das Maß für die Streuung von Analysenergebnissen
Abacus Validation Systems Präzision in der Analytik Ein unentbehrlicher Teil der Methodenvalidierung Joachim Pum, MMed (Univ. Pretoria) 2008 Definition Präzision ist das Maß für die Streuung von Analysenergebnissen
Kardio-CT im akuten Koronarsyndrom Gegenwart und Zukun. Hamburg Heart View,
 Kardio-CT im akuten Koronarsyndrom Gegenwart und Zukun. Hamburg Heart View, 05.11.2016 Prof. Dr. Gunnar Lund, Klinik und Poliklinik für diagnostische und interventionelle Radiologie, Universitätskrankenhaus
Kardio-CT im akuten Koronarsyndrom Gegenwart und Zukun. Hamburg Heart View, 05.11.2016 Prof. Dr. Gunnar Lund, Klinik und Poliklinik für diagnostische und interventionelle Radiologie, Universitätskrankenhaus
QMS EVEROLIMUS-ANWENDUNG Beckman Coulter AU680 /AU5800
 QMS EVEROLIMUS-ANWENDUNG Beckman Coulter AU680 /AU5800 Beckman Coulter-Reagens REF A53729 Der QMS Everolimus-Assay ist für die quantitative Bestimmung von Everolimus in menschlichem Vollblut mit automatischen
QMS EVEROLIMUS-ANWENDUNG Beckman Coulter AU680 /AU5800 Beckman Coulter-Reagens REF A53729 Der QMS Everolimus-Assay ist für die quantitative Bestimmung von Everolimus in menschlichem Vollblut mit automatischen
Progensa PCA3 Urine Specimen Transport Kit
 Anleitung für Ärzte Progensa PCA3 Urine Specimen Transport Kit Zur in vitro diagnostischen Anwendung. Nur zum US-Export. Anleitung 1. Es kann sich als nützlich erweisen, wenn der Patient eine große Menge
Anleitung für Ärzte Progensa PCA3 Urine Specimen Transport Kit Zur in vitro diagnostischen Anwendung. Nur zum US-Export. Anleitung 1. Es kann sich als nützlich erweisen, wenn der Patient eine große Menge
APACE UPDATE Advantageous Predictors of Acute Coronary Syndrome Evaluation
 APACE UPDATE Advantageous Predictors of Acute Coronary Syndrome Evaluation 22.10.2013 Group of clinical research of Prof. Christian Mueller Universitätsspital Basel Unsere Gruppe Übersicht A. APACE allgemein
APACE UPDATE Advantageous Predictors of Acute Coronary Syndrome Evaluation 22.10.2013 Group of clinical research of Prof. Christian Mueller Universitätsspital Basel Unsere Gruppe Übersicht A. APACE allgemein
Akuter Myokardinfarkt
 Akuter Myokardifarkt PD. Dr med. Christoph Kaiser Kardiologie, USB Wie hoch ist die Mortalität bei akutem Myokardinfarkt von Symptom-Beginn bis zur Spitalentlassung? A) 5% B) 10% C) 15% D) 20% E) 40% Akuter
Akuter Myokardifarkt PD. Dr med. Christoph Kaiser Kardiologie, USB Wie hoch ist die Mortalität bei akutem Myokardinfarkt von Symptom-Beginn bis zur Spitalentlassung? A) 5% B) 10% C) 15% D) 20% E) 40% Akuter
Diagnosereagenz für die quantitative In-vitro-Bestimmung von Gesamt- Creatinkinase (CK) in Serum oder Plasma mittels Kolorimetrie.
 2013/07/30 A93A01321ADE A11A01632 26 ml 6.5 ml Pentra C400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von Gesamt- Creatinkinase (CK) in Serum oder Plasma mittels Kolorimetrie. QUAL-QA-TEMP-0846
2013/07/30 A93A01321ADE A11A01632 26 ml 6.5 ml Pentra C400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von Gesamt- Creatinkinase (CK) in Serum oder Plasma mittels Kolorimetrie. QUAL-QA-TEMP-0846
CEDIA CYCLOSPORINE PLUS (NIEDRIGER BEREICH)- ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800
 CEDIA CYCLOSPORINE PLUS (NIEDRIGER BEREICH)- ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF A31849 Der CEDIA Cyclosporine PLUS-Assay ist für die quantitative In-vitro-Bestimmung
CEDIA CYCLOSPORINE PLUS (NIEDRIGER BEREICH)- ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF A31849 Der CEDIA Cyclosporine PLUS-Assay ist für die quantitative In-vitro-Bestimmung
Leistungsverzeichnis LV_MBGR. Dermatomyositis (hochspezifisch, 15 30%) Idiopathische Myositis 88 12%) Polymyositis Mi-2beta
 Seite 1 von 5 1. Klinische Indikation Analyt: Dermato- und Polymyositis Idiopathische Myositis Anti-Synthetase-Syndrom Überlappungssyndrome Klinische Bedeutung: Antigen: Myositis-Antikörper (Immunoblot)
Seite 1 von 5 1. Klinische Indikation Analyt: Dermato- und Polymyositis Idiopathische Myositis Anti-Synthetase-Syndrom Überlappungssyndrome Klinische Bedeutung: Antigen: Myositis-Antikörper (Immunoblot)
Chlamydia MIF IgG. Leistungsmerkmale. Produktnummer: IF1250G Rev. J. Nicht für den Vertrieb in den USA
 Produktnummer: IF1250G Rev. J Leistungsmerkmale Nicht für den Vertrieb in den USA ERWARTETE WERTE Patienten mit ambulant erworbener Pneumonie Zwei externe Prüfer untersuchten den Focus Chlamydia MIF IgM
Produktnummer: IF1250G Rev. J Leistungsmerkmale Nicht für den Vertrieb in den USA ERWARTETE WERTE Patienten mit ambulant erworbener Pneumonie Zwei externe Prüfer untersuchten den Focus Chlamydia MIF IgM
Willi Fox. Cardiac Marker Combo. Bluttest. Testanleitung (IFU)
 Willi Fox Cardiac Marker Combo Bluttest Testanleitung (IFU) Schnelltest zum Nachweis von Myoglobin, CK-MB und Troponin I im Vollblut, Serum oder Plasma 1. Anwendungsbereich Der Willi Fox Cardiac Marker
Willi Fox Cardiac Marker Combo Bluttest Testanleitung (IFU) Schnelltest zum Nachweis von Myoglobin, CK-MB und Troponin I im Vollblut, Serum oder Plasma 1. Anwendungsbereich Der Willi Fox Cardiac Marker
Leistungsverzeichnis LV_SBGR. Antikörper gegen Systemische Sklerose-assoziierte Antigene (Immunoblot)
 Seite 1 von 5 1. Klinische Indikation Analyt: Antikörper gegen Systemische Sklerose-assoziierte Antigene (Immunoblot) V. a. und Differentialdiagnostik der progressiven Systemsklerose (), begrenzte (limitierte)
Seite 1 von 5 1. Klinische Indikation Analyt: Antikörper gegen Systemische Sklerose-assoziierte Antigene (Immunoblot) V. a. und Differentialdiagnostik der progressiven Systemsklerose (), begrenzte (limitierte)
Diagnosereagenz für die quantitative In-vitro-Bestimmung von Gesamt- Creatinkinase (CK) in Serum oder Plasma mittels Kolorimetrie.
 2016/09/27 A93A00052NDE A11A01632 26 ml 6.5 ml 400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von Gesamt- Creatinkinase (CK) in Serum oder Plasma mittels Kolorimetrie. QUAL-QA-TEMP-0846 Rev.9
2016/09/27 A93A00052NDE A11A01632 26 ml 6.5 ml 400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von Gesamt- Creatinkinase (CK) in Serum oder Plasma mittels Kolorimetrie. QUAL-QA-TEMP-0846 Rev.9
ABX Pentra CK-MB RTU. Diagnosereagenz für die quantitative In-vitro-Bestimmung von CK-MB in Serum mittels Kolorimetrie. Applikationsversion
 2016/09/27 A93A00062PDE A11A01643 1 x 20 ml 1 x 5 ml 400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von CK-MB in Serum mittels Kolorimetrie. QUAL-QA-TEMP-0846 Rev.9 Applikationsversion Serum:
2016/09/27 A93A00062PDE A11A01643 1 x 20 ml 1 x 5 ml 400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von CK-MB in Serum mittels Kolorimetrie. QUAL-QA-TEMP-0846 Rev.9 Applikationsversion Serum:
Cardiac Troponin I / (ctni)
 Cardiac Troponin I / (ctni) Verwendungszweck Der i-stat ctnl-test ist ein In-vitro-Diagnosetest zur quantitativen Messung des kardialen Troponins I (ctnl) in Vollblut- oder Plasmaproben. Messungen des
Cardiac Troponin I / (ctni) Verwendungszweck Der i-stat ctnl-test ist ein In-vitro-Diagnosetest zur quantitativen Messung des kardialen Troponins I (ctnl) in Vollblut- oder Plasmaproben. Messungen des
Dr. Aribert Stief Troponin T high sensitive Einsatz in der klinischen Routine
 Dr. Aribert Stief Troponin T high sensitive Einsatz in der klinischen Routine Akuter Myokard Infarkt (AMI) Zeit ist Leben Jedes Jahr haben mehr als 7 Millionen Menschen einen AMI 1 AMI ist eine lebensbedrohliche
Dr. Aribert Stief Troponin T high sensitive Einsatz in der klinischen Routine Akuter Myokard Infarkt (AMI) Zeit ist Leben Jedes Jahr haben mehr als 7 Millionen Menschen einen AMI 1 AMI ist eine lebensbedrohliche
LD BioScreen. Low Density Biochip Schnelltest-Systeme. Offenes System für Indirekte Immunoassays (Antikörpertitration) LD BioScreen
 LD BioScreen Low Density Biochip Schnelltest-Systeme Offenes System für Indirekte Immunoassays (Antikörpertitration) LD BioScreen Die Alternative zur Mikrotiterplatte Für Assays im Forschungslabor Sie
LD BioScreen Low Density Biochip Schnelltest-Systeme Offenes System für Indirekte Immunoassays (Antikörpertitration) LD BioScreen Die Alternative zur Mikrotiterplatte Für Assays im Forschungslabor Sie
QMS EVEROLIMUS-ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800
 QMS EVEROLIMUS-ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF A53716 (international) Der QMS Everolimus-Assay ist für die quantitative Bestimmung von Everolimus in menschlichem
QMS EVEROLIMUS-ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF A53716 (international) Der QMS Everolimus-Assay ist für die quantitative Bestimmung von Everolimus in menschlichem
Das EliA System. nn Protokolle, QC- und Rohdaten leicht zugänglich nn Optionaler Anschluss an die Laborsoftware nn Detailliertes QC-Management
 CCP Das EliA System Mehr Zeit für s Wesentliche nn Vollständig automatisiert (echter Walk-away-Modus, Übernachtläufe) nn Einfaches Management des Instruments mit maßgefertigter Software nn Barcode-Lesegerät
CCP Das EliA System Mehr Zeit für s Wesentliche nn Vollständig automatisiert (echter Walk-away-Modus, Übernachtläufe) nn Einfaches Management des Instruments mit maßgefertigter Software nn Barcode-Lesegerät
GEBRAUCHSANLEITUNG. Lowry Assay Kit. Kit für die Proteinkonzentrationsbestimmung. (Kat.-Nr )
 GEBRAUCHSANLEITUNG Lowry Assay Kit Kit für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39236) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010
GEBRAUCHSANLEITUNG Lowry Assay Kit Kit für die Proteinkonzentrationsbestimmung (Kat.-Nr. 39236) SERVA Electrophoresis GmbH Carl-Benz-Str. 7 D-69115 Heidelberg Phone +49-6221-138400, Fax +49-6221-1384010
Fehlerquellen bei der Bestimmung und Berechnung des Antikörperindex (AI)
 Quelle: www.fotolia.com Fehlerquellen bei der Bestimmung und Berechnung des Antikörperindex (AI) Q spez Q IgG Q ges Q IgM Quelle: www.horeiber.de AI Q Alb Q Lim 1. Allgemeine Fehlerquellen: Keinen bluthaltigen
Quelle: www.fotolia.com Fehlerquellen bei der Bestimmung und Berechnung des Antikörperindex (AI) Q spez Q IgG Q ges Q IgM Quelle: www.horeiber.de AI Q Alb Q Lim 1. Allgemeine Fehlerquellen: Keinen bluthaltigen
Validierung von NT-proBNP Cut-off-Werten für die Risikostratifizierung von Nicht-Hochrisiko Patienten mit akuter Lungenembolie
 Validierung von NT-proBNP Cut-off-Werten für die Risikostratifizierung von Nicht-Hochrisiko Patienten mit akuter Lungenembolie Dr. Mareike Lankeit et.al, Mainz Erweiterte Zusammenfassung In der Bundesrepublik
Validierung von NT-proBNP Cut-off-Werten für die Risikostratifizierung von Nicht-Hochrisiko Patienten mit akuter Lungenembolie Dr. Mareike Lankeit et.al, Mainz Erweiterte Zusammenfassung In der Bundesrepublik
Milenia QuickLine HIT. Labordiagnostischer HIT Ausschluss einfach und schnell
 Milenia QuickLine HIT Labordiagnostischer HIT Ausschluss einfach und schnell Inhalt Die HIT Diagnostik im Labor Die praktikable Lösung rund um die Uhr Die Durchführung des Milenia QuickLine HIT -Schnelltests
Milenia QuickLine HIT Labordiagnostischer HIT Ausschluss einfach und schnell Inhalt Die HIT Diagnostik im Labor Die praktikable Lösung rund um die Uhr Die Durchführung des Milenia QuickLine HIT -Schnelltests
CEDIA CYCLOSPORINE PLUS (HOHER BEREICH)- ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800
 CEDIA CYCLOSPORINE PLUS (HOHER BEREICH)- ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF A31849 Der CEDIA Cyclosporine PLUS-Assay ist für die quantitative In-vitro-Bestimmung
CEDIA CYCLOSPORINE PLUS (HOHER BEREICH)- ANWENDUNG BECKMAN COULTER AU480 /AU680 /AU5800 Beckman Coulter-Reagens REF A31849 Der CEDIA Cyclosporine PLUS-Assay ist für die quantitative In-vitro-Bestimmung
Aquaporin-4 (AQP4) Ab ELISA
 Arbeitsanleitung Aquaporin-4 (AQP4) Ab ELISA Enzymimmunoassay für die quantitative Bestimmung von AQP4-Autoantikörpern in Serum REF EA111/96 12 x 8 I V D 2 8 C DLD Gesellschaft für Diagnostika und medizinische
Arbeitsanleitung Aquaporin-4 (AQP4) Ab ELISA Enzymimmunoassay für die quantitative Bestimmung von AQP4-Autoantikörpern in Serum REF EA111/96 12 x 8 I V D 2 8 C DLD Gesellschaft für Diagnostika und medizinische
RIDA TUBE Calprotectin
 RIDA TUBE Calprotectin Zubehör für RIDASCREEN Calprotectin Art. No. GZ3016 R-Biopharm AG, An der neuen Bergstraße 17, D-64297 Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax: +49 (0) 61 51 81
RIDA TUBE Calprotectin Zubehör für RIDASCREEN Calprotectin Art. No. GZ3016 R-Biopharm AG, An der neuen Bergstraße 17, D-64297 Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax: +49 (0) 61 51 81
KARTUSCHEN- UND ANALYSEINFORMATIONEN
 KARTUSCHEN- UND ANALYSEINFORMATIONEN i-stat Sensoren sind in einer Vielzahl von Konfigurationen erhältlich. Die Sensoren befinden sich in Kartuschen, die Microfluid-Komponenten und in manchen Fällen Kalibrierlösung
KARTUSCHEN- UND ANALYSEINFORMATIONEN i-stat Sensoren sind in einer Vielzahl von Konfigurationen erhältlich. Die Sensoren befinden sich in Kartuschen, die Microfluid-Komponenten und in manchen Fällen Kalibrierlösung
Von Microgenics lieferbare Materialien:
 Microgenics Corporation Part of Thermo Fisher Scientific CEDIA Cyclosporine PLUS High Range Anwendung Ortho Clinical Diagnostics VITROS 5600 Integrated System und VITROS 5,1 FS und 4600 Chemistry Systeme
Microgenics Corporation Part of Thermo Fisher Scientific CEDIA Cyclosporine PLUS High Range Anwendung Ortho Clinical Diagnostics VITROS 5600 Integrated System und VITROS 5,1 FS und 4600 Chemistry Systeme
Troponin I (ctnl) Rapid Test Rapid Test for the qualitative determination of Cardiac Troponin I (ctni) in human whole blood, serum and plasma
 Product information Information about other products is available at: www.demeditec.com Userś Manual Troponin I (ctnl) Rapid Test Rapid Test for the qualitative determination of Cardiac Troponin I (ctni)
Product information Information about other products is available at: www.demeditec.com Userś Manual Troponin I (ctnl) Rapid Test Rapid Test for the qualitative determination of Cardiac Troponin I (ctni)
Krankheitsbild und Epidemiologie des akuten Koronarsyndroms
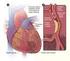 Krankheitsbild und Epidemiologie des akuten Koronarsyndroms Uwe Zeymer Herzzentrum Ludwigshafen Institut für Herzinfarktforschung Ludwigshafen Forum Herz: Versorgung bei Akutem Koronarsyndrom Berlin, 26.11.2015
Krankheitsbild und Epidemiologie des akuten Koronarsyndroms Uwe Zeymer Herzzentrum Ludwigshafen Institut für Herzinfarktforschung Ludwigshafen Forum Herz: Versorgung bei Akutem Koronarsyndrom Berlin, 26.11.2015
Kardiale Biomarker bei Dialysepatienten. PD Dr. med. Ferruh Artunc Sektion Nieren- und Hochdruckkrankheiten Universitätsklinikum Tübingen
 Kardiale Biomarker bei Dialysepatienten PD Dr. med. Ferruh Artunc Sektion Nieren- und Hochdruckkrankheiten Universitätsklinikum Tübingen TED-Frage Bei einem asymptomatischen Hämodialysepatienten findet
Kardiale Biomarker bei Dialysepatienten PD Dr. med. Ferruh Artunc Sektion Nieren- und Hochdruckkrankheiten Universitätsklinikum Tübingen TED-Frage Bei einem asymptomatischen Hämodialysepatienten findet
ADVIA Centaur- und ADVIA Centaur XP-Systeme 1 / 14
 ADVIA Centaur- und ADVIA Centaur XP-Systeme 1 / 14 PSA 0088 Testzusammenfassung Inhalt Probentyp Serum Probenvolumen 35 µl Kalibrator Q Sensitivität und Meßbereich 0,01 100 ng/ml REF Inhalt Testanzahl
ADVIA Centaur- und ADVIA Centaur XP-Systeme 1 / 14 PSA 0088 Testzusammenfassung Inhalt Probentyp Serum Probenvolumen 35 µl Kalibrator Q Sensitivität und Meßbereich 0,01 100 ng/ml REF Inhalt Testanzahl
Siemens Material Number (SMN)
 , Ludwig-Erhard-Str. 12, 65760 Eschborn Name Abteilung QM Deutschland Telefon +49 800 5 806 910 50 Telefax +49 6196 7713-8899 E-Mail Internet Unser Zeichen Datum 24.11.2016 www.healthcare.siemens.de/ laboratory-diagnostics
, Ludwig-Erhard-Str. 12, 65760 Eschborn Name Abteilung QM Deutschland Telefon +49 800 5 806 910 50 Telefax +49 6196 7713-8899 E-Mail Internet Unser Zeichen Datum 24.11.2016 www.healthcare.siemens.de/ laboratory-diagnostics
Akuter Myokardinfarkt. Prof. Christoph Kaiser Kardiologie USB
 Akuter Myokardinfarkt Prof. Christoph Kaiser Kardiologie USB Definition Klinisches Ereignis mit Evidenz für myokardiale Nekrose typische Dynamik von Biomarkern der Myokardnekrose (Troponin) + eines der
Akuter Myokardinfarkt Prof. Christoph Kaiser Kardiologie USB Definition Klinisches Ereignis mit Evidenz für myokardiale Nekrose typische Dynamik von Biomarkern der Myokardnekrose (Troponin) + eines der
unsere Lieferbelege weisen aus, dass Sie von nachfolgenden Produkten erhalten haben: Siemens Material Nummer (SMN)
 Healthcare Siemens Healthcare Diagnostics AG, Freilagerstr. 40, CH-8047 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( 0) 585 581 066 Telefax +41 (0) 585 581 151 Mobil E-mail robert.schlatter@siemens.com
Healthcare Siemens Healthcare Diagnostics AG, Freilagerstr. 40, CH-8047 Zürich Name Abteilung Robert Schlatter RAQS-EHS Telefon +41( 0) 585 581 066 Telefax +41 (0) 585 581 151 Mobil E-mail robert.schlatter@siemens.com
21-Hydroxylase Ab ELISA
 Arbeitsanleitung 21-Hydroxylase Ab ELISA M. Addison, autoimmune polyglanduläre Syndrome Typ I/II Enzymimmunoassay für die quantitative Bestimmung von 21-Hydroxylase-Autoantikörpern in Serum REF EA112/96
Arbeitsanleitung 21-Hydroxylase Ab ELISA M. Addison, autoimmune polyglanduläre Syndrome Typ I/II Enzymimmunoassay für die quantitative Bestimmung von 21-Hydroxylase-Autoantikörpern in Serum REF EA112/96
RIDA Aviditätsreagenz
 RIDA Aviditätsreagenz Art. No.: LB0023 R-Biopharm AG, An der neuen Bergstraße 17, D-64297 Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax: +49 (0) 61 51 81 02-20 1. Allgemeines Für die in vitro
RIDA Aviditätsreagenz Art. No.: LB0023 R-Biopharm AG, An der neuen Bergstraße 17, D-64297 Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax: +49 (0) 61 51 81 02-20 1. Allgemeines Für die in vitro
Das Quidel Triage System
 Das Quidel Triage System Automatisiert. Kalibriert. Verbunden. Professionelle Diagnostik am Behandlungsort BR1026500DE00.qxp_Layout 1 8/29/18 6:23 AM Page 4 Das Quidel Triage System Schnelle quantitative
Das Quidel Triage System Automatisiert. Kalibriert. Verbunden. Professionelle Diagnostik am Behandlungsort BR1026500DE00.qxp_Layout 1 8/29/18 6:23 AM Page 4 Das Quidel Triage System Schnelle quantitative
4. Ergebnisse. Tab. 10:
 4. Ergebnisse 4.1 in vitro-ergebnisse Es war aus sicherheitstechnischen und arbeitsrechtlichen Gründen nicht möglich, die für den Tierversuch hergestellten, radioaktiv markierten PMMA-Nanopartikel auf
4. Ergebnisse 4.1 in vitro-ergebnisse Es war aus sicherheitstechnischen und arbeitsrechtlichen Gründen nicht möglich, die für den Tierversuch hergestellten, radioaktiv markierten PMMA-Nanopartikel auf
AAT. IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. PRINZIP PROBE. REF (150 Tests) -Diagnostikum. Datum.
 IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. Alpha 1 -Antitrypsin REF 447740 (150 Tests) In-vitro-Diagnostikum -Diagnostikum JÄHRLICHE BEURTEILUNG Beurteilt durch: Datum
IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. Alpha 1 -Antitrypsin REF 447740 (150 Tests) In-vitro-Diagnostikum -Diagnostikum JÄHRLICHE BEURTEILUNG Beurteilt durch: Datum
Willi Fox. Troponin I. Bluttest. Testanleitung (IFU) Schnelltest zum Nachweis Troponin I im Vollblut, Serum oder Plasma
 Willi Fox Troponin I Bluttest Testanleitung (IFU) Schnelltest zum Nachweis Troponin I im Vollblut, Serum oder Plasma 1. Anwendungsbereich Der Willi Fox Troponin I Schnelltest ist ein visueller Ein-Stufen-Immunoassay
Willi Fox Troponin I Bluttest Testanleitung (IFU) Schnelltest zum Nachweis Troponin I im Vollblut, Serum oder Plasma 1. Anwendungsbereich Der Willi Fox Troponin I Schnelltest ist ein visueller Ein-Stufen-Immunoassay
Kartuschen- und Analyseinformationen
 Kartuschen- und Analyseinformationen i-stat Sensoren sind in einer Vielzahl von Konfigurationen erhältlich. Die Sensoren befinden sich in Kartuschen, die Microfluid-Komponenten und in manchen Fällen Kalibrierlösung
Kartuschen- und Analyseinformationen i-stat Sensoren sind in einer Vielzahl von Konfigurationen erhältlich. Die Sensoren befinden sich in Kartuschen, die Microfluid-Komponenten und in manchen Fällen Kalibrierlösung
Free PSA (fpsa) Testzusammenfassung. Inhalt. Verwendungszweck. Erforderliche, aber nicht enthaltene Materialien
 ADVIA Centaur ADVIA Centaur XP Immunoassay Systems Free PSA (fpsa) Testzusammenfassung Inhalt Probentyp Serum Probenvolumen 30 µl Kalibrator fpsa Sensitivität und Messbereich 0,01 25,00 ng/ml (µg/l) REF
ADVIA Centaur ADVIA Centaur XP Immunoassay Systems Free PSA (fpsa) Testzusammenfassung Inhalt Probentyp Serum Probenvolumen 30 µl Kalibrator fpsa Sensitivität und Messbereich 0,01 25,00 ng/ml (µg/l) REF
Prävalenz bei ambulanten Patienten mit ambulant erworbener Pneumonie nach Erreger
 Produktnummer: IF1250M Rev. I Leistungsmerkmale Nicht für den Vertrieb in den USA ERWARTETE WERTE Patienten mit ambulant erworbener Pneumonie Zwei externe Prüfer untersuchten den Focus Chlamydia MIF IgM
Produktnummer: IF1250M Rev. I Leistungsmerkmale Nicht für den Vertrieb in den USA ERWARTETE WERTE Patienten mit ambulant erworbener Pneumonie Zwei externe Prüfer untersuchten den Focus Chlamydia MIF IgM
DRINGENDE SICHERHEITSINFORMATION (Urgent Field Safety Notice) für IVD
 Ortho Clinical Diagnostics GmbH Gubelstrasse 34 CH-6300 Zug EINSCHREIBEN Ihr Zeichen/Nachricht Unser Zeichen TC14-030 Telefon +41 (0) 58 231 23 51 Telefax +41 (0) 58 231 25 04 Datum Zug, 30. Januar 2014
Ortho Clinical Diagnostics GmbH Gubelstrasse 34 CH-6300 Zug EINSCHREIBEN Ihr Zeichen/Nachricht Unser Zeichen TC14-030 Telefon +41 (0) 58 231 23 51 Telefax +41 (0) 58 231 25 04 Datum Zug, 30. Januar 2014
Arbeitsanleitung. Calretinin ELISA. Enzymimmunoassay für die quantitative Bestimmung von Calretinin in Plasma und Serum 2 8 C
 Arbeitsanleitung Calretinin ELISA Enzymimmunoassay für die quantitative Bestimmung von Calretinin in Plasma und Serum REF EA611/96 96 2 8 C DLD Gesellschaft für Diagnostika und medizinische Geräte mbh
Arbeitsanleitung Calretinin ELISA Enzymimmunoassay für die quantitative Bestimmung von Calretinin in Plasma und Serum REF EA611/96 96 2 8 C DLD Gesellschaft für Diagnostika und medizinische Geräte mbh
AMH: DIE NÄCHSTE GENERATION
 AMH: DIE NÄCHSTE GENERATION Wie der neue automatisierte ACCESS AMH-ASSAY Ihr Labor nach vorne bringt LAB FORWARD HERAUSFORDERUNGEN Der neue ACCES AMH-ASSAY hilft Ihrem Labor sich nachhaltig im Markt behaupten
AMH: DIE NÄCHSTE GENERATION Wie der neue automatisierte ACCESS AMH-ASSAY Ihr Labor nach vorne bringt LAB FORWARD HERAUSFORDERUNGEN Der neue ACCES AMH-ASSAY hilft Ihrem Labor sich nachhaltig im Markt behaupten
APA. IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. PRINZIP PROBE. REF (300 Tests) -Diagnostikum. Datum.
 IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. Apolipoprotein A-1 REF 446410 (300 Tests) In-vitro-Diagnostikum -Diagnostikum JÄHRLICHE BEURTEILUNG Beurteilt durch: Datum
IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. Apolipoprotein A-1 REF 446410 (300 Tests) In-vitro-Diagnostikum -Diagnostikum JÄHRLICHE BEURTEILUNG Beurteilt durch: Datum
AXpress Schnelltests Bewährte Qualität und Zuverlässigkeit mit internen Kontrollen und Zubehör «on board» AXpress Schnelltests
 AXpress Schnelltests Bewährte Qualität und Zuverlässigkeit mit internen Kontrollen und Zubehör «on board» AXpress Schnelltests Schnell, präzise, preiswert Unsere AXpress Schnelltests bieten Ihnen für viele
AXpress Schnelltests Bewährte Qualität und Zuverlässigkeit mit internen Kontrollen und Zubehör «on board» AXpress Schnelltests Schnell, präzise, preiswert Unsere AXpress Schnelltests bieten Ihnen für viele
ACCESS Immunoassay System. HIV combo QC4 & QC5. Zur Überwachung der Systemleistung des Access HIV combo-assays. B71109A - [DE] /01
![ACCESS Immunoassay System. HIV combo QC4 & QC5. Zur Überwachung der Systemleistung des Access HIV combo-assays. B71109A - [DE] /01 ACCESS Immunoassay System. HIV combo QC4 & QC5. Zur Überwachung der Systemleistung des Access HIV combo-assays. B71109A - [DE] /01](/thumbs/55/36391423.jpg) ACCESS Immunoassay System HIV combo QC4 & QC5 B22822 Zur Überwachung der Systemleistung des Access HIV combo-assays. - [DE] - 2015/01 Inhaltsverzeichnis Access HIV combo QC4 & QC5 1 Verwendungszweck...
ACCESS Immunoassay System HIV combo QC4 & QC5 B22822 Zur Überwachung der Systemleistung des Access HIV combo-assays. - [DE] - 2015/01 Inhaltsverzeichnis Access HIV combo QC4 & QC5 1 Verwendungszweck...
KHK mit Angina pectoris: Ivabradin reduziert kardiale Ereignisse
 Neue Ergebnisse aus der BEAUTIfUL-Studie KHK mit Angina pectoris: Ivabradin reduziert kardiale Ereignisse Barcelona, Spanien, 31. August 2009 Aktuelle Daten einer auf dem Kongress der European Society
Neue Ergebnisse aus der BEAUTIfUL-Studie KHK mit Angina pectoris: Ivabradin reduziert kardiale Ereignisse Barcelona, Spanien, 31. August 2009 Aktuelle Daten einer auf dem Kongress der European Society
Instructions for use. PeliClass human IgG subclass Plus kit PeliClass sheep anti human IgG2 Plus. PeliClass latex sheep anti human IgG4 Plus
 Instructions for use Sanquin Reagents B.V. Plesmanlaan 125 1066 CX Amsterdam The Netherlands PeliClass human IgG subclass Plus kit PeliClass sheep anti human IgG1 Plus PeliClass sheep anti human IgG2 Plus
Instructions for use Sanquin Reagents B.V. Plesmanlaan 125 1066 CX Amsterdam The Netherlands PeliClass human IgG subclass Plus kit PeliClass sheep anti human IgG1 Plus PeliClass sheep anti human IgG2 Plus
Diagnosereagenz für die quantitative In-vitro-Bestimmung von Harnstoff / Blut-Harnstoff-Stickstoff in Serum, Plasma oder Urin mittels Kolorimetrie.
 2014/09/24 A93A00292MDE A11A01641 60 ml 15 ml 400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von Harnstoff / Blut-Harnstoff-Stickstoff in Serum, Plasma oder Urin mittels Kolorimetrie. Applikationsversion
2014/09/24 A93A00292MDE A11A01641 60 ml 15 ml 400 Diagnosereagenz für die quantitative In-vitro-Bestimmung von Harnstoff / Blut-Harnstoff-Stickstoff in Serum, Plasma oder Urin mittels Kolorimetrie. Applikationsversion
Akuter Myokardinfarkt Leitlinien und ihre Umsetzbarkeit im Rettungsdienst
 Akuter Myokardinfarkt Leitlinien und ihre Umsetzbarkeit im Rettungsdienst 23. Leipzig-Probstheidaer Notfalltag Nicolas Majunke Universität Leipzig - Herzzentrum Papyrus Ebers (1600 BC) Triffst du einen
Akuter Myokardinfarkt Leitlinien und ihre Umsetzbarkeit im Rettungsdienst 23. Leipzig-Probstheidaer Notfalltag Nicolas Majunke Universität Leipzig - Herzzentrum Papyrus Ebers (1600 BC) Triffst du einen
Einleitung. I. GENAUIGKEIT Methode
 Genauigkeit und Präzision des Accu-Chek Aviva Systems Einleitung Die Genauigkeit des Systems wurde gemäß der Norm ISO 15197:2003 untersucht. In einer externen Diabetesklinik wurde Diabetikern kapillares
Genauigkeit und Präzision des Accu-Chek Aviva Systems Einleitung Die Genauigkeit des Systems wurde gemäß der Norm ISO 15197:2003 untersucht. In einer externen Diabetesklinik wurde Diabetikern kapillares
Zink Transporter 8 (ZnT8) Ab ELISA
 Arbeitsanleitung Zink Transporter 8 (ZnT8) Ab ELISA Enzymimmunoassay für die quantitative Bestimmung von ZnT8-Autoantikörpern in Serum I V D REF EA102/96 12 x 8 2 8 C DLD Gesellschaft für Diagnostika und
Arbeitsanleitung Zink Transporter 8 (ZnT8) Ab ELISA Enzymimmunoassay für die quantitative Bestimmung von ZnT8-Autoantikörpern in Serum I V D REF EA102/96 12 x 8 2 8 C DLD Gesellschaft für Diagnostika und
SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen
 GEBRAUCHSANLEITUNG SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen (Kat.-Nr. 42177) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg
GEBRAUCHSANLEITUNG SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen (Kat.-Nr. 42177) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg
Borrelien-Serologie. Kriterien analytischer Leistungsfähigkeit am Beispiel kommerziell erhältlicher Testsysteme (ELISA)
 Borrelien-Serologie Kriterien analytischer Leistungsfähigkeit am Beispiel kommerziell erhältlicher Testsysteme (ELISA) Warum dieser Vortrag? Serologie kann entscheidend für Diagnose und Behandlung sein.
Borrelien-Serologie Kriterien analytischer Leistungsfähigkeit am Beispiel kommerziell erhältlicher Testsysteme (ELISA) Warum dieser Vortrag? Serologie kann entscheidend für Diagnose und Behandlung sein.
IGM. IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. PRINZIP PROBE. REF (300 Tests) -Diagnostikum. Datum.
 IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. Immunglobulin M REF 447610 (300 Tests) In-vitro-Diagnostikum -Diagnostikum JÄHRLICHE BEURTEILUNG Beurteilt durch: Datum Beurteilt
IMMAGE -Immunchemiesysteme Methodenblatt Copyright 2013 Beckman Coulter, Inc. Immunglobulin M REF 447610 (300 Tests) In-vitro-Diagnostikum -Diagnostikum JÄHRLICHE BEURTEILUNG Beurteilt durch: Datum Beurteilt
Grundlagen der Labormedizin. Die analytische Phase
 Grundlagen der Labormedizin Die analytische Phase Die analytische Phase im diagnostischen Prozess Begriffe analytischer Qualität - Richtigkeit - Präzision - Genauigkeit Definition der Richtigkeit Die Richtigkeit
Grundlagen der Labormedizin Die analytische Phase Die analytische Phase im diagnostischen Prozess Begriffe analytischer Qualität - Richtigkeit - Präzision - Genauigkeit Definition der Richtigkeit Die Richtigkeit
IME-DC Forschung & Entwicklung Labor Q4/2012 Q2/2013 Fachabteilung Biochemie
 Blutzuckermesssysteme GDHFAD Enzym Testsensoren Interferenzstudie Testbericht IMEDC Forschung & Entwicklung Labor Q4/2012 Q2/2013 Fachabteilung Biochemie Dok. Nr. RD020022 EINLEITUNG Der Zweck dieses Berichts
Blutzuckermesssysteme GDHFAD Enzym Testsensoren Interferenzstudie Testbericht IMEDC Forschung & Entwicklung Labor Q4/2012 Q2/2013 Fachabteilung Biochemie Dok. Nr. RD020022 EINLEITUNG Der Zweck dieses Berichts
Hat die Komplementär-Information einer CT- Koronarangiographie einen prognostischen Zusatznutzen zur Ischämie Diagnostik?
 Hat die Komplementär-Information einer CT- Koronarangiographie einen prognostischen Zusatznutzen zur Ischämie Diagnostik? Mohamed Marwan Medizinische Klinik 2, Universitätsklinikum Erlangen Warum sind
Hat die Komplementär-Information einer CT- Koronarangiographie einen prognostischen Zusatznutzen zur Ischämie Diagnostik? Mohamed Marwan Medizinische Klinik 2, Universitätsklinikum Erlangen Warum sind
Ein neuer Standard für das HIV-Screening
 Ein neuer Standard für das HIV-Screening Entdecken Sie neue Möglichkeiten für die Patientenversorgung Als Point-of-Care-Test der 4. Generation weist Alere HIV Combo gleichzeitig freie HIV-1 p24 Antigene
Ein neuer Standard für das HIV-Screening Entdecken Sie neue Möglichkeiten für die Patientenversorgung Als Point-of-Care-Test der 4. Generation weist Alere HIV Combo gleichzeitig freie HIV-1 p24 Antigene
Thyreoglobulin. Wichtige Werte in der Thyreologie Schilddrüsendialog 2018 Markus Exner
 Gruppenpraxis FachärztInnen für Medizinische und Chemische Labordiagnostik Thyreoglobulin Wichtige Werte in der Thyreologie Schilddrüsendialog 2018 Markus Exner Seefeld in Tirol, 16.3.2018 Was ist Thyreoglobulin?
Gruppenpraxis FachärztInnen für Medizinische und Chemische Labordiagnostik Thyreoglobulin Wichtige Werte in der Thyreologie Schilddrüsendialog 2018 Markus Exner Seefeld in Tirol, 16.3.2018 Was ist Thyreoglobulin?
Leistungsverzeichnis LV_IGF-1
 Seite 1 von 6 1. Klinische Indikation Analyt: Insulin-like growth factor 1 (IGF-1, Somatomedin) - Differentialdiagnostik des Großwuchses bei Kindern - V.a. Akromegalie bei Erwachsenen - Differentialdiagnostik
Seite 1 von 6 1. Klinische Indikation Analyt: Insulin-like growth factor 1 (IGF-1, Somatomedin) - Differentialdiagnostik des Großwuchses bei Kindern - V.a. Akromegalie bei Erwachsenen - Differentialdiagnostik
