Dipl.-Phys. Dr. Horst Weißsieker
|
|
|
- Kevin Heinrich
- vor 7 Jahren
- Abrufe
Transkript
1 1
2 ULG Reinraumtechnik Modul «Reinraumbetrieb» Block 16: Reinraumbetrieb - Grundlagen
3 Eine Übersicht und Einordnung
4 VDI 2083 Reinraumtechnik Status heute Laufende Projekte VDI 2083/9.2 Verbrauchsmaterialien VDI 2083/16.2 Barrieresysteme (Isolatoren und Mini-Environments) - Wirksamkeit und Zertifizierung VDI 2083/19 Dichtheitsprüfung von Reinräumen
5 Visualisierung der Zusammenhänge
6 Die Qualitätsspirale in der RRT
7 Risikomanagement! Immer!
8 Überwachung und Monitoring
9 Verantwortung und systematische Vorgehensweise Siehe auch primär die Checklisten in: - VDI 2083, Blatt 4.1 Planung, Bau und Erstinbetriebnahme - VDI 2083, Blatt 5.1 Betrieb
10 Änderungskontrolle Traceability Qualifizierungszyklus in Anlehnung an Aidé Memoire der ZLG Policies, SOPs Validierungsmasterplan/Qualifizierungsmasterplan GMP-Review FDA Preapproval Yes GO? No Dokumentationsanforderungen GMP-Anforderungen Design-Anforderungen Dokumentenprüfung Sichtprüfung, SAT, FAT Design- Qualifizierung Yes DQ? No Installations- Qualifizierung Bedarfsanalyse / Feasibility Anforderungsprofil Lastenheft Materialanalyse/Lieferantenauswahl Pflichtenheft Bestellung / Vertrag Validierung / Qualifizierung nicht nur für Pharmazie / GMP Kalibrierung Yes IQ? No Risikoanalyse Prüfung kritischer Anlagenfunktionen Operational- Qualifizierung Yes OQ? No Prüfung auf Produktbasis Prüfung verbundener Anlagen Performance- Qualifizierung Betrieb, Wartung, Kalibrierung Reinigungsvalidierung / Prozessvalidierung
11 Life Cycle Cost of Ownership von Anfang an Kostenarten Investitionskosten Betriebskosten Mikroelektronik pharmazeutische Industrie Mikroelektronik pharmazeutische Industrie Gebäude 20 bis bis bis 21 5 bis 7 Infrastruktur 20 bis bis 22 Raumlufttechnik 280 bis bis bis bis 52 Medienversorgung und -entsorgung 180 bis bis bis bis 45 Personal 30 bis bis bis bis 180 Automation 45 bis 60 5 bis bis 20 8 bis 10 Qualifizierung 270 bis bis bis bis 120 Sicherheit 75 bis bis bis bis 33 Umweltschutz 40 bis 55 5 bis bis bis 33 Summe 960 bis bis bis
12 Inhalt und Vorgehensweise VDI 2083 Blatt 11 1 Anwendungsbereich 2 Zugehörige Vorschriften, Normen und Richtlinien 3 Verwendete Begriffe 4 Verantwortung der obersten Leitung 5 Grundsätze zum Qualitätsmanagement 5.1 Der Qualitätskreis 5.2 Struktur des Qualitätsmanagementsystems (QM-Struktur) 5.3 Dokumentation des Qualitätsmanagementsystems 5.4 Auditieren des Qualitätsmanagementsystems 6 Wirtschaftlichkeit - Überlegungen zu qualitätsbezogenen Kosten 6.1 Allgemeines 6.2 Auswahl geeigneter Elemente 6.3 Arten von qualitätsbezogenen Kosten Qualitätskosten 6.4 Sichtbarmachen durch die oberste Leitung 7 Definition der Schnittstellen 7.1 Allgemeines 7.2 Lastenheft/Pflichtenheft (siehe auch VDI/VDE 3694 Checkliste ) 7.3 Vertrauensbildende Maßnahmen
13 8 Qualität bei Auslegung und Design siehe auch VDI 2083, Blatt Allgemeines 8.2 Designplanung und -ziele 8.3 Prüfung und Messung des Produktes/des Prozesses/der Dienstleistung 8.4 Designqualifizierung und Designvalidierung 8.5 Design-Review 8.6 Grundlegendes Design und Freigabe des Designs 8.7 Lenkung von Designänderungen, Wiederholungsqualifizierung 9 Qualität bei der Beschaffung 9.1 Allgemeines 9.2 Forderungen an Spezifikationen, Zeichnungen und Bestellungen 9.3 Auswahl von qualifizierten Lieferanten 9.4 Vereinbarung bezüglich der Darlegung der Qualitätssicherung 9.5 Vereinbarung über Verifizierungsmethoden 9.6 Vorkehrungen zur Beilegung von Differenzen bezüglich der Qualität 9.7 Planung und Überwachung der Eingangsprüfung 9.8 Aufzeichnungen über die Qualität der Lieferanten 10 Qualität im Prozess 10.1 Planung eines beherrschten Prozesses 10.2 Prozessfähigkeit 10.3 Qualitätsprüfungsmethoden 11 Prozesslenkung 11.1 Definition und Zielsetzung Inhalt und QM Fahrplan Teil II
14 12 Prüfungen 12.1 Allgemeines 12.2 Prüfungen in der Beschaffung 12.3 Prüfungen im Prozess 12.4 Prüfungen des (End-)Produktes 13 Prüfmittelüberwachung 13.1 Allgemeines 13.2 Prüfplanung 13.3 Prüfmittelbeschaffung 13.4 Qualifizierung der Prüfmittel, Kalibrierung und Instandhaltung 13.5 Qualifizierung der Durchführung 13.6 Transport, Handhabung und Aufbewahrung von Prüfmitteln 14 Umgang mit Fehlern und fehlerhaften Produkten 14.1 Definitionen 14.2 Verantwortlichkeiten 14.3 Identifikation 14.4 Übergeordnete Verantwortlichkeiten 15 Korrekturmaßnahmen 15.1 Allgemeines 15.2 Analyse, Ursachen und Verantwortlichkeiten 15.3 Korrekturmaßnahmen und Dokumentation Planung und Bau einer Reinraumtechnischen Anlage Betrieb einer Reinraumtechnischen Anlage Inhalt und QM Fahrplan Teil III
15 16 Handhabung und Aufgaben nach dem Prozess 16.1 Lagerung 16.2 Produktkennzeichnung 16.3 Verpackung 16.4 Lieferung 16.5 Transport 16.6 Montage 16.7 Instandhaltung 16.8 Rückmeldungen aus dem Markt 17 Qualitätsdokumentation und Qualitätsaufzeichnungen 17.1 Definition und Zielsetzung 17.2 Art der Qualitätsaufzeichnungen 17.3 Verantwortung und Organisation 18 Personal 18.1 Schulung, Qualifikation und Motivation 19 Produktsicherung und Produkthaftung 20 Statistische Methoden 20.1 Anwendungsmöglichkeiten Inhalt und QM Fahrplan Teil IV
16 Anhang A Umsetzung der DIN EN ISO 9001 in VDI 2083 Anhang B Berechnungsmodell "Cost-of-Ownership" Anhang C Qualitätskostenverhältnisse Anhang D Prozessfähigkeitsindizes Anhang E Qualitätsprüfungsmethoden Anhang F Hinweise zur Prüfmittelüberwachung und Hinweise zur Prüfplanung Anhang G Beispiel für mögliche Darstellung von Qualitätsaufzeichnungen in der Mikroelektronik Anhang H Häufig verwendete statistische Methoden und Verfahren Anhang J Alternative Prüfmethode für nicht direkt messbare Vorgänge Inhalt und QM Fahrplan Teil V
17 Zusammenfassung Prüfung: 1.) Wir bauen uns einen Reinraum für die pharmazeutische Nutzung, Tablettenproduktion, 300 m² Vorgehensweise, Funktionsblöcke, grobe Auslegung Räume, Luft, Grob- Layout, Budgetkosten alternativ 2.) Life Cycle Cost of Ownership einer pharmazeutischen Produktion Kosten der einzelnen Gewerke als Investitions- und Betriebskosten
QUALITATSSICHERUNC. der fiktiven Firma Muster" für die Arzneimittelherstellung. einschl. verwandter Produkte. Dritte Auflage 1998
 QUALITATSSICHERUNC Qualitätssicherungshandbuch der fiktiven Firma Muster" für die Arzneimittelherstellung einschl. verwandter Produkte Dritte Auflage 98 Bundesfachverband der Arzneimittelhersteller e.v.
QUALITATSSICHERUNC Qualitätssicherungshandbuch der fiktiven Firma Muster" für die Arzneimittelherstellung einschl. verwandter Produkte Dritte Auflage 98 Bundesfachverband der Arzneimittelhersteller e.v.
DIN EN (VDE ): EN 62304: A1:2015
 Inhalt Vorwort...2 Europäisches Vorwort zu A1...3 Einleitung...10 1 Anwendungsbereich...14 1.1 *Zweck...14 1.2 *Anwendungsgebiet...14 1.3 Beziehung zu anderen Normen...14 1.4 Einhaltung...14 2 *Normative
Inhalt Vorwort...2 Europäisches Vorwort zu A1...3 Einleitung...10 1 Anwendungsbereich...14 1.1 *Zweck...14 1.2 *Anwendungsgebiet...14 1.3 Beziehung zu anderen Normen...14 1.4 Einhaltung...14 2 *Normative
Eingesetzte Mittel Anlagen, Methoden, Fähigkeiten, Techniken, Geld, Kapital PROZESS. Bündel oder Folge von Aktivitäten
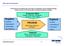 Was ist ein Prozess? Ein Prozess ist ein Bündel oder eine Folge von Aktivitäten, für die Vorgaben benötigt werden und die ein für den Kunden verwertbares Ergebnis erzeugen. Vorgaben Rohstoffe Halbfertigteile
Was ist ein Prozess? Ein Prozess ist ein Bündel oder eine Folge von Aktivitäten, für die Vorgaben benötigt werden und die ein für den Kunden verwertbares Ergebnis erzeugen. Vorgaben Rohstoffe Halbfertigteile
Musterhandbuch Qualitätsmanagementplan
 Musterhandbuch Leseprobe DIN ISO 10005:2009 Konditionen: 14 Tage Rückgaberecht! Kein Abo! ISBN 978-3-942882-25-5 Auflage 1 Grundlagen... 2 Gültigkeit... 2 Ziel und Grund... 2 Abkürzungen... 2 Informationen...
Musterhandbuch Leseprobe DIN ISO 10005:2009 Konditionen: 14 Tage Rückgaberecht! Kein Abo! ISBN 978-3-942882-25-5 Auflage 1 Grundlagen... 2 Gültigkeit... 2 Ziel und Grund... 2 Abkürzungen... 2 Informationen...
ISO 13485:2016. TÜV SÜD Akademie GmbH Rev. <xx > / Stand: EN ISO 13485:2016 1
 ISO 13485:2016 Änderungen / Neue Anforderungen TÜV SÜD Akademie GmbH Rev. / Stand: 07 2016 EN ISO 13485:2016 1 ISO 13485:2016 Änderungen / Neue Anforderungen EN ISO 13485 DIN EN ISO 13485 TÜV SÜD
ISO 13485:2016 Änderungen / Neue Anforderungen TÜV SÜD Akademie GmbH Rev. / Stand: 07 2016 EN ISO 13485:2016 1 ISO 13485:2016 Änderungen / Neue Anforderungen EN ISO 13485 DIN EN ISO 13485 TÜV SÜD
Qualifizierung im Überblick
 Qualifizierung im Überblick Ein Auszug aus Praxisbuch GMP-Anlagenqualifizierung in der Pharmaindustrie von Thomas Peither, Dr. Petra Rempe, Winfried Büßing Grundlegende GMP-Anforderung Die Qualifizierung
Qualifizierung im Überblick Ein Auszug aus Praxisbuch GMP-Anlagenqualifizierung in der Pharmaindustrie von Thomas Peither, Dr. Petra Rempe, Winfried Büßing Grundlegende GMP-Anforderung Die Qualifizierung
Qualitätsmanagement nach QS 9000 und VDA 6.1
 Qualitätsmanagement nach QS 9000 und VDA 6.1 Bearbeitet von Michael Cassel 1. Auflage 1999. Loseblatt. II, 872 S. ISBN 978 3 446 21116 2 Format (B x L): 24,4 x 31 cm Gewicht: 4941 g schnell und portofrei
Qualitätsmanagement nach QS 9000 und VDA 6.1 Bearbeitet von Michael Cassel 1. Auflage 1999. Loseblatt. II, 872 S. ISBN 978 3 446 21116 2 Format (B x L): 24,4 x 31 cm Gewicht: 4941 g schnell und portofrei
Grundlagen des Qualitätsmanagements in der Medizin ( )
 S C I E N C E P A S S I O N T E C H N O L O G Y Grundlagen des Qualitätsmanagements in der Medizin (718.025) Schröttner J. E-Mail: [email protected] Tel.: 873/7395 Institut für Health Care Engineering
S C I E N C E P A S S I O N T E C H N O L O G Y Grundlagen des Qualitätsmanagements in der Medizin (718.025) Schröttner J. E-Mail: [email protected] Tel.: 873/7395 Institut für Health Care Engineering
Gegenüberstellung von DIN EN ISO 9001:2015. und DIN EN ISO 9001:2008
 Gegenüberstellung von DIN EN ISO 9001:2015 und DIN EN ISO 9001:2008 DIN EN ISO 9001:2015 DIN EN ISO 9001:2008 4 Kontext der Organisation weitgehend neu, siehe aber auch 1 Anwendungsbereich 4.1 Verstehen
Gegenüberstellung von DIN EN ISO 9001:2015 und DIN EN ISO 9001:2008 DIN EN ISO 9001:2015 DIN EN ISO 9001:2008 4 Kontext der Organisation weitgehend neu, siehe aber auch 1 Anwendungsbereich 4.1 Verstehen
ISO Qualitätsmanagement prozessorientiert umsetzen
 ISO 9001 - Qualitätsmanagement prozessorientiert umsetzen Bearbeitet von Michael Cassel 1. Auflage 2007. Buch. XII, 283 S. Hardcover ISBN 978 3 446 22731 6 Format (B x L): 17,4 x 24,7 cm Gewicht: 678 g
ISO 9001 - Qualitätsmanagement prozessorientiert umsetzen Bearbeitet von Michael Cassel 1. Auflage 2007. Buch. XII, 283 S. Hardcover ISBN 978 3 446 22731 6 Format (B x L): 17,4 x 24,7 cm Gewicht: 678 g
Gegenüberstellung von DIN EN ISO 9001:2015. und DIN EN ISO 9001:2008
 Gegenüberstellung von DIN EN ISO 9001:2015 und DIN EN ISO 9001:2008 IN EN ISO 9001:2015 DIN EN ISO 9001:2008 4 Kontext der Organisation weitgehend neu, siehe aber auch 1 Anwendungsbereich 4.1 Verstehen
Gegenüberstellung von DIN EN ISO 9001:2015 und DIN EN ISO 9001:2008 IN EN ISO 9001:2015 DIN EN ISO 9001:2008 4 Kontext der Organisation weitgehend neu, siehe aber auch 1 Anwendungsbereich 4.1 Verstehen
Vergleich der Anforderungen der RiliBÄK K 2008 mit denen der DIN EN ISO 15189
 Vergleich der der K 2008 mit denen der Petra Möller und Gerd Hafner Zentrum für Labormedizin und Mikrobiologie, Essen 5.1 Das Labor muss unter fachlich qualifizierter Leitung stehen???????? Es besteht
Vergleich der der K 2008 mit denen der Petra Möller und Gerd Hafner Zentrum für Labormedizin und Mikrobiologie, Essen 5.1 Das Labor muss unter fachlich qualifizierter Leitung stehen???????? Es besteht
Übersicht über ISO 9001:2000
 Übersicht über die ISO 9001:2000 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe Übersicht über die ISO 9001:2000 4 Qualitätsmanagementsystem 5 Verantwortung der Leitung 6 Management
Übersicht über die ISO 9001:2000 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe Übersicht über die ISO 9001:2000 4 Qualitätsmanagementsystem 5 Verantwortung der Leitung 6 Management
Qualitätsmanagement. von der Theorie zur Praxis. (Einführung und Umsetzung im Arbeitsalltag) Seite 0
 Qualitätsmanagement von der Theorie zur Praxis (Einführung und Umsetzung im Arbeitsalltag) 16.11.2011 Seite 0 Theorie ist, wenn man alles weiss, aber nichts funktioniert. Praxis ist, wenn alles funktioniert,
Qualitätsmanagement von der Theorie zur Praxis (Einführung und Umsetzung im Arbeitsalltag) 16.11.2011 Seite 0 Theorie ist, wenn man alles weiss, aber nichts funktioniert. Praxis ist, wenn alles funktioniert,
Dokumentenübersicht Revision vom Ersteller/-in Verteiler Grund der letzten Änderung
 Handbuch Kapitel 1 und 2 Anwendungsbereich & Normative Verweise 0 BdoL BdoL Kapitel 3 Begriffe Abkürzungen 0 BdoL BdoL Kapitel 4 Qualitätsmanagementsystem 0 BdoL BdoL Kapitel 5 Verantwortung der Leitung
Handbuch Kapitel 1 und 2 Anwendungsbereich & Normative Verweise 0 BdoL BdoL Kapitel 3 Begriffe Abkürzungen 0 BdoL BdoL Kapitel 4 Qualitätsmanagementsystem 0 BdoL BdoL Kapitel 5 Verantwortung der Leitung
Inhaltsübersicht MH Medizin IBSN Inhalt der CD sortiert nach Normpunkten DIN EN ISO 9001:2000
 Seite 1 von 8 Seiten Inhaltsübersicht CD struktur Inhalt der CD sortiert nach punkten DIN EN ISO 9001:2000 Form Kapitel 1+2 2.0.0 1 und 2 Anwendungsbereich ative Verweise 424 Liste der en und Erlasse CD:\1
Seite 1 von 8 Seiten Inhaltsübersicht CD struktur Inhalt der CD sortiert nach punkten DIN EN ISO 9001:2000 Form Kapitel 1+2 2.0.0 1 und 2 Anwendungsbereich ative Verweise 424 Liste der en und Erlasse CD:\1
ISO 9001: Einleitung. 1 Anwendungsbereich. 2 Normative Verweisungen. 4 Qualitätsmanagementsystem. 4.1 Allgemeine Anforderungen
 DIN EN ISO 9001 Vergleich ISO 9001:2015 und ISO 9001:2015 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe 4 Kontext der Organisation 4.1 Verstehen der Organisation und ihres Kontextes
DIN EN ISO 9001 Vergleich ISO 9001:2015 und ISO 9001:2015 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe 4 Kontext der Organisation 4.1 Verstehen der Organisation und ihres Kontextes
Grundlagen Qualitätsmanagement
 Holger Brüggemann Peik Bremer Grundlagen Qualitätsmanagement Von den Werkzeugen über Methoden zum TQM 2., überarbeitete und erweiterte Auflage Springer Vieweg VII Inhaltsverzeichnis Seite 1 Einfuhrung
Holger Brüggemann Peik Bremer Grundlagen Qualitätsmanagement Von den Werkzeugen über Methoden zum TQM 2., überarbeitete und erweiterte Auflage Springer Vieweg VII Inhaltsverzeichnis Seite 1 Einfuhrung
Produktvorstellung. Seiler. Musterbeispiel DIN ISO 10005: QM-Plan. Zielgruppe: Große Unternehmen. Inhalte. Lieferung. Leseprobe.
 Produktvorstellung Qualitätsmanagement Verlag Musterbeispiel DIN ISO 10005:2009 - Seiler Dokumentationen Zielgruppe: Große Unternehmen Egal was Du tust, mach es mit Begeisterung! Inhalte AA mit QMS, Prozessbeschreibungen
Produktvorstellung Qualitätsmanagement Verlag Musterbeispiel DIN ISO 10005:2009 - Seiler Dokumentationen Zielgruppe: Große Unternehmen Egal was Du tust, mach es mit Begeisterung! Inhalte AA mit QMS, Prozessbeschreibungen
Grundlagen Qualitätsmanagement
 Grundlagen Qualitätsmanagement Von den Werkzeugen über Methoden zum TQM von Holger Brüggemann, Peik Bremer 1. Auflage Springer Vieweg Wiesbaden 2012 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3
Grundlagen Qualitätsmanagement Von den Werkzeugen über Methoden zum TQM von Holger Brüggemann, Peik Bremer 1. Auflage Springer Vieweg Wiesbaden 2012 Verlag C.H. Beck im Internet: www.beck.de ISBN 978 3
Inhaltsverzeichnis IVZ. Vorwort der Herausgeber zur 1. Auflage 5. Die Autoren 7. 1 Audits und Inspektionen 17
 Vorwort der Herausgeber zur 1. Auflage 5 Die Autoren 7 1 Audits und Inspektionen 17 1.A Grundsätze 21 1.A.1 Begriffe 21 1.A.2 Rechtliche Aspekte 23 1.A.3 Anlässe für Audits 23 1.A.4 Kernforderungen an
Vorwort der Herausgeber zur 1. Auflage 5 Die Autoren 7 1 Audits und Inspektionen 17 1.A Grundsätze 21 1.A.1 Begriffe 21 1.A.2 Rechtliche Aspekte 23 1.A.3 Anlässe für Audits 23 1.A.4 Kernforderungen an
Einführung Systemvalidierung Schulung (Modul 0) Version: V03
 Einführung Systemvalidierung Schulung (Modul 0) Version: V03 Ronald Speer LIFE Leipzig Systemvalidierung - Schulung Modul 0 - Einführung Ronald Speer Seite 1 Einleitung Studiensoftware muss GCP-konform
Einführung Systemvalidierung Schulung (Modul 0) Version: V03 Ronald Speer LIFE Leipzig Systemvalidierung - Schulung Modul 0 - Einführung Ronald Speer Seite 1 Einleitung Studiensoftware muss GCP-konform
Produktvorstellung. Seiler. Musterbeispiel Medizin mit DIN EN ISO 13485:2015
 Produktvorstellung Qualitätsmanagement Verlag Musterbeispiel Medizin mit DIN EN ISO 13485:2015 en Zielgruppe: Medizinprodukteherstellung Inverkehrbringung von Medizinprodukten Egal was Du tust, mach es
Produktvorstellung Qualitätsmanagement Verlag Musterbeispiel Medizin mit DIN EN ISO 13485:2015 en Zielgruppe: Medizinprodukteherstellung Inverkehrbringung von Medizinprodukten Egal was Du tust, mach es
Leitfaden zur Einführung von Qualitätsmanagementsystemen in Energieversorgungsunternehmen
 VGB TECHNISCHE VEREINIGUNG DER GROSSKRAFTWERKSBETREIBER E.V. Leitfaden zur Einführung von Qualitätsmanagementsystemen in Energieversorgungsunternehmen VGB-R 150 Herausgegeben von der VGB TECHNISCHEN VEREINIGUNG
VGB TECHNISCHE VEREINIGUNG DER GROSSKRAFTWERKSBETREIBER E.V. Leitfaden zur Einführung von Qualitätsmanagementsystemen in Energieversorgungsunternehmen VGB-R 150 Herausgegeben von der VGB TECHNISCHEN VEREINIGUNG
Gegenüberstellung DIN EN 9100:2018 DIN EN 9100:2010
 Gegenüberstellung DIN EN 9100:2018 DIN EN 9100:2010 DIN EN 9100:2018 DIN EN 9100:2010 4 Kontext der 4 Qualitätsmanagementsystem 4.1 Verstehen der und ihres Kontextes 4 5.6 4.2 Verstehen der Erfordernisse
Gegenüberstellung DIN EN 9100:2018 DIN EN 9100:2010 DIN EN 9100:2018 DIN EN 9100:2010 4 Kontext der 4 Qualitätsmanagementsystem 4.1 Verstehen der und ihres Kontextes 4 5.6 4.2 Verstehen der Erfordernisse
Gegenüberstellung der Normkapitel
 Zuordnungstabelle ISO 9001: 2015 ISO 9001:2008 ISO 9001:2015 ISO 9001:2008 4 Kontext der Organisation 4.0 Qualitätsmanagementsystem 4.1 Verstehen der Organisation und Ihres 4.0 Qualitätsmanagementsystem
Zuordnungstabelle ISO 9001: 2015 ISO 9001:2008 ISO 9001:2015 ISO 9001:2008 4 Kontext der Organisation 4.0 Qualitätsmanagementsystem 4.1 Verstehen der Organisation und Ihres 4.0 Qualitätsmanagementsystem
Die QM-System. System- Dokumentaion
 Die QM-System System- Dokumentaion QM-Handbuch (QM-H) Allgemeiner Teil der QM-System Dokumentation, zu deren Gestaltung es keine verbindlichen Vorschriften gibt Im QM-H H sollte immer beschrieben und vorgestellt
Die QM-System System- Dokumentaion QM-Handbuch (QM-H) Allgemeiner Teil der QM-System Dokumentation, zu deren Gestaltung es keine verbindlichen Vorschriften gibt Im QM-H H sollte immer beschrieben und vorgestellt
Grundlagen Qualitätsmanagement
 Grundlagen Qualitätsmanagement Von den Werkzeugen über Methoden zum TQM Bearbeitet von Von: Holger Brüggemann, und Peik Bremer 2., überarbeitete und erweiterte Auflage 2015. Buch. X, 275 S. Paperback ISBN
Grundlagen Qualitätsmanagement Von den Werkzeugen über Methoden zum TQM Bearbeitet von Von: Holger Brüggemann, und Peik Bremer 2., überarbeitete und erweiterte Auflage 2015. Buch. X, 275 S. Paperback ISBN
Gegenüberstellung IATF 16949:2016 und ISO/TS 16949:2009
 Gegenüberstellung IATF 16949:2016 und ISO/TS 16949:2009 4 Kontext der Organisation Teilweise neu, siehe aber auch 1 Anwendungsbereich 4.1 Verstehen der Organisation und ihres 1.1 Allgemeines Kontextes
Gegenüberstellung IATF 16949:2016 und ISO/TS 16949:2009 4 Kontext der Organisation Teilweise neu, siehe aber auch 1 Anwendungsbereich 4.1 Verstehen der Organisation und ihres 1.1 Allgemeines Kontextes
QM in der Zahnarztpraxis Muster-QM-Handbuch
 QM in der Zahnarztpraxis Muster-QM-Handbuch So führen Sie ein QM-System in Ihrer Praxis ein, das die Anforderungen der QM-Richtlinie des G-BA und der ISO 9001:2015 erfüllt - und verbessern damit Ihre Praxisprozesse!
QM in der Zahnarztpraxis Muster-QM-Handbuch So führen Sie ein QM-System in Ihrer Praxis ein, das die Anforderungen der QM-Richtlinie des G-BA und der ISO 9001:2015 erfüllt - und verbessern damit Ihre Praxisprozesse!
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE. Praxisleitfaden für Hersteller und Zulieferer. 2., überarbeitete Auflage HANSER
 Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
Werks-Anlagen und Einrichtungsplanung
 IATF 16949:2016 ISO/TS 16949:2009 1.1 Allgemeines 4.1 Verstehen der Organisation und ihres Kontextes 1.1 Allgemeines 4.2 Verstehen der Erfordernisse und Erwartungen interessierter Parteien 1.1 Anwendungen
IATF 16949:2016 ISO/TS 16949:2009 1.1 Allgemeines 4.1 Verstehen der Organisation und ihres Kontextes 1.1 Allgemeines 4.2 Verstehen der Erfordernisse und Erwartungen interessierter Parteien 1.1 Anwendungen
Inhaltsverzeichnis. Gerhard Gietl, Werner Lobinger. Leitfaden für Qualitätsauditoren. Planung und Durchführung von Audits nach ISO 9001:2008
 Inhaltsverzeichnis Gerhard Gietl, Werner Lobinger Leitfaden für Qualitätsauditoren Planung und Durchführung von Audits nach ISO 9001:2008 ISBN: 978-3-446-41835-6 Weitere Informationen oder Bestellungen
Inhaltsverzeichnis Gerhard Gietl, Werner Lobinger Leitfaden für Qualitätsauditoren Planung und Durchführung von Audits nach ISO 9001:2008 ISBN: 978-3-446-41835-6 Weitere Informationen oder Bestellungen
Kundencheckliste zur DIN EN ISO 9001
 Kundencheckliste zur Forderung der QM-System 4.1 Sind in Ihrem Unternehmen ausgegliederte Prozesse vorhanden, die sie für Ihr QM- System (die Produkt- /Dienstleistungsqualität benötigen? Wie stellen Sie
Kundencheckliste zur Forderung der QM-System 4.1 Sind in Ihrem Unternehmen ausgegliederte Prozesse vorhanden, die sie für Ihr QM- System (die Produkt- /Dienstleistungsqualität benötigen? Wie stellen Sie
REINRAUMTECHNIK KLIMATECHNIK QUALIFIZIERUNGEN. Cleanroom professional. Datenblatt Reinraumanlagen
 REINRAUMTECHNIK KLIMATECHNIK QUALIFIZIERUNGEN Cleanroom professional Datenblatt Reinraumanlagen Stand April 2017 1 Reinraumprojekte sollen ideale Bedingungen für hochentwickelte Arbeits- und Produktionsprozesse
REINRAUMTECHNIK KLIMATECHNIK QUALIFIZIERUNGEN Cleanroom professional Datenblatt Reinraumanlagen Stand April 2017 1 Reinraumprojekte sollen ideale Bedingungen für hochentwickelte Arbeits- und Produktionsprozesse
Checkliste Technische Dokumentation Produktname
 Teil 1: Allgemeines Qualitätsmanagement Nr. Vorgelegte Dokumentation Anmerkung 1 Managementhandbuch 2 Spezielle Prozessanweisungen, Verfahrensanweisungen und Arbeitsanweisungen 3 Mitgeltende Formblätter
Teil 1: Allgemeines Qualitätsmanagement Nr. Vorgelegte Dokumentation Anmerkung 1 Managementhandbuch 2 Spezielle Prozessanweisungen, Verfahrensanweisungen und Arbeitsanweisungen 3 Mitgeltende Formblätter
Vorschau. QM-Dokumentation Verzeichnis der Aufzeichnungen
 Vorschau Bitte beachten Sie, dieses Dokument ist nur eine Vorschau. Hier werden nur Auszüge dargestellt. Nach dem Erwerb steht Ihnen selbstverständlich die vollständige Version im offenen Dateiformat zur
Vorschau Bitte beachten Sie, dieses Dokument ist nur eine Vorschau. Hier werden nur Auszüge dargestellt. Nach dem Erwerb steht Ihnen selbstverständlich die vollständige Version im offenen Dateiformat zur
4.2.3 Liste der Dokumente MH Gesundheitsvorsorge
 Interne Dokumente Kapitel- und Dokumentenbeschreibung Version vom Seitenanzahl 0 Einführung Deckblatt Musterhandbuch 1 Vorwort 2 Deckblatt Allgemeine Informationen 1 Abkürzungsverzeichnis 1 1 Managementhandbuch
Interne Dokumente Kapitel- und Dokumentenbeschreibung Version vom Seitenanzahl 0 Einführung Deckblatt Musterhandbuch 1 Vorwort 2 Deckblatt Allgemeine Informationen 1 Abkürzungsverzeichnis 1 1 Managementhandbuch
6 Teilnehmerunterlage (nur auf CD-ROM)
 Modul 1: Einführung in die DIN EN ISO 9000er Reihe 1. So wenden Sie diese Praxislösung an.................... 7 1 DIN EN ISO 9000 ff. Warum? 1/01 Gründe für ein zertifiziertes Qualitätsmanagementsystem.......................
Modul 1: Einführung in die DIN EN ISO 9000er Reihe 1. So wenden Sie diese Praxislösung an.................... 7 1 DIN EN ISO 9000 ff. Warum? 1/01 Gründe für ein zertifiziertes Qualitätsmanagementsystem.......................
Erfahrungen der. DQS GmbH. bei der Zertifizierung von Medizinprodukteherstellern
 Erfahrungen der DQS GmbH bei der Zertifizierung von Medizinprodukteherstellern 2004-11-24, Seite 1 Normensituation Medizinprodukte DIN EN ISO 9001:94 DIN EN ISO 9001:2000 DIN EN 46001/2:1996 DIN EN ISO
Erfahrungen der DQS GmbH bei der Zertifizierung von Medizinprodukteherstellern 2004-11-24, Seite 1 Normensituation Medizinprodukte DIN EN ISO 9001:94 DIN EN ISO 9001:2000 DIN EN 46001/2:1996 DIN EN ISO
Das 4 Phasen Modell der TIS CH
 GAP Analysen der strukturierte Weg zum GMP upgrade Das 4 Phasen Modell der TIS CH Vortrag am 06.11.2017 im Rahmen des 13. SCC Event in Pratteln Wolfgang Hähnel Geschäftsführer testo industrial services
GAP Analysen der strukturierte Weg zum GMP upgrade Das 4 Phasen Modell der TIS CH Vortrag am 06.11.2017 im Rahmen des 13. SCC Event in Pratteln Wolfgang Hähnel Geschäftsführer testo industrial services
IATS 16949:2016 ISO/TS 16949:2009
 IATS 16949:2016 ISO/TS 16949:2009 4 Kontext der Organisation Zum Teil neu, siehe Anwendungsbereich 4.1 Verstehen der Organisation und ihres 1.1 Allgemeines Kontextes 4.2 Verstehen der Erfordernisse und
IATS 16949:2016 ISO/TS 16949:2009 4 Kontext der Organisation Zum Teil neu, siehe Anwendungsbereich 4.1 Verstehen der Organisation und ihres 1.1 Allgemeines Kontextes 4.2 Verstehen der Erfordernisse und
CE-Kennzeichnung von Asphalt Der Weg ist das Ziel
 CE-Kennzeichnung von Asphalt Der Weg ist das Ziel Dr. M. Kostjak Die CE-Kennzeichnung von Asphalt Der Weg ist das Ziel Erste Vorgabe Was ist zu erreichen? Zweite Vorgabe Wie ist es zu erreichen? Die CE-Kennzeichnung
CE-Kennzeichnung von Asphalt Der Weg ist das Ziel Dr. M. Kostjak Die CE-Kennzeichnung von Asphalt Der Weg ist das Ziel Erste Vorgabe Was ist zu erreichen? Zweite Vorgabe Wie ist es zu erreichen? Die CE-Kennzeichnung
Gegenüberstellung von ISO 9001:2015 und ISO 9001:2008
 von ISO 9001:2015 und ISO 9001:2008 ISO 9001:2015 ISO 9001:2008 4 Kontext der 4 Qualitätsmanagementsystem 4.1 Verstehen der und ihres Kontextes 4 5.6 4.2 Verstehen der Erfordernisse und Erwartungen interessierter
von ISO 9001:2015 und ISO 9001:2008 ISO 9001:2015 ISO 9001:2008 4 Kontext der 4 Qualitätsmanagementsystem 4.1 Verstehen der und ihres Kontextes 4 5.6 4.2 Verstehen der Erfordernisse und Erwartungen interessierter
Qualitätsmanagement. Denny Bayer
 Qualitätsmanagement Denny Bayer 2 Inhalt Was ist QM Motivation Entstehung ISO 9000 ff. Zertifizierung Methoden des QM 3 Motivation Qualität wird vom Nutzer wahrgenommen Kundenorientierung Zuverlässige
Qualitätsmanagement Denny Bayer 2 Inhalt Was ist QM Motivation Entstehung ISO 9000 ff. Zertifizierung Methoden des QM 3 Motivation Qualität wird vom Nutzer wahrgenommen Kundenorientierung Zuverlässige
Lenkung fehlerhafter Produkte mit dem Werkzeug einer QAB Datenbank
 Lenkung fehlerhafter Produkte mit dem Werkzeug einer QAB Datenbank Nicolas Allerkamp Herford, den 11.05.2006 Inhalt Wer ist Ferrocontrol und was liefern wir? Forderungen, unter dem Aspekt Produkthaftung
Lenkung fehlerhafter Produkte mit dem Werkzeug einer QAB Datenbank Nicolas Allerkamp Herford, den 11.05.2006 Inhalt Wer ist Ferrocontrol und was liefern wir? Forderungen, unter dem Aspekt Produkthaftung
Checkliste ISO/IEC 27001:2013 Dokumente und Aufzeichnungen
 Checkliste ISO/IEC 27001:2013 Dokumente und Aufzeichnungen Version: 1.1 Datum: 01.06.2016 Änderungsverfolgung Version Datum Geänderte Seiten / Kapitel Autor Bemerkungen 1.0 07.01.2016 Alle F. Thater Initiale
Checkliste ISO/IEC 27001:2013 Dokumente und Aufzeichnungen Version: 1.1 Datum: 01.06.2016 Änderungsverfolgung Version Datum Geänderte Seiten / Kapitel Autor Bemerkungen 1.0 07.01.2016 Alle F. Thater Initiale
Inhaltsverzeichnis. Claudia Brückner. Qualitätsmanagement - Das Praxishandbuch für die Automobilindustrie ISBN:
 Inhaltsverzeichnis Claudia Brückner Qualitätsmanagement - Das Praxishandbuch für die Automobilindustrie ISBN: 978-3-446-42337-4 Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-42337-4
Inhaltsverzeichnis Claudia Brückner Qualitätsmanagement - Das Praxishandbuch für die Automobilindustrie ISBN: 978-3-446-42337-4 Weitere Informationen oder Bestellungen unter http://www.hanser.de/978-3-446-42337-4
Gebrauchstauglichkeit von
 Gebrauchstauglichkeit von Medizinprodukten i d EN 60601-1-6:2006 und EN 62366:2008 Stefan Hofmann Tel.: +49 69 95427-262 Email: [email protected] DQS Medizinprodukte GmbH Gebrauchstauglichkeit Gebrauchstauglichkeit
Gebrauchstauglichkeit von Medizinprodukten i d EN 60601-1-6:2006 und EN 62366:2008 Stefan Hofmann Tel.: +49 69 95427-262 Email: [email protected] DQS Medizinprodukte GmbH Gebrauchstauglichkeit Gebrauchstauglichkeit
Projektplanung Reinraumtechnik
 Lothar Gail / Udo Gommel / Horst Weißsieker (Hrsg.) Projektplanung Reinraumtechnik Hüthig Verlag Heidelberg Inhaltsverzeichnis Vorwort " V Die Autoren VI Einführung: Leitfaden für Reinraumprojekte 1 1
Lothar Gail / Udo Gommel / Horst Weißsieker (Hrsg.) Projektplanung Reinraumtechnik Hüthig Verlag Heidelberg Inhaltsverzeichnis Vorwort " V Die Autoren VI Einführung: Leitfaden für Reinraumprojekte 1 1
3. Vorstellung der DIN EN ISO Lernziele. Vorstellung der Normen und Regelwerke
 3. Vorstellung der DIN EN ISO 9001 2016 Kuhnt 1 Lernziele Kennenlernen wesentlicher Norminhalte Überblick über Anforderungen eines zertifizierbaren Qualitätsmanagementsystems 2016 Kuhnt 2 Vorstellung der
3. Vorstellung der DIN EN ISO 9001 2016 Kuhnt 1 Lernziele Kennenlernen wesentlicher Norminhalte Überblick über Anforderungen eines zertifizierbaren Qualitätsmanagementsystems 2016 Kuhnt 2 Vorstellung der
wir müssen reden. Über Qualität!
 wir müssen reden. Über Qualität! "Made in Quality - Made for Success" 1 Auditors Liebling! Der Messmittelmanagementprozess Jörg Roggensack 1 Warum Auditors Liebling? Es ist eine muss Forderung jeder Systemnorm!
wir müssen reden. Über Qualität! "Made in Quality - Made for Success" 1 Auditors Liebling! Der Messmittelmanagementprozess Jörg Roggensack 1 Warum Auditors Liebling? Es ist eine muss Forderung jeder Systemnorm!
Praxisbuch GMP- Anlagenqualifizierung in der Pharmaindustrie Planung, Durchführung, Beispieldokumente
 Thomas Peither, Dr. Petra Rempe, Winfried Büßing Praxisbuch GMP- Anlagenqualifizierung in der Pharmaindustrie Planung, Durchführung, Beispieldokumente Inhaltsverzeichnis INHALTSVERZEICHNIS I i Vorwort
Thomas Peither, Dr. Petra Rempe, Winfried Büßing Praxisbuch GMP- Anlagenqualifizierung in der Pharmaindustrie Planung, Durchführung, Beispieldokumente Inhaltsverzeichnis INHALTSVERZEICHNIS I i Vorwort
Qualitätsmanagement Das Praxishandbuch für die Automobilindustrie
 Claudia Brückner Qualitätsmanagement Das Praxishandbuch für die Automobilindustrie HANSER Inhalt 1 Zertifizierungsnormen in der Automobilindustrie 1 1.1 Welche Normen sind von Bedeutung? 1 1.1.1 Ziel und
Claudia Brückner Qualitätsmanagement Das Praxishandbuch für die Automobilindustrie HANSER Inhalt 1 Zertifizierungsnormen in der Automobilindustrie 1 1.1 Welche Normen sind von Bedeutung? 1 1.1.1 Ziel und
Inhalt. 5.1 Managementaufgaben Beschreibung kompakt Zielsetzung und Nutzen Wichtiges in Kürze Literaturhinweise 80
 Inhalt 1 Zertifizierungsnormen in der Automobilindustrie 1 1.1 Welche Normen sind von Bedeutung? 1 1.1.1 Ziel und Anwendungsbereich 2 1.1.2 Beschreibung kompakt 2 1.1.3 Der Zertifizierungsablauf. 3 1.1.4
Inhalt 1 Zertifizierungsnormen in der Automobilindustrie 1 1.1 Welche Normen sind von Bedeutung? 1 1.1.1 Ziel und Anwendungsbereich 2 1.1.2 Beschreibung kompakt 2 1.1.3 Der Zertifizierungsablauf. 3 1.1.4
ISO/TS Qualitätsmanagement in der Automobilindustrie umsetzen
 ISO/TS 16949 - Qualitätsmanagement in der Automobilindustrie umsetzen Michael Cassel ISBN 3-446-22729-6 Inhaltsverzeichnis Weitere Informationen oder Bestellungen unter http://www.hanser.de/3-446-22729-6
ISO/TS 16949 - Qualitätsmanagement in der Automobilindustrie umsetzen Michael Cassel ISBN 3-446-22729-6 Inhaltsverzeichnis Weitere Informationen oder Bestellungen unter http://www.hanser.de/3-446-22729-6
Hygienic Design. Line Qualification
 Hygienic Design Line Qualification Hygienic Design Funktionalität und Effizienz Nutzen Sie unsere Kompetenz für die Optimierung und die Nachhaltigkeit Ihrer Lebensmittelherstellungsprozesse. Durch unsere
Hygienic Design Line Qualification Hygienic Design Funktionalität und Effizienz Nutzen Sie unsere Kompetenz für die Optimierung und die Nachhaltigkeit Ihrer Lebensmittelherstellungsprozesse. Durch unsere
Legende: Keine Aktion erforderlich! Anpassung erforderlich Neue Anforderung
 Legende: Keine Aktion erforderlich! Anpassung erforderlich Neue Anforderung Abschnitte der ISO 9001:2008 Abschnitte der ISO 9001:2015 Delta- Anforderungen, Bemerkungen 4 Qualitätsmanagementsystem 4.4 QMS
Legende: Keine Aktion erforderlich! Anpassung erforderlich Neue Anforderung Abschnitte der ISO 9001:2008 Abschnitte der ISO 9001:2015 Delta- Anforderungen, Bemerkungen 4 Qualitätsmanagementsystem 4.4 QMS
Inhalt. 2 Umsetzung der Einzelanforderungen Einleitung 49
 1 Projektplanung und Durchführung 1 1.1 Einleitung 1 1.2 Projektdurchführung, 4 1.2.1 Projektvorbereitung 5 1.2.1.1 Ziele des Projekts definieren 5 1.2.1.2 Projektteam bilden 6 1.2.2 Vorgehensplanung und
1 Projektplanung und Durchführung 1 1.1 Einleitung 1 1.2 Projektdurchführung, 4 1.2.1 Projektvorbereitung 5 1.2.1.1 Ziele des Projekts definieren 5 1.2.1.2 Projektteam bilden 6 1.2.2 Vorgehensplanung und
Lieferantenzulassung. Lieferantenbewertung FRAGENKATALOG
 Lieferant: Lieferantenzulassung Lieferantenbewertung FRAGENKATALOG V E R T R A U L I C H Anhang zu 120222-0025-000 1 / 11 Ausgabe 27.09.2011 Firmenname Adresse Telefon NQ, Ausgabe 8.4.04 Fax e-mail zugehörige
Lieferant: Lieferantenzulassung Lieferantenbewertung FRAGENKATALOG V E R T R A U L I C H Anhang zu 120222-0025-000 1 / 11 Ausgabe 27.09.2011 Firmenname Adresse Telefon NQ, Ausgabe 8.4.04 Fax e-mail zugehörige
Was ist ein Lastenheft?
 Lastenheft Was ist ein Lastenheft? Wann wird ein Lastenheft erstellt? Wozu wird ein Lastenheft erstellt? Was beinhaltet ein Lastenheft? Wer erstellt ein Lastenheft? Wie wird ein Lastenheft erstellt? Was
Lastenheft Was ist ein Lastenheft? Wann wird ein Lastenheft erstellt? Wozu wird ein Lastenheft erstellt? Was beinhaltet ein Lastenheft? Wer erstellt ein Lastenheft? Wie wird ein Lastenheft erstellt? Was
Transition KaWa. Gleich geht es los, bestimmt. Auditcheckliste Jörg Roggensack TESTO 2014
 Transition KaWa Gleich geht es los, bestimmt. 1 wir müssen reden. Über Qualität! "Morgens um halb zehn in Ihrem Unternehmen" 2 Auditors Liebling! Der Messmittelmanagementprozess Jörg Roggensack Warum Auditors
Transition KaWa Gleich geht es los, bestimmt. 1 wir müssen reden. Über Qualität! "Morgens um halb zehn in Ihrem Unternehmen" 2 Auditors Liebling! Der Messmittelmanagementprozess Jörg Roggensack Warum Auditors
Audit-Bericht ISO 9001
 Audit-Art: 4. Wiederholungsaudit Audit-Grundlage / Standard / Ausgabedatum: ISO 9001:2008 ohne Produktentwicklung Handbuch / Revision / Datum 8; 9.12.2013 Audit-Zeitraum vor Ort (Solltermin): 2013-12-19-2013-12-19
Audit-Art: 4. Wiederholungsaudit Audit-Grundlage / Standard / Ausgabedatum: ISO 9001:2008 ohne Produktentwicklung Handbuch / Revision / Datum 8; 9.12.2013 Audit-Zeitraum vor Ort (Solltermin): 2013-12-19-2013-12-19
Entwurf. Erstellen von Gebrauchsanleitungen Gliederung, Inhalt und Darstellung Teil 1: Allgemeine Grundsätze und ausführliche Anforderungen
 Erstellen von Gebrauchsanleitungen Gliederung, Inhalt und Darstellung Teil 1: Allgemeine Grundsätze und ausführliche Anforderungen Inhalt Einleitung... 9 1 Anwendungsbereich... 11 2 Normative Verweisungen...
Erstellen von Gebrauchsanleitungen Gliederung, Inhalt und Darstellung Teil 1: Allgemeine Grundsätze und ausführliche Anforderungen Inhalt Einleitung... 9 1 Anwendungsbereich... 11 2 Normative Verweisungen...
Normrevision DIN EN ISO 9001:2015. Seite: 1
 Seite: 1 Qualitätsmanagement nach DIN EN ISO 9001 neu Inhalt: Zeitplan für Unternehmen und Organisationen Gegenüberstellung der Gliederung der Versionen 2008 und 2015 Die wichtigsten Neuerungen und deren
Seite: 1 Qualitätsmanagement nach DIN EN ISO 9001 neu Inhalt: Zeitplan für Unternehmen und Organisationen Gegenüberstellung der Gliederung der Versionen 2008 und 2015 Die wichtigsten Neuerungen und deren
Michael Cassel ISO 9001. Qualitätsmanagement prozessorientiert umsetzen. it 81 Abbildungen HANSER
 Michael Cassel ISO 9001 Qualitätsmanagement prozessorientiert umsetzen it 81 Abbildungen HANSER Inhalt 1 Projektplanung und Durchführung 1 1.1 Einleitung 1 1.2 Projektdurchführung 3 1.2.1 Projektvorbereitung
Michael Cassel ISO 9001 Qualitätsmanagement prozessorientiert umsetzen it 81 Abbildungen HANSER Inhalt 1 Projektplanung und Durchführung 1 1.1 Einleitung 1 1.2 Projektdurchführung 3 1.2.1 Projektvorbereitung
Konformität in der Apheresetechnik. Uwe Wallstab Roland E. Winkler Wolfgang Ramlow
 Konformität in der Apheresetechnik Uwe Wallstab Roland E. Winkler Wolfgang Ramlow Institut für Angewandte Biowissenschaften e.v., 1999 Konformitätsbewertung in der Apherese- Technik Wichtige Rechtsvorschriften
Konformität in der Apheresetechnik Uwe Wallstab Roland E. Winkler Wolfgang Ramlow Institut für Angewandte Biowissenschaften e.v., 1999 Konformitätsbewertung in der Apherese- Technik Wichtige Rechtsvorschriften
Aktualisierte Leitlinie für die Validierung der maschinellen Reinigung und Desinfektion (in der Fassung von 2017)
 Aktualisierte Leitlinie für die Validierung der maschinellen Reinigung und Desinfektion (in der Fassung von 2017) Arbeitskreis Infektionsprophylaxe, Markus Hoppe, 13./14.03.2018 Historie der Leitlinie
Aktualisierte Leitlinie für die Validierung der maschinellen Reinigung und Desinfektion (in der Fassung von 2017) Arbeitskreis Infektionsprophylaxe, Markus Hoppe, 13./14.03.2018 Historie der Leitlinie
E DIN EN ISO 9001: (D/E)
 E DIN EN ISO 9001:2014-08 (D/E) Qualitätsmanagementsysteme - Anforderungen (ISO/DIS 9001:2014); Deutsche und Englische Fassung pren ISO 9001:2014 Quality management systems - Requirements (ISO/DIS 9001:2014);
E DIN EN ISO 9001:2014-08 (D/E) Qualitätsmanagementsysteme - Anforderungen (ISO/DIS 9001:2014); Deutsche und Englische Fassung pren ISO 9001:2014 Quality management systems - Requirements (ISO/DIS 9001:2014);
Qualitätsmanagement Änderungen in der ISO 9001 Entwurf 2007
 Qualitätsmanagement Änderungen in der ISO 9001 Entwurf 2007 30. Januar 2008 München Ablauf der Revision 2008 Start Systematic Review 15.12.2003 Ermittlung von Kundenfeedback 01/2004 Justification study
Qualitätsmanagement Änderungen in der ISO 9001 Entwurf 2007 30. Januar 2008 München Ablauf der Revision 2008 Start Systematic Review 15.12.2003 Ermittlung von Kundenfeedback 01/2004 Justification study
Qualitätsvereinbarung. zwischen der Firma. E + E Elektronik Ges. m. b. H. Langwiesen 7 A Engerwitzdorf - nachfolgend "E+E" genannt -
 zwischen der Firma E + E Elektronik Ges. m. b. H. Langwiesen 7 A - 4209 Engerwitzdorf - nachfolgend "E+E" genannt - und der Firma - nachfolgend "Lieferer" genannt - 1/5 INHALTSANGABE SEITE 1. GELTUNGSBEREICH
zwischen der Firma E + E Elektronik Ges. m. b. H. Langwiesen 7 A - 4209 Engerwitzdorf - nachfolgend "E+E" genannt - und der Firma - nachfolgend "Lieferer" genannt - 1/5 INHALTSANGABE SEITE 1. GELTUNGSBEREICH
SCHUCHERT-Selbstcheck zu neuen Anforderungen der DIN EN ISO 9001:2015
 SCHUCHERT-Selbstcheck zu neuen Anforderungen der DIN EN ISO 9001:2015 Hinweise zur Nutzung Unternehmen und Organisationen haben bis zum 14.09.2018 Zeit, ihr QM-System auf die neue Norm umzustellen. Bei
SCHUCHERT-Selbstcheck zu neuen Anforderungen der DIN EN ISO 9001:2015 Hinweise zur Nutzung Unternehmen und Organisationen haben bis zum 14.09.2018 Zeit, ihr QM-System auf die neue Norm umzustellen. Bei
UMSTELLUNGSHILFE ISO 9001:2008 auf ISO 9001:2015
 UMSTELLUNGSHILFE ISO 9001:2008 auf ISO 9001:2015 Was ist wirklich NEU? Was ist zu tun? Was kann ich besser oder anders machen? Das nachfolgende Dokument beinhaltet eine Gegenüberstellung bzw. Zuordnung
UMSTELLUNGSHILFE ISO 9001:2008 auf ISO 9001:2015 Was ist wirklich NEU? Was ist zu tun? Was kann ich besser oder anders machen? Das nachfolgende Dokument beinhaltet eine Gegenüberstellung bzw. Zuordnung
Softwareentwicklung nach der ISO9001?
 Agenda Softwareentwicklung nach der ISO9001? von Robert Woll Motivation Einige aktuelle Herausforderungen für Unternehmen heutzutage: zunehmende Konkurrenz höhere Kundenanforderungen stärkere Integration
Agenda Softwareentwicklung nach der ISO9001? von Robert Woll Motivation Einige aktuelle Herausforderungen für Unternehmen heutzutage: zunehmende Konkurrenz höhere Kundenanforderungen stärkere Integration
Qualitätsmanagement-Leitfaden
 Qualitätsmanagement nach ISO 9001:2015 QM-Leitfaden der de-build.net GmbH "design & building of networks" 1 Grundsatz... 3 1.1 Grundsatzerklärung... 3 2 Aufbau des QM-Systems... 4 2.1 Aufbau des Qualitätsmanagementsystems...
Qualitätsmanagement nach ISO 9001:2015 QM-Leitfaden der de-build.net GmbH "design & building of networks" 1 Grundsatz... 3 1.1 Grundsatzerklärung... 3 2 Aufbau des QM-Systems... 4 2.1 Aufbau des Qualitätsmanagementsystems...
ICH Q7A Good Manufacturing Practice for Active Pharmaceutical Ingredients
 ICH Q7A GMP fur Wirkstoffe International Conference on Harmonization (ICH) ICH Q7A Good Manufacturing Practice for Active Pharmaceutical Ingredients CPMP/ICH/4106/00 Englisches Original und deutsche Ubersetzung
ICH Q7A GMP fur Wirkstoffe International Conference on Harmonization (ICH) ICH Q7A Good Manufacturing Practice for Active Pharmaceutical Ingredients CPMP/ICH/4106/00 Englisches Original und deutsche Ubersetzung
Die Anforderungen der DIN EN ISO 9001:2015 Eine erste Einschätzung
 Die Anforderungen der DIN EN ISO 9001:2015 Eine erste Einschätzung auf Grlage des DIS (Draft International Standard) 2014 1 Die (wesentlichen) neuen Inhalte (gegenüber der Version ISO 9001:2008) Eine neue
Die Anforderungen der DIN EN ISO 9001:2015 Eine erste Einschätzung auf Grlage des DIS (Draft International Standard) 2014 1 Die (wesentlichen) neuen Inhalte (gegenüber der Version ISO 9001:2008) Eine neue
Integriertes Management-Handbuch
 Muster GmbH Integriertes Management-Handbuch Qualitätsmanagement (DIN EN ISO 9001) Umweltmanagement (DIN EN ISO 14001) Handbuch-Exemplar Nummer: 01-2014 Dieses Handbuch unterliegt dem Änderungsdienst:
Muster GmbH Integriertes Management-Handbuch Qualitätsmanagement (DIN EN ISO 9001) Umweltmanagement (DIN EN ISO 14001) Handbuch-Exemplar Nummer: 01-2014 Dieses Handbuch unterliegt dem Änderungsdienst:
Produktvorstellung. Seiler. Regelwerk Technische Dokumentation nach EWG 93/42
 Produktvorstellung Qualitätsmanagement Verlag Regelwerk Technische Dokumentation nach EWG 93/42 Seiler Dokumentationen Zielgruppe: Dieses Regelwerk ist für Inverkehrbringer von Medizinprodukten. Es beinhaltet
Produktvorstellung Qualitätsmanagement Verlag Regelwerk Technische Dokumentation nach EWG 93/42 Seiler Dokumentationen Zielgruppe: Dieses Regelwerk ist für Inverkehrbringer von Medizinprodukten. Es beinhaltet
DIN EN ISO 9000:2000 Normenreihe
 DIN EN ISO 9000:2000 Normenreihe DIN EN ISO Normen zum Qualitätsmanagement: 1987 entstanden, 1994 überarbeitet und 2000 reformiert DIN EN ISO 9000:2000: Qualitätsmanagementsysteme Grundlagen und Begriffe
DIN EN ISO 9000:2000 Normenreihe DIN EN ISO Normen zum Qualitätsmanagement: 1987 entstanden, 1994 überarbeitet und 2000 reformiert DIN EN ISO 9000:2000: Qualitätsmanagementsysteme Grundlagen und Begriffe
Risikomanagement: PTS Webinar in dem Webinar-Raum
 Tagesaktueller Trainingsplan sortiert nach Themengebiet und Datum. Januar 2019 Risikomanagement: PTS Webinar in dem Webinar-Raum http://www.pts.eu/k3318.html Webinar: Moderne Formen von GxP-Trainings am
Tagesaktueller Trainingsplan sortiert nach Themengebiet und Datum. Januar 2019 Risikomanagement: PTS Webinar in dem Webinar-Raum http://www.pts.eu/k3318.html Webinar: Moderne Formen von GxP-Trainings am
Prozess-Systeme für die Pharmazie, Biotechnologie & Kosmetikindustrie. Pharmatec GmbH
 Prozess-Systeme für die Pharmazie, Biotechnologie & Kosmetikindustrie Pharmatec GmbH KIESELMANN Pharmatec GmbH Hauptsitz der KIESELMANN Gruppe am Standort Knittlingen Engineering und Projektmanagement
Prozess-Systeme für die Pharmazie, Biotechnologie & Kosmetikindustrie Pharmatec GmbH KIESELMANN Pharmatec GmbH Hauptsitz der KIESELMANN Gruppe am Standort Knittlingen Engineering und Projektmanagement
ICH Q7A Good Manufacturing Practice for Active Pharmaceutical Ingredients
 ICH Q7A GMP für Wirkstoffe International Conference on Harmonization (ICH) ICH Q7A Good Manufacturing Practice for Active Pharmaceutical Ingredients CPMP/ICH/4106/00 Englisches Original und deutsche Übersetzung
ICH Q7A GMP für Wirkstoffe International Conference on Harmonization (ICH) ICH Q7A Good Manufacturing Practice for Active Pharmaceutical Ingredients CPMP/ICH/4106/00 Englisches Original und deutsche Übersetzung
Schutzgebühr: 24,80 zzgl. 19 % MwSt. Die herausgebende Stelle. systemqm e.v. Barbarossa-Str Annweiler
 Manual internes Qualitätsmanagement für n in Orientierung an den Kriterien der nbetriebsordnung und der DIN EN ISO 9001:2015 Version 1.1 - Datum: 16.03.2016 Seite 1 von 26 Die herausgebende Stelle systemqm
Manual internes Qualitätsmanagement für n in Orientierung an den Kriterien der nbetriebsordnung und der DIN EN ISO 9001:2015 Version 1.1 - Datum: 16.03.2016 Seite 1 von 26 Die herausgebende Stelle systemqm
QM nach DIN EN ISO 9001:2015. copyright managementsysteme Seiler Tel:
 QM nach DIN EN ISO 9001:2015 1 copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 2 Prozessplanung copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 3 Kennzahlen im Unternehmen 48 Lieferzeit
QM nach DIN EN ISO 9001:2015 1 copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 2 Prozessplanung copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 3 Kennzahlen im Unternehmen 48 Lieferzeit
Erfahrungen aus der Zertifizierung
 DGSV-Kongress 2010 08.10.2010, Fulda Erfahrungen aus der Zertifizierung von Qualitätsmanagement-Systemen nach DIN EN ISO 13485 für die Aufbereitung von Medizinprodukten Dr. Thomas Kießling Sachverständiger
DGSV-Kongress 2010 08.10.2010, Fulda Erfahrungen aus der Zertifizierung von Qualitätsmanagement-Systemen nach DIN EN ISO 13485 für die Aufbereitung von Medizinprodukten Dr. Thomas Kießling Sachverständiger
Umweltmanagementsysteme / ISO 14001: Bedeutung, Prinzipien & Funktionsweise
 IKAÖ/Universität Bern Minor Allgemeine Ökologie, VL Umweltmanagement: Betriebs- und volkswirtschaftlich, Teil 2 Umweltmanagementsysteme / ISO 14001: Bedeutung, Prinzipien & Funktionsweise Dr. Jost Hamschmidt,
IKAÖ/Universität Bern Minor Allgemeine Ökologie, VL Umweltmanagement: Betriebs- und volkswirtschaftlich, Teil 2 Umweltmanagementsysteme / ISO 14001: Bedeutung, Prinzipien & Funktionsweise Dr. Jost Hamschmidt,
VDI Raumlufttechnik, Raumluftqualität Hygieneanforderungen an Raumlufttechnische Anlagen und Geräte
 VDI 6022 Raumlufttechnik, Raumluftqualität Hygieneanforderungen an Raumlufttechnische Anlagen und Geräte Dipl.-Ing. Clemens Schickel Technischer Referent BTGA e.v. 1 - Historie - Übersicht zum aktuellen
VDI 6022 Raumlufttechnik, Raumluftqualität Hygieneanforderungen an Raumlufttechnische Anlagen und Geräte Dipl.-Ing. Clemens Schickel Technischer Referent BTGA e.v. 1 - Historie - Übersicht zum aktuellen
TEIL 1 allgemeiner Teil
 TEIL 1 allgemeiner Teil Einleitung 0 Einleitung 0 Einleitung 0 Einleitung Einleitung 0 Allgemeines 0.1 Hintergrund 0.1 Hintergrund 0.1 Allgemeines 0.1 Grundsätze des Qualitätsmanagements 0.2 Ziel eines
TEIL 1 allgemeiner Teil Einleitung 0 Einleitung 0 Einleitung 0 Einleitung Einleitung 0 Allgemeines 0.1 Hintergrund 0.1 Hintergrund 0.1 Allgemeines 0.1 Grundsätze des Qualitätsmanagements 0.2 Ziel eines
Ansicht Anzeigen Haken bei Führungslinien setzten Start Folien Zurücksetzen Basiswissen GMP
 Basiswissen GMP Inhalt: Vorgaben Gesetzliche Grundlagen Vorschriften B-CH SRK Vereinbarungen mit Fraktionierern GMP Bedeutung/Definition Was ist GMP? Was regelt GMP? Was machen wir damit? Swiss Transfusion
Basiswissen GMP Inhalt: Vorgaben Gesetzliche Grundlagen Vorschriften B-CH SRK Vereinbarungen mit Fraktionierern GMP Bedeutung/Definition Was ist GMP? Was regelt GMP? Was machen wir damit? Swiss Transfusion
Kurzpräsentation. PROSYS Industrial Solutions Group
 Kurzpräsentation PROSYS Industrial Solutions Group Firmenprofil PROSYS Firmengruppe in Zahlen: 70 Mitarbeiter weltweit 9 Mio. EUR durchschnittlicher Umsatz Seit 1990 weltweit innovative und effiziente
Kurzpräsentation PROSYS Industrial Solutions Group Firmenprofil PROSYS Firmengruppe in Zahlen: 70 Mitarbeiter weltweit 9 Mio. EUR durchschnittlicher Umsatz Seit 1990 weltweit innovative und effiziente
Lernzielkatalog für das Modul Qualitätsmanagement
 Lernzielkatalog für das Modul Qualitätsmanagement Kapitel 1 - Qualität gewinnt an Bedeutung 1. Die Bedürfnispyramide von Maslow erklären können. Herrmann/Fritz S. 2f. Kapitel 2 - Qualität managen 2. Die
Lernzielkatalog für das Modul Qualitätsmanagement Kapitel 1 - Qualität gewinnt an Bedeutung 1. Die Bedürfnispyramide von Maslow erklären können. Herrmann/Fritz S. 2f. Kapitel 2 - Qualität managen 2. Die
EINFÜHRUNG UND UMSETZUNG
 Thema DIN EN ISO 9001:2000 EINFÜHRUNG UND UMSETZUNG 1 Agenda Allgemein 9000:2000 Das neue Normenkonzept Umsetzung 2 Allgemein 3 Allgemein Warum neue Normen? 4 Allgemein Warum neue Normen? Überprüfungszyklus
Thema DIN EN ISO 9001:2000 EINFÜHRUNG UND UMSETZUNG 1 Agenda Allgemein 9000:2000 Das neue Normenkonzept Umsetzung 2 Allgemein 3 Allgemein Warum neue Normen? 4 Allgemein Warum neue Normen? Überprüfungszyklus
ISO 9001: vom Praktiker für Praktiker. Bearbeitet von Norbert Waldy
 ISO 9001: 2015 vom Praktiker für Praktiker Bearbeitet von Norbert Waldy 1. Auflage 2015. Buch. 168 S. Hardcover ISBN 978 3 7323 3353 0 Format (B x L): 14 x 21 cm Gewicht: 385 g Wirtschaft > Management
ISO 9001: 2015 vom Praktiker für Praktiker Bearbeitet von Norbert Waldy 1. Auflage 2015. Buch. 168 S. Hardcover ISBN 978 3 7323 3353 0 Format (B x L): 14 x 21 cm Gewicht: 385 g Wirtschaft > Management
Verfahrensanweisung Umgang_mit_Einspruechen.doc INHALT
 INHALT 1 Zweck und Anwendungsbereich 2 2 Begriffe / Definitionen 2 2.1 Definitionen 2 3 Zuständigkeiten 2 4 Verfahrensbeschreibung 3 4.1 Beschreibung 3 4.1.1 Erfassung 3 4.1.2 Vertraulichkeit 3 4.1.3 Information
INHALT 1 Zweck und Anwendungsbereich 2 2 Begriffe / Definitionen 2 2.1 Definitionen 2 3 Zuständigkeiten 2 4 Verfahrensbeschreibung 3 4.1 Beschreibung 3 4.1.1 Erfassung 3 4.1.2 Vertraulichkeit 3 4.1.3 Information
