3. Material und Methoden
|
|
|
- Elisabeth Kruse
- vor 7 Jahren
- Abrufe
Transkript
1 3. Material und Methoden 3.1. Untersuchungsmaterial und Versuchsaufteilung Die Untersuchungen im Rahmen dieser Arbeit gliederten sich in vier Abschnitte. Für jeden Versuchsabschnitt wurden die Cumulus-Oozyten-Komplexe (COK) in vier Klassen eingeteilt. Jeweils 7 Maturationszeiten (0, 4, 8, 12, 16, 20 und 24 Stunden) wurden in den ersten drei Abschnitten berücksichtigt. Im letzten Teil erfolgte die Untersuchung der Entwicklungsfähigkeit in vitro von COK der verschiedenen Klassen bis zur Blastozyste. Der erste Abschnitt umfasste die Beurteilung der Chromatinkonfiguration in den Oozyten sowie die Beurteilung der Aktivität und Aggregation von Mitochondrien im Ooplasma. An einer Oozyte konnten jeweils alle drei Parameter erhoben werden. Für die Durchführung des ersten Abschnittes wurden insgesamt 1473 Cumulus-Oozyten-Komplexe verwendet. Im zweiten Abschnitt erfolgte die Beurteilung des Apoptoseverlaufes während der IVM in Cumuluszellen. Für diese Untersuchung wurden 855 Cumulus-Oozyten-Komplexe isoliert. Die Auswertung im Rahmen dieser Untersuchung erfolgte an Cumuluszellen. Der dritte Versuchsabschnitt war auf die Bestimmung von Caspase-3 im Ooplasma und in den Cumuluszellen gerichtig (n=140 COK). Für die Untersuchungen zur Entwicklungskompetenz im vierten Abschnitt wurden 1106 Oozyten verschiedener COK-Klassen in vitro gereift, befruchtet und kultiviert. Für alle 4 Versuchsabschnitte wurden zur experimentellen Bearbeitung insgesamt 3574 Cumulus-Oozyten-Komplexe genutzt. Es wurden ausschließlich Ovarien und Cumulus-Oozyten-Komplexe geschlachteter Rinder für die Durchführung der Versuche verwendet. Die Probennahme und die Probenvorbereitung wurden auf dem Schlachthof Erlangen und im Embryotransfer-Labor des Besamungsvereins Neustadt an der Aisch e.v. durchgeführt. Die Auswertungen wurden zum Teil im Forschungsinstitut für die Biologie landwirtschaftlicher Nutztiere in Dummerstorf durchgeführt. Die Zusammensetzung und Herstellung der verwendeten Medien ist im Anhang unter Kapitel 9.1. aufgeführt. Die Abbildung 1 verdeutlicht die Durchführung der einzelnen Versuchsabschnitte. 55
2 Abb. 1 Versuchsabschnitte Gewinnung der Ovarien (Vieh- und Schlachthof Erlangen) Klassifizierung der COK (4 Klassen) 7 Maturationszeiten (0, 4, 8, 12, 16, 20, 24) Chromatinkonfiguration Aggregation und Aktivität der Mitochondrien Apoptoseverlauf in Cumuluszellen Caspase-3-Bestimmung im Ooplasma Entwicklungskompetenz Färbung mit MitoTracker Orange CMTMRos Färbung mit HOECHST In Situ Cell Death Detection Kit (Fa. Roche, Mannheim) Apoptosis Sampler Kit (Fa. New England Biolabs) Nutzung des IVP- Verfahrens nach BREM und BERG (1989) 3.2. Spendertiere Bei den Spendertieren handelte es sich zum größten Teil um Kühe und Jungrinder der Rasse Deutsches Fleckvieh. Ein geringer Anteil der Spendertiere entfiel auf die Rassen Deutsche Schwarzbunte und Gelbvieh. Es erfolgte keine Selektion der Spendertiere in Bezug auf Alter, Gewicht, Gesundheitszustand und Zyklusstand Entnahme der Ovarien Die Entnahme der Ovarien erfolgte für alle Versuchsabschnitte nach der gleichen Methode. Sie wird daher an dieser Stelle für alle weiteren Abschnitte beschrieben. Die für die Untersuchungen verwendeten Oozyten wurden aus den Ovarien geschlachteter Kühe gewonnen. Die Entnahme der Ovarien wurde auf dem Schlachthof Erlangen vorgenommen und erfolgte unmittelbar nach Eröffnen der Bauchhöhle ca. 15 Minuten nach dem Tod des Tieres. Die Entnahme wurde unter möglichst hygienischen Bedingungen mit Hilfe einer chirurgischen Schere vorgenommen. Es wurden nur Ovarien ohne pathologische Veränderungen entnommen. 56
3 Unmittelbar nach der Entnahme wurden die Ovarien in ein mitgeführtes Thermogefäß mit physiologischer Kochsalzlösung (30-37 C) überführt. Innerhalb von max. drei Stunden nach der Entnahme erfolgte die weitere Bearbeitung der Ovarien im Labor Gewinnung und Klassifizierung der Cumulus-Oozyten- Komplexe (COK) Die Gewinnung der Cumulus-Oozyten-Komplexe (COK) erfolgte im Labor des Besamungsvereins Neustadt an der Aisch e.v. mit Hilfe der Slicing-Methode. Die Ovarien wurden mit einer Arterienklemme in einer Petrischale aus Borosilikatglas mit einem Durchmesser von 14,5 cm (Fa. Roth, Karlsruhe) fixiert. Der Boden der Petrischale wurde zu Beginn des Slicing-Vorganges mit 37 C warmer modifizierter phosphatgepufferter Salzlösung nach Dulbecco (mpbs; Fa. Biochrom, Berlin) bedeckt. Danach wurden die Ovarien beidseitig gleichmäßig mit Hilfe eines Mehrfachmessers in Längsrichtung durchschnitten. Das Mehrfachmesser bestand aus 5-6 parallel angeordneten Rasierklingen (Fa. Goldhand, Düsseldorf). Nach dem Durchschneiden der Ovaroberfläche wurde diese gründlich mit mpbs gespült. Die gewonnene Flüssigkeit wurde nun zur Entfernung der groben Gewebebestandteile durch ein handelsübliches Teesieb in ein Becherglas mit einem Volumen von 600 ml (Fa. Roth, Karlsruhe) überführt. Die Wände und der Boden des Becherglases wurden zuvor mit warmer mpbs-lösung benetzt. Anschließend erfolgte eine Filtration, der im Becherglas befindlichen Flüssigkeit mit Hilfe eines Prüfsiebes (Durchmesser 100mm, Maschenweite 75µm; Fa. Jürgens, Hannover). Die aufgefangenen Gewebepartikel wurden nun gründlich mit warmer mpbs-lösung gespült. Das Filtrat wurde nach gründlichen Spülungen des Rückstandes und der Siebmaschen in eine gerasterte Petrischale (90mm; Fa. Greiner, Frickenhausen) dekantiert. Der Boden der Petrischale wurde zuvor mit warmer mpbs-lösung benetzt. Abschließend wurde das Filtrat mit warmer mpbs-lösung aufgeschwemmt und die Petrischale auf einer 37 C warmen Wärmeplatte aufbewahrt. Das Aufsuchen der COK erfolgte unter einem Stereomikroskop (SMZ 800; Fa. Nikon, Düsseldorf) bei 15facher Vergrößerung. Aus der Rasterschale wurden die COK in eine 4- Well-Schale (Fa. Nunc, Dänemark) überführt. Jede Vertiefung der 4-Well-Schale enthielt 500 µl TCM199 (Tissue culture medium 199, s. Kapitel 9.1) + 10% ECS (oestrous cow serum) und 15 µl FSH Lösung ovinen Ursprungs (Ovagen, Fa. Bondico, Alkmaar, Holland). Bei der 57
4 Überführung der COK wurden diese direkt klassifiziert und entsprechend ihrer Einteilung in die Vertiefung 1-4 der 4-Well-Schale übertragen. Die Einteilung der COK erfolgte in vier Klassen. Sie richtete sich nach der morphologischen Beschaffenheit von Ooplasma und umgebenen Cumuluszellen. Die Beurteilung erfolgte unter dem Stereomikroskop bei 15facher Vergrößerung. Tab. 10 Klassifizierung der Cumulus-Oozyten-Komplexe Klasse 1 Klasse 2 Klasse 3 Klasse 4 Oozyten mit dunklem, homogenem Ooplasma und kompaktem Cumulus oophorus Oozyten mit dunklem, homogenem Ooplasma und aufgelockertem Cumulus oophorus Oozyten mit dunklem, homogenem oder granuliertem Ooplasma und expandiertem Cumulus oophorus mit Clusterbildung Oozyten mit dunklem, homogenem oder granuliertem Ooplasma und mit geringem oder fehlendem Cumulus oophorus a b c d Abb. 2 COK-Klassen a: Oozyte mit kompaktem Cumulus o. (Klasse I), b: Oozyte mit aufgelockertem Cumulus o. (Klasse II) c: Oozyte mit expandiertem Cumulus o. (Klasse III), d: denudierte Oozyte (Klasse IV) 3.5. In-vitro-Reifung (IVM) der Cumulus-Oozyten-Komplexe Nach Beendigung des Aufsuchens der COK und deren Klassifizierung erfolgte das Umsetzen der COK in eine Waschschale. Als Waschschale diente eine 4-Well-Schale. In jede der vier Vertiefungen der Schale wurden 500 µl TCM 199, sowie 15 µl FSH-Lösung ovinen Ursprungs (Ovagen ; Fa. Bondico, Alkmaar, Holland) pipettiert. Nach diesem Waschschritt erfolgte das Umsetzen der COK in die Reifungsschale. Hier handelte es sich ebenfalls um eine 4-Well-Schale. In jede der 4 Vertiefungen der Schale wurden 500 µl 58
5 TCM 199, sowie 15 µl FSH-Lösung pipettiert und mit 200 µl Mineralöl (Fa. Sigma, Steinheim) überschichtet. Die Sammelschale, die Waschschale und je eine Reifungsschale pro Maturationszeit wurden ca. 4 Stunden vor der Verwendung vorbereitet und im Brutschrank bei einer Temperatur von 39 C in feuchtigkeitsgesättigter Atmosphäre bei einem Gasgehalt von 5% CO 2 in Luft äquilibriert. Die Reifungsdauer betrug 0, 4, 8, 12, 16, 20 bzw. 24 Stunden. Es wurden am Entnahmetag jeweils COK für 2 Maturationszeiten gewonnen. Das Umsetzen der COK erfolgte mit Hilfe der Pipettierhilfe MicroClassic (Fa. Brand, Wertheim) unter Verwendung von 20 µl Glaskapillaren (Fa. Heiland, Hamburg) Beurteilung der Chromatinkonfiguration in den Oozyten und Bestimmung der Aktivität und Verteilung von Mitochondrien im Ooplasma Bei dieser Untersuchung konnten 3 Parameter an dem COK-Material erhoben werden. Im Embryotransfer-Labor des Besamungsvereins Neustadt an der Aisch e.v. wurden die Probennahme sowie die Färbungen durchgeführt. Die fluoreszenzmikroskopische Auswertung der Proben erfolgte im Forschungsinstitut für die Biologie landwirtschaftlicher Nutztiere (FBN) in Dummerstorf. Die statistische Auswertung wurde ebenfalls im FBN Dummerstorf durchgeführt Anfärbung der Mitochondrien zur Bestimmung der Verteilung und Aktivität im Ooplasma Für die Anfärbung der Mitochondrien im Ooplasma wurde der Fluoreszenzfarbstoff MitoTracker Orange CMTMRos (Fa. Molecular Probes, Eugene, OR, USA) verwendet. Eigenschaften des Farbstoffes MitoTracker Orange CMTMRos Bei MitoTracker Orange CMTMRos handelt es sich um einen Fluoreszenzfarbstoff, der selektiv aktive Mitochondrien anfärbt. Der Farbstoff enthält eine thiolreaktive Chloromethyl- Gruppe. Diese Gruppe ermöglicht es, dass die Färbung auch nach einer Fixation mit Aldehyden bestehen bleibt. 59
6 Während der Inkubation der entsprechenden Zellen mit einer mikromolaren Menge Farbstoff, erfolgt ein passiver Transport der Farbstoffmoleküle durch die Plasmamembran und eine Akkumulation in den aktiven Mitochondrien. MitoTracker Orange CMTMRos ist ein Derivat des Tetramethylrosamin. Die Verbindung reagiert mit Thiolverbindungen von Proteinen und Peptiden der Atmungskette in den Mitochondrien (Produktinformation, Fa. Molecular Probes, Eugene, OR, USA) Herstellung der Färbelösung Zur Herstellung der Stammlösung wurde eine Ampulle MitoTracker Orange CMTMRos à 50 µg bei Zimmertemperatur aufgetaut und in 117 µl Dimethylsulfoxid (DMSO, Fa. Sigma, Steinheim) gelöst. Von der hergestellten Stammlösung wurden 10 µl in Tubes mit einem Fassungsvermögen von 0,2 ml (Fa. Eppendorf, Hamburg) abgefüllt. Die Tubes wurden in einem Kunststoffbehälter (Fa. Eppendorf, Hamburg) aufbewahrt, der mit Alufolie als Lichtschutz umwickelt wurde. Die Lagerung erfolgte bei 20 C. Die Stammlösung wurde vor Beginn der gesamten Versuchsreihe hergestellt und abgefüllt. Die Färbelösung wurde ca. 30 Minuten vor der Verwendung aus der Stammlösung hergestellt. Eine Ampulle der Stammlösung à 10 µl wurde mit Alufolie umwickelt und bei Zimmertemperatur aufgetaut. Nach dem Auftauen wurden 2 µl Stammlösung in 4 ml modifizierter PBS-Lösung (mpbs) in einem Zentrifugenröhrchen gelöst. Das Zentrifugenröhrchen wurde ebenfalls mit Alufolie als Lichtschutz umwickelt. Durch leichtes Schwenken des Röhrchens wurde die Stammlösung in der mpbs-lösung verteilt. Anschließend wurden in jede Vertiefung einer 4-Well-Schale 500 µl der fertigen Färbelösung (200nM) pipettiert. Die 4-Well-Schale wurde mit Alufolie umwickelt, mit einer Styroporschale abgedeckt und auf einer 37 C warmen Wärmeplatte bis zur Verwendung gelagert. Entfernung des Cumulus oophorus Die Entfernung des Cumulus oophorus erfolgte mit 0,3% Na-Citrat (Fa, Sigma, Steinheim). Das Na- Citrat wurde ca. ½ Stunde vor Beginn des Färbevorganges aus dem Kühlschrank genommen und bei Raumtemperatur erwärmt. Vier Probefläschchen mit Schraubverschluss (Borosilikatglas, 8 ml Fassungsvermögen, Fa. VWR, Nürnberg) wurden mit jeweils 2 ml Na-Citrat gefüllt. 1½ Stunden vor Ablauf der entsprechenden Maturationszeit wurden zunächst die COK der Klasse I aus der Kulturschale in ein Probenfläschchen überführt. Das mit Na-Citrat befüllte Probenfläschchen wurde nun ca. 1 Minute geschüttelt. Danach wurde der Inhalt des Fläschchens in eine Petrischale mit einem Durchmesser von 35 mm (Fa. Greiner bio-one, Frickenhausen) überführt. Das Fläschchen wurde nun mit 1 ml Na-Citrat ausgespült und der 60
7 Inhalt ebenfalls in die Petrischale geschüttet. Anschließend wurde die Petrischale unter dem Stereomikroskop (SMZ 800; Fa. Nikon, Düsseldorf) bei 15facher Vergrößerung durchsucht. Alle Oozyten die vollständig von Cumuluszellen befreit waren, wurden in die Vertiefung Nr. 1 einer 4-Well-Schale überführt. Jede Vertiefung dieser Waschschale enthielt 500 µl mpbs. Im Anschluss an diesen Waschschritt erfolgte ein erneutes Umsetzen in eine Waschschale mit 500 µl mpbs pro Vertiefung. Dieser Vorgang wurde mit den COK der weiteren Klassen wiederholt. Durchführung der Färbung mit MitoTracker Orange CMTMRos Nach den zwei Waschschritten erfolgte das Umsetzen der Eizellen in die Färbelösung MitoTracker Orange CMTMRos. Während des Pipettiervorganges wurde die Schale mit der Färbelösung weiterhin von einer Alufolie als Lichtschutz bedeckt. Die Oozyten verblieben für 30 Minuten bei 37 C unter Lichtschutz in der Färbelösung. Während der Färbezeit wurde die Fixation vorbereitet. In jede Vertiefung einer 4-Well-Schale (Fa. Nunc, Roskilde, Dänemark) wurden 500 µl 3%iges Paraformaldehyd (Fa. Sigma, Steinheim) pipettiert. Nach Ablauf der Färbezeit wurden die Oozyten unter Beibehaltung der Klassen zweimal in PBS-Lösung (phosphatgepufferte Salzlösung nach DULBECCO, nicht modifiziert) gewaschen. Die Waschschritte erfolgten ebenfalls in 4-Well-Schalen. Nach den Waschschritten wurden die Eizellen für 15 Minuten in 3%igem Paraformaldehyd fixiert. Die Fixation erfolgte nach Ablauf der entsprechenden Maturationszeit. Im Anschluss an die Fixation folgten wiederum drei Waschschritte in PBS-Lösung. Die ersten zwei Waschschritte wurden in 4-Well-Schalen durchgeführt. Der letzte Waschschritt erfolgte in einer viergeteilten Gewebekulturschale (Cellstar ; 35mm Durchmesser; Fa. Greiner bioone, Frickenhausen). Die Einteilungen der Gewebekulturschale enthielten 150 µl PBS- Lösung. Aus der Gewebekulturschale wurden die Eizellen unter Beibehaltung der Klassen auf Objektträger aufgebracht. Pro Objektträger (SuperFrost weiß, 76x26mm; Fa. Roth, Karlsruhe) wurden 2 x 5 Oozyten in jeweils ca. 10 µl PBS- aufgebracht. Im Anschluss erfolgte nun die Zugabe des Farbstoffes HOECHST (Fa. Sigma, Steinheim). Die fertige Färbelösung wurde vor Beginn der gesamten Versuchsreihe hergestellt, in einem mit Alufolie umwickeltem Zentrifugenröhrchen abgefüllt und bei 7 C gelagert. Ca. 10 Minuten vor der Verwendung wurde die Färbelösung aus dem Kühlschrank entnommen, geschwenkt und bis zur Verwendung bei Zimmertemperatur gelagert. Der Versuchsansatz ist zur Verdeutlichung in einem Schema dargestellt (Abb. 3). 61
8 Abb. 3 Versuchsschema Chromatinkonfiguration/Aggregation und Aktivität der Mitochondrien Entnahme der Ovarien Slicing Auffinden der COK Suchschale mit PBS- Sammelschale TCM + 10% ECS Maturationsschale TCM + 10% ECS + 3 % FSH + Mineralöl Entfernung des Cumulus oophorus mit Na-Citrat 2 Waschschritte in PBS- 30 Min. Inkubation mit MitoTracker CMTMRos bei 37 C, dunkel 2 Waschschritte in PBS- 15 Min. Fixation in 3%igem Paraformaldehyd bei 37 C 3 Waschschritte in PBS- Aufbringen von 2 x 5 Oozyten in ca. 10 µl PBS- auf einen Objektträger Aufbringen von 6 µl HOECHST in Form von 3 Tropfen á 2 µl neben den Tropfen PBS- Deckglas vorsichtig auflegen Ränder des Deckglases mit Nagellack versiegeln ca. 10 µl PBS- mit 5 Eizellen ca. 2 µl HOECHST
9 Anfärbung des Chromatin Die Chromatinfärbung erfolgte als Parallelfärbung zur Mitochondrienfärbung nach der Fixation der Oozyten. Die Herstellung des Farbstoffes wird unter Kapitel 9.1. beschrieben. Eigenschaften des Farbstoffes HOECHST Hoechst gehört zur Gruppe der Bisbenzimid-Farbstoffe. Es handelt sich um einen membrandurchgängigen Fluoreszenzfarbstoff, der spezifisch in der A-T-Region der DNA interkaliert. Diese Bindung führt zu einem Wechsel des Emissionsmaximums von 500 nach 460 nm. Der Farbstoff emittiert im blauen Bereich bei 450 nm und weist eine geringe Cytotoxizität auf. Durchführung der Färbung mit HOECHST Im Anschluss an die Fixation der Oozyten mit 3%igem Paraformaldehyd wurden 2 x 5 Oozyten einer Klasse in ca. 10 µl PBS-Lösung auf einen Objektträger (76 x 26 mm, SuperFrost, Fa. Roth, Karlsruhe) aufgebracht. Vor der Eindeckelung mit einem Deckgläschen (18 x 18 mm, Fa. Heiland, Hamburg) erfolgte die Zugabe des Farbstoffes Hoechst Insgesamt wurden pro 5 Eizellen 6 µl Farbstoff in Form von 3 kleinen Tropfen, die um die Eizellen positioniert wurden, verwendet. Nach Eindeckelung der Proben wurden die Deckgläschen durch einen handelsüblichen Nagellack an allen Seiten versiegelt und abgedunkelt bei 7 C gelagert. Fluoreszenzmikroskopische Auswertung der Chromatinkonfiguration Die Auswertung der Chromatinkonfiguration erfolgte an dem Fluoreszenzmikroskop Jenalumar (Fa. Carl Zeiss, Jena) bei 450 nm. Die Beurteilung der Chromatinkonfiguration in den Oozyten erfolgte nach dem Auftreten des Diplotäns, der Diakinese, Metaphase I, Anaphase I, Telophase I, Metaphase II, aktiviertes Chromatin und Degenerationsphasen in allen Meiosestadien. 63
10 Fluoreszenzmikroskopische Auswertung der mitochondrialen Verteilung und Messung der Aktivität Die Messung der mitochondrialen Aktivität erfolgte bei 570 nm (Emissionswellenlänge) mit einem Photomultiplyer P100 der Fa. Nikon, Düsseldorf bei 550 µv und 4-4,3 A. Es wurde zunächst die Hintergrundfluoreszenz bestimmt und anschließend die Aktivität der Mitochondrien. Die Hintergrundfluoreszenz wurde dann von dem Messergebnis der Mitochondrienaktivität subtrahiert, um die endgültige Intensität zu ermitteln. Die Auswertung der mitochondrialen Verteilung erfolgte ebenfalls mit dem Fluoreszenzmikroskop Jenalumar (Fa. Carl Zeiss, Jena) bei 570 nm. Die Verteilung der Mitochondrien wurde zunächst nach der Homogenität bzw. Heterogenität eingeteilt. Im Anschluß erfolgte eine spezifische Beschreibung der Verteilung in feinkörnig, grobkörnig und kristallin Beurteilung des Apoptoseverlaufes in Cumuluszellen während der In-vitro-Reifung Für die Untersuchung des Apoptoseverlaufes wurden die Oozyten und Cumuluszellen der COK-Klassen I-III verwendet Entfernung der Cumuluszellen nach der Reifung und Herstellung der Präparate zur Apoptosebestimmung Nach Ablauf der entsprechenden Maturationszeiten wurden die COK unter Beibehaltung der Klassen in eine 4-Well-Schale mit 500 µl Trypsin/EDTA (10%) in Hanks-Lösung pro Vertiefung umgesetzt. Nach einer Inkubationszeit von 2 Minuten wurde der Cumulus oophorus durch wiederholtes Pipettieren entfernt. Nach der Entfernung des Cumulus oophorus wurden die denudierten Eizellen entfernt und verworfen. Die Flüssigkeit mit den Cumuluszellen in den Vertiefungen der 4-Well-Schale wurde mit einer 500 µl-eppendorf-pipette aufgesogen und unter Beibehaltung der Klassen in Tubes (1,5 ml, Fa. Eppendorf, Hamburg) überführt. Jede Vertiefung der Schale wurde nun anschließend zweimal mit 500 µl PBS-Lösung ohne Ca/Mg gespült und die Flüssigkeit wurde ebenfalls wieder in Tubes überführt. 64
11 Die Tubes wurden 5 Minuten bei 2000 Umdrehungen/Min. (600g) zentrifugiert. Nach der Zentrifugation wurden 1000 µl der Flüssigkeit abgezogen und erneut 1000 µl PBS-Lösung ohne Ca/Mg zugegeben. Die Tubes wurden nun erneut 5 Minuten bei 2000 Umdrehungen zentrifugiert. Nach der zweiten Zentrifugation wurde die Flüssigkeit bis zur vorher gesetzten 60 µl-markierung abgezogen. Nach dem Resuspendieren der Cumuluszellen wurden 2 x 20 µl auf einen Poly-L-lysin beschichteten Objektträger (s. 9.1.) aufgetragen. Die aufgebrachten Tropfen wurden mit einer Pipettenspitze auf eine Größe von ca. 1 x 1 cm ausgezogen. Die Objektträger wurden bis zur Trocknung abgedeckt bei Raumtemperatur gelagert. Anschließend erfolgte die Lagerung horizontal bei 7 C Nachweis von Apoptose in Cumuluszellen durch Markierung von DNA-Strangbrüchen mit TdT (TUNEL) Eigenschaften der TUNEL-Färbung Während der Apoptose entstehen DNA-Strangbrüche. Diese können für die Identifizierung apoptotischer Zellen verwendet werden. Für die Untersuchung im Rahmen dieser Arbeit wurde der In Situ Cell Death Detection Kit, Fluorescein (Fa. Roche, Mannheim) verwendet. Dieser Kit identifiziert DNA-Strangbrüche durch enzymatische Markierung. Dabei werden freie 3 -OH-Enden der DNA mit fluoresceingekoppelten Nukleotiden markiert. Diese Reaktion wird durch das Enzym terminale Desoxynukleotidyl-Transferase katalysiert. Diese Reaktion wird beschrieben als TUNEL (TdT-mediated dutp nick end labeling) oder als ISEL (in situ end labeling). Der Vorteil dieser Methode besteht in der Identifizierung jeder einzelnen apoptotischen Zelle in einer frühen Phase ihrer Apoptose. Eigenschaften des Farbstoffes Propidiumiodid Propidiumiodid ist ein Fluoreszenzfarbstoff, der an Nukleinsäuren bindet und sowohl DNA als auch RNA anfärbt. Nach der Bindung steigt die Fluoreszenz auf das 20-30fache. Propidiumiodid kann die Zellmembran nicht passieren. Das Absorptionsmaximum von Propidiumiodid liegt bei 535 nm und das Emissionsmaximum bei 617 nm. 65
12 Fixierung und Permeabilisierung Die Herstellung der verwendeten Reagentien wird in Kapitel 9 beschrieben. Die auf dem Objektträger angetrockneten Cumuluszellen wurden zunächst 30 Minuten mit Paraformaldehyd (4%) bei Raumtemperatur fixiert. Nach der Fixation wurden die Präparate 2 x für 5 Minuten mit PBS-Lösung gespült. Anschließend erfolgte die Permeabilisierung mit TRITON X-100 (Fa. Sigma, Steinheim) für 2 Minuten auf Eis. Danach wurden die Präparate erneut 2 x für 5 Minuten mit PBS-Lösung gespült und am Rand gründlich getrocknet. TUNEL-Reaktion Für die Anwendung der TUNEL-Reaktion wurde nach Vorschrift des Herstellers verfahren. Die fixierten und permeabilisierten Cumuluszellen wurden mit 50 µl TUNEL reaction mixture pro markierten Zellen für 60 Minuten bei 37 C abgedunkelt in einer feuchten Kammer inkubiert. Gegenfärbung mit Propidiumiodid und Eindeckelung der Präparate Alle folgenden Schritte wurden im Dunkeln durchgeführt. Die Präparate wurden nach der Inkubation 1 x für 5 Minuten mit PBS-Lösung gespült. Anschließend erfolgte die Gegenfärbung mit Propidiumiodid für 20 Minuten bei Raumtemperatur. Es folgte ein erneuter Waschschritt mit PBS-Lösung für 5 Minuten. Danach wurden die Präparate in destilliertes Wasser eingetaucht und anschließend am Rand gründlich getrocknet. Vor dem Auflegen wurde auf die Deckgläschen 4 µl Moviol aufgetragen. Die Präparate wurden ca. 1 h im Dunkeln bei Raumtemperatur getrocknet und im Anschluss horizontal bei 7 C in einer Objektträgermappe gelagert Fluoreszenzmikroskopische Auswertung Die Auswertung des Apoptoseverlaufes in den Cumuluszellen erfolgte mit dem Fluoreszenzmikroskop Jenalumar (Fa. Carl Zeiss, Jena) bei 480 nm. Pro Untersuchungsfeld wurden 1000 Cumuluszellen ausgezählt. Rot bzw. orange gefärbte Zellen wurden als nicht apoptotisch gezählt und deutlich grün gefärbte Zellen als apoptotisch definiert. 66
13 3.8. Caspase-Bestimmung im Ooplasma und in den Cumuluszellen Herstellung und Lagerung der Präparate für die Caspasebestimmung in den Cumuluszellen Nach Ablauf der entsprechenden Reifungszeit wurden die COK unter Beibehaltung der Klassen in eine 4-Well-Schale mit 500 µl Trypsin/EDTA (10%) in Hanks-Lösung pro Vertiefung umgesetzt. Nach einer Inkubationszeit von 2 Minuten wurde der Cumulus oophorus durch wiederholtes Pipettieren entfernt. Nach der Entfernung des Cumulus oophorus wurden die denudierten Eizellen entfernt und unter Beibehaltung der Klassen in eine 4-Well-Schale mit 500 µl TCM % ECS überführt und bis zur weiteren Verwendung im Brutschrank bei 39 C und 5% CO 2 gelagert. Die Flüssigkeit mit den Cumuluszellen in den Vertiefungen der 4-Well-Schale wurde unter Beibehaltung der Klassen in Reaktionsgefäße (1,5 ml, Fa. Eppendorf, Hamburg) überführt. Jede Vertiefung der Schale wurde nun anschließend zweimal mit 500 µl PBS-Lösung ohne Ca 2+ /Mg 2+ gespült und die Flüssigkeit wurde ebenfalls wieder in Reaktionsgefäße überführt. Die Reaktionsgefäße wurden 5 Minuten bei 2000 Umdrehungen/Min. (600g) zentrifugiert. Nach der Zentrifugation wurde das Zellsediment mit 1 ml PBS-Lösung ohne Ca 2+ /Mg 2+ 2 x gewaschen. Nach der zweiten Zentrifugation wurde der Überstand bis zur vorher gesetzten 40 µl-markierung abgezogen und verworfen. Nach dem Resuspendieren der Cumuluszellen wurden die Reaktionsgefäße bei 20 C bis zur weiteren Analyse gelagert. Herstellung und Lagerung der Präparate für die Caspase-Bestimmung im Ooplasma Die denudierten Oozyten (s ) wurden aus dem Brutschrank entnommen und anschließend in einer 4-Well-Schale mit 500 µl TCM % ECS gewaschen. Die Entfernung des eventuell verbliebenen Cumulus oophorus der Klassen I-III erfolgte mit 0,3% Na-Citrat (Fa. Sigma, Steinheim). Das Na- Citrat wurde ca. ½ Stunde vor Beginn des Färbevorganges aus dem Kühlschrank entnommen und bei Raumtemperatur erwärmt. Vier Probefläschchen mit Schraubverschluss (Borosilikatglas, 8 ml Fassungsvermögen, Fa. VWR, Nürnberg) wurden mit jeweils 2 ml Na-Citrat gefüllt. 90 Minuten vor Ablauf der entsprechenden Reifungszeit wurden zunächst die COK der Klasse I aus der Kulturschale in ein Probenfläschchen überführt. Das mit Na-Citrat befüllte 67
14 Probenfläschchen wurde nun ca. 1 Minute geschüttelt. Danach wurde der Inhalt des Fläschchens in eine Petrischale mit einem Durchmesser von 35 mm (Fa. Greiner bio-one, Frickenhausen) überführt. Das Fläschchen wurde nun mit 1 ml Na-Citrat ausgespült und der Inhalt ebenfalls in die Petrischale verbracht. Anschließend wurde die Petrischale unter dem Stereomikroskop (SMZ 800; Fa. Nikon, Düsseldorf) bei 15facher Vergrößerung durchsucht. Alle Oozyten die vollständig von Cumuluszellen befreit waren, wurden in die Vertiefung Nr. 1 einer 4-Well-Schale überführt. Jede Vertiefung dieser Waschschale wurde mit 500 µl PBS- Lösung befüllt. Dieser Vorgang wurde mit den COK der Klassen II-III wiederholt. Anschließend wurde eine Petrischale (Durchmesser 14,5 cm, Fa. Roth, Karlsruhe) mit Hilfe eines Farbstiftes in vier Felder unterteilt. In Feld Nr. 1 wurden 4 Tropfen Polyvinylalkohol (Fa. Sigma, Steinheim) á 200 µl aufgetragen. Auf die Felder 2-4 wurden jeweils 4 Tropfen PBS- Lösung á 200 µl pipettiert. Die Oozyten wurden nun unter Beibehaltung der Klassen zunächst für 2 Minuten in Polyvinylalkohol inkubiert. Anschließend erfolgten Waschschritte in PBS-Lösung in Feld 2, Feld 3 und Feld 4. Aus den Waschtropfen in Feld 4 wurden die Oozyten in jeweils 5 µl PBS- Lösung in Reaktionsgefäße (Fa. Eppendorf, Hamburg) überführt und bei 20 C bis zur weiteren Verwendung gelagert. Die Abbildung 4 verdeutlicht die gesamte Probenbearbeitung dieses Versuchsabschnittes. Herstellung und Lagerung der Präparate für die Caspase-3-Bestimmung in Cumulus- Oozyten-Komplexen (COK) Für die Bestimmung der Caspase-3 in kompletten COK wurden die COK unter Beibehaltung der Klassen nach der entsprechenden Reifungszeit 2 x in PBS-Lösung ohne Ca 2+ /Mg 2+ gewaschen. Anschließend wurden jeweils 10 bzw. 20 COK jeder Klasse in ca. 5 µl PBS- Lösung ohne Ca 2+ /Mg 2+ in Reaktionsgefäße überführt und bis zur biochemischen Analyse bei -20 C gelagert. 68
15 Abb. 4 Schema der Probenbearbeitung für die Caspase-3-Bestimmung COK-Entnahme aus der Suchschale Überführung in eine Sammelschale mit TCM % ECS 2 Waschschritte in TCM % ECS + 15 µl FSH Maturation über 0, 4, 8, 12, 16, 20 oder 24h in TCM % ECS + 15 µl FSH + Mineralöl Waschschritt in TCM % ECS Entfernung des Cumulus oophorus in Trypsin Oozyten Cumuluszellen 2 Waschschritte in Grundmedium + 10% ECS Entfernung der restlichen Cumuluszellen durch Schütteln in 2 ml Na-Citrat, Auffangen der Oozyten, Fläschchen mit 1000 µl Na-Citrat spülen Cumuluszellen aus Vertiefung in Tube überführen, Vertiefung 2 x mit PBS ohne Ca/Mg spülen Zentrifugieren 1000 µl Flüssigkeit abziehen, 1000 µl PBS ohne Ca/Mg zugeben, resuspendieren Zentrifugieren Aufsuchen der denudierten Oozyten in einer kleinen Petrischale Überstand bis zur 40 µl- Markierung abziehen, resuspendieren Waschschritt in PBS Tubes bei -20 C lagern 2 Minuten Inkubation in Polyvinylalkohol 3 Waschschritte in PBS 10 Oozyten in 5 µl PBS in Tubes überführen, bei 20 C lagern 69
16 Biochemische Techniken zur Analyse von Caspase-3 im Ooplasma Die biochemischen Untersuchungen wurden in der Arbeitsgruppe Biochemie des Forschungsbereiches Fortpflanzungbiologie des Forschungsinstituts für die Biologie landwirtschaftlicher Nutztiere Dummerstorf durchgeführt. Zur Auftrennung von Proteinen mittels SDS-PAGE wurden die Proben elektrophoretisch nach der Methode nach LAEMMLI (1970) behandelt. Die Zusammensetzung der verwendeten Gele befindet sich im Anhang 9.2. Der Nachweis der Proteine erfolgte mittels Western Blotting. Die bei 80 C gelagerten Proben wurden zunächst aufgetaut und bei U/Minute zentrifugiert. Der entstandene Überstand wurde entfernt und das Zellsediment mit 10 µl Probenpuffer resuspendiert. Anschließend erfolgte das Auftragen des Probenmaterials auf 12%ige SDS-Gele. Die Elektrophorese wurde bei konstant 25 ma durchgeführt, bis die Bromophenolblaubande das untere Ende des Gels erreicht hatte. Nach Beendigung der Elektrophorese erfolgte die Übertragung der Proteine vom Gel auf eine PVDF-Membran (TOWBIN et al. 1979). Der Transfer erfolgte mittels eines semidry Elektroblotters, bei 1 ma pro cm 2 Membranfläche für 1 h. Nach dem Transfer wurden freie Bindungsstellen der Membran durch Inkubation in 5% fettfreier Trockenmilch in TTBS (1 h, bei Raumtemperatur) abgesättigt. Danach und nach jeder weiteren Inkubation wurde die Membran in TTBS 3 x für zehn Minuten bei Raumtemperatur gewaschen. Die Inkubation des ersten Antikörpers erfolgte bei einer Verdünnung von 1:1000 in TTBS über Nacht bei 4 C. Der zweite Antikörper (anti-kaninchen IgG, HRP-konjugiert) erfolgte für 90 Minuten bei Raumtemperatur. Für die Darstellung der Antigen-Antikörper-Reaktion auf der Membran wurde die Chemilumineszenzreaktion (ECL-Plus, Amersham Biosiences, Freiburg) verwendet. Die Proteinbanden wurden auf Röntgenfilm sichtbar gemacht. 70
17 3.9. Einschätzung der Entwicklungsfähigkeit der einzelnen COK-Klassen In-vitro-Fertilisation (IVF) Vorbereitung der Spermien durch das Swim-up-Verfahren Für die Fertilisation wurde tiefgefrierkonserviertes Sperma der für die IVF getesteten Fleckviehbullen Humid (Hb-Nr ) und Weinold (Hb-Nr ) von jeweils einem einzigen Ejakulat (Ejakulatnummer 2405 bzw. 705) verwendet. Die Aufbereitung der Spermien erfolgte nach dem Swim-up-Verfahren nach PARRISH et al. (1986). Eine Spermienportion (0,25 ml Paillette, Fa. Minitüb, Landshut) wurde für 100 Eizellen verwendet. Ca. 2 Stunden nach Ablauf der 24stündigen Reifungszeit der COK wurde die Spermienportion für 10 Sekunden in 38 C warmen Wasser aufgetaut. Anschließend wurden je 125µl der Spermienportion am Boden zweier Kryoröhrchen (1,5 ml, Fa. Nunc, Roskilde, Dänemark), die 1 ml Sperm-TALP (s. Kapitel 9.1.) enthielten, abgesetzt. Die Kryoröhrchen sowie ein leeres Zentrifugenröhrchen (Fa. Greiner bio-one, Frickenhausen) verblieben nun für 1 Stunde bei 39 C und 5% CO 2 in einem Winkel von 45 im Brutschrank. Nach Ablauf dieser Inkubationszeit wurden 800 µl des Mediums mit den motilen Spermien abgenommen und in das vorgewärmte Zentrifugenröhrchen überführt. Die Spermiensuspension wurde nun 10 Minuten bei 1000 Umdrehungen zentrifugiert. Anschließend wurde der Überstand bis zum Spermienpellet abgezogen und durch die gleiche Menge Sperm-TALP ersetzt. Es folgte eine erneute Zentrifugation für 10 Minuten bei 1000 Umdrehungen. Danach wurde der Überstand bis zum Spermienpellet abgezogen und das Pellet mit 40 µl Fert-TALP (s. Kapitel 9.1) resuspendiert. Die Spermiendichte wurde mit einer Zählkammer nach THOMA bestimmt und zur Berechnung des für die Befruchtung benötigten Volumens der Spermiensuspension herangezogen. Pro Befruchtungstropfen wurden ca Spermien eingesetzt. In-vitro-Fertilisation (IVF) der Oozyten Für die IVF wurde das Medium Fert-TALP verwendet. In einer Petrischale (30 mm Durchmesser, Fa. Greiner, bio-one, Frickenhausen) wurden 4 Tropfen á 60 µl dieses Mediums aufgebracht und komplett mit Mineralöl (Fa. Sigma, Steinheim) überschichtet. Die Befruchtungstropfen wurden für mind. 2 Stunden im Brutschrank bei 39 C, 5% CO 2 und 95% Luftfeuchtigkeit äquilibriert. 71
18 Nach Ablauf der Reifungszeit von 24 Stunden wurden die COK unter Beibehaltung der Klassen in 200 µl Fert-TALP gewaschen und anschließend in die Befruchtungstropfen umgesetzt. Anschließend wurde das berechnete Volumen Spermiensuspension zugegeben und Oozyten und Spermien für 18 bis 22 h im Brutschrank inkubiert. In-vitro-Kultivierung (IVK) Nach 18 bis 22 Stunden wurden die Oozyten unter Beibehaltung der ursprünglichen Klassen in 200 µl Grundmedium + 10% ECS umgesetzt. Durch wiederholtes Pipettieren wurden die aufgelockerten Cumuluszellen und die abgestorbenen Spermien entfernt. Danach wurden die Oozyten unter Beibehaltung der Klassen in 200 µl TCM % ECS gewaschen und anschließend in eine 4-Well-Schale mit 500 µl TCM % ECS + Mineralöl überführt. Am 4. und 6. Tag der Kultivierung wurden in jede Vertiefung der Kultivierungsschale 100 µl Grundmedium + 10% ECS pipettiert. Beurteilung der Teilungs- und Entwicklungsstadien Am 3. Tag nach der Kultivierung wurde die Anzahl der befruchteten Oozyten ermittelt und die Teilungsrate berechnet. Dazu wurden alle Oozyten/Embryonen unter dem Stereomikroskop bei 30facher Vergrößerung beurteilt und der Prozentsatz an Embryonen mit mindestens 2 gleichmäßigen Blastomeren bestimmt. Die Blastozystenrate wurde an den Tagen 7, 8 und 9 ermittelt. Die Beurteilung erfolgte in Anlehnung an KAUFFOLD und THAMM (1985) Statistische Auswertungen Die statistischen Berechnungen wurden mit SAS Version 9.13 (SAS 2004) durchgeführt. Die statistischen Masszahlen sowie die prozentualen Häufigkeiten wurden mit den Prozeduren MEANS und FREQ aus SAS/Base (SAS 2004) berechnet. Für die Merkmale prozentuale Häufigkeiten der Chromatinkonfiguration und mitochondriale Aggregation wurden verschiedene Modelle mit der Prozedur GENMOD aus SAS/STAT 9.1 (SAS 2004b) ausgewertet. Kontraste interessierender Häufigkeiten wurden getestet. Für das Merkmal Aktivität wurden für die verschiedenen Modelle Varianzanalysen (ANOVA) durchgeführt. Zusätzlich wurden alle LS-Mittelwerte der entsprechenden Stufen der interessierenden Effekte in den verschiedenen Modellen paarweise verglichen. Die Vergleiche und ANOVAs wurden mit der Prozedur GLM aus SAS/STAT durchgeführt. 72
8.1. Zusammensetzung und Herstellung der verwendeten Medien für die In-vitro-Maturation, -Fertilisation und - Kultivierung
 8. Anhang 8.1. Zusammensetzung und Herstellung der verwendeten Medien für die In-vitro-Maturation, -Fertilisation und - Kultivierung 1.) Spüllösung (modifizierte PBS-Lösung) modifizierte PBS-Lösung 500
8. Anhang 8.1. Zusammensetzung und Herstellung der verwendeten Medien für die In-vitro-Maturation, -Fertilisation und - Kultivierung 1.) Spüllösung (modifizierte PBS-Lösung) modifizierte PBS-Lösung 500
SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen
 GEBRAUCHSANLEITUNG SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen (Kat.-Nr. 42177) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg
GEBRAUCHSANLEITUNG SERVA Streptavidin Agarose Resin Agarosematrix zur Affinitätsreinigung von biotinylierten Biomolekülen (Kat.-Nr. 42177) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7-69115 Heidelberg
Phalloidin-Färbung an kultivierten adhärenten Säugerzellen. Formaldehyd-Fixierung
 Phalloidin-Färbung an kultivierten adhärenten Säugerzellen Formaldehyd-Fixierung 2 Materialien Pinzetten Für das Handling der Zellen ist es empfehlenswert Pinzetten mit sehr feiner Spitze zu nutzen. Hier
Phalloidin-Färbung an kultivierten adhärenten Säugerzellen Formaldehyd-Fixierung 2 Materialien Pinzetten Für das Handling der Zellen ist es empfehlenswert Pinzetten mit sehr feiner Spitze zu nutzen. Hier
Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS
 Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS Von: Andreas Tschammer, Fachhochschule Aalen-Hochschule f. Technik und Wirtschaft, Fachbereich Chemie, Schwerpunkt Molekulare Biotechnologie Material
Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS Von: Andreas Tschammer, Fachhochschule Aalen-Hochschule f. Technik und Wirtschaft, Fachbereich Chemie, Schwerpunkt Molekulare Biotechnologie Material
Immunofluoreszenz-Markierung an kultivierten adhärenten Säugerzellen. Methanol-Fixierung
 Immunofluoreszenz-Markierung an kultivierten adhärenten Säugerzellen Methanol-Fixierung 2 Materialien Pinzetten Für das Handling der Zellen ist es empfehlenswert Pinzetten mit sehr feiner Spitze zu nutzen.
Immunofluoreszenz-Markierung an kultivierten adhärenten Säugerzellen Methanol-Fixierung 2 Materialien Pinzetten Für das Handling der Zellen ist es empfehlenswert Pinzetten mit sehr feiner Spitze zu nutzen.
Western Blot. Zuerst wird ein Proteingemisch mit Hilfe einer Gel-Elektrophorese aufgetrennt.
 Western Blot Der Western Blot ist eine analytische Methode zum Nachweis bestimmter Proteine in einer Probe. Der Nachweis erfolgt mit spezifischen Antikörpern, die das gesuchte Protein erkennen und daran
Western Blot Der Western Blot ist eine analytische Methode zum Nachweis bestimmter Proteine in einer Probe. Der Nachweis erfolgt mit spezifischen Antikörpern, die das gesuchte Protein erkennen und daran
Nach dem Auftauen erfolgte die Kultivierung der Zellen zunächst in mit Gelatine-Lösung (Bacto Gelatine, 1,5% in PBS) beschichteten 6-Lochplatten.
 4 Methoden 4.1 Zellkultur 4.1.1 Kultivierung der Endothelzellen Nach dem Auftauen erfolgte die Kultivierung der Zellen zunächst in mit Gelatine-Lösung (Bacto Gelatine, 1,5% in PBS) beschichteten 6-Lochplatten.
4 Methoden 4.1 Zellkultur 4.1.1 Kultivierung der Endothelzellen Nach dem Auftauen erfolgte die Kultivierung der Zellen zunächst in mit Gelatine-Lösung (Bacto Gelatine, 1,5% in PBS) beschichteten 6-Lochplatten.
Praktikumsteil: Zellkultur und Fluoreszenzmikroskopie
 (Version: 2008 12 02) Praktikumsteil: Zellkultur und Fluoreszenzmikroskopie Darstellung und Untersuchung von Zellorganellen und Zytoskelettkomponenten Einleitung Der Lokalisation von Proteinen kommt in
(Version: 2008 12 02) Praktikumsteil: Zellkultur und Fluoreszenzmikroskopie Darstellung und Untersuchung von Zellorganellen und Zytoskelettkomponenten Einleitung Der Lokalisation von Proteinen kommt in
Bioanalytik-Vorlesung Western-Blot. Vorlesung Bioanalytik/ Westfälische Hochschule WS 1015/16
 Bioanalytik-Vorlesung Western-Blot Vorlesung Bioanalytik/ Westfälische Hochschule WS 1015/16 Western-Blot Western-Blot: Übertragung von elektrophoretisch aufgetrennten Proteinen auf eine Membran und Nachweis
Bioanalytik-Vorlesung Western-Blot Vorlesung Bioanalytik/ Westfälische Hochschule WS 1015/16 Western-Blot Western-Blot: Übertragung von elektrophoretisch aufgetrennten Proteinen auf eine Membran und Nachweis
SERVA Lightning Sci2. SERVA Lightning Sci3. SERVA Lightning Sci5. SERVA Lightning SciDye Set
 GEBRAUCHSANLEITUNG SERVA Lightning Sci2 (Kat.-Nr. 43404) SERVA Lightning Sci3 (Kat.-Nr. 43405) SERVA Lightning Sci5 (Kat.-Nr. 43406) SERVA Lightning SciDye Set (Kat.-Nr. 43407) Fluoreszenzfarbstoffe für
GEBRAUCHSANLEITUNG SERVA Lightning Sci2 (Kat.-Nr. 43404) SERVA Lightning Sci3 (Kat.-Nr. 43405) SERVA Lightning Sci5 (Kat.-Nr. 43406) SERVA Lightning SciDye Set (Kat.-Nr. 43407) Fluoreszenzfarbstoffe für
SERVA ProteinStain Fluo-Y Sensitive Fluoreszenz-Proteinfärbung für Polyacrylamidgele
 GEBRAUCHSANLEITUNG SERVA ProteinStain Fluo-Y Sensitive Fluoreszenz-Proteinfärbung für Polyacrylamidgele (Kat.-Nr. 35092) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7 - D-69115 Heidelberg Phone +49-6221-138400,
GEBRAUCHSANLEITUNG SERVA ProteinStain Fluo-Y Sensitive Fluoreszenz-Proteinfärbung für Polyacrylamidgele (Kat.-Nr. 35092) SERVA Electrophoresis GmbH - Carl-Benz-Str. 7 - D-69115 Heidelberg Phone +49-6221-138400,
Immunofluoreszenz-Markierung an kultivierten adhärenten Säugerzellen. Formaldehyd-Fixierung
 Immunofluoreszenz-Markierung an kultivierten adhärenten Säugerzellen Formaldehyd-Fixierung 2 Materialien Pinzetten Für das Handling der Zellen ist es empfehlenswert Pinzetten mit sehr feiner Spitze zu
Immunofluoreszenz-Markierung an kultivierten adhärenten Säugerzellen Formaldehyd-Fixierung 2 Materialien Pinzetten Für das Handling der Zellen ist es empfehlenswert Pinzetten mit sehr feiner Spitze zu
3,58 g 0,136 g. ad 100 ml
 9 Anhang 9.1 Rezepturen der Puffer und Lösungen 9.1.1 Vorbereitung der Proben zur Extraktion Coon s-puffer (0,1 M, ph 7,2-7,6) Na 2 HPO 4 x 12 H 2 O KH 2 PO 4 Aqua dest. 3,58 g 0,136 g 8,77 g 9.1.2 Aufbereitung
9 Anhang 9.1 Rezepturen der Puffer und Lösungen 9.1.1 Vorbereitung der Proben zur Extraktion Coon s-puffer (0,1 M, ph 7,2-7,6) Na 2 HPO 4 x 12 H 2 O KH 2 PO 4 Aqua dest. 3,58 g 0,136 g 8,77 g 9.1.2 Aufbereitung
2) Mischen Sie daraufhin das Ligationsprodukt zusammen. Dazu werden 50 µl Zellen und 2 µl Plasmid zusammengegeben
 Translation of lab protocols Transformation Protocol 1) Stellen Sie die kompetenten Zellen auf Eis 2) Mischen Sie daraufhin das Ligationsprodukt zusammen. Dazu werden 50 µl Zellen und 2 µl Plasmid zusammengegeben
Translation of lab protocols Transformation Protocol 1) Stellen Sie die kompetenten Zellen auf Eis 2) Mischen Sie daraufhin das Ligationsprodukt zusammen. Dazu werden 50 µl Zellen und 2 µl Plasmid zusammengegeben
der Blutzellen Separa der Isolation der mononuklear paration Blutausstrichs, Cytopreps und in Institut für Immunologie Biotechnologie
 Separa paration der Blutzellen Isolation der mononuklear learenen Zellenen aus dem Blut: Präparationation des Blutausstrichs, Cytopreps und der Anfärbung Universität Pécs, Fakult ultät für Medizin in Institut
Separa paration der Blutzellen Isolation der mononuklear learenen Zellenen aus dem Blut: Präparationation des Blutausstrichs, Cytopreps und der Anfärbung Universität Pécs, Fakult ultät für Medizin in Institut
Pflanze direkt 2x PCR-Mastermix
 Datenblatt Artikel-Nr. BS91.322.0250 Artikel-Nr. BS91.322.1250 250 Reaktionen in 20 μl 1250 Reaktionen in 20 μl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
Datenblatt Artikel-Nr. BS91.322.0250 Artikel-Nr. BS91.322.1250 250 Reaktionen in 20 μl 1250 Reaktionen in 20 μl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
Saturn-2D Labeling Kit Page 1
 2 Lagerung und Haltbarkeit Produktinformation Labeling Kit Product no. PR31, PR32, PR33 Weinbergweg 23 D-06120 Halle Technical Support Fon: +49 (0) 345-2799 6413 e-mail: service@dyeagnostics.com www.dyeagnostics.com
2 Lagerung und Haltbarkeit Produktinformation Labeling Kit Product no. PR31, PR32, PR33 Weinbergweg 23 D-06120 Halle Technical Support Fon: +49 (0) 345-2799 6413 e-mail: service@dyeagnostics.com www.dyeagnostics.com
Anlage zur Akkreditierungsurkunde D-ML nach DIN EN ISO 15189:2014
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-ML-17607-01-00 nach DIN EN ISO 15189:2014 Gültigkeitsdauer: 21.09.2015 bis 21.11.2017 Ausstellungsdatum: 21.09.2015 Urkundeninhaber:
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-ML-17607-01-00 nach DIN EN ISO 15189:2014 Gültigkeitsdauer: 21.09.2015 bis 21.11.2017 Ausstellungsdatum: 21.09.2015 Urkundeninhaber:
Protokoll Versuch 1: VDJ-Rekombination in humanen prä-b-zellen
 F2-Praktikum Genetik Protokoll Versuch 1: VDJ-Rekombination in humanen prä-b-zellen Gruppe 4 (Susanne Duncker, Kristin Hofmann) Einleitung Wir untersuchten in diesem Versuch die Effizienz der VDJ-Rekombination
F2-Praktikum Genetik Protokoll Versuch 1: VDJ-Rekombination in humanen prä-b-zellen Gruppe 4 (Susanne Duncker, Kristin Hofmann) Einleitung Wir untersuchten in diesem Versuch die Effizienz der VDJ-Rekombination
GEBRAUCHSANLEITUNG. Glutatione Agarose Resin
 GEBRAUCHSANLEITUNG Glutatione Agarose Resin Agarose zur Affinitätsreinigung von GST-Tag-Fusionsproteinen und anderen Glutathion-Bindungsproteinen (Kat.-Nr. 42172) SERVA Electrophoresis GmbH - Carl-Benz-Str.
GEBRAUCHSANLEITUNG Glutatione Agarose Resin Agarose zur Affinitätsreinigung von GST-Tag-Fusionsproteinen und anderen Glutathion-Bindungsproteinen (Kat.-Nr. 42172) SERVA Electrophoresis GmbH - Carl-Benz-Str.
AdnaTest OvarianCancerSelect
 AdnaTest OvarianCancerSelect Anreicherung von Tumorzellen aus dem Blut von Ovarialkrebspatientinnen zur Genexpressionsanalyse Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-526 Inhaltsverzeichnis Bestellinformation...
AdnaTest OvarianCancerSelect Anreicherung von Tumorzellen aus dem Blut von Ovarialkrebspatientinnen zur Genexpressionsanalyse Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-526 Inhaltsverzeichnis Bestellinformation...
Funktionelle Organisation des Zellkerns: DNA-Methylierung in Drosophila
 Funktionelle Organisation des Zellkerns: DNA-Methylierung in Drosophila 01.-04.03.04 Joachim Marhold, Regine Garcia Boy, Natascha Kunert, Cora Mund, Frank Lyko Programm 01.03.04: Präparation genomischer
Funktionelle Organisation des Zellkerns: DNA-Methylierung in Drosophila 01.-04.03.04 Joachim Marhold, Regine Garcia Boy, Natascha Kunert, Cora Mund, Frank Lyko Programm 01.03.04: Präparation genomischer
Blut DNA Mini Kit. Datenblatt. (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen: Farbe: Bio&SELL
 Datenblatt Artikel-Nr. BS44.711.0010 Artikel-Nr. BS44.711.0050 Artikel-Nr. BS44.711.0250 10 Präparationen 50 Präparationen 250 Präparationen (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens
Datenblatt Artikel-Nr. BS44.711.0010 Artikel-Nr. BS44.711.0050 Artikel-Nr. BS44.711.0250 10 Präparationen 50 Präparationen 250 Präparationen (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens
aktualisiert, 10.03.2011, Wera Roth, DE1 WESTERN BLOT
 1 aktualisiert, 10.03.2011, Wera Roth, DE1 WESTERN BLOT 1. Hinweise zu Membranen a. Nitrocellulose b. PVDF (alternativ) 2. Aufbau des Transfers a. Naßblot b. Semi-dry (alternativ) 3. Färben und Dokumentation
1 aktualisiert, 10.03.2011, Wera Roth, DE1 WESTERN BLOT 1. Hinweise zu Membranen a. Nitrocellulose b. PVDF (alternativ) 2. Aufbau des Transfers a. Naßblot b. Semi-dry (alternativ) 3. Färben und Dokumentation
Probe und Probenmenge Wassermenge Auftragspuffermenge 5 µl Kaninchenmuskelextrakt 50 µl 100 µl
 Arbeitsgruppe D 6 Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Kurs 3: Proteinanalysen Im heutigen Kurs extrahierten wir zum einen Proteine aus verschiedenen Geweben eines Kaninchens und führten
Arbeitsgruppe D 6 Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Kurs 3: Proteinanalysen Im heutigen Kurs extrahierten wir zum einen Proteine aus verschiedenen Geweben eines Kaninchens und führten
1. Proteinnachweis mit Bradford-Farbreagenz
 1. Proteinnachweis mit Bradford-Farbreagenz 96-well-Platte Pipetten (10, 20 und 200 µl) Pipettenspitzen Proteinvorratslösung (1 mg/ml Albumin in destillierten Wasser) Destilliertes Wasser Bradford Farbreagenz
1. Proteinnachweis mit Bradford-Farbreagenz 96-well-Platte Pipetten (10, 20 und 200 µl) Pipettenspitzen Proteinvorratslösung (1 mg/ml Albumin in destillierten Wasser) Destilliertes Wasser Bradford Farbreagenz
Blut DNA Midi Kit. Datenblatt. (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen: Farbe: Bio&SELL
 Datenblatt Artikel-Nr. BS44.721.0010 Artikel-Nr. BS44.721.0050 Artikel-Nr. BS44.721.0250 10 Präparationen 50 Präparationen 250 Präparationen (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens
Datenblatt Artikel-Nr. BS44.721.0010 Artikel-Nr. BS44.721.0050 Artikel-Nr. BS44.721.0250 10 Präparationen 50 Präparationen 250 Präparationen (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens
AdnaTest ColonCancerSelect
 AdnaTest ColonCancerSelect Anreicherung von Tumorzellen aus dem Blut von Darmkrebspatienten zur Genexpressionsanalyse Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-504 Inhaltsverzeichnis Bestellinformation...
AdnaTest ColonCancerSelect Anreicherung von Tumorzellen aus dem Blut von Darmkrebspatienten zur Genexpressionsanalyse Zur In-vitro-Diagnostik Gebrauchsanweisung T-1-504 Inhaltsverzeichnis Bestellinformation...
AdnaTest EMT-1/StemCellSelect
 AdnaTest EMT-1/StemCellSelect Anreicherung von Tumorzellen aus Blut zur Genexpressionsanalyse Nur für Forschungszwecke Gebrauchsanweisung T-1-533 Inhaltsverzeichnis Bestellinformation... 3 Anwendungszweck...
AdnaTest EMT-1/StemCellSelect Anreicherung von Tumorzellen aus Blut zur Genexpressionsanalyse Nur für Forschungszwecke Gebrauchsanweisung T-1-533 Inhaltsverzeichnis Bestellinformation... 3 Anwendungszweck...
en zum sicheren Einfrieren und Auftauen von Zellkulturen in TPP-Kryoröhrchen
 Empfehlung mpfehlungen en zum sicheren Einfrieren und Auftauen von Zellkulturen in TPP-Kryoröhrchen Information der Biochrom AG vom 23. Mai 2011 Zellkulturen können durch Kryokonservierung nahezu unbegrenzt
Empfehlung mpfehlungen en zum sicheren Einfrieren und Auftauen von Zellkulturen in TPP-Kryoröhrchen Information der Biochrom AG vom 23. Mai 2011 Zellkulturen können durch Kryokonservierung nahezu unbegrenzt
Einfluss von Anti-Inhibin und. Kokultursystemen auf die In-vitro- Maturation und Befruchtung von. Schweineeizellen
 Einfluss von Anti-Inhibin und Kokultursystemen auf die In-vitro- Maturation und Befruchtung von Schweineeizellen Manuela Ropeter-Scharfenstein Institut für Tierzucht und Haustiergenetik Universität Göttingen
Einfluss von Anti-Inhibin und Kokultursystemen auf die In-vitro- Maturation und Befruchtung von Schweineeizellen Manuela Ropeter-Scharfenstein Institut für Tierzucht und Haustiergenetik Universität Göttingen
RESOLUTION OENO 24/2004 NACHWEIS VON EIWEISSSTOFFEN PFLANZLICHER HERKUNFT IN WEIN UND MOST
 NACHWEIS VON EIWEISSSTOFFEN PFLANZLICHER HERKUNFT IN WEIN UND MOST DIE GENERALVERSAMMLUNG, unter Bezugnahme auf Artikel 2, Paragraf 2 IV des Gründungsübereinkommens vom 3. April 2001 der Internationalen
NACHWEIS VON EIWEISSSTOFFEN PFLANZLICHER HERKUNFT IN WEIN UND MOST DIE GENERALVERSAMMLUNG, unter Bezugnahme auf Artikel 2, Paragraf 2 IV des Gründungsübereinkommens vom 3. April 2001 der Internationalen
Immunhistochemische Färbung F Immunfluoreszenz. Vortrag Immunologie am von Christopher Tollrian
 Immunhistochemische Färbung F und Immunfluoreszenz Vortrag Immunologie am 22.05.2009 von Christopher Tollrian Inhalt Grundlagen Immunhistochemische Färbung Immunfluoreszenz Proben-Vorbereitung Methoden
Immunhistochemische Färbung F und Immunfluoreszenz Vortrag Immunologie am 22.05.2009 von Christopher Tollrian Inhalt Grundlagen Immunhistochemische Färbung Immunfluoreszenz Proben-Vorbereitung Methoden
Abbildung 1: Schematische Darstellung der Domänenorganisation von Survivin
 Abbildung 1: Schematische Darstellung der Domänenorganisation von Survivin Survivin weist eine N-terminale BIR-Domäne (grün) und eine C-terminale α-helix (blau) auf. Das intrinsische nuclear export signal
Abbildung 1: Schematische Darstellung der Domänenorganisation von Survivin Survivin weist eine N-terminale BIR-Domäne (grün) und eine C-terminale α-helix (blau) auf. Das intrinsische nuclear export signal
p53-menge bei 4197 nach Bestrahlung mit 4Gy Röntgenstrahlung 3,51 PAb421 PAb1801 PAb240 Do-1 Antikörper
 1.1 STRAHLENINDUZIERTE P53-MENGE 1.1.1 FRAGESTELLUNG Die Kenntnis, daß ionisierende Strahlen DNA Schäden verursachen und daß das Protein p53 an den zellulären Mechanismen beteiligt ist, die der Manifestation
1.1 STRAHLENINDUZIERTE P53-MENGE 1.1.1 FRAGESTELLUNG Die Kenntnis, daß ionisierende Strahlen DNA Schäden verursachen und daß das Protein p53 an den zellulären Mechanismen beteiligt ist, die der Manifestation
Anwendungsempfehlung für die kalte Lagerung von Zellen in ChillProtec
 Anwendungsempfehlung für die kalte Lagerung von Zellen in ChillProtec Information der Biochrom AG vom 09. Mai 2011 In dem neuen Schutzmedium ChillProtec überdauern adhärente Zellen, Zellsuspensionen oder
Anwendungsempfehlung für die kalte Lagerung von Zellen in ChillProtec Information der Biochrom AG vom 09. Mai 2011 In dem neuen Schutzmedium ChillProtec überdauern adhärente Zellen, Zellsuspensionen oder
ZytoFast EBV Probe (Biotin-markiert)
 ZytoFast EBV Probe (Biotin-markiert) T-1014-400 40 (0,4 ml) Zum Nachweis von Epstein-Barr-Virus (EBV) EBER RNA durch chromogene in situ Hybridisierung (CISH) Nur für Forschungszwecke bestimmt Biotin-markierte
ZytoFast EBV Probe (Biotin-markiert) T-1014-400 40 (0,4 ml) Zum Nachweis von Epstein-Barr-Virus (EBV) EBER RNA durch chromogene in situ Hybridisierung (CISH) Nur für Forschungszwecke bestimmt Biotin-markierte
Enzymatischer Eiweiß-Verdau Best.- Nr
 Enzymatischer Eiweiß-Verdau Best.- Nr. 200.9547 I. Materialzusammenstellung Die folgende Auflistung ermöglicht Ihnen die Vollständigkeit des erhaltenen Materials zu überprüfen oder zu kontrollieren, ob
Enzymatischer Eiweiß-Verdau Best.- Nr. 200.9547 I. Materialzusammenstellung Die folgende Auflistung ermöglicht Ihnen die Vollständigkeit des erhaltenen Materials zu überprüfen oder zu kontrollieren, ob
Praktikum Biochemie Einführung in die Molekularbiologie. Bettina Siebers
 Praktikum Biochemie Einführung in die Molekularbiologie Bettina Siebers Rekombinante Expression einer Esterase aus Pseudomonas aeruginosa in E. coli Polyacrylamide Gelelektrophorese (PAGE) Denaturierende
Praktikum Biochemie Einführung in die Molekularbiologie Bettina Siebers Rekombinante Expression einer Esterase aus Pseudomonas aeruginosa in E. coli Polyacrylamide Gelelektrophorese (PAGE) Denaturierende
KERNMODUL 3 ZELL- UND ENTWICKLUNGSBIOLOGISCHER KURS VL:
 KERNMODUL 3 ZELL- UND ENTWICKLUNGSBIOLOGISCHER KURS VL: 17 131 00032 SS2008 TEILSKRIPT: ENTWICKLUNGSBIOLOGIE BUTTGEREIT, DETLEV; RENKAWITZ-POHL, RENATE 1 VERSUCH 1: PRÄPARATION VON FURCHUNGSSTADIEN VON
KERNMODUL 3 ZELL- UND ENTWICKLUNGSBIOLOGISCHER KURS VL: 17 131 00032 SS2008 TEILSKRIPT: ENTWICKLUNGSBIOLOGIE BUTTGEREIT, DETLEV; RENKAWITZ-POHL, RENATE 1 VERSUCH 1: PRÄPARATION VON FURCHUNGSSTADIEN VON
Arbeitsprotokoll. Proteinanalytik. Stand
 Arbeitsprotokoll Stand 16. 07. 2003 Dieses Protokoll basiert auf folgenden Publikationen: Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels, Shevchenko A, Wilm M, Vorm O, Mann
Arbeitsprotokoll Stand 16. 07. 2003 Dieses Protokoll basiert auf folgenden Publikationen: Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels, Shevchenko A, Wilm M, Vorm O, Mann
DAC-Probe 10. Hochleistungsdünnschichtchromatographie (HPTLC) Einleitung. Allgemeine Angaben
 DAC-Probe 0 Probe_0 DAC-Probe 0 Hochleistungsdünnschichtchromatographie (HPTLC) Sofern in der Monographie nichts anderes angegeben ist, wird die Auftrennung mit den folgenden Angaben durchgeführt: es werden
DAC-Probe 0 Probe_0 DAC-Probe 0 Hochleistungsdünnschichtchromatographie (HPTLC) Sofern in der Monographie nichts anderes angegeben ist, wird die Auftrennung mit den folgenden Angaben durchgeführt: es werden
ZytoFast DNA (-) Control Probe
 ZytoFast DNA (-) Control Probe (Digoxigenin-markiert) T-1054-400 40 (0,4 ml) Zur Abschätzung der unspezifischen Hintergrundfärbung durch chromogene in situ Hybridisierung (CISH).... In-Vitro-Diagnostikum
ZytoFast DNA (-) Control Probe (Digoxigenin-markiert) T-1054-400 40 (0,4 ml) Zur Abschätzung der unspezifischen Hintergrundfärbung durch chromogene in situ Hybridisierung (CISH).... In-Vitro-Diagnostikum
Die Substratspezifität der Enzyme Trypsin und Chymotrypsin
 Die Substratspezifität der Enzyme Trypsin und Chymotrypsin Einleitung Die Proteine Trypsin und Chymotrypsin sind Enzyme, die im Magen von Säugetieren vorkommen und die Hydrolyse von Peptidbindungen katalysieren.
Die Substratspezifität der Enzyme Trypsin und Chymotrypsin Einleitung Die Proteine Trypsin und Chymotrypsin sind Enzyme, die im Magen von Säugetieren vorkommen und die Hydrolyse von Peptidbindungen katalysieren.
Plasmidpräparation aus Bakterien Inhalt
 Inhalt Einleitung... 2 Materialien... 4 Gewinnung der Bakterien... 6 Zerstörung der Bakterien... 7 Trennung von Plasmid-DNA und genomischer DNA... 8 Reinigung der Plasmid-DNA... 10 Elution der gereinigten
Inhalt Einleitung... 2 Materialien... 4 Gewinnung der Bakterien... 6 Zerstörung der Bakterien... 7 Trennung von Plasmid-DNA und genomischer DNA... 8 Reinigung der Plasmid-DNA... 10 Elution der gereinigten
EdU Click-488 ROTI kit für Imaging
 Gebrauchsanweisung EdU Click-488 ROTI kit für Imaging ROTI kit für Imaging Carl Roth GmbH + Co. KG EdU Click-488 ROTI kit für Imaging Das EdU Click-488 Kit beinhaltet Reagenzien für bis 100 Reaktionen
Gebrauchsanweisung EdU Click-488 ROTI kit für Imaging ROTI kit für Imaging Carl Roth GmbH + Co. KG EdU Click-488 ROTI kit für Imaging Das EdU Click-488 Kit beinhaltet Reagenzien für bis 100 Reaktionen
SCRIPTUM HIGH PRECISE
 Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
2 Materialien und Methodik
 2 Materialien und Methodik 2.1 Geräte Adhäsivobjektträger; MERCK, Darmstadt Brutschrank INCO 2; MEMMERT, Schwabach Cydok Bildanalysesystem; FIRMA C. H. HILGES, Königswinter Deckglas; TECHNISCHES GLAS ILMENAU
2 Materialien und Methodik 2.1 Geräte Adhäsivobjektträger; MERCK, Darmstadt Brutschrank INCO 2; MEMMERT, Schwabach Cydok Bildanalysesystem; FIRMA C. H. HILGES, Königswinter Deckglas; TECHNISCHES GLAS ILMENAU
Protokoll Praktikum für Humanbiologie Studenten
 Protokoll Praktikum für Humanbiologie Studenten Teil A: Charakterisierung der Auswirkungen von γ Interferon auf die Protein und mrna Mengen in humanen A549 Lungenepithelzellen. Studentenaufgaben Tag 1
Protokoll Praktikum für Humanbiologie Studenten Teil A: Charakterisierung der Auswirkungen von γ Interferon auf die Protein und mrna Mengen in humanen A549 Lungenepithelzellen. Studentenaufgaben Tag 1
PROTEINBESTIMMUNG. Vergleich Bradford und BCA
 PROTEINBESTIMMUNG Vergleich Bradford und BCA ÜBERSICHT Einleitung Theorie Durchführung Resultate und Diskussion Fragen EINLEITUNG Aufgabenstellung: Vergleich der Methoden zur quantitativen Proteinbestimmung
PROTEINBESTIMMUNG Vergleich Bradford und BCA ÜBERSICHT Einleitung Theorie Durchführung Resultate und Diskussion Fragen EINLEITUNG Aufgabenstellung: Vergleich der Methoden zur quantitativen Proteinbestimmung
ZytoLight SPEC EWSR1 Dual Color Break Apart Probe
 ZytoLight SPEC EWSR1 Dual Color Break Apart Probe Z-2096-200 Z-2096-50 20 (0,2 ml) 5 (0,05 ml) Zum Nachweis von Translokationen mit Beteiligung des EWSR1-Gens in der Region 22q12.2 durch Fluoreszenz in
ZytoLight SPEC EWSR1 Dual Color Break Apart Probe Z-2096-200 Z-2096-50 20 (0,2 ml) 5 (0,05 ml) Zum Nachweis von Translokationen mit Beteiligung des EWSR1-Gens in der Region 22q12.2 durch Fluoreszenz in
Die Isolierung von Cosmid-DNA erfolgte entsprechend den Protokollen von Sambrook et al. (1989).
 3 Methoden 3.1 Isolierung von Cosmid-DNA Die Isolierung von Cosmid-DNA erfolgte entsprechend den Protokollen von Sambrook et al. (1989). 3.2 Präparation von YAC-DNA aus Hefezellen Die Hefe-DNA wurde modifiziert
3 Methoden 3.1 Isolierung von Cosmid-DNA Die Isolierung von Cosmid-DNA erfolgte entsprechend den Protokollen von Sambrook et al. (1989). 3.2 Präparation von YAC-DNA aus Hefezellen Die Hefe-DNA wurde modifiziert
5.1. Untersuchungen zu nukleären Veränderungen
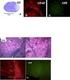 5. Diskussion In der vorliegenden Arbeit wurden die Veränderungen der Chromatinkonfiguration sowie die Veränderungen der respiratorischen Aktivität und Aggregation von Mitochondrien in bovinen Oozyten
5. Diskussion In der vorliegenden Arbeit wurden die Veränderungen der Chromatinkonfiguration sowie die Veränderungen der respiratorischen Aktivität und Aggregation von Mitochondrien in bovinen Oozyten
5.1 Allgemeine Untersuchungen zur Qualität und Maturationsfähigkeit von COC in Abhängigkeit vom übergeordneten Dominanten Follikel
 5 Diskussion Mit den vorliegenden Untersuchungen sollte ermittelt werden, ob der Funktionszustand des Dominanten Follikels bei weiblichen Rindern einen Einfluß auf die Eizellen aus untergeordneten Follikeln
5 Diskussion Mit den vorliegenden Untersuchungen sollte ermittelt werden, ob der Funktionszustand des Dominanten Follikels bei weiblichen Rindern einen Einfluß auf die Eizellen aus untergeordneten Follikeln
Substratverwertung bei Hefen Best.- Nr Best.- Nr
 Substratverwertung bei Hefen Best.- Nr. 201.3956 Best.- Nr. 201.3132 1. Einleitung Dieses Material ist für die Jahrgänge der oberen Mittelstufe und der Oberstufe geeignet und ermöglicht Untersuchungen
Substratverwertung bei Hefen Best.- Nr. 201.3956 Best.- Nr. 201.3132 1. Einleitung Dieses Material ist für die Jahrgänge der oberen Mittelstufe und der Oberstufe geeignet und ermöglicht Untersuchungen
ype 6/11/16/18/31/33/35 Screening Probe (Biotin-markiert
 ZytoFast HPV typ ype 6/11/16/18/31/33/35 Screening Probe (Biotin-markiert markiert) T-1044-400 40 (0,4 ml) Zum Nachweis von Human Papilloma Virus (HPV) Typ 6/11/16/18/31/33/35 DNA durch chromogene in situ
ZytoFast HPV typ ype 6/11/16/18/31/33/35 Screening Probe (Biotin-markiert markiert) T-1044-400 40 (0,4 ml) Zum Nachweis von Human Papilloma Virus (HPV) Typ 6/11/16/18/31/33/35 DNA durch chromogene in situ
Anlage zur Akkreditierungsurkunde D-ML nach DIN EN ISO 15189:2014
 Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-ML-13268-01-00 nach DIN EN ISO 15189:2014 Gültigkeitsdauer: 26.02.2016 bis 25.02.2021 Ausstellungsdatum: 26.02.2016 Urkundeninhaber:
Deutsche Akkreditierungsstelle GmbH Anlage zur Akkreditierungsurkunde D-ML-13268-01-00 nach DIN EN ISO 15189:2014 Gültigkeitsdauer: 26.02.2016 bis 25.02.2021 Ausstellungsdatum: 26.02.2016 Urkundeninhaber:
3 Methoden. Methoden 24. 3.1 Zellkultur. Kultivieren von Zellen
 Methoden 24 3 Methoden 3.1 Zellkultur Kultivieren von Zellen Die Nierenkarzinomzelllinien A498, SN12 und ACHN (Referenzen für die verwendeten Zelllinien siehe unter 2.2) wurden nach Anleitung der American
Methoden 24 3 Methoden 3.1 Zellkultur Kultivieren von Zellen Die Nierenkarzinomzelllinien A498, SN12 und ACHN (Referenzen für die verwendeten Zelllinien siehe unter 2.2) wurden nach Anleitung der American
www.gbo.com/bioscience Gewebekultur 1 Zell- und Microplatten 2 HTS- 3 Immunologie/ HLA 4 Mikrobiologie/ Bakteriologie Mehrzweckgefäße 5 Röhrchen/
 13 Reaktions/ 2 HTS 1 Zell und 4 Mikrobiologie / 1 Zell und 2 HTS n 4 I 2 n Sondermodelle 4 I 3 Keimzählschale 4 I 3 Macroplatte 4 I 3 Kontaktschalen 4 I 4 Quadratische 4 I 4 CELLSTAR OneWell Plate TM
13 Reaktions/ 2 HTS 1 Zell und 4 Mikrobiologie / 1 Zell und 2 HTS n 4 I 2 n Sondermodelle 4 I 3 Keimzählschale 4 I 3 Macroplatte 4 I 3 Kontaktschalen 4 I 4 Quadratische 4 I 4 CELLSTAR OneWell Plate TM
Im Einsatz reduziert der C-Chip das Infektionsrisiko durch minimierte Exposition zu biologisch aktiven, infektiösen Materialien.
 Tipps zum Zählen von Zellen mit der neuen Einweg-Zählkammer C-Chip C Chip Biochrom AG Information Die Einweg-Zählkammer C-Chip aus Kunststoff sieht genauso aus wie die bekannte Neubauer improved -Zählkammer.
Tipps zum Zählen von Zellen mit der neuen Einweg-Zählkammer C-Chip C Chip Biochrom AG Information Die Einweg-Zählkammer C-Chip aus Kunststoff sieht genauso aus wie die bekannte Neubauer improved -Zählkammer.
Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005
 Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005 F1 Molekulare Zoologie Teil II: Expressionsanalyse Proteinexpressionsanalyse
Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005 F1 Molekulare Zoologie Teil II: Expressionsanalyse Proteinexpressionsanalyse
Innovation als Garant für den Erfolg bei unerfülltem Kinderwusch!
 Der Zech-Selector Innovation als Garant für den Erfolg bei unerfülltem Kinderwusch! Dr. Josef Zech entwickelte vor mehreren Jahren eine Technologie, die es möglich macht, Samenzellen ohne Zentrifugation
Der Zech-Selector Innovation als Garant für den Erfolg bei unerfülltem Kinderwusch! Dr. Josef Zech entwickelte vor mehreren Jahren eine Technologie, die es möglich macht, Samenzellen ohne Zentrifugation
Versuch 1: Zell-Kultur
 Versuch 1: Zell-Kultur Lernziele: 1) Umgang mit Zellkulturen 2) Freisetzung von Enzymen aus subzellulären Kompartimenten mittels Detergentien 3) Einfluss von Detergens auf die Zell-Vitalität 4) mitochondriale
Versuch 1: Zell-Kultur Lernziele: 1) Umgang mit Zellkulturen 2) Freisetzung von Enzymen aus subzellulären Kompartimenten mittels Detergentien 3) Einfluss von Detergens auf die Zell-Vitalität 4) mitochondriale
Methodensammlung des LAG PCR-Nachweis von gentechnisch veränderten Organismen, die von pbr322 abgeleitete Sequenzen enthalten
 Methodensammlung des LAG PCR-Nachweis von gentechnisch veränderten Organismen, die von pbr322 abgeleitete Sequenzen enthalten erstellt vom Unterausschuß Methodenentwicklung des LAG 1. Zweck und Anwendungsbereich
Methodensammlung des LAG PCR-Nachweis von gentechnisch veränderten Organismen, die von pbr322 abgeleitete Sequenzen enthalten erstellt vom Unterausschuß Methodenentwicklung des LAG 1. Zweck und Anwendungsbereich
4.2 Kokulturen Epithelzellen und Makrophagen
 Ergebnisse 4.2 Kokulturen Epithelzellen und Makrophagen Nach der eingehenden Untersuchung der einzelnen Zelllinien wurden die Versuche auf Kokulturen aus den A549-Epithelzellen und den Makrophagenzelllinien
Ergebnisse 4.2 Kokulturen Epithelzellen und Makrophagen Nach der eingehenden Untersuchung der einzelnen Zelllinien wurden die Versuche auf Kokulturen aus den A549-Epithelzellen und den Makrophagenzelllinien
MPP Multiplex 2x PCR-Mastermix
 Datenblatt Artikel-Nr. BS91.522.0250 250 Reaktionen in 20µl Artikel-Nr. BS91.522.1250 1250 Reaktionen a 20µl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
Datenblatt Artikel-Nr. BS91.522.0250 250 Reaktionen in 20µl Artikel-Nr. BS91.522.1250 1250 Reaktionen a 20µl (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen:
ZytoLight SPEC ERBB3/CEN 12 Dual Color Probe
 ZytoLight SPEC ERBB3/CEN 12 Dual Color Probe Z-2056-200 20 (0,2 ml) Zum Nachweis der chromosomalen Region des humanen ERBB3-Gens und der alpha-satelliten von Chromosom 12 durch Fluoreszenz in situ Hybridisierung
ZytoLight SPEC ERBB3/CEN 12 Dual Color Probe Z-2056-200 20 (0,2 ml) Zum Nachweis der chromosomalen Region des humanen ERBB3-Gens und der alpha-satelliten von Chromosom 12 durch Fluoreszenz in situ Hybridisierung
4 Methoden METHODEN Zellkultur Zellkulturmedien
 METHODEN 25 4 Methoden 4.1 Zellkultur 4.1.1 Zellkulturmedien Die Zellen wurden in folgenden Medien kultiviert: 5583-S, DLD1, SW480, LS174T und HCT116 in DMEM + 10% FCS. HT 29, CSC-1, NCM460 in RPMI + 10%
METHODEN 25 4 Methoden 4.1 Zellkultur 4.1.1 Zellkulturmedien Die Zellen wurden in folgenden Medien kultiviert: 5583-S, DLD1, SW480, LS174T und HCT116 in DMEM + 10% FCS. HT 29, CSC-1, NCM460 in RPMI + 10%
Auf der Suche nach der Wundermedizin
 Auf der Suche nach der Wundermedizin Experimente im Schullabor 1 Herausgeber Novartis Pharma AG, CH-4002 Basel Autoren: Dr. Gesche Standke und Dr. Christiane Röckl Michel Zeichnungen: Fonds der Chemischen
Auf der Suche nach der Wundermedizin Experimente im Schullabor 1 Herausgeber Novartis Pharma AG, CH-4002 Basel Autoren: Dr. Gesche Standke und Dr. Christiane Röckl Michel Zeichnungen: Fonds der Chemischen
Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie
 Name Datum Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie Material: DC-Karten (Kieselgel), Glas mit Deckel(DC-Kammer), Kapillare, Messzylinder Chemikalien: Blaue M&Ms,
Name Datum Identifizierung des Farbstoffes in blauen M&Ms durch Dünnschichtchromatographie Material: DC-Karten (Kieselgel), Glas mit Deckel(DC-Kammer), Kapillare, Messzylinder Chemikalien: Blaue M&Ms,
KULTIVIERUNG VON MIKROORGANISMEN
 KULTIVIERUNG VON MIKROORGANISMEN KULTIVIERUNG VON MIKROORGANISMEN Verfahren, das Bakterien außerhalb des natürlichen Standortes zur Vermehrung bringt (unbelebte Substrate oder Zellkulturen) 1 Voraussetzungen
KULTIVIERUNG VON MIKROORGANISMEN KULTIVIERUNG VON MIKROORGANISMEN Verfahren, das Bakterien außerhalb des natürlichen Standortes zur Vermehrung bringt (unbelebte Substrate oder Zellkulturen) 1 Voraussetzungen
Klonierung beim Rind. Verfahren der Erstellung genetisch identischer Individuen
 Klonen Definition: Klonierung beim Rind Verfahren der Erstellung genetisch identischer Individuen Techniken der Klonierung von Säugern: Isolierung und Proliferation einzelner embryonaler Zellen (Blastomeren
Klonen Definition: Klonierung beim Rind Verfahren der Erstellung genetisch identischer Individuen Techniken der Klonierung von Säugern: Isolierung und Proliferation einzelner embryonaler Zellen (Blastomeren
Standardabweichung und Variationskoeffizient. Themen. Prinzip. Material TEAS Qualitätskontrolle, Standardabweichung, Variationskoeffizient.
 Standardabweichung und TEAS Themen Qualitätskontrolle, Standardabweichung,. Prinzip Die Standardabweichung gibt an, wie hoch die Streuung der Messwerte um den eigenen Mittelwert ist. Sie ist eine statistische
Standardabweichung und TEAS Themen Qualitätskontrolle, Standardabweichung,. Prinzip Die Standardabweichung gibt an, wie hoch die Streuung der Messwerte um den eigenen Mittelwert ist. Sie ist eine statistische
Benutzerhandbuch Version PathoTrack EDIM ELISA. Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM)
 Benutzerhandbuch Version 2016-05 PathoTrack EDIM ELISA Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM) 2 Inhaltsverzeichnis Auf einen Blick Produktbeschreibung Inhalt des Kits Versand
Benutzerhandbuch Version 2016-05 PathoTrack EDIM ELISA Testkit zum Nachweis von Anti körpern gegen das murine Rotavirus (EDIM) 2 Inhaltsverzeichnis Auf einen Blick Produktbeschreibung Inhalt des Kits Versand
HybriScan D Abwasser Gesamtkeimzahlbestimmung
 HybriScan D Abwasser Gesamtkeimzahlbestimmung Modul I Molekularbiologisches Schnelltestsystem zum Nachweis von Bakterien im Abwasser Produkt-Nr.: 78436 Kontaktinformationen: HybriScan - Schnelltestsystem
HybriScan D Abwasser Gesamtkeimzahlbestimmung Modul I Molekularbiologisches Schnelltestsystem zum Nachweis von Bakterien im Abwasser Produkt-Nr.: 78436 Kontaktinformationen: HybriScan - Schnelltestsystem
Applications Note 202 Oktober 2008
 Applications Note 202 Oktober 2008 Technical Report Eppendorf Polypropylen Microplates Schnelles und sicheres Auffinden von Proben Natascha Weiß 1, Wolf Wente 2, Sophie Freitag 2, Daniel Wehrhahn 1 1 Eppendorf
Applications Note 202 Oktober 2008 Technical Report Eppendorf Polypropylen Microplates Schnelles und sicheres Auffinden von Proben Natascha Weiß 1, Wolf Wente 2, Sophie Freitag 2, Daniel Wehrhahn 1 1 Eppendorf
SICH AUF DIE PROLIFERATION UND APOPTOSE VON
 GELEE ROYALE (RJ) UND Human Interferon-AlphaN3 (HuIFN-ΑlphaN3) WIRKEN SICH AUF DIE PROLIFERATION UND APOPTOSE VON CaCo 2 ZELLEN AUS UND VERINGERN IHR TUMORIGENES POTENTIAL IN VITRO FILIPIČ B. 1), GRADIŠNIK
GELEE ROYALE (RJ) UND Human Interferon-AlphaN3 (HuIFN-ΑlphaN3) WIRKEN SICH AUF DIE PROLIFERATION UND APOPTOSE VON CaCo 2 ZELLEN AUS UND VERINGERN IHR TUMORIGENES POTENTIAL IN VITRO FILIPIČ B. 1), GRADIŠNIK
Dünnschichtchromatografie (DC1) von Eiweißen (Aminosäure) Best.- Nr
 Dünnschichtchromatografie (DC1) von Eiweißen (Aminosäure) Best.- Nr. 201.3275 I P R O D U K T U M F A N G 1. Produktbeschreibung a) Dieser Versuch vertieft verschiedene bedeutsame Grundkenntnisse: - Das
Dünnschichtchromatografie (DC1) von Eiweißen (Aminosäure) Best.- Nr. 201.3275 I P R O D U K T U M F A N G 1. Produktbeschreibung a) Dieser Versuch vertieft verschiedene bedeutsame Grundkenntnisse: - Das
Robin Martin. Elektrophorese. von Nucleinsäuren
 Robin Martin Elektrophorese von Nucleinsäuren Abkürzungen 11 Vorwort 13 Danksagung 15 I. Grundprinzipien und Methoden 1. Einleitung: Verschiedene Arten und Formen von Nucleinsäure 19 1.1 Überblick 19
Robin Martin Elektrophorese von Nucleinsäuren Abkürzungen 11 Vorwort 13 Danksagung 15 I. Grundprinzipien und Methoden 1. Einleitung: Verschiedene Arten und Formen von Nucleinsäure 19 1.1 Überblick 19
QIAsymphony SP Protokollblatt
 QIAsymphony SP Protokollblatt Protokoll: DNA_Buffy_Coat_400_V6_DSP Allgemeine Informationen Für in-vitro-diagnostische Anwendungen. Dieses Protokoll ist für die Reinigung von genomischer Gesamt-DNA und
QIAsymphony SP Protokollblatt Protokoll: DNA_Buffy_Coat_400_V6_DSP Allgemeine Informationen Für in-vitro-diagnostische Anwendungen. Dieses Protokoll ist für die Reinigung von genomischer Gesamt-DNA und
Isolierung von Nukleinsäuren (DNA) aus Formalin-fixierten Paraffingewebe-Schnitten (FFPE) DNA - Isolierung aus FFPE Schnitten Grundlagen
 Isolierung von Nukleinsäuren (DNA) aus Formalin-fixierten Paraffingewebe-Schnitten (FFPE) Grundlagen Fixierung DNA Isolierung Grundlagen Nukleotid: Zucker, Phosphor, Base Cytosin Guanin Thymin Adenin Bildquelle:
Isolierung von Nukleinsäuren (DNA) aus Formalin-fixierten Paraffingewebe-Schnitten (FFPE) Grundlagen Fixierung DNA Isolierung Grundlagen Nukleotid: Zucker, Phosphor, Base Cytosin Guanin Thymin Adenin Bildquelle:
2.9 Konfokale Fluoreszenzmikroskopie
 30 2.9 Konfokale Fluoreszenzmikroskopie Die Präparate (Zellkulturen und Hirnschnitte) wurden an einem konfokalen Laserscanmikroskop (LSM 410, Carl Zeiss, Jena) ausgewertet und ein 40x bzw. 100x Ölimmersionsobjektiv
30 2.9 Konfokale Fluoreszenzmikroskopie Die Präparate (Zellkulturen und Hirnschnitte) wurden an einem konfokalen Laserscanmikroskop (LSM 410, Carl Zeiss, Jena) ausgewertet und ein 40x bzw. 100x Ölimmersionsobjektiv
Dissertation zur Erlangung des akademischen Grades Doktor der Medizin (Dr. med.)
 Aus dem Institut für Anatomie und Zellbiologie. an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Dr. agr. Bernd Fischer) und aus der Universität Göttingen Sektion Embryologie
Aus dem Institut für Anatomie und Zellbiologie. an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Prof. Dr. med. Dr. agr. Bernd Fischer) und aus der Universität Göttingen Sektion Embryologie
Grundlagen: Galvanische Zellen:
 E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
E1 : Ionenprodukt des Wassers Grundlagen: Galvanische Zellen: Die Galvanische Zelle ist eine elektrochemische Zelle. In ihr laufen spontan elektrochemische Reaktionen unter Erzeugung von elektrischer Energie
(Nur für die Forschung) Bei Kontakt mit Augen oder Haut sofort mit viel Wasser abspülen!
 Datenblatt Artikel-Nr. 56.200.0010 10 Aufreinigungen 56.200.0050 50 Aufreinigungen 56.200.0250 250 Aufreinigungen (Nur für die Forschung) Sicherheitsanweisungen Bitte gehen Sie mit allen Materialien und
Datenblatt Artikel-Nr. 56.200.0010 10 Aufreinigungen 56.200.0050 50 Aufreinigungen 56.200.0250 250 Aufreinigungen (Nur für die Forschung) Sicherheitsanweisungen Bitte gehen Sie mit allen Materialien und
Trennungsverfahren Techniken (in der Biologie)
 Trennungsverfahren Techniken (in der Biologie)? Biomoleküle können getrennt werden aufgrund ihrer - chemischen Eigenschaften: Ladung, Löslichkeit, Wechselwirkung mit spezifischen Reagenzen, Molmasse -
Trennungsverfahren Techniken (in der Biologie)? Biomoleküle können getrennt werden aufgrund ihrer - chemischen Eigenschaften: Ladung, Löslichkeit, Wechselwirkung mit spezifischen Reagenzen, Molmasse -
ZytoLight porcine X/Y Dual Color Probe
 ZytoLight porcine X/Y Dual Color Probe Z-2094-200 20 (0,2 ml) Zum Nachweis porciner Chromosom-X- und Chromosom-Y-spezifischer Sequenzen durch Fluoreszenz in situ Hybridisierung (FISH) Nur für Forschungszwecke
ZytoLight porcine X/Y Dual Color Probe Z-2094-200 20 (0,2 ml) Zum Nachweis porciner Chromosom-X- und Chromosom-Y-spezifischer Sequenzen durch Fluoreszenz in situ Hybridisierung (FISH) Nur für Forschungszwecke
Einführung zum ELISA - Test Best.- Nr. 201.3793 Ü B E R S I C H T
 Einführung zum ELISA - Test Best.- Nr. 201.3793 Ü B E R S I C H T I. Inhalt II. Benötigtes Zubehör III. Versuchsprinzip IV. Protokoll V. Anleitung für Lehrer Seite 1 von 12 I. I N H A L T Dieser Versuch
Einführung zum ELISA - Test Best.- Nr. 201.3793 Ü B E R S I C H T I. Inhalt II. Benötigtes Zubehör III. Versuchsprinzip IV. Protokoll V. Anleitung für Lehrer Seite 1 von 12 I. I N H A L T Dieser Versuch
Gebrauchsanweisung Lagerung
 Für detaillierte Warnhinweise, Vorsichtsmaßnahmen, Garantiebeschränkungen, Haftungsbeschränkungen, Lagerung, Entsorgung und weitere Gebrauchshinweise siehe Packungsbeilage. Gebrauchsanweisung Lagerung
Für detaillierte Warnhinweise, Vorsichtsmaßnahmen, Garantiebeschränkungen, Haftungsbeschränkungen, Lagerung, Entsorgung und weitere Gebrauchshinweise siehe Packungsbeilage. Gebrauchsanweisung Lagerung
2.1.4. Industriell gefertigte Testkits für den Nachweis von IgG- oder IgM- Antikörpern gegen A. phagocytophilum
 2. Material und Methoden 2.1. Materialverzeichnis 2.1.1. Technische Geräte Brutschrank (Heraeus, Hanau) Fluoreszenzmikroskop mit einer Wellenlänge von 390-420 nm (Zeiss, Jena) Vortex Mixer Reax 2000 (Heidolph,
2. Material und Methoden 2.1. Materialverzeichnis 2.1.1. Technische Geräte Brutschrank (Heraeus, Hanau) Fluoreszenzmikroskop mit einer Wellenlänge von 390-420 nm (Zeiss, Jena) Vortex Mixer Reax 2000 (Heidolph,
Infektion mit Microcytos mackini
 Amtliche Methodensammlung Infektion mit Microcytos mackini 1. Charakterisierung der Infektion 2. Untersuchungsmaterial 3. Untersuchungsgang Amtliche Methodensammlung des FLI Stand 30.06.2014 1. Charakterisierung
Amtliche Methodensammlung Infektion mit Microcytos mackini 1. Charakterisierung der Infektion 2. Untersuchungsmaterial 3. Untersuchungsgang Amtliche Methodensammlung des FLI Stand 30.06.2014 1. Charakterisierung
Zellkultur, Transfektion und Mikroskopie in einem Slide
 www.biontex.com www.ibidi.com µ Transfection Kit VI Zellkultur, Transfektion und Mikroskopie in einem Slide Das µ Transfection Kit VI kombiniert die effiziente Transfektion von METAFECTENE µ (Biontex Laboratories
www.biontex.com www.ibidi.com µ Transfection Kit VI Zellkultur, Transfektion und Mikroskopie in einem Slide Das µ Transfection Kit VI kombiniert die effiziente Transfektion von METAFECTENE µ (Biontex Laboratories
Zellbiologie und Physiologie Labormethoden der Biologie
 Zellbiologie und Physiologie Labormethoden der Biologie Molekularbiologie I Dr. Stefan Weinl > Molekularbiologie I Plasmidpräparation Transformation Restriktionsverdau Gel-Elektrophorese 1 > Experimenteller
Zellbiologie und Physiologie Labormethoden der Biologie Molekularbiologie I Dr. Stefan Weinl > Molekularbiologie I Plasmidpräparation Transformation Restriktionsverdau Gel-Elektrophorese 1 > Experimenteller
Nachweis von Fälschungen durch Farbvergleiche Ist eine Farbe nur EINE Farbe?
 Name: Datum: Nachweis von durch Farbvergleiche Ist eine Farbe nur EINE Farbe? Materialien: Fruchtzwerge-Becher Rundfilter mit Loch rechteckiges Filterpapier verschiedene Filzstifte (möglichst schwarz)
Name: Datum: Nachweis von durch Farbvergleiche Ist eine Farbe nur EINE Farbe? Materialien: Fruchtzwerge-Becher Rundfilter mit Loch rechteckiges Filterpapier verschiedene Filzstifte (möglichst schwarz)
Labor für Technische Akustik
 Labor für Technische Akustik Kraus Abbildung 1: Experimenteller Aufbau zur optischen Ermittlung der Schallgeschwindigkeit. 1. Versuchsziel In einer mit einer Flüssigkeit gefüllten Küvette ist eine stehende
Labor für Technische Akustik Kraus Abbildung 1: Experimenteller Aufbau zur optischen Ermittlung der Schallgeschwindigkeit. 1. Versuchsziel In einer mit einer Flüssigkeit gefüllten Küvette ist eine stehende
Photochemische Reaktion
 TU Ilmenau Chemisches Praktikum Versuch Fachgebiet Chemie 1. Aufgabe Photochemische Reaktion V5 Es soll die Reduktion des Eisen(III)-trisoxalats nach Gleichung (1) unter der Einwirkung von Licht untersucht
TU Ilmenau Chemisches Praktikum Versuch Fachgebiet Chemie 1. Aufgabe Photochemische Reaktion V5 Es soll die Reduktion des Eisen(III)-trisoxalats nach Gleichung (1) unter der Einwirkung von Licht untersucht
Messung des extrahierbaren Silbers aus Askina Calgitrol Ag am Schweine-Modell
 Messung des extrahierbaren Silbers aus Askina Calgitrol Ag am Schweine-Modell ZIEL Messung der Konzentration an extrahierbarem Silber aus Askina Calgitrol Ag nach Applikation auf tiefe Hautwunden beim
Messung des extrahierbaren Silbers aus Askina Calgitrol Ag am Schweine-Modell ZIEL Messung der Konzentration an extrahierbarem Silber aus Askina Calgitrol Ag nach Applikation auf tiefe Hautwunden beim
Neue (und alte) Aspekte für die Praxis
 Neue (und alte) Aspekte für die Praxis Christine Wrenzycki Klinik für Geburtshilfe, Gynäkologie und Andrologie der Groß- und Kleintiere mit Tierärztlicher Ambulanz - Professur für Molekulare Reproduktionsmedizin
Neue (und alte) Aspekte für die Praxis Christine Wrenzycki Klinik für Geburtshilfe, Gynäkologie und Andrologie der Groß- und Kleintiere mit Tierärztlicher Ambulanz - Professur für Molekulare Reproduktionsmedizin
