Molekulare Analysen zur Funktion von SPOC1 (PHF13) in der epigenetischen Regulation der Spermatogenese mit Hilfe eines Spoc1 -/- -Mausmodells
|
|
|
- Brigitte Vogt
- vor 7 Jahren
- Abrufe
Transkript
1 Molekulare Analysen zur Funktion von SPOC1 (PHF13) in der epigenetischen Regulation der Spermatogenese mit Hilfe eines Spoc1 -/- -Mausmodells Der Naturwissenschaftlichen Fakultät der Friedrich-Alexander Universität Erlangen-Nürnberg zur Erlangung des Doktorgrades Dr. rer. nat. vorgelegt von Claudia Nelkenbrecher aus Schwabach
2 Als Dissertation genehmigt von der Naturwissenschaftlichen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Tag der mündlichen Prüfung: 05. März 2014 Vorsitzender des Promotionsorgans: Prof. Dr. J. Barth Gutachter: Prof. Dr. A. Winterpacht PD Dr. M. Schoppmeier
3 Inhaltsverzeichnis 1 Einleitung Spermatogenese Anatomie des Hodens Epigenetische Regulation Meiotic Sex Chromosome Inactivation (MSCI) SPOC Zielsetzung Material und Methoden Versuchstiere Isolierung von Nukleinsäuren DNA- und RNA-Standardmethoden Klonierung PCR- und Sequenziermethoden DNA- und RNA-Hybridisierungsmethoden Herstellung von Präparaten und verschiedene Färbungen Proteinmethoden In silico Analysen Reagenzien und Materialien Ergebnisse Die Rolle des genetischen Hintergrunds der Spoc1 - Gene trap -Maus Untersuchung des Spermatogenesedefekts auf zellulärer Ebene Histonmodifikationen der undifferenzierten Spermatogonien Vergleichende Genexpressionsanalysen Untersuchungen zur MSCI Diskussion Einfluss des genetischen Hintergrunds auf den Spoc1 -/- -Phänotyp Charakterisierung des Spoc1 -/- -Phänotyps Genomweite Expressionsanalyse Der Knockdown von Spoc1 führt zu einer defekten MSCI Mögliche Modelle zu Wirkungsweise von SPOC Ausblick Zusammenfassung 148 Summary 149 A Anhang 150 Literaturverzeichnis 158 iii
4 Abbildungsverzeichnis 1.1 Aufbau des humanen Hodens Aufbau des Keimepithels Mitotische Proliferation und Differenzierung Ablauf der Meiose Ablauf der Spermiogenese Stadien des murinen Keimepithels Aufbau des Nukleosoms und mögliche Histonmodifikationen Bivalenter Chromatinzustand von Entwicklungsgenen in ES-Zellen Zeitlicher Ablauf der MSCI Schematischer Ablauf der MSCI Schematischer Aufbau des humanen SPOC1 -Gens Subzelluläre Lokalisation von SPOC1 während der Mitose Histologische Querschnitte der Tubuli seminiferi in Wildtyp und Spoc1 -Knockout-Gewebe Überprüfung des Spoc1 -Knockdowns Genotypenverteilung bei heterozygoter Verpaarung Embryonen verschiedener Entwicklungsstadien Sterblichkeitsrate und embryonale Genotypenverteilung Embryonale Defekte in den Spoc1 -/- -Tieren Skelettveränderungen der Spoc1 -/- -Maus Übersicht über die Anzahl der Nachkommen Gonadal-somatischer Index (GSI) Spermienzählung Histologische Übersichtsfärbungen des Hodengewebes Auswertung der Tubulusgröße Auswertung der Tubulusstruktur Histologische Übersichtsfärbung des Hodengewebes von älteren Mäusen (59 Wo) Analyse der Sertoli-Zellen Analyse der Proliferationsmarker Analyse der Apoptoserate in Spoc1 -/- -Mäusen Identifizierung der apoptotischen Zellen Klonales Apoptose-Muster Verteilung der undifferenzierten Spermatogonien Expression von Spoc1 in undifferenzierten Spermatogonien Kolokalisation von SPOC1 mit unterschiedlichen Histonmethylierungen (Teil 1) Kolokalisation von SPOC1 mit verschiedenen Histonmethylierungen (Teil 2) iv
5 Abbildungsverzeichnis 3.23 Koexpression von SPOC1 mit PLZF Veränderungen der Histonmodifikationen im Gewebe von Spoc1 -/- - Mäusen (Teil 1) Veränderungen der Histonmodifikationen im Gewebe von Spoc1 -/- - Mäusen (Teil 2) Heatmaps der Expressionsanalysen Expressionsanalyse ausgewählter Gene aus Migrationspathways Genomische Position von Spoc1 und Tas1r Expression von Tas1r Vergleich der Genexpression zwischen Spoc1 +/+ - und Spoc1 -/- - Tieren Expressionslevel der Chromosomen 1, 2 und X Vergleich der chromosomenweiten Genexpressionslevel Real Time-PCR und RNA-FISH Transkriptionsaktivität im XY-Body Bildung des XY-Bodys Auszählung der Stadien der Prophase I Histon H3-Methylierung im Pachytänstadium Histonmodifikationen im Pachytänstadium H3K9me2 ist während der Prophase I dynamisch reguliert Veränderung von H3K27me2 im XY-Body Veränderung von H3K36me2/3 im XY-Body Veränderung von H2AK119ub im XY-Body Exon-Skipping der gene trap Kassette Sequenzvergleich von SPOC1 und PHF Humane Expressionsmuster von SPOC1 und PHF Ausprägung eines Phänotyps Schematische Darstellung der Schädel Juvenile versus adulte Spermatogenese Unterschiede der murinen Tas1r1 -Allele Aufbau der Blut-Hoden-Schranke SPOC1 an bivalenten Chromatin Mögliche Wirkungsweise zu SPOC A.1 Überprüfung der RNA-Proben für den Microarray mittels Bioanalyzer A.2 Histogramme beider GeneChip-Analysen A.3 Hauptkomponentenanalyse beider GeneChip-Analysen A.4 Ursachenquellen beider GeneChip-Analysen A.5 Pathway Express: Leukocyte transendothelial migration A.6 Pathway Express: Cell adhesion A.7 Verteilung der differentiell exprimierten Gene A.8 Mittlere Expressionslevel A.9 Aktuelles Gesundheitszeugnis der Mäuse A.10 Spezifität des H3K27me3-Antikörpers (abe44) von Millipore v
6 Tabellenverzeichnis 1.1 Übersicht der Histonmodifikationen Übersicht über die Entwicklungsdefekte Mittlere Wurfgröße Lokalisation der Histonmethylierungen Unterschiede der Histonmodifikationen in undiff. Spermatogonien Auswertung mittels Pathway Express Regulierte Gene in den Pathways Leukozytenmigration (LM) und Zelladhäsion (CAMs) SNP-Analyse Histonmodifikationen und Histonvarianten im Pachytänstadium Vergleich zwischen Spermatogenese und Oogenese (human) vi
7 Abkürzungsverzeichnis männlich weiblich A Adenin A. bidest. Aqua bidestillata Abb. Abbildung ac Acetyl- AE Axiale Elemente AP Alkalische Phosphatase AS Aminosäure ATP Adenosintriphosphat A al Typ A-Spermatogonium (A aligned ) A pr Typ A-Spermatogonium (A paired ) A s Typ A-Spermatogonium (A single ) BAC bacterial artificial chromosome bp Basenpaare BSA Rinderserumalbumin BTB Blood-Testis-Barrier bzw. beziehungsweise C Cytosin c Zenti (10 2 ) ca. circa ChIP Chromatin-Immunopräzipitation Chr. Chromosom cdna komplementäre DNA CpG Cytosin-Guanin-Dinukleotid C-terminal carboxy-terminal Cy2 cyanine dye 2 (grün) Cy3 cyanine dye 3 (rot) Cys Cystein DAB 3,3 -Diaminobenzidin DAPI 4,6-diamidino-2-phenylindol DDR DNA damage response DEPC Diethylpyrocarbonat DIG Digoxygenin DNA Desoxyribonukleinsäure DNase Desoxyribonuklease dntp 2 -Desoxynucleosid-5 -triphosphat dpp day post partum DSB double strand break E Embryonaltag vii
8 Abkürzungsverzeichnis ES Embryonale Stammzelle EST expressed sequence tag EtOH Ethanol F, Fw forward FC fold change FELASA Federation of European Laboratory Animal Science Association FISH fluorescence in situ hybridization FITC Fluorescein Isothiocyanat FSH Follikel stimulierendes Hormon G Guanin g Erdbeschleunigung g Gramm GSI Gonadal-Somatischer Index Grad Celsius H Histon h Stunde HAT Histon-Acetyl-Transferase HDAC Histon Deacetylase HE Hämatoxylin/Eosin His Histidin HOX Homeobox HRP horse raddish peroxidase ID Idenetifikations- In intermediate Indel insertion or deletion IVC individual ventilation cage K Lysin k Kilo (10 3 ) kb Kilobasenpaare kda Kilodalton l Liter M molar m Meter m Milli (10 3 ) µ Mikro (10 6 ) Mb Megabasen me Methylmin Minute(n) mrna messenger Ribonukleinsäure MSCI meiotic sex chromosome inactivation MSUC meiotic silencing of unsynapsed chromatin n Anzahl n Nano (10 9 ) NLS Kernlokalisationssequenz N-terminal amino-terminal viii
9 Abkürzungsverzeichnis NTD N-terminale Domäne OD optische Dichte P Phopho- P Postnataltag PCA principal component analysis PCR polymerase chain reaction PGC promordial germ cell ph negativer dekadischer Logarithmus der H + -Ionen- Konzentration PMSC postmeiotisches sex-chromatin PyRAT Python based Relational Animal Tracking qpcr quantitative Real Time-PCR R Arginin R, Rv, Rev reverse Ref. Referenz im Literaturverzeichnis RNA Ribonukleinsäure RNase Ribonuklease RT Raumtemperatur RT-PCR reverse transcriptase polymerase chain reaction S Serin s Sekunde(n) SSC spermatogonale Stammzelle Seq Sequenzierung SNP single nucleotide polymorphism SNV single nucleotide variation SV seminal vesicles Samenblase T Testis T Thymin Tab. Tabelle Taq Thermus aquaticus TRITC Tetramethylrhodamine-5-(and-6)-Isothiocyanate TUNEL Terminal deoxynucleotidyl transferase dutp nick end labeling U units (Enzymeinheiten) ub Ubiquitin ün über Nacht u. a. unter anderem u. U. unter Umständen UV ultraviolett V Volt vgl. vergleiche Vol. Volumen WB Western Blot WT Wildtyp X i X-Inaktivierung z. B. zum Beispiel ix
10
11 1 Einleitung Inhaltsangabe 1.1 Spermatogenese Anatomie des Hodens Aufbau und Funktion des Keimepithels Ablauf der Spermatogenese Morphologie und Kinetik der Spermatogenese Epigenetische Regulation Übersicht über die Mechanismen der epigenetischen Regulation Die Plant Homeodomain (PHD) Der Polycomb Repressive Complex (PRC) Meiotic Sex Chromosome Inactivation (MSCI) Evolution der MSCI Transkriptionsaktivität während der Meiose Ablauf der MSCI in der Meiose Folgen einer defekten MSCI SPOC Aufbau der Gen- und Proteinstruktur von Spoc Assoziation von SPOC1 mit Krebsentstehung und -progression Die Rolle von SPOC1 in der Mitose Die Rolle von SPOC1 in der Spermatogenese Zielsetzung Spermatogenese Als Spermatogenese wird der Entwicklungsprozess der männlichen Keimzellen bezeichnet. Bei Säugetieren werden in diesem vektoriellen Prozess zyklisch aus diploiden spermatogonalen Stammzellen (SSCs) haploide Spermien gebildet. Die Spermatogenese findet in den Samenkanälchen der Hoden statt. 1.2 Anatomie des Hodens Während der Organogenese in Wirbeltierembryonen entstehen die Anlagen für die männlichen Keimdrüsen (Testes) paarig im Bauchraum. Bei Primaten wandern die Hoden, durch die Hormone Anti-Müller-Hormon und Testosteron gesteuert, noch während der Embryonalentwicklung, in den außerhalb der Bauchhöhle gelegenen Hodensack (Scrotum). Bei 1
12 1 Einleitung Nagetieren findet dieser sogenannte Hodenabstieg (Descensus testis) erst während der Pubertät statt [310]. Das Scrotum wird über eine Scheidewand (Septum scroti) in zwei Kompartimente unterteilt, welche die beiden paarig angelegten Hoden beherbergen. Mehrere unterschiedliche Gewebe, die Tunica dartos, der Musculus cremaster, die Fasciae spermatica externa und interna und die Tunica vaginalis testis umgeben die Testes. Darunter liegt eine dicke Bindegewebskapsel, die Tunica albuginea. Von ihr aus dringen peripher Bindegewebssepten (Septula testis) in den Hoden ein und unterteilen diesen in unvollständig voneinander getrennte Läppchen, die Lobuli testis (vgl. Abb. 1.1). In diesen Lobuli befinden sich, in feinfaseriges, interstitielles Bindegewebe eingebettet, die Samenkanälchen (Tubuli seminiferi), die das Keimepithel beherbergen. In dem interstitiellen Hodengewebe sind Myofibroblasten, Fibrozyten und Leydig-Zellen zu einem lockeren Bindegewebe angeordnet, welches mit Nerven sowie Blut- und Lymphgefäßen durchzogen ist. Die Tubuli verlaufen zu einem großen Teil gewunden (Tubuli seminiferi contorti) in diesem Bindegewebe und münden dann über einen geraden Teil (Tubuli seminiferi recti) in das Rete testis (vgl. Abb. 1.1). Dieses stellt ein netzartiges System dar, in dem verschiedene Gänge miteinander verbunden sind [25][45][243]. Abbildung 1.1 Aufbau des humanen Hodens Gezeigt ist das Schema des inneren Aufbaus des Hodens (Testis) und des Nebenhodens (Epididymis) mit den Strukturen Ductus deferens, Ductuli efferentes, Rete testis, Tunica albuginea, Tubulus seminiferus, Septum und den Lobuli testis. (verändert nach: [110]) Aus dem Rete testis führen die Ductuli efferentes heraus, welche sich zum Nebenhodengang (Ductus epididymis) vereinigen. Der Nebenhoden (Epididymis) lagert sich dorsal an den Hoden an und stellt den Ort der finalen Reifung und Speicherung der Spermien dar. 2
13 1.2 Anatomie des Hodens Aus dem Nebenhoden führt der Samenleiter (Ductus deferens) in den Harnleiter (Ureter), welcher unterhalb der Harnblase in die Harnröhre (Urethra) mündet [168]. Akzessorische Geschlechtsdrüsen stellen die Prostata, die Cowper-Drüsen (Glandula bulbourethralis) und die Samenblase (Vesicula seminalis) dar. Von der Prostata wird ein leicht saures (ph 6,4) Sekret sezerniert, das 30 % des Spermas ausmacht und für die Funktion der Spermien wichtige Bestandteile, wie z.b. das bewegungsstimulierende Polyamin Spermin, enthält. Das Sekret der Cowper-Drüse ist ein Präejakulat, welches Harnreste neutralisiert. Die Samenblase sezerniert ein alkalisches Sekret, welches der Versorgung der Spermatozoen dient [86][245] Aufbau und Funktion des Keimepithels Das Keimzellen-produzierende Gewebe ist das Keimepithel, das sich innerhalb der Tubuli seminiferi befindet (vgl. Abb. 1.2). Es besteht aus somatischen Versorgungszellen (Sertoli- Zellen) und den Keimzellen. In diesem Keimepithel läuft die Spermatogenese von basal nach adluminal in zeitlich-räumlich geordneter Form ab. Ein genauer Überblick über den Ablauf der Spermatogenese findet sich unter Abbildung 1.2 Aufbau des Keimepithels Gezeigt ist ein Ausschnitt aus einem Tubulus seminiferus. Die Spermatogenese erfolgt vektoriell von der Basallamina (unten) zum Lumen hin (oben). Neben den Keimzellen befinden sich die somatischen Sertoli-Zellen im Keimepithel. Das Keimepithel ist vom interstitiellen Raum abgegrenzt durch die Basallamina. (verändert nach: [8]) 3
14 1 Einleitung Sertoli-Zellen Die Sertoli-Zellen (Epitheliocyti sustentantes) sind große Zellen, deren Zellkerne sich in der Peripherie des Keimepithels befinden. Die Zellen haben direkten Kontakt zu der Basallamina und ihr Zytoplasma durchzieht das gesamte Keimepithel und reicht bis ins Lumen der Tubuli hinein. Diese Zellen übernehmen unterschiedliche, essentielle Funktionen bei der Spermatogenese. Neben einer Stützfunktion für die Keimzellen, sind sie an der Zellmigration beteiligt und sekretieren viele Stoffe, die der Versorgung der Keimzellen dienen. Sie sezernieren verschiedene Glykoproteine, wie Transport- und bioaktive Proteine (z.b. Androgen-Bindeproteine, Metallionen-Transporter), Proteasen und Proteaseinhibitoren, Komponenten der extrazellulären Matrix, Wachstumsfaktoren, Zytokine, Hormone und Energiemetaboliten [106]. Sertoli-Zellen besitzen im Gegensatz zu den Keimzellen Rezeptoren für die hormonellen Regulatoren der Spermatogenese FSH (Follikel stimulierendes Hormon) und Testosteron [268]. Die Sertoli-Zellen stehen mit einer Anzahl von Keimzellen in direkten Zell- Zell Kontakt, um diese Signale weiterzugeben. Die Anzahl der Keimzellen, die von einer Sertoli-Zelle versorgt werden, ist speziesabhängig. Beim Menschen geht man von etwa 10 Keimzellen pro Sertoli-Zelle aus, bei Nagern wie z.b. der Ratte sind es etwa 50 Keimzellen [268]. Eine weitere essentielle Funktion der Sertoli-Zellen ist die Ausbildung der Blut-Hoden- Schranke. Die Sertoli-Zellen stellen untereinander Zell-Zell-Kontakte ( Tight junctions ) her, welche als sogenannte Zonulae ocludentes eine Diffusionsbarriere zwischen diesen Zellen bilden. Diese Barriere ist zwischen dem basalen Teil der Tubuli und den weiter entwickelten Keimzellen, welche weiter adluminal liegen, lokalisiert [110][183]. Im basalen Kompartiment liegen sowohl die Spermatogonien als auch primäre Spermatozyten im Preleptotän- und Leptotänstadium vor. Es entsteht hier eine Nische für die spermatogonalen Stammzellen (SSCs), welche für deren Erhalt essentiell ist [177]. Im adluminalen Kompartiment befinden sich die meiotischen Spermatozyten ab dem Zygotänstadium, sowie die Spermatiden und unreifen Spermatozoen [208]. Neben der Funktion einer immunologischen Barriere [27] schafft diese Schranke ein spezielles Milieu für die verschiedenen Reifestadien der Keimzellen, das für den Ablauf der Spermatogenese wichtig ist. Obwohl die Blut-Hoden-Schranke eine der effektivsten Barrieren im Säugetierorganismus darstellt, muss sie periodisch geöffnet werden, damit die Keimzellen in das adluminale Kompartiment übertreten können. Dieser Übertritt findet im späten VIII. bis frühen IX. Stadium des epithelialen Zyklus statt [247], wenn sich die Keimzellen im Leptotänstadium befinden (vgl. Kap ). Sertoli-Zellen übernehmen also eine Vielzahl essentieller Aufgaben im Keimepithel. Ohne diese Zellen können sich die Keimzellen nicht entwickeln und gehen in die Apoptose über [160]. Die Sertoli-Zellen hingegen können auch ohne Keimzellen im Keimepithel existieren. Dementsprechend gibt es eine Vielzahl beschriebener Sertoli-Cell-Only Phänotypen [7][57][66][89]. Keimzellen Der Ursprung der spermatogonalen Stammzellen sind die primordialen Keimzellen (PGCs), welche während der Embryogenese vom primären Ektoderm in die Genitalleiste wandern. 4
15 1.2 Anatomie des Hodens Sie werden dort von den Vorläufern der Sertoli-Zellen umhüllt und differenzieren in diesem Milieu zu Gonozyten [82]. Diese Zellen sind in der G0/G1-Phase des Zellzyklus arretiert bis sie kurz nach der Geburt (Postnataltag 3 im murinen Organismus) reaktiviert werden. Sie wandern aus dem Lumen in den basalen Teil des Tubulus. Dort finden sie ihren Platz in der Stammzellnische des Keimepithels und entwickeln sich zu spermatogonalen Stammzellen (SSCs). Aus diesen Zellen entstehen im Verlauf der Spermatogenese alle anderen, weiter differenzierten Keimzellen. Der Verlauf dieses Entwicklungsprozesses ist im folgenden Abschnitt (1.2.2) dargestellt Ablauf der Spermatogenese Die Spermatogenese ist ein vektorieller, zyklischer Prozess, in dessen Verlauf aus diploiden prämeiotischen männlichen Keimzellen haploide Spermien gebildet werden. Die Spermatogenese kann in drei Phasen unterteilt werden: (1) Proliferation der Stammzellen (Spermatogonien) und Differenzierung zu Spermatozyten (2) Reduktion des Chromosomensatzes und Austausch genetischen Materials während der Meiose (3) Differenzierung der Keimzellen zu Spermien (Spermiogenese) Die Spermatogenese beginnt nach der Geburt und findet in den Samenkanälchen (Tubuli seminiferi contorti) der Hoden (Testes) statt. Mitotische Proliferation und Differenzierung Die Spermatogenese beginnt mit den Keimzellen, die sich an der Peripherie der Tubuli direkt an der Basallamina befinden. Bei Nagern sind das die A single -Spermatogonien. Diese stellen die spermatogonalen Stammzellen (SSCs) dar, die sich in einer speziellen Stammzellnische befinden [78]. Es konnte gezeigt werden, dass murine und humane SSCs in vitro zu Zellen konvertiert werden können, die embryonalen Stammzellcharakter aufweisen [151] [152] [120] [259] [65]. Diese Zellen teilen sich entweder zur Erhaltung des Stammzellpools in neue Stammzellen oder in weiter differenzierte Zellen. Bei Nagern differenzieren die A single - Spermatogonien durch Mitose mit unvollständiger Cytokinese zu A paired -Spermatogonien. Durch weitere mitotische Teilungen werden diese zu A aligned -Spermatogonien, die aus 4-16 selten auch 32, miteinander über eine Cytoplasmabrücke verbundenen Zellen bestehen (vgl. Abb. 1.3). Diese Typ A-Spermatogonien werden auch als undifferenzierte Spermatogonien bezeichnet, da diese, wie Transplantationsexperimente gezeigt haben, die Fähigkeit besitzen, die Funktion einer spermatogonalen Stammzelle zu übernehmen [215] [322]. Bei Primaten werden die spermatogonalen Stammzellen in A dark -Spermatogonien und A pale - Spermatogonien unterteilt [6]. Die A dark -Spermatogonien befinden sich normalerweise in einem Ruhezustand und sind nicht teilungsaktiv, während die A pale -Spermatogonien neue Spermatogonien für die weitere Differenzierung hervorbringen. Die A dark -Spermatogonien können bei einem Verlust der A pale -Spermatogonien reaktiviert werden und den A dark - Zellpool wieder auffüllen [245]. Im murinen Gewebe entsprechen die A single-aligned -Zellen den A dark -Zellen. Es wird aber vermutet, dass sich ähnlich wie beim humanen Keimzellen 5
16 1 Einleitung Abbildung 1.3 Mitotische Proliferation und Differenzierung Ausgangspunkt ist eine spermatogonale Stammzelle (A single oder A s ), die sich selbst erneuert oder zu A paired -Spermatogonien (A pr ) differenziert. Sowohl dieser Differenzierungsschritt sowie die nachfolgende Differenzierung zu A aligned -Spermatogonien (A al ) erfolgt in fast allen epithelialen Stadien. Die A aligned -Spermatogonien differenzieren sich synchron zu A 1 -Spermatogonien, die sich über mitotische Teilungen zu A 2 -, A 3 - und A 4 -Spermatogonien zu Intermediate (In-) Spermatogonien entwickeln. Diese teilen sich schließlich in Typ B-Spermatogonien, welche anschließend in die Meiose eintreten. eine Subpopulation der A single -Zellen in einem teilungsinaktiven Zustand befinden [143]. Im Folgenden soll genauer auf die Vorgänge im murinem Gewebe eingegangen werden. Bei der murinen Spermatogenese gehen aus den undifferenzierten A aligned -Spermatogonien ohne Teilung die A1-Spermatogonien hervor. Diese durchlaufen dann drei weitere Mitosen und werden zu A2-, A3- und A4-Spermatogonien. Die Typ A-Spermatogonien zeichnen sich durch einen geringen Anteil an Heterochromatin aus, während die intermediären (In-) Spermatogonien, welche durch Teilung aus den A4-Spermatogonien hervorgehen, deutlich mehr heterochromatische Strukturen im Nukleus aufweisen. Die In-Spermatogonien teilen sich wiederum und werden zu Typ B-Spermatogonien, welche sehr viel Heterochromatin besitzen [60]. Mit Eintritt in die Pubertät beginnen die Typ B-Spermatogonien sich durch Teilung in primäre Spermatozyten zu differenzieren, welche anschließend in die erste meiotische Reifeteilung eintreten. Meiotische Reifeteilungen Die Meiose dient der Halbierung und der Rekombination des genetischen Materials für die entstehenden Keimzellen. Sie besteht aus zwei Reifeteilungen, wobei die erste Reifeteilung die Trennung der homologen Chromosomen (Reduktionsteilung) und die zweite die Trennung der Schwesterchromatiden (Äquationsteilung) zur Folge hat (vgl. Abb. 1.4). Die Prophase der Reduktionsteilung (Prophase I) ist stark verlängert, da es hierbei zur homologen Rekombination und somit zum Austausch genetischen Materials zwischen den homologen Chromosomen kommt. Sie wird deshalb in mehrere Phasen unterteilt: Die primären Spermatozyten gehen zunächst in das Leptotän-Stadium über, in dem die Chromosomen zu kondensieren beginnen und somit einzeln sichtbar werden. Gleichzeitig werden die axialen Elemente des synaptonemalen Komplexes entlang der Chromosomen gebildet [318] [324]. Im Zygotän-Stadium werden die Chromosomen bouquetartig angeordnet, 6
17 1.2 Anatomie des Hodens wobei sich die Telomere am Rand des Zellkerns konzentrieren. Die axialen Elemente, die nun laterale Elemente genannt werden, werden über die zentralen Elemente des synaptonemalen Komplexes zwischen den homologen Chromosomen verbunden. Dies geschieht reißverschlussartig, dabei kann der Beginn der Verknüpfung am Centromer, an den Telomeren oder an intermediären Positionen liegen. Die gepaarten Chromosomen werden als Bivalent oder Tetrade bezeichnet. Es werden in diesem Stadium Doppelstrangbrüche induziert, die zum Austausch von Information zwischen Nicht-Schwester-Chromatiden ( Cross over ) der homologen Chromosomen führen. Die Geschlechtschromosomen können in der männlichen Meiose nur an den pseudoautosomalen Bereichen paaren. Beim Übergang in das Pachytän-Stadium wird der ungepaarte Rest der Gonosomen besonders stark kondensiert und es kommt zu einer transkriptionellen Stilllegung, die Meiotic Sex Chromosome Inactivation (MSCI) genannt wird [287]. Dieser Prozess wird in Kapitel 1.4 näher erläutert. Nach dem Pachytän folgt im Diplotän-Stadium eine erste Trennung der homologen Chromosomen, die Tetradenstruktur wird nun sichtbar und der synap- Abbildung 1.4 Ablauf der Meiose Gezeigt ist der schematische Ablauf der Meiose. Die Prophase I der Meiose beinhaltet die Stadien: Leptotän, Zygotän, Pachytän, Diplotän und Diakinese. Innerhalb dieser Phase findet die homologe Rekombination statt. In der ersten Reifeteilung (Reduktionsteilung) werden die homologen Chromosomenpaare getrennt, in der zweiten Reifeteilung (Äquationsteilung) werden die Schwesterchromatiden getrennt. (verändert nach [32]) tonemale Komplex löst sich wieder auf. Anschließend folgt die Diakinese bei der sich die homologen Paare voneinander entfernen und nur noch an den Stellen, an denen ein 7
18 1 Einleitung Cross over stattgefunden hat, miteinander verbunden sind. Diese deutlich sichtbaren Strukturen werden als Chiasmata bezeichnet. In dieser Phase wird außerdem, ähnlich der Prometaphase einer Mitose, die Kernmembran aufgelöst und der Spindelapparat formiert sich für die bevorstehende Teilung. Anschließend folgt die Metaphase I, bei der die Chromosomen in der Äquatorialebene der Zelle angeordnet werden. Die Kinetochoren der Schwesterchromatiden verschmelzen hierbei, sodass die Fasern des Spindelfaserapparates an den Kinetochoren der Homologen ansetzen. In der Anaphase I zieht der Spindelfaserapparat also die homologen Chromosomen auseinander. Es folgt die Telophase I und die erste Zytokinese, bei der die sekundären, haploiden Spermatozyten entstehen, welche anschließend die Äquationsteilung durchlaufen. Diese zweite Reifeteilung erfolgt analog zu einer Mitose, wobei jedoch nur ein haploider Chromosomensatz vorhanden ist. Es entstehen also aus einem primären Spermatozyt im Verlauf der Meiose vier runde Spermatiden mit unterschiedlichem genetischem Material, die entweder ein X- oder ein Y-Chromosom tragen. Spermiogenese Die Spermiogenese stellt den Prozess dar, in dem die runden, frühen Spermatiden zu elongierten Spermatiden (testikuläre Spermatozoen) differenzieren. Dabei werden komplexe Veränderungen der Zellmorphologie und Zellphysiologie vollzogen (vgl. Abb. 1.5). Diese Veränderungen umfassen die Ausbildung eines Spermienkopfes, eines Flagellums, eines Akrosomenkomplexes und die Elongation der Zellen. Der Spermienkopf bildet sich durch die Kondensation des Zellkernes auf etwa 10 % seines ursprünglichen Volumens zurück. Dies geschieht insbesondere durch Veränderungen der Chromatin-assoziierten Proteine. Der Großteil der Histone wird hierbei durch Protamine ausgetauscht, welche eine kompaktere Verpackung des Chromatins ermöglichen. Der Zellkörper streckt sich deutlich und der Kern wird an einem der beiden Pole lokalisiert. Dort bildet sich durch Akkumulation verschiedener Proteine der Akrosomenkomplex aus. Am anderen Zellpol bildet sich, verankert am Centrosom eine Geißel aus, die der Bewegung des Spermiums dient. Das überschüssige Zytoplasma wird als Residualkörper abgeschnürt, sodass nur ein kleines Mittelstück zwischen Spermienkopf und Flagellum übrigbleibt. Dieses Mittelstück beherbergt Mitochondrien und dient der Energieversorgung der Spermatozoe. Der abgeschnürte Residualkörper wird von den Sertoli-Zellen phagozytiert. Die elongierten Spermatiden werden in das Lumen der Tubuli abgegeben und gelangen über das Rete testis und die Ductuli efferentes in den Nebenhoden, wo die Spermatozoen zu befruchtungsfähigen Spermien heranreifen [96] [245] [27] Morphologie und Kinetik der Spermatogenese Um eine kontinuierliche Spermienproduktion zu gewährleisten, erfolgt die Spermatogenese innerhalb eines Tubulus nicht synchron sondern in Wellen. Dadurch lassen sich Querschnitte der Tubuli semeniferi in unterschiedliche Stadien aufteilen, die sich in der Keimzellpopulation unterscheiden. Im humanem Keimepithel wird zwischen 6 Stadien (I-VI) [63], in murinem Gewebe zwischen 12 Stadien (I-XII) [221] differenziert. Die epithelialen Stadien der Maus sollen im folgenden Abschnitt näher erläutert werden. 8
19 1.2 Anatomie des Hodens Abbildung 1.5 Ablauf der Spermiogenese Abgebildet ist die schematische Darstellung der Spermiogenese. Im Verlauf der Spermiogenese werden die unreifen Spermatiden zu elongierten Spermatiden umgewandelt. Dabei gehen verschiedene Umbildungen einher: Ein Akrosomenkomplex bildet sich am Kopf des Spermatids, die Histone werden durch Protamine ausgetauscht und die DNA kompakter verpackt, eine lange Flagelle bildet sich, das überschüssige Zytoplasma wird als Residualkörper abgeschnürt und in das Mittelstück werden Mitochondrien dicht gepackt. (verändert nach: [8]) Die undifferenzierten Typ A-Spermatogonien (A s, A pr und A al ) kommen in allen epithelialen Stadien vor, wobei die A al -Spermatogonien aufgrund erhöhter Proliferation in Stadium X-III vermehrt vertreten sind [60]. Sie differenzieren in den Stadien VII/VIII nahezu vollständig zu A1-Spermatogonien, die darauffolgenden mitotischen Teilung verlaufen synchron. Die zeitliche Entstehung der restlichen Spermatogonien ist aus Abbildung 1.6 zu entnehmen. A1-A4 Spermatogonien sind morphologisch kaum voneinander zu unterscheiden und können mikroskopisch nur durch die Zuordnung zu einem epithelialen Stadium determiniert werden. Die Zellkerne dieser Zellen sind wenig strukturiert, da sie kaum Heterochromatin besitzen. Erst mit der Differenzierung zu In-Spermatogonien (Stadium II) bildet sich am Rand des Nukleus ein heterochromatischer Ring [60]. In den weiter differenzierten Spermatogonien (Typ B, Stadium IV) sind schließlich deutlich heterochromatische Domänen erkennbar. Anschließend folgen die primären Spermatozyten (ab Stadium VII), die auf Grund der verlängerten Prophase I der Meiose (vgl. Kap ) in sehr vielen epithelialen Stadien vorkommen. Die Morphologie der Zellen ändert sich dahingehend, dass die Nuklei der Zellen, die in die Meiose eintreten, deutlich größer werden. Die größten in einem Tubulus vorhandenen Zellen sind die Pachytän-Zellen (Stadium I-X). Am einfachsten lässt sich das epitheliale Stadium durch das Vorkommen der ver- 9
20 1 Einleitung Abbildung 1.6 Stadien des murinen Keimepithels In jeder Spalte sind die Zelltypen dargestellt, welche in dem entsprechenden Stadium vorkommen. I-XII = Epitheliale Stadien, 1-16 = Stadien der Spermiogenese, In = Intermediate Spermatogonien, B = Typ B Spermatogonien, Pl = Prä-Leptotän, L = Leptotän, Z = Zygotän, P = Pachytän, D = Diplotän, 2nd = Sekundäre Spermatozyten. (verändert nach [166]) schiedenen Entwicklungsstadien der Spermiogenese bestimmen, die sich auf alle Stadien des Keimepithels verteilen. Die Spermiogenese wird in 16 Stadien unterteilt. Stadien 1-8 umfassen die runden, 9-16 die elongierten Spermatiden. Die Keimepithelstadien I-XII setzen sich dementsprechend aus einer Kombination verschiedener Differenzierungsstadien der unterschiedlichen Keimzellen zusammen [132]. 1.3 Epigenetische Regulation Der Begriff Epigenetik setzt sich aus der griechischen Vorsilbe Epi und dem Begriff Genetik zusammen, was wörtlich übersetzt Über -Genetik bedeutet. Die Epigenetik beschäftigt sich mit allen vererbbaren Charakteristika des Chromatins, welche nicht auf Unterschieden in der DNA-Sequenz beruhen und somit über die normale Genetik hinausgehen [114]. Das Epigenom ist kein starres Gebilde wie das Genom, welches Änderungen nur über Mutationen und homologe Rekombination erfahren kann, sondern unterliegt einer ständigen dynamischen Umgestaltung. Diese Art von Information ist für einen vielzelligen Organismus essentiell, da die verschiedenen Zelltypen sehr unterschiedliche Aufgaben übernehmen, obwohl sie, bis auf wenige Ausnahmen, ein identisches Genom besitzen [235]. Mit Hilfe der epigenetischen Regulation werden bestimmte genomische Regionen, welche einzelne 10
21 1.3 Epigenetische Regulation Gene bis komplette Chromosomen umfassen können, transkriptionell beeinflusst. Dies kann sowohl durch eine Stilllegung oder eine Aktivierung der Transkription geschehen. Diese Regulation wird über epigenetische Modifikationen gesteuert, welche normalerweise an die Tochterzelle weiter gegeben werden. Sie können aber in Differenzierungsschritten gelöscht und neue Veränderungen etabliert werden. Die Gametogenese sticht hierbei besonders hervor, da nicht nur zelltypspezifische Veränderungen gelöscht werden, sondern auch epigenetische Markierungen, die von der Parentalgeneration stammen (genomisches Imprinting). Im Zusammenhang mit epigenetischer Regulation der Genexpression sind folgende Mechanismen beschrieben: DNA-Methylierung Histonmodifikationen Histonvarianten Chromatin Remodeling RNA-Interferenz Auf die ersten vier genannten Mechanismen, die direkte Veränderungen der DNA oder des Chromatins bewirken, soll im Folgenden näher eingegangen werden Übersicht über die Mechanismen der epigenetischen Regulation DNA-Methylierung Eine Möglichkeit epigenetische Informationen zu codieren stellt die direkte Modifikation der DNA über Methylierung dar. Dabei wird eine Methylgruppe an die C5 Position im Pyrimidinring eines Cytosins übertragen. Die Methylierung erfolgt an 5 -CpG-3 Dinukleotiden mit Hilfe von DNA-Methyltransferasen. Dabei kann man zwischen der Erhaltungsund der de novo-methylierung unterscheiden. Nach der Replikation wird die hemimethylierte DNA von der DNA-Methyltransferase DNMT1 erkannt und die Methylierung auf dem neu synthetisierten Strang gesetzt. Um die DNA an einem bisher noch nicht modifizierten CpG zu methylieren, sind dagegen die Proteine DNMT3a und DNMT3b notwendig [58]. Die Methylierung eines CpGs kann durch die DNA-Demethylase MBD2 (Methyl-CpG-Dömane-bindendes Protein 2) rückgängig gemacht werden [161]. Da methylierte Cytosine häufig, durch eine Desaminierung, zu einer C zu T Transition führen, sind CpG Nukleotide normalerweise im Genom unterrepräsentiert [109]. In Säugetieren sind etwa 60 % - 90 % der CpGs methyliert [87]. Eine Häufung dieses Dinukleotids kommt also vor allem dann vor, wenn die Methylierungen der Cytosine eine funktionelle Aufgabe erfüllen [250]. Einer dieser Aufgaben ist die Repression von Fremd -DNA (Retroviren, Transposable Elemente), die im Laufe der Evolution in das Genom integriert wurden [119]. Auch beim genomischen Imprinting spielt die DNA-Methylierung eine wichtige Rolle. Bei einem Gen, das dem genomischen Imprinting unterliegt wird nur eines der beiden Allele, abhängig vom parentalen Ursprung, exprimiert. Häufig ist dabei das inaktive Allel stark methyliert. Diese Methylierungsmuster werden in der Keimbahn gelöscht und anschließend neu etabliert. Dabei unterscheidet sich die Spermatogenese und die Oogenese darin, welche Gene methyliert werden [315]. Eine weitere Häufung des Dinukleotids, die man vor allem in regulatorischen Bereichen von Genen (Promotoren und up - bzw. 11
22 1 Einleitung downstream Elementen) findet, nennt man CpG-Inseln [150] [128]. Mit dem Methylierungsgrad dieser regulatorischen Elemente verändert sich die Zugänglichkeit für die Transkriptionsmaschinerie. Eine Hypomethylierung vermittelt hierbei aktive Genexpression, während Hypermethylierung zur Inaktivierung der Transkription führt. Außerdem spielt die DNA-Methylierung auch eine Rolle für die Genomstabilität, die X-Inaktivierung und die Unterdrückung der Rekombination zwischen repetitiven Regionen. Methylierungzustände der DNA können sowohl von einer Zelle auf die nächste weitergegeben, an die nächste Generation vererbt (Imprinting) oder dynamisch reguliert werden. Eine Fehlregulation der DNA-Methylierung führt zu einer fehlerhaften Genregulation und ist mit Krebsentstehung assoziiert [171] [172]. Neben der Methylierung von Cytosinen können diese auch hydroxymethyliert werden. Dabei wird ein methyliertes Cytosin mit Hilfe von TET-Enzymen (TET1-3) oxidiert [194]. Es wird diskutiert, ob die Hydroxymethylierung eine Rolle bei der Demethylierung der DNA spielt. Hydroxymethylierte Cytosine können mittels Desaminierung zu 5-Hydroxyuridin werden, welches vom BER-(Base excision repair) Sytem erkannt und aus der DNA entfernt wird [121]. Möglicherweise sind für eine globale Entfernung der Methylcytosine weitere Oxidationen zu 5-Formylcytosin oder 5-Carboxylcytosin nötig, um eine aktive Entfernung der Methylcytosine zu bewerkstelligen [113] [230]. Es konnte kürzlich gezeigt werden, dass die Hydroxymethylierung selbst in Säugetierzellen auch epigenetische Informationen darstellen kann. Die Hydroxymethylierung ist z.b. bei der Genregulation in pluripotenten Stammzellen wichtig [303]. Histonmodifikationen Neben der direkten Modifikation der DNA stellt die Modifikation von Core -Histonen eine potente Möglichkeit der epigenetischen Regulation dar. Auf Grund der Eigenschaft der DNA, dass sie als Chromatin verpackt wird, stellen diese Proteine gute Möglichkeiten dar, die Zugänglichkeit der DNA für interagierende Proteine (z.b. Transkriptionsfaktoren) zu variieren. Die Grundeinheit des Chromatins ist das Nukleosom. Es besteht aus einem Oktamer aus Core -Histonen und ist über eine Linker -DNA mit dem nächsten Nukleosom verbunden (vgl. Abb. 1.7). Das Core -Oktamer besteht aus einem Komplex von je zwei H2A, H2B, H3 und H4 Histonen. Um dieses Kernstück sind 146 bp der DNA in zwei linksgerichteten, superhelikalen Windungen angelagert. Das Histon H1 liegt an der Eintritts- bzw. der Austrittsstelle an der DNA an. Die Histone, deren Sequenzen zwischen den Eukaryoten hoch konserviert vorliegen, sind an ihren terminalen Enden reich an den basischen, positiv geladenen Aminosäuren Arginin und Lysin [163]. Diese N-Termini liegen relativ frei und können daher von entsprechenden Enzymen leicht modifiziert werden. Dementsprechend stellen die Aminosäuren in diesen Bereichen Positionen dar, an denen posttranslationale Modifikationen eingebracht werden. Die wichtigsten Modifikationen sind Acetylierung, Phosphorylierung, Ubiquitinylierung und Methylierung. Durch die Acetylierung wird eine Auflockerung des Chromatins bewirkt. Hierbei werden Acetylgruppen durch Histon-Acetyl-Transferasen (HATs) auf Lysine (K) der Histon- Enden übertragen. Von dieser Art der Modifikation sind alle vier Core-Histone betroffen. Hierdurch wird die positive Ladung des jeweiligen Aminosäurerestes abgeschwächt, was eine Dekondensation der Chromatinstruktur zur Folge hat. Die DNA wird zugänglich 12
23 1.3 Epigenetische Regulation Abbildung 1.7 Aufbau des Nukleosoms und mögliche Histonmodifikationen Schematische Übersicht über den Aufbau der Nukleosomen: 146 Basenpaare der DNA sind um ein Histonoktamer (je zwei H2A, H2B, H3 und H4- Moleküle) gewunden. Nukleosomen sind untereinander durch Linker-DNA verbunden. N-terminale Modifikationen der H3- und H4- Histone sind eingezeichnet: Kreis (rot): Acetyliertes Lysin; Kreis (blau): Methyliertes Lysin; Kreis (weiß): Methyliertes Arginin; Quadrat (grün): Phosphorylierung; Zahlen geben die jeweilige Aminosäure- Position an. für Proteine wie Transkriptionsfaktoren und Bestandteile des RNA-Polymerasekomplexes und es kommt somit zu einer gesteigerten Transkription [174]. Die Acetylierung stellt eine reversible Modifikation von Aminosäureresten dar, da sie durch Histon-Deacetylasen (HDACs) wieder entfernt werden kann. Stark acetylierte Chromatinregionen findet man in euchromatischen Regionen; in heterochromatischen Bereichen sind acetylierte Histone jedoch kaum vorhanden [148]. Eine weitere Form der Histonmodifikation, die an allen Core-Histonen stattfinden kann, ist die Phosphorylierung an Serin- (S) oder Threonin- (T) resten. Die Übertragung der Phosphatgruppe erfolgt über Proteinkinasen und ist durch Phosphatasen reversibel. Die Phosphorylierung von Histonen in bestimmten Bereichen der DNA kann sowohl zu einer Aktivierung, als auch zu einer Repression der Transkription führen, ist aber insbesondere auch für transkriptionsunabhängige Prozesse wie Apoptose, Mitose oder der DNA-Reparatur wichtig [234] [102]. Durch das Anhängen der Phosphatgruppe erhält der Aminosäurenrest eine negative Ladung, was im Normalfall, aufgrund der negativen Ladung der DNA, zu einer Auflockerung des Chromatins führt. Bei der Ubiquitinylierung von Histonen wird ein Ubiquitin-Molekül von einer E3-Ligase auf einen Lysinrest übertragen. Die Modifikation tritt an den Histonen H1, H2A, H2B und H4 auf. Bei einer Monoubiquitinylierung kann das Ubiquitin durch spezifische Proteasen 13
24 1 Einleitung wieder entfernt werden [307]. Die Monoubiquitinylierung kann sowohl Genaktivierung (ubh2b) als auch Geninaktivierung (ubh2a) zu Folge haben [307]. Neben der Monoubiquitinylierung kann ein Histon auch polyubiquitinyliert werden, indem weitere Ubiquitine an den Lysinrest (K) des vorhergehenden Ubiquitins übertragen werden. Ein polyubiquitinyliertes Histon, das mindestens vier Ubiquitine hintereinander besitzt, wird über das 26S-Proteasom abgebaut [59]. Dies ist ein Mechanismus durch den die kanonischen Histone durch seltenere Histonvarianten ausgetauscht werden, ein weiterer epigenetischer Mechanismus, auf den weiter unten eingegangen wird. Die Polyubiquitinylierung hat somit einen Einfluss auf die Chromatinstruktur, die Genexpression und die Genomstabilität [263]. Die wohl häufigste und auch äußerst komplexe Modifikation von Histonen stellt die Methylierung dar. Sie erfolgt sowohl an Lysin- (K) als auch an Arginin- (R) resten und kann als Mono-, Di- oder Trimethylierung vorliegen. Bekannte Methylierungstellen liegen auf den Histonen H1, H3 und H4 vor. Tabelle 1.1 Übersicht der Histonmodifikationen Histon AS Mod. Funktion Quelle H3 Lys4 me1 Transkriptionsaktivierung [178] Lys4 me2 Transkriptionsaktivierung, permissives [91] Euchromatin Lys4 me3 Transkriptionsaktivierung, Bivalentes [28] Chromatin Lys9 me1 Transkriptionsrepression [195] Lys9 me2 Transkriptionsrepression [306] Lys9 me3 Transkriptionsinaktivierung, DNA- [291] Methylierung, Elongation Lys27 me1 Transkriptionsaktivierung [17] Lys27 me2 Transkriptionsrepression [306] Lys27 me3 Bivalentes Chromatin, Transkriptionsrepression, [232] [49] X-Inaktivierung Lys36 me1 Transkriptionsaktivierung (Elongation) [283] Lys36 me2 Histon-Crosstalk (H3K27me), DSB- [325] [103] Repair Lys36 me3 Histon-Crosstalk (H3K27me)) [325] Lys79 me1 Funktion bisher unklar [277] Lys79 me2 Histon-Crosstalk (H2BK120ub), Zellzyklus [326] [99] Lys79 me3 Funktion bisher unklar [199] Methylierungen werden von Histon-Methyltransferasen (HMTs) gesetzt und können von Demethylasen spezifisch entfernt werden [64]. Während Methylierungen an Argininresten oft mit einer Transkriptionsaktivierung assoziiert sind [270] [26], erfüllen Methylierun- 14
25 1.3 Epigenetische Regulation gen an Lysinresten sehr vielfältige Funktionen. Die Methylierung selbst führt zu keiner Ladungsänderung der Aminosäurereste und wirkt sich damit nicht direkt auf die Chromatindichte aus. Vielmehr stellen diese Modifikationen Erkennungsmuster dar, die von epigenetischen Readern erkannt werden. Epigenetische Reader sind Proteine, die epigenetische Modifikationen über bestimmte Domänen erkennen können (vgl. auch Abschnitt 1.2.2). Neben den Readern gibt es auch Writer und Eraser -Proteine, die epigenetische Modifikationen etablieren, bzw. diese entfernen [13]. Die Interaktion von Reader und den Effektor-Proteinen führt zur fein regulierten Dynamik der Histonmodifikationen. Die verschiedenen Histonmethylierungen stellen ein komplexes Informationssystem dar, das neben Genaktivierung und -repression auch DNA-Methylierung und Imprinting beeinflussen kann [202] sowie bei der X-Chromosomeninaktivierung [55] und zahlreiche weitere biologische Prozesse eine wichtige Rolle spielen. Für die Methylierung an den Lysinen des Histons H3 sind die Funktionen in Tabelle zusammengefasst. Neben diesen häufigen und relativ gut untersuchten Modifikationen gibt es auch noch weitere bekannte posttranslationale Veränderungen wie die Deiminierung von Arginin zu Citrullin [122] [68], die Biotinylierung [271], die Sumoylierung [217], die ADP- Ribosylierung [127] und die Crotonylierung [281]. Es liegt nahe, dass vermutlich noch weitere Histonmodifikationen existieren, die bisher noch nicht untersucht wurden. Bei der Interpretation von Histonmodifikationen ist es von großer Bedeutung den Kontext mit einzubeziehen. An einem einzelnen Histonoktamer liegen verschiedene Modifikationen kombiniert vor und bilden einen sogenannten Histon-Code [173] [273] [284]. Erst durch das Zusammenspiel verschiedener Modifikationen werden viele der oben genannten Funktionen erfüllt. Die unterschiedlichen Modifikationen der Histone beeinflussen sich gegenseitig, und können andere Modifikationen induzieren, verhindern oder auch entfernen. Dieser Crosstalk, der zwischen den Modifikationen besteht, kann auch auf benachbarte Nukleosomen ausgeweitet werden, so dass es zu einer Ausbreitung eines bestimmten Histon Codes kommen kann [175] [275]. Histonvarianten Von den 5 verschiedenen Histontypen existieren viele Varianten. Neben kanonischen Varianten, die sich nur geringfügig voneinander unterscheiden gibt es auch Varianten, die sich insbesondere in ihrem N-terminalen Bereich unterscheiden und sehr spezifische Funktionen erfüllen. Im Folgenden sollen die nicht kanonischen Subtypen der Histone beschrieben werden. Das Linker-Histon H1 besitzt im murinen Organismus mindestens acht Subtypen, wovon zwei Keimbahn-spezifische Varianten darstellen [305] [226]. Der Knockout eines einzelnen somatischen H1-Subtyps führt zu keinem veränderten Phänotyp in der Maus [265] [94]. Ein kombinierter Knockout von drei Varianten (H1c, H1d und H1e) zeigte jedoch eine embryonale (E ) Letalität [265]. Überexpressionsexperimente an Zellen zeigten, dass die H1-Subtypen an der Progression des Zellzyklus (H1 ) und Transkriptionsaktivierung (H1c) beteiligt sind [41] [42]. Die Testis-spezifische Variante H1t ist ausschließlich in Meiozyten des Pachytän-Stadium bis zu frühen Spermatiden exprimiert und vermittelt vermutlich eine Lockerung der Chromatinstruktur [280]. Diese Auflockerung erleichtert wahrscheinlich die Rekombination und den Austausch der Histone durch Protamine. 15
26 1 Einleitung Knockout-Mäuse dieser Histonvariante sind allerdings fertil und zeigen eine normale Spermatogenese [179] [95] [85]. Es wird daher vermutet, dass eine Umverteilung der anderen H1-Varianten das Fehlen von H1t kompensieren kann. Daneben gibt es auch noch eine kürzlich identifizierte Oozyten-spezifische Variante H1oo, deren Funktion bisher unklar ist [282]. Für die strukturell sehr ähnlichen Histone H2A und H3 existieren mehrere Varianten. H2A bildet zusammen mit H2B ein Heterodimer innerhalb der Kernkomponente des Nukleosoms. Für H2A existieren 19 Varianten im humanen Organismus. Einige der Varianten weisen neben dem Histonanteil auch noch außerhalb des Nukleosoms liegende Proteinbereiche auf. Die Variante H2A.Bbd unterscheidet sich relativ stark zu den anderen H2A-Varianten. Diese Variante ist bei weiblichen Säugetieren am aktiven X-Chromosom angereichert und ist aus dem inaktiven X-Chromosom ausgeschlossen [54]. Die Beteiligung dieser Variante am Aufbau des Nukleosoms führt zu einer Destabilisierung des Nukleosoms unter in vitro Bedingungen [88]. Kürzlich konnte gezeigt werden, dass diese Histonvariante eine Rolle bei der Spermiogenese spielt und dort vermutlich bei dem Austausch der Histon durch Protamine beteiligt ist [147]. Eine weitere der H2A-Varianten stellt das Histon macroh2a dar, das von dem H2AFY -Gen codiert wird und in zwei Isoformen, macroh2a1 und macroh2a2, vorkommt. Beide Isoformen sind in malignen Krebszellen herab reguliert und könnten somit eine Rolle bei der Tumorsuppression spielen [153]. Außerdem reguliert macroh2a1 zusammen mit macroh2a2 die Expression des HOXA-Clusters in pluripotenten Zellen [46]. Beide Isoformen spielen außerdem eine Rolle bei der X-Chromosomeninaktivierung [53] [131] [220]. Die Variante macroh2a1 scheint aber auch bei der MSCI eine Rolle zu spielen [18]. H2AX ist eine weitere H2A-Variante. Sie spielt eine entscheidende Rolle bei der Reparatur von DNA-Schäden. Bei der Induktion von DNA-Schäden wird H2AX an Serin 139 zu γh2ax phosphoryliert [242]. Diese phosphorylierte Form der Histonvariante spielt, neben der DNA-Reparatur, eine wichtige Rolle in vielen verschiedenen Prozessen wie der Apoptose, Checkpoints des Zellzyklus, JNK-Signalling, und der MSCI [267] [227] [101] [102]. Die Histonvariante H2AZ verändert die Nukleosomenstabilität und ist bei der Transkriptionskontrolle involviert [239]. Diese Variante ist an den Promotoren von Entwicklungsgenen zu finden, die über den PRC2 reguliert werden. Dabei scheint H2AZ mit den PcG-Proteinen zu interagieren und für die Aktivierung der Gene verantwortlich zu sein [67]. Über die Varianten des Histons H2B ist relativ wenig bekannt. Das Histon bildet mit H2A ein Heterodimer aus, welche im Kern des Histon-Okatamers lokalisiert ist. Es existieren 19 Varianten im humanen Organismus, über deren spezifische Funktionen nicht viel beschrieben ist. H2B Type W-T unterscheidet sich deutlich im N-terminalen Bereich des Histons von den anderen H2B-Varianten und hat vermutlich distinkte Funktionen. Es wurde gezeigt, dass es bei der Etablierung von mitotischen Chromatin beteiligt ist [36]. Das Histon H3 ist strukturell mit H2A verwandt und bildet mit H4 ein Heterodimer aus. Im Menschen existieren für dieses Histon 6 verschiedene Varianten. H3 ist für seine große Bandbreite an möglichen posttranslationalen Modifikationen besonders wichtig für die epigenetische Regulation vieler Prozesse. Eine besondere Variante dieses Histon stellt CENPA dar. Diese Variante wird spezifisch in die Nukleosome, welche an den heterochromatischen Centromer lokalisiert sind, eingebaut [276] [129]. Bei der Ausbildung der Kinetochoren und bei der Bildung des Spindelapparates ist diese Variante essentiell [293]. 16
27 1.3 Epigenetische Regulation Die Varianten H3.1, H3.2 und H3.3 werden entweder während der Replikation oder über Induktion durch bestimmte Faktoren auch außerhalb der S-Phase eingebaut [123]. Sie sind in allen Geweben vorhanden und üben über posttranslationale Modifikationen verschiedene Funktionen aus. Außerdem existiert von H3 die gewebespezifische Variante H3.1t. Die Expression dieser Variante ist nur in den primären Spermatozyten des Hodengewebes zu finden [313]. Man vermutet, dass diese H3-Variante wichtig für die kompakte Verpackung des Chromatin innerhalb der Spermien ist [278]. H4 ist das am stärksten konservierte Histon. Obwohl H4 im humanen Organismus von 14 Genen codiert wird, gibt es nur eine einzige Variante des Histon [212]. Es kann an vielen Stellen posttranslational modifiziert werden und dient als Andockstelle für die anderen Histone [104] [108]. Chromatin Remodeling Unter Chromatin Remodeling versteht man das Zusammenspiel der Histonmodifikationen, dem ATP-abhängigen Verschieben oder Entfernen der Nukleosomen und den Austausch einzelner Histone durch spezifische Varianten. Dabei wird das Chromatin neu strukturiert und arrangiert und somit die Zugänglichkeit der DNA für Proteine verändert. In Eukaryoten wurden bisher 5 ATP-abhängige Chromatin-Remodeling -Komplexe beschrieben: SWI/SNF [189], ISWI [90], NURD/Mi-2/CHD [170], INO80 [16] und SWR1 [207]. Diese Komplexe können mit Hilfe von ATP Nukleosomen auf der DNA verschieben, verdrehen oder entfernen bzw. einzelne Histone durch Varianten austauschen [299]. Alle diese Komplexe besitzen eine ATPase Domäne und je nach ihrer Funktion weitere Domänen. Der ISWI-Komplex ist z.b. dafür verantwortlich, dass die Nukleosomen aufgebaut werden und der Abstand zwischen den einzelnen Nukleosomen einheitlich ist. Dadurch ist dieser Komplex essentiell für den Aufbau und den Erhalt der Chromatin-Struktur nach der DNA- Replikation. Im Gegensatz dazu sorgt der SWI-SNF-Komplex dafür, dass die Nukleosomen wieder verschoben werden. Er spielt zusammen mit dem INO80-Komplex eine wichtige Rolle bei DNA-Doppelstrangbrüchen und bei der DNA-Reparatur [15]. NURD/Mi-2/CHD vermittelt die Repression der Transkription und ist wichtig für den Erhalt des pluripotenten Charakters von embryonalen Stammzellen [299] [140] Die Plant Homeodomain (PHD) Die epigenetischen Informationen werden durch eine Vielzahl von Reader -Molekülen ausgelesen. Diese können über bestimmte Domänen (z.b. SANT, Chromodomain, Bromodomain, JmjC [74] [93]) an spezifische Histonmodifikationen binden. Eine weitere Domäne, für die eine Bindung an Chromatin nachgewiesen ist, ist die Plant Homeodomain (PHD). Sie wird im Folgenden detaillierter besprochen, da sie u.a. Bestandteil des Proteins SPOC1 ist, das im Rahmen der vorliegenden Arbeit näher funktionell charakterisiert wurde (vgl. Kap.1.4). Der PHD-Finger besteht aus zwei überlappenden, atypischen Zink- Finger-Motiven mit einer Cys4-His-Cys2-Struktur, über die zwei Zink-Ionen koordinativ gebunden werden [30] [13]. Von den über 100 bekannten, humanen PHD-Proteinen sind die meisten im Kern lokalisiert und übernehmen eine Rolle bei der chromatinvermittelten 17
28 1 Einleitung Genregulation [1]. Die Bindung dieser Domäne erfolgt mehrheitlich an methylierten Lysinen des Histons H3. Es existieren mehrere Subtypen der PHD-Finger, welche spezifisch bestimmte, methylierte Lysine erkennen [260]. Der PHD-Finger von SPOC1 gehört zu der Gruppe, die an H3K4me3 bindet [39]. Die PHD-Finger-Proteine können entweder reine Reader-Moleküle sein, die andere Proteine rekrutieren, oder auch selbst Effektorproteine darstellen, die Histonmodifikationen einfügen ( Writer ) oder löschen ( Eraser ). Ein Beispiel für ein Writer -Protein ist Dot1p [35], einen Eraser stellt MLL5 dar [3] Der Polycomb Repressive Complex (PRC) Einen wesentlichen Beitrag zum epigenetischen Silencing bestimmter DNA-Abschnitte wird von den Polycomb group Proteinen geleistet. Zu dieser Gruppe von Proteinen werden die Bestandteile zweier Komplexe gezählt, die des Polycomb Repressive Complex 1 (PRC1) und des analog benannten Polycomb Repressive Complex 2 (PRC2). Durch das Zusammenspiel dieser beiden Komplexe kann die Expression eines Gens dauerhaft unterdrückt werden. Dabei wird zunächst über den PRC2 eine Methylierung des Histons H3 an Lysin 27 (H3K4me2/3) eingebracht [92]. Der PRC2 besteht aus einem Zink-Finger- Protein (Suz12), dem Protein Eed, einer Methyltransferase (Ezh2) und einem Histon- Binde-Protein (RbAp48) [188] [141]. Der PRC2 spielt eine wichtige Rolle bei zahlreichen biologischen Prozessen, so u.a. bei der X-Inaktivierung [51] [231], beim Stammzellerhalt [133] und beim Imprinting [181]. Eine fehlerhafte Expression von Komponenten des PRC2 wurde auch mit Entstehung und Progression von Krebszellen assoziiert [56]. Über den PRC2 wird dann der PRC1 rekrutiert, der die durch PRC2 induzierte Repression festigt. Dies erfolgt über Chromatin remodeling und der Monoubiquitinylierung des Histons H2A an Lysin 119 (ubh2a). Diese repressive Histonmodifikation wird stabil über viele Generationen hinweg an die Tochterzellen weitergegeben. Der PRC1 besteht aus mehreren Proteinen, wobei eine wichtige Komponente die E3 Ligase RNF2/RING2 darstellt [294] [269] [233]. Als antagonistisches System zu den Polycomb group -Proteinen wirken die Proteine der Trithorax-Familie. Der TrxG-Komplex kann über Methyltransferasen die Trimethylierung des Histons 3 an Lysin 4 (H3K4me3) katalysieren. Diese Modifikation ist mit aktiv transkribierten DNA-Abschnitten assoziiert. Außerdem kann durch diesen Komplex die H3K27me3 Modifikation durch eine Acetylierung an dieser Position zu einer aktivierenden Markierung geändert werden [257]. In embryonalen Stammzellen (ES-Zellen) gibt es einige Gene (Entwicklungsgene), an die sowohl die PRC als auch die TrxG-Komplexe gebunden sind. Diese Bereiche weisen sowohl die aktivierende Histonmodifikation H3K4me3 als auch die reprimierende H3K27me3 auf. Dieser Zustand wird als bivalent bezeichnet (vgl. Abb. 1.8). Im Laufe der Differenzierung werden Entwicklungsgene auf diesem Weg schnell angeschaltet und anschließend dauerhaft stillgelegt. Zu den wichtigsten Genen, die mit diesem Mechanismus reguliert werden, zählen die HOX-Gene und andere entwicklungsspezifische Transkriptionsfaktoren [116]. 18
29 1.4 Meiotic Sex Chromosome Inactivation (MSCI) Abbildung 1.8 Bivalenter Chromatinzustand von Entwicklungsgenen in ES-Zellen Über den PRC2 wird zunächst die Trimethylierung von H3K27 induziert. PRC2 rekrutiert anschließend den PRC1 an das Chromatin. Durch PRC1 wird das Histon H2A monoubiquitinyliert, was zu Repression der Transkription führt. Während des bivalenten Zustandes von Genen bindet außerdem der TrxG-Komplex an das Chromatin und induziert die, mit aktiver Transkription assoziierte H3K4me3-Markierung. Roter Kreis: H3K27me3, grüner: Kreis H3K4me3, rotes Dreieck: H2AK119ub. 1.4 Meiotic Sex Chromosome Inactivation (MSCI) Unter Meiotic Sex Chromosome Inactivation (MSCI) versteht man die transkriptionelle Inaktivierung der Geschlechtschromosomen in der männlichen Meiose. Dieser Prozess ist essentiell für den Verlauf der Spermatogenese und wird über epigenetische Mechanismen reguliert. Der Prozess ähnelt der X-Inaktivierung bei weiblichen Säugetieren, welche der Dosiskompensation dient [61]. Im Gegensatz zur X-Inaktivierung ist die MSCI jedoch unabhängig von Xist [192] Evolution der MSCI Die MSCI tritt in nahezu allen Organismen auf, die heterologe Geschlechtschromosomen besitzen, und geht vermutlich auf den allgemeineren Prozess des Meiotic Silencing of Unsynapsed Chromatin (MSUC) [253] zurück. Bei dieser Art des Silencing werden DNA-Abschnitte, welche während der ersten meiotischen Reifeteilung über große Bereiche ungepaart vorliegen, zunächst stillgelegt und anschließend die Apoptose der Zelle induziert. Dieser Mechanismus dient vermutlich dem Schutz des Genoms vor Insertionen von Fremd-DNA, wie transposablen Elementen und Retroviren, aber auch vor der Weitergabe von erworbenen Chromosomenaberrationen und Aneuplodien an die nächste Generation [156]. Es wird angenommen, dass durch das Silencing für die Spermatogenese wichtige Gene inaktiviert werden, deren fehlende Expression zur Apoptose führen [290]. Die MSUC existiert schon in dem Schimmelpilz Neurospora crassa [262] und findet auch bei Mammaliern sowohl während der weiblichen, als auch der männlichen Meiose statt. Mit Hilfe des Modellorganismus Saccharomyces cerevisiae (Bäckerhefe) konnte gezeigt werden, dass 19
30 1 Einleitung ungepaarte DNA-Regionen während des Pachytän-Stadiums von Checkpoint -Proteinen erkannt werden, welche anschließend einen Arrest der Meiose auslösen [240]. Die Evolution heterologer Geschlechtschromosomen führte dazu, dass sich die MSCI entwickelte, bei der die Geschlechtschromosomen während des Pachytän transkriptionell inaktiviert werden [286]. Diese entwickelte sich vermutlich unabhängig voneinander, sowohl für die männliche Meiose bei Mammaliern, sowie für die weibliche Meiose bei Vögeln [182] [255]. Obwohl Spermatogenese-spezifische Gene auf dem Y-Chromosom angereichert sind, finden sich keine Gene auf den Gonosomen, deren Expression im Pachytänstadium der männlichen Meiose wichtig sind [81]. Kommt es zu einem Defekt in der MSCI, dann werden Gene exprimiert, die zum Arrest der Meiose im Pachytänstadium und zur Apoptose führen [285] Transkriptionsaktivität während der Meiose Vor dem Eintritt in die Meiose haben die Typ B-Spermatogonien ein normales, globales Transkriptionsniveau. Zu Beginn der Meiose wird die globale Transkriptionsaktivität zwar gedrosselt, ist aber genomweit auf einem gleichen Niveau [290] (vgl. Abb. 1.9). Da die Prophase I der Meiose deutlich verlängert gegenüber einer mitotischen Prophase ist, ist die fortgeführte Transkription einiger Gene für das Überleben der Zelle essentiell. Die für die unterschiedlichen Stadien der Prophase I wichtigen Gene müssen exprimiert und reguliert werden. Beim Übergang in das Pachytänstadium wird die Transkription auf den Abbildung 1.9 Zeitlicher Ablauf der MSCI Vor dem Eintritt in die Meiose sind die Gonosomen transkriptionell aktiv. Erst bei dem Übergang vom Zygotän- ins Pachytänstadium werden das X- und das Y-Chromosom stillgelegt und der XY- Body gebildet. Nach Abschluss der Meiose sind die beiden Gonosomen weiterhin transkriptionell inaktiv und liegen als Postmeiotic Sex Chromatin (PMSC) vor. (aus [287]) beiden Geschlechtschromosomen inaktiviert, während die Transkription auf den Autosomen erhalten bleibt. Die Gonosomen werden in einem subnukleären Kompartiment, dem sogenannten XY-Body lokalisiert, der an den Rand des Zellkernes wandert. Vor der Trennung der homologen Chromosomenpaare wandert der XY-Body in den zentralen Bereich des Zellkernes. Die transkriptionelle Stilllegung der Gonosomen bleibt auch über die Meiose hinaus erhalten und manifestiert sich als Postmeiotic Sex Chromatin (PM- 20
31 1.4 Meiotic Sex Chromosome Inactivation (MSCI) SC) [216]. Dieses bleibt über die gesamte Spermiogenese, bei der das Chromatin große Veränderungen erfährt (vgl. Kap Spermiogenese), bestehen Ablauf der MSCI in der Meiose Die Mechanismen, die dazu führen, dass die heterologen Geschlechtschromosomen erkannt und transkriptionell stillgelegt werden, sind noch nicht ausreichend untersucht, um diesen Prozess auf molekularer Ebene zu erklären [145]. Untersuchungen mit Hilfe von Mausmodellen konnten jedoch zeigen, dass die Induktion von Doppelstrangbrüchen im Zygotän [23] und eine Beteiligung von DNA-Reparatur-Genen ( DNA-Damage Response ; DDR- Faktoren) essentiell sind [102] [251]. Im Verlauf dieses Prozesses kommt es zu einer massiven Umstrukturierung des Chromatins der beiden Geschlechtschromosomen. Die bisher bekannten molekularen Veränderungen und die Rahmenbedingungen der Meiose sind im Folgenden dargestellt: Im Leptotän-Stadium der Reduktionsteilung der männlichen Meiose paaren die homologen Chromosomen und es werden Doppelstrangbrüche eingeführt. Diese Doppelstrangbrüche aktivieren die DNA-Reparatur-Maschinerie und der DDR-Faktor ATM (ataxia telangiectasia mutated) phosphoryliert die Histonvariante H2AX am Serin 139 (γh2ax). Dies entspricht dem Vorgang der DNA-Reparatur in somatischen Zellen [100]. Außerdem werden in diesem Stadium die ersten axialen Elemente (AEs) gebildet, an denen sich die DDR-Faktoren BRCA1 (Breast cancer 1, early onset) und ATR (ataxia telangiectasia and Rad3 related) anlagern (vgl. Abb. 1.10). Während die Autosomen im Zygotän über die gesamte Länge paaren können, ist der homologe Bereich der Gonosomen auf die pseudoautosomale Region (PAR) beschränkt. BRCA1 und ATR verschwinden von den nun gepaarten Bereichen und beschränken sich auf die noch ungepaarten Bereiche der Autosomen und der Gonosomen [258] [288]. Es kommt dort zu einer Meiose-spezifischen, ATR-abhängigen Phosphorylierung von H2AX [23]. Im Übergang vom Zygotän- in das Pachytänstadium lagern sich BRCA1 und ATR über die gesamte Länge der axialen Elemente an, das γh2ax-signal breitet sich, durch MDC1 (Mediator of DNA damage checkpoint 1) vermittelt, auch auf die außerhalb der axialen Elemente gelegenen Bereiche der Geschlechtschromosomen aus [145]. Dieses γh2ax-signal führt dazu, dass die Gonosomen in einem XY-Body, Sex-Vesicle oder Sex-Body lokalisiert werden. Dieser wird im Pachytän in die Peripherie des Zellkernes verlagert und bildet ein eigenes subnukleäres Kompartiment. Anschließend kommt es zu einer massiven Umstrukturierung des Chromatins innerhalb des XY-Bodys: Dimethylierung des Histon 3 an Lysin 9 (H3K9me2), Ubiquitinylierung des Histon 2A (H2AK119ub) und Austausch von Histonen mit Varianten wie macroh2a stellen einige wesentliche Merkmale dieses Umbauprozesses dar [137] [136]. Eine Untersuchung des PRC1 zeigte hierbei, dass der Komplex aus dem XY-Body ausgeschlossen und die Dimethylierung an H3K27 nicht vorhanden ist [279]. Diese Umstrukturierung des Chromatins führt dazu, dass die Gonosomen extrem kondensieren und die transkriptionelle Inaktivierung manifestiert wird und somit auch über die Meiose hinaus erhalten bleibt. Dies wird dann als sogenanntes Postmeiotischen Sex Chromatin (PMSC) bezeichnet [216]. 21
32 1 Einleitung Abbildung 1.10 Schematischer Ablauf der MSCI Während des Leptotänstadiums kommt es zu einer ATM-abhängigen Phosphorylierung von H2AX (grün) verteilt über den gesamten Zellkern als Antwort auf induzierte Doppelstrangbrüche. Die DDR-Faktoren BRCA1 (rot) und ATR (lila) lagern sich an die neu gebildeten axialen Elemente an. Im Zygotänstadium paaren die homologen Chromosomen und die DDR-Faktoren dissoziieren von den nun gepaarten AEs. Nur an den nicht gepaarten Stellen der Autosomen verbleiben die Faktoren, bis diese schließlich mit dem kompletten Vollzug der Synapsis verschwinden. Hierbei geht auch das Rekombinations-abhängige γh2ax-signal verloren. Da die Gonosomen nur an der pseudoautosomalen Regionen paaren, bleibt hier das Signal erhalten. Im Übergang zum Pachytän kommt es zu einer ATR-abhängigen Phosphorylierung von H2AX (grün), welche sich über die AEs hinaus über das gesamte Chromatin der Gonosomen ausbreitet. Dadurch kommt es zu Kompartimentierung der Gonosomen in den XY-Body, der an der Peripherie des Zellkerns lokalisiert wird. Im Pachytän kommt es zu einer massiven Umstrukturierung des Chromatins (orange) im XY-Body und damit zur transkriptionellen Inaktivierung. Es wird vermutet, dass die Chromatinveränderungen während der MSCI in der männlichen Meiose auch als Signal für die imprinted X-Inaktivierung (Xi) im frühen, weiblichen Säugetierembryo wirken [228]. Bei dieser Form der X-Inktivierung wird immer das paternale X inaktiviert. Die bekanntere X-Inaktivierung, bei der statistisch zufällig eines der beiden parentalen X-Chromosomen inaktiviert wird, ist eine evolutionäre neue Form der Xi, die nur bei den höheren Säugetieren (Eutheria) vorkommt [185]. Bei anderen Säugetieren (Metatheria) ist die imprinted X-Inaktivierung die einzige Form der Xi und bleibt während der gesamten somatischen Entwicklung des Organismus erhalten [117]. Bei den höheren Säugetieren wird die imprinted X-Inaktivierung jedoch wieder gelöscht indem das paternale X-Chromosom reaktiviert wird. Dies erfolgt nur in der inneren Zellmasse im Epiblasten während im Trophektoderm die imprinted X-Inaktivierung erhalten bleibt [224]. Der Anteil der Plazenta, welche vom Embryo gebildet wird, hat dementsprechend bevorzugt ein inaktives paternales X-Chromosom. 22
33 1.4 Meiotic Sex Chromosome Inactivation (MSCI) Folgen einer defekten MSCI Die MSCI ist ein essentieller Schritt in der männlichen Meiose bei Säugetieren. Findet die transkriptionelle Stilllegung der Geschlechtschromosomen nicht statt, so wird dies im Pachytän- Checkpoint erkannt und die Apoptose induziert [240] [246]. Entgeht eines der beiden Geschlechtschromosomen, z.b. durch Bereitstellung eines homologen Partners (XYY-Mäuse), der Stilllegung, dann wird ebenfalls die Apoptose induziert [289]. Es ist hierbei durchaus möglich, dass die Expression bestimmter Y-gebundener Gene (Zfy1/2 ) hierbei eine wichtige Rolle spielt [246]. Auch Defekte in Prozessen, die für die MSCI essentiell sind, führen zu einem Arrest und zur Apoptose im Pachytänstadium. Dazu zählen neben der Induktion von Doppelstrangbrüchen [23], der DNA-Reparatur [288] auch epigenetische Veränderungen des Chromatins. Es existieren mehrere Mausmodelle, bei denen eine defekte MSCI zu Infertilität in den männlichen Tieren führt. Einige wichtige Beispiele sollen hier aufgeführt werden. Eine der offensichtlich wichtigen Komponenten bei der MSCI ist die Histonvariante H2AX, deren Phosphorylierung an Serin 139 für die Formation des XY-Bodys verantwortlich gemacht wird. Ein Mausmodell, bei dem das zugehörige Gen H2AFX ausgeschaltet ist, zeigt neben einer allgemeinen genomischen Instabilität, einer Wachstumsverzögerung und einer Immundefizienz eine Infertilität der männlichen Tiere [52]. Fernandez-Capetillo et al. zeigten, dass bei diesen H2AFX -/- -Tieren die Gonosomen während des Pachytäns nicht mehr kondensieren um den XY-Body zu bilden. Die MSCI bleibt aus und es kommt zu schweren Paarungsdefekten. Außerdem lokalisieren Faktoren, wie macroh2a.1 und XMR, die für die Aufrechterhaltung der Transkriptionsinaktivierung wichtig sind nicht mehr an den Gonosomen [102]. SPO11 (Meiotic Protein Covalently Bound To DSB Homolog (S. Cerevisiae)) ist ein Protein, das für die Initiation der meiotischen Rekombination und der Synapsis benötigt wird. Dazu induziert das Protein DNA-Doppelstrangbrüche. Demnach stellt dieses Protein einen Trigger für die Phosphorylierung von H2AX dar. Es konnte mit einem Spo11 -/- -Modell gezeigt werden, dass die Defizienz dieses Proteins zu Infertilität bei männlichen Mäusen führt [244]. In einer weiteren Studie konnte mittels des Knockoutmodells von Spo11 gezeigt werden, dass ATR für die Phophorylierung von H2AX im XY-Body verantwortlich ist [23]. Für Atr existiert ebenfalls ein Knockoutmodell. Dieser Knockout ist jedoch embryonal letal [73]. Das Gen Brca1 (Breast tumor suppressor gene 1) spielt eine wichtige Rolle bei der MSCI. Es konnte gezeigt werden, dass die homozygote Deletion des Exons 11 des Brca-Gens in Kombination einer heterozygoter Deletion des Trp53 -Gens zu Infertilität der männlichen Mäuse führt. Diese Tiere zeigten eine Reduzierung in der Formation des XY-Bodys, verminderte RAD51 Foci und fehlende MLH1 Foci [316]. Weiterführende Untersuchungen ergaben, dass BRCA1 wichtig für die Lokalisation von ATR zu den Gonosomen ist [288]. Da ATR für die Phosphorylierung von H2AX verantwortlich ist (siehe oben), fehlt das γh2ax-signal an den Gonosomen und die MSCI verliert ihren Trigger. Dmrt7 bzw. Dmrtc2 (Doublesex and mab-3 related transcription factor like family C2) ist spezifisch im Pachytänstadium der männlichen Meiose exprimiert [72]. Der Verlust dieses Gens führt im Mausmodell zu Infertilität der männlichen Tiere und zur Apoptose im Pachytänstadium [154]. Die Formation des XY-Bodys verläuft bei dieser Mauslinie 23
34 1 Einleitung jedoch normal. Weitere Analysen zeigten jedoch, dass die MSCI nicht korrekt verläuft. Die Autoren vermuten eine Aktivierung von Retrotransposons, infolge dessen es zu dem Defekt in der MSCI kommt [72]. Die katalytische Untereinheit des Swi/Snf-like BAF Chromatin remodeling Komplexes BRG1, übernimmt ebenfalls eine Rolle bei der MSCI. Das Gen wird schwach in Spermatogonien und sehr stark in Pachytän-Zellen exprimiert. Ein Verlust des Gens führt zur Apoptose im Pachytänstadium und geht mit Defekten in der homologen Rekombination und der MSCI einher. Die Induktion von γh2ax scheint hierbei jedoch normal zu verlaufen [302]. Das Protein MDC1 (mediator of DNA damage checkpoint 1) ist ein Interaktionspartner von γh2ax. Ichijima et al. konnten zeigen, dass ein Knockout des Gens Mdc1 zu einer defekten MSCI führt. Dabei stellte sich heraus, dass die MSCI aus zwei Abschnitten besteht. Im ersten, von MDC1-unabhängigen Prozess werden die ungepaarten Chromosomenachsen von DDR-Faktoren (DNA damage response) erkannt. Im zweiten Abschnitt wird MDC1 benötigt um das γh2ax-signal auf die gesamten Chromosomen auszuweiten [145]. Das Gen Ago4 (Argonaute RISC Catalytic Component 4) codiert für ein Protein, das in dem microrna-pathway involviert ist. Das Protein reichert sich während des Pachytäns an ungepaarten Chromatin an. Durch ein Knockoutmodell konnte gezeigt werden, dass dieses Protein essentiell für die MSCI ist [201]. Die Spermatogonien treten aufgrund eines fehlgesteuerten Retinsäure-Pathways zu früh in die Meiose ein. Der XY-Body wird nicht korrekt ausgebildet. Interessant ist hierbei der Befund, dass es bei der Meiose zu einem Verlust vieler micrornas kommt, wobei besonders viele auf dem X-Chromosome lokalisiert sind [201]. Von den Autoren wurde postuliert, dass micrornas eine wichtige Rolle bei der MSCI spielen. Es existieren noch viele weitere beschriebene Mausmodelle, bei denen es zu einem Defekt in der MSCI und dadurch zu Infertilität bei männlichen Tieren kommt [71] [314] [4]. Dies zeigt, dass die MSCI ein essentieller Prozess bei der Spermatogenese von Säugetieren ist, bei dem eine Vielzahl von Faktoren synergistisch zusammenwirken müssen um diesen Prozess aufrecht zu erhalten. 24
35 1.5 SPOC1 1.5 SPOC1 Das Gen SPOC1 (survival time associated PHD finger protein in ovarian cancer 1 ), auch PHF13 (PHD-finger 13 ) genannt, wurde 2003 als ein differentiell exprimiertes Gen bei der Zelldifferenzierung in der humanen Wachstumsfuge gefunden [203]. Weitere Analysen zeigten, dass das Protein eine generelle Rolle bei Differenzierungsprozessen spielt. Neben einer negativen Korrelation der SPOC1 Expression mit der Überlebenschance bei Ovarialkarzinompatientinnen [204] und einer dynamischen Assoziation mit dem Chromatin während der Mitose und der Chromosomenstabilität [162] konnte auch gezeigt werden, dass SPOC1 eine wesentliche Rolle bei der murinen Spermatogenese spielt [39] [40] Aufbau der Gen- und Proteinstruktur von Spoc1 Das Gen SPOC1 ist im humanen Genom auf Chromosom 1 lokalisiert. Es nimmt einen Bereich von 10,9 kb auf dem Abschnitt 1p36.23 ein. Im murinen Genom existiert zu dieser Region ein syntäner Bereich auf Chromosom 4. Dort erstreckt sich Spoc1 über 7,1 kb in der Region 4qE2. Innerhalb der Säugetiere ist die Exon/Intron Struktur mit 4 Exons hoch konserviert (vgl. Abb. 1.11). Auch in anderen Wirbeltieren gibt es orthologe Spoc1 -Gene. Außerhalb der Gruppe der Chordaten konnte kein Ortholog identifiziert werden. Abbildung 1.11 Schematischer Aufbau des humanen SPOC1 -Gens SPOC1 besteht aus 4 Exons und 3 Introns. Der Transkriptionsstartpunkt (Pfeil) liegt in Exon 1. Die N-terminale Domäne (NTD, rot, AS 20-70) befindet sich in Exon 2, die Nukleäre Lokalisationssequenz (NLS, grün, AS ) in Exon 3. Die Plant Homeodomäne (PHD, blau, AS ) und das Stopp-Codon (Kreis) befinden sich in Exon 4. Außerdem besitzt das Protein zwei PEST-Domänen (PEST1, orange, AS Exon 2/3 und PEST2, orange, AS Exon 3). Das humane Transkript hat eine Länge von 3644 bp und einen durchgehenden offenen Leserahmen von 903 bp. Das humane SPOC1 codiert für ein Protein von 300 AS Länge, das murine Protein ist mit 296 AS nur geringfügig kleiner. Beide Proteine haben ein ähnliches Molekulargewicht von etwa 34 kda. Es konnten mehrere Domänen im SPOC1-Protein identifiziert werden. Zwei PEST-Domänen (PEST1 AS Exon 2/3 und PEST2 AS Exon 3) regulieren den Abbau des Proteins, durch das Proteasom [162]. In Exon 2 befindet sich 25
36 1 Einleitung eine N-terminale Domäne (NTD), welche in dieser Art bisher nur in SPOC1 und in seinem nächsten Verwandten, PHF23, gefunden werden konnte. Vermutlich vermittelt diese Domäne Protein-Protein-Interaktion sowohl zwischen SPOC1 und anderen Proteinen als auch die Multimerisierung von SPOC1 [256]. Die subnukleäre Lokalisation in den Nukleus wird durch die bipartite Kernlokalisationssequenz (NLS) vermittelt, welche in Exon 3 lokalisiert ist [162]. In Exon 4 gibt es außerdem eine plant homeodomain (PHD). PHD-Finger sind für ihre zahlreichen Interaktionen mit Chromatin, insbesondere mit Histon H3 bekannt [213]. Meist stellen PHD-Finger Proteine dar, die über epigenetische Mechanismen Transkription regulieren oder an der Reorganisation des Chromatins beteiligt sind [30] [1] (vgl. auch Kap ). Der PHD-Finger von Spoc1 interagiert spezifisch mit H3K4me3 [39] [256] und stellt somit einen Reader epigenetischer Informationen dar Assoziation von SPOC1 mit Krebsentstehung und -progression SPOC1 ist im humanen Genom in der chromosomalen Region 1p36.23 lokalisiert. Interessanterweise ist diese Region für eine hohe chromosomale Instabilität bekannt und ein Verlust dieser Region scheint eine Rolle bei Tumorentwicklung und -progression zu spielen [12]. Insbesondere bei Prostatakarzinomen, Glioblastomen und Brustkrebs tritt ein Verlust dieses Chromosomenabschnitts häufig auf [105] [321] [97]. Ein weiterer Hinweis dafür, dass SPOC1 eine Rolle bei der Krebsentstehung spielen könnte liefert das Protein PHF23. Dieses Protein gehört wie SPOC1 zu einer Genfamilie, die durch das Vorhandensein eines PHD-Fingers (vgl. Kap ) gekennzeichnet ist. Innerhalb dieser Familie ist PHF23 SPOC1 am ähnlichsten. Die PHD ist bei beiden Proteinen nahezu identisch und sie tragen beide eine distinkte N-terminale Domäne, welche bisher nur bei diesen beiden Proteinen identifiziert werden konnte. PHF23 ist ein Protein, das in Verbindung mit Leukämien gebracht wurde [300] [237] [238]. Es konnte gezeigt werden, dass ein Fusionsprotein von PHF23 und NUP98 zu akuter myeloischer Leukämie führt. Schließlich konnte ein signifikant erhöhtes Expressionsniveau von SPOC1 in epithelialen Ovarialkarzinomen in einigen Patienten nachgewiesen werden. Diese erhöhte Expression korrelierte mit einer geringeren 5-Jahres Überlebenschance und dem Auftreten von Residualkarzinomen [204]. Hierbei ist allerdings zu bedenken, dass die erhöhte SPOC1- Expression auf die Beteiligung von Stammzellen zurückzuführen sein kann, da dort die Expression von SPOC1 deutlich erhöht ist [162] [210]. Weitere Hinweise, dass SPOC1 eine Rolle bei der Krebsentstehung und -progression spielt liegen derzeit nicht vor. 26
37 1.5 SPOC Die Rolle von SPOC1 in der Mitose Die erhöhte Expression von SPOC1 in sich schnell teilendem Gewebe [204] deutet darauf hin, dass SPOC1 eine Rolle im Zellzyklus spielen könnte. Kinkley et al. konnten zeigen, dass SPOC1 während der Mitose dynamisch mit dem Chromatin assoziiert ist [162]. Wie Abbildung 1.12 Subzelluläre Lokalisation von SPOC1 während der Mitose Immunfluoreszenz an endogenem SPOC1 in mitotischen Zellen zeigen eine dynamische Assoziation des Proteins mit dem Chromatin. Maßstabsbalken: 10 µm. (Verändert aus [162]) in Abb zu sehen ist, wird die Lokalisation von SPOC1 im Verlauf der Mitose sehr spezifisch und dynamisch reguliert. Zunächst wird die Lokalisation des Proteins, das während der Interphase normalerweise in speckles an Chromatin angelagert ist, während der frühen Prophase kaum verändert. Im Übergang zur Metaphase (Prometaphase) trennen sich dann kondensierendes Chromatin und SPOC1. Während der Metaphase und der frühen Anaphase ist keine Kolokalisation von SPOC1 mit den Chromosomen erkennbar. Im Verlauf der Anaphase lagert sich SPOC1 wieder an das Chromatin an. Darüber hinaus konnte gezeigt werden, dass der Knockdown von SPOC1 über sirna in U2OS-Zellen zu Defekten in der Chromosomenkondensation und der Segregation der Schwesterchromatiden führt. Die Daten weisen darauf hin, dass SPOC1 unmittelbar an einer korrekten Mitose beteiligt ist. 27
38 1 Einleitung Die Rolle von SPOC1 in der Spermatogenese Bördlein et al. konnten ein Knockout-Mausmodell für Spoc1 generieren, welches der Aufklärung der Funktion von Spoc1 in vivo dienen sollte. Dazu wurde eine ES-Zelllinie des Stammes 129P2 OlaHsd verwendet, bei der in das Intron 1 des Spoc1 -Gens eine Gene trap -Kassette inseriert wurde. Es konnte gezeigt werden, dass diese Insertion zu einem vollständigen Verlust von SPOC1 auf Proteinebene führt [39] [40]. Die Untersuchung dieses funktionalen Knockouts zeigte, dass bei diesen Tieren die Spermatogenese gestört ist. Der Verlust von SPOC1 führt zu einem progressiven Verlust der Keimzellen (vgl. Abb. 1.13) und schließlich zu einem Sertoli-Cell-Only Phänotyp. Abbildung 1.13 Histologische Querschnitte der Tubuli seminiferi in Wildtyp und Spoc1 -Knockout-Gewebe Toluidinblau-Färbungen an Hoden von 5, 10 und 20 Wochen alten Wildtyp- und Spoc1 -Knockout- Mäusen zeigen deutlich einen progressiven Verlust der Keimzellen im Knockout-Gewebe. Maßstabsbalken 50 µm. (aus [39]) Es konnte ferner gezeigt werden, dass Spoc1 eine spezifisch erhöhte Expression in den undifferenzierten Spermatogonien des murinen Keimepithels aufweist [39]. Diese Expression konnte später auch für humanes Gewebe bestätigt werden [210]. Die Lokalisation des Proteins und weitere funktionale Analysen deuten darauf hin, dass SPOC1 eine Rolle bei der Transition der undifferenzierten Spermatogonien hin zu den differenzierten Spermatogonien spielt [40]. 28
39 1.6 Zielsetzung 1.6 Zielsetzung Ziel der vorliegenden Arbeit war es, die Funktion von SPOC1, anhand des vorliegenden Spoc1 -Knockout Mausmodells weiter zu charakterisieren. Zu diesem Zweck sollte die Mauslinie, welche in einem gemischt-genetischen Hintergrund (C57BL/6 x 129P2) vorlag, in den congenen C57BL/6-Hintergrund zurück gekreuzt werden. Für die Charakterisierung des Knockoutmodells sollten ausführliche Untersuchungen zu dem Phänotyp im gemischt-genetischen und congenen Hintergrund durchgeführt werden. Dazu zählen insbesondere Auffälligkeiten bei der Embryonalentwicklung, des Skelettsystems und bei der Spermatogenese. Ein weiterer Schwerpunkt der Analysen sollte auf die mögliche Funktion von SPOC1 als epigenetischer Reader gelegt werden. Dazu sollte untersucht werden, für welche Histonmethylierungen die Voraussetzungen für eine Interaktion mit SPOC1 in den undifferenzierten Spermatogonien erfüllt sind. Des weiteren sollte geklärt werden, ob durch den Knockout von Spoc1 eine Änderung der Histonmethylierungen in den undifferenzierten Spermatogonien bewirkt wird. Genomweite Expressionsanalysen sollten durchgeführt werden, um einen Aufschluss über die Funktionsweise von SPOC1 in der Spermatogenese zu erhalten. Schließlich sollten Untersuchungen durchgeführt werden, die eine mögliche Beteiligung von SPOC1 an der meiotischen Inaktivierung der Geschlechtschromosomen aufzeigen sollten. Hierbei sollten insbesondere epigenetische Veränderungen des XY-Bodys näher betrachtet werden. Mittels der gewonnenen Daten sollte ein Modell zum Wirkmechanismus von SPOC1 aufgestellt und diskutiert werden. 29
40 2 Material und Methoden Inhaltsangabe 2.1 Versuchstiere Tierhaltung Schwanzbiopsien und Genotypisierung Tötung der Versuchstiere Isolierung von Nukleinsäuren Isolierung von Plasmid-DNA Isolierung genomischer DNA aus Gewebe RNA-Isolierung aus Gewebe und Zellen Bestimmung der DNA- und RNA- Konzentration DNA- und RNA-Standardmethoden Agarose-Gelelektrophorese von DNA- und RNA-Fragmenten Isolierung von DNA-Fragmenten aus Agarosegelen Aufreinigung von DNA/RNA durch Phenol-Chloroform-Extraktion Quantitative Fällung von DNA Isopropanolfällung von PCR-Produkten Spaltung von DNA mit Restriktionsendonukleasen Aufreinigung von RNA durch DNase Verdau Klonierung Klonierung von PCR-Produkten Herstellung kleiner Inserts aus synthetischen Oligonukleotiden Phosphorylierung und Dephosphorylierung doppelsträngiger DNA Ligation doppelsträngiger DNA Transformation von Plasmiden Selektion positiver Klone PCR- und Sequenziermethoden Polymerase-Ketten-Reaktion (PCR) PCR mit dem GC-rich PCR-System Reverse Transkription Quantitative Real Time -PCR Gerichtete Mutagenese Aufreinigung von PCR-Produkten für die Sequenzierung Sequenzierreaktion und Aufreinigung DNA- und RNA-Hybridisierungsmethoden RNA FISH DNA FISH
41 2.1 Versuchstiere Genomweite Microarray-Analyse Herstellung von Präparaten und verschiedene Färbungen Herstellung von Paraffinpräparaten Hämatoxilin/Eosin (HE) Färbung Tolluidinblau Färbung Darstellung des Skeletts TUNEL-Assay Proteinmethoden Proteinisolierung aus Gewebe Bestimmung der Proteinkonzentration nach Bradford SDS-Polyacrylamid Gelelektrophorese Westernblot Immunhistochemischer Nachweis an Paraffinschnitten Immunfluoreszenz an Meiozytenspreitungen In silico Analysen Reagenzien und Materialien Puffer und Lösungen Vektoren Antikörper Bakterienstämme & Medien Mausstämme Enzyme, Kits und Standards Chemikalien, Materialien und Geräte Synthetisierte Oligonukleotide Versuchstiere Für die vorliegende Arbeit wurden Mäuse der Stämme C57Bl/6, 129/P2 und 129/Sv verwendet. Die Versuche, sowie die Zucht und Haltung der Tiere, wurden durch den Tierschutzbeauftragten genehmigt (Aktenzeichen TS-2/07). Es erfolgte eine jährliche Meldung der zu Versuchszwecken oder bestimmten anderen Zwecken verwendeten Wirbeltiere Tierhaltung Die Zucht und Haltung der Versuchstiere erfolgte im Franz-Penzoldt-Zentrum der Friedrich- Alexander-Universität Erlangen-Nürnberg. Eine Haltung unter möglichst sterilen Bedingungen wurde hierbei durch die IVC- ( individual ventilation cage ) Haltung und eine Barriere in Form einer Überdruckschleuse gewährleistet. Zu den Haltungsbedingungen gehörten außerdem ein Tag/Nacht-Rhythmus von 12/12 Stunden und eine konstante Temperatur bei 23. Die spezifische Pathogenfreiheit wurde mittels vierteljährlichem Health monitoring überwacht. Hierzu wurden Sentinel -Mäuse des Stammes Balb/c zu den Mäusen gesetzt und anschließend von der Firma Mfd Diagnostics (Wendelsheim) 31
42 2 Material und Methoden und der Gesellschaft für innovative Mikroökologie mbh (GIM, Michendorf) nach den FELASA- (Federation of European Laboratory Animal Science Association) Richtlinien auf verschiedene Viren, Bakterien, Pilze, andere Parasiten und pathologische Veränderungen getestet. Ein aktuelles Gesundheitszeugnis der gehaltenen Tiere findet sich in Anhang A.9. Ein deutlicher Befall der IVC-Population mit dem Mouse Norovirus konnte hierbei festgestellt werden, was aber auf die Versuche dieser Arbeit keinen Einfluss hatte. Die Mäuse wurden mit Zucht-Extrudat-Futter (Ssniff, Soest) und Wasser ad libitum versorgt. Für die Zucht der Tiere wurden je zwei Weibchen im fertilen Alter (8-30 Wochen) mit einem Männchen (5-50 Wochen) verpaart. Zur Erzeugung homozygoter Gene trap - Tiere wurden heterozygote Tiere verpaart. Für die Rückkreuzung in den C57Bl/6-Stamm wurden heterozygote Weibchen gemischt-genetischen Hintergrunds (129/P2 x C57Bl/6) mit congenen Wildtyp-Männchen (C57Bl/6) verpaart. Die Jungtiere wurden im Alter von 3-5 Wochen von den Elterntieren abgesetzt, mit einer ID-Nummer und einer Ohr- Markierung versehen und geschlechtsspezifisch getrennt. Zur Verwaltung der Tiere wurde das Programm PyRAT ( Python Based Relational Animal Tracking V2.3 Build 6724) verwendet Schwanzbiopsien und Genotypisierung Für die Ermittlung des Genotyps nach heterozygoter Verpaarung wurde von 3-5 Wochen alten Tieren eine 1-2 mm lange Schwanzbiospie entnommen. Aus dieser wurde mit dem nexttec Genomic DNA Isolation Kit for Tissue and Cells (Biozym, Hessisch Oldendorf) DNA isoliert und diese für eine Genotypisierungs-PCR eingesetzt. Mit zwei getrennten PCR-Ansätzen (vgl ) wurden hierbei spezifische Abschnitte des Gene trap -Konstrukts (332 bp) bzw. der Wildtyp-DNA (512 bp) amplifiziert Tötung der Versuchstiere Für die Entnahme verschiedener Organe wurden die Mäuse zunächst mit CO 2 narkotisiert und im Anschluss durch cervikale Dislokation getötet. Für statistische Zwecke wurden die Mäuse gewogen und außerdem eine weitere Schwanzbiopsie entnommen um den Genotyp zu verifizieren. Die Eröffnung der Tiere erfolgte am Abdomen auf der ventralen Seite mit sterilem Sektionsbesteck. Die entnommenen Organe wurden kurz in kaltem PBS gespült und ebenfalls gewogen. Für die weitere Verwendung wurden die Organe entweder in ein Fixans (Bouin, 10 % Formalin, 4 % PFA/PBS) gegeben, bei -70 eingefroren oder direkt weiterverarbeitet (vgl , 2.2.3). 2.2 Isolierung von Nukleinsäuren Isolierung von Plasmid-DNA Für die Isolierung geringer Mengen Plasmid-DNA (Minipräparation) wurde eine alkalische Lyse in abgewandelter Form nach Birnboim und Doly [33] durchgeführt. Dazu wurden 3 ml LB-Medium mit einem entsprechenden Antibiotikum (Ampicillin 50 µg/ml, Kanamycin 100 µg/ml oder Chloramphenicol 50 µg/ml) versetzt, mit einer Bakterienkolonie beimpft 32
43 2.2 Isolierung von Nukleinsäuren und über Nacht bei 37 im Schüttelinkubator bei 220 rpm inkubiert. Die Zellernte erfolgte durch Zentrifugation für 1 min bei g und Raumtemperatur (RT). Das Pellet wurde nach Zugabe von 300 µl Puffer P1 resuspendiert und anschließend mit 300 µl des alkalischen Lyse-Puffer P2 versetzt, durch mehrmaliges Invertieren gemischt und für 5 min bei RT inkubiert. Nach der Lyse wurde der Suspension 300 µl säurehaltigen Neutralisation- Puffer P3 zugesetzt und wiederum durch Invertieren gemischt. Nach 5 minütiger Inkubation auf Eis konnten die Zelltrümmer und die genomische DNA durch Zentrifugation (10 min, g, RT) pelletiert werden. Dem Überstand (ca. 800 µl) wurde zur Fällung der Plasmid-DNA 560 µl 100 % Isopropanol zugesetzt und gevortext. Die Plasmid-DNA wurde anschließend pelletiert (10 min, g, RT) und mit 200 µl 70 %igem Ethanol gewaschen. Nach einer weiteren Zentrifugation (20 min, g, RT) wurde das Pellet bei 37 luftgetrocknet und in 20 µl H 2 O gelöst. Zur Isolierung größerer Mengen qualitativ hochreiner Plasmid DNA wurden Kits der Firmen Qiagen und Macherey Nagel verwendet. Für Mengen bis zu 500 µg Plasmid wurde der Kit Nucleobond Xtra Midi (Macherey Nagel, Düren) und für größere Mengen der Qiagen Maxi Kit (Qiagen, Hilden) jeweils nach Herstellerangaben verwendet. Für die Lagerung der Bakterien über einen längeren Zeitraum wurden Glycerinstocks angelegt. Dazu wurden µl ÜN-Kultur mit dem gleichen Volumen 50 %igem Glycerin versetzt und bei -70 eingefroren Isolierung genomischer DNA aus Gewebe Für die Isolierung genomischer DNA aus Schwanzbiopsien für die routinemäßige Genotypisierung (vgl ) wurde der nexttec Genomic DNA Isolation Kit for Tissue and Cells (Biozym, Hessisch Oldendorf) nach Angaben des Herstellers verwendet RNA-Isolierung aus Gewebe und Zellen Um RNA aus Gewebe zu isolieren, wurden die entnommenen Organe (Milz, Darm, Embryo) gewogen, mit flüssigem Stickstoff versetzt und mit Hilfe eines Mörsers zu einem feinen Pulver gemahlen. Anschließend wurde das Pulver mit 1 ml Trizol pro 100 µg Ausgangsgewebe versetzt. Andere Organe (weiche Organe wie Hoden oder Gehirn) wurden direkt in Trizol gegeben. Nach Zugabe von Trizol wurde das Gewebe in Glashomogenisatoren überführt und für mindestens 3 min homogenisiert. Nach 5 minütiger Inkubation bei Raumtemperatur wurde der Suspension 200 µl Chloroform auf 1 ml Trizol zugesetzt und diese für 15 min stark geschüttelt. Darauf folgte eine 3 minütige Inkubation bei RT und anschließend wurden die Phasen durch Zentrifugation (15 min, g, 4 ) getrennt. Die wässrige Phase wurde danach mit 500 µl Isopropanol gefällt. Einer weiteren Inkubation (10 min, RT) folgte das Pelletieren der RNA durch Zentrifugation (10 min, g, 4 ). Die RNA wurde mit 1 ml 70 % Ethanol gewaschen, für 5 min bei g und 4 abzentrifugiert und getrocknet. Das so entstandene Pellet wurde luftgetrocknet, in 50 µl DEPC-H 2 O gelöst und für 10 min bei 55 inkubiert. Für die RNA-Isolierung aus Zellkulturen wurden die Zellen zunächst mehrfach mit PBS gewaschen. Zu den Zellen wurde anschließend 1 ml Trizol gegeben und die Zellen anschließend mit einem Zellschaber von der Oberfläche der Kulturschale gelöst. Die so entstandene 33
44 2 Material und Methoden Zellsuspension wurde in ein Eppendorfgefäß überführt und mit Hilfe einer 20 G Kanüle homogenisiert. Danach wurde, wie oben beschrieben, die RNA mittels Chloroform und Isopropanol aufgereinigt. Die RNA aus Zellen wurde allerdings in 50 µl DEPC-H 2 O gelöst Bestimmung der DNA- und RNA- Konzentration Zur Bestimmung der Konzentration einer Nukleinsäurelösung wurde diese in einem Photometer vermessen. Dafür wurden zwei verschiedene Geräte verwendet. Für die Messung am Biophotometer (Eppendorf, Hamburg) wurde die Lösung 1:100 in 10 mm TrisHCl verdünnt, während für die Messung am Infinite F200 NanoQuant (Tecan, Männedorf, Schweiz) unverdünnte Lösung eingesetzt wurde. Neben der Extinktion bei 260 nm wurde auch die Extinktion bei 280 nm gemessen, um mögliche Verunreinigungen mit Proteinen auszuschließen. Aus den beiden Absorptionswerten wurde der Quotient (E bei 260 nm/e bei 280 nm) gebildet. Liegt dieser zwischen 1,8 und 2,0 kann von einer reinen DNA/RNA- Lösung ausgegangen werden. Bei einer Extinktion (260 nm) von 1 liegt die Konzentration einer dsdna-lösung bei 50 µl/ml und die einer ssrna-lösung bei 40 µl/ml. Die Qualität und Konzentration der Nukleinsäuren wurde anschließend mittels Gelelektrophorese (vgl ) überprüft. 2.3 DNA- und RNA-Standardmethoden Agarose-Gelelektrophorese von DNA- und RNA-Fragmenten Die Auftrennung von DNA- und RNA-Fragmenten erfolgte mittels einer horizontalen Gelelektrophorese. Dazu wurden, der Größe der DNA-Fragmente entsprechend, 1-2 %ige Agarose-Lösung in TAE durch Aufkochen hergestellt. Die Proben wurden mit 1/5 Vol Ladepuffer versetzt und bei V für 20 min - 1 h aufgetrennt. Als Größenstandard wurden 5 µl 100 bp- bzw. 1 kb-ladder (Invitrogen, Karlsruhe) mit aufgetragen. Als Laufpuffer diente 1x TAE. Nach Beendigung des Laufes wurden die Gele in 0,02 % Ethidiumbromid gefärbt. Zur Dokumentation wurden sie mit Hilfe eines Transilluminators (UV Star, Biometra, Göttingen) bei UV-Licht (312 nm) fotografiert. Dazu wurde die Software BioDocAnalyze (Biometra, Göttingen) verwendet Isolierung von DNA-Fragmenten aus Agarosegelen Für die Isolierung von DNA-Fragmenten wurden die nach elektrophoretischer Auftrennung (vgl ) gefärbten Banden auf einem Transilluminator ausgeschnitten. Die Aufreinigung der DNA aus diesen Gelstücken erfolgte mit Hilfe des NucleoSpin Extract II Kit (Macherey-Nagel, Düren) nach Angaben des Herstellers Aufreinigung von DNA/RNA durch Phenol-Chloroform-Extraktion Um Nukleinsäuren nach einer Behandlung mit Enzymen (z.b. DNase vgl , Restriktionsenzymen vgl ) aufzureinigen, wurde eine Phenol-Chloroform Extraktion durchgeführt. Die Lösung wurde hierzu mit USF-H 2 O auf 100 µl aufgefüllt. Es wurden 50 µl 34
45 2.3 DNA- und RNA-Standardmethoden Phenol in TE und 50 µl Chloroform/Isoamylalkohol (25:1) zugesetzt und durch vortexen vermischt. Die Phasentrennung erfolgte für 5 min bei g und RT. Um Phenolreste vollständig zu entfernen wurde die wässrige Phase erneut mit 100 µl Chloroform/Isoamylalkohol (25:1) versetzt. Nach erneuter Phasentrennung (5 min, g, RT) wurde die wässrige, DNA-haltige Lösung abgenommen und mit Ethanol gefällt (vgl ) Quantitative Fällung von DNA Zur quantitativen Fällung von Nukleinsäuren wurde die Lösung mit 1/10 Vol 3 M Natriumacetat-Lösung (ph 5,5) und 2,5 Vol 100 % Ethanol versetzt. Nach Durchmischen der Probe erfolgte die quantitative Fällung für mindestens 30 min bei -70. Die gefällte DNA wurde anschließend für 30 min bei g und 4 pelletiert. Das Präzipitat wurde dann mit 70 % Ethanol gewaschen und erneut zentrifugiert (10 min, g, 4 ). Das Pellet wurde luftgetrocknet und in µl USF-H 2 O gelöst Isopropanolfällung von PCR-Produkten Um PCR-Produkte aufzureinigen, wurden diese mit 1 Vol 4 M Ammoniumacetat und 2 Vol 100 % Isopropanol versetzt und nach Mischen abzentrifugiert (30 min, g, 4 ). Das Pellet wurde anschließend mit 5 Vol 70 % Ethanol gewaschen und erneut abzentrifugiert (10 min g, 4 ). Das so entstandene Präzipitat wurde luftgetrocknet und in 10 µl USF-H 2 O gelöst Spaltung von DNA mit Restriktionsendonukleasen Zur gezielten Spaltung von DNA wurden Restriktionsendonukleasen der Firma New England Biolabs (Frankfurt am Main) verwendet. Die Reaktionen wurden mit den mitgelieferten Puffern und entsprechenden Zusätzen (BSA, SAM) angesetzt. Die Menge der eingesetzten Enzymmenge (U) hing dabei von der Menge (m P ) und der Länge (l P ) der zu restringierenden DNA, der Anzahl an Schnittstellen (n P ) und der Aktivität der Enzyme (gemessen an einer Referenz-DNA (Ref)) ab: U = m P lref n P l P n Ref Der Verdau erfolgte für mindestens 30 min bei 37 und wurde, wenn möglich, anschließend bei einer höheren Temperatur (vgl. Angaben des Herstellers) inaktiviert. Zur Kontrolle wurde mit 1/20 des Ansatzes eine Gelelektrophorese (vgl ) durchgeführt. Anschließend wurde der Verdau mittels Gelelution (vgl ) oder Phenol-Chloroform- Fällung (vgl ) aufgereinigt Aufreinigung von RNA durch DNase Verdau Für die Verwendung isolierter RNA (vgl ) für die quantitative Real Time-PCR (vgl ) und den GeneChip Array (vgl ) musste die RNA von Rückständen geno- 35
46 2 Material und Methoden mischer DNA gereinigt werden. Für die Verwendung der RNA im Microarray wurde das RNeasy Mini Kit (Qiagen, Hilden) nach Angaben des Herstellers verwendet. Dabei wurde der optionale DNase-Verdau auf den Säulen mit dem RNase free DNase Set (Qiagen, Hilden) durchgeführt. Für die Verwendung der RNA in der Real Time-PCR wurde sie mit der RNase-freien, rekombinanten DNase I von Roche (Mannheim) behandelt. Hierbei wurde folgender Ansatz pipettiert: Menge Reagenz µg RNA 5 µl 10 X Inkubationspuffer 2,5-10 U DNase I (Roche) 10 U RNase OUT (Invitrogen) ad 50 µl USF-H 2 O Der Ansatz wurde für 20 min bei 37 inkubiert und anschließend durch Zugabe von 2 µl 0,2 M EDTA (ph 8,0) und Erhitzen (75, 10 min) inaktiviert. Anschließend wurde die RNA mittels Phenol-Chloroform-Extraktion (vgl ) aufgereinigt und danach die cdna-synthese mittels reverser Transkription (vgl ) durchgeführt. 2.4 Klonierung Klonierung von PCR-Produkten Für die blunt end -Klonierung von PCR-Produkten wurde entweder das TOPO TA Cloning Kit von Invitrogen (Karlsruhe) oder das CloneJET PCR Cloning Kit von Fermentas (St. Leon-Rot) nach Herstellerangaben verwendet. Zur sticky end -Klonierung wurde das entsprechende DNA-Fragment mit linker -Primern mittels PCR (vgl ) amplifiziert. Sowohl das PCR-Produkt, als auch der Vektor wurden mit Restriktionsendonukleasen geschnitten (vgl ) und entweder über Phenol-Chloroform-Fällung (vgl ) oder über Gelelution (vgl ) aufgereinigt. Die so aufgereinigten Fragmente konnten für die anschließende Ligation (vgl ) verwendet werden Herstellung kleiner Inserts aus synthetischen Oligonukleotiden Um kleine Inserts (z.b. TAGs) herzustellen wurden zwei komplementäre Oligonukleotide mit passenden 3 - oder 5 -Überhängen zusammen gelagert. Dafür wurden 3 µg der Oligos in 50 µl Annealing -Puffer gemischt und in einem Cycler folgendes Programm durchgeführt: 36
47 2.4 Klonierung Temperatur Dauer Schritt 90 4:00 Denaturierung 70 10:00 Annealing 65 3:00 Annealing 60 3:00 Annealing 55 3:00 Annealing 50 3:00 Annealing 45 3:00 Annealing 40 3:00 Annealing 35 3:00 Annealing 30 5:00 Annealing 25 5:00 Annealing 15 5:00 Annealing 4 10:00 Abkühlung Die so hergestellten Inserts wurden ohne weitere Aufreinigung für die Ligation (vgl ) verwendet Phosphorylierung und Dephosphorylierung doppelsträngiger DNA Um zu verhindern, dass einfach gespaltene Vektoren mit sich selbst religieren, wurden diese dephosphoryliert. Dazu wurde der verdaute Vektor mit 2 µl Antarktischer Phosphatase von New England Biolabs (Frankfurt am Main) mit entsprechenden Puffern versetzt. Nach einstündiger Inkubation bei 37 wurde das Enzym bei 65 für 5 min inaktiviert. Der Vektor wurde ohne weitere Aufreinigung für die Ligation (vgl ) verwendet. Um PCR-Produkte mit dephosphorylierten Vektoren ligieren zu können, mussten die amplifizierten DNA-Fragmente phosphoryliert werden. Hierzu wurde folgender Ansatz verwendet: Menge Reagenz 1-20 pmol PCR-Produkt 2 µl 10 X PNK-Puffer 200 pmol ATP 10 U T4 Polynukleotidkinase (Fermentas) ad 20 µl USF-H 2 O Die Phosphorylierung erfolgte bei 37 für 30 min. Zur Inaktivierung wurde 1 µl 0,5 M ETDA ph 8,0 hinzugefügt und der Ansatz bei 75 für 10 min inkubiert. Vor der Verwendung für die Ligation wurde eine Phenol-Chloroform-Fällung (vgl ) durchgeführt. 37
48 2 Material und Methoden Ligation doppelsträngiger DNA Um DNA-Fragmente zu ligieren wurde die T4 DNA-Ligase von Fermentas (St. Leon-Rot) verwendet. Dazu wurde der linearisierte Vektor mit der dreifachen molaren Menge der Insert-DNA im folgenden Ansatz pipettiert: Menge Reagenz ng linearisierter Vektor ng Insert-DNA 2 µl 10 x Ligationspuffer 2 U T4 DNA-Ligase (Fermentas) ad 20 µl USF-H 2 O Die Ligation erfolgte für 1-16 h bei 22. Bei Elimination verwendeter Restriktionsstellen konnte durch Zugabe von 0,5 µl des entsprechenden Enzyms für 30 min bei 37 ein optionaler Nachverdau durchgeführt werden. Der Ligationsansatz wurde ohne weitere Aufreingung für die Transformation von E.coli Zellen (vgl ) verwendet Transformation von Plasmiden Für die Transformation von Plasmiden in Bakterien wurden chemisch kompetente One Shot TOP10 E.coli-Zellen (Invitrogen, Karlsruhe) verwendet. Nachdem diese Zellen (50 µl) mit Ligationsansatz (0,5-5 µl) vermischt und für 30 min auf Eis inkubiert wurden, erfolgte ein Hitzeschock (45 sec, 42 ), um die Aufnahme des Plasmids zu ermöglichen. Anschließend wurden die Zellen mit 250 µl warmen SOC-Medium versetzt und bei 37 für min bei 200 rpm inkubiert. Von diesem Transformationsansatz wurden jeweils 50 µl und 250 µl auf antibiotikahaltigen LB-Agar-Medium ausplattiert. Zum Anziehen der Kolonien wurden die Platten ün bei 37 inkubiert Selektion positiver Klone Um positive Klone zu identifizieren wurde eine Kolonie-PCR mit Vektorprimern (vgl ) oder einer Kombination aus Vektor- und Insertprimern durchgeführt. Die PCR- Reaktion wurde hierbei wie in beschrieben durchgeführt. Als Matrize diente entweder der direkt gepickte Klon oder ca. 3 µl der entsprechenden ün-kultur. Die Überprüfung positiver Klone erfolgte mittels DNA-Sequenzierung (vgl ). Für die Langzeitlagerung von Klonen wurden 500 µl ün-kultur mit der gleichen Menge 50 % Glycerin versetzt und bei -70 eingefroren. 38
49 2.5 PCR- und Sequenziermethoden 2.5 PCR- und Sequenziermethoden Polymerase-Ketten-Reaktion (PCR) Für die Amplifikation von DNA wurde standardmäßig eine Polymerase-Ketten-Reaktion (PCR) [248] in einem 50 µl Ansatz durchgeführt. Menge Reagenz 5 µl 10 x PCR-Puffer 1 M Betaine (optional) 100 nm dntps (Invitrogen) 200 nm Primer Fw 200 nm Primer Rev 10 ng - 1 µg Template 1 µl Win-TAQ (AG Winterpacht) ad 50 µl USF-H 2 O Abhängig von den verwendeten Primern und der Templates wurden die Amplifikationsbedingungen, ausgehend vom folgenden Standardprogramm, variiert: Schritt Temp. Dauer Zyklen Initiale Denaturierung 95 5 min 1 Denaturierung 95 1 min Annealing 58 1 min 35 Elongation 72 1 min Terminale Elongation min 1 Zur Durchführung des PCR-Programms wurden unterschiedliche Cycler-Geräte (vgl ) verwendet. Um die Amplifikation zu überprüfen wurde 1/10 Vol. der PCR-Reaktion auf einem 1-2 %igem Agarosegel elektrophoretisch aufgetrennt (vgl ) PCR mit dem GC-rich PCR-System Für die Amplifikation von DNA-Fragmenten, welche einen sehr hohen GC-Gehalt (>70 %) aufweisen, wurde das Kit GC-RICH PCR System (Roche, Mannheim) verwendet. Hierbei wurde nach Herstellerangaben vorgegangen Reverse Transkription Um aus mrna komplementäre DNA (cdna) herzustellen, wurden die SuperScript II Reverse Transcriptase oder die SuperScript III Reverse Transcriptase (Invitrogen, Karlsruhe) und Oligo(dT) Primer bzw. Random Hexamer Primer verwendet. Dabei wurde laut Herstellerangaben vorgegangen und 1-5 µg RNA eingesetzt. Der Reaktionsansatz wurde anschließend auf eine RNA-Ausgangskonzentration von 40 ng/µl verdünnt. Um den Erfolg der reversen Transkription zu überprüfen wurde eine Test-PCR (vgl ) 39
50 2 Material und Methoden mit Primern für die Housekeeping -Gene ActB (murin) oder GAPDH (murin/human) durchgeführt Quantitative Real Time -PCR Die quantitative Real Time-PCR (RTq-PCR) stellt eine Echtzeitmessung der Amplifikation während der PCR dar [134]. Hierbei interkaliert der Farbstoff SYBR-Green unspezifisch an die kleine Furche doppelsträngiger DNA und emittiert ein Signal bei 521 nm welches proportional zur gebildeten DNA-Menge ist. Um auszuschließen, dass das gemessene Signal aufgrund unspezifischer Produkte entstanden ist wurde jeweils eine Schmelzkurvenanalyse durchgeführt. Als passive Referenz - um Pipettierungenauigkeiten und Fluktuationen der Fluoreszenz auszugleichen - wurde der Fluoreszenzfarbstoff ROX verwendet. Die Reaktion wurde in Tripletts in einer 384 Well-Platte folgendermaßen angesetzt: Menge Reagenz 10 µl 2 x SYBR Green Mix 400 nm Primer Fw 400 nm Primer Rev 20 ng cdna ad 20 µl USF-H 2 O Die Amplifikation und Echtzeitdetektionen erfolgte in einem ABI PRISM 7900 HT Sequence Detection System von Applied Biosystems (Weiterstadt) mit folgenden Programm: Schritt Temp. Dauer Zyklen Initiale Denaturierung und Aktivierung der Polymerase min 1 Denaturierung s 45 Annealing/Elongation 58 1 min Zur Auswertung der Rohdaten wurde die Software ABI PRISM 7900 HT SDS V2.1.1 von Applied Biosystems (Weiterstadt) verwendet. Durch Festlegung der Basislinie ( Baseline ) und des Schwellenwertes ( Threshold ) wurden die C T -Werte ermittelt. Durch eine mitgeführte Standardkurve (5-80 ng cdna) konnte die Effizienz der jeweiligen Primerspezifischen Reaktion ermittelt werden. Die relative Expression wurde dann bezogen auf ein Housekeeping -Gen (G6PDH, GapDH ) mit Hilfe von Microsoft Excel berechnet (vgl. User Bulletins No.2, Applied Biosystems, Weiterstadt) Gerichtete Mutagenese Bei der gerichteten Mutagenese wird eine Mutation (Austausch von Basen, Insertionen und Deletionen, max. 4 Basen gleichzeitig) über eine PCR in ein Plasmid eingefügt. Dazu wurde der Kit QuikChange Site-Directed Mutagenesis von Stratagene (La Jolla, USA) verwendet. Folgender Reaktionsansatz wurde auf Eis pipettiert: 40
51 2.5 PCR- und Sequenziermethoden Menge Reagenz 5 µl 10 x Reaktions-Puffer 200 nm dntps (Invitrogen) 125 ng Primer Fw 125 ng Primer Rev ng Plasmid 2,5 U µ PfuTurbo DNA polymerase ad 50 µl USF-H 2 O Um das vollständige Plasmid zu amplifizieren wurde in einem Primus Cycler folgendes PCR-Programm verwendet: Schritt Temp. Dauer Zyklen Initiale Denaturierung 95 5 min 1 Denaturierung s Annealing 55 1 min 18 Elongation 68 2 min/kb Terminale Elongation min 1 Anschließend wurde das maternale Plasmid mit Hilfe der methylierungssensitiven Restriktionsendonuklase DpnI verdaut. Der Erfolg des Verdaus wurde mittels einer Agarosegelelektrophorese (vgl ) überprüft. Danach wurden 4 µl des Ansatzes für eine Transformation (vgl ) eingesetzt. Mittels Sequenzierung (vgl ) wurde die Einbringung der gewünschten Mutation überprüft Aufreinigung von PCR-Produkten für die Sequenzierung Um PCR-Produkte im 96 Well-Format für eine anschließende Sequenzierung aufzureinigen, wurde der Pipettierroboter Biomek NX (Beckmann Coulter, Krefeld) und magnetic beads (Agencourt Ampure ; Beckmann Coulter) verwendet Sequenzierreaktion und Aufreinigung Für die Sequenzierung von DNA wurde die Kettenabbruchmethode [249] verwendet, welche für die Verwendung von fluoreszierenden Didesoxynukleotiden verändert wurde [176]. Dazu wurde folgender Reaktionsansatz angesetzt: Menge Reagenz 2 µl 5 x Sequenzier-Puffer 500 nm Primer ng DNA 0,25-1 µl Big Dye Terminator Version 3.1 ad 10 µl USF-H 2 O 41
52 2 Material und Methoden Die Reaktion erfolgte in einem Thermo-, oder Eppendorf-Cycler: Schritt Temp. Dauer Zyklen Initiale Denaturierung 96 1 min 1 Denaturierung s Annealing 50 5 s 25 Elongation 60 4 min Die Aufreinigung des Sequenzieransatzes erfolgte über den Pipettierrobotor Biomek NX (Beckmann Coulter, Krefeld) mit Hilfe von magnetic beads (Agencourt CleanSeq ; Beckmann Coulter). Anschließend wurde die DNA-Sequenz an dem 48-Kapillar-Sequenziergerät ABI PRISM 3730 DNA Analyzer (Applied Biosystems, Weiterstadt) ermittelt. Die anschließende Auswertung der DNA-Sequenzen erfolgte mit den Programmen Chromas 2 (Technelysium Pty Ltd, Australien) und SeqMan II (DNA Star, Madison, USA). 42
53 2.6 DNA- und RNA-Hybridisierungsmethoden 2.6 DNA- und RNA-Hybridisierungsmethoden RNA FISH Um naszente RNA in Meiozyten nachzuweisen, wurde ein leicht verändertes Protokoll nach Mahadevaiah [186] verwendet. Herstellung der Sonden Die BAC-Klone wurden in LB-Medium, welches mit 50 mg/ml Chloramphenicol versetzt wurde, angezogen und die BACs mittels des Nucleobond Xtra Midi -Kits (Macherey Nagel, Düren) für low copy Plasmide nach Herstellerangaben isoliert. Die Markierung der Sonde mit biotinylierten Nukleotiden erfolgte mit dem BioNick DNA Labeling System (Invitrogen, Karlsruhe) mit folgendem Ansatz: Menge Reagenz 5 µl 10 x dntp Mix 1 µg Plasmid 5 µl 10 x Enzym-Mix ad 50 µl DEPC-H 2 O Die Translation erfolgte für 2 h bei 16 und wurde durch Zugabe von 5 µl Stop-Buffer beendet. Die Größe der durch die Translation erzeugten Fragmente wurde durch Gelelektrophorese (vgl ) überprüft. Zur Aufreinigung der Sonde wurde folgender Ansatz pipettiert: Menge Reagenz 5 µl Translationsansatz 3 µg mouse CotI DNA 10 µg Salmon sperm DNA 200 µl 100 % EtOH Die DNA wurde für mind. 20 min bei -80 gefällt und anschließend bei g und 4 für 10 min abzentrifugiert. Das entstandene Pellet wurde mit 70 %igem Ethanol gewaschen und erneut pelletiert. Nach Trocknung des Pellets wurde dieses in 10 µl Formamid aufgenommen und die Sonde bei -20 gelagert. 43
54 2 Material und Methoden Herstellung der Meiozytenpräparate Für die Isolierung der Meiozyten wurden frisch entnommene oder bei -80 eingefrorene Maushoden verwendet. Diese wurden mit Hilfe von Skalpellen mazeriert und die so entstandene Lösung auf Objektträger aufgetropft. Die Zellen wurden mit kaltem CSK-Puffer für 10 min permeabilisiert und anschließend mit 4 % PFA/PBS auf Eis fixiert. Anschließend erfolgte eine Dehydrierung der Zellen mittels einer aufsteigenden Ethanolreihe und die Trocknung der Objektträger. Hybridisierung der Zellen Die Sonden wurden für 10 min bei 80 denaturiert, mit Hybridisierungspuffer versetzt und für 30 min bei 37 prähybridisiert. Anschließend wurde die Sonde auf den Objektträger mit den präparierten Meiocyten aufgetropft, mit einem Deckgläschen versehen und mit Fixogum abgedichtet. Die Hybridisierung erfolgte über Nacht bei 37. Die Zellen wurden 3 mal für 5 min bei 42 in SWS-A und 2 mal in SWS-B gewaschen. Anschließend wurden die Objektträger für mind. 15 min bei RT in SWS-C inkubiert. Detektion Für die Detektion wurden die Zellen zunächst für 30 min bei 37 in Blockierlösung inkubiert. Anschließend wurde in Detektionspuffer verdünntes, mit AlexaFluor 555 gekoppeltes Streptavidin (Invitrogen, Karlsruhe) zugegeben und für 30 min bei 37 inkubiert. Nach dreifachem Waschen mit SWS-C wurde zur Verstärkung des Signals ein mit Biotin konjugierter anti-streptavidin Antikörper (Vector Laboratories, Burlingame, USA) in s auf die Zellen gegeben und diese erneut für 30 min bei 37 inkubiert. Die Zellen wurden wiederum mit SWS-C gewaschen und nochmals mit AlexaFluor 555 gekoppelten Streptavidin für 30 min bei 37 inkubiert und anschließend mit SWS-C gewaschen. Zur Identifizierung des XY-Bodys wurden die Zellen mit anti-γh2ax (Cell Signaling Technology, Inc., Danvers, USA) (1:1 000 in PBT) für 1 h bei 37 in einer feuchten Kammer inkubiert, anschließend kurz in PBT gewaschen und dann mit anti-rabbit Alexa488 (Invitrogen, Karlsruhe) (1:1 000 in PBT) für 1 h inkubiert. Die Präparate wurden mit AquaPolyMount (VWR International GmbH, Darmstadt) eingebettet und am Fluoreszenzmikroskop (AxioImager, Zeiss, Oberkochen) mit der Axiovision Software (Zeiss, Oberkochen) ausgewertet DNA FISH Um zu überprüfen, ob der Ort des RNA-FISH-Signals dem Genort entspricht wurde anschließend eine DNA-FISH durchgeführt. Herstellung der Sonden Die Plasmide wurden wie in präpariert. Die Markierung der Sonde mit Digoxigeninmarkierten Nukleotiden erfolgte mit dem DIG-Nick Translation Mix (Roche, Mannheim) mit folgendem Ansatz: 44
55 2.6 DNA- und RNA-Hybridisierungsmethoden Menge Reagenz 1 µg Plasmid 4 µl DIG-Nick-Mix ad 20 µl DEPC-H 2 O Die Translation erfolgte für 2 h bei 15 und wurde durch Zugabe von 1 µl 0,5 M EDTA (ph 8.0) und 10 minütiger Inkubation bei 65 beendet. Die Größe der durch die Translation erzeugten Fragmente wurde durch Gelektrophorese (vgl ) überprüft. Zur Aufreinigung der Sonde wurde folgender Ansatz pipettiert: Menge Reagenz 2,5 µl Translationsansatz 3 µg mouse CotI DNA 10 µg Salmon sperm DNA 200 µl 100% EtOH Die DNA wurde für mind. 20 min bei -80 gefällt und anschließend bei g und 4 für 10 min abzentrifugiert. Das entstandene Pellet wurde mit 70 %igem Ethanol gewaschen und erneut pelletiert. Nach Trocknung des Pellets wurde dieses in 10 µl Formamid aufgenommen und die Sonde bei -20 gelagert. Vorbereitung der Zellen Von den Präparaten der RNA-FISH (vgl wurde das Deckgläschen vorsichtig entfernt und die Objektträger 3 mal 5 min in PBS gewaschen. Die Histone wurden über eine Inkubation in einer Pepsin-Lösung (500 µg/ml in 10 mm HCl) angedaut. Anschließend wurden die Zellen 3 x 5 min in PBS gewaschen und dann kurz in SWS-B gespült. Für die Denaturierung der DNA wurden die Objektträger zunächst für 5 min in SWS-B bei 80 inkubiert und anschließend in 70 % Formamid in 1 x SSC für 3 min bei 80 denaturiert. Die Zellen wurden anschließend in kalten 70 %igem Ethanol für 3 min abgekühlt. Vor der Hybridisierung mit der Sonde wurde eine Dehydrierung wie in beschrieben durchgeführt. Hybridisierung der Zellen Die Sonden wurden für 10 min bei 80 denaturiert, mit Hybridisierungspuffer versetzt und für 30 min bei 37 prähybridisiert. Anschließend wurde die Sonde auf den Objektträger mit den präparierten Meiocyten aufgetropft, mit einem Deckgläschen versehen und mit Fixogum abgedichtet. Die Hybridisierung erfolgte über Nacht bei 37. Die Zellen wurden 3 mal 5 min bei 42 in SWS-A und 2 mal in SWS-B gewaschen. Anschließend wurden die Objektträger für mind. 15 min bei RT in SWS-C inkubiert. 45
56 2 Material und Methoden Detektion Für die Detektion wurden die Zellen zunächst 30 min bei 37 in Blockierlösung inkubiert. Abschließend wurde in Detektionspuffer verdünnter, mit FITC gekoppelter α-digoxigenin Antikörper (Roche, Mannheim) zugegeben und für 1 h bei 37 inkubiert. Nach dreifachem Waschen mit SWS-C wurden die Objektträger kurz in PBT gewaschen und dann mit DAPI in PBS für 2 min inkubiert. Die Präparate wurden mit AquaPolyMount (VWR, Darmstadt) eingebettet und am Fluoreszenzmikroskop (AxioImager, Zeiss, Oberkochen) mit der Axiovision Software (Zeiss, Oberkochen) ausgewertet Genomweite Microarray-Analyse Für die genomweiten Expressionsanalysen wurde der GeneChip Mouse Genome der Firma Affymetrix verwendet. Dieses DNA-Microarray Set umfasst rund murine ESTs. Es wurden aus je drei Mäusen unterschiedlichen Genotyps (Wildtyp und Spoc1 -/- ), im Alter von 5 Wochen, RNA aus Hodengewebe isoliert (vgl ), welche über den RNeasy Mini Kit (Qiagen, Hilden) mit DNaseI Verdau aufgereinigt wurden. Die Qualitätskontrolle der RNA, sowie die Analyse des GeneChips einschließlich der Auswertung der Rohdaten, erfolgte in der Affymetrix-Abteilung des Humangenetischen Institutes des Universitätsklinikums Erlangen unter der Leitung von Dr. Arif Ekici. Die Analyse der Rohdaten wurde mit der Software Eukaryote Total RNA Nano Series II durchgeführt. Eine weiterführende Analyse der differentiell exprimierten Gene wurde mit den Programmen Pathway Express ( wayne.edu/projects.htm#pathway-express), Panther ( und Microsoft Access 2007 unter Verwendung von Datensätzen des UCSC Genome Browsers ( durchgeführt. 2.7 Herstellung von Präparaten und verschiedene Färbungen Herstellung von Paraffinpräparaten Für die Herstellung von Paraffinpräparaten wurden zwei Protokolle verwendet: Formalin-Fixierung Bei dieser Fixiermethode wurde das Gewebe zunächst bei RT in 10 % Formalin fixiert. Die Dauer der Fixierung hängt hierbei von der Größe des Gewebes ab und lag zwischen 4 und 20 h. Anschließend wurde das Gewebe für mindestens 24 h mit H 2 O gewaschen. Darauf folgte eine aufsteigende Ethanolreihe (je 30 min 50 %, 70 %, 90 % und dreimal 30 min 100 % EtOH) zur Dehydrierung des Gewebes. Um das Präparat zugänglich für Paraffin zu machen wurde es für 3 mal 30 min in Roticlear (Roth, Karlsruhe) inkubiert. Das Roticlear wurde anschließend für 3 mal 60 min bei 60 mit Paraffin substituiert. Die mit Paraffin komplett durchtränkten Präparate wurden eingebettet und bei 4 gelagert. 46
57 2.7 Herstellung von Präparaten und verschiedene Färbungen PFA-Fixierung Als zweite Fixiermethode wurde die Fixierung mit Paraformaldehyd (PFA) verwendet. Dazu wurde das Gewebe über Nacht in 4 % PFA/PBS bei 4 inkubiert und das Präparat anschließend über eine aufsteigende Ethanol-/Isopropanolreihe (je 3 mal 20 min 50 %, 70 %, 95 % EtOH und 100 % Isopropanol) dehydriert. Nach kurzem Spülen mit Roticlear folgten zwei 30 minütige Schritte in Roticlear. Die Substitution mit Paraffin und die Einbettung erfolgte wie bei der Fixierung mit Formalin. Herstellung von Paraffinschnitten Für die Herstellung von Paraffinschnitten wurde ein Rotationsmikrotom (HM340E, Microm, Walldorf) verwendet. Es wurden Schnitte mit einer Dicke von 5 µm hergestellt, diese in einem kalten Wasserbad auf die Objekträger aufgezogen und in einem 50 warmen Wasserbad gestreckt. Die Schnitte wurden über Nacht bei 37 getrocknet und konnten so für maximal 2 Monate gelagert werden Hämatoxilin/Eosin (HE) Färbung Um Gewebeschnitte histologisch zu untersuchen, wurde eine Hämatoxilin/Eosin (HE)- Färbung durchgeführt. Hierzu wurden getrocknete Paraffinschnitte zunächst durch die Zugaben von Roticlear und der Durchführung einer absteigenden Ethanolreihe rehydriert. Anschließend wurden die Schnitte in PBS gewaschen und für 3 min in Hämatoxilin (Sigma Aldrich, München) inkubiert. Nach 10 minütigem Bläuen unter fließendem Leitungswasser erfolgte eine 3 minütige Inkubation in Eosin (Sigma Aldrich, München). Die Schnitte wurden in destilliertem Wasser gewaschen und über eine aufsteigende Ethanolreihe dehydriert. Vor dem Einbetten mit Organo/Limonene Mount (Sigma Aldrich, München) wurden die Objekträger für 5 min in Roticlear gegeben Tolluidinblau Färbung Um Gewebeschnitte mit Toluidinblau zu färben, wurden die Objektträger zunächst mehrfach in Roticlear inkubiert, bevor sie über eine absteigende Isopropanolreihe in 70 % Isopronaol gebracht wurden. Die Färbung mit einer 0,1 %igen Toluidinblau-Lösung in 70 % Isopropanol erfolgte für 8 h. Vor dem Einbetten mit Organo/Limonene Mount (Sigma Aldrich, München) wurden die Schnitte über eine aufsteigende Isopropanolreihe vollständig dehydriert Darstellung des Skeletts Zur Darstellung des Skeletts adulter Mäuse wurden die Tiere nach Tötung komplett entweidet und das Fell abgezogen. Das Präparat wurde über Nacht in 96 %igem techn. Ethanol gewaschen und anschließend für 24 h in Aceton eingelegt. Nach Spülung in techn. Ethanol wurde die Knorpelfärbung durchgeführt. Dazu wurde die Färbelösung mit 0,015 % Alcian Blau GX (Sigma Aldrich, München) mit 0,2 % (V/V) Eisessig in techn. Ethanol 47
58 2 Material und Methoden für 24 h auf das Präparat gegeben. Anschließend wurde mehrfach in techn. Ethanol gespült und für mind. 24 h darin inkubiert. Danach erfolgte das Bleichen des Gewebes mit einer 2 %igen KOH-Lösung bei 4 für 24 h. Um das Knochengewebe zu Färben wurde das Präparat für 6 h in einer 0,005 %igen Alizarin Rot (Sigma Aldrich, München)-Lösung in 2 % KOH inkubiert. Um das restliche Gewebe (insbesondere Muskelgewebe) von dem Skelett zu lösen, wurde es in 5 % KOH eingelegt. Anschließend wurde die Bleiche über eine aufsteigende Reihe durch Glycerin ersetzt, um das Gewebe zu lagern TUNEL-Assay Um apoptotische Zellen zu identifizieren, wurde entweder eine immunhistochemische Färbung mit akt. Caspase 3 (vgl ) oder ein TUNEL ( TdT-mediated dutp-biotin nick end labeling )-Assay durchgeführt. Bei diesem Assay handelt es sich um den Nachweis fragmentierter DNA, wie sie bei der Apoptose entsteht [111][218]. Hierbei wird über das Enzym terminale desoxynucleotyl Transferase (TdT) biotinylierte Nukleotide (BIO-dUTP) an die Enden der fragmentierten DNA angelagert, welche anschließend mittels einer Antikörperreaktion nachgewiesen werden können. Zur Durchführung des TUNEL-Assay wurde der In Situ Cell Death Detection Kit, AP (Roche, Mannheim) nach Angaben des Herstellers verwendet. Die Auswertung erfolgte am AxioImager Fluoreszenzmikrospkop (Zeiss, Oberkochen). 2.8 Proteinmethoden Proteinisolierung aus Gewebe Die Protein-Isolierung erfolgte, indem zunächst mg Gewebe mit Hilfe von flüssigen Stickstoff zermörsert und in µl RIPA-Puffer aufgenommen wurde. Das homogenisierte Gewebe wurde geschert, indem es mehrfach durch eine 20 G Kanüle auf- und abgezogen wurde. Nach einem Inkubationsschritt (30 min auf Eis) wurde zur Entfernung der Zelltrümmer, das Lysat für 20 min bei 4 und g zentrifugiert. Der Überstand wurde erneut zentrifugiert und anschließend zur Entfernung von kleineren Zellresten 1 h bei 4 und g zentrifugiert. Das Lysat wurde anschließend aliquotiert und bei -80 gelagert Bestimmung der Proteinkonzentration nach Bradford Um die Proteinkonzentration einer Probe zu ermitteln, wurde der sogenannte Bradford- Assay [38] verwendet. Zur Erstellung der Eichkurve wurden BSA-Verdünnungen (Endkonzentration 1 bis 25 µg/ml) hergestellt, mit 1/5 Vol Bradfordreagenz gemischt und für 5 min bei Raumtemperatur inkubiert. Die Absorptionsmessung erfolgte bei 595 nm im Photometer (Biometra, Gottingen). Die Proben, deren Proteingehalt bestimmt werden sollte, wurden 1:100-1:1 000 in USF-H 2 O verdünnt und ebenfalls nach Zugabe von 1/5 Vol Bradfordreagenz und 5 minütiger Inkubation photometrisch vermessen. Die Proteinkonzentration konnte mit Hilfe der erstellten Eichkurve ermittelt werden. 48
59 2.8 Proteinmethoden SDS-Polyacrylamid Gelelektrophorese Durch die SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE) können Proteine aufgrund ihrer relativen Molekülmasse aufgetrennt werden [169]. Natriumdodecylsulfat (SDS) lagert sich an hydrophobe Bereiche der Proteine an, wodurch eine Entfaltung der Proteine bewirkt wird. Gleichzeitig wird durch die Einführung negativer Ladungen die Eigenladung der Proteine vernachlässigbar, sodass die Moleküle ausschließlich nach ihrer Molekülmasse aufgetrennt werden können. Zur SDS-PAGE wurden je 15 µg Proteinlösung mit 3 x Laemmli Ladepuffer versetzt und für 5 min bei 96 aufgekocht. Die gelelektrophoretische Auftrennung erfolgte auf 1 mm dicken PAA (Polyacrylamid)-Gelen, wobei das Sammelgel 5 % und das Trenngel 15 % Acrylamid enthielt. Die Gelelektrophorese erfolgte erst bei 80 V, bis die Proben in das Trenngel eingelaufen waren (ca. 20 min) und anschließend bei 150 V für 60 min. Als Laufpuffer wurde Tris-Glycin-Puffer verwendet, als Standard diente PageRuler von Fermentas Westernblot Der Proteintransfer von einem PAA-Gel (vgl ) auf eine Nitrocellulosemembran (Porengröße 0,2 µm) erfolgte unter Verwendung der Fastblot Apparatur von Whatman Biometra mit kontinuierlichem Puffersystem, entsprechend den Angaben des Herstellers. Der Transfer erfolgte für 30 min bei 125 ma (für 1 Gel) bzw. 250 ma (für 2 Gele). Zur Überprüfung des Transfers wurde die Membran 2 min in Ponceau-Lösung (Sigma Aldrich, Taufkirchen) inkubiert, wodurch Proteine unspezifisch angefärbt werden und anschließend in TBST gewaschen. Um freie Bindungsstellen auf der Membran zu blockieren, wurde die Membran über Nacht mit 5 % Milchpulver in TBS bei 4 inkubiert. Am nächsten Tag wurde der Primärantikörper in 5 % Milchpulver in TBST verdünnt und unter leichtem Schütteln eine Stunde bei Raumtemperatur mit der Membran inkubiert. Nach dreimaligem Waschen (1 mal 15 min, 2 mal 5 min) mit TBST wurde der HRP2-gekoppelte sekundäre Antikörper ebenfalls in 5 % Milchpulver in TBST verdünnt und eine Stunde bei Raumtemperatur mit der Membran inkubiert. Nach weiteren Waschschritten von 1 mal 15 min und 2 mal 5 min mit TBST erfolgte die Detektion durch enhanced chemiluminescence. Dazu wurden die Western Blotting Chemiluminescence Luminol Reagenzien (Thermo, Birmingham) im Verhältnis 1:1 gemischt und die Membran 2 min damit inkubiert. Nach Abtropfen der Lösung wurde die Membran eingeschweißt und ein Röntgenfilm (Hyperfilm ECL, Amersham, Freiburg) aufgelegt. Die Exposition erfolgte für 5-30 min. Anschließend wurde der Film entwickelt, fixiert und getrocknet Immunhistochemischer Nachweis an Paraffinschnitten Um Proteine in Paraffinschnitten nachzuweisen, wurden zum einem Antikörper verwendet, die mittels der Avidin-Biotin-Komplex- (ABC) Technik [139] arbeiten. Zum anderen wurden fluoreszenzgekoppelte Antikörper eingesetzt. 49
60 2 Material und Methoden ABC-Technik Für die Färbung der Proteine mit einer Peroxidase-Reaktion wurde der Vectastain ABC Elite Kit (Vector Laboratories, Burlingame, USA) verwendet. Die getrockneten Paraffinschnitte (vgl ) wurden zunächst über einen mehrfachen Waschschritt mit Roticlear (3 x 10 min) entparaffiniert und anschließend über eine absteigende Ethanolreihe rehydriert (3 x 100 %, 90 %, 70 % und 50 % EtOH, je 10 min). Nach einem 10 minütigen Waschschritt in PBS erfolgte die Demaskierung der Antigenbindestellen, indem die Schnitte für 1 h bei 95 in 10 mm Citratpuffer unter leichtem Schütteln inkubiert wurden. Die Inaktivierung der endogenen Peroxidase erfolgte für 30 min in 0,3 % H 2 O 2 /10% Methanol in PBS bei RT. Nach Waschen der Schnitte in PBS (2 x 5 min) wurden die Schnitte für 20 min in 0,5 % Triton X-100 in PBS permeabilisiert. Danach wurden die Schnitte mit Blockierlösung (1,5 % Goatserum in PBS) für mind. 1 h inkubiert, um unspezifische Bindestellen abzusättigen. Die Inkubation mit dem primären Antikörper (Verdünnt in Blockierlösung) erfolgte ün bei 4 in einer feuchten Kammer. Nach der Inkubation wurden die Schnitte 3 mal 10 min in PBS gewaschen, bevor der sekundäre, biotinylierte, Antiköper hinzugegeben wurde. Anschließend wurden die Präparate für 1-2 h bei RT inkubiert. Die verwendeten Verdünnungen sind der Tabelle in Kap zu entnehmen. Nach erneutem dreimaligen Waschen in PBS wurden die Schnitte für 30 min mit dem ABC-Komplex (Kit), bestehend aus Avidin und biotinylierter Peroxidase, inkubiert. Anschließend wurden die Schnitte zweimal für 5 min in PBS gewaschen, bevor die Umsetzung des Substrates Diaminobenzidin (DAB, Vector Laboratories, Burlingame, USA) erfolgte. Die Färbereaktion, die sich durch Bildung eines braunen Niederschlags auszeichnet, wurde optisch verfolgt und bei ausreichender Färbung durch Überführen der Schnitte in Leitungswasser abgestoppt. Die Schnitte wurden mit Mayer s Hämalaun (Roth, Karlsruhe) gegengefärbt und für 10 min unter fließendem Leitungswasser gebläut. Anschließend wurden die Schnitte mit Crystal/Mount (Sigma Aldrich, Taufkirchen) und Clarion (Sigma Aldrich, Taufkirchen) Mounting Medium eingedeckelt. Die Auswertung erfolgte am Stereomikroskop MZ16 (Leica, Wetzlar). Fluoreszenz-Nachweis Bei der Verwendung von Fluoreszenz-markierten Sekundärantikörpern wurde das oben beschriebene Protokoll leicht verändert. Die Inaktivierung der endogenen Peroxidase ist hierbei nicht nötig und wurde somit nicht durchgeführt. Als Blockierlösung wurde ein Gemisch aus Ovalbumin, Fischgelatine und NaCl in PBT (NOFPT-Puffer) verwendet. Außerdem wurde nach der Inkubation mit dem sekundären Antikörper direkt die Gegenfärbung mit DAPI (4,6-Diamidin-2-phenylindol) durchgeführt und anschließend die Schnitte mit AquaPolyMount (VWR, Darmstadt) eingedeckelt. Nach Aushärten des Einbettmediums bei 4 wurden die Schnitte am AxioImager (Zeiss, Oberkochen) ausgewertet Immunfluoreszenz an Meiozytenspreitungen Für die immuncytologische Untersuchung von nukleären Proteinen während der Meiose wurden unterschiedliche Methoden der Meiozytenspreitung verwendet. Zum einen wurde zur Untersuchung der Doppelstrangbrüche, die während des Zygotän eingeführt werden, 50
61 2.9 In silico Analysen ein von Scherthan et al. [252] optimiertes Protokoll verwendet. Zum anderen wurde zur detaillierten Untersuchung von Histonmodifikationen innerhalb des XY-Bodys im Pächytänstadium ein verändertes Protokoll nach Mahadevaiah [186] verwendet. 2D-Spreitung Um die Darstellung des synaptonemalen Komplexes während der Meiose zu ermöglichen, wurde das Hodengewebe auf Eis in eine 0,9 %ige NaCl Lösung überführt, die mit der entsprechenden Menge Proteinase Inhibitor ( complete mini, Roche, Mannheim) versetzt wurde. Nach Zerkleinern des Gewebes wurde die Suspension durch ein 0,45 µm Sieb filtriert und auf Objektträger aufgetropft. Die Zellen wurden durch die Zugabe des Detergenz Lipsol (0,25 %ig) aufgeschlossen und anschließend mit Peters Fixans fixiert. Die Objektträger wurden luftgetrocknet und danach kurz in 0,5 % Glycin in PBS und anschließend in H 2 O gewaschen. Danach folgte eine Färbung mit fluoreszenzmarkierten Antikörpern, wie in beschrieben. 3D-Spreitung Da es für die detaillierte Lokalisation von Proteinen wichtig ist, dass die dreidimensionale Struktur des Zellkerns erhalten bleibt. Um dies zu ermöglichen wurden die Meiozyten wie für die FISH-Analysen präpariert (vgl. RNA-FISH 2.7.4). Nach der Fixierung in 4 % PFA/PBS folgten drei Waschschritte in PBT für 3 min, bevor die Zellen in Blockierlösung (RNA-FISH) für 1 h bei 37 inkubiert wurden. Der primäre Antikörper wurde in PBT verdünnt und für 1 h bei 37 auf die Präparate gegeben. Die Zellen wurden anschließend 3 mal 3 min in PBT gewaschen, bevor der sekundäre Antikörper (in PBT) zugegeben wurde und die Präparate wiederum für 1 h inkubiert wurden. Die Antikörperverdünnungen sind der Tabelle in Kap zu entnehmen. Danach wurden die Zellen 3 x 3 min in PBT gewaschen und anschließend mit DAPI gegengefärbt und wie in eingedeckelt. 2.9 In silico Analysen Für Homologievergleiche mit Nukleotiddatenbanken wurden die Programme BLASTN vom NCBI-Server (National Center for Biotechnology Information, nlm.nih.gov) und UCSC Genome Browser ( verwendet. Für Gen- und Exonvorhersagen diente GENSCAN ( html). In silico-analysen zu den Genprodukten erfolgten unter Verwendung der auf dem EXPASY Molecular Biology Server zur Verfügung gestellten Programme ( expasy.org). Eine Vorhersage des Molekulargewichts ermöglicht das Compute pi/mw tool ( Der Primerdesign erfolgte in der Regel mit dem auf Primer3 basierenden tool Primer-BLAST ( nih.gov/tools/primer-blast/index.cgi?link_loc=blasthome) 51
62 2 Material und Methoden 2.10 Reagenzien und Materialien Puffer und Lösungen Alizarinrot-Lösung Alzianblau-Lösung Annealing Puffer 0,005 % w/v Alizarinrot 2 % KOH 0,015 % w/v Alzianblau 8 GX 75 % v/v Ethanol 20 % v/v Essigsäure 100 mm NaCl 50 mm HEPES; ph 7,4 Anodenpuffer I 300 mm Tris (für Western Blot) 620 % v/v Methanol; ph 10,4 Anodenpuffer II 25 mm Tris (für Western Blot) 20 % v/v Methanol; ph 10,4 Blockierlösung (IHC) Blocking Buffer (RNA-FISH) Citratpuffer (10 mm) CSK-Puffer (RNA-FISH) DNA/RNA-Ladepuffer (6 x) 0,5 M NaCl 0,1 % w/v Ovalbumin 0,5 % v/v Fischgelatine 0,01 % v/v Tween-20 1 x PBS 4 x SSC 4 mg/ml BSA 0,1 % Tween-20 1,8 mm Citronensäure-Monohydrat 8,2 mm Tri-Natriumcitrat-Dihydrat 100 mm NaCl 300 mm Sucrose 3 mm MgCl 2 10 mm PIPES ph 6,0 0,25 % w/v Bromphenolblau 0,25 % w/v Xylencyanol FF 30 % v/v Glycerin Formalin (10 %) 55 mm Na 2 HPO 4 12 mm NaH 2 PO 4 x 2H 2 O 100 % v/v Formaldehyd Kathodenpuffer (für Western Blot) 25 mm Tris 40 mm 6-Aminohexansäure 20 % v/v Methanol; ph 9,4 Lämmli-Puffer (3 x) 0,312 M Tris-HCl ph 6,8 10 % w/v SDS 25 % v/v β-mercaptoethanol 52
63 2.10 Reagenzien und Materialien 0,05 % w/v Bromphenolblau 10 % v/v Glycerin Lysepuffer 150 mm NaCl (für Zellen) 50 mm Tris/HCl, ph 8,0 1 % v/v TritonX-100 MAB (1x) Mowiol NTE NTM (1x) 0,1 M Maleinsäure 0,15 M NaCl, ph 7,5 6 g Glycerol 2,4 g Mowiol 6 ml H 2 O 12 ml 0,2 M Tris-HCl, ph 8,5 0,5 M NaCl 10 mm Tris/HCl, ph 7,0 5 mm EDTA, ph 8,0 0,1 M NaCl 0,1 M Tris/HCl, ph 9,5 0,05 M MgCl 2 PAA-Gel (12 %) 375 mm Tris/HCl, ph 8,8 12 % Acrylamid 0,1 % SDS 0,1 % APS 0,04 % TEMED PAA-Gel (5 %) 125 mm Tris/HCl, ph 6,8 5 % Acrylamid 0,1 % SDS 0,1 % APS 0,1 % TEMED PBS (10 x) PBST PCR-Puffer 1,37 M NaCl 65 mm Na 2 HPO 4 2 H 2 O 27 mm KCl 11,5 mm KH 2 PO 4 PBS 0,1 % Tween mm KCl 100 mm Tris 15 mm MgCl 2 PE (10x) 100 mm PIPES ph 6,8 10 mm EDTA ph 8,0 PFA-Lösung Ponceau-Färbelösung (10 x) 4 % (w/v) PFA in 1 PBS 2 % w/v Ponceau 53
64 2 Material und Methoden Proteinase K-Puffer 30 % w/v Trichloressigsäure 30 % w/v Sulfosalicylsäure 20 mm Tris/HCl 1 mm EDTA ph 7,2 in DEPC-H 2 O Puffer P1 50 mm Tris HCl, ph 8,0 10 mm EDTA 100 µg/ml Rnase A Puffer P2 200 mm NaOH 1 % SDS Puffer P3 3 M KaAc, ph 5,0 RIPA-Puffer 50 mm TrisHCl ph mm NaCl 1 % v/v NP-40 0,5 % w/v Na-Deoxycholate 0,1 % w/v SDS SSC (20 x) TAE (1 x) TBE (1 x) TBS (10 x) TBST Tris-Glycin Elektrophorese-Puffer (für Westernblot Gellauf) Towbin s Electrotransfer Buffer 3 M NaCl 0,3 M Na 3 -Citrat; ph 7,0 40 mm Tris 40 mm Essigsäure 1 mm EDTA; ph 8,3 90 mm Tris 90 mm Borsäure 1,25 mm EDTA; ph 8,3 25 mm Tris 1,37 M NaCl, ph 7,6 27 mm KCl 1TBS 0,1 % Tween mm Tris 250 mm Glycin 0,1 % w/v SDS; ph 8,3 25 mm Tris 192 mm Glycin; ph 8,3 20 % v/v Methanol 54
65 2.10 Reagenzien und Materialien Vektoren pcr 4-TOPO Invitrogen, Karlsruhe pcr 2.1-TOPO Invitrogen, Karlsruhe pcdna 3.1 (+) Invitrogen, Karlsruhe pcdna 3.1 (+)/HA-His A Invitrogen, Karlsruhe pcdna 3.1 (+)/myc-his A Invitrogen, Karlsruhe pcdna 3.1 (+)/FLAG A Invitrogen, Karlsruhe pjet 1.2/blunt Fermentas, St. Leon- Rot Antikörper Primäre Antikörper gegen Spezies Verdünnung Herkunft ProduktNr. Actin Rabbit 1:3 000 Santa Cruz sc1616-r BMI-1 Mouse 1:100 Active Motif BRCA1 Rabbit 1:50 Antibodies online ABIN Claudin11 Rabbit 1:100 Santa Cruz sc GATA-1 (N1) Rat 1:200 Santa Cruz sc-266 γ-h2ax Rabbit 1:500 Biomol IHC γ-h2ax Rabbit 1:500 Cell Signaling 9718 H2AK119ub Mouse 1:200 Millipore H3K4me2 Rabbit 1:500 Cell Signaling 9725 H3K4me3 Rabbit 1:500 Cell Signaling 9751 H3K9me2 Rabbit 1:500 Cell Signaling 9753 H3K9me3 Rabbit 1:500 Cell Signaling 9754 H3K9me3 Rabbit 1:1 000 Ref. [229] H3K9me3 Rabbit 1:500 Life Technologies H3K27me2 Rabbit 1:500 Cell Signaling 9728 H3K27me3 Rabbit 1:500 Cell Signaling 9733 H3K36me2 Rabbit 1:500 Cell Signaling 2901 H3K36me3 Rabbit 1:500 Cell Signaling 4909 H3K79me2 Rabbit 1:500 Cell Signaling 9757 H3K79me3 Rabbit 1:500 Cell Signaling 4260 H3K9ac Rabbit 1:500 Cell Signaling 9649 H3K14ac Rabbit 1:500 Cell Signaling 4318 H3K18ac Rabbit 1:500 Cell Signaling 9675 H3K27ac Rabbit 1:500 Cell Signaling 4353 H3K56ac Rabbit 1:500 Cell Signaling 4243 H3S10P Mouse 1:200 Millipore H4K20me2 Rabbit 1:200 Active Motif Histone H3 Rabbit 1:500 Cell Signaling 4499 KI67 Rabbit 1:200 Abcam ab
66 2 Material und Methoden gegen Spezies Verdünnung Herkunft ProduktNr. macroh2a1 Rabbit 1:100 Active Motif MRE11 Rabbit 1:200 Novus Biologicals NB NGN3 Goat 1:200 Sanat Cruz sc OCT4 (POU5F1) Rabbit 1:100 Sigma P 0873 PCNA Rabbit 1: Abcam ab2426 PHC1 Goat 1:100 Santa Cruz sc PHC2 Mouse 1:100 Active Motif Phospho-ATM Mouse 1:100 Active Motif PLZF (D9) Mouse 1:250 Santa Cruz sc RNA-Polymerase II Mouse 1:100 Millipore SCP1 Rabbit 1:200 Abcam ab15087 SCP3 Rabbit 1:500 Abcam ab SCP3 Mouse 1:500 Abcam ab97672 SCP3 Mouse 1:10 AG Scherthan SPOC1 Rat 1:10 (IHC) Ref. [162] SPOC1 Rat 1:1 000 (WB) Ref. [162] 56
67 2.10 Reagenzien und Materialien Sekundäre Antikörper gegen Spezies gekoppelt Verdünnung Herkunft ProduktNr. Rabbit Goat Biotin 1:100 Vector Vectastain ABC-Kit Rat Rabbit Biotin 1:200 Vector BA-4001 Mouse Horse Biotin 1:200 Vector BA-2000 Goat Rabbit Biotin 1:200 Vector BA-5000 Rat Rabbit HRP 1:5 000 Cell signaling 7074 Rat Goat HRP 1: Santa Cruz sc-2006 Rat Rabbit HRP 1: Dako P0450 Rabbit Swine HRP 1: Dako P0217 Mouse Rabbit HRP 1: Dako P0161 Mouse Goat Cy2 1:500 dianova Mouse Goat Cy3 1:500 dianova Rat Goat Cy3 1:500 dianova Goat Rabbit FITC 1:500 Sigma F9012 Rabbit Goat TRITC 1:500 Abcam ab6718 Rabbit Goat Alexa Fluor 488 1:200 Invitrogen A11034 Mouse Donkey Alexa Flour 350 1:500 Invitrogen A10035 Andere Antikörper gegen Spezies gekoppelt Verdünnung Herkunft ProduktNr. Biotin Strepatavidin Alexa Fluor 555 1:100 Invitrogen S21381 Digoxigenin Sheep FITC 1:10 Roche Digoxigenin Sheep AP 1:100 Roche Streptavidin Goat Biotin 1:100 Vector BA Bakterienstämme & Medien Kompetente Bakterienstämme One Shot TOP10 Invitrogen, Karlsruhe Medien Agar-Platten LB-Medium 15 g Agar-Agar ad 1 l LB-Medium 10 g Trypton 5 g Hefeextrakt 10 g NaCl ad 1 l A. bidest. ph 7,5 57
68 2 Material und Methoden SOC-Medium Antibiotika Ampicillin Kanamycin Chloramphenical 4 g Tryptone 1 g Hefeextrakt 0,1 g NaCl 2 ml 250 mm KCl 3,6 ml 20 % Glucose 1 m. 2 M MgCl 2 ad 200 ml H 2 O Roth, Karlsruhe Roth, Karlsruhe Roth, Karlsruhe Mausstämme C57BL/6NCrl C57BL/6 Charles River, Sulzfeld 129S2/SvPasCrl 129/Sv Charles River, Sulzfeld 129P2/OlaHsd (ES-Zelllinie XB691) 129P2 Bay Genomics, San Francisco Enzyme, Kits und Standards Enzyme Antarktische Phosphatase DNase I, RNase frei Pfu-Turbo Polymerase Proteinase K Restriktionsendonucleasen und Puffer RNase A RNase Erase ICN RNaseOUT Ribonuclease Inhibitor SuperScript II RNase H-Reverse Transcriptase SuperScript III RNase H-Reverse Transcriptase T3 RNA-Polymerase T7 RNA-Polymerase T4 DNA Ligase Taq DNA-Polymerase rekombinant Taq DNA-Polymerase Trypsin NEB, Frankfurt am Main Roche, Mannheim Roche, Mannheim Roche, Mannheim NEB, Frankfurt am Main Qiagen, Hilden Biomedicals, Ohio, USA Invitrogen, Karlsruhe Invitrogen, Karlsruhe Invitrogen, Karlsruhe Fermentas, St. Leon-Rot Fermentas, St. Leon-Rot Fermentas, St. Leon-Rot Invitrogen, Karlsruhe AG Winterpacht, Erlangen Invitrogen, Karlsruhe 58
69 2.10 Reagenzien und Materialien Kits ABsolute Blue QPCR SYBR Green ROX Mix Thermo, Birmingham BioNick DNA Labelling System Invitrogen, Karlsruhe CloneJET PCR Cloning Kit Fermentas, St. Leon-Rot DIG-Nick Translation Mix Roche, Mannheim Expand Long Template PCR System Roche, Mannheim GC-Rich PCR System Roche, Mannheim In Situ Cell Death Detection Kit, Fluorescein Roche, Mannheim Maxima SYBR Green qpcr Mater Mix Fermentas, St. Leon-Rot Nexttec Genomic DNA Isolation Kit for Tissue and Bio&Cell, Nürnberg Cells NucleoBond Xtra Midi Macherey-Nagel, Düren NucleoSpin Extract II Macherey-Nagel, Düren Peroxidase DAB Substrate Kit Axxora, Lörrach Peroxidase Vectastain Elite ABC Kit Rabbit Axxora, Lörrach QIAamp DNA Blood Mini Kit Qiagen, Hilden Qiagen Plasmid Midi Kit Qiagen, Hilden QuikChange Site-Directed Mutagenesis Kit Stratagene, La Jolla, USA RNase-Free DNase Set Qiagen, Hilden RNeasy Mini Kit Qiagen, Hilden TOPO TA Cloning Kit Invitrogen, Karlsruhe Vectastain ABC Elite Kit Vector Laboratories, Burlingame (USA) Standards 100 bp DNA Ladder Invitrogen, Karlsruhe 1 kb DNA Ladder Invitrogen, Karlsruhe SeeBlue Plus2 Invitrogen, Karlsruhe Page-Ruler Prestained Protein Ladder Fermentas, St. Leon-Roth Chemikalien, Materialien und Geräte Chemikalien Agar-Agar Ampicillin Agarose Ammoniumacetat Betaine Borsäure Bradfordreagenz Bromphenolblau BSA (Albumin bovine fraction V) Roth, Karlsruhe Roth, Karlsruhe Biozym, Hessisch Oldendorf Roth, Karlsruhe Sigma-Aldrich, Taufkirchen Roth, Karlsruhe Biorad, München Sigma-Aldrich, Taufkirchen Sigma-Aldrich, Taufkirchen 59
70 2 Material und Methoden Chloroform Coomassie Brilliant Blue R250 Diethylether D-Saccharose DMSO EDTA Entwicklerkonzentrat Eosin Essigsäure Ethanol Ethidiumbromid Fixiererkonzentrat Formaldehyd Glycerin Hämalaunlösung sauer nach Mayer Hämatoxylin Hefeextrakt Isoamylalkohol Isopropanol K 3 Fe(CN) 6 K 4 Fe(CN) 6 Kanamycin KCl KH 2 PO 4 Methanol MgCl 2 MgSO 4 Mowiol Na-Deoxycholate Na 2 HPO 4 Na 2 HPO 4 2 H 2 O NaH 2 PO 4 2 H 2 O NaCl NaOH-Plätzchen Natriumacetat Trihydrat Natriumcitrat Natriumdodecylsulfat (SDS) NP-40 Paraformaldehyd Phenol Roticlear Toluidinblau Tris TritonX-100 Trizol Trypanblau Merck, Darmstadt Roth, Karlsruhe Roth, Karlsruhe Roth, Karlsruhe Merck, Darmstadt Roth, Karlsruhe Tetenal, Norderstedt Sigma-Aldrich, Taufkirchen Roth, Karlsruhe Roth, Karlsruhe Roth, Karlsruhe Tetenal, Norderstedt Merck, Darmstadt Roth, Karlsruhe Roth, Karlsruhe Sigma-Aldrich, Taufkirchen Roth, Karlsruhe Roth, Karlsruhe Roth, Karlsruhe Sigma-Aldrich, Taufkirchen Sigma-Aldrich, Taufkirchen Roche, Mannheim Sigma-Aldrich, Taufkirchen Sigma-Aldrich, Taufkirchen Roth, Karlsruhe Merck, Darmstadt Merck, Darmstadt Roth, Karlsruhe Sigma-Aldrich, Taufkirchen Merck, Darmstadt Merck, Darmstadt Merck, Darmstadt Sigma-Aldrich, Taufkirchen Roth, Karlsruhe Roth, Karlsruhe Sigma-Aldrich, Taufkirchen Merck, Darmstadt Sigma-Aldrich, Taufkirchen Merck, Darmstadt Roth, Karlsruhe Roth, Karlsruhe Merck, Darmstadt Roth, Karlsruhe ICN, Eschwege Invitrogen, Karlsruhe Invitrogen, Karlsruhe 60
71 2.10 Reagenzien und Materialien Trypton/Pepton Tween 20 Xylol Roth, Karlsruhe Roth, Karlsruhe Roth, Karlsruhe Materialien 100 mm dntp Set Invitrogen, Karlsruhe Assay-on-demand Applied Biosystems, Foster City (USA) 24-well-Schalen für Zellkultur Peske, Aindling-Arnhofen BigDye Terminator v3.1 Applied Biosystems, Foster City (USA) Bradfordreagenz Biorad, München Clarion Mounting Media Biomeda, Foster City (USA) Complete Mini; Protease Inhibitor Cocktail Roche, Mannheim Crystal/Mount Biomeda, Foster City Deckgläser Roth, Karlsruhe Diamantmesser Dukker Dynabeads MyOne Streptavidin C1 Invitrogen, Karlsruhe Dual-Luziferase Reporter Assay System Promega, Mannheim Einbettformen 15 x 15 x 5mm Leica, Wetzlar Einbettformen 24 x 24 x 12mm Leica, Wetzlar Einbettkassetten ohne Deckel Roth, Karlsruhe Entellan Merck, Darmstadt Expresshyb-Hybridisierungspuffer Clontech, Heidelberg Faltenfilter Schleicher und Schüll, Dassel Färbekästen nach Hellendahl mit Erweiterung Roth, Karlsruhe GeneChips Mouse Genome Array Affymetrix Glutathion-Sepharose Säulen Amersham, Freiburg Hyperfilm ECL Amersham, Freiburg Hyperfilm MP Amersham, Freiburg Lipofectamin 2000 Invitrogen, Karlsruhe Magnetic Beads Beckmann Coulter, Krefeld (Agencourt Ampure oder CleanSeq ) Metalldeckel für Einbettkassetten Roth, Karlsruhe Mikrotommesser Low Profile Blades SEC 35p Microm, Walldorf Muschelglykogen Invitrogen, Karlsruhe Nalgene Cryo 1 Freezing Container Nalge Nunc Int., Hereford (UK) NuPAGE Western-Blot-Apparatur Invitrogen, Karlsruhe Nylonmembran, positiv geladen Roche, Mannheim Objektträger Superfrost Plus Roth, Karlsruhe OneShot TOP10 E. coli Invitrogen, Karlsruhe PapPen Immunostaining Pen Kisker, Steinfurt Paraffin Roth, Karlsruhe Probe Quant G-50 Colums Amersham, Freiburg 61
72 2 Material und Methoden Protease Inhibitor Cocktail qpcr Mastermix (2x) Ready-To-Go DNA Labelling Beads SDS-Gel NuPAGE 4-12% Bis-Tris 1.5 mm 10 well SOC-Medium TC-Flaschen 75 cm 2 für Zellkultur Tissue-Tec TOPO TA Cloning Kit Western Blotting Substratlösung (SuperSignal West Femto Maximum Sensitivity Substrate) Roche, Mannheim Eurogentec, Seraing (Belgien) Amersham, Freiburg Invitrogen, Karlsruhe Invitrogen, Karlsruhe Peske, Aindling-Arnhofen Sakura, Zoeterwoude (NL) Invitrogen, Karlsruhe Thermo, Rockford (USA) Geräte Autoklav Hiclave HV-85 Bakterienschüttler Innova 4000 Brutschränke DNA-Sequenziergerät ABI PRISM 3730 DNA Analyzer Eismaschine Geldokumentation Gelelektrophorese-Kammern Hybridisierungsofen Microtom HM340E Kryostat HM 560 Kühlplatte CP60 Luminometer Luminoskan Ascent Mikroskop Olympus IX70 Mikroskop Zeiss Axioplan 2 Paraffinspender Paraffinstreckbad SB80 Photometer BioPhotometer Pipettierrobotor Biomek NX Sterile Werkbank LaminAir Taqman ABI Prism 7900HT SDS Thermocycler - Mastercycler gradient Thermomixer compact Ultracut Ultraschallbehandler Sonifier 250D Wasserbäder Western Blot Gellauf Kammer XCell SureLock HMC, Engelsberg New Brunswick Scientific, Nürtingen Binder, Tuttlingen Heraeus, Hanau Applied Biosystems, Weiterstadt Ziegra, Isernhagen BioDocAnalyze (Biometra, Göttingen) PEQLAB, Erlangen Memmert, Schwabach Microm, Walldorf Microm, Walldorf Microm, Walldorf Thermo Labsystems, Erlangen Hauppauge, New York (USA) Zeiss, Jena Medax, Olching Microm, Walldorf Eppendorf, Hamburg Beckmann Coulter, Krefeld Heraeus, Hanau Applied Biosystems, Weiterstadt Eppendorf, Hamburg Eppendorf, Hamburg Reichert-Jung Branson Ultrasonic, Genf (Schweiz) SW-20C (Julabo, Seelbach) GFL, Burgwedel Invitrogen, Karlsruhe 62
73 2.10 Reagenzien und Materialien Western Blot Transfer Kammer XCell II BlotModule Zentrifugen Invitrogen, Karlsruhe Centrifuge 5415 D (Eppendorf, Hamburg) Centrifuge 5415 R (Eppendorf, Hamburg) Centrifuge 5810 D (Eppendorf, Hamburg) Synthetisierte Oligonukleotide Primer für Genotypisierung Spoc1_WT_F Spoc1_WT_R Spoc1_WT_3F Spoc1_WT_3R Spoc1_KO_F Spoc1_KO_R Primer für die qpcr mceacam10_2f mceacam10_2r makr1b_2f makr1b7_2r mcrisp1_2f mcrisp1_2r mgpx3_2f mgpx3_2r mptgs2_2f mptgs2_2r mspink10_2f mspink10_2r mspink8_2f mspink8_r mserpina1f_2f mserpina1f_2r mrpiia_f mrpiia_r mplzf_qpcr_3f mplzf_qpcr_3r Mm_Sox3_RTQ_Fw Mm_Sox3_RTQ_Rv Mm_Ngn3_RTQ_Fw Mm_Ngn3_RTQ_Rv Mm_PHF13_RTQ_Fw Mm_PHF13_RTQ_Rv msox8_f msox8_2r 5 CCTGGTGGAGCAAGTTGGAAC 3 5 CTCACCTTGTCGCTACCCCAAC 3 5 GAGTTGGGGCCCGGTTGGTC 3 5 GCGTCTGCAGCTCAGGGGAC 3 5 GGGTGCGTTGGTTGTGGATAAG 3 5 CATTCAGGCTGCGCAACTGTTGGG 3 5 CACCAAGAATGATGAGGGAGT 3 5 GAGGGCTCAAGGAGGGTAA 3 5 CCACCTTCGTGGAACTCAG 3 5 CGATACCCAGCATCAATGG 3 5 GATTGTAAGCAAGCACAACCA 3 5 TACACTTGTCTGCCCATTGC 3 5 AGCCAGCTACTGAGGTCTGA 3 5 GAAGCCCAGAATGACCAAG 3 5 GATGCTCTTCCGAGCTGTG 3 5 TGGTCAAATCCTGTGCTCAT 3 5 TTTCTGCAAGGCACTGAGAC 3 5 GGCCAGGATGAAAGTGATTT 3 5 CAGCAACCAAGTGACCTACG 3 5 CATCCGAGGAGTGTTCACAT 3 5 GTTCCTGGCTGTGGTGAACT 3 5 TTGATTGTCATGCCGTATCC 3 5 CAAGAGAGTGCAGTTCGGAGT 3 5 TCCGTTGTTTCTGGGTATTTG 3 5 CACCTTCGCTCACATACAGG 3 5 TTGTGGCTCTTGAGTGTGCT 3 5 AAGTTTGGCCGTAACTGTCG 3 5 TCTAGCAAGTCCCATTTCCG 3 5 GAGTCGGGAGAACTAGGATGG 3 5 AGGTTGTTGTGTCTCTGGGG 3 5 CGGAACATGGACTCCGAC 3 5 AAGTCTTCCACAGTCCGGC 3 5 CAGTACCCGCATCTCCATAA 3 5 ACAAACGGCCTCTTCTCG 3 63
74 2 Material und Methoden mgdnf_2f 5 GGGCCACTTGGAGTTAATGT 3 mgdnf_2r 5 AGCCACGACATCCCATAAC 3 mgata1_2f 5 AGCATCAGCACTGGCCTA 3 mgata1_2r 5 TGGATACACCTGAAAGACTGG 3 mfgf9_f 5 AACGGTACTATCCAGGGAACC 3 mfgf9_r 5 ACCAGGCCCACTGCTATACT 3 mfgf9_2f 5 ACAGTGGACTCTACCTCGGC 3 mfgf9_2r 5 TGTTCTCTGAACACACATTCCTG 3 mgdnf_3f 5 CTGAAGACCACTCCCTCGG 3 mgdnf_3r 5 CGTCATCAAACTGGTCAGGA 3 Mm_Nectin3_RTQ_F 5 GTGACTGTGTTAGTTGAACCC 3 Mm_Nectin3_RTQ_R 5 CTGCTACTGTCTCATTCCCT 3 Mm_CyclinD2_RTQ_F 5 GCAGTGTTCCTATTTCAAGTG 3 Mm_CyclinD2_RTQ_R 5 CTCACAGACCTCTAGCATCC 3 Mm_MapK3_RTQ_F 5 CTGACTCCAAAGCTCTTGAC 3 Mm_MapK3_RTQ_R 5 CTGTTCCAGGTAAGGGTGAG 3 Mm_Alcam_RTQ_F 5 ATGTCTCTGCGATAAGTATTCC 3 Mm_Alcam_RTQ_R 5 AACGACAATTCCCACAATCAG 3 MM_CyclinG1_RTQ_F 5 CTAAGGCAAAGCCTTCTGTG 3 MM_CyclinG1_RTQ_R 5 TCTACTCCTTCTGTTAACTCTACG 3 Mm_Actb_RTQ_F 5 CCTTCTTGGGTATGGAATCCT 3 Mm_Actb_RTQ_R 5 TTGGCATAGAGGTCTTTACGG 3 Mm_Tub_RTQ_F 5 AGCCTACGGTAAGAAGTATGTG 3 Mm_Tub_RTQ_R 5 TGAAAGAGGACTCCCAATCTG 3 Mm_Cadm1_RTQ_Fw 5 TGAAGTCAACTGTACTGCCA 3 Mm_Cadm1_RTQ_Rv 5 CTCTGATTTGCCTTTGAGTTCC 3 Mm_F11R_RTQ_Fw 5 CTCTTCACGTCTATGATCCTG 3 Mm_F11R_RTQ_Rv 5 CAATTTGATGGACTCGTTCTC 3 Mm_Cldn10_RTQ_Fw 5 CAAAGTAGAAGGTTACATCCAG 3 Mm_Cldn10_RTQ_Rv 5 CGACTTTGGAACATTTCATTCC 3 Mm_Cldn11_RTQ_Fw 5 ATCCTTCCAGGCTACGTGCAG 3 Mm_Cldn11_RTQ_Rv 5 TCGGATGCAGGGGAGAACTG 3 Mm_Cd99_RTQ_Fw 5 AGTGACGACTTCAACCTGGGCG 3 Mm_Cd99_RTQ_Rv 5 GCGTCCTCCAGGTCGAAGCCT 3 Mm_Tub_RTQ_2F 5 TGGCCAGTGTGGCAACCAGA 3 Mm_Tub_RTQ_2R 5 CCACAGTAGCTCCCAGCGCA 3 Mm_Tub_RTQ_3F 5 TGGCAACCAGATCGGAGCCAAG 3 Mm_Tub_RTQ_3R 5 CCACAGTAGCTCCCAGCGCA 3 Mm_TBP_RTQ_F 5 GAAAAATGGTGTGCACAGGAGCC 3 Mm_TBP_RTQ_R 5 AGCTGGGAAGCCCAACTTCTGC 3 Mm_TBP_RTQ_2F 5 GCAGTCATCATGAGAATAAGAG 3 Mm_TBP_RTQ_2R 5 TGGATTGTTCTTCACTCTTGG 3 Mm_TBP_RTQ_3F 5 GAGCTGTGATGTGAAGTTCC 3 Mm_TBP_RTQ_3R 5 GGCTCATAGCTACTGAACTG 3 Mm_G6PDH_RTQ_F 5 ATCATCAGGGATGTTATGCAG 3 Mm_G6PDH_RTQ_R 5 CACTTTGACCTTCTCATCAC 3 64
75 2.10 Reagenzien und Materialien Mm_G6PDH_RTQ_2F 5 CCTGGCATGTTCTTTAACCC 3 Mm_G6PDH_RTQ_2R 5 GGAGCTTCACATTCTTGTATCTG 3 Mm_Rbmy1a1_RTQ_1F 5 TCCGACGCCTTGCAGATGCT 3 Mm_Rbmy1a1_RTQ_1R 5 AGTGATGATGGTCTCCTGGCTTGT 3 Mm_Ddx3y_RTQ_1F 5 TGATCGTGGAAGTGGATCCAGGGG 3 Mm_Ddx3y_RTQ_1R 5 CCAGTTCGGTCACGACCACCAAT 3 Mm_Ube1y1_RTQ_1F 5 GGCATTGGTCCCATAGAGATCAAAGTTC 3 Mm_Ube1y1_RTQ_1R 5 CACGGATGTACTCAGAGAAGCTGGAG 3 Mm_Rbmy31y_RTQ_1F 5 ACCTCCATCCAGCCTATCTACCATG 3 Mm_Rbmy31y_RTQ_1R 5 ACCCTTCCCGGAATTGCTCTGTT 3 Mm_Hprt_RTQ_1F 5 CCTGGTTAAGCAGTACAGCCCCA 3 Mm_Hprt_RTQ_1R 5 TGGCCTGTATCCAACACTTCGAGA 3 Mm_Ddx3x_RTQ_1F 5 TGGAGATCGTGGAAGTGGATCAAGG 3 Mm_Ddx3x_RTQ_1R 5 TATCTCCACGGCCACCAATGCCA 3 Mm_Pdha1_RTQ_1F 5 AAGATGCTTGCCGCTGTATCCCG 3 Mm_Pdha1_RTQ_1R 5 GAAGCAACCAGCACTCGGCTT 3 Mm_Nrk_RTQ_1F 5 GAGCTGAAGCGCCGCTCAATCA 3 Mm_Nrk_RTQ_1R 5 AAACCCGGCTGTGGTCATTGCTC 3 Mm_Pgk2_RTQ_1F 5 AAGGCCACCTCCAATGGCTGT 3 Mm_Pgk2_RTQ_1R 5 AGTGCCCCATTTGGCGCAGC 3 Mm_Tas1r1_RTQ_1F 5 GCTGCTTCGAGTGCATGCCCT 3 Mm_Tas1r1_RTQ_1R 5 CCACAAGGCTGGCAGGTGTGA 3 Primer für Northern Blot-Sonden Spoc-mus-Fw1 5 GTGAGCAGATCAAACCGTGAGAG 3 Spoc-mus-Rev1 5 GTGGAAAGGCGGCTACACATTGTC 3 mspoc-fw-5 5 GCCACTGTTACACTGGGTGTC 3 mspoc-rv-5 5 GAAAGGTGACACACTGGCCAC 3 Primer für SNP-Analyse (Chip) mtas1r1-snp1-f 5 CGTGGTCGTGGTCTTCTCTA 3 mtas1r1-snp1-r 5 AGAATTGGATGTTCTGGATGC 3 mklhl32-snp1-f 5 CAATCTTCCCACCTCCTCAT 3 mklhl32-snp1-r 5 GATCGCAAAGCCAACAGAC 3 mmxra8-snp1-f 5 TCTGACTGCCTTTCTCAACG 3 mmxra8-snp1-r 5 TGTGACCAGACCCATTGC 3 mhist1h4a-snp-f 5 CTTGAGCGCGTAGACCAC 3 mhist1h4a-snp-r 5 CTGATGGGCGAGATATGTG 3 mchgb-snp1-f 5 CAGTGGATAACAGGGATCACA 3 mchgb-snp1-r 5 GGTAAGGTGGAGGCTGGA 3 Primer für die Klonierung von Spoc1 in den Expressionsvektor mspoc-start-ecori 5 GACGAATTCATGGACTCCGACTCCTG 3 mspoc-stop-xhoi 5 GATCTCGAGCAGATCAGTCCAGAAAC 3 65
76 3 Ergebnisse Inhaltsangabe 3.1 Die Rolle des genetischen Hintergrunds der Spoc1 - Gene trap - Maus Überprüfung des Spoc1 - Knockouts Allgemeine Phänotypisierung Defekte in der Embryonalentwicklung Veränderungen des Skeletts Unterschiede in der Ausprägung des Spermatogenesedefekts Untersuchung des Spermatogenesedefekts auf zellulärer Ebene Histologie der Hoden Untersuchung der Sertoli-Zellen Proliferations- und Apoptoserate während der Spermatogenese Die Verteilung der undifferenzierten Spermatogonien Histonmodifikationen der undifferenzierten Spermatogonien Lokalisation von SPOC Kolokalisation von SPOC1 und verschiedener Histonmethylierungen Kolokalisation mit PLZF Veränderungen der Histonmodifikationen im Spoc1 -/- -Gewebe Vergleichende Genexpressionsanalysen Genomweite Expressionsanalysen Analyse der Expressionsdaten mittels Pathway Express Migrationsmarker Genomische Lokalisation der differentiell exprimierten Gene Chromosomenweite Regulation durch SPOC Untersuchungen zur MSCI Bestätigung des MSCI-Defekts Bildung des XY-Bodys und Induktion der Doppelstrangbrüche Histonmodifikationen während der MSCI Epigenetische Unterschiede während der MSCI
77 3.1 Die Rolle des genetischen Hintergrunds der Spoc1- Gene trap -Maus 3.1 Die Rolle des genetischen Hintergrunds der Spoc1- Gene trap -Maus Für die Untersuchung des Gens Spoc1 (Phf13 ) wurde ein für Spoc1 defizientes Mausmodell verwendet. Die Gene trap -Maus wurde von Bördlein et al. generiert und phänotypisiert [40] (vgl. auch Kap ). Die offizielle Bezeichnung der Mauslinie nach den Richtlinien der JAX-Nomenklatur (The Jackson Laboratory) ist Phf13 Gt(XB691)Byg. Zur Vereinfachung wird in dieser Arbeit jedoch die von Bördlein et al. eingeführte Bezeichnung Spoc1 -/- verwendet. Da die Generierung der Spoc1 -Knockout Maus mittels embryonaler Stamm (ES)-Zellen des Mausstammes 129P2 und den Trophoblasten des Stammes C57BL/6 erfolgte, konnten zunächst nur Mäuse untersucht werden, die einen gemischt-genetischen Hintergrund (C57BL/6 x 129P2) aufwiesen [39] [40]. Für weitergehende Untersuchungen wurden die Mäuse, im Rahmen dieser Arbeit, in einen congenen genetischen Hintergrund (C57BL/6) über 10 Generationen, mit Selektion auf die inserierte Gene trap -Kassette, zurück gekreuzt. Durch diese hohe Anzahl an Rückkreuzungen sind rechnerisch lediglich weniger als 0,05 % des genetischen Materials des ES-Zell-Donorstammes in diesen Tieren vorhanden. Die Rückkreuzung in einen homozygoten Inzuchtstamm ist in der Genetik von großer Bedeutung, da die genomische Homogenität der hier untersuchten Mäuse sehr hoch ist. Gefundene phänotypische Unterschiede können deshalb besser auf die eingebrachte genetische Veränderung (Mutation, Knockout, Transgen) bzw. auf stammspezifische Modifier zurückgeführt werden [180]. Im Rahmen der vorliegenden Arbeit sollte zunächst untersucht werden, ob der Phänotyp der Spoc1 -/- -Tiere des congenen Stammes dem der Tiere mit gemischt-genetischen Hintergrund gleicht Überprüfung des Spoc1- Knockouts Für die homozygoten Gene trap -Mäuse in der gemischt-genetischen Mauslinie konnte gezeigt werden, dass ein geringer Anteil an Spoc1 mrna (4-15 %) noch gebildet wird. Diese residuale Expression ist vermutlich auf Exon-Skipping zurückzuführen, bei dem die in Intron 1 inserierte Gene trap -Kassette beim Spleißen ausgelassen wird. Mittels Northernblot-Analysen konnte in den homozygoten Gene trap -Tieren jedoch keine funktionale mrna des Spoc1 -Gens nachgewiesen werden. Auch auf Proteinebene war SPOC1 nicht detektierbar, wie Westernblot- und immunhistochemische Analysen zeigten [39]. Aufgrund der Tatsache, dass kein funktionales Protein in den homozygoten Gene trap - Tieren nachgewiesen werden konnte, wurde von Bördlein et al. davon ausgegangen, dass es sich bei der Gene trap -Maus um einen kompletten funktionellen Knockout des SPOC1- Proteins handelt. Für die congene Mauslinie wurde der Anteil an residualem Spoc1 mittels Real Time- PCR und Westernblot ermittelt. Die Real Time-PCR zeigte hierbei, dass bei den Tieren im congenen Hintergrund, im Gegensatz zu dem in gemischt-genetischen Stamm kein residuales Spoc1 -Transkript nachgewiesen werden konnte (Abb. 3.1 A). Der Westernblot zeigte wie erwartet eine in der Intensität um die Hälfte reduzierte SPOC1-positive Bande bei den heterozygoten Tieren und kein Signal bei den homozygoten Gene trap -Mäusen 67
78 3 Ergebnisse (Abb. 3.1 B). Somit kann man davon ausgehen, dass bei diesen Tieren ebenfalls ein kompletter funktioneller Knockout von SPOC1 vorliegt. Abbildung 3.1 Überprüfung des Spoc1 -Knockdowns A) Die Real Time-PCR zeigt im Vergleich zu Mäusen mit gemischt-genetischem Hintergrund C57BL/6 x 129P2 keine residuale Expression des Spoc1 -Gens in den Mäusen mit congenem Hintergrund. Bei den gemischt-genetischen Mäusen lag die Residualexpression dagegen bei 4-15 %. B) Die Westernblot-Analyse von Proteinlysaten aus Hodengewebe unterschiedlichen Alters zeigt, dass in den heterozygoten Tieren die Proteinmenge von SPOC1 halbiert und das Protein in den homozygoten Spoc1 -/- -Tieren nicht nachweisbar ist. Als Ladekontrolle wurde ein rabbit-anti-β-actin Antikörper (1:10 000) verwendet. Zur Detektion von SPOC1 wurde ein monoklonaler rat-anti- SPOC1 Antikörper (1:1 000) verwendet (vgl. Kap. 2.10) Allgemeine Phänotypisierung Für die allgemeine Phänotypisierung wurden für beide genetischen Hintergründe Mäuse unterschiedlichen Alters untersucht. Dabei beziehen sich die meisten Daten auf adulte Tiere im Alter zwischen 5- und 20 Wochen. Für weitere Erhebungen wurden aber auch jüngere Tiere (ab P0) und deutlich ältere Tiere (max. 100 Wochen) untersucht. Die Anzahl der untersuchten Tiere variiert je nach Analyse. Die Spoc1 -/- -Mäuse der gemischt-genetischen Mauslinie zeigten neben der Hodenhypoplasie und der Infertilität, aufgrund des progressiven Keimzellverlusts, keine offensichtlichen äußerlichen Auffälligkeiten gegenüber den Wildtyp-Mäusen. Lediglich eine Reduktion des Körpergewichts bei adulten Mäusen um 23,58 % konnte festgestellt werden (n = 113, p = 0,021). Bei dem Großteil der Mäuse mit congenem Hintergrund verstärkt sich diese Gewichtsreduktion geringfügig auf 25,23 % (n = 68, p = 0,002). Bei einigen Tieren (13 % der untersuchten Spoc1 -/- -Tiere) zeigte sich jedoch eine deutlich stärkere Reduktion des Gewichts um bis zu 67 % gegenüber den Wildtyp-Vergleichstieren. Diese Tiere wiesen deutlich verkürzte Skelettknochen auf. Außerdem konnte bei den Spoc1 -/- -Tieren der congenen Mauslinie eine typisch veränderte Kopfform festgestellt werden. Eine detaillierte Darstellung dieses Skelettphänotyps findet sich in Abschnitt Nachdem die inneren Organe grob-morphologisch normal erschienen, wurden für eine histologische Untersuchung Gewebeschnitte von Gehirn, Lunge, Herz, Niere, Leber, Dickdarm und Milz der Neugeborenen und adulten Tieren mit Hämatoxylin/Eosin gefärbt und mit Wildtyp-Gewebe verglichen. Dabei konnten jedoch keine offensichtlichen Unter- 68
79 3.1 Die Rolle des genetischen Hintergrunds der Spoc1- Gene trap -Maus schiede zwischen den Spoc1 -/- - und den Spoc1 +/+ -Tieren festgestellt werden (Daten nicht gezeigt). Morphologisch auffällig waren dagegen die Hoden, die deutlich verkleinert waren. Die Hodenatrophie, sowie der damit verbundene progressive Keimzellverlust, der bereits bei den gemischt-genetischen Spoc1 -/- -Mäusen auftrat (vgl. Kap. 1.5 und [40]), konnte auch in der congenen Mauslinie bestätigt werden. Der Keimzellverlust scheint hierbei jedoch früher zu beginnen und stärker zu sein. Ein detaillierter Vergleich des Spermatogenese- Defekts findet sich in Abschnitt Einige der Spoc1 -/- -Tiere wiesen ein dünnes bzw. lichtes (ab ca. 40 Wochen) Fell auf. Dazu wurden im Rahmen von Abschlussarbeiten [83] [165] Untersuchungen durchgeführt, die jedoch nicht zu einem klaren Ergebnis führten. Eine mögliche Rolle von SPOC1 in den Stammzellen der Haarfollikel ist aber nicht auszuschließen. Die Spoc -/- -Mäuse waren in ihrem Verhalten unauffällig Defekte in der Embryonalentwicklung Bei der Untersuchung der Genotypenverteilung bei heterozygoter Verpaarung fiel, im Rahmen der Doktorarbeit von A. Bördlein, eine deutliche Fehlverteilung gegenüber einer normalen Mendel schen Vererbung auf [39]. Im Rahmen der vorliegenden Arbeit wurden diese Analysen für die gemischt-genetischen Mauslinie mit einer größeren Anzahl an Verpaarungen (n = 146) wiederholt. Für die congenen Tiere wurden ebenfalls heterozygote Verpaarungen ausgewertet (n = 143). Dafür Abbildung 3.2 Genotypenverteilung bei heterozygoter Verpaarung Grün: Erwartete Mendel sche Verteilung der Genotypen, blau: Verteilung der Genotypen im gemischt-genetischen Hintergrund (C57BL/6 x 129P2), rot: Verteilung im congenen Hintergrund (C57BL/6). wurden die Tiere im Alter von 3-4 Wochen, nachdem sie von den Elterntieren abgesetzt wurden, biopsiert und die Genotypen mit Hilfe einer PCR ermittelt (vgl. Kap ). Bei 69
80 3 Ergebnisse den Verpaarungen gingen deutlich weniger homozygote Spoc1 -/- -Tiere hervor, als man bei einer Mendel schen Verteilung erwarten würde (Abb. 3.2). Bei den Tieren mit gemischt-genetischem Hintergrund lag der Anteil von Spoc1 +/+ -Tieren bei heterozygoter Verpaarung bei 34 %, statt der erwarteten 25 %. Bei den heterozygoten Tieren wich der Anteil von den erwarteten 50 % mit 52 % nur geringfügig ab. Am deutlichsten war diese Abweichung bei den Spoc1 -/- -Tieren. Lediglich 14 % statt 25 % dieser Tiere gingen aus den heterozygoten Verpaarungen hervor. Diese Verschiebung der Genotypenverteilung war bei den Tieren mit congenem Hintergrund noch deutlich verstärkt (Abb. 3.2). Hier traten bei heterozygoter Verpaarung 39 % Spoc1 +/+ -, 55 % Spoc1 +/- - und nur 6 % Spoc1 -/- -Tiere auf. Im Absetzalter (3-4 Wochen) sind also deutlich weniger Spoc1 -/- -Tiere vorhanden, als man erwarten würde. Um die Ursache für diese Fehlverteilung aufzuklären, wurden sowohl neugeborene Tiere als auch Embryonen unterschiedlichen Alters untersucht. Abbildung 3.3 Embryonen verschiedener Entwicklungsstadien A) und B) Unauffällige hetero- und homozygote Embryonen des Entwicklungsstadiums E9.5 und E14.5. C) Auffällige Embryonen des Entwicklungsstadium E15.5. D) Embryonen des Entwicklungsstadiums E16.5. Die homozygoten Spoc1 -/- -Tiere zeigten Fehlbildungen unterschiedlicher Ausprägung. Bei den Embryonen in sehr frühen (E9.5; n = 8) bis frühen (E14.5; n = 43) Stadien konnten keine offensichtlichen Unterschiede zwischen den homozygoten Spoc1 -/- - und den Wildtyp-Tieren gefunden werden (Abb. 3.3 A und B). Bei einer weiter vorangeschrittenen Entwicklung (E E16.5) wurden bei der Präparation der Embryonen (n = 53) in einigen Tieren deutliche Entwicklungsdefekte gefunden (Abb. 3.3 C und D). Eini- 70
81 3.1 Die Rolle des genetischen Hintergrunds der Spoc1- Gene trap -Maus ge Spoc1 -/- -Embryonen zeigten eine ausgeprägte Entwicklungsverzögerung und deutliche Fehlbildungen der Augen, des Gehirns sowie des craniofazialen Bereichs. Aber auch bei den heterozygoten Tieren zeigte ein Anteil der Embryonen Auffälligkeiten (Abb. 3.3 C). Dieser Anteil ist jedoch deutlich geringer als bei den homozygoten Tieren (siehe Tab 3.1). Die Fehlbildungen umfassen neben Dysplasien des Gehirns auch Malformationen der Augen. Das Spektrum dieser Augenfehlbildungen reicht von einer unauffälligen Augenentwicklung über Pigmentdefekte und unilateralem Mikrophthalmus bis zu bilateralem Anophthalmus. Die Fehlbildungen des Gehirns reichen von einer leichten Mikrozephalie bis zu dem Fehlen ganzer Hirnbereiche (siehe Tab. 3.1). Tabelle 3.1 Übersicht über die Entwicklungsdefekte Defekt Spoc1 +/+ Spoc1 +/- Spoc1 -/- Pigmentierungsdefekt (Auge) 0/7 1/25 4/11 Unilaterale Anophthalmie 0/7 1/25 3/11 Bilaterale Anophthalmie 0/10 1/25 3/17 Koloboma 0/10 1/25 1/17 Augendefekt (gesamt) 0/10 4/36 10/18 Schädelfehlbildung 0/10 1/36 7/18 Entwicklungsverzögerung 0/10 3/36 6/18 Subepidermales Ödem 0/10 0/36 3/18 Exencephalie 0/10 0/36 3/18 Defekt (gesamt) 0/10 7/36 10/18 Bei den neugeborenen Tieren war eine hohe Sterblichkeit auffällig. Die Sterblichkeitsrate konnte jedoch, aufgrund der Tatsache, dass die Elterntiere den verstorbenen Nachwuchs meist ohne Verzögerung auffressen, nicht quantifiziert werden. Eine Sektion der verstorbenen Neugeborenen zeigte, dass einige dieser Tiere keine Milz entwickelt hatten. Diese Asplenie wurde im Rahmen der vorliegenden Arbeit jedoch nicht weiter untersucht. Über die Genotypen-Verteilung konnte eine Sterblichkeitsrate der homozygoten und heterozygoten Spoc1 -/- -Tiere im Vergleich zu Wildtyp-Tieren erstellt werden (Abb. 3.4 A). Es zeigte sich, dass bei der gemischt-genetischen Mauslinie 57,5 % der Spoc1 -/- -Tiere vor dem Absetzalter versterben. Bei den heterozygoten Tieren sind es 24,5 %. Für die congene Mauslinie erhöhen sich diese Werte auf 85,1 % bei den homozygoten und auf 30,4 % bei den heterozygoten Tieren. Eine Analyse der Genotypenverteilung bei Embryonen des Alters E14.5 im congenen Stamm ergab, dass die Genotypen in diesem Entwicklungsstadium noch nicht so stark fehlverteilt sind wie bei den 3-4 Wochen alten Tieren (Abb. 3.4 B). Es zeigte sich, dass am Embryonaltag E14.5 noch etwa 19 % Spoc1 -/- -Tiere zu finden waren, während der Anteil dieser Tiere im Absetzalter bei nur knapp 6 % lag. Hieraus lässt sich schlussfolgern, dass viele der Spoc1 -/- -Tiere im Alter zwischen E14.5 und dem Absetzalter verloren gehen. 71
82 3 Ergebnisse Abbildung 3.4 Sterblichkeitsrate und embryonale Genotypenverteilung A) Sterblichkeitsrate der heterozygoten und homozygoten Knockout-Mäuse im gemischten (blau, n = 960) und congenen Hintergrund (rot, n = 818). B) Vergleich der Genotypenverteilung der congenen Mauslinie im Alter von 3 Wochen (P21) (rot, n = 818) und an Embryonaltag 14.5 (lila, n = 63). Bei der Untersuchung der unterschiedlich alten Embryonen fiel auf, dass vor E15.5 keine deutlichen Defekte zu finden waren. Die Anzahl der untersuchten Embryonen mit Defekten zu den unterschiedlichen Entwicklungszeitpunkten wurden quantitativ ausgewertet (Abb. 3.5). Es war deutlich zu erkennen, dass in den Tieren bis E14.5, unabhängig vom Genotyp, kaum offensichtliche Defekte zu finden waren. Bei den Tieren ab E15.5 konnten dagegen bei 31 % der heterozygoten und bei 87.5 % der homozygoten Knockout-Tiere Defekte gefunden werden. Trotz der relativ geringen Anzahl an untersuchten Tieren war dieser Unterschied hoch signifikant. Als mögliche Ursache für diesen Befund kommt ein degenerativer Prozess infrage, der die schon bestehenden Strukturen wieder abbaut. Dies näher zu untersuchen war jedoch nicht das Ziel der vorliegenden Arbeit und soll daher in Anschlussarbeiten näher untersucht werden. Abbildung 3.5 Embryonale Defekte in den Spoc1 -/- -Tieren Übersicht über die Anzahl an Embryonen mit diversen Defekten zu unterschiedlichen Zeitpunkten. ** p 0,01. P-Werte wurden mit Hilfe des Cochran s Q-test ermittelt 72
83 3.1 Die Rolle des genetischen Hintergrunds der Spoc1- Gene trap -Maus Diese Untersuchungen zeigen, dass Spoc1 für die Embryonalentwicklung der Maus eine relativ wichtige Rolle spielt und die teilweise embryonale Letalität der Embryonen die verschobene Genotypenverteilung erklärt (vgl. Kap ). Überdies ist klar geworden, dass deutliche Unterschiede bei der Ausprägung dieser Defekte zwischen den unterschiedlichen Mauslinien existieren (vgl. Kap. 4.1) Veränderungen des Skeletts Es zeigte sich bei adulten Spoc1 -/- -Tieren (ab 5 Wochen) eine deutliche Verminderung des Körpergewichts um bis zu 67 % gegenüber dem Gewicht von Wildtyp-Geschwistertieren. Auffällig war bei diesen Tieren zudem eine stark reduzierte Körpergröße. Interessanterweise war das Körpergewicht der neugeborenen Tiere allerdings normal. Abbildung 3.6 Skelettveränderungen der Spoc1 -/- -Maus A) Vergleich zweier Spoc1 +/+ -/Spoc1 -/- -Mauspaare im Alter von 10 Wochen. B) Vergleich der Kopfform zwischen Wildtyp- und Spoc1 -/- -Mäusen. C) Knochenpräparation eines Spoc1 +/+ -/ Spoc1 -/- Mauspaares von links nach rechts: Schädel (Cranium), Schulterblatt und Schlüsselbein (Scapula, Clavicula), Oberarmknochen (Humerus), Elle (Ulna), Speiche (Radius), Hüftbein (Os coxae), Oberschenkelknochen (Femur), Schien- und Wadenbein (Tibia und Fibula). Pfeile deuten die Stellen an, an denen in der Spoc1 -/- -Maus noch keine Verknöcherung stattgefunden hat. Maßstabsbalken = 5 mm. 73
84 3 Ergebnisse Bei der morphologischen Untersuchung der Spoc1 -/- -Tiere fiel auf, dass im congenen Hintergrund 13 % der Tiere Skelettauffälligkeiten aufwiesen. Die Messung der Kopf-Rumpf- Länge (Nasenspitze - Schwanzwurzel) der adulten Spoc1 -/- -Tiere ergab, dass die Länge der Tiere um bis zu 33 % verringert war (Abb. 3.6 A). Außerdem stellte sich heraus, dass die Kopfform bei den Spoc1 -/- -Mäusen deutlich von der normalen Kopfform einer adulten Maus abwich. Während die Breite des Schädels normal war, zeigte sich eine deutliche Reduktion in der Länge des Schädels. Diese Verkürzung des Schädels konnte bei allen untersuchten, adulten Spoc1 -/- -Tieren dieser Mauslinie festgestellt werden, variierte jedoch in der Stärke des Phänotyps. Diese Form des Schädels führt dazu, dass die Spoc1 -/- -Mäuse ein typisches Aussehen mit einer scheinbar hohen Stirn und einer verkürzten Schnauze aufweisen, was auf die Veränderung der Suturen un die Verkrümmung des Nasenbein zurückzuführen ist (siehe Abb. 3.6 B und C). Weiterführende Untersuchungen zur craniofazialen Gestalt wurden im Rahmen dieser Arbeit nicht durchgeführt. Um die Ursache der Größenreduktion zu untersuchen, wurde eine Skelettpräparation an 10 Wochen alten Mäusen durchgeführt. Dabei wurden knöcherne Strukturen mit Alizarin- Rot und knorpelige Strukturen mit Alcian-Blau angefärbt. Die Präparation zeigte deutlich, dass alle Skelettknochen proportional verkürzt waren (Abb. 3.6 C). Es zeigte sich außerdem, dass in einigen Knochen die Wachstumsfuge noch nicht geschlossen (Pfeile in Abb. 3.6 C) und damit das Längenwachstum der Knochen noch nicht abgeschlossen war. Es wird vermutet, dass es in den Spoc1 -/- -Mäusen zu einer Verzögerung in der enchondralen Ossifikation und damit zu einem Minderwuchs der Tiere kommt Unterschiede in der Ausprägung des Spermatogenesedefekts In der Mauslinie mit gemischt-genetischem Hintergrund (C57BL/6 x 129P2) zeigten die männlichen Spoc1 -/- -Tiere einen progressiven Verlust der Keimzellen [39] [40]. Diese Mäuse waren bis zu einem Alter von max. 10 Wochen in der Lage, Nachkommen zu zeugen. Im Rahmen der vorliegenden Arbeit wurde der Spermatogenesedefekt in der gemischtgenetischen und in der congenen Mauslinie erweitert analysiert und miteinander verglichen. Dabei wurde festgestellt, dass der Phänotyp bei den Mäusen mit congenem Hintergrund (C57BL/6) deutlich ausgeprägter war. Diese Mäuse konnten zu keiner Zeit Nachkommen zeugen. Analyse der Wurfgröße Für eine quantitative Auswertung der Infertilität wurden Zuchtpaare angesetzt. Dabei wurden männliche Tiere im Alter von 5 Wochen zu 9-10 Wochen alten Weibchen gesetzt. Die Geschlechtsreife wird bei den männlichen Tieren nach etwa 35 Tagen, bei weiblichen Tieren zwischen 6 und 8 Wochen erreicht [264]. Mit der Ausnahme der homozygoten Spoc1 -/- -Tiere im congenen C57BL/6-Hintergrund wurden insgesamt je 11 Zuchtpaare pro Genotyp und genetischem Hintergrund über einen Zeitraum von 9 Monaten ausgewertet. Aufgrund der geringen Anzahl an Spoc1 -/- -Tieren im congenen Hintergrund wurden hier nur 8 Zuchtpaare untersucht, wobei nur ein Zuchtpaar über den gesamten Zeitraum von 9 Monaten verpaart wurde. Da diese Tiere jedoch schon bei Erreichen der Geschlechtsreife 74
85 3.1 Die Rolle des genetischen Hintergrunds der Spoc1- Gene trap -Maus im Alter von 5-6 Wochen keine Nachkommen zeugen konnten, sollte dies keinen Einfluss auf die Auswertung der Daten haben. Für diese Analyse wurde die Gesamtanzahl der Nachkommen gegen das Alter der männlichen Tiere (Abb. 3.7 A) bzw. die relative Anzahl der Nachkommen im Vergleich zu den Wildtyp-Tieren aufgetragen (Abb. 3.7 B). Abbildung 3.7 Übersicht über die Anzahl der Nachkommen A) Gesamtanzahl der Nachkommen männlicher Tiere im Zeitverlauf. B) Relative Anzahl der Nachkommen zum jeweiligen Zeitpunkt im Vergleich zu den Wildtyp-Kontrolltieren. Diese Untersuchung zeigte, dass die Anzahl an Nachkommen vom Genotyp und vom genetischen Hintergrund der männlichen Tiere abhängig ist. Es ist deutlich zu erkennen, dass die Verpaarung von Spoc1 +/+ -Männchen mit Wildtyp-Weibchen im C57BL/6- Hintergrund deutlich produktiver ist, als alle anderen Verpaarungen. Hierbei kam es zu einer durchschnittlichen Wurfgröße von 7,4 Tieren pro Wurf (Tab. 3.2, Literaturwert 7,0 [264]). Die Wurfgrößen nahmen mit dem Alter der Tiere leicht ab. Tabelle 3.2 Mittlere Wurfgröße Wurf C57BL/6 C57BL/6 x 129P2 Spoc1 +/+ Spoc1 +/- Spoc1 -/- Spoc1 +/- Spoc1 -/
86 3 Ergebnisse Bei den heterozygoten Tieren zeigte sich eine reduzierte Wurfgröße um 10 % gegenüber den Wildtyp-Verpaarungen. Da die Anzahl der Nachkommen im Absetzalter von Tagen ermittelt wurde, könnte diese Reduktion an der erhöhten Sterblichkeit der Spoc1 +/- - und Spoc1 -/- -Tiere liegen (vgl. Abb. 3.4). Somit wurde davon ausgegangen, dass die Spoc1 +/- -Tiere im gemischt-genetischen Hintergrund keine eingeschränkte Fertilität aufweisen. Im Gegensatz dazu war die Anzahl an Nachkommen der Spoc1 -/- -Tiere im gemischt-genetischen Hintergrund stark reduziert. Auffällig ist hierbei, dass jeweils die erste Verpaarung der Tiere im Alter von 5 Wochen eher zu Nachkommen führte. Insgesamt zeigte sich eine mittlere Wurfgröße von 0,53 Tiere pro Wurf. Von den 11 Zuchtpaaren zeigten 7 Paare keinen Zuchterfolg, 3 Paare hatten einen Wurf und ein einzelnes Zuchtpaar hatte über den gesamten Verpaarungszeitraum 9 Würfe. Insgesamt ist die Infertilität der Spoc1 -/- -Mäuse im gemischt-genetischen Hintergrund stark eingeschränkt, wobei die jüngeren Tiere eher in der Lage waren Nachkommen zu zeugen. Die Fertilität im congenen C57BL/6-Hintergrund ist deutlich verändert gegenüber dem gemischt-genetischen Hintergrund. Bei den Spoc1 +/- -Tieren zeigte sich eine Reduktion der Wurfgröße um etwa die Hälfte gegenüber den Wildtyp-Tieren. Hierbei wird jedoch deutlich, dass die Tiere bis zu einem Alter von ca. 30 Wochen mehr Nachkommen zeugten als in einem höheren Alter. Bis zu diesem Alter kann die Reduktion der Nachkommen wieder auf die erhöhte Sterblichkeit der Spoc1 +/- - und Spoc1 -/- -Tiere zurückgeführt werden, die im congenen Hintergrund höher ist. Die stetige Abnahme der Nachkommen der älteren Tieren muss jedoch eine andere Ursache haben. Dies deutet auf eine Abnahme der Fertilität in den Spoc1 +/- -Mäusen im congenen Hintergrund hin. Die Verpaarung von männlichen Spoc1 -/- -Tieren im congenen Hintergrund führte zu keiner Zeit zu Nachkommen. Dabei wurden auch männliche Spoc1 -/- -Tiere mit Wildtyp-Weibchen verpaart. Die Verpaarung von weiblichen Spoc1 -/- -Tieren mit männlichen Wildtyp- oder Spoc1 +/- - Tieren wurde nicht quantitativ untersucht, da diese keine offensichtliche Verminderung der Fertilität aufwiesen und Nachkommen zeugen konnten. Aus diesem Ergebnis ist deutlich erkennbar, dass die Fertilität der Spoc1 -/- -Tiere, abhängig vom genetischen Hintergrund, unterschiedlich stark beeinträchtigt ist. Hypoplasie des Hodens Im Rahmen der Doktorarbeit von A. Bördlein konnte eine Hypoplasie der Hoden in den Spoc1 -/- -Tieren der gemischt-genetischen Mauslinie festgestellt werden [39]. Diese Hypoplasie wurde allerdings nur bei Tieren im Alter von 10 Wochen untersucht. Deshalb wurde im Rahmen der vorliegenden Arbeit die Hodenatropie über mehrere Altersstufen hinweg in beiden Mauslinien untersucht und miteinander verglichen. Um das generell verringerte Körpergewicht der Spoc1 -/- -Tiere mit einzubeziehen, wurde der Gonadal-Somatische Index (GSI) errechnet: GSI = Gewicht Hoden Gewicht Körper 100 Für diese Untersuchung wurde das, bei jeder Sektion ermittelte, Körper- und Hodengewicht verwendet. Dazu wurden Daten von 5-60 Wochen alten Tieren herangezogen. Für 76
87 3.1 Die Rolle des genetischen Hintergrunds der Spoc1- Gene trap -Maus jede Altersstufe und für jeden genetischen Hintergrund wurden 5-17 Tiere verwendet (Abb. 3.8 A). Abbildung 3.8 Gonadal-somatischer Index (GSI) A) und B) Bei Hodensektion adulter Mäuse (5-60 Wochen) wurde das Körpergewicht und das Hodengewicht bestimmt und daraus der GSI (siehe oben) berechnet. Bei beiden genetischen Hintergründen ist der GSI der Spoc1 -/- -Tiere erniedrigt. Diese Hodenhypoplasie ist im congenen Hintergrund (rot) deutlich stärker ausgeprägt. C) und D) Der männliche Genitaltrakt von 10 Wochen alten Mäusen, inklusive der Samenblase (SV), wurde präpariert. Die Hoden (T) waren bei den Spoc1 -/- -Tieren deutlich verkleinert, während die Samenblase weitgehend unverändert war. Maßstabsbalken = 1 cm. Diese Untersuchung der Hoden zeigte eine deutlich erhöhte Hypoplasie des Hodens der Spoc1 -/- - gegenüber den Wildtyp-Tieren über alle untersuchten Altersstufen hinweg (Abb. 3.8). Deutlich ersichtlich war auch, dass akzessorische Organe wie die Samenblase und die Nebenhoden eine, für die Körpergröße, normale Größe aufwiesen (Abb. 3.8 C und D). Während bei den Mäusen mit gemischt-genetischem Hintergrund die Hoden im Durchschnitt auf 44,5 % des Wildtyp-Gewichts reduziert waren, zeigte sich bei dem congenen Stamm eine Reduktion auf nur 23,7 % (Abb. 3.8 A und B). Bei den Tieren der gemischtengenetischen Mauslinie war der GSI der 5-9 Wochen alten Tiere auf 51,8 % des Wildtypwertes reduziert. Bei den Wochen alten Tieren sank der Wert auf 48,2 % und bei den Wochen alten Tieren sogar auf 30,1 %. Bei älteren Tieren über 30 Wochen stieg der Wert wieder auf 49,3 %. Bei den congenen Tieren war die Reduktion über alle Altersstufen hinweg deutlicher. Bei den 5-9 Wochen alten Tieren erreichte der GSI-Wert gerade mal 12,9 % des Wildtyp-Wertes. Bei den Wochen alten Tieren stieg der Wert auf 33,3 %, bei den Wochen alten Tieren auf 27,6 %. Bei den Tieren über 30 Wochen lag der Wert bei 19,2 %. 77
88 3 Ergebnisse Diese Unterschiede deuten darauf hin, dass der Spermatogenesedefekt in den Mäusen mit congenem Hintergrund deutlich stärker ausgeprägt ist. Spermienparameter Um zu untersuchen, ob die Spoc1 -/- -Mäuse normale Spermien produzieren können, wurden Spermienpräparationen aus dem Nebenhoden durchgeführt. Es konnten hierbei keine Unterschiede in der Form und der Beweglichkeit der Spermien in Abhängigkeit von dem Genotyp der Mäuse detektiert werden. Allerdings zeigte sich deutlich, dass es bei allen Spoc1 -/- -Mäusen zu einer drastischen Reduktion in der Anzahl der Spermien kommt (Abb. 3.9 A). Bei den Tieren im gemischt-genetischen Hintergrund zeigt sich bei 5 Wo- Abbildung 3.9 Spermienzählung A) Spermienpräparation von 10 Wochen alten Spoc1 +/+ - und Spoc1 -/- -Mäusen aus den Nebenhoden. B) Die Auszählung der Spermien im gemischt-genetischen Hintergrund zeigt eine drastische, progressive Reduktion der Spermien in 5, 10 und 20 Wochen alten Tieren. C) Die Reduktion der Spermien ist im congenen Hintergrund bei 5 und 10 Wochen alten Tieren deutlich zu sehen. chen alten Spoc1 -/- -Tieren eine Reduktion der Spermienanzahl auf 28,57 % gegenüber Wildtyp-Vergleichstieren. Bei den 10 und 20 Wochen alten Mäusen steigerte sich diese Reduktion auf rund 10 % (Abb. 3.9 B). Im Gegensatz dazu waren in den Nebenhoden der Spoc1 -/- -Mäuse im congenen Hintergrund kaum Spermien vorhanden. In den 5 Wochen alten Tieren wurde eine Spermienreduktion auf 2,28 % des Wildtyp-Wertes festgestellt, dies reduzierte sich bei 10 Wochen alten Tieren auf 0,08 % (Abb. 3.9 C). Aufgrund des Sertoli-Cell-Only -Phänotyps, der bei den congenen Spoc1 -/- -Tieren nach etwa 20 Wochen einsetzt (vgl. Abb. 3.10), konnte davon ausgegangen werden, dass in diesem Alter keine Spermien mehr hergestellt werden können. Deshalb wurden die 20 Wochen alten Tiere in diesem Hintergrund nicht mehr untersucht. Beinträchtigung der Fertilität ist abhängig vom genetischen Hintergrund Die Untersuchungen zu den Nachkommen, des gonadal somatischen Indices und der Spermienanzahl zeigen deutlich, dass der Grad der Infertilität der Spoc1 -/- -Tiere stark von genetischen Hintergrund der Tiere abhängig ist. Wie auch schon bei den anderen phänotypischen Merkmalen ist der Phänotyp, der die Spermatogenese betrifft, bei den Tieren 78
89 3.2 Untersuchung des Spermatogenesedefekts auf zellulärer Ebene der congenen Mauslinie deutlich ausgeprägter. Um den Spermatogenesedefekt näher zu charakterisieren, wurden mehrere Analysen auf zellulärer Ebene durchgeführt. Diese sollen im folgenden Abschnitt dargestellt werden. 3.2 Untersuchung des Spermatogenesedefekts auf zellulärer Ebene Histologie der Hoden Zur weiteren Charakterisierung des Hodenphänotyps im congenen Mausstamm wurden histologische Analysen an Paraffinschnitten von Hoden durchgeführt. Zunächst wurde mittels Hämatoxy-lin/Eosin-Färbung der Aufbau der Tubuli seminiferi untersucht (Abb. 3.10). Abbildung 3.10 Histologische Übersichtsfärbungen des Hodengewebes Mikrotomschnitte von Hoden verschiedener Altersstufen (5, 10 und 20 Wochen) nach Hämatoxylin/Eosin- Färbung. Ausschnitte aus Spoc1 +/+ - und Spoc1 -/- -Gewebe sind vergleichend gegenübergestellt. Spoc1 -/-mix = gemischt-genetische Mauslinie, Spoc -/-congen = congener Stamm, Maßstabsbalken = 200 µm. 79
90 3 Ergebnisse Hierbei zeigte sich, dass es sich bei dem Spermatogenesedefekt um einen progressiven Verlust der Keimzellen handelt, der schließlich zu dem Sertoly-Cell-Only -Phänotyp führt. Dies wurde für die gemischt-genetische Mauslinie schon im Rahmen der Doktorarbeit von A. Bördlein gezeigt [39]. Hier konnte dieser Befund bestätigt und auf die Tiere der congenen Mauslinie ausgeweitet werden. Dabei zeigten sich jedoch auch Unterschiede zwischen den beiden Mauslinien. Der progressive Keimzellverlust war in den Tieren des congenen Hintergrunds deutlich stärker ausgeprägt. Zur quantitativen Auswertung des Phänotyps wurden zum einen die Größe der Tubuli ermittelt und zum anderen die Zellzusammensetzung bewertet. Auswertung der Tubulusgröße Zur quantitativen Analyse der Defekte im Aufbau der Tubuli wurde zunächst die Tubulusgröße ermittelt. Für diese Analyse wurden je 4 Tiere pro Genotyp, genetischem Hintergrund und Alterstufe verwendet. Dazu wurden wiederum Hämatoxilin/Eosin-Färbungen Abbildung 3.11 Auswertung der Tubulusgröße Die Auswertung der Tubulusgröße erfolgte an Tieren des gemischt-genetischen (A) und des congenen (B) Hintergrunds. Von Hoden verschiedener Altersstufen (5, 10 und 20 Wochen) wurden Mikrotomschnitte angefertigt und mit Hämatoxylin/Eosin gefärbt. Die Größe der Tubuli wurde mittels der AxioVision-Software gemessen. Die p-werte wurden mit einem t-test ermittelt (** p 0,001). von Hodenschnitten herangezogen und die Fläche von mindestens 100 Tubuli pro Tier mittels der AxioVision-Software (Zeiss, Jena) ermittelt. Um auszuschließen, dass schräg oder längs angeschnittene Tubuli die Messung verfälschen, wurden nur Tubuli ausgewertet deren Länge zu Breite Verhältnis (Feret-Verhältnis) größer als 0,5 war. Es zeigte sich deutlich, dass in beiden Mauslinien die Flächen der Tubulus-Querschnitte bei den Spoc1 -/- - Tieren deutlich verringert sind (Abb. 3.11). In der gemischt-genetischen Mauslinie ist die Reduktion der Tubulus-Größe auf 86 % der Wildtyp-Größe in den 5 Wochen alten Tieren noch sehr moderat. Bei den 10 Wochen alten Tieren ist die Größe auf 71 % und in den 20 Wochen alten Tieren auf 56 % reduziert. Bei den Tieren im congenen Hintergrund zeigt sich diese Reduktion der Tubulus-Größe deutlicher. Schon bei den 5 Wochen alten Tieren ist die Fläche der Tubuli auf 37 % reduziert. Bei den 10 und 20 Wochen alten Tieren liegen 80
91 3.2 Untersuchung des Spermatogenesedefekts auf zellulärer Ebene die Werte bei 29 % bzw. 20 %. Bei diesen stark in der Größe reduzierten Tubuli zeigte sich eine deutliche Vergrößerung des interstitiellen Gewebes. Auswertung der Tubulusarchitektur Neben der Tubulusgröße wurde auch die Struktur der Tubuli quantitativ untersucht. Dies bedurfte einer qualitativen Bewertung der Tubulusarchitektur. Hierbei wurden möglichst klare Kriterien zu Rate gezogen. Die Tubuli wurden in drei Gruppen eingeteilt (Abb A). Der Gruppe 1 wurden hierbei die Tubuli zugeordnet, die eine normale Struktur zeigten. Diese konnten klar einem Stadium des Keimzellepithels (vgl. Kap ) zugeordnet werden und zeigten alle diesem Stadium zugehörigen Zelltypen. Die Gruppe 2 bestand aus Tubuli, deren Struktur desorganisiert war. Hierbei konnten die Tubuli oft noch dem epithelialen Stadium zugeordnet werden, jedoch zeigten sie nicht das gesamte erwartete Spektrum an Zelltypen, da meist die postmeiotischen Zellen fehlten. Außerdem wurden in diese Gruppe Tubuli eingeordnet, in denen neben den Sertoli-Zellen auch noch Keimzellen zu finden waren, aber keinem epithelialen Stadium mehr zugeordnet werden konnten. Die dritte Gruppe bestand aus den Tubuli, in denen nur noch Sertoli-Zellen vorhanden waren. Hierin wurden neben den Tubuli, die nur am basalen Teil der Tubuli Sertoli-Zellen zeigten, auch die Tubuli aufgenommen, bei denen die Sertoli-Zellen sich von der Basallamina gelöst hatten und als stark vakuolisierte Zellen im Inneren der Tubuli vorlagen. Für diese Analyse wurden, wie bei der Ermittlung der Tubulusgröße, je 4 Tiere pro Genotyp, genetischem Hintergrund und Alter untersucht. Es wurden immer mindestens 100 Tubuli den Gruppen zugeordnet. Bei der gemischt-genetischen Mauslinie zeigten sich im Alter von 5 Wochen nur wenige Auffälligkeiten innerhalb der Tubuli (Abb B). Der Großteil der Tubuli wies, wie das entsprechende Wildtyp-Gewebe, alle typischen Zelltypen des Keimepithels auf. Es fanden sich auch alle epithelialen Stadien in der, für dieses Alter entsprechenden Häufigkeit (vgl. Kap ). Im Alter von 5 Wochen ist die erste Welle der Spermatogenese (vgl. Abb. 4.6) gerade abgeschlossen. Bei den 10 Wochen alten Tieren konnte man schon deutlichere Unterschiede zwischen dem Wildtyp- und dem Spoc1 -/- -Gewebe erkennen. Etwa die Hälfte aller Tubuli wies Auffälligkeiten auf, die im Vergleichsgewebe nicht zu finden waren. Neben Tubuli, in denen die heranreifenden Spermatiden reduziert waren oder ganz fehlten, traten auch die ersten Sertoly-Cell-Only -Tubuli auf. Bei den 20 Wochen alten Tieren war der Verlust der Keimzellen deutlich vorangeschritten. Nur noch ca. 1/4 der Tubuli entsprachen den Tubuli des Vergleichsgewebes. Bei etwa der Hälfte der Tubuli waren die postmeiotischen Keimzellen verloren gegangen und bei ca. 1/4 der Tubuli waren nur die somatischen Sertoli-Zellen in den Tubuli verblieben. Dagegen zeigten sich bei den Tieren im congenen Hintergrund schon bei den 5 Wochen alten Tiere deutliche Auffälligkeiten. Zum einen waren die Tubuli deutlich kleiner als die der Vergleichstiere. Zum anderen war auch die Zusammensetzung der Zellen innerhalb der Tubuli deutlich verändert (Abb. 3.12). Weniger als die Hälfte der Tubuli wies eine normale Zellzusammensetzung auf, heranreifende Spermatiden konnten nur in sehr wenigen Tubuli beobachtet werden. Bereits in diesem Alter konnten ca. 20 % der Tubuli dem Sertoly-Cell-Only -Phänotyp zugeordnet werden. Bei den 10 Wochen alten Tieren waren schon über 80 % der Tubuli anormal. Etwa die Hälfte der Tubuli zeigten den Verlust der postmeiotischen Zellen, etwa ein Drittel wies 81
92 3 Ergebnisse Abbildung 3.12 Auswertung der Tubulusstruktur A) Die Struktur der ausgewerteten Tubuli wurde bewertet und in unterschiedliche Gruppen eingeteilt. B) und C) Graphische Auswertung der Analyse der Tubulusstruktur. nur noch Sertoli-Zellen auf. Bei den 20 Wochen alten Tieren waren schließlich weniger als 5 % normal strukturierte Tubuli vorhanden, über 70 % der Tubuli wiesen keine Keimzellen mehr auf. Es zeigte sich also, dass bei den Mäusen im gemischt-genetischen Hintergrund im Alter von 5 Wochen die Zerstörung der Tubulusarchitektur noch nicht weit vorangeschritten ist, was auch erklärt, dass die Tiere in diesem Alter manchmal in der Lage sind, Nachkommen zu zeugen. Im Gegensatz dazu setzt bei den Tieren mit congenem Hintergrund der progressive Verlust der Keimzellen deutlich früher ein. Im Alter von 5 Wochen ist der Verlust schon weit fortgeschritten. Die Verpaarung dieser Tiere hatte zu keinem Zeitpunkt Nachkommen zu Folge. Histologische Untersuchung des Hodengewebes sehr alter Tiere Zusätzlich wurde an Spoc1 +/+ -, Spoc1 +/- - und Spoc1 -/- -Tieren, sehr hohen Alters (>1 Jahr), histologische Untersuchungen durchgeführt. Hierbei zeigte sich, dass im gemischtgenetischen Hintergrund bei den heterozygoten Tieren auch im sehr hohen Alter keine Veränderungen im Vergleich zum Wildtyp zu finden waren (Abb. 3.13). Die homozygoten Spoc1 -/- -Mäuse zeigten sehr kleine Tubuli, in denen keine Keimzellen mehr vorhanden sind. Die Sertoli-Zellen wiesen eine vakuolisierte Form auf und waren zu einem großen 82
93 3.2 Untersuchung des Spermatogenesedefekts auf zellulärer Ebene Teil von der Basallamina gelöst. Sie traten in Clustern im Inneren der Tubuli auf. Das interstitielle Gewebe war aufgrund der stark verkleinerten Tubuli vergrößert und nahm den überschüssigen Platz ein. In der congenen Mauslinie sahen die Tubulusquerschnitte der ho- Abbildung 3.13 Histologische Übersichtsfärbung des Hodengewebes von älteren Mäusen (59 Wo) Von den Hoden wurden Mikrotomschnitte angefertigt und mit Hämatoxylin/Eosin gefärbt. Maßstabsbalken = 100 µm. mozygoten Spoc1 -/- -Mäuse sehr ähnlich aus wie die im gemischt-genetischen Hintergrund. Dies scheint der finale Phänotyp des progressiven Keimzellverlusts zu sein. Interessanterweise waren bei den C57BL/6-Tieren im hohen Alter aber auch die heterozygoten Tiere betroffen. Man erkennt hier nun eine deutliche Destrukturierung der Tubuli. Dieser eintretende Phänotyp konnte bei allen untersuchten heterozygoten Tieren diesen Alters (n = 3) des congenen Hintergrunds gefunden werden. Dies würde zu einem grundsätzlich schwereren Phänotyp des Spoc1 -Knockouts im congenen C57BL/6-Hintergrund passen Untersuchung der Sertoli-Zellen Um zu untersuchen, ob eine reduzierte Anzahl an Sertoli-Zellen für den Verlust der Keimzellen verantwortlich sein kann, wurden vergleichende Zählungen dieser somatischen Zellen in beiden Mauslinien durchgeführt. Dazu wurden die Sertoli-Zellen mittels des Markers GATA1, der spezifisch in den somatischen Zellen innerhalb der Tubuli exprimiert wird, angefärbt (Abb A). Es zeigte sich, dass unabhängig vom genetischen Hintergrund keine Unterschiede in der Anzahl der Sertoli-Zellen bestehen (Abb B). Auch die Lokalisation und die Morphologie der Sertoli-Zellen erschien normal. Deshalb konnte davon ausgegangen werden, dass die somatischen Zellen grundsätzlich von dem Spoc1 -Knockout nicht direkt betroffen sind und keine kausale Rolle beim Verlust der Keimzellen spielen. 83
94 3 Ergebnisse Abbildung 3.14 Analyse der Sertoli-Zellen A) Die Sertoli-Zellen wurden in 10 Wochen alten Tieren mit einem Antikörper gegen GATA1 angefärbt. Links ist ein Ausschnitt des Wildtypgewebes mit den typischen Sertoli-Zellen gezeigt. * = Sertoli-Zellen Maßstabsbalken = 50 µm. B) und C) Die Auswertung der Sertoli-Zellen erfolgte durch die Auszählung von mind. 50 Tubuli pro Tier. Für jede Altersstufe wurden je drei Spoc1 -/- - und drei Spoc1 +/+ -Tiere ausgewertet. Für den gemischt-genetischen Hintergrund wurden nur 10 Wochen alte Tiere untersucht Proliferations- und Apoptoserate während der Spermatogenese In einem nächsten Versuch sollte geklärt werden, ob der Verlust der Keimzellen auf einen Proliferationsdefekt oder auf eine erhöhte Apoptose zurückzuführen ist. Aus diesem Grund wurde das Hodengewebe beider Mauslinien vergleichend auf diese beiden Möglichkeiten hin untersucht. Proliferationsrate Um die Proliferationsrate zu bestimmen, wurden immunhistochemische Untersuchungen mit Antikörpern gegen die beiden Proliferationsmarker PCNA und KI67 durchgeführt. PCNA ist während der S-Phase des Zellzyklus exprimiert und kennzeichnet somit Zellen, die vor einer Mitose stehen [124] [254]. KI67 ist in allen Phasen des Zellzyklus mit Ausnah- 84
95 3.2 Untersuchung des Spermatogenesedefekts auf zellulärer Ebene me der G0-Phase und somit in allen Zellen exprimiert, die teilungsaktiv sind [157]. Für die Untersuchung wurden diese beiden Marker in Paraffinschnitte von Spoc1 +/+ - und Spoc1 -/- - Hoden angefärbt (Abb A). Dafür wurden je drei Spoc1 +/+ - und drei Spoc1 -/- -Tiere des congenen Stammes im Alter von 5, 10 und 20 Wochen verwendet. Für die Auswertung wurden alle positiv gefärbten Zellen pro Tubulus ausgewertet. Neben den teilungsaktiven Keimzellen wurden somit auch die proliferierenden Sertoli-Zellen erfasst. Die Auswertung Abbildung 3.15 Analyse der Proliferationsmarker A) Immunhistochemische Fluoreszenzfärbung mit dem Proliferationsmarker PCNA. Maßstabsbalken = 50 µm. B) Auswertung der PCNA-Auszählung. Gezeigt ist die Anzahl PCNA-positiver Zellen pro Tubulus. C) Auswertung der Ki67-Auszählung. Gezeigt ist die Anzahl Ki67-positiver Zellen pro Tubulus. p-werte wurden mit dem t-test ermittelt. (* p 0,05). zeigte, dass die Anzahl der teilungsaktiven Zellen, welche positiv für PCNA waren, pro Tubulus in den Spoc1 -/- -Tieren, gegenüber den Vergleichstieren, durchgehend erniedrigt war (Abb B). Dieser Unterschied war allerdings nur für die 20 Wochen alten Tiere knapp signifikant. Zu diesem Stadium ist der Keimzellverlust jedoch schon sehr weit fortgeschritten, was aufgrund der sehr niedrigen Anzahl an verbleibenden Zellen zu ei- 85
96 3 Ergebnisse ner Verzerrung des Versuchsergebnisses geführt haben kann. Eine weitere Möglichkeit für diesen Unterschied könnte darin liegen, dass aufgrund der reduzierten Tubulusgröße (vgl. Abb. 3.11) die gesamte Anzahl an Zellen pro Tubulus verringert war. Für den Marker Ki67 zeigten sich für die 5 und die 20 Wochen alten Tiere keine Unterschiede zwischen Spoc1 +/+ - und Spoc1 -/- -Gewebe (Abb C). Bei den 10 Wochen alten Gewebe war die Anzahl an positiven Zellen in den Spoc1 -/- -Tieren leicht erhöht. Dieser Unterschied war jedoch nicht signifikant. Insgesamt weisen die Daten darauf hin, dass kein Defekt in der Proliferationsaktivität der Keimzellen vorliegt. Apoptoserate Um zu untersuchen, ob auf der anderen Seite eine erhöhte Apoptoserate in den Keimzellen der Spoc1 -/- -Tiere vorliegt, wurden zum einem TUNEL-Assays [218] und zum anderen immunhistochemische Färbungen gegen aktivierte Caspase 3 [200] durchgeführt. Die Färbungen wurden in beiden Mauslinien an je zwei Spoc1 +/+ - und zwei Spoc1 -/- -Tieren der Altersstufen 5, 10 und 20 Wochen durchgeführt. Abbildung 3.16 Analyse der Apoptoserate in Spoc1 -/- -Mäusen A) Apoptoserate in 5-20 Wochen alten Mäusen des gemischt-genetischen und des congenen Hintergrunds. B) Verteilung der apoptotischen Zellen auf einzelne Meiosestadien. 86
97 3.2 Untersuchung des Spermatogenesedefekts auf zellulärer Ebene Um zu identifizieren, in welchen Zellen die Apoptoserate erhöht ist, wurden außerdem Doppelfärbungen mit γh2ax und Phospho-H3 durchgeführt (Abb. 3.17). Mittels des deutlichen γh2ax-signals in den meiotischen Zellen konnten die Zellen dem Pachytän zugeordnet werden, da in diesem Stadium das Signal am XY-Body konzentriert ist. Phospho- H3 ist an metaphasischen Chromosomen besonders stark vertreten [126]. Neben diesen beiden Markern wurden spät apoptotische Zellen, die aufgrund der Fragmentierung des Chromatins keine Histonmarker mehr aufweisen, mittel ihres DAPI-Signals und ihrer Lokalisation innerhalb der Tubuli, diesen beiden Stadien zugeordnet. Alle Zellen, die nicht eindeutig zuzuordnen waren, wurden als andere Zelltypen zusammengefasst. Der TUNEL- Assay zeigte deutlich, dass es bei beiden Mauslinien zu einer erhöhten Apoptoserate bei den Spoc1 -/- -Tieren kommt (Abb A). Diese war in allen untersuchten Altersstufen zu sehen. Die Daten zur aktivierten Caspase 3 bestätigten dieses Ergebnis (Daten nicht gezeigt). Die Anzahl metaphasischer, apoptotischer Zellen scheint im Spoc1 -/- -Gewebe nicht verändert zu sein (Abb B). Dafür findet man eine sehr große Anzahl an apoptotischen Pachytän-Zellen. Auch in anderen nicht zugeordneten Zelltypen scheint die Apoptoserate erhöht zu sein (Abb B). Abbildung 3.17 Identifizierung der apoptotischen Zellen Die Färbung mittels TUNEL-Assay und Co-Färbung mit den Markern γh2ax bzw. phospho-h3 ermöglicht eine exakte Identifizierung der Zelltypen. Zur Kontrastverstärkung wurden die Farben invertiert. Pfeil: XY-Body einer apoptotischen Zelle. * = Metaphasezelle, die sich in der Apoptose befindet. Die gestrichelte Linie verdeutlicht den Tubulus-Rand. Bei dieser Analyse fiel auf, dass die apoptotischen Zellen im Spoc1 -/- -Gewebe oft kettenartig aufgereiht sind. Um dieses Verteilungsmuster näher zu untersuchen, wurden erneut TUNEL-Assays mit Co-Färbungen durchgeführt. Die Färbungen wurden mit mit je drei Spoc1 +/+ - und Spoc1 -/- -Tieren der Altersstufen 5 und 10 Wochen im congenen Hintergrund durchgeführt. Zusätzlich wurde die Färbung mit je einem Spoc1 -/- -Tier der Altersstufen 5, 10 und 20 Wochen im gemischt-genetischen Hintergrund wiederholt. Als Marker wurde neben γh2ax außerdem SCP3 verwendet, welches ein Bestandteil des synaptonemalen Komplexes ist. Das Cluster -Muster, das in der vorausgegangenen Analyse 87
98 3 Ergebnisse Abbildung 3.18 Klonales Apoptose-Muster. Die Färbung mittels TUNEL- Assay und Co-Färbung mit den Markern γh2ax bzw. SCP3 zeigt ein klonales Muster der apoptotischen Pachytänzellen. Die Färbung wurde an 5 Wochen alten Spoc1 -/- -Tieren im congenen Hintergrund durchgeführt. Maßstabsbalken = 20 µm. gefunden wurde, konnte hierbei unabhängig vom genetischen Hintergrund bestätigt werden (Abb. 3.18). Ein Großteil der TUNEL-positiven Zellen waren in Clustern von 4-18 Zellen zu finden. Diese gruppierten Zellen konnten meistens dem Pachytänstadium zugeordnet werden. Neben den Clustern wurden auch einzelne Zellen angefärbt. Der Verlust der Keimzellen ist somit - zumindest zum Teil - auf eine erhöhte Apoptoserate im Pachytänstadium zurückzuführen. Es kommt hierbei zu einem klonalen Verteilungsmuster der apoptotischen Zellen Die Verteilung der undifferenzierten Spermatogonien Eine weitere Auffälligkeit zeigte sich in der Verteilung der undifferenzierten Spermatogonien. Um dies zu untersuchen wurden Hodenschnitte mit dem Marker PLZF, welcher spezifisch in diesen Zellen exprimiert wird, gefärbt (Abb A) [43]. Diese Analysen wurden an den Mäusen des congenen Stammes durchgeführt. Für das P0-Gewebe wurden je zwei Spoc1 +/+ - bzw. Spoc1 -/- -Tiere verwendet. Bei den adulten Tieren wurden immer mindestens 3 Tiere pro Altersstufe und Genotyp untersucht. Die Auszählung der positiven Zellen erfolgte an mind. 50 Tubuli pro untersuchten Tier. Hierbei zeigte sich zunächst, dass die durchschnittliche Anzahl an PLZF-positiven-Zellen pro Tubulus nicht verändert war (Abb B). Betrachtet man allerdings die Verteilung genauer, so fällt auf, dass bei den adulten Tieren ein deutlich höherer Anteil an Tubuli ohne PLZF-positiven Zellen vorhanden war (Abb C). Demgegenüber war diese Fehlverteilung bei dem Gewebe der neugeborenen Tiere noch nicht vorhanden. Um diese Fehlverteilung in den adulten Tieren genauer zu untersuchen, wurden die PLZFpositiven Zellen pro Tubuli näher analysiert (Abb D - F). Es zeigte sich, dass schon bei den 5 Wochen alten Spoc1 -/- -Tieren 20 % der Tubuli kein PLZF-Signal zeigten, bei den Wildtyp-Tieren waren es dagegen nur 5 %. Gleichzeitig gab es im Spoc1 -/- -Gewebe deutlich mehr Tubuli, die außergewöhnlich viele PLZF-positive Zellen aufwiesen. Während die Verteilung der undifferenzierten Spermatogonien im Wildtyp-Gewebe im Verlauf der Zeit gleich blieb, zeigte sich bei den Spoc1 -/- -Tieren, dass der Anteil an Tubuli ohne diese Zellen deutlich stieg. Im Gewebe der 10 Wochen alten Tieren wurden ca. 28 %, bei den 20 Wochen alten Tieren sogar 85 % dieser Tubuli gefunden. Gleichzeitig aber stieg die Anzahl der Tubuli mit außergewöhnlich vielen undifferenzierten Spermatogonien. 88
99 3.2 Untersuchung des Spermatogenesedefekts auf zellulärer Ebene Abbildung 3.19 Verteilung der undifferenzierten Spermatogonien A) Immunhistochemische DAB-Färbung des Markers PLZF in Hodengewebe adulter und neugeborener (P0) Spoc1 -/- bzw. Spoc1 +/+ -Tiere. Maßstabsbalken = 50 µm. B) Mittlere Anzahl an PLZF-positiven Zellen pro Tubulus. C) Anteil der Tubuli ohne PLZF-positive Zellen. Der p-wert wurde über t-test ermittelt. D-F) Verteilung der PLZF-positiven Zellen pro Tubulus bei 5, 10 und 20 Wochen alten Tieren. Fasst man die Ergebnisse zusammen, so kann man sagen, dass es in den Spoc1 -/- -Tieren zu einer Umverteilung der spermatogonalen Stammzellen kommt. Obwohl die mittlere Anzahl an undifferenzierten Spermatogonien zunächst keiner signifikanten Veränderung unterliegt, scheint es Abschnitte des Keimepithels zu geben, in denen diese Zellen drastisch verloren gehen. In anderen Abschnitten findet sich dagegen ein vorübergehender Anstieg an undifferenzierten Spermatogonien. Da diese sehr oft in Ketten nebeneinander zu finden sind, ist es wahrscheinlich, dass es sich hierbei um A aligned -Spermatogonien handelt. Dieser transiente Anstieg kann jedoch nicht aufrechterhalten werden und es kommt schließlich zum Verlust aller undifferenzierten Spermatogonien und zum Sertoli- Cell-Only -Phänotyp. Dies deutet darauf hin, dass bei der Transition der undifferenzierten Spermatogonien zu weiter differenzierten Zellen ein Defekt vorhanden sein könnte (vgl. Kap. 4.1). 89
100 3 Ergebnisse 3.3 Histonmodifikationen der undifferenzierten Spermatogonien Da die molekularen Wirkmechanismen von SPOC1 noch nicht aufgeklärt werden konnten, sollte untersucht werden, ob SPOC1 als Effektorprotein in epigenetischen Regulationsmechanismen involviert ist. Es ist bereits bekannt, dass SPOC1 über seine hochkonservierte Plant Homeodomain (PHD) an H3K4me3 binden kann und somit einen epigenetischen Reader dieser Modifikation darstellt [39] [256]. Im Rahmen der vorliegenden Arbeit sollte geklärt werden, mit welchen Histonmodifikationen SPOC1 in den undifferenzierten Spermatogonien interagieren könnte und ob das Protein als Writer oder Eraser Modifikationen beeinflussen kann. Dazu war es erforderlich die Expression von Spoc1 genauer zu untersuchen, um zu bestimmen, welche Zellen im weiteren vergleichend analysiert werden sollten. Eine Doppelfärbung von SPOC1 mit unterschiedlichen Histonmodifikationen sollte dann klären, welche epigenetischen Modifikationen einen potentiellen Interaktionspartner in den undifferenzierten Spermatogonien darstellen. Abschließend sollte untersucht werden, ob es im Hodengewebe der Spoc1 -/- - Tiere zu Veränderungen der untersuchten Histonmodifikationen in den undifferenzierten Spermatogonien kommt Lokalisation von SPOC1 Im Rahmen der Doktorarbeit von A. Bördlein konnte gezeigt werde, dass Spoc1 in A single - und A paired -Spermatogonien exprimiert ist [39]. Im Rahmen der vorliegenden Arbeit konnte diese Lokalisation des Protein bestätigt werden. Dazu wurden histologische Schnitte des Hodengewebes von Wildtyp-Tieren mit einem Antikörper gegen SPOC1 mittels der ABC-Technik angefärbt (vgl. Kap ). Das DAB-Signal ist deutlich in wenigen basal liegenden Zellen der Tubuli zu sehen (Abb A). Abbildung 3.20 Expression von Spoc1 in undifferenzierten Spermatogonien A) Immunhistochemische DAB-Färbung an einem Mikrotomschnitt von Hodengewebe einer 10 Wochen alten Wildtyp-Maus mit einem Antikörper gegen SPOC1. Maßstabsbalken = 10 µm. B) Immunfluoreszenzfärbung mit einem Antikörper gegen SPOC1 an Whole-mount Präparationen von Tubuli einer 10 Wochen alten Wildtyp-Maus. Maßstabsbalken = 100 µm. 90
101 3.3 Histonmodifikationen der undifferenzierten Spermatogonien Neben den einzeln liegenden Zellen, die den A single -Spermatogonien entsprechen, sind auch paarweise angeordnete Zellen zu erkennen, bei denen es sich um A paired -Spermatogonien handelt. Um zu untersuchen, ob auch die weiter differenzierten A aligned -Spermatogonien eine starke Spoc1 -Expression aufweisen, wurde eine andere Färbung verwendet, da diese kettenartig aufgereihten Zellen im Schnitt nicht von den A paired eindeutig zu unterscheiden sind. Dazu wurden Tubuli aus Wildtyp-Mäusen isoliert und als Whole-mount - Präparate mit einem Antikörper gegen SPOC1 angefärbt. Im Mikroskop ist somit der gesamte Tubulus mit der nativen Anordnung der Zellen zu sehen. Es war deutlich erkennbar, dass das SPOC1-Signal sowohl in einzeln oder paarweise vorliegenden Zellen zu sehen war. Zusätzlich konnten jedoch auch Zellen gefunden werden, die in zusammenhängenden Ketten von 4-16 Zellen vorhanden waren (Abb B). Mittels dieser Whole-mount - Immunfluoreszenz konnte demnach gezeigt werden, dass eine zusätzliche starke Expression von Spoc1 in der A aligned -Spermatogonien vorhanden ist (Abb. 3.20). Somit wird Spoc1 in allen undifferenzierten Spermatogonien des murinen Testis-Gewebe stark exprimiert. Von Kopylow et al. konnten zusätzlich eine schwache Expression des Gens in Sertoli-Zellen und differenzierten Spermatogonien in humanem Testis-Gewebe zeigen [297] Kolokalisation von SPOC1 und verschiedener Histonmethylierungen Als nächstes wurde untersucht, mit welchen Histonmethylierungen SPOC1 im Hodengewebe kolokalisiert. Dazu wurden Doppelfärbungen in Wildtyp-Gewebe 5, 10 und 20 Wochen alter Tiere durchgeführt (siehe Abb und 3.22). Es wurden dafür Antikörper gegen einige Di- und Trimethylierungen am Histon 3 verwendet. Die Modifikationen an den Lysinen K4, K36 und K79 sind hierbei mit aktivem Chromatin assoziiert. Die Modifikationen an den Resten K9 und K27 wurden dagegen im Zusammenhang mit konstitutivem Heterochromatin gebracht [148]). In Abb und 3.22 sind exemplarisch Doppelfärbungen der Histonmodifikationen mit SPOC1 dargestellt. Eine deutliche Kolokalisation konnte für H3K4me3, H3K27me2/3 und H3K36me3 gefunden werden. Die anderen Modifikationen sind in den undifferenzierten Spermatogonien nur schwach oder gar nicht vorhanden. Die Ergebnisse sind in Tabelle 3.3 zusammengefasst. Sertoli- Zellen Tabelle 3.3 Undiff. Sp. Lokalisation der Histonmethylierungen Diff. Sp. Meiozyten Runde Spermatiden Elongierte Spermatiden Kolokalisation mit SPOC1 H3K4me2 kein Signal schwach stark dynamisch stark mittel teilweise H3K4me3 kein Signal stark vorhanden schwach stark schwach ja H3K9me2 Nucleoli kein Signal stark kein Signal kein Signal kein Signal nein H3K9me3 Nucleoli peripher peripher Telomere Nucleoli Nucleoli teilweise H3K27me2 vorhanden stark schwach vorhanden schwach kein Signal ja H3K27me3 sehr stark stark speckles speckles speckles kein Signal ja H3K36me3 kein Signal stark stark stark stark stark ja H3K79me2 kein Signal kein Signal kein Signal kein Signal stark stark nein H3K79me3 kein Signal kein Signal kein Signal kein Signal schwach schwach nein Undiff. Sp. = Undifferenzierte Spermatogonien; Diff. Sp. = Differenzierte Spermatogonien 91
102 3 Ergebnisse Abbildung 3.21 Kolokalisation von SPOC1 mit unterschiedlichen Histonmethylierungen (Teil 1) Immunhistochemische Doppelfärbung an Mikrotomschnitten von 10 Wochen altem Wildtyp Hodengewebe. Neben SPOC1 (rot) sind jeweils unterschiedlich methylierte Formen des Histons H3 an den Lysin-Positionen 4, oder 9 (grün) angefärbt. Die DNA wurde mit DAPI gegengefärbt. * markiert SPOC1-positive Zellen. Maßstabsbalken = 5 µm. Die meisten der untersuchten Histonmodifikationen unterliegen im Verlauf der Spermatogenese einer strikten Kontrolle und zeigen daher unterschiedliche Signalstärken in den unterschiedlichen Zelltypen des Keimepithels. 92
103 3.3 Histonmodifikationen der undifferenzierten Spermatogonien Abbildung 3.22 Kolokalisation von SPOC1 mit verschiedenen Histonmethylierungen (Teil 2) Immunhistochemische Doppelfärbung an Mikrotomschnitten von 10 Wochen altem Wildtyp Hodengewebe. Neben SPOC1 (rot) sind jeweils unterschiedlich methylierte Formen des Histons H3 an den Lysin-Positionen 27, 36 oder 79 (grün) angefärbt. Die DNA wurde mit DAPI gegengefärbt. * markiert SPOC1-positive Zellen. Maßstabsbalken = 5 µm. 93
104 3 Ergebnisse Kolokalisation mit PLZF Um mögliche Veränderungen der Histonmodifikation in den undifferenzierten Spermatogonien zwischen Wildtyp- und Spoc1 -/- -Tieren näher zu untersuchen, wurde PLZF als Marker für diese Zellen ausgewählt. Um die Eignung von PLZF als Marker für SPOC1- positive Zellen zu testen, wurden zunächst Doppelfärbungen durchgeführt, die zeigen sollten, dass die beiden Proteine weitgehend koexprimiert sind (Abb. 3.23). Abbildung 3.23 Koexpression von SPOC1 mit PLZF Immunhistochemische Doppelfärbung von SPOC1 (rot) und PLZF (grün) an Mikrotomschnitten. Für die Präparation wurden Testis-Gewebe von unterschiedlich alten (P1 - P70) Wildtyp-Mäusen verwendet. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 10 µm. Es zeigte sich hierbei, dass in % aller SPOC1-positiven Zellen auch PLZF exprimiert wird. Umgekehrt sind % der PLZF-positiven Zellen auch positiv für SPOC1. Aufgrund der guten Übereinstimmung des Expressionsmusters beider Proteine konnte PLZF als Marker für SPOC1-positive Zellen verwendet werden. 94
105 3.3 Histonmodifikationen der undifferenzierten Spermatogonien Veränderungen der Histonmodifikationen im Spoc1 -/- -Gewebe Um Veränderungen an den Methylmodifikationen an Histon H3 in den Spoc1 -/- -Tieren zu untersuchen, wurden Doppelfärbungen mit PLZF durchgeführt. Es wurden hierbei Gewebe von 5, 10 und 20 Wochen alten Mäusen untersucht (Abb und 3.25). Um eine semiquantitative Auswertung zu erhalten, wurden Aufnahmen unter gleichen Bedingungen (Belichtungszeit, gleicher Objektträger) von Spoc1 -/- -Gewebe und einem Wildtyp- Vergleichsgewebe erstellt. Die Intensität einzelner undifferenzierter Spermatogonien wurde mittels der AxioVision-Software gemessen und auf die Intensität des DAPI-Signals normalisiert. Diese Werte wurden je Genotyp für mind. 20 Zellen ermittelt und anschließend die Intensitätswerte der Spoc1 -/- -Zellen auf die Werte der Spoc1 +/+ -Zellen normalisiert. Für jedes Alter und jeden Genotyp wurden sechs Tiere untersucht und daraus der in der Tabelle 3.4 dargestellte Mittelwert und der p-wert errechnet. Tabelle 3.4 Unterschiede der Histonmodifikationen in undiff. Spermatogonien Histonmodifikation Messung KO/WT p-wert H3K4me2 0, , H3K4me3 0, , H3K9me3 0, , H3K27me2 0, , H3K27me3 1, , H3K36me3 0, , H3K79me2 0, , H3K79me3 0, , p-werte wurden mit dem t-test ermittelt. Für keine der untersuchten Histonmethylierungen konnten signifikante Unterschiede in der Intensität der Signale in den undifferenzierten Spermatogonien gefunden werden. Die PLZF-positiven Zellen zeigten unabhängig vom Genotyp der Tiere die Lokalisation der Histonmethylierungen. Dabei zeigte sich das gleiche Kolokalisationsmuster der Histonmodifikationen mit PLZF wie mit SPOC1 (vgl. Tab. 3.3). Unterschiede in der Anzahl der doppelt positiven Zellen konnten nicht festgestellt werden. Insgesamt konnte eine Tendenz für ein etwas schwächeres Histonmethylierungssignal im Spoc1 -/- -Gewebe gefunden werden. Nur für H3K27me3 konnte etwas mehr Signal in den undifferenzierten Spermatogonien des Spoc1 -/- -Gewebes detektiert werden. Da diese Unterschiede jedoch nicht signifikant waren, muss davon ausgegangen werden, dass keine grundlegenden Änderungen der H3-Methylierungen in den undifferenzierten Spermatogonien des Spoc1 -/- -Gewebes vorhanden sind. 95
106 3 Ergebnisse Abbildung 3.24 Veränderungen der Histonmodifikationen im Gewebe von Spoc1-/- -Mäusen (Teil 1) Mikrotomschnitte des Hodengewebes 10 Wochen alter Wildtyp- und Spoc1-/- -Mäuse, die mit Antikörpern gegen PLZF (rot) und gegen eine Histonmodfikation (grün) inkubiert wurden. Die DNAFärbung erfolgte mit DAPI. Maßstabsbalken = 10 µm. 96
107 3.3 Histonmodifikationen der undifferenzierten Spermatogonien Abbildung 3.25 Veränderungen der Histonmodifikationen im Gewebe von Spoc1-/- -Mäusen (Teil 2) Mikrotomschnitte des Hodengewebes 10 Wochen alter Wiltyp- und Spoc1-/- -Mäuse, die mit Antikörpern gegen PLZF (rot) und gegen eine Histonmodfikation (grün) inkubiert wurden. Die DNAFärbung erfolgte mit DAPI. Maßstabsbalken = 10 µm. 97
108 3 Ergebnisse 3.4 Vergleichende Genexpressionsanalysen Um einen tieferen Einblick in die Auswirkungen des Knockdowns von Spoc1 zu gewinnen, wurden vergleichende Genexpressionsanalysen durchgeführt. Dazu wurden genomweite Micorarrays der Firma Affymetrix ( GeneChip Mouse Genome ) verwendet, deren Ergebnisse mittels Real Time-PCR überprüft wurden. Anschließend wurden die Ergebnisse in einem Chromosomen-weiten Zusammenhang ausgewertet Genomweite Expressionsanalysen Für die genomweiten Expressionsanalysen wurden jeweils 4 bzw. 3 Spoc1 -/- -Mäuse des gemischten, als auch des congenen genetischen Hintergrunds und als Vergleichstiere deren Spoc1 +/+ -Geschwister untersucht. Als Ausgangsmaterial wurde RNA verwendet, die aus Gesamthodengewebe gewonnen worden war: Verwendete Mäuse: C57BL/6 x 129P2: jeweils 4 Tiere im Alter von Wochen (Array 1) C57BL/6: jeweils 3 Tiere im Alter von 5 Wochen (Array 2) Die Durchführung des ersten Arrays erfolgte im Rahmen der Dissertation von A. Bördlein, der zweite Array im Rahmen der vorliegenden Doktorarbeit. Für eine detaillierte Auswertung wurden die Ergebnisse beider Arrays vergleichend herangezogen. Für die Microarray-Analyse wurde Gesamt-RNA aus Hodengewebe isoliert und über einen DNase-Verdau aufgereinigt. Die Überprüfung der Probenqualität erfolgte am BioAnalyzer (vgl. Anhang A.1). Die Proben wurden auf dem GeneChip Mouse Genome (Affymetrix) hybridisiert und anschließend mit der Partek Genomics Suite von Dr. Arif Ekici analysiert. Das Histogramm der Analysen zeigten bei beiden Arrays eine gleichmäßige Verteilung (vgl. Anhang. A.2). Die Principle Component Analyse (PCA, vgl. Anhang A.3) zeigte, dass die beiden Gruppen - Spoc1 +/+ und Spoc1 -/- - gut voneinander trennbar sind. Auch die Analyse der Variationsquellen zeigte, dass der Genotyp als Hauptursache für differentielle Expression angesehen werden kann (vgl. Anhang A.4). In beiden Arrays konnten differentiell exprimierte Gene detektiert werden. Dabei war der Großteil der Gene im Spoc1 -/- -Gewebe hoch reguliert, was darauf hindeutet, das SPOC1 eher eine reprimierende Wirkung auf die Transkription hat (Abb. 3.26). Insgesamt konnten bei ersten Array 995 differentiell exprimierte Gene mit einem Fold Change (= x-fache Änderung der Expressionsstärke) von 1,5 identifiziert werden, beim zweiten Array waren es 748 Gene. Von diesen Genen wurden 217 in beiden Arrays als differenziert exprimierte Gene identifiziert. Es fällt auf, dass bei dem ersten Array ein nicht homogener Bereich zu erkennen ist, bei dem die Expression auch zwischen den biologischen Replikaten eines Genotyps stark voneinander abweichen (Abb. 3.26). Die Expression dieser Gene ist vermutlich stammspezifisch und somit vom genetischen Hintergrund der Tiere abhängig [118]. Da die Tiere des ersten Array einen gemischt-genetischen Hintergrund aufwiesen, die des zweiten Arrays auf einen congenen Hintergrund zurück gekreuzt wurden ist dieser inhomogene Bereich im zweiten Array nicht mehr vorhanden. 98
109 3.4 Vergleichende Genexpressionsanalysen Abbildung 3.26 Heatmaps der Expressionsanalysen Mittels GeneChip -Analysen wurden Gene identifiziert, die im Spoc1 -/- -Gewebe differentiell exprimiert sind. In der Abbildung stellt ein waagrechter Strich ein Gen dar. Eine erhöhte Expression ist durch die rote Farbe gekennzeichnet. In Blau sind die Gene dargestellt, die in den Spoc1 -/- -Tieren herab reguliert sind Analyse der Expressionsdaten mittels Pathway Express Um detaillierter zu untersuchen, welche Signalwege durch den Knockout von Spoc1 betroffen sind, wurden die differentiell exprimierten Gene beider Arrays mittels Pathway Express ( analysiert. Hierbei handelt es sich um ein Online-Tool, welches die Gene in Kategorien einordnet und somit einen Zusammenhang zu Signalwegen herstellt. Die Analyse wurde sowohl für die beiden Arrays einzeln, als auch für die kombinierten Daten durchgeführt. In beiden Arrays sind zwei Signalwege mit einer sehr hohen Wahrscheinlichkeit betroffen: transendotheliale Leukozytenmigration und Zelladhäsion. Eine Übersicht über die in den beiden Pathways regulierten Gene findet sich in Anhang A.5 und A.6. In Tabelle 3.5 sind die Ergebnisse der Pathwayanalyse der einzelnen und der kombinierten Array-Ergebnisse zusammengefasst. Der Impact steht hierbei für die ermittelte Relevanz des Pathways, die sich aus der relativen Anzahl der in dem Pathway regulierten Gene (% Pathway Genes) und dem Anteil der betroffenen Gene im ermittelten Array (% Input Genes) ergibt. Der p-wert wird von dem Programm als korrigierter Gamma-p-Wert ausgegeben. Migrationsprozesse sind aufgrund der vektoriellen Wanderung der Keimzellen im Verlauf ihrer Differenzierung von großer Bedeutung. Dabei muss die Blut-Hoden-Schranke (Blood-Testis-Barrier, BTB) geöffnet und anschließend wieder geschlossen werden, ohne dass die immunologische Barriere verloren geht. Dazu sind viele Proteine notwendig, die an Migrationsprozessen und an der Zelladhäsion beteiligt sind (vgl. Abschnitt 4.3.3). Aufgrund dieses Ergebnisses wurden Marker, die für die Migration der Keimzellen innerhalb des Hoden wichtig sind, näher untersucht. 99
110 3 Ergebnisse Tabelle 3.5 Pathway-Express-Analyse des 1. Arrays Auswertung mittels Pathway Express Rank Pathway Impact % Input Genes % Pathway Genes 1 Leukocyte transendothelial migration Cell adhesion molecules (CAMs) Regulation of actin cytoskeleton Pathways in cancer Antigen processing and presentation Pathway-Express-Analyse des 2. Arrays Rank Pathway Impact % Input Genes % Pathway Genes 1 Leukocyte transendothelial migration Cell adhesion molecules (CAMs) Phosphatidylinositol signaling system Adherens junction Taste transduction Pathway-Express-Analyse der kombinierten Arrays Rank Pathway Impact % Input Genes % Pathway Genes Gammap-Value Gammap-Value Gammap-Value 1 Cell adhesion molecules (CAMs) Leukocyte transendothelial migration Phosphatidylinositol signaling system Pathways in cancer Focal adhesion Gezeigt sind jeweils die ersten fünf Pathways Migrationsmarker Die Ergebnisse der Pathway Express -Analyse zeigten, dass zwei Signalwege (Leukozytenmigration (LM) und Zelladhäsion (CAMs)) bei Verlust des Spoc1 -Gens im Hoden besonders stark betroffen waren (siehe Tabelle 3.6). Für beide Signalkaskaden sind Moleküle wichtig, die auf der Zelloberfläche exprimiert werden und Migration und Adhäsion vermitteln können. Deshalb wurden ausgewählte Gene, die im Array als differentiell exprimiert identifiziert wurden und einen hohen Fold-Change aufwiesen, mittels Real Time-PCR überprüft. Die Gene Alcam, Claudin11 (Cldn11 ) und F11R waren in allen untersuchten Spoc1 -/- - Tieren deutlich erhöht. Für Cadm1 konnte kein signifikanter Unterschied in der Real Time-PCR gefunden werden. Für CLDN11 wurden zusätzlich immunhistochemische Analysen durchgeführt. Hierbei konnte in 20 Wochen alten Tieren gezeigt werden, dass das Signal für das Protein in den Spoc1 -/- -Tieren stärker war und sich außerdem die Lokalisation geändert hat. Während in den Wildtyp-Tieren das Signal parallel zur Basallamina zu finden ist, zeigte sich in den Spoc1 -/- -Tieren das Signal, das senkrecht zur Basallamina, zwischen den Keimzellen, lokalisiert war. Bei 20 Wochen alten Tieren ist jedoch der progressive Keimzellverlust schon weit fortgeschritten, so dass auch ein sekundärer Effekt in den Spoc1 -/- -Tieren nicht auszuschließen ist. 100
111 3.4 Vergleichende Genexpressionsanalysen Tabelle 3.6 Regulierte Gene in den Pathways Leukozytenmigration (LM) und Zelladhäsion (CAMs) Gen Pathway Array 1 KO/WT GNAI1 (guanine nucleotide binding protein (G protein), alpha inhibiting activity polypeptide 1) PIK3R6 (phosphoinositide-3-kinase, regulatory subunit 6) F11R (F11 receptor) CAMs LM CXCR4 (chemokine (C-X-C motif) receptor 4) Array 2 KO/WT Funktion LM G-Protein, Inhibitor der Adenylyl Cyclase, inhibitorische Wirkung auf Tumormigration [320] LM Regulatorische Untereinheit des PI3K gamma Komplex, wirkt aktivierend [296] Komponente des apikalen Junvtion- Komplex [206] LM Chemokin-Rezeptor, reguliert Migration, Proliferation und Überleben verschiedener Zelltypen [319] CLDN11 (Claudin 11) CAMs Essentielles Claudin für die Bildung der Tight Junction und der Integrität der BTB [191] RAP1A (Member Of RAS Oncogene Family) CTNNA1 (Catenin (Cadherin-Associated Protein)), Alpha 1 LM Gehört zu den RAS-like Onkogenen und ist wichtig für Zelladhäsion und Lymphozytenmigration [34] LM Alpha-Catenin, interzelluläres Adhäsionsmolekül, reguliert Actin [164] ALCAM (Activated leukocyte cell adhesion molecule) CAMs Zelladhäsionsmolekül, wichtige Rolle bei Krebs [223] Abbildung 3.27 Expressionsanalyse ausgewählter Gene aus Migrationspathways A) Für die Real Time-PCR wurde RNA aus Hodengewebe isoliert. Die Expression der Gene Alcam, Cadm1, Claudin11 und F11R wurden analysiert. Als Referenz wurde G6PDH verwendet. Die p-werte wurden mittels t-test berechnet. (** p 0,001). B) Immunfluoreszenzfärbung von Claudin11 an Hodengewebe 20 Wochen alter Wildtyp- bzw. Spoc1 -/- -Mäuse. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 20 µm. 101
112 3 Ergebnisse Genomische Lokalisation der differentiell exprimierten Gene Bei der Kartierung der differentiell exprimierten Gene auf ihre genomische Position fiel auf, dass sich überproportional viele dieser Gene sich in der Nachbarschaft zu dem Spoc1 - Gen (Chr.4 E2) befinden. Dieser Befund ist überraschend. Insbesondere das Gen Tas1r1 war in beiden Arrays bei den Spoc1 -/- -Tieren stark herab reguliert. Abbildung 3.28 Genomische Position von Spoc1 und Tas1r1 Spoc1 und Tas1r1 liegen in räumlicher Nähe zueinander in der Chromosomenregion 4qE2. Die Gene liegen in einem Abstand von 38 kb zueinander. Da eine Deletion des Bereichs in den Spoc1 -/- -Mäusen aufgrund der vorliegenden Daten [39] [40] ausgeschlossen werden konnte, kamen als Erklärungsmöglichkeit stammspezifische Unterschiede im Expressionsmuster in Frage. Zu beachten ist hierbei, dass bei der Rückkreuzung in den congenen C57BL/6-Mausstamm eine Selektion auf das Spoc1 -Allel des Stammes 129P2 erfolgte. Unmittelbar benachbarte Gene, die mit Spoc1 stark gekoppelt vorliegen sind demnach für Spoc1 -/- -Tiere homozygot für das 129P2-Allel, während die Spoc1 +/+ -Tiere homozygot die C57BL/6-Variante tragen. Eines der Gene, das in unmittelbarer Nähe zu Spoc1 lokalisiert ist, wird als Tas1r1 (taste receptor, type 1, member 1) bezeichnet. Das Gen codiert für eine Untereinheit des Umami-Geschmackrezeptors und ist normalerweise in den Papillen der Zunge (Papillae fungiformes) exprimiert [20]. Im Mausstamm C57BL/6 konnte jedoch auch eine Aktivität des Promotors in den Spermatozoen gezeigt werden [196]. Dieses Gen liegt in räumlicher Nähe zu dem Spoc1 -Gen auf Chromosom 4qE2 (Abb. 3.28). Es sollte nun geklärt werden, ob es sich bei der Reduktion der Tas1r1 Expression um einen stammspezifischen Unterschied zwischen den Mausstämmen C57BL/6 und 129P2 handelt, oder ob der Knockout von Spoc1 dafür verantwortlich ist. Zunächst wurden quantitative Real Time-PCRs mit cdna aus dem Hodengewebe von C57BL/6-, und 129/Sv-Mäusen sowie deren Hybriden (C57BL/6 x 129/Sv) und den Spoc1 -/- -Mäusen im congenen C57BL/6-Hintergrund durchgeführt. Da der Stamm 129P2, aus dem die Gene trap -ES-Zellen stammen nicht verfügbar war, wurde als Ersatz der Stamm 129/Sv verwendet, der mit 129P2 nah verwandt ist [21]. Die Analysen zeigten, dass eine deutliche Expression von Tas1r1 im Hodengewebe des Stammes C57BL/6 vorhanden ist, während in den 129/Sv-Tieren keine Expression des Gens detektiert werden konnte. 102
113 3.4 Vergleichende Genexpressionsanalysen Abbildung 3.29 Expression von Tas1r1 A) Real Time PCR-Analysen an den Mausstämmen C57BL/6 und 129/Sv, deren Hybriden (C57BL/6 x 129/Sv) und den Spoc1 -/- -Mäusen im congenen C57BL/6-Hintergrund zeigen, dass die Expression von Tas1r1 im Hodengewebe bei den C57BL/6-Tieren, jedoch nicht bei den Tieren des Stammes 129/Sv auftritt. Als Referenzgen wurde G6PDH verwendet. B) Semiquantitative PCR an Zungen- und Hodengewebe der Ratte (Rattus norvegicus) zeigen, dass in der Ratte Tas1r1 nicht im Hoden exprimiert wird. Die Hybriden der beiden Stämme zeigten erwartungsgemäß eine intermediäre Expression, was auf die Transkription des C57BL/6 Allels zurückzuführen ist. Die Spoc1 -/- -Mäuse im zurück gekreuzten C57BL/6-Hintergrund zeigten ebenfalls keine Expression des Gens im Hodengewebe (Abb A). Um einen Hinweis zu erhalten, ob die Expression von Tas1r1 im Hodengewebe in Nagetieren dem Normalzustand entspricht, oder ob die Expression in dem 129/Sv-Stamm verloren ging, wurde die Expression des Gens in einem anderen Nagetier untersucht. Dazu wurde mittels einer semiquantitativen PCR untersucht, ob in der Ratte (Rattus norvegicus) eine Expression von Tas1r1 im Hoden vorliegt. Die Ratte wurde gewählt, da sie einen nahen Verwandten der Maus darstellt. Die PCR zeigte, dass die Expression von Tas1r1 zwar in der Zunge vorhanden war, im Hoden jedoch nicht nachgewiesen werden konnte (Abb B). Diese Ergebnisse deuten darauf hin, dass die Herabregulation von Tas1r1 im Hodengewebe in den Spoc1 -/- -Mäusen auf stammspezifische Unterschiede zurückzuführen ist und vermutlich eine erworbene Expression im C57BL/6-Stamm darstellt, welche nicht dem Expressionsmuster des Gens in anderen Nagetieren wiederspiegelt. Um dieses Ergebnis zu bestätigen, sollte untersucht werden, welche stammspezifischen Allele des 38 kb distal von Spoc1 gelegenen Tas1r1 -Gens sowie verschiedener Kontrollgene in den jeweiligen Mäusen vorliegen. Hierbei wurden stammspezifische SNPs ( Single Nucleotide Polymorphism ), welche in der Datenbank des Mouse Genome Informatics- Server ( hinterlegt sind, verwendet. Die Genotypisierung der SNPs erfolgte mittels PCR und anschließender Sequenzierung (vgl. Kap. 2.5). 103
114 3 Ergebnisse Tabelle 3.7 SNP-Analyse Gen Position C57Bl6 129/Sv C57BL/6 Spoc1 +/+ C57BL/6 Spoc1 -/- Kopplung Allel Allel B906 B935 B832 B907 B936 B937 Tas1r1 Chr4: A G A A A G G G Tas1r1 Chr4: T G T T T G G G Starke Tas1r1 Chr4: A G A A A G G G Kopplung Tas1r1 Chr4: A G A A A G G G mit Spoc1 Tas1r1 Chr4: G A G G G A A A Mxra8 Chr4: G A A A G A A G Mxra8 Chr4: A G G G A G G A Leichte Mxra8 Chr4: T C T/C T/C T C T/C T Kopplung Fam132a Chr4: C T T/C T/C C T T/C C mit Spoc1 Fam132a Chr4: G C G/C G/C G C C C Zbtb8a Chr4: G A G G G G G G Zbtb8a Chr4: A C A A A A A A Keine Klhl32 Chr4: A G A A A A A A Kopplung Klhl32 Chr4: A G A A A A A A mit Spoc1 Chgb Chr2: G A G G G G G G Rot = C57BL/6-Allel; Blau = 129/Sv-Allel; Lila = heterozygot für dieses Allel; C57BL/6 Spoc1 -/- bzw.spoc1 +/+ sind die congenen Tiere, die für Array 2 verendet wurden. Die Nummern identifizieren die einzelnen Tiere Neben mehreren SNPs in dem Gen Tas1r1 wurden auch SNPs in anderen Genen untersucht. Fam132a und Mrxa8 liegen ebenfalls in der Chromosomenregion 4E2, sind aber etwas weiter entfernt von Spoc1 als Tas1r1. Beide liegen distal, 3,84 Mb bzw 3,97 Mb von Spoc1. Dagegen sindzbtb8a und Klhl32 auf demselben Chromosom lokalisiert, nicht aber in der Region 4E2. Zbtb8A liegt 22,61 Mb, Klhl32 127,14 Mb proximal von Spoc1. Als Kontrolle wurde außerdem das Gen Chgb untersucht, welches auf Chromosom 2 liegt. Die Ergebnisse der SNP-Analyse sind in Tab. 3.7 zusammengefasst. Es zeigte sich, dass alle untersuchten Spoc1 -/- -Tiere das Tas1r1 -Allel trugen, das für die beiden 129-Stämme spezifisch ist. Die Wildtyp-Geschwistertiere dagegen wiesen die C57BL/6-spezifische Variante auf. Aufgrund der geringen Entfernung von Tas1r1 zu Spoc1 kam es daher zwischen diesen beiden Genen zu keinen Rekombinationsereignissen, wodurch das mutierte Spoc1 - Allel in seiner ursprünglichen 129-Umgebung bleibt. Die Gene Fam132a und Mrxa8 sind weiter von Spoc1 entfernt, wodurch es im Verlauf der Rückkreuzungen zu Crossing over - Ereignissen kam. Noch deutlicher wird dies bei den weiter entfernt liegenden Genen Zbtb8a und Klhl32. Für das Kontrollgen Chgb konnte, wie erwartet, nur das C57BL/6-Allel gefunden werden. Es kann also davon ausgegangen werden, dass die beobachteten Unterschiede in der Expression der Untereinheit des Tas1r1 -Gens auf stammspezifische Unterschiede zurückzuführen sind. Möglicherweise sind weitere Gene in der unmittelbaren Nähe des Spoc1 -Gens in ähnlicher Weise von diesen Unterschieden betroffen. Ein Blick auf die Verteilung der in der genomweiten Expressionsanalyse differentiell exprimierten Gene (vgl. Abb. A.7 Anhang) zeigt dementsprechend eine Häufung differentiell regulierter Gene im chromosomalen Bereich 4E2. 104
115 3.4 Vergleichende Genexpressionsanalysen Chromosomenweite Regulation durch SPOC1 Die Daten der beiden Microarrays wurden auf chromosomenweiter Ebene näher untersucht. Zunächst wurden die differentiell regulierten Gene, die einen Fold Change von 1,5 oder höher aufwiesen, den einzelnen Chromosomen zugeordnet (Abb A) Abbildung 3.30 Vergleich der Genexpression zwischen Spoc1 +/+ - und Spoc1 -/- - Tieren A) Anzahl der im Microarray ermittelten differentiell regulierten Gene (FC 1,5) pro Chromosom. Der blau markierte Anteil entspricht der Anzahl der hoch regulierten Gene, der rot markierte Bereich der Anzahl der Gene, die herab reguliert waren. B) Mittelwert der Expressionslevel (Spoc1 +/+ / Spoc1 -/- ) für jedes Chromosom. Hierbei zeigte sich bei der Analyse des ersten Arrays (vgl. Kap ), dass eine signifikant erhöhte Anzahl der Gene auf beiden Geschlechtschromosomen differentiell reguliert war. Dabei sind alle dieser Gene im Spoc1 -/- -Gewebe nach oben reguliert. Auf den Autosomen teilen sich die differentiell regulierten Gene in hoch- (ca. 67 %) und herab regulierte (ca. 33 %) Gene auf. Im zweiten Array (vgl. Kap ), der mit jüngeren Tieren durchgeführt wurde, konnte dieser Effekt nicht nur bestätigt werden, sondern er war bei diesen Mäusen noch ausgeprägter. Die Analyse der gesamten Array-Daten zeigte, dass diesem Effekt eine chromosomenweite Basis zu Grunde liegt. Während die mittleren Expressionslevel der Autosomen bei 0,99-1,05 liegt, betrug der Wert für die Gonosomen 1,23-1,27 (Abb B). Dies ist eine deutliche Erhöhung des Expressionsniveaus in den Spoc1 -/- -Hoden und sollte daher im weiteren Verlauf der Arbeit näher untersucht werden. Dazu wurden zunächst die gesamten Daten des zweiten Arrays der entsprechenden genomischen Position zugeordnet. Beispielhaft sind die Auswertungen für die Chromosomen 105
116 3 Ergebnisse Abbildung 3.31 Expressionslevel der Chromosomen 1, 2 und X Der Abstand auf der X-Achse entspricht der Position der Gene vom proximalen Ende der Chromosomen. Die durchschnittlichen Expressionslevel pro Chromosom sind angegeben (Pfeile). Abbildung 3.32 Vergleich der chromosomenweiten Genexpressionslevel Der Vergleich, der Genexpressionslevel zwischen Spoc1 +/+ - und Spoc1 -/- -Gewebe zeigt deutlich, dass auf den Autosomen kaum ein Unterschied besteht, während auf den Gonosomen die Expression im Spoc1 -/- -Gewebe deutlich erhöht ist. Der zentrale Punkt entspricht dem Median, die Balken enthalten 50 % und die Fehlerbalken 90 % der Datenpunkte. Die statistische Auswertung erfolgte mittels eines gepaarten t-tests (** p 0,001). 1, 2 und X dargestellt (siehe Abb. 3.31), die Auswertungen der restlichen Chromosomen finden sich im Anhang A.8. Diese Auswertung der Expressionsdaten in Bezug zur chromosomalen Lokalisation bestätigte die Vermutung einer chromosomenweiten Regulation zahlreicher Gene. Während auf den Autosomen kein Unterschied im Expressionsniveau zwischen Wildtyp- und Spoc1 -/- - Tieren besteht und die Gene gleichmäßig hoch- bzw. herab reguliert sind, ist das Expressionsniveau der Gene auf den Gonosomen im Spoc1 -/- -Gewebe deutlich erhöht und eine Herabregulation nicht detektierbar. Diese Daten wurden statistisch ausgewertet (Abb. 3.32). Der Boxplot zeigt deutlich die Unterschiede zwischen den Autosomen und den Geschlechtschromosomen. Die Unterschiede sind statistisch hoch signifikant (Abb. 3.32). 106
117 3.5 Untersuchungen zur MSCI Da die Gene auf den Gonosomen normalerweise inaktiviert sind (MSCI) liegt es nahe, dass das Fehlen von SPOC1 eine Auswirkung auf die meiotische Inaktivierung der Geschlechtschromosomen (MSCI vgl. auch Kap ) hat. 3.5 Untersuchungen zur MSCI Um einen direkten Hinweis dafür zu erlangen, dass SPOC1 unmittelbar an der korrekten Ausbildung der MSCI beteiligt ist, wurden mehrere Analysen durchgeführt. Zunächst sollte mittels RNA-FISH gezeigt werden, dass Gene auf den Gonosomen in der Tat der transkriptionellen Inaktivierung in den Spoc1 -/- -Meiozyten entgehen können. Eine immunchemische Untersuchung der aktiven Polymerase II sollte dann klären, ob die Transkription im XY-Body der Spoc1 -/- -Tiere gegenüber dem Wildtyp generell erhöht ist. Außerdem sollte untersucht werden, ob der XY-Body, der für MSCI essentiell ist, korrekt gebildet wird. Schließlich wurde untersucht, ob der Knockout von Spoc1 einen Effekt auf epigenetische Modifikationen der Histone in den meiotischen Zellen hat Bestätigung des MSCI-Defekts Expression gonosomaler Gene - qpcr Zunächst wurde die verstärkte Expression einiger auf den Gonosomen lokalisierten Gene mittels Real Time-PCR bestätigt. Dazu wurden Gene ausgewählt, deren Expression bei der genomweiten Expressionsanalyse in den Spoc1 -/- -Tieren deutlich erhöht war gegenüber den Wildtyp-Tieren. Für diese Real-Time PCR wurden neben den Tieren, die für den Microarray verwendet wurden zusätzlich je drei weitere Spoc1 +/+ - und Spoc1 -/- -Tiere im Alter von 5 Wochen verwendet. Nach Isolation der RNA aus frischen Hodengewebe wurde mit Hilfe einer reversen Transkriptase cdna hergestellt (vgl. Kap.2.5.3). Die Echtzeitmessung bei der Real Time-PCR erfolgte mittels des fluoreszierenden Farbstoffs SYBR-Green. Hierbei zeigte sich, dass die Expression der Gene Rbmy1a1, Ddx3y, Ube1y1, Hprt, Ddx3x, Pdha1 und Nrk in den Spoc1 -/- -Tieren signifikant erhöht war (siehe Abb A). Das Y-gekoppelte Gen Rbm31y zeigte als einziges untersuchtes, Gen keine differentielle Expression, ebenso wie die autosomale Kontrolle Pgk2. Diese Daten zeigen deutlich, dass diese gonosomalen Gene in den Testes der Spoc1 -/- - und Spoc1 +/+ -Tiere unterschiedlich exprimiert werden. Diese Analyse bestätigt somit die Ergebnisse des genomweiten Expressionsanalyse und bestätigt den Verdacht einer chromosomenweiten Fehlregulation der gonosomalen Gene in den Spoc1 -/- -Tieren während der Spermatogenese. Expression gonsosomaler Gene - RNA-FISH Für die RNA-FISH wurden Spreitungen der meiotischen Zellen hergestellt (vgl. Kap ). Dabei wurde mittels spezifischer DNA-Sonden naszente mrna nachgewiesen. Die Lokalisation der zugehörigen Gene wurde anschließend mittels DNA-FISH bestätigt. Mit dieser Methode konnte eine Expression der Gene Rbmy1a1 und Ddx3 (nicht gezeigt) in den Spoc1 -/- -Pachytänzellen gezeigt werden (Abb B). Die Expression der Gene 107
118 3 Ergebnisse Abbildung 3.33 Real Time-PCR und RNA-FISH A) Real Time-PCR einiger gonosomaler Gene, die im Microarray im Spoc1 -/- -Gewebe hoch reguliert waren. Die gestrichelte Linie entspricht dem Expressionsniveau der Wildtyp-Tiere. Die p-werte wurden mittels t-test errechnet (* p 0,05; ** p 0,01). B) RNA-FISH: Spreitungen von Meiozyten im Pachytänstadium von 10 Wochen alten Tieren wurden mit einem Antikörper gegen γh2ax (grün) und mit einer DNA-Sonde (rot) gegen naszente mrna des Y-gekoppelten Rbmy1a1 - (rechte Reihe) oder des autosomalen Pgk2 -Gens (linke Reihe) gefärbt. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 5 µm. erfolgte innerhalb des XY-Bodys, der mit dem Marker γh2ax angefärbt wurde, während in Wildtyp-Zellen keine Expression zu sehen war. Das autosomale Gen Pgk2 diente auch hier als Kontrolle. Die Expression dieses Gens konnte in den Wildtyp und in den Spoc1 -/- - Zellen außerhalb des XY-Bodys gezeigt werden (Abb B). Dieses Ergebnis ist von Bedeutung, da hier gezeigt werden konnte, dass innerhalb des XY- Bodys, der normalerweise eine transkriptionell inaktive subnukleäre Domäne darstellt die Expression von gonosomalen Genen in den Spoc1 -/- -Meiozyten erfolgt. 108
119 3.5 Untersuchungen zur MSCI Expressionslevel Um die Expression innerhalb des XY-Bodys genauer zu untersuchen, wurden in Meiozytenspreitungen Doppelfärbungen der aktiven Polymerase II (phopho-ser5) und γh2ax durchgeführt. Abbildung 3.34 Transkriptionsaktivität im XY-Body Meiozytenspreitungen von 10 Wochen alten Wildtyp- bzw. Spoc1 -/- -Gewebe wurden mit Antikörpern gegen γh2ax (grün) und aktiver RNA-Polymerase II (rot) gefärbt. Die DNA wurde mit DAPI gegengefärbt. Der XY-Body ist durch eine gestrichelte Linie gekennzeichnet. Maßstabsbalken = 5 µm. Dabei zeigte sich, dass die Stärke des Signals der aktiven RNA-Polymerase II in den Wildtyp-Zellen innerhalb des XY-Bodys weniger stark ist als im restlichen Zellkern. Dieser Effekt geht einher mit der MSCI und ist schon mehrfach beschrieben worden [225] [158]. Obwohl der RNA-Polymerase-Komplex auch an diesen Chromosomen während des Pachytäns vorhanden ist, weisen diese keine transkriprionelle Aktivität auf. Der Komplex ist zwar initiiert, die Elongation erfolgt allerdings erst durch die Phosphorylierung an Serin 5 der RNA-Pol II, welcher hier nachgewiesen wurde. Bei den Spoc1 -/- -Zellen konnte dagegen kein Unterschied in der Signalstärke zwischen XY-Body und dem restlichen Zellkern festgestellt werden (Abb. 3.34). An den Gonosomen der Spoc1 -/- -Meiozyten ist also nicht nur inaktive RNA-Polymerase zu finden sondern auch die aktive, elongierende Form. Dies deutet auf Transkription innerhalb des XY-Bodys hin. Das Ergebnis dieser Analyse bestätigt die Ergebnisse des Microarrays und der RNA-FISH. 109
120 3 Ergebnisse Bildung des XY-Bodys und Induktion der Doppelstrangbrüche Eine erhöhte Apoptose, wie sie bei den Spoc1 -/- -Tieren festgestellt wurde, hat häufig eine fehlerhafte Rekombination, eine gestörte DNA-Reparatur oder defekte Kondensation der Chromosomen als Ursache [23] [145]. Um zu untersuchen, ob in den Meiozyten des Spoc1 -/- -Gewebes die Induktion des XY-Bodys gestört ist, wurden Immunfluoreszenzfärbungen an Gewebeschnitten und Meiozytenspreitungen durchgeführt. Insbesondere wurden Untersuchungen mit dem Markern γh2ax und SYCP3 durchgeführt. Bei γh2ax handelt es sich um eine Histonmodifikation der Histonvariante H2AX. Dieses Histon wird nach dem Auftreten von DNA-Doppelstrangbrüchen am Serin 139 phosphoryliert. Während der Meiose tritt diese Histonmodifikation bei der Rekombination und bei der Bildung des XY-Bodys auf (vgl. Kap ). Das Protein SYCP3 (synaptonemal complex protein 3) ist ein Bestandteil des synaptonemalen Komplexes und während der Prophase 1 der Meiose exprimiert. Mit diesen zwei Markern wurden ausführliche Untersuchungen an Meiozytenspreitungen durchgeführt (Abb. 3.35). Abbildung 3.35 Bildung des XY-Bodys Die Meiozyten von 10 Wochen alten Knockout/Wildtyp-Tieren wurden gespreitet und mit Antikörper gegen γh2ax (grün) und gegen SYCP3 (rot) gefärbt. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 10 µm. Wie bereits beschrieben [287], taucht das γh2ax-signal im Präleptotänstadium auf, da dort die ersten Doppelstrangbrüche eingeführt werden. Das Signal verstärkt sich im Leptotän und Zygotän und verschwindet dann beim Übergang ins Pachytän von den Autosomen. Hierbei konnten keine offensichtlichen Unterschiede zwischen den Spoc1 -/- -Meiozyten und den Wildtyp-Vergleichszellen gefunden werden. Im Pachytän ist das Signal nur noch im XY-Body zu finden. Zusätzlich auftretende Foci, außerhalb der XY-Bodys, traten bei Wildtyp- und Spoc1 -/- -Meiozyten gleich häufig auf [83]. Das Signal für SYCP3 zeigt die Bildung des synaptonemalen Komplexes zwischen den gepaarten homologen Chromosomen. Das Signal taucht zu Beginn der Prophase 1 auf und markiert im Zygotän die gesamte Achse, an der die homologen Chromosomen gepaart sind. Diese Achsen erreichen im Pachytän ihre maximale Kondensation. Im Diplotän verstärkt 110
121 3.5 Untersuchungen zur MSCI sich das Signal an den distalen Enden, während die Chromosomen im Tetradenstadium vorliegen. Nach Beendigung der Prophase 1 löst sich der synaptonemale Komplex wieder auf. Auch für diesen Marker konnten keine Unterschiede zwischen Wildtyp- und Spoc1 -/- - Zellen gefunden werden. Im Rahmen der Dissertation von Dr. A. Bördlein wurden zusätzlich die Marker MRE11 (Meiotic recombination 11 homolog A) für Doppelstrangbrüche und die Histonmodifikation phospho-h3 für Chromosomenkondensation untersucht [39]. Auch für diese Marker konnten keine Unterschiede gefunden werden. Um den Defekt in der Meiose näher zu charakterisieren wurden die gespreiteten Zellen den Substadien zugeordnet und ausgezählt (Abb. 3.36). Für diese statistische Analyse wurden je drei Wildtyp-Tiere des congenen Hintegrunds und drei Spoc1 -/- -Tiere des gemischtgenetischen und des congenen Hintergrunds ausgewertet. Alle untersuchten Tiere waren 10 Wochen alt. Abbildung 3.36 Auszählung der Stadien der Prophase I A) Anzahl der Meiozyten im Verhältnis zu allen gespreiteten Zellen. B) Relativer Anteil an Substadien der Prophase I. Der p-wert wurde mit Hilfe des χ-quadrat-tests ermittelt (*p 0,05; **p 0,01). Es war deutlich zu erkennen, dass die relative Anzahl an meiotischen Zellen bei der Spreitung in den Spoc1 -/- -Tieren deutlich geringer ausfiel (Abb A). Bei den Spoc1 +/+ - Tieren waren etwa 25,2 % SCP3-positive Meiozyten. Bei den Spoc1 -/- -Tieren des gemischtgenetischen Hindergrundes konnten nur noch 10,5 % SCP3-positive Meiozyten gefunden werden un bei den Spoc1 -/- -Tieren des congenen Hintergrunds waren es lediglich 1,9 % SCP3-positive Meiozyten. Aber nicht nur in der Anzahl, der sich in der Prophase I befindlichen Zellen war verändert, sondern auch deren Verteilung auf die Substadien (Abb B). Bei den Spoc1 +/+ -Tieren zeigte sich, dass etwa 4,0 % der SCP3-positven Meiozyten dem Leptotän zugeordnet werden konnten. Weitere 19,3 % gehörten dem Zygotän an. Der Großteil dieser Zellen (62,3 %) waren im Pachtänstadium und etwa 14,4 % im Diplotän. Diese Werte entsprechen den Literaturwerten [72]. In den Spoc1 -/- -Tieren zeig- 111
122 3 Ergebnisse te sich degegen eine andere Verteilung der Substadien. Es konnten deutlich mehr frühe Stadien gefunden werden. Bei den Tieren der gemischt-genetischen Mauslinie ließen sich 11,3 % dem Leptotän und 39,2 % dem Zygotän zuordnen. Bei den Spoc1 -/- -Tieren der congenen Linie waren es sogar 15,4 % Leptotän- und 52,4 % Zygotänstadien. Die späteren Stadien konnten dagegen eher selten gefunden werden. Bei den gemischt-genetische Tieren fanden sich 29,8 % Pachytän- und 6,9 % Diplotänstadien. in der congenen Mauslinie waren es lediglich 29,8 % Pachytän- und 2,4 % Diplotänzellen. Diese Ergebnisse stimmen mit den Analysen zur Apoptose überein, die zeigten, dass es im Pachytänstadium der Spoc1 -/- -Zellen zu vermehrter Apoptose kommt (vgl. Kap.3.2.3). Die wenigene meiotischen Zellen, die in den Spoc1 -/- -Tieren zu finden waren befanden sich mehrheitlich in den frühen Stadien der Prophase I. Die Spoc1 -/- -Maus zeigt also keine offensichtlichen Defekte bei der Chromosomenkondensation, der Induktion von DNA-Doppelstrangbrüchen für die Rekombination und bei der Bildung des XY-Bodys. Die Einteilung der meiotischen Zellen in die Substadien der Prophase I zeigt allerdings deutlich, dass es zu einer Anreicherung früher Stadien kommt, was auf einen Defekt in der Meiose hinweist Histonmodifikationen während der MSCI Da kein offensichtlicher Defekt in der Formation des XY-Bodys in den Spoc1 -/- -Tieren gefunden werden konnte und da die Expression von Spoc1 auf undifferenzierte Spermatogonien beschränkt ist wurde vermutet, dass durch das Protein epigenetische Modifikationen in den Spermatogonien eingeführt werden, die später für die MSCI essentiell sind. Immunhistochemische Untersuchungen der Histon H3-Methylierungen zeigten jedoch keine deutlichen Unterschiede zwischen Spoc1 -/- - und Spoc1 +/+ -Gewebe gefunden werden. Zusätzlich wurden daher epigenetische Histonmodifikation während der Prophase 1 untersucht. Für viele epigenetische Histonmodifikationen wurde postuliert, dass sie an der Aufrechterhaltung der meiotischen Inaktivierung der Gonosomen beteiligt sind [292] [159] [289]. Neben dem Methylierungsmuster von H3K27, der Acetylierung von K3K9 ist insbesondere die Histonvariante macroh2a und die Ubiquitinylierung von H2A an Lysin 119 von Bedeutung [187] [225] [138] [145]. Für die Untersuchung der Histonmodifikationen wurden Spreitungen aus Spoc1 +/+ - und Spoc1 -/- -Gewebe hergestellt und mit Antikörpern gegen die entsprechenden Modifikationen und gegen SYCP3 gefärbt. Es wurden insbesondere die Zellen ausgewertet, die sich im Pachytänstadium befanden, da dort die MSCI stattfindet [287] (Abb. 3.37). Für die Histonmodifikation H3K4me2 konnte eine diffuse Färbung über den gesamten Zellkern gefunden werden. Außerdem zeigte sich eine deutlich stärkere, homogene Färbung des XY-Bodys im frühen bis mittleren Pachytän, im späten Pachytän ist diese Lokalisation nicht mehr zu finden. Für die Trimethylierung an dieser Position konnte kein Signal gefunden werden. 112
123 3.5 Untersuchungen zur MSCI Abbildung 3.37 Histon H3-Methylierung im Pachytänstadium Die Meiozyten von 10 Wochen alten Spoc1 -/- /Spoc1 +/+ -Tieren wurden gespreitet und mit Antikörper gegen die jeweilige Histonmodifikation (grün) und gegen SYCP3 (rot) gefärbt. Der XY-Body ist durch eine gestrichelte Linie gekennzeichnet. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 5 µm. 113
124 3 Ergebnisse Die Histonmodifikation H3K9me2 zeigte ein schwaches in frühen Pachytänzellen bis deutliches Signal in den späten Pachytän-Zellen des Wildtyps. Bei den Spoc1 -/- -Zellen konnte eine ähnliche Verteilung gefunden werden, wobei deutlich mehr Zellen mit schwachen Signal zu finden waren, da im Spoc1 -/- -Gewebe deutlich weniger späte Pachytänzellen vorhanden sind. Das Signal war weitgehend homogen verteilt. Demgegenüber zeigte H3K9me3 ein interessantes Muster, da dort einzelne Chromatin-Domänen angefärbt wurden. Diese beinhalten die Telomerbereiche der Chromosomen, die konstitutiv heterochromatisch sind. Das Signal für H3K9me3 schien in den Spoc1 -/- -Meiozyten etwas schwächer zu sein, zeigte aber das gleiche Verteilungsmuster. Das Signal für H3K27me2 zeigte in den Wildtyp-Zellen eine homogene Verteilung über der Zellkern mit Ausnahme des XY-Bodys, der ausgespart ist. Dieses Verteilungsmuster zeigen die Wildtypzellen auch für H3K37me3, jedoch ist das Signal deutlich schwächer. Für H3K27me3 wurde die Aussparung des XY-Bodys schon beschrieben [145], für die Dimethylierung konnten keine entsprechenden Quellen gefunden werden. Obwohl die Methylierung an Lysin 27 des Histons H3 eine reprimierende Modifikation ist, scheint sie bei der MSCI diese Funktion nicht zu übernehmen. Interessanterweise ist das Signal für H3K27me2 in den Spoc1 -/- -Zellen gleichmäßig über den gesamten Zellkern verteilt. Bei dieser Modifikation geht also die spezifische Diskriminierung zwischen Autosomen und den Gonosomen verloren. Für die Trimethylierung konnten keine signifikanten Unterschiede gefunden werden. Für die Histonmodifikationen H3K36me2 und H3K36me3 zeigte sich ein homogenes, deutliches Signal im Zellkern. Dabei war der XY-Body oft ausgespart. Auch hier konnte ein deutlicher Unterschied zwischen Spoc1 +/+ - und Spoc1 -/- -Gewebe festgestellt werden. Bei deutlich mehr Spoc1 -/- -Zellen ist die Aussparung des XY-Bodys nicht zu finden. Die Di- und Trimethylierung des Histons 3 an Lysin 79 ist in den Meiozyten, unabhängig des Genotyps, nur sehr schwach vorhanden. Unterschied konnten nicht detektiert werden. Neben den Methylierungsmuster des Histons H3 wurden auch das Acetylierungsmuster an den Lysinen 9, 15, 18, 27 und 56 untersucht. Hierbei wurde deutlich, das H3K9ac, welches in den Spoc1 +/+ -Meiozyten aus dem XY- Body ausgeschlossen in den meisten Spoc1 -/- -Pachytänzellen homogen über den gesamten Zellkern verteilt ist. Die Acetylierung an K14 war extrem schwach sowohl in den Spoc1 +/+ - als auch in den Spoc1 -/- -Meiozyten vorhanden. Hier konnten keine Unterschiede zwischen den Genotypen detektiert werden. Das Signal für die Acetylierung an K18 war in beiden Genotypen stark vorhanden. Diese Signal ist stärker im aufgelockerten Chromatin und deutlich abgeschwächt in Heterochromatin vorhanden. Dieses Verteilungsmuster zeigte sich sowohl in den Wiltyp- als auch in den Spoc1 -/- -Meiozyten. In den Spoc1 +/+ -Pachytänzellen zeigte sich eine Akkumulation des H3K27ac-Signals im XY-Body. Diese Akkumulation konnte in den Spoc1 -/- -Meiozyten jedoch nicht gefunden werden und stellt somit einen deutlichen Unterschied zwischen Spoc1 +/+ - und Spoc1 -/- - Pachytänzellen dar. Die Acetylierung an K56 war, wie die an K14, nur sehr schwach detektierbar. Ein Unterschied konnte nicht gefunden werden. 114
125 3.5 Untersuchungen zur MSCI Abbildung 3.38 Histonmodifikationen im Pachytänstadium Die Meiozyten von 10 Wochen alten Spoc1 -/- /Spoc1 +/+ -Tieren wurden gespreitet und mit Antikörper gegen die jeweilige Histonmodifikation (grün) und gegen SYCP3 (rot) bzw. γh2ax (bei H2AK119ub) gefärbt. Der XY-Body ist durch eine gestrichelte Linie gekennzeichnet. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 5 µm. Als weitere Histonmodifikation wurde die Ubiquitinylierung an H2A an Lysin 119 untersucht. Diese Histonmodifikation war in den Pachytänzellen der Wildtyp-Tiere deutlich am XY-Body zu finden. In den Meiozyten der Spoc1 -/- -Tiere war diese Lokalisation nur selten zu beobachten. Mehrheitlich konnte kein Signal für diese Histonmodifikation beobachtet werden. Mit Hilfe dieser Experimente konnte ein Hinweis dazu geliefert werden, dass bei den Spoc1 -/- -Tieren die epigenetische Regulation, die für die MSCI essentiell ist, nicht ordnungsgemäß abläuft. Die Ergebnisse dieser Analyse sind in Tabelle 3.8 zusammengefasst. 115
126 3 Ergebnisse Tabelle 3.8 Histonmodifikationen und Histonvarianten im Pachytänstadium Histon Spoc1 +/+ Spoc1 -/- Unterschied H3K4me2 mittleres Signal, Akkumulation im XY-Body mittleres Signal, Akkumulation im XY-Body H3K4me3 kein Signal kein Signal nein H3K9me2 H3K9me3 H3K27me2 mittleres-starkes Signal, homogen verteilt Anreicherung an den Telomerbereichen starkes Signal, Ausschluss aus XY- Body schwaches-mittleress Signal, homogen verteilt Anreicherung an den Telomerbereichen starkes Signal, homogen verteilt H3K27me3 kaum Signal kaum Signal nein H3K36me2 H3K36me3 starkes Signal, Ausschluss aus XY- Body starkes Signal, Ausschluss aus XY- Body starkes Signal, Ausschluss aus XY- Body fehlt bei etwa 50% der Zellen starkes Signal, Ausschluss aus XY- Body fehlt bei etwa 50% der Zellen H3K79me2 kein Signal kein Signal nein H3K79me3 kein Signal kein Signal nein H3K9ac starkes Signal, Ausschluss aus XY- Body in einigen Zellen nein nicht signifikant, betrifft nicht den XY-Body nein ja, XY-Body ja, XY-Body ja, XY-Body starkes Signal, homogen verteilt nicht signifikant, betrifft den XY- Body H3K14ac kein Signal kein Signal nein H3K18ac H3K27ac Starkes Signal, schwächer in heterochromatischen Bereichen schwaches-mittleres Signal, Anreicherung im XY-Body in einigen Zellen Starkes Signal, schwächer in heterochromatischen Bereichen schwaches-mittleres Signal, homogen verteilt H3K56ac kein Signal kein Signal nein nein ja, XY-Body H2AK119ub Lokalisation im XY-Body Lokalisation im XY-Body ja, XY-Body γh2ax Lokalisation im XY-Body Lokalisation im XY-Body nein Epigenetische Unterschiede während der MSCI Für einige der untersuchten epigenetischen Histonmodifikationen konnten deutliche Unterschiede zwischen den Wildtyp- und den Spoc1 -/- -Meiozyten festgestellt werden. Diese wurden näher untersucht um die gefundenen Veränderungen näher zu charakterisieren. Dazu wurden erneut Spreitungen an je drei Wildtyp- und Spoc1 -/- -Tieren durchgeführt und anschließend die Färbungen mit den entsprechenden Markern ausgewertet. Dabei wurde entweder die Dynamik der Marker genauer untersucht oder die angefärbten Zellen quantitativ ausgewertet. H3K9me2 und H3K9ac Für H3K9me2 zeigte sich, dass bei 46,7 % der Wildtyp-Pachytänzellen ein deutliches Signal dieser Histonmodifkation vorhanden war. Bei den restlichen Pachytänzellen konnte kein Signal nachgewiesen werden. Bei den Zellen des Spoc1 -/- -Gewebes zeigte sich ein anderes Muster. Hier waren lediglich 13,7 % der Pachytän-Zellen positiv für H3K9me2. Der Großteil der Zellen (86,3 %) zeigte kein Signal für diese Histonmodifikation. Eine Un- 116
127 3.5 Untersuchungen zur MSCI terteilung des Pachytänstadium in frühes - mittleres Pachtän und spätes Pachytän zeigt deutlich, dass diese Modifikation während diesen Stadium dynamisch reguliert ist (Abb. 3.39). Im frühen bis mittleren Pachytän konnte H3K9me2 sowohl in den Wildtyp- als auch in den Spoc1 -/- -Zellen kaum nachgewiesen werden. Im späten Pachytän konnte dagegen das H3K9me2-Signal über den gesamten Zellkern nachgewiesen werden. Mit dem Übergang in das Diplotän akkumuliert das Signal am XY-Body und verschwindet von den Autosomen. Für die Histonmodifikation H3K9ac zeigte sich ein inverses Muster zu den Methylierungen an dieser Position. Sowohl die stark heterochromatischen Bereiche, die positiv für H3K9me3 sind, als auch der XY-Body in späten Pachytänzellen zeigten ein deutlich reduziertes Signal für die Acetylierung an dieser Position. Die gefundenen Unterschiede, die den XY-Body betreffen sind wiederum der Tatsache geschuldet, dass nur wenige Zellen vorhanden sind, die über das Pachytänstadium hinausgehen. Abbildung 3.39 H3K9me2 ist während der Prophase I dynamisch reguliert Die Auswertung der Fluoreszenzbilder zeigt deutlich, dass in den Spoc1 -/- -Meiozyten das Signal für H3K9me2 in den Meiozyten stark von dem Substadium abhängig ist. Bis zum mittleren Pachytän ist kaum Signal vorhanden. Im mittleren Pachytän kann man dagegen ein homogen verteiltes Signal finden, das sich gegen Ende des Pachytäns und im Diplotän am XY-Body akkumuliert. Maßstabsbalken = 5 µm. Nach der Einteilung in die Substadien des Pachytäns konnten keine deutlichen Unterschiede zwischen den Wildtyp- und den Spoc1 -/- -Zellen gefunden werden. Da aber aufgrund der erhöhten Apoptoserate (vgl. Abb. 3.16) deutlich weniger späte Pachytänstadien in den 117
128 3 Ergebnisse Spoc1 -/- -Meiozyten vorhanden sind zeigte sich bei der Auszählung aller Pachytänstadien der Unterschied zu den Wildtyp-Zellen. H3K27me2 und H3K27ac Die Methylierung des Histon H3 am Lysin 27 stellt normalerweise eine repressive Histonmodifikation dar [190], zeigt aber einen Ausschluss aus dem XY-Body in den Pachytänzellen bei der murinen Spermatogenese [145]. Diesen Ausschluss des Signal von H3K27me2 zeigte deutliche Unterschiede zwischen den Spoc1 +/+ - und den Spoc1 -/- -Zellen (Abb Es zeigte sich, dass der erwartete Ausschluss des Signals in den Spoc1 -/- -Zellen kaum zu finden war. Abbildung 3.40 Veränderung von H3K27me2 im XY-Body A) Die Meiozyten von 10 Wochen alten Knockout/Wildtyp-Tieren wurden gespreitet und mit Antikörper gegen H3K27me2 (grün) und gegen SYCP3 (rot) gefärbt. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 5 µm. B) Die Auswertung der Fluoreszenzbilder zeigt deutlich, dass in den Spoc1 -/- -Meiozyten das Signal für H3K27me2 auch im XY-Body vorkommt. Die Fluoreszenzbilder wurden ausgezählt und ausgewertet. Dabei stellte sich heraus, dass auch in den Wildtyp-Zellen Pachytänstadien vorhanden sind, die keinen Ausschluss des Signals im XY-Body zeigen (12,9 %). In den Spoc1 -/- -Zellen zeigte sich dieses Verteilungsmuster allerdings bei fast allen Zellen (95,8 %). Für die Histonmodifikation H3K27me3 konnte dagegen kein signifikanter Unterschied gefunden werden. Ein weitere mögliche Modifikation an Lysin 27 stellt die Acetylierung dar. Für diese Histonmodifkation konnte wiederum eine Unterschied festgestellt werden. Diese Histonacetylierung akkumuliert in den Spoc1 +/+ -Zellen im XY-Body während des Pachytänstadium, während in den Spoc1 -/- -Zellen dort kein verstärktes Signal gefunden werden kann (vgl. Abb. 3.38). Dieses Ergebnis ist nicht verwunderlich, da jeweils nur eine Modifikation an dem selben Aminosäurerest vorliegen kann und die Acetylierung an Lysin 27 somit komplementär zu der Methylierung an dieser Position ist. 118
129 3.5 Untersuchungen zur MSCI Die Tatsache, dass dieser Unterschied von H3K27me2 so deutlich ist und dass sich der Unterschied auf den XY-Body beschränkt deutet darauf hin, dass für diese Veränderung möglicherweise ein kausaler Zusammenhang zwischen dem Knockout von Spoc1 und der defekten MSCI besteht. H3K36me2/3 Bei den Signalen für die Di- und Trimethylierungen des Histons H3 an Lysin 36 zeigte sich sowohl in den Wildtyp- als auch in den Spoc1 -/- -Zellen eine hohe Variabilität in Bezug auf den XY-Body. Bei den Spoc1 +/+ -Zellen des Pachytänstadium zeigten 70,6 % einen Ausschluss des Signal für die Dimethylierung und 67,9 % für die Trimethylierung (Abb. 3.41). Die restlichen Zellen zeigten eine homogene Verteilung des jeweiligen Signals. Bei den Spoc1 -/- -Meiozyten zeigte sich der Ausschluss dieser Histonmodifikationen aus dem XY-Body deutlich seltener. Für H3K36me2 konnte er in 29,4 % und für H3K36me3 in 32,1 % der Pachytänzellen gefunden werden. Dementsprechend ist der Ausschluss dieser Histonmethylierungen in den Spoc1 -/- -Meiozyten deutlich verändert. Abbildung 3.41 Veränderung von H3K36me2/3 im XY-Body Die Auswertungen der Spreitungen für H3K36me2 (A) und H3K36me3 (B) zeigen deutlich, dass in den Spoc1 -/- -Meiozyten das Signal für diese beiden Modifikationen deutlich häufiger im XY-Body vorkommen. Dieses Ergebnis ist von besonderen Interesse, da ein Zusammenhang zwischen der Methylierung von H3K36 und H3K27 vermutet wird [48] (vgl. auch Kap ). 119
130 3 Ergebnisse H2AK119ub Die Ubiquitinylierung von H2A am Lysin 119 gehört zu den Histonmodifikationen, von denen vermutet wird, dass sie wesentlich an der Aufrechterhaltung der MSCI beteiligt sind [5]. Die Spreitungen der Spoc1 -/- -Meiozyten zeigten, dass diese Modifikation nicht wie im Wildtyp während des Pachytäns am XY-Body lokalisiert war (Abb A). In den Meiozyten der Spoc1 +/+ -Tiere konnte ein Kolokalisation von γh2ax und H2AK119ub am XY-Body in nahezu allen Pachytänzellen (96,3 %) gefunden werden (Abb B). In den Spoc1 -/- -Zellen konnte das Signal für H2AK119ub dagegen nur in 20,4 % der Pachytänzellen detektiert werden. Der Großteil der Zellen zeigte kein oder nur sehr geringes Signal im XY-Body (Abb A unterste Reihe). Abbildung 3.42 Veränderung von H2AK119ub im XY-Body A) Die Meiozyten von 10 Wochen alten Knockout/Wildtyp-Tieren wurden gespreitet und mit Antikörper gegen H2AK119ub (rot) und gegen γh2a (grün) gefärbt. Die DNA wurde mit DAPI gegengefärbt. Maßstabsbalken = 5 µm. B) Die Auswertung der Fluoreszenzbilder zeigt deutlich, dass in den Spoc1 -/- -Meiozyten das Signal für H2AK119ub im XY-Body verändert ist. Eine Beteiligung der veränderten Verteilung dieser Modifikation an der Ausprägung des Infertilitätsphänotyp durch einen Defekt in der MSCI ist denkbar. Da H2AK119ub ein Bestandteil des bivalenten Chromatinstatus ist (vgl. Kap ) ist eine Verbindung der Methylierungen von Histon H3 an Lysin 4 und Lysin 27 und dem PRC2 gegeben [28]. 120
131 4 Diskussion Inhaltsangabe 4.1 Einfluss des genetischen Hintergrunds auf den Spoc1 -/- -Phänotyp Exon-Skipping des gene trap -Konstrukts Funktionsübernahme durch PHF Genetische Modifier Zusätzliche Faktoren Charakterisierung des Spoc1 -/- -Phänotyps Spoc1 ist wichtig für eine normale Embryonal- und Fetalentwicklung Die Funktion von Spoc1 bei der Skelettentwicklung Der Verlust von Spoc1 führt zu Infertilität bei männlichen Tieren Die mögliche Rolle von SPOC1 beim humanen 1p36-Deletionssyndrom Genomweite Expressionsanalyse Die Auswirkungen des genetischen Hintergrunds Die repressiven Eigenschaften von SPOC Die Rolle von SPOC1 bei der Aufrechterhaltung der BTB Die Rolle von SPOC1 während der Meiose Der Knockdown von Spoc1 führt zu einer defekten MSCI Hinweise für eine fehlerhafte MSCI Bildung des XY-Bodys und Induktion von Doppelstrangbrüchen Epigenetische Veränderungen während der MSCI Mögliche Modelle zu Wirkungsweise von SPOC Ausblick Die vorliegende Arbeit befasst sich mit der funktionellen Analyse des Proteins SPOC1 anhand eines für dieses Protein defizientem Mausmodells. Dabei wurde zum einen der Phänotyp in verschiedenen genetischen Hintergründen vergleichend charakterisiert, zum anderen wurden die Ursachen der bereits beschriebenen Infertilität untersucht. Ein besonderes Augenmerk wurde hierbei auf eine mögliche epigenetische Funktion des Proteins während der Spermatogenese und insbesondere der dabei stattfindenden meiotischen Inaktivierung der Geschlechtschromosomen (MSCI) gelegt. 4.1 Einfluss des genetischen Hintergrunds auf den Spoc1 -/- -Phänotyp Bei der vergleichenden Phänotypisierung der gemischt-genetischen (129P2 x C57BL/6) und der congenen (C57BL/6) Spoc1 -/- -Mauslinie konnten eindeutige Unterschiede festgestellt werden. Im Allgemeinen konnte gezeigt werden, dass der Knockdown von Spoc1 121
132 4 Diskussion einen schwereren Phänotyp bei der congenen Mauslinie hervorruft. Die Defekte, welche in der gemischt-genetischen Mauslinie gefunden wurden, wie die Fehlverteilung der Genotypen bei heterozygoter Verpaarung und der progressive Keimzellverlust bei den männlichen Tieren, waren in der congenen Mauslinie erheblich verstärkt. Zusätzlich konnten weitere Auffälligkeiten gefunden werden. Insbesondere zeigte sich bei einem Teil der Spoc1 -/- -Mäuse eine deutliche Verkürzung der Skelettknochen, die zu einem Kleinwuchs der betroffenen Tiere führte. Bei allen Spoc1 -/- -Tieren konnte außerdem eine Fehlbildung des Schädels gefunden werden. Die Schädel der gemischt-genetischen Mauslinie zeigten dagegen keinen Unterschied zwischen Spoc1 +/+ - und Spoc1 -/- -Tieren. Somit zeigen die beiden Mauslinien unterschiede in der Expressivität von Merkmalen als auch in deren Penetranz. Für diesen stammspezifisch unterschiedlich stark ausgeprägten Phänotyp der Spoc1 -/- - Mäuse kann es mehrere Ursachen geben, die nachfolgend diskutiert werden Exon-Skipping des gene trap -Konstrukts Die Untersuchungen zu der residualen Expression des endogenen Spoc1 -Transkripts zeigten, dass in den Tieren mit gemischt-genetischen Hintergrund noch 4-15 % der nativen mrna vorhanden war. In den congenen Spoc1 -/- -Mäusen konnte dagegen kein residuales Spoc1 -Transkript nachgewiesen werden (vgl. Abb. 3.1). Dieser Unterschied ließe sich auf Exon-Skipping zurückführen. Es wäre denkbar, dass die gene trap -Kassette, die in Intron 1 liegt nicht als Exon erkannt und somit nicht mit gespleißt wird (vgl. Abb. 4.1) [39]. Abbildung 4.1 Exon-Skipping der gene trap Kassette Beim Exon-Skipping entsteht ein vollständiges, natives Spoc1 -Transkript (mrna 2), das zu einem funktionsfähigen Protein translatiert werden kann. Es konnte schon mehrfach gezeigt werden, dass sich die Spleißmechanismen in dem Laborstamm C57BL/6 von denen anderer Mauslinien unterscheiden [44] [274]. Wenn man davon ausgeht, dass die residuale Expression des Spoc1 -Transkripts in den Mäusen mit gemischt-genetischen Hintergrund ausreichend ist, um insbesondere die Entwicklungsdefekte während der Embryogenese zu verhindern, könnte das Exon-Skipping ein Grund für die unterschiedlich starke Ausprägung des Phänotyps sein. Demgegenüber steht die Tatsache, dass SPOC1 zumindest auf Proteinebene in den homozygoten Spoc1 -/- -Mäusen, 122
133 4.1 Einfluss des genetischen Hintergrunds auf den Spoc1 -/- -Phänotyp unabhängig vom genetischen Hintergrund, nicht nachgewiesen werden konnte (vgl. Kap ). Eine geringe, unter der Nachweisgrenze liegende Menge an residualem Protein kann hiermit allerdings nicht ausgeschlossen werden. Ob eine solche Menge allerdings ausreichend für die phänotypischen Unterschiede in den unterschiedlichen Stämmen sein könnte, erscheint zweifelhaft Funktionsübernahme durch PHF23 Eine weitere mögliche Ursache für die unterschiedliche Ausprägung des Phänotyps in Abhängigkeit des genetischen Hintergrunds, könnte in einer Funktionsübernahme durch das Protein PHF23 (Plant Homeodomain Finger Protein 23) liegen. PHF23 gehört zu der gleichen PHD-Protein Familie wie SPOC1. Beide Proteine zeigen eine hohe Sequenzidentität, wobei sowohl die N-terminale Domäne, als auch der PHD-Finger extreme Ähnlichkeit aufweisen (vgl. Abb. 4.2). Es konnte gezeigt werden, dass sowohl SPOC1, als auch PHF23 an die Histonmodifikation H3K4me3 binden können [300] [39]. Beide Proteine stellen also Reader dieser epigenetischen Information dar. Abbildung 4.2 Sequenzvergleich von SPOC1 und PHF23 Rechts: Vergleichende Gegenüberstellung der humanen Proteine PHF23 und SPOC1. Links: Alignment der murinen Proteine. Der Vergleich wurde mittels des Online-Tools PRALINE des IBIVU- Servers ( erstellt. NTD = N-terminale Domäne; PHD = Plant Homeo Domain. Aufgrund der Ähnlichkeit in der Proteinsequenz kann man davon ausgehen, dass beide Gene von demselben Vorläufergen abstammen, welches bei einer der Genomduplikationen, 123
134 4 Diskussion die auf der evolutionären Stufe früher Vertebraten stattfand, oder bei einer Genduplikation verdoppelt wurde [80] [47]. Beide Gene behielten im Laufe der Evolution ihren offenen Leserahmen und akkumulierten keine wesentlichen Mutationen in den funktionellen Domänen. Es ist daher davon auszugehen, dass beide Gene zwar ähnlich wirken, aber auch unabhängig voneinander separate Funktionen übernommen haben, da man bei einer vollständigen Redundanz eine höhere Anzahl an Mutationen und den Verlust des offenen Leserahmens in einem der beiden Gene erwarten würde [47]. Die Expressionsmuster beider Gene ähneln einander stark, mit der Ausnahme des Hodengewebes, bei dem SPOC1 eine starke, PHF23 aber nur eine mittlere Expression zeigt (vgl. Abb. 4.3). Abbildung 4.3 Humane Expressionsmuster von SPOC1 und PHF23. Gezeigt sind Daten aus der Datenbank BioGPS ( bei der 76 verschiedene menschliche Gewebe auf den Array HG-U133A (Affymetrix) analysiert wurden. Bei der Auswertung wurde der Affymetrix MAS5 Algorithmus verwendet. Dargestellt sind die graphisch aufbereiteten Daten der Gendatenbank GeneCards (http: // Es ist durchaus möglich, dass PHF23 einen Teil des Spoc1 -/- -Phänotyps kompensieren kann. Eine solche kompensatorische Funktion ähnlicher Proteine konnte schon mehrfach gezeigt werden [31] [211]. Allerdings konnte eine erhöhte Expression von Phf23 in den durchgeführten Arrays weder für die gemischt-genetische (FC = -1,059) noch für die congene (FC = 1,018) Mauslinie gefunden werden. Da hierbei jedoch nur die Expression im Hodengewebe untersucht wurde, kann keine Aussage über einen möglichen kompensatorischen Expressionsunterschied in anderen Geweben und während der Embryonalentwicklung getroffen werden. Außerdem ist es auch möglich, dass die kompensatorische Regulation auf posttranslationaler Ebene, durch eine geringere Abbaurate des Proteins durch das Proteasom, gewährleistet wird [204]. Falls eine kompensatorische Wirkung von PHF23 vorliegt, ist es denkbar, dass diese in der gemischt-genetischen Mauslinie stärker vorhanden ist und somit zu den starken phänotypischen Unterschieden zwischen den Mauslinien beiträgt. Die vollständige Penetranz des Infertilitätsaspektes des Phänotyps könnte bei dieser Theorie dadurch erklärt werden, das SPOC1 bei der Spermatogenese eine einzigartige Funktion hat, die von PHF23 nicht vollständig übernommen werden kann. 124
135 4.1 Einfluss des genetischen Hintergrunds auf den Spoc1 -/- -Phänotyp Ob eine kompensatorische Wirkung von PHF23 bei der Ausprägung des Phänotyps eine Rolle spielt, kann mit den im Rahmen dieser Arbeit ermittelten Daten nicht abschließend geklärt werden. Eine weitere Aufklärung des Zusammenspiels beider Proteine könnte durch weitere Untersuchungen, wie die Analyse eines PHF23 defizienten Mausmodells, eines Doppelknockouts oder verschiedener Rescue -Experimente erbracht werden Genetische Modifier Die Genome der gängigen Mausstämme, die in den genetischen Laboren verwendet werden, sind teilweise sehr unterschiedlich. Diese Unterschiede sind mitunter so weitreichend, dass bei einer Verpaarung zweier sehr unterschiedlicher Stämme (z.b. C3H und C57BL/6) die Hybridgeneration infertil sein kann [115]. Eine Studie von Yalcin et al. zeigte durch eine vergleichende Analyse von mehreren Mausstämmen, die mittels Next Generation Sequencing untersucht wurden, dass gängige Laborstämme bis zu 3, SNPs (Stamm: SPRET/EiJ) gegenüber dem Referenzstamm C57BL/6J aufweisen können [317]. Daneben existieren bis zu Indel-Varianten zwischen den Stämmen. Als Laborstiere werden Mausstämme verwendet, die aus drei Mausspezies hergeleitet wurden. Neben den Stämmen, die von Mus musculus abstammen gibt es auch Tiere die den Spezies Mus spretus (z.b. SPRET/EiJ) oder Mus castaneum (z.b. Cast/EiJ) zuzuordnen sind. Diese unterscheiden sich untereinander natürlich stärker in der genetischen Varianz, als die Stämme einer einzelenen Art. Aber auch innerhalb der Mus musculus-stämme tritt eine Vielzahl genetischer Veränderungen auf. So existieren zwischen dem Referenzstamm C57BL/6J und dem Stamm 129/Sv 6, SNPS und 523 Indel-Varianten (Daten aus der MGI- Datenbank [317]) Diese hohe genetische Varianz führt dazu, dass die Ausprägung eines Phänotyps in den einzelnen Stämmen stark unterschiedlich sein kann. Zwar existieren viele klar monogene Merkmale bzw. Erkrankungen in der Maus bei denen einzelne Loci (z.b. Cystische Fibrose, Albinismus) betroffen sind, es gibt aber auch - wie beim Menschen - zahlreiche Hinweise auf komplexe, multigen bestimmte Merkmale bzw. Erkrankungen (z.b. SLE, Diabetes) [205]. Häufig kann jedoch ein monogenes Merkmal sehr von anderen Loci moduliert werden. Diese Loci bezeichnet man dann als Modifier- Loci. Diese Gene wirken meist synergistisch mit dem zu untersuchende Gen, und haben somit einen Einfluss auf die Ausprägung eines Merkmals [205] [214]. Die Ausprägung eines bestimmten Phänotyps hängt somit oft nicht nur von einem einzelnen Locus ab, sondern resultiert aus dem Zusammenspiel mehrerer Gene und ist somit stark von dem genetischen Hintergrund abhängig. In der humanen Population zeigt sich somit häufig eine hohe Varianz in der Ausprägung eines Merkmals oder einer Erkrankung, da der genetische Hintergrund eine hohe Varianz aufweist (Abb. 4.4). Bei murinen Laborstämmen kann diese Varianz durch Inzucht minimiert werden. Somit zeigen Inzuchtstämme häufig bei der Ausprägung eines Merkmals eine geringe Varianz innerhalb eines Stammes, zwischen den einzelnen Stämmen können jedoch deutliche Unterschiede gefunden werden [205]. Es konnte insbesondere gezeigt werden, dass die Rolle des gewählten Mausstammes bei Defekten in der Gehirnentwicklung [84] und bei der Skelettentwicklung [19] kritisch ist. Dies sind zwei Aspekte des Spoc1 -Phänotyps, die zwischen den beiden Mauslinien stark unterschiedlich sind. Aber auch die progressive Infertilität, die bei beiden Mauslinien auf- 125
136 4 Diskussion Abbildung 4.4 Ausprägung eines Phänotyps. Ein Vergleich zwischen der Ausprägung eines Phänotyps zwischen der humanen Population und murinen Inzuchtstämmen. In der humanen Population zeigt sich eine große Varianz des Phänotyps, während die Inzuchtstämme meistens eine geringe Varianz innerhalb des Stammes und häufig deutliche Unterschiede zueinander aufweisen. (Verändert nach [205]) tritt, ist in ihrem Schweregrad unterschiedlich stark ausgeprägt. Da durch Bördlein et al. [40] und auch im Rahmen der vorliegenden Arbeit gezeigt werden konnte, dass diese insbesondere durch eine erhöhte Apoptoserate im späten Pachytän hervorgerufen wird, könnte eine beschriebene erhöhte Sensitivität auf Apoptosesignale im Mausstamm C57BL/6 hier eine Rolle spielen [219]. Diese Apoptose-Präferenz der C57BL/6-Tiere könnte auch einen Grund für die höhere Letalität der Spoc1 -/- -Embryonen darstellen. Die Wahrscheinlichkeit, dass die unterschiedliche Ausprägung des Spoc1 -/- -Phänotyps durch Modifier-Gene verursacht wird, ist relativ hoch, da sich die beiden Mauslinien 129P2OlaHsd und C57BL/6 relativ stark voneinander unterscheiden [312]. Der genetische Hintergrund spielt also hierbei vermutlich ein große Rolle Zusätzliche Faktoren Die oben genannten Erklärungen für die stammspezifische Variabilität des Phänotyps würden sehr gut die Unterschiede zwischen den beiden Mauslinien erklären. Sie erklären aber nicht die reduzierte Penetranz der Entwicklungsdefekte in den einzelnen Linien. Da diese Mäuse ein, bis auf die genomische Region Chr.4 E2, identisches Genom aufweisen, ist der Einfluss durch Modifier-Gene und anderer Stamm-spezifische Gründe vernachlässigbar. Vielmehr sind es hier andere Faktoren, die eine Rolle spielen müssen. Einen Einfluss haben neben äußeren Faktoren und stochastischen Effekten [236] auch epigenetische Modifikationen. Diese sind von Individuum zu Individuum unterschiedlich. Da SPOC1 selbst ein Reader epigenetischer Informationen ist, ist die Wahrscheinlichkeit relativ hoch, dass die Epigenetik einen großen Teil der Varianz des Spoc1-/- -Phänotyps innerhalb der congenen Mauslinie ausmacht. 126
137 4.2 Charakterisierung des Spoc1 -/- -Phänotyps 4.2 Charakterisierung des Spoc1 -/- -Phänotyps Der Phänotyp der Spoc1 -/- -Maus wurde im Verlauf dieser Arbeit eingehend charakterisiert. Neben der schon bekannten Infertilität der männlichen Tiere konnten weitere Aspekte des komplexen Phänotyps identifiziert werden. Diese umfassen neben Auffälligkeiten in der Skelettentwicklung vor allem embryonale Entwicklungsdefekte des craniofazialen Bereichs Spoc1 ist wichtig für eine normale Embryonal- und Fetalentwicklung Eine Analyse der Genotypenverteilung bei heterozygoter Verpaarung ergab, dass der Anteil an Spoc1 -/- -Tieren deutlich unter dem erwarteten Wert von 25 % lag (vgl. Abb. 3.2). Dieses Ergebnis deutete darauf hin, dass ein großer Teil der Spoc1 -/- -Tiere nicht das Absetzalter von ca. 3-4 Wochen erreicht. Eine Untersuchung der unterschiedlichen embryonalen Entwicklungsstadien im congenen Stamm zeigte, dass bei einem Anteil der Spoc1 -/- und Spoc1 +/- -Embryonen Entwicklungsdefekte auftreten (vgl. Abb. 3.3). Dabei entspricht deren Anteil jeweils der Überlebensrate der verschiedenen Genotypen (vgl. Abb. 3.4). Das bedeutet, dass etwa 80 % der Spoc1 -/- -Embryonen und 20 % der heterozygoten Embryonen Auffälligkeiten aufwiesen. Die Wildtyp-Tiere zeigten dagegen keine offensichtlichen Defekte. Die auftretenden Defekte betrafen meist den Kopfbereich der Tiere und führten zu einer embryonalen oder perinatalen Letalität. Das Spektrum dieser Defekte ist sehr variabel und reicht von Fehlbildungen der Augen (Anophthalmie) bis hin zu schweren Fehlbildungen des Gehirns (Exencephalie) und des Schädels (vgl. Tab. 3.1). Die betroffenen Strukturen wiesen zunächst darauf hin, dass es sich bei diesem Phänotyp um einen Neurogenese- oder Neuralleistendefekt handeln könnte. Da die Schichtung des Gehirns jedoch keine offensichtlichen Auffälligkeiten zeigte (Daten nicht gezeigt) wurde vermutet, dass es sich nicht um einen Neurogenesedefekt handelt. Für einen Neuralleistendefekt sprechen die betroffenen Strukturen. Sowohl die Knochen des Schädels, der Kiefer und auch die Pigmentschicht der Augen sind Strukturen, die aus Zellen der Neuralleiste hervorgehen [112]. Ein möglicher betroffener Signaltransduktionsweg ist der Wnt-Pathway, der in den beschriebenen Strukturen von großer Bedeutung ist. Eine mögliche Rolle von SPOC1 in diesem Pathway konnte von Sarah Kinkley (Berlin) gezeigt werden (Persönliche Mitteilung). Hierbei konnte durch genomweite Microarrays und ChIP-Seq gezeigt werden, dass durch einen Knockdown von SPOC1 in menschlichen embryonalen Stammzellen Gene des Wnt-Pathways überproportional betroffen waren. Bemerkenswert ist bei den in der vorliegenden Arbeit untersuchten embryonalen Defekten, dass diese erst ab einem embryonalen Entwicklungsstadium von E15.5 auftreten (vgl. Abb. 3.5). Davor ( E14.5) konnten keine derartigen Auffälligkeiten gefunden werden, obwohl die betroffenen Strukturen zu diesen Zeitpunkt schon angelegt sind und es nachfolgend hauptsächlich noch zu Wachstum und Enddifferenzierung kommt [112]. Die statistische Auswertung der Daten zeigte, dass diese Beobachtung signifikant ist. Dagegen werden bei einem klassischen Neuralleistendefekt diese Strukturen nicht korrekt angelegt und es kommt schon in einem sehr frühen Embryonalstadium zu entsprechenden Defekten [142]. Die Tatsache, dass die jüngeren Embryonen unauffällig sind lässt vermuten, dass es sich hierbei nicht um einen Anlagendefekt, sondern um eine Degeneration der entsprechenden 127
138 4 Diskussion Strukturen handeln könnte. Für einen Apoptose-abhängigen Degenerationseffekt spricht auch die Tatsache, dass der congene C57BL/6-Stamm stärker betroffen ist und bekanntermaßen eine höhere Suszeptibilität für Apoptose (vgl. Kap. 4.1) [219] aufweist. In der Literatur wurde ein ähnlicher embryonaler Phänotyp bisher jedoch nicht beschrieben und es bedarf weiterführender Untersuchungen, um den Verlauf und die Ursachen der komplexen Fehlbildungen in den Spoc1-Knockout-Tieren aufzuklären. Dazu sind mehrere Analysen geplant, die allerdings den Rahmen der vorliegenden Arbeit gesprengt hätten Die Funktion von Spoc1 bei der Skelettentwicklung Ursprünglich wurde SPOC1 als ein Gen identifiziert, dass besonders stark in der humanen Wachstumsfuge der Skelettknochen exprimiert ist [203]. Daher wurde ein Zusammenhang zwischen SPOC1 und der enchondralen Ossifikation vermutet. Die ersten Analysen der Spoc1 -Knockout-Maus im gemischt-genetischen Hintergrund lieferten hierzu allerdings keine weiteren Hinweise. Erst durch die Rückkreuzung der Mäuse in den congenen C57BL/6-Hintergrund kam es zu Auffälligkeiten des Skelettsystems, die darauf hinweisen, dass Spoc1 hier vermutlich eine Rolle spielt. Bei etwa 13 % der untersuchten Spoc1 -/- -Tiere konnte eine deutliche Hypoplasie der Skelettknochen festgestellt werden (vgl. Kap ). Eine Darstellung der Skelette mittels Alcian-Blau und Alizarin-Rot zeigte, dass bei den Spoc1 -/- -Tieren die Wachstumsfugen noch knorpelige Strukturen aufweisen, die bei den Vergleichstieren schon geschlossen sind (vgl. Abb. 3.6). Außerdem zeigte der Schädel distinkte Veränderungen, die bei allen Spoc1 -/- -Tieren des congenen Stammes auftraten. Hierbei war der Schädel normal in seiner Breite, jedoch deutlich verkürzt (Brachycephalie). Bei der Darstellung der Schädel fiel auf, dass sowohl das Os occipitale als auch das Os parietale normal in ihrer Form sind. Das Stirn- und Nasenbein sind dagegen deutlich verkürzt. Das Nasenbein zeigt neben der Verkürzung auch eine Verkrümmung. Die Stirnund die Kranznaht (Sutura fronatlis und Sutura coronalis) sind zudem deutlich verändert (Abb. 4.5). Diese Brachycephalie kann durch eine Craniosynostose gut erklärt werden. Vermutlich kommt es bei den Spoc1 -/- -Tieren zu einer verfrühten Verknöcherung der Kranznaht (Sutura coronalis) und in Folge dessen zu den beobachteten Veränderungen. Solche Brachycephalien sind auch schon bei anderen Mausmodellen beschrieben worden, und konnten dort auf die Synostose der Kranznaht zurückgeführt werden. Solche Craniosynostosen sind vor allem bei aktivierenden Mutationen der Fibroblast Growth Faktor Rezeptoren (Fgfr1-3) bekannt [62] [135]. Bei Mutationen in diesen Rezeptoren kommt es auch häufig, aufgrund der Veränderungen in der Kranznaht, zu einer Veränderung der Stirnnaht und zu einer Verkrümmung des Nasenbeins [304]. Aber auch Mutationen in TWIST (Twist Basic Helix-Loop-Helix Transcription Factor 1) oder MSX2 (Msh Homeobox 2) können zu einem solchen Phänotyp führen. Die Funktion von TWIST1 scheint insbesondere interessant zu sein, da dieses Gen in der genomweiten Expressionsanalyse, der mit den congenen Tieren durchgeführt wurde (vgl. Kap. 3.4) in den Spoc1 -/- -Tieren hoch reguliert (FC = 1,86) ist, wobei aber zu beachten ist, dass dieser Expressionsarray in Hodengewebe durchgeführt wurde und nicht die Situation in dem wachsenden Schädel widerspiegelt. Deshalb kann dieser Befund nur als Hinweis für weitere Analysen dienen. Bei 128
139 4.2 Charakterisierung des Spoc1 -/- -Phänotyps Abbildung 4.5 Schematische Darstellung der Schädel Im schematischen Vergleich zwischen den Schädeln der Spoc1 +/+ - und der Spoc1 -/- -Tiere wird gezeigt, dass sowohl das Hinterhauptsbein, als auch die Scheitelbeine normal in ihrer Form sind. Stirn- und Nasenbein sind dagegen deutlich verkürzt. Veränderungen in der Kranz- und Stirnnaht sind deutlich erkennbar. Mutationen in den oben beschriebenen Genen kommt es auch häufig zu Veränderungen der Skelettknochen, wie sie auch bei den hier untersuchten Tieren zu finden sind. Es ist vorstellbar, das SPOC1 die Expression eines der oben genannten Gene während der Skelettentwicklung beeinflusst und somit als Regulator für diesen Ossifikationsprozess wirken kann. Um diese Vermutungen zu bestätigen, sind weitere Analysen notwendig. Zum einen soll eine weitere genomweite Analyse der Genexpression durchgeführt werden, bei dem die RNA spezifisch aus den Köpfen der Spoc1 -/- - und Spoc1 +/+ -Tiere isoliert wird. Zum anderen müssen zur Untersuchung der postulierten Craniosynostose histologische Schnitte angefertigt werden, um zu ermitteln ob und wann eine Verknöcherung der Kranznaht vorliegt. Außerdem kann eine histologische Untersuchung der veränderten Wachstumsfugen weitere Hinweise zur Aufklärung der Skelettdefekte liefern. Aufgrund der limitierten Anzahl von Knockout-Tieren, insbesondere im congenen Stamm sowie der Tatsache, dass im Verlauf dieser Arbeit der Schwerpunkt primär auf die Infertilität der Spoc1 -/- -Tiere gelegt wurde, wurden diese Analysen im Rahmen der vorliegenden Arbeit nicht durchgeführt. 129
140 4 Diskussion Der Verlust von Spoc1 führt zu Infertilität bei männlichen Tieren Wie schon bei der ersten Analyse der Spoc1 - gene trap -Maus von A. Bördlein [39] gezeigt werden konnte, findet sich bei den Spoc1 -/- -Tieren ein Defekt in der Spermatogenese, der zu Infertilität führt. Hierbei war spezifisch die Spermatogenese, aber nicht die Oogenese betroffen. Dies ist kein seltenes Phänomen, da sich einige Aspekte zwischen der weiblichen und männlichen Gametogenese bei Säugetieren grundlegend unterscheiden [112] [144]. Die wichtigsten Unterschiede sind in der Tabelle 4.1 zusammengefasst. Tabelle 4.1 Vergleich zwischen Spermatogenese und Oogenese (human) Spermatogenese Oogenese Ort Im Keimepithel der extraperitoneal In den Ovarien [45] gelegenen Testes [45] Prinzip Kontinuierliche Produktion von Keimzellen, beginnend mit der Pubertät bis zum Tod [112] Erschöpfung eines fötal angelegten Vorrats; Endet mit der Menopause [110] Menge Bis zu 100 Mio Spermien pro Tag Wenige Eizellen pro Zyklus Anzahl 4 Spermien pro Meiose [112] 1 Oozyte, 3 Polkörperchen pro Meiose [112] Dauer ca. 74 Tage [112] Jahre (Arrest im Dictyotän) [112] Gameten Kleines, ca. 6 µm großes Spermium, das sich mit Hilfe einer Flagelle fortbewegen kann (motil) [110] Riesige, ca. 0,12 mm große Eizelle, die unbeweglich ist (passiver Transport) [45] Imprinting Paternales Imprinting [98] Maternales Imprinting [98] Histone Austausch der Histone durch Kein Austausch nötig [112] Protamine während der Spermiohistogenese [112] Geschlechtschromosomen Ungleiche Paarung von XY führt zu Bildung des XY-Bodys und zur MSCI [287] Paarung von XX erfolgt normal [125] Untersuchungen an entsprechenden Mausmodellen haben gezeigt, dass das Fehlen einiger Gene zu spezifischen Defekten in der Spermatogenese bzw. in der Oogenese führen kann [144]. Insbesondere sind bei den Faktoren, deren Defizienz zu männlicher Infertilität führt, Gene betroffen, die eine Rolle bei den Erhalt der spermatogonalen Stammzellen spielen [14] [66] oder in die MSCI involviert sind [72] [144]. In der vorliegenden Arbeit konnte bei der vergleichenden Analyse des Phänotyps in den Spoc1 -/- -Mäusen der gemischt-genetischen und der congenen Mauslinie gezeigt werden, dass bei beiden Linien eine deutliche Hodenhypoplasie vorhanden ist (vgl. Abb. 3.8). Der berechnete Gonadal-somatische Index verdeutlicht, dass diese Hodenhypoplasie nicht auf eine allgemein reduzierte Körpergröße zurückzuführen ist. Diese Hodenhypoplasie ist im 130
141 4.2 Charakterisierung des Spoc1 -/- -Phänotyps congenen Stamm deutlich ausgeprägter. Akzessorische Strukturen wie die Samenblase waren dagegen normal ausgebildet. Dieses Ergebnis spricht dafür, dass es sich bei dem Defekt um eine direkte Auswirkung auf die Spermatogenese handelt und vermutlich nicht von einer fehlerhaften hormonellen Steuerung herrührt. Eine Auswertung der Spermienanzahl ergab, dass die Anzahl der Spermien deutlich erniedrigt ist (vgl. Abb. 3.9). Dieser Defekt nimmt mit dem Alter der Tiere zu und ist im congenen Hintergrund deutlich ausgeprägter. Die Hodenhypoplasie hat also einen Verlust der Keimzellen zur Folge und führt somit zur Infertilität der Spoc1 -/- -Tiere. Eine vergleichende histologische Analyse der Tubuli seminiferi zeigte, dass es sich hierbei um einen progressiven Verlust der Keimzellen im Spoc1 -/- -Gewebe handelt, bei dem letztendlich nur die somatischen Sertoli-Zellen im Keimepithel verbleiben (vgl. Abb. 3.10). Eine quantitative Auswertung der Tubulusgröße und -architektur verdeutlicht den Verlust der Keimzellen und zeigt auf, dass der Phänotyp in den Tieren mit congenen Hintergrund deutlich stärker ausgeprägt ist (vgl. Abb. 3.11). In den heterozygoten Tieren konnte dieser Effekt bei bis zu 25 Wochen alten Tieren nicht gefunden werden (Daten nicht gezeigt). Bei der Analyse sehr alter Tiere (> 1 Jahr) konnte jedoch gezeigt werden, dass auch bei den heterozygoten Tieren im congenen Hintergrund die Destrukturierung des Hodens einsetzt (vgl. Abb. 3.13). Somit scheint bei den congenen Tieren eine Haploinsuffizienz vorzuliegen, die erst nach lang andauernden Zyklen der Spermatogenese auftritt. Die Anzahl und die grobe Morphologie der Sertoli-Zellen sind nicht verändert im Vergleich zu den Spoc1 +/+ -Vergleichstieren (vgl. Abb. 3.14). Dies ist insbesondere deshalb von Bedeutung, da die Anzahl der Sertoli-Zellen, die mit den Keimzellen interagieren, für eine Spezies hoch konstant und essentiell für die Sertoli-Zell-Keimzell-Interaktion ist [209]. Um abzuklären, ob der Verlust der Keimzellen auf eine verringerte Proliferation der Zellen oder einer erhöhte Apoptose zurückzuführen ist, wurden entsprechende Versuche mit den Proliferationsmarker PCNA (Proliferating Cell Nuclear Antigen) und KI67 (Antigen Identified By Monoclonal Antibody Ki-67) bzw. aktivierte Caspase 3 und TUNEL-Assay für Apoptose durchgeführt. Dabei zeigte sich keine signifikante Verringerung der Proliferationsrate in allen untersuchten Altersstufen (vgl. Abb. 3.15). Die Apoptose in den Keimzellen des Pachytänstadiums hingegen war deutlich erhöht (vgl. Abb. 3.16). Eine solche Ursache für den Verlust von Keimzellen ist schon mehrfach beschrieben worden, wie zum Beispiel für den Knockout-Mäusen für das Gen Plzf. Diese Tiere weisen einen sehr ähnlichen Phänotyp wie die Spoc1 -/- -Tiere auf und Plzf wird, wie Spoc1, in undifferenzierten Spermatogonien exprimiert [66]. Nähere Untersuchungen der Spoc1 -/- -Tiere zeigten, dass die Apoptose insbesondere während der Prophase I im Pachytänstadium stattfindet. Ähnliches ist schon von anderen Mausmodellen bekannt. Insbesondere von Mäusen, bei denen Gene defizient sind, deren Verlust zu einem Defekt in der meiotischen Inaktivierung der Geschlechtschromosomen (MSCI) führt [102] [201] [302]. Besonders auffällig bei der Analyse der apoptotischen Zellen war das klonale Verteilungsmuster, das die apoptotischen Pachytänzellen aufwiesen (vgl. Abb. 3.18). Dieses Ergebnis lässt die Vermutung zu, dass die Ursache für die Apoptose möglicherweise schon früh, d.h. während der Differenzierung der spermatogonalen Stammzellen, vorliegt. Da Spoc1 in den undifferenzierten Spermatogonien exprimiert wird (vgl. Abschnitt 3.3.1), ist es denkbar, dass hier durch SPOC1 epigenetische Modifikationen reguliert werden, die an die Tochterzellen 131
142 4 Diskussion weitervererbt werden. Bei dem Verlust des Proteins in den Spoc1 -/- -Tieren fehlen diese spezifischen epigenetischen Veränderungen und es kommt zur Apoptose während des Pachytän-Checkpoints. In diesem Checkpoint wird sichergestellt, dass die Paarung der homologen Chromosomen korrekt verläuft [193]. Dieser Checkpoint ist somit für die Aufrechterhaltung der Spermatogenese von großer Bedeutung, da hier sichergestellt wird, dass die meiotische Rekombination und die Synapsis der Chromosomen fehlerfrei abgeschlossen wurden. Dieser Mechanismus verhindert Fehler bei der Chromosomensegregation und schützt somit vor der Entstehung aneuploider Gameten [240]. Eine Vielzahl von Proteinen unterschiedlicher Funktionen sind an diesem Checkpoint beteiligt und führen dazu, dass Fehler während der Meiose durch das Einleiten der Apoptose ausgemerzt werden. Die Untersuchung der Verteilung undifferenzierter Spermatogonien, mit Hilfe des Markers PLZF, zeigte, dass zwar die Gesamtanzahl dieser Zellen nicht signifikant abweicht, jedoch die Verteilung der Zellen innerhalb eines Tubulusquerschnitts deutlich verändert ist (vgl. Abb ). Es kommt in einigen Tubuli zu einer Akkumulation der undifferenzierten Spermatogonien, während sie in anderen Tubuli verloren gehen. Dies deutet darauf hin, dass es bei dem Verlust von Spoc1 möglicherweise zu einem Differenzierungsdefekt der Spermatogonien kommt. Ein ähnlicher Effekt ist bei dem Verlust des Gens Plzf zu beobachten [43] [66]. Bei PLZF (Promyelocytic Leukemia Zinc Finger Protein) oder auch ZBTB16 (Zinc Finger And BTB Domain Containing 16) handelt es sich um ein Mitglied der BTB-POZ-ZF-Familie (broad complex, tramtrack, bric-à-brac or poxvirus and zinc finger), welche Transkriptionsfaktoren darstellen. Es wurde postuliert, dass PLZF und andere Proteine dieser Familie repressive Transkriptionsfaktoren sind, die über epigenetische Mechanismen die Zugänglichkeit des Chromatins verändern [155]. Buaas et al. zeigten dass bei einem Knockout von Plzf die epigenetischen Regulationsmechanismen in den undifferenzierten Spermatogonien verändert sind. Als Folge dessen kommt es auch hier zu einem Verlust der Keimzellen bis zu dem Sertoli-Cell-Only Phänotyp [43]. Einen Defekt während der MSCI wurde bei PLZF-defizienten Mäusen jedoch nicht gezeigt. Somit ist deutlich ersichtlich, dass der Spermatogenesedefekt, der durch den Verlust von SPOC1 entsteht zwei klar voneinander getrennte Aspekte aufweist. Dies betrifft zum einen den Differenzierungsdefekt in der mitotischen Phase der Spermatogenese und zum anderen die erhöhte Apoptoserate im Pachytänstadium der Meiose. Hierbei ist es möglich, dass es sich bei beiden Aspekten um funktionell getrennte Mechanismen handelt, die voneinander unabhängig sind. Es ist aber auch denkbar, dass beide Aspekte über epigenetische Modifikationen und Rückkopplungsmechanismen miteinander verbunden sind. In Kap. 4.5 werden zwei mögliche Modelle zu dem Spermatogenesedefekt führen könnten. Auffällig ist bei der Defizienz von SPOC1, dass das Keimepithel zunächst normal angelegt wird. Bis zu einem Alter von 5 Wochen sind keine Veränderungen des Keimepithels in den Tieren mit gemischt-genetischem Hintergrund zu finden. Aber auch bei den congenen C57BL/6-Mäusen ist im Alter von 5 Wochen zu einem großen Teil normales Epithel vorhanden. Der Verlust der Keimzellen tritt also erst später auf. Um dies aufzuklären muss man die unterschiedlichen Wellen der Spermatogenese betrachten. Man unterscheidet zwischen der juvenilen und der adulten Spermatogenese, die sich in einigen Aspekten deutlich voneinander unterscheiden (vgl. Abb.4.6). Die juvenile Spermatogenese stellt die erste Welle dieses Entwicklungsprozesses dar. Sie beginnt synchron im gesamten Hodengewebe ab Postnataltag 0 und dauert bis Postnataltag 35 an. Hierbei entwickeln sich aus den 132
143 4.2 Charakterisierung des Spoc1 -/- -Phänotyps Gonozyten direkt differenzierende Typ A1 Spermatogonien welche weiter zu Typ B Spermatogonien differenzieren und anschließend in die Meiose eintreten. Diese Population an Gonozyten ist nach dieser juvenilen Welle komplett aufgebraucht [323]. Die restlichen Gonozyten entwickeln sich dagegen in undifferenzierte Spermatogonien, aus denen auch der Stammzellpool der Keimzellen hervorgeht. Bei diesen Zellen halten sich Differenzierungsund Aufrechterhaltungsprozesse die Waage, sodass sich aus diesem Zellpool ständig neue Spermatogenesewellen entwickeln können [76] [77] [6]. Diese Stammzellen exprimieren neben den Stammzellmarkern Oct4, Plzf und Ret auch den Marker Ngn3, der in den Gonozyten, die direkt in die differenzierenden Spermatogonien übergehen (Abb. 4.6 #1), nicht zu finden ist [323]. Abbildung 4.6 Juvenile versus adulte Spermatogenese Ein Teil der Gonozyten differenzieren in der ersten Spermatogenesewelle (juvenile Spermatogenese) direkt in differenzierende Spermatogonien, die anschließend alle weiteren Stadien der Spermatogenese durchlaufen. Die übrigen Gonozyten entwickeln sich in undifferenzierte Spermatogonien, die neben den Stammzellmarker Oct4, Plzf und Ret zusätzlich Ngn3 exprimieren. Diese Zellen haben die Fähigkeit zur Selbsterneuerung und halten den Stammzellpool aufrecht. Aufgrund dieser Unterschiede kann man zwischen Defekten unterscheiden, welche die gesamte oder nur die adulte Spermatogenese betreffen. Dies ist zum Beispiel auch für die Defizienz von Plzf [66] [43] und Erm [57] beschrieben. Bei diesen Mausmodellen ist wie bei den Spoc1 -/- -Tieren nur die adulte Spermatogenes betroffen. ERM stellt dabei ein Protein 133
144 4 Diskussion dar, das in den Sertoli-Zellen exprimiert wird und essentiell für den Erhalt der Stammzellnische ist. Plzf dagegen wird (wie Spoc1 ) in den undifferenzierten Spermatogonien exprimiert (vgl. Kap ) und ist dort essentiell für den Stammzellerhalt Die mögliche Rolle von SPOC1 beim humanen 1p36-Deletions-syndrom Das 1p36-Deletionssyndrom oder Monosomie 1p36 ist eine genetische Erkrankung, bei der eine Deletion des äußersten Banden des kleinen Arms auf Chromosom 1 vorliegt. Das Syndrom tritt mit einer Häufigkeit von 1: : auf. Meist betrifft die Deletion den terminalen Teil des Chromosoms, wobei der Großteil der Bruchpunkte in der Bande 1p36.2 liegt. Es treten aber auch häufig größere Deletionen auf, die bis in die Bande 1p36.13 reichen und somit das Gen SPOC1 (Bande 1p36.31) umfassen. In Abhängigkeit von der Größe der Deletion treten bei diesen Syndrom unterschiedliche klinische Merkmale auf. Diese umfassen moderate bis schwere mentale Retardierung, Wachstumsverzögerung, Hypotonie, Epilepsie, eingeschränkte Sprachfähigkeiten, Malformationen, Hör- und Sehprobleme und spezifische faziale Auffälligkeiten. Die fazialen Auffälligkeiten zeichnen sich durch eine große Fontanelle, ein kleines Kinn, flachen Nasenrücken, tief gestellte, kleine Ohren und orofazialer Gaumenspalte aus. Daneben existieren auch Malformationen des Genitalsystems die Hodendystopie und eine Hypoplasie des Hoden umfassen. Außerdem zeigen viele Patienten eine Mikrozephalie [266]. Der chromosomale Bereich 1p36 wurde außerdem schon früh mit der Entstehung von Krebs assoziiert [309] und beinhaltet putative Tumorsuppressorgene [130]. Die Tatsache, dass SPOC1 innerhalb des deletierten Bereich liegen kann, lässt die Vermutung zu, dass das Gen einen Beitrag zu dem Spektrum der Symptome des 1p36- Deletionssyndrom leisten könnte. Die ist jedoch nur bei einem relativ geringen Anteil der 1p36-Patienten der Fall. Vergleicht man den Phänotyp des Syndroms mit dem in dieser Arbeit untersuchten Mausmodell fällt auf, dass einige phänotypische Aspekte korrelieren. Die Malformationen des männlichen Genitaltraktes, sowie die Wachstumsverzögerung, die Mikrocephalie und spezifische faziale Auffälligkeiten haben beide gemein. Es kann außerdem davon ausgegangen werden, dass bei einem Anteil der Patienten die Haploinsuffizienz von SPOC1 ausreichend ist um Defekte hervorzurufen, da auch die Spoc1 +/- -Tiere zu einem gewissen Anteil Auffälligkeiten bis zur Letalität zeigen. Da nur eine geringe Anzahl an Patienten mit 1p36-Syndrom eine Deletion von SPOC1 aufweisen ist davon auszugehen, dass SPOC1 höchstens eine untergeordnete Rolle bei diesem Syndrom spielt. Um die Rolle von SPOC1 bei diesen Syndrom näher zu untersuchen bedarf es einer ausführlichen Charakterisierung der Patienten bei denen SPOC1 von der Deletion betroffen ist. 134
145 4.3 Genomweite Expressionsanalyse 4.3 Genomweite Expressionsanalyse Um auf genomweiter Ebene die Auswirkung des Knockouts von Spoc1 zu untersuchen wurden genomweite Genexpressionsanalysen mittels der Microarray-Technologie durchgeführt. Dabei wurden zum einem Testis-Gewebe von Wochen alten Mäusen des gemischt-genetischen Hintergrunds und zum anderen Testis-Gewebe von 5 Wochen alten Tieren des congenen Hintergrund verwendet. Es wurden jeweils drei Spoc1 -/- -Tiere mit drei Wildtyp-Vergleichstieren verwendet Die Auswirkungen des genetischen Hintergrunds Bei der Auswertung der ersten genomweiten Expressionsanalyse, die mit je drei Spoc1 -/- - und Spoc1 +/+ -Tieren des gemischt-genetischen Hintergrund durchgeführt wurde, zeigte sich zunächst, dass eine relative hohe Anzahl an Genen zwischen den einzelnen Mäusen, unabhängig vom Genotyp, unterschiedlich exprimiert waren (vgl. Abb. 3.26). Diese Gene unterliegen vermutlich schon in den beiden Mausstämmen 129P2 und C57BL/6 einer unterschiedlichen Regulation. Im gemischt-genetischen Hintergrund kommt es zu einer Homogenisierung der beiden Genome durch Rekombination. Dies gilt allerdings nicht für Gene, die in unmittelbarer Nähe des Spoc1 -Gens auf Chromosom 4 E2 liegen. Diese Gene werden praktisch immer gekoppelt mit Spoc1 - Gene trap -Konstrukt weitergegeben. Da die Generierung des Gene traps im Stamm 129P2 erfolgte, tragen die Spoc1 -/- -Mäuse in diesem Bereich die Allele dieses Stammes homozygot. Stammspezifische Expressionsunterschiede dieser Gene sind somit in den Spoc1 -/- -Tieren unmittelbar zu beobachten. Einige Gene aus der unmittelbaren Nachbarschaft zu Spoc1 zeigen im zweiten Array, der mit congenen Tieren durchgeführt wurde, eine differentielle Expression in den Spoc1 -/- - Tieren. Insbesondere das Gen Tas1r1, welches 38 kb distal von Spoc1 lokalisiert ist (vgl. Abb. 3.28) und für eine Untereinheit des Umami-Geschmacksrezeptors codiert, zeigte eine starke Herabregulation in der Expression in den Spoc1 -/- -Tieren. Um auszuschließen, dass diese starke Herabregulation einen Einfluss auf den Phänotyp der Tiere hat, wurden Expressionsanalysen durchgeführt. Es zeigte sich, dass das Gen Tas1r1 nur im Hodengewebe von C57BL/6-Tieren exprimiert wird, nicht aber in Tieren des Stammes 129/Sv (vgl. Abb. 3.29). Dies spricht dafür, dass nur das C57BL/6-Allel im Testis aktiv ist. Eine Sequenzanalyse zeigte, dass die Spoc1 -/- -Tiere ohne Ausnahme homozygot das 129P2-Allel tragen, welches nicht im Hodengewebe exprimiert wird (vgl. Tab. 3.7). Eine weitergehende Sequenzanalyse des Gens mit den Sequenzdaten mehrerer Mausstämme, welche aus der Arbeit von Yalcin et al. [317] entnommen wurde zeigte, dass grundsätzlich zwei Allele des Gens Tas1r1 in den verschiedenen gängigen Laborstämmen existieren, wobei die Gruppe der 129-Stämme und der C57BL/6-Stamm jeweils über die unterschiedlichen Allele verfügen (vgl. Abb. 4.7). Hierbei zeigte sich, dass neben den 27 annotierten SNPs ( single nucleotide polymorphism ), 18 weitere SNVs ( single nucleotide variation ), 4 Deletionen (3-8 bp) und 2 Insertionen (1-4 bp) in dem 129/Sv-Allel vorhanden sind. Davon liegen 5 SNVs und 11 SNPs in den Exonbereichen des Gens. Zwei der SNPs führen zu einem Aminosäureaustausch, welcher in Verbindung mit der unterschiedlichen Prävalenz der Mausstämme bei 135
146 4 Diskussion Abbildung 4.7 Unterschiede der murinen Tas1r1 -Allele Die Exons sind als blaue Pfeile dargestellt, intronische Bereiche einschließlich der genomischen Bereiche vor dem 1. bzw. nach dem 6. Exon sind in grau dargestellt. Putative CTCF-Bindestellen sind rot gekennzeichnet. SNVs sind als schwarze vertikale Striche, Deletionen in rot und Insertionen in grün dargestellt. Die fett markierten SNPs wurden in der SNP-Analyse näher untersucht. Als Referenz wurde die Sequenz des Stammes C57BL/6 verwendet, die Unterschiede gelten für den Stamm 129/Sv. der Glutamataufnahme gebracht wurde [20]. Bei dieser Analyse fiel auf, dass der Promotor des Gens allerdings keine stammspezifischen Unterschiede aufweist und somit höchstwahrscheinlich nicht für die Expressionsunterschiede verantwortlich ist. Eine mögliche Erklärung für die unterschiedliche Expression des Gens könnte in der stammspezifischen Expression eines, für die Aktivierung des Promotors essentiellen Transkriptionsfaktors liegen, also einem trans-effekt. Dies ist aber ebenfalls unwahrscheinlich, da der Expressionsunterschied auch bestehen bleibt, wenn das 129P2-Allel in den C57BL/6-Hintergrund gebracht wurde (vgl. Abb. 3.29). Dies deutet darauf hin, dass es sich hierbei um einen in cis wirkenden Mechanismus handeln muss. Eine mögliche Erklärung findet sich bei der Betrachtung der putativen CTCF-Bindestellen in diesem Gen. Bei CTCF (CCCCTC-binding factor) handelt es sich um einen multifunktionellen Transkriptionsfaktor, der sowohl aktivierend als auch reprimierend auf die Transkription wirken kann. Dabei ist er an der Bildung von Chromatinschlaufen beteiligt, welche eine isolierende Funktion aufweisen [272] [22] [311]. Die im ENCODE-Track des UCSC Genome Browsers ( build:mm9) enthaltenen Daten zeigen deutlich mögliche CTCF-Bindestellen innerhalb des Tas1r1 -Gens. Eine Bindestelle liegt in Intron 1, zwei weitere in Intron 5. Die erste in Intron 5 lokalisierte Bindestelle ist von dem SNP32 (rs ) betroffen, welcher vermutlich die Bindeeigenschaften dieser Sequenz verändert. Wenn man davon ausgeht, dass die Expression von Tas1r1 im Testis nicht der gewöhnlich vorliegende Zustand ist, wofür auch die Expressionsanalyse im Rattenhoden spricht ist es denkbar, dass der in den C57BL/6- Tieren vorhandene SNP zu einer geringeren Affinität zu CTCF führt und somit die inhibierende Insulatorfunktion wegfällt. Es könnte somit zu einer ektopen Expression des Gens im Hodengewebe kommen. Um die Auswirkung der geringeren Expression von Tas1r1 auf den Phänotyp der Spoc1 -/- -Mäuse beurteilen zu können, muss festgestellt werden, ob bei Mäusen des Stammes 129/Sv im Vergleich zu C57BL/6-Tieren Unterschiede bei der Fertilität auftreten. Die in der vorliegenden Arbeit erhobenen Daten zeigen, dass beide Mausstämme gleichermaßen fertil sind, wobei die durchschnittliche Anzahl der Nachkommen bei den 129/Sv-Mäusen etwas niedriger ist [264]. Tas1r1 codiert für eine Untereinheit des Umami-Geschmacksrezeptors, der für die Wahrnehmung von Fleischgeschmack verantwortlich ist [20]. Für beide Untereinheiten dieses Rezeptors (TAS1R1 und TAS1R3) 136
147 4.3 Genomweite Expressionsanalyse existieren defiziente Mausmodelle, bei denen jedoch keine Auswirkungen auf die Fertilität gezeigt werden konnten [196] [69]. Insbesondere für Tas1r1 wurden hierbei ausführlich Analysen durchgeführt, bei denen jedoch lediglich eine erhöhte Ca 2+ -Konzentration, sowie eine vermehrte Menge an basalen camp in frisch isolierten Spermien gefunden werden konnte, welche allerdings keine Auswirkungen auf die Akrosomenreaktion hatte [196]. Aufgrund dieser Tatsachen ist davon auszugehen, dass der Expressionsunterschied von Tas1r1 keinen Einfluss auf die Ausprägung des Spoc1 -/- -Phänotyps hat. Die vorliegende Arbeit zeigt aber, dass man bei Defizienz-Modellen jedoch grundsätzlich stammspezifische Expressionsunterschiede bei der Verwendung unterschiedlicher Mausstämme als Donor und Rezipient bedenken sollte Die repressiven Eigenschaften von SPOC1 Die Ergebnisse beider genomweiten Expressionsanalysen zeigten deutlich, dass in den Spoc1 -/- -Tieren etwa zwei Drittel der differentiell exprimierten Gene (FC 1) gegenüber den Spoc1 +/+ -Vergleichstieren hoch reguliert waren. Dies lässt vermuten, dass SPOC1 normalerweise eher reprimierend auf die Genexpression wirkt. Eine mögliche Erklärung hierfür ist die putative Interaktion von SPOC1 mit Komponenten der Komplexe PRC1 und PRC2. Es konnte von Kinkley et al. gezeigt werden, dass SPOC1 mit EZH2 interagieren kann, welches eine Kernkomponente des PRC2 darstellt und dort für die Methylierung des Histons H3 an Position K27 zuständig ist [50]. Die Trimethylierung von H3K27 stellt eine stark reprimierende epigenetische Modifikation dar, die insbesondere bei der dauerhaften Inaktivierung von Genen wichtig ist (vgl. Kap. 1.3) [188] Die Rolle von SPOC1 bei der Aufrechterhaltung der BTB Gene, die als differentiell exprimiert in den beiden Microarray-Experimenten identifiziert wurden, wurden auf ihre Beteiligung in unterschiedlichen Pathways hin untersucht. Die Analyse mit dem Programm Pathway Express zeigte deutlich, dass in beiden Arrays eine signifikante Assoziation mit den Pathways Leukocyte transendothelial migration (KEGG:04670) und Cell adhesion molecules (CAMs; KEGG: 04514) besteht (vgl. Tab. 3.5). Beide Pathways sind bei der Migration von Zellen wichtig. Betrachtet man diese Ergebnisse im Zusammenhang mit der Spermatogenese fällt auf, dass Migrationsprozesse von essentieller Bedeutung für den Fortlauf der Spermatogenese sind. Bei der Transition von undifferenzierten Spermatogonien zu A1-Spermatogonien beginnen sich die Keimzellen von der Basallamina zu lösen und wandern in Richtung des adluminalen Kompartiments (Abb. 4.8). Im Präleptotänstadium durchwandern die Keimzellen die Blut-Hoden- Schranke (BTB) und gelangen in das adluminale Kompartiment. Die Durchquerung dieser immunologischen Schranke, bei der Tight-Junctions überwunden werden müssen, ähnelt der Migration von Leukozyten durch endotheliale Tight Junctions bei Entzündungsprozessen [298]. Wie aus Tabelle 3.6 ersichtlich, sind die meisten veränderten Komponenten der BTB, mit Ausnahme der PI3K, im Spoc1 -/- -Gewebe stärker exprimiert als im Vergleichsgewebe der Wildtyp-Tiere. Eine mögliche Erklärung hierfür ist, dass die Differenzierung der 137
148 4 Diskussion Abbildung 4.8 Aufbau der Blut-Hoden-Schranke Bei der Wanderung der Keimzellen im Epithel müssen diese zunächst die Tight Junctions der BTB aufgebrochen werden. Direkt nach der Migration bilden sich die Tight Junctions wieder aus. Die Wanderung der Keimzellen wird durch adhärente Proteine zwischen Sertoli- und Keimzellen bewerkstelligt. Aus [298]. Keimzellen fehl reguliert ist und es somit zu einem verfrühten Übergang durch die BTB kommt. Für die Gene Alcam, Claudin 11 und F11R konnten die Ergebnisse des Arrays über quantitative Real Time-PCR bestätigt werden (vgl. Abb A). Immunhistochemischen Analysen der BTB-Komponente Claudin 11 zeigte, dass die Struktur der BTB in 20 Wochen alten Hodengewebe der Spoc1 -/- -Tiere stark verändert ist (vgl. Abb B). Jedoch ist der Keimzellverlust in diesem Stadium schon sehr weit fortgeschritten und eine normale Architektur der Tubuli nicht zu erwarten. Bei jüngeren Tieren konnten keine Unterschiede in der Lokalisation des Adhäsionsmolekül festgestellt werden. Die Daten der genomweiten Expressionsanalyse und der immunhistochemische Versuche deuten darauf hin, dass bei den Spoc1 -/- -Tieren möglicherweise ein Defekt bei den Migrationsprozessen der Keimzellen besteht. Vermutlich werden durch eine vorzeitige Dif- 138
149 4.4 Der Knockdown von Spoc1 führt zu einer defekten MSCI ferenzierung die Gene aktiviert, welche für die Migration der Keimzellen verantwortlich sind. Die Frage, ob die Veränderungen im Migrationsverhalten eine direkte Folge des Verlusts von Spoc1 darstellt, oder vielmehr eine Folge des Differenzierungsdefekts ist, konnte im Rahmen dieser Arbeit nicht abschließend geklärt werden Die Rolle von SPOC1 während der Meiose Die Auswertung der genomweiten Expressionsanalysen zeigte bei Chromosomen-weiter Betrachtung, dass die Gene, welche auf den Gonosomen liegen, anders reguliert sind, als die Gene auf den Autosomen (vgl. Abb. 3.30). Es zeigte sich eine allgemeine Aktivierung der Gene auf X- und Y-Chromosom. Diese Tatsache zusammen mit den Ergebnissen des TUNEL-Assays, der eine deutlich erhöhte Apoptose während des Pachytänstadiums zeigte, lässt darauf schließen, dass es bei den Spoc1 -/- -Meiozyten zu einem Defekt in der meiotischen Geschlechtschromosomeninaktivierung (MSCI) kommt. Diese Ergebnisse sollen im folgenden Abschnitt diskutiert werden. 4.4 Der Knockdown von Spoc1 führt zu einer defekten MSCI Die genomweiten Expressionsanalyse ergaben, dass im Hoden der Spoc1 -/- -Mäuse eine Chromosomen-weite Änderung der Genexpression auf dem X- und Y-Chromosom vorliegt, die hochsignifikant ist (vgl. Abb und 3.32). Dieses Ergebnis deutete auf einen Defekt bei der meiotischen Inaktivierung der Geschlechtschromosomen hin, welche für die andauernde Spermatogenese in Mammaliern essentiell ist. Um diesen Hinweis näher zu untersuchen, wurden verschiedene Experimente durchgeführt, welche diese Hypothese bestärken sollten Hinweise für eine fehlerhafte MSCI Die MSCI stellt einen Mechanismus dar, bei dem während des Pachytäns bei der männlichen Meiose in Mammaliern die Expressionsaktivität auf den Gonosomen herab reguliert wird. Die MSCI stellt einen Sonderfall der meiotischen Inaktivierung ungepaarten Chromatins (MSUC) dar, bei der die heterogenen Geschlechtschromosomen inaktiviert und in eine subnukleäre Domäne transloziert werden [287]. Den ersten Hinweis für eine fehlerhafte MSCI bei den Spoc1 -/- -Mäusen erbrachten die Ergebnisse der genomweiten Expressionsanalysen, die deutlich zeigten, dass die Gene auf den Gonosomen fehl reguliert sind (vgl. Abb. 3.30, 3.31 und 3.32). Diese Ergebnisse konnten in Real Time-PCR Analysen bestätigt werden (vgl. Abb.3.33). Eine Möglichkeit, die Expression einzelner Gene während der MSCI unmittelbar zu untersuchen, stellt die RNA-FISH dar [186]. Mittels dieser Methode konnte gezeigt werden, dass die naszente mrna der Gene Rbmy1a1 und Ddx3x innerhalb des XY-Bodys der Spoc1 -/- -Meiozyten vorhanden ist (vgl. Abb. 3.33). Dies konnte vor allem in mittleren bis späten Pachytän-Zellen gezeigt werden. Eine Expression dieser beiden Gene war in den Spoc1 +/+ -Meiozyten demgegenüber nicht zu beobachten. Um die globale Expression auf den Gonosomen zu untersuchen, 139
150 4 Diskussion wurde eine Immunfluoreszanalyse mit einem Antikörper gegen die an Serin 5 phosphorylierte Polymerase II durchgeführt. Diese aktive Form der Polymerase II ist nur an transkriptionell aktiven Chromatin zu finden [224] [2]. Hierbei zeigte sich, dass diese aktive Form der Polymerase II im XY-Body der Spoc1 +/+ -Meiozyten ein deutlich reduziertes Signal aufweist (vgl. Abb. 3.34), während in den Spoc1 -/- -Meiozyten hingegen homogen über den gesamten Nukleus verteilt ist. Die Ergebnisse dieser beiden Experimente zeigen deutlich, dass die MSCI in den Spoc1 -/- -Meiozyten nicht mehr korrekt abläuft Bildung des XY-Bodys und Induktion von Doppelstrangbrüchen Die Induktion von Doppelstrangbrüchen und die Bildung des XY-Bodys sind von essentieller Bedeutung für die Meiose und die MSCI. Die Induktion der Doppelstrangbrüche in der frühen Phase der Prophase 1 führt zu crossover-ereignissen, die für die Rekombination der paternalen und maternalen Chromosomen unerlässlich sind. Gleichzeitig sind die Doppelstrangbrüche für die korrekte Paarung und Segregation der Chromosomen wichtig [146]. Die Induktion des XY-Bodys, der ein subnukleoäres Kompartiment darstellt ist für die Inaktivierung der Geschlechtschromosomen essentiell [287]. Um zu untersuchen, ob es bei den Spoc1 -/- -Tieren zu einem Defekt bei der Bildung des XY-Bodys, der Induktion der Doppelstrangbrüche oder der Rekombination kommt, wurden Immunfluoreszenzanalysen mit unterschiedlichen Markern sowohl an Gewebeschnitten als auch an Meiozytenspreitungen durchgeführt. MRE11 (Meiotic Recombination 11 Homolog A (S. Cerevisiae)) ist ein nukleäres Protein, das eine Rolle bei homologer Rekombination, bei der Regulierung der Telomerlängen und bei der Reparatur von DNA-Doppelstrangbrüchen spielt [70]. Es wird als Marker für diese Prozesse verwendet. Der Marker Phospho-Histon H3 (H3S10p) stellt eine Histonmodifikation dar, die bei der Chromosomenkondensation während der Mitose und auch der Meiose wichtig ist [308]. Als wichtigster Marker für die Induktion von Doppelstrangbrüchen wurde der Marker γh2ax verwendet. Die Histonvariante H2AX erfährt bei DNA-Schäden eine Phosphorylierung an Serin 131 [15] und ist an der Ausbildung des XY-Bodys essentiell beteiligt [102]. Außerdem wurden Färbungen mit Komponenten des synaptonemalen Komplex durchgeführt. Dazu wurden die Proteine SCP3 und SCP1 verwendet. Bei keinem Markern konnten Unterschiede zwischen den Spoc1 +/+ - und den Spoc1 -/- - Tieren gefunden werden (vgl. Abb. 3.35), nur die Daten für γh2ax und SCP3 sind gezeigt). Dabei wurde auch untersucht, ob es bei den Gonosomen zu Paarungsdefekten kommt, wie es für die Lmna1 -/- beschrieben wurde [4]. Alsheimer et al. konnten zeigen, dass in 45 % der Lmna1 -/- -Tiere einen Paarungsdefekt in 45 % aller Pachytänzellen auftritt. Im Rahmen der vorliegenden Arbei zeigte sich in den Spoc1 -/- -Meiozyten ein Paarungsdefekt mit einer Frequenz von 0,9 % und liegt damit im selben Bereich wie die Spoc1 +/+ -Vergleichszellen. Da keiner dieser untersuchten Marker einen Unterschied zwischen den verschiedenen Genotypen zeigte, wurde davon ausgegangen, dass die vermehrte Apoptose nicht auf Defekten beruht, die sich auf die Induktion der Doppelstrangbrüche, DNA-Reparaturdefekte, Paarungsdefekte oder der Formation des XY-Bodys auswirken. Es wurde daher vermutet, dass die epigenetischen Silencing-Mechanismen, die die Aufrechterhaltung der Inaktivierung bewerkstelligen, beeinträchtigt sein könnten. 140
151 4.4 Der Knockdown von Spoc1 führt zu einer defekten MSCI Epigenetische Veränderungen während der MSCI Die MSCI geht mit einer gravierenden Umgestaltung des Chromatins einher. Insbesondere Histonmodifikationen und seltene Histonvarianten spielen hierbei eine große Rolle. Diese epigenetischen Mechanismen sind essentiell für die Aufrechterhaltung der Geninaktivierung auch über die Meiose hinaus [145]. Um zu untersuchen, ob epigenetische Veränderungen in den Spoc1 -/- -Meiozyten vorliegen, wurden Immunfluoreszenzanalysen an Spreitungen mit verschiedenen epigenetischen Markern durchgeführt. Diese umfassten Methyl- und Acetyl-Modifikationen des Histons H3, die Ubiquitinylierung von H2A an K119, und der Histonvarianten γh2ax. Veränderungen konnten für H3K27me2, H3K36me2/3, H3K9ac und H2AK119ub festgestellt werden. Diese Veränderungen sollen im Folgenden erläutert und in einem zusammenhängenden Kontext gebracht werden. Veränderungen der Histonmodifikation H3K27me2 Die Methylierung von H3K27 stellt in somatischen Zellen eine inaktivierende Modifikation dar, die durch den PRC2 vermittelt wird [222]. In den meiotischen Keimzellen zeigt die Dimethylierung an H3K27 ein weitgehend homogenes Signal, das in stark heterochromatischen Bereichen etwas geringer ist. In den Zellen des Pachytäns wird diese Modifikation aus dem XY-Body ausgeschlossen und zeigt diese Verteilung auch im anschließenden Diplotän. In den Meiozyten von Spoc1 -/- -Tieren ist dieser Ausschluss nicht mehr gewährleistet (vgl. Abb. 3.40) der XY-Body ist positive für H3K27me2. Die Trimethylierung an H3K27 ist normalerweise ebenfalls aus dem XY-Body ausgeschlossen [145]. Hier zeigt sich aber kein Unterschied zwischen Spoc1 -/- - und Wildtypzellen. Eine Veränderung der Methylierung an dieser Position ist bisher nur für die Trimethylierung beschrieben worden. So führt der Knockout des Gens Mdc1 (Mediator of DNA-Damage Checkpoint1) zu einem homogenen Signal des K3K27me3 und einem für H3K27me positiven XY-Body [145]. Bei diesem Mausmodell liegt ebenfalls ein Defekt in der MSCI vor. Hierbei ist allerdings zu bedenken, dass der in dieser Arbeit verwendete Antikörper gegen H3K27me3 (Anti-trimethyl Histone H3 (Lys27) Antibody ABE44; Millipore) auch in einem geringeren Maße mit H3K27me2 und H3K9me3 reagiert (siehe Anhang A.10). Da das Signal von H3K27me2 deutlich stärker ist als das der Trimethylierung (vgl. Abb. 3.24) könnte es hierbei also zu einer Überlagerung des Signals gekommen sein. Die Interpretation des im Rahmen dieser Arbeit erbrachten Ergebnisses zu H3K27me2 ist diffizil, da die Methylierung von H3K27 normalerweise mit einer transkriptionalen Inaktivierung von Genen einhergeht und bei den Spoc1 -/- -Zellen das Signal in den Pachytänzellen innerhalb des XY-Bodys zu finden ist, jedoch die anderen Ergebnisse eine fehlerhafte Inaktivierung zeigen. Möglicherweise hat die Dimethylierung von H3K27 während der Meiose eine von H3K27me3 unabhängige Funktion, die bisher noch nicht beschrieben wurde. Veränderungen der Histonmodifikation H3K36me2/3 Die Signale für die Di- und Trimethylierung von H3K36 zeigten eine Lokalisation im weniger dicht gepacktem Chromatin, waren in den frühen Phasen der Meiose stärker vorhanden 141
152 4 Diskussion und nahmen mit dem Übergang in das Pachytän ab. Außerdem waren beide Modifikationen während des Pachytäns aus dem XY-Body ausgeschlossen. In den Spoc1 -/- -Meiozyten hingegen zeigte sich, dass die Signale für H3K36me2/3 in einigen Pachytänzellen nicht mehr ausgeschlossen sind. So fand sich bei etwa der Hälfte der Zellen ein homogen verteiltes Signal im Zellkern. Im Allgemeinen sind Methylierungen an H3K36 mit offenen, aktiv transkribierten Chromatin assoziiert [197] und besitzen eine Funktion bei Histon- Crosstalk und der DNA-Reparatur [48] [103]. In S.cerevisiae konnte gezeigt werden, dass die Methylierung von H3K36 zu einer Reduzierung der Histonacetylierung führt [295]. Eine Rolle dieser Histonmodifikation während der Meiose von Mammaliern wurde bisher noch nicht beschrieben. Jedoch liegt die Tatsache, dass die Modifikation während der Meiose dynamisch reguliert wird, eine Bedeutung nahe. Im Modellorganismus C. elegans konnte gezeigt werden, dass der Knockout von MES-4, der H3K36 Methyltransferase in diesem Organismus, zu einem maternalen Defekt in den primordialen Keimzellen führt [107]. Auch in den Fadenwürmern gibt es interessanterweise einen Prozess, der zum Silencing der X-Chromosomen während der Meiose führt. MES-4 und sein Produkt H3K36me2/3 sind in C. elegans an den Autosomen angereichert aber nicht an den X-Chromosomen vorhanden. Der Verlust von MES-4 führt zur Reaktivierung der X-gebundene Gene in den Keimzellen [24]. Eine mögliche Funktion während der männlichen Meiose in Mammaliern könnte durch Histon-Crosstalk entstehen. Es konnte von Cai et al in murinen pluripotenten Stammzellen gezeigt werden, dass H3K36me3 durch den PRC2 erkannt werden kann und somit HK36me3 einen Einfluss auf die Methylierung an H3K27 an diesen Stellen haben kann [48]. Veränderungen der Histonmodifikation H3K9ac Die Acetylierung des Histons H3 an der Position Lysin 9 zeigt wie die Dimethylierung an dieser Position ein dynamisches Muster. Zu Anfang des Pachytäns sind die Gonosomen hyperacetyliert. Im Laufe des Pachytäns wird die Modifikation jedoch entfernt und eine Methylierung an dieser Position findet statt [158]. Somit ist in der späten Prophase H3K9ac nicht mehr im XY-Body vorhanden. Diese Transition von Hyperacetylierung zu Hypermethylierung könnte beträchtlich zur Aufrechterhaltung der transkriptionellen Inaktivierung beitragen. Die Histonmodifikation H3K9ac führt zu einer Auflockerung der Chromatinstruktur und aktiver Transkription. Insbesondere die Elongation des RNA- Polymerasekomplexes II ist abhängig von dieser Modifikation [149]. Bei den Spoc1 -/- - Tieren findet sich keine Reduktion des Acetylierungssignals am XY-Body, was zu einer fehlerhaften Transkriptionsaufrechterhaltung auf den Geschlechtschromosomen dieser Tiere passt. Denkbar wäre allerdings auch, dass der beobachtete Effekt, wie bei H3K9me2, auf der Verschiebung der Substadien der Prophase I (vgl. Abb. 3.36) hin zu den früheren Stadien in den Spoc1 -/- -Tieren beruht. Veränderungen der Histonmodifikation H2AK119ub Im Allgemeinen ist die Ubiquitinylierung des Histons H2 an Lysin 119 mit Transkriptionsinaktivierung verbunden [75] [301]. Es konnte gezeigt werden, dass diese Modifikation 142
153 4.4 Der Knockdown von Spoc1 führt zu einer defekten MSCI einen essentiellen Beitrag zur MSCI leistet [10]. In normalem Meiozyten ist diese Modifikation im Pachytänstadium deutlich am XY-Body lokalisiert [11]. Mäuse mit einer Defizienz für die E2-Ligase UBE2B zeigen, dass es bei fehlender Ubiquitinylierung von H2K119 zu einem Defekt in der Spermatogenese kommt, der sich in einer fehl regulierten MSCI und einer erhöhter Apoptoserate äußert [241] [9]. Auch in den homozygoten Spoc1 -Knockout- Mäusen zeigte sich eine deutliche Reduktion des Signals für H2AK119ub im XY-Body. Weiterführende Untersuchungen zeigten jedoch keine Reduktion der Ubiquitin konjugierenden Enzyme UBE2A (HR6A) und UBE2B (HR6B) (Daten nicht gezeigt). Eine wichtige Rolle bei der Ubiquitinylierung von Histon H2A nehmen die Polycomb Group Proteine ein. Diese vermitteln über verschiedene Histonmodikationen zusammen mit Proteinen der Trithorax-Gruppe den sogenannten bivalenten Chromatinstatus, bei dem sowohl aktivierende als auch inaktivierende Histonmodifikationen vorhanden sind (vgl. auch Kap ). Dieser Zustand des Chromatin ist inaktiv, kann jedoch durch das Entfernen der reprimierenden Modifikationen H2AK119ub und H3K27me3 schnell aktiviert werden [28]. Es ist denkbar dass ein ähnlicher Chromatinzustand bei der MSCI eine Rolle spielt, allerdings weist das Fehlen der Histonmodifikation H3K27me3 im XY-Body der Wildtyp-Meiozyten darauf hin, dass hier möglicherweise ein abgewandelter Histon-Code vorliegt, wie es bei der Spermatogenese im Allgemeinen vermutet wird [37]. Synergistische Wirkung der Histonmodifikationen Die Histonmodifikationen H3K27me2, H3K36me2/3 und H2AK119ub zeichnen sich durch einen gemeinsamen Crosstalk aus. Die Methylierung von H3K36 kann über PRC2 erkannt werden, welcher die Methylierung von H3K27 bewerkstelligt [48]. Das Vorhandensein des methylierten H3K27 kann zusammen mit PRC2 den PRC1 rekrutieren, welcher bei der Ubiquitinylierung von H2AK119 beteiligt ist [294]. Dies, zusammen mit der Tatsache, dass SPOC1 sowohl an H3K4me3 als auch an der PRC2-Komponente EZH2 binden kann [39] [256], stellt eine Verbindung zu bivalentem Chromatinstatus her. H3K4me3 ist in diesem Chromatinzustand als aktivierende Histonmodifikation ein Gegenpol zu den repressiven Modifikationen H3K27me3 und H2AK119ub und wird durch die Proteine der Trithorax-Familie eingefügt [198]. Gehen bei diesem Chromatinzustand die repressiven Modifikationen verloren erfolgt eine schnelle Aktivierung des Chromatins. Dieser bivalente Zustand des Chromatins ist für die Regulation von Entwicklungsgenen während verschiedener Differenzierungsprozesse essentiell. Eine abgewandelte Form dieses Regulationsmechanismus könnte bei der MSCI eine Rolle spielen, da die Modifikationen H3K4me3 und H2AK119ub im XY-Body lokalisiert sind. Hierbei ist die Methylierung an H3K27 jedoch normalerweise aus dem XY-Body ausgeschlossen. Bivalentes Chromatin ist für eine schnelle Aktivierung von Genen, insbesondere Entwicklungsgenen verantwortlich [28]. Auch nach dem Pachytän-Stadium ist auf den Geschlechtschromosomen eine schnelle Reaktivierung Spermatiden-spezifischer Gene notwendig [225]. Des weiteren spricht für einen solchen Mechanismus die Tatsache, dass der RNA-Polymerase II-Komplex an den Geschlechtschromosomen nicht in die Elogantion übergeht [158]. Weitergehende Untersuchungen mittels ChIP-Seq sollen Aufklärung bringen, ob tatsächlich bivalenter Chromatinstatus an den Gonosomen des Pachytänstadiums vorliegen. 143
154 4 Diskussion Besonders bemerkenswert ist, das Spoc1 in den meiotischen Zellen nicht exprimiert wird, sondern vielmehr in den undifferenzierten Vorläuferzellen (vgl. Kap ). Es stellt sich also die Frage, ob epigenetische Veränderungen schon in den undifferenzierten Spematogonien eingefügt werden, welche anschließend an die Tochterzellen weitergegeben werden und dann dort zu dem MSCI-Defekt führen. Dies soll im Folgenden als möglicher Wirkmechanismus von SPOC1 diskutiert werden. 4.5 Mögliche Modelle zu Wirkungsweise von SPOC1 Es konnte im Rahmen dieser Arbeit gezeigt werden, dass SPOC1 an einer Vielzahl von Differenzierungsprozessen beteiligt ist. Insbesondere die Spermatogenese, bei der eine exakte Balance zwischen Stammzellerhalt und Differenzierung sowie eine weitgehende Umstrukturierung des Chromatin wichtig sind, ist durch den Verlust von SPOC1 beeinträchtigt. SPOC1 ist in den undifferenzierten Spermatogonien des murinen Hodengewebes lokalisiert und zeigt keine Expression in meiotischen Zellen. Dies ist insbesondere deshalb von Bedeutung, da der eine Aspekt des Spermatogenesedefekts die erhöhte Apoptoserate in den Paxhytänzellen der Meiose betrifft. Somit sind von dem Defekt Zellen betroffen, die keine Expression des Gens aufweisen. Dies und das klonale Apoptosemuster (vgl. Kap ) weisen darauf hin, dass epigenetische Modifikationen von den Spoc1 exprimierenden Zellen an die meiotischen Zellen vererbt werden. SPOC1 scheint hierbei eine essentielle Rolle zu spielen. Im Folgenden soll ein Modell entwickelt werden, auf dessen Basis die Wirkung von SPOC1 erklärt werden kann. SPOC1 wird in den undifferenzierten Spermatogonien exprimiert und bindet dort an H3K4me3. Dort kann es über seine N-terminale Domäne zum einen multimerisieren und zum anderen den PRC2 über das Protein EZH2 rekrutieren [256]. Vermutlich geschieht dies an Stellen, an denen Entwicklungsgene unter dem Einfluss des bivalenten Chromatins stehen, da gezeigt werden konnte, dass in den Spoc1 -/- -Tieren während der Embryonalentwicklung insbesondere die Expression der Gene verändert waren, die einen solchen Chromatinstatus aufwiesen [184]. Dadurch wird der Chromatinzustand beeinflusst und es kommt zur korrekten Regulation - in diesem Fall vermutlich Repression - dieser Gene. Durch den Abbau von SPOC1 im weiteren Verlauf der Spermatogenese wird die Struktur des bivalenten Chromatins geändert und es kommt zur Expression der Differenzierungsgene. Mit Übergang von undifferenzierten zu differenzierten Spermatogonien nimmt die Expression von Spoc1 deutlich ab. Bei Verlust des Proteins sind nun zwei Szenarien denkbar: 1. Durch den Verlust von SPOC1 kommt es zu einer Fehlregulierung der Entwicklungsgene. Die Zellen gehen zu früh in weiter differenzierte Stadien über, in denen die epigenetischen Modifikationen noch nicht korrekt etabliert sind. Für den Übergang der undifferenzierten Spermatogonien in weiter differenzierte Zellen ist eine beträchtliche Anzahl an epigenitischen Veränderungen beschrieben worden [261]. Die Proteine der Transmigration der BTB werden hoch reguliert und die Zellen wandern ins adluminale Kompartiment obwohl sie dafür noch nicht reif sind. Die fehlenden epigenetischen Regulationsmechanismen führen dazu, dass die MSCI nicht 144
155 4.5 Mögliche Modelle zu Wirkungsweise von SPOC1 Abbildung 4.9 SPOC1 an bivalenten Chromatin SPOC1 kann über H3K4me3 und EZH2 an bivalentes Chromatin binden. Über nicht näher bestimmte Mechanismen übt SPOC1 eine reprimierende Funktion auf die RNA-Pol II aus. Es wird vermutet, dass dies über epigenetische Mechanismen abläuft. korrekt ablaufen kann und es kommt zur Apoptose im Pachytänstadium. Durch die Verschiebung der Balance zwischen Stammzellerhalt und Differenzierung kommt es dazu, dass der Stammzellpool mit der Zeit aufgebraucht wird, und es kommt zum Verlust der gesamten Keimzellen und zum Sertoli-Cell-Only Phänotyp. 2. Der Verlust von SPOC1 hat einen direkten Einfluss auf epigenetische Veränderungen, möglicherweise an bivalenten Chromatinabschnitten. Die Differenzierung erfolgt jedoch weitgehend normal. Bei der Meiose kommt es bei der Asynapsis der Gonosomen zu einem Defekt in der transkriptionellen Stilllegung, da die putativen, durch SPOC1 induzierten epigenetischen Veränderungen fehlen. Dies wird im Rahmen des Pachytän-Checkpoints erkannt und es kommt zur Apoptose während des Pachytänstadiums und zum Verlust der meiotischen Zellen. Dieser Verlust führt über einen Rückkopplungsmechanismus [29] [79] zu einer erhöhten Differenzierung der Stammzellen. Durch die erhöhte Differenzierungsaktivität werden die Gene, die für die Migration über die Blood-Testis-Barrier notwendig sind verstärkt exprimiert. Schließlich führt die Verschiebung der Stammzellerhaltungs- und Differenzierungsprozesse hin zur Differenzierung zum Verbrauch des Stammzellpools. Welche der beiden Hypothesen sich näher an der realen Wirkweise von SPOC1 befindet, konnte nicht abschließend geklärt werden. Jedoch ist davon auszugehen, dass die beiden Mechanismen, die diesen Hypothesen gemein sind - die Verschiebung der Balance zwischen Stammzellerhalt und Differenzierung und der Defekt in der MSCI (vgl. auch Abb. 4.10) - beides gleichermaßen wesentliche Bestandteile der Funktionsweise von SPOC1 sind. Die Theorie, dass der Wirkort von Spoc1 tatsächlich in den undifferenzierten Spermatogonien liegt, wird neben der Expression und Lokalisation des Proteins durch das klonale Apoptosemuster unterstützt (vgl. Kap ). Hierbei zeigte sich, dass die Meiozyten immer gruppenweise in die Apoptose übergehen und nicht wie bei anderen MSCI-Defekten statistisch verteilt vorliegen [167]. 145
156 4 Diskussion Abbildung 4.10 Mögliche Wirkungsweise zu SPOC1 Durch den Verlust von Spoc1 verschiebt sich die Balance zwischen Stammzellerhalt und Differenzierung, was schließlich zu einem Verlust der Keimzellen führt. Außerdem zeigen die SPOC1- defizienten Zellen einen Defekt in der MSCI, welche zur Reaktivierung der gonosomalen Gene und zur Apoptose der Pachytänzellen führt. 146
157 4.6 Ausblick 4.6 Ausblick Die Daten der vorliegenden Arbeit zeigen, dass SPOC1 eine wichtige Rolle in der epigenetischen Regulation von Entwicklungsprozessen - insbesondere der Spermatogenese - spielt. Um die Funktion dieses Proteins auf molekularer Ebene weiter aufzuklären, sind jedoch weiterführende Experimente notwendig. Das vorliegende Mausmodell bietet dafür viele Möglichkeiten. Geplante Versuche sollen aufklären, an welche Bereichen innerhalb des Genoms SPOC1 binden kann. Dazu sollen Versuche mittels der ChIP-Seq -Technologie durchgeführt werden, bei denen Histonmodifikationen vergleichend, über die verschiedenen Genotypen hinweg, untersucht werden. Dadurch können epigenetische Veränderungen an den Gonosomen in den undifferenzierten Spermatogonien untersucht werden, die in immunhistochemischen Untersuchungen nicht detektiert werden können. Des weiteren sollen weitere Histonmodifikationen und -varianten, die bei der MSCI eine Rolle spielen mittels immunhistochemischen Analysen an Meiozytenspreitungen untersucht werden. Dazu zählen z.b. die Varianten macroh2a1, H2AZ und die Histonmodifikation H4K20me2. Um die embryonalen Entwicklungsdefekte weiter zu charakterisieren, ist es notwendig ausführliche Untersuchungen an Embryopräparationen durchzuführen. Histologische Färbungen können hierbei Aufklärung über das Ausmaß der Defekte geben. Untersuchungen zur Apoptoserate könnten aufzeigen, ob es sich bei den Defekten tatsächlich um destruktive Prozesse handelt. Dies kann dann, mit Hilfe genomweiter Expressionsanalysen an Spoc1 +/+ - und Spoc1 -/- -Embryonen, Hinweise darauf geben, auf welche Signalwege der Knockout von Spoc1 während der Embryonalentwicklung einen Einfluss haben könnte. Neben Versuchen am vorliegenden Mausmodell bieten sich aber auch davon unabhängige Analysen an. So wäre es beispielsweise extrem interessant Interaktionspartner von SPOC1 zu identifizieren, z.b. mit Hilfe von Yeast-two-Hybrid -Experimenten und Co- IP -Analysen verifiziert werden. Die Identifikation von Interaktionspartnern kann einen wesentlichen Beitrag zur Aufklärung der Funktion eines Proteins beitragen. Weitere wichtige Versuche sind: Mittels RNAi sollen Knockdown-Experimente in eukaryotischen Zelllinien durchgeführt und der Verlust von SPOC1 auf zellulärer Ebene weiter aufgeklärt werden. Durch die bioinformatische Vernetzung der Next-Gen -Daten sollen in humanen Kohorten Mutationen im Gen SPOC1 gefunden werden und möglicherweise mit humanen Krankheitsbildern assoziiert werden. 147
158 Zusammenfassung Die Spermatogenese ist ein fein regulierter Prozess, in dem die männlichen Gameten generiert werden. Bei diesem Prozess durchlaufen die Keimzellen eine Vielzahl von Differenzierungsschritten, die für die Aufrechterhaltung der Spermatogenese essentiell sind. Ein wichtiger Schritt findet während der Meiose statt, während die homologen Chromosomen entlang ihrer Achse paaren und cross-over -Ereignisse induziert werden. Hierbei wird ungepaartes Chromatin bei dem Übergang von Zygotän- ins Pachytänstadium transkriptionell inaktiviert (meiotic silencing of unsynapsed Chromatin, MSUC). Ungepaartes, inaktiviertes Chromatin kann bei der Meiose zur Induktion von Apoptoseprozessen und damit zum Keimzellverlust und Infertilität führen. Bei der männlichen Meiose können die heterologen Gonosomen nur an der pseudoautosomalen Region (PAR) miteinander paaren, der Großteil der Gonosomen liegt ungepaart vor. Dies führt zu einer transkriptionellen Inaktivierung der Geschlechtschronosomen, was als meiotic sex chromosome inactivation (MSCI) während des Pachytäns erfolgt. Diese Inaktivierung ist ein essentieller Schritt in der männlichen Meiose von Säugetieren und wird über epigenetische Regulationsmechanismen gesteuert. Diese Mechanismen umfassen Histonmodifikation, den Austausch von Histone durch seltene Varianten und Chromatin remodeling. SPOC1 (PHF13 ) wurde ursprünglich als ein Gen identifiziert, dessen Expression mit der Überlebenszeit in einer Kohorte von Ovarialkarzinompatienten negativ korreliert war. SPOC1 hat eine Funktion in der Mitose und ist in allen proliferierenden Zellen basal exprimiert. In der vorliegenden Arbeit konnte gezeigt werden, dass Spoc1 stark in den undifferenzierten Spermatogonien des murinen Keimepithels exprimiert wird und der Verlust des Gens zu einer Infertilität in männlichen Mäusen führt. Die funktionelle Analyse dieser Spoc1 defizienten Mäuse mittels genomweiter Expressionsanalysen und Real Time- PCR zeigten deutlich, dass eine Defekt in der MSCI vorliegt. Die Bildung des XY-Bodys, welcher das subnukleäre Kompartiment der MSCI darstellt, schien in den Tieren jedoch normal zu verlaufen, was ein Hinweis dafür ist, dass möglicherweise epigenetische Mechanismen in den Defekt involviert sind. Immunfluoreszenz-Färbungungen an Spreitungen der Spoc1 -/- -Meiozyten zeigten, dass die Histonmodifikationen H3K27me, H3K36me2/3, H3K9ac, H3K27ac und H2AK119ub deutliche Unterschiede in den XY-Bodys aufwiesen. Die vorliegenden Daten weisen darauf hin, dass SPOC1, welches einen epigenetischen Reader der Histonmodifikation H3K4me3 darstellt, eine wichtige Rolle bei der MSCI spielt und damit für die Aufrechterhaltung der Spermatogenese unverzichtbar ist. Desweiteren konnte gezeigt werden, dass der Verlust von Spoc1 zu hoch variablen Defekten in der Embryonalentwicklung führten. Das Spektrum dieser Defekte reicht von milden Veränderungen des Schädels bis zu schwerwiegenden neuronalen Defekten, welche zu intrauterinen Letalität führen. Diese Entwicklungsdefekte zeigen, dass SPOC1 möglicherweise eine generelle Rolle bei der epigenetischen Regulation von Differenzierungsprozessen spielt. Die vorliegenden Daten deuten darauf hin, dass das Protein mit bivalenten Chromatin interagieren könnte, welches für die räumlich-zeitliche Regulation von Entwicklungsgenen und somit für viele Differenzierungsprozesse essentiell ist. 148
159 Summary Spermatogenesis is a highly regulated process producing male gametes. During this process the spermatogonial stem cells either renew or undergo various differentiation steps that are essential for sustained production of the sperm cells. One critical event takes place during meiosis of the spermatocytes, when the homologous chromosomes pair along their axes and cross-over events are induced. Unsynapsed Chromatin becomes transcriptionally inactive at the zygotene-pachytene stage (meiotic silencing of unsynapsed chromatin, MSUC) and may lead to germ cell loss via apoptosis resulting in male infertility. In male meiosis the heterologous sex chromosomes pair only at their short pseudoautosomal region (PAR), while the major parts of the chromosomes remain unsynapsed. The meiotic silencing of the sex chromosomes (MSCI) during pachytene is therefore an essential step during mammalian male meiosis, silencing unpaired chromatin. The process is highly regulated via epigenetic mechanisms involving histone modification, rare histone variants, and vast chromatin remodeling. SPOC1 (PHF13 ) was identified as a gene whose expression was negatively correlated with the survival time in a cohort of patients with ovarian cancer. The protein exhibits a function during mitosis and is expressed ubiquitously in all proliferating cells at a basal level. Here we could show that SPOC1 is highly abundant in the nuclei of undifferentiated spermatogonia of the murine testis and that the deletion of Spoc1 leads to male infertility in mice. Functional analyses of the Spoc1 -knockout mice using whole genome expression arrays and quantitative Real time-pcr demonstrated a defect in the silencing of the sex chromosomes during meiosis. Since the induction of the XY-body, the subnuclear compartment where MSCI takes place, appeared normal in the knockout mice, the increased level of transcription on the sex chromosomes indicates an epigenetic effect. Immunofluorescence experiments with meiocyte spreads showed specific changes of the histone modifications H3K27me2, H3K36me2/3, H3K9ac, H3K27ac and H2AK119ub within the XY-body of knockout cells. The present data demonstrate that SPOC1, which has been shown to be an epigenetic reader of H3K4me2/3, is essential for some aspects of the epigenetic program of MSCI and is thus required for sustained spermatogenesis. Furthermore, the knockout of Spoc1 in mice leads to highly variable defects in embryonic development processes, ranging from mild abnormalities of the cranium to severe neuronal defects resulting in embryonic lethality. This shows that SPOC1 is probably involved in the epigenetic regulation of cell differentiation in a more general manner. The presented data suggest that the protein may interact with bivalent chromatin, which is crucial for spacio-temporal regulation of differentiation genes and therefore important for various differentiation processes. 149
160 A Anhang Abbildung A.1 Überprüfung der RNA-Proben für den Microarray mittels Bioanalyzer Die RNA-Integrität wurde mit den 2100 Bioanalyzer Instrument von Agilent (Santa Clara, USA) überprüft. Abbildung A.2 Histogramme beider GeneChip-Analysen Die Histogramme zeigen eine einheitliche Verteilung der Signale in den verwendeten Geweben der unterschiedlichen Versuchstiere. Dies zeigt, dass eine hohe Vergleichbarkeit vorhanden ist. 150
161 Abbildung A.3 Hauptkomponentenanalyse beider GeneChip-Analysen Bei den Hauptkomponentenanalysen zeigte sich, dass jeweils die Tiere des gleichen Genotyps clustern und sich deutlich von den Tieren des anderen Genotyps abheben. Abbildung A.4 Ursachenquellen beider GeneChip-Analysen Als Hauptrsache für die unterschiedliche Signalstärke der GeneChip-Sonden konnte in beiden Analysen der Genotyp identifieziert werden. Bei der ersten Analyse spielte zusätzlich das Alter eine Rolle. 151
162 A Anhang Abbildung A.5 Pathway Express: Leukocyte transendothelial migration Die Analyse mittels Pathway-Express zeigte eine starke Assoziation des Knockout von Spoc1 mit dem Pathway Leukocyte transendothelial migration. 152
163 Abbildung A.6 Pathway Express: Cell adhesion Die Analyse mittels Pathway-Express zeigte eine starke Assoziation des Knockout von Spoc1 mit dem Pathway Cell adhesion. 153
Testis Nebenhoden Ductus deferens Prostata. Vorlesung Histologie. Die Studierenden sollen
 Kurstag 19 Männliche Geschlechtsorgane Themen Testis Nebenhoden Ductus deferens Prostata Lernziele Prüfungsrelevante Lerninhalte Männliche Geschlechtsorgane Hoden: Tubuli seminiferi, Keimepithel: Sertolizellen,
Kurstag 19 Männliche Geschlechtsorgane Themen Testis Nebenhoden Ductus deferens Prostata Lernziele Prüfungsrelevante Lerninhalte Männliche Geschlechtsorgane Hoden: Tubuli seminiferi, Keimepithel: Sertolizellen,
Modul Biologische Grundlagen Kapitel I.2 Grundbegriffe der Genetik
 Frage Was sind Fachbegriffe zum Thema Grundbegriffe der Genetik? Antwort - Gene - Genotyp - Phänotyp - Genom - Dexoxyribonucleinsäure - Träger genetischer Information - Nukleotide - Basen - Peptid - Start-Codon
Frage Was sind Fachbegriffe zum Thema Grundbegriffe der Genetik? Antwort - Gene - Genotyp - Phänotyp - Genom - Dexoxyribonucleinsäure - Träger genetischer Information - Nukleotide - Basen - Peptid - Start-Codon
Learn4Med. Ein Gen steuert die Haarfarbe einer Katze. Es gibt ein Allel (also eine Version) für ein schwarzes Fell und ein Allel für rote Haare.
 1. Mendelsche Regeln Bei Mendel ist ein Gen als Teil des Erbmaterials definiert, der für die Ausbildung eines bestimmten Merkmals verantwortlich ist. Gibt es für dieses Gen verschiedene Ausprägungen, nennt
1. Mendelsche Regeln Bei Mendel ist ein Gen als Teil des Erbmaterials definiert, der für die Ausbildung eines bestimmten Merkmals verantwortlich ist. Gibt es für dieses Gen verschiedene Ausprägungen, nennt
Epigenetische Regulierung
 Epigenetische Regulierung 1. Die epigenetische Regulierung der Transkription Dia 1. Die Struktur des Chromatins Nach der S-Phase des Zellzyklus gibt es in den Zellen ca. 4x1 Meter langen DNA, in 4x23 Stücke
Epigenetische Regulierung 1. Die epigenetische Regulierung der Transkription Dia 1. Die Struktur des Chromatins Nach der S-Phase des Zellzyklus gibt es in den Zellen ca. 4x1 Meter langen DNA, in 4x23 Stücke
Biologie für Mediziner WiSe 2007/08
 Biologie für Mediziner WiSe 2007/08 Praktikumsteilteil: Zellzyklus und Mitose (Zellteilung) Meiose (Reifeteilung) Leitung: PD Dr. Joachim Schachtner Folien zum download: http://web.uni-marburg.de/cyto
Biologie für Mediziner WiSe 2007/08 Praktikumsteilteil: Zellzyklus und Mitose (Zellteilung) Meiose (Reifeteilung) Leitung: PD Dr. Joachim Schachtner Folien zum download: http://web.uni-marburg.de/cyto
20 Männliche Geschlechtsorgane
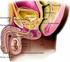 0 Männliche Geschlechtsorgane Hoden, Mensch, HE... -8 Hoden, Ratte, Semidünnschnitt, Toluidinblau,... 9 Nebenhoden, HE... 0- Funiculus spermaticus, HE...,5 Glandula vesiculosa, HE... 6-8 Prostata, HE...
0 Männliche Geschlechtsorgane Hoden, Mensch, HE... -8 Hoden, Ratte, Semidünnschnitt, Toluidinblau,... 9 Nebenhoden, HE... 0- Funiculus spermaticus, HE...,5 Glandula vesiculosa, HE... 6-8 Prostata, HE...
Biologie für Mediziner WS 2007/08
 Biologie für Mediziner WS 2007/08 Teil Allgemeine Genetik, Prof. Dr. Uwe Homberg 1. Endozytose 2. Lysosomen 3. Zellkern, Chromosomen 4. Struktur und Funktion der DNA, Replikation 5. Zellzyklus und Zellteilung
Biologie für Mediziner WS 2007/08 Teil Allgemeine Genetik, Prof. Dr. Uwe Homberg 1. Endozytose 2. Lysosomen 3. Zellkern, Chromosomen 4. Struktur und Funktion der DNA, Replikation 5. Zellzyklus und Zellteilung
Akzessorische Geschlechtsdrüsen ( lat. accessorius hinzukommend)
 Männliche Geschlechtsorgane Hoden (lat. Testis und gr. Orch) Nebenhoden (Epididymis, lat. Epi auf/oben didym Zwilling) Samenleiter (Ductus deferens, lat deferre herabführend) Akzessorische Geschlechtsdrüsen
Männliche Geschlechtsorgane Hoden (lat. Testis und gr. Orch) Nebenhoden (Epididymis, lat. Epi auf/oben didym Zwilling) Samenleiter (Ductus deferens, lat deferre herabführend) Akzessorische Geschlechtsdrüsen
5.Epigenetische Regulierung
 5.Epigenetische Regulierung Die Grundeinheit des Chromatins ist das Nukleosom DNA Linker DNA Nukleosom Kern DNS H1 10 nm 1. 30 nm Nukleosom Perle (4x2 Hyston Moleküle + 146 Paare Nukleotiden) 10 nm Strang
5.Epigenetische Regulierung Die Grundeinheit des Chromatins ist das Nukleosom DNA Linker DNA Nukleosom Kern DNS H1 10 nm 1. 30 nm Nukleosom Perle (4x2 Hyston Moleküle + 146 Paare Nukleotiden) 10 nm Strang
Genaktivierung und Genexpression
 Genaktivierung und Genexpression Unter Genexpression versteht man ganz allgemein die Ausprägung des Genotyps zum Phänotyp einer Zelle oder eines ganzen Organismus. Genotyp: Gesamtheit der Informationen
Genaktivierung und Genexpression Unter Genexpression versteht man ganz allgemein die Ausprägung des Genotyps zum Phänotyp einer Zelle oder eines ganzen Organismus. Genotyp: Gesamtheit der Informationen
1. Definition und Mechanismen
 Zusammenfassung 1. Definition und Mechanismen Epigenetik (von griechisch epi- über ) bezeichnet erbliche Veränderungen in der Genexpression, die nicht von Veränderungen in der DNA Sequenz (Mutationen)
Zusammenfassung 1. Definition und Mechanismen Epigenetik (von griechisch epi- über ) bezeichnet erbliche Veränderungen in der Genexpression, die nicht von Veränderungen in der DNA Sequenz (Mutationen)
Zelluläre Reproduktion: Zellzyklus. Regulation des Zellzyklus - Proliferation
 Zelluläre Reproduktion: Zellzyklus Regulation des Zellzyklus - Proliferation Alle Zellen entstehen durch Zellteilung Der Zellzyklus kann in vier Haupt-Phasen eingeteilt werden Interphase Zellwachstum;
Zelluläre Reproduktion: Zellzyklus Regulation des Zellzyklus - Proliferation Alle Zellen entstehen durch Zellteilung Der Zellzyklus kann in vier Haupt-Phasen eingeteilt werden Interphase Zellwachstum;
Skript zum Thema Epigenetik
 Skript zum Thema Epigenetik Name: Seite! 2 von! 14 Worum geht s hier eigentlich? Zelle Erbgut im Zellkern Organismus 1 Die genetische Information, die jeder Mensch in seinen Zellkernen trägt, ist in jeder
Skript zum Thema Epigenetik Name: Seite! 2 von! 14 Worum geht s hier eigentlich? Zelle Erbgut im Zellkern Organismus 1 Die genetische Information, die jeder Mensch in seinen Zellkernen trägt, ist in jeder
Von der DNA zum Eiweißmolekül Die Proteinbiosynthese. Ribosom
 Von der DNA zum Eiweißmolekül Die Proteinbiosynthese Ribosom Wiederholung: DNA-Replikation und Chromosomenkondensation / Mitose Jede Zelle macht von Teilung zu Teilung einen Zellzyklus durch, der aus einer
Von der DNA zum Eiweißmolekül Die Proteinbiosynthese Ribosom Wiederholung: DNA-Replikation und Chromosomenkondensation / Mitose Jede Zelle macht von Teilung zu Teilung einen Zellzyklus durch, der aus einer
Skript zum Thema Epigenetik
 Skript zum Thema Epigenetik Name: Seite! 2 von! 14 Worum geht s hier eigentlich? Zelle Erbgut im Zellkern Organismus 1 Die genetische Information, die jeder Mensch in seinen Zellkernen trägt, ist in jeder
Skript zum Thema Epigenetik Name: Seite! 2 von! 14 Worum geht s hier eigentlich? Zelle Erbgut im Zellkern Organismus 1 Die genetische Information, die jeder Mensch in seinen Zellkernen trägt, ist in jeder
3 Ergebnisse. 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren
 3 Ergebnisse 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren 76-120 Die Existenz verschiedener Isoformen von WT1 ist unter anderem auf die Verwendung einer für die Aminosäuren KTS kodierenden alternativen
3 Ergebnisse 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren 76-120 Die Existenz verschiedener Isoformen von WT1 ist unter anderem auf die Verwendung einer für die Aminosäuren KTS kodierenden alternativen
KV: DNA Michael Altmann
 Institut für Biochemie und Molekulare Medizin KV: DNA Michael Altmann Herbstsemester 2008/2009 Übersicht VL DNA 1.) Lernmittel 1-3 2.) Struktur der Doppelhelix 3.) Die 4 Bausteine der DNA 4.) Bildung eines
Institut für Biochemie und Molekulare Medizin KV: DNA Michael Altmann Herbstsemester 2008/2009 Übersicht VL DNA 1.) Lernmittel 1-3 2.) Struktur der Doppelhelix 3.) Die 4 Bausteine der DNA 4.) Bildung eines
Die Stille der Transkription. Mating-type switching in der Bäckerhefe. Heterochromatin in Drosophila (Entdeckung der Histon-Methyltransferasen)
 Die Stille der Transkription Mating-type switching in der Bäckerhefe Heterochromatin in Drosophila (Entdeckung der Histon-Methyltransferasen) 85 Kondensation größerer Chromatinbereiche zb. am Telomer 86
Die Stille der Transkription Mating-type switching in der Bäckerhefe Heterochromatin in Drosophila (Entdeckung der Histon-Methyltransferasen) 85 Kondensation größerer Chromatinbereiche zb. am Telomer 86
Zytologie, Zellteilung
 Biologie Zytologie, Zellteilung Zusammenfassungen Semesterprüfung Freitag, 17. Juni 2016 Zellbau Zelldifferenzierung Zellteilung (Zellzyklus, Mitose, Meiose) Marisa DESIGN + LAYOUT Steffi BIOLOGIE Zellbiologie
Biologie Zytologie, Zellteilung Zusammenfassungen Semesterprüfung Freitag, 17. Juni 2016 Zellbau Zelldifferenzierung Zellteilung (Zellzyklus, Mitose, Meiose) Marisa DESIGN + LAYOUT Steffi BIOLOGIE Zellbiologie
Evolution, Genetik und Erfahrung
 Chromosomen, Fortpflanzung und Genkopplung Entscheidende Entdeckung: Gene sind auf Chromosomen lokalisiert! 1 CHROMOSOM fadenförmige Strukturen im Kern der Zellen (wikipedia) Chromosomen in Körperzellen
Chromosomen, Fortpflanzung und Genkopplung Entscheidende Entdeckung: Gene sind auf Chromosomen lokalisiert! 1 CHROMOSOM fadenförmige Strukturen im Kern der Zellen (wikipedia) Chromosomen in Körperzellen
Einstieg: Fortpflanzung
 Einstieg: Fortpflanzung Wozu ist Sex gut? - Nachkommen werden gezeugt --> Erhalt der Spezies. - Es entstehen Nachkommen mit Merkmalen (z.b. Aussehen), die denen von Vater und Mutter ähneln. Beide Eltern
Einstieg: Fortpflanzung Wozu ist Sex gut? - Nachkommen werden gezeugt --> Erhalt der Spezies. - Es entstehen Nachkommen mit Merkmalen (z.b. Aussehen), die denen von Vater und Mutter ähneln. Beide Eltern
Hoden, Ovar. Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar
 Hoden, Ovar Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar Hoden Präparat 66 Färbung HE dichte kollagenfaserige Tunica albuginea Anschnitte des Tubulussystems Gefäß Hodenparenchym Rest
Hoden, Ovar Kurspräparate: Nr. 66 Hoden Nr. 67 Hoden Nr. 68 Ovar Nr. 69 Ovar Hoden Präparat 66 Färbung HE dichte kollagenfaserige Tunica albuginea Anschnitte des Tubulussystems Gefäß Hodenparenchym Rest
Nothing in Biology makes sense except in the light of evolution.
 Meine Referenz an Charles Darwin...ist ein Zitat von Theodosius Dobzhansky: Nothing in Biology makes sense except in the light of evolution. Collegium Generale, 18. März 2009 Genetik versus Epigenetik
Meine Referenz an Charles Darwin...ist ein Zitat von Theodosius Dobzhansky: Nothing in Biology makes sense except in the light of evolution. Collegium Generale, 18. März 2009 Genetik versus Epigenetik
GENETIK. für Studierende. Michaela Aubele. für Ahnungslose. Eine Einstiegshilfe. 2. Auflage. Dr. Michaela Aubele, München.
 Michaela Aubele GENETIK für Ahnungslose Eine Einstiegshilfe für Studierende 2. Auflage von Prof. Dr. Michaela Aubele, München Mit 52 Abbildungen und 33 Tabellen S. Hirzel Verlag die VII Vorwort V Kurzer
Michaela Aubele GENETIK für Ahnungslose Eine Einstiegshilfe für Studierende 2. Auflage von Prof. Dr. Michaela Aubele, München Mit 52 Abbildungen und 33 Tabellen S. Hirzel Verlag die VII Vorwort V Kurzer
C SB. Genomics Herausforderungen und Chancen. Genomics. Genomic data. Prinzipien dominieren über Detail-Fluten. in 10 Minuten!
 Genomics Herausforderungen und Chancen Prinzipien dominieren über Detail-Fluten Genomics in 10 Minuten! biol. Prin cip les Genomic data Dr.Thomas WERNER Scientific & Business Consulting +49 89 81889252
Genomics Herausforderungen und Chancen Prinzipien dominieren über Detail-Fluten Genomics in 10 Minuten! biol. Prin cip les Genomic data Dr.Thomas WERNER Scientific & Business Consulting +49 89 81889252
Konversion von Mesenchym zu Epithel durch Zelladhäsionsmoleküle
 Konversion von Mesenchym zu Epithel durch Zelladhäsionsmoleküle Entwicklung des Harnapparats Phylogenese Vorniere Pronephros Zyklostoma Urniere Mesonephros Fische, Amphibien Nachniere Metanephros Kriechtiere,
Konversion von Mesenchym zu Epithel durch Zelladhäsionsmoleküle Entwicklung des Harnapparats Phylogenese Vorniere Pronephros Zyklostoma Urniere Mesonephros Fische, Amphibien Nachniere Metanephros Kriechtiere,
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016
 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Vorbemerkung für die Erlangung des Testats: Bearbeiten Sie die unten gestellten Aufgaben
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Vorbemerkung für die Erlangung des Testats: Bearbeiten Sie die unten gestellten Aufgaben
Abbildung 1: Ein höheres Oberfläche/Volumen-Verhältnis begünstigt den Stoffaustausch
 4.2 Struktur und Aufbau von Zellen 1. Zellen sind mikroskopisch klein. Weshalb? Die Oberfläche einer Zelle muss im Verhältnis zu ihrem Volumen möglichst gross sein, damit der lebenswichtige Stoffaustausch
4.2 Struktur und Aufbau von Zellen 1. Zellen sind mikroskopisch klein. Weshalb? Die Oberfläche einer Zelle muss im Verhältnis zu ihrem Volumen möglichst gross sein, damit der lebenswichtige Stoffaustausch
Die Entschlüsselung des epigenetischen Codes. Einblicke in die Betriebsanleitung des menschlichen Genoms
 epigenetik 2 Die Entschlüsselung des epigenetischen Codes Einblicke in die Betriebsanleitung des menschlichen Genoms Prof. Dr. Albert Jeltsch, Institut für Biochemie, Universität Stuttgart 3 epigenetik
epigenetik 2 Die Entschlüsselung des epigenetischen Codes Einblicke in die Betriebsanleitung des menschlichen Genoms Prof. Dr. Albert Jeltsch, Institut für Biochemie, Universität Stuttgart 3 epigenetik
Praktikum Biologie für MedizinerInnen. Chromosomentheorie der Vererbung
 Praktikum Biologie für MedizinerInnen Chromosomentheorie der Vererbung Teil 1 Zellzyklus und Mitose Bei allen Eukaryoten erfolgt die Zellvermehrung durch mitotische Teilung. Nach der Wachstumsphase, in
Praktikum Biologie für MedizinerInnen Chromosomentheorie der Vererbung Teil 1 Zellzyklus und Mitose Bei allen Eukaryoten erfolgt die Zellvermehrung durch mitotische Teilung. Nach der Wachstumsphase, in
Männliche Geschlechtsorgane
 Männliche Geschlechtsorgane Hoden (Testis, Orchis) Samenwege - Nebenhoden (Epididymis) - Samenleiter (Ductus deferens) akzessorische Geschlechtsdrüsen - 2 Samenblasen (Gll. vesiculosae) - 1 Vorsteherdrüse
Männliche Geschlechtsorgane Hoden (Testis, Orchis) Samenwege - Nebenhoden (Epididymis) - Samenleiter (Ductus deferens) akzessorische Geschlechtsdrüsen - 2 Samenblasen (Gll. vesiculosae) - 1 Vorsteherdrüse
2. Übung: Chromosomentheorie
 Konzepte: 2. Übung: Chromosomentheorie Mitose/Meiose Geschlechtschromosomale Vererbung Chromosomentheorie Zellzyklus G 1 Phase: postmitotische Phase oder Präsynthesephase Zelle beginnt wieder zu wachsen
Konzepte: 2. Übung: Chromosomentheorie Mitose/Meiose Geschlechtschromosomale Vererbung Chromosomentheorie Zellzyklus G 1 Phase: postmitotische Phase oder Präsynthesephase Zelle beginnt wieder zu wachsen
Beschreiben Sie in Stichworten zwei der drei Suppressormutationen, die man in Hefe charakterisiert hat. Starzinski-Powitz, 6 Fragen, 53 Punkte Name
 Starzinski-Powitz, 6 Fragen, 53 Punkte Name Frage 1 8 Punkte Nennen Sie 2 Möglichkeiten, wie der Verlust von Heterozygotie bei Tumorsuppressorgenen (Z.B. dem Retinoblastomgen) zum klompletten Funktionsverlust
Starzinski-Powitz, 6 Fragen, 53 Punkte Name Frage 1 8 Punkte Nennen Sie 2 Möglichkeiten, wie der Verlust von Heterozygotie bei Tumorsuppressorgenen (Z.B. dem Retinoblastomgen) zum klompletten Funktionsverlust
Reifeteilung Arbeitsvideo / 2 Kurzfilme
 42 02516 Reifeteilung: Arbeitsvideo Seite 1 Reifeteilung Arbeitsvideo / 2 Kurzfilme VHS 42 02516 16 min Kurzbeschreibung Bei der sexuellen Fortpflanzung verschmilzt der Kern einer Eizelle mit dem einer
42 02516 Reifeteilung: Arbeitsvideo Seite 1 Reifeteilung Arbeitsvideo / 2 Kurzfilme VHS 42 02516 16 min Kurzbeschreibung Bei der sexuellen Fortpflanzung verschmilzt der Kern einer Eizelle mit dem einer
Chromosomen & Populationsgenetik (1)
 Übungsblatt Molekularbiologie und Genetik für Studierende der Bioinformatik II 1 Name des Studierenden: Datum: 1 Karyogramme Chromosomen & Populationsgenetik (1) Bestimmen Sie den Karyotyp der folgenden
Übungsblatt Molekularbiologie und Genetik für Studierende der Bioinformatik II 1 Name des Studierenden: Datum: 1 Karyogramme Chromosomen & Populationsgenetik (1) Bestimmen Sie den Karyotyp der folgenden
Molekulargenetik Biologie am Inhaltsverzeichnis Die Begriffe DNA, Nukleotid, Gen, Chromosom und Epigenom definieren...
 Molekulargenetik Inhaltsverzeichnis Die Begriffe DNA, Nukleotid, Gen, Chromosom und Epigenom definieren... 2 Beschreiben, wie die DNA aufgebaut ist... 3 Den Ablauf der Replikation erklären und dabei die
Molekulargenetik Inhaltsverzeichnis Die Begriffe DNA, Nukleotid, Gen, Chromosom und Epigenom definieren... 2 Beschreiben, wie die DNA aufgebaut ist... 3 Den Ablauf der Replikation erklären und dabei die
Warum sehen Kinder ihre Eltern ähnlich?
 Warum sehen Kinder ihre Eltern ähnlich? Du siehst aber deiner Mutter ähnlich! Sieh mal, er hat die Haare wie sein Vater! Du hast wirklich die Augen wie Mama und Oma! Diese oder ähnliche Sätze hat sicherlich
Warum sehen Kinder ihre Eltern ähnlich? Du siehst aber deiner Mutter ähnlich! Sieh mal, er hat die Haare wie sein Vater! Du hast wirklich die Augen wie Mama und Oma! Diese oder ähnliche Sätze hat sicherlich
Genexpressionsanalyse von DNA-Reparaturgenen in primären. Fibroblasten von Tumorpatienten mittels Real Time-PCR
 Aus dem Institut für Humangenetik der Universitätsmedizin der Johannes Gutenberg-Universität Mainz Genexpressionsanalyse von DNA-Reparaturgenen in primären Fibroblasten von Tumorpatienten mittels Real
Aus dem Institut für Humangenetik der Universitätsmedizin der Johannes Gutenberg-Universität Mainz Genexpressionsanalyse von DNA-Reparaturgenen in primären Fibroblasten von Tumorpatienten mittels Real
Untersuchungen zur differenziellen Genexpression im ZNS von Noradrenalintransporter-Knockout- und Wildtyp-Mäusen
 Untersuchungen zur differenziellen Genexpression im ZNS von Noradrenalintransporter-Knockout- und Wildtyp-Mäusen Inaugural-Dissertation zur Erlangung des Doktorgrades (Dr. rer. nat.) der Mathematisch-Naturwissenschaftlichen
Untersuchungen zur differenziellen Genexpression im ZNS von Noradrenalintransporter-Knockout- und Wildtyp-Mäusen Inaugural-Dissertation zur Erlangung des Doktorgrades (Dr. rer. nat.) der Mathematisch-Naturwissenschaftlichen
An den Chromatiden entstehen durch Anfärbung sichtbare Querbanden. Sie sind auf beiden Chromatiden gleich. (nur Autosome nicht Gonosome)
 Zusammenfassung / Vorbereitung auf Biologie Klausur Die Arme von Chromosomen werden unterteilt in: 1. kurzes Stück oben = p-arm 2. langes Stück unten = q-arm Die Arme der Chromosomen werden Chromatiden
Zusammenfassung / Vorbereitung auf Biologie Klausur Die Arme von Chromosomen werden unterteilt in: 1. kurzes Stück oben = p-arm 2. langes Stück unten = q-arm Die Arme der Chromosomen werden Chromatiden
Zellzyklus, Replikation und Chromosomen
 Zellzyklus, Replikation und Chromosomen Wiederholung: Größenverhältnisse im DNA-Molekül 3 5 Das größte menschliche Chromosom enthält 247 Millionen Basenpaare Moleküllänge: 8.4 cm Die Länge des gesamten
Zellzyklus, Replikation und Chromosomen Wiederholung: Größenverhältnisse im DNA-Molekül 3 5 Das größte menschliche Chromosom enthält 247 Millionen Basenpaare Moleküllänge: 8.4 cm Die Länge des gesamten
Definition: Zelle. Die Zelle ist die kleinste, für sich lebensfähige biologische Einheit
 Definition: Zelle Die Zelle ist die kleinste, für sich lebensfähige biologische Einheit Zellen einfache Gewebe zusammengesetzte Gewebe Organe Organsysteme Zellen: Unterschiede Form... Größe... Lebensdauer...
Definition: Zelle Die Zelle ist die kleinste, für sich lebensfähige biologische Einheit Zellen einfache Gewebe zusammengesetzte Gewebe Organe Organsysteme Zellen: Unterschiede Form... Größe... Lebensdauer...
Signale und Signalwege in Zellen
 Signale und Signalwege in Zellen Zellen müssen Signale empfangen, auf sie reagieren und Signale zu anderen Zellen senden können Signalübertragungsprozesse sind biochemische (und z.t. elektrische) Prozesse
Signale und Signalwege in Zellen Zellen müssen Signale empfangen, auf sie reagieren und Signale zu anderen Zellen senden können Signalübertragungsprozesse sind biochemische (und z.t. elektrische) Prozesse
In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit
 In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit in der Nucleotidsequenz der DNA verschlüsselt (codiert)
In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit in der Nucleotidsequenz der DNA verschlüsselt (codiert)
Struktur und Eigenschaften der DNA in Pro und Eukaryonten
 Struktur und Eigenschaften der DNA in Pro und Eukaryonten Bausteine von Nukleinsäuren: Nukleotide bestehen aus 3 Komponenten: C5-Zucker (RNA: D-Ribose, DNA: 2-Deoxy-D-ribose) Purin- und Pyrimidin-Basen
Struktur und Eigenschaften der DNA in Pro und Eukaryonten Bausteine von Nukleinsäuren: Nukleotide bestehen aus 3 Komponenten: C5-Zucker (RNA: D-Ribose, DNA: 2-Deoxy-D-ribose) Purin- und Pyrimidin-Basen
Genetik-Protokolle 1.Teil
 Naturwissenschaft Sabrina Engels Genetik-Protokolle 1.Teil 1 Genetisches Blockpraktikum für Lehramt SII im Hauptstudium 1. Woche vom 18.2-23.2.2002 Cytogenetischer Teil - Chromosomen Gliederung. 1. Präparation
Naturwissenschaft Sabrina Engels Genetik-Protokolle 1.Teil 1 Genetisches Blockpraktikum für Lehramt SII im Hauptstudium 1. Woche vom 18.2-23.2.2002 Cytogenetischer Teil - Chromosomen Gliederung. 1. Präparation
1 Regeln der Vererbung
 1 Regeln der Vererbung Natura Genetik 1 Regeln der Vererbung Lösungen zu den Aufgaben Seiten 6 7 1.1 Eltern geben genetisches Material weiter 1 Erstelle einen möglichen Karyogrammausschnitt für ein weiteres
1 Regeln der Vererbung Natura Genetik 1 Regeln der Vererbung Lösungen zu den Aufgaben Seiten 6 7 1.1 Eltern geben genetisches Material weiter 1 Erstelle einen möglichen Karyogrammausschnitt für ein weiteres
Posttranskriptionale Veränderungen der Genexpression bei hereditären Erkrankungen
 Posttranskriptionale Veränderungen der Genexpression bei hereditären Erkrankungen Dissertation zur Erlangung des Doktorgrades Dr. rer. nat. des Fachbereichs Biologie, Chemie, Pharmazie der Freien Universität
Posttranskriptionale Veränderungen der Genexpression bei hereditären Erkrankungen Dissertation zur Erlangung des Doktorgrades Dr. rer. nat. des Fachbereichs Biologie, Chemie, Pharmazie der Freien Universität
Mündliche Themen: aus der Grundanforderungen
 Mündliche Themen: aus der Grundanforderungen 1 - Sie ziehen Themen aus derselben Liste wegen der ungelungenen Klausuren- 1. Die wichtigsten Eigenschaften des Kohlenstoffes und Wassers im Hinsicht des Lebens
Mündliche Themen: aus der Grundanforderungen 1 - Sie ziehen Themen aus derselben Liste wegen der ungelungenen Klausuren- 1. Die wichtigsten Eigenschaften des Kohlenstoffes und Wassers im Hinsicht des Lebens
Es ist die Zeit gekommen, zu verstehen, wie es zur Proteinbiosynthese kommt?! Wobei jeweils eine AS von 3 Basen codiert wird..
 Proteinbiosynthese Es ist die Zeit gekommen, zu verstehen, wie es zur Proteinbiosynthese kommt?! Alle Proteine, sind über die DNA codiert Wobei jeweils eine AS von 3 Basen codiert wird.. GENETISCHER CODE
Proteinbiosynthese Es ist die Zeit gekommen, zu verstehen, wie es zur Proteinbiosynthese kommt?! Alle Proteine, sind über die DNA codiert Wobei jeweils eine AS von 3 Basen codiert wird.. GENETISCHER CODE
Transkription Teil 2. - Transkription bei Eukaryoten -
 Transkription Teil 2 - Transkription bei Eukaryoten - Inhalte: Unterschiede in der Transkription von Pro- und Eukaryoten Die RNA-Polymerasen der Eukaryoten Cis- und trans-aktive Elemente Promotoren Transkriptionsfaktoren
Transkription Teil 2 - Transkription bei Eukaryoten - Inhalte: Unterschiede in der Transkription von Pro- und Eukaryoten Die RNA-Polymerasen der Eukaryoten Cis- und trans-aktive Elemente Promotoren Transkriptionsfaktoren
3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung
 3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung Transkriptionsfaktoren erfahren oft eine posttranslationelle Modifikation in Form von Phosphorylierung und werden dadurch in ihrer Aktivität
3.2 Posttranslationelle Modifikation von Wt1 durch Phosphorylierung Transkriptionsfaktoren erfahren oft eine posttranslationelle Modifikation in Form von Phosphorylierung und werden dadurch in ihrer Aktivität
Die Entwicklung von B Lymphozyten
 Die Entwicklung von B Lymphozyten Die Entwicklung von B Lymphozyten Übersicht Gliederung I II III IV Stammzellen im Knochenmark VDJ Rekombination Positive Selektion Negative Selektion I Stammzellen im
Die Entwicklung von B Lymphozyten Die Entwicklung von B Lymphozyten Übersicht Gliederung I II III IV Stammzellen im Knochenmark VDJ Rekombination Positive Selektion Negative Selektion I Stammzellen im
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die klassische Genetik: T.H. Morgan und seine Experimente mit Drosophila melanogaster Das komplette Material finden Sie hier: Download
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die klassische Genetik: T.H. Morgan und seine Experimente mit Drosophila melanogaster Das komplette Material finden Sie hier: Download
Transkription und Translation sind in Eukaryoten räumlich und zeitlich getrennt. Abb. aus Stryer (5th Ed.)
 Transkription und Translation sind in Eukaryoten räumlich und zeitlich getrennt Die Initiation der Translation bei Eukaryoten Der eukaryotische Initiationskomplex erkennt zuerst das 5 -cap der mrna und
Transkription und Translation sind in Eukaryoten räumlich und zeitlich getrennt Die Initiation der Translation bei Eukaryoten Der eukaryotische Initiationskomplex erkennt zuerst das 5 -cap der mrna und
Übungsaufgaben zum Zellzykler 1/5 Jahrgangsstufe
 Übungsaufgaben zum Zellzykler 1/5 Jahrgangsstufe 9 + 11 Übungsaufgaben zum Kapitel Genetik mit Hilfe des Lernprogramms Zellzykler Tipp: Vergleiche auf der KGA-Biologie-Unterrichtsmaterialseite im Lehrplan
Übungsaufgaben zum Zellzykler 1/5 Jahrgangsstufe 9 + 11 Übungsaufgaben zum Kapitel Genetik mit Hilfe des Lernprogramms Zellzykler Tipp: Vergleiche auf der KGA-Biologie-Unterrichtsmaterialseite im Lehrplan
Wie steuern Zellen ihren Zellzyklus? Prof. Dr. Ulrike Spörhase-Eichmann Pädagogische Hochschule Freiburg
 Wie steuern Zellen ihren Zellzyklus? Prof. Dr. Ulrike Spörhase-Eichmann Pädagogische Hochschule Freiburg Lehrziele Sie sollen eine Vorstellung von den verschiedenen Phasen des Zellzyklus erlangen erkennen,
Wie steuern Zellen ihren Zellzyklus? Prof. Dr. Ulrike Spörhase-Eichmann Pädagogische Hochschule Freiburg Lehrziele Sie sollen eine Vorstellung von den verschiedenen Phasen des Zellzyklus erlangen erkennen,
Ausbildung zum Bienenwirtschaftsmeister Mai 2012 Christian Boigenzahn
 Einführung in die Grundlagen der Genetik Ausbildung zum Bienenwirtschaftsmeister Mai 2012 Christian Boigenzahn Molekularbiologische Grundlagen Die Zelle ist die grundlegende, strukturelle und funktionelle
Einführung in die Grundlagen der Genetik Ausbildung zum Bienenwirtschaftsmeister Mai 2012 Christian Boigenzahn Molekularbiologische Grundlagen Die Zelle ist die grundlegende, strukturelle und funktionelle
Mechanismen der Pasteurella multocida Toxin vermittelten Modulation des Osteoimmunsystems
 Mechanismen der Pasteurella multocida Toxin vermittelten Modulation des Osteoimmunsystems Gutachter Prof. Dr. Alexander Dalpke Prof. Dr. Ralf Bartenschlager Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung
Mechanismen der Pasteurella multocida Toxin vermittelten Modulation des Osteoimmunsystems Gutachter Prof. Dr. Alexander Dalpke Prof. Dr. Ralf Bartenschlager Inhaltsverzeichnis 1 Zusammenfassung 1 2 Einleitung
Charakterisierung von CD25+ regulatorischen T Zellen
 Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
Charakterisierung von CD25+ regulatorischen T Zellen Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.) eingereicht im Fachbereich Biologie, Chemie,
KATA LOGO Biologie - Genetik - Vom Chromosom zum Gen
 KATA LOGO Biologie - Genetik - Vom Chromosom zum Gen Bild 1 Ausdehnung eines Chromosoms (C) 1. Besteht aus Chromatin. Das ist die DNS + Proteine 2. Chromosomen liegen im Zellkern 3. Menschliche Körperzellen
KATA LOGO Biologie - Genetik - Vom Chromosom zum Gen Bild 1 Ausdehnung eines Chromosoms (C) 1. Besteht aus Chromatin. Das ist die DNS + Proteine 2. Chromosomen liegen im Zellkern 3. Menschliche Körperzellen
5. Selbstreplikation wie funktioniert Replikation bei natürlichen Organismen?
 5. Selbstreplikation wie funktioniert Replikation bei natürlichen Organismen? Grundlagen der Genetik Grundvorstellung: Bauplan des Organismus gespeichert in DNA-Molekülen, diese werden repliziert DNA als
5. Selbstreplikation wie funktioniert Replikation bei natürlichen Organismen? Grundlagen der Genetik Grundvorstellung: Bauplan des Organismus gespeichert in DNA-Molekülen, diese werden repliziert DNA als
Vorwort Seite 4. Einleitung Seite 5. Kapitel I: Zelluläre Grundlagen der Vererbung Seiten 6 28 VORSCHAU. Kapitel II: Vom Gen zum Merkmal Seiten 29 35
 Inhalt Vorwort Seite 4 Einleitung Seite 5 Kapitel I: Zelluläre Grundlagen der Vererbung Seiten 6 28 Vergleich Tier- und Planzenzelle Aufbau des Zellkerns Chromosomen Zellteilungsvorgänge Mitose Zellteilungsvorgänge
Inhalt Vorwort Seite 4 Einleitung Seite 5 Kapitel I: Zelluläre Grundlagen der Vererbung Seiten 6 28 Vergleich Tier- und Planzenzelle Aufbau des Zellkerns Chromosomen Zellteilungsvorgänge Mitose Zellteilungsvorgänge
AlgoBio WS 16/17 Protein-DNA Interaktionen ChiP-Seq Datenanalyse. Annalisa Marsico
 AlgoBio WS 16/17 Protein-DNA Interaktionen ChiP-Seq Datenanalyse Annalisa Marsico 6.02.2017 Protein-DNA Interaktionen Häufig binden sich Proteine an DNA, um ihre biologische Funktion zu regulieren. Transkriptionsfaktoren
AlgoBio WS 16/17 Protein-DNA Interaktionen ChiP-Seq Datenanalyse Annalisa Marsico 6.02.2017 Protein-DNA Interaktionen Häufig binden sich Proteine an DNA, um ihre biologische Funktion zu regulieren. Transkriptionsfaktoren
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Zur Progesteron-abhängigen Differenzierung von Endometrium- und Brustkrebs-Zellen: Molekulare Konzepte und Implikationen für die Klinik
 Aus dem Institut für Anatomie und Reproduktionsbiologie des Universitätsklinikums Aachen (Direktor: Universitätsprofessor Dr. med. Dr. rer. nat. Henning M. Beier) Zur Progesteron-abhängigen Differenzierung
Aus dem Institut für Anatomie und Reproduktionsbiologie des Universitätsklinikums Aachen (Direktor: Universitätsprofessor Dr. med. Dr. rer. nat. Henning M. Beier) Zur Progesteron-abhängigen Differenzierung
Gewebeprotektive Eigenschaften von. lnterleukin-22 in der Leber
 Gewebeprotektive Eigenschaften von lnterleukin-22 in der Leber Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie der Johann
Gewebeprotektive Eigenschaften von lnterleukin-22 in der Leber Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften vorgelegt beim Fachbereich Biochemie, Chemie und Pharmazie der Johann
Was ist der Promotor? Antwort: Eine spezielle Nucleotidsequenz auf der DNA, an der die RNA-Polymerase bindet um die Transkription zu starten.
 Was ist der Promotor? Antwort: Eine spezielle Nucleotidsequenz auf der DNA, an der die RNA-Polymerase bindet um die Transkription zu starten. Wie bezeichnet man den Strang der DNA- Doppelhelix, der die
Was ist der Promotor? Antwort: Eine spezielle Nucleotidsequenz auf der DNA, an der die RNA-Polymerase bindet um die Transkription zu starten. Wie bezeichnet man den Strang der DNA- Doppelhelix, der die
Genexpressionsregulation
 Genexpressionsregulation Genexpressionsregulation Different tissue types 1 2 3 4 5 6 7 8 Taken from Caron et al., 2001 Verschiedene Ebenen der Genexpressionsregulation Epigenetic mechanisms Transkriptionskontrolle
Genexpressionsregulation Genexpressionsregulation Different tissue types 1 2 3 4 5 6 7 8 Taken from Caron et al., 2001 Verschiedene Ebenen der Genexpressionsregulation Epigenetic mechanisms Transkriptionskontrolle
Die Connexine Cx33 und Cx43 werden in der Retina der Ratte tageszeitlich reguliert
 Aus dem Institut für Funktionelle und Klinische Anatomie der Universitätsmedizin der Johannes Gutenberg-Universität Mainz Die Connexine Cx33 und Cx43 werden in der Retina der Ratte tageszeitlich reguliert
Aus dem Institut für Funktionelle und Klinische Anatomie der Universitätsmedizin der Johannes Gutenberg-Universität Mainz Die Connexine Cx33 und Cx43 werden in der Retina der Ratte tageszeitlich reguliert
Lsd1 weist Stammzellen im Mausembryo den richtigen Weg
 Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/lsd1-weist-stammzellen-immausembryo-den-richtigen-weg/ Lsd1 weist Stammzellen im Mausembryo den richtigen Weg Die
Powered by Seiten-Adresse: https://www.gesundheitsindustriebw.de/de/fachbeitrag/aktuell/lsd1-weist-stammzellen-immausembryo-den-richtigen-weg/ Lsd1 weist Stammzellen im Mausembryo den richtigen Weg Die
VORANSICHT II/B2. Studien an eineiigen Zwillingen. Der zweite Code die DNA ist nicht die ganze Antwort Reihe 13 Verlauf Material S 4
 S 4 M 2 Studien an eineiigen Zwillingen Was ist für die Unterschiede bei eineiigen Zwillingen verantwortlich? Aufgaben 1. Fassen Sie die Informationen des Textes zusammen. 2. Wie sind die im Text beschriebenen
S 4 M 2 Studien an eineiigen Zwillingen Was ist für die Unterschiede bei eineiigen Zwillingen verantwortlich? Aufgaben 1. Fassen Sie die Informationen des Textes zusammen. 2. Wie sind die im Text beschriebenen
Der Zellzyklus und mögliche Störungen durch chemische Substanzen
 Teil 2 Der Zellzyklus und mögliche Störungen durch chemische Substanzen Aplasie Hemmung der Zellzyklusprogression Gesteigerte oder unkontrollierte Zellzyklusprogression Hyperplasie Karzinogenese Proliferierende
Teil 2 Der Zellzyklus und mögliche Störungen durch chemische Substanzen Aplasie Hemmung der Zellzyklusprogression Gesteigerte oder unkontrollierte Zellzyklusprogression Hyperplasie Karzinogenese Proliferierende
Charakterisierung der mirna-expression im großzellig anaplastischen T-Zell-Lymphom
 Charakterisierung der mirna-expression im großzellig anaplastischen T-Zell-Lymphom Dissertation der Mathematisch-Naturwissenschaftlichen Fakultät der Eberhard Karls Universität Tübingen zur Erlangung des
Charakterisierung der mirna-expression im großzellig anaplastischen T-Zell-Lymphom Dissertation der Mathematisch-Naturwissenschaftlichen Fakultät der Eberhard Karls Universität Tübingen zur Erlangung des
Pinschertage der OG Bonn Grundlagen der Zucht
 Pinschertage der OG Bonn 31.05. - 01.06.2008 Grundlagen der Zucht von Ralf Wiechmann Der Phänotyp Ist die Gesamtheit der wahrnehmbaren Merkmale eines Organismus. das äußere Erscheinungsbild das Aussehen,
Pinschertage der OG Bonn 31.05. - 01.06.2008 Grundlagen der Zucht von Ralf Wiechmann Der Phänotyp Ist die Gesamtheit der wahrnehmbaren Merkmale eines Organismus. das äußere Erscheinungsbild das Aussehen,
Wiederholung Dissimilation; biologische Oxidation; Atmung Hydrolyse der Stärke; Endo- ( -Amylase) und Exoamylasen ( -Amylase) Phosphorolyse der Stärke
 Wiederholung Dissimilation; biologische Oxidation; Atmung Hydrolyse der Stärke; Endo- ( -Amylase) und Exoamylasen ( -Amylase) Phosphorolyse der Stärke Wiederholung 1. Glukoseaktivierung 2. Glykolyse 3.
Wiederholung Dissimilation; biologische Oxidation; Atmung Hydrolyse der Stärke; Endo- ( -Amylase) und Exoamylasen ( -Amylase) Phosphorolyse der Stärke Wiederholung 1. Glukoseaktivierung 2. Glykolyse 3.
Eukaryontische DNA-Bindedomänen
 1. Viele eukaryotische (und auch prokaryotische) Transkriptionsfaktoren besitzen eine DNA-bindende Domäne, die an eine ganz bestimmte DNA- Sequenz binden kann. Aufgrund von Ähnlichkeiten in der Struktur
1. Viele eukaryotische (und auch prokaryotische) Transkriptionsfaktoren besitzen eine DNA-bindende Domäne, die an eine ganz bestimmte DNA- Sequenz binden kann. Aufgrund von Ähnlichkeiten in der Struktur
Pharmazeutische Biologie WS2011/2012. Das neue Paradigma: Personalisierte Medizin
 3. Vorlesung Pharmazeutische Biologie WS2011/2012 Das neue Paradigma: Personalisierte Medizin Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt
3. Vorlesung Pharmazeutische Biologie WS2011/2012 Das neue Paradigma: Personalisierte Medizin Prof. Theo Dingermann Institut für Pharmazeutische Biologie Biozentrum Max-von Laue-Str. 9 60438 Frankfurt
B-Zellentwicklung. Grundlagen der Immunologie 5. Semester - Dienstags Uhr Ruhr-Universität Bochum, HMA 20 HEV.
 Grundlagen der Immunologie 5. Semester - Dienstags 11.15 Uhr Ruhr-Universität Bochum, HMA 20 B-Zellentwicklung Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu T und B Zellen zirkulieren unablässig durch
Grundlagen der Immunologie 5. Semester - Dienstags 11.15 Uhr Ruhr-Universität Bochum, HMA 20 B-Zellentwicklung Albrecht Bufe www.ruhr-uni-bochum.de/homeexpneu T und B Zellen zirkulieren unablässig durch
Die Entwicklung der Keimbahn. wahrend der Embryogenese von Caenorhabditis elegans
 Die Entwicklung der Keimbahn wahrend der Embryogenese von Caenorhabditis elegans Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des
Die Entwicklung der Keimbahn wahrend der Embryogenese von Caenorhabditis elegans Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des
Eline Biedermann (Autor) Untersuchungen zur Charakterisierung von Prenyltransferasen aus Hypericum-Arten nach Expression in Nicotiana benthamiana
 Eline Biedermann (Autor) Untersuchungen zur Charakterisierung von Prenyltransferasen aus Hypericum-Arten nach Expression in Nicotiana benthamiana https://cuvillier.de/de/shop/publications/7653 Copyright:
Eline Biedermann (Autor) Untersuchungen zur Charakterisierung von Prenyltransferasen aus Hypericum-Arten nach Expression in Nicotiana benthamiana https://cuvillier.de/de/shop/publications/7653 Copyright:
Characterization o f glioblastoma stem cells upon. triggering o f CD95
 Aus dem Deutschen Krebsforschungszentrum Heidelberg Direktor (kommissarisch): Prof. Dr. rer. nat. Michael Boutros Abteilung für Molekulare Neurobiologie Abteilungsleiterin Prof. Dr. med. Ana Martin-Villalba
Aus dem Deutschen Krebsforschungszentrum Heidelberg Direktor (kommissarisch): Prof. Dr. rer. nat. Michael Boutros Abteilung für Molekulare Neurobiologie Abteilungsleiterin Prof. Dr. med. Ana Martin-Villalba
Mesonephros: Bildung der Urnierentubuli. Urogenitalsystem
 Mesonephros: Bildung der Urnierentubuli Urogenitalsystem Entwicklung der Nachnieren Urogenitalsystem * intermediäres Mesoderm Stiel wird zum Ureter * Urogenitalsystem Harnblase und Harnröhre a) 32. Tag:
Mesonephros: Bildung der Urnierentubuli Urogenitalsystem Entwicklung der Nachnieren Urogenitalsystem * intermediäres Mesoderm Stiel wird zum Ureter * Urogenitalsystem Harnblase und Harnröhre a) 32. Tag:
(Molekulare-) Zytogenetik
 (Molekulare-) Zytogenetik numerische Chromosomenaberrationen autosomale Aneuploidien Trisomie 13: Pätau-Syndrom (47,XX+13) Trisomie 18: Edwards-Syndrom (47,XY+18) Trisomie 21: Down-Syndrom (47,XX+21) gonosomale
(Molekulare-) Zytogenetik numerische Chromosomenaberrationen autosomale Aneuploidien Trisomie 13: Pätau-Syndrom (47,XX+13) Trisomie 18: Edwards-Syndrom (47,XY+18) Trisomie 21: Down-Syndrom (47,XX+21) gonosomale
F2 aus der Kreuzung mit der ersten Mutante: 602 normal, 198 keine Blatthaare
 Klausur Genetik Name: Matrikelnummer: Sie haben 90 Minuten Zeit zur Bearbeitung der 23 Fragen (z. T. mit Unterpunkten). Insgesamt sind 42 Punkte zu vergeben. Die Klausur gilt als bestanden, falls 21 Punkte
Klausur Genetik Name: Matrikelnummer: Sie haben 90 Minuten Zeit zur Bearbeitung der 23 Fragen (z. T. mit Unterpunkten). Insgesamt sind 42 Punkte zu vergeben. Die Klausur gilt als bestanden, falls 21 Punkte
I. Inhaltsverzeichnis I. II. Abbildunqsverzeichnis. III. Tabellenverzeichnis. IV. Abkürzunasverzeichnis. V. Zusammenfassung XIII. 1.
 I. Inhaltsverzeichnis I II. Abbildunqsverzeichnis III. Tabellenverzeichnis IV. Abkürzunasverzeichnis VII IX X V. Zusammenfassung XIII VI. Abstract XVIII 1. Einleitung 1 1.1 Zielstellung der Arbeit 1 1.2
I. Inhaltsverzeichnis I II. Abbildunqsverzeichnis III. Tabellenverzeichnis IV. Abkürzunasverzeichnis VII IX X V. Zusammenfassung XIII VI. Abstract XVIII 1. Einleitung 1 1.1 Zielstellung der Arbeit 1 1.2
The auxin-insensitive bodenlos mutation affects primary root formation and apicalbasal patterning in the Arabidopsis embryo
 The auxin-insensitive bodenlos mutation affects primary root formation and apicalbasal patterning in the Arabidopsis embryo Thorsten Hamann, Ulrike Mayer and Gerd Jürgens The Arabidopsis BODENLOS gene
The auxin-insensitive bodenlos mutation affects primary root formation and apicalbasal patterning in the Arabidopsis embryo Thorsten Hamann, Ulrike Mayer and Gerd Jürgens The Arabidopsis BODENLOS gene
Proteinbiosynthese: Transkripion:
 Proteinbiosynthese: - Basensequenz der DNA wird in die Basensequenz der RNA übersetzt (Transkription) - Übersetzen der mrna in die spezifische Aminosäuresequenz (Translation) - Bei Eukaryoten sind Transkription
Proteinbiosynthese: - Basensequenz der DNA wird in die Basensequenz der RNA übersetzt (Transkription) - Übersetzen der mrna in die spezifische Aminosäuresequenz (Translation) - Bei Eukaryoten sind Transkription
Bioinformatik I: Grundlagen der Gentechnik
 Bioinformatik I: Grundlagen der Gentechnik Dr. Maik Böhmer Institut für Biologie und Biotechnologie der Pflanzen Schlossplatz 7 Schwerpunkte: Vorlesung 1: Einführung & Enzyme der Gentechnik Vorlesung 2:
Bioinformatik I: Grundlagen der Gentechnik Dr. Maik Böhmer Institut für Biologie und Biotechnologie der Pflanzen Schlossplatz 7 Schwerpunkte: Vorlesung 1: Einführung & Enzyme der Gentechnik Vorlesung 2:
27 Funktionelle Genomanalysen Sachverzeichnis
 Inhaltsverzeichnis 27 Funktionelle Genomanalysen... 543 27.1 Einleitung... 543 27.2 RNA-Interferenz: sirna/shrna-screens 543 Gunter Meister 27.3 Knock-out-Technologie: homologe Rekombination im Genom der
Inhaltsverzeichnis 27 Funktionelle Genomanalysen... 543 27.1 Einleitung... 543 27.2 RNA-Interferenz: sirna/shrna-screens 543 Gunter Meister 27.3 Knock-out-Technologie: homologe Rekombination im Genom der
Evolution und Entwicklung
 Evolution und Entwicklung Wie aus einzelnen Zellen die Menschen wurden: Phylogenese Klassische Genetik: Mendel Moderne Genetik: Watson & Crick Wie aus einer einzigen Zelle ein Mensch wird: Ontogenese Vererbung
Evolution und Entwicklung Wie aus einzelnen Zellen die Menschen wurden: Phylogenese Klassische Genetik: Mendel Moderne Genetik: Watson & Crick Wie aus einer einzigen Zelle ein Mensch wird: Ontogenese Vererbung
DIE ROLLE DER HISTONACETYLIERUNG FÜR DEN HISTON-PROTAMIN-AUSTAUSCH WÄHREND DER SPERMIOGENESE VON MENSCH UND MAUS VIOLETTA SONNACK
 DIE ROLLE DER HISTONACETYLIERUNG FÜR DEN HISTON-PROTAMIN-AUSTAUSCH WÄHREND DER SPERMIOGENESE VON MENSCH UND MAUS VIOLETTA SONNACK INAUGURAL-DISSERTATION zur Erlangung des Grades eines Dr. Med. vet. beim
DIE ROLLE DER HISTONACETYLIERUNG FÜR DEN HISTON-PROTAMIN-AUSTAUSCH WÄHREND DER SPERMIOGENESE VON MENSCH UND MAUS VIOLETTA SONNACK INAUGURAL-DISSERTATION zur Erlangung des Grades eines Dr. Med. vet. beim
Der Träger aller genetischen Informationen ist die D N A - Desoxyribonucleic acid (Desoxyribonucleinsäure, DNS)
 N U C L E I N S Ä U R E N Der Träger aller genetischen Informationen ist die D N A - Desoxyribonucleic acid (Desoxyribonucleinsäure, DNS) BAUSTEINE DER NUCLEINSÄUREN Die monomeren Bausteine der Nucleinsäuren
N U C L E I N S Ä U R E N Der Träger aller genetischen Informationen ist die D N A - Desoxyribonucleic acid (Desoxyribonucleinsäure, DNS) BAUSTEINE DER NUCLEINSÄUREN Die monomeren Bausteine der Nucleinsäuren
7. Variabilität. Die Variabilität
 Die Variabilität DIA 48 Variabilität Zwischen Mitgliedern der Populationen gibt es phänotypische Unterschiede. Mit Ausnahme der eineiigen Zwillinge gibt es keine identischen Individuen. Die phänotypische
Die Variabilität DIA 48 Variabilität Zwischen Mitgliedern der Populationen gibt es phänotypische Unterschiede. Mit Ausnahme der eineiigen Zwillinge gibt es keine identischen Individuen. Die phänotypische
...-Arg-Met-Phe-Ala-Asn-His-Lys-Ser-Val-Gly-...
 1. Im Enzym Xase, das aus einer Polypeptidkette aus 300 Aminosäuren besteht, findet sich in der Region der Aminosäuren 40-50 die folgende Aminosäurensequenz:...-Arg-Met-Phe-Ala-Asn-His-Lys-Ser-Val-Gly-...
1. Im Enzym Xase, das aus einer Polypeptidkette aus 300 Aminosäuren besteht, findet sich in der Region der Aminosäuren 40-50 die folgende Aminosäurensequenz:...-Arg-Met-Phe-Ala-Asn-His-Lys-Ser-Val-Gly-...
IV. Übungsaufgaben für die Jahrgangstufe 9 & 10
 IV. Übungsaufgaben für die Jahrgangstufe 9 & 10 Von der Erbanlage zum Erbmerkmal: 34) Welche Aufgaben haben Chromosomen? 35) Zeichne und benenne die Teile eines Chromosoms, wie sie im Lichtmikroskop während
IV. Übungsaufgaben für die Jahrgangstufe 9 & 10 Von der Erbanlage zum Erbmerkmal: 34) Welche Aufgaben haben Chromosomen? 35) Zeichne und benenne die Teile eines Chromosoms, wie sie im Lichtmikroskop während
