Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ANBI/BIOL. Musterlösung
|
|
|
- Christa Rothbauer
- vor 5 Jahren
- Abrufe
Transkript
1 Prüfungen Analytische Chemie Montag, 10. März 2003 Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ANBI/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36. Die Maximalnote wird mit mindestens 30 Punkten erreicht. Zeit: 60 Minuten. Teilen Sie sich Ihre Zeit gut ein! Unleserliche Texte, unklare Formulierungen oder unsaubere Skizzen können nicht bewertet werden. Bitte bemühen Sie sich um eine saubere Darstellung. Beginnen Sie jede Aufgabe auf einem neuen Blatt und schreiben Sie jedes abzugebende Blatt einzeln mit Ihrem Namen an. Dieses Deckblatt ist ausgefüllt abzugeben. Die Aufgabenstellung ist ebenfalls einzureichen. Wir bitten Sie um Fairness und wünschen Ihnen viel Erfolg!
2
3 1 Aufgabe 1 10 Punkte Auf den folgenden Seiten finden Sie die IR-, Massen-, 1 H-NMR- und 13 C-NMR-Spektren der Verbindung Q50 mit der relativen Molmasse M r = 161. Sie weist folgende Konstitution auf: S H N Q50 Zusätzlich zum gewöhnlichen 1 H-NMR-Spektrum (Spektrum A) finden Sie ein zweites 1 H- NMR-Spektrum (Spektrum B), das nach einer Vorbehandlung der Probe aufgenommen wurde: Die Lösung der Substanz Q50 in CD 3 wurde mit einer grossen Menge D 2 während einigen Stunden geschüttelt. Danach wurde die wässrige Phase abpipettiert. Mit der verbleibenden Lösung wurde das Spektrum B aufgenommen. Einige Hinweise zu den Spektren: Im Massenspektrum von Q50 sind ausschliesslich einfach positiv geladene Ionen sichtbar. Die Kopplungen der amidartigen N H-Protonen mit anderen Protonen sind im 1 H-NMR- Spektrum sichtbar, wenn der Abstand zu den Kopplungspartnern höchstens 3 Bindungen beträgt. Amidartige N H-Protonen koppeln mit dem benachbarten 14 N-Kern. Dadurch wird das Signal dieser Protonen im 1 H-NMR-Spektrum stark verbreitert und ihre Feinstruktur ist dadurch nicht mehr sichtbar. Dieser Effekt hat keinen Einfluss auf andere Protonen. a) Rationalisieren Sie den Basispeak m/z = 43 im Massenspektrum! Nehmen Sie dazu die Fragmentierungsregeln zur Hilfe! (2 Punkte) Sie kennen nur Regeln über direkte Fragmentierungen von Einfachbindungen. Die folgende Fragmentierung ist die einzige, die zu einem Bruchstück mit der Masse 43 führt, S H N
4 2 Regel IV besagt, dass die zweite Bindung neben einem Heteroatom bevorzugt bricht. In diesem Fall: =C N. Das -Atom steuert die Fragmentierung. Wenn eine Bindung zwischen einem C-Atom und einem Heteroatom bricht, bleibt die Ladung gemäss Regel V bevorzugt auf der C-Seite. In diesem Fall erhält das Fragment mit der Masse 43 die Ladung und ist somit im Spektrum sichtbar. b) Nennen Sie mindestens zwei eindeutige Argumente, dass das Fragment mit m/z = 43 im Massenspektrum kein Schwefelatom enthält! (2 Punkte) 1. Die Masse des häufigsten S-Isotops beträgt 32. Wenn das Fragment mit der Masse 43 Schwefel enthält, muss der Rest von 11 durch andere Atome von Q50 erklärt werden. Die einzige Möglichkeit sind 11 H-Atome. Dies ergäbe ein Fragment mit der Zusammensetzung SH 11 + : Unsinn. 2. Im Schwefel kommt das Isotop mit der Masse 34 zu 4.5 % (bezogen auf 100 % 32 S) vor. Wenn das Fragment mit der Masse 43 Schwefel enthält, erscheint notwendigerweise auch die Masse 45 mit einer Intensität von mindestens 4.5 % der Intensität von 43. Da 43 der Basispeak ist, also auf die Intensität 100 % normiert ist, müsste die Masse 45 mit einer absoluten Intensität von mindestens 4.5 % (Skala links) erscheinen. Man findet die Masse 45 tatsächlich, aber mit einer Intensität von weniger als 3 %. c) Erklären Sie die Unterschiede zwischen den beiden 1 H-NMR-Spektren A und B! Was hat die Behandlung mit D 2 bewirkt? Zeichnen Sie die Strukturformel der Verbindung Q50 nach der Behandlung! Rationalisieren Sie die Kopplungsmuster vor und nach der Behandlung! (3 Punkte) Die Behandlung mit D 2 hat das amidartige H-Atom verschwinden lassen. Das Signal bei 6.3 ppm im Spektrum A, das von diesem H stammt, ist im Spektrum B nicht mehr vorhanden. Das Signal bei 3.4 ppm, das im Spektrum A als 4-Liniensystem erscheint, weist im Spektrum B nur noch 3 Linien auf. Einer der ursprünglichen Nachbarn muss verschwunden sein. Durch das Schütteln mit D 2 wurde das amidartige H gegen Deuterium ausgetauscht: S D N 3.4 ppm
5 3 d) Im Vergleich zu anderen Carbonylverbindungen erscheint die Bande bei 1670 cm 1 relativ breit, besonders an der Spitze. Was für einen Grund könnte diese Verbreiterung haben? (2 Punkte) 1. Die Verbindung Q50 weist zwei Carbonylgruppen auf, die nicht die gleiche chemische Umgebung haben und daher auch nicht die gleiche Frequenz haben müssen. Es erscheinen also zwei Banden im Spektrum, die in diesem Fall aber so nahe beieinander liegen, dass nur eine Bandenverbreiterung resultiert. 2. Die Einfachbindungen in den Gruppierungen =C S und =C N weisen infolge von Konjugation mit der C=-Gruppe einen gewissen Doppelbindungscharakter auf. Dadurch ist die Rotation um diese Bindungen gehemmt. Daraus resultieren jeweils zwei bevorzugte planare Anordnungen der Carbonylumgebung. Im IR-Spektrum sieht man daher ein "Gemisch" von Konformeren, die leicht unterschiedliche Lagen für die Carbonylbanden aufweisen. 3. Moleküle mit Carbonylgruppen und polaren X H-Gruppen (X:,N,S...) bilden leicht Dimere über Wasserstoffbrücken C=...H X. Dadurch wird die Carbonylgruppe gestört. Ihre Frequenz ist nicht mehr klar definiert. Dies bewirkt eine Bandenverbreiterung. Hinweis: Erklärung 1 dürfte die richtige sein. Auch die zweite könnte einen Einfluss haben, Die dritte widespricht meiner Erfahrung. Entscheidend ist aber für die Prüfung nicht die Wahrheit, (die wir oft selbst nicht kennen) sondern eine plausible Argumentation. Daher wurden alle drei Erklärungen als richtig angesehen. e) In den 1 H-NMR-Spektren finden Sie bei 7.3 ppm ein kleines Signal. Es stammt vom Lösungsmittel. Wie kommt dieses Signal zustande? (1 Punkt) In einem 1 H-NMR-Experiment sieht man nur Protonen direkt als Signale. Kopplungspartner bestimmen zwar das Aufspaltungsmuster der Signale, aber ohne Protonen kann kein Signal erscheinen. Das zur Diskussion stehende Signal muss also von Protonen stammen. Käufliche deuterierte Lösungmittel sind typischerweise zu 99.8 % deuteriert. Die restlichen Moleküle enthalten Protonen, die für das kleine Signal bei 7.3 ppm verantwortlich sind.
6 4 IR: Perkin-Elmer Modell 125 Q50 aufgenommen in CH 3 Schichtdicke 0.1 mm 100 [%] [cm 1] 500 MS: EI, 70 ev 100 % M : m/z
7 5 1 H-NMR: 60 MHz, aufgenommen in CD 3 Q50 Spektrum A ppm 0 Spektrum B ppm 0
8 6 13 C-NMR: Q50 50 MHz, breitbandentkoppelt, aufgenommen in CD 3 CH CH CH CH C 96.0 C 170.3
9 7 Aufgabe 2 8 Punkte Für die Verbindung Q50 werden die alternativen Konstitutionen 1-4 vorgeschlagen. Finden Sie für jede Alternative mindestens zwei spektroskopische Argumente, die gegen sie sprechen. (maximal 2 Punkte pro Alternative) H Q50 S N 1 N H Wie soll der Basispeak (m/z=43) im MS entstehen? Es gibt kein amidartiges H: wie soll im Spektrum B ein Signal verschwinden? Es gibt kein amidartiges H: wie soll im Spektrum B ein Signal sein Aufspaltungsmuster verändert haben? Wie soll ein 4-Liniensystem im Spektrum A entstehen? Welche Protonen haben 3 Nachbarn? In 13 C-NMR-Spektrum sind je zwei CH 3 -, CH 2 -, und C-Gruppen bezeichnet. Bei Alternative 1 würde man nur eine C-, dafür aber eine CH-Grupe erwarten. 2 H N S Wie soll der Basispeak (m/z=43) im MS entstehen? Wo ist die Bande der H-Streckschwingung im IR-Spektrum bei ca cm 1? Es gibt kein amidartiges H: wie soll im Spektrum B ein Signal verschwinden? Es gibt kein amidartiges H: wie soll im Spektrum B ein Signal sein Aufspaltungsmuster verändert haben? Wie soll ein 4-Liniensystem im Spektrum A entstehen? Weiche Protonen haben 3 Nachbarn?
10 8 3 H N Wie soll der Basispeak (m/z=43) im MS entstehen? Es gibt kein weiteres, absolut disqualifizierendes Argument. Die chemische Verschiebung der beiden CH 3 -Gruppen wären grösser als jene der CH 2 - Gruppen, sowohl im 1 H- als auch im 13 C-NMR-Spektrum (gilt als zwei Argumente). 4 H N Die CH 2 -Gruppe neben dem amidartigen N hat nur das Proton der Amidgruppe als Nachbar. Es sollte also im Spektrum A als Dublett erscheinen. Die CH 2 -Gruppe neben dem amidartigen N hat nur das Proton der Amidgruppe als Nachbar. Es sollte also im Spektrum B als Singlett erscheinen, da das Molekül dieses Proton nicht mehr enthält, mithin keinen Nachbar hat.
11 9 Aufgabe 3 6 Punkte Das Regenwasser im Zentrum der Stadt Zürich weist oftmals grössere Konzentrationen an Säuren auf, besonders nach einer längeren niederschlagsfreien Periode. Der ph-wert liegt deutlich unter 7. Dafür sind hauptsächlich die unten aufgeführten Mineralsäuren verantwortlich, die ihren Ursprung in den Abgasen von Fahrzeugen, Kehrichtverbrennungsanlagen, Raumheizungen und anderen Quellen haben. Es finden sich auch kleine Mengen an organischesäuren im Regenwasser. Sie haben die Aufgabe, die genannten Säuren quantitativ zu bestimmen. Die Kohlensäure H 2 C 3 stammt aus gelöstem C 2 und kann nicht als Schadstoff bezeichnet werden. Auf ihre Bestimmung kann notfalls verzichtet werden. Säuren im Regenwasser: H HN 3 HN 2 H 2 S 4 H 2 S 3 H 2 C 3 xalsäure Malonsäure Bernsteinsäure Ameisensäure Essigsäure HC CH HC CH 2 CH HC CH 2 CH 2 CH H CH CH 3 CH Was ist eine Säure? Säuren dissoziieren zu H + und dem entsprechenden Anion. Das Unterscheidungsmerkmal zwischen verschiedenen Säuren im wässriger Lösung ist also das Anion. a) Schlagen Sie eine Methode zur Trennung und Quantifizierung der Säuren vor! Welchen Detektor setzen Sie ein? Trennmethode der Wahl: Ionenchromatographie. Leitfähigkeitsdetektor. Wenn man Carbonat als Elektrolyt verwendet, kann dieses unmittelbar vor dem Detektor durch einen mit H + beladenen Kationenaustauscher in Kohlensäure umgewandelt werden. Letztere zerfällt sofort in H 2 und C 2. Durch diese Massnahme wird die Leitfähigkeit des Laufmittels stark erniedrigt (Suppression). Natürlich kann die Kohlensäure im Regenwasser dann nicht bestimmt werden. b) Ist eine Vorbehandlung des Regenwassers notwendig? Durch ein Mikrofilter filtrieren, um die Säule vor Kontaminationen zu schützen. c) Können Sie alle aufgeführten Säuren in einem einzigen Analysengang quantifizieren? Ja. Die Anionen sind wasserlöslich, Die Unterscheidung zwischen anorganisch und organisch ist nicht nötig. Hinweis: Auch andere Vorschläge wurden als richtig beurteilt. Es wurden gaschromatographische Verfahren vorgeschlagen, die nicht alle aufgeführten Ionen erfassen können. Insbesondere sind die Dicarbonsäuren xal-, Malon- und Bernsteinsäure sowie die Schwefelsäure nicht genügend flüchtig, also gaschromatographisch nicht zu erfassen. In Punkt c) wurde also die gegenteilige Ansicht als richtig anerkannt.
12 10 Aufgabe 4 12 Punkte In jüngster Zeit wurden bei Routineuntersuchungen in einer Grundwasserfassung zur Produktion von Trinkwasser erhöhte Konzentrationen von chlorierten Kohlenwasserstoffen festgestellt. In unmittelbarer Nähe der Fassung befindet sich ein ehemaliger Produktionsbetrieb, in dem bis 1963 die unten dargestellten Insektizide in grossen Mengen hergestellt wurden. S Aldrin Endosulfan Dieldrin Endrin Es besteht der Verdacht, dass Rückstände der Produktion, die möglicherweise illegal auf dem Werksgelände oder in seiner Umgebung deponiert wurden, ins Erdreich eingedrungen sind und nun das Grundwasser erreicht haben. Sie haben die Aufgabe, die vier genannten Substanzen im Trinkwasser und im Erdreich der ehemaligen Produktionsstätte nachzuweisen und zu quantifizieren. Dazu steht Ihnen je ein Gramm der reinen Insektizide zur Verfügung. In der Literatur haben Sie auch eine Methode zur Trennung der fraglichen Substanzen gefunden (nächste Seite). Sie haben die Säule DB beschafft und können damit die Methode nachvollziehen.
13 11 European Red List Semivolatiles Column: Carrier: ven: Injector: Detector: DB m length, mm i.d., 0.5 µm film Helium at 35 cm/s, measured at 40 C 40 C for 2 min C at 12 /min 325 C for 2 min splitless, 250 C 1µl of ng/µl standards in methanol mass selective, 280 C transfer line full scan at m/z Time (min) 1 Chlorotoluene 9 Lindane 2 1,2,4-Trichlorobenzene 10 Malathion 3 Hexachlorobutadiene 11 Aldrin 4 Dichlorvos 12 Endosulfan 5 Trifluralin 13 Dieldrin 6 Simazine 14 Endrin 7 Atrazine 15 p,p'-ddt 8 Pentachlorophenol 16 Azinphos methyl
14 12 a) Wie würden Sie die gegebene Methode auf Ihr spezielles Trennproblem ausrichten? Sehen Sie Möglichkeiten, Verbesserungen vorzunehmen? Welche? Was versprechen Sie sich von den jeweiligen Veränderungen? Welche Schwierigkeiten würden Sie sich möglicherweise dadurch einhandeln? Die vier fraglichen Insektizide eluieren im Chromatogramm nach mehr als 20 Minuten innerhalb von weniger als 3 Minuten. Das Temperaturprogramm ist auf die Trennung aller aufgeführten Substanzen ausgerichtet, was im gegebenen Fall nicht nötig ist. Man erhöht also die Anfangstemperatur auf z. B Vermutlich ist sogar ein isothermer Betrieb bei z. B. 310 möglich. Dadurch erspart man sich die Wartezeit durch das Abkühlen und Konditionieren des fens nach einem Experiment. b) Sie besitzen keinen massenselektiven Detektor. Schlagen Sie einen anderen Detektor vor! Begründen Sie Ihre Wahl! Bei welchen Schwierigkeiten würden Sie dennoch die Beschaffung des teuren Massenspektrometers erwägen? Was sind die besonderen Vorteile eines massenselektiven Detektors in der gegebenen Situation? Die vier zu trennenden Substanzen enthalten jeweils 6 Halogenatome im Molekül. Der Detektor der Wahl ist der ECD (Electron Capture Detector). Er ist besonders empfindlich auf Halogene. Er ist dem FID (Flame Ionization Detector) in diesem Fall deutlich überlegen. Nachteil: Es ist damit zu rechnen, dass bei der Produktion der Insektizide viele andere Halogenverbindungen entstanden, die noch immer auf dem ehemaligen Werksgelände und auch im Grundwasser vorhanden sind, Zudem könnten innerhalb der 40 Jahre seit dem Ende der Produktion vielfältige Abbaureaktionen abgelaufen sein, die die Anzahl der Verbindungen noch erhöht hat. Es ist daher mit einer Vielfalt von Verunreinigungen zu rechnen, für die der ECD empfindlich ist. Dadurch könnte die Quantifizierung der vier Insektizide erschwert bis verunmöglicht werden. Wenn eine genügende Trennung der Insektizide von anderen Verbindungen durch Variation der Versuchsbedingungen nicht erreicht werden kann, müsste allenfalls doch ein massenselektiver Detektor eingesetzt werden. Im MS der Insektizide kann dann eine prominent erscheinende Masse ausgesucht und als einzige detektiert werden. Dadurch werden die meisten anderen Substanzen für den Detektor unsichtbar und müssen demnach auch nicht von den Insektiziden getrennt werden. c) Sie erwarten Konzentrationen von einigen Mikrogramm Insektizid pro Liter Trinkwasser. Wie isolieren Sie die Insektizide aus dem Wasser? Kann man allenfalls das Trinkwasser ohne Aufarbeitung direkt in den Gaschromatographen einspritzen? Wie sehen Sie die Chancen, mit einer HPLC-Methode zum Ziel zu gelangen? Trinkwasser enthält nichtflüchtige Salze, die bei direkter Einspritzung das Trennsystem verschmutzen können. Dadurch müsste man den Einspritzblock regelmässig reinigen. Eine Quantifizierung ohne Anreicherung der Insektizide im Trinkwasser ist infolge der kleinen Konzentration sehr schwierig. Zur Anreicherung kann man z. B. einen Liter Wasser mehrfach mit 20 ml eines apolaren Lösungsmittels wie Hexan ausschütteln. Die gesammelten Hexanfraktionen können dann eingedampft und durch eine definierte Menge Lösungsmittel, z. B. 1 ml, wieder aufgenommen
15 13 werden. Dadurch kann man die Konzentration der Insektizide um einen Faktor 1000 erhöhen und die nichtflüchtigen Anteile des Wassers fast vollständig entfernen. Eine weitere Möglichkeit der Anreicherung besteht darin, eiwa einen Liter Trinkwasser durch eine kleine Säule zu schicken, die die glaiche Phase enthält, wie eine HPLC-Säule (reversed phase). Alle apolaren Bestandteile des Wassers bleiben auf der Säule haften, insbesondere auch die gesuchten Insektizide. Nach dem Trocknen der Säule werden die Insektizide mit einem apolaren Lösungsmittel ausgewaschen. (Diese Methode steht nicht im Manuskript, wurde aber in einer Übung vorgestellt.) Eine HPLC-Methode hat kaum eine Chance. Die gängigen HPLC-Säulen erreichen bei weitem nicht die Trennleistung einer GC-Kapillarsäule. Zudem besteht ein Detektionsproblem. Man müsste wohl ein MS einsetzen, um die nötige Selektivität und Empfindlichkeit zu erreichen. Die Kopplung HPLC-MS ist zwar eine etablierte Analysenmethode, kann aber nicht als Routinemethode bezeichnet werden. Eine massive Anreicherung wäre unabdingbar. Zur Quantifizierung: Es ist nicht möglich, die gesamte in der Probe vorhandene Menge Insektizid zu extrahieren. Ein Teil geht immer verloren. Man kann diesen Anteil bestimmen, indem man eine künstliche Probe mit einer bekannten Menge der Insektizide zubereitet und die Aufarbeitung durchführt: man bestimmt die Wiederfindungsrate. Die Kalibration kann auf verschiedene Arten durchgeführt werden. Man kann eine Lösung mit einer bekannten Konzentration der Insektizide in Hexan herstellen und in den GC einspritzen. Man kann aber auch der Probe eine bekannte Menge Insektizid zusetzen (Aufstocken, Standard- Addition) und dann aufarbeiten. Dies ist zwar aufwendiger, erspart aber die Bestimmung der Wiederfindungsrate, die zudem Schwankungen unterworfen sein kann. d) Sie erwarten Konzentrationen von einigen Milligramm Insektizid pro Kilogramm Erdreich. Schlagen Sie Methoden vor, die Erdprobe aufzuarbeiten und die Insektizide zu quantifizieren! Welche Schwierigkeiten erwarten Sie? Würden Sie eine HPLC-Methode vorziehen? Die Insektizide müssen aus dem Erdreich mit einem apolaren Lösungsmittel extrahiert werden. Dazu ist es sinnvoll, die Probe vorgängig zu trocknen. Dies sollte nicht durch Erhitzen geschehen, damit möglichst keine Verluste auftreten. Die Aufarbeitung des Erdreichs ist wesentlich aufwendiger als jene des Trinkwassers. Es ist auch damit zu rechnen, dass deutlich mehr Verunreinigungen aus dem Erdreich extrahiert werden, als dies beim Trinkwasser der Fall ist. Die tausendfach grössere Konzentration der Insektizide dürfte diese zusätzlichen Schwierigkeiten wettmachen. Die Quantifizierung gestaltet sich ähnlich wie bei der Trinkwasserprobe. Man kann die Wiederfindungsrate bestimmen und sich darauf verlassen, dass sie einigermassen konstant ist, oder man kann die Insektizide dem Erdreich zusetzen und die Aufarbeitung durchführen. Die Schwierigkeiten der Quantifizierung sind deutlich grösser als beim Trinkwasser. Mit entsprechend hohen Messfehlern ist zu rechnen.
16 14 Eine HPLC-Methode ist auch hier nicht geeignet. Das Trennproblem ist gegenüber dem Trinkwasser wesentlich verschärft, da das Extraktionsmittel viele zusätzliche Verunreinigungen in vergleichsweise grosser Konzentration aus dem Erdreich löst. Es wäre wiederum ein MS als Detektor unerlässlich. Hinweis: Auch andere Lösungsvorschläge wurden positiv bewertet, wenn sie in sich schlüssig waren. Uns interessiert nicht die letzte Wahrheit, die auch Experten nicht am Schreibtisch herausfinden können, sondern die grundsätzliche Fähigkeit, die Probleme zu benennen und Lösungsvorschläge zu unterbreiten.
Schriftliche Prüfung 2. Vordiplom Frühling 2003
 Prüfungen Analytische Chemie Montag, 10. März 2003 Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ABI/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 10. März 2003 Schriftliche Prüfung 2. Vordiplom Frühling 2003 D ABI/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Frühling 2006
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Schriftliche Prüfung BSc Frühling 2006 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Prüfungen Analytische Chemie Mittwoch, 8. März 2006 Schriftliche Prüfung BSc Frühling 2006 D CAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die
Schriftliche Prüfung BSc Frühling 2008
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung 2. Vordiplom Frühling 2004
 Prüfungen Analytische Chemie Montag, 10. März 2004 Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Montag, 10. März 2004 Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Montag, 3. September 2007 Schriftliche Prüfung BSc Herbst 2007 D CHAB/BIOL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Schriftliche Prüfung BSc Frühling 2010
 Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Donnerstag, 11. Februar 2010 Schriftliche Prüfung BSc Frühling 2010 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung 2. Vordiplom / BSc Herbst 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 21. September 4 Schriftliche Prüfung 2. Vordiplom / BSc erbst 4 D CAB/BIL Musterlösung Vorname:... ame:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIOL. Musterlösung. für den Teil Spektroskopie
 Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Prüfungen Analytische Chemie Samstag, 9. Februar 2008 Schriftliche Prüfung BSc Frühling 2008 D CHAB/BIL Musterlösung für den Teil Spektroskopie Vorname:... Name:... Jede Aufgabe wird separat bewertet.
Schriftliche Prüfung BSc Sommer 2016
 Prüfungen Analytische Chemie Donnerstag, 11. August 2016 Schriftliche Prüfung BSc Sommer 2016 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Donnerstag, 11. August 2016 Schriftliche Prüfung BSc Sommer 2016 D CHAB/BIOL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung BSc Herbst 2011
 Prüfungen Analytische Chemie Montag, 29. August 2011 Schriftliche Prüfung BSc Herbst 2011 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Prüfungen Analytische Chemie Montag, 29. August 2011 Schriftliche Prüfung BSc Herbst 2011 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt 36.
Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Mittwoch, 4. Februar 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Mittwoch, 4. Februar 2015 Schriftliche Prüfung BSc Herbst 2015 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Sommer 2011 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL
 Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
Schriftliche Prüfungen Jahreskurs Analytische Chemie I&II Winter 2011/2012 BSc D-CHAB/BIOL Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011
 Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfungen Smesterkurs Analytische Chemie I Instrumentalanalyse organischer Vebindungen Sommer 2011 Vorname: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120
Schriftliche Prüfung Analytische Chemie I Sommer 2014
 Schriftliche Prüfung Analytische Chemie I Sommer 2014 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut ein. Es sind
Schriftliche Prüfung Analytische Chemie I Sommer 2014 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut ein. Es sind
Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Dienstag, 1. März 2005 Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische Chemie Dienstag, 1. März 2005 Schriftliche Prüfung 2. Vordiplom / BSc Frühling 2005 D CHAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Schriftliche Prüfung Analytische Chemie I / Instrumentalanalyse organischer Verbindungen
 Schriftliche Prüfung Analytische Chemie I / Instrumentalanalyse organischer Verbindungen Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen
Schriftliche Prüfung Analytische Chemie I / Instrumentalanalyse organischer Verbindungen Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen
Schriftliche Prüfung BSc Frühling 2012
 Prüfungen Analytische Chemie Samstag, 4. Februar 2012 Schriftliche Prüfung BSc Frühling 2012 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Prüfungen Analytische Chemie Samstag, 4. Februar 2012 Schriftliche Prüfung BSc Frühling 2012 D CHAB/BIL Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl beträgt
Schriftliche Prüfung S Analytische Chemie I Sommer 2015
 Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
Schriftliche Prüfung 529-0051- 00S Analytische Chemie I Sommer 2015 Vorname: Name: Legi-Nr.: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 60 Min. Teilen Sie sich Ihre Zeit gut
P105. Konstitution. Massenspektrum 100 % m/z
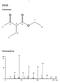 1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
1 P105 Konstitution 7 1 2 6 8 4 5 Massenspektrum 100 % 4 116 50 7 101 29 55 88 15 61 10 14 158 0 0 50 100 150 m/z 2 Direkte Fragmentierungen: 4 115 11 45 129 29 85 7 Damit lassen sich die prominenten Signale
Schriftliche Prüfung 2. Vordiplom Frühling 2004 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische Chemie Montag, 10. März 004 Schriftliche Prüfung. Vordiplom Frühling 004 D CAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Prüfungen Analytische Chemie Montag, 10. März 004 Schriftliche Prüfung. Vordiplom Frühling 004 D CAB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare Punktzahl
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
1. Klausur OC1 (BSc-Studiengang) PIN: 18.02.2016 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
Übungsaufgaben - Analytik
 Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Übungsaufgaben - Analytik Übung 1 Von einer Substanz soll der molare Extinktionskoeffizient bestimmt werden. Der Laborant hat mässig exakt verdünnt. Er hat jeweils die auf der x-achse angegbene Zahl an
Grundlagen der Chromatographie
 Grundlagen der Chromatographie Was ist Chromatographie? Trennung ähnlicher Moleküle aus komplexen Gemischen o Die Analyte werden in einer mobilen Phase gelöst und darin durch eine stationäre Phase transportiert.
Grundlagen der Chromatographie Was ist Chromatographie? Trennung ähnlicher Moleküle aus komplexen Gemischen o Die Analyte werden in einer mobilen Phase gelöst und darin durch eine stationäre Phase transportiert.
Schriftliche Prüfung J Analytische Chemie I&II Sommer 2015
 Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Sommer 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 5.1 1 H-NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung d (in ppm):
Schriftliche Prüfung J Analytische Chemie I&II Winter 2015
 Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Winter 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung 529-0058- 00J Analytische Chemie I&II Winter 2015 Vorname: Legi-Nr.: Name: Es sind alle Aufgaben zu lösen. Jede Aufgabe wird separat benotet. Zeit: 120 Min. Teilen Sie sich Ihre Zeit
Schriftliche Prüfung 2. Vordiplom Herbst 2003 D CHAB/BIOL. Musterlösung
 Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
Prüfungen Analytische hemie Mittwoch, 1. ktober 2003 Schriftliche Prüfung 2. Vordiplom erbst 2003 D AB/BIL Musterlösung Vorname:... Name:... Jede Aufgabe wird separat bewertet. Die maximal erreichbare
4. Seminartag Analyse einer Altlast
 4. Seminartag Analyse einer Altlast Versuch 3: Umweltschadstoffe Welche Eigenschaften haben Umweltschadstoffe? - Toxisch / kanzerogen / mutagen - Hormonell aktiv - Schlechte Abbaubarkeit (hohe Halbwertszeiten)
4. Seminartag Analyse einer Altlast Versuch 3: Umweltschadstoffe Welche Eigenschaften haben Umweltschadstoffe? - Toxisch / kanzerogen / mutagen - Hormonell aktiv - Schlechte Abbaubarkeit (hohe Halbwertszeiten)
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4 NMR-Spektroskopie 5.1 1 H-NMR-Spektroskopie Wasserstoffatome ( 1 H, natürliche Häufigkeit 99,985 %) mit
Übungen zur Spektroskopie 2
 Übungen zur Spektroskopie 2 C. Dubler und Dr. D. S. Stephenson Department Chemie, Universität München Sie finden diese Übungen und alte Klausuren (mit Lösung) auf unserer Homepage: http://cicum200.cup.unimuenchen.de/intranet/depch/analytik/nmr_f/index.php
Übungen zur Spektroskopie 2 C. Dubler und Dr. D. S. Stephenson Department Chemie, Universität München Sie finden diese Übungen und alte Klausuren (mit Lösung) auf unserer Homepage: http://cicum200.cup.unimuenchen.de/intranet/depch/analytik/nmr_f/index.php
NMR - Seite 1. NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie
 NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
NMR - Seite 1 NMR (Kernresonanzspektroskopie) Allgemeines zur Theorie Protonen besitzen ebenso wie Elektronen einen eigenen Spin (Drehung um die eigene Achse).Allerdings gibt es mehrere Möglichkeiten als
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
Präparat Organische Analyse. Synthesepraktikum Assoc. Prof. Michael Schnürch
 Präparat Organische Analyse Synthesepraktikum 163.145 Assoc. Prof. Michael Schnürch Aufgabenstellung Trennung eines 3 Komponentengemisches 2 Neutralstoffe und 1 Verbindung mit sauren/basischen Eigenschaften
Präparat Organische Analyse Synthesepraktikum 163.145 Assoc. Prof. Michael Schnürch Aufgabenstellung Trennung eines 3 Komponentengemisches 2 Neutralstoffe und 1 Verbindung mit sauren/basischen Eigenschaften
Kombinierte Übungen zur Spektroskopie Beispiele für die Bearbeitung
 Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Im folgenden soll gezeigt werden, daß es großen Spaß macht, spektroskopische Probleme zu lösen. Es gibt kein automatisches Lösungsschema, sondern höchstens Strategien, wie beim "Puzzle Lösen"; häufig hilft
Spektroskopiemodul II. H-NMR und 13 C-NMR
 Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Spektroskopiemodul II 1 H-NMR und 13 C-NMR 1 1. Was gehört zu einer vollständigen Spektreninterpretation zur Strukturaufklärung? 1.1. 1 H-NMR-Spektren Man muss die chemische Verschiebung jedes einzelnen
Übungsaufgaben zur NMR-Spektrometrie
 Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Übungsaufgaben NMR 33 Übungsaufgaben zur NMR-Spektrometrie Aufgabe 1 a) Wieviele unterschiedliche Orientierungen des Kernmomentes relativ zu einem externen Magnetfeld sind beim 14 N-Kern (I = 1, γ = 1.932
Charakterisierung und Vergleich zwischen technischen Lösungsmitteln und den hochreinen Produkten für die Laboranwendung
 Honeywell Burdick & Jackson S. LORENZ, M. BOSMA, A. KEMPERMAN, V. MOHAN AND J. PRYZBYTEK Charakterisierung und Vergleich zwischen technischen Lösungsmitteln und den hochreinen Produkten für die Laboranwendung
Honeywell Burdick & Jackson S. LORENZ, M. BOSMA, A. KEMPERMAN, V. MOHAN AND J. PRYZBYTEK Charakterisierung und Vergleich zwischen technischen Lösungsmitteln und den hochreinen Produkten für die Laboranwendung
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17
 Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2016/17 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus
 NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol OH
 4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18
 Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
Finale (O-ho!) Dr. Christian Merten, Ruhr-Uni Bochum, WiSe 2017/18 www.ruhr-uni-bochum.de/chirality Rückblick: IR Schwingung von Atomen kann im klassischen Bild als harmonische Schwingung (harmonischer
D-(+)-Biotin (Vitamin H)
 D-(+)-Biotin (Vitamin H) Benedikt Jacobi 28. Januar 2005 1 Inhaltsverzeichnis 1 Einleitung 1 1.1 Aufgabenstellung: Prüfung der Stabilität von Biotin (Vitamin H) unter alltäglichen Bedingungen (Kochen,
D-(+)-Biotin (Vitamin H) Benedikt Jacobi 28. Januar 2005 1 Inhaltsverzeichnis 1 Einleitung 1 1.1 Aufgabenstellung: Prüfung der Stabilität von Biotin (Vitamin H) unter alltäglichen Bedingungen (Kochen,
Übungsaufgaben zur HPLC für Biolaboranten
 Übungsaufgaben zur HPLC für Biolaboranten 1.1 Trennung von Paracetamol und HPLC Im LTC-Praktikum wurde in einer Kalibrierlösung Paracetamol und Coffein über eine HPLC getrennt. Bedingungen: β(cof) = 12,5
Übungsaufgaben zur HPLC für Biolaboranten 1.1 Trennung von Paracetamol und HPLC Im LTC-Praktikum wurde in einer Kalibrierlösung Paracetamol und Coffein über eine HPLC getrennt. Bedingungen: β(cof) = 12,5
NMR-Spektroskopie Teil 2
 BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
BC 3.4 : Analytische Chemie I NMR Teil 2 NMR-Spektroskopie Teil 2 Stefanie Wolfram Stefanie.Wolfram.1@uni-jena.de Raum 228, TO Vom Spektrum zur Struktur 50000 40000 Peaks u. Integrale 30000 Chemische Verschiebung
Kurs "Spektroskopische Methoden in der Anorganischen und Organischen Chemie" Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt 1)
 Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
Kernresonanzspektroskopie - Übungen Lösung zu NMR-6 (Blatt ) Zum Lösungsmittel: Das Kohlenstoffspektrum zeigt bei 77 ppm drei gleich große äquidistante Signale. Diese stammen von CDC 3. Chemische Verschiebungen
1007 Synthese von 2,4,6-Tribromanilin aus 4-Bromacetanilid
 1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Chemisches Praktikum für Biologen Klausur am 17.11.2015 Name: Vorname: Matrikelnummer: Aufgabe Maximale Punktzahl Erreichte Punktzahl 1 3 2 3 3 3 4 3 5 3 6 3 7 3 8 3 Gesamt 24 Bestanden: Die Klausur besteht
Spektroskopie-Seminar SS NMR-Spektroskopie. C-NMR-Spektroskopie und 2D-Spektroskopie
 13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
13 C-NMR-Spektroskopie und 2D-Spektroskopie 6.1 Allgemeines Kernresonanz: Wechselwirkungen zwischen dem magnetischen Moment von Atomkernen mit einem magnetischen Wechselfeld Nur solche Isotope können untersucht
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol
 4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Spektroskopie-Seminar SS NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
1 H-NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 4.1 Allgemeines Spektroskopische Methode zur Untersuchung von Atomen: elektronische Umgebung Wechselwirkung
4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester
 NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
1. Standortbestimmung, Januar Chemie. Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung,
 1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
1. Standortbestimmung, Januar 2015 Chemie Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte und vom Dozenten visierte Formelsammlung, Ein netzunabhängiger,
Klausur Arzneistoffanalytik unter besonderer Berücksichtigung der Arzneibücher (Qualitätskontrolle und -sicherung bei Arzneistoffen) 6.
 Klausur Arzneistoffanalytik unter besonderer Berücksichtigung der Arzneibücher (Qualitätskontrolle und -sicherung bei Arzneistoffen) 6. Fachsemester SS 2013 Datum: 22.07. 2013 NAME (in Druckbuchstaben):
Klausur Arzneistoffanalytik unter besonderer Berücksichtigung der Arzneibücher (Qualitätskontrolle und -sicherung bei Arzneistoffen) 6. Fachsemester SS 2013 Datum: 22.07. 2013 NAME (in Druckbuchstaben):
III. Bestimmung der Doppelbindungsisomere von Alkenen der Bienenwachse
 III. Bestimmung der Doppelbindungsisomere von Alkenen der Bienenwachse III.1. Einleitung Bei der Art Apis mellifera lassen sich nach Angaben von Carlson et al. (1989) europäische und afrikanische Rassen
III. Bestimmung der Doppelbindungsisomere von Alkenen der Bienenwachse III.1. Einleitung Bei der Art Apis mellifera lassen sich nach Angaben von Carlson et al. (1989) europäische und afrikanische Rassen
5 HPLC-Methodenentwicklung zur Isomerentrennung
 HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
HPLC-Untersuchungen 5 HPLC-Untersuchungen 65 5 HPLC-Methodenentwicklung zur Isomerentrennung Die bei der -Substitution des Benzimidazolgrundgerüstes entstehenden Isomere machen eine nachfolgende Trennung
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 2. Klausur OC1 (BA-Studiengang) PIN: 11.03.2015 11:00 14:00 Uhr N5 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
2. Klausur OC1 (BA-Studiengang) PIN: 11.03.2015 11:00 14:00 Uhr N5 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7 52-50=3.0
NMR-Spektroskopie. Magnet. Steuerung. Probenrohr Spinner. Shimspulen. B -Spulen. Gradient 2. Vorverstärker
 NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
NMR-Spektroskopie Magnet Steuerung He He CPU Frequenz Pulsform Pulsleistung Zeitkontrolle Temperierung Gradienten Shim/Lock/Gas Vorverstärker N N Probenrohr Spinner Shimspulen B -Spulen Gradient 2 H K
Spektroskopische Methoden in der Organischen Chemie (OC IV) NMR Spektroskopie 1. Physikalische Grundlagen
 NMR Spektroskopie 1. Physikalische Grundlagen Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
NMR Spektroskopie 1. Physikalische Grundlagen Viele Atomkerne besitzen einen von Null verschiedenen Eigendrehimpuls (Spin) p=ħ I, der ganz oder halbzahlige Werte von ħ betragen kann. I bezeichnet die Kernspin-Quantenzahl.
Z 12 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN
 ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
ANALYTIK 1) BESTIMMUNG DER SUMMENFORMEL: a. AUS DEN MASSENPROZENTEN Ziel: Ermittlung einer Summenformel einer Substanz aus C, und O wenn die Massenprozent der Elemente und die Molmasse M r der Substanz
Aufgabe 1: (18 Punkte)
 Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Aufgabe 1: (18 Punkte) In der Arbeitsgruppe Hilt wurde folgende Reaktionssequenz durchgeführt: A H 10 H B O O O 1 1 2 2 + 10 3 3 4 4 Δ DA- Produkt 6-9 5 5 6-9 2 Ph Ph Co(dppe) 2 3 3 4 4 Im ersten Reaktionsschritt
Übungsaufgaben NMR-Spektroskopie (1)
 Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Übungsaufgaben NMR-Spektroskopie (1) 1. Kerne haben drei wichtige Eigenschaften: Masse m, Ladung Q und Eigendrehimpuls p. Kernsorte Spin natürliche Häufigkeit Gyromagnet. Verhältnis γ [Tsec] 1 1 H 1/2
Standortbestimmung / Äquivalenzprüfung. Chemie. Mittwoch, 13. April 2016, Uhr
 Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
Seite 1 von 7 Standortbestimmung / Äquivalenzprüfung Chemie Mittwoch, 13. April 2016, 16.45-18.15 Uhr Dauer der Prüfung: 90 Minuten Erlaubte Hilfsmittel: Eine gedruckte und/oder eine persönlich erstellte
LAF-Wiederholungsklausur. Wintersemester 2012/13
 LAF-Wiederholungsklausur Wintersemester 2012/13 Name/Vorname:... Matrikelnummer:... Geburtsdatum:... A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 X X X X Schreiben Sie bitte gut leserlich! Mit Bleistift geschriebene
LAF-Wiederholungsklausur Wintersemester 2012/13 Name/Vorname:... Matrikelnummer:... Geburtsdatum:... A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 X X X X Schreiben Sie bitte gut leserlich! Mit Bleistift geschriebene
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Application Bulletin
 Nr. 6/ d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L,, 3, 4, 5, 7, 8, 9,, 6 IC-Säule Metrosep Anion Dual (6.006.00) für die Bestimmung von Anionen mit und ohne chemische
Nr. 6/ d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L,, 3, 4, 5, 7, 8, 9,, 6 IC-Säule Metrosep Anion Dual (6.006.00) für die Bestimmung von Anionen mit und ohne chemische
Bist Du nicht "FIT", dann musst Du nacharbeiten.
 Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
Überlege zunächst, ob Du die gestellte Frage beantworten kannst und kreuze in der Tabelle entsprechend an. Überprüfe Deine Angabe an Hand der entsprechenden Aufgabe. (Die Nummerierung der Frage und der
4002 Synthese von Benzil aus Benzoin
 4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
Spektroskopie-Seminar WS 17/18 5 NMR-Spektroskopie. H-NMR-Spektroskopie. nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie
 WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
WS 17/18 1 -NMR-Spektroskopie nuclear magnetic resonance spectroscopy- Kernmagnetresonanzspektroskopie 1 5.1 1 -NMR-Spektroskopie NMR-Spektrum liefert folgende Informationen: Chemische Verschiebung δ(in
Massenspektrometrie (MS)
 Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Massenspektrometrie (MS) Die Massenspektrometrie ist unter den heute routinemäßig verwendeten Methoden die jüngste, denn ihre Anwendung begann erst um 1960. Seit den Arbeiten von BIEMANN über Fragmentierungsmuster
Application Bulletin
 Nr. 262/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Anionensäule Phenomenex Star Ion A300 (6.1005.100) für die Bestimmung von Anionen
Nr. 262/1 d Application Bulletin Von Interesse für: Allgemein analytische Laboratorien I L 1, 2, 3, 4, 5, 7, 8, 9, 11, 16 IC-Anionensäule Phenomenex Star Ion A300 (6.1005.100) für die Bestimmung von Anionen
Ionenchromatographie
 Analytisches Physikalisches Praktikum Ionenchromatographie Version 2, Gruppe M14 Jorge Ferreiro, Studiengang Chemieingenieur 4. Semester, fjorge@student.ethz.ch Natalja Früh, Studiengang Interdisziplinäre
Analytisches Physikalisches Praktikum Ionenchromatographie Version 2, Gruppe M14 Jorge Ferreiro, Studiengang Chemieingenieur 4. Semester, fjorge@student.ethz.ch Natalja Früh, Studiengang Interdisziplinäre
5. Probenaufbereitung
 Analytische Chemie für Biologie, Pharmazie, 75 Teil Chromatographische und 5. Probenaufbereitung Wieso ist eine Probeaufarbeitung für viele Proben notwendig? Störende andere Substanzen sollen entfernt
Analytische Chemie für Biologie, Pharmazie, 75 Teil Chromatographische und 5. Probenaufbereitung Wieso ist eine Probeaufarbeitung für viele Proben notwendig? Störende andere Substanzen sollen entfernt
2. Wiederholungsklausur OC1 (BA-Studiengang) :00 16:00 Uhr M1 C-Bau. Name: Punkte: Matrikel Nr. Note:
 2. Wiederholungsklausur C1 (BA-Studiengang) PI: 07.04.2011 13:00 16:00 Uhr M1 C-Bau ame: Punkte: Matrikel r. ote: otenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7
2. Wiederholungsklausur C1 (BA-Studiengang) PI: 07.04.2011 13:00 16:00 Uhr M1 C-Bau ame: Punkte: Matrikel r. ote: otenskala: 80-78=1.0 77-75=1.3 74-71=1.5 70-67=1.7 66-63=2.0 62-59=2.3 58-56=2.5 55-53=2.7
Komprehensive Gaschromatographie Ein Weg zur Trennung von Tausenden von umweltrelevanten Chlorparaffinen
 Komprehensive Gaschromatographie Ein Weg zur Trennung von Tausenden von umweltrelevanten Chlorparaffinen Michael Oehme Institut für angewandte analytische Chemie Chlorparaffine (CP) Chlorparaffine (CP)
Komprehensive Gaschromatographie Ein Weg zur Trennung von Tausenden von umweltrelevanten Chlorparaffinen Michael Oehme Institut für angewandte analytische Chemie Chlorparaffine (CP) Chlorparaffine (CP)
5 Analyseverfahren. Qualitative Analyse: Identifikation eines Stoffs bzw. Bestimmung der Zusammensetzung eines Stoffgemischs
 5 Analyseverfahren 1 Qualitative Analyse: Identifikation eines Stoffs bzw. Bestimmung der Zusammensetzung eines Stoffgemischs Quantitative Analyse: Bestimmung der absoluten Menge bzw. des Anteils (Konzentration)
5 Analyseverfahren 1 Qualitative Analyse: Identifikation eines Stoffs bzw. Bestimmung der Zusammensetzung eines Stoffgemischs Quantitative Analyse: Bestimmung der absoluten Menge bzw. des Anteils (Konzentration)
Vorlesung. Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen
 Vorlesung Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen Zusammenfassung des Teils "Spektroskopie" für die Prüfung BSc
Vorlesung Analytik (für Biologen und Pharmazeuten) Einführung in spektroskopische Methoden der Strukturaufklärung organischer Verbindungen Zusammenfassung des Teils "Spektroskopie" für die Prüfung BSc
ETHANOL 70 Prozent Ethanolum 70 per centum. Aethanolum dilutum. Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser.
 ÖAB 2008/004 ETHANOL 70 Prozent Ethanolum 70 per centum Aethanolum dilutum Definition Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser. Gehalt: Ethanol 70 Prozent enthält mindestens
ÖAB 2008/004 ETHANOL 70 Prozent Ethanolum 70 per centum Aethanolum dilutum Definition Ethanol 70 Prozent ist eine Mischung von Ethanol 96 Prozent und Wasser. Gehalt: Ethanol 70 Prozent enthält mindestens
Protokoll: Infrarotspektroskopie
 Protokoll: Infrarotspektroskopie Durchführung und Beobachtung 1. Backgroundmessung im leeren Gerät Man erkennt, dass das Gerät ausreichend mit getrockneter Luft gespült wurde. Durch die Backgroundmessung
Protokoll: Infrarotspektroskopie Durchführung und Beobachtung 1. Backgroundmessung im leeren Gerät Man erkennt, dass das Gerät ausreichend mit getrockneter Luft gespült wurde. Durch die Backgroundmessung
III. Strukturbestimmung organischer Moleküle
 III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
III. Strukturbestimmung organischer Moleküle Röntgenstrukturbestimmung g Spektroskopie UV-VIS IR NMR Massenspektrometrie (MS) Röntgenstruktur eines bakteriellen Kohlenhydrats O O O O O O O C3 Röntgenstruktur
3021 Oxidation von Anthracen zu Anthrachinon
 xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
NMR Spektroskopie. Aufgaben
 hemische Verschiebung 1. Zeichnen Sie zu den nachfolgend aufgeführten Stoffen die Strukturformeln! Unterscheiden Sie dann zwischen chemisch äquvalenten und nichtäquivalenten Kernen. Bezeichnen Sie die
hemische Verschiebung 1. Zeichnen Sie zu den nachfolgend aufgeführten Stoffen die Strukturformeln! Unterscheiden Sie dann zwischen chemisch äquvalenten und nichtäquivalenten Kernen. Bezeichnen Sie die
Protokoll. Kombinierte Anwendung verschiedener Spektroskopischer Methoden
 Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Protokoll Kombinierte Anwendung verschiedener Spektroskopischer Methoden Zielstellung: Durch die Auswertung von IR-, Raman-, MR-, UV-VIS- und Massenspektren soll die Struktur einer unbekannten Substanz
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
Teil 1 Aufgaben zum Stoff der Vorlesung OC1a (Grundvorlesung Organische Chemie) Maximale Punktezahl: 20 Notwendige Mindestpunkte: 8
 3. Klausur OC1 (BSc-Studiengang) PIN: 21.03.2017 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-75=1.0 74-71=1.3 70-67=1.7 66-63=2.0 62-59=2.3 58-53=2.7 52-50=3.0 49-48=3.3 47-42=3.7
3. Klausur OC1 (BSc-Studiengang) PIN: 21.03.2017 11:00 14:00 Uhr N6 Name: Punkte: Matrikel Nr. Note: Notenskala: 80-75=1.0 74-71=1.3 70-67=1.7 66-63=2.0 62-59=2.3 58-53=2.7 52-50=3.0 49-48=3.3 47-42=3.7
Praktikum Allgemeine und analytische Chemie der anorganischen Arznei-, Hilfs- und Schadstoffe. Abschlussklausur. am 25.
 D E P A R T M E N T P H A R M A Z I E - Z E N T R U M F Ü R P H A R M A F O R S C H U N G Praktikum Allgemeine und analytische Chemie der anorganischen Arznei-, Hilfs- und Schadstoffe Abschlussklausur
D E P A R T M E N T P H A R M A Z I E - Z E N T R U M F Ü R P H A R M A F O R S C H U N G Praktikum Allgemeine und analytische Chemie der anorganischen Arznei-, Hilfs- und Schadstoffe Abschlussklausur
1005 Bromierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol
 1005 omierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol H 3 H 3 K 3, H Essigsäure H 3 H 3 + Nebenprodukt 8 H 10 2 K 3 (167.0) 8 H 8 2 2 (138.2) H (80.9) (296.0) Klassifizierung Reaktionstypen
1005 omierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol H 3 H 3 K 3, H Essigsäure H 3 H 3 + Nebenprodukt 8 H 10 2 K 3 (167.0) 8 H 8 2 2 (138.2) H (80.9) (296.0) Klassifizierung Reaktionstypen
Thematische Aufgliederung der Prüfungsfragen
 Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Seite 1 Thematische Aufgliederung der Prüfungsfragen (gemäss Abschlussprüfungen im Fach Chemie der Eidgenössischen Berufsmaturitätsprüfung Technischer Richtung) 1. Heterogene Mischungen; Trennmethoden
Spektroskopie-Seminar SS 18 8 Massenspektrometrie Massenspektrometrie
 SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
!! Schriftliche!Prüfung!!!529%0058%00J!Analytische!Chemie!I&II! Winter!2016!
 SchriftlichePrüfung 529%0058%00JAnalytischeChemieI&II Winter2016 Vorname: Legi-Nr.: Name: EssindalleAufgabenzulösen.JedeAufgabewirdseparatbenotet. Zeit:120Min.TeilenSiesichIhreZeitgutein. EssindalleHilfsmittelmitAusnahmevonComputernundTelekommunikation
SchriftlichePrüfung 529%0058%00JAnalytischeChemieI&II Winter2016 Vorname: Legi-Nr.: Name: EssindalleAufgabenzulösen.JedeAufgabewirdseparatbenotet. Zeit:120Min.TeilenSiesichIhreZeitgutein. EssindalleHilfsmittelmitAusnahmevonComputernundTelekommunikation
4. GERÄTE UND MATERIALEN 4.1. SPME-FASERN UND HALTER
 4. GERÄTE UND MATERIALEN 4.1. SPME-FASERN UND HALTER Für die Methodenvalidierungen kamen die kommerziell im Handel erhältlichen SPME- Fasern sowie die manuellen Faserhalterungen von der Firma Supelco (Deisenhofen)
4. GERÄTE UND MATERIALEN 4.1. SPME-FASERN UND HALTER Für die Methodenvalidierungen kamen die kommerziell im Handel erhältlichen SPME- Fasern sowie die manuellen Faserhalterungen von der Firma Supelco (Deisenhofen)
Abschlussprüfung 2013 von Peter Senn und Sandro Brandenberger
 Seite 1 von 15 Bachelor Zulassungsstudium Name:... Abschlussprüfung 2013 von Peter Senn und Sandro Brandenberger Fach: Chemie Datum: Freitag, den 28. Mai 2013 Zeit: 16:45 18:45 Dauer: 2h Maximale Punktzahl:
Seite 1 von 15 Bachelor Zulassungsstudium Name:... Abschlussprüfung 2013 von Peter Senn und Sandro Brandenberger Fach: Chemie Datum: Freitag, den 28. Mai 2013 Zeit: 16:45 18:45 Dauer: 2h Maximale Punktzahl:
Analytische Chemie (für Biol. / Pharm. Wiss.)
 Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst Laboratory of Organic Chemistry HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/
Analytische Chemie (für Biol. / Pharm. Wiss.) Teil: Trenntechniken (Chromatographie, Elektrophorese) Dr. Martin Pabst Laboratory of Organic Chemistry HCI D323 martin.pabst@org.chem.ethz.ch http://www.analytik.ethz.ch/
Strukturerklärung mit Flüssigchromatographie Massenspektrometrie (LC-MS)
 Strukturerklärung mit Flüssigchromatographie Massenspektrometrie (LC-MS) Untersuchung von Imatinib Mesylate und Metaboliten Julia dermatt, Kantonsschule bwalden, Sarnen Jerome Dayer, ovartis 1. Zusammenfassung
Strukturerklärung mit Flüssigchromatographie Massenspektrometrie (LC-MS) Untersuchung von Imatinib Mesylate und Metaboliten Julia dermatt, Kantonsschule bwalden, Sarnen Jerome Dayer, ovartis 1. Zusammenfassung
3012 Synthese von Adamantylidenadamantan aus Adamantanon
 Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
