BIOCHEMIE des Stoffwechsels ( )
|
|
|
- Helmut Grosse
- vor 5 Jahren
- Abrufe
Transkript
1 BICEMIE des Stoffwechsels ( ) 10. Einheit Glycogen Stoffwechsel
2 Speicherkohlenhydrate Glykogenabbau Glycogensynthese Regulation und Integration des Glycogenstoffwechsels Signaltransduktion (Insulin, Glucagon, Adrenalin)
3 Speicherkohlenhydrate
4 öhere rganismen bilden GLUCANE als Brennstoffspeicher (Depot- Polysaccharide). Der Vorteil dieser Glucane liegt in ihrer raschen Mobilisierbarkeit und in der Tatsache, dass durch die Polymerisierung der osmotische Druck in der Zelle drastisch gesenkt wird. Der osmotische Druck hängt nicht vom Molekulargewicht sondern von der Stoffmenge ab. Pflanzen: Stärke (Amylose, Amylopectin) Tiere: Glycogen Stärke dient als Energie- bzw. Nährstoffreserve für Pflanzen und als wichtige Kohlenhydratquelle für tierische rganismen. Stärke kommt im Cytosol der Pflanzenzelle in Form unlöslicher Granula vor und besteht aus -Amylose und Amylopectin.
5 -Amylose (20-30%) ist ein lineares Polymer aus einigen tausend Glucose-Einheiten, die (1 4)-glycosidisch miteinander verknüpft sind. Unregelmäßig, helical geknäuelte Aggregation. Links-gängige elix -1,4-Bindung zwischen zwei Glucose-Einheiten -glycosidische Bindungen neigen generell zu helicalen Polymeren, während -glycosidische Bindungen (z.b. Cellulose) gerade Stränge (Strukturfasern) bilden.
6 Amylopectin (70-80%) ist ein Polymer aus (1 4)-glycosidisch miteinander verknüpften Glucoseeinheiten mit (1 6)- Verzweigungen an jeder Glucoseeinheit. Zählt mit bis zu Glucosemolekülen zu den größten Makromolekülen in der Natur. Schematische Darstellung der verästelten Struktur des Amylopectins (Verzweigungsstellen sind rot). Realität: Abstand zwischen zwei Verzweigungsstellen: Glucoseeinheiten (1 6)- glycosidische Bindung 2 C
7 Der Mensch benötigt g an Glucose pro Tag (75% davon benötigt das Gehirn). Diverse Körperflüssigkeiten (z.b. Blut) transportieren etwa 20 g und g werden in Form von Glycogen gespeichert. Fazit: Der Körpervorrat reicht nicht viel mehr als für einen Tag! Prinzipiell gibt es drei mögliche Wege den Glucosebedarf zu decken: (A) (B) (C) NARUNG (z.b. Verdau von Stärkeprodukten oder tierischem Glycogen). Sehr effektiver, fast 100%iger Abbau, jedoch nicht kontrolliert. GLYCGENABBAU: unterliegt strenger Kontrolle GLUCNEGENESE von Glucose aus Nichtkohlenhydraten (Lactat, Aminosäuren, Glycerin usw.): unterliegt strikter Regulation (siehe Einheit 9).
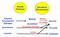
8 Verdauung von Stärke und tierischem Glycogen: Mundbereich: -Amylase (Endoglucosidase) im Speichel spaltet lineare (1 4)-Bindungen, jedoch nicht solche, die an Verzweigungspunkten liegen. Magenbereich: -Amylase wird durch Säure inaktiviert. Die durchschnittliche Kettenlänge ist inzwischen von einigen 1000 auf durchschnittlich 8 reduziert. Dünndarm: -Amylase des Pankreas (homolog der -Amylase der Speicheldrüsen) bildet Gemisch aus (1 4)-verknüpfter Maltose (Disaccharid) und Maltotriose (Trisaccharid). Außerdem entstehen Dextrine (ligosaccharide) mit (1 6)-Verzweigungen. Weitere Enzyme im Bürstensaum des Darmepithels sind -Glucosidase, -Dextrinase und schließlich die Disaccharid-hydrolysierenden Enzyme Saccharase, Maltase oder Lactase.
9 -(1 4)-Glucosidase (Exoglucosidase) spaltet endständige Glucosereste von ligosacchariden ab. -Amylase -(1 4)-Gucosidase -Dextrinase ( -(1 6)- Glucosidase; debranching enzyme): hydrolysiert (1 6)- und (1 4)-Verknüpfungen. Saccharase (Invertase) spaltet Saccharose in Glucose und Fructose. -(1 6)-Glucosidase Maltase spaltet Maltose und Lactase spaltet Lactose.
10 Glycogen: (1 4)-verknüptes Glucan (1 6)-Verzweigung im Abstand von 8-12 Resten (1 6)-Verknüpfung Nichtreduzierende Enden Reduzierendes Ende Verzweigungs punkt (1 4)-Verknüpfung Linksgängige elix mit 6,5 Glucoseeinheiten pro Windung
11 Lokalisation im Cytoplasma. Granulas haben einen Durchmesser von etwa 10 bis 40 nm und ein Molekulargewicht von bis Da. Ihr Massenanteil in Muskelzellen beträgt etwa 1-2 %, in Leberzellen hingegen bis zu 10%. Aufgrund der größeren Masse enthält die Skelettmuskulatur aber absolut mehr Glycogen. Die Granulas enthalten Glycogen und Enzyme des Abbaus, der Synthese und der Regulation des Glycogenstoffwechsels und z. T. auch der Glycolyse. Glycogen- Granula Leberzelle
12
13 Glycogen ist der wichtigste kurz- bis mittelfristige Energiespeicher. Synthese und Abbau sind streng kontrolliert. Für Säugetiere ist Glycogen in der Regulation des Blutglucose- Spiegels und als Glucosereservoir für anstrengende Muskelarbeit extrem bedeutend. Fett kommt im Körper zwar in größeren Mengen vor als Glycogen, kann jedoch nicht so schnell mobilisiert werden. Fettsäuren können nicht anaerob metabolisiert werden. Tiere können Fettsäuren nicht in Glucosevorstufen verwandeln. Der Fettstoffwechsel kann den lebensnotwendigen Glucosespiegel im Blut nicht aufrechterhalten (siehe auch Einheit 9, Gluconeogenese).
14 Während körperlicher Aktivitäten, stammt der Großteil der für die ATP- Synthese notwendigen Glucose aus dem Glycogen. Prozent (%) Glycogengehalt 100 Geringe körperliche Aktivitäten Während körperlicher Aktivität wird nur ein geringer Anteil von Glucose durch Gluconeogenese nachgeliefert. 50 Starke körperliche Aktivität Moderate körperliche Aktivität Der Glycogenabbau hängt von der Intensität der Tätigkeit ab Belastung in Minuten
15 Gehalt an Glycogen im Muskel (g Glycogen pro kg Muskel) Effiziente Regenerierung des durch körperliche Aktivitäten geplünderten Glycogen-Pools erfolgt innerhalb eines Tages nur durch Kohlenhydratreiche Nahrung! Protein und fettreiche Nahrung regenerieren den Glycogenspiegel im Muskel nur sehr langsam Nach 2 Stunden körperlicher Tätigkeit Kohlenhydratreiche Nahrung Regenerierung ohne Nahrungszufuhr Fett- und Protein- Diet Regenerierung des Glycogens in Stunden
16 Speicherkohlenhydrate Glykogenabbau
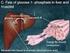
17 Muskel: Leber: Glycogen Glucose-1-P Glucose-6-P Glycolyse Glycogen Glucose-1-P Glucose-6-P Glucose Blut Der letzte Schritt in der Leber wird durch das Enzym Glucose-6-phosphatase katalysiert, das in den Muskeln fehlt (siehe Einheit 9). 3 Enzyme: Glycogen-Phosphorylase (oder Phosphorylase) Glycogen-debranching enzyme Glucosephosphat-Mutase
18 Glycogen-Abbau 1. Reaktion: Glycogen-Phosphorylase Phosphorolyse von Glycogen zu Glucose-1-phosphat. Phosphorolyse bedeutet Bindungsspaltung durch Substitution mit einer Phosphatgruppe Glycogen n + P i Glycogen n-1 + Glucose-1-phosphat Freisetzung der Glucose von den nichtreduzierenden Enden (Enden ohne C(1)--Gruppe) der Glucan-Kette. Freisetzung von Glucoseeinheiten, die wenigstens 5 Einheiten von der nächsten Verzweigung entfernt liegen. Cofaktor: Pyridoxalphosphat omodimer: Pro Untereinheit 842 Reste (97 kda). Schrittmacher-Reaktion des Glycogen-Abbaus. Regulation durch allosterische WW, Substrat-Cyclus und kovalente Modifikation.
19 Schematische Darstellung der verzweigten Struktur von Glycogen. Nichtreduzierendes Ende Verzweigungspunkt Reduzierendes Ende Das Molekül besitzt unabhängig von seiner Größe nur ein einziges reduzierendes Ende! Funktion der starken Verzweigung des Glycogens: Rascher Abbau des Glycogens durch gleichzeitige Freisetzung der Glucose an den Verzweigungsenden!
20 Glycogen bildet linksgängige elix in den nichtverzweigten Regionen (6,5 Glucosereste pro Windung). Das Enzym Phosphorylase bindet dieses Motiv an der sog. Glycogenspeicherstelle, einem 3 nm langen Spalt, der 4-5 Zuckerreste aufnehmen kann und diesselbe Krümmung wie die Glycogenhelix hat. Sobald (1 6) Verzweigungen auftreten, dissoziiert die Phosphorylase ab.
21 Phosphorylase Turm Glycogen- Speicherstelle Glycogenbindungssubdomäne Allosterisches Zentrum N-terminale Kontakzone Katalytisches Zentrum Pyridoxalphosphat-Bindungsstelle C-terminale Domäne
22 Wozu benötigt nun die Phosphorylase den Cofaktor Pyridoxalphosphat? Pyridoxalphosphat kann vom menschlichen Körper nicht synthetisiert werden. Als Vitamin B 6 wird es in Form von Pyridoxin aufgenommen und im Körper zu Pyridoxalphosphat umgewandelt: C 2 - P - C N C 3 N C 3 Pyridoxin (Vitamin B 6 ) Pyridoxal-5-phosphat Pyridoxalphosphat ist auch Cofaktor in Aminotransferasen (hat dort jedoch andere Funktionalität).
23 Lysin C C N C 2 C 2 C 2 C 2 Der Cofaktor Pyridoxalphosphat ist im aktiven Zentrum der Phosphorylase über eine Schiff-Base kovalent gebunden. N - P - C N C 3
24 Die Vitamine werden aus der Nahrung aufgenommen. Vitamine B sind wasserlöslich! Bereits besprochene Vitamine sind in rot dargestellt: Vitamin Thiamin (Vitamin B 1 ) Riboflavin (Vitamin B 2 ) Cofaktor Thiaminpyrophosphat FAD Niacin (Vitamin B 3 ) NAD + Pantothenat (Vitamin B 5 ) Pyridoxin (Vitamin B 6 ) Vitamin B 12 Coenzym A Pyridoxalphosphat (siehe Glykogen- und Aminosäurestoffwechsel) Cobalamin (Fettsäurestoffwechsel)
25 Pyridoxalphosphat ist ein wichtiger Cofaktor der Phosphorylase und von Aminotransferasen (siehe Einheit 12). Die Funktionalität in diesen Enzymsystemen ist aber komplett unterschiedlich. PLP - P Rest - P - Abspaltung der Glucose am nichtreduzierenden Ende unter Beibehaltung der Konfiguration, d.h. sowohl freigesetztes Glucose-1- phosphat als auch Glycogen haben am C-1 -Konfiguration. Die Abspaltung erfolgt unter Ausschluß von Wasser. Vorteil: Produkt ist nicht Glucose, sondern Glucose-1-phosphat.
26 - PLP P Rest - P - Im ersten Schritt gibt rthophosphat ein Proton an den 4- der verbleibenden Glycogenkette ab und erhält gleichzeitig ein Proton von der Phosphatgruppe des Pyridoxalphosphats. Die Phosphatgruppe des Pyridoxalphosphats wirkt als Protonendonor und in weiterer Folge als Protonenakzeptor (Säure-Basekatalysator).
27 - P - - PLP P - Durch die Bindungsspaltung entsteht ein Carbenium-Ion (auch xonium-ion genannt), das durch das benachbarte rthophosphat stabilisiert wird. Rest Beweis für die Entstehung des xonium-ions als Zwischenprodukt ist die effiziente emmung der Phosphorylase mit dem Strukturanalogon 1,5- Gluconolacton:
28 - PLP - P - P Das rthophosphat greift das xonium-ion an und Glucose- 1-phosphat entsteht, dissoziiert ab und das Enzym samt Cofaktor befindet sich wieder im Ausgangszustand. Der Vorteil der nichthydrolytischen Spaltung der (1 4)-Bindung ist die Gewinnung eines phosphorylierten Zuckers.
29 Glycogen-Abbau 2. Reaktion: Debranching enzyme Reaktion: Beseitigung der Verzweigungen des Glycogens. Das debranching enzyme hat zwei katalytische Fähigkeiten: (1 4)-Transglycosylase (Glycosyl-Transferase) (1 6)-Glucosidase-Reaktion Übertragung einer Trisaccharid-Einheit vom Endzweig des Glycogens auf das nichtreduzierende Ende eines anderen Zweiges. Schaffung einer neuen (1 4)-Bindung (= Transglycosylase-Aktivität). Verbleibende (1 6)-Bindungen werden durch das gleiche Enzym unter Bildung von Glucose hydrolysiert (= (1 6)-Glucosidase-Aktivität).
30 Abbau von Glycogen durch Phosphorylase und debranching enzyme. Etwa 90% des Glycogens werden in Glucose-1- phosphat, etwa 10% (an den Verzweigungsstellen) in Glucose umgewandelt.
31 Glycogen-Abbau 3. Reaktion: Glucosephoshat-Mutase Glucose-1-phosphat Glucose-6-phosphat So wie die Phosphoglycerat-Mutase der Glycolyse 2,3-Bisphosphoglycerat in Spuren benötigt, braucht die Glucosephosphat-Mutase Glucose-1,6-bisphosphat in Spuren zur Aufrechterhaltung der Aktivität. Der Reaktionsmechanismus ist sehr ähnlich. Die Glucosephosphat-Mutase enthält im aktiven Zentrum phosphoryliertes Serin, während die Phosphoglycerat-Mutase phosphoryliertes istidin enthält (siehe Einheit 5). Das Enzym Glucosephosphat-Kinase produziert Glucose-1,6- bisphosphat: Glucose-1-phosphat + ATP Glucose-1,6-bisphosphat + ADP
32 Mechanismus der Phosphoglucomutase (Glucosephosphat-Mutase): 2 C Mutase P P - 2 C Mutase P P - 2 C Mutase P 3 2- Glucose-1-phosphat Glucose-1,6-bisphosphat Glucose-6-phosphat P - -
33 Thermodynamik des Glycogenabbaus Phosphorylase-Reaktion G = + 3,1 kj/mol (wäre im Gleichgewicht ( G = 0) wenn [P i ]/[Glucose-1phosphat] = 3,5 Realität [P i ]/[Glucose-1-phosphat] = G = -5 bis -8 kj/mol) Unter physiologischen Bedingungen ist die Phosphorylase-Reaktion exergonisch und daher die Schrittmacher-Reaktion des Glycogenabbaus! Glycogenabbau und -synthese müssen sich daher wieder in diesem Reaktionsschritt unterscheiden. Weil a) bei im selben Kompartiment (Cytosol) ablaufenden scheinbar reversiblen Reaktionen (idente Konzentration der Reaktanten) eine Reaktion nur in einer Richtung exergonisch sein kann, und b) eine reziproke Kontrolle erst dadurch möglich ist: Substrat-Cyclus
34 Speicherkohlenhydrate Glykogenabbau Glycogensynthese
35 McArdlescheKrankheit: Glycogenspeicherkrankheit (Muskelkrämpfe bei Anstrengung). Fehlen der Glycogen-Phosphorylase (kein Glycogenabbau). Trotzdem enthalten Muskeln Glycogen. Abbau und Synthese unabhängig! 3 Enzyme: UDP-Glucose-Pyrophosphorylase Glycogen-Synthase Glycogen branching enzyme ( Verzweigungsenzym )
36 Glycogen-Synthese 1. Reaktion: UDP-Glucose-Pyrophosphorylase Neue Glucose-Einheiten werden an die nichtreduzierenden Enden des Glycogens addiert. Glucose muss dazu aktiviert werden. Umsetzung von Glucose-1-phosphat mit UTP zu UDP-Glucose und Pyrophosphat. Phosphorsäureanhydrid-Tausch: G = 0 kj/mol Jedoch wird durch die Reaktivität der anorganischen Pyrophosphatase (ydrolyse von Pyrophosphat ist stark exergonisch!) die Reaktion in Summe exergonisch. Glucose-1-phosphat + UTP UDP-Glucose + PP i G = 0 kj/mol 2 + PP i 2 P i G = -31 kj/mol Glucose-1-phosphat + UTP UDP-Glucose + 2 P i G = -31 kj/mol
37 C 2 P P C Uridindiphosphat-Glucose, UDP-Glucose N N UDP-Glucose + 2 Glucose + UDP G = -31,9 kj/mol Uridindiphosphat, UDP
38 UDP-Glucose ist der Glucosedonor in der Glycogen-Biosynthese = aktivierte Form der Glucose (so wie ATP oder Acetyl-CoA aktivierte Formen von rthophosphat bzw. Acetat sind). Reaktionsweg 1957 von Louis Leloir aufgeklärt. Für jedes in Glycogen umgewandelte und anschließend wieder regenerierte Glucose-1-phosphat wird UTP zu UDP und P i hydrolysiert (siehe Bilanz der Glycogen-Synthese). Regenerierung des in der Glycogen-Biosynthese benötigten UTP- Vorrats durch Nucleosid-diphosphat-Kinase: UDP + ATP UTP + ADP
39 Glucose-1- phosphat (gebildet aus Glucose-6- phosphat mittels Phosphoglucomutase) UDP-Pyrophosphorylase-Reaktion - P Mechanismus: Der Phosphorylsauerstoff des Glucose-1-phosphat greift das - Phosphoratom des UTP an P P - P Uridintriphosphat N N
40 Phosphorsäureanhydrid-Austausch unter Bildung von UDP- Glucose und Pyrophosphat. Letzteres wird durch die anorganische Pyrophosphatase gespalten. - P - P P P N Uridindiphosphat-Glucose N 2 P i
41 Glycogen-Synthese 2. Reaktion: Glycogen-Synthase Übertragung der Glucosyl-Einheit der UDP-Glucose auf die C(4)- -Gruppe eines der nichtreduzierenden Enden des Glycogens. Knüpfung einer (1 4)-glycosidischen Bindung. Übergangszustand: Start der Reaktion: Glucosyloxonium-Ion (1,5-Gluconolacton als Inhibitor; siehe Phosphorylase) Einfache Verknüpfung aus zwei Glucose- Resten nicht möglich. Die Glycogen-Synthase braucht einen Primer. Diese Primer- Funktion übernimmt das Glycogenin, ein 37 kda-protein, das ein ligosaccharid aus -1,4-verknüpften Glucoseresten gekoppelt an einer phenolischen ydroxylgruppe eines Tyrosinrestes trägt.
42 Das Glycogenin bindet autokatalytisch etwa acht Glucosereste. UDP-Glucose fungiert dabei als Donor. Die Glycogen-Synthase bindet an Glycogenin und wird nun aktiv. Interessant ist, dass Glycogen-Synthase nur in der an Glycogenin gebundenen Form aktiv ist. Dies limitiert die Größe der Glycogengranula, denn sobald die Glycogen-Synthase den Kontakt zum Glycogenin verliert, endet ihre katalytische Aktivität (= molekulare Vorrichtung zur Beschränkung der Größe einer molekularen Struktur). Die Glycogen-Synthase-Reaktion ist exergonisch ( G = -13,4 kj/mol) und ist daher die Schrittmacherreaktion der Glycogen- Biosynthese.
43 Carbenium- oder xonium-ion als Zwischenstufe - P Mechanismus der Glycogen-Synthase: Bildung des Glucosyloxonium-Ions als Zwischenprodukt, das Glycogen an der C-4-ydroxylgruppe angreift: - P UDP N N Rest
44 Glycogen- Synthase Reaktion xonium-intermediat Glycogen (n Reste) Glycogen (n+1 Reste)
45 Glycogen-Synthese 3. Reaktion: Branching enzyme Verzweigung der Glycogen-Kette durch die Amylo-(1,4 1,6)- transglycosylase (Branching enzyme oder Verzweigungsenzym ) Debranching enzyme: (1 4)-glycosidische Bindungen werden gespalten und geknüpft (1 6)-glycosidische Bindungen werden nur hydrolysiert Branching enzyme: (1 4)-glycosidische Bindungen werden gespalten und (1 6)- glycosidische Bindungen werden gebildet Übertragung von terminalen Kettenabschnitten (meist sieben Glycosylresten) auf die C(6)--Gruppe von Glucose-Resten..
46 Branching enzyme (1 4)-glycosidische Bindungen werden gespalten, die abgespaltene Kette transferiert und und (1 6)- glycosidische Bindungen werden gebildet
47 Bilanz: Einzelreaktionen: Glucose-6-phosphat Glucose-1-phosphat Glucose-1-phosphat + UTP UDP-Glucose + PP i PP i P i UDP-Glucose + Glycogen n Glycogen n+1 + UDP UDP + ATP UTP + ADP (Branching enzyme) Glucose-6-phosphat + ATP + Glycogen n + 2 Glycogen n+1 + ADP + 2 P i Beim Einbau von Glucose in Glycogen wird ein ATP hydrolysiert.
48 Bei der Freisetzung werden etwa 90% phosphorolytisch zu Glucose-1-phosphat bzw. in der Folge zu Glucose-6-phosphat umgewandelt. Etwa 10% ist freie Glucose, die dann unter ATP- Verbrauch wieder in Glucose-6-phosphat umgewandelt werden muss. Die vollständige xidation von Glucose-6-phosphat liefert etwa 31 ATP (siehe Einheit 8). Ein ATP wird bei der Speicherung verbraucht. Der Wirkungsgrad der Speicherung ist also sehr hoch (>96%). Glycogen ist eine sehr effiziente Form der Glucose- Speicherung.
49 Speicherkohlenhydrate Glykogenabbau Glycogensynthese Regulation und Integration des Glycogenstoffwechsels
50 Glycogen-Abbau und Glycogen-Synthese sind beide exergonisch. Gleichzeitige Beschreitung beider Wege würde nur zu UTP- Verbrauch durch ydrolyse führen. Es ist daher eine genaue Regulierung der Aktivitäten der Schrittmacher-Enzyme Glycogen- Phosphorylase und Glycogen-Synthase notwendig. Dies geschieht durch Allosterische Regulation Substrat-Cyclus aus Glycogen-Phosphorylase und Glycogen-Synthase (siehe auch Einheit 9) Kovalente Modifikation: Phosphorylierung durch Phosphorylase-Kinase (Adrenalin und Glucagon abhängig) und Dephosphorylierung durch Proteinphosphatase 1 (Insulin abhängig) ormonelle Steuerung (Signalkaskade) der Aktivitäten der Phosphorylase-Kinase und Proteinphosphatase 1
51 Phosphorylase Turm Glycogen- Speicherstelle Glycogenbindungssubdomäne Allosterisches Zentrum N-terminale Kontakzone Katalytisches Zentrum Pyridoxalphosphat-Bindungsstelle C-terminale Domäne
52 C-terminale Domäne N-terminale Domäne Glycogen- Bindungsstelle der N- terminalen Domäne omodimer: Phosphorylase aus asenmuskel im R-Zustand Kontaktstelle der N- terminalen Domäne
53 Glycogen-Phosphorylase wird über verschiedene allosterische Effektoren, die den Energiestatus der Zelle signalisieren, und durch reversible Phosphorylierung, die auf ormone wie Insulin, Adrenalin und Glucagon reagiert, kontrolliert. Die Regulation der Glycogen-Phosphorylase des Muskels und der Leber ist unterschiedlich. Das dimere Enzym kommt prinzipiell in beiden rganen in zwei Formen vor, die ineinander umgewandelt werden können: Für gewöhnlich aktive Form: Für gewöhnlich inaktive Form: Phosphorylase a Phosphorylase b Jede der beiden Formen liegt im Gleichgewicht zwischen einem aktivem, entspannten (R, relaxed) und einem viel weniger aktiven, gespannten (T, tense) Zustand vor.
54 Phosphorylase a: Phosphorylase b: Protein an Ser-14 phosphoryliert. R-Zustand begünstigt Protein nicht-phosphoryliert. T-Zustand begünstigt Das regulatorische Enzym Phosphorylase-Kinase katalysiert die kovalente Modifikation, d.h. die Umwandlung von Phosphorylase b in Phosphorylase a. Geringe strukturelle Veränderungen, hervorgerufen durch die Phosporylierung von Ser-14 an den Kontaktflächen der Untereinheiten, werden auf die aktiven Zentren übertragen. Strukturveränderungen bei der Phosphorylierung machen das aktive Zentrum zugänglich für das Substrat.
55 Phosphorylase b Phosphorylase a Phosphorylase b ist für gewöhnlich weniger aktiv, weil das Gleichgewicht den T-Zustand begünstigt.
56 Subunit 1 Ser 14-P Kontaktzone: Tower-elix und N-Terminus Subunit 2 omodimer Phosphorylase a
57 Vergleich der Strukturen von Phosphorylase a und b am Beispiel von Subunit 2 Phosphorylase a Phosphorylase b
58 Zusätzlich wird das Gleichgewicht der Phosphorylase b zwischen T- und R-Zustand durch zelluläre Zustände beeinflußt (Feinabstimmung): In der Muskelzelle stabilisiert eine niedrige Energieladung (hohe AMP-Konzentrationen) die Phosphorylase b im R-Zustand, während eine hohe Energieladung (viel ATP und Glucose-6-phosphat) das Enzym vollkommen inaktiviert.
59 Der Übergang der Phosphorylase b vom R- zum T-Zustand wird also von der Energieladung der Muskelzelle kontrolliert. Unter den meisten physiologischen Bedingungen ist die Phosphorylase b aufgrund der emmeffekte von ATP und Glucose-6-phosphat inaktiv, während die Phosphorylase a vollaktiv ist (unabhängig von der Energieladung). Im ruhenden Muskel ist fast das gesamte Enzym im b-zustand. Muskeltätigkeit (elektrische Reizung) und erhöhter Adrenalinspiegel führen zur Bildung von Phosphorylase a. Da Glucose-6-phosphatase (das letzte Enzym der Gluconeogenese; siehe Einheit 9) im Muskel fehlt, wird das aus Glycogen gebildete Glucose-6-phosphat zur Energiegewinnung (Glycolyse) genutzt.
60 Die Glycogen-Phosphorylase der Leber unterscheidet sich in der Regulation von dem Muskel-Enzym (omologie etwa 90%). Im Gegensatz zum Muskel-Enzym zeigt beim Leber-Enzym die Phosphorylase a den am stärksten reagierenden T-R-Übergang. Bindung von Glucose verschiebt das allosterische Gleichgewicht von der R-Form zum T-Zustand. Dies gibt Sinn, weil die Leber für die Glucose-omöostase des Gesamtorganismus von Bedeutung ist. Sie stellt mit ilfe des Enzyms Glucose-6-phosphatase Glucose für den Export zu anderen Geweben bereit. Ist Glucose aus anderen Quellen verfügbar, gibt es keinen Grund Glycogen zu mobilisieren!
61 Die Phosphorylase wird durch das Enzym Phosphorylase- Kinase phosphoryliert. Großes Protein (im Skellettmuskel 1200 kda) mit der Untereinheitenstruktur ( ) 4. Die Phosphorylase-Kinase selbst wird zweifach kontrolliert: a) Sie wird ebenfalls durch Phosphorylierung aktiviert. Enzym: Protein-Kinase A, die ihrerseits auf camp reagiert. b) Aktivierung durch Ca 2+ -Spiegel von etwa 1 µm. Die -Untereinheit der Phosphorylase-Kinase ist Calmodulin, ein Calciumsensor, der in Eukaryoten viele Enzyme stimuliert. Im Muskel wird durch Kontraktion Ca 2+ aus dem sarkoplasmatischen Retikulum freigesetzt.
62 Aktivierung der Phosphorylase-Kinase: Phosphorylase a Proteinkinase A Phosphorylase b
63 Die Proteinkinase A, die wiederum die Phosphorylase-Kinase aktiviert, wird letztendlich (über camp) von ormonen aktiviert (siehe unten): Adrenalin (Epinephrin) stimuliert den Glycogenabbau im Skelletmuskel Glucagon (ungerhormon) stimuliert den Glycogenabbau in der Leber Adrenalin und Glucagon (aber auch Insulin) können die Zelle nicht betreten. Wie wird aber letztendlich die Information, dass diese ormone ins Blut ausgeschüttet wurden, an die jeweiligen Schrittmacherenzyme im Zellkompartiment übermittelt? Die Informationsübermittlung zwischen ormon und Schrittmacherenzym wird als Signaltransduktion, der Weg als Signaltransduktionskaskade bezeichnet.
64 Speicherkohlenhydrate Glykogenabbau Glycogensynthese Regulation und Integration des Glycogenstoffwechsels Signaltransduktion (Insulin, Glucagon, Adrenalin)
65 Die ormone Adrenalin und Glucagon binden an spezifische Rezeptoren (7TM-Rezeptoren) in der Plasmamembran von Muskelund Leberzellen. Adrenalin bindet an den -adrenergen Rezeptor des Muskels, während Glucagon an den Glucagon-Rezeptor der Leber bindet. Signaltransduktionskaskade am Beispiel Adrenalin und Glycogen-Abbau
66 Generell sorgen Rezeptoren mit sieben Transmembranhelices (7TM-Rezeptoren) für die Übermittlung von Informationen unterschiedlichster Signale (ormone, Neurotransmitter, Duftstoffe, Geschmacksstoffe, Photonen usw.). Sieben membrandurchspannende -elices ( Serpentinenrezeptoren ) Beispiel Rhodopsin (Sehvorgang; Ligand = Photon) Bindung eines Liganden (Licht, oder ormon aus der Zellumgebung) führt zu einer Konformationsänderung an den im Cytoplasma liegenden Loops und am C-terminalen Ende. Retinal (Rezeptor molekül)
67 Interessant war die Beobachtung, dass neben dem ormon auch GTP zur Signalübertragung notwendig ist und dass die Bindung des ormons an den 7TM-Rezeptor die ydrolyse von GTP anregt. Das sog. G-Protein (G steht für Guanylnucleotid) stellt eine Zwischenstufe in der von den 7TM-Rezeptoren ausgehenden Signaltransduktionskaskade dar. Im nicht aktivierten Zustand liegt das G-Protein als eterotrimer (,, ) vor, das GDP an die -UE (= G ) bindet. eterotrimer
68 Bei ormonbindung an den Rezeptor kommt es aber zu einer Konformationsänderung, die an das G-Protein weitergegeben wird: an G wird GDP gegen GTP ausgetauscht G dissoziiert von G ab Konformationsänderung durch Binden von GTP an G bewirkt drastische Konformationsänderung (die drei Schalterbereiche ) treten direkt mit dem -Phosphat des GTP in Kontakt. Affinität zu G geht so verloren.
69 Ein einziger ormon-rezeptorkomplex kann in vielen G-Protein- eterotrimeren für den Austausch des Nukleotids sorgen (Signalverstärkung). Generell sind alle 7TM-Rezeptoren an G-Proteine gekoppelt und deshalb werden sie auch als G-Protein-gekoppelte Rezeptoren oder GPCRs bezeichnet. Es gibt verschiedenste G-Proteine und diese können sich nach ihrer Aktivierung ganz unterschiedlich auf nachgeschaltete Ziele auswirken: G -Klasse aktivierendes Signal weitergegebenes Signal G s -adrenerge Amine, Stimulation (s) der Glucagon, Parathormon Adenylyl-Cyclase G i Acetylcholin, -adrenerge Inhibierung (i) der Amine, viele Neurotrans- Adenylyl-Cyclase mitter usw. usw.
70 G s bindet an das integrale Membranprotein Adenylyl-Cyclase und aktiviert dieses. Den enzymatisch aktiven Teil der Adenylyl-Cyclase bilden zwei Domänen im Inneren der Zelle: Die Wechselwirkung zwischen G s und der Adenylyl-Cyclase begünstigt eine katalytisch aktive Konformation des Enzyms und regt in der Folge die Produktion von camp an.
71 Adenylyl-Cyclasen (früher: Adenylatcyclasen) sind integrale Membranproteine der Klasse der Lyasen. Mehrere Isoenzyme sind bekannt. Ihre Aufgabe ist die Katalyse der Synthese von cyclischem Adenosinmonophosphat (camp) aus ATP.
72 Die steigende camp-konzentration hat vielfältigste Auswirkungen, jedoch werden die meisten Wirkungen in Eukaryotenzellen durch die Aktivierung einer einzigen Proteinkinase vermittelt: Proteinkinase A (PKA). Die Proteinkinase A besteht aus zwei regulatorischen (R-) und zwei katalytischen (C-)Ketten. hne camp ist der R 2 C 2 -Komplex inaktiv. Durch Binden von camp dissoziiert C 2 ab und wird enzymatisch aktiv, d.h. phosphoryliert einzelne Serin- und Threoninreste in vielen Zielproteinen, z.b. im Glycogenstoffwechsel (siehe oben). Die PKA stimuliert aber auch die Expression von Genen durch Phosphorylierung von Transkriptionsfaktoren (camp-response Element-Bindeprotein, CREB). Der Effekt der PKA kann also bis in den Zellkern reichen und die Genexpression beeinflussen.
73 Signaltransduktionskaskade am Beispiel Adrenalin und Glycogen-Abbau. Schema gilt auch für Glucagon! Bindendes ormon bewirkt Strukturänderungen im Rezeptor und in der Folge im G-Protein. Die GTP- Form der -UE aktiviert die Adenylyl-Cyclase.
74 Adenylyl-Cyclase, ein Transmembranprotein, katalysiert die Bildung von camp aus ATP. camp ist ein sekundärer Botenstoff (second messenger). Der erhöhte camp- Spiegel aktiviert die Proteinkinase A durch Binden von camp an regulatorische Untereinheiten.
75 Die Proteinkinase A phosphoryliert die Phosphorylase-Kinase, die dann ihrerseits die Glycogen-Phosphorylase phosphoryliert. Die camp-kaskade führt zu einer Verstärkung von ormoneffekten. Eine kleine Zahl von ormon-molekülen kann sehr viele Glucose-Moleküle freisetzen.
76 Signaltransduktionswege müssen auch rasch wieder abgeschaltet werden können! Die G -Untereinheit besitzt eine eigene GTPase-Aktivität und kann gebundenes GTP zu GDP und P i hydrolysieren (relativ langsam: Sekunden bis Minuten). Jedenfalls wirkt das G -Protein wie eine Zeitschaltuhr, die nach kurzer Zeit das Protein vom aktiven wieder in den inaktiven Ausgangszustand (eterotrimer) zurückbringt. Auch der aktivierte Rezeptor muss abgeschaltet werden können. (a) (b) Das ormon dissoziiert wieder ab (Dissoziatonsgleichgewicht: hängt von der ormonkonzentration ab!). Der ormon-rezeptorkomplex wird durch Phosphorylierung inaktiviert: Kinase des -adrenergen Rezeptors phosphoryliert nur den Komplex, aber nicht den freien Rezeptor. Zusätzlich bindet das Protein -Arrestin an den phosphorylierten Rezeptor und vermindert die Aktivierung von G-Proteinen. Desensibilisierung nach längerer Einwirkung von Adrenalin.
77 Rückführung von G in den Grundzustand: Beendigung des Signals:
78 Glycogenabbau- und Glycogen-Synthese werden reziprok über die hormoninduzierte camp-kaskade reguliert. Die Phosphorylase wird durch Phosphorylierung durch die Proteinkinase A (über Phosphorylase-Kinase) aktiviert, die Glycogen-Synthase direkt inaktiviert: Glycogen- Synthase b aktiv nicht aktiv
79 Die Informationskaskade ormon Schrittmacherenzym verläuft beim Insulin anders. Bei hohem Blutglucose-Spiegel stimuliert Insulin die Glycogen-Synthese. Mechanismus: Bindung von Insulin an sog. Rezeptor-Tyrosin-Kinase in der Plasmamembran Aktivierung insulinsensibler Protein-Kinasen, die die sog. Proteinphosphatase-1 phosphorylieren und dadurch aktivieren Diese katalysiert die Dephosphorylierung der Glycogen- Synthase (=Aktivierung), der Phosphorylase-Kinase (= Inaktivierung) und der Glycogen-Phosphorylase (=Inaktivierung).
80 Während 7TM-Rezeptoren Signaltransduktionswege durch Veränderung ihrer Tertiärstruktur in Gang setzen, die durch Bindung des Liganden (z.b. Glucagon, Adrenalin) ausgelöst werden, funktionieren andere Rezeptoren nach anderen Mechanismen. Bei manchen Rezeptoren führt die Ligandenbindung (z.b. beim menschlichen Wachstumsfaktor) zu einer Änderung der Quartärstruktur. Es kommt zu einer Dimerisierung des Rezeptors, wobei Proteinkinasedomänen im Zellinneren in Kontakt kommen und sich gegenseitig phosphorylieren (cross-phosphorylation). Diese gegenseitige Phosphorylierung initiiert dann die weitere Übertragung des Signals.
81 Zu diesem Typen von Rezeptoren gehören auch Rezeptor-Tyrosin- Kinasen (RTKs). Typische Liganden für RTKs sind Insulin, Epidermiswachstumsfaktor und Blutplättchen-wachstumsfaktor. Ligandenbindung führt zur Dimerisierung. Der Insulinrezeptor ist eine Ausnahme, da er auch ohne Insulin bereits in der dimeren Form vorliegt ( ). Dennoch ist die Bindung von Insulin zur Aktivierung der Kinase erforderlich (cross-phosphorylation). Diese cross-phosphorylation löst schließlich weitere intrazelluläre Kinase-Kaskaden aus (Kaskade von intrazellulären Phosphorylierungsreaktionen). Letztendlich wird durch Insulin sowohl die Glucoseaufnahme in die Zellen gefördert (Erhöhung der Expression der GLUT4-Transporter) als auch ihr Einbau in Glycogen (Stimulierung der Glycogenbiosynthese).
82 Kinase-Kaskade: Insulin-abhängige cross-phosphorylation an der Rezeptor-Tyrosin-Kinase Aktivierte Tyrosin-Kinasen phosphorylieren insulinsensible Protein-Kinasen Insulinsensible Protein-Kinasen phosphorylieren die sog. Proteinphosphatase-1. Letztere wird dadurch aktiviert. Diese katalysiert die Dephosphorylierung der Glycogen- Synthase (=Aktivierung), der Phosphorylase-Kinase (= Inaktivierung) und der Glycogen-Phosphorylase (=Inaktivierung).
83 Letztendlich wird durch das Enzym Proteinphosphatase 1 die Phosphorylgruppe von der Glycogen-Phosphorylase abgespalten und die inaktive b-form gebildet. Ebenso wird die Glycogen- Synthase dephosphoryliert und dadurch in die aktive a-form überführt. Die Proteinphosphatase 1 beschleunigt also die Glycogen-Synthese (Wirkung des Insulins). Proteinphosphatase 1 besteht aus drei Komponenten: PP1 R Gl Inhibitor (I) katalytische Untereinheit Untereinheit mit hoher Affinität zu Glycogen Regulatorische UE, die im phosphorylierten Zustand PP1 hemmt.
84 Insulinsensible Protein-Kinasen aktivieren die Proteinphosphatase-1 durch Phosphorylierung ihrer R Gl -UE. Dadurch kann R Gl -UE mit PP1 und dem Glycogenmolekül assoziieren. In dieser Form ist die Proteinphosphatase 1 aktiv und kann die Glycogen-Synthase (=Aktivierung), Phosphorylase-Kinase (= Inaktivierung) und Glycogen-Phosphorylase (=Inaktivierung) dephosphorylieren. Diese Enzyme sind oftmals mit Glycogen assoziiert vorliegend. Die Proteinphosphatase-1 kann aber durch Phosphorylierung durch Proteinkinase A auch abgeschaltet werden (Adrenalin und Glucagon abhängig). Phosphorylierung an anderer Position.
85 Die Proteinphosphatase 1 ist bei Überwiegen des Glycogenabbaus, wenn die Proteinkinase A aktiv ist (nach Adrenalinausschüttung!) inhibiert! 2 Mechanismen der Inhibierung: Adrenalin (1) Proteinkinase A phosphoryliert R Gl, wodurch sich die katalytische UE (PP1) vom Glycogenpartikel abtrennt Inaktivierung. (2) Proteinkinase A phosphoryliert Inhibitor (I), der im phosphorylierten Zustand die katalytische Aktivität der Proteinphosphatase 1 vollkommen hemmt.
BIOCHEMIE des Stoffwechsels ( )
 BICEMIE des Stoffwechsels (772.113) 10. Einheit Glycogen Stoffwechsel Speicherkohlenhydrate Glykogenabbau Glycogensynthese Regulation und Integration des Glycogenstoffwechsels Signaltransduktion (Insulin,
BICEMIE des Stoffwechsels (772.113) 10. Einheit Glycogen Stoffwechsel Speicherkohlenhydrate Glykogenabbau Glycogensynthese Regulation und Integration des Glycogenstoffwechsels Signaltransduktion (Insulin,
Glykogen. 1,6-glykosidisch verbunden sind. Die Verzweigungen dienen dazu das Molekül an vielen Stellen gleichzeitig ab- oder aufzubauen.
 Glykogen Glykogen stellt die Speicherform der Glucose dar. Der menschliche Körper kann Glucose nicht speichern (Osmose). Es können ca. 400g Glucose als Glykogen aufbewahrt werden. Chemischer Aufbau: Glykogen
Glykogen Glykogen stellt die Speicherform der Glucose dar. Der menschliche Körper kann Glucose nicht speichern (Osmose). Es können ca. 400g Glucose als Glykogen aufbewahrt werden. Chemischer Aufbau: Glykogen
Glykogenstoffwechsel. Glykogensynthese und Glykogenolyse
 Glykogenstoffwechsel Glykogensynthese und Glykogenolyse Glykogen lykogen ist das Speicher- bzw. Reserve-Kohlenhydrat bei Tieren Vergleichbar dem Amylopektin, ist Glykogen ein nichtlineares Polymer aus
Glykogenstoffwechsel Glykogensynthese und Glykogenolyse Glykogen lykogen ist das Speicher- bzw. Reserve-Kohlenhydrat bei Tieren Vergleichbar dem Amylopektin, ist Glykogen ein nichtlineares Polymer aus
Pentosephosphat-Weg: alternativer Abbau von Glucose. Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet.
 Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Gluconeognese Neusynthese von Glucose aus Pyruvat
 Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Wirkungsmechanismen regulatorischer Enzyme
 Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Praktikum Biochemie B.Sc. Water Science WS Enzymregulation. Marinja Niggemann, Denise Schäfer
 Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
6.3 Phospholipide und Signaltransduktion. Allgemeines
 6.3 Phospholipide und Signaltransduktion Allgemeines Bei der Signaltransduktion, das heißt der Weiterleitung von Signalen über die Zellmembran in das Innere der Zelle, denkt man zuerst einmal vor allem
6.3 Phospholipide und Signaltransduktion Allgemeines Bei der Signaltransduktion, das heißt der Weiterleitung von Signalen über die Zellmembran in das Innere der Zelle, denkt man zuerst einmal vor allem
Fakten und Fragen zur Vorbereitung auf das Seminar Signaltransduktion
 Prof. Dr. KH. Friedrich, Institut für Biochemie II Fakten und Fragen zur Vorbereitung auf das Seminar Signaltransduktion Voraussetzung für einen produktiven und allseits erfreulichen Ablauf des Seminars
Prof. Dr. KH. Friedrich, Institut für Biochemie II Fakten und Fragen zur Vorbereitung auf das Seminar Signaltransduktion Voraussetzung für einen produktiven und allseits erfreulichen Ablauf des Seminars
Klausur zur Vorlesung Biochemie I im WS 2001/02
 (insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
(insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
Testfragen zur 1. Vorlesung in Biochemie
 Testfragen zur 1. Vorlesung in Biochemie 1. Nennen Sie die zentralen Komponenten des Zwei-Komponenten-Systems 2. Auf welche Aminosäurereste werden die Phosphatgruppen übertragen? 3. Was wird bei der Chemotaxis
Testfragen zur 1. Vorlesung in Biochemie 1. Nennen Sie die zentralen Komponenten des Zwei-Komponenten-Systems 2. Auf welche Aminosäurereste werden die Phosphatgruppen übertragen? 3. Was wird bei der Chemotaxis
Z 11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
Z11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
Stoffwechsel. Metabolismus (3)
 Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Grundlagen der Physiologie
 Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
-Übersicht. 2. G-Protein-gekoppelte Rezeptoren. 5. Na + -K + -Pumpe REZEPTOREN. 1. Allgemeine Definition: Rezeptoren. 3. Tyrosin-Kinase Rezeptoren
 REZEPTOREN -Übersicht 1. Allgemeine Definition: Rezeptoren 2. G-Protein-gekoppelte Rezeptoren 3. Tyrosin-Kinase Rezeptoren Beispiel: Insulin 4. Steroidhormone 5. Na + -K + -Pumpe EINFÜHRUNG Definition
REZEPTOREN -Übersicht 1. Allgemeine Definition: Rezeptoren 2. G-Protein-gekoppelte Rezeptoren 3. Tyrosin-Kinase Rezeptoren Beispiel: Insulin 4. Steroidhormone 5. Na + -K + -Pumpe EINFÜHRUNG Definition
Kohlenhydrate C n. O) n (H 2. z.b. C 6 O 6 O) 6 H 12 : C 6. Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Monosaccharide
 Kohlenhydrate C n (H 2 O) n z.b. C 6 (H 2 O) 6 : C 6 H 12 O 6 Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Vortragender: Dr. W. Helliger Monosaccharide Reaktionen der Monosaccharide
Kohlenhydrate C n (H 2 O) n z.b. C 6 (H 2 O) 6 : C 6 H 12 O 6 Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Vortragender: Dr. W. Helliger Monosaccharide Reaktionen der Monosaccharide
Grundzüge des Kohlenhydratstoffwechsels
 Grundzüge des Kohlenhydratstoffwechsels 4.2 Grundzüge des Kohlenhydratstoffwechsels 4.2.1 Mono-, Oligo- und Polysaccharide Funktionen der Kohlenhydrate Kohlenhydrate erfüllen im Organismus zahlreiche wichtige
Grundzüge des Kohlenhydratstoffwechsels 4.2 Grundzüge des Kohlenhydratstoffwechsels 4.2.1 Mono-, Oligo- und Polysaccharide Funktionen der Kohlenhydrate Kohlenhydrate erfüllen im Organismus zahlreiche wichtige
Tyrosinkinase- Rezeptoren
 Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Tyrosinkinase- Rezeptoren für bestimmte Hormone gibt es integrale Membranproteine als Rezeptoren Aufbau und Signaltransduktionsweg unterscheiden sich von denen der G- Protein- gekoppelten Rezeptoren Polypeptide
Hemmung der Enzym-Aktivität
 Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Fettsäurebiosynthese
 Fettsäurebiosynthese Inhalt Fettsäuren Triacylglyceride FS-Biosynthese und einzelne Schritte Fettsäuren Lange CH-Ketten mit einer endständigen Carboxylgruppe 3 Gruppen: -> gesättigte FS -> einfach ungesättigte
Fettsäurebiosynthese Inhalt Fettsäuren Triacylglyceride FS-Biosynthese und einzelne Schritte Fettsäuren Lange CH-Ketten mit einer endständigen Carboxylgruppe 3 Gruppen: -> gesättigte FS -> einfach ungesättigte
o α(1->4) Glucanketten des Amylopektins in helikaler Hyperstruktur o α(1->6) Glucanverzweigungen an amorphe Lamellen Regionen
 Stärke wird dann gebildet, wenn im Calvin-Zyklus durch Belichtung mehr Kohlenhydrate gebildet werden als durch Export, Weiterverarbeitung und Regeneration verbraucht werden 1. Das Stärkekorn Mehrere Arten:
Stärke wird dann gebildet, wenn im Calvin-Zyklus durch Belichtung mehr Kohlenhydrate gebildet werden als durch Export, Weiterverarbeitung und Regeneration verbraucht werden 1. Das Stärkekorn Mehrere Arten:
Asmaa Mebrad Caroline Mühlmann Gluconeogenese
 Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Signale und Signalwege in Zellen
 Signale und Signalwege in Zellen Zellen müssen Signale empfangen, auf sie reagieren und Signale zu anderen Zellen senden können Signalübertragungsprozesse sind biochemische (und z.t. elektrische) Prozesse
Signale und Signalwege in Zellen Zellen müssen Signale empfangen, auf sie reagieren und Signale zu anderen Zellen senden können Signalübertragungsprozesse sind biochemische (und z.t. elektrische) Prozesse
Arten zellulärer Signalübertragung
 Arten zellulärer Signalübertragung Hormone SignalZelle Synapse Transmittermoleküle RezeptorLigand vermittelter Zell-Zell Kontakt Hormone als Signalmoleküle Adrenalin: Cortisol: Östradiol: Glucagon: Insulin:
Arten zellulärer Signalübertragung Hormone SignalZelle Synapse Transmittermoleküle RezeptorLigand vermittelter Zell-Zell Kontakt Hormone als Signalmoleküle Adrenalin: Cortisol: Östradiol: Glucagon: Insulin:
KOHLENHYDRATE PYRUVAT-DEHYDROGENASE
 PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
Hemmung der Enzym-Aktivität
 Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Citratzyklus. Biochemie Maria Otto,Bo Mi Ok Kwon Park
 Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Mechanismus der Enzymkatalyse
 Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O O 2 6 CO H 2 O G kj
 Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O G 0-2872 kj Hydrolyse der Stärke Ausgangssubstrate: Glucose, Fructose Stärkehydrolyse: Amylasen Endo- ( -Amylase) und
Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O G 0-2872 kj Hydrolyse der Stärke Ausgangssubstrate: Glucose, Fructose Stärkehydrolyse: Amylasen Endo- ( -Amylase) und
Glucose/Fettstoffwechsel
 Glucose/Fettstoffwechsel Glucose/Fettstoffwechsel Blutzuckerspiegel immer konstant 60 100 mg/100 ml oder 3,33 5,55 mmol/l. Synthese: Pankreas Hormon-Antagonisten Insulin Glucagon hemmt steigert Zucker-Neubildung
Glucose/Fettstoffwechsel Glucose/Fettstoffwechsel Blutzuckerspiegel immer konstant 60 100 mg/100 ml oder 3,33 5,55 mmol/l. Synthese: Pankreas Hormon-Antagonisten Insulin Glucagon hemmt steigert Zucker-Neubildung
9. Abbau der Glukose zum Pyruvat
 9. Abbau der Glukose zum Pyruvat 236 9.1. Übersicht: Abbau von Glucose Pentosephosphate Pathway (PPP) NADP + NADPH Glucose Glycolysis Oxidative Phosphorylation PDH Complex Citric Acid Citric Acid Cycle
9. Abbau der Glukose zum Pyruvat 236 9.1. Übersicht: Abbau von Glucose Pentosephosphate Pathway (PPP) NADP + NADPH Glucose Glycolysis Oxidative Phosphorylation PDH Complex Citric Acid Citric Acid Cycle
Liebe Studentinnen und Studenten Herzlich Willkommen im II. Semester!
 Liebe Studentinnen und Studenten Herzlich Willkommen im II. Semester! 1 Signalwege 2 Inhalt des Thema 1. Einleitung - 1. Vorlesung 2. Komponenten der Signalwegen 1. Vorlesung 3. Hauptsignalwege 2. Vorlesung
Liebe Studentinnen und Studenten Herzlich Willkommen im II. Semester! 1 Signalwege 2 Inhalt des Thema 1. Einleitung - 1. Vorlesung 2. Komponenten der Signalwegen 1. Vorlesung 3. Hauptsignalwege 2. Vorlesung
Chemische Signale bei Tieren
 Chemische Signale bei Tieren 1. Steuersysteme der Körper: - Endokrines System (Hormonsystem) im Ueberblick 2. Wirkungsweise chemischer Signale - auf Zielzellen - Aktivierung von Signalübertragungswege
Chemische Signale bei Tieren 1. Steuersysteme der Körper: - Endokrines System (Hormonsystem) im Ueberblick 2. Wirkungsweise chemischer Signale - auf Zielzellen - Aktivierung von Signalübertragungswege
Abschlussklausur zur Vorlesung Biomoleküle II WS 2004/05
 16.02.2005 Abschlussklausur zur Vorlesung Biomoleküle II WS 2004/05 Name: Studienfach: Matrikelnummer: Fachsemester: Hinweise: 1. Bitte tragen Sie Ihren Namen, Matrikelnummer, Studienfach und Semesterzahl
16.02.2005 Abschlussklausur zur Vorlesung Biomoleküle II WS 2004/05 Name: Studienfach: Matrikelnummer: Fachsemester: Hinweise: 1. Bitte tragen Sie Ihren Namen, Matrikelnummer, Studienfach und Semesterzahl
BIOCHEMIE. Prof. Manfred SUSSITZ. über(be)arbeitet und zusammengestellt nach Internetvorlagen:
 BIOCHEMIE Prof. Manfred SUSSITZ über(be)arbeitet und zusammengestellt nach Internetvorlagen: Medizinische Fakultät, Universität Erlangen http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html
BIOCHEMIE Prof. Manfred SUSSITZ über(be)arbeitet und zusammengestellt nach Internetvorlagen: Medizinische Fakultät, Universität Erlangen http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html
Wiederholungsklausur zur Vorlesung Biochemie IV im SS 2000
 Wiederholungsklausur zur Vorlesung Biochemie IV im SS 2000 am 15.11.2000 von 13.45 15.15 Uhr (insgesamt 100 Punkte, mindestens 50 erforderlich) Bitte Name, Matrikelnummer und Studienfach 1. Wie erfolgt
Wiederholungsklausur zur Vorlesung Biochemie IV im SS 2000 am 15.11.2000 von 13.45 15.15 Uhr (insgesamt 100 Punkte, mindestens 50 erforderlich) Bitte Name, Matrikelnummer und Studienfach 1. Wie erfolgt
Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte)
 Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
ENZYME. Teil 1: Grundlagen und Substratbestimmungen
 ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 09.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 09.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Signaltermination bei G-Protein gekoppelten Rezeptoren. Viele Schalter für ein Signal!
 Signaltermination bei G-Protein gekoppelten Rezeptoren Viele Schalter für ein Signal! SIGNALE: Hormone Neurotransmitter Cytokine Fettsäurederivate Licht Duft ZELLE REAKTION: Stoffwechsel Proteinsynthese
Signaltermination bei G-Protein gekoppelten Rezeptoren Viele Schalter für ein Signal! SIGNALE: Hormone Neurotransmitter Cytokine Fettsäurederivate Licht Duft ZELLE REAKTION: Stoffwechsel Proteinsynthese
Der Stoffwechsel. Wir zeigen dir wie er funktioniert.
 Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Guter Stoffwechsel, schlechter Stoffwechsel, der Stoffwechsel schläft, den Stoffwechsel ankurbeln,
Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Guter Stoffwechsel, schlechter Stoffwechsel, der Stoffwechsel schläft, den Stoffwechsel ankurbeln,
-Klausur Biochemie Name: Matrikelnr.: 1. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist.
 4.07.205 Name: Matrikelnr.:. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist. 2. Was bedeutet es, wenn eine schwache Säure einen pks von 5 hat? 3. Nennen Sie
4.07.205 Name: Matrikelnr.:. a) Erklären Sie, warum ist Wasser gutes Lösungsmittel von Salzen und polaren Biomolekülen ist. 2. Was bedeutet es, wenn eine schwache Säure einen pks von 5 hat? 3. Nennen Sie
Glucose-6-Phosphat > Glucose-1-Phosphat Glucose-1-Phosphat + UTP UTP > > UDP-Glucose + PPi PPi
 Phosphoglucomutase Phosphoglucomutase Glucose-6-Phosphat -------------------> Glucose-1-Phosphat Glucose-1-Phosphat + UTP UTP -------> -------> UDP-Glucose + PPi PPi fehlt fehlt bei bei Galactoseseintolleranz
Phosphoglucomutase Phosphoglucomutase Glucose-6-Phosphat -------------------> Glucose-1-Phosphat Glucose-1-Phosphat + UTP UTP -------> -------> UDP-Glucose + PPi PPi fehlt fehlt bei bei Galactoseseintolleranz
Parotis Pankreas. Dünndarm Bürstensaum. Amylose Amylopektin Glykogen. Maltose. Glucose. Isomaltose. Saccharose. Fructose. Lactose. Galaktose.
 Parotis Pankreas Dünndarm Bürstensaum Amylose Amylopektin Glykogen Saccharose Lactose Maltose Isomaltose Saccharase (Sucrase) Lactase Maltase Isomaltase Glucose Fructose Galaktose Abbau von Stärke und
Parotis Pankreas Dünndarm Bürstensaum Amylose Amylopektin Glykogen Saccharose Lactose Maltose Isomaltose Saccharase (Sucrase) Lactase Maltase Isomaltase Glucose Fructose Galaktose Abbau von Stärke und
Weitere Übungsfragen
 1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
Mohammed Jaber KOHLENHYDRATE
 Mohammed Jaber KOHLENHYDRATE Wichtige Disaccharide: Maltose alpha-glc(1-4)glc entsteht als Zwischenprodukt beim Stärkeund Glykogenabbau Saccharose a-glc(1-6)ß-fru kann bei parenteraler Zufuhr nicht gespalten
Mohammed Jaber KOHLENHYDRATE Wichtige Disaccharide: Maltose alpha-glc(1-4)glc entsteht als Zwischenprodukt beim Stärkeund Glykogenabbau Saccharose a-glc(1-6)ß-fru kann bei parenteraler Zufuhr nicht gespalten
Was bisher geschah 1
 Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Schrittweise Oxidation und Decarboxylierung von Glucose-6-phosphat zu Ribulose-5- phosphat
 1. Der plastidäre oxidative Pentosephosphatweg Abbau von Hexose unter NADPH+H + -Synthese Schlüsselenzym=Glucose-6-phosphat-Dehydrogenase Glucose-6-phosphat-Dehydrogenase wird durch Thioredoxin im reduzierten
1. Der plastidäre oxidative Pentosephosphatweg Abbau von Hexose unter NADPH+H + -Synthese Schlüsselenzym=Glucose-6-phosphat-Dehydrogenase Glucose-6-phosphat-Dehydrogenase wird durch Thioredoxin im reduzierten
Zellen verwandeln Zucker in Energie
 Zellen verwandeln Zucker in Energie Kohlenhydrate sind äusserst wichtige Brennstofflieferanten. Pflanzen können Zucker selber herstellen (vgl. autotrophe Organismen); Tiere hingegen müssen Zucker (und
Zellen verwandeln Zucker in Energie Kohlenhydrate sind äusserst wichtige Brennstofflieferanten. Pflanzen können Zucker selber herstellen (vgl. autotrophe Organismen); Tiere hingegen müssen Zucker (und
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Citratzyklus. Citratzyklus
 Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
Kohlenhydrate Aminosäuren Peptide
 Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Regulation der Glykolyse: Phosphofructokinase
 Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
Der Fettsäurestoffwechsel. Basierend auf Stryer Kapitel 22
 Der Fettsäurestoffwechsel Basierend auf Stryer Kapitel 22 1 CoA 2 3 Überblick 4 Ein paar Grundlagen... Carbonsäure Alkohol Carbonsäureester Eine Acyl-Gruppe 5 Eine Acyl-Gruppe H O Formyl H 3 C O Acetyl
Der Fettsäurestoffwechsel Basierend auf Stryer Kapitel 22 1 CoA 2 3 Überblick 4 Ein paar Grundlagen... Carbonsäure Alkohol Carbonsäureester Eine Acyl-Gruppe 5 Eine Acyl-Gruppe H O Formyl H 3 C O Acetyl
Klausur zur Vorlesung Biochemie I im WS 2004/05
 Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
Inhaltsverzeichnis. I Stoffwechsel. 1 Vom Organismus zum Molekül Aminosäuren Peptide und Proteine Enzyme...
 XI I Stoffwechsel 1 Vom Organismus zum Molekül...................... 2 1.1 Aufbau des Organismus.............................. 2 1.2 Chemische Grundlagen des Stoffwechsels.................. 6 1.3 Informationsübertragung
XI I Stoffwechsel 1 Vom Organismus zum Molekül...................... 2 1.1 Aufbau des Organismus.............................. 2 1.2 Chemische Grundlagen des Stoffwechsels.................. 6 1.3 Informationsübertragung
Biologische Katalysatoren
 Biologische Katalysatoren Die Entdeckung der biologischen Katalysatoren (Enzyme) ist eng mit der Entstehungsgeschichte der Biochemie verknüpft: Ende 19. Jhdt: Speichel - Fleischverdauung durch Magensäfte
Biologische Katalysatoren Die Entdeckung der biologischen Katalysatoren (Enzyme) ist eng mit der Entstehungsgeschichte der Biochemie verknüpft: Ende 19. Jhdt: Speichel - Fleischverdauung durch Magensäfte
Oxidative Phosphorylierung
 BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
- der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen
 Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Einführung in die Biochemie Wirkungsweise von Enzymen
 Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Basiswissen Ernährungslehre
 Basiswissen Ernährungslehre Hauptnährstoffgruppen und bioaktive Substanzen Ergänze folgende Übersicht zu den natürlichen Bestandteilen der Nahrung Natürliche Bestandteile der Nahrung Nährstoffe Funktionsgruppen
Basiswissen Ernährungslehre Hauptnährstoffgruppen und bioaktive Substanzen Ergänze folgende Übersicht zu den natürlichen Bestandteilen der Nahrung Natürliche Bestandteile der Nahrung Nährstoffe Funktionsgruppen
D) Die Verbindung enthält fünf sekundäre OH-Gruppen. E) Es handelt sich um einen zyklischen Ester (Lacton).
 1, Fragentyp D Welche der folgenden Aussagen ist (sind) richtig? 1. Nur die Zellwand grampositiver Bakterien besitzt als wesentliches Bauelement Peptidoglycan (Murein). 2. Murein besteht aus Heteropolysaccharidketten,
1, Fragentyp D Welche der folgenden Aussagen ist (sind) richtig? 1. Nur die Zellwand grampositiver Bakterien besitzt als wesentliches Bauelement Peptidoglycan (Murein). 2. Murein besteht aus Heteropolysaccharidketten,
Testklausur aus Seminar für 3. Biochemieklausur 2001 (Membranen, Hormone)
 Testklausur aus Seminar für 3. Biochemieklausur 2001 (Membranen, Hormone) 1. - 4. Ordnen Sie die in der ersten Liste aufgeführten Membrankomponenten (A-E) den Aussagen der zweiten Liste (1-4) zu: A. Cerebroside
Testklausur aus Seminar für 3. Biochemieklausur 2001 (Membranen, Hormone) 1. - 4. Ordnen Sie die in der ersten Liste aufgeführten Membrankomponenten (A-E) den Aussagen der zweiten Liste (1-4) zu: A. Cerebroside
Übung 6 Vorlesung Bio-Engineering Sommersemester Nervenzellen: Kapitel 4. 1
 Bitte schreiben Sie Ihre Antworten direkt auf das Übungsblatt. Falls Sie mehr Platz brauchen verweisen Sie auf Zusatzblätter. Vergessen Sie Ihren Namen nicht! Abgabe der Übung bis spätestens 21. 04. 08-16:30
Bitte schreiben Sie Ihre Antworten direkt auf das Übungsblatt. Falls Sie mehr Platz brauchen verweisen Sie auf Zusatzblätter. Vergessen Sie Ihren Namen nicht! Abgabe der Übung bis spätestens 21. 04. 08-16:30
Der Energiestoffwechsel eukaryotischer Zellen
 Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
CAM Säurestoffwechsel der Dickblattgewächse zeitliche nicht räumliche Trennung
 CAM Säurestoffwechsel der Dickblattgewächse zeitliche nicht räumliche Trennung 1. Die CAM-Pflanzen Crassulaceen-Säurestoffwechsel o Stoffwechsel-Leistung einer Zelle o Die Photosynthese-bezogene Stoffwechsel-Prozesse
CAM Säurestoffwechsel der Dickblattgewächse zeitliche nicht räumliche Trennung 1. Die CAM-Pflanzen Crassulaceen-Säurestoffwechsel o Stoffwechsel-Leistung einer Zelle o Die Photosynthese-bezogene Stoffwechsel-Prozesse
Funktion von Proteinen:
 Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
Klausur zur Vorlesung Biochemie I im WS 1993/1994. am 18. Februar Nachklausur zur Vorlesung Biochemie I im WS 1993/1994. am 30. Mai 1994.
 Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Biochemie II. im Wintersemester 2009/2010. Joachim Wegener. Institut für Analytische Chemie, Chemo- und Biosensorik Universität Regensburg
 Biochemie II im Wintersemester 2009/2010 Joachim Wegener Institut für Analytische Chemie, Chemo- und Biosensorik Universität Regensburg 18.10.2010 1/14 Biochemie II im WS 2010 / 2011 All Dozenten auf einen
Biochemie II im Wintersemester 2009/2010 Joachim Wegener Institut für Analytische Chemie, Chemo- und Biosensorik Universität Regensburg 18.10.2010 1/14 Biochemie II im WS 2010 / 2011 All Dozenten auf einen
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail. Mag. Gerald Trutschl
 Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Elektronenmikroskopie zeigte die Existenz der A-, P- und E- trna-bindungsstellen. Abb. aus Stryer (5th Ed.)
 Elektronenmikroskopie zeigte die Existenz der A-, P- und E- trna-bindungsstellen Die verschiedenen Ribosomen-Komplexe können im Elektronenmikroskop beobachtet werden Durch Röntgenkristallographie wurden
Elektronenmikroskopie zeigte die Existenz der A-, P- und E- trna-bindungsstellen Die verschiedenen Ribosomen-Komplexe können im Elektronenmikroskop beobachtet werden Durch Röntgenkristallographie wurden
Die Wege des Kohlenstoffes
 Die Wege des Kohlenstoffes 1. Licht vs. Dunkelreaktionen Lichtgetriebene Reaktionen o Dunkle -Reaktionen laufen nicht im Dunklen ab reduzieren CO 2-Zucker für Pflanzen zum Wachsen und für uns zum Nutzen
Die Wege des Kohlenstoffes 1. Licht vs. Dunkelreaktionen Lichtgetriebene Reaktionen o Dunkle -Reaktionen laufen nicht im Dunklen ab reduzieren CO 2-Zucker für Pflanzen zum Wachsen und für uns zum Nutzen
52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat
 2. Testat Biochemie 93/94 - Teil B (Leider ist dies nur ein Teil der Fragen!) 52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat 3) Biotin 2)
2. Testat Biochemie 93/94 - Teil B (Leider ist dies nur ein Teil der Fragen!) 52: Welche der Coenzyme sind an der oxidativen Decarboxylierung von Pyruvat beteiligt? 1) Thiaminpyrophosphat 3) Biotin 2)
Eukaryotische messenger-rna
 Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende u.u. nicht-codierende Bereiche (Introns) Spleißen von prä-mrna Viele Protein-codierende Gene in Eukaryoten sind durch nicht-codierende
Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende u.u. nicht-codierende Bereiche (Introns) Spleißen von prä-mrna Viele Protein-codierende Gene in Eukaryoten sind durch nicht-codierende
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue rüfungsordnung Dauer Std.),. 4. 203, 8:30-9:30 Uhr, Mensa -3, sowie Biochemische Teilklausur zum Grundmodul 07
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue rüfungsordnung Dauer Std.),. 4. 203, 8:30-9:30 Uhr, Mensa -3, sowie Biochemische Teilklausur zum Grundmodul 07
Enzym-Regulation (Abb. 1) Heute werde ich mich mit dem Thema Enzym-Regulation auseinandersetzen. Im Stoffwechsel von lebenden Zellen arbeiten Gruppen
 1 Enzym-Regulation (Abb. 1) Heute werde ich mich mit dem Thema Enzym-Regulation auseinandersetzen. Im Stoffwechsel von lebenden Zellen arbeiten Gruppen von Enzymen nacheinander in dem Sinne, dass das Produkt
1 Enzym-Regulation (Abb. 1) Heute werde ich mich mit dem Thema Enzym-Regulation auseinandersetzen. Im Stoffwechsel von lebenden Zellen arbeiten Gruppen von Enzymen nacheinander in dem Sinne, dass das Produkt
Membranen. U. Albrecht
 Membranen Struktur einer Plasmamembran Moleküle gegeneinander beweglich -> flüssiger Charakter Fluidität abhängig von 1) Lipidzusammensetzung (gesättigt/ungesättigt) 2) Umgebungstemperatur Biologische
Membranen Struktur einer Plasmamembran Moleküle gegeneinander beweglich -> flüssiger Charakter Fluidität abhängig von 1) Lipidzusammensetzung (gesättigt/ungesättigt) 2) Umgebungstemperatur Biologische
Stoffwechsel der essentiellen Aminosäuren
 Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Enzyme SPF BCH am
 Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Zucker und Polysaccharide (Voet Kapitel 10)
 Zucker und Polysaccharide (Voet Kapitel 10) 1. Monosaccharide 2. Polysaccharide 3. Glycoproteine 2. Polysaccharide Polysaccharide = Glycane, bestehen aus glycosidisch miteinander verbundenen Monosacchariden
Zucker und Polysaccharide (Voet Kapitel 10) 1. Monosaccharide 2. Polysaccharide 3. Glycoproteine 2. Polysaccharide Polysaccharide = Glycane, bestehen aus glycosidisch miteinander verbundenen Monosacchariden
Präsentation STOFFWECHSEL STOFFWECHSEL. Fettstoffwechsel im Sport. Biologische Oxidation Zitratzyklus und Atmungskette
 STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
Posttranskriptionale RNA-Prozessierung
 Posttranskriptionale RNA-Prozessierung Spaltung + Modifikation G Q Spleissen + Editing U UUU Prozessierung einer prä-trna Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende
Posttranskriptionale RNA-Prozessierung Spaltung + Modifikation G Q Spleissen + Editing U UUU Prozessierung einer prä-trna Eukaryotische messenger-rna Cap-Nukleotid am 5 -Ende Polyadenylierung am 3 -Ende
Kohlenhydrate und ihre Funktionen
 Kohlenhydrate und ihre Funktionen Gliederung Monosaccharide Aufbau Nomenklatur Stereoisomerie/Konfiguration Zyklisierung O-glykosidische Bindung N-glykosidische Bindung Disaccharide Kohlenhydrate im Überblick
Kohlenhydrate und ihre Funktionen Gliederung Monosaccharide Aufbau Nomenklatur Stereoisomerie/Konfiguration Zyklisierung O-glykosidische Bindung N-glykosidische Bindung Disaccharide Kohlenhydrate im Überblick
Um diesen Prozess zu verstehen, müssen wir die Wege der Glukose genauer betrachten.
 Glukose hilft uns, auch bei intensiven Belastungen zu überleben. Wieso? Um diesen Prozess zu verstehen, müssen wir die Wege der Glukose genauer betrachten. In diesem Artikel geht es nicht nur um den Abbau
Glukose hilft uns, auch bei intensiven Belastungen zu überleben. Wieso? Um diesen Prozess zu verstehen, müssen wir die Wege der Glukose genauer betrachten. In diesem Artikel geht es nicht nur um den Abbau
Vorlesungsdoppelstunde am (Vertretung für Anne Ulrich)
 Vorlesungsdoppelstunde am 11.06.2015 (Vertretung für Anne Ulrich) Inhalt: Lehrbuch: Stryer, Biochemie (ab 6. Auflage): Kapitel 16: Glukoneogenese aus dem Kapitel Glykolyse Kapitel 21: Der Glykogenstoffwechsel
Vorlesungsdoppelstunde am 11.06.2015 (Vertretung für Anne Ulrich) Inhalt: Lehrbuch: Stryer, Biochemie (ab 6. Auflage): Kapitel 16: Glukoneogenese aus dem Kapitel Glykolyse Kapitel 21: Der Glykogenstoffwechsel
LIPIDE. Periphere Gruppe mit Cysteinylrest. FS-Synthase. Zentrale Gruppe Phosphopanthetinarm kovalente Bindung
 Periphere Gruppe mit Cysteinylrest FS-Synthase Zentrale Gruppe Phosphopanthetinarm kovalente Bindung Die FS-Biosynthse aus Acetyl-CoA und Malonyl-CoA, wird komplett an dem dimeren Multienzymkomplex FETTSÄURESYNTHETASE
Periphere Gruppe mit Cysteinylrest FS-Synthase Zentrale Gruppe Phosphopanthetinarm kovalente Bindung Die FS-Biosynthse aus Acetyl-CoA und Malonyl-CoA, wird komplett an dem dimeren Multienzymkomplex FETTSÄURESYNTHETASE
In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit
 In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit in der Nucleotidsequenz der DNA verschlüsselt (codiert)
In den Proteinen der Lebewesen treten in der Regel 20 verschiedene Aminosäuren auf. Deren Reihenfolge muss in der Nucleotidsequenz der mrna und damit in der Nucleotidsequenz der DNA verschlüsselt (codiert)
Aufnahme von Zucker aus dem Darm
 Arbeitsanweisung Arbeitsauftrag Ziel: Es wird erklärt, wie die verschiedenen Zucker ins Blut aufgenommen werden. Dabei müssen aufgrund der verschiedenen Zucker und deren Strukturen verschiedene Mechanismen
Arbeitsanweisung Arbeitsauftrag Ziel: Es wird erklärt, wie die verschiedenen Zucker ins Blut aufgenommen werden. Dabei müssen aufgrund der verschiedenen Zucker und deren Strukturen verschiedene Mechanismen
Primärstoffwechsel. Prof. Dr. Albert Duschl
 Primärstoffwechsel Prof. Dr. Albert Duschl Aufgaben Der Primärstoffwechsel sorgt für Aufbau (Anabolismus) und Abbau (Katabolismus) biologischer Moleküle, wie Aminosäuren, Lipide, Kohlenhydrate und Nukleinsäuren.
Primärstoffwechsel Prof. Dr. Albert Duschl Aufgaben Der Primärstoffwechsel sorgt für Aufbau (Anabolismus) und Abbau (Katabolismus) biologischer Moleküle, wie Aminosäuren, Lipide, Kohlenhydrate und Nukleinsäuren.
Abschlußklausur zur VorlesUD!! Biomoleküle III
 Abschlußklausur zur VorlesUD!! Biomoleküle III Berlin, den 25. Juli 2008 SS 2008 Name: Studienfach: Matrikelnummer: Fachsemester: Hinweise: 1. Bitte tragen Sie Ihren Namen, Matrikelnummer, Studienfach
Abschlußklausur zur VorlesUD!! Biomoleküle III Berlin, den 25. Juli 2008 SS 2008 Name: Studienfach: Matrikelnummer: Fachsemester: Hinweise: 1. Bitte tragen Sie Ihren Namen, Matrikelnummer, Studienfach
Praktikumsreferat Biochemie
 Praktikumsreferat Biochemie Thema: Glycolyse und Gluconeogenese 1. Glycolyse im Überblick Die Glycolyse (gr.: glykys = süß, lysis = auflösen) beschreibt den Abbau von Glucose zu Pyruvat (aerobe Glycolyse
Praktikumsreferat Biochemie Thema: Glycolyse und Gluconeogenese 1. Glycolyse im Überblick Die Glycolyse (gr.: glykys = süß, lysis = auflösen) beschreibt den Abbau von Glucose zu Pyruvat (aerobe Glycolyse
Biomoleküle II Enzymkinetik, Hämoglobin, Signalkaskaden (MAPK & G-Protein)
 Biomoleküle II Enzymkinetik, Hämoglobin, Signalkaskaden (MAPK & G-Protein) 1. Was sind Enzyme? - Biokatalysatoren - Beschleunigen chem. Reaktionen in der Zelle - Spezifität/ Affinität zum Substrat - katalytische
Biomoleküle II Enzymkinetik, Hämoglobin, Signalkaskaden (MAPK & G-Protein) 1. Was sind Enzyme? - Biokatalysatoren - Beschleunigen chem. Reaktionen in der Zelle - Spezifität/ Affinität zum Substrat - katalytische
- Biochemieklausur Name: Matrikelnr.:
 07.02.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
07.02.207 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Alle(s) Zucker oder was?
 Alle(s) Zucker oder was? Ein gesundes Gehirn Alles eine Frage des Zuckers? Werner Reutter Institut für Biochemie und Molekularbiologie Charité - Universitätsmedizin Berlin Campus Benjamin Franklin Konstanz
Alle(s) Zucker oder was? Ein gesundes Gehirn Alles eine Frage des Zuckers? Werner Reutter Institut für Biochemie und Molekularbiologie Charité - Universitätsmedizin Berlin Campus Benjamin Franklin Konstanz
Biologie für Mediziner WS 2007/08
 Biologie für Mediziner WS 2007/08 Teil Allgemeine Genetik, Prof. Dr. Uwe Homberg 1. Endozytose 2. Lysosomen 3. Zellkern, Chromosomen 4. Struktur und Funktion der DNA, Replikation 5. Zellzyklus und Zellteilung
Biologie für Mediziner WS 2007/08 Teil Allgemeine Genetik, Prof. Dr. Uwe Homberg 1. Endozytose 2. Lysosomen 3. Zellkern, Chromosomen 4. Struktur und Funktion der DNA, Replikation 5. Zellzyklus und Zellteilung
