BIOCHEMIE des Stoffwechsels ( )
|
|
|
- Angelika Kohl
- vor 7 Jahren
- Abrufe
Transkript
1 Glycolyse 6. Reaktion: Glycerinaldehyd-3- phosphat-dehydrogenase BIEMIE des Stoffwechsels ( ) 5. Einheit Glycerinaldehyd-3- + NAD + + i 1,3-Bisphosphoglycerat + NAD + + Enzym: xidoreductase Glycerinaldehyd-3-phosphat-Dehydrogenase (E ) Tetramer 4 37 kda (Kaninchenmuskel) Glycerinaldehyd-3-1,3-Bisphosphoglycerat Glycolyse (2) 3 + NAD + + i + NAD Glycerinaldehyd-3-- Dehydrogenase (Mensch): Tetramer Aldehydoxidation: stark exergonisch Bildung von NAD und Bisphosphoglycerat (Acylphosphat = gemischtes Anhydrid): endergonisch G = + 6,3 kj/mol (K eq = 0,078) G = -1,29 kj/mol NAD + Mechanistische Untersuchungen: A. Glycerinaldehyd-3--D wird durch Alkylierung mit stöchiometrischen Mengen IDAETAT inaktiviert. Akkumulierung von Fructose-1,6-bisphosphat im ytosol ( ystein im aktiven Zentrum). Enzym- 2 -S + I 2 - Enzym- 2 -S- 2 - I roteinhydrolyse B aus 1-3 -GA wird durch Glycerinaldehyd-3-D auf NAD + übertragen ( Reaktion verläuft über direkte ydrid-übertragung) NAD + + i + NAD N 3 2 S arboxymethylcystein + andere Aminosäuren 1
2 Mechanistische Untersuchungen:. Die GA-D katalysiert (reversible) Isotopenaustauschreaktion von 32 zwischen [ 32 ]- i und Acetylphosphat (Analogon des rodukts). Dies weist auf Acyl-Enzym-Zwischenprodukt hin (reversible kovalente Knüpfung der gemischten Anhydridbindung). GA-D Reaktionsmechanismus 1. Binden von Glycerinaldehyd-3-hosphat an das Enzym 2. Nucleophiler Angriff der Sulfhydrylgruppe am arbonyl--atom des Aldehyds. Bildung eines Thiohalbacetals. B: S 2 3 B + S 2 3 Bildung eines Thiohalbacetals: kovalente Katalyse Reaktionsmechanismus 3. xidation des Thiohalbacetals zu einem Acylthioester (wurde als Zwischenprodukt isoliert) durch direkte Übertragung eines ydrid-ions auf NAD + N 2 B + S N R N 2 S B Acylthioester N R Im Acylthioester wird der Großteil der bei der xidationsreaktion freigesetzten Freien Enthalpie gespeichert (letztendlich für die Kopplung an o-hosphat und Ausbildung des gemischten Anhydrids) 4. NAD + verdrängt NAD 5. Nucleophiler Angriff von i an das Thioester- Zwischenprodukt 6. Knüpfung der gemischten Anhydridbindung S - B ,3-Bisphosphoglycerat Veränderung der Freien Enthalpie bei der xidation von Glycerinaldehyd mit anschließender Bildung von Acylphosphat. Acylthioester (A) ypothetischer Fall ohne Kopplung beider rozesse. Der zweite Schritt benötigt eine große Aktivierungsenergie, was die Reaktion sehr verlangsamt. (B) Der tatsächliche Verlauf. Die beiden Reaktionen sind über ein Thioester- Zwischenprodukt miteinander gekoppelt. 2
3 Arsenat entkoppelt die xidationsreaktion von der hosphorylierungsreaktion: Arsenat (As 3-4 ) ist anionisches Analogon zu hosphat. Es reagiert mit GA-D unter Bildung von 1-Arseno-3- hosphoglycerat: As Glycerinaldehyd-3--Dehydrogenase (Mensch): Tetramer ier ist die Struktur eines Monomers dargestellt. Acylarsenate sind jedoch ydrolyse-labil und zerfallen unter Bildung von 3-hosphoglycerat. Glycolyse geht weiter, jedoch ist AT-Bildung über Substratkettenphosphorylierung durch nachfolgende Kinase-Reaktion nicht mehr möglich. NAD+ Blick von außen auf NAD + -Bindungsstelle NAD + NAD + NAD Markierungsversuche mit Deuterium: GA-D überträgt ydrid-ion stets auf die si-seite des Nicotinamidringes von NAD +. Das übertragene -Atom wird zum pro-s-substituenten am (4) des NAD. Die ydrid- Ionenübertragung ist absolut stereospezifisch. re-seite R N N2 si-seite :D D -- si-seite R N R D s N2 Lactat-D, Alkohol-D katalysieren die Übertragung des pro-r- Wasserstoffs von NAD 3
4 Glycolyse 7. Reaktion: hosphoglycerat-kinase 1,3-Bisphosphoglycerat + AD 3-hosphoglycerat + AT Enzym: hosphotransferase hosphoglycerat-kinase (E ) Monomer 64 kda (Kaninchenmuskel) ofactor: Mg 2+ 1,3-Bisphosphoglycerat 3-hosphoglycerat AD GK, Mg G = -18,9 kj/mol (K eq = 2060), G = 0,1 kj/mol Reaktion 6 und 7 der Glycolyse sind gekoppelt (1,3- Bisphosphoglycerat als Intermediat): Glycerinaldehyd-3- + AD + i + NAD + 3-hosphoglycerat + AT + NAD + + G 6+7 = -12,6 kj/mol SUBSTRATKETTENSRYLIERUNG + AT hosphoglycerat-kinase aus efe GK-Komplex mit AT und 1,3-BG AT AT Domäne 1: Bindungsstelle für Mg 2+- AD Domäne 2: Bindungsstelle für 1,3-BG Typische (zweilappige) Domänenstruktur (vgl. exokinase) Bindungsstellen der beiden Substrate: 10 Å entfernt; Kinase: Substratinduzierte Konformationsänderung Sequentieller kinetischer Mechanismus: Angriff des terminalen hosphoryl-sauerstoffs des AD auf das (1)-hosphoratom von 1,3-BG: - Mg Adenosin Mg 2+ Adenosin Nebenweg der Glykolyse: Synthese von 2,3-Bisphosphoglycerat in Erythrocyten Glycerinaldehyd-3-hosphat GA-D 1,3-Bisphosphoglycerat GK 3-hosphoglycerat GM hosphoglycerat Bisphospho- glycerat- Mutase i 2,3- Bisphospho glycerat- hosphatase ,3- Bisphosphoglycerat 4
5 Bisphosphoglycerat-Mutase ,3-Bisphosphoglycerat-hosphatase 2,3- BG ,3- BG 2 i Intermolekularer hosphoryltransfer vom (1) des 1,3-BG zum (2) des 3-G Konzentration von 2,3 BG in Erythrocyten: 3 mm; in Spuren in allen anderen Zellen ,3 BG ist wichtigster allosterischer Effektor des ämoglobins; Bindung an Desoxyhämoglobin: Erniedrigung der Sauerstoffaffinität Kopplung Glycolyse und Sauerstoffmetabolismus. * exosekinasemangel Sinken des 2,3-BG- Spiegels gesteigerte Sauerstoffaffinität des ämoglobins * yruvatkinase- Mangel Steigen des 2,3-BG-Spiegels verringerte Sauerstoffaffinität des ämoglobins exokinase-mangel p 2 in Torr Normale Erythrocythen yruvat yruvat-kinase-mangel Glycolyse 8. Reaktion: hosphoglycerat-mutase hosphoglycerat-mutase 3-hosphoglycerat hosphoglycerat Enzym: Isomerase hosphoglycerat-mutase (E ) Dimer: 2 27 kda (Kaninchenmuskel) ofactor: 2,3 -BG hosphoglycerat hosphoglycerat Mutase: Formal intramolekulare Übertragung einer funktionellen Gruppe (formal, da dies nicht immer mit dem Mechanismus vereinbar sein muss) G = + 4,4 kj/mol (K eq = 0,169); G = 0,83 kj/mol 5
6 Typ 1 Mutasen: efe, Säugetiere 2,3-Bisphosphoglycerat als ofaktor nötig Experimentelle Daten: 1. Für die Enzymaktivitäten sind katalytische Mengen von 2,3-Bisphosphoglycerat (2,3-BG) erforderlich 2. Inkubation des Enzyms mit katalytischen Mengen von 32 -markiertem 2,3-BG ergibt ein 32 -markiertes Enzym 3. hosphoryliert wird ein im aktiven Zentrum sitzendes istidin (8) Aktives Zentrum von efe- hosphoglycerat- Mutase Aktives Enzym: istidin 8 ist phosphoryliert Enzym 2 N hospho-is-rest N 3 Schritt 1: 3-G wird an das hosphoenzym gebunden, in dem is 8 phosphoryliert ist Schritt 2: Die hosphorylgruppe wird auf das Substrat übertragen, wodurch 2,3-Bisphosphoglycerat im Komplex mit dem Enzym entsteht Typ 2 Mutasen: flanzen (z.b. Weizen) 2,3-Bisphosphoglycerat ist kein ofaktor Schritt 3: Zersetzung des Komplexes unter Bildung des roduktes G, wobei das Enzym regeneriert wird. Die ursprüngliche hosphorylgruppe des 3-G landet also am (2) des nächsten 3-G, das diese Reaktion eingeht! Geringer rozentsatz des 2,3-BG dissoziiert ständig ab, daher muss 2,3-BG in Spuren vorhanden sein Intramolekularer hosphorylgruppentransfer von (3) auf (2) 6
7 hosphoglycerat- Mutase aus efe (Tetramer) is 8 hosphoglycerat- Mutase aus efe (Tetramer) Glycolyse 9. Reaktion: Enolase hosphoglycerat hosphoenolpyruvat + 2 Enzym: Lyase Enolase (E ) Dimer: 2 41 kda (Kaninchenmuskel) ofaktor: Mg 2+ hosphoglycerat hosphoenolpyruvat, E Dehydratation (Eliminierung eines Wassermoleküls) G = + 1,8 kj/mol (K eq = 0,5); G = +1,1 kj/mol Innere Logik der Glykolyse : Durch ydrolyse von E kann viel mehr Energie freigesetzt (-61,9 kj/mol) werden als durch ydrolyse von G (-17,6 kj/mol). Inhibierung der Enolase durch Fluorid: Anwendung in der Kariesprophylaxe. Durch emmung der bakterieller Enolase durch Fluorid wird der Abbau von Zucker in organische Säuren durch Bakterien in den laques verhindert. Säuren würden den Zahnschmelz [ydroxyapatit (a 10 ( 4 ) 6 () 2 )] auflösen. emmung der Enolase. Konsequenz: Akkumulation von G und (durch G- Mutase Aktivität) von 3-G. [F - wird aber auch in den Apatit des Zahnschmelzes eingebaut; der Ersatz von - durch F - im Apatit macht das Mineral resistenter gegen seine Auflösung]. - -B: 3 -B Reaktionsmechanismus der Enolase: Bestimmung des geschwindigkeitsbestimmenden Schritts im Enzym- Turnover. Austausch des (2) rotons von G mit dem Lösungsmittel viel schneller als die E-Bildung ( arbanion-bildung durch die Gegenwart einer basischen Gruppe erfolgt sehr rasch). Dagegen tauscht der (3)-Sauerstoff des G mit dem Lösungsmittel mit einer Geschwindigkeit aus, die jener der E-Bildung entspricht. arbanion-bildung an (2) durch Base (schnelle Reaktion). Abstrahiertes roton tauscht rasch mit Lösungsmittel (bulk phase) aus. Beweis durch Isotopenaustauschuntersuchungen, dass der Austausch des (2)-rotons mit dem Lösungsmittel 12 schneller als die E-Bildung abläuft. 7
8 Enolase -B B: - 3 E omodimer Eliminierung der (3)--Gruppe (langsamer = geschwindigkeitsbestimmender Schritt). Glycolyse 10 Reaktion: yruvat-kinase hosphoenolpyruvat + AD + + yruvat + AT Enzym: hosphotransferase yruvat-kinase (E ) Tetramer: 4 57 kda (Kaninchenmuskel) ofactor: Mg 2+, K + G (kj/mol) hosphoenolpyruvat + 2 yruvat ,2 AD AT ,5 hosphoenolpyruvat + AD yruvat - + AT ,7 K eq = ; G (Erythrocyten) = -23 kj/mol hosphoenolpyruvat yruvat Dritte stark exergonische Reaktion: Dritter Regulationspunkt der Glycolyse. yruvat-kinase wird allosterisch reguliert. Warum ist hosphoenolpyruvat so energiereich : Die hosphatgruppe fixiert quasi das Molekül in seiner instabilen Enolform! Mechanismus: 1. Das -hosphorylsauerstoffatom des AD greift das E- hosphoratom nucleophil an. Unter Verdrängung von Enolpyruvat wird AT gebildet E - - Mg AD Adenosin 2. Enolpyruvat geht in yruvat über. Stark exergonische Keto-Enol-Tautomerisierung (treibt AT-Synthese an). - - Enolpyruvat + - yruvat 8
9 Instabile Enolform des yruvats Tautomerisierung - G = -28,3 kj/mol Stabile Ketoform des yruvats - 3 G = -33,6 kj/mol yruvat-kinase-reaktion: hosphorylgruppen-transfer von E auf AD 4 Stufen: (a) Koordinativ zu AD gebundenes Wasser wird durch die hosphorylgruppe des E ersetzt (b) Mg 2+ dissoziiert vom - des AD ab (c) Transfer der hosphorylgruppe (d) rotonierung der Enolatform des yruvats yruvat-kinase Glucose + 2 AD + 2 i + 2 NAD + 2 yruvat + 2 AT + 2 NAD Evolution der Glycolyse? Zufälliges Auftreten der Enzymaktivität mit anschließender Feinabstimmung? UNWARSEINLI! WARSEINLIER: Gen-DULIKATINEN und divergente Evolution des Enzyms des vorhergehenden Schritts. Beispiel: Enolase und yruvat-kinase besitzen beide - terminale E-bindende -Barrels mit fast deckungsgleichem Rückgrat Inhaltsverzeichnis Glycolyse 1. Glucosetransport 2. Abfolge der chemischen Umwandlungen der Glucose in yruvat (10 Reaktionen) 3. Mechanismen der einzelnen Reaktionen 4. Thermodynamik und Regulation Reaktionen und Thermodynamik der Glycolyse Reaktion Enzym G K eq G kj/mol 25 kj/mol -D-Glucose + AT 4- Glucose-6-hosphat + AD exokinase -16, ,9 Glucose-6-hosphat Glucosephosphat Fructose-6-hosphat Isomerase +1,67 0,51-2,92 Fructose-6-hosphat + AT 4- hosphofructo- Fructose-1,6-Bisphosphat + AD kinase -14, ,8 Fructose-1,6-bisphosphat Dihydroxyacetonphosphat + Glycerinaldehyd-3- Aldolase +23,9 6, ,23 9
10 Reaktion Enzym G K eq G kj/mol kj/mol Dihydroxyacetonphosphat Triosephosphat- Glycerinaldehyd-3- Isomerase 7,56 0,0472 2,41 Glycerinaldehyd-3- + i + Glycerinaldehyd-3-- NAD + 1,3- Bisphosphoglycerat Dehydrogenase + NAD ,3 0,0786-1,29 1,3-Bisphosphoglycerat + AD 3 hosphoglycerat- - 3-hosphoglycerat + AT 4- Kinase -18, ,1 3-hosphoglycerat hosphoglycerat- hosphoglycerat Mutase +4,4 0,169 +0,83 hosphoglycerat hosphoenolpyruvat + 2 Enolase +1,8 0,483 +1,1 hosphoenolpyruvat + AD yruvat- yruvat + AT 4- kinase -31,7 3, yruvat + NAD + + Lactat- Lactat + NAD + Dehydrogenase -25,2 2, ,8 Standardbedingungen G G in vivo-konzentrationen Glycolyse-Reaktionen Glycolyse-Reaktionen (1) exokinase; (3) hosphofructokinase; (10) yruvatkinase; (11) Lactat-Dehydrogenase Die Glycolyse hat zwei Funktionen: 1. roduktion von AT 2. roduktion von Bausteinen für Biosynthesen (Beispiel: Fettsäure-Biosynthese aus Acetyl-oA). Enzyme, die weitgehend irreversible Reaktionen katalysieren, sind generell in Stoffwechselwegen potentielle Kontrollpunkte. Diese Enzyme haben also neben katalytischen auch regulatorische Funktionen (Kontrollpunkte). Glycolyse: exokinase hosphofructokinase yruvatkinase exokinase Die exokinase wird durch Glucose-6-hosphat (G6) gehemmt. (feedback-emmung). In der Leber befindet sich anstelle der exokinase Glucokinase, die nicht durch G6 gehemmt wird. Glucokinase phosphoryliert Glucose nur, wenn sie in höheren Mengen vorhanden ist. Ihr hoher K M -Wert garantiert die Glucoseversorgung des Gehirns und der Muskulatur. Die Aufgabe der Glucokinase besteht darin, Glucose-6-phosphat für die Synthese von Glycogen zu liefern, einer Glucose- Speicherform. Die Expression von Glucokinase wird durch Insulinausschüttung gesteigert. Das eigentliche Schrittmacherenzym der Glycolyse ist aber die hosphofructokinase. hosphofructokinase Glucose Viel bedeutender als die exokinase hinsichtlich der Regulation ist die hosphofructokinase. Warum? Weil Glucose-6- nicht nur in der Glycolyse, sondern auch in der Glycogen-Biosynthese und dem entosephosphatweg (NAD roduktion) eine Rolle spielt. Es gibt daher Sinn, dass die erste irreversible Reaktion, die NUR in der Glycolyse stattfindet (= hosphofructokinase-reaktion) den wichtigsten Regulationspunkt darstellt (den sog. committed step ). Allgemein stellt jenes Enzym, das die Schrittmachereaktion einer Reaktionsfolge katalysiert, das wichtigste Kontrollelement dieses Stoffwechselweges dar. xidativer entose- phosphat- Weg Glucose-6-hosphat Fructose-6-hosphat Glycolyse yruvat Glycogen- Biosynthese 10
11 yruvatkinase yruvatkinase katalysiert den dritten irreversiblen Schritt der Glycolyse. Es kontrolliert die Menge der gebildeten Endprodukte AT und yruvat. yruvat kann als Baustein für Biosynthesen dienen oder weiteroxidiert werden. In Säugetieren gibt es zwei Isoformen (Isozyme, Isoenzyme) der yruvat-kinase (allosterisches Enzym: Tetramer), die von verschiedenen Genen codiert werden. Beide Isoformen werden durch Fructose-1,6-bisphosphat (FB) aktiviert (feedforward-aktivierung). L-Typ (Isoform): Leber; M-Typ (Isoform): Muskel, Gehirn. ohe Energieladung (AT) und Alanin (Aminosäure-Äquivalent des yruvats) inhibieren die yruvat-kinase. Das Leber (L)-Isoenzym, nicht jedoch das M-Isozym, wird zusätzlich durch roteinphosphorylierung in seiner Aktivität modifiziert. Niedriger Glucosespiegel im Blut ist der Auslöser einer bedeutenden Reaktions-Kaskade (cam-kaskade, siehe Einheit 10). Das ormon Glucagon wird ausgeschüttet und aktiviert (camabhängig) letztendlich eine sog. rotein-kinase, die die L-Form der yruvat-kinase phosphoryliert. In phosphorylierter Form ist yruvat- Kinase weniger aktiv und E wird eher für die Glucose-Synthese (Gluconeogenese) verwendet. Auch ein Anstieg des intrazellulären a 2+ führt zur hosphorylierung der yruvat-kinase. Die Aktivierung der yruvat-kinase durch Fructose-1,6-bisphospat wird als feedforward- Stimulierung bezeichnet hosphofructokinase Die hosphofructokinase ist das wichtigste Kontrollelement der Glycolyse. Ein hoher AT-Spiegel senkt die Affinität des Enzyms für das Substrat Fructose-6-hosphat. AM und AD heben diesen emmeffekt wieder auf. Die Aktivität des Enzyms steigt also, wenn der AT/AM-Quotient kleiner wird. Generell wird die Glycolyse angeregt, wenn die Energieladung der Zelle sinkt. hosphofructokinase wird auch beim Absenken des p- Wertes (Anstieg der + -Ionen) gehemmt. Dies verhindert eine exzessive Lactatbildung und den damit verbunden Abfall des Blut-p-Wertes (Acidose). Inhibierung der hosphofructokinase durch hohe AT- Konzentrationen. Umwandlung der hyperbolischen Bindungskurve für das Substrat F6 in eine sigmoide Kurve (typisch für allosterische Enzyme). Der emmeffekt des AT wird von AM (und itrat) vermindert. AT, AD und AM modulieren also die Aktivität des Schrittmacher-Enzyms hosphofructokinase (FK): Bei hohen AT-Konzentrationen wird die Kinetik der FK kooperativ (sigmoider Kurvenverlauf). Allerdings schwanken die zellulären AT-Konzentrationen nur um maximal 10%. Jedoch kann der Fluss durch die Glykolyse um den Faktor 100 schwanken!!! AM und AD heben die inhibitorischen Eigenschaften von AT auf. Die Schwankungsbreite der AM-Konzentrationen in der Zelle ist im Vergleich zu AT viel größer! Der Adenylat-ool jeder Zelle wird durch das ubiquitäre Enzym Adenylat-Kinase (früher Myokinase) ineinander übergeführt: AD + AD AT + AM K eq = [AT][AM]/[AD] 2 = 0,44 Rechenbeispiel: Berechnen Sie die Änderung der [AM]- Konzentration, wenn in einer Erythrocyten-Zelle plötzlich 8% des AT in AD hydrolysiert werden. Typische Konzentrationen im Erythrocyt: [AT] = 1850 µm, [AD] = 145 µm, [AM] = 5 µm. Gesamtadenylatkonzentration: 2000 µm K eq = [AT][AM]/[AD] 2 = 0,44 AT: 8% hydrolysiert: [AT] = 1850(0,92) = 1702 µm [AM] + [AD] = = 298 µm [AM] = 298 µm - [AD] K eq = (1702)(298 - [AD])/([AD] 2 ) = 0,44 [AD] = 278 µm, [AM] = 20 µm Die AM-Konzentration steigt um das Vierfache!!! 11
12 Die hosphofructokinase ist eines von vielen Schrittmacher- Enzymen, die durch den Energiezustand reguliert werden. Ein Index für den Energiezustand einer Zelle ist die Energieladung (energy charge). Sie entspricht dem Stoffmengenanteil (früher Molenbruch) des AT plus dem halben Molenbruch des AD (AT enthält zwei und AD eine energiereiche gemischte Anhydrid-Bindung) [AT] + 0,5.[AD] Energieladung = [AT] + [AD] + [AM] Relative Reaktionsgeschwindigkeit AT erzeugender Weg AT verbrauchender Weg Energieladung = 0 nur AM Energieladung = 1 nur AT Die Energieladung der meisten Zellen ist zwischen 0,80 und 0,95 gepuffert. Typisch sind folgende Konzentrationsverhältnisse: [AD] 0,1 [AT] und [AM] 0,01 [AT] Einfluß der Energieladung auf Schrittmacherenzyme von anabolen und katabolen Stoffwechselwegen omöostase 0,25 0,5 Energieladung 0,75 1 Katabole Stoffwechselwege werden durch eine hohe Energieladung gehemmt, anabole Stoffwechselwege (verbrauchen AT) werden dagegen angeregt! Die Energieladung einer Zelle ist gepuffert. Die für anaerobe körperliche Anstrengung (z.b. kurze Sprints) verwendeten Brennstoffe unterscheiden sich von denen, die für aerobe körperliche Anstrengung (Langstreckenlauf) benutzt werden. Das rotein Myosin, das unmittelbar für die Umsetzung chemischer Energie in Bewegung verantwortlich ist, wird direkt von AT angetrieben. Im Muskel steht prinzipiell nur wenig AT zur Verfügung. Die erzeugte Leistung und damit auch die erzielte Laufgeschwindigkeit hängen von der Schnelligkeit ab, mit der AT aus anderen Energiequellen bereitgestellt wird und/oder durch Stoffwechselprozesse nachgeliefert wird. In einer Muskelzelle kann AT rasch aus reatinphosphat (hosphocreatin = AT-Depot) gebildet werden. Bildung von reatinphosphat ist Umkehrreaktion. Enzym: reatin-kinase: reatinphosphat + AD + + AT + reatin K eq = 162 Typische Konzentrationen im ruhenden Muskel: [AT] = 4 mm, [AD] = 0,013 mm, [reatinphosphat] = 25 mm, [reatin] = 13 mm Für einen Sprinter ist reatinphosphat die auptquelle für energiereiches hosphat. Doch auch die Menge an reatinphosphat ist beschränkt. Die gespeicherten Mengen AT und hosphocreatin reichen für einen Sprint von maximal 5-6 Sekunden. Dann muss durch anaerobe Glycogenolyse und Glycolyse AT nachgeliefert werden. Bei längerem Lauf wird dann die oxidative hosphorylierung (siehe Einheiten 7 & 8) zunehmend wichtig. AT-Quellen während körperlicher Anstrengung Energie AT reatinphosphat Sekunden Minuten Stunden Aerober Metabolismus (Glycolyse, itrat- yclus, Atmungskette) Anaerober Metabolismus (Glycogenolyse, Glycolyse) Da die Glycolyse auch Moleküle produziert, die in Biosynthesen verwendet werden, wird hosphofructokinase auch durch andere, nicht in der Glycolyse vorkommende Metaboliten reguliert. itrat (itronensäurezyklus) inhibiert die hosphofructokinase. Ein hoher itratspiegel bedeutet, dass reichlich Biosynthesevorstufen vorhanden sind. itrat steigert den inhibitorischen Effekt des AT. -D-Fructose-2,6-bisphosphat aktiviert die hosphofructokinase. Es erhöht die Affinität zum Substrat Fructose-6-hosphat. Es ist ein allosterischer Aktivator (siehe auch Gluconeogenese). Außerdem wird die Aktivität der hosphofructokinase durch F6, Ammonium-Ionen und anorganisches hosphat stimuliert. 12
13 Fructose-2,6-bisphosphat ist ein allosterischer Aktivator der hosphofructokinase. In seiner Gegenwart (1 µm) wird die sigmoidale Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration hyperbolisch (A). Fructose- 2,6-bisphosphat hebt den emmeffekt von AT auf. AT als Substrat stimuliert vorerst die Aktivität. Steigt seine Konzentration, wirkt es als allosterischer Inhibitor. Wie kann man sich nun den Einfluss dieser Effektoren auf die Enzymaktivität auf molekularer Ebene vorstellen? Die allosterischen Eigenschaften der hophofructokinase lassen sich durch das Symmetrie-Modell der Allosterie erklären: Symmetriemodell: 1965 von Jacques Monod, Jeffrie Wyman und Jean-ierre hangeaux postuliert hosphofructokinase ist ein Tetramer, das aus untereinander symmetrischen rotomeren besteht. Die Untereinheiten sind funktionell identisch. Jedes rotomer kann in mindestens 2 Konformationszuständen vorliegen, T und R, die miteinander im Gleichgewicht stehen. Die molekulare Symmetrie des roteins bleibt während des Konformationswechsels erhalten, d.h. die Umwandlung erfolgt in einer konzertierten Reaktion. Das oloenzym liegt entweder in R oder in T vor. hosphofructokinase Die hosphofructokinase ist der wichtigste Regulationspunkt der Glykolyse. Ihre Aktivität wird daher durch eine Vielzahl niedermolekularer Verbindungen kontrolliert: Inhibitoren: AT (d.h. AT ist Substrat und Inhibitor!), itrat, + Aktivatoren: AD, AM, Fructose-2,6-bisphosphat, Fructose-6- hosphat, Ammonium-Ionen, anorganisches hosphat Das Enzym kann in 2 Konformationen, die miteinander im Gleichgewicht stehen, vorliegen: R T Wie jedes allosterische rotein (Enzym) ist hosphofructokinase ein ligomer, konkret ein Tetramer. Jede Untereinheit hat eine Substratund eine allosterische Bindungsstelle. Die allosterischen Effektoren bestimmen, ob das Enzym im R- oder T-Zustand vorliegt. Nur der R- Zustand hat eine hohe Affinität zum Substrat F6. hosphofructokinase (E. coli), Dimer Komplex mit AD und Fructose-1,6-bisphosphat (FB). Das humane Enzym der Leber ist ein 340 kda Tetramer. ro Untereinheit ist also eine Substrat- Bindungsstelle (AD, F6) und eine allosterische Bindungsstelle (AD) AD vorhanden. Bindung der Effektoren an die allosterische Bindungsstelle bewirkt charakteristische Konformationsänderung im aktiven Zentrum (Substratbindungsstelle). Fructose-1,6-bisphosphat 13
14 Fructose-6-hosphat: AT, Reaktionsprodukt AD: AM, AD (Aktivatoren): AT, itrat ohe Affinität für den R-Zustand, niedrige Affinität für den T-Zustand. Bindungsstelle: Substratbindungsstelle omotropischer Effekt: Binden von F6 erhöht die Affinität von weiteren F6 Molekülen. Substratbindungsstelle Allosterische Bindungsstelle ositiver heterotropischer Effekt: Binden von AM oder AD verschiebt Gleichgewicht Richtung R-Zustand. Allosterische Bindungsstelle; verschieben Gleichgewicht Richtung T-Zustand; negativer heterotroper Effekt Wieso hat das Substrat Fructose-6-hosphat, F6, zum Enzym im R-Zustand eine hohe und zum T-Zustand eine niedrige Affinität? Die Betrachung der jeweiligen dreidimensionalen Strukturen (Röntgenkristallographie oder NMR-Spektroskopie) zeigt dramatische Konformationsunterschiede im aktiven Zentrum: R-Zustand: T-Zustand: Arginin (positive Guanidiniumgruppe) ist Teil der Bindungsstelle für F6 (negative hosphatgruppe) Arginin um 180 gedreht. In die Bindungstasche zeigt nun die arboxylat-gruppe eines Glutamat- Restes (Abstoßung von F6) R-Zustand Glu 161 Arg 162 AD- Substrat R-Zustand F6 AD- Effektor Glu 161 Arg 162 hosphofructokinase (Dimer) aus Bacillus stearothermophilus AD- Effektor AD-Substrat R-Zustand Überlagerung R- und T-Zustand Vergleich R- und T-Zustand F6 Arg162 Glu161 allo- AD R T 14
15 Zusammenfassung: exokinase, hosphofructokinase und yruvat- Kinase sind also jene (allosterischen) Enzyme der Glycolyse, deren Reaktionsgeschwindigkeit von Effektoren beeinflußt wird. Enzym Inhibitoren Aktivatoren exokinase G6 hospho- fructo- Kinase AT, itrat, + AD, AM, F2,6, F6, N 4+, i yruvatkinase AT, niedriger FB Blutglucosespiegel, Anstieg des intrazellulären a 2+ -Spiegels ( hosphorylierung) AT-Quellen während körperlicher Anstrengung Energie Aerober Metabolismus (Glycolyse, itrat- yclus, Atmungskette) reatinphosphat AT Anaerober Metabolismus (Glycogenolyse, Glycolyse) Sekunden Minuten Stunden Inhaltsverzeichnis Glycolyse 1. Glucosetransport 2. Abfolge der chemischen Umwandlungen der Glucose in yruvat (10 Reaktionen) 3. Mechanismen der einzelnen Reaktionen 4. Thermodynamik und Regulation 5. Einschleusen von Galactose, Mannose, Fructose und Glycerin in die Glykolyse Neben der Glucose steht den Zellen eine Reihe anderer Zucker zur Verfügung, entweder aus der Nahrung oder aus dem Abbau von Kohlenhydratspeichern, Glycoproteinen oder Glycolipiden. Für jeden dieser Zucker gibt es spezielle Reaktionswege, die einen Anschluß an die Glycolyse ermöglichen. Beispiele: Saccharose (aushaltszucker): Glucose und Fructose Lactose (Milchzucker): Glucose und Galactose Neben Fructose und Galactose sind Mannose und die entosen Ribose, Ribulose und Xylose häufig. Auch Glycerin (siehe Triglyceride) kann in die Glycolyse eingeschleust werden. Einige exemplarische Beispiele seien erwähnt. 15
16 Mannose: Mannose Verdauung von Glycoproteinen, Glycolipiden und olysacchariden Mannose -D-Glucose -D-Mannose Glucose und Mannose sind Epimere (unterschiedliche Stellung der -Gruppe am -2) -D-Mannose - - Mannose-6- AT AD - exokinase (Mg 2+ ) hospho- mannose- Isomerase Mannose-6- phosphat 2 Fructose-6-hosphat Galactose -D-Glucose Glucose und Galactose sind Epimere (unterschiedliche Stellung der -Gruppe am -4) -D-Galactose Galactose: Verdauung des Milchzuckers Lactose. Einschleusen in Glycolyse umfasst vier Schritte (Leloir-Zyklus; Louis Leloir) Die Reaktion beginnt mit einer hosphorylierung der Galactose am -1, katalysiert durch die Galactokinase, einem Leberenzym: -D-Galactose AT AD Mg 2+ 3 Galactose-1-phosphat Im nachfolgenden Schritt wird Galactose dann gegen Glucose im UD-Addukt ausgetauscht (hosphohexose-uridyltransferase) hosphohexose- Uridyltransferase Galactose-1-phosphat 3 N N UD-Glucose (Uridin-diphosphat- Glucose) 16
17 UD-Galactose (Uridin-diphosphat- Galactose) Glucose-1-phosphat N N Glucose-1-phosphat - - Glycogenbiosynthese hosphogluco- Mutase Glucose-6-phosphat - - Glycolyse - - UD-Galactose UD-Glucose-Epimerase UD-Glucose N N N - - N Epimerase ändert die Stellung einer funktionellen Gruppe an einem konkreten -Atom, während Mutase eine funktionelle Gruppe innerhalb eines Moleküls transferiert! Die UD-Glucose-Epimerase benötigt NAD + in Spuren als ofaktor, obwohl der Reaktionsschritt keine Netto-Redoxreaktion darstellt. Grund: Reaktionsmechanismus. UD-Galactose UD NAD + NAD + + UD NAD + NAD + + UD UD-Glucose UD-Glucose wird bei der Umwandlung von Galactose in Glucose nicht verbraucht, weil sie durch die Epimerase aus UD-Galactose regeneriert wird. Diese Epimerase-Reaktion ist reversibel und das rodukt der umgekehrten Reaktion ist ebenfalls wichtig: Synthese von Galactoseeinheiten in komplexen olysacchariden und Glycoproteinen, wenn der Anteil der Galactose aus der Nahrung nicht ausreicht. Leloir-yclus: Galactose + AT Glucose-1-hosphat + AD + + Galactosämie Die angeborene Krankheit Galactosämie beruht in den meisten Fällen auf dem Fehlen der hosphohexose-uridyltransferase. Bei Kindern, die viel Milch trinken, kommt es zu hohen Galactose- Konzentrationen im Blut und in der Folge zu den typischen Krankheitsbildern: Entwicklungsstörungen, geistige Retardierung, Katarakte im Auge, Tod durch Leberschäden usw. Durch die Unterbleibung der Bildung von UD-Galactose aus Gal-1-- häufen sich 2 giftige Stoffwechselprodukte an. Ein Beispiel ist die Reduktion der Galactose zu Galactit(ol) in der Augenlinse (Enzym: Aldose-Reductase), die für die Linsentrübung (grauer Star) mitverantwortlich gemacht wird. Galactosämie-kranke Kinder dürfen keine Milch bzw. Galactose-hältige Lebensmittel konsumieren. 2 D-Galactitol 17
18 Viele Erwachse können das Kohlenhydrat der Milch, die Lactose, nicht abbauen. Folgeerscheinung: Darmstörungen. Diese Lactoseintoleranz (ypolactasie) wird vor allem durch einen Mangel des Enzyms Lactase hervorgerufen, das Lactose in Glucose und Galactose spaltet: Die Abnahme der Lactase-Konzentration beginnt schon bei Kleinkindern nach dem Abstillen und setzt sich im Erwachsenenalter fort. Die Abnahme kann aber je nach Bevölkerungsgruppen unterschiedlich stark ausgeprägt sein. Was ist die Ursache für die Darmprobleme bei Lactase-Mangel? Lactose ist eine wichtige Energiequelle für Mikroorganismen (z.b. Lactobacilli) im Dickdarm. Sie vergären Lactose zu Milchsäure (Lactat) und erzeugen dabei Methan, 4 (g), und 2 (g): Ursache für Blähungen. Zudem ist Milchsäure osmotisch aktiv und führt zum Einstrom von Wasser in den Darm (Durchfall). Fructose Fructose wird vor allem durch die Aufnahme und ydrolyse von Saccharose in den Stoffwechsel eingeführt. Sie kann direkt in die Glycolyse eintreten, da die Fructose, ebenso wie Glucose und Mannose, am -6 durch die exokinase phosphoryliert werden kann: 2 Fructose AT AD Mg 2+ exokinase Fructose-6-phosphat Jedoch ist die Affinität der exokinase zu Glucose 20-mal größer als zu Fructose. In der Leber ist der Glucosespiegel hoch und daher wird hier nur wenig Fructose-6-phosphat gebildet. Auch im Muskel ist Glucose der bevorzugte Brennstoff, der durch exokinase umgesetzt wird. Während Leber und Muskulatur mehr Glucose als Fructose phosphorylieren, erhält das Fettgewebe mehr Fructose als Glucose. Deshalb wird die Entstehung von Fructose-6-phosphat dort nur unwesentlich kompetitiv gehemmt. Im Fettgewebe tritt daher die meiste Fructose über Fructose-6- phosphat in den Stoffwechsel ein. In der Leber von Säugetieren gibt es einen alternativen Weg, bei dem die hosphorylierung durch das Enzym Fructokinase am -1 erfolgt. 2 AT AD Mg 2+ Fructokinase Fructose 2 Fructose-1-phosphat Fructose-1-phosphat wird in der Folge durch eine spezifische Aldolase in Dihydroxyacetonphosphat und Glycerinaldehyd gespalten. Klasse-I-Aldolasen: Typ A (Muskel): Spezifisch für Fructose-1,6-bisphosphat Typ B (Leber): Verwertet auch Fructose-1-phosphat - - Glycolyse - 2 Fructose-1-phosphat Dihydroxyacetonphosphat Aldolase B 2 Glycerinaldehyd 18
19 2 Glycerinaldehyd AT AD Mg 2+ Glycerinaldehyd- Kinase 2 3 Glycerinaldehyd-phosphat Glycolyse Es gibt mehrere Bedenken gegenüber einer Fructose-reichen Diät; vor allem seit Fructose als Ersatz-Süßstoff in vielen Lebensmitteln verwendet wird (früher sogar für intravenöse Ernährung verwendet). Der Mensch hat nämlich nur eine begrenzte Kapazität der Fructoseverwertung. Die Leber kann zwar Fructose rasch phosphorylieren, aber das rodukt Fructose-1-phosphat nur langsam umsetzen. Die Fructoseverwertung ist also schlecht reguliert, und eine extreme Fructosebelastung vermindert die Kapazität der Leberzellen zur AT-Bildung (der anorganische hosphat-ool wird geplündert!). Einige Menschen haben eine angeborene Enzymmangelkrankheit, die als Fructose-Intoleranz bezeichnet wird. Diese atienten haben einen Mangel an Leber Aldolase B. Auch hier kommt es zu einem Anstau von Fructose-1-phosphat und einem Mangel an AT und i in der Leber und einer bedrohlichen ypoglykämie durch Verdrängung der Glucose (Unterzuckerung bei der der Blutzuckerspiegel auf Werte unter 50 mg/dl absinkt). Wichtige rgane werden nicht mehr mit einer ausreichenden Menge Glucose versorgt. Kommt es bei Kindern mit dieser Störung zu einer länger dauernden Fructosebelastung, kann dies ernste Folgen haben. ftmals entwickeln diese ersonen aber Abneigung gegenüber allem Süßen. Mannose Glycerin Glycerin in ein wichtiger Lipidbaustein und entsteht beim Abbau von z.b. Triacylglycerinen. 2 2 Glycerin-Kinase Mg 2+ AT AD Glycerin Glycerin-3-phosphat Glycerinphosphat- 2 Dehydrogenase 2 NAD + NAD Glycerin-3-phosphat Dihydroxyacetonphosphat Alternativ: 2 2 Glycerin Glycolyse NAD + NAD + + Alkohol- Dehydrogenase AT AD 2 Glycerinaldehydphosphat Glycerinaldehyd- Kinase Glycerinaldehyd 19
20 Inhaltsverzeichnis Glycolyse 1. Glucosetransport 2. Abfolge der chemischen Umwandlungen der Glucose in yruvat (10 Reaktionen) 3. Mechanismen der einzelnen Reaktionen 4. Thermodynamik und Regulation 5. Einschleusen von Galactose, Mannose, Fructose und Glycerin in die Glykolyse 6. Schicksale des yruvats 20
BIOCHEMIE des Stoffwechsels ( )
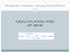
 BIEMIE des Stoffwechsels (772.113) 5. Einheit Glycolyse (2) Glycolyse 6. Reaktion: Glycerinaldehyd-3- phosphat-dehydrogenase Glycerinaldehyd-3-P + NAD + + P i 1,3-Bisphosphoglycerat + NAD + + Enzym: xidoreductase
BIEMIE des Stoffwechsels (772.113) 5. Einheit Glycolyse (2) Glycolyse 6. Reaktion: Glycerinaldehyd-3- phosphat-dehydrogenase Glycerinaldehyd-3-P + NAD + + P i 1,3-Bisphosphoglycerat + NAD + + Enzym: xidoreductase
Wirkungsmechanismen regulatorischer Enzyme
 Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Glycolyse und Gluconeogenese
 Glycolyse und Gluconeogenese Arbeiten, deren Beginn sich auf die Zeit um 1905 datieren lässt, führten dazu, dass in den 1940er Jahren alle Schritte der Glycolyse bekannt waren. Durchsicht der aktuellen
Glycolyse und Gluconeogenese Arbeiten, deren Beginn sich auf die Zeit um 1905 datieren lässt, führten dazu, dass in den 1940er Jahren alle Schritte der Glycolyse bekannt waren. Durchsicht der aktuellen
Pharmazeutische Biologie Grundlagen der Biochemie
 harmazeutische Biologie Grundlagen der Biochemie A Enzyme E1 E2 E3 E4 Biosynthese A B D E B E7 E2 E6 E1 E3 E5 E4 E1 E2 E5 E4 rof. Dr. Theo Dingermann Institut für harmazeutische Biologie Goethe-Universität
harmazeutische Biologie Grundlagen der Biochemie A Enzyme E1 E2 E3 E4 Biosynthese A B D E B E7 E2 E6 E1 E3 E5 E4 E1 E2 E5 E4 rof. Dr. Theo Dingermann Institut für harmazeutische Biologie Goethe-Universität
9. Abbau der Glukose zum Pyruvat
 9. Abbau der Glukose zum Pyruvat 236 9.1. Übersicht: Abbau von Glucose Pentosephosphate Pathway (PPP) NADP + NADPH Glucose Glycolysis Oxidative Phosphorylation PDH Complex Citric Acid Citric Acid Cycle
9. Abbau der Glukose zum Pyruvat 236 9.1. Übersicht: Abbau von Glucose Pentosephosphate Pathway (PPP) NADP + NADPH Glucose Glycolysis Oxidative Phosphorylation PDH Complex Citric Acid Citric Acid Cycle
BIOCHEMIE. Prof. Manfred SUSSITZ. über(be)arbeitet und zusammengestellt nach Internetvorlagen:
 BIOCHEMIE Prof. Manfred SUSSITZ über(be)arbeitet und zusammengestellt nach Internetvorlagen: Medizinische Fakultät, Universität Erlangen http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html
BIOCHEMIE Prof. Manfred SUSSITZ über(be)arbeitet und zusammengestellt nach Internetvorlagen: Medizinische Fakultät, Universität Erlangen http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/start.html
Die Wege des Kohlenstoffes
 Die Wege des Kohlenstoffes 1. Licht vs. Dunkelreaktionen Lichtgetriebene Reaktionen o Dunkle -Reaktionen laufen nicht im Dunklen ab reduzieren CO 2-Zucker für Pflanzen zum Wachsen und für uns zum Nutzen
Die Wege des Kohlenstoffes 1. Licht vs. Dunkelreaktionen Lichtgetriebene Reaktionen o Dunkle -Reaktionen laufen nicht im Dunklen ab reduzieren CO 2-Zucker für Pflanzen zum Wachsen und für uns zum Nutzen
Grundzüge des Energiestoffwechsels I
 Grundzüge des Energiestoffwechsels I 4.5 Grundzüge des Energiestoffwechsels 4.5.2 Glykolyse 4.5.3 Pyruvatdecarboxylierung 4.5.4 Citratzyklus 4.5.5 Glyoxylatzyklus und Gluconeogenese 4.5.6 Atmung, Endoxidation
Grundzüge des Energiestoffwechsels I 4.5 Grundzüge des Energiestoffwechsels 4.5.2 Glykolyse 4.5.3 Pyruvatdecarboxylierung 4.5.4 Citratzyklus 4.5.5 Glyoxylatzyklus und Gluconeogenese 4.5.6 Atmung, Endoxidation
Kohlenhydrate C n. O) n (H 2. z.b. C 6 O 6 O) 6 H 12 : C 6. Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Monosaccharide
 Kohlenhydrate C n (H 2 O) n z.b. C 6 (H 2 O) 6 : C 6 H 12 O 6 Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Vortragender: Dr. W. Helliger Monosaccharide Reaktionen der Monosaccharide
Kohlenhydrate C n (H 2 O) n z.b. C 6 (H 2 O) 6 : C 6 H 12 O 6 Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Vortragender: Dr. W. Helliger Monosaccharide Reaktionen der Monosaccharide
Hämoglobin: Proteinfunktion und Mikrokosmos (Voet Kapitel 9)
 Hämoglobin: Proteinfunktion und Mikrokosmos (Voet Kapitel 9) 1. Funktion des Hämoglobins 2. Struktur und Mechanismus 3. Anormale Hämoglobine 4. Allosterische Regulation 4. Allosterische Regulation Organismen
Hämoglobin: Proteinfunktion und Mikrokosmos (Voet Kapitel 9) 1. Funktion des Hämoglobins 2. Struktur und Mechanismus 3. Anormale Hämoglobine 4. Allosterische Regulation 4. Allosterische Regulation Organismen
Wiederholungsklausur zur Vorlesung Biochemie I im WS 2004/05
 Wiederholungsklausur zur Vorlesung Biochemie I im WS 2004/05 am 09.05.2005 von 08.00-09.30 Uhr Mensa & 2 Lösungen in rot unkte in grün Aufgabe : Formulieren Sie drei unterschiedliche Reaktionswege, wie
Wiederholungsklausur zur Vorlesung Biochemie I im WS 2004/05 am 09.05.2005 von 08.00-09.30 Uhr Mensa & 2 Lösungen in rot unkte in grün Aufgabe : Formulieren Sie drei unterschiedliche Reaktionswege, wie
Mechanismus der Enzymkatalyse
 Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Mechanismus der Enzymkatalyse Allgemeine Prinzipien Annäherung des Substrats an das aktive Zentrum des Enzyms Enzym und Substrat treten in Wechselwirkung: Bildung des [ES]-Komplexes. Konformationsänderung
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue rüfungsordnung Dauer Std.),. 4. 203, 8:30-9:30 Uhr, Mensa -3, sowie Biochemische Teilklausur zum Grundmodul 07
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue rüfungsordnung Dauer Std.),. 4. 203, 8:30-9:30 Uhr, Mensa -3, sowie Biochemische Teilklausur zum Grundmodul 07
Gluconeognese Neusynthese von Glucose aus Pyruvat
 Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Stoffwechsel. Metabolismus (3)
 Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Grundlagen der Physiologie
 Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Inhaltsverzeichnis - Kapitel
 Inhaltsverzeichnis - Kapitel 1. Einleitung: Die Chemie des Lebens 2. Kohlenhydrate 3. Lipide und Membranen 4. Nukleinsäuren 5. Aminosäuren und Proteine 6. Enzyme und Katalyse 7. Vitamine & Kofaktoren 8.
Inhaltsverzeichnis - Kapitel 1. Einleitung: Die Chemie des Lebens 2. Kohlenhydrate 3. Lipide und Membranen 4. Nukleinsäuren 5. Aminosäuren und Proteine 6. Enzyme und Katalyse 7. Vitamine & Kofaktoren 8.
Clinical definition of the metabolic syndrome
 Metabolismus: Lehrbuch der Biochemie: Voet/Voet Kapitel 13: Einführung in den Stoffwechsel Kapitel 14: Glucose Katabolismus Kapitel 15: Glycogen Metabolismus und Gluconeogenese Kapitel 16: Citratcyclus
Metabolismus: Lehrbuch der Biochemie: Voet/Voet Kapitel 13: Einführung in den Stoffwechsel Kapitel 14: Glucose Katabolismus Kapitel 15: Glycogen Metabolismus und Gluconeogenese Kapitel 16: Citratcyclus
Hemmung der Enzym-Aktivität
 Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
- der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen
 Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Katalyse. höhere Reaktionsgeschwindigkeit bei derselben Temperatur! Achtung: Gleichgewicht der chemischen Reaktion wird nicht verschoben
 Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Katalyse Ein Katalysator setzt Aktivierungsenergie einer Reaktion herab, indem er einen anderen Reaktionsweg ermöglicht, so dass der geschwindigkeitsbestimmende Schritt der nicht-katalysierten Reaktion
Z 11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
BIOCHEMIE des Stoffwechsels ( )
 BIEMIE des Stoffwechsels (772.113) 9. Einheit und oxidativer entosephosphatweg Metabolismus des Menschen Einige Fakten: Täglicher Bedarf von 160 + 20 g Glucose. Davon konsumiert das Gehirn etwa 75%. Gehirn
BIEMIE des Stoffwechsels (772.113) 9. Einheit und oxidativer entosephosphatweg Metabolismus des Menschen Einige Fakten: Täglicher Bedarf von 160 + 20 g Glucose. Davon konsumiert das Gehirn etwa 75%. Gehirn
Einführung in die Biochemie Gärung anaerober Abbau
 Gärungen sind ATP liefernde Energiestoffwechsel, die ohne Sauerstoff als xidationsmittel ablaufen. Ein Grund zur Nutzung der Gärung kann ein plötzlich anstehender Bedarf an rasch verfügbarerer Energie
Gärungen sind ATP liefernde Energiestoffwechsel, die ohne Sauerstoff als xidationsmittel ablaufen. Ein Grund zur Nutzung der Gärung kann ein plötzlich anstehender Bedarf an rasch verfügbarerer Energie
Praktikum Biochemie B.Sc. Water Science WS Enzymregulation. Marinja Niggemann, Denise Schäfer
 Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Z11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
ENZYME. Teil 1: Grundlagen und Substratbestimmungen
 ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
Präsentation STOFFWECHSEL STOFFWECHSEL. Fettstoffwechsel im Sport. Biologische Oxidation Zitratzyklus und Atmungskette
 STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Klausur zur Vorlesung Biochemie I im WS 1993/1994. am 18. Februar Nachklausur zur Vorlesung Biochemie I im WS 1993/1994. am 30. Mai 1994.
 Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Biochemie 1, WS 93 http://www.uni-kl.de/fb-biologie/fs/klausur/chemie/biochem/bc1ws93.htm 1 von 2 17.07.01 20:50 Klausur zur Vorlesung Biochemie I im WS 1993/1994 am 18. Februar 1994 1 (16 Punkte) Formulieren
Asmaa Mebrad Caroline Mühlmann Gluconeogenese
 Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Versuch 6. Leitenzyme
 Versuch 6 Leitenzyme Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X Dr. Kojro Einleitung Ziel dieses Versuches ist der Nachweis von bestimmten
Versuch 6 Leitenzyme Protokollant: E-mail: Studiengang: Gruppen-Nr: Semester: Betreuer: Max Mustermann max@quantentunnel.de X X X Dr. Kojro Einleitung Ziel dieses Versuches ist der Nachweis von bestimmten
Einführung in die Biochemie Glykolyse
 Glykolyse Der Abbau der Glukose beginnt beim aeroben und beim anaeroben Abbau nach dem gleichen rinzip, der Glykolyse. Dabei wird Brenztraubensäure (2-Ketopropansäure) gebildet. Die Glykolyse ist die erste
Glykolyse Der Abbau der Glukose beginnt beim aeroben und beim anaeroben Abbau nach dem gleichen rinzip, der Glykolyse. Dabei wird Brenztraubensäure (2-Ketopropansäure) gebildet. Die Glykolyse ist die erste
BIOCHEMIE des Stoffwechsels ( )
 BIEMIE des Stoffwechsels (772.113) 3. Einheit Thermodynamische Konzepte für biologische Systeme (2) Abhängigkeit der Spontaneität einer Reaktion von der Reaktions-Enthalpie und Reaktions-Entropie r S r
BIEMIE des Stoffwechsels (772.113) 3. Einheit Thermodynamische Konzepte für biologische Systeme (2) Abhängigkeit der Spontaneität einer Reaktion von der Reaktions-Enthalpie und Reaktions-Entropie r S r
Der Stoffwechsel: Konzepte und Grundmuster
 Der Stoffwechsel: Konzepte und Grundmuster 1 Lebende Organismen Was unterscheidet lebende Organismen von toter Materie? Lebende Organismen haben einen hohen Gehalt an chemischer Komplexität und Organisation
Der Stoffwechsel: Konzepte und Grundmuster 1 Lebende Organismen Was unterscheidet lebende Organismen von toter Materie? Lebende Organismen haben einen hohen Gehalt an chemischer Komplexität und Organisation
Enzyme SPF BCH am
 Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Pentosephosphat-Weg: alternativer Abbau von Glucose. Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet.
 Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Stoffwechsel. Die Chemie des Lebens ist in Stoffwechselwegen organisiert
 Die Chemie des Lebens ist in Stoffwechselwegen organisiert Der Stoffwechsel ist die Summe aller chemischen Reaktionen, die in den Zellen eines Organismus auftreten. Unter Mithilfe von Enzymen verläuft
Die Chemie des Lebens ist in Stoffwechselwegen organisiert Der Stoffwechsel ist die Summe aller chemischen Reaktionen, die in den Zellen eines Organismus auftreten. Unter Mithilfe von Enzymen verläuft
KOHLENHYDRATE PYRUVAT-DEHYDROGENASE
 PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
Klausur zur Vorlesung Biochemie I im WS 2001/02
 (insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
(insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
Mucosazelle. Mucosazelle
 Saccharase, Lactase Mucosazelle Mucosazelle Na-abhängiger Na-abhängiger Glucosetransporter (SGLT; (SGLT; aktiv): aktiv): nur nur in in Mucosazellen Mucosazellen (luminal) (luminal) und und Zellen Zellen
Saccharase, Lactase Mucosazelle Mucosazelle Na-abhängiger Na-abhängiger Glucosetransporter (SGLT; (SGLT; aktiv): aktiv): nur nur in in Mucosazellen Mucosazellen (luminal) (luminal) und und Zellen Zellen
Abbauwege im Energiestoffwechsel (Katabolismus)
 5.2.2. Abbauwege im Energiestoffwechsel (Katabolismus) 5.2.1. Enzyme 5.2.1.1. Definition der Enzyme Enzyme sind roteine, die als Biokatalysatoren wirken, d.h., Sie beschleunigen bestimmte Reaktionen durch
5.2.2. Abbauwege im Energiestoffwechsel (Katabolismus) 5.2.1. Enzyme 5.2.1.1. Definition der Enzyme Enzyme sind roteine, die als Biokatalysatoren wirken, d.h., Sie beschleunigen bestimmte Reaktionen durch
Versuch: Enzyme (LDH)
 Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Versuch: Enzyme (LDH) 25.11.02 Seiten im Campell, Tierphysbuch (Penzlin) und Eckert Zusammenfassung Campbell S. 105-113 Zusammenfassung Eckert S. 77 89 Zusammenfassung Penzlin S. 50 ff. Allgemein: Temperatur
Citratzyklus. Biochemie Maria Otto,Bo Mi Ok Kwon Park
 Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Versuchsprotokoll: Leitenzyme
 Versuchsprotokoll: Leitenzyme Aufschluss von Lebergewebe / Fraktionierte Zentrifugation / Aufschluss von Mitochondrien / Nachweis von Leitenzymen im Cytosol und 1.1. Einleitung Für die Trennung der Organellen
Versuchsprotokoll: Leitenzyme Aufschluss von Lebergewebe / Fraktionierte Zentrifugation / Aufschluss von Mitochondrien / Nachweis von Leitenzymen im Cytosol und 1.1. Einleitung Für die Trennung der Organellen
BIOCHEMIE des Stoffwechsels ( )
 BICEMIE des Stoffwechsels (772.113) 10. Einheit Glycogen Stoffwechsel Speicherkohlenhydrate Glykogenabbau Glycogensynthese Regulation und Integration des Glycogenstoffwechsels Signaltransduktion (Insulin,
BICEMIE des Stoffwechsels (772.113) 10. Einheit Glycogen Stoffwechsel Speicherkohlenhydrate Glykogenabbau Glycogensynthese Regulation und Integration des Glycogenstoffwechsels Signaltransduktion (Insulin,
Kohlenhydrate und ihre Funktionen
 Kohlenhydrate und ihre Funktionen Gliederung Monosaccharide Aufbau Nomenklatur Stereoisomerie/Konfiguration Zyklisierung O-glykosidische Bindung N-glykosidische Bindung Disaccharide Kohlenhydrate im Überblick
Kohlenhydrate und ihre Funktionen Gliederung Monosaccharide Aufbau Nomenklatur Stereoisomerie/Konfiguration Zyklisierung O-glykosidische Bindung N-glykosidische Bindung Disaccharide Kohlenhydrate im Überblick
Um diesen Prozess zu verstehen, müssen wir die Wege der Glukose genauer betrachten.
 Glukose hilft uns, auch bei intensiven Belastungen zu überleben. Wieso? Um diesen Prozess zu verstehen, müssen wir die Wege der Glukose genauer betrachten. In diesem Artikel geht es nicht nur um den Abbau
Glukose hilft uns, auch bei intensiven Belastungen zu überleben. Wieso? Um diesen Prozess zu verstehen, müssen wir die Wege der Glukose genauer betrachten. In diesem Artikel geht es nicht nur um den Abbau
Biochemie II. im Wintersemester 2009/2010. Joachim Wegener. Institut für Analytische Chemie, Chemo- und Biosensorik Universität Regensburg
 Biochemie II im Wintersemester 2009/2010 Joachim Wegener Institut für Analytische Chemie, Chemo- und Biosensorik Universität Regensburg 18.10.2010 1/14 Biochemie II im WS 2010 / 2011 All Dozenten auf einen
Biochemie II im Wintersemester 2009/2010 Joachim Wegener Institut für Analytische Chemie, Chemo- und Biosensorik Universität Regensburg 18.10.2010 1/14 Biochemie II im WS 2010 / 2011 All Dozenten auf einen
1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P)
 1. Klausur zum Modul 5.3 Biochemie WS 09/10 12.2.2010 1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P) 2) Welche Funktion
1. Klausur zum Modul 5.3 Biochemie WS 09/10 12.2.2010 1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P) 2) Welche Funktion
KOHLENHYDRATE. Die Glykolyse
 Die Glykolyse Hexokinase Glucose Kostet 1ATP Mg 2+ Glucose-6-P Die Glucokinase kann durch Insulin induziert werden in : 1) Den Fettzellen 2) Den ß-Zellen des Pankreas 3) Der Nierenrinde 4) Der Leber Die
Die Glykolyse Hexokinase Glucose Kostet 1ATP Mg 2+ Glucose-6-P Die Glucokinase kann durch Insulin induziert werden in : 1) Den Fettzellen 2) Den ß-Zellen des Pankreas 3) Der Nierenrinde 4) Der Leber Die
Einführung in die Biochemie
 Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Metabolismus Umwandlung von Stoffen und Energie nach den Gesetzen der Thermodynamik
 Metabolismus Umwandlung von Stoffen und Energie nach den Gesetzen der Thermodynamik Der Metabolismus oder Stoffwechsel ist die Gesamtheit der in einem Organismus ablaufenden (bio)chemischen Prozesse Der
Metabolismus Umwandlung von Stoffen und Energie nach den Gesetzen der Thermodynamik Der Metabolismus oder Stoffwechsel ist die Gesamtheit der in einem Organismus ablaufenden (bio)chemischen Prozesse Der
1. Nennen Sie 3 kohlenhydrathaltige Nahrungsmittel. 2. Wieso sind Kohlenhydrate für unseren Körper so wichtig?
 1. Nennen Sie 3 kohlenhydrathaltige Nahrungsmittel. 2. Wieso sind Kohlenhydrate für unseren Körper so wichtig? 3. Aus welchen Elementen bestehen die Kohlenhydrate? 4. Nennen Sie die Summenformel der Kohlenhydrate.
1. Nennen Sie 3 kohlenhydrathaltige Nahrungsmittel. 2. Wieso sind Kohlenhydrate für unseren Körper so wichtig? 3. Aus welchen Elementen bestehen die Kohlenhydrate? 4. Nennen Sie die Summenformel der Kohlenhydrate.
Der Stoffwechsel. Wir zeigen dir wie er funktioniert.
 Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Guter Stoffwechsel, schlechter Stoffwechsel, der Stoffwechsel schläft, den Stoffwechsel ankurbeln,
Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Der Stoffwechsel. Wir zeigen dir wie er funktioniert. Guter Stoffwechsel, schlechter Stoffwechsel, der Stoffwechsel schläft, den Stoffwechsel ankurbeln,
Autotrophe und heterotrophe Organismen
 Grundlagen der Umwelttechnik 5. Biomoleküle und Grundlagen des Stoffwechsels Vorlesung an der ochschule Augsburg Dr. Siegfried Kreibe Stand 2013 1 Autotrophe und heterotrophe Organismen Autotrophe Organismen:
Grundlagen der Umwelttechnik 5. Biomoleküle und Grundlagen des Stoffwechsels Vorlesung an der ochschule Augsburg Dr. Siegfried Kreibe Stand 2013 1 Autotrophe und heterotrophe Organismen Autotrophe Organismen:
Kohlenhydrate. Prof. Dr. Albert Duschl
 Kohlenhydrate Prof. Dr. Albert Duschl Kohlenhydrate in der Nahrung Kohlenhydrate sind in zwei Formen in unserer Nahrung vorhanden: Als komplexe Zucker, wie Stärke in Getreideprodukten, und als einfache
Kohlenhydrate Prof. Dr. Albert Duschl Kohlenhydrate in der Nahrung Kohlenhydrate sind in zwei Formen in unserer Nahrung vorhanden: Als komplexe Zucker, wie Stärke in Getreideprodukten, und als einfache
Zellen verwandeln Zucker in Energie
 Zellen verwandeln Zucker in Energie Kohlenhydrate sind äusserst wichtige Brennstofflieferanten. Pflanzen können Zucker selber herstellen (vgl. autotrophe Organismen); Tiere hingegen müssen Zucker (und
Zellen verwandeln Zucker in Energie Kohlenhydrate sind äusserst wichtige Brennstofflieferanten. Pflanzen können Zucker selber herstellen (vgl. autotrophe Organismen); Tiere hingegen müssen Zucker (und
Glykogen. 1,6-glykosidisch verbunden sind. Die Verzweigungen dienen dazu das Molekül an vielen Stellen gleichzeitig ab- oder aufzubauen.
 Glykogen Glykogen stellt die Speicherform der Glucose dar. Der menschliche Körper kann Glucose nicht speichern (Osmose). Es können ca. 400g Glucose als Glykogen aufbewahrt werden. Chemischer Aufbau: Glykogen
Glykogen Glykogen stellt die Speicherform der Glucose dar. Der menschliche Körper kann Glucose nicht speichern (Osmose). Es können ca. 400g Glucose als Glykogen aufbewahrt werden. Chemischer Aufbau: Glykogen
Parotis Pankreas. Dünndarm Bürstensaum. Amylose Amylopektin Glykogen. Maltose. Glucose. Isomaltose. Saccharose. Fructose. Lactose. Galaktose.
 Parotis Pankreas Dünndarm Bürstensaum Amylose Amylopektin Glykogen Saccharose Lactose Maltose Isomaltose Saccharase (Sucrase) Lactase Maltase Isomaltase Glucose Fructose Galaktose Abbau von Stärke und
Parotis Pankreas Dünndarm Bürstensaum Amylose Amylopektin Glykogen Saccharose Lactose Maltose Isomaltose Saccharase (Sucrase) Lactase Maltase Isomaltase Glucose Fructose Galaktose Abbau von Stärke und
Citratzyklus. Citratzyklus
 Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
Der hat in der Zelle verschiedene Aufgaben. Teilschritte werden z.b. bei manchen Gärungen eingesetzt (Methyl-Malonyl-CoA-Weg). Er ist wichtig zur Bereitstellung verschiedener Vorstufen für Biosynthesen,
Enzyme: Grundlegende Konzepte und Kinetik
 Enzyme: Grundlegende Konzepte und Kinetik Enzyme sind Katalysatoren biologischer Systeme Wichtigste Eigenschaften: katalytische Stärke und Spezifität Nahezu alle bekannten Enzyme sind Proteine, es gibt
Enzyme: Grundlegende Konzepte und Kinetik Enzyme sind Katalysatoren biologischer Systeme Wichtigste Eigenschaften: katalytische Stärke und Spezifität Nahezu alle bekannten Enzyme sind Proteine, es gibt
Praktikumsreferat Biochemie
 Praktikumsreferat Biochemie Thema: Glycolyse und Gluconeogenese 1. Glycolyse im Überblick Die Glycolyse (gr.: glykys = süß, lysis = auflösen) beschreibt den Abbau von Glucose zu Pyruvat (aerobe Glycolyse
Praktikumsreferat Biochemie Thema: Glycolyse und Gluconeogenese 1. Glycolyse im Überblick Die Glycolyse (gr.: glykys = süß, lysis = auflösen) beschreibt den Abbau von Glucose zu Pyruvat (aerobe Glycolyse
Kohlenhydrate. spielen in der Natur eine sehr wichtige Rolle. dienen als Energiespeicher: Stärke, Glykogen
 Kohlenhydrate spielen in der Natur eine sehr wichtige Rolle dienen als Energiespeicher: Stärke, Glykogen sind Bestandteile von DNA bzw. RNA, Zellwänden,... gebunden an Proteine und Lipide Einteilung der
Kohlenhydrate spielen in der Natur eine sehr wichtige Rolle dienen als Energiespeicher: Stärke, Glykogen sind Bestandteile von DNA bzw. RNA, Zellwänden,... gebunden an Proteine und Lipide Einteilung der
Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O O 2 6 CO H 2 O G kj
 Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O G 0-2872 kj Hydrolyse der Stärke Ausgangssubstrate: Glucose, Fructose Stärkehydrolyse: Amylasen Endo- ( -Amylase) und
Biologische Oxidation: Atmung (Dissimilation) C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O G 0-2872 kj Hydrolyse der Stärke Ausgangssubstrate: Glucose, Fructose Stärkehydrolyse: Amylasen Endo- ( -Amylase) und
Seminar Biotechnologie. Isomerases for Biotransformation of D- hexoses
 Seminar Biotechnologie Isomerases for Biotransformation of D- hexoses Wanmeng Mu, Lina Yu, Wenli Zhang, Tao Zhang, Bo Jiang (2015) Gläser Lars 2545317 3. SEMESTER MSC. BIOTECHNOLOGIE 2 D-Hexosen Hexosen
Seminar Biotechnologie Isomerases for Biotransformation of D- hexoses Wanmeng Mu, Lina Yu, Wenli Zhang, Tao Zhang, Bo Jiang (2015) Gläser Lars 2545317 3. SEMESTER MSC. BIOTECHNOLOGIE 2 D-Hexosen Hexosen
Grundwissenkarten Gymnasium Vilsbisburg. 10. Klasse. Biologie
 Grundwissenkarten Gymnasium Vilsbisburg 10. Klasse Biologie Es sind insgesamt 12 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Gymnasium Vilsbisburg 10. Klasse Biologie Es sind insgesamt 12 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Hemmung der Enzym-Aktivität
 Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Hemmung der Enzym-Aktivität Substrat Kompetitiver Inhibitor Enzym Enzym Substrat Nichtkompetitiver Inhibitor Irreversibler Inhibitor Enzym Enzym Enzym - Kinetik Michaelis Menten Gleichung Lineweaver -
Einführung in die Biochemie Wirkungsweise von Enzymen
 Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Die Glycolyse (Glucose Katabolismus)
 Die Glycolyse (Glucose Katabolismus) 1. Übersicht über die Glykolyse 2. Reaktionschritte der Glykolyse 3. Gärung: Der anaerobe Weg des Pyruvats 4. Kontrolle der Glykolyse 5. Stoffwechsel von anderen Hexosen
Die Glycolyse (Glucose Katabolismus) 1. Übersicht über die Glykolyse 2. Reaktionschritte der Glykolyse 3. Gärung: Der anaerobe Weg des Pyruvats 4. Kontrolle der Glykolyse 5. Stoffwechsel von anderen Hexosen
Thermodynamik & Kinetik
 Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Thermodynamik & Kinetik Inhaltsverzeichnis Ihr versteht die Begriffe offenes System, geschlossenes System, isoliertes System, Enthalpie, exotherm und endotherm... 3 Ihr kennt die Funktionsweise eines Kalorimeters
Energiegewinnung aus Nahrungsbestandteilen
 Energiegewinnung aus Nahrungsbestandteilen Fett Kohlenhydrate PROTEIN Fettsäuren und Glycerol Glucose und andere Zucker Acetyl CoA Aminosäuren Stadium I Stadium II ATP ADP CoA O 2 Oxidative Phosphorylierung
Energiegewinnung aus Nahrungsbestandteilen Fett Kohlenhydrate PROTEIN Fettsäuren und Glycerol Glucose und andere Zucker Acetyl CoA Aminosäuren Stadium I Stadium II ATP ADP CoA O 2 Oxidative Phosphorylierung
Einführung in die Biochemie
 Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus)
 Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Kinetik Kinetik: a) Reaktionsgeschwindigkeit (zeitlicher Verlauf) b) Reaktionsweg (Mechanismus) Klassifizierung chem. Reaktionen nach kinetischen Aspekten a) Reaktionsmolekularität: wie viele Teilchen
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail. Mag. Gerald Trutschl
 Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Wichtig für die Resorption von Glucose. Wird im Abschnitt Verdauung/ Resorption besprochen.
 6. Stoffwechsel der Kohlenhydrate: 6.1. Glycolyse: Glucose 2 * Pyruvat Glucose+ 2 NAD + + 2 P i + 2 ADP 2* (Pyruvat + NADH + H + +ATP +H 2 O ) Glycos: süß, lysis: Spaltung Ubiquitärer Stoffwechselweg:
6. Stoffwechsel der Kohlenhydrate: 6.1. Glycolyse: Glucose 2 * Pyruvat Glucose+ 2 NAD + + 2 P i + 2 ADP 2* (Pyruvat + NADH + H + +ATP +H 2 O ) Glycos: süß, lysis: Spaltung Ubiquitärer Stoffwechselweg:
Kohlenhydrate Aminosäuren Peptide
 Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Funktion von Proteinen:
 Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
Schrittweise Oxidation und Decarboxylierung von Glucose-6-phosphat zu Ribulose-5- phosphat
 1. Der plastidäre oxidative Pentosephosphatweg Abbau von Hexose unter NADPH+H + -Synthese Schlüsselenzym=Glucose-6-phosphat-Dehydrogenase Glucose-6-phosphat-Dehydrogenase wird durch Thioredoxin im reduzierten
1. Der plastidäre oxidative Pentosephosphatweg Abbau von Hexose unter NADPH+H + -Synthese Schlüsselenzym=Glucose-6-phosphat-Dehydrogenase Glucose-6-phosphat-Dehydrogenase wird durch Thioredoxin im reduzierten
1. Zeichnen und beschriften Sie die stereochemische Struktur von L- Threonin. Geben Sie an, ob R- oder S-Konfiguration vorliegt.
 Übung und Lösung zur Übung Aminosäuren 1. Zeichnen und beschriften Sie die stereochemische Struktur von L- Threonin. Geben Sie an, ob R- oder S-Konfiguration vorliegt. 2. Das Tripeptid Glutathion ( -Glu-Cys-Gly)
Übung und Lösung zur Übung Aminosäuren 1. Zeichnen und beschriften Sie die stereochemische Struktur von L- Threonin. Geben Sie an, ob R- oder S-Konfiguration vorliegt. 2. Das Tripeptid Glutathion ( -Glu-Cys-Gly)
N H H. Carbanionen Lewis-Basen Olefine (Alkane) Die Stärke der Nucleophilie wird von versch. Faktoren beeinflußt z.b.
 Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Organische hemie Nucleophil = kernliebend Nucleophil = Teilchen oder Gruppe, die Lewis-basische Eigenschaften aufweist (also mind. ein freies Elektronenpaar besitzt), es gibt neutrale Nucleophile sowie
Johann Wolfgang Goethe-Universität Frankfurt am Main
 Johann Wolfgang Goethe-Universität Frankfurt am Main Fachbereich Biowissenschaften Teilklausur Biochemie Studiengang Biowissenschaften Modul BSc-Biowiss-7 Studiengang Bioinformatik Modul BSc-Bioinf-8.Studiengang
Johann Wolfgang Goethe-Universität Frankfurt am Main Fachbereich Biowissenschaften Teilklausur Biochemie Studiengang Biowissenschaften Modul BSc-Biowiss-7 Studiengang Bioinformatik Modul BSc-Bioinf-8.Studiengang
BIOCHEMIE DER ERNÄHRUNG II Oxidation von Lipiden. Gastrointestinaltrakt. Fettsäureoxidation zu Acetyl-CoA
 xidation von Lipiden ß-xidation: Fettsäureoxidation zu Acetyl-oA BIEMIE DER ERNÄRUNG II 07.05.2012 wichtigste Fettsäurequelle in Nahrung: Triacylglyceride Import freier Fettsäuren ins ytosol oder Erzeugung
xidation von Lipiden ß-xidation: Fettsäureoxidation zu Acetyl-oA BIEMIE DER ERNÄRUNG II 07.05.2012 wichtigste Fettsäurequelle in Nahrung: Triacylglyceride Import freier Fettsäuren ins ytosol oder Erzeugung
Kohlenhydrate Einleitung
 Einleitung Kohlenhydrate (Saccharide) sind Polyhydroxycarbonyl-Verbindungen, die neben Kohlenstoff noch Wasserstoff und Sauerstoff im Stoffmengenverhältnis 2:1 enthalten. Der Begriff Kohlenhydrate ist
Einleitung Kohlenhydrate (Saccharide) sind Polyhydroxycarbonyl-Verbindungen, die neben Kohlenstoff noch Wasserstoff und Sauerstoff im Stoffmengenverhältnis 2:1 enthalten. Der Begriff Kohlenhydrate ist
Pentosephosphatzyklus. Synonym: Hexosemonophosphatweg
 Pentosephosphatzyklus Synonym: Hexosemonophosphatweg Gliederung Funktion & Lokalisation Grundgerüst des Ablaufs Anpassung an Stoffwechselsituation Regelung Beispielreaktion Funktion & Lokalisation Gewinnung
Pentosephosphatzyklus Synonym: Hexosemonophosphatweg Gliederung Funktion & Lokalisation Grundgerüst des Ablaufs Anpassung an Stoffwechselsituation Regelung Beispielreaktion Funktion & Lokalisation Gewinnung
Enthalpie. Ob eine Reaktion exergonisch ist, entscheidet die Änderung des Wärmeinhalts (heat content) H = Enthalpie
 Enthalpie Ob eine Reaktion exergonisch ist, entscheidet die Änderung des Wärmeinhalts (heat content) H = Enthalpie C 6 H 12 O 6 + 6O 2 6CO 2 + 6 H 2 O H = -2818 kj/mol - bei exergonischen Reaktionen Entropie
Enthalpie Ob eine Reaktion exergonisch ist, entscheidet die Änderung des Wärmeinhalts (heat content) H = Enthalpie C 6 H 12 O 6 + 6O 2 6CO 2 + 6 H 2 O H = -2818 kj/mol - bei exergonischen Reaktionen Entropie
Kontrolle der Genexpression auf mrna-ebene. Abb. aus Stryer (5th Ed.)
 Kontrolle der Genexpression auf mrna-ebene Abb. aus Stryer (5th Ed.) RNA interference (RNAi) sirna (small interfering RNA) mirna (micro RNA) Abb. aus Stryer (5th Ed.) Transcriptional silencing Inhibition
Kontrolle der Genexpression auf mrna-ebene Abb. aus Stryer (5th Ed.) RNA interference (RNAi) sirna (small interfering RNA) mirna (micro RNA) Abb. aus Stryer (5th Ed.) Transcriptional silencing Inhibition
Grundlagen der Physiologie
 Grundlagen der Physiologie Regulation www.icbm.de/pmbio Mensch und Affe Was unterscheidet uns vom Affen? 5 %? 1 Nachbar Was unterscheidet Sie von Ihrem Nachbarn? Was unterscheidet uns vom Affen? Was unterscheidet
Grundlagen der Physiologie Regulation www.icbm.de/pmbio Mensch und Affe Was unterscheidet uns vom Affen? 5 %? 1 Nachbar Was unterscheidet Sie von Ihrem Nachbarn? Was unterscheidet uns vom Affen? Was unterscheidet
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Stoffwechsel. Metabolismus (1)
 Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (1) Zum Nachlesen Bücher Campbell: Kap. 6 59.95 Kap. 3 Kap. 13-14 29.95 www.icbm.de/pmbio - - - > Teaching diese Folien, VL Physiologie der
Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (1) Zum Nachlesen Bücher Campbell: Kap. 6 59.95 Kap. 3 Kap. 13-14 29.95 www.icbm.de/pmbio - - - > Teaching diese Folien, VL Physiologie der
BIOCHEMIE des Stoffwechsels ( )
 BIEMIE des Stoffwechsels (772.113) 4. Einheit Glycolyse (1) Wie werden nun Moleküle in der lebenden Zelle synthetisiert und abgebaut? Wie funktioniert der Intermediärstoffwechsel? Der Intermediärstoffwechsel
BIEMIE des Stoffwechsels (772.113) 4. Einheit Glycolyse (1) Wie werden nun Moleküle in der lebenden Zelle synthetisiert und abgebaut? Wie funktioniert der Intermediärstoffwechsel? Der Intermediärstoffwechsel
Einführung in die Biochemie
 Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Stoffwechselvorgänge, bei denen Kohlenhydrate abgebaut werden um dem rganismus Energie zur Verfügung zu stellen, können auf verschieden Wegen ablaufen: 1. Die Atmung ist der aerobe Abbau, bei dem zur Energiegewinnung
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie
 Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Richtung von spontanem Prozeßablauf und Veränderung der G in Abhängigkeit vom Vorzeichen der Enthalpie und der Entropie H S G= H-T S Prozeß 1. (-) (+) (-) immer exergonisch, erfolgt spontan bei allen Temperaturen
Hauptwege des Stoffwechsels
 Hauptwege des Stoffwechsels Auf- und Abbau der Stoffgruppen Kohlenhydrate 1 Enzyme Hauptklassen 1 2 3 4 5 6 Biochemie 08/2 Enzyme 1. Erhöhung der Reaktionsgeschwindigkeit ΔΔG kat = ΔG unkat - ΔG kat Erniedrigung
Hauptwege des Stoffwechsels Auf- und Abbau der Stoffgruppen Kohlenhydrate 1 Enzyme Hauptklassen 1 2 3 4 5 6 Biochemie 08/2 Enzyme 1. Erhöhung der Reaktionsgeschwindigkeit ΔΔG kat = ΔG unkat - ΔG kat Erniedrigung
Beckers Welt der Zelle 8., aktualisierte Auflage. Jeff Hardin Gregory Bertoni Lewis Kleinsmith. Deutsche Bearbeitung von Wolf-Michael Weber
 Beckers Welt der Zelle 8., aktualisierte Auflage Jeff Hardin Gregory Bertoni Lewis Kleinsmith Deutsche Bearbeitung von Wolf-Michael Weber 9 Chemotropher Energiemetabolismus I: Glykolyse und Fermentation
Beckers Welt der Zelle 8., aktualisierte Auflage Jeff Hardin Gregory Bertoni Lewis Kleinsmith Deutsche Bearbeitung von Wolf-Michael Weber 9 Chemotropher Energiemetabolismus I: Glykolyse und Fermentation
Glycerin Produktion am Beispiel von Saccharomyces cerevisiae
 Glycerin Produktion am Beispiel von Saccharomyces cerevisiae Inhalt Sinn und Zweck Biosynthese Glycerinphosphatdehydrogenase Überexpression des GPD1-Gens Nebenprodukte Zusammenfassung Literatur Sinn und
Glycerin Produktion am Beispiel von Saccharomyces cerevisiae Inhalt Sinn und Zweck Biosynthese Glycerinphosphatdehydrogenase Überexpression des GPD1-Gens Nebenprodukte Zusammenfassung Literatur Sinn und
Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen. c(a) t. v = -
 REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
REAKTIONSKINETIK 1 Reaktionskinetik Reaktionskinetik: - Geschwindigkeit chemischer Reaktionen - Untersuchung (bzw. Bestimmung) der Reaktionsmechanismen Anwendung: - Vorgänge in den lebenden Organismen
