ORGANISCHE CHEMIE 1. Stoff der 15. Vorlesung: Atommodell, Bindungsmodell...
|
|
|
- Lothar Melsbach
- vor 7 Jahren
- Abrufe
Transkript
1 Stoff der 15. Vorlesung: Atommodell, Bindungsmodell... ORGANISCHE CHEMIE Vorlesung, Dienstag, 07. Juni Einelektronensysteme: H-Atom s,p,d Orbital - Mehrelektronensysteme: He-Atom Pauli-Prinzip, Hund sche Regel - Moleküle: H 2 -Molekül LCAO-MO-Ansatz - Singulett-Triplett-Zustände im H 2 Harald Schwalbe Institut für Organische Chemie und Chemische Biologie Goethe Universität Frankfurt Tel.: +49 (0) schwalbe@nmr.uni-frankfurt.de Literatur zur 15. Vorlesung: -Aspekte der organischen Chemie (Quinkert, G., Egert, E., Griesinger, C.), -Vorlesungsskript
2 One hundred years after Niels Bohr published his model of the atom, a special issue of Nature explores its legacy and how much there is still to learn about atomic structure June 2013 kopiert von nature.com
3 Inhalt der heutigen Vorlesungsstunde: Chemische Bindung aus der Sicht der OC I. Atomorbitale (s-, p-, d-, f-orbitale) - exakte Lösungen des Wasserstoffatoms II. Mehrelektronensysteme - Heliumatom, ein Kern und zwei Elektronen III. Regeln für die Elektronenbesetzung von Atomorbitalen - Pauliprinzip, Hund sche Regel IV. Molekülorbitale - LCAO-MO-Ansatzes.
4 Die Schrödingergleichung beschreibt Elektronendichtewahrscheinlichkeit Die Ψ-Funktion Ψ 2 * = Ψ Ψ = dw dv * Ψ ΨjdV i = = = 0 1 für i für i = j j
5 Ein-Elektronensystem: das Wasserstoffatom z ϑ e - r y Z + ϕ x
6 Die Lösungsfunktionen des Wasserstoffatoms E [ev] Z 2 2s 2p x 2p y 2p z Z 2 1s Es gibt eine unendlich große Anzahl möglicher Lösungsfunktionen Ψ (Funktionen 1s, 2s,2p, 3s,3p,3d, etc) Die Lösungsfunktionen haben diskrete Energien, abh. von der Kernladung Z. Lösungsfunktionen, auch Zustandsfunktionen genannt, heißen auch Orbitale.
7 Die Lösungsfunktionen des Wasserstoffatoms: 1s-Funktion aus Quinkert, Egert, Griesinger
8 Die Lösungsfunktionen des Wasserstoffatoms: 2s-Funktion aus Quinkert, Egert, Griesinger
9 Mathematische Berechnungen: 1s-, 2s- und 2p-Funktion aus Claydon, Warren
10 Mehrelektronensystem: 1 Kern, 2 Elektronen: He-Atom r + e _ e 2 _ r 2 Z + r 1 e 1 _ H-Atom He-Atom
11 Mathematische Näherungsverfahren zur Beschreibung von Mehrelektronensystem Näherungen: 1. Es gibt keine Elektron/Elektron-Wechselwirkungen Jedes Elektron spürt nur den Atomkern einer Ladung, nicht aber die Abstoßung durch andere Elektronen. 2. Lösung der Schrödingergleichung für jedes der n Elektronen setzt sich zusammen aus den Lösungen des Einelektronensystems. Man nennt dies einen Produktansatz: Ψ ( ) Orbitalnäherung r r,..., r ϕ ( r ) ϕ ( r )... ϕ ( r ) 1, 2 n n n
12 Mathematische Näherungsverfahren zur Beschreibung von Mehrelektronensystem 3.) Die reale Kernladung wird durch eine effektive Kernladung ersetzt. Jedes Elektron im Mehrelektronenatom spürt eine reduzierte Kernladung aufgrund der Anwesenheit weiterer Elektronen. Die Elektronenkorrelation (des Ortes, der Spins etc.) bleibt unberücksichtigt.
13 Regeln für die Besetzung von Orbitalen mit Elektronen in Mehrelektronensystem Pauli-Prinzip: 2 Elektronen können nur dann durch gleiche Einelektronenfunktionen beschrieben werden, wenn sie sich durch den Spin unterscheiden. Elektronen besetzen paarweise Orbitale von niedrigster zur höchsten Energie. Hund sche Regel: Bei Besetzung energiegleicher (entarteter) Orbitale ist Anordnung mit Elektronen gleichen Spins am stabilsten.
14 Moleküle: H 2 H 2 -Molekül r 1 r 2 R 1 R 2 (,R,...,R,r,r,..., ) Ψ R r 1 2 m 1 2 n
15 Moleküle: H 2 - Born-Oppenheimer-Näherung H 2 -Molekül r 1 r 2 R 1 R 2 (,R,...,R,r,r,..., ) Ψ R r 1 2 m 1 2 n Ψ ( R,R,...,R,r,r,...,r ) χ( R,R,...,R ) Ψ ( r,r,..., ) 1 2 m 1 2 n 1 2 m 1 2 rn χ(r 1-m ) beschreibt das fixierte Kerngerüst Die Radien r 1-n stehen für die Elektronenkoordinaten im fixierten Kerngerüst
16 Moleküle: H 2 LCAO-MO-Ansatz E σ σ = (1s-1s )/ 2 1s 1s σ σ = (1s+1s )/ 2
17 Moleküle: H 2 Grund- und angeregte Zustände im Molekül - Besetzungsregeln E 1 σ* 2 2 H-Orbitale 1s 1s 1 σσ* 3 σσ* H 2 -Molekül 1 σ 2
18 Moleküle: H 2 Singulett- und Triplett-Zustände E 1 σ* 2 2 H-Orbitale 1s 1s 1 σσ* 3 σσ* H 2 -Molekül 1 σ 2
19 Moleküle: H 2 Singulett- und Triplett-Zustände mögliche Verteilung der zwei Elektronen E σ * 1 σ *2 H 2 1s 1s 1 σ σ * 3 σ σ * σ 1 σ 2 2 H-Atomorbitale 1 σ 2 3 σ σ * 1 σ σ * 1 σ *2
ORGANISCHE CHEMIE 1. Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO...
 Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Stoff der 16. Vorlesung: Hybridisierung, Hückel-MO... ORGANISCHE CHEMIE 1 16. Vorlesung, Freitag, 14. Juni 2013 I. Hybridorbitale im Kohlenstoff - Regeln für Wechselwirkung von Orbitalen - σ und π MO s
Quantenzahlen. A B z. Einführung in die Struktur der Materie 67
 Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
Quantenzahlen Wir haben uns bis jetzt nur mit dem Grundzustand des H + 2 Moleküls beschäftigt Wie sieht es aus mit angeregten Zuständen wie z.b. 2p Zuständen im H Atom? Bezeichnung der Molekülorbitale
: Quantenmechanische Lösung H + 2. Molekülion und. Aufstellen der Schrödingergleichung für das H + 2
 H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
H + 2 Die molekulare Bindung : Quantenmechanische Lösung Aufstellen der Schrödingergleichung für das H + 2 Molekülion und Lösung Wichtige Einschränkung: Die Kerne sind festgehalten H Ψ(r) = E Ψ(r) (11)
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Sarah Römer (roemer@em.uni-frankfurt.de) Simona Scheit (simona.scheit@googlemail.com) Juanma
Das quantenmechanische Atommodell
 Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten
 Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Konstantin Falahati (k.falahati@yahoo.com) Jan von Cosel (jvcosel@theochem.uni-frankfurt.de)
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Konstantin Falahati (k.falahati@yahoo.com) Jan von Cosel (jvcosel@theochem.uni-frankfurt.de)
11. Quantenchemische Methoden
 Computeranwendung in der Chemie Informatik für Chemiker(innen) 11. Quantenchemische Methoden Jens Döbler 2004 "Computer in der Chemie", WS 2003-04, Humboldt-Universität VL11 Folie 1 Grundlagen Moleküle
Computeranwendung in der Chemie Informatik für Chemiker(innen) 11. Quantenchemische Methoden Jens Döbler 2004 "Computer in der Chemie", WS 2003-04, Humboldt-Universität VL11 Folie 1 Grundlagen Moleküle
Das H + 2 -Molekülion
 Das Näherungen für das elektronische Problem und Kernbewegungen 7. Dezember 2011 Schrödinger-Gleichung des s Abbildung: Arthur Beiser; Atome, Moleküle, Festkörper; Vieweg, Braunschweig 1983 ( K/E 2 2 +
Das Näherungen für das elektronische Problem und Kernbewegungen 7. Dezember 2011 Schrödinger-Gleichung des s Abbildung: Arthur Beiser; Atome, Moleküle, Festkörper; Vieweg, Braunschweig 1983 ( K/E 2 2 +
Grundlagen der Theoretischen Chemie (TC 1)
 Grundlagen der Theoretischen Chemie (TC 1) Vorlesung: Mo 10h-12h, Do 9h-10h Übungen: Do 8h-9h (2 Gruppen: H1, B3; Betreuung: J. Plötner, IB) Vorlesungsmaterial + Übungen: http://www.chimie.ens.fr/umr8642/quantique/tc1-l6.pdf
Grundlagen der Theoretischen Chemie (TC 1) Vorlesung: Mo 10h-12h, Do 9h-10h Übungen: Do 8h-9h (2 Gruppen: H1, B3; Betreuung: J. Plötner, IB) Vorlesungsmaterial + Übungen: http://www.chimie.ens.fr/umr8642/quantique/tc1-l6.pdf
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Das Bohr sche Atommodell: Strahlenabsorption, -emission, Elektromagentische Strahlung, Wellen, Wellenlänge, Frequenz, Wellenzahl. Postulate: * Elektronen bewegen
Wiederholung der letzten Vorlesungsstunde: Das Bohr sche Atommodell: Strahlenabsorption, -emission, Elektromagentische Strahlung, Wellen, Wellenlänge, Frequenz, Wellenzahl. Postulate: * Elektronen bewegen
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
Atommodell. Atommodell nach Bohr und Sommerfeld Für sein neues Atommodell stellte Bohr folgende Postulate auf:
 Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt.
 12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
12 Moleküle Slide 267 Vorbemerkungen Da Atome viele ununterscheidbare Elektronen besitzen, sind ihre Zustände durch interelektronische Coulomb- und Austausch-Wechselwirkungen bestimmt. Je 2 Elektronen
Chemische Bindung zweiatomiger Moleküle
 Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Die Born Oppenheimer Näherung vernachlässigt Elektronenimpulse gegenüber Kernimpulsen und erlaubt die Gesamtwellenfunktion als ein Produkt aus einer Kernwellenfunktion F q ( R) und der einer Elektronenwellenfunktion
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Übungen zu Physik 2 für Maschinenwesen
 Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Physikdepartment E13 SS 011 Übungen zu Physik für Maschinenwesen Prof. Dr. Peter Müller-Buschbaum, Dr. Eva M. Herzig, Dr. Volker Körstgens, David Magerl, Markus Schindler, Moritz v. Sivers Vorlesung 1.07.011,
Festkörperelektronik 4. Übung
 Festkörperelektronik 4. Übung Felix Glöckler 23. Juni 2006 1 Übersicht Themen heute: Feedback Spin Drehimpuls Wasserstoffatom, Bohr vs. Schrödinger Wasserstoffmolekülion, kovalente Bindung Elektronen in
Festkörperelektronik 4. Übung Felix Glöckler 23. Juni 2006 1 Übersicht Themen heute: Feedback Spin Drehimpuls Wasserstoffatom, Bohr vs. Schrödinger Wasserstoffmolekülion, kovalente Bindung Elektronen in
Orbitalmodell SPF BCH am
 Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
c = Ausbreitungsgeschwindigkeit (2, m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 )
 2.3 Struktur der Elektronenhülle Elektromagnetische Strahlung c = λ ν c = Ausbreitungsgeschwindigkeit (2,9979 10 8 m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 ) Quantentheorie (Max Planck, 1900) Die
2.3 Struktur der Elektronenhülle Elektromagnetische Strahlung c = λ ν c = Ausbreitungsgeschwindigkeit (2,9979 10 8 m/s) λ = Wellenlänge (m) ν = Frequenz (Hz, s -1 ) Quantentheorie (Max Planck, 1900) Die
Atome und ihre Eigenschaften
 Atome und ihre Eigenschaften Vom Atomkern zum Atom - von der Kernphysik zur Chemie Die Chemie beginnt dort, wo die Temperaturen soweit gefallen sind, daß die positiv geladenen Atomkerne freie Elektronen
Atome und ihre Eigenschaften Vom Atomkern zum Atom - von der Kernphysik zur Chemie Die Chemie beginnt dort, wo die Temperaturen soweit gefallen sind, daß die positiv geladenen Atomkerne freie Elektronen
4 Die Atombindung im Wasserstoff-Molekül
 4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
4.1 Übersicht und Lernziele Thema Bis jetzt haben wir nur von Atomen gesprochen. In der Chemie beschäftigen wir uns aber normalerweise mit Molekülen oder Ionen. Wir wollen deshalb in diesem Kapitel auf
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Topic: Helium-Atom Vorlesung: Mo 10h-12h, Do9h-10h Übungen: Do 8h-9h Web site: http://www.theochem.uni-frankfurt.de/tc1
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Topic: Helium-Atom Vorlesung: Mo 10h-12h, Do9h-10h Übungen: Do 8h-9h Web site: http://www.theochem.uni-frankfurt.de/tc1
Molekülphysik. April Grundzustand und angeregte Zustände eines Moleküls
 Molekülphysik April 2010 1 Grundzustand und angeregte Zustände eines Moleküls 1.1 Hamiltonoperator für das Gesamtproblem Die Quantenmechanik ist die fundamentale Theorie der Materie. Sowohl die Koordinaten
Molekülphysik April 2010 1 Grundzustand und angeregte Zustände eines Moleküls 1.1 Hamiltonoperator für das Gesamtproblem Die Quantenmechanik ist die fundamentale Theorie der Materie. Sowohl die Koordinaten
2 Die Atombindung im Wasserstoff-Molekül
 2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
5 Mehrelektronensysteme
 5.1 Übersicht und Lernziele Thema Im ersten Teil dieses Kapitels behandeln wir Atome, die mehr als ein Elektron besitzen. Anschliessend betrachten wir im zweiten Teil die Bildung von Bindungen zwischen
5.1 Übersicht und Lernziele Thema Im ersten Teil dieses Kapitels behandeln wir Atome, die mehr als ein Elektron besitzen. Anschliessend betrachten wir im zweiten Teil die Bildung von Bindungen zwischen
Orbitalmodell im gymnasialen Chemieunterricht MINT-LERNZENTRUM
 Orbitalmodell im gymnasialen Chemieunterricht Atom @ Google Kugelwolkenmodell Schrödingergleichung Orbitalmodell Ausgangslage Experiment Folgerung Streuversuch von E. Rutherford (1911) Kern-Hülle-Modell
Orbitalmodell im gymnasialen Chemieunterricht Atom @ Google Kugelwolkenmodell Schrödingergleichung Orbitalmodell Ausgangslage Experiment Folgerung Streuversuch von E. Rutherford (1911) Kern-Hülle-Modell
1. Das qualitative MO-Modell
 1. Das qualitative MO-Modell Kapitel 8.1. in Quinkert et al. Inhalte: I. Die Grenzen des klassischen Strukturmodells werden an 4 Beispielen aufgezeichnet: a.) Amidbindung, b.) anomerer Effekt, c.) Inversionsbarriere
1. Das qualitative MO-Modell Kapitel 8.1. in Quinkert et al. Inhalte: I. Die Grenzen des klassischen Strukturmodells werden an 4 Beispielen aufgezeichnet: a.) Amidbindung, b.) anomerer Effekt, c.) Inversionsbarriere
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Organisatorisches Kurs-Skript http://www.uni-due.de/ adb297b
Übungen zur Vorlesung Physikalische Chemie II Lösungsvorschlag zu Blatt 5
 Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Wintersemester 006 / 007 04.1.006 1. Aufgabe Die Wellenfunktionen unterscheiden sich gar nicht. Während der Lösung der elektronischen Schrödingergleichung werden die Kerne als ruhend betrachtet. Es kommt
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
WAS FEHLT? STATISCHE KORRELATION UND VOLLE KONFIGURATIONSWECHSELWIRKUNG
 31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
31 besetzen als die β Elektronen. Wenn man dies in der Variation der Wellenfunktion zulässt, also den Satz der Orbitale verdoppelt und α und β Orbitale gleichzeitig optimiert, so ist i. A. die Energie
2.4. Atome mit mehreren Elektronen
 2.4. Atome mit mehreren Elektronen 2.4.1. Das Heliumatom Wellenfunktion für das Heliumatom Nach dem Wasserstoffatom ist das Heliumatom das nächst einfachere Atom. Das Heliumatom besitzt einen Kern der
2.4. Atome mit mehreren Elektronen 2.4.1. Das Heliumatom Wellenfunktion für das Heliumatom Nach dem Wasserstoffatom ist das Heliumatom das nächst einfachere Atom. Das Heliumatom besitzt einen Kern der
Atom-, Molekül- und Festkörperphysik
 Atom-, Molekül- und Festkörperphysik für LAK, SS 2014 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 4. Vorlesung, 27. 3. 2014 Molekülbindung, H2+ - Molekülion, Hybridisierung, Kohlenstoffverbindungen
Atom-, Molekül- und Festkörperphysik für LAK, SS 2014 Peter Puschnig basierend auf Unterlagen von Prof. Ulrich Hohenester 4. Vorlesung, 27. 3. 2014 Molekülbindung, H2+ - Molekülion, Hybridisierung, Kohlenstoffverbindungen
3.7. Coulomb-Loch und FERMI-Loch Eigenschaften der Slater-Determinante: antisymmetrisches Produkt von Einelektronenfunktionen ( )" 2.
 3.7. Coulomb-Loch und FERMI-Loch Eigenschaften der Slater-Determinante: antisymmetrisches Produkt von Einelektronenfunktionen!( x 1,x ) = 1 ( ) " ( 1) ( ) " ( ) = 1 $ " 1 1 " 1 1 " 1 ( )" ( ) " 1 ( )"
3.7. Coulomb-Loch und FERMI-Loch Eigenschaften der Slater-Determinante: antisymmetrisches Produkt von Einelektronenfunktionen!( x 1,x ) = 1 ( ) " ( 1) ( ) " ( ) = 1 $ " 1 1 " 1 1 " 1 ( )" ( ) " 1 ( )"
Das Bohrsche Atommodell
 Das Bohrsche Atommodell Auf ein Elektron, welches im elektrischen Feld eines Atomkerns kreist wirkt ein magnetisches Feld. Der Abstand zum Atomkern ist das Ergebnis, der elektrostatischen Coulomb-Anziehung
Das Bohrsche Atommodell Auf ein Elektron, welches im elektrischen Feld eines Atomkerns kreist wirkt ein magnetisches Feld. Der Abstand zum Atomkern ist das Ergebnis, der elektrostatischen Coulomb-Anziehung
Daltonsche Atomhypothese (1808)
 Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Daltonsche Atomhypothese (1808) Chemische Elemente bestehen aus kleinsten, chemisch nicht weiter zerlegbaren Teilchen, den Atomen. Alle Atome eines Elementes haben untereinander gleiche Masse, während
Physikdepartment. Ferienkurs zur Experimentalphysik 4. Daniel Jost 09/09/15
 Physikdepartment Ferienkurs zur Experimentalphysik 4 Daniel Jost 09/09/15 Inhaltsverzeichnis Technische Universität München 1 Nachtrag: Helium-Atom 1 2 Röntgen-Spektren 2 3 Approximationen 6 3.1 Linear
Physikdepartment Ferienkurs zur Experimentalphysik 4 Daniel Jost 09/09/15 Inhaltsverzeichnis Technische Universität München 1 Nachtrag: Helium-Atom 1 2 Röntgen-Spektren 2 3 Approximationen 6 3.1 Linear
Die chemische Bindung
 Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
Die chemische Bindung Die Valenz-Bond Theorie Molekülorbitale Die Bänder Theorie der Festkörper bei einer ionischen Bindung bildet bildet sich ein Dipol aus ('Übertragung von Elektronen') Eine kovalente
TC1 Grundlagen der Theoretischen Chemie
 TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Topic: Wasserstoffatom Vorlesung: Mo 1h-12h, Do9h-1h Übungen: Do 8h-9h Web site: http://www.theochem.uni-frankfurt.de/tc1
TC1 Grundlagen der Theoretischen Chemie Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Topic: Wasserstoffatom Vorlesung: Mo 1h-12h, Do9h-1h Übungen: Do 8h-9h Web site: http://www.theochem.uni-frankfurt.de/tc1
Aufbau von Atomen. Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem
 Aufbau von Atomen Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem Wiederholung Im Kern: Protonen + Neutronen In der Hülle: Elektronen Rutherfords Streuversuch (90) Goldatome
Aufbau von Atomen Atommodelle Spektrum des Wasserstoffs Quantenzahlen Orbitalbesetzung Periodensystem Wiederholung Im Kern: Protonen + Neutronen In der Hülle: Elektronen Rutherfords Streuversuch (90) Goldatome
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Wechselwirkungen zwischen Atomen Was bisher geschah Quantenmechanisches
9. Moleküle. 9.1 Wasserstoff-Molekül Ion H Wasserstoff-Molekül H Schwerere Moleküle 9.4 Angeregte Moleküle. Physik IV SS
 9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
9.1 Wasserstoff-Molekül Ion H + 9. Wasserstoff-Molekül H 9.3 Schwerere Moleküle 9.4 Angeregte Moleküle 9.1 9.1 Wasserstoff-Molekül Ion H + Einfachstes Molekül: H + = p + e p + Coulomb-Potenzial: Schrödinger-Gleichung:
Theoretische Chemie (TC II) Computational Chemistry
 Theoretische Chemie (TC II) Computational Chemistry Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Dr. Matthias Ruckenbauer (matruc@theochem.uni-frankfurt.de) Dr. Haleh Hashemi
Theoretische Chemie (TC II) Computational Chemistry Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Praktikumsbetreuung: Dr. Matthias Ruckenbauer (matruc@theochem.uni-frankfurt.de) Dr. Haleh Hashemi
Grundlagen der Chemie Allgemeine Chemie Teil 2
 Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Allgemeine Chemie Teil 2 Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu AO-Theorie Wellenmechanik So wie Licht
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Moleküle. Zweiatomige Moleküle: H 2+
 Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Moleküle Zweiatomige Moleküle: 2+ : zwei Kerne, ein Elektron Der Abstand zwischen den Atomkernen wird so klein gewählt, dass die 1s-Orbitale überlappen und durch Linearkombination Molekülorbitale gebildet
Zusammenfassung Wasserstoffatom
 Ach ja... ter Teil der Vorlesung Prof. Dr. Tobias Hertel Lehrstuhl II für Physikalische Chemie Institut für Physikalische und Theoretische Chemie Raum 13 Tel.: 0931 318 6300 e-mail: tobias.hertel@uni-wuerzburg.de
Ach ja... ter Teil der Vorlesung Prof. Dr. Tobias Hertel Lehrstuhl II für Physikalische Chemie Institut für Physikalische und Theoretische Chemie Raum 13 Tel.: 0931 318 6300 e-mail: tobias.hertel@uni-wuerzburg.de
Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil
 Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil 1. Grundlagen der Quantenmechanik (a) Wellenfunktion: Die Wellenfunktion Ψ(x, t) beschreibt den quantenmechanischen Zustand eines Teilchens am Ort x zur
Quantenchemie WS 2008/2009 Zusammenfassung 1. Teil 1. Grundlagen der Quantenmechanik (a) Wellenfunktion: Die Wellenfunktion Ψ(x, t) beschreibt den quantenmechanischen Zustand eines Teilchens am Ort x zur
Lösung 14. Allgemeine Chemie II Frühjahrsemester 2013
 Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
Lösung 14 Allgemeine Chemie II Frühjahrsemester 2013 1. Aufgabe Bohr hat für das Wasserstoffatom ein Modell erstellt, das der klassischen Mechanik gehorcht und gewisse Ähnlichkeiten mit dem Planetenmodell
FERIENKURS EXPERIMENTALPHYSIK 4. Mehrelektronensysteme
 FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
FERIENKURS EXPERIMENTALPHYSIK 4 Vorlesung 3 am 04.09.2013 Mehrelektronensysteme Hannah Schamoni, Susanne Goerke Inhaltsverzeichnis 1 Das Helium-Atom 2 1.1 Grundlagen und Ortswellenfunktion........................
Moleküle und Wärmestatistik
 Moleküle und Wärmestatistik Vorlesung 22.08.2008 Inhaltsverzeichnis Moleküle 2. Born-Oppenheimer Näherung (adiabatische Näherung).... 3.2 LCAO Näherung......................... 4.3 Molekülorbitalnäherung.....................
Moleküle und Wärmestatistik Vorlesung 22.08.2008 Inhaltsverzeichnis Moleküle 2. Born-Oppenheimer Näherung (adiabatische Näherung).... 3.2 LCAO Näherung......................... 4.3 Molekülorbitalnäherung.....................
Übungen zur Vorlesung Theoretische Chemie II Übungsblatt 1 SoSe 2015 Lösungen Ĥ Ψ = E Ψ (1) c b
 Übungen zur Vorlesung Theoretische Chemie II Übungsblatt SoSe 205 Lösungen. H 2 + Molekülion a) Konstruieren Sie die Schrödingergleichung in Matrixdarstellung. Zunächst geht man von der stationären Schrödinger-Gleichung
Übungen zur Vorlesung Theoretische Chemie II Übungsblatt SoSe 205 Lösungen. H 2 + Molekülion a) Konstruieren Sie die Schrödingergleichung in Matrixdarstellung. Zunächst geht man von der stationären Schrödinger-Gleichung
Gesamtdrehimpuls Spin-Bahn-Kopplung
 Gesamtdrehimpuls Spin-Bahn-Kopplung > 0 Elektron besitzt Bahndrehimpuls L und S koppeln über die resultierenden Magnetfelder (Spin-Bahn-Kopplung) Vektoraddition zum Gesamtdrehimpuls J = L + S Für J gelten
Gesamtdrehimpuls Spin-Bahn-Kopplung > 0 Elektron besitzt Bahndrehimpuls L und S koppeln über die resultierenden Magnetfelder (Spin-Bahn-Kopplung) Vektoraddition zum Gesamtdrehimpuls J = L + S Für J gelten
Moleküle und Wärmestatistik
 Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Moleküle und Wärmestatistik Musterlösung.08.008 Molekülbindung Ein Molekül bestehe aus zwei Atomkernen A und B und zwei Elektronen. a) Wie lautet der Ansatz für die symmetrische Wellenfunktion in der Molekülorbitalnäherung?
Vorlesung 21. Identische Teilchen und das Pauli-Prinzip
 Vorlesung 1 Identische Teilchen und das Pauli-Prinzip Identische Teilchen: Jede Art von Teilchen in der Natur definieren wir durch ihre Eigenschaften, z.b. Massen, Spins, Ladungen usw. Das bedeutet, dass
Vorlesung 1 Identische Teilchen und das Pauli-Prinzip Identische Teilchen: Jede Art von Teilchen in der Natur definieren wir durch ihre Eigenschaften, z.b. Massen, Spins, Ladungen usw. Das bedeutet, dass
Theoretische Chemie (TC II) Computational Chemistry
 Theoretische Chemie (TC II) Computational Chemistry Lecture 2 28/10/2011 Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Vorlesung: Mi 11h30-13h, Fr 8h-9h30 Praktikum (gemäß Ankündigung, statt Vorlesung):
Theoretische Chemie (TC II) Computational Chemistry Lecture 2 28/10/2011 Irene Burghardt (burghardt@chemie.uni-frankfurt.de) Vorlesung: Mi 11h30-13h, Fr 8h-9h30 Praktikum (gemäß Ankündigung, statt Vorlesung):
Die Hartree-Fock-Methode
 February 11, 2016 1 Herleitung der Hartree-Fock-Gleichung 2 Das Heliumatom Gauß sche s-basis Roothaan-Hall-Gleichung Moleküle Herleitung der Hartree-Fock-Gleichung Betrachten wir zunächst das H 2 -Molekül:
February 11, 2016 1 Herleitung der Hartree-Fock-Gleichung 2 Das Heliumatom Gauß sche s-basis Roothaan-Hall-Gleichung Moleküle Herleitung der Hartree-Fock-Gleichung Betrachten wir zunächst das H 2 -Molekül:
Experimentalphysik Modul PH-EP4 / PH-DP-EP4
 6 Moleküle Universität Leipzig, Fakultät für Physik und Geowissenschaften Experimentalphysik Modul PH-EP4 / PH-DP-EP4 Script für Vorlesung 08. Juni 009 Nach der Beschreibung Ein- und Mehrelektronen-Atomen
6 Moleküle Universität Leipzig, Fakultät für Physik und Geowissenschaften Experimentalphysik Modul PH-EP4 / PH-DP-EP4 Script für Vorlesung 08. Juni 009 Nach der Beschreibung Ein- und Mehrelektronen-Atomen
Entwicklung der Atommodelle
 Entwicklung der Atommodelle Entwicklung der Atommodelle Demokrit 460 v Chr. Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter; in Wirklichkeit gibt es nur Atome im leeren Raum.
Entwicklung der Atommodelle Entwicklung der Atommodelle Demokrit 460 v Chr. Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter; in Wirklichkeit gibt es nur Atome im leeren Raum.
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
4. Aufbau der Elektronenhülle 4.1. Grundlagen 4.2. Bohrsches Atommodell 4.3. Grundlagen der Quantenmechanik 4.4. Quantenzahlen 4.5.
 4. Aufbau der Elektronenhülle 4.. Grundlagen 4.. Bohrsches Atommodell 4.3. Grundlagen der Quantenmechanik 4.4. Quantenzahlen 4.5. Atomorbitale 4. Aufbau der Elektronenhülle 4.. Grundlagen 4.. Bohrsches
4. Aufbau der Elektronenhülle 4.. Grundlagen 4.. Bohrsches Atommodell 4.3. Grundlagen der Quantenmechanik 4.4. Quantenzahlen 4.5. Atomorbitale 4. Aufbau der Elektronenhülle 4.. Grundlagen 4.. Bohrsches
Organische Chemie Chemie der Kohlenstoffverbindungen
 Organische Chemie Chemie der Kohlenstoffverbindungen Christoph Kreutz Lehrveranstaltungsnummer: 719.021 Bachelorstudium Biologie Wintersemester 2018/2019 Allgemeines zur Vorlesung Vorlesungsunterlagen
Organische Chemie Chemie der Kohlenstoffverbindungen Christoph Kreutz Lehrveranstaltungsnummer: 719.021 Bachelorstudium Biologie Wintersemester 2018/2019 Allgemeines zur Vorlesung Vorlesungsunterlagen
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
2.4. Atome mit mehreren Elektronen
 2.4. Atome mit mehreren Elektronen 2.4.1. Das Heliumatom Wellenfunktion für das Heliumatom Nach dem Wasserstoffatom ist das Heliumatom das nächst einfachere Atom. Das Heliumatom besitzt einen Kern der
2.4. Atome mit mehreren Elektronen 2.4.1. Das Heliumatom Wellenfunktion für das Heliumatom Nach dem Wasserstoffatom ist das Heliumatom das nächst einfachere Atom. Das Heliumatom besitzt einen Kern der
Vom Atombau zum Königreich der Elemente
 Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Atombindung Das Lewis Modell der kovalenten Bindung Bildung von Molekülen (Einfachbindungen) Aus jeweils einem ungepaarten Elektron eines Atoms bildet sich ein gemeinsames Elektronenpaar als Molekülorbital
Physikalische Chemie I SS 2018
 Physikalische Chemie I SS 2018 Vorlesung für BA Chemie und BA Nanoscience Prof. Dr. K. Hauser Fachbereich Chemie Karin.Hauser@uni-konstanz.de Advance Organizer Polymerchemie Kolloidchemie Molekülanalytik
Physikalische Chemie I SS 2018 Vorlesung für BA Chemie und BA Nanoscience Prof. Dr. K. Hauser Fachbereich Chemie Karin.Hauser@uni-konstanz.de Advance Organizer Polymerchemie Kolloidchemie Molekülanalytik
3. Bausteine der Materie: Atomhülle. Form der Atomorbitale. s-orbitale kugelsymmetrische Elektronendichteverteilung
 3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
3. Bausteine der Materie: Atomhülle Form der Atomorbitale s-orbitale kugelsymmetrische Elektronendichteverteilung 1s 2s 3d - Orbitale 3. Bausteine der Materie: Atomhülle 3. Bausteine der Materie: Atomhülle
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesungsteil II - Atombau und Periodensystem
 Chemie Zusammenfassung Vorlesungsteil II - Atombau und Periodensystem Zwei wichtige Formeln dazu: Coulombkraft: Schrödinger Gleichung: beschreibt die Kraft zwischen zwei kugelsymmetrisch verteilten elektrischen
Chemie Zusammenfassung Vorlesungsteil II - Atombau und Periodensystem Zwei wichtige Formeln dazu: Coulombkraft: Schrödinger Gleichung: beschreibt die Kraft zwischen zwei kugelsymmetrisch verteilten elektrischen
Die Schrödingergleichung II - Das Wasserstoffatom
 Die Schrödingergleichung II - Das Wasserstoffatom Das Wasserstoffatom im Bohr-Sommerfeld-Atommodell Entstehung des Emissionslinienspektrums von Wasserstoff Das Bohr-Sommerfeld sche Atommodell erlaubt für
Die Schrödingergleichung II - Das Wasserstoffatom Das Wasserstoffatom im Bohr-Sommerfeld-Atommodell Entstehung des Emissionslinienspektrums von Wasserstoff Das Bohr-Sommerfeld sche Atommodell erlaubt für
Chemie-Vorkurs für Pharmaziestudenten SoSe Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn
 Chemie-Vorkurs für Pharmaziestudenten SoSe 2018 Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn gbendas@uni-bonn.de Einteilung der Veranstaltungen: die Veranstaltungen
Chemie-Vorkurs für Pharmaziestudenten SoSe 2018 Gerd Bendas Fachbereich Pharmazie Rheinische Friedrich Wilhelms Universität Bonn gbendas@uni-bonn.de Einteilung der Veranstaltungen: die Veranstaltungen
Fachschule für f. r Technik. Dipl.FL. D.Strache FST UH
 . FST UH Ein Atommodell ist eine Vorstellung von den kleinsten Teilen der Stoffe. Lange Zeit gab es keine experimentellen Hinweise für die Existenz kleinster Teilchen, sondern lediglich die intuitive Ablehnung
. FST UH Ein Atommodell ist eine Vorstellung von den kleinsten Teilen der Stoffe. Lange Zeit gab es keine experimentellen Hinweise für die Existenz kleinster Teilchen, sondern lediglich die intuitive Ablehnung
OC I Vorlesung, zweiter Teil
 C I Vorlesung, zweiter Teil (Skriptversion 1.4) Verantwortliche: Prof. Dr. arald Schwalbe, email: schwalbe@nmr.uni-frankfurt.de Institut für rganische Chemie und Chemische Biologie Johann Wolfgang Goethe-Universität
C I Vorlesung, zweiter Teil (Skriptversion 1.4) Verantwortliche: Prof. Dr. arald Schwalbe, email: schwalbe@nmr.uni-frankfurt.de Institut für rganische Chemie und Chemische Biologie Johann Wolfgang Goethe-Universität
Ein Lehrbuch für Studierende der Chemie im 2. Studienabschnitt
 Atom- und Molekülbau Ein Lehrbuch für Studierende der Chemie im 2. Studienabschnitt Von Peter C. Schmidt und Konrad G. Weil 147 Abbildungen, 19 Tabellen Georg Thieme Verlag Stuttgart New York 1982 Vorwort
Atom- und Molekülbau Ein Lehrbuch für Studierende der Chemie im 2. Studienabschnitt Von Peter C. Schmidt und Konrad G. Weil 147 Abbildungen, 19 Tabellen Georg Thieme Verlag Stuttgart New York 1982 Vorwort
Kurze Einführung in die Physikalische Chemie
 Hermann Rau Kurze Einführung in die Physikalische Chemie Mit 97 Abbildungen Vieweg V Einleitung 1 Teill Mikroskopische Systeme Atom- und Molekülbau 1. Entwicklung der Quantentheorie 3 1.1. Die Quantisierung
Hermann Rau Kurze Einführung in die Physikalische Chemie Mit 97 Abbildungen Vieweg V Einleitung 1 Teill Mikroskopische Systeme Atom- und Molekülbau 1. Entwicklung der Quantentheorie 3 1.1. Die Quantisierung
Der nichtrelativistische Hamiltonoperator für ein System aus N k Atomkernen (mit Ladung +Z n ) und N e = N k. n=1 Z n Elektronen lautet: z n z m e 2
 2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
2 Molekülphysik Moleküle sind Systeme aus mehreren Atomen, die durch Coulomb-Wechselwirkungen Elektronen und Atomkerne ( chemische Bindung ) zusammengehalten werden. 2.1 Born-Oppenheimer Näherung Der nichtrelativistische
Das H + 2 -Molekül. Das Wasserstoffmolekülion H + 2 ist das einfachste
 Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
Moleküle Wir haben in den vergangenen Wochen gelernt, wie sich Atome, zusammengesetzt aus elektrisch geladenen Kernen und Elektronen, verhalten. Wie aber verbinden sich elektrisch neutrale Atome zu Molekülen
Ferienkurs Experimentalphysik IV
 Ferienkurs Experimentalphysik IV Michael Mittermair, Daniel Jost 04.09.14 Inhaltsverzeichnis 1 Moleküle 2 1.1 Das H + 2 Molekül-Ion....................... 2 1.2 Näherungen............................ 3
Ferienkurs Experimentalphysik IV Michael Mittermair, Daniel Jost 04.09.14 Inhaltsverzeichnis 1 Moleküle 2 1.1 Das H + 2 Molekül-Ion....................... 2 1.2 Näherungen............................ 3
6. Viel-Elektronen Atome
 6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
6. Viel-Elektronen 6.1 Periodensystem der Elemente 6.2 Schwerere 6.3 L S und j j Kopplung 6.1 6.1 Periodensystem der Elemente 6.2 Auffüllen der Elektronen-Orbitale Pauliprinzip: je 1 Elektron je Zustand
Thema heute: Aufbau der Materie: Das Bohr sche Atommodell
 Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Wiederholung der letzten Vorlesungsstunde: Erste Atommodelle, Dalton Thomson, Rutherford, Atombau, Coulomb-Gesetz, Proton, Elektron, Neutron, weitere Elementarteilchen, atomare Masseneinheit u, 118 bekannte
Vorlesung Allgemeine Chemie (CH01)
 Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Vorlesung Allgemeine Chemie (CH01) Für Studierende im B.Sc.-Studiengang Chemie Prof. Dr. Martin Köckerling Arbeitsgruppe Anorganische Festkörperchemie Mathematisch-Naturwissenschaftliche Fakultät, Institut
Eine Basis dient der Darstellung eines komplizierten Sachverhaltes aufbauend auf einfacheren
 Was ist eine Basis und wozu dient sie? Eine Basis dient der Darstellung eines komplizierten Sachverhaltes aufbauend auf einfacheren Bausteinen. Beispielsweise kann ein Piano-Stück als aus den einzelnen
Was ist eine Basis und wozu dient sie? Eine Basis dient der Darstellung eines komplizierten Sachverhaltes aufbauend auf einfacheren Bausteinen. Beispielsweise kann ein Piano-Stück als aus den einzelnen
Das Periodensystem. 1. Auflage, WS 2015/16
 Das Periodensystem Prof. Dr.-Ing. Jürgen Ulm Fakultät für Technik und Wirtschaft Künzelsau (TW) Studiengang Elektrotechnik Institut für schnelle mechatronische Systeme (ISM) 1. Auflage, WS 2015/16 Vorwort
Das Periodensystem Prof. Dr.-Ing. Jürgen Ulm Fakultät für Technik und Wirtschaft Künzelsau (TW) Studiengang Elektrotechnik Institut für schnelle mechatronische Systeme (ISM) 1. Auflage, WS 2015/16 Vorwort
1 Atome mit mehreren Elektronen
 1 Atome mit mehreren Elektronen 1.1 Zentralfeldnäherungen Wir wollen uns in diesem Abschnitt die Elektronenkonfiguration (besser Zustandskonfiguration) von Atomen mit mehreren Elektronen klarmachen. Die
1 Atome mit mehreren Elektronen 1.1 Zentralfeldnäherungen Wir wollen uns in diesem Abschnitt die Elektronenkonfiguration (besser Zustandskonfiguration) von Atomen mit mehreren Elektronen klarmachen. Die
4.2) Mehrelektronenatome
 4.) Mehrelektronenatome Elektronen besetzen Zustände mit verschiedenen Kombinationen von n,l,m,s Reihenfolge der Füllung bestimmt durch Wechselwirkung zwischen V ( r) und dem Zentrifugalpotential l (l+1)/r
4.) Mehrelektronenatome Elektronen besetzen Zustände mit verschiedenen Kombinationen von n,l,m,s Reihenfolge der Füllung bestimmt durch Wechselwirkung zwischen V ( r) und dem Zentrifugalpotential l (l+1)/r
7. Elektronendynamik
 7. Elektronendynamik Grundproblem: Bewegung der Elektronen in periodischem Potential Grundlegende Fragestellung Unterschiede in der Leitfähigkeit zwischen verschiedenen Materialien Grundprinzipien I Zweiter
7. Elektronendynamik Grundproblem: Bewegung der Elektronen in periodischem Potential Grundlegende Fragestellung Unterschiede in der Leitfähigkeit zwischen verschiedenen Materialien Grundprinzipien I Zweiter
Widerlegung des Modells von Thomson durch Rutherford
 Atomkerne Eine wichtige Frage stellt sich nach dem Aufbau eines Atoms aus diesen subatomaren Bausteinen. Gibt es eine Systematik des Aufbaus der Atome der verschiedenen chemischen Element im Hinblick auf
Atomkerne Eine wichtige Frage stellt sich nach dem Aufbau eines Atoms aus diesen subatomaren Bausteinen. Gibt es eine Systematik des Aufbaus der Atome der verschiedenen chemischen Element im Hinblick auf
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Inhalt der Vorlesung PC 1b/ PC 2
 Inhalt der Vorlesung PC 1b/ PC 2 Nachtrag PC 1b 11. Elektrochemie/Elektrische Leitfähigkeit 11.1 Eigenschaften von Elektrolytlösungen - Einleitung 11.2 Faradaysche Gesetze 11.3 Leitfähigkeit von Elektrolyten
Inhalt der Vorlesung PC 1b/ PC 2 Nachtrag PC 1b 11. Elektrochemie/Elektrische Leitfähigkeit 11.1 Eigenschaften von Elektrolytlösungen - Einleitung 11.2 Faradaysche Gesetze 11.3 Leitfähigkeit von Elektrolyten
4.Teil Kovalente Bindung
 4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
4.Teil Kovalente Bindung Lewis-Konzept, Valenstrichformel, Oktettregel Polare Elektronenpaarbindung und Elektronegativität Gebrochene Bindungsordnung und Mesomerie Valenzschalen-Elektronenpaar-Abstoßungsmodell
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
2. Linear Combination of Atomic Orbitals
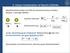 . Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
. Linear Combination of Atomi Orbitals Molekülorbitale werden mit ilfe des Variationsansatzes erhalten. Beispiel: -atomiges Molekül Atom, ϕ Atom, ϕ amilton-operator: Orthonormierung: ˆ ϕ El. Atom ϕ = =
Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet)
 Ph/Ch UE Quantenchemie Datum: Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet) 5 Ziel: Darstellung von MOs aus AOs erklärt Bindungsarten Man kann an den elektrischen Ladungsdichten
Ph/Ch UE Quantenchemie Datum: Arbeitsblatt: Bindungsarten & ihre Beschreibung durch AOs 3 (EVA geeignet) 5 Ziel: Darstellung von MOs aus AOs erklärt Bindungsarten Man kann an den elektrischen Ladungsdichten
Besetzung der Orbitale
 Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
Frage Beim Wiederholen des Stoffes bin ich auf die Rechnung zur Energie gestoßen. Warum und zu welchem Zweck haben wir das gemacht? Was kann man daran jetzt erkennen? Was beschreibt die Formel zu E(n),
Die zu dieser Zeit bekannten 63 Elemente konnten trotzdem nach ihren chemischen Eigenschaften in einem periodischen System angeordnet werden.
 phys4.022 Page 1 12.4 Das Periodensystem der Elemente Dimitri Mendeleev (1869): Ordnet man die chemischen Elemente nach ihrer Ladungszahl Z, so tauchen Elemente mit ähnlichen chemischen und physikalischen
phys4.022 Page 1 12.4 Das Periodensystem der Elemente Dimitri Mendeleev (1869): Ordnet man die chemischen Elemente nach ihrer Ladungszahl Z, so tauchen Elemente mit ähnlichen chemischen und physikalischen
Elektronenstrukturrechungen
 Seminar zur Theorie der Atome, Kerne und kondensierten Materie WS 13/14 Elektronenstrukturrechungen Basissätze und Elektronenkorrelation Bastian Schäfer 9.1.014 Inhaltsverzeichnis 1 Einleitung 1 Lösung
Seminar zur Theorie der Atome, Kerne und kondensierten Materie WS 13/14 Elektronenstrukturrechungen Basissätze und Elektronenkorrelation Bastian Schäfer 9.1.014 Inhaltsverzeichnis 1 Einleitung 1 Lösung

 Erratum: Potentialbarriere E
Erratum: Potentialbarriere E