Wiederholung: Isomerie
|
|
|
- Babette Hoch
- vor 6 Jahren
- Abrufe
Transkript
1 3. Stereochemie 65
2 Wiederholung: Isomerie Definition: Als Isomere bezeichnet man Moleküle mit gleicher Summenformel, die sich jedoch in der Sequenz der Atome (Konstitutionsisomere) oder deren räumlichen Anordnung (Stereoisomere) unterscheiden. Isomere Konstitutionsisomere Stereoisomere Schmelzpunkt Siedepunkt Summenformel Konstitutionsformel Essigsäure Glykolaldehyd (ydroxyacetaldehyd) 17 C 97 C 118 C Zersetzung C C z.b. E/Z-Isomerie Enantiomere (cis-/trans-isomere) - gleiche Summenformel - gleiche Konstitutionsformel - Stereosisomere unterscheiden sich in der räumlichen Anordnung der Atome. eine Carbonsäure Aldehydfunktion Alkoholfunktion - gleiche Summenformel - verschiedene Konstitutionsformel - Konstitutionsisomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften. 66
3 Diastereoisomerie - E/Z-Isomerie Bei höhersubstituierten Doppelbindungen werden Substitutenten nach Cahn-Ingold-Prelog Regeln (CIP-Regeln) nach fallender rdnungszahl geordnet. Cl Cl Br Cl Br Cl Br Br E-Isomer Z-Isomer E-Isomer Z-Isomer C 2 C 3 > C 3 Br > Cl Cl > C 2 C 3 Br > C 3 EINIGE WICTIGE RDNUNGSZALEN: Wasserstoff Z = 1, Kohlenstoff C Z = 6, Brom Br Z = 35, Chlor Cl Z = 17, Fluor F Z = 9, Iod I Z = 53, Sauerstoff Z = 8, Stickstoff N Z = 7 Übungs-Beispiele: Br Br I 3 C N 2 67
4 Chiralität Defintion CIRALITÄT Ist eine Verbindung assymmetrisch aufgebaut und zwar so, dass durch Spiegelung ihrer Struktur an einer Ebene oder einem Inversionszentrum eine Struktur entsteht, die mit der ursprünglichen Struktur durch Verschieben und Drehen im Raum nicht zur Deckung gebracht werden kann, dann ist die Verbindung chiral 1. Spiegelebene Spiegelebene D-Glycerinaldehyd L-Glycerinaldehyd Es gilt: 1Verbindungen mit gleicher Summenformel und gleicher Konstitution aber unterschiedlicher räumlicher Anordnung werden Stereoisomere genannt. 2Verbindungen, die sich wie Bild und Spiegelbild verhalten, werden Enantiomere (optische Antipoden) genannt. 3Verbindungen mit gleicher Summernformel und Konstitution, die sich wie NICT Bild und Spiegelbild verhalten, werden Diastereomere genannt. 4Enantiomere besitzen nahezu gleiche (isotrope) chemische und physikalische Eigenschaften, sie unterscheiden sich in ihren biologischen (pharmakologischen, medizinischen) Eigenschaften und sie weisen entgegengesetzte optische Aktivität auf. 1 griechisch cheir 'and' 68
5 ptische Aktivität Lösungen von optisch aktiven Verbindungen, z.b. D-Glycerinaldehyd, drehen die Schwingungsebene von linear polarisierten Licht (= Lichtstrahlen schwingen in einer Ebene). Beim Durchtritt durch eine Lösung der optisch aktiven Verbindung wird die Schwingungsebene um einen bestimmten Winkel a gedreht. Der Drehsinn wird so definiert, dass eine Drehung der Schwingung im Uhrzeigersinn ein positives Vorzeichen gibt, dagegen ein negatives Vorzeichen. Ein Enantiomerenpaar, also Bild und Spiegelbild, zeigen gleiche Drehung, aber in entgegengesetzte Richtungen. z.b. (+)-Glycerinaldehyd und (-)-Glycerinaldehyd. optisch aktive Lösung = 69
6 Enantiomere und Diastereomere Es gilt: 1. Zwei Stereoisomere können nicht gleichzeitig enantiomer und diastereomer zueinander sein, und 2. von einem bestimmten Molekül existieren immernur zwei Enantiomere, mehrere Diastereomere sind möglich. Diastereomere (z.b. E/Z-Isomerie) unterscheiden sich inchemischen und physikalischen Eigenschaften. Enantiomere (Bild und Spiegelbild) haben die gleichen physikalischen und chemischen Eigenschaften, sie unterscheiden sich durch ihre Wechselwirkung mitlinear polarisierten Licht (optische Aktivität). Racemat: 1/1 Mischung von Bild und Spiegelbild, optisch inaktiv, da linear polarisiertes Licht zu gleichen Teil links und rechts gedreht wird. Racemat 70
7 Stereochemische Schreibweisen und Nomenklatur 1. Keilschreibweise (durchgezogener Keil ragt aus Blattebene hinaus, gestrichelter Keil zeigt hinter Blattebene) * * Identifizieren von asymmetrischen Kohlenstoffzentren = Chiralitätszentren: - C-Atom von vier (konstitutionell) verschiedenen Resten umgeben ist. - dies wird häufig durch einen Stern * hervorgehoben. Weinsäure 2. Fischer-Projektion (v.a. in Zuckerchemie) alle Bindungen werden als normale Linien dargestellt, die nur senkrecht oder waagrecht verlaufen dürfen. Per Definition zeigen alle waagrechten Linien auf den Betrachter zu und alle senkrechten Linien vom Betrachter weg. Cl * * C 3 3 C Cl 3 C Cl Cl C 3 2-Chlorpropanal Weg zur FISCER PRJEKTIN: Weinsäure 180 Rotation (um C-C Bindung) 90 Rotation (gegen UZS) 71
8 Stereochemische Schreibweisen und Nomenklatur 1. Keilschreibweise (durchgezogener Keil ragt aus Blattebene hinaus, gestrichelter Keil zeigt hinter Blattebene) * * Identifizieren von asymmetrischen Kohlenstoffzentren = Chiralitätszentren: - C-Atom von vier (konstitutionell) verschiedenen Resten umgeben ist. - dies wird häufig durch einen Stern * hervorgehoben. 2. Fischer-Projektion (v.a. in Zuckerchemie) alle Bindungen werden als normale Linien dargestellt, die nur senkrecht oder waagrecht verlaufen dürfen. Per Definition zeigen alle waagrechten Linien auf den Betrachter zu und alle senkrechten Linien vom Betrachter weg. Cl * * C 3 3 C Cl 3 C Cl Cl C 3 2-Chlorpropanal Weg zur FISCER PRJEKTIN: 180 Rotation (um C-C Bindung) 90 Rotation (gegen UZS) 72
9 R,S- Nomenklatur der absoluten Konfiguration Zur Bestimmung der absoluten Konfiguration bedient man sich der Regeln von Cahn, Ingold und Prelog (CIP-Regeln). A. Identifizieren von asymmetrisch substituierten C-Atomen (= C-Atome mit 4 unterschiedlichen Substituenten). B. Die direkt an das asymmetrische C-Atom gebundenen Atome werden nach fallender rdnungszahl (Z) angeordnet: (a) Atom mit höhere Z hat die höhere Priorität. (b) Bei gleichwertigen Atomen, wird die Prioritätsreihenfolge ermittelt, indem weiter entfernt stehende Atome betrachtet werden. (c) Mehrfachbindungen zählen als mehrere Einfachbindungen. C. Man betrachtet nun das Molekül in der Weise, dass der Substituent mit der niedrigsten Priorität nach hinten zeigt. Entspricht die Reihenfolge der restlichen drei Substituenten nach fallender Priorität gereiht einer Drehung im Uhrzeigersinn ist das Zentrum R konfiguriert, bei Drehsinn gegen Uhrzeiger S konfiguriert. (b) (b) Asymmetrisches C-Atom (4 unterschiedliche Substituenten) (a) Cl C 3 (c) (d) (d) 3 C (c) Cl (a) Blickrichtung (b) (b) Blickrichtung 1 = erste Substituentensphäre 2 = zweite Substituentensphäre 3 = dritte Substituentensphäre Cl C 3 (a) (c) 3 C (c) Cl (a) IM Uhrzeigersinn: R GEGEN Uhrzeigersinn: S 73
10 Beispiele Cl Cl 3 C C 3 N Adrenalin 74
11 Bestimmung der absoluten Konfiguration mit der Fischer Projektion Wir wissen bereits: Fischer-Projektion alle Bindungen werden als normale Linien dargestellt, die nur senkrecht oder waagrecht verlaufen dürfen. Per Definition zeigen alle waagrechten Linien auf den Betrachter zu und alle senkrechten Linien vom Betrachter weg. (1) (2) Substituent mit Priorität d weist zu Betrachter hin à Regel des doppelten Austausches anwenden (R)-2-ydroxypropansäure (D-Milchsäure) (S)-2-Amino-3-hydroxypropansäure (L-Serin) 75
12 Verbindungen mit mehreren Chiralitätszentren Beispiel: Zucker Erythrose und Threose 2 konstitutionell ungleiche asymmetrische C-Atome 2 2 = 4 Stereoisomere D-Erythrose (1) L-Erythrose (2) D-Threose (3) L-Threose (4) Konfiguration 2R,3R 2S,3S 2S,3R 2R,3S enantiomer diastereomer diastereomer diastereomer enantiomer 76
13 Verbindungen mit mehreren Chiralitätszentren Beispiel: Weinsäure 2 konstitutionell gleiche asymmetrische C-Atome = 3 Stereoisomere Interne Symmetrieebene D-Weinsäure (1) L-Weinsäure (2) DL-Weinsäure (meso-form) (3) = (4) Konfiguration 2S,3S 2R,3R R,S enantiomer diastereomer diastereomer 77
14 N N N N N N N N S N 2 S N 2 N N N N N N J J J J N 2 J J J J 2 N Limonen Barbiturat Thalidomid, Contergan Penicillamin Ethambutol Propanolol Thyroxin Zitronengeruch rangengeruch krampfauslösend narkotisch extrem teratogen antiarthritisch extrem toxisch tuberculostatisch Erblindung ß-Blocker Contraceptivum Schilddrüsenhormon Antihypocholestericum Schlafmittel 78
15 4.1. GESÄTTIGTE KLENWASSERSTFFE - ALKANE 79
16 ffenkettige Alkane C 3 C C 3 3 C C 3 3 C C 3 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 4 10 à für n C-Atome ergibt sich: C n 2n+2 Summen-formel Formel Name Schmelzpunkt / C Siedepunkt / C als Rest C 4 C 2 6 C 3 8 C 4 10 C 5 12 C 6 14 C 7 16 C 8 18 C 9 20 C C C C 4 C 3 -C 3 C 3 -C 2 -C 3 C 3 -(C 2 ) 2 -C 3 C 3 -(C 2 ) 3 -C 3 C 3 -(C 2 ) 4 -C 3 C 3 -(C 2 ) 5 -C 3 C 3 -(C 2 ) 6 -C 3 C 3 -(C 2 ) 7 -C 3 C 3 -(C 2 ) 8 -C 3.. C 3 -(C 2 ) 15 -C 3 C 3 -(C 2 ) 18 -C 3 Methan Ethan Propan Butan Pentan exan eptan ctan Nonan Decan.. eptadecan Eicosan Methyl- Ethyl- Propyl- Butyl- Pentyl- exyl- eptyl- ctyl- Nonyl- Decyl-.. eptadecyl- Eicosyl- 80
17 Alkane Nomenklatur und Struktur à bisher: unverzweigte Alkane, daneben gibtes verzweigte Alkane. Beispiel: C 5 12 n-pentan C Methylbutan C ,2-Dimethylpropan C 5 12 Siedepunkt 36 C 27.9 C 9.5 C Schmelzpunkt C C - 20 C Nomenklatur: Eine organische Verbindung wird nach dem längsten geradkettigen Abschnitt im Molekül benannt (= Prinzip der längsten Kette). Substituenten werden unter Angabe der Position als yl-rest angegeben. Kommt ein Substituent öfter vor, wird die Anzahl der Reste durch Vorsilben wie di-, tri-, tetra-, usw. ausgedrückt. Konstitutions-/Strukturisomere: = Moleküle mit gleicher Summenformel, aber unterschiedlicher Strukturformel, weisen unterschiedliche physikalische Eigenschaften auf. 81
18 Alkane Bau der Moleküle, Konformationsanalyse àin gesättigten Kohlenwasserstoffen findet man NUR s-bindungen, d.h. Bindungsrotationen sind erlaubt, daraus ergeben sichunterschiedliche räumliche Anordnungen, die mankonformere nennt. Beispiel: Ethan C 3 -C 3 1. Sägebock-Projektion C C gestaffelt (staggered) C C ekliptisch, auf Deckung (eclipsed) 2. Stereo-Projektion (Keilstrichformel) C C gestaffelt (staggered) C C ekliptisch, auf Deckung (eclipsed) 3. Newman-Projektion Blickrichtung C C 60 C gestaffelt (staggered) C ekliptisch, auf Deckung (eclipsed)
19 Konformationsanalyse - Butan Blickrichtung 3 C C C C 3 C 3 C C 3 ENERGETISC GÜNSTIG staggered C C 3 3 C ENERGETISC UNGÜNSTIG ekliptisch, auf Deckung (eclipsed) synplanar anticlinal anticlinal synplanar relativ kleine Aktivierungsenergie: Bei Raumtemperatur (RT) stehen die drei Konformere in einem schnellen Gleichgewicht: 15% M-synclinal 15% P-synclinal 70% antiperiplanar M-synclinal (gauche WW) antiperiplanar P-synclinal (gauche WW) 83
20 Allgemeines zu Alkanen Vorkommen, Gewinnung à aus Erdöl bzw. Erdgas Eigenschaften - Reaktionsträge daher der Name Paraffin (lat.: parum affinis = wenig geneigt) - Erhöhung der Schmelz- und Siedepunkte durch Van der Waals Wechselwirkungen - unpolar, lösen sich gut in apolaren Lösungsmittel und z. B. nicht in Wasser à hydrophob (wasserabweisend) bzw. lipophil (fettfreundlich) Verwendung v.a. in chemischer Industrie als Ausgangsstoff für Kunststoffe, aber auch als Brennstoff (Erdgas auptbestandteile Methan und Ethan). Feste Alkane à Kerzen aus Paraffinwachs Alkane in Natur - Methan-produzierende Bakterien - Pheromone: chemische Botenstoffe v.a. für Kommunikation zwischen Insekten à Sexuallockstoff. 84
21 Cyclische Alkane Cycloalkane sind gesättigte Kohlenwasserstoffe mit ringförmig geschlossenem Kohlenstoffgerüst (durch Ringschluss ändert sich Summenformel im Vergleich zu offenkettigen Alkanen à C n 2n ). Cyclopropan Cyclobutan Cyclopentan Cyclohexan Ringspannung (Bayer-Spannung) (durch Abweichung vom Tetraederwinkel 90 nicht 109 ) Torsionsspannung (alle s fast ekliptisch) Ringspannung (Bayer-Spannung) (leichte Abweichung vom Tetraederwinkel) Torsionsspannung (s zum Teil ekliptisch) kaum Ringspannung (Bayer-Spannung) keine Torsionsspannung (alle s gestaffelt) 85
22 Konformationsanalyse - Cyclohexan Relevanz: Zucker können in der sogennanten Pyranoseform vorliegen à Cyclisches System mit 6 Atomen. C 3 C 1 äquatorial axial äq C 3 ax C 1 axial äquatorial Sessel 1 Blickrichtung via Übergangszustand: Wanne (energetisch ungünstig) Wanne C 3 axial C 1 Blickrichtung äquatorial äq ax C 3 axial C 1 äquatorial Sessel 2 86
23 Konformationsanalyse von höhersubstituierten Cyclohexan Methylcyclohexan C 3 C 3 äquatoriale Methylgruppe 7.5 kj/mol stabiler axiale Methylgruppe sterische Wechselwirkung mit Protonen in 1,3-Position (1,3-diaxiale WW) à sterisch anspruchsvolle Substitutenten möglichst in äquatorialer Position! 87
24 Kondensierte Ringsysteme à Bei 2 cyclische Verbindungen, die über eine gemeinsame C-C Bindung verknüpft sind, spricht man von einem kondensierten System. Beispiel 1: Decalin trans-decalin cis-decalin Beispiel 2: Steran (Gonan)-Grundgerüst à Steroide leitensichdavon ab. C D C D A B A B 5a-Steran 5b-Steran = Cholesterin 88
25 4.2. UNGESÄTTIGTE KLENWASSERSTFFE - ALKENE, ALKINE 89
26 Alkene à Alkene (früher:lefine) sind organische Verbindungen mit einer oder mehreren C=C Doppelbindungen. Diese Doppelbindung(en) werden durch die Endung en in der Nomenklatur berücksichtigt. Analog zu den Alkanen gibt es unverzweigte, verzweigte und cyclische Alkene. à Allgemeine Summenformmel: C n 2n à Diastereoisomerie: durch gehinderte Rotation aufgrund von p-bindung: E-Z-Isomerie C C C 3 C C 2 C C C C 3 C 3 C C C 3 Ethen Propen 1-Buten 2-Methylpropen (Isobuten) Unverzweigte Alkene, homologe Reihe (jeweils ein C mehr) Verzweigtes Alken, Konstitutionsisomer zu 1-Buten 3 C C 3 C 3 C 3 Cyclohexen E-2-Buten Z-2-Buten Cyclisches Alken E-Z-Isomerie 90
27 Alkine à Treten C-C DREIFAC-Bindungen in einer organischen Verbindung auf spricht man von Alkinen. Die Verbindungsklasse wird durch die Endung in benannt. à Wiederholung: sp-ybridisierung: 2 Bindungspartner mit 180 zwischen den Bindungen = lineare Anordnung. C C Ethin (Acetylen) Schweißgas 3 C N C 3 Neocarzinostatin Krebsmedikament à Bildung von Radikalspezies à greift Krebzellen an 91
28 Biologisch interessante Alkene und Alkine Ethen Funktion als Phytohormon und dient zur Regulation des Pflanzenwachstums und Fruchtreifung. Tomaten prodzuieren Ethen aus der Aminosäure Methionin, das Ethen bewirkt den Reifungsprozeß der Tomate. In genmanipulierte Tomaten ist das Gen zur Ethenproduktion ausgeschalten. Diese Tomaten können durch externe Begasung mit Ethen auf Wunsch gereift werden. Geschlechts- und Alarmpheromone C 3 Sexuallockstoff der Fruchtmotte Retinal Bestandteil von Rhodopsin (Sehfarbstoff) Licht Energie E Z b-carotin Farbstoff der Karotte Lycopin Farbstoff der Paprika und Tomate 92
29 Biologisch interessante Alkene und Alkine - Polyenantibiotika C 3 Fumagilin ein Antibiotikum 3 C 3 C C 3 N 2 C 3 Amphotericin B ein Antibiotikum 93
30 Reaktionen von Alkenen und Alkine ELEKTRPILE ADDITINSREAKTINEN E E + + C C C C + + Nu - E Nu C C E E + + C C C + E Nu + Nu - C C Zweistufiger Mechanismus 1. Elektrophil wird nucleophil von Mehrfachbindung angegriffen: Ausbildung einer s-bindung zwischen C-Atom und Elektrophil, Bildung eines Carbokations (sp 2 hybridisiert bei Alkenen, sp hybridisiert bei Alkinen). 2. Angriff eines Nucleophils auf Carbokation unter Ausbildung einer weiteren s-bindung. Addition von alogenwasserstoffen (z.b. Bromwasserstoff Br) Br + + Br - + C C C C + Br - Br C C 94
31 Addition von alogenwasserstoffen an Alkene Regel von Markownikow Stabilitätsfolge von Carbokationen R 2 R C + 1 R 3 R 1 =R 2 =R 3 =C 3 à tertiäres Carbokation stabiler als R 1 =, R 2 =R 3 =C 3 à sekundäres Carbokation stabiler als R 1 =R 2 =, R 3 =C 3 à primäres Carbokation stabiler als R 1 =R 2 =R 3 = à Methyl-Carbokation à ergibt sich aus +I-Effekt der Alkyl-Gruppe!! C 3 C 3 Br C + C 3 C 3 BEVRZUGTES ZWISCENPRDUKT à tertiäres Carbokation stabiler! C 3 C 3 Br C + C 3 C 3 WIRD NICT BEBACTET à primäres Carbokation weniger stabil! Nach der Regel von Markownikow wird folgende Reaktion beobachtet: C 3 C 3 + C + Br - C 3 C 3 C 3 C Br C 3 95
32 Addition von Wasser an Alkene (ydratisierung) starke Säure z.b. 2 S 4 3 C Alken + 3 C C C C Alkohol Epoxidierung von Alkenen R R + R' R R + R' Alken eine Percarbonsäure ein Epoxid eine Carbonsäure 96
33 Eine biologisch-wichtige Alken-Reaktion Reaktion von Squalen (ein Polyalken) zum Steroid-Grundgerüst 2 Enzym + C + Squalen Squalenoxid C + Dominoreaktion - + Lanosterin 97
34 4.3. Aromatische Kohlenwasserstoffe 98
35 Chemische Bindung in Aromaten - Aromatizität Bisher: Lokalisierte Doppelbindung, aber auch konjugierte Doppelbindungen mit Elektronendelokalisation bei 2 Doppelbindungen in1,3-abstand. Jetzt: sp 2 -hybridisierte C-Atome in cyclischer Anordnung mit 4n+2 p-elektronen à vollständige Delokalisation der p-elektronen ober- und unterhalb der Ringebene. Alle C-C Bindungen gleich lang mit 120 Winkel zwischen C-C-Bindungen. Es lassen sich IDENTISCE Mesomeriestrukturen formulieren: Benzol ÜCKEL-Regel cyclische Anordnung, sp 2 -hybridisierte C-Atome mit 4n+2 p-elektronen à ARMATEN: weisen MESMERIESTABILISERUNG auf! C 3 C 3 1 C C 3 3 C C 3 C 3 Benzol Toluol 1,2-Xylol ortho-xylol 1,3-Xylol meta-xylol 1,4-Xylol para-xylol Naphthalin Anthracen 99
36 Eigenschaften von aromatischen Kohlenwasserstoffen ALLGEMEIN: Aromatische Verbindungen sind gesundheitsschädlich und können zur Bildung von Krebs führen! Benzol Früher als Lösungsmittel verwendet à mittlerweile ersetzt durch weniger gfitige Verbindungen (z.b. Toluol). Chronische Benzol-Vergiftungen führen zu einer Schädigung der Leber und Niere und auch ders Knochenmarks (à Zahl der roten Blutlörper geht zurück). Kondensierte Aromaten (z.b. Pyren, Benzopyren) Stark toxisch und krebserregend (kanzerogen), v.a. bei Rauchern, da die kondensierten Aromaten im Rauch enthalten sind à Lungenkrebsrisiko steigt! z.b. Benzopyren: Schädigung der DNA (=Desoxyribonukleinsäure, Erbgut) à Bildung von Krebs 2 Enzym 2 2 Enzym DNA-N 2 N DNA 100
37 Reaktionen aromatischer Verbindungen Allgemein: Aromatische Verbindungen sind aufgrund ihrer Resonanzstabilisierung relativ reaktionsträge. Katalytische ydrierung 2 / Ni 200 C xidation C 3 C KMn 4 Toluol Benzoesäure Elektrophilearomatische Substitution C + + E + E - + E - -Atom wird durch Elektrophil (E + ) ersetzt (substituiert). - Treibende Kraft der + -Abspaltung ist die Wiederausbildung des aromatischen Charakters. 101
38 Elektrophile aromatische Substitution Nitrierung C + N + + N N + - Sulfonierung C + + S - S - + S S eine Sulfonsäure Aromatische Substitutionen in biologischen Systemen Phenylalanin- ydroxylase 2 N 2 N Gefährliche Erbkrankheit Phenylketonurie à Mangel an Phenylalanin-ydroxylase, Phenylalalnin wird nicht abgebaut à geistige Schäden! Phenylalanin Thyrosin 102
39 4.4. alogenkohlenwasserstoffe 103
40 Chemische Eigenschaften von alogenkohlenwasserstoffen Der Ersatz von -Atomen durch alogenatome (X) führt zu veränderten elektronischen Verhältnissen aufgrund des -I Effektes. Die C-X ist aufgrund der Elektronegativitätsunterschiede polarisiert. δ+ δ- C X δ+ δ- C X X δ- δ- X δ+ δ- C X X δ- δ- X δ+ δ- < < < X C X F > Cl > Br > I δ- X δ- Polarisierung nimmt mit Anzahl der alogensubstituten zu! Polarisierung nimmt innerhalb der Gruppe von oben nach unten ab Die wichtigsten Reaktionen von alogenkohlenwasserstoffen: 1. Nucleophile Substitution am C-Atom C X Nu - + C Nu + X - 1. Eliminierungsreaktion C C X + Base C C + X - 104
41 Verwendung von alogenkohlenwasserstoffen Iod- und Bromkohlenwasserstoffe sind relativ leicht herstellbar und gute Ausgangssubstanzen für Synthesen. Chlorierte Verbindungen sind recht inert und finden Verwendung als Lösungsmittel (Chloroform à früher als Narkotikum, Methylenchlorid) Polymere Fluorkohlenwasserstoffe sind sehr hitzebständig und dienen z.b. zum Beschichten von Pfannen (Teflon ). Früher wurde kurzkettige Fluorverbindungen als Kühlmittel in Kühlschränken verwendet (Freon, Frigen) à heute verboten wegen Schädigung der zonschicht. Name Formel Schmp. / C Sdp. / C Verwendung Dichlormethan Chloroform (Trichlormethan) Tetrachlorkohlenstoff Dichlordifluormethan Tetrafluorethen Vinylchlorid C 2 Cl 2 CCl 3 CCl 4 CCl 2 F 2 CF 2 =CF 2 C 2 =C-Cl Lösungsmittel Lösungsmittel (früher: Narkotikum) Fettlösemittel Treibmittel, Kältemittel (FCKW) Polymer: TEFLN Polymer: PVC Kunststoff 105
42 Biologisch relevante alogenkohlenwasserstoffen N Cl Cl N Br 2 N Br N Chloramphenicol (Antibiotikum in Molekularbiologie) 6,6 -Dibromindigo (Antiker Purpur, aus Pupurschnecke) I I N 2 Cl Cl I I CCl 3 L-Thyroxin (ormon der Schilddrüse) DDT (früher als Insektizid, heute verboten) 106
43 Eliminierungsreaktionen in biologischen Systemen Fettsäuresynthese - 2 R SCoA Enzym ydratase R SCoA N N - S - P P N N N 2 N N Coenzym A (CoA) P - Ungesättigte Fettsäurensynthese - 2 R SCoA Enzym Desaturase R SCoA 107
44 4.5. Alkohole 108
45 Beispiele, Namensgebung und Eigenschaften von Alkoholen Funktionelle Gruppe: - je nach Substitutionsgrad unterscheidet man primäre, sekundäre und tertiäre Alkohole Nomenklatur: Endung ol wird angehängt. Primäre Alkohole 3 C 3 C C 2 3 C C 2 C 2 3 C C 2 C 2 C 2 Methanol Ethanol 1-Propanol 1-Butanol Sekundäre Alkohole Tertiäre Alkohole Zweiwertige Alkohole Dreiwertige Alkohole 3 C 3 C C 2-Propanol C 3 3 C C C 3 2-Methyl-2-propanol 2 C C 2 1,2-Ethandiol Glykol 2 C C C 2 1,2,3-Propantriol Gycerin In Lösungen bilden Alkohole Wasserstoffbrücken aus à Erhöhung des Siede- und Schmelzpunktes. die Gruppe erhöht die Löslichkeit in Wasser, d.h. Alkohole sind polarer (hydrophiler) als Alkane. R R R R R Assoziation via -Brücken 109
46 Reaktivität der Alkohole Basizität und Acidität von Alkoholen à Alkohole sind AMPLYTE (vgl. Wasser). starke Base starke Säure - C 3 C C 3 pk a von Methanol: pk a (C 3 ) = 15.2 à Methoxid (C 3 - ) ist eine STARKE Base: pk b (C 3 - ) = 14 - pk a (C 3 ) = -1.2 Aciditätnimmt in der Reihenfolge primär > sekundär > tertiär ab (+I-Effekt). Säurekatalysierte Eliminierung 3 C C 3 C C C 3 C C C + C 3 3 C C C 2 3 C xidationsreaktionen primärer Alkohol xidation Aldehyd xidation Carbonsäure sekundärer Alkohol xidation Keton 110
47 4.6. Phenole 111
48 Phenole - Beispiele und Nomenklatur Phenole sind aromatische Systeme an denen direkt eine -Gruppe gebunden ist. Manunterscheidet ein- und mehrwertige Phenole: Einwertige Phenole C 3 C 3 C 3 Phenol ortho-kresol meta-kresol para-kresol a-naphtol b-naphtol Zweiwertige Phenole Brenzcatechin Resorcin ydrochinon Phloroglucin 112
49 Säureeigenschaften von Phenolen Aciditätvon Phenolen ist im Vergleich zu Alkoholenerheblich größerà Mesomeriestabilisierungdes Phenolat-Anions C - C - pk a = 9 C - 2 N N 2 à Zusätzliche Stabilisierung der negativen Ladung durch -M-Effekt der Nitrogruppen! N 2 Pikrinsäure pk a =
50 Biologisch interessante Phenolen C 3 C Eugenol (Gewürznelke) Thymol (Thymianöl) Gallussäure Pyrogallol Phenole im Wein Thyrosin Quercetin Catechin Reservatrol 2 N Thyrosin C N R R = Noradrenalin R = C 3 Adrenalin à French-Paradox: erzinfarkte in Süd- und Südwestfrankreich seltener, obwohl fettreiche und üppige Nahrung. à mögliche Erklärung: das Glas Rotwein dazu! 114
51 Schwefelverbindungen à Thiole: S-Analog zu Alkohol à Sulfide: S-Analog zu Ether à Disulfide: durch xidationvon Thiolen (à Strutkurelement in Proteinen) à Sulfoxide: xidation von Sulfiden à Sulfonsäure C 3 S C 3 S C 3 C 3 S S C 3 3 C S C 3 S Methanthiol Dimethylthioether Dimethyldisulfid Dimethylsulfoxid (DMS) Benzolsulfonsäure Biologisch interessante Schwefelverbindungen 2 N 2 C 2 C SC 3 C 2 N 2 C S C X 2 N 2 C S S 2 N C C 2 C Methionin Cystein Cystin 115
52 Biologisch interessante Schwefelverbindungen à SAM: eine biologischer Methylgruppen-Donor N 3 + C 3 - C S + N Nu - N 2 N N C Nu - C S N N 2 N N N N N S-Adenosylmethion (AdoMet, SAM) S-Adenosylhomocystein à Biotin: Vitamin B 7 bzw. Vitamin ist oft Teil (prosthetische Gruppe) von Enzymen, z.b. Carboxylasen (übertragen Carbonsäure- Funktion). N N S C à Knoblauch-Wirkstoffe N 2 S C S S à Süßstoff - Saccharin N S Alliin Allicin 116
53 4.7. Amine 117
54 Nomenklatur und Beispiele primäre, sekundäre und tertiäre Amine (bezieht sich auf Substitutionsgrad des Stickstoffes) C 3 3 C N 2 3 C N C 3 3 C N C 3 Methylamin (primäres Amin) Dimethylamin (sekundäres Amin) Trimethylamin (tertiäres Amin) Di- und Triamine Aromatische Amine 2 N N 2 N 2 2 N C 2 C 2 N 2 Ethylendiamin N 2 2,4,6-Triaminobenzoesäure Anilin Cyclische Amine N Piperidin N Pyrrolidin 118
55 erstellung von Aminen Ammoniak-Stickstoff ist Nucleophil, Umsatz mit Aklylhalogen à Amin 3 C I + N 3 3 C N 2 + I 3 C I + 3 N C 3 3 C N + I C 3 C 3 3 C I + N C 3 3 C N + I C 3 C 3 PRBLEM: Zunahme der Nucleophilie durch +I-Effekt der Alkylgruppen à FLGE: höhersubstituierte Amine begünstigt! à S N -Reaktion: nucleophile Substitutionsreaktion 119
56 Eigenschaften von Aminen In Lösungen bilden Amine Wasserstoffbrücken aus. freies Elektronenpaar am Stickstoff verleiht Aminen basische und nucleophile Eigenschaften. Zur Basizität von Aminen: +I - Effekt + N 3 N Ammoniak ist eine Base: pk B = N 2 N Methylamin ist die stärkere Base als Ammoniak: pk B = 3.36 C 3 C 3 Basizität nimmt zu C 3 C 3 + N N Dimethylamin ist die stärkere Base als Methylamin: pk B = 3.29 C 3 C 3 Name pk B Formel Anilin Ammoniak Methylamin Dimethylamin C 6 5 N 2 N 3 C 3 N 2 (C 3 ) 2 N Steigende Basizität 120
57 Aromatische Amine schwächere Basen, da freies Elektronenpaar von Stickstoff mit p-system des Aromaten wechselwirken kann (+M- Effekt). + N 2 N 2 + N 2 + N 2 C - C - C - à Protonierung hebt Mesomerie zum Teil auf: N + N + à Geringere Basizität aromatischer Amine ist Folge der größeren Resonanzstabilisierung des Amins im Vergleich zum Ammoniumsalz. 121
58 Biochemisch wichtige Amine N 2 N 2 C 3 N Dopamin (bei Mangel Parkinsonsche Krankheit) Noradrenalin (Vorläufer von Adrenalin) Adrenalin (blutdrucksteigernd, Stresshormon) 3 C C 3 C 3 N 2 N C 3 C 3 C 3 - N + C 3 C 3 Cholin (gefäßerweiternd, blutdrucksenkend, regelt Darmbewegung) Mescalin (kommt in Peyotl-Kaktus vor à älteste-bekannte alluzinogen) Ephedrin Blutdrucksteigernd, anregend für Nervensystem à Aufputschmittel, zb Amphetamine) C 3 - N + C 3 C 3 Acteylcholin (Neurotransmitter, blutdrucksenkend, stark muskelkontrahierend) 122
Stereoisomerie. C 2 H 4 O 2 Schmelzpunkt 17 Grad Celcius
 3. Stereochemie Stereoisomerie Definition Isomerie: Als Isomere bezeichnet man Moleküle mit gleicher Summenformel, die sich jedoch in der Sequenz der Atome (Konstitutionsisomere) oder deren räumlichen
3. Stereochemie Stereoisomerie Definition Isomerie: Als Isomere bezeichnet man Moleküle mit gleicher Summenformel, die sich jedoch in der Sequenz der Atome (Konstitutionsisomere) oder deren räumlichen
4.1. Gesättigte Kohlenwasserstoffe (Alkane)
 4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
4. Stoffgruppen 4.1. Gesättigte Kohlenwasserstoffe (Alkane) ffenkettige Alkane à für n C-Atome ergibt sich: C n 2n+2 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 3 C C 3 3 C C 3 C 4 10 3 C C 3 à Es gibt
4.1. GESÄTTIGTE KOHLENWASSERSTOFFE - ALKANE
 4.1. GESÄTTIGTE KLENWASSERSTFFE - ALKANE 79 ffenkettige Alkane C 3 C C 3 3 C C 3 3 C C 3 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 4 10 à für n C-Atome ergibt sich: C n 2n+2 Summen-formel Formel Name
4.1. GESÄTTIGTE KLENWASSERSTFFE - ALKANE 79 ffenkettige Alkane C 3 C C 3 3 C C 3 3 C C 3 Methan Ethan Propan Butan C 4 C 2 6 C 3 8 C 4 10 à für n C-Atome ergibt sich: C n 2n+2 Summen-formel Formel Name
4. Stereochemie. Das wichtigste Kriterium für Chiralität ist, dass sich Objekt und Spiegelbild nicht zur Deckung bringen lassen.
 4. Stereochemie Auch die cis-trans-isomerie zählt zur Stereoisomerie: 4.1 Chirale Moleküle Chirale Moleküle besitzen ein asymmetrisches C- Atom = Chiralitätszentrum. Das wichtigste Kriterium für Chiralität
4. Stereochemie Auch die cis-trans-isomerie zählt zur Stereoisomerie: 4.1 Chirale Moleküle Chirale Moleküle besitzen ein asymmetrisches C- Atom = Chiralitätszentrum. Das wichtigste Kriterium für Chiralität
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
Konfigurationsisomerie
 Konfigurationsisomerie Enatiomerie, Diastereomerie (σ undπ). Prof.Dr. Ivo C. Ivanov 1 Optische Aktivität Zur Bestimmung des Drehwertes bedient man sich eines Polarimeters, dessen Aufbau nachfolgend schematisch
Konfigurationsisomerie Enatiomerie, Diastereomerie (σ undπ). Prof.Dr. Ivo C. Ivanov 1 Optische Aktivität Zur Bestimmung des Drehwertes bedient man sich eines Polarimeters, dessen Aufbau nachfolgend schematisch
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
c) Gleichzeitiger Bruch der C-X-Bindung und der C-H-Bindung
 Eliminierungen Das Nucleophil mit seinem freien Elektronenpaar muß nicht am Kohlenstoffatom der C-- Bindung angreifen, es kann auch am nächsten Kohlenstoffatom ein Proton abstrahieren und somit als Base
Eliminierungen Das Nucleophil mit seinem freien Elektronenpaar muß nicht am Kohlenstoffatom der C-- Bindung angreifen, es kann auch am nächsten Kohlenstoffatom ein Proton abstrahieren und somit als Base
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Chemie für Biologen, 2017 Übung 10 Stereochemie (Thema 11.1 11.4) Aufgabe 1: a) Zeichnen Sie den Isomeren-Stammbaum auf. b) Erklären Sie folgende Isomerie-Arten: i) Konstitutionsisomere Konstitutionsisomere
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Einführung in die Nomenklatur der organischen Chemie. Einteilung der Kohlenwasserstoffe
 organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
organischen hemie Klasse 8 Einteilung der Kohlenwasserstoffe Alkane Alkene Alkine Kettenverbindungen Organische hemie socyclen ycloalkane ycloalkene ycloalkine Aromate Ringverbindungen eterocyclen Fünfringe
Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Cycloalkane
 3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
Kohlenwasserstoffe. sp 3 -Orbitale. Alkane. Alkene. sp 2 - Orbitale p z - Orbital. sp -Orbitale p y, p z - Orbitale. Alkine
 Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Kohlenwasserstoffe sp 3 -Orbitale Alkane sp 2 - Orbitale p z - Orbital Alkene sp -Orbitale p y, p z - Orbitale Alkine Offenkettige Alkane 4 4 than "Erdgas" 2 6 3 3 Ethan 3 8 3 2 3 Propan Bei Raumtemperatur
Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Cycloalkane
 3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
3. Cycloalkane Cycloalkane enthalten eine oder mehrere gesättigte, ringförmige Kohlenstoffketten. Einteilung: Cycloalkane Cycloaliphaten (Alicyclen, Carbocyclen) Polycyclen Cycloaliphaten (Alicyclen, Carbocyclen):
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Übung 9: Aufbau und Struktur organischer Verbindungen Übung für Medizinische Biologen - Jun.-Prof. Dr. Michael Giese.
 Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
Zusammenfassung Aufbau und Struktur organischer Verbindungen Kohlenstoff besitzt eine Sonderstellung unter den Elementen ybridisierungsmodell beschreibt die Bindungsverhältnisse in Kohlenstoffverbindungen
4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind!
 4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism ball de.svg OC I Lehramt F. H. Schacher 1 Stereoisomerie andere
4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism ball de.svg OC I Lehramt F. H. Schacher 1 Stereoisomerie andere
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
2. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
 2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
2. AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybridisierungskonzepts verstehen und anschaulich darstellen (siehe
4. Stereoisomerie. ! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! Organische Chemie I LA / J. C.
 4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism-ball-de.svg Organische Chemie I LA / J. C. Brendel 1 Stereoisomerie
4. Stereoisomerie! Diastereomer hier: allg. alle Stereosiomere, die keine Enantiomere sind! http://de.wikipedia.org/wiki/datei:isomerism-ball-de.svg Organische Chemie I LA / J. C. Brendel 1 Stereoisomerie
Alkane. Name: Summenformel: vereinfachte Formel: Zustand: Methan CH 4 CH 4 g (gaseous) Ethan C 2 H 6 CH 3 CH 3 g. Propan C 3 H 8 CH 3 CH 2 CH 3 g
 Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Alkane Name: Summenformel: vereinfachte Formel: Zustand: Methan C 4 C 4 g (gaseous) Ethan C 2 6 C 3 C 3 g Propan C 3 8 C 3 C 2 C 3 g Butan C 4 10 C 3 C 2 C 2 C 3 g Pentan C 5 12 C 3 C 2 C 2 C 2 C 3 l (liquid)
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Weiterführende Fragen und Knobeleien zur Vorlesung Organische Chemie für chemieinteressierte Studierende mit Chemie als Nebenfach.
 Weiterführende Fragen und Knobeleien zur Vorlesung rganische Chemie für chemieinteressierte Studierende mit Chemie als Nebenfach Teil II Mit diesem Blatt will ich Sie anregen, weiter über das Thema Chiralität
Weiterführende Fragen und Knobeleien zur Vorlesung rganische Chemie für chemieinteressierte Studierende mit Chemie als Nebenfach Teil II Mit diesem Blatt will ich Sie anregen, weiter über das Thema Chiralität
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Decan Homologe Reihe der Alkane, unterschiedlich lange C-Ketten mit C- C (sp 3 /sp 3 ) und C-H (sp 3 /s)-bindungen (σ-bindungen) Beispiele: Butan
 1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
1 30.09.005 0.1 Alkane Eine einfache Stoffgruppe der organischen Chemie sind die Alkane. Dabei handelt es sich um eine spezielle Gruppe der Kohlenwasserstoffe (KW). Alle Alkane gehorchen folgendem Prinzip:
EINFÜHRUNG IN DIE ORGANISCHE CHEMIE
 rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
rganische Chemie Lehrgang CEMIE FÜR BILGIELERKRÄFTE EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
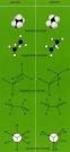 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Verzeichnis der Wortabkürzungen... Verzeichnis der Zeichen und Symbole...XVII
 VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
VII Verzeichnis der Wortabkürzungen... XIII Verzeichnis der Zeichen und Symbole...XVII Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung... 3 3.1.2 Einfachbindungen...
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Inhaltsverzeichnis. 3 Organische Chemie. Vorwort Chemische Bindung Chemische Reaktionstypen Bindungen...
 VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
VII Inhaltsverzeichnis Vorwort... V 3 Organische Chemie 3.1 Chemische Bindung... 3 3.1.1 Orbitale, deren Hybridisierung und Überlappung....................... 3 3.1.2 Einfachbindungen... 12 3.1.3 Doppelbindungen...
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Inhaltsverzeichnis VII. Vorwort... V
 VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Organische Chemie. 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8. Lehrstuhl für Organische Chemie
 Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Organische Chemie 3. Semester, SWS: V-3, Ü-1, P-3; insgesamt: V-45, Ü-15, P-45; ECTS 8 Lehrstuhl für Organische Chemie (ivanov43@gmail.com) Prof. Dr. Ivo C. Ivanov 1 1. Gegenstand der Organischen Chemie,
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Organische Chemie im Überblick
 Evelyne Chelain Nadeqe Lubin-Germain Jacques Uziel Organische Chemie im Überblick Grundwissen in Lerneinheiten Aus dem Französischen übersetzt von Karin Beifuss ~ Springer Spektrum Inhaltsverzeichnis 1
Evelyne Chelain Nadeqe Lubin-Germain Jacques Uziel Organische Chemie im Überblick Grundwissen in Lerneinheiten Aus dem Französischen übersetzt von Karin Beifuss ~ Springer Spektrum Inhaltsverzeichnis 1
Organische Chemie I/II. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Organische Chemie I/II Name: Fachprüfung Vorname: 5. Februar 2003, 15 30-18 30 h Matr.-Nr.: Raum 250 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10
Grundlagen zum Verständnis chemischer Reaktionen = Handwerkszeug
 Grundlagen zum Verständnis chemischer Reaktionen = andwerkszeug chemische Bindung: ionische, kovalente, Dipolmomente, Bindungsstärke, Atom- und Molekülorbitale, ybridisierung Substanzklassen, funktionelle
Grundlagen zum Verständnis chemischer Reaktionen = andwerkszeug chemische Bindung: ionische, kovalente, Dipolmomente, Bindungsstärke, Atom- und Molekülorbitale, ybridisierung Substanzklassen, funktionelle
Übungen zur VL Chemie für Biologen und Humanbiologen Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur:
 Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Übungen zur VL Chemie für Biologen und Humanbiologen 21.01.2011 1. Benennen Sie die folgenden Verbindungen nach IUPAC-Nomenklatur: a) 3-Methyl-4-propylhexan Erklärung: Es liegt keine funktionelle Gruppe
Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )
![Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 ) Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )](/thumbs/74/69784240.jpg) 1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
2. Grundbegriffe organisch-chemischer Reaktionen
 2. Grundbegriffe organisch-chemischer Reaktionen 44 Reaktionen mit Substanzen mit kovalenten Bindungen Ein wichtiger Schritt bei Reaktionen ist die Bildung und Auflösung von kovalenten Bindungen. omolytische
2. Grundbegriffe organisch-chemischer Reaktionen 44 Reaktionen mit Substanzen mit kovalenten Bindungen Ein wichtiger Schritt bei Reaktionen ist die Bildung und Auflösung von kovalenten Bindungen. omolytische
Grundwissen Chemie 10. Klasse NTG
 Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Isomerie organischer Verbindungen
 15 Isomerie organischer Verbindungen Organische Verbindungen können, bei gleicher Summenformel, sehr unterschiedliche Strukturen besitzen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur
15 Isomerie organischer Verbindungen Organische Verbindungen können, bei gleicher Summenformel, sehr unterschiedliche Strukturen besitzen. Moleküle mit gleicher Summenformel aber unterschiedlicher Struktur
ORGANISCHE CHEMIE. Katherina Standhartinger. für Ahnungslose Eine Einstiegshilfe für Studierende. von Katherina Standhartinger, Memmingen
 Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 2.
 Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Prof. Dr. ashmi, Sommersemester 2005 13 IV. Alkane Methan -C 2 - Ethan -C 2 -C 2 - Propan -C 2 -C 2 -C 2 - Butan -C 2 -C 2 -C 2 -C 2 - Pentan -C 2 -C 2 -C 2 -C 2 -C 2 - exan -C 2 -C 2 -C 2 -C 2 -C 2 -C
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Summenformel. Strukturformel. Halbstrukturformel. Fossile Energieträger. ( 10. Klasse NTG 1 / 47 ) ( 10. Klasse NTG 2 / 47 ) ( 10. Klasse NTG 3 / 47 )
 Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Summenformel ( 10. Klasse NTG 1 / 47 ) Angabe der Atomsorten und deren Anzahl innerhalb eines Moleküls z.b. Ethanol C 2 6 O Strukturformel ( 10. Klasse NTG 2 / 47 ) Darstellung der bindenden und freien
Inhaltsverzeichnis. Teil I Volle Kraft voraus: Die Chemie des Kohlenstoffs 23. Einführung 17. Kapitel 1 Die wundervolle Welt der organischen Chemie 25
 Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
Inhaltsverzeichnis Inhaltsverzeichnis Über den Autor 7 Einführung 17 Über dieses Buch 18 Konventionen in diesem Buch 19 Törichte Annahmen über den Leser 19 Wie dieses Buch aufgebaut ist 20 Teil I: Es war
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Wichtige Konzepte der Grundvorlesung Organischen Chemie
 Wichtige Konzepte der Grundvorlesung rganischen Chemie 1: Struktur und Bindung ybridisierung bei Kohlenstoffverbindungen: Abhängig von der Zahl der Zahle der Atome, mit denen der Kohlenstoff verbunden
Wichtige Konzepte der Grundvorlesung rganischen Chemie 1: Struktur und Bindung ybridisierung bei Kohlenstoffverbindungen: Abhängig von der Zahl der Zahle der Atome, mit denen der Kohlenstoff verbunden
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig
 26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
26 sisomerie (Stereoisomerie I) Konstitutionsisomerie nicht einzige Art der Isomerie, daneben sind auch Stereoisomerie wichtig Isomerie II: sisomere: sisomere (bzw. Konformere) sind Isomere, die sich durch
weiteres Beispiel für Stereoisomere: Enantiomere Spiegelebene
 Stereoisomere - Isomerie I: Konstitutionsisomere (siehe oben) - Isomerie II: Konformationsisomere (Konformere, siehe oben) - Isomerie III: Stereoisomere; Stereoisomere weisen eine identische Konstitution
Stereoisomere - Isomerie I: Konstitutionsisomere (siehe oben) - Isomerie II: Konformationsisomere (Konformere, siehe oben) - Isomerie III: Stereoisomere; Stereoisomere weisen eine identische Konstitution
Organische Chemie der Freien Universität Berlin. Klausur SS 2008 Teil 1
 rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 201a) Klausur SS 2008 Teil 1 Verfasser: Datum: 07.06.2008 Prof. Dr. H.-U. Reißig Semester: SS 08 Höchstpunktzahl:
rganische Chemie der Freien Universität Berlin C I Grundlagen der rganischen Chemie (LV 21 201a) Klausur SS 2008 Teil 1 Verfasser: Datum: 07.06.2008 Prof. Dr. H.-U. Reißig Semester: SS 08 Höchstpunktzahl:
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Zusammenfassung der Vorlesung OC I, 1. Teil (Stand SS 2010)
 Zusammenfassung der Vorlesung OC I, 1. Teil (Stand SS 2010) Stoffklassen Typische Vertreter/ Wichtige Verbindungen Wichtige eaktionen Begriffe, Prinzipien, Phänomene Alkane Cycloalkane n Methan Propan
Zusammenfassung der Vorlesung OC I, 1. Teil (Stand SS 2010) Stoffklassen Typische Vertreter/ Wichtige Verbindungen Wichtige eaktionen Begriffe, Prinzipien, Phänomene Alkane Cycloalkane n Methan Propan
Beispielklausur Allgemeine Chemie II (Organische Chemie)
 Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
Beispielklausur Allgemeine hemie II (rganische hemie) für Studierende mit hemie als Nebenfach zum Üben LÖSUNGEN (Teilweise gibt es viele mögliche richtige Antworten, dann sind lediglich Beispiele angegeben.)
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
1 E 172.1: rganische hemie für die Life Sciences Prof Dr. J. A. Robinson 2. rganische Verbindungen - Einordnung nach funktionellen Gruppen. Alkane : Moleküle ohne funktionelle Gruppen 2.1 Funktionelle
L.9 Organische Chemie I
 L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
L.9 rganische hemie I 9.1. Schreiben Sie die Konstitutionsformeln für die 4 Isomere der Summenformel 4 9 auf. Zur Summenformel 4 10 existieren zwei verschiedene Konstitutionsisomere (n-butan und iso-butan):
Bestimmen Sie für die folgenden Verbindungen den korrekten Namen nach IUPAC inklusive die korrekte Stereochemie nach CIP-Nomenklatur.
 Aufgabe: Nomenklatur estimmen Sie für die folgenden Verbindungen den korrekten Namen nach IUPA inklusive die korrekte Stereochemie nach IP-Nomenklatur. P 2 r Wieviele Stereoisomere sind denkbar S Wieviele
Aufgabe: Nomenklatur estimmen Sie für die folgenden Verbindungen den korrekten Namen nach IUPA inklusive die korrekte Stereochemie nach IP-Nomenklatur. P 2 r Wieviele Stereoisomere sind denkbar S Wieviele
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 5
 Prof. Dr. ashmi, Sommersemester 2005 45 Mechanismus der 1,2-Isomerisierung: Start: [o III ] Kette: reversible omolyse nur 65 kj/mol Metall--Bindung Organometall-Verbindung X + [o II ] + -Abstraktion das
Prof. Dr. ashmi, Sommersemester 2005 45 Mechanismus der 1,2-Isomerisierung: Start: [o III ] Kette: reversible omolyse nur 65 kj/mol Metall--Bindung Organometall-Verbindung X + [o II ] + -Abstraktion das
Organische Chemie für MST 6. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 6 Lienkamp/ Prucker/ Rühe Valenzisomere Inhalt 6 Isomerie Konstitutionsisomere Tautomere/ Protonenisomere (= Strukturisomere) Skelett-Isomere Isomerie Isomere = Substanzen mit
Organische Chemie für MST 6 Lienkamp/ Prucker/ Rühe Valenzisomere Inhalt 6 Isomerie Konstitutionsisomere Tautomere/ Protonenisomere (= Strukturisomere) Skelett-Isomere Isomerie Isomere = Substanzen mit
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße Jena
 Vorlesung/Seminare Organische Chemie für Materialwissenschaften Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße 10 07743 Jena 03641/9 48270 03641/9 48271
Vorlesung/Seminare Organische Chemie für Materialwissenschaften Prof. Dr. Thomas Heinze Institut für Organische Chemie und Makromolekulare Chemie Humboldtstraße 10 07743 Jena 03641/9 48270 03641/9 48271
Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Arene Arene sind cyclisch konjugierte
Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Arene Arene sind cyclisch konjugierte
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Kohlenstoffverbindungen
 Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Kohlenstoffverbindungen Zusammenfassung Im 19. Jahrhundert begann man die Zusammensetzung von Naturstoffen zu untersuchen. Dieser Zweig der hemie wird Organische hemie genannt. Ursprünglich glaubte man,
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Lernkontrollen Medizinerpraktikum LK 3. - eine kleine Sammlung verschiedener, alter Lernkontrollen mit Lösungen -
 Lernkontrollen Medizinerpraktikum LK 3 - eine kleine Sammlung verschiedener, alter Lernkontrollen mit Lösungen - Lernkontrollen zur Übung - LK 3a SS 1996 1.) (2.5) Welche absolute Konfiguration (R oder
Lernkontrollen Medizinerpraktikum LK 3 - eine kleine Sammlung verschiedener, alter Lernkontrollen mit Lösungen - Lernkontrollen zur Übung - LK 3a SS 1996 1.) (2.5) Welche absolute Konfiguration (R oder
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Bachelorprüfung im Fach Biologie, Teilfach Chemie am a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel
 Bachelorprüfung im Fach Biologie, Teilfach Chemie am 16.05.2014 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O 3 ein, die die folgenden Eigenschaften
Bachelorprüfung im Fach Biologie, Teilfach Chemie am 16.05.2014 2 Aufgabe 1 a) Zeichnen Sie bitte unten die Strukturformel einer Verbindung der Summenformel C 3 H 6 O 3 ein, die die folgenden Eigenschaften
13. Amine und ihre Derivate
 Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
I. Alkane Homologe Reihe, Nomenklatur
 Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Organische Chemie Grundkurs (11. Klasse) Theorie und Übungen I. Alkane omologe Reihe, Nomenklatur omologe Reihe der Alkane Aufgabe: Setzen Sie die Tabelle fort Name Summenformel Struktur Rest Methan C
Bundesrealgymnasium Imst. Chemie Klasse 8. Aliphate
 Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
Bundesrealgymnasium Imst Chemie 2010-11 Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet
