Qualitätsmängel bei Arzneimitteln
|
|
|
- Hede Beyer
- vor 6 Jahren
- Abrufe
Transkript
1
2 AGES PharmMed - Institut Inspektionen, Medizinprodukte & Hämovigilanz Qualitätsmängel bei Arzneimitteln Mag. Martina Unteregger Medizinmarktüberwachung 2
3 AGES PharmMed - Institut Inspektionen, Medizinprodukte & Hämovigilanz Medizinmarktüberwachung (MMÜ) Mag. Hannes Würkner Mag. (FH) Andrea Ungersbäck Mag. Martina Unteregger +43 (0) / 36405, 36419,
4 AGES PharmMed - Institut Inspektionen, Medizinprodukte & Hämovigilanz Inhalt 1. Rechtliches 2. Ablauf 3. Vernetzung mit Abteilung Inspektionen Pharma 4. Statistik 4
5 1. Rechtliches Arzneimittelgesetz 75a. und 75b. Meldung von Qualitätsmängeln & Beobachtungen und Daten, die Auswirkungen auf die Arzneimittelsicherheit haben, an das Bundesamt für Sicherheit im Gesundheitswesen (BASG). Meldeverpflichtung für Ärzte, Zahnärzte, Tierärzte, Dentisten, Hebammen, Apotheker, Drogisten, Großhändlern und Zulassungsinhaber. Vom Zulassungsinhaber wird weiters eine Aussage über das Nutzen-Risiko- Verhältnis und die erforderlichen Maßnahmen erwartet. Pharmakovigilanz-Verordnung (8) und 4 (9) Qualitätsmängel: wenn Arzneimittel in ihrer Qualität nicht dem jeweiligen Stand der Wissenschaft entsprechen, wenn sie in ihrer Zusammensetzung, Beschaffenheit, Aufmachung nicht entsprechen und dadurch eine Gefährdung von Leben und Gesundheit von Menschen/Tieren zu besorgen ist. 5 und 8 stehen im Zusammenhang mit 75a und 75b Arzneimittelgesetz 5
6 1. Rechtliches Arzneimittelbetriebsordnung Jeder Betrieb muss ein System führen, um schnell einen Rückruf von Arzneimitteln durchführen zu können. Jeder Mangel muss aufgezeichnet und untersucht werden. Eine Meldung ans BASG muss erfolgen, wenn der Mangel zu einem Rückruf oder einer ungewöhnlichen Vertriebseinschränkung führen könnte. 35 Für Prüfpräparate gelten dieselben Vorkehrungsmaßnahmen wie oben beschrieben. 6
7 2. Ablauf: Meldung Meldung über Meldekarten Download des Formulars von Meldewesen: Qualitätsmangel-Meldung 3 Meldekarten: 1. Anwender 2. Apotheken,Großhändler, Drogerien 3. ZI 7
8 2. Ablauf: Meldung 8 Neue Neue Version Version von Meldekarten! Meldekarten! Update Update
9 2. Ablauf: Einleitung eines neuen Falles Ein neuer Fall beginnt: Eintreffen der Meldekarte: Erstbeurteilung der Gesundheitsgefährdung durch Einteilung in die drei Risikoklassen gemäß der Compilation of Community Procedures Unterschiedliche Vorgehensweisen nach der Klassifizierung Achtung Arzneimittelfälschung! Ein Qualitätsmangel/Produktdefekt kann auch Ergebnis einer Fälschung sein! 9
10 2. Ablauf: Einleitung eines neuen Falles Klasse III Klasse X Klasse II Klasse I Keine Gesundheitsgefährdung Gesundheitsgefährdung nein ja Ernsthafte Gesundheitsgefährdung Info an Zulassungsinhaber Überprüfung bei periodischer Inspektion Stellungnahme vom Zulassungsinhaber Risikoevaluierung & Einleitung von Sofortmaßnahmen Rapid Alert Notification Information auf (aller Interessensvertretungen) 10
11 2. Ablauf: Klasse III-Mängel Vorgehensweise bei Klasse III-Mängeln: Klasse III-Mängel: Stellen kein Gesundheitsrisiko dar und werden demnach auch als Produktdefekte bezeichnet Beispiele: Geringe Kennzeichnungsmängel Defekte Verschlüsse Verschmutzungen 11
12 2. Ablauf: Klasse III-Mängel: Beispiele 12
13 2. Ablauf: Klasse III-Mängel Information der Zulassungsinhabers über den gemeldeten Produktdefekt Die Abarbeitung mit einer möglichen Setzung von Maßnahmen obliegt dem Zulassungsinhaber und wird bei der nächsten GMP/GDP-Inspektion behandelt. Wenn das Defektmuster an das OMCL geschickt wurde: Übermittlung des Gutachtens an den Zulassungsinhaber Keine Gesundheitsgefährdung: Fall wird abgeschlossen Gesundheitsgefährdung möglich: Zulassungsinhaber wird zur Stellungnahme aufgefordert Aufwertung des Falles in Risikoklasse II 13
14 2. Ablauf: Klasse X-Mängel Vorgehensweise bei Klasse X-Mängeln: Klasse X-Mängel: Stellen kein Gesundheitsrisiko dar und können den drei vorgegebenen Klassen nicht zugeordnet werden Beispiele: Mögliche Verwechslungsgefahr verschiedener Produkte Korrekte, aber unklare Kennzeichnung Mängel, welche sich als Anwenderfehler herausstellten: Stopfenausstanzungen durch falsche Handhabung, Schlierenbildung durch falsche Lagerung 14
15 2. Ablauf: Klasse X-Mängel: Beispiel 15
16 2. Ablauf: Klasse X-Mängel Dieselbe Vorgehensweise wie bei Klasse III-Mängel, aber: Wenn das OMCL-Gutachten ergibt, dass ein Anwendungsfehler vorliegt, dann Information von Seiten der Medizinmarktüberwachung an den Melder das verwendete Infusionsbesteck Mängel aufweist, dann Weiterleitung dieser Erkenntnisse an die Abteilung Inspektionen Medizinprodukte & IT (Dr. Ronald Bauer) 16
17 2. Ablauf: Klasse II-Mängel Vorgehensweise bei Klasse II-Mängeln: Klasse II-Mängel: Stellen eine Gesundheitsgefährdung dar, indem diese Mängel Krankheit oder Fehlbehandlung verursachen können Beispiele: Schwere Kennzeichnungsmängel Chemische/physikalische Kontamination Abweichung von der Spezifikation (OOS-Ergebnisse) Undichte Verpackungen (z.b. bei zytotoxischen Produkten) 17
18 2. Ablauf: Klasse II-Mängel: Beispiele 18
19 2. Ablauf: Klasse II-Mängel Wenn Zulassungsinhaber selbst der Melder ist: Bereitstellung einer ersten Risikoevaluierung neben der Meldekarte Einleitung einer Triage AGES PharmMed-intern: Dr. Andreas Mayrhofer OMCL Dr. Peter Platzer LCM, Abteilung Arzneimittelqualität Dr. Christoph Baumgärtel LCM, Abteilung Medizinische Bewertung von Humanarzneispezialitäten Absprache mit dem Zulassungsinhaber über weitere Vorgehensweise: Austausch der Ware (Rückruf, wenn keine Ersatzcharge verfügbar) Informationsschreiben an belieferte Kunden Artikel in Apotheker- und/oder Ärztezeitung Periodische Übermittlung von Ergebnissen aus Testungen der Rückstellmuster Bei Austausch/Rückruf: wenn Charge auch in anderen Ländern vertrieben wird: Rapid Alert Notification an betroffene Länderbehörden ggf. Information auf Homepage unter Amtliche Nachrichten 19
20 2. Ablauf: Klasse II-Mängel Wenn Meldung vom Markt: Zulassungsinhaber wird zu einer vorläufigen Stellungnahme aufgefordert Wenn Defektmuster ans OMCL und das Gutachten bestätigt ein OOS-Ergebnis ohne Gesundheitsgefährdung: Fall wird abgeschlossen OOS- oder S-Ergebnis mit Gesundheitsgefährdung: Aufforderung zur Stellungnahme Einleitung weiterer Maßnahmen (Triage, Austausch/Rückruf, Kundeninformation etc.) 20
21 2. Ablauf: Klasse I-Mängel Vorgehensweise bei Klasse I-Mängeln: Klasse I-Mängel: Sind potentiell lebensbedrohend oder stellen eine ernsthafte Gesundheitsgefährdung dar Beispiele: Falscher Inhalt, falscher API, falsche Wirkstoffstärke Chemische Kontamination mit ernster Patientengefährdung (z.b. Kreuzkontaminationen) Vertauschungen Unsterilitäten bei Ophtalmica und injizierbaren Produkten 21
22 2. Ablauf: Klasse I-Mängel: Beispiele 22
23 2. Ablauf: Klasse I-Mängel Zulassungsinhaber bisher immer selbst der Melder: Bereitstellung einer Risikoevaluierung inklusive Vorschlag von Maßnahmen neben der Meldekarte AGES PharmMed-intern: Einleitung einer Triage Informierung des Institutsleiters DDr. Alexander Hönel, Bereichsleitung Dr. Marcus Müllner, Bundesministerium f. Gesundheit Prof. Hubert Hrabcik Rapid Alert Notification an alle Länder im Staatenverbund Aussendung einer Information an Apotheker-, Ärztekammer, Landessanitätsdirektionen, Landesvertretungen Information auf Homepage unter Amtliche Nachrichten Rückruf der Ware (Austausch, wenn Ersatzcharge vorhanden) 23
24 3. Vernetzung mit Abteilung Inspektionen Pharma Jeder neue Fall wird, wenn möglich, mit der im GMP-Zertifikat genannten Betriebezahl verknüpft: Sämtliche Fälle liegen somit den Inspektoren für die Vorbereitung einer Inspektion vor Sofortige Involvierung der Inspektoren bei offensichtlich groben Herstellungsfehlern: Bei Bedarf: Akutinspektion, wenn Hersteller im Inland sitzt Erfahrungsaustausch bei Erstevaluierung eines neuen Falles 24
25 4. Statistik 2008 wurden insgesamt 167 Qualitätsmängel sowie 104 Rapid Alerts gemeldet Qualitätsmangelfälle und Rapid Alerts Anzahl Jänner Februar März April Mai Juni Juli August September Oktober November Dezember Q-Mängel RA
26 4. Statistik Aufteilung der Meldungen nach Meldern Herkunft der Meldungen % 28% 26% 25% 22% 20% 15% 10% 5% 8% 8% 5% 0% 0% 2% 26 Meldungen [%] öffentl. Apotheken KH-Apotheken Anwender Großhändler MAH AGES-intern RA-System andere Behörden
27 4. Statistik Einteilung Meldungen nach Risikoklassen Meldungen 2008 nach Risikoklassen 19% 5% 40% Meldungen 2007 gesamt nach Risikoklassen 36% 22% 17% Klasse I Klasse II Klasse III Klasse x 31% 30% Klasse I Klasse II Klasse III Klasse X 27
28 4. Statistik Rapid Alert Notifications 2008: Seit 2006 hat AGES PharmMed 6 Rapid Alert Notifications versendet RA-Eingänge Anzahl Eingänge (25%) 9 (10%) 13 (13%) Eingänge mit AT-Bezug Jahr 28
29 4. Statistik Einteilung der Risikoklassen nach Meldern Q-Mängel 2008 nach Meldern und Risikoklasse Klasse I [%] Klasse II [%] Klasse III [%] Klasse x [%] 29 [%] öffentl. Apotheken KH-Apotheken Anwender Großhändler MAH AGES-intern RA-System andere Behörden
30 30
Inhalt. Vorstellung. Historisches. Rechtliche Grundlagen. Meldung von Nebenwirkungen. Kontaktangaben
 Inhalt Vorstellung Historisches Rechtliche Grundlagen Meldung von Nebenwirkungen Kontaktangaben 2 Wer sind wir Institut Pharmakovigilanz Gruppe KIVE (Kommunikation, Implementierung und Veterinär) 3 Definition
Inhalt Vorstellung Historisches Rechtliche Grundlagen Meldung von Nebenwirkungen Kontaktangaben 2 Wer sind wir Institut Pharmakovigilanz Gruppe KIVE (Kommunikation, Implementierung und Veterinär) 3 Definition
Dokumenten-Nr.: Bewertung von Abweichungen, Fehlern und Mängeln 2/5
 Bewertung von Abweichungen, Fehlern und Mängeln 2/5 1 Zweck Ziel der Verfahrensanweisung ist es, bekannt gewordene, vermutete Abweichungen im Zusammenhang mit GMP-Inspektionen zu untersuchen und zu bewerten.
Bewertung von Abweichungen, Fehlern und Mängeln 2/5 1 Zweck Ziel der Verfahrensanweisung ist es, bekannt gewordene, vermutete Abweichungen im Zusammenhang mit GMP-Inspektionen zu untersuchen und zu bewerten.
Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 23.11.2016 Inhaltsverzeichnis
Gesetzliche Grundlagen und Meldepflicht
 Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Gesetzliche Grundlagen und Meldepflicht Mag. Doris Datlinger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Gespräch Hämovigilanz Wien, 09.06.2010 www.basg.at Österreichische Agentur für Gesundheit
Neue Fälschungsfälle: Neulasta (Pegfilgrastim), Viread (Tenofovir) 76. Routinesitzung,
 Neue Fälschungsfälle: Neulasta (Pegfilgrastim), Viread (Tenofovir) 76. Routinesitzung, 21.04.2015 Mehrere Verdachtsfälle: Fälschung Neulasta 6 mg der Firma Amgen Wirkstoff: Pegfilgrastim aus E. coli K12
Neue Fälschungsfälle: Neulasta (Pegfilgrastim), Viread (Tenofovir) 76. Routinesitzung, 21.04.2015 Mehrere Verdachtsfälle: Fälschung Neulasta 6 mg der Firma Amgen Wirkstoff: Pegfilgrastim aus E. coli K12
Das BASG / AGES PharmMed
 CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
CMI-WORKSHOP Dipl.-Ing. Meinrad Guggenbichler Institut Inspektionen, Medizinprodukte und Hämovigilanz Das BASG / AGES PharmMed Das Bundesamt für Sicherheit im Gesundheitswesen (BASG) ist die Aufsichtsbehörde
Produktrückrufe und Warnungen Herausforderungen für die Kommunikation und Öffentlichkeitsarbeit
 Produktrückrufe und Warnungen Herausforderungen für die Kommunikation und Öffentlichkeitsarbeit Ingrid Kiefer Fachbereich Risikokommunikation Produktwarnungen und Produktrückrufe Krise im Unternehmen VO
Produktrückrufe und Warnungen Herausforderungen für die Kommunikation und Öffentlichkeitsarbeit Ingrid Kiefer Fachbereich Risikokommunikation Produktwarnungen und Produktrückrufe Krise im Unternehmen VO
Das AGES MEA OMCL als innovativer Partner im europäischen Netzwerk
 AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte Das AGES MEA OMCL als innovativer Partner im europäischen Netzwerk Gerhard Beck AGES Medizinmarktaufsicht
AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte Das AGES MEA OMCL als innovativer Partner im europäischen Netzwerk Gerhard Beck AGES Medizinmarktaufsicht
Gemeinsam gegen Arzneimittelfälschungen!
 Gemeinsam gegen Arzneimittelfälschungen! Arzneimittelkauf übers Internet Der Vertrieb illegaler Arzneimittel über das Internet und damit die Gefährdung der öffentlichen Gesundheit wächst laufend. Heute
Gemeinsam gegen Arzneimittelfälschungen! Arzneimittelkauf übers Internet Der Vertrieb illegaler Arzneimittel über das Internet und damit die Gefährdung der öffentlichen Gesundheit wächst laufend. Heute
Zentrale Arzneimittelüberwachung Bayern GCP- Fortbildungsveranstaltung am in München Qualität in klinischen Arzneimittelstudien am Menschen
 Zentrale Arzneimittelüberwachung Bayern GCP- Fortbildungsveranstaltung am 17.09.2009 in München Qualität in klinischen Arzneimittelstudien am Menschen Findings bei der Inspektion klinischer Prüfungen durch
Zentrale Arzneimittelüberwachung Bayern GCP- Fortbildungsveranstaltung am 17.09.2009 in München Qualität in klinischen Arzneimittelstudien am Menschen Findings bei der Inspektion klinischer Prüfungen durch
Arzneimitteltransport: Anforderungen und Inspektion
 Arzneimitteltransport: Anforderungen und Inspektion Andreas Kraßnigg Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Kontakt AGES PharmMed Institut Inspektionen, Medizinprodukte &
Arzneimitteltransport: Anforderungen und Inspektion Andreas Kraßnigg Österreichische Agentur für Gesundheit und Ernährungssicherheit GmbH Kontakt AGES PharmMed Institut Inspektionen, Medizinprodukte &
Bedeutung der Norm EN ISO GCP für Medizinprodukte in der Praxis -
 Bedeutung der Norm EN ISO 14155 - GCP für Medizinprodukte in der Praxis - Dr. Violetta Zmuda AGES MEA, Institut Überwachung, Abteilung Klinische Prüfung violetta.zmuda@ages.at AGES-Gespräch Wien, 12. Oktober
Bedeutung der Norm EN ISO 14155 - GCP für Medizinprodukte in der Praxis - Dr. Violetta Zmuda AGES MEA, Institut Überwachung, Abteilung Klinische Prüfung violetta.zmuda@ages.at AGES-Gespräch Wien, 12. Oktober
Arzneimittelfälschungen als Aufgabe der Medizinmarktüberwachung in der AGES PharmMed
 AGES PharmMed Institut Inspektionen, Arzneimittelfälschungen als Aufgabe der Medizinmarktüberwachung in der AGES PharmMed DDr. Hönel Alexander, MBA Institut Inspektionen, Medizinprodukte & Hämovigilanz
AGES PharmMed Institut Inspektionen, Arzneimittelfälschungen als Aufgabe der Medizinmarktüberwachung in der AGES PharmMed DDr. Hönel Alexander, MBA Institut Inspektionen, Medizinprodukte & Hämovigilanz
GCP-Routineinspektionen im Rahmen von klinischen Prüfungen - Ein Erfahrungsbericht -
 GCP-Routineinspektionen im Rahmen von klinischen Prüfungen - Ein Erfahrungsbericht - Katharina Thorn 11. DVMD-Fachtagung, Hannover Inspektionen / Audits GCP-Inspektionen im Rahmen von Zulassungsverfahren
GCP-Routineinspektionen im Rahmen von klinischen Prüfungen - Ein Erfahrungsbericht - Katharina Thorn 11. DVMD-Fachtagung, Hannover Inspektionen / Audits GCP-Inspektionen im Rahmen von Zulassungsverfahren
10901/J XXIV. GP. Dieser Text wurde elektronisch übermittelt. Abweichungen vom Original sind möglich. Anfrage
 10901/J XXIV. GP - Anfrage (elektr. übermittelte Version) 1 von 5 10901/J XXIV. GP Eingelangt am 01.03.2012 Anfrage der Abgeordneten Judith Schwentner, Kurt Grünewald, Freundinnen und Freunde an den Bundesminister
10901/J XXIV. GP - Anfrage (elektr. übermittelte Version) 1 von 5 10901/J XXIV. GP Eingelangt am 01.03.2012 Anfrage der Abgeordneten Judith Schwentner, Kurt Grünewald, Freundinnen und Freunde an den Bundesminister
Änderungen bei der Meldung einer klinischen Prüfung gemäß MPG
 Änderungen bei der Meldung einer klinischen Prüfung gemäß MPG Dr. Svetlana Seiter Abteilung Klinische Prüfung, Institut Überwachung, AGES MEA AGES Gespräch 25.11.2014 www.ages.at Österreichische Agentur
Änderungen bei der Meldung einer klinischen Prüfung gemäß MPG Dr. Svetlana Seiter Abteilung Klinische Prüfung, Institut Überwachung, AGES MEA AGES Gespräch 25.11.2014 www.ages.at Österreichische Agentur
Sicherheit von Medizinprodukten. Vigilanzsystem und Meldepflichten
 Sicherheit von Medizinprodukten Vigilanzsystem und Meldepflichten Dr. Reinhard Berger PharmMed Austria Institut Medizinprodukte & Haemovigilanz 5. Mai 2007 Disclaimer: Die Inhalte dieses Vortrages sind
Sicherheit von Medizinprodukten Vigilanzsystem und Meldepflichten Dr. Reinhard Berger PharmMed Austria Institut Medizinprodukte & Haemovigilanz 5. Mai 2007 Disclaimer: Die Inhalte dieses Vortrages sind
Label und Off-Label Use von Medikamenten bei Kindern und Jugendlichen in Österreich
 Label und Off-Label Use von Medikamenten bei Kindern und Jugendlichen in Österreich AGES Gespräch 04.10.2007 Dr. Doris Tschabitscher AGES PharmMed, National Contact Point Paediatrics Erkenntnis Kinder
Label und Off-Label Use von Medikamenten bei Kindern und Jugendlichen in Österreich AGES Gespräch 04.10.2007 Dr. Doris Tschabitscher AGES PharmMed, National Contact Point Paediatrics Erkenntnis Kinder
2016 brachte einen Rückgang der Klinischen Prüfungen in Österreich im Vergleich zu 2015, obwohl das Minimum von 2014 nicht erreicht wurde.
 Klinische Prüfungen: Statistik 216 Abteilung Klinische Prüfung (CLTR) Aktuelle Statistik der Klinischen Prüfung für Arzneimittel in Österreich 216 brachte einen Rückgang der Klinischen Prüfungen in Österreich
Klinische Prüfungen: Statistik 216 Abteilung Klinische Prüfung (CLTR) Aktuelle Statistik der Klinischen Prüfung für Arzneimittel in Österreich 216 brachte einen Rückgang der Klinischen Prüfungen in Österreich
GM/DP-Inspektionen. Andreas Kraßnigg
 GM/DP-Inspektionen Andreas Kraßnigg Kontakt AGES PharmMed Institut Inspektionen, Medizinprodukte & Haemovigilanz Schnirchgasse 9 1030 Wien +43 (0) 50555 36402 inspektionen@ages.at Who is who? Inspektionen,
GM/DP-Inspektionen Andreas Kraßnigg Kontakt AGES PharmMed Institut Inspektionen, Medizinprodukte & Haemovigilanz Schnirchgasse 9 1030 Wien +43 (0) 50555 36402 inspektionen@ages.at Who is who? Inspektionen,
Bewertung von Abweichungen, Fehlern und Mängeln
 Seite 2 von 8 1 Zweck Ziel der Verfahrensanweisung ist es, Kriterien für die Bewertung von Abweichungen festzulegen, die im Zusammenhang mit GMP-Inspektionen festgestellt werden. Diese VAW regelt ferner
Seite 2 von 8 1 Zweck Ziel der Verfahrensanweisung ist es, Kriterien für die Bewertung von Abweichungen festzulegen, die im Zusammenhang mit GMP-Inspektionen festgestellt werden. Diese VAW regelt ferner
Vorgehensweise bei Risikoverdachtsfällen, Verbraucherbeschwerden und Beanstandungen bei immunologischen Tierarzneimitteln
 Seite 1 von 6 Geltungsbereich Oberste Landesbehörde Inspektorat Schlüsselwörter Querverweise 121103 erstellt Immunologische Tierarzneimittel; Risikoverdacht; Rapid Alert System (RAS) der EU; Zuständigkeit;
Seite 1 von 6 Geltungsbereich Oberste Landesbehörde Inspektorat Schlüsselwörter Querverweise 121103 erstellt Immunologische Tierarzneimittel; Risikoverdacht; Rapid Alert System (RAS) der EU; Zuständigkeit;
Ordentliche Mitgliederversammlung des BVDVA. Die österreichische Arzneimittelfernabsatzverordnung
 Ordentliche Mitgliederversammlung des BVDVA 10. Juni 2015, Berlin Die österreichische Arzneimittelfernabsatzverordnung Jakob Hütthaler-Brandauer Rechtsanwalt Arzneimittelversandhandel Österreich - Überblick
Ordentliche Mitgliederversammlung des BVDVA 10. Juni 2015, Berlin Die österreichische Arzneimittelfernabsatzverordnung Jakob Hütthaler-Brandauer Rechtsanwalt Arzneimittelversandhandel Österreich - Überblick
Geschäftsordnung des Bundesamtes für Sicherheit im Gesundheitswesen
 Anlage zu 1 Abs. 1 Diese Geschäftsordnungsbestimmung legt die Ermächtigung von Leitern der jeweiligen Organisationseinheit und deren Stellvertretern zur Anordnung verfahrensleitender Verfügungen, zur Ausstellung
Anlage zu 1 Abs. 1 Diese Geschäftsordnungsbestimmung legt die Ermächtigung von Leitern der jeweiligen Organisationseinheit und deren Stellvertretern zur Anordnung verfahrensleitender Verfügungen, zur Ausstellung
Erfahrungen mit GCP Inspektionen von MPG Studien
 Erfahrungen mit GCP Inspektionen von MPG Studien Yvonne Borck, Universitätsklinik Bonn Arbeitsgemeinschaft für angewandte Humanpharmakologie (AGAH) e.v Hintergrund Nach 26 MPG unterliegen Betriebe und
Erfahrungen mit GCP Inspektionen von MPG Studien Yvonne Borck, Universitätsklinik Bonn Arbeitsgemeinschaft für angewandte Humanpharmakologie (AGAH) e.v Hintergrund Nach 26 MPG unterliegen Betriebe und
Unterschiede bei Audits
 Unterschiede bei Audits XVI. Fortbildungsveranstaltung der ARGE Plasmapherese e. V. (19. November 2016) Elke Weitershaus, Landesverwaltungsamt Sachsen-Anhalt Inhalt 1. Definition und Rechtsgrundlage 2.
Unterschiede bei Audits XVI. Fortbildungsveranstaltung der ARGE Plasmapherese e. V. (19. November 2016) Elke Weitershaus, Landesverwaltungsamt Sachsen-Anhalt Inhalt 1. Definition und Rechtsgrundlage 2.
Risikokommunikation der Behörden Risiken und Nutzen von Arzneimitteln
 Risikokommunikation der Behörden Risiken und Nutzen von Arzneimitteln Marcus Müllner AGES PharmMed / Bundesamt für Sicherheit im Gesundheitswesen 21.11.2011 www.basg.at Österreichische Agentur für Gesundheit
Risikokommunikation der Behörden Risiken und Nutzen von Arzneimitteln Marcus Müllner AGES PharmMed / Bundesamt für Sicherheit im Gesundheitswesen 21.11.2011 www.basg.at Österreichische Agentur für Gesundheit
Bundesamt für Sicherheit im Gesundheitswesen
 Schutzmaßnahmen im Zuge der Arzneimittelüberwachung gemäß 78 AMG 670.015-40-11-INS Nowicky Pharma Dip!. Ing. Dr. J. Wassyl Nowicky pharmazeutische Produkte Margaretenstraße 7/7 1040 Wien Wien, am 22. Nn\J.
Schutzmaßnahmen im Zuge der Arzneimittelüberwachung gemäß 78 AMG 670.015-40-11-INS Nowicky Pharma Dip!. Ing. Dr. J. Wassyl Nowicky pharmazeutische Produkte Margaretenstraße 7/7 1040 Wien Wien, am 22. Nn\J.
Behördliche Überwachung der klinischen Prüfung beim Prüfarzt
 Behördliche Überwachung der klinischen Prüfung beim Prüfarzt Michael Rappl Regierung von Oberbayern Zentrale Arzneimittelüberwachung Bayern (GMP/GCP) Vortrag im Rahmen des 5. GCP-Kurses am Klinikum rechts
Behördliche Überwachung der klinischen Prüfung beim Prüfarzt Michael Rappl Regierung von Oberbayern Zentrale Arzneimittelüberwachung Bayern (GMP/GCP) Vortrag im Rahmen des 5. GCP-Kurses am Klinikum rechts
Marktzugang - Vigilanz und PMS
 Marktzugang - Vigilanz und PMS Dr. Reinhard Berger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Medizinmarktaufsicht 2012 07.03.2012 Disclaimer: Die Inhalte dieses Vortrages sind die Privatmeinung
Marktzugang - Vigilanz und PMS Dr. Reinhard Berger Institut Inspektionen, Medizinprodukte & Hämovigilanz AGES Medizinmarktaufsicht 2012 07.03.2012 Disclaimer: Die Inhalte dieses Vortrages sind die Privatmeinung
A r z n e i m i t t e l ü b e r w a c h u n g i n D e u t s c h l a n d J a h r e s b e r i c h t 2014/2015
 Inhaltsverzeichnis 1 Deskriptiver Teil... 3 1.1 Aufbau der Überwachung... 3 1.1.1 Strukturen... 3 1.1.2 Karte der Arzneimittelüberwachung (GxP) der Landesbehörden in Deutschland. 3 1.1.3 Personal... 3
Inhaltsverzeichnis 1 Deskriptiver Teil... 3 1.1 Aufbau der Überwachung... 3 1.1.1 Strukturen... 3 1.1.2 Karte der Arzneimittelüberwachung (GxP) der Landesbehörden in Deutschland. 3 1.1.3 Personal... 3
Vorgehensweise bei Arzneimittelrisiken, Verbraucherbeschwerden und sonstigen Beanstandungen. Oberste Landesbehörde Inspektorat ZLG
 Seite 1 von 10 Geltungsbereich Oberste Landesbehörde Inspektorat Schlüsselwörter Arzneimittelrisiko; Zuständigkeit; Maßnahmen Querverweise 101101; 121103; 121105; 121108; 161106 erstellt EFG 01 CoCP-Relevanz
Seite 1 von 10 Geltungsbereich Oberste Landesbehörde Inspektorat Schlüsselwörter Arzneimittelrisiko; Zuständigkeit; Maßnahmen Querverweise 101101; 121103; 121105; 121108; 161106 erstellt EFG 01 CoCP-Relevanz
Praktische Erfahrungen der Überwachungsbehörden der Länder
 Praktische Erfahrungen der Überwachungsbehörden der Länder PMS-Workshop, 29.09.2005 Auswirkungen der 12. AMG-Novelle auf die klinische Forschung in Deutschland Dr. Sabine Paris Zentralstelle der Länder
Praktische Erfahrungen der Überwachungsbehörden der Länder PMS-Workshop, 29.09.2005 Auswirkungen der 12. AMG-Novelle auf die klinische Forschung in Deutschland Dr. Sabine Paris Zentralstelle der Länder
Leitlinie Kommentar Arbeitshilfe. Leitlinie der Bundesapothekerkammer zur Qualitätssicherung. Prüfung der Fertigarzneimittel und apothekenpflichtigen
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Prüfung der Fertigarzneimittel und apothekenpflichtigen Medizinprodukte Stand der Revision:16.06.2016 Inhaltsverzeichnis
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Prüfung der Fertigarzneimittel und apothekenpflichtigen Medizinprodukte Stand der Revision:16.06.2016 Inhaltsverzeichnis
AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs
 AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs DI., Dr. Christa Wirthumer-Hoche Geschäftsfeldleiterin AGES Medizinmarktaufsicht
AGES Medizinmarktaufsicht (MEA) steht für sichere und wirksame Arzneimittel und Medizinprodukte ein Überblick des Aufgabenbereichs DI., Dr. Christa Wirthumer-Hoche Geschäftsfeldleiterin AGES Medizinmarktaufsicht
Der Abgrenzungsbeirat in Österreich Ein Vorbild für Deutschland?
 Der Abgrenzungsbeirat in Österreich Ein Vorbild für Deutschland? R. Länger AGES PharmMed Abteilung Pflanzliche Arzneimittel und Homöopathika Abgrenzung Arzneimittel Medizinprodukt Neuartiges Lebensmittel
Der Abgrenzungsbeirat in Österreich Ein Vorbild für Deutschland? R. Länger AGES PharmMed Abteilung Pflanzliche Arzneimittel und Homöopathika Abgrenzung Arzneimittel Medizinprodukt Neuartiges Lebensmittel
Arzneimittelüberwachung in Deutschland. Jahresbericht der Länder
 Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten Arzneimittelüberwachung in Deutschland Jahresbericht der Länder 2010 Inhaltsverzeichnis 1 Deskriptiver Teil... 3 1.1
Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten Arzneimittelüberwachung in Deutschland Jahresbericht der Länder 2010 Inhaltsverzeichnis 1 Deskriptiver Teil... 3 1.1
VERSANDHANDEL IN ÖSTERREICH. Dr. Robert Semp (BMG) Mag. Andreas Krassnigg (AGES)
 VERSANDHANDEL IN ÖSTERREICH Dr. Robert Semp (BMG) Mag. Andreas Krassnigg (AGES) Richtlinie gefälschte Arzneimittel RICHTLINIE 2011/62/EU DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 8. Juni 2011 zur Änderung
VERSANDHANDEL IN ÖSTERREICH Dr. Robert Semp (BMG) Mag. Andreas Krassnigg (AGES) Richtlinie gefälschte Arzneimittel RICHTLINIE 2011/62/EU DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 8. Juni 2011 zur Änderung
MEDIZINPRODUKTEABGABENVERORDNUNG
 MEDIZINPRODUKTEABGABENVERORDNUNG Wer ist abgabepflichtig? Jede natürliche und juristische Person, die Medizinprodukte an Letztverbraucher entgeltlich abgibt. Unter Abgeben ist in diesem Fall die entgeltliche
MEDIZINPRODUKTEABGABENVERORDNUNG Wer ist abgabepflichtig? Jede natürliche und juristische Person, die Medizinprodukte an Letztverbraucher entgeltlich abgibt. Unter Abgeben ist in diesem Fall die entgeltliche
Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke
 Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 13.11.2013 Inhaltsübersicht
Leitlinie Kommentar Arbeitshilfe Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Risiken bei Arzneimitteln und Medizinprodukten Maßnahmen in der Apotheke Stand der Revision: 13.11.2013 Inhaltsübersicht
Arzneimittelüberwachung in Deutschland. Jahresbericht der Länder
 Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten Arzneimittelüberwachung in Deutschland Jahresbericht der Länder 2009 Inhalt 1 Vorwort... 3 2 Deskriptiver Teil... 4
Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten Arzneimittelüberwachung in Deutschland Jahresbericht der Länder 2009 Inhalt 1 Vorwort... 3 2 Deskriptiver Teil... 4
Pharmakovigilanz: Risiken erfassen und kontrollieren
 Pharmakovigilanz: Risiken erfassen und kontrollieren Dr. Norbert Paeschke Dr. Norbert Paeschke Risiken erfassen und kontrollieren 15./16.9.2015 Seite 1 Prozess von der Risikoerfassung zur Risikokontrolle
Pharmakovigilanz: Risiken erfassen und kontrollieren Dr. Norbert Paeschke Dr. Norbert Paeschke Risiken erfassen und kontrollieren 15./16.9.2015 Seite 1 Prozess von der Risikoerfassung zur Risikokontrolle
https://www.zlg.de/arzneimittel/qualitaetssystem/qualitaetssicherungshandbuch.html
 Anlage 1 PZ-QS01 1 Klinikkopf Checkliste Vor- und Nachbereitung Audits und Inspektionen Checkliste Vor- und Nachbereitung Audits und Inspektionen https://www.zlg.de/arzneimittel/qualitaetssystem/qualitaetssicherungshandbuch.html
Anlage 1 PZ-QS01 1 Klinikkopf Checkliste Vor- und Nachbereitung Audits und Inspektionen Checkliste Vor- und Nachbereitung Audits und Inspektionen https://www.zlg.de/arzneimittel/qualitaetssystem/qualitaetssicherungshandbuch.html
Die Stellungnahme des Bundesinstitutes für Arzneimittel und Medizinprodukte ist zu diesem Thema eindeutig:
 Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
Händedesinfektionsmittel: Arzneimittel oder Biozide 2009 wurde mit der 15. Änderung des Arzneimitteländerungsgesetzes der Begriff Arzneimittel im AMG neu definiert. Während der bisherigen Arzneimitteldefinition
Verantwortlichkeiten nach der EU-Kosmetikverordnung
 Verantwortlichkeiten nach der EU-Kosmetikverordnung Mag. Christina Zwinger 9. Oktober 2012 Verantwortliche Person Nur kosmetische Mittel, für die eine juristische oder natürliche Person innerhalb des Gemeinschaftsgebiets
Verantwortlichkeiten nach der EU-Kosmetikverordnung Mag. Christina Zwinger 9. Oktober 2012 Verantwortliche Person Nur kosmetische Mittel, für die eine juristische oder natürliche Person innerhalb des Gemeinschaftsgebiets
Revision RL 93/42/EWG Aufgaben der Benannten Stelle
 RICHTLINIE 2007/47/EG DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 5. September 2007 zur Änderung der Richtlinien 90/385/EWG des Rates zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über aktive
RICHTLINIE 2007/47/EG DES EUROPÄISCHEN PARLAMENTS UND DES RATES vom 5. September 2007 zur Änderung der Richtlinien 90/385/EWG des Rates zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über aktive
INTERNATIONALES Paediatric Committee (PDCO) 4 Arbeitsgruppe Relative Effectiveness 5
 2 UPTODATE NEWS Erneut erfolgreiche Zusammenarbeit zwischen OMCL und Polizei 2 Neuer Leitfaden Klinische Prüfung 2 Österreichisches Arzneibuch: Erste neue Monographien 3 Neues auf www.ages.at 3 4 INTERNATIONALES
2 UPTODATE NEWS Erneut erfolgreiche Zusammenarbeit zwischen OMCL und Polizei 2 Neuer Leitfaden Klinische Prüfung 2 Österreichisches Arzneibuch: Erste neue Monographien 3 Neues auf www.ages.at 3 4 INTERNATIONALES
Suchtmittel Nachweisungen Jahresstatistik
 Suchtmittel Nachweisungen Jahresstatistik Mag. (FH) Andrea Ungersbäck Institut Überwachung, Abteilung GMDP AGES Gespräch Fokus Suchtmittel Wien, 12.01.2017 Bundesamt für Sicherheit im Gesundheitswesen
Suchtmittel Nachweisungen Jahresstatistik Mag. (FH) Andrea Ungersbäck Institut Überwachung, Abteilung GMDP AGES Gespräch Fokus Suchtmittel Wien, 12.01.2017 Bundesamt für Sicherheit im Gesundheitswesen
Verordnung des Bundesministers für Gesundheit, mit der die Arzneimittelbetriebsordnung 2009 geändert wird. Vorblatt. Ziele. Inhalt
 1 von 7 Verordnung des Bundesministers für Gesundheit, mit der die Arzneimittelbetriebsordnung 2009 geändert wird Einbringende Stelle: Bundesministerium für Gesundheit Laufendes Finanzjahr: 2013 Inkrafttreten/
1 von 7 Verordnung des Bundesministers für Gesundheit, mit der die Arzneimittelbetriebsordnung 2009 geändert wird Einbringende Stelle: Bundesministerium für Gesundheit Laufendes Finanzjahr: 2013 Inkrafttreten/
Umsetzung der Internationalen Gesundheitsvorschriften in Deutschland
 Umsetzung der Internationalen Gesundheitsvorschriften in Deutschland Quelle: Erich Westendarp / pixelio.de Quelle: URSfoto / pixelio.de Stand: Juni 2016, Erstellt vom Robert Koch-Institut (RKI) Deutschland
Umsetzung der Internationalen Gesundheitsvorschriften in Deutschland Quelle: Erich Westendarp / pixelio.de Quelle: URSfoto / pixelio.de Stand: Juni 2016, Erstellt vom Robert Koch-Institut (RKI) Deutschland
Verwaltungsvorschriften über Informationswege und Maßnahmen bei Arzneimittelzwischenfällen im Land Berlin. Vom 2. September 2013.
 Verwaltungsvorschriften über Informationswege und Maßnahmen bei Arzneimittelzwischenfällen im Land Berlin Vom 2. September 2013 GesSoz I F 2 Telefon: 90 28-16 38, intern 9 28-16 38 Auf Grund des 6 Absatz
Verwaltungsvorschriften über Informationswege und Maßnahmen bei Arzneimittelzwischenfällen im Land Berlin Vom 2. September 2013 GesSoz I F 2 Telefon: 90 28-16 38, intern 9 28-16 38 Auf Grund des 6 Absatz
imedication Identifizierung und Überwachung von unerwünschten Arzneimittelwirkungen
 imedication Identifizierung und Überwachung von unerwünschten Arzneimittelwirkungen DI Manuela Plößnig, MSc Salzburg Research 21. November 2012 Heilen ist eine Frage der Zeit, mitunter aber auch eine Frage
imedication Identifizierung und Überwachung von unerwünschten Arzneimittelwirkungen DI Manuela Plößnig, MSc Salzburg Research 21. November 2012 Heilen ist eine Frage der Zeit, mitunter aber auch eine Frage
Die Kontrolle durch die Lebensmittelaufsicht. Die geltende VA - K Steppert Stefan Lebensmittelinspektor
 Die Kontrolle durch die Lebensmittelaufsicht Die geltende VA - K 0211.06 Steppert Stefan Lebensmittelinspektor Lebensmittelkontrolle in NÖ Aufbau der NÖ Lebensmittelaufsicht: Bundesministerium für Gesundheit
Die Kontrolle durch die Lebensmittelaufsicht Die geltende VA - K 0211.06 Steppert Stefan Lebensmittelinspektor Lebensmittelkontrolle in NÖ Aufbau der NÖ Lebensmittelaufsicht: Bundesministerium für Gesundheit
BAES Neu ab
 BAES Neu ab 1.1.2016 Mag. Josefine Sinkovits BAES, stellvertretende Direktorin Leitung Rechtsdienst, Zulassung, Zertifizierung und Kommunikation Informationsveranstaltung - Pflanzenschutzmittel: Zulassung,
BAES Neu ab 1.1.2016 Mag. Josefine Sinkovits BAES, stellvertretende Direktorin Leitung Rechtsdienst, Zulassung, Zertifizierung und Kommunikation Informationsveranstaltung - Pflanzenschutzmittel: Zulassung,
Inhaltsverzeichnis. Vorwort Einleitung 1
 Vorwort V Einleitung 1 Erster Teil: Unionsrecht als ursprüngliche Quelle gewebesicherheitsrechtlicher Vorschriften 3 I. Kompetenzfrage 3 A. Ist Art AEUV 152 EGV) eine taugliche Kompetenzgrundlage für die
Vorwort V Einleitung 1 Erster Teil: Unionsrecht als ursprüngliche Quelle gewebesicherheitsrechtlicher Vorschriften 3 I. Kompetenzfrage 3 A. Ist Art AEUV 152 EGV) eine taugliche Kompetenzgrundlage für die
Pharmazentralnummer (PZN): Funktion und Bedeutung
 Seite 1 von 6 Landesuntersuchungsamt Rheinland-Pfalz Institut für Lebensmittelchemie und Arzneimittelprüfung, Mainz Pharmazentralnummer (PZN): Funktion und Bedeutung Stand: 03/2009 Verfügbar unter: http://www.lua.rlp.de/navigation/downloads/
Seite 1 von 6 Landesuntersuchungsamt Rheinland-Pfalz Institut für Lebensmittelchemie und Arzneimittelprüfung, Mainz Pharmazentralnummer (PZN): Funktion und Bedeutung Stand: 03/2009 Verfügbar unter: http://www.lua.rlp.de/navigation/downloads/
Vorabinformation zur Inspektion der Guten Laborpraxis (GLP)
 Sehr geehrte Damen und Herren! Ihr Betrieb ist für eine Inspektion der Guten Laborpraxis (GLP) nach dem Arzneimittelgesetz (AMG) vorgemerkt. Zur Vorbereitung erhalten Sie diese Unterlagen, welche Ihren
Sehr geehrte Damen und Herren! Ihr Betrieb ist für eine Inspektion der Guten Laborpraxis (GLP) nach dem Arzneimittelgesetz (AMG) vorgemerkt. Zur Vorbereitung erhalten Sie diese Unterlagen, welche Ihren
BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH. Jahrgang 2013 Ausgegeben am 24. Juni 2013 Teil II
 1 von 6 BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH Jahrgang 2013 Ausgegeben am 24. Juni 2013 Teil II 179. Verordnung: Änderung der Arzneimittelbetriebsordnung 2009 [CELEX-Nr.: 32011L0062] 179. Verordnung
1 von 6 BUNDESGESETZBLATT FÜR DIE REPUBLIK ÖSTERREICH Jahrgang 2013 Ausgegeben am 24. Juni 2013 Teil II 179. Verordnung: Änderung der Arzneimittelbetriebsordnung 2009 [CELEX-Nr.: 32011L0062] 179. Verordnung
Risikoüberwachung von Arzneimitteln - Aktuelle Situation
 Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Risikoüberwachung von Arzneimitteln - Aktuelle Situation U. Hagemann Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Pharmakovigilanz Fortbildung für den Öffentlichen Dienst Berlin, 2. April
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017
 Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Curriculum Entwicklungspsychopharmakologie: Arzneimittel in der Kinder- und Jugendpsychiatrie, Ulm 2017 Welche Nebenwirkungen sollten gemeldet werden? Erläuterung und Diskussion anhand von Fallbeispielen
Umsetzung der risikoorientierten Fleischuntersuchung in Kleinbetrieben
 Umsetzung der risikoorientierten Fleischuntersuchung in Kleinbetrieben Erfassung der Befunddaten Gießen, den Ziel: Datenfluss Tierhalter Hoftierarzt LKI LMU Schlachthof Befunddaten Ergebnisse SU / FU Visuelle
Umsetzung der risikoorientierten Fleischuntersuchung in Kleinbetrieben Erfassung der Befunddaten Gießen, den Ziel: Datenfluss Tierhalter Hoftierarzt LKI LMU Schlachthof Befunddaten Ergebnisse SU / FU Visuelle
Begehungen des Landesamtes für soziale Dienste. Medizinprodukteaufbereitung
 Begehungen des Landesamtes für soziale Dienste Medizinprodukteaufbereitung 1. Organisation des Landesamtes 2. Organisation der Medizinprodukteüberwachung in SH 3. Grundlagen zur Begehung von Kliniken und
Begehungen des Landesamtes für soziale Dienste Medizinprodukteaufbereitung 1. Organisation des Landesamtes 2. Organisation der Medizinprodukteüberwachung in SH 3. Grundlagen zur Begehung von Kliniken und
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER. Prospan Hustenliquid Flüssigkeit zum Einnehmen Wirkstoff: Efeublättertrockenextrakt
 GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Prospan Hustenliquid Flüssigkeit zum Einnehmen Wirkstoff: Efeublättertrockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER Prospan Hustenliquid Flüssigkeit zum Einnehmen Wirkstoff: Efeublättertrockenextrakt Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie
Kapitel 8 Beanstandungen, Qualitätsmängel und Produktrückrufe
 Kapitel 8 Beanstandungen, Qualitätsmängel und Produktrückrufe Rechtsgrundlage zur Veröffentlichung des Leitfadens: Artikel 47 der Richtlinie 2001/83/EG zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel
Kapitel 8 Beanstandungen, Qualitätsmängel und Produktrückrufe Rechtsgrundlage zur Veröffentlichung des Leitfadens: Artikel 47 der Richtlinie 2001/83/EG zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel
Abgrenzung aus Sicht des BVL. Nahrungsergänzungsmittel und bilanzierte Diäten
 Abgrenzung aus Sicht des BVL Nahrungsergänzungsmittel und bilanzierte Diäten Aufgaben des Bundesamtes Nahrungsergänzungsmittel, bilanzierte Diäten Nationale Kontaktstelle für Anträge auf Zulassung neuartiger
Abgrenzung aus Sicht des BVL Nahrungsergänzungsmittel und bilanzierte Diäten Aufgaben des Bundesamtes Nahrungsergänzungsmittel, bilanzierte Diäten Nationale Kontaktstelle für Anträge auf Zulassung neuartiger
Verordnung des Bundesamtes für Sicherheit im Gesundheitswesen über den Gebührentarif gemäß GESG
 Verordnung des Bundesamtes für Sicherheit im Gesundheitswesen über den Gebührentarif gemäß GESG Auf Grund des 6a Abs. 6 des Gesundheits- und Ernährungssicherheitsgesetzes, BGBl. I Nr. 63/2002, zuletzt
Verordnung des Bundesamtes für Sicherheit im Gesundheitswesen über den Gebührentarif gemäß GESG Auf Grund des 6a Abs. 6 des Gesundheits- und Ernährungssicherheitsgesetzes, BGBl. I Nr. 63/2002, zuletzt
Arzneimittelfälschungen Realitäten zwischen illegalen Machenschaften und hoch regulierter Vertriebskette
 22. Februar 2012 Arzneimittelfälschungen Realitäten zwischen illegalen Machenschaften und hoch regulierter Vertriebskette Dr. Jan Oliver Huber 39. Gesundheitspolitisches Forum 22. Februar 2012 Verband
22. Februar 2012 Arzneimittelfälschungen Realitäten zwischen illegalen Machenschaften und hoch regulierter Vertriebskette Dr. Jan Oliver Huber 39. Gesundheitspolitisches Forum 22. Februar 2012 Verband
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Initialvorlesung WS 2011 / Schwerpunktthema: Industrielle Arzneimittelherstellung versus Individualherstellung 26. Oktober 2011 in Mainz
 Initialvorlesung WS 2011 / 2012 Schwerpunktthema: Industrielle Arzneimittelherstellung versus Individualherstellung in Mainz Folie 1 Mittelalter bis zum 19. Jahrhundert traditionelle Arzneimittelherstellung
Initialvorlesung WS 2011 / 2012 Schwerpunktthema: Industrielle Arzneimittelherstellung versus Individualherstellung in Mainz Folie 1 Mittelalter bis zum 19. Jahrhundert traditionelle Arzneimittelherstellung
R H I. R e g i o n a l e s H e i l m i t t e l i n s p e k t o r a t d e r N o r d w e s t s c h w e i z
 R H I R e g i o n a l e s H e i l m i t t e l i n s p e k t o r a t d e r N o r d w e s t s c h w e i z Checkliste zur Vorbereitung der Inspektion in Praxisapotheken von Ärzten und Ärztinnen 1. Einführungsgespräch
R H I R e g i o n a l e s H e i l m i t t e l i n s p e k t o r a t d e r N o r d w e s t s c h w e i z Checkliste zur Vorbereitung der Inspektion in Praxisapotheken von Ärzten und Ärztinnen 1. Einführungsgespräch
Arzneimittelfälschungen bekämpfen werden Patienten ausreichend geschützt?
 Arzneimittelfälschungen bekämpfen werden Patienten ausreichend geschützt? Berlin, 31.05.2011 Dr. Stephan Schwarze Counterfeit Protection Management, Bayer HealthCare Agenda Arzneimittelfälschungen bekämpfen
Arzneimittelfälschungen bekämpfen werden Patienten ausreichend geschützt? Berlin, 31.05.2011 Dr. Stephan Schwarze Counterfeit Protection Management, Bayer HealthCare Agenda Arzneimittelfälschungen bekämpfen
Gutachten des Abgrenzungsbeirates gem. 49a AMG zu active+med Magen-Darm-Pastillen
 Abgrenzungsbeirat beim Bundesministerium für Gesundheit Gutachten des Abgrenzungsbeirates gem. 49a AMG zu active+med Magen-Darm-Pastillen im Rahmen des Feststellungsverfahrens gem. 1 Abs. 3b in Verbindung
Abgrenzungsbeirat beim Bundesministerium für Gesundheit Gutachten des Abgrenzungsbeirates gem. 49a AMG zu active+med Magen-Darm-Pastillen im Rahmen des Feststellungsverfahrens gem. 1 Abs. 3b in Verbindung
Inhalt des Leitfadens. Wo wird der neue Leitfaden zu finden sein?
 NEU! LEITFADEN Klinische Prüfung von Medizinprodukten (MP) und Leistungsbewertungsprüfung von In-vitro-Diagnostika (IVD) Einreichung und Durchführung Dr. med. Violetta Zmuda AGES MEA, Institut Überwachung,
NEU! LEITFADEN Klinische Prüfung von Medizinprodukten (MP) und Leistungsbewertungsprüfung von In-vitro-Diagnostika (IVD) Einreichung und Durchführung Dr. med. Violetta Zmuda AGES MEA, Institut Überwachung,
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR)
 EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
EMPFEHLUNG DES PAUL-EHRLICH-INSITUTES ZUR VORLAGE VON PERIODISCHEN SICHERHEITSBERICHTEN (Periodic Safety Update Report - PSUR) IM ZUSAMMENHANG MIT BLUTKOMPONENTEN nach 63i Abs. 4 AMG Allgemeines: Durch
ARBEITSBOGEN 4: PRÜFUNG DER FERTIGARZNEIMITTEL UND APOTHEKENPFLICHTIGEN MEDIZIN- PRODUKTE
 I Hinweis zur Bearbeitung des Arbeitsbogens Überprüfen Sie ein Fertigarzneimittel (FAM) oder ein apothekenpflichtiges Medizinprodukt (MP) gemäß 12 Apothekenbetriebsordnung (ApBetrO). Grundlage des Arbeitsbogens
I Hinweis zur Bearbeitung des Arbeitsbogens Überprüfen Sie ein Fertigarzneimittel (FAM) oder ein apothekenpflichtiges Medizinprodukt (MP) gemäß 12 Apothekenbetriebsordnung (ApBetrO). Grundlage des Arbeitsbogens
Wie bereite ich mich auf ein Audit der ZSVA vor? Dr. sc. nat. Nicola Franscini, Abteilung Medizinprodukte, Swissmedic
 Wie bereite ich mich auf ein Audit der ZSVA vor? Dr. sc. nat. Nicola Franscini, Abteilung Medizinprodukte, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern 9 www.swissmedic.ch
Wie bereite ich mich auf ein Audit der ZSVA vor? Dr. sc. nat. Nicola Franscini, Abteilung Medizinprodukte, Swissmedic Swissmedic Schweizerisches Heilmittelinstitut Hallerstrasse 7 CH-3000 Bern 9 www.swissmedic.ch
Hochwertige Markenmedikamente müssen nicht teuer sein
 Hochwertige Markenmedikamente müssen nicht teuer sein So günstig? Das gleiche Medikament?! Ja. Import-Arzneimittel sind preiswert und sicher. Das gleiche Medikament importiert bis zu 30 % günstiger. Das
Hochwertige Markenmedikamente müssen nicht teuer sein So günstig? Das gleiche Medikament?! Ja. Import-Arzneimittel sind preiswert und sicher. Das gleiche Medikament importiert bis zu 30 % günstiger. Das
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation. Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group
 Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Klinische Prüfung: Planung, Verantwortlichkeiten und Organisation Michael Fuchs Leiter der Studienzentrale der German Hodgkin Study Group Hämatologie im Wandel, Frankfurt 28. Februar 2015 2 Überblick Einführung
Die Suchtmittel- Nachweismeldungen
 Die Suchtmittel- Nachweismeldungen Stand: Berichtsjahr 2016 Mag. (FH) Andrea Ungersbäck Abteilung GMDP, Institut Überwachung RECHTSGRUNDLAGEN I Welche gesetzlichen Aufgaben hat das BASG? 6a. (1) GESG:
Die Suchtmittel- Nachweismeldungen Stand: Berichtsjahr 2016 Mag. (FH) Andrea Ungersbäck Abteilung GMDP, Institut Überwachung RECHTSGRUNDLAGEN I Welche gesetzlichen Aufgaben hat das BASG? 6a. (1) GESG:
I N F O R M A T I O N
 I N F O R M A T I O N zur Pressekonferenz mit Landesrat Rudi Anschober am 29. Juli 2011 zum Thema "Vorschläge für mehr Biss für den Konsument/innenschutz Durch mehr Transparenz und mehr Macht für die Konsument/innen"
I N F O R M A T I O N zur Pressekonferenz mit Landesrat Rudi Anschober am 29. Juli 2011 zum Thema "Vorschläge für mehr Biss für den Konsument/innenschutz Durch mehr Transparenz und mehr Macht für die Konsument/innen"
Risikomanagement. Schaden
 management Eine sehr kurze Einführung 1 Physische Verletzung oder Schädigung der Gesundheit von Menschen oder Schädigung von Gütern oder der Umwelt 2 1 Gefährdung und Gefährdungssituation Gefährdung potentielle
management Eine sehr kurze Einführung 1 Physische Verletzung oder Schädigung der Gesundheit von Menschen oder Schädigung von Gütern oder der Umwelt 2 1 Gefährdung und Gefährdungssituation Gefährdung potentielle
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm
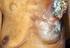 Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Erivedge (Vismodegib): Wichtige Informationen für die sichere Anwendung, einschließlich Informationen zum Schwangerschaftsverhütungs-Programm Sehr geehrte Frau Doktor, sehr geehrter Herr Doktor, Dieses
Datum: Kontakt: Abteilung: Tel. / Fax: Unser Zeichen: Ihr Zeichen:
 BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
BASG / AGES Institut LCM Traisengasse 5, A-1200 Wien Datum: Kontakt: Abteilung: Tel. / Fax: E-Mail: Unser Zeichen: Ihr Zeichen: 25.06.2015 Mag. pharm. Dr. Ulrike Rehberger REGA +43 (0) 505 55 36258 pv-implementation@ages.at
Führen einer tierärztlichen Hausapotheke in der Kleintierpraxis
 Führen einer tierärztlichen Hausapotheke in der Kleintierpraxis Dr. Anke Litwicki, Dr. Nadine Werth Inhaltsübersicht A Gesetzliche Grundlagen B Allgemeines Verfahren (Ablauf einer Kontrolle) C Schwerpunkte
Führen einer tierärztlichen Hausapotheke in der Kleintierpraxis Dr. Anke Litwicki, Dr. Nadine Werth Inhaltsübersicht A Gesetzliche Grundlagen B Allgemeines Verfahren (Ablauf einer Kontrolle) C Schwerpunkte
Verordnung des Bundesamtes für Sicherheit im Gesundheitswesen über den Gebührentarif gemäß GESG
 Verordnung des Bundesamtes für Sicherheit im Gesundheitswesen über den Gebührentarif gemäß GESG Auf Grund des 6a Abs. 6 des Gesundheits- und Ernährungssicherheitsgesetzes, BGBl. I Nr. 63/2002, zuletzt
Verordnung des Bundesamtes für Sicherheit im Gesundheitswesen über den Gebührentarif gemäß GESG Auf Grund des 6a Abs. 6 des Gesundheits- und Ernährungssicherheitsgesetzes, BGBl. I Nr. 63/2002, zuletzt
Prüfung und Lagerung der Ausgangsstoffe
 Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Stand der Revision: 21.04.2009 Inhaltsübersicht I II III IV V Zweckbestimmung und Geltungsbereich Regulatorische Anforderungen Zuständigkeiten
Leitlinie der Bundesapothekerkammer zur Qualitätssicherung Stand der Revision: 21.04.2009 Inhaltsübersicht I II III IV V Zweckbestimmung und Geltungsbereich Regulatorische Anforderungen Zuständigkeiten
(zusätzlich Avastin und MabThera)
 BASG / AGES Institut Überwachung Traisengasse 5, 1200 Wien, Österreich (BITTE DEN BEIGEFÜGTEN TEXT UNVERÄNDERT WEITERSENDEN!) DRINGEND! Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische
BASG / AGES Institut Überwachung Traisengasse 5, 1200 Wien, Österreich (BITTE DEN BEIGEFÜGTEN TEXT UNVERÄNDERT WEITERSENDEN!) DRINGEND! Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische
TÜV SÜD Industrie Service GmbH
 Chemikalienrecht, REACH, GHS aktueller Stand TÜV SÜD Industrie Service GmbH Martin Albert, Dr. Dieter Reiml Immissionsschutz und Umwelt aktuell, München, 13.10.2009 Programm Spezielle Themen Aktuelles
Chemikalienrecht, REACH, GHS aktueller Stand TÜV SÜD Industrie Service GmbH Martin Albert, Dr. Dieter Reiml Immissionsschutz und Umwelt aktuell, München, 13.10.2009 Programm Spezielle Themen Aktuelles
Gesamte Rechtsvorschrift für Arzneimittel aus menschlichem Blut, Fassung vom
 Gesamte Rechtsvorschrift für Arzneimittel aus menschlichem Blut, Fassung vom 02.04.2015 Langtitel Verordnung der Bundesministerin für Gesundheit und Frauen betreffend Arzneimittel aus menschlichem Blut
Gesamte Rechtsvorschrift für Arzneimittel aus menschlichem Blut, Fassung vom 02.04.2015 Langtitel Verordnung der Bundesministerin für Gesundheit und Frauen betreffend Arzneimittel aus menschlichem Blut
vom 6. September 2011
 812.103.1 Liechtensteinisches Landesgesetzblatt Jahrgang 2011 Nr. 439 ausgegeben am 13. September 2011 Verordnung vom 6. September 2011 über den Verkehr mit Arzneimitteln sowie den Umgang mit menschlichen
812.103.1 Liechtensteinisches Landesgesetzblatt Jahrgang 2011 Nr. 439 ausgegeben am 13. September 2011 Verordnung vom 6. September 2011 über den Verkehr mit Arzneimitteln sowie den Umgang mit menschlichen
DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE
 DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE 1 Mara Ernst Referentin Arzneimittelsicherheit Bundesverband der Arzneimittel-Hersteller 2. März 2016 BEHÖRDLICHE VORGABEN Bekanntmachung
DAS PERFEKTE SCHULUNGSMATERIAL AUS SICHT DER PHARMAZEUTISCHEN INDUSTRIE 1 Mara Ernst Referentin Arzneimittelsicherheit Bundesverband der Arzneimittel-Hersteller 2. März 2016 BEHÖRDLICHE VORGABEN Bekanntmachung
Die Wirtschaftskammer Österreich dankt für die Übermittlung des im Betreff genannten Entwurfes und nimmt hiezu wie folgt Stellung.
 Bundesministerium für soziale Sicherheit und Generationen Sektion VIII Radetzkystraße 2 1030 Wien Wiedner Hauptstraße 63 1045 Wien Telefon 01/50 105 DW Telefax 01/50 105 DW 5037 Internet: http://wko.at
Bundesministerium für soziale Sicherheit und Generationen Sektion VIII Radetzkystraße 2 1030 Wien Wiedner Hauptstraße 63 1045 Wien Telefon 01/50 105 DW Telefax 01/50 105 DW 5037 Internet: http://wko.at
Mit den Apotheken auf der sicheren Seite
 Mag. pharm. Wellan Max Mit den Apotheken auf der sicheren Seite INFORMATIONSKAMPAGNE GEGEN ARZNEIMITTELFÄLSCHUNGEN Immer öfter fallen User im Internet auf dubiose Online-Medikamentenshops mit vermeintlich
Mag. pharm. Wellan Max Mit den Apotheken auf der sicheren Seite INFORMATIONSKAMPAGNE GEGEN ARZNEIMITTELFÄLSCHUNGEN Immer öfter fallen User im Internet auf dubiose Online-Medikamentenshops mit vermeintlich
Kombinationsprodukte im Kontext der Revision der RL 93/42/EWG. Tamara Bauer
 Kombinationsprodukte im Kontext der Revision der RL 93/42/EWG Tamara Bauer Inhalt Definitionen Richtlinien Kombinationsprodukte 2 Fallbeispiele: Medizinprodukt/Arzneimittel Medizinprodukt/Arzneimittel
Kombinationsprodukte im Kontext der Revision der RL 93/42/EWG Tamara Bauer Inhalt Definitionen Richtlinien Kombinationsprodukte 2 Fallbeispiele: Medizinprodukt/Arzneimittel Medizinprodukt/Arzneimittel
Gebrauchsinformation: Information für Patienten. Graphites D 12, Jodum D 15, Petroleum rectificatum D 12, Thallium sulfuricum.
 Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Tropfen gegen Haarausfall und brüchige Nägel Similasan 1 Gebrauchsinformation: Information für Patienten Tropfen gegen Haarausfall und brüchige Nägel Similasan Graphites D 12, Jodum D 15, Petroleum rectificatum
Überwachung des Einzelhandels mit freiverkäuflichen Arzneimitteln. Oberste Landesbehörde Inspektorat Zuständige Überwachungsbehörde
 Seite 1 von 6 Geltungsbereich Oberste Landesbehörde Inspektorat Zuständige Überwachungsbehörde Schlüsselwörter Besichtigung; Einzelhandel; freiverkäufliche Arzneimittel Querverweise 071111; 071121; 071123;
Seite 1 von 6 Geltungsbereich Oberste Landesbehörde Inspektorat Zuständige Überwachungsbehörde Schlüsselwörter Besichtigung; Einzelhandel; freiverkäufliche Arzneimittel Querverweise 071111; 071121; 071123;
Abgrenzungsbeirat beim Bundesministerium für Gesundheit, Familie und Jugend
 Abgrenzungsbeirat beim Bundesministerium für Gesundheit, Familie und Jugend Gutachten des Abgrenzungsbeirates gem. 49a AMG zu active+med Halstabletten Zitrone im Rahmen der Beratung der Bundesministerin
Abgrenzungsbeirat beim Bundesministerium für Gesundheit, Familie und Jugend Gutachten des Abgrenzungsbeirates gem. 49a AMG zu active+med Halstabletten Zitrone im Rahmen der Beratung der Bundesministerin
SWV - santésuisse Wirtschaftlichkeitsverfahren bei Arztpraxen
 SWV - santésuisse Wirtschaftlichkeitsverfahren bei Arztpraxen Vorgehensweise von santésuisse bei den Wirtschaftlichkeitsverfahren Juerg B. Reust Leiter Ambulante Versorgung Workshop Zürich 6. November
SWV - santésuisse Wirtschaftlichkeitsverfahren bei Arztpraxen Vorgehensweise von santésuisse bei den Wirtschaftlichkeitsverfahren Juerg B. Reust Leiter Ambulante Versorgung Workshop Zürich 6. November
