Aus der Frauenklinik am Marienhospital Herne -Universitätsklinikder Ruhr-Universität Bochum Direktor: Prof. Dr. med.
|
|
|
- Leon Arnold
- vor 2 Jahren
- Abrufe
Transkript
1 Aus der Frauenklinik am Marienhospital Herne -Universitätsklinikder Ruhr-Universität Bochum Direktor: Prof. Dr. med. Clemens Tempfer Prospektive Studie über die Behandlung von Frauen mit rezidiviertem Platinum-resistenten Ovarialkarzinom mittels Pressurized IntraPeritoneal Aerosol Chemotherapy (PIPAC) mit Cisplatin und Doxorubicin Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Mariele Zielonka aus Herne 2016
2 Dekan: Prof. Dr. med. Albrecht Bufe Referent: Prof. Dr. med. Clemens Tempfer Korreferent: Prof. Dr. med. Arne W.O. Jensen Tag der mündlichen Prüfung:
3 Abstract Mariele Zielonka Prospektive Studie über die Behandlung von Frauen mit rezidiviertem Platinumresistenten Ovarialkarzinom mittels PressurizedIntraPeritoneal Aerosol Chemotherapy (PIPAC) mit Cisplatin und Doxorubicin Problem: Das Ovarialkarzinom hat die höchste Letalitätsrate aller gynäkologischen Malignome, wird aufgrund fehlender effektiver Screeningmethoden erst in späten Stadien diagnostiziert und rezidiviert auch nach erfolgreicher First-Line-Therapie häufig. Das rezidivierte Ovarialkarzinom kann als chronische Erkrankung angesehen werden, deren Therapie vordergründig eine Kontrolle der Symptome, ein Erhalt oder eine Verbesserung der Lebensqualität und eine Stabilisierung der Tumorprogression bieten sollte. Methode: In dieser offenen, einarmigen Phase-2-Studie erhielten die Patientinnen drei Zyklen PIPAC-Therapie im Abstand von 28 bis 42 Tagen. Nach laparoskopischer Insufflation von 12 mmhg CO 2 wurde Cisplatin (7,5 mg/m 2 Körperoberfläche) und Doxorubicin (1,5 mg/m 2 Körperoberfläche) als Aerosol in das Pneumoperitoneum appliziert und für 30 Minuten bei 37 C belassen. Als primärer Endpunkt der Studie gilt das objektive Tumoransprechen, gemäß den RECIST Kriterien Version 1.1 am Ende des dritten Behandlungszyklus. Sekundäre Endpunkte stellen die histologische Tumorregression, Verbesserung des PCI und der Einfluss auf die mittels EORTC QLQ- C30 Fragebogen erhobene Lebensqualität dar. Die Nebenwirkungen wurden mittels CTCAE, Version 4.0, eingeteilt. Bei jedem Zyklus wurden CRP, Kreatinin, Phosphat und CA-125 vor und nach der Laparoskopie erhoben. Ergebnis: 64 Patientinnen wurden in die Studie eingeschlossen. Bei 11/64 Patientinnen (17 %) war der laparoskopische Zugang nicht möglich. 53/64 Patientinnen erhielten zumindest einen Zyklus der Studienmedikation (ITT Population). Bei 33/53 Patientinnen konnte ein objektives Tumoransprechen nachgewiesen werden. Drei Patientinnen zeigten ein partielles Ansprechen und 30 Patientinnen wiesen einen stabilen Krankheitsverlauf auf. Bei 26/34 (76%) Patientinnen, die alle drei PIPAC- Zyklen durchlaufen hatten, zeigte sich eine histologische Tumorregression und eine Verbesserung des PCI. Die Parameter Serum CA-125, CRP und Phosphat zeigten keine
4 statistisch signifikanten Veränderungen. Der Kreatinin-Wert stieg von der ersten bis zur dritten PIPAC leicht an (1.PIPAC: 0, PIPAC: ). Es traten keine behandlungsbezogenen Todesfälle auf. Ein Toxizitäts-Grad 4 nach den Kriterien des CTCAE konnte nicht beobachtet werden. Folgende Grad-3-Toxizitäten traten während der PIPAC-Zyklen auf: Trokar-Hernie (n=2), Darmobstruktion (n=2), abdominale Schmerzen (n=2), Hämatome (n=1), intraoperative Blutungen (n=1), Zystitis mit Urosepsis (n=1). Die Lebensqualität insgesamt und hinsichtlich der EORTC QLQ-C30 Bewertungsskalen Nausea/Erbrechen, Appetitlosigkeit, Diarrhö, Obstipation, Müdigkeit/Schlaflosigkeit verbesserten sich kontinuierlich. Diskussion: Die PIPAC-Therapie bewirkt ein objektives Tumoransprechen und eine histologische Tumorregression mit einer akzeptablen lokalen und systemischen Toxizität. Die Lebensqualität der Patientinnen wird hinsichtlich der global-physischen Gesundheit, Nausea/Erbrechen, Appetitlosigkeit, Diarrhö, Obstipation, Müdigkeit und physischer, kognitiver und emotionaler Befindlichkeit verbessert. Übliche Nebenwirkungen systemischer Chemotherapien (Alopezie, Neurotoxizität, Nausea, Myelosuppression) treten nicht auf. Die Kreatinin-Veränderungen und der mögliche Einfluss auf die Nierenfunktion sowie der generelle Nutzen und die Langzeitfolgen sollten in weiteren Studien genauer untersucht werden.
5 Inhaltsverzeichnis 1. Einleitung Das Ovarialkarzinom Epidemiologie Ätiologie und Risikofaktoren Klassifikation Histologie Pathogenese Stadieneinteilung (Staging) Diagnostik Frühdiagnostik und Screening Bildgebende Verfahren Therapie Operative Therapie First-Line-Chemotherapie Intraperitoneale Chemotherapie (IPC) Neoadjuvante Chemotherapie Rezidivtherapie Operative Rezidivtherapie Second-Line-Chemotherapie Radiatio Zielsetzung Material und Methoden Studiendesign Ein- und Ausschlusskriterien Karnofsky-Index und Performance-Status Prozeduren Erhebung des Peritoneal Cancer Index (PCI) Weitere Prozeduren EORTC QLQ-C Statistische Analyse Ergebnisse Patientinnen-Charakteristika 52 1
6 4.2 Tumoransprechen PCI-Veränderungen unter PIPAC Laborchemische Veränderung unter PIPAC Einfluss auf das Überleben Nebenwirkungen Einfluss auf die Lebensqualität Erklärung zum Eigenanteil an der Dissertationsschrift Diskussion Zusammenfassung Literaturverzeichnis 91 2
7 Abkürzungsverzeichnis A ADL AGO Activities of Daily Living Arbeitsgemeinschaft Gynäkologische Onkologie B BfArM Bundesinstitut für Arzneimittel und Medizinprodukte BRCA 1 Breast Cancer 1 BRCA 2 Breast Cancer 2 C CA-125 Cancer-Antigen 125 CBR Clinical Benefit Rate CRS Zytoreduktive Chirurgie CRP C-reaktives Protein CT Computertomografie CTCAE Common Terminology Criteria for Adverse Events D DNA Desoxyribonukleinsäure E ECOG Eastern Cooperative Oncology Group F FIGO FSH Fédération Internationale de Gynécologie et d'obstétrique Follikelstimulierendes Hormon G GOG Gynecologic Oncology Group H HE-Färbung HIPEC HNPCC Hämatoxylin-Eosin-Färbung Hypertherme intraperitoneale Chemotherapie hereditäres non-polypöses kolorektales Karzinom 3
8 HR Hazard-Ratio I IPC ITT intraperitoneale Chemotherapie Intention-to-treat L LH Luteinisierendes Hormon M MMS-Gruppe MRT ml multimodale Screening-Gruppe Magnetresonanztomografie Milliliter N NaCl Natriumchlorid P PC PCI PET PFS PID PIPAC PLCO PLD PP Peritonealkarzinose Peritoneal Cancer Index Positronen-Emissions-Tomografie progressionsfreies Überleben Pelvic inflammatory disease Pressurized IntraPeritoneal Aerosol Chemotherapy The Prostate, Lung, Colorectal and Ovarian pegyliertes liposomales Doxorubicin per-protocol R RKI RECIST Robert Koch-Institut Response Evaluation Criteria in Solid Tumors S SD Standardabweichung 4
9 T TVS transvaginale Sonographie U UKCTOCS USS-Gruppe United Kingdom Collaborative Trial of Ovarian Cancer Screening Ultraschall-Gruppe V VEGF Vaskulär-endothelialer Wachstumsfaktor W WHO Weltgesundheitsorganisation 5
10 Abbildungsverzeichnis Abbildung 1 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines papillär serösen Ovarialkarzinoms (Eisenhauer et al., 2012) 15 Abbildung 2 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines muzinösen Ovarialkarzinoms (Eisenhauer et al., 2012) 16 Abbildung 3 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines endometrioiden Ovarialkarzinoms (Eisenhauer et al., 2012) 17 Abbildung 4 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines klarzelligen Ovarialkarzinoms (Eisenhauer et al., 2012) 18 Abbildung 5 Anatomische Landmarken des Peritoneal Cancer Index (PCI) (Begossi et al., 2002) 46 Abbildung 6 EORTC QLQ-C30 Fragebogen (Version 3.0.) 51 Abbildung 7 Intraoperativer (a1, a2, a3) und histologischer (b1, b2, b3) Befund vor der ersten, zweiten und dritten PIPAC 57 Abbildung 8 Kaplan-Meier Gesamtüberlebenskurve von 53 Patientinnen, die mindestens eine PIPAC-Therapie erhalten haben (intention-to-treat-population) 60 Abbildung 9 Kaplan-Meier Gesamtüberlebenskurve von 34 Patientinnen, die alle drei PIPAC-Zyklen durchlaufen haben (per-protocol-population) 61 Abbildung 10 Progressionsfreies Überleben (nach Kaplan-Meier) der intention-to-treat- Population von 53 Patientinnen, die mindestens eine PIPAC-Therapie erhalten haben 62 Abbildung 11 Progressionsfreies Überleben (nach Kaplan-Meier) der per-protocol- Population von 34 Patientinnen, die alle drei PIPAC-Zyklen erhalten haben 63 Abbildung 12 Lebensqualität Skalen insgesamt gemäß den Punkten aus dem EORTC QLQ-C30 Fragebogen während der PIPAC-Zyklen 1 bis 3 67 Abbildung 13 Gastrointestinale Symptome gemäß den Punkten aus dem EORTC QLQ- C30 Fragebogen während der PIPAC-Zyklen 1 bis 3 68 Abbildung 14 Skalen zu Physis, Rollenerleben, Emotionen, kognitiven Fähigkeiten und sozialen Qualitäten gemäß den Punkten aus dem EORTC QLQ-C30 Fragebogen während der PIPAC-Zyklen 1 bis 3 69 Abbildung 15 Skalen zu Schmerzen, Müdigkeit, Dyspnoe und Schlaflosigkeit gemäß den Punkten aus dem EORTC QLQ-C30 Fragebogen während der PIPAC-Zyklen 1 bis
11 Tabellenverzeichnis Tabelle 1 Risikofaktoren und protektive Faktoren für die Entstehung eines Ovarialkarzinoms 11 Tabelle 2 Subtypen des epithelialen Ovarialkarzinoms und ihre Eigenschaften 14 Tabelle 3 Einteilung der Ovarialtumore anhand der TNM- und FIGO-Klassifikation (Prat, 2014) 20 Tabelle 4 Rezidivierende Symptome bei Ovarialkarzinom und deren Häufigkeit (Goff et al., 2004) 23 Tabelle 5 Odds Ratio für Symptome bei Ovarialkarzinom (Goff et al., 2004) 23 Tabelle 6 Bildgebende Verfahren und ihre Indikation bei Ovarialkarzinom (Fischerova und Burgetova, 2014) 27 Tabelle 7 Karnofsky-Index (Karnofsky und Burchenal, 1949) 44 Tabelle 8 Läsionsgröße und die entsprechende Gradeinteilung des Peritoneal Cancer Index (PCI) 47 Tabelle 9 Patientinnen-Charakteristika von 53 Frauen mit rezidiviertem Platinumresistenten Ovarial-, Tuben- oder primärem Peritonealkarzinom, die eine PIPAC erhalten haben 53 Tabelle 10 Histologische Beurteilung der Tumorregression bei 53 Patientinnen mit rezidiviertem Platinum-resistenten Ovarial-, Tuben- oder primären Peritonealkarzinom, die eine PIPAC erhalten haben 56 Tabelle 11 Direkter Vergleich der Mittelwerte, Standardabweichungen und P-Werte von CA-125, CRP, Phosphat und Kreatinin zum Zeitpunkt des ersten und dritten PIPAC-Zyklus (Werte gerundet) 58 Tabelle 12 Definition der Schweregrade der CTCAE-Grade (Common Terminology Criteria for Adverse Events (CTCAE) version 4.0, 2009) 64 Tabelle 13 Akute und chronische Nebenwirkungen bei 53 Patientinnen, die eine PIPAC-Therapie erhalten haben 65 7
12 1. Einleitung 1.1. Das Ovarialkarzinom Epidemiologie Das epitheliale Ovarialkarzinom (Eierstockkrebs) ist die sechsthäufigste Krebserkrankung der Frau in Industrieländern und hat die höchste Letalitätsrate aller gynäkologischen Malignome (Schüler et. al., 2013). Durchschnittlich erkrankt eine von 68 Frauen im Laufe ihres Lebens am Ovarialkarzinom (RKI 2013). Damit ist das Risiko, an Ovarialkarzinom zu erkranken, mit einem Lebenszeit-Risiko von 1,7 % im Vergleich zu anderen Krebserkrankungen wie Brust- oder Prostatakrebs eher selten. Unterschiedlich ist die Inzidenz in Entwicklungsländern im Vergleich zu Industrieländern. In Entwicklungsländern lag die altersstandardisierte Inzidenz im Jahre 2008 bei 5,0 und die Mortalitätsrate (pro Frauen) bei 3,1, während in den Industrieländern die Inzidenz des Ovarialkarzinoms bei 9,4 und die Mortalität bei 5,1 lag (American Cancer Society, 2011). Die höchste Inzidenz tritt in Europa, den USA und Israel auf, die niedrigste in Japan und den Entwicklungsländern (Hennessy et al., 2009). Gerade in fortschrittlichen und gut entwickelten Ländern kommt es zum vermehrten Auftreten des Ovarialkarzinoms. In Deutschland sind 3,5 % aller bösartigen Neubildungen und 5,6 % aller Krebssterbefälle bei Frauen durch das Ovarialkarzinom bedingt (RKI, 2013). Die Neuerkrankungsrate im Jahre 2010 lag bei Frauen, die rohe Erkrankungsrate bei 18,7 Erkrankungsfällen je Personen (RKI, 2013). Altersstandardisiert nach der alten Europabevölkerung erkrankten 2010 in Deutschland 12,1 Frauen an Eierstockkrebs. Das mittlere Erkrankungsalter lag in den Jahren 2009 und 2010 bei 69 Jahren (RKI, 2013). Im Jahre 2009 starben Patientinnen am Ovarialkarzinom, 2010 gab es einen leichten Rückgang der Sterbefälle auf (RKI, 2013). Bedingt durch die oft erst im späten Krankheitsstadium gestellte Diagnose lag die relative 5-Jahres-Überlebensrate in den Jahren 2009 bis 2010 bei nur 42 % (RKI, 2013). Das Robert-Koch-Institut proklamiert, dass die Erkrankungs- und Sterberaten sowie die absoluten Fallzahlen seit der Jahrtausendwende rückläufig gewesen seien. So lag die Erkrankungsrate 1998 noch bei ca. 15 Frauen je , während sie 2010 bei 12,1 8
13 Frauen je lag. Die Sterbefälle reduzierten sich ebenfalls von 9 Frauen je im Jahre 1998 auf 7,5 Frauen je im Jahre 2010 (RKI, 2013) Ätiologie und Risikofaktoren Die Entstehung des Ovarialkarzinoms ist bis heute nicht vollständig geklärt. Es werden drei Theorien zur Entstehung der Ovarialkarzinome unterschieden, wobei durchaus Interferenzen zwischen diesen bestehen. Die erste Theorie zur Entstehung des Ovarialkarzinoms ist die sogenannte incessant ovulation, die Hyperovulationshypothese. Bei dieser Hypothese geht man davon aus, dass es durch die wiederholten Läsionen des Oberflächenepithels des Ovars durch die Ovulation und der daraus resultierenden postovulatorischen Zell-Proliferation zu einer schrittweisen Anhäufung genetischer Abnormitäten mit Inaktivierung von Tumorsuppressorgenen kommt (Hennessy et al., 2009; von Georgi und Münstedt, 2002). Die dadurch entstehenden Zysten könnten das Risiko einer karzinogenen Entwicklung begünstigen, indem sie z. B. über Wachstumsfaktoren, Phospholipide oder VEGF stimuliert werden und somit intrazelluläre Kinaseaktivierende Prozesse beeinflussen (Hennessy et al., 2009). Bei der Hyperovulationshypothese werden eine frühe Menarche und eine späte Menopause als Risikofaktoren für das Ovarialkarzinom suggeriert sowie die Einnahme ovulationsfördernder Mittel (von Georgi und Münstedt, 2002). Man geht davon aus, dass eine verminderte Anzahl an Ovulationen, durch z. B. Schwangerschaften oder Verwendung von oralen Kontrazeptiva, das Risiko für die Entstehung eines Ovarialkarzinoms reduziert (Koshiyama et al., 2014; Hankinson et al., 1993). Ebenfalls ein vermindertes Risiko, an Ovarialkarzinom zu erkranken, besteht bei der Tubenligatur (Hankinson et al., 1993). Die zweite Theorie ist die Gonadotropinhypothese. Sie geht davon aus, dass die monatlichen Gonadotropin-Anstiege während der Ovulation und die hohen Spiegel dieser Hormone in der Menopause die Epithelzellen des Ovars stimulieren, wodurch es, wie auch bei der ersten Hypothese, zu einem vermehrten Auftreten genetischer Fehler und somit zu einer möglichen karzinogenen Entwicklung kommen kann (Hennessy et al., 2009). Mit dieser Theorie ließe sich auch die Annahme erklären, dass mit zunehmendem Alter das Risiko an Ovarialkarzinom zu erkranken, steigt, da gerade vor und nach der Menopause die FSH und LH Konzentrationen erhöht sind (von Georgi und Münstedt, 2002). 9
14 Die Entzündungshypothese zählt zur dritten Theorie der Entstehung des Ovarialkarzinoms. Hier wird angenommen, dass die durch Entzündungen im Becken und Bauchraum freigesetzten Radikale die Reparaturvorgänge nach der Ovulation beeinflussen und das Risiko einer Karzinomentstehung erhöhen (Hennessy et al., 2009). Dafür spricht die Assoziation von Ovarialkarzinom mit Asbest-Exposition, Endometriose, Pelvic inflammatory disease (PID) und Mumps sowie die Risikoreduktion durch Einnahme von nicht-steroidalen Antiphlogistika (Hennessy et al., 2009). Von Georgi und Münstedt fanden heraus, dass die Entzündungen zu Gewebeschädigungen und Mutationen von Tumorsupressorgenen führten, eine vermehrte Zellteilung induzierten sowie die Wahrscheinlichkeiten von Fehlern in der DNA-Replikation und Reparatur erhöhten (von Georgi und Münstedt, 2002). Als wichtigste Risikofaktoren für die Entstehung eines Ovarialkarzinoms gelten eine familiäre Häufung von Brustkrebs oder Eierstockkrebs sowie eine genetische Disposition. Bei 10 bis 15 % der erkrankten Patientinnen finden sich Mutationen des BRCA1 und BRCA2 Gens (Hennessy et al., 2009). Das Risiko gesunder Frauen, mit einer Mutation im BRCA1- oder BRCA2-Gen an Ovarialkarzinom zu erkranken, beträgt 11 bis 40 % (Petrucelli et al., 2013). Bei einer isolierten Mutation im BRCA1-Gen beträgt das Risiko 24 bis 40 %. Bei einer Mutation im BRCA2-Gen ist das Risiko, an Ovarialkarzinom zu erkranken, mit 11 bis 18 % geringer (Petrucelli et al., 2013). Bei Patientinnen mit positiver Familienanamnese kann eine Bestimmung des BRCA1- und BRCA2-Gens und eine genetische Beratung hilfreich sein. So kann das individuelle Risiko besser abgeschätzt werden und mögliche präventive Maßnahmen, wie chirurgische Interventionen oder engmaschige Vorsorgeuntersuchungen, geplant werden. Durch eine präventive Salpingo-Oophorektomie kann das Risiko, an Ovarialkrebs zu erkranken, um ca. 95 % gesenkt werden, und auch das Auftreten einer Peritonealkarzinose nach der Resektion ist sehr gering (Rhiem et al., 2010). In den aktuellen Leitlinien wird die bilaterale Salpingo-Oophorektomie bei Patientinnen mit nachgewiesener BRCA1/2-Mutation und abgeschlossener Familienplanung mit über 40 Jahren oder 5 Jahre vor der jüngsten in der Familie an Ovarialkarzinom Erkrankten empfohlen (Leitlinienprogramm Onkologie, 2013). Unerlässlich bei der genetischen Beratung ist eine sorgfältige psychologische und therapeutische Betreuung der Betroffenen. Die Patientin sollte schon vor der Untersuchung über mögliche Befundergebnisse aufgeklärt und die daraus resultierenden eventuellen Konsequenzen besprochen worden sein. 10
15 Auch das hereditäre non-polypöse kolorektale Karzinom (HNPCC) geht mit einer erhöhten Wahrscheinlichkeit für ein Ovarialkarzinom einher. Bei dieser Erkrankung kommt es zu Mutationen von DNA-Abschnitten, die für Reparaturproteine codieren. So kommt es zu einer Anhäufung von Mutationen, die nicht mehr repariert werden können und karzinogenes Potenzial entwickeln. Liegt ein HNPCC vor, so liegt das Risiko dieser Frauen bei 12 %, ein Ovarialkarzinom zu entwickeln (Bandera, 2005). Als protektiver Faktor bei der Entstehung eines ovariellen Karzinoms wird dagegen die Einnahme oraler Kontrazeptiva angesehen. Eine epidemiologische Studie aus dem Jahre 2008 fand heraus, dass sich das Risiko, an Ovarialkarzinom zu erkranken, umso mehr reduzierte, je länger Frauen orale Kontrazeptiva einnahmen (Collaborative Group on Epidemiological Studies of Ovarian Cancer, 2008). Tabelle 1 zeigt eine Zusammenfassung der Risikofaktoren und protektiven Faktoren. Tabelle 1 Risikofaktoren und protektive Faktoren für die Entstehung eines Ovarialkarzinoms Risikofaktor Familiäre Disposition HNPCC BRCA1-, BRCA2-Mutationen Entzündungen Asbest Exposition Protektive Faktoren Einnahme oraler Kontrazeptiva Schwangerschaften Salpingo-Oophorektomie Einnahme nicht-steroidaler Antiphlogistika Tubenligatur Menopause Alter Einnahme ovulationsfördernder Mittel Endometriose Mumps Pelvic inflammatory disease 11
16 1.1.3 Klassifikation Ovarialkarzinome lassen sich nach ihrem Ursprungsgewebe in drei Kategorien unterteilen: Epitheliale Tumoren, Keimstrang-Stroma-Tumoren und Keimzell-Tumoren (Chen et al., 2003). Jede dieser Tumorarten beinhaltet zahlreiche Subtypen. Auch aus unterschiedlichen Subtypen gemischte Tumoren kommen gelegentlich vor (Chen et al., 2003). Zu den epithelialen Ovarialkarzinomen zählen seröse, muzinöse, klarzellige Tumoren sowie Endometrioide, Brenner-Tumoren, Adenokarzinome und undifferenzierte Karzinome. Die epithelialen Tumoren machen ca. 90 % aller Ovarialkarzinome aus und betreffen meist Frauen im mittleren oder hohen Alter (Chen et al., 2003). Zu den Keimstrang-Stroma-Tumoren gehören vorrangig mesenchymale und mesonephrische Tumoren, wie Thekome, Granulosazelltumore, Fibrome, Sertoli-Zell- Tumoren sowie Sertoli-Leydig-Zell-Tumoren und Steroid-Zell-Tumoren (Chen et al., 2003). Mit einer Häufigkeit von 7 % aller malignen Ovarialkarzinome gehören die Keimstrang-Stroma-Tumoren somit zu den seltenen Tumoren des Ovars (Chen et al., 2003). Zur letzten Kategorie, den Keimzell-Tumoren, gehören Dysgerminome, Chorionkarzinome, Dottersacktumoren, embryonale Tumoren und Teratome (Chen et al., 2003). Sie entstehen durch entartete Stammzellen und entartete Vorläuferzellen während der embryonalen Entwicklung und können prinzipiell in jeder Körperregion auftreten. In Bezug auf das Ovar machen sie ungefähr 3 bis 7 % der malignen Ovarialtumoren aus und können bereits im Kindesalter auftreten (Chen et al., 2003). Im Folgenden soll nur auf das häufigste maligne Ovarialkarzinom eingegangen werden, das epitheliale Karzinom. Zum epithelialen Ovarialkarzinom zählen zahlreiche und unterschiedliche morphologische Tumor-Subtypen. Grob können diese Subtypen wiederum in zwei Typen eingeteilt werden. Zum Typ 1 gehören niedriggradige seröse Karzinome, niedriggradige Endometriode, klarzellige und muzinöse Karzinome (Kurman und Shih, 2010). Diese Karzinome wachsen langsam, werden meist in einem frühen Stadium diagnostiziert, entstammen gut differenzierten Vorläuferzellen und sind auf das Ovar begrenzt (Kurman und Shih, 2010). Auch eine genetische Stabilität ist Charakteristikum dieser Gruppe (Kurman und Shih, 2010 ). Oft lässt sich eine Ähnlichkeit zu gutartigen zystischen Neoplasien beobachten und auch Zwischenformen, so genannte Borderline-Tumoren sind möglich (Kurman und Shih, 2010). Bei den Borderline-Tumoren handelt es sich um 12
17 semimaligne Tumoren, die ähnlich wie bei der Adenom-Karzinom-Sequenz des kolorektalen Karzinoms aus gutartigen Vorstufen entstehen (Kurman und Shih, 2010). Sie werden in 75 % der Fälle im FIGO (Fédération Internationale de Gynécologie et d'obstétrique) Stadium 1 diagnostiziert. Nur in äußerst seltenen Fällen finden sich Tumorzellen außerhalb der Peritonealhöhle, was einem FIGO Stadium 4 entspräche (Ewald-Riegler et al., 2012). Sie verhalten sich klinisch vorwiegend benigne und haben eine gute Heilungsprognose. Es wurden jedoch auch Rezidive und Implantate, also Tumorzellen außerhalb des Ovars in der Peritonealhöhle beobachtet (Chen et al., 2003). Die Tumoren aus der Typ 1-Gruppe zeichnen sich durch bestimmte Mutationen aus. So fanden Cho und Shih im Jahre 2012 heraus, dass KRAS, BRAF, ERBB2, CTNNB1, PTEN und PIK3CA und selten auch TP53 in Karzinomen dieser Gruppe auftreten (Cho und Shih, 2010). Zur zweiten Gruppe, den Typ 2 Karzinomen, zählen dagegen aggressive und genetisch instabile Tumoren. Diese werden oft erst in späten Stadien entdeckt und sind mit 75 % die am häufigsten vorkommenden Ovarialkarzinome (Kurman und Shih, 2010) und deswegen auch Hauptgrund für die Malignität und hohe Mortalitätsrate des Ovarialkarzinoms (White et al., 2014). Zu den Typ 2 Karzinomen zählen hochgradige seröse Karzinome, hochgradige Endometriode und undifferenzierte Karzinome sowie Sarkome (Kurman und Shih, 2010). Diese Tumoren entwickeln sich aus intraepithelialen Karzinomen im Eileiter und zeigen häufig eine Mutation des TP53 und selten die Mutationen der ersten Gruppe (Cho und Shih, 2010). Tabelle 2 zeigt eine Übersicht der unterschiedlichen Subtypen des epithelialen Ovarialkarzinoms und ihrer Eigenschaften. 13
18 Tabelle 2 Subtypen des epithelialen Ovarialkarzinoms und ihre Eigenschaften Typ 1 Typ 2 Wachstum Langsam Schnell Stadium bei Diagnose Früh Spät Mutationen Aggressivität Tumore KRAS, BRAF, ERBB2, CTNNB1, PTEN, PIK3CA, TP53 (selten) Niedrig maligne, semimaligne Niedriggradige seröse Karzinome, niedriggradige Endometriode, klarzellige und muzinöse Karzinome, Borderline Tumoren TP53 Hoch maligne hochgradige seröse Karzinome, hochgradige Endometriode, undifferenzierte Karzinome, Sarkome Häufigkeit 25 % 75 % 14
19 1.1.4 Histologie Die epithelialen Karzinome des Ovars ähneln histologisch stark den Zellen des Mesothels, welche das Peritoneum auskleiden, was sich mit ihrer gemeinsamen embryologischen Abstammung begründen lässt (Chen et al., 2003). Die verschiedenen Subgruppen der epithelialen Ovarialkarzinome lassen sich histologisch unterscheiden. Typisch für die papillären serösen Adenokarzinome sind, wie in Abbildung 1 dargestellt, markant fibröse Stiele und nicht-muzin-produzierende Epithelzellen. Abbildung 1 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines papillär serösen Ovarialkarzinoms (Eisenhauer et al., 2012) 15
20 Das muzinöse Adenokarzinom des Ovars zeigt sich im Mikroskop als Ansammlung großer, säulenförmig angeordneter Zellen. Die Zellen produzieren im Gegensatz zum papillär serösen Adenokarzinom Muzine (siehe Abbildung 2). Abbildung 2 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines muzinösen Ovarialkarzinoms (Eisenhauer et al., 2012) 16
21 Endometrioide zählen ebenfalls zu den epithelialen Tumoren des Ovars. Auch hier finden sich säulenförmige Zellen sowie pseudo-geschichtete Epithel-Zellen mit prominenten, langgezogenen hyperchromatischen Nuclei (siehe Abbildung 3). Abbildung 3 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines endometrioiden Ovarialkarzinoms (Eisenhauer et al., 2012) 17
22 Klarzellige Ovarialkarzinome zeigen sekretorische Zellen ohne Zilien, wie sie physiologisch in der Tuba uterina vorkommen. Die Zellen, die die Drüsen auskleiden, erinnern an die Form einer Schuhzwecke. Die Nuclei sind bauchig und hyperchromatisch und ragen zum Teil in das Drüsenlumen. Abbildung 4 Hämatoxylin-Eosin-Färbung (HE-Färbung) eines klarzelligen Ovarialkarzinoms (Eisenhauer et al., 2012) Pathogenese Bisher konnte noch nicht herausgefunden werden, wo die Tumorzellen primär ihren Ursprung haben. Kurman und Shih kommen zu dem Schluss, dass sich die Karzinome vom Typ 1 und Typ 2 unabhängig voneinander und mit unterschiedlichen molekularen Entstehungswegen entwickeln, ihren Ursprung außerhalb des Ovars haben und erst sekundär in das Ovar einwandern (Kurman und Shih, 2010). In ihrer Literaturrecherche beschreiben sie verschiedene Theorien zu möglichen Ursprüngen des Ovarialkarzinoms: Seröse Tumore entwickeln sich demnach aus dem mit Fimbrien besetzten Teil der Eileiter. Endometrioide und klarzellige Tumoren entstammen dem Endometriumsgewebe, was vermutlich auf retrograde Menstruation der Eileiter zurückzuführen ist. Die Bren- 18
23 ner-tumoren und muzinösen Tumoren entwickeln sich aus epithelialem Übergangsgewebe der Region, wo die Fimbrien des Eileiters in Kontakt mit dem Peritoneum treten. Dennoch weisen die Autoren daraufhin, dass keine der bisher existierenden Theorien eine adäquate Erklärung zur Karzinogenese von Ovarialtumoren abgeben konnte (Kurman und Shih, 2010) Stadieneinteilung (Staging) Das Ovarialkarzinom kann sowohl nach der FIGO-Klassifikation als auch nach der TNM-Klassifikation eingeteilt werden. Die FIGO-Klassifikation ist ein von der Fédération Internationale de Gynécologie et d'obstétrique erstelltes System zur Einteilung gynäkologischer Tumoren. Die Fédération ist eine weltweite Organisation, die sich aus Gynäkologen und Geburtshelfern aus 125 Ländern zusammensetzt (FIGO, 2014). Das Ziel der FIGO-Klassifikation ist es, den Vergleich von Patientinnen zwischen verschiedenen Behandlungszentren zu ermöglichen und sie anhand ihres Tumorstadiums in prognostische Gruppen einzuteilen, anhand derer die stadiumspezifische Therapie angeknüpft werden kann (Prat, 2014). Die Einteilung des Ovarialkarzinoms in seine verschiedenen Stadien erfolgt dabei chirurgisch und pathologisch (Prat, 2014). Zuletzt wurde die FIGO-Klassifikation im Jahre 1988 in Rio de Janeiro aktualisiert (Prat, 2014). Aufgrund der Fortschritte in der medizinischen Diagnostik, der Möglichkeit genauerer Prognosebestimmungen und der Entwicklung anderer Tumor-Einteilungen sowie der Erkenntnis, dass das Ovarialkarzinom eine Vielzahl an morphologisch und biologisch unterschiedlichen Subtypen beinhaltet, kam das FIGO-Komitee zu dem Schluss, die Klassifikation im Jahre 2013 zu überarbeiten (Prat, 2013/2014). Es entstand ein neues flexibles Staging-System, das die wichtigsten prognoserelevanten Faktoren aller Subtypen des Ovarialkarzinoms beinhaltet. Des Weiteren kann eine Einteilung des Tumorstadiums anhand der TNM-Klassifikation erfolgen. Diese Tumorklassifikation ist für jede Tumorart genau definiert und gilt ebenfalls als hilfreich beim Vergleich von Patienten und Therapien bzw. Therapieerfolgen. Dabei steht das T für die Größe des Tumors, das N für die Beteiligung von Lymphknoten (lat. Nodi lymphatici) und das M für die Existenz von Metastasen. Hinter jedem dieser Buchstaben können Ziffern stehen, welche die Ausdehnung des Tumors (T 1-4), die Anzahl und Lage der befallenen Lymphknoten (N 0-2) und die Existenz von Fern- 19
24 metastasen (M 0 und M 1) beschreiben. Ein genaues Staging ist auch bei der TNM- Klassifikation erst nach der operativen Exploration möglich. Beide Klassifikationen bilden die Grundlage der Therapieentscheidung. Die aktuelle Einteilung der Stadien des Ovarialkarzinoms in TNM- und FIGO-Klassifikation ist in der folgenden Tabelle aufgeführt. Tabelle 3 Einteilung der Ovarialtumore anhand der TNM- und FIGO- Klassifikation (Prat, 2014) TNM FIGO Befund T1-N0-M0 IA Tumor begrenzt auf Ovarien T1a-N0-M0 IA Tumor begrenzt auf ein Ovar; Kapsel intakt; keine Tumorzellen auf Ovaroberfläche, im Aszites oder in der Peritonealzytologie T1b-N0-M0 IB Tumor begrenzt auf beide Ovarien; Kapseln intakt, keine Tumorzellen auf Ovaroberfläche, im Aszites oder in der Peritonealzytologie T1c-N0-M0 IC Tumor begrenzt auf ein oder beide Ovarien; Kapsel rupturiert oder Tumor an Ovaroberfläche oder maligne Zellen im Aszites oder in der Peritonealzytologie T2-N0-M0 II Tumor befällt ein oder beide Ovarien mit Ausbreitung im Becken oder mit primärer Peritonealkarzinose T2a-N0-M0 IIA Tumorausdehnung und/oder Implantate an Uterus und/oder den Tuben T2b-N0-M0 IIB Tumorausdehnung auf andere intraperitoneale Gewebe des Beckens 20
25 T1/T2-N1-M0 III Tumor befällt eine oder beide Ovarien oder primäre Peritonealkarzinose, mit zytologisch und histologisch gesicherter Ausdehnung auf das Peritoneum außerhalb des Beckens und/oder Metastasen der retroperitonealen Lymphknoten T3a2-N0/N1-M0 IIIA1 Zytologisch oder histologisch gesicherte positive retroperitoneale Lymphknoten IIIA 1(i) Mikroskopische Peritonealmetastasen bis zu 10 mm IIIA1(ii) Mikroskopische Peritonealmetastasen größer als 10 mm T3a2-N0/N1-M0 IIIA2 Mikroskopische Ausdehnung auf extrapelvine Gewebe mit/ohne positive Lymphknoten T3b-N0/N1-M0 IIIB Makroskopische peritoneale Metastasen außerhalb des Beckens bis zu zwei cm, mit/ohne positive retroperitoneale Lymphknoten T3c-N0/N1-M0 IIIC Makroskopische peritoneale Metastasen außerhalb des Beckens größer als zwei cm, mit/ohne positive retroperitoneale Lymphknoten (beinhaltet die Ausdehnung des Tumors auf die Kapsel von Leber und Milz) T1-4-N0-2-M1 IV Fernmetastasen (ausschließlich Peritonealmetastasen) IVA Pleuraerguss mit positiver Zytologie IVB Parenchymatöse Leber- und Milz-Metastasen und Metastasen extraabdominaler Organe einschließlich inguinaler Lymphknoten und Lymphknoten außerhalb der Abdominalhöhle 21
26 1.2 Diagnostik Frühdiagnostik und Screening 75 % aller Ovarialkarzinome werden im Stadium III oder IV diagnostiziert, wenn die 5- Jahres-Überlebensrate mit ca. 33 % nur noch gering ist (Hennessy et al., 2009; Heintz et al., 2006). Die mit einer 5-Jahres-Überlebensrate von nahezu 90 % und damit prognostisch günstigeren Tumoren im Stadium I und II werden hingegen selten früh entdeckt (Heintz et al., 2006). Hier liegt die eigentliche Problematik des Ovarialkarzinoms und der Grund für die hohe Malignität. Die Symptome des Ovarialkarzinoms sind unspezifisch. Oft werden sie erst wahr- und ernstgenommen, wenn die Krankheit bereits fortgeschritten ist. Manche Patientinnen berichten von einem Völlegefühl, Verdauungsstörungen, frühem Sättigungsgefühl oder Blutungen durch den erhöhten intraabadominellen Druck durch z.b. Aszites oder durch den Befall des Omentums (Cannistra, 2004). Im frühen Stadium (I und II) traten in einer Fall-Kontroll-Studie aus dem Jahre 2005 besonders Schmerzen im Becken und Abdomen in den Vordergrund, aber auch andere abdominale und gastrointestinale Symptome wie z.b. Appetitverlust, Übelkeit und Obstipation sowie Rückenschmerzen und eine Dysurie und Urininkontinenz konnten beobachtet werden (Friedman et al., 2005). Die Symptome zeigen also gerade in niedrigen Stadien eine große Varianz und es finden sich keine definierten Leitsymptome, die eine Diagnose erleichtern. Die ideale Screening-Methode zur Früherkennung des Ovarialkarzinoms sollte eine hohe Sensitivität von mehr als 75 % und eine sehr hohe Spezifität von mehr als 99,6 % haben, um einen positiven prädiktiven Wert von über 10 % zu erreichen (Hennessy, 2009). Bisher konnte allerdings noch keine derartig effektive Methode gefunden werden. Dennoch gibt es viele Studien, die sich mit möglichen Methoden zur Früherkennung des Ovarialkarzinoms beschäftigen. Die prospektive Fall-Kontroll-Studie von Goff et al. stellte heraus, dass bestimmte Symptome, die besonders stark und rezidivierend imponieren, eine schnellere diagnostische Abklärung erhalten sollten, da sie eine erhöhte Assoziation zu malignen oder benignen Veränderungen des Ovars aufweisen (siehe Tabelle 5). In ihrer beobachteten Patientinnen-Population von Frauen mit Ovarialkarzinom wiesen 72 % der Frauen rezidivierende Symptome vor der Diagnosestellung auf (Goff et al., 2004). Die Häufigkeit der Symptome ist in Tabelle 4 aufgeführt. Im Durchschnitt zeigte jede Patientin zwei dieser aufgeführten Symptome. 22
27 Tabelle 4 Rezidivierende Symptome bei Ovarialkarzinom und deren Häufigkeit (Goff et al., 2004) Symptom Häufigkeit Rückenschmerzen 45 % Müdigkeit 34 % Blutungen 27 % Obstipation 24 % Abdominelle Schmerzen 22 % Harntrakt bezogenen Störungen 35 % Tabelle 5 Odds Ratio für Symptome bei Ovarialkarzinom (Goff et al., 2004) Symptom Odds Ratio Vergrößerter Abdominalumfang 7,4 Blutungen 3,6 Plötzlicher Harndrang 2,5 Schmerzen im Becken 2,2 Durch die manuelle Untersuchung des Beckens können nur fortgeschrittene Stadien des Ovarialkarzinoms entdeckt werden. Sie eignet sich demnach nicht als Mittel in der Frühdiagnostik. Auch der Tumormarker CA-125 konnte trotz guter Sensitivität bei Risikopatientinnen mit zystischen Tumoren im Unterbauch wegen einer zu hohen Rate an falsch positiven Ergebnissen nicht als Screening Methode überzeugen. CA-125 steigt im Serum nicht nur bei Ovarialkarzinom an, sondern auch bei benignen Ovarialzysten, Endometriose, Uterus myomatosus, Schwangerschaft, Tuboovarialabszessen, jeder Reizung des Peristoms, Leberzirrhose, Mitralstenose, Pleuritis, Perikarditis und bei Aszites. Somit hat der CA-125-Marker eine zu geringe Spezifität, um als alleiniger Screening- 23
28 Parameter zu bestehen. In den randomisierten kontrollierten Studien PLCO-Study und Japan-Screening-Study wurde der Tumormarker CA-125 mit transvaginalen Ultraschalluntersuchungen gekoppelt. Die japanische Studie beinhaltete zusätzlich noch eine körperliche Untersuchung. Doch auch das konnte die Mortalität des Ovarialkarzinoms nicht signifikant reduzieren (Buys et al., 2011; Kobayashi et al., 2008). In der randomisierten kontrollierten Studie United Kingdom Collaborative Trial of Ovarian Cancer Screening (UKCTOCS) wurden zwei Screening-Methoden bei einer Kontrollgruppe getestet. Zur Studienpopulation gehörten 50- bis 74-jährige Frauen in der Postmenopause. Die Kontrollgruppe erhielt keine Behandlung. Die multimodale Screening-Gruppe (= MMS) bekam eine jährliche Kontrolle des Serum CA-125 Spiegels sowie eine transvaginale Ultraschall-Untersuchung. Die Ultraschall-Gruppe (= USS) erhielt nur eine jährliche transvaginale Ultraschall-Untersuchung (Menon et al., 2009). Die Studie mit Frauen ist die bisher größte Studie zu Screening-Methoden bei Ovarialkarzinom (Chan et al., 2012). In der USS-Gruppe wurden Frauen gescreent. Bei 45 Patientinnen wurden ein epitheliales Ovarialkarzinom oder Karzinome der Tuben diagnostiziert. Die Sensitivität lag in dieser Screening-Gruppe bei 84,9 % und 50 % aller diagnostizierten Tumoren befanden sich im Stadium 1 oder 2. In der MMS-Gruppe wurden Frauen gescreent. Bei 42 dieser Frauen wurde ein epitheliales Ovarialkarzinom oder Tuben-Karzinom entdeckt. Die Sensitivität lag bei 89,4 %. 47 % der Tumoren befanden sich im 1. oder 2. Stadium (Menon et al., 2009). Die Spezifität war in der multimodalen Screening-Gruppe mit 99,8 % höher als in der Ultraschall-Gruppe mit 98,2 %. Daraus resultierten weniger wiederholte Testungen und weniger Operationen bis zur Entdeckung der Karzinome (Menon et al., 2009). Ob durch diese Ergebnisse die Mortalität reduziert werden kann, bleibt abzuwarten. Derzeit wird ein Routine- Screening zur Früherkennung des Ovarialkarzinoms von den Leitlinien nicht empfohlen (Leitlinienprogramm Onkologie, 2013) Bildgebende Verfahren Erst bei wiederholten und anhaltenden Symptomen von Völlegefühl, Blähungen, unklaren abdominellen Schmerzen oder Beschwerden sowie einer Zunahme der Miktionsfrequenz empfiehlt die aktuelle Leitlinie weitergehende Diagnostik (Leitlinienprogramm Onkologie, 2013). Entscheidend bei der gynäkologischen Untersuchung sind Palpation, transvaginaler Ultraschall und ergänzend dazu die Doppler-Sonographie. Suspekte Tastbefunde sind die Vergrößerung einer oder beider Ovarien, eine derbe oder höckrige 24
29 Oberfläche der Ovarien, Knoten im Douglas-Raum und ein im Becken fixierter Tumor. Auch eine Palpation des Abdomens mit Augenmerk auf die Leber und Leistenregion sollte erfolgen. Die transvaginale Sonographie (TVS) gehört aufgrund hoher Sensitivität zur First-Line- Bildgebung (Fischerova und Burgetova, 2014). Die TVS ermöglicht außer der Detektion pathologischer Prozesse der Adnexe auch eine Charakterisierung des Gewebes bezüglich des Malignitätsgrades (Yazbek, 2008). Studien zeigen, dass gynäkologisch- Ultraschall-erfahrene Ärzte mit einer Treffsicherheit von 95 % zwischen benignen und malignen Gewebeveränderungen der Adnexe allein anhand der TVS unterscheiden können (Valentin, 1999). Mögliche Anzeichen für Malignität sind multiokulär-solide oder solide Zysten, die in ihrer Gesamtheit meist echoarm erscheinen, aber zum Teil interne echoreiche Anteile beinhalten, ein intaktes Septum und eine glatte Zystenwand aufweisen (Abbas, 2014). Je fortgeschrittener der Tumor, desto größer ist der solide Anteil des Gewebes und desto vaskularisierter erscheint der Tumor in der Doppler-Untersuchung (Valentin, 2006). Auch beim Staging, in der Nachsorge und bei durch Bildgebung unterstützten Biopsien zählt die TVS zur First-Line-Diagnostik (Fischerova und Burgetova, 2014). Die Computertomografische Untersuchung (CT) wird besonders zum präoperativen Staging und in der Nachsorge empfohlen, nicht jedoch in der primären Diagnostik zur Detektion eines möglichen Tumors (Fischerova und Burgetova, 2014). Stellenwert hat das CT auch in der durch Bildgebung unterstützten Biopsie. Es zählt zur Second-Line- Diagnostik bei Tumor-Gewebe an mittels TVS-unterstützter Biopsie schlecht zu erreichenden Stellen (Fischerova und Burgetova, 2014). Bei Kontraindikation für ein CT oder für Aufnahmen des Beckens kann im Staging und in der Nachsorge auch eine Magnetresonanzaufnahme (MRT) durchgeführt werden. Findet sich in der TVS ein auffälliger undefinierbarer Befund, kann als Second-Line- Diagnostik ebenfalls ein MRT zur genaueren Tumor-Detektion durchgeführt werden (Fischerova und Burgetova, 2014). Die Positronen-Emissions-Tomografie (PET) kombiniert mit einer CT-Untersuchung kommt in der Diagnostik eines möglichen Rezidivs zum Einsatz. Das PET-CT wird besonders bei Patientinnen in der Nachsorge eingesetzt, deren Serum CA-125 angestiegen ist und wo konventionelle Bildgebung negative Befunde ergeben haben (Fischerova 25
30 und Burgetova, 2014). Meta-Analysen ergaben, dass das PET-CT in der Rezidivdiagnostik mit einer Sensitivität von 91 % und einer Spezifität von 88 % dem CT (Sensitivität 79 %, Spezifität 84 %) und MRT (Sensitivität 75 %, Spezifität 78 %) überlegen ist (Gu et al., 2009). In der Primär-Diagnostik hat das PET-CT aufgrund hoher falsch positiver Ergebnisse keinen Stellenwert (Iyer und Lee, 2010). Um das Staging zu konkretisieren, kommt das PET-CT auch bei Patientinnen in hohen Krankheitsstadien (Stadium 4) zum Einsatz, um eventuell positive Lymphknoten oder Fernmetastasen zu detektieren (Fischerova und Burgetova, 2014). Ein früher präsymptomatischer Beginn einer Rezidivbehandlung ist allerdings nicht mit einem verbesserten Gesamtüberleben verbunden, sondern verkürzt lediglich die therapiefreie Zeit (Geurts et al., 2011). Eine Zusammenfassung der bildgebenden Verfahren und ihrer Indikation bei Ovarialkarzinom ist in Tabelle 6 aufgelistet: 26
31 Tabelle 6 Bildgebende Verfahren und ihre Indikation bei Ovarialkarzinom (Fischerova und Burgetova, 2014) Indikation Bildgebende Verfahren TVS CT MRT PET-CT Detektion und First-Line- nicht emp- Second-Line- nicht empfohlen Tumor- Diagnostik fohlen Diagnostik (bei Charakterisierung unklaren Befunden in der TVS) Staging First-Line- First-Line- Second-Line- Second-Line- Diagnostik Diagnostik Diagnostik (bei Diagnostik Kontraindikationen (Fernmetastasen) für das CT oder Beckenaufnahmen) Nachsorge First-Line- First-Line- Second-Line- Second-Line- Diagnostik Diagnostik Diagnostik (für Diagnostik (Ca- Beckenaufnahmen) 125-Anstieg im Serum, negative Befunde in TVS, CT, MRT) Biopsie First-Line- Second- nicht empfohlen nicht empfohlen Technik Line- Technik Obwohl viele apparative diagnostische Maßnahmen existieren, gibt es dennoch kein verlässliches Verfahren, das ein operatives Staging zur Einschätzung der Operabilität des Tumors und zur definitiven Diagnosesicherung ersetzen könnte (Salani et al., 2008). Studien kritisieren, dass das CT in der Entscheidung, ob die Patientin chirurgisch resektabel ist oder vor der primären Operation eine neoadjuvante Chemotherapie erhalten sollte, aufgrund niedriger positiver prädiktiver Werte unzuverlässig sei (Axtell et al., 2007; Gemer et al., 2009). In der CT-Untersuchung zeigen sich vermeintlich schwierig 27
32 zu resezierende Tumoren, die sich intraoperativ als resektabel entpuppen. Derzeit existiert kein bildgebendes Verfahren, was eine präoperative Selektion der Patientinnen bezüglich ihrer weiteren Behandlung ermöglicht (Fischerova und Burgetova, 2014). Eine perkutane Biopsie gilt es aufgrund des Risikos der Verteilung von Tumorzellen zu vermeiden (Cannistra, 2004). 1.3 Therapie Die Therapie des Ovarialkarzinoms setzt sich aus zwei wesentlichen Bausteinen zusammen: der maximalen Debulking-Operation und der adjuvanten Platinum-basierten zytostatischen Chemotherapie (Colombo et al., 2010). In den vergangenen Jahren gab es zahlreiche Studien, die unterschiedliche Kombinationen von Chemotherapeutika, eine unterschiedliche Behandlungsdauer und ein zusätzliches drittes Chemotherapeutikum testeten (Bookman et al., 2009). Bis heute allerdings gilt als Standard in der First-Line- Therapie des fortgeschrittenen Ovarialkarzinoms Carboplatin in Kombination mit Paclitaxel (Della Pepa und Banerjee, 2014) Operative Therapie Der erste Baustein in der Therapie des Ovarialkarzinoms ist die operative Resektion des Tumors. Dabei sollte, wenn möglich, immer die maximale Resektion angestrebt werden. Der operative Zugang erfolgt durch eine Längsschnittlaparotomie. Vor der Längsschnittlaparotomie kann ggf. ein laparoskopisches Staging erfolgen (Colombo et al., 2010). Ansonsten erfolgt das Staging im Zuge der Laparotomie. Die S3-Leitlinie 2013 empfiehlt folgendes operatives Vorgehen: Es erfolgt zunächst eine Inspektion und Palpation der gesamten Abdominalhöhle: Zwerchfellkuppeln, Leberoberfläche, Gallenblase, Milz, Magen, Pankreas, Nieren, Omentum majus, Dünndarm vom Treitz schen Band bis zur Ileozökalklappe inkl. Mesenterialwurzel, parakolische Rinnen, Dickdarm vom Zökum bis zum Rektum, paraaortale Lymphknoten, pelvine Lymphknoten, Adnexe beidseits, Uterus und Beckenperitoneum. Anschließend wird eine Peritonealzytologie entweder aus dem Aszites oder, falls dieser nicht vorhanden ist, durch Spülung der Peritonealhöhle mit Kochsalzlösung angefertigt. Es folgen Biopsien von auffälligen Stellen und Verwachsungen und mehrere Peritonealbiopsien aus unauffälligen Regionen (Peritoneum von Harnblase und Douglas Raum, parakoli- 28
33 sche Rinnen, Zwerchfell). Es erfolgt nun die beidseitige Adnexexstirpation und im Anschluss die Hysterektomie mit einer mindestens infrakolischen Omentektomie und einer Entfernung der pelvinen und paraaortalen Lymphknoten beidseits. Die Lymphadenektomie hat hierbei vor allem diagnostischen Wert. Die paraaortalen Lymphknoten sollten bis auf Höhe der Venae renales entfernt werden. Bei muzinösen oder unklaren Tumortypen wird zusätzlich eine Appendektomie empfohlen. Bei Patientinnen im gesicherten FIGO Stadium IA kann, wenn noch ein Kinderwunsch besteht, nur eine unilaterale Salpingo-Oophorektomie durchgeführt und somit fertilitätserhaltend operiert werden. Unerlässlich ist dabei eine gründliche Aufklärung der Patientin über das erhöhte Risiko eines fertilitätserhaltenden Eingriffs (Leitlinienprogramm Onkologie, 2013). Je fortgeschrittener der Tumor, desto radikaler sollte die operative Resektion erfolgen. Ggf. muss eine Peritoneumresektion im Unter- und Oberbauch, sowie die Resektion anderer Bauchorgane in Erwägung gezogen werden. Auch ein Intervall-Debulking ist möglich. Ziele der operativen Resektion sind das genaue Staging, die maximale Reduktion des Tumors und makroskopische Tumorfreiheit, um die beste Basis für eine adjuvante Therapie zu schaffen. Daraus folgt, dass die Prognose der Patientin in einem nicht geringen Ausmaß von den Fähigkeiten des Operateurs beeinflusst wird. Studien fanden heraus, dass das Gesamtüberleben der in spezialisierten gynäkologischonkologischen Zentren behandelten Frauen länger ist als das der Frauen, die anderweitig behandelt werden (Woo et al., 2012; Earle et al., 2005). Eine optimale Resektion erwirkt ein medianes Überleben von 39 Monaten, wohingegen eine suboptimale Resektion nur ein Überleben von 17 Monaten sichert (Colombo et al., 2010). Unter einer optimalen Resektion versteht man makroskopische Tumorfreiheit First-Line-Chemotherapie Der zweite Baustein in der Therapie des Ovarialkarzinoms ist die postoperative, also adjuvante Chemotherapie. Die Zusammensetzung der Chemotherapie zur Behandlung des Ovarialkarzinoms hat sich über die letzten zwei Jahrzehnte stetig weiterentwickelt verglich die GOG 111 Studie die damalige Standardtherapie zur Behandlung von Ovarialkarzinom mit Cisplatin (75 mg/m 2 ) und Cyclophosamid (750 mg/m 2 ) mit einer neuen Chemotherapie mit Cisplatin (75 mg/m 2 ) in Kombination mit Paclitaxel (135 mg/m 2 über 24h). Die Ergebnisse zeigten eine statistisch signifikante Verbesserung des Outcomes der Patientinnen, die mit Cisplatin/Paclitaxel behandelt wurden. Die Kombination Cisplatin/Paclitaxel wurde zur Standardtherapie. Cisplatin wurde in den folgen- 29
34 den Jahren durch Carboplatin ersetzt. In der GOG 114 Studie zeigte sich, dass Carboplatin verglichen mit Cisplatin ein äquivalentes Outcome bei geringerer Toxizität aufweist Therapie des frühen Ovarialkarzinoms In frühen Stadien des Ovarialkarzinoms (IC, IA/B und Grad 3) wird eine Platinumhaltige Chemotherapie über sechs Zyklen verabreicht. Eine Meta-Analyse über fünf randomisierte klinische Studien zeigte, dass eine Platinum-basierte Chemotherapie das Gesamtüberleben von Patientinnen in frühen Stadien eines Ovarialkarzinoms im Vergleich zu Patientinnen ohne adjuvante Chemotherapie verlängert (Hazard-Ratio 0,71; 95 % Konfidenzintervall 0, ) (Winter-Roach et al., 2012). Auch das progressionsfreie Überleben (PFS) dieser Patientinnen konnte mit einer adjuvanten Therapie verlängert werden (HR 0,67; 95 % Konfidenzintervall 0,53-0,84) (Winter-Roach et al., 2012). Nur eine Subgruppe von Patientinnen mit dem Stadium IA Grad 1 mit gut bis moderat differenzierten, unilateralen, umkapselten Tumoren profitiert nach optimaler chirurgischer Resektion nicht von einer adjuvanten Chemotherapie (HR des Gesamtüberlebens 1,22; 95 % Konfidenzintervall 0,63-2,37) (Winter-Roach et al., 2012). Diese Subgruppen früher Tumorstadien gilt es durch interdisziplinäre Zusammenarbeit mit Pathologen, Chirurgen, Onkologen herauszufiltern, um die Toxizität einer unnötigen Chemotherapie zu vermeiden. Die optimale Behandlungsdauer von drei oder sechs Therapie-Zyklen ist bis heute Gegenstand von Diskussionen. Bisher fand eine randomisierte klinische Phase-3-Studie heraus, dass sechs Zyklen Carboplatin und Paclitaxel im Vergleich zu drei Zyklen nicht zu einem verlängerten progressionsfreien oder verlängerten Gesamtüberleben führen. Dabei beziehen sich die Daten nur auf die frühen Tumorstadien IA Grad 3, IB Grad 3, klarzellige Karzinome, IC und chirurgisch komplett resezierte Stadium-2-Karzinome. In der Gruppe, in der sechs Zyklen Chemotherapie verabreicht wurden, fand sich eine höhere Toxizität als in der Gruppe mit drei Zyklen (Bell et al., 2006). Aktuell gilt allerdings aufgrund der schwachen Datenlage eine Platinum-haltige Chemotherapie über sechs Zyklen als weltweiter Therapiestandard. 30
35 Therapie des fortgeschrittenen Ovarialkarzinoms Bei fortgeschrittenem Ovarialkarzinom (IIb - IV) gilt für alle Patientinnen die adjuvante Chemotherapie als Therapie der Wahl. Das Protokoll beinhaltet dabei sechs Zyklen intravenöser Gabe von Carboplatin AUC 5 in Kombination mit Paclitaxel (175 mg/m 2 ) über drei Stunden in einem Abstand von je drei Wochen. Im Stadium IIIB - IV kann eine zusätzliche Therapie mit Bevacizumab in Betracht gezogen werden. Die Ergebnisse zweier großer Studien zur Behandlung mit dem vaskulär-endothelialen Wachstumsfaktor-Inhibitor (VEGF-Inhibitor) sind erstmals 2011 publiziert worden. Die GOG-218 Studie der amerikanischen Gyneocologic Oncology Group verglich placebokontrolliert den Therapiearm Carboplatin AUC 6/Paclitaxel 175 mg/m 2 und Bevacizumab 15 mg/kg parallel zur Chemotherapie beginnend am 2. Zyklus und als Erhaltungstherapie für 16 Zyklen nach Abschluss der Chemotherapie für insgesamt 15 Monate mit dem Standardtherapiearm. Das mediane PFS im experimentellen Arm lag bei 14,1 Monaten und somit signifikant über dem der Standardtherapiegruppe ohne Bevacizumab (10,3 Monate). In einem dritten Studienarm wurde Bevacizumab während der Chemotherapie verabreicht anstatt als Erhaltungstherapie nach Abschluss der Chemotherapie. Hier lag das PFS jedoch nur bei 11,2 Monaten und war somit nicht signifikant verbessert im Vergleich zum Standardarm. Im Erhaltungsarm war die Rate an Grad 2-Hypertonien mit 23 % signifikant höher als im Standardarm mit 7 % (Burger et al., 2011). In die europäische ICON7-Studie, einer randomisierten Phase-3-Studie, wurden sowohl Patientinnen mit optimal resezierten Tumoren als auch einige Patientinnen mit frühem high risk Tumorstadium (10 %) eingeschlossen. Im Gegensatz zur GOG-Studie wurde den Patientinnen mit 7,5 mg/kg eine geringere Dosis Bevacizumab parallel zur Chemotherapie mit Carboplatin AUC 5 oder 6/Paclitaxel 175 mg/m 2 und als Erhaltungstherapie für 12 Zyklen über insgesamt 12 Monate verabreicht. Auch hier zeigte sich in der Bevacizumab-Gruppe ein verbessertes PFS von 19 Monaten, während im Standardarm das PFS nur bei 17,3 Monaten lag. Die Anzahl aufgetretener Hypertonien mit Grad 2 war im experimentellen Arm mit 18 % höher als bei der Standardtherapie. Außerdem zeigte sich als Folge von Bevacizumab ein vermehrtes Auftreten thromboembolischer Ereignisse von Grad 3 (7 %) im Vergleich zur Standardtherapie (3 %) (Perren et al., 2011). Sowohl die GOG-218 Studie als auch die ICON7-Studie zeigten eine Verbesserung des PFS durch den zusätzlichen Einsatz von Bevacizumab zur Standardtherapie und somit die Effektivität eines antiangiogenetischen Therapieprinzips bei Ovarialkarzinom (Perren et al., 2011; Burger et al., 2011). Seit Dezember 2011 ist Bevacizumab (15 mg/kg) in 31
36 Kombination mit Carboplatin und Paclitaxel als Erhaltungstherapie für insgesamt 15 Monate bei Patientinnen mit fortgeschrittenem Ovarialkarzinom (IIIB, IIIC, IV) zugelassen. Das Gesamtüberleben der Frauen mit fortgeschrittenem Ovarialkarzinom ist trotz aller Therapien aber weiterhin nicht zufriedenstellend. In den vergangenen Jahren wurden in der Hoffnung auf eine Verbesserung der Therapie des fortgeschrittenen Ovarialkarzinoms verschiedene dritte Chemotherapeutika, wie z.b. Epirubicin, Gemcitabin oder Topotecan zur Standardtherapie mit Carboplatin und Paclitaxel hinzugefügt (Du Bois et al., 2006; Du Bois et al., 2010; Pfisterer et al., 2006). Keines dieser Protokolle zeigte Vorteile für die Patientinnen bezüglich Gesamtüberleben, PFS oder Tumoransprechen (Zia et al., 2005). Stattdessen wies die Therapie mit einem dritten Chemotherapeutikum eine erhöhte systemische Toxizität auf und verringerte so die Lebensqualität der Patientinnen. Auch die additive Therapie mit Lonafarnib, einem Farnesyltransferase Inhibitors, hatte weder auf das PFS noch auf das Gesamtüberleben einen positiven Effekt (Meier et al., 2012) Intraperitoneale Chemotherapie (IPC) Die intraperitoneale Chemotherapie (IPC) stellt eine Ergänzung zur operativen Resektion und systemischen Chemotherapie im adjuvanten Setting dar. Die IPC zielt auf direktem Wege auf die malignen Tumorzellen des Peritoneums ab, während andere Zellen, wie z.b. das Knochenmark, von den Zytostatika ausgespart werden (Armstrong et al., 2006). Die Chemotherapeutika werden dazu mit zwei Litern erwärmter NaCl-Lösung versetzt und so schnell wie möglich per Peritoneal-Katheter ins Peritoneum injiziert (Armstrong et al., 2006). In randomisierten klinischen Studien und Metaanalysen wurde herausgefunden, dass besonders Frauen mit optimal chirurgisch verkleinertem Ovarialkarzinom im FIGO-Stadium 3 von einer IPC mit Cisplatin und Paclitaxel in Kombination mit intravenöser Chemotherapie mit Paclitaxel profitieren (Armstrong et al., 2006). Sie zeigten ein verlängertes progressionsfreies Überleben sowie einen Anstieg des Gesamtüberlebens (Armstrong et al., 2006). Die Problematik der IPC mit kombinierter zytoreduktiver Chirurgie besteht allerdings in der hohen peri- und postoperativen Morbidität und Mortalität. In einer Studie mit 145 Pseudomyxoma-peritonei-Patientinnen, die mit zytoreduktiver Chirurgie und IPC behandelt wurden, betrug die Mortalitätsrate 3 % und die Morbidität bei Grad 3 und 4 lag bei 23 % bzw. 24 % (Saxena et al., 2010). 32
37 Die Lebensqualität während der Therapie war signifikant verschlechtert (Armstrong et al., 2006). Als nachteilig bei der IPC gelten Schmerzen und Infektionen durch den Peritoneal-Katheter sowie Katheterblockaden (Jaaback und Johnson, 2006). Auch Pankreasfisteln, Pneumonien, Thromboembolien sowie intraabdominelle Abszesse wurden beobachtet (Stewart et al., 2006). Obwohl nur ein Teil der Chemotherapeutika in den Blutkreislauf übertritt, wurden auch systemische Nebenwirkungen festgestellt. Bei einer Gesamttoxizität von 20 bis 26 % wurden am häufigsten mit 16 bis 19 % nephrotoxische Wirkungen und mit 14 bis 20 % hämatotoxische Wirkungen angegeben (Pelz und Germer, 2013). Die intraperitoneale Chemotherapie zählt somit nicht zur Standardtherapie des fortgeschrittenen Ovarialkarzinoms Neoadjuvante Chemotherapie In der Vergangenheit gab es Bestrebungen, eine präoperative Chemotherapie zu verabreichen, um den Tumor vor der OP zu verkleinern und so weniger radikal resezieren zu müssen. Es zeigte sich jedoch, dass das Überleben bei Frauen mit fortgeschrittenem Ovarialkarzinom ohne Rezidiv durch die adjuvante Therapie höher war als beim neoadjuvanten Therapieansatz (Rosen et al., 2014). Die neoadjuvant behandelten Frauen wiesen zwar seltener ein Rezidiv auf (49 %) als die adjuvant behandelten Frauen (59 %), ihre 7-Jahres-Überlebensrate lag jedoch nur bei 8,6 %, während die der primär chirurgisch behandelten Patientinnen mit 41 % deutlich höher war (Rosen et al., 2014). Die neoadjuvante Chemotherapie sollte nur bei Patientinnen eingesetzt werden, die nicht operationsfähig sind. Ansonsten gilt die Debulking-Operation in Kombination mit der adjuvanten Chemotherapie als Goldstandard. 1.4 Rezidivtherapie Die Therapie des Rezidivs nimmt in der Behandlung des Ovarialkarzinoms einen großen Stellenwert ein. 80 % der Patientinnen mit einem Ovarialkarzinom im Stadium 3 oder 4 rezidivieren auch nach erfolgreicher First-Line-Therapie in durchschnittlich 15 Monaten nach Erstdiagnose (Hennessy et al., 2009). Dabei werden zwei Populationen unterschieden: die Patientinnen mit Platinum-sensitivem Ovarialkarzinom, deren Rezidiv frühestens sechs Monate nach Abschluss einer Platinum-haltigen Chemotherapie auftritt und die Patientinnen mit Platinum-resistentem Ovarialkarzinom. Bei letzteren 33
38 kommt es innerhalb von sechs Monaten nach Abschluss der Platinum-haltigen First- Line-Therapie zum Rezidiv. Als Subgruppe der Platinum-resistenten Karzinome bezeichnet man die Platinum-refraktären Ovarialkarzinom-Rezidive. Diese Karzinome sprechen nicht auf eine Platinum-haltige Chemotherapie an und sind innerhalb von vier Wochen nach Abschluss der Therapie progredient. Bei nahezu 25 % aller Erstrezidiven findet sich eine Platinum-Resistenz und so gut wie alle Patientinnen entwickeln im Verlauf der Krankheit eine Resistenz gegen Platinum-haltige Chemotherapien (Pujade- Lauraine et al., 2014). Die Behandlung des rezidivierenden Ovarialkarzinoms ist somit als nicht kurativ anzusehen. Die Therapie zielt auf eine Symptomkontrolle sowie eine Verlängerung des progressionsfreien Überlebens (PFS) und des Gesamtüberlebens ab. Das rezidivierende Ovarialkarzinom wird auch als chronische Erkrankung angesehen, die durch eine sogenannte Erhaltungstherapie kontrolliert wird. Besonders der Erhalt der Lebensqualität steht dabei im Vordergrund Operative Rezidivtherapie Zur Effektivität sekundärer zytoreduktiver Chirurgie beim Ovarialkarzinom-Rezidiv gibt es noch keine genauen Empfehlungen. Prospektive Studiendaten mit hohem Evidenzgehalt gibt es nur wenige. Alleine die retrospektiven Studien suggerieren einen möglichen klinischen Nutzen (Chuang et al., 2012). Ziel der operativen Rezidivtherapie ist die makroskopische Komplettresektion. Faktoren, die dabei das verbesserte Outcome der Patientinnen begünstigen, sind vermutlich die Abwesenheit von Aszites, ein guter Performance-Status sowie eine optimale primäre Debulking Resektion (Lorusso et al., 2012). Eine Meta-Analyse kam zu dem Ergebnis, dass Frauen mit einem Platinumsensitiven Rezidiv nach einer optimalen sekundären Zytoreduktion ein verbessertes Gesamtüberleben zeigen (Rawahi et al., 2013). Aufgrund fehlender randomisierter Studien konnte jedoch nicht bewiesen werden, ob das verbesserte Gesamtüberleben mit der Operation oder mit der Tumorbiologie zusammenhängt. Auch über Nebenwirkungen und den Einfluss des zweiten chirurgischen Eingriffs auf die Lebensqualität der Patientinnen fanden sich keine Berichte (Rawahi, 2013). Auch Sehouli et al. kamen zu dem Schluss, dass bei nicht vorhandenem Aszites, bei Platinum-Sensitivität, einem initialen FIGO-Stadium unter 4 und optimaler chirurgischer Resektion eine Rezidivoperation mit einer signifikant besseren Langzeitprognose korreliert (Sehouli et al., 2010). 34
39 Für das isolierte Platinum-resistente Rezidiv konnten ebenfalls positive Ergebnisse durch eine sekundäre Operation erzielt werden. Bei Patientinnen, deren Rezidiv zusätzlich zur Chemotherapie operativ behandelt wurde, dauerte es im Median 32 Monate bis zum nächsten Rezidiv, während die Patientinnen, die nur eine Chemotherapie bekamen, schon nach acht Monaten progredient wurden (Petrillo et al., 2014). Die Ergebnisse derzeit laufender randomisierter Phase-3-Studien bleiben abzuwarten. Sowohl die AGO-OVAR DESKTOP-3 als auch die GOG 213- und die SOCceR-Studie untersuchen derzeit, ob beim Rezidiv des Ovarialkarzinoms die sekundäre Tumor-Debulking Operation vorteilhaft gegenüber alleiniger Chemotherapie ist Second-Line-Chemotherapie Die Art der Chemotherapie bei rezidivierendem Ovarialkarzinom richtet sich nach den Eigenschaften des Rezidivs. Hat der Tumor auf die Platinum-haltige First-Line- Chemotherapie angesprochen, und das Rezidiv tritt erst nach sechs oder mehr Monaten nach Abschluss der initialen Therapie auf, dann sollte eine weitere Platinum-haltige Kombinationstherapie verabreicht werden. Dabei wird Carboplatin mit verschiedenen anderen Substanzen kombiniert. Sowohl die Kombination mit Gemcitabin zeigte ein verlängertes PFS und Gesamtüberleben (Pfisterer et al., 2006) im Vergleich zur konventionellen Platinum-basierten Chemotherapie als auch die Kombination mit Paclitaxel (Parmar et al., 2003). Bei Patientinnen, die jedoch bereits in der First-Line- Chemotherapie mit Paclitaxel behandelt wurden, ist in der Second-Line-Therapie aufgrund neurotoxischer Nebenwirkungen und dem damit verbundenen Verlust von Lebensqualität eine taxanfreie Behandlung zu bevorzugen. Als Alternative zu Gemcitabin kann Carboplatin auch mit pegyliertem liposomalen Doxorubicin kombiniert werden. In der CALYPSO-Studie zeigte sich mit 11,3 Monaten (medianer Wert) ein signifikant verbessertes PFS im Vergleich zu einer Therapie mit Paclitaxel (medianes PFS 9,4 Monate) (Pujade-Lauraine et al., 2010). Hypersensitivitätsreaktionen sowie periphere Neuropathien und Alopezie traten bei den mit pegyliertem liposomalen Doxorubicin behandelten Frauen seltener auf als in der Vergleichsgruppe mit Carboplatin und Paclitaxel (Pujade-Lauraine et al., 2010). Aufgrund einer besseren Verträglichkeit werden auch höhere Dosen sowie eine längere Behandlungsdauer toleriert. Enthielt die First-Line-Therapie kein Bevacizumab, so kann zusätzlich zum Carboplatin und Gemcitabin noch Bevacizumab verabreicht werden. Die randomisierte, doppelblin- 35
40 de, placebokontrollierte OCEANS-Studie zeigte, dass die Patientinnen, die zusätzlich zur Chemotherapie mit Gemcitabin und Carboplatin bis zur Progression noch Bevacizumab erhielten, ein längeres PFS aufwiesen als Patientinnen, bei denen die Chemotherapie mit einem Placebo kombiniert war. Das mediane PFS lag in der Bevacizumab- Gruppe bei 12,4 Monaten, während die Placebo-Gruppe nur ein medianes PFS von 8,4 Monaten aufwies. Auch die objektive Remissionsrate war bei Patientinnen, die den VEGF-Inhibitor erhielten, mit 78,5 % gegenüber 57,4 % signifikant höher (Aghajanian et al., 2012). Allerdings zeigte sich kein positiver Einfluss auf das Gesamtüberleben. Grad-3-Hypertonien und Proteinurie traten in der Bevacizumab-Gruppe öfter auf als in der Placebo-Gruppe (Aghajanian et al., 2012). Welche Second-Line-Chemotherapie beim Platinum-sensitiven Rezidiv verabreicht wird, muss letztendlich individuell, in Abhängigkeit einer möglichen Resttoxizität nach der Primärtherapie und der persönlichen Präferenz der Patientin entschieden werden. Ob in Zukunft der Einsatz von Topotecan in Kombination mit Carboplatin bei der Second-Line-Therapie des Platinumsensitiven Rezidivs einen Stellenwert erlangt, wird derzeit in der prospektiven, randomisierten Phase-3 HECTOR-Studie untersucht. Topotecan wird derzeit erfolgreich in der Therapie des Platinum-resistenten Rezidivs eingesetzt. Bei Rezidiven, die innerhalb von sechs Monaten nach Abschluss der initialen Platinum-haltigen Therapie auftreten, wird als Second-Line-Therapie eine nicht Platinum-haltige Monotherapie empfohlen. Als Zytostatika werden neben Topotecan auch pegyliertes liposomales Doxorubicin, Gemcitabine sowie wöchentlich verabreichtes Paclitaxel eingesetzt. Dabei zeigt pegyliertes liposomales Doxorubicin sowohl ein verbessertes PFS im Vergleich zu Topotecan (28,9 Wochen vs. 23,3, Wochen im Median) als auch ein verlängertes Gesamtüberleben (108 Wochen vs. 71,1 Wochen im Median) (Gordon et al., 2001). Gemcitabine weisen einen ähnlichen therapeutischen Effekt bei Platinum-resistenten Rezidiven auf wie PLD (Mutch et al., 2007). Kombinationstherapien, wie z.b. Paclitaxel kombiniert mit Epidoxorubicin (Buda et al., 2004) oder Topotecan mit Etoposide oder Gemcitabin (Sehouli et la., 2008) sowie wöchentliches Paclitaxel zusammen mit Carboplatin (Lortholary et al., 2012), bieten keine Vorteile gegenüber der Monotherapie, sondern weisen eine erhöhte Toxizität und damit eine verschlechterte Lebensqualität auf. Auch in der Therapie des Platinum-resistenten Rezidivs scheint der Einsatz des monoklonalen Antikörpers Bevacizumab vorteilhaft zu sein. Die AURELIA Studie veröffentlichte 2014 ihre Ergebnisse. In der randomisierten Phase-3 Studie wurde Bevacizumab 36
41 zusätzlich zur Second-Line-Chemotherapie verabreicht und bezüglich Wirksamkeit, Sicherheit und Einfluss auf die Lebensqualität untersucht. Die Ergebnisse waren positiv: Der zusätzliche Einsatz von Bevacizumab zur Standard-Chemotherapie verbessert das PFS (im Median 6,7 Monate vs. 3,4 Monate) und das objektive Ansprechen des Tumors (27,3 % vs. 11,8 %). Der Einfluss auf das Gesamtüberleben war nicht signifikant (im Median 16,6 Monate vs. 13,3 Monate) (Pujade-Lauraine et al., 2014). Bis auf die bekannten Nebenwirkungen wie Hypertonie und Proteinurie wurden keine weiteren Symptome berichtet. Die Studiengruppe kam zu dem Schluss, dass Bevacizumab in Addition zur Second-Line-Chemotherapie in die Leitlinien aufgenommen werden sollte (Pujade-Lauraine et al., 2014). In randomisierten Phase-2-Studien wurden Target-Medikamente getestet, wie der Tyrosinkinasehemmer Vandetanib. In Kombination mit Docetaxel zeigte sich allerdings kein Vorteil bezüglich des PFS gegenüber einer alleinigen Docetaxel-Therapie (Coleman et al., 2014), und auch Vandetanib in Kombination mit PLD konnte aufgrund starker Toxizität nicht überzeugen (Harter et al., 2013). Welche Second-Line-Chemotherapie letztendlich verabreicht wird, ist sowohl beim Platinum-resistenten als auch beim Platinum-sensitiven Rezidiv abhängig von der individuellen Situation und Patientenpräferenz. 37
42 1.4.3 Radiatio Zusätzlich zur Chemotherapie könnte in Zukunft auch eine Bestrahlung zur Behandlung von Chemotherapie-resistenten Rezidiven erfolgen. Im palliativen Setting zur Symptomkontrolle wird die Radiatio bereits genutzt, unklar ist jedoch noch, ob auch bei asymptomatischen Patientinnen eine Radiatio die Verlängerung des PFS oder des Gesamtüberlebens bewirkt. Retrospektive Studien zeigen, dass das PFS nach einer Radiatio bei intrapelvinen Rezidiven signifikant länger ist als bei Patientinnen mit vorangegangener Chemotherapie (Machida et al., 2014; Brown et al., 2013). Dies lässt einen potentiellen Nutzen der Radiatio bei Chemotherapie-resistenten Rezidiven vermuten. 2. Zielsetzung In 75 % aller Fälle wird die Diagnose aufgrund lange unklarer oder unauffälliger Symptomatik und fehlender Screening-Methoden erst spät im FIGO-Stadium 3 oder 4 gestellt (Hennessy et al., 2009). Trotz radikaler Operationsverfahren, wie der totalen Hysterektomie mit beidseitiger Salpingo-Oophorektomie, und adjuvanten Maßnahmen, wie sechs Zyklen intravenöser Chemotherapie mit Carboplatin und Paclitaxel, kommt es in vielen Fällen von Ovarialkarzinom zu einem Rezidiv. Frauen mit initial fortgeschrittenem Tumorstadium rezidivieren in 80 % der Fälle auch nach erfolgreicher First-Line- Therapie in durchschnittlich 15 Monaten nach Erstdiagnose (Hennessy et al., 2009). Second-Line-Therapien können die Lebensdauer verlängern und die Lebensqualität verbessern, sind jedoch nicht als kurativ anzusehen (Hennessy et al., 2009). Es gibt wenig standardisierte Therapieansätze in der Behandlung des Rezidivs, wobei gerade Patientinnen mit Platinum-sensitivem Ovarialkarzinom bei erneuter Platinum-haltiger Chemotherapie eine Verlängerung des progressionsfreien Überlebens und auch des Gesamtüberlebens erreichen können (Hanker et al., 2012). In der Gruppe der Platinumresistenten Ovarialkarzinome kann im Gegensatz zu den Platinum-sensitiven Karzinomen allein das progressionsfreie Überleben durch eine Second-Line-Therapie verbessert werden (Hanker et al., 2012). Hier steht besonders der Erhalt bzw. die Verbesserung der Lebensqualität im Vordergrund (Hanker et al., 2012). Doch gerade Chemotherapien können aufgrund ihrer starken Toxizität die Lebensqualität stark beeinträchtigen. Nicht nur schnell teilende Tumorzellen werden durch die Chemotherapeutika angegriffen, sondern auch alle anderen sich schnell teilenden Kör- 38
43 perzellen. So zählen Haarausfall, Leukozytopenie mit Infektanfälligkeit, Erythrozytopenie mit Anämie-Symptomatik, Thrombozytopenie mit erhöhter Blutungsneigung, Appetitlosigkeit, Diarrhö, Verstopfungen, Entzündungen der Schleimhäute, Kribbeln der Extremitäten, Geschmacksstörungen, psychische Verstimmungen, Hauttrockenheit, Nagelveränderungen und körperliche Schwäche zu häufigen Nebenwirkungen. Daraus folgt, dass gerade Patientinnen mit Platinum-resistenten Ovarialkarzinomen einer Therapie bedürfen, die ihr progressionsfreies Überleben verlängert, die Lebensqualität dabei aber so wenig wie möglich einschränkt. Die aktuelle S3-Leitlinie der Deutschen Krebsgesellschaft empfiehlt bei Platinum-sensitiven Rezidiven eine Platinum-haltige Chemotherapie mit Gemcitabin und Bevacizumab oder in Kombination mit pegyliertem liposomalem Doxorubicin, oder zusammen mit Paclitaxel oder Gemcitabin. Bei Platinumresistenten Rezidiven soll laut der Leitlinie eine nicht Platinum-haltige Monotherapie erfolgen. Als Zytostatika werden pegyliertes liposomales Doxorubicin, Topotecan, Gemcitabine und Paclitaxel empfohlen (Leitlinienprogramm Onkologie, 2013). Das mediane Überleben nach der Diagnose eines Rezidivs liegt dennoch nur zwischen vier und zehn Monaten (Hanker et al., 2012). Die Prognose des Ovarialkarzinoms und besonders die des Rezidivs ist also weiterhin schlecht. Das Rezidiv zeigt sich dabei meist in Form einer Peritonealkarzinose (PC), wie bei den meisten gynäkologisch genitalen Malignomen. Doch gerade die Peritonealkarzinose macht es aufgrund der geringen Durchblutung des Peritoneums und der großen Fläche schwierig, systemisch mittels einer intravenösen Chemotherapie zu therapieren (Tempfer et al., 2014). Das gilt auch, weil die intravenöse Chemotherapie aufgrund ihrer Myelotoxizität in ihrer Dosierung limitiert ist (Armstrong et al., 2006). Intraperitoneale Chemotherapie (IPC) könnte eine Alternative bzw. eine Ergänzung zu bisherigen Therapieansätzen bei rezidiviertem Ovarialkarzinom darstellen. Bei Frauen mit Peritonealkarzinose durch den Tumor Pseudomyxoma peritonei zählt es mittlerweile zum Therapiestandard, zytoreduktive Chirurgie mit adjuvanter IPC zu kombinieren (Varona et al., 2005). Beim rezidivierten Ovarialkarzinom wurde die IPC bisher allerdings nur in Phase-1- und Phase-2-Studien erprobt und meist bei Patientinnen mit malignem Aszites angewandt (Tempfer et al., 2014). Dabei kamen antiangiogenetische Therapeutika wie Bevacizumab und VEGF-Factor-Trap sowie Catumaxomab als Vertreter der nicht angiogenetischen Arzneimittel zum Einsatz (Eskander und Tewari, 2012). Doch die IPC hat nicht nur Nachteile, was ihre Verträglichkeit angeht, sondern auch ihre Wirksamkeit ist limitiert. Die IPC kann aufgrund einer zu schlechten Verteilung des Chemotherapeuti- 39
44 kums in der Abdominalhöhle nicht alle Tumorzellen erreichen (Dedrick und Flesner, 1997). So bleibt immer ein Teil der Tumorzellen unbehandelt und kann früher zur Progredienz führen. Es gilt also, eine Alternative zur IPC bzw. eine Verbesserung zu finden, die nebenwirkungsarm bei guter technischer Durchführbarkeit auch bei rezidiviertem Ovarialkarzinom einen günstigen Effekt auf das progressionsfreie Überleben und die Lebensqualität hat und möglichst alle Tumorzellen im Peritoneum erreicht. Eine Möglichkeit, die begrenzenden Faktoren der IPC zu vermeiden, ist, das Chemotherapeutikum als Aerosol und mit Druck zu applizieren. Esquis et al. fanden im Jahre 2006 im Rahmen ihrer Studie an Schweinen heraus, dass ein erhöhter intraabdomineller Druck die Eindringtiefe von Cisplatin in Tumorknoten bei Peritonealkarzinose erhöht (Esquis et al., 2006). Eine mögliche Variante der IPC, basierend auf den Beobachtungen von Esquis et al., ist die Pressurized IntraPeritoneal Aerosol Chemotherapy (PIPAC), die laparoskopisch verabreicht wird und auch wiederholt durchgeführt werden kann (Tempfer et al., 2014). Nicht nur der erhöhte intraabdominale Druck, sondern auch die Applikation des Chemotherapeutikums als Aerosol könnten ein Vorteil sein. So besteht die Annahme, dass durch dieses Verfahren größere Flächen des Peritoneums mit Chemotherapie in Kontakt kommen und eine gesteigerte Eindringtiefe als bei der flüssigkeitsbasierten IPC erreicht werden kann. Dies führt möglicherweise zu einem besseren Ansprechen der Peritonealkarzinose bei rezidivierendem Ovarialkarzinom, mit geringerer Morbidität als bei der PCI und der Möglichkeit wiederholter Durchführungen. Ziel dieser Arbeit ist es, diese Hypothese zu überprüfen und festzustellen, ob die PIPAC-Therapie eine potentielle Therapiemöglichkeit bei Frauen mit rezidiviertem Ovarialkarzinom darstellt. 3. Material und Methoden Das rezidivierte Ovarialkarzinom mit einem Befall des Peritoneums ist resistent gegen systemische Chemotherapie. Bisher existiert keine wirksame standardisierte Therapie, um den Krankheitsverlauf effektiv zu verzögern, ohne Einbußen in der Lebensqualität zu verzeichnen. Eine vielversprechende Möglichkeit zur Therapie dieser Patientinnengruppe ist die Pressurized IntraPeritoneal Aerosol Chemotherapy (PIPAC). Basierend auf den experimentellen Daten der Studie von Esquis et al. (Esquis et al., 2006) wurde die PIPAC mit Doxorubicin und Cisplatin an drei sich im Endstadium be- 40
45 findlichen Patientinnen mit rezidiviertem Ovarialkarzinom mit Peritonealkarzinose verabreicht (Solass et al., 2013). Es zeigte sich, dass PIPAC eine Regression der peritonealen Tumorzellen bewirkt und dabei nur eine geringe renale und hepatische Toxizität aufweist. In einer Fallstudie mit 18 Patientinnen mit rezidiviertem Ovarialkarzinom und PC konnte durch die PIPAC bei sechs Patientinnen ein objektives Tumoransprechen mit einer akzeptablen Toxizität nachgewiesen werden (Tempfer et al., 2014). Dabei zeigte eine Patientin eine komplette Tumor-Remission, zwei Patientinnen eine partielle und eine Patientin wies einen stabilen Krankheitsverlauf auf. Fünf Nebenwirkungen vom WHO Grad 2 konnten im Zuge der PIPAC in dieser Fall-Serie beobachtet werden. Gesundheitliche Schäden für das OP-Personal durch eine mögliche Kontamination der Luft im Operationssaal mit Partikeln der Aerosol-Chemotherapie konnten ausgeschlossen werden (Solass et al., 2013). Basierend auf diesen Informationen wurde in dieser Phase-2-Studie die Wirkung von PIPAC mit Cisplatin und Doxorubicin bei Patientinnen mit rezidiviertem, Platinum-resistenten Ovarial-, Tuben- oder Peritonealkarzinom und Peritonealkarzinose getestet. 3.1 Studiendesign Es handelt sich um eine offene, einarmige Phase-2-Studie, zu der Frauen mit rezidiviertem Platinum-resistenten Ovarialkarzinom mit mindestens zwei vorangegangenen Zyklen leitliniengerechter systemischer Chemotherapie berechtigt waren. Vor Beginn der Studie wurde durch die Ethik-Kommission der Ruhr-Universität Bochum die Zustimmung für die Studie erteilt (Ethik-Kommission der Ruhr-Universität Bochum, Deutschland: Registrierungsnummer FF; Ausstellungsdatum ). Die Studie wurde vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) genehmigt (Registrierungsnummer: ). Die Studie ist registriert bei ClinicalTrials.gov, unter der Nummer NCT , und bei EudraCT, unter der Nummer Alle teilnehmenden Patientinnen haben eine Einverständniserklärung unterschrieben. 41
46 3.2 Ein- und Ausschlusskriterien Einschlusskriterien Zur Teilnahme berechtigte Patientinnen mussten folgende Bedingungen und Kriterien erfüllen. - klinischer und/oder radiologischer Beweis für die Existenz von Peritonealkarzinose - Alter zwischen 18 und 85 Jahren - guter Performance-Status (Karnofsky Index > 70 %) - Diagnose eines rezidivierenden Karzinoms mit Progression nach mindestens einem Zyklus vorangegangener intravenöser Platinum-haltiger Chemotherapie - Blut-, Elektrolyte-, Leberwerte und renale Funktionsparameter innerhalb von 10 % des Normwertes, welcher vom Labor der Studieninstitution vorgegeben wird - postmenopausaler Status oder Zustand nach Oophorektomie - schriftliche Einverständniserklärung der Patientin Ausschlusskriterien Nicht zur Studienteilnahme berechtigt waren hingegen Patientinnen mit folgenden Kriterien: - auf extraabdominale Organe metastasierte Krankheit, ausgenommen isoliert pleurale Karzinose - Chemotherapie oder Debulking Chirurgie innerhalb der letzten vier Wochen vor Studienteilnahme - vorangegangene Behandlung mit der maximalen Dosis von Doxorubicin, Daunorubicin, Epirubicin, Idarubicin und/oder anderen Anthrazyklinen - allergische Reaktion auf Cisplatin oder andere Platinum-haltige Arzneien oder auf Doxorubicin in der Vergangenheit - schwere Leber- oder Niereninsuffizienz mit um mehr als das Doppelte des Normwertes erhöhten organspezifischen Parametern - unbehandelte Herzinsuffizienz, unbehandelte Herzrhythmusstörungen - Zustand nach Myokardinfarkt oder Myelosuppression 42
47 - Schwäche oder Erkrankung des Immunsystems oder immunsuppressive Therapie - vorangegangene intraabdominale Chemotherapie oder intraabdominale Antikörper-Therapie Karnofsky-Index und Performance-Status Der Karnofsky-Index ist eine Skala zur Bewertung der Selbstversorgung und Aktivität von an Krebs erkrankten Patienten. Bewertet werden der Grad der Beeinflussung von Aktivität und Selbstversorgung des Patienten durch die Krebserkrankung selbst und alle damit einhergehende Symptome. Der Index reicht von einem Performance-Status von 100 % ohne Beschwerden, ohne Krankheitszeichen und voller Aktivität bis hin zu einem Status von 0 %, der dem Tod entspricht. Die Abstufung wird i. d. R. in 10-Punkt- Schritten vollzogen. Der Index ist hilfreich zur Einschätzung der Prognose des Patienten. Außerdem lassen sich anhand der angegebenen Aktivitäts- und Selbstversorgungseinschränkungen klare Therapieziele formulieren, die je nach Krankheitsstadium die Heilung, die Lebensverlängerung, eine funktionelle Restitution oder eine palliative Versorgung fokussieren können. Auch das Maß an Pflegebedürftigkeit lässt sich anhand der Prozentzahlen ablesen. Ab einem Index von 60 % benötigt der Patient in einigen Lebensbereichen Hilfestellung, ab 40 % gilt der Patient als behindert und benötigt qualifizierte Hilfe. Bei einem Index von 20 % sind intensivmedizinische Maßnahmen erforderlich. Der Karnofsky-Index sollte möglichst am Anfangsstadium der Erkrankung erhoben werden und auch vor operativen Eingriffen und neuen Therapieansätzen, damit eine mögliche Veränderung des Performance-Status dokumentiert werden kann. 43
48 Tabelle 7 Karnofsky-Index (Karnofsky und Burchenal, 1949) 100 % Keine Beschwerden; keine Zeichen der Krankheit 90 % Fähig zu normaler Aktivität; kaum oder geringe Symptome 80 % Normale Aktivität mit Anstrengung möglich; deutliche Symptome 70 % Selbstversorgung; normale Aktivität oder Arbeit nicht möglich 60 % Einige Hilfestellungen nötig; selbstständig in den meisten Bereichen 50 % Hilfe und medizinische Versorgung wird oft in Anspruch genommen 40 % Behindert; qualifizierte Hilfe benötigt 30 % Schwerbehindert; Hospitalisation erforderlich 20 % Schwerkrank; intensive medizinische Maßnahmen erforderlich 10 % Moribund; unaufhaltsamer körperlicher Verfall 0 % Tod 3.3 Prozeduren Der Zugang zum Peritoneum erfolgt laparoskopisch in einem mit Laminar-air-Flow- System ausgestatteten Operationssaal. Nach Insufflation von 12 mmhg CO 2 entsteht ein gut einsehbares Pneumoperitoneum. Zwei Sicherheitstrokare (5 und 12 mm, Applied Medical, Düsseldorf) werden durch die Abdominalwand ins Peritoneum eingeführt. Die Videodokumentation beginnt und der Peritoneal Cancer Index (PCI) nach Sugarbaker, basierend auf Läsions-Größe und Streuung, wird bestimmt (Mazzei et al., 2013) Erhebung des Peritoneal Cancer Index (PCI) Der PCI wurde von Jacqueut u. Sugarbaker (1996) zur detaillierten semiquantitativen Beurteilung der peritonealen Ausbreitung intrabadominaler und intrapelviner Neoplasien entwickelt. Der PC-Index (PCI) wird erst bei der chirurgischen Exploration des Abdomens und des Beckens erhoben. Zur Beurteilung der Tumorausdehnung wird das Abdomen und das Becken durch zwei sagittale und zwei transversale Ebenen in neun Regionen unterteilt. 44
49 Dabei ist die obere transversale Ebene an den unteren Kostalrändern lokalisiert und die untere transversale Ebene liegt auf der Höhe der Spinae iliacae anterior superior. Die sagittale Ebene teilt das Abdomen in drei gleichgroße Bereiche. Die Linien definieren so neun Regionen, denen im Uhrzeigersinn Nummern zugewiesen werden. Die Nabelregion ist die Null und die Nummer eins bezeichnet den Bereich unter dem rechten Zwerchfell. Die Nummern neun bis zwölf unterteilen den Dünndarm in oberes und unteres Jejunum und oberes und unteres Ileum. Jede dieser Regionen ist nicht nur durch die körperlichen Landmarken definiert, sondern auch durch die spezifischen anatomischen Strukturen, die in der jeweiligen Region zu finden sind. Unter Kamerasicht werden 13 Lokalisationen (zentrale Abdominal-Wand, Epigastrium, rechte untere Abdominal-Wand, rechte obere Abdominal-Wand, rechte Flanke, linke untere Abdominal- Wand, linke obere Abdominal-Wand, linke Flanke, Becken, oberes Jejunum, unteres Jejunum, oberes Ileum und unteres Ileum) in der Bauchhöhle inspiziert und ihr jeweiliger Befall von Peritonealkarzinose als Grad von 0 bis 3 festgelegt. Die Läsionsgröße wird erst nach gründlicher Adhäsiolyse und kompletter Inspektion des gesamten Peritoneums bestimmt. Dabei spricht man von Grad 0, wenn keine makroskopisch sichtbare Karzinose vorhanden ist. Tumorknoten von weniger als 0,5 cm im größten Durchmesser entsprechen Grad 1, eine Läsionsgröße zwischen 0,5 cm und 5 cm entspricht Grad 2 und eine Größe von mehr als 5 cm entspricht Grad 3. Konfluierende Läsionen werden immer als Grad 3 beurteilt. Die Summe aller 13 Grade werden als PCI festgehalten. Der Wert kann 0 bis 39 sein. Tentes et al. fanden heraus, dass der PCI ein signifikanter Index für das Überleben bei Patientinnen mit Ovarialkarzinom darstellt. Der PCI lasse eine detaillierte Evaluation des peritonealen Tumorbefalls zu, wodurch das Überleben dieser Patientinnen besser abgeschätzt werden könne (Tentes et al., 2003). Ein Wert von > 10 sei mit einer ungünstigen Prognose verbunden, das mittlere Überleben läge bei 38 Monaten, die 5-Jahres-Überlebensrate bei 29 % gegenüber 80 Monaten bzw. 65 % bei einem PCI von 10 (Tentes et al., 2003). 45
50 Abbildung 5 Anatomische Landmarken des Peritoneal Cancer Index (PCI) (Begossi et al., 2002) 46
51 Tabelle 8 Läsionsgröße und die entsprechende Gradeinteilung des Peritoneal Cancer Index (PCI) Grad Läsionsgröße 0 Kein sichtbarer Tumor 1 Tumor < 0,5 cm 2 Tumor zwischen 0,5 cm und 5 cm 3 Tumor > 5 cm oder konfluierende Läsionen 3.4 Weitere Prozeduren Zusätzlich wird bei jeder PIPAC-Prozedur eine Biopsie durchgeführt, um die Peritonealkarzinose histologisch zu bestimmen und den Verlauf der Therapie und eine Tumorregression beweisen zu können. Das Aszites-Volumen wird dokumentiert und der Aszites wird abgesaugt. Anschließend wird ein Nebulisator (Reger Medizintechnik, Rottweil) an einen intravenösen Hochdruck-Injektor (Injektron 82M, MedTron, Saarbrücken) angeschlossen und in die Abdominalhöhle appliziert. Die Dichtigkeit des Abdomens wird via CO 2 -Null- Fluss dokumentiert. Nun wird das unter Druck stehende Aerosol mittels Nebulisator und Injektor in die Abdominalhöhle appliziert. Das Aerosol besteht aus Cisplatin in einer Dosis von 7,5 mg/m 2 Körperoberfläche verdünnt mit 150 ml NaCl 0,9 %, gefolgt von Doxorubicin (1,5 mg/m 2 Körperoberfläche) in einer Lösung mit 50 ml NaCl 0,9 %. Die in dieser Studie benutzte Chemotherapie-Dosis basiert auf bisherigen klinischen Erfahrungen, in denen Patientinnen mit Peritonealkarzinose mit PIPAC behandelt wurden (Solass et al., 2013 und Tempfer et al., 2014). Die Injektionsparameter werden auf eine Flussrate von 30 ml/min und einen maximalen Einspritzdruck von 200 psi eingestellt. Die Injektion ist ferngesteuert, um die Exposition des Personals zu minimieren. Das therapeutische Pneumoperitoneum wird für 30 Minuten bei einer Temperatur von 37 C belassen. Danach wird das chemotherapeutische Aerosol mittels eines geschlossenen Systems über zwei sequenzielle Mikropartikel-Filter in das krankenhauseigene Abluftsystem geleitet. Zum Schluss werden die Trokare entfernt und die Laparoskopie beendet. Es wird keine Drainage gelegt. Die PIPAC-Prozedur wird vier bis sechs Wo- 47
52 chen später wiederholt, es sei denn, der Tumor zeigt einen Progress oder die Toxizität der Behandlung erfordert eine vorzeitige Beendigung der Therapie. Eine die PIPAC begleitende zytoreduktive Chirurgie ist durch das Studienprotokoll nicht erlaubt. Als primärer Endpunkt der Studie gilt das objektive Tumoransprechen, gemäß den RECIST-Kriterien Version 1.1 am Ende des dritten Behandlungszyklus (Eisenhauer et al., 2009). Peritoneale, subperitoneale, viszerale und pleurale Manifestationen werden gesondert beurteilt. Die computertomographischen Aufnahmen wurden vom Institut für Diagnostische, Interventionelle Radiologie und Nuklearmedizin, Ruhr-Universität Bochum, Marienhospital Herne ausgewertet und beurteilt. Die teilnehmenden Patientinnen wurden gebeten, sich drei Monate nach Abschluss von drei PIPAC-Zyklen erneut einer Follow-up-CT- Untersuchung zu unterziehen. Diese CT-Aufnahmen wurden gesammelt und anonymisiert von einem zertifizierten radiologischen Facharzt ausgewertet. Dabei waren die CT- Aufnahmen verblindet hinsichtlich bisheriger CT-Aufnahmen sowie bezüglich aller dazugehörigen klinischen Daten. Die histologische Regression wurde vom Institut für Pathologie, Ruhr-Universität Bochum, Klinikum Bergmannsheil beurteilt. Auch hier wurden alle Proben gesammelt, anonymisiert und von einem zertifizierten, auf Gynäkologie spezialisierten pathologischen Facharzt beurteilt. Dabei war die Beurteilung verblindet hinsichtlich bisheriger histologischer Befunde und auch bezüglich aller klinischen Daten. Die histopathologische Tumor-Regression wurde nach folgenden Stadien eingeteilt: vitale Tumorzellen, milde Regression, starke Regression, keine Tumorzellen (Glaze et al., 2012). Nebenwirkungen der PIPAC-Therapie wurden nach der Common Terminology Criteria for Adverse Events (CTCAE), Version 4.0. eingeteilt. Zusätzlich wurden das C-reaktive Protein (CRP) sowie das Kreatinin, Phosphat und der Tumormarker CA-125 im Serum bei jeder PIPAC am Tag vor, am ersten Tag danach sowie am dritten Tag nach der PIPAC ermittelt. Eine Verdopplung des initialen CRP- Wertes wurde als Toxizität Grad 1, eine Verdreifachung des initialen CRP-Wertes als Toxizität Grad 2 definiert. 48
53 Die Lebensqualität wurde anhand des EORTC QLQ-C30 Fragebogens bemessen. Dabei handelt es sich um einen validierten Fragebogen, der Lebensqualität von Krebspatienten erfasst (van der Kloot et al., 2014) EORTC QLQ-C30 Der EORTC QLQ Fragebogen wurde erstmals 1987, damals noch unter der Bezeichnung EORTC QLQ-C36 veröffentlicht (Aaronson N.K. et al. 1991). Der Fragebogen wurde entwickelt, um validiert, kulturunabhängig und einfach in Erfassung und Auswertung die krebsspezifische Lebensqualität dokumentieren zu können. Der Fragebogen wurde stetig weiterentwickelt und die aktuelle Version (QLQ-C30) wird seit 1997 für alle Studien von der Quality of Life Group empfohlen (EORTC, 2015). Der Fragebogen (Abbildung 6) orientiert sich an den physischen, psychischen und den sozialen Funktionen und Beeinträchtigungen der Krebspatienten. Er besteht aus 30 Einzelfragen und umfasst fünf Funktions- und drei Symptomskalen sowie eine Lebensqualitätsskala und sechs einzelne Items. Mittels mehrerer unterschiedlich formulierter Fragen, sogenannter Multi-Item-Skalen, werden das körperliche (Fragen 1 bis 5) und emotionale Befinden (Fragen 21 bis 24), das Rollenerleben (Fragen 6 und 7) sowie soziale (Fragen 26 und 27) und kognitive Funktionen (Fragen 20 und 25) erfasst. Jede Frage hat vier Antwortmöglichkeiten, denen jeweils Punktwerte zugeordnet sind (überhaupt nicht = 1 Punkt, wenig = 2 Punkte, mäßig = 3 Punkte, sehr = 4 Punkte). Je höher der Punktwert, desto stärker fühlt sich der Patient in der erfragten Funktion beeinträchtigt. Die Symptome Schmerzen (Fragen 9 und 19), Müdigkeit (Fragen 10, 12 und 18) und Übelkeit und Erbrechen (Fragen 14 und 15) werden ebenfalls nach der Multi-Item-Methode erhoben. Nach den Symptomen Atemnot (Frage 8), Appetitverlust (Frage 13), Diarrhö (Frage 17), Obstipation (Frage 16) und Schlafstörungen (Frage 11) sowie nach der Beeinträchtigung der finanziellen Situation wird direkt in sechs weiteren Items gefragt. Auch hier gilt, je höher der Punktwert, desto mehr stellt das Symptom ein Problem für die Patienten dar. Die Lebensqualität des Patienten insgesamt wird in Frage 29 und 30 erfasst. Je besser der Patient seine Lebensqualität einschätzt, desto höher ist die Punktzahl (sehr schlecht = 1 bis ausgezeichnet = 7). 49
54 GERMAN EORTC QLQ-C30 (version 3.0) Wir sind an einigen Angaben interessiert, die Sie und Ihre Gesundheit betreffen. Bitte beantworten Sie die folgenden Fragen selbst, indem Sie die Zahl ankreuzen, die am besten auf Sie zutrifft. Es gibt keine richtigen oder falschen Antworten. Ihre Angaben werden streng vertraulich behandelt. Bitte tragen Sie Ihre Initialen ein: Ihr Geburtstag (Tag, Monat, Jahr): Das heutige Datum (Tag, Monat, Jahr): bbbb cececdde cececdde Überhaupt nicht Wenig Mäßig Sehr 1. Bereitet es Ihnen Schwierigkeiten sich körperlich anzustrengen (z.b. eine schwere Einkaufstasche oder einen Koffer zu tragen?) Bereitet es Ihnen Schwierigkeiten, einen längeren Spaziergang zu machen? Bereitet es Ihnen Schwierigkeiten, eine kurze Strecke außer Haus zu gehen? Müssen Sie tagsüber im Bett liegen oder in einem Sessel sitzen? Brauchen Sie Hilfe beim Essen, Anziehen, Waschen oder Benutzen der Toilette? Während der letzten Woche: Überhaupt nicht Wenig Mäßig Sehr 6. Waren Sie bei Ihrer Arbeit oder bei anderen tagtäglichen Beschäftigungen eingeschränkt? Waren Sie bei Ihren Hobbys oder anderen Freizeitbeschäftigungen eingeschränkt? Waren Sie kurzatmig? Hatten Sie Schmerzen? Mussten Sie sich ausruhen? Hatten Sie Schlafstörungen? Fühlten Sie sich schwach? Hatten Sie Appetitmangel? War Ihnen übel? Haben Sie erbrochen? Bitte wenden 50
55 GERMAN Während der letzten Woche: Überhaupt nicht Wenig Mäßig Sehr 16. Hatten Sie Verstopfung? Hatten Sie Durchfall? Waren Sie müde? Fühlten Sie sich durch Schmerzen in Ihrem alltäglichen Leben beeinträchtigt? Hatten Sie Schwierigkeiten sich auf etwas zu konzentrieren, z.b. auf das Zeitunglesen oder das Fernsehen? Fühlten Sie sich angespannt? Haben Sie sich Sorgen gemacht? Waren Sie reizbar? Fühlten Sie sich niedergeschlagen? Hatten Sie Schwierigkeiten, sich an Dinge zu erinnern? Hat Ihr körperlicher Zustand oder Ihre medizinische Behandlung Ihr Familienleben beeinträchtigt? Hat Ihr körperlicher Zustand oder Ihre medizinische Behandlung Ihr Zusammensein oder Ihre gemeinsamen Unternehmungen mit anderen Menschen beeinträchtigt? Hat Ihr körperlicher Zustand oder Ihre medizinische Behandlung für Sie finanzielle Schwierigkeiten mit sich gebracht? Bitte kreuzen Sie bei den folgenden Fragen die Zahl zwischen 1 und 7 an, die am besten auf Sie zutrifft 29. Wie würden Sie insgesamt Ihren Gesundheitszustand während der letzten Woche einschätzen? sehr schlecht ausgezeichnet 30. Wie würden Sie insgesamt Ihre Lebensqualität während der letzten Woche einschätzen? sehr schlecht ausgezeichnet Copyright 1995 EORTC Study Group on Quality of Life. Alle Rechte vorbehalten. Version 3.0 Abbildung 6 EORTC QLQ-C30 Fragebogen (Version 3.0.) 51
56 3.5 Statistische Analyse Alle P-Werte (Signifikanzwerte) sind zweiseitig und ein P-Wert < 0,05 wurde als statistisch signifikant angesehen. Die Fallzahl wurde berechnet auf der Basis des Anteils der Patientinnen mit einer klinischen Benefitrate (CBR). Dabei wurde dieser Anteil von Patientinnen unterteilt in solche mit kompletter Remission, partieller Remission und stabilem Krankheitsverlauf gemäß den RECIST Kriterien, Version 1.1. Dabei galten 40 % oder mehr als Beweis für die Wirksamkeit der PIPAC bei dieser Patientinnen- Population und weniger als 20 % wiesen auf eine Unwirksamkeit der Therapie hin. Es wird ein Risiko von α = 0,05 (Fehler Typ 1) und β = 0,10 (Fehler Typ 2) angenommen und eine Drop-out-Rate von 10 %. Wenn keine Annahme über die Form der Verteilung der Daten getroffen werden konnte, wurde die Analyse mittels nonparametrischer Tests durchgeführt. Im Fall von normal verteilten Daten wurden parametrische Testverfahren verwendet. Die Werte werden im Median angegeben. Das Überleben wird anhand der Kaplan- Meier-Überlebenskurve dargestellt. Für die statistische Analyse wurde die Software SPSS 11.0 für Windows (SPSS11.0, SPSS Inc., Chicago, IL) benutzt. 4. Ergebnisse 4.1 Patientinnen-Charakteristika 64 Patientinnen mit rezidiviertem Platinum-resistenten Ovarialkarzinom wurden zwischen dem 11. Februar 2013 und dem 17. Februar 2014 in die PIPAC-Studie eingeschlossen. Die Datenerhebung wurde am 13. September 2014 beendet. Bei 11 von 64 Patientinnen (17 %) war der laparoskopische Zugang nicht möglich. 53 Patientinnen erhielten zumindest einen Zyklus der Studienmedikation (intention-to-treat (ITT)- Population) und konnten so in die Sicherheits- und Wirksamkeitsanalysen eingeschlossen werden. 34 Patientinnen durchliefen drei Zyklen der PIPAC-Therapie (per-protocol (PP)- Population). Neun Patientinnen durchliefen zwei PIPAC-Zyklen und zehn Patientinnen einen Zyklus der PIPAC. Einen Protokollverstoß gab es bei einer Patientin zu verzeichnen, die vor Studienteilnahme erst eine systemische intravenöse Chemotherapie erhalten hatte. Sie hat alle drei PIPAC-Zyklen durchlaufen und ist sowohl in den Sicherheits- als auch in den Wirksamkeitsanalysen eingeschlossen. Bei drei von 53 Pati- 52
57 entinnen konnten in den Peritonealbiopsien während der PIPAC keine Tumorzellen identifiziert werden. Bei diesen Patientinnen wurde das Rezidiv anhand computertomografischer Untersuchungen, Serum CA-125 und/oder anhand der intraoperativen PCI- Bewertung nachgewiesen. Diese drei Patientinnen sind in den Sicherheits- und Wirksamkeitsanalysen mit aufgeführt. Die Patientinnen-Charakteristika sind in der nachfolgenden Tabelle 9 aufgeführt: Tabelle 9 Patientinnen-Charakteristika von 53 Frauen mit rezidiviertem Platinumresistenten Ovarial-, Tuben- oder primärem Peritonealkarzinom, die eine PIPAC erhalten haben Patientinnen-Charakteristika Variable Anzahl der Patientinnen 53 Alter (Jahre; durchschnittlich, ± SD) 62 ( ± 10) ECOG Performance Score (60 %) 20 (38 %) 0 1 (2 %) Anzahl vorangegangener Chemotherapien (Mittelwert, Bandbreite) 3 (2,8) Vorherige Radiatio keine Pleuraerguss 5/53 (9 %) Aszites 22/53 (42 %) Aszites Volumen (ml; Mittelwert, Bandbreite) 483 (0,4500) PCI (U/ml; durchschnittlich, ± SD) 16.3 (± 9,9) Serum CA-125 (U/ml; durchschnittlich, ± SD) 1558 (± 3964) 53
58 Lokalisation des Karzinoms Ovar Tuben Peritoneum Zelltyp Seröses papilläres Adenokarzinom muzinöses Adenokarzinom Andere Vorangegangene Immuntherapie Ja Nein 47 (89 %) 2 (4 %) 4 (7 %) 48 (91 %) 1 (2 %) 4 (7 %) 29 (55 %) 24 (45 %) Vorangegangene chirurgische Zytoreduktion Ja Nein 0 53 (100 %) Anmerkung: SD = Standardabweichung; ECOG= Eastern Cooperative Oncology Group; PCI=Peritoneal Cancer Index; ml=milliliter 4.2 Tumoransprechen In der ITT-Population konnte bei 33 von 53 Patientinnen unter der PIPAC-Therapie ein objektives Tumoransprechen nachgewiesen werden. Drei Patientinnen zeigten ein partielles Ansprechen und 30 Patientinnen wiesen einen stabilen Krankheitsverlauf auf. Bei 17 Patientinnen kam es zu einem Progress des Tumors und drei Patientinnen konnten bezüglich dieses Endpunktes nicht evaluiert werden. Eine Patientin schien zunächst die Einschlusskriterien für die Studie zu erfüllen und durchlief alle drei PIPAC-Zyklen, später stellte sie sich jedoch als nicht protokollgemäß heraus. Bei zwei Patientinnen konnten keine Follow-up Daten erhoben werden. 54
59 In einer zweiten, verblindeten radiologischen Analyse von 31 Patientinnen der PP- Population zeigten sich vergleichbare Ergebnisse hinsichtlich des Tumoransprechens. 16 der 31 Patientinnen (52 %) zeigten ein objektives Ansprechen auf die Therapie. Eine Patientin zeigte ein partielles Ansprechen, 15 einen stabilen Krankheitsverlauf. Eine histologische Tumorregression konnte bei 33 von 53 Patientinnen (62 %) der ITT- Population und bei 26 von 34 Patientinnen (76 %) in der PP-Population nachgewiesen werden. In einer externen, verblindeten histologischen Untersuchung der Peritoneal- Biopsien konnten vergleichbare Ergebnisse festgehalten werden: Bei 38 von 53 Patientinnen (72 %) der ITT-Population und bei 30 von 34 Patientinnen (88 %) der PP- Population konnte eine Tumor-Regression beobachtet werden. Die folgende Tabelle 8 zeigt die histologischen Regressionsraten der ITT- und PP-Population, unterteilt in moderate und starke Regression. Dabei werden sowohl die Ergebnisse der internen als auch die Ergebnisse der externen, verblindeten histologischen Untersuchung demonstriert. 55
60 Tabelle 10 Histologische Beurteilung der Tumorregression bei 53 Patientinnen mit rezidiviertem Platinum-resistenten Ovarial-, Tuben- oder primären Peritonealkarzinom, die eine PIPAC erhalten haben Population Moderate Starke Regression Regression Regression insgesamt Interne pathologische Beurteilung ITT Population (n=53) /53 (62 %) PP-Population (n=34) /34 (76 %) Externe, verblindete pathologische Beurteilung ITT-Population (n=53) /53 (72 %) PP-Population (n=34) /34 (88 %) Anmerkung: ITT= Intention to treat; PP= per protocol 4.3 PCI-Veränderungen unter PIPAC Eine Verbesserung des PCI konnte in den laparoskopischen Video-Aufnahmen bei 26 von 34 Patientinnen (76 %), die alle drei PIPAC-Zyklen durchlaufen haben, beobachtet werden. Abbildung 7 zeigt Bilder einer laparoskopischen Videoaufnahme einer Patientin während der ersten, zweiten und dritten PIPAC und die jeweiligen Proben der Tumor-Biopsien. Im intraoperativen makroskopischen Befund (Bild a1, a2, a3) lassen sich im Verlauf der PIPAC-Therapie sowohl Sklerosen der Peritonealknoten als auch Vernarbungen des viszeralen und parietalen Peritoneum beobachten. Die dazugehörigen histologischen Befunde wurden ebenfalls während der ersten, zweiten und dritten PIPAC gewonnen und demonstrieren die Regression des Tumors, eine Fibrose und eine 56
61 akute und chronische Entzündung (Bild b1, b2, b3). Insgesamt zeigt sich also im Verlauf der PIPAC-Anwendung sowohl eine makroskopisch als auch eine histologisch sichtbare Tumor-Regression und Vernarbung. Abbildung 7 Intraoperativer (a1, a2, a3) und histologischer (b1, b2, b3) Befund vor der ersten, zweiten und dritten PIPAC 57
62 4.4 Laborchemische Veränderung unter PIPAC Vor jedem der drei PIPAC-Zyklen wurde den Patientinnen Blut abgenommen und laborchemisch untersucht. Dabei wurden insbesondere die Veränderungen des Tumormarkers CA-125 sowie von CRP, Phosphat und Kreatinin detektiert. Für jeden dieser Untersuchungsparameter werden hier die Mittelwerte von der ersten PIPAC mit den Mittelwerten der dritten PIPAC verglichen. Zur genaueren Untersuchung und Bewertung der Unterschiede dieser Mittelwerte und zur Prüfung der Signifikanz wurde der T- Test angewendet. Die P-Werte sind zweiseitig und ein P-Wert von < 0,05 wird als statistisch signifikant angesehen. Tabelle 11 zeigt den direkten Vergleich der Mittelwerte, Standardabweichungen und P-Werte von CA-125, CRP, Phosphat und Kreatinin zum Zeitpunkt des ersten und dritten PIPAC-Zyklus. Die Werte des Serum-CA-125 nehmen von der ersten zur dritten PIPAC ab (1. PIPAC: 1551,00 3. PIPAC: 1466,75). Auch die CRP-Werte sinken von 10,2357 auf 3,6923. Die Phosphat-Werte bleiben im Verlauf stabil. Beim Kreatinin ist ein leichter Anstieg von 0,8834 zum Zeitpunkt der ersten PIPAC auf 0,9639 bei der dritten PIPAC zu sehen. Im T-Test zeigt sich, dass bei allen untersuchten laborchemischen Parametern (Ca-125, CRP, Phosphat, Kreatinin) die P-Werte über 0,05 liegen. Es besteht also kein statistisch signifikanter Unterschied der Laborparameter zum Zeitpunkt vor der ersten PIPAC und vor der dritten PIPAC. Tabelle 11 Direkter Vergleich der Mittelwerte, Standardabweichungen und P-Werte von CA-125, CRP, Phosphat und Kreatinin zum Zeitpunkt des ersten und dritten PIPAC-Zyklus (Werte gerundet) 1. PIPAC 3. PIPAC P-Wert CA-125 Mittelwert 1551,0 1466,75 Standardabweichung 3735,7 2493,9 0,9 CRP Mittelwert 10,2 3,7 Standardabweichung 43,5 4,3 0,4 Phosphat Mittelwert 3,1 3,2 Standardabweichung 0,61 0,82 0,6 Kreatinin Mittelwert 0,88 0,96 Standardabweichung 0,29 0,44 0,3 58
63 4.5 Einfluss auf das Überleben Das Gesamtüberleben und das progressionsfreie Überleben der ITT- und PP-Population sind auf den folgenden Abbildungen 8, 9, 10 und 11 als Kaplan-Meier Kurven dargestellt. Abbildung 8 und 9 zeigen dabei den Zusammenhang zwischen der Gesamtüberlebensrate und der Überlebenszeit in Tagen von 53 Patientinnen, die mindestens eine PIPAC-Therapie erhalten haben. Auf der x-achse ist dabei die Überlebenszeit in Tagen (Survival Time [Days]) und auf der y-achse die nach dem Kaplan-Meier-Verfahren berechnete Gesamtüberlebensrate (Overall-Survival) in Prozent abgebildet. Abbildung 8 bezieht sich dabei auf die ITT-Population und Abbildung 9 auf die PP-Population. Die kumulative Gesamtüberlebensrate der ITT-Population lag nach einem Jahr bei 50 % mit einer mittleren Überlebenszeit von 331 Tagen (95 % Konfidenzintervall 291 bis 371 Tage). In der PP-Population lag das kumulative Gesamtüberleben nach einem Jahr bei 63 % mit einer mittleren Überlebenszeit von 407 Tagen (95 % Konfidenzintervall 347 bis 468 Tage). Die Abbildungen 10 und 11 zeigen die Kaplan-Meier-Kurven zum progressionsfreien Überleben. Auf der x-achse wird ebenfalls die Überlebenszeit in Tagen (Survival Time [Days]) abgebildet und auf der y-achse das progressionsfreie Überleben (Progression- Free Survival) in Prozent, berechnet nach Kaplan-Meier. Abbildung 10 bezieht sich auf die ITT-Population, während Abbildung 11 die Daten für die PP-Population abbildet. In der ITT-Population dauerte es im Mittel 144 Tage bis zur Progression (95 % Konfidenzintervall 122 bis 168 Tage). In der PP-Population brauchte es im Mittel 174 Tage (95 % Konfidenzintervall 150 bis 199 Tage) bis zum Progress des Tumors. 59
64 Abbildung 8 Kaplan-Meier Gesamtüberlebenskurve von 53 Patientinnen, die mindestens eine PIPAC-Therapie erhalten haben (ITT-Population) 60
65 Abbildung 9 Kaplan-Meier Gesamtüberlebenskurve von 34 Patientinnen, die alle drei PIPAC-Zyklen durchlaufen haben (PP-Population) 61
66 Abbildung 10 Progressionsfreies Überleben (nach Kaplan-Meier) der ITT- Population von 53 Patientinnen, die mindestens eine PIPAC-Therapie erhalten haben 62
67 Abbildung 11 Progressionsfreies Überleben (nach Kaplan-Meier) der PP- Population von 34 Patientinnen, die alle drei PIPAC-Zyklen erhalten haben 4.6 Nebenwirkungen Die CTCAE-Kriterien (Common Terminology Criteria for Adverse Events) stellen eine deskriptive Terminologie dar, anhand derer Nebenwirkungen und deren Schweregrad eingeteilt werden können (Common Terminology Criteria for Adverse Events (CTCAE) version 4.0, 2009). Dabei ist ein Adverse Event definiert als jedes unerwünschte und unbeabsichtigte Zeichen (einschließlich abnormaler Laborbefunde), jedes Symptom oder jede Erkrankung, die eine medizinische Behandlung oder Prozedur nach sich zieht. Dabei werden alle Adverse Events dokumentiert, egal ob sie aus der medizinischen Behandlung resultieren oder nicht. Für jede Körperregion werden die jeweiligen Schweregrade von 1 bis 5 eingeteilt und organspezifisch definiert. Allgemein können die Grade allerdings wie in der folgenden Tabelle determiniert werden. 63
68 Tabelle 12 Definition der Schweregrade der CTCAE-Grade (Common Terminology Criteria for Adverse Events (CTCAE) version 4.0, 2009) Grad Definition 1 Mild; asymptomatische oder milde Symptome; klinische oder diagnostische Beobachtung; keine Intervention erforderlich 2 Moderat; minimale, lokale oder noninvasive Intervention erforderlich; limitiert altersabhängige instrumentelle ADL* 3 Ernst oder medizinisch relevant, aber nicht unmittelbar lebensbedrohlich; Hospitalisation oder verlängerte Hospitalisation indiziert; behindernd; limitiert Self-Care-ADL** 4 Lebensbedrohliche Folgen; Intervention dringend erforderlich 5 Tod infolge der Adverse Events *instrumentelle ADL (=Activities of Daily Living) = Mahlzeiten bereiten, Lebensmittel/Kleidung einkaufen ** Self-Care-ADL = Waschen, Anziehen, Ausziehen, Essen, Toilettenbenutzung, Medikamenteneinnahme, keine Bettlägerigkeit In dieser Studie gab es keine behandlungsbezogenen Todesfälle. Ein Toxizitäts-Grad 4 nach den Kriterien des CTCAE konnte nicht beobachtet werden. Folgende Grad-3-Toxizitäten traten während der PIPAC-Zyklen auf: Trokar-Hernie (n=2), Darmobstruktion (n=2), abdominale Schmerzen (n=2), Hämatome (n=1), intraoperative Blutungen (n=1), Zystitis mit Urosepsis (n=1). Akute und chronische Nebenwirkungen während der PIPAC-Zyklen sind in Tabelle 15 dargestellt. 64
69 Tabelle 13 Akute und chronische Nebenwirkungen bei 53 Patientinnen, die eine PIPAC-Therapie erhalten haben Grad 1 Grad 2 Grad 3 Trokar-Hernie (4 %) Abdominale Schmerzen 53/53 (100 %) 0 2 (4 %) Darmobstruktion (2 %) Blutung (2 %) Intraoperative Blutung (2 %) Zystitis 0 1 (2 %) 0 Urosepsis (2 %) Kardial 6 (11 %) 0 0 Neurologisch 1 (2 %) 0 0 Renal 1 (2 %) 1 (2 %) 0 Pulmonal 0 5 (9 %) 0 inflammatorisch* 10 (19 %) 25 (47 %) 0 Anmerkung: * CRP-Anstieg (Verdopplung des initialen CRP-Wertes = Grad 1, Verdreifachung des initialen CRP-Wertes = Grad 2) 4.7 Einfluss auf die Lebensqualität Die Lebensqualität der mit PIPAC therapierten Patientinnen wurde mittels des EORTC QLQ-C30 Fragebogen bemessen. Die derzeit aktuellste Version ist der EORTC QLQ- C30 Version (siehe EORTC QLQ-C30, Seite 49-51). Die Patientinnen beantworteten diesen Fragebogen einen Tag vor der ersten, zweiten und dritten PIPAC. Sieben Patientinnen füllten den Fragebogen vor der ersten, vier vor der zweiten und sechs vor der dritten PIPAC nicht aus, sodass ihre Werte nicht erhoben werden konnten. Die Abbildungen 12 bis 15 stellen anhand von Säulendiagrammen die 65
70 Ergebnisse der erfragten unterschiedlichen Qualitäten in Prozent dar. In Abbildung 12 sind die unterschiedlichen erfragten Qualitäten des EORTC QLQ-C30 Fragebogens in einer Bewertungsskala zusammengefasst. Die einzelnen Säulen zeigen die Lebensqualität insgesamt zum Zeitpunkt der ersten, zweiten und dritten PIPAC. Aus der Grafik geht eine kontinuierliche Verbesserung der Lebensqualität unter der PIPAC-Therapie hervor. Vor der ersten PIPAC liegt der Wert bei 52 (95 % Konfidenzintervall 45,8 bis 58,3), vor der zweiten PIPAC bei 58,1 (95 % Konfidenzintervall 50,7 bis 65,6) und vor der dritten PIPAC sind 59,5 (95 % Konfidenzintervall 51,3 bis 67,6) zu verzeichnen. Die Symptome Nausea/Erbrechen, Appetitlosigkeit, Diarrhö und Obstipation sind in Abbildung 13 dargestellt. Sie nahmen während der Therapie ab. Besonders die Obstipation zeigte einen deutlichen Rückgang von 30 % bei der ersten PIPAC auf nur noch 11 % beim dritten Zyklus. Die Symptome Übelkeit und Erbrechen nahmen von 17 % auf 11 % ab. In Abbildung 14 zeigt sich eine Verbesserung der physischen und kognitiven Funktionen. Die Punkte für emotionale Befindlichkeit und die sozialen Qualitäten steigen von der ersten zur zweiten PIPAC deutlich an (Emotion: von 62 % auf 72 %, soziale Qualitäten: von 55 % auf 68 %). Von der zweiten zur dritten PIPAC kommt es zu einer minimalen Verschlechterung um 5 % bei den sozialen Qualitäten und um 4 % bei der emotionalen Befindlichkeit. Das Rollenerleben bleibt im Verlauf aller PIPAC- Behandlungen stabil, beim dritten Zyklus ist ein minimaler Anstieg um 0,5 % zu erkennen. Im letzten Säulendiagramm zur Darstellung der Lebensqualität während der PIPAC-Therapie (Abbildung 15) zeigt sich eine Verschlechterung der Symptome Dyspnoe und Schmerzen. Die Schmerzen verstärken sich von 34 % bei der ersten PIPAC auf 38 % bei der dritten PIPAC. Die Dyspnoe zeigt einen Anstieg von 29 % auf 34 %. Eine Symptomverbesserung weisen die Qualitäten Müdigkeit und Schlaflosigkeit auf. Die Müdigkeit nimmt von noch 48 % während des ersten PIPAC-Zyklus auf 42 % bei der dritten PIPAC ab, die Schlaflosigkeit reduziert sich um 3 %. 66
71 Abbildung 12 Skalen zur Lebensqualität insgesamt gemäß den Punkten aus dem EORTC QLQ-C30 Fragebogen während der PIPAC-Zyklen 1 bis 3 67
72 Abbildung 13 Gastrointestinale Symptome gemäß den Punkten aus dem EORTC QLQ-C30 Fragebogen während der PIPAC-Zyklen 1 bis 3 68
73 Abbildung 14 Skalen zu Physis, Rollenerleben, Emotionen, kognitiven Fähigkeiten und sozialen Qualitäten gemäß den Punkten aus dem EORTC QLQ-C30 Fragebogen während der PIPAC-Zyklen 1 bis 3 69
74 Abbildung 15 Skalen zu Schmerzen, Müdigkeit, Dyspnoe und Schlaflosigkeit gemäß den Punkten aus dem EORTC QLQ-C30 Fragebogen während der PIPAC- Zyklen 1 bis 3 70
Hauptvorlesung Gynäkologie und Geburtshilfe. Behandlung von Ovarialtumoren. Diagnostik präoperativ. Minimal invasive Therapie
 Hauptvorlesung Gynäkologie und Geburtshilfe VII. Diagnostik und Therapie der Tumoren des Ovars Behandlung von Ovarialtumoren Diagnostik präoperativ Vaginalsonographie Karzinomrisiko-Abschätzung Klinisches
Hauptvorlesung Gynäkologie und Geburtshilfe VII. Diagnostik und Therapie der Tumoren des Ovars Behandlung von Ovarialtumoren Diagnostik präoperativ Vaginalsonographie Karzinomrisiko-Abschätzung Klinisches
FIGO Stadien 2014 ( massgeblich ist das postoperative Stadium.
 Ovarialkarzinom = Invasives Adenokarzinom des Ovars 1 ; die gilt auch für das Tubenkarzinom und das primäre peritoneale Karzinom 1. Grundlagen S3-2013 (Blaubuch) ESMO Guideline (Blaubuch) Jede Patientin
Ovarialkarzinom = Invasives Adenokarzinom des Ovars 1 ; die gilt auch für das Tubenkarzinom und das primäre peritoneale Karzinom 1. Grundlagen S3-2013 (Blaubuch) ESMO Guideline (Blaubuch) Jede Patientin
Vulvakarzinom Epitheliales Ovarialkarzinom Zervixkarzinom Endometriumkarzinom
 Vulvakarzinom Epitheliales Ovarialkarzinom Zervixkarzinom Endometriumkarzinom Verantwortlich: M. Bossart, K.Henne Freigabe: interdisziplinärer Qualitätszirkel Stand: 06/16, gültig bis 07/18 Version 3.1
Vulvakarzinom Epitheliales Ovarialkarzinom Zervixkarzinom Endometriumkarzinom Verantwortlich: M. Bossart, K.Henne Freigabe: interdisziplinärer Qualitätszirkel Stand: 06/16, gültig bis 07/18 Version 3.1
4.1. Chirurgie gemäss Leitlinie Gynäkologische Onkologie
 Ovarialkarzinom = Invasives Adenokarzinom des Ovars 1 ; die gilt auch für das Tubenkarzinom und das primäre peritoneale Karzinom 1. Grundlagen S3-2013 (Blaubuch) ESMO Guideline (Blaubuch) Jede Patientin
Ovarialkarzinom = Invasives Adenokarzinom des Ovars 1 ; die gilt auch für das Tubenkarzinom und das primäre peritoneale Karzinom 1. Grundlagen S3-2013 (Blaubuch) ESMO Guideline (Blaubuch) Jede Patientin
Ovarialkarzinom. Dr. Szabó Gábor
 Ovarialkarzinom Dr. Szabó Gábor Allgemeine aber persistierende Beschwerden Müdigkeit Blähungen Becken- oder Bauchschmerzen Probleme beim Essen zb. sich schnell satt zu fühlen Harnsymptome (Dranggefühl,
Ovarialkarzinom Dr. Szabó Gábor Allgemeine aber persistierende Beschwerden Müdigkeit Blähungen Becken- oder Bauchschmerzen Probleme beim Essen zb. sich schnell satt zu fühlen Harnsymptome (Dranggefühl,
Hauptvorlesung Gynäkologie und Geburtshilfe. VII. Diagnostik und Therapie der Tumoren des Ovars
 Hauptvorlesung Gynäkologie und Geburtshilfe VII. Diagnostik und Therapie der Tumoren des Ovars Behandlung von Ovarialtumoren Diagnostik präoperativ Vaginalsonographie Karzinomrisiko-Abschätzung Klinisches
Hauptvorlesung Gynäkologie und Geburtshilfe VII. Diagnostik und Therapie der Tumoren des Ovars Behandlung von Ovarialtumoren Diagnostik präoperativ Vaginalsonographie Karzinomrisiko-Abschätzung Klinisches
3.12 Eierstöcke. ähnlich den Seminomen und embryonalen Hodentumoren. Kernaussagen
 ICD-10 C56 Ergebnisse zur 93 3.12 Eierstöcke Kernaussagen Inzidenz und Mortalität: Die Neuerkrankungsraten haben sich zwischen 1980 und 2004 in den verschiedenen Altersgruppen unterschiedlich entwickelt.
ICD-10 C56 Ergebnisse zur 93 3.12 Eierstöcke Kernaussagen Inzidenz und Mortalität: Die Neuerkrankungsraten haben sich zwischen 1980 und 2004 in den verschiedenen Altersgruppen unterschiedlich entwickelt.
Darum liegt in mehr als der Hälfte der Fälle bereits bei Diagnosestellung ein fortgeschritteneres Stadium der Erkrankung vor.
 OVARIALKARZINOM EPIDEMIOLOGIE Das Ovarialkarzinom (Eierstockkrebs) stellt die häufigste Todesursache durch ein Malignom bei der Frau dar. In Österreich erkranken jährlich rund 936 Frauen an einem Eierstockkrebs.
OVARIALKARZINOM EPIDEMIOLOGIE Das Ovarialkarzinom (Eierstockkrebs) stellt die häufigste Todesursache durch ein Malignom bei der Frau dar. In Österreich erkranken jährlich rund 936 Frauen an einem Eierstockkrebs.
Fertilitätserhaltende Therapie
 ende Therapie B. Schmalfeldt Ovarialkarzinom Borderline Tumoren Keimzelltumoren Frühes Ovarialkarzinom FIGO I-II Statement 2007 Bei gesichertem Stadium FIGO IA mit Grading 1 ist ein fertilitätserhaltendes
ende Therapie B. Schmalfeldt Ovarialkarzinom Borderline Tumoren Keimzelltumoren Frühes Ovarialkarzinom FIGO I-II Statement 2007 Bei gesichertem Stadium FIGO IA mit Grading 1 ist ein fertilitätserhaltendes
Protokol ID: AGO-OVAR OP.4 (AGO DESKTOP OVAR III)
 EINE RANDOMISIERTE, MULTIZENTRISCHE STUDIE ZUM VERGLEICH DER WIRKSAMKEIT EINER ZUSÄTZLICHEN TUMORDEBULKING-OPERATION GEGEN EINE ALLEINIGE CHEMOTHERAPIE BEI PATIENTINNEN MIT EINEM PLATIN-SENSIBLEN OVARIALKARZINOM-REZIDIV
EINE RANDOMISIERTE, MULTIZENTRISCHE STUDIE ZUM VERGLEICH DER WIRKSAMKEIT EINER ZUSÄTZLICHEN TUMORDEBULKING-OPERATION GEGEN EINE ALLEINIGE CHEMOTHERAPIE BEI PATIENTINNEN MIT EINEM PLATIN-SENSIBLEN OVARIALKARZINOM-REZIDIV
Ovarialkarzinom-wie wird die Diagnose am Besten gestellt
 Ovarialkarzinom-wie wird die Diagnose am Besten gestellt Priv.Doz.Dr.med Herbert Mecke Vivantes Auguste-Viktoria Klinikum Berlin Tumorstadieneinteilung Eileiter Gebärmutter Stadium I Stadium II Eierstöcke
Ovarialkarzinom-wie wird die Diagnose am Besten gestellt Priv.Doz.Dr.med Herbert Mecke Vivantes Auguste-Viktoria Klinikum Berlin Tumorstadieneinteilung Eileiter Gebärmutter Stadium I Stadium II Eierstöcke
Uterine Leiomyosarkome
 Uterine Leiomyosarkome U. A. Ulrich Martin-Luther-Krankenhaus, Berlin AGO State-of-the-Art München, 6. 8. April 2017 LMS: Epidemiologie 1,3 % der uterinen Malignome, 50 % der uterinen Sarkome medianes
Uterine Leiomyosarkome U. A. Ulrich Martin-Luther-Krankenhaus, Berlin AGO State-of-the-Art München, 6. 8. April 2017 LMS: Epidemiologie 1,3 % der uterinen Malignome, 50 % der uterinen Sarkome medianes
AGO-OVAR 19 / TRUST. (platinfreies Intervall 6-12 Monate) Intermediär-platinsensibles Rezidiv. Erstdiagnose FIGO IIIB-IV
 Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand juni 2017 Intermediär-platinsensibles Rezidiv (platinfreies
Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand juni 2017 Intermediär-platinsensibles Rezidiv (platinfreies
OVAR (C56) SITUATION IN DEUTSCHLAND SITUATION IN RHEINLAND-PFALZ. Das mittlere Erkrankungsalter beträgt 69 Jahre.
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN OVAR (C56) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 213 13,8 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN OVAR (C56) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 213 13,8 Mortalität
Berno Tanner. State of the Art Ovar 19.06.2009
 Pathologie und Konsequenzen für die Klinik Histologische Tumortypen Friedrich Kommoss Berno Tanner State of the Art Ovar 19.06.2009 Histologische Tumortypen benigne borderline maligne Histologische Tumortypen
Pathologie und Konsequenzen für die Klinik Histologische Tumortypen Friedrich Kommoss Berno Tanner State of the Art Ovar 19.06.2009 Histologische Tumortypen benigne borderline maligne Histologische Tumortypen
Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms. Diagnostik
 Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms Diagnostik Diagnostik: Zielsetzung und Fragestellungen Diagnostik (siehe Kapitel 3.3) Welche Symptome weisen auf ein
Die aktuelle S3-Leitlinie zur Diagnsotik, Therapie und Nachsorge des Ovarialkarzinoms Diagnostik Diagnostik: Zielsetzung und Fragestellungen Diagnostik (siehe Kapitel 3.3) Welche Symptome weisen auf ein
Pathologie des Ovars
 Pathologie des Ovars Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Nichtneoplastische Zysten und tumorartige Läsionen
Pathologie des Ovars Cornelius Kuhnen Institut für Pathologie am Clemenshospital Münster Medical-Center Düesbergweg 128 48153 Münster www.patho-muenster.de Nichtneoplastische Zysten und tumorartige Läsionen
internationalen SAiL Studie, in der die Sicherheit und Wirksamkeit des VEGF Antikörpers in der täglichen Routine analysiert werden.
 DGP Kongress in Lübeck Avastin überwindet Therapiestillstand beim fortgeschrittenen NSCLC Lübeck (11. April 2008) - Die zielgerichtete First Line -Therapie mit dem Angiogenese Hemmer Bevacizumab (Avastin
DGP Kongress in Lübeck Avastin überwindet Therapiestillstand beim fortgeschrittenen NSCLC Lübeck (11. April 2008) - Die zielgerichtete First Line -Therapie mit dem Angiogenese Hemmer Bevacizumab (Avastin
BRUST (C50) SITUATION IN DEUTSCHLAND SITUATION IN RHEINLAND-PFALZ
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN BRUST (C5) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 121,5 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN BRUST (C5) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 121,5 Mortalität
Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/ ,
 Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand Dezember 2017, A.Jaeger 1 Erstdiagnose FIGO IIIB-IV
Ovarialkarzinom Aktuelle Studien in der Klinik für Gynäkologie des UKE Kontakt Studiensekretariat: Sylke Krenkel (040/7410-57970, skrenkel@uke.de) Stand Dezember 2017, A.Jaeger 1 Erstdiagnose FIGO IIIB-IV
Was ist die beste Nachsorge? 2. Berliner Tag des Eierstock- und Bauchfellkrebses am 11. September 2010
 Was ist die beste Nachsorge? 2. Berliner Tag des Eierstock- und Bauchfellkrebses am 11. September 2010 Jochem Potenberg Ev. Waldkrankenhaus Berlin Einführung 8500 Neuerkrankungen in Deutschland pro Jahr
Was ist die beste Nachsorge? 2. Berliner Tag des Eierstock- und Bauchfellkrebses am 11. September 2010 Jochem Potenberg Ev. Waldkrankenhaus Berlin Einführung 8500 Neuerkrankungen in Deutschland pro Jahr
Das Mammakarzinom: Diagnostik und Therapie
 Medizin Martin Smollich Das Mammakarzinom: Diagnostik und Therapie Wissenschaftlicher Aufsatz Martin Smollich Das Mammakarzinoms: Diagnostik und Therapie 1. Inzidenz, Risikofaktoren, Prävention, Früherkennung
Medizin Martin Smollich Das Mammakarzinom: Diagnostik und Therapie Wissenschaftlicher Aufsatz Martin Smollich Das Mammakarzinoms: Diagnostik und Therapie 1. Inzidenz, Risikofaktoren, Prävention, Früherkennung
Pathologie und Prognoseparameter. AGO e.v. in der DGGG e.v. sowie in der DKG e.v. Dietmar Schmidt Institut für Pathologie A2,2; Mannheim
 Pathologie und Prognoseparameter Dietmar Schmidt Institut für Pathologie A2,2; Mannheim Endometriales Adenokarzinom Histologische Typen (WHO 2003) Endometrioid Muzinös Serös Klarzellig Undifferenziert
Pathologie und Prognoseparameter Dietmar Schmidt Institut für Pathologie A2,2; Mannheim Endometriales Adenokarzinom Histologische Typen (WHO 2003) Endometrioid Muzinös Serös Klarzellig Undifferenziert
Hintergrundwissen. " Tumorstadium. " postoperativer Tumorrest. " Alter. " Allgemeinzustand
 550 GebFra HandsOn Allgemeine Gynäkologie Onkologie Geburtshilfe Perinatalmedizin Endokrinologie Reproduktionsmedizin Spezialgebiete HandsOn " Primäres Ovarialkarzinom Hintergrundwissen " Operative Therapie
550 GebFra HandsOn Allgemeine Gynäkologie Onkologie Geburtshilfe Perinatalmedizin Endokrinologie Reproduktionsmedizin Spezialgebiete HandsOn " Primäres Ovarialkarzinom Hintergrundwissen " Operative Therapie
DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN
 DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN Allgemeines Wesentlich in der Therapie der Hodentumore sind: die exakte histologische Untersuchung die Bestimmung des Stadiums die Festlegung der
DIAGNOSTIK UND THERAPIE NICHTSEMINOMATÖSER HODENTUMOREN Allgemeines Wesentlich in der Therapie der Hodentumore sind: die exakte histologische Untersuchung die Bestimmung des Stadiums die Festlegung der
Update Onkologie - Gynäkologie und Senologie- Prof. Dr. Dorothea Fischer Klinikum Ernst von Bergmann Potsdam
 Update Onkologie - Gynäkologie und Senologie- Prof. Dr. Dorothea Fischer Klinikum Ernst von Bergmann Potsdam Agenda Ovar/ Tube/ Peritoneum Endometrium Zervix Vulva Mamma Ovarial- /Tuben- /Peritonealkarzinom
Update Onkologie - Gynäkologie und Senologie- Prof. Dr. Dorothea Fischer Klinikum Ernst von Bergmann Potsdam Agenda Ovar/ Tube/ Peritoneum Endometrium Zervix Vulva Mamma Ovarial- /Tuben- /Peritonealkarzinom
O f f e n e S t u d i e n - August 2013 -
 Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
Sehr geehrte Patientinnen und Angehörige, sehr geehrte Ärztinnen und Ärzte, Klinische Studien zur Behandlung des Ovarial-, Tuben-, Endometrium- und Peritonealkarzinoms: bevor antihormonelle, chemotherapeutische
MALIGNE KEIMZELLTUMOREN DES OVARS. W. Schröder
 MALIGNE KEIMZELLTUMOREN DES OVARS W. Schröder INZIDENZ VON KEIMZELLTUMOREN DES OVARS 20-25% aller Ovarialtumoren 3% aller Keimzelltumoren sind maligne 60-70% aller Ovarialtumoren < 20 Jahren 3-10% aller
MALIGNE KEIMZELLTUMOREN DES OVARS W. Schröder INZIDENZ VON KEIMZELLTUMOREN DES OVARS 20-25% aller Ovarialtumoren 3% aller Keimzelltumoren sind maligne 60-70% aller Ovarialtumoren < 20 Jahren 3-10% aller
Operative und systemische Therapie des Endometriumkarzinoms
 Operative und systemische Therapie des Endometriumkarzinoms J. Huober Workshop DESO St.Gallen 20./21. Februar 2015 Univ.-Frauenklinik Ulm Integratives Tumorzentrum des Universitätsklinikums und der Medizinischen
Operative und systemische Therapie des Endometriumkarzinoms J. Huober Workshop DESO St.Gallen 20./21. Februar 2015 Univ.-Frauenklinik Ulm Integratives Tumorzentrum des Universitätsklinikums und der Medizinischen
3 Ergebnisse 3.1 Klinische Befunde Alter und Geschlecht in Abhängigkeit von der Überlebenszeit
 13 3 Ergebnisse 3.1 Klinische Befunde 3.1.1 Alter und Geschlecht in Abhängigkeit von der Überlebenszeit Es wurden die klinischen Daten von 33 Patienten ausgewertet. Es handelte sich um 22 Frauen (66,7
13 3 Ergebnisse 3.1 Klinische Befunde 3.1.1 Alter und Geschlecht in Abhängigkeit von der Überlebenszeit Es wurden die klinischen Daten von 33 Patienten ausgewertet. Es handelte sich um 22 Frauen (66,7
3.2 Speiseröhre. Kernaussagen
 ICD-10 C15 Ergebnisse zur 21 3.2 Speiseröhre Kernaussagen Inzidenz und Mortalität: In Deutschland erkrankten nach der tausendwende pro etwa 1.050 und 3.900 an Speiseröhrenkrebs. Seit 1980 waren die Erkrankungs-
ICD-10 C15 Ergebnisse zur 21 3.2 Speiseröhre Kernaussagen Inzidenz und Mortalität: In Deutschland erkrankten nach der tausendwende pro etwa 1.050 und 3.900 an Speiseröhrenkrebs. Seit 1980 waren die Erkrankungs-
PROSTATA (C61) SITUATION IN DEUTSCHLAND SITUATION IN RHEINLAND-PFALZ
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PROSTATA (C61) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 86,6 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PROSTATA (C61) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212 86,6 Mortalität
Brustkrebs aktuell - OSP am Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms?
 Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
Brustkrebs aktuell - OSP am 21.10.2015 Was ist eigentlich die Aufgabe des Pathologen in Diagnostik und Therapie des Mammakarzinoms? Prof. Dr. German Ott, Institut für Pathologie Robert-Bosch-Krankenhaus
PROSTATA (C61) SITUATION IN DEUTSCHLAND SITUATION IN RHEINLAND-PFALZ
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PROSTATA (C61) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 213 78,3 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PROSTATA (C61) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 213 78,3 Mortalität
Prof. Dr. med. Jalid Sehouli
 Post-ASCO 2010: Aktuelle Ergebnisse zum Ovarial- und Zervixkarzinom Haben wir einen neuen Standard für die Primärtherapie des fortgeschrittenen Ovarialkarzinoms? Prof. Dr. med. Jalid Sehouli Berlin (23.
Post-ASCO 2010: Aktuelle Ergebnisse zum Ovarial- und Zervixkarzinom Haben wir einen neuen Standard für die Primärtherapie des fortgeschrittenen Ovarialkarzinoms? Prof. Dr. med. Jalid Sehouli Berlin (23.
Diagnostik und Behandlung des Gebärmutterkrebs
 Diagnostik und Behandlung des Gebärmutterkrebs PD Dr. med. Patrick Imesch Leitender Arzt Klinik für Gynäkologie Cancer Academy - Gynäkologische Tumoren, Dienstag, 14. Mai 2019 Die Betrogene Offizierswitwe
Diagnostik und Behandlung des Gebärmutterkrebs PD Dr. med. Patrick Imesch Leitender Arzt Klinik für Gynäkologie Cancer Academy - Gynäkologische Tumoren, Dienstag, 14. Mai 2019 Die Betrogene Offizierswitwe
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
GEBÄRMUTTERKÖRPER (C54-C55)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERKÖRPER (C54-C55) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT C54 C55 Altersstandardisierte Rate (/1.) Europastandard Inzidenz
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERKÖRPER (C54-C55) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT C54 C55 Altersstandardisierte Rate (/1.) Europastandard Inzidenz
HIPEC noch Wissenschaft oder schon Routine in der Rezidivsituation? Walther Kuhn Universitätsfrauenklinik, Bonn
 HIPEC noch Wissenschaft oder schon Routine in der Rezidivsituation? Walther Kuhn Universitätsfrauenklinik, Bonn Intraperitoneale Therapie: Rationale Ovarialkarzinom-Peritoneale Erkrankung Intraperitoneale
HIPEC noch Wissenschaft oder schon Routine in der Rezidivsituation? Walther Kuhn Universitätsfrauenklinik, Bonn Intraperitoneale Therapie: Rationale Ovarialkarzinom-Peritoneale Erkrankung Intraperitoneale
Empfehlungen für die Diagnostik und Therapie maligner Ovarialtumoren
 Empfehlungen für die Diagnostik und Therapie maligner Ovarialtumoren Aktualisierte Empfehlungen der Kommission Ovar auf Grundlage der S2k Leitlinie (Version 1.0, Mai 2007) ohne Angabe der Evidenzlevel
Empfehlungen für die Diagnostik und Therapie maligner Ovarialtumoren Aktualisierte Empfehlungen der Kommission Ovar auf Grundlage der S2k Leitlinie (Version 1.0, Mai 2007) ohne Angabe der Evidenzlevel
Aktuelle Aspekte zur Operation. Dr. med. Jens-Peter Scharf
 Aktuelle Aspekte zur Operation Dr. med. Jens-Peter Scharf Grundlagen der Behandlung Eine optimale Operation und anschließend eine optimale Chemotherapie Beide Behandlungsformen gehören zusammen 2 Was ist
Aktuelle Aspekte zur Operation Dr. med. Jens-Peter Scharf Grundlagen der Behandlung Eine optimale Operation und anschließend eine optimale Chemotherapie Beide Behandlungsformen gehören zusammen 2 Was ist
GEBÄRMUTTERKÖRPER (C54-C55)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERKÖRPER (C54-C55) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT C54 C55 Altersstandardisierte Rate (/1.) Europastandard Inzidenz
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERKÖRPER (C54-C55) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT C54 C55 Altersstandardisierte Rate (/1.) Europastandard Inzidenz
Therapie der älteren Patientin
 Therapie der älteren Patientin P. Wimberger, F. Hilpert Universitätsklinikum Essen Universitätsklinikum Kiel Ovarialkarzinom - State of the Art AGO-Symposium München 20.Juni 2009 Lebenserwartung von Frauen
Therapie der älteren Patientin P. Wimberger, F. Hilpert Universitätsklinikum Essen Universitätsklinikum Kiel Ovarialkarzinom - State of the Art AGO-Symposium München 20.Juni 2009 Lebenserwartung von Frauen
Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC
 SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
SATURN-Studie: Erhaltungstherapie mit Erlotinib verlängert Gesamtüberleben bei fortgeschrittenem NSCLC Grenzach-Wyhlen (13. August 2009) - Aktuelle Daten der SATURN-Studie bestätigen eine signifikante
Systematische pelvine und paraaortale Lymphonodektomie beim Ovarialkarzinom?
 Thema 11/4/22 Prof. Peter Scheidel Frauenklinik Marienkrankenhaus D 2287 Hamburg Systematische pelvine und paraaortale Lymphonodektomie beim Ovarialkarzinom? In den vergangenen Jahren wurde beim Ovarialkarzinom
Thema 11/4/22 Prof. Peter Scheidel Frauenklinik Marienkrankenhaus D 2287 Hamburg Systematische pelvine und paraaortale Lymphonodektomie beim Ovarialkarzinom? In den vergangenen Jahren wurde beim Ovarialkarzinom
Uterine Sarkome. S2k Leitlinie AWMF-Nummer 015/074
 S2k Leitlinie AWMF-Nummer 015/074 Version 1 Gültig 08/15 07/18 Federführende Autoren: Dominik Denschlag Falk C. Thiel Matthias W. Beckmann Mitglieder der Arbeitsgruppe: Sven Ackermann Lars Christian Horn
S2k Leitlinie AWMF-Nummer 015/074 Version 1 Gültig 08/15 07/18 Federführende Autoren: Dominik Denschlag Falk C. Thiel Matthias W. Beckmann Mitglieder der Arbeitsgruppe: Sven Ackermann Lars Christian Horn
Neues vom ASCO. P. Wimberger Carl-Gustav-Carus Universität Technische Universität Dresden. Neues vom ASCO 2013
 Neues vom ASCO 2013 Neues vom ASCO P. Wimberger Carl-Gustav-Carus Universität Technische Universität Dresden First-line Therapie: Neoadjuvanz First-line Therapie: Neoadjuvanz First-line Therapie: Neoadjuvanz
Neues vom ASCO 2013 Neues vom ASCO P. Wimberger Carl-Gustav-Carus Universität Technische Universität Dresden First-line Therapie: Neoadjuvanz First-line Therapie: Neoadjuvanz First-line Therapie: Neoadjuvanz
Die Therapie des Ovarialkarzinoms in Deutschland. Die Therapie des Ovarialkarzinoms in Deutschland
 Die Therapie des Ovarialkarzinoms in Deutschland eine Qualitätssicherungserhebung tssicherungserhebung Q III 2004 A. du Bois, J. Rochon 2, C. Lamparter 3, J. Pfisterer 4 für r die AGO Organkommission OVAR
Die Therapie des Ovarialkarzinoms in Deutschland eine Qualitätssicherungserhebung tssicherungserhebung Q III 2004 A. du Bois, J. Rochon 2, C. Lamparter 3, J. Pfisterer 4 für r die AGO Organkommission OVAR
Strahlentherapie des Endometriumkarzinoms. Dirk Vordermark Universitätsklinik für Strahlentherapie Martin-Luther-Universität Halle-Wittenberg
 Strahlentherapie des Endometriumkarzinoms Dirk Vordermark Universitätsklinik für Strahlentherapie Martin-Luther-Universität Halle-Wittenberg Übersicht Aktuelle Empfehlungen: risikoadaptierter Einsatz der
Strahlentherapie des Endometriumkarzinoms Dirk Vordermark Universitätsklinik für Strahlentherapie Martin-Luther-Universität Halle-Wittenberg Übersicht Aktuelle Empfehlungen: risikoadaptierter Einsatz der
Empfehlungen für die Diagnostik und Therapie maligner Ovarialtumoren
 Empfehlungen für die Diagnostik und Therapie maligner Ovarialtumoren Aktualisierte Empfehlungen der Kommission Ovar auf Grundlage der S2k Leitlinie (Version 1.0, Mai 2007) ohne Angabe der Evidenzlevel
Empfehlungen für die Diagnostik und Therapie maligner Ovarialtumoren Aktualisierte Empfehlungen der Kommission Ovar auf Grundlage der S2k Leitlinie (Version 1.0, Mai 2007) ohne Angabe der Evidenzlevel
3 Ergebnisse zur Prävalenz nach ICD-10
 ICD-C10 C00 C14 Ergebnisse zur 13 3 Ergebnisse zur nach ICD-10 3.1 Mundhöhle und Rachen Kernaussagen Inzidenz und Mortalität: Seit der tausendwende erkrankten jährlich etwa 2.800 und etwa 7.600 an bösartigen
ICD-C10 C00 C14 Ergebnisse zur 13 3 Ergebnisse zur nach ICD-10 3.1 Mundhöhle und Rachen Kernaussagen Inzidenz und Mortalität: Seit der tausendwende erkrankten jährlich etwa 2.800 und etwa 7.600 an bösartigen
Das Ovarialkarzinom. Prim. Univ. Doz. Dr. Gerhard Sliutz
 Das Ovarialkarzinom Prim. Univ. Doz. Dr. Gerhard Sliutz Seite 1 Chirurgie Frühstadium Seite 2 Chirurgie Frühstadium Komplette und intakte Entfernung des Tumors Durchführung eines Gefrierschnitts Stagingoperation
Das Ovarialkarzinom Prim. Univ. Doz. Dr. Gerhard Sliutz Seite 1 Chirurgie Frühstadium Seite 2 Chirurgie Frühstadium Komplette und intakte Entfernung des Tumors Durchführung eines Gefrierschnitts Stagingoperation
GEHIRN UND ZENTRALES NERVENSYSTEM (C70-C72)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEHIRN UND ZENTRALES NERVENSYSTEM (C7-C72) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEHIRN UND ZENTRALES NERVENSYSTEM (C7-C72) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard
Tumor des Gebärmutterkörpers (1)
 Tumor des Gebärmutterkörpers (1) Epidemiologie: Das Korpuskarzinom (auch Endometriumkarzinom) ist der häufigste weibliche Genitaltumor. Das Robert-Koch-Institut gibt die Inzidenz in Deutschland für 2004
Tumor des Gebärmutterkörpers (1) Epidemiologie: Das Korpuskarzinom (auch Endometriumkarzinom) ist der häufigste weibliche Genitaltumor. Das Robert-Koch-Institut gibt die Inzidenz in Deutschland für 2004
Verlängerung des platinfreien Intervalls und Gesamtüberlebens mit Trabectedin
 Behandlung des Ovarialkarzinoms Verlängerung des platinfreien Intervalls und Gesamtüberlebens mit Trabectedin Berlin (18. Januar 2011) Durch eine Behandlung mit dem ursprünglich in marinen Seescheiden
Behandlung des Ovarialkarzinoms Verlängerung des platinfreien Intervalls und Gesamtüberlebens mit Trabectedin Berlin (18. Januar 2011) Durch eine Behandlung mit dem ursprünglich in marinen Seescheiden
12. Gemeinsame Jahrestagung, September, Radebeul. Sächsische Radiologische Gesellschaft,
 12. Gemeinsame Jahrestagung, 09. 11. September, Radebeul Sächsische Radiologische Gesellschaft, Thüringische Gesellschaft für Radiologie und Nuklearmedizin Pankreas: Von der Morphe zur Funktion 1 Normales
12. Gemeinsame Jahrestagung, 09. 11. September, Radebeul Sächsische Radiologische Gesellschaft, Thüringische Gesellschaft für Radiologie und Nuklearmedizin Pankreas: Von der Morphe zur Funktion 1 Normales
Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland 214 3,8 7,7 Mortalität Saarland 214,9,6 geschätzte Inzidenz
SCHILDDRÜSE (C73) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland 214 3,8 7,7 Mortalität Saarland 214,9,6 geschätzte Inzidenz
Mortalitätsrate. 575 und mehr. 341 bis unter bis unter bis unter bis unter 411.
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG KREBS GESAMT SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212* 43,8 373,5 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG KREBS GESAMT SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212* 43,8 373,5 Mortalität
Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht?
 Ovarialkarzinom State of the Art AGO-Symposium Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht? Pauline Wimberger Klinik und Poliklinik für Gynäkologie und Geburtshilfe Technische Universität
Ovarialkarzinom State of the Art AGO-Symposium Aktuelle Aspekte der PARP-Inhibition: Wer profitiert, wer nicht? Pauline Wimberger Klinik und Poliklinik für Gynäkologie und Geburtshilfe Technische Universität
Neues in der Diagnostik bei gynäkologischen Malignomen
 Neues in der Diagnostik bei gynäkologischen Malignomen Veysonnaz 2018 Andreas Müller Vorschau Zervixkarzinom Endometriumkarzinom neue S3-Leitlinie (Ovarialkarzinom) (Vulvakarzinom) Vorschau Zervixkarzinom
Neues in der Diagnostik bei gynäkologischen Malignomen Veysonnaz 2018 Andreas Müller Vorschau Zervixkarzinom Endometriumkarzinom neue S3-Leitlinie (Ovarialkarzinom) (Vulvakarzinom) Vorschau Zervixkarzinom
AGO Organkommission OVAR in Zusammenarbeit mit der AGO Studiengruppe Ovarialkarzinom und der NOGGO e.v.
 Erhebung invasives epitheliales Ovarialkarzinom (exkl. Borderline) - Erfassung der im III. Quartal 2012 neu diagnostizierten Patientinnen Eine Qualitätssicherungsinitiative der AGO Organkommission OVAR,
Erhebung invasives epitheliales Ovarialkarzinom (exkl. Borderline) - Erfassung der im III. Quartal 2012 neu diagnostizierten Patientinnen Eine Qualitätssicherungsinitiative der AGO Organkommission OVAR,
GEHIRN UND ZENTRALES NERVENSYSTEM (C70-C72)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEHIRN UND ZENTRALES NERVENSYSTEM (C7-C72) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEHIRN UND ZENTRALES NERVENSYSTEM (C7-C72) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard
Brustkrebserkrankung. Definition verschiedener Situationen
 Brustkrebserkrankung 3 Brustkrebserkrankung Definition verschiedener Situationen Frühe Brustkrebserkrankung Die Diagnose Brustkrebs wird erstmals gestellt. Im Allgemeinen ist die Erkrankung auf die Brust
Brustkrebserkrankung 3 Brustkrebserkrankung Definition verschiedener Situationen Frühe Brustkrebserkrankung Die Diagnose Brustkrebs wird erstmals gestellt. Im Allgemeinen ist die Erkrankung auf die Brust
Zytoreduktive Chirurgie (CRS) und hypertherme intraperitoneale Chemotherapie (HIPEC)
 Zytoreduktive Chirurgie (CRS) und hypertherme intraperitoneale Chemotherapie (HIPEC) Interdisziplinäre multimodale Therapie bei Tumorbefall des Bauchfells PD Dr. Gabriel Glockzin Klinik für Allgemein-,
Zytoreduktive Chirurgie (CRS) und hypertherme intraperitoneale Chemotherapie (HIPEC) Interdisziplinäre multimodale Therapie bei Tumorbefall des Bauchfells PD Dr. Gabriel Glockzin Klinik für Allgemein-,
Wiederauftreten der Erkrankung: was tun? Priv.-Doz. Dr. med. Gülten Oskay-Özcelik Praxisklinik Krebsheilkunde für Frauen /Berlin
 Wiederauftreten der Erkrankung: was tun? Priv.-Doz. Dr. med. Gülten Oskay-Özcelik Praxisklinik Krebsheilkunde für Frauen /Berlin Wiederauftreten der Erkrankung Operation? Eierstockkrebs kommt häufig (auch
Wiederauftreten der Erkrankung: was tun? Priv.-Doz. Dr. med. Gülten Oskay-Özcelik Praxisklinik Krebsheilkunde für Frauen /Berlin Wiederauftreten der Erkrankung Operation? Eierstockkrebs kommt häufig (auch
Dossierbewertung A16-10 Version 1.0 Ramucirumab (Kolorektalkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Ramucirumab gemäß 35a SGB V beauftragt. Die Bewertung erfolgte auf Basis
HODEN (C62) SITUATION IN RHEINLAND-PFALZ SITUATION IN DEUTSCHLAND
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HODEN (C62) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 213 11,5 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HODEN (C62) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 213 11,5 Mortalität
HODEN (C62) SITUATION IN DEUTSCHLAND SITUATION IN RHEINLAND-PFALZ
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HODEN (C62) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 12 9,2 Mortalität
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HODEN (C62) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 12 9,2 Mortalität
Präoperative Triagierung auffälliger Ultraschallbefunde nach IOTA, RMI und Leuven
 Präoperative Triagierung auffälliger Ultraschallbefunde nach IOTA, RMI und Leuven PD Dr. Gwendolin Manegold-Brauer Abteilung für gyn. Sonographie und Pränataldiagnostik, Frauenklinik, Universitätsspital
Präoperative Triagierung auffälliger Ultraschallbefunde nach IOTA, RMI und Leuven PD Dr. Gwendolin Manegold-Brauer Abteilung für gyn. Sonographie und Pränataldiagnostik, Frauenklinik, Universitätsspital
Nur in bestimmten Fällen werden Rezidive zuverlässiger erkannt als mit herkömmlichen Verfahren
 Nutzen von PET und PET/CT bei Eierstockkrebs ist nicht belegt Nur in bestimmten Fällen werden Rezidive zuverlässiger erkannt als mit herkömmlichen Verfahren Köln (23. Mai 2012) - Mangels Studien gibt es
Nutzen von PET und PET/CT bei Eierstockkrebs ist nicht belegt Nur in bestimmten Fällen werden Rezidive zuverlässiger erkannt als mit herkömmlichen Verfahren Köln (23. Mai 2012) - Mangels Studien gibt es
DIFFERENZIERTER EINSATZ DES
 STATE OF THE ART OVARIALKARZINOM DIFFERENZIERTER EINSATZ DES TUMORMARKERS CA125 W. Meier Düsseldorf Kommission Ovar CA125, CA 72-4, CEA, TPA, CASA, CA 19-9 CA 15-3, HE4 (92, 74) usw. Aufgrund seiner hohen
STATE OF THE ART OVARIALKARZINOM DIFFERENZIERTER EINSATZ DES TUMORMARKERS CA125 W. Meier Düsseldorf Kommission Ovar CA125, CA 72-4, CEA, TPA, CASA, CA 19-9 CA 15-3, HE4 (92, 74) usw. Aufgrund seiner hohen
Dossierbewertung A17-67 Version 1.0 Alectinib (nicht kleinzelliges Lungenkarzinom)
 2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Alectinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
2 Nutzenbewertung 2.1 Kurzfassung der Nutzenbewertung Hintergrund Der G-BA hat das IQWiG mit der Nutzenbewertung des Wirkstoffs Alectinib gemäß 35a SGB V beauftragt. Die Bewertung erfolgt auf Basis eines
3.8 Malignes Melanom der Haut
 ICD-10 C43 Ergebnisse zur 69 3.8 Malignes Melanom der Haut Kernaussagen Inzidenz: Im 2004 erkrankten in Deutschland etwa 8.400 und 6.500 an einem malignen Melanom der Haut. Seit 1980 sind die Erkrankungsraten
ICD-10 C43 Ergebnisse zur 69 3.8 Malignes Melanom der Haut Kernaussagen Inzidenz: Im 2004 erkrankten in Deutschland etwa 8.400 und 6.500 an einem malignen Melanom der Haut. Seit 1980 sind die Erkrankungsraten
3.21 Krebs gesamt. Hintergrund. Kernaussagen
 156 Ergebnisse zur Krebs gesamt 3.21 Krebs gesamt Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten in Deutschland ca. 230.500 und ca. 206.000 an einer Krebserkrankung (ohne nicht melanotische Hauttumoren).
156 Ergebnisse zur Krebs gesamt 3.21 Krebs gesamt Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten in Deutschland ca. 230.500 und ca. 206.000 an einer Krebserkrankung (ohne nicht melanotische Hauttumoren).
Pank n reaszent n r t um u M ü M n ü c n he h n: Opt p i t mierun u g n g de d r Pati t ent n e t nv n ersor o gu g n u g
 Pankreaszentrum München: Optimierung der Patientenversorgung Biomarker-Studie : Rash-basierte Therapiestrategie Dr. med. Stefan Böck Prof. Dr. med. Volker Heinemann Medizinische Klinik und Poliklinik III
Pankreaszentrum München: Optimierung der Patientenversorgung Biomarker-Studie : Rash-basierte Therapiestrategie Dr. med. Stefan Böck Prof. Dr. med. Volker Heinemann Medizinische Klinik und Poliklinik III
GEBÄRMUTTERHALS (C53)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERHALS (C53) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 12 13,8
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERHALS (C53) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 12 13,8
Altersspezifische Rate Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 DARM (C18-C21) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland 214 6,6 41,7 Mortalität Saarland 214 22,3 14, geschätzte Inzidenz
DARM (C18-C21) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/.) Europastandard Inzidenz Saarland 214 6,6 41,7 Mortalität Saarland 214 22,3 14, geschätzte Inzidenz
HARNBLASE (C67, D09.0, D41.4)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HARNBLASE (C67, D9., D41.4) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN HARNBLASE (C67, D9., D41.4) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz
3.7 Lunge. Kernaussagen
 ICD-10 C33, C34 Ergebnisse zur 61 3.7 Lunge Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten ca. 13.200 und 33.000 an Lungenkrebs. Die Zahl der jährlichen Erkrankungsfälle hat sich bei den seit
ICD-10 C33, C34 Ergebnisse zur 61 3.7 Lunge Kernaussagen Inzidenz und Mortalität: Im 2004 erkrankten ca. 13.200 und 33.000 an Lungenkrebs. Die Zahl der jährlichen Erkrankungsfälle hat sich bei den seit
Welche Untersuchungen führt der Urologe bei Verdacht auf einen Hodentumor durch?
 Hodenkrebs Was ist ein Hodentumor, was ist Hodenkrebs? Ein Hodentumor ist ein in der Regel bösartiges Geschwulst (Tumor) im Hoden, der potentiell über den Blut oder Lymphweg Tochtergeschwulste (Metastasen)
Hodenkrebs Was ist ein Hodentumor, was ist Hodenkrebs? Ein Hodentumor ist ein in der Regel bösartiges Geschwulst (Tumor) im Hoden, der potentiell über den Blut oder Lymphweg Tochtergeschwulste (Metastasen)
Ursachen und Entstehungstheorien des Eierstockkrebses ( Ovarialkarzinom)
 Ursachen und Entstehungstheorien des Eierstockkrebses ( Ovarialkarzinom) Dr. Sabine Rothe Helios Klinikum Berlin Buch Eierstockkrebs, Bauchfellkrebs und Eileiterkrebs gehören zu der gleichen Erkrankungsgruppe.
Ursachen und Entstehungstheorien des Eierstockkrebses ( Ovarialkarzinom) Dr. Sabine Rothe Helios Klinikum Berlin Buch Eierstockkrebs, Bauchfellkrebs und Eileiterkrebs gehören zu der gleichen Erkrankungsgruppe.
Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN DARM (C18-C21) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN DARM (C18-C21) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN LEBER (C22) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN LEBER (C22) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
Kennzahlenjahr. nicht operiert. operiert
 Anlage Version X.X (Auditjahr 2014 / Kennzahlenjahr 2013) Basisdaten Gynäkologie Reg.-Nr. (Muster Zertifikat) Zentrum Standort Ansprechpartner Erstelldatum Datum Erstzertifizierung Kennzahlenjahr 2013
Anlage Version X.X (Auditjahr 2014 / Kennzahlenjahr 2013) Basisdaten Gynäkologie Reg.-Nr. (Muster Zertifikat) Zentrum Standort Ansprechpartner Erstelldatum Datum Erstzertifizierung Kennzahlenjahr 2013
Phase II-Studie zur Behandlung des nicht kleinzelligen Bronchialkarzinoms im Stadium III b und IV mit der Kombination Docetaxel und Carboplatin
 Aus der Universitätsklinik und Poliklinik für Innere Medizin II an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Herr Professor Dr. med. Bernd Osten) Phase II-Studie zur Behandlung des nicht
Aus der Universitätsklinik und Poliklinik für Innere Medizin II an der Martin-Luther-Universität Halle-Wittenberg (Direktor: Herr Professor Dr. med. Bernd Osten) Phase II-Studie zur Behandlung des nicht
ENDOMETRIUM- KARZINOM
 ENDOMETRIUM- KARZINOM 1 ENDOMETRIUMKARZINOM Epidemiologie und Ätiologie Das Endometriumkarzinom (Gebärmutterkörperkrebs), ist die vierthäufigste Krebserkrankung der Frau. 12% aller Krebsarten der Frau
ENDOMETRIUM- KARZINOM 1 ENDOMETRIUMKARZINOM Epidemiologie und Ätiologie Das Endometriumkarzinom (Gebärmutterkörperkrebs), ist die vierthäufigste Krebserkrankung der Frau. 12% aller Krebsarten der Frau
Altersspezifische Rate Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN DARM (C18-C21) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN DARM (C18-C21) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland
3.3 Magen. ein zu hoher Verzehr von gepökelten und geräucherten Lebensmitteln. Rauchen und übermäßiger Alkoholkonsum erhöhen das Magenkrebsrisiko,
 ICD-10 C16 Ergebnisse zur 29 3.3 Magen Kernaussagen Inzidenz und Mortalität: Seit mehr als 30 en ist in Deutschland ein stetiger Rückgang der Erkrankungen an Magenkrebs zu beobachten. Die altersstandardisierten
ICD-10 C16 Ergebnisse zur 29 3.3 Magen Kernaussagen Inzidenz und Mortalität: Seit mehr als 30 en ist in Deutschland ein stetiger Rückgang der Erkrankungen an Magenkrebs zu beobachten. Die altersstandardisierten
Mortalitätsrate 137,2 124,2 111,8. und mehr. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 LEBER (C22) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 14 13,7 4,2 Mortalität Saarland 14 11,9 3,3 geschätzte Inzidenz
LEBER (C22) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 14 13,7 4,2 Mortalität Saarland 14 11,9 3,3 geschätzte Inzidenz
Krebs - was kann ich tun?
 Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
Krebs - was kann ich tun? von Dr. Ursula Vehling-Kaiser 1. Auflage Krebs - was kann ich tun? Vehling-Kaiser schnell und portofrei erhältlich bei beck-shop.de DIE FACHBUCHHANDLUNG W. Zuckschwerdt 2010 Verlag
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MAGEN (C16) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN MAGEN (C16) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 212
Diagnostik und operatives Staging des Zervixkarzinoms
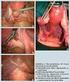 S2k-Leitlinie Zervixkarzinom Diagnostik und operatives Staging des Zervixkarzinoms Uwe Ulrich Frauenklinik / Gynäkologisches Krebszentrum Martin-Luther-Krankenhaus Berlin State-of-the-Art 2013 Kongress
S2k-Leitlinie Zervixkarzinom Diagnostik und operatives Staging des Zervixkarzinoms Uwe Ulrich Frauenklinik / Gynäkologisches Krebszentrum Martin-Luther-Krankenhaus Berlin State-of-the-Art 2013 Kongress
0-14. Mortalitätsrate. und mehr 137,2 124,2 111,8. bis unter. bis unter 124,2 100,0 88,9. bis unter. bis unter 111,8 78,4 68,6
 PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 214 12,4 1,3 Mortalität Saarland 214 11, 1,6 geschätzte Inzidenz
PANKREAS (C25) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT MÄNNER FRAUEN Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 214 12,4 1,3 Mortalität Saarland 214 11, 1,6 geschätzte Inzidenz
IQWiG: Vorbericht zu PET und PET/CT bei Eierstockkrebs veröffentlicht
 IQWiG: Vorbericht zu PET und PET/CT bei Eierstockkrebs veröffentlicht Nutzen der Positronen-Emissions-Tomographie (PET) lässt sich mangels Studien derzeit nicht beurteilen Berlin (18. Juli 2011) - Der
IQWiG: Vorbericht zu PET und PET/CT bei Eierstockkrebs veröffentlicht Nutzen der Positronen-Emissions-Tomographie (PET) lässt sich mangels Studien derzeit nicht beurteilen Berlin (18. Juli 2011) - Der
GEBÄRMUTTERHALS (C53)
 EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERHALS (C53) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 13 11,8
EPIDEMIOLOGISCHE KREBSREGISTRIERUNG // EINZELNE KREBSARTEN GEBÄRMUTTERHALS (C53) SITUATION IN DEUTSCHLAND INZIDENZ UND MORTALITÄT Altersstandardisierte Rate (/1.) Europastandard Inzidenz Saarland 13 11,8
