2.4. Aromaten Benzol
|
|
|
- Franz Dunkle
- vor 7 Jahren
- Abrufe
Transkript
1 2.4. Aromaten Benzol Benzol: Herstellung und Eigenschaften Der einfachste aromatische Kohlenwasserstoff ist das Benzol C 6 H 6. Es bildet sich bei der Verkokung von Steinkohle und wird aus den dabei entstehenden Rohgasen und teerigen Produkten gewonnen. Große Mengen erhält man auch aus dem Erdöl. Benzol ist eine farblose, leicht bewegliche und stark lichtbrechende Flüssigkeit mit charakteristischem Geruch (Sp 80,1 C; Fp 5,5 C; ρ = 0,8789 g/cm 3 bei 20 C). In Wasser ist es nur sehr wenig, in Ethanol und Benzin in jedem Verhältnis löslich. Benzol bzw. seine Dämpfe sind sehr giftig und nachgewiesenermaßen krebserregend! Es wird in der Leber über Phenol (s.u.) zu Chinonen O=C 6 H 4 =O oxidiert, welche als starke Elektrophile mit DNA, RNA und Proteinen reagieren und u.a. durch Störung der Reifung der Knochenmarkszellen myelitische Leukämie auslösen. Benzol besitzt als Ausgangsstoff für Farbstoffe, Kunststoffe, synthetische Waschmittel, pharmazeutische Präparate und Insektizide für die chemische Industrie große Bedeutung. Daneben dient es als Zusatz für Motorenkraftstoffe zur Verringerung der Klopfneigung (daher die Saugrüssel an der Tankstelle) und als gutes Lösungsmittel für Fette und Wachse u.a. in chemischen Reinigungen (!) Der aromatische Zustand Aufgrund der Summenformel C 6 H 6 müsste Benzol wie ein stark ungesättigter Kohlenwasserstoff reagieren. Es lassen sich jedoch weder mit Brom noch mit Kaliumpermanganat reaktionsfähige Doppelbindungen nachweisen. Der Grund für dieses überraschende Reaktionsverhalten liegt in der Mesomeriestabilisierung der Doppelbindungen. Das Benzolmolekül bildet ein ebenes Sechseck, dessen Bindungsabstände alle gleich groß sind und zwischen den Bindungslängen für Einfach- und Doppelbindungen liegen. Es lassen sich zwei völlig gleichberechtigte mesomere Grenzformen angeben, die übereinander gelegt die tatsächliche Elektronenverteilung beschreiben. Die π-elektronen sind demnach gleichmäßig über alle C-Atome verteilt (delokalisiert) und können nicht mehr einer einzelnen Bindung zugeordnet werden! Verteilung der π-elektronen mesomere Grenzformen Kurzschreibweise Die gleichmäßige Verteilung der π-elektronen über das ganze Molekül durch Mesomerie mit mindestens zwei völlig gleichberechtigten Grenzstrukturen ist der Grund für die chemische Stabilität der Aromaten und das Kennzeichen des aromatischen Zustandes. Er tritt immer dann auf, wenn sich in ebenen Ringsystemen Einfach- und Doppelbindungen abwechseln, so dass jede Einfachbindung durch Mesomerie in eine Doppelbindung umgewandelt werden kann. Die Moleküle vieler Natur- und Farbstoffe weisen solche miteinander verbundene Benzolringe auf. In den Molekülen von Heteroaromaten sind neben C-Atomen noch andere Atome im Ring vorhanden. In den Molekülen des Thiophens, Furans und Pyrrols ist ein freies Elektronenpaar des Heteroatoms am delokalisierten π-elektronensystem beteiligt. In Cyclooctatetraen dagegen ist die Mesomerie durch die Faltung des Moleküls in Wannenform behindert Naphthalin Anthracen Phenanthren Benzpyren Cyclooactatetraen (nicht aromatisch) N S O Pyridin Thiophen Furan Übungen: Aufgaben zu Aromaten Aufgabe 1 N H Pyrrol 1
2 Entstehung und Verwendung von Kohle Kohle entsteht durch Zersetzung pflanzlicher Stoffe unter Luftabschluss und hohem Druck der darüber liegenden Sedimente im Laufe von vielen Millionen Jahren. Dabei entweichen nach und nach alle flüchtigen Anteile der Pflanzen. Die Kohlenwasserstoffketten- und -Ringe lagern sich aneinander an, so dass unter Abgabe von Wasserstoff über die Zwischenstufen Benzol, Naphtalin, Anthracen, Benzpyren, usw. schließlich Graphit entsteht. Mit zunehmendem Alter der Kohle nehmen Dichte, Kohlenstoffgehalt und Brennwert und leider auch die Tiefe der Lagerstätten zu. Der Kohlungsprozess lässt sich durch künstliche Erhöhung des Druckes und der Temperatur unter Luftausschluss beschleunigen. Z.B. gewinnt der Köhler auf diese Weise Holzkohle durch Schwelbrand im Kohlenmeiler. Koks entsteht durch Erhitzen von Steinkohlestaub auf 1000 C unter Luftabschluss. Im Vergleich zu Erdöl hat Kohle wegen der fehlenden H-Atome ( exotherme Bildung von Wasser) einen geringeren Brennwert und lässt sich schwieriger handhaben (In der Industrie wird fast nur Kohlestaub verwendet). Da die Kohlevorräte aber weitaus ergiebiger sind als die Erdölvorräte, versucht man Kohle durch Kohleverflüssigung (Reaktion mit Wasserstoff bei 500 C und 300 bar zu Kohlenwasserstoffen) oder Kohlevergasung (Reaktion mit Wasserdampf bei 1000 C zu Synthesegas CO + H 2 ) zu veredeln. Diese Technologien sind schon früh in der früheren DDR und Südafrika entwickelt worden, um die politische und wirtschaftliche Abhängigkeit von den Erdöl produzierenden Staaten zu verringern. Übungen: Aufgaben zu Aromaten Nr Elektrophile Substitution S E an Aromaten Je 10 ml Hexan, Hexen und Benzol in 100 ml Erlenmeyerkolben geben und jeweils 1 Tropfen Brom (Abzug!) aus der Pipette direkt in die Flüssigkeit einfließen lassen. Beobachtung? Anschließend Hexan auf OHP stellen und Benzol mit frisch reduzierten Eisenspänen oder Eisenwolle (nicht Pulver!) versehen. Alle drei Ansätze mit feuchtem Indikatorpapier direkt über der Flüssigkeitsoberfläche untersuchen. Tropft man Brom zu Cyclohexen, so erfolgt eine schnelle Reaktion, dagegen erhält man bei Zugabe von Brom zu Benzol nur eine rotbraune Lösung. Obwohl das Benzolmolekül mit dem π-elektronensystem eine hohe negative Ladungsdichte aufweist, die einen elektrophilen Angriff erleichtern sollte, erfolgt zunächst keine Reaktion. Erst bei Zugabe von Aluminium oder Eisen entfärbt sich die Lösung von Brom in Benzol, wobei Bromwasserstoff und Brombenzol entstehen. Es läuft also eine Substitution und keine Addition ab. Mechanismus der elektrophilen Substitution Halogenierung am Beispiel Brom und Benzol 1. Schritt: elektrophiler Angriff auf das π-system Wie bei der elektrophilen Addition bildet auch das Benzolmolekül zunächst einen π-komplex mit dem Brommolekül. Die heterolytische Spaltung des Brommoleküls in Br + und Br gelingt hier aber erst bei Zugabe eines elektrophilen Katalysators, der die Polarisierung des Br 2 -Moleküls unterstützt. Er besteht aus FeBr 3 bzw. AlBr 3, welches sich in der Lösung aus dem zugegebenem Fe bzw. Al mit Brom bildet und in Benzol teilweise molekular (!!) gelöst vorliegt. Das Br + kann sich nun elektrophil an ein C- Atom addieren. Da dieses C-Atom sp 3 -hybridisiert ist und nun vier σ- Bindungen besitzt, heißt das gebildete Carbenium-Ion σ-komplex. Der σ- Komplex ist infolge der Delokalisierung der positiven Ladungen mesomeriestabilisiert. Das übrige Br bildet mit dem gelösten AlBr 3 einen AlBr 4 -Komplex. (Tetrabromoaluminat) Brennstoff Alter in Jahren C-Gehalt Holz 0 50 % Torf % Braunkohle 5 Mio 70 % Steinkohle 300 Mio 80 % Anthrazit 350 Mio 95 % 2
3 2. Schritt: nukleophiler Angriff auf den σ-komplex Der positiv geladene σ-komplex reagiert unter Abgabe eines Protons mit dem AlBr 4. Es entstehen Brombenzol, Bromwasserstoff und Aluminiumbromid Reaktivität der Halogene Die Reaktivität steigt von Iod zu Fluor stark an: Iod reagiert nur teilweise (Gleichgewichtsreaktion), Fluor hingegen explosionsartig. Der Grund liegt wie bei der radikalischen Substitution in der wachsenden Stabilität der C-Halogen-Bindung. Elektrophile Addition als Konkurrenzreaktion Der σ-komplex könnte auch wie bei der elektrophilen Addition an Alkene ein Bromidion addieren. Bei dieser Reaktion entstünde dann ein Dibromcyclohexadien, bei dem sich das π-elektronensystem nur über vier Kohlenstoffatome erstrecken würde. Dadurch würde der besonders energiearme aromatische Zustand nicht mehr erreicht, so dass diese Reaktion keine nennenswerte Konkurrenz zur Substitution darstellt. Die charakteristische Reaktion des Benzols und anderer Aromaten ist die elektrophile Substitution. Damit ist die elektrophile Substitution auch ein weiteres Kriterium für den aromatischen Zustand. Nitrierung Das sehr giftige, nach Bittermandeln riechende Nitrobenzol wird aus Benzol und einem Gemisch aus konzentrierter Salpetersäure und Schwefelsäure gewonnen. Das elektrophile Teilchen ist bei dieser Reaktion das Nitrylkation NO 2 +, das sich durch Abspaltung eines Wassermoleküls aus einem protonierten Salpetersäuremolekül bilden kann: 1. Schritt: Bildung des Nitrlykations 2. Schritt: elektrophile Substitution Nitrobenzol dient als Ausgangsstoff für die Synthese von Aminobenzol (Anilin) Sulfonierung Mit rauchender Schwefelsäure reagiert Benzol zur Benzolsulfonsäure. Als elektrophile Teilchen wirkt hier das Schwefeltrioxidmolekül SO 3, das in rauchender Schwefelsäure enthalten ist. Das Schwefelatom des Schwefeltrioxidmoleküls weist eine stark positive Teilladung auf. Die Benzolsulfonsäure ist aufgrund der SO 3 H- Gruppe eine wasserlösliche, starke Säure, die als Zwischenprodukt zur Herstellung von Farbstoffen und Arzneimitteln dient. Benzolsulfonate, bei denen jeweils ein Wasserstoffatom des Benzolrings durch einen langen Alkylrest ersetzt ist, sind wichtige anionische Tenside. Alkylierung Mit Chloralkanen reagiert Benzol unter Zusatz des elektrophilen Katalysators AlCl 3 zu Phenylalkanen. Der Katalysator bewirkt eine noch stärkere Polarisierung der polaren C-Cl-Bindung, so dass das positivierte C-Atom als elektrophiles Teilchen wirken kann. Die wichtigsten Phenylalkane sind Methylbenzol (Toluol Benzoesäure), Phenylethan (Ethylbenzol Styrol) und Cumol (2-Phenylpropan Phenol), die in großen Mengen als Zwischenprodukte für technische Synthesen eingesetzt werden: Übungen: Aufgaben zu Aromaten Nr. 3 und 4 3
4 Einige wichtige Aromaten Phenylethen (Styrol) Vorkommen: Steinkohleteer Herstellung Technisch durch Anlagerung von Benzol an Ethen in Gegenwart von AlCl 3 zu Phenylethan, das bei 600 C am ZnO-Kontakt zu Phenylethen dehydriert wird. Eigenschaften: Flüssigkeit mit Sp 146 C, die bei Rt unter Lichteinfluss allmählich durch radikalische Polymerisation zu Polstyrol erstarrt. Die Radikale sind mesomeriestabilisiert: Verwendung: Herstellung von Polystyrol Übungen: Aufgaben zu Aromaten Nr. 5 Aminobenzol (Anilin) Vorkommen: Steinkohleteer Herstellung: Reduktion von Nitrobenzol (s.o.) mit Eisen oder Zink in verdünnter Salzsäure: C 6 H 5 N +III O Fe ±0 + H 2 O C 6 H 5 N III H 2 + Fe +III 2O 3 Eigenschaften: giftiges (MAK 19 mg/m 3 ), farbloses, unangenehm riechendes Öl mit Sp 184 C, das sich an der Luft infolge Autoxidation schnell braun färbt und in Wasser kaum löslich ist. Das einsame Elektronenpaar des N-Atoms beteiligt sich an der Mesomerie und bewirkt in o- und p- Stellung eine erhöhte Elektronendichte: Daher werden bei elektrophilen Zweitsubstitutionen (nach vorheriger Maskierung der Aminogruppe durch Kondensation mit Ethansäure) zu Aminobenzolsulfonsäuren und Nitroanilinen auch vor allem o- und p-isomere gebildet. Aus dem gleichen Grund ist die Basizität der aromatische Amine nur sehr schwach ausgeprägt (pk B 9,42). Verwendung: Herstellung von Farbstoffen, z.b. Indigo nach der 1. Heumannschen Synthese (BASF 1890): Nach der Kondensation mit Chloressigsäure erfolgt der Ringschluß durch Kondensation in alkalischer Schmelze mit Natriumamid und dann Oxidation durch Stehenlassen an der Luft: Übungen: Aufgaben zu Aromaten Nr 6 Hydroxybenzol (Phenol) Vorkommen: Steinkohleteer Herstellung (Hock-Synthese): Durch Addition von Propen an Benzol erhält man zunächst 2-Phenylpropan (Cumol). Dieses wird durch Luftsauerstoff zu Cumolhydroperoxid oxidiert, welches mit verdünnten Säuren isomerisiert und schließlich zu Phenol und Aceton gespalten wird. Die Synthese verläuft im Gegensatz zu älteren (vom Mechanismus her einfacheren) Synthesen unter einfachen Bedingungen und ohne Nebenprodukte: + O 2 + H + + H 2 O - H + - H 2 O HO C O OH O C OH H C H 3 CH H C 3 3 CH 3 H 3 C CH 3 H 3 C CH 3 Cumol Cumolhydroperoxid Carbenium-Ion Halbacetal C + + O OH C H 3 C CH 3 Aceton + Phenol 4
5 Eigenschaften: Phenol ist giftig (MAK 19 mg/m 3 ) und wird auch durch die Haut aufgenommen! Es bildet farblose Nadeln, Fp 41 C, ist sublimierbar, in Wasser mäßig und in Alkohol gut löslich. Die einsamen Elektronenpaar des O-Atoms beteiligen sich wie beim Anilin an der Mesomerie und führen zu ähnlichen Eigenschaften: p- und o- Orientierung bei der Zweitsubstitution und saurer Charakter (pk s = 10). Die Phenolate sind sehr viel besser in Wasser löslich. Verwendung: Herstellung von Farb- und Kunststoffen (z.b. ε-caprolactam Nylon) Übungen: Aufgaben zu Aromaten Nr. 7 Phenylmethansäure (Benzoesäure) Vorkommen: In Pflanzen (Preiselbeeren) und Tieren (Milch) als Konservierungsmittel. Herstellung: Oxidation von Toluol mit KMnO 4, CrO 3 oder Luftsauerstoff über die Zwischenstufen Benzylalkohol und Benzaldehyd Eigenschaften: Fp 122 C, sublimierbar, löslich in heißem Wasser und Alkohol, der pk s = 4,21 liegt zwischen dem der Ameisensäure (pk s = 3,77) und dem der Hexansäure (pk 2 = 4,86). Der Phenylring hat einerseits einen m-, andererseits einen +I-Effekt! Benzoesäure hemmt das Wachstum von Pilzen (z.b. Hefe und Schimmel) stark, ist Bakterien aber weniger giftig und für Pflanzen und Tiere in kleinen Mengen ungiftig (LD g/kg). In der Niere wird es mit Glycin zu Hippursäure C 6 H 6 CO NH CH 3 COOH kondensiert und ausgeschieden. Den Softdrinks werden zunächst der besseren Löslichkeit wegen die Salze zugesetzt, die in den sauren Softdrinks sofort protoniert werden. Die Salze selber zeigen aber kaum fungizide Wirkung! Verwendung: Jahresproduktion t vor allem als Konservierungsmittel E 210 bzw. in Form der Salze E in Softdrinks (Cola, Fanta). Übungen: Aufgaben zu Aromaten Nr Elektrophile Zweitsubstitution Die Reaktionsgeschwindigkeit und der Ort, an dem eine elektrophile Zweitsubstitution am Benzol erfolgt, sind von dem bereits vorhandenen Erstsubstituenten abhängig: Erstsubstituent ortho-proukt meta-produkt para-produkt NO 2 NO 2 + HNO 3 = CH 3 58 % 5 % 37 % = NO 2 6 % 91 % 1 % Reaktivität und induktiver Effekt Erstsubstituenten beeinflussen die Reaktivität durch ihren induktiven Effekt. Substituenten mit +I-Effekt erhöhen die Elektronendichte im aromatischen Kern und erleichtern dadurch einen elektrophilen Angriff. Substituenten mit I-Effekt vermindern die Elektronendichte und erschweren die Reaktion. Toluol wird daher schneller bromiert als Benzol, während Chlorbenzol langsamer reagiert. Reaktivität und mesomerer Effekt Obwohl die Hydroxylgruppe einen I-Effekt hat, lässt sich Phenol ohne Katalysator bromieren. Der Grund für diese überraschende Reaktivität des Phenols ist die Beteiligung eines freien Elektronenpaars des Sauerstoffatoms am delokalisierten 7- Elektronensystem, man spricht auch von einem mesomeren Effekt. Die mesomeren Grenzformeln des Phenols zeigen, daß die Elektronendichte im aromatischen Kern erhöht wird. Die OH- Mesomere Grenzformeln des Phenols Gruppe hat also einen positiven mesomeren Effekt. Dieser +M- Effekt der OH-Gruppe ist stärker als ihr I-Effekt, Phenol wird daher rasch substituiert. Substituenten wie die Nitrogruppe, bei denen das dem Kern benachbarte Atom durch eine Mehrfachbindung mit einem elektronegativeren Atom verbunden ist, vermindern durch einen M-Effekt die Elektronendichte im Kern und erschweren damit eine Zweitsubstitution. NO 2 5
6 Orientierung und mesomerer Effekt Bei der Bromierung von Phenol entstehen überwiegend o- Bromphenol und p-bromphenol. Vereinfacht lässt sich der ortho/para-dirigierende Einfluß der OH-Gruppe mit Hilfe der mesomeren Grenzformeln des Phenols erklären. In diesen treten in ortho- und para-stellung zur OH-Gruppe negative Formalladungen auf. Ein elektrophiler Angriff erfolgt daher bevorzugt dort. Eine genauere Begründung geht von der Stabilität der σ Komplexe aus. Bei einer ortho- oder para-substitution lassen sich für die σ-komplexe je vier mesomere Grenzformeln angeben, bei einer meta-substitution nur drei. Wegen der größeren Stabilität der σ-komplexe erfolgt eine Zweitsubstitution überwiegend in orthound para-stellung zur OH-Gruppe. Substituenten mit M-Effekt dirigieren die Zweitsubstitution in meta-stellung. So entsteht bei der Bromierung von Nitrobenzol überwiegend m-bromnitrobenzol. Dies lässt sich mit Hilfe der positiven Formalladungen erklären, die bei den mesomeren Grenzformeln des Nitrobenzols in ortho- und para-stellung Mesomere Grenzformeln für den s- Komplex des Phenols bei Zweitsubstitution durch Brom in o-, m- und p-stellung auftreten. Der Angriff eines Elektrophils ist dort mehr erschwert als in meta-stellung. Der Vergleich der 3 möglichen σ-komplexe zeigt, dass in diesem Fall der σ-komplex bei einer meta-substitution am stabilsten ist, so dass diese bevorzugt erfolgt. Erstsubstituent I- und M-Effekte Reaktivität im Vergleich zu Benzol dirigiert nach OH, OR, NH 2 I < +M viel größer ortho und para R +I größer Cl, Br I > + M geringer NO 2, CHO, SO 3 H, COOH I, M viel geringer meta 6
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Bundesrealgymnasium Imst. Chemie Klasse 8. Aromaten und deren Reaktionen
 Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
9 Aromaten. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Organische Chemie 2 SPF BCH am Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema... 2
 Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Organische Chemie 2 Inhaltsverzeichnis Sie kennen alle Karteikärtchen zum Thema.... 2 Sie kennen vier Grundtypen von Reaktionen mit ihren Mechanismen (S. 239) mit aliphatischen, organischen Stoffen und
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
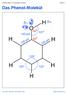 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden!
 Übung r. 8 Mi. 25.04.2012 bzw. Fr. 7.05.2 1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden! 2 CH 3 H a) b) I H c) d) C F e) f) H
Übung r. 8 Mi. 25.04.2012 bzw. Fr. 7.05.2 1. Umwandlung funktioneller Gruppen Geben Sie Reagenzien an, mit denen Sie die folgenden Umwandlungen durchführen würden! 2 CH 3 H a) b) I H c) d) C F e) f) H
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Nr. Aufgabe Pkt. 2.2 Erklären Sie die ungewöhnliche Stabilität aromatischer Systeme gegenüber Additionsversuchen!
 aromatische Kohlenwasserstoffe Jahrgang Index Nr. Aufgabe Pkt 15/IV 1 o-bromtoluol soll aus Benzol, Methan und Brom mit geeigneten Katalysatoren hergestellt werden. Beschreiben Sie unter Verwendung von
aromatische Kohlenwasserstoffe Jahrgang Index Nr. Aufgabe Pkt 15/IV 1 o-bromtoluol soll aus Benzol, Methan und Brom mit geeigneten Katalysatoren hergestellt werden. Beschreiben Sie unter Verwendung von
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Aromaten, Fette und Tenside Seminar zu chem2010 Stephan Bernt
 , Fette und Tenside 12.05.2010 Seminar zu chem2010 Stephan Bernt Kriterien für Aromatizität: cyclisch planar vollständig konjugiertes π-elektronensystem Hückel-Regel: 4n+2 π-elektronen Prototyp des Aromaten:
, Fette und Tenside 12.05.2010 Seminar zu chem2010 Stephan Bernt Kriterien für Aromatizität: cyclisch planar vollständig konjugiertes π-elektronensystem Hückel-Regel: 4n+2 π-elektronen Prototyp des Aromaten:
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Beispiele. Polysubstituierte Benzole. Chapter 16. Organic Chemistry. Reaktionen of Substituierter Benzole. Bezeichnung durch Numerierung oder Präfix
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Beispiele Chapter 16 Reaktionen of Substituierter Benzole Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice Hall Bezeichnung durch
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Versuch: Bromierung von Phenol
 Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Arene Arene sind cyclisch konjugierte
Organische Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de Arene Arene sind cyclisch konjugierte
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
13. Amine und ihre Derivate
 Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
Phenole sind aromatische Verbindungen, bei denen mindestens eine OH-Gruppe direkt mit dem Stammsystem verbunden. 2-Methylphenol o-kresol
 Ri 97 2.2. Phenole Phenole sind aromatische Verbindungen, bei denen mindestens eine -Gruppe direkt mit dem Stammsystem verbunden ist. Nomenklatur Die wichtigsten Phenole tragen weit verbreitete Trivialnamen.
Ri 97 2.2. Phenole Phenole sind aromatische Verbindungen, bei denen mindestens eine -Gruppe direkt mit dem Stammsystem verbunden ist. Nomenklatur Die wichtigsten Phenole tragen weit verbreitete Trivialnamen.
REAKTIONEN DER ORGANISCHEN CHEMIE
 REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
REAKTIONEN DER ORGANISCHEN CHEMIE 1) ÜBERSICHT VON DEN REAKTIONEN AUSGEHEND: Die Reaktion der OC lassen sich auf 4 Grundtypen zurückführen: Grundtyp Addition Substitution Eliminierung Umlagerung allg A
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
 Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11 Praktikumsleitung: Dr. Reiß Assistent(in): Jan Schäfer Name: Johannes Hergt Datum: 23.11.2010 Gruppe 4: Aromaten Versuch (elektr.
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Reak%onen an der Carbonylgruppe
 Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Reak%onen an der Carbonylgruppe H. Wünsch 2013 1.1 Struktur der Carbonylgruppe Die Carbonylgruppe entsteht bei der OxidaBon primärer und sekundärer Alkohole. Kohlenstoff und Sauerstoff sind doppelt gebunden,
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
SCHRIFTLICHE ABITURPRÜFUNG 2006 CHEMIE (Grundkursniveau)
 CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Endersch, Jonas 26./ Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Cyclopenten von Benzol unterscheiden?
 14-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
14-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten Eine Gruppe mischt Spiritus mit Wasser. Füllt dazu zunächst zwei Messzylinder mit je exakt
Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! 3-Ethylheptan-2-on
 15-2 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Pyridin Acetylchlorid p-xylol 3-Ethylheptan-2-on Glycol Ölsäure Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
15-2 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Pyridin Acetylchlorid p-xylol 3-Ethylheptan-2-on Glycol Ölsäure Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
Beispiel für eine Anionenaustausch-Matrix. Als funktionelle Gruppe dient hier eine Diethylaminoethylgruppe.
 Aufgabe 1 Essigsäure exansäure Der Laugenverbrauch ist im Falle der Essigsäure höher. Essigsäure verteilt sich besser in die Wasserphase, exansäure aufgrund der höheren Anzahl unpolarer Alkylreste besser
Aufgabe 1 Essigsäure exansäure Der Laugenverbrauch ist im Falle der Essigsäure höher. Essigsäure verteilt sich besser in die Wasserphase, exansäure aufgrund der höheren Anzahl unpolarer Alkylreste besser
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )
![Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 ) Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )](/thumbs/74/69784240.jpg) 1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
Übung zu den Vorlesungen Organische und Anorganische Chemie
 Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Übung zu den Vorlesungen Organische und Anorganische Chemie für Biologen und Humanbiologen 12.11.08 1. Stellen sie die Reaktionsgleichung für die Herstellung von Natriumsulfid aus den Elementen auf. Wieviel
Darstellung von Malachitgrün Präparat 5
 Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Janine Schneider 22.05.00 Darstellung von Malachitgrün Präparat 5 1. Reaktionstyp: säurekatalysierte Kondensation (elektrophile Substitution) 2. Reaktionsgleichung: O + 2 ( + ) Benzaldehyd N,N- Dimethylanilin
Aromatische Kohlenwasserstoffe
 Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
ALDEHYDE & KETONE. Referat über die Carbonylverbindungen: Aldehyde und Ketone Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium
 ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1
 Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2018
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
Aufgabe S. 2/b (2 Punkte) Wobei kann es sich um ein Derivat (gleiche Oxidationsstufe des Carboxyl-C-Atoms) einer Carbonsäure handeln?
 14-3 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
14-3 2 Zur Punktevergabe bei multiple choice-aufgaben: Meist gibt es 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Aromatische Substitution. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! 3-Ethylheptan-2-on
 15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
15-3 2 Aufgabe S. 2/a (6 Punkte) Zeichnen Sie die Strukturformeln der folgenden Verbindungen! Anilin Propionsäure Phenol 3-Ethylheptan-2-on Glycerin Formaldehyd Aufgabe S. 2/b (6 Punkte) Zeichnen Sie jeweils
Inhaltsverzeichnis zu Kapitel 6. Aromaten
 Inhaltsverzeichnis zu Kapitel 6. Aromaten 6. Aromaten 6.1 Aromatizität 73 6.2 omenklatur 75 6.3 Darstellung 76 6.4 lektrophile Substitution am Aromaten 76 6.5 Beispiele für S -Reaktionen (was ist?) 77
Inhaltsverzeichnis zu Kapitel 6. Aromaten 6. Aromaten 6.1 Aromatizität 73 6.2 omenklatur 75 6.3 Darstellung 76 6.4 lektrophile Substitution am Aromaten 76 6.5 Beispiele für S -Reaktionen (was ist?) 77
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Benzolstruktur und Delokalisation (Leitprogramm)
 Leitprogramm Benzol Seite 1 Benzolstruktur und Delokalisation (Leitprogramm) Benzol ist eine farblose, leicht entzündliche Flüssigkeit, die aus Erdöl gewonnen wird. In Wasser ist es nur sehr wenig löslich,
Leitprogramm Benzol Seite 1 Benzolstruktur und Delokalisation (Leitprogramm) Benzol ist eine farblose, leicht entzündliche Flüssigkeit, die aus Erdöl gewonnen wird. In Wasser ist es nur sehr wenig löslich,
Abschlussklausur zur Grundvorlesung Organische Chemie im SS 2007 Nachholtermin -
 Prof. Dr. H.-A. Wagenknecht Institut für rganische Chemie Universität Regensburg Abschlussklausur zur Grundvorlesung rganische Chemie im SS 2007 Nachholtermin - am Freitag, dem 12. ktober 2007... Vorname:...
Prof. Dr. H.-A. Wagenknecht Institut für rganische Chemie Universität Regensburg Abschlussklausur zur Grundvorlesung rganische Chemie im SS 2007 Nachholtermin - am Freitag, dem 12. ktober 2007... Vorname:...
Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231
 Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231 Fachhochschule Aachen, Campus Jülich Fachprüfung 32330/32231 Organische Chemie für Biotechnologen II Prüfungsdatum: 10.07.2013 Prüfungsdauer:
Klausur Organische Chemie II für Biotechnoligen Prüfung 32330/32231 Fachhochschule Aachen, Campus Jülich Fachprüfung 32330/32231 Organische Chemie für Biotechnologen II Prüfungsdatum: 10.07.2013 Prüfungsdauer:
3. Übung Grundlagen der Hauptgruppenchemie
 Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
Allgemeine und Anorganische Chemie 3. Übung Grundlagen der Hauptgruppenchemie Aufgabe 1: Beschreiben Sie die Herstellung von Schwefelsäure nach dem Kontaktverfahren mit Hilfe von chemischen Gleichungen
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Halogenierung von gesättigten Kohlenwaserstoffen
 Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2016
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Lernwerkstatt: Organische Chemie II. Das komplette Material finden Sie hier:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Lernwerkstatt: Organische Chemie II Das komplette Material finden Sie hier: School-Scout.de Titel: Lernwerkstatt: Organische Chemie
7. Studieneinheit. Siebte Studieneinheit
 86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
Zweite Klausur zum Organisch-Chemischen Grundpraktikum
 Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
Prof. Dr. Jens Christoffers 12. Juni 2006 Universität ldenburg Zweite Klausur zum rganisch-chemischen Grundpraktikum Vorname: Name: Matrikelnummer: Studiengang: Falls Sie zusätzliche Seiten verwenden,
Organische Chemie I Molekül der Woche - Azulen
 I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
Aktuelle Beispiele aus der Forschung
 Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Vorlesung: Allgemeine Chemie Organische Chemie 05.12.; 08.12.; Prof. Dr. C. Meier Eine Einführung in die Organische Chemie Themen: Elektronenstruktur, kovalente Bindung, Säure-Basen-Eigenschaften in Abhängigkeit
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon
 Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
1. a) Geben sie den Reaktionsmechanismus für die Nitrierung und die Sulfonierung von Benzol an. Beginnen sie mit der Erzeugung des Elektrophils.
 Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Übungsblatt 05 - C I - SoSe 2014 (Prof. Bunz) 1. a) Geben sie den Reaktionsmechanismus für die itrierung und die Sulfonierung von Benzol an. Beginnen sie mit der rzeugung des lektrophils. I) rzeugung lektrophil:
Herstellung und Oxidation von 2,4,6-Tri-tert-butylphenol
 2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
5. Aromatische Kohlenwasserstoffe
 Inhalt Index 5. Aromatische Kohlenwasserstoffe Aufgrund der starken Aromas, das viele Benzolderivate ausströmen, nennt man sie aromatische Verbindungen. Deshalb gilt Benzol als Stammverbindung der Aromaten.
Inhalt Index 5. Aromatische Kohlenwasserstoffe Aufgrund der starken Aromas, das viele Benzolderivate ausströmen, nennt man sie aromatische Verbindungen. Deshalb gilt Benzol als Stammverbindung der Aromaten.
Name, Vorname: Matrikelnummer: Studienrichtung: Fragen auf den folgenden Seiten: Musterlösung zur Klausur zur Experimentalvorlesung Organische Chemie
 rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
rganisch-chemisches nstitut Fakultät für Chemie und Geowissenschaften Universität eidelberg 23. Juni 2015 Musterlösung zur Klausur zur Experimentalvorlesung rganische Chemie von Prof. Stephen ashmi Name,
Kunststoffe (Polykondensation)
 Kunststoffe (Polykondensation) Herstellung eines Phenoplasts 7. Stunde (13 15 14 00 Uhr) am Donnerstag, den 27. Januar 2011 Ein Chemieprotokoll von Sebastian Huber, Maximilian Mayer, Robert Bozsak und
Kunststoffe (Polykondensation) Herstellung eines Phenoplasts 7. Stunde (13 15 14 00 Uhr) am Donnerstag, den 27. Januar 2011 Ein Chemieprotokoll von Sebastian Huber, Maximilian Mayer, Robert Bozsak und
Arzneistoff der Woche. Alkohole. Eliminierungen. Organische Chemie Agenda. Johann Wolfgang Goethe -Universität Frankfurt am Main
 Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
