Entmischung von Polymerlösungen
|
|
|
- Hildegard Günther
- vor 7 Jahren
- Abrufe
Transkript
1 Entmischung von Polymerlösungen Betreuerin: Dr. V. Strehmel Arbeitskreis: Prof. Dr. A. Laschewsky Tel.: 54
2 Im Gegensatz zu ihren niedermolekularen Analoga sind Polymere nur in wenigen Lösemitteln löslich, und dass auch nur in einem engen Temperaturbereich. Während z.b. ein Wachs der Formel H-(CH ) n -H sich in vielen Lösemitteln auflöst, finden sich für Polyethylen kaum welche. Die empirische Regel, dass sich "Gleiches in Gleichem" löst, ist für Polymere nur sehr beschränkt gültig, und wird im Falle von Mischungen zweier Polymere sogar völlig hinfällig. Diese stark eingeschränkte Löslichkeit bzw. Mischbarkeit von Polymeren ist für den praktischen Einsatz von Polymermaterialien sehr wichtig und ist ein direkter Effekt der Größe von Makromolekülen. Theoretische Grundlagen In Analogie zu Mischungen niedermolekularer Komponenten geht man zur Beschreibung von isobar-isothermen Mischungsvorgängen von Polymeren mit einem Lösungsmittel von der Gibbs schen Gleichung () aus. G = H T S () G molare Gibbs sche Mischungsenthalpie H molare Mischungsenthalpie S molare Mischungsentropie T Temperatur in Kelvin Bei idealen Lösungen sind definitionsgemäß die Kräfte zwischen den Lösungsmittelmolekülen und den Kettensegmenten gleich groß. Für ideale Mischungen ist die Mischungsenthalpie daher gleich Null und somit gilt: G ideal = T S (a) Die Mischungsentropie wird durch die statistische Thermodynamik gegeben (Zustandssumme). Translationsentropie, innere Rotationsentropie und Vibrationsentropie bleiben beim Mischen konstant. Die Abweichungen vom idealen Verhalten werden durch sogenannte Excessgrößen ( E ) beschrieben. Damit definiert man die molare Gibbs sche Mischungsenthalpie für eine reale Mischung ( G) als Summe aus der Gibbs schen Mischungsenthalpie für die ideale Mischung ( G ideal ) und einer molaren freien Excessmischungsenthalpie ( G E ): ideal E G = G + G ()
3 Gemäß Gleichung () und (a) lässt sich die Excessmischungsenthalpie mit Gleichung (3) beschreiben: E E G = H T S (3) Je nach dem Anteil und dem Vorzeichen des idealen Gliedes ( G ideal ) und des Excess-Terms ( G E ) werden Lösungen in folgende vier Typen eingeteilt: ideale, athermische, reguläre und reale Lösungen. Bei der idealen Lösung wird die Gibbs sche Mischungsenthalpie ausschließlich durch die ideale Mischungsentropie bestimmt. Bei der athermischen Lösung ist die Mischungsenthalpie zwar immer noch gleich Null. Die Mischungsentropie weicht jedoch bei der athermischen Lösung von der idealen Mischungsentropie ab. Bei der regulären Lösung ist dagegen die Mischungsentropie noch ideal, aber die Mischungsenthalpie ist von null verschieden. Reale Lösungen werden dagegen durch eine Mischungsenthalpie und eine Excess-Mischungsentropie beschrieben. Bei Polymerlösungen handelt es sich immer um reale Lösungen. Ein Spezialfall der realen Lösung ist die sogenannte Theta-Lösung. Eine verdünnte Lösung verhält sich bei einer bestimmten Temperatur, der Theta-Temperatur, wie eine ideale Lösung, da sich bei dieser Temperatur die Mischungsenthalpie und die Excess-Mischungsentropie kompensieren. Eine Theta-Lösung ist also pseudoideal. Die Fähigkeit eines Makromoleküls, sich in einem Lösungsmittel zu lösen, wird sowohl durch enthalpische als auch durch entropische Effekte bedingt (siehe Gleichungen ()-(3)). Theoretische Betrachtungen zeigen, dass ohne spezifische Wechselwirkungen (also bei Berücksichtigung nur der van-der-waals und London-Kräfte) die Mischung zweier verschiedener Stoffe immer eine positive Mischungsenthalpie aufweist, also enthalpisch gesehen ungünstig ist. Im Normalfall sorgt nur eine ausreichend hohe Mischungsentropie für eine Mischbarkeit. Der Bedarf an Mischungsentropie ist um so kleiner, je weniger sich die Stoffe abstoßen. Daher sind Makromoleküle am ehesten in den Lösungsmitteln löslich, die ihren Grundbausteinen möglichst ähnlich sind ( Gleiches löst Gleiches ). Da die Molekülsegmente im Kristall besonders gut miteinander wechselwirken (und somit die Mischungsenthalpie besonders ungünstig wird), lösen sich amorphe Polymere deutlich besser als kristalline. Entsprechend lösen sich kristalline Polymere im Extremfall nicht einmal mehr in ihren eigenen Monomeren (Polyacrylnitril ist z.b. in Acrylnitril unlöslich) oder in chemisch eng verwandten Lösungsmitteln (während Amylose in Wasser stark quillt und sich z.t. löst, ist Cellulose in Wasser unlöslich). 3
4 Traditionell wird die Mischungsentropie von Lösevorgängen als ideal angenommen. Dies setzt u.a. voraus, dass die beiden Komponenten in der binären Mischung annähernd gleich sind. Da bei einer Polymerlösung die Größe des Makromoleküls deutlich von der des Lösungsmittels verschieden ist, sind die für niedermolekulare binäre Mischungen abgeleiteten Zusammenhänge nicht ohne weiteres anwendbar. Außerdem wird bei den Makromolekülen die Beweglichkeit der Molekülketten durch den Aufbau bestimmt. Flory und Huggins entwickelten daher auf der Basis des Gittermodells einer Flüssigkeit ein Modell für eine binäre Lösung eines Polymeren in einem niedermolekularen Lösungsmittel. Bei diesem Modell wird das Makromolekül in Segmente zerlegt, die miteinander verbunden sind. Die Segmente werden so gewählt, dass diese in ihrer Größe und Geometrie (kugelförmige Gestalt) mit den Lösungsmittelmolekülen vergleichbar sind. Die Gitterplätze werden bei diesem Modell von Lösungsmittelmolekülen oder von Segmenten des Makromoleküls besetzt (Abb. ). Bei gleichem Platzbedarf von Lösungsmittelmolekülen und Polymerkettensegmenten ergibt sich die Anzahl der Segmente (N) in einem Makromolekül aus Gleichung (4), wobei V das Molvolumen des Lösungsmittels ist und V das Molvolumen eines Polymerkettensegmentes. V V N = (4) Abb. : Anordnung von Lösungsmittelmolekülen () und von Segmenten eines Makromoleküls ()in einem zweidimensionalen Gitter Die Segmente eines Makromoleküls und die Lösungsmittelmoleküle können in dem zweidimensionalen Gitter in Abb. auf verschiedenen Plätzen angeordnet sein. Aus der Vielzahl der möglichen Kombinationen resultiert unter der Voraussetzung, dass die Molvolumina der beiden Komponenten gleich groß sind, eine Entropie ( S comb ), die auch als Konfigurations- 4
5 entropie bezeichnet wird (Gleichung (5)). Der Index comb (kombinatorisch) weist dabei auf die statistischen Annahmen hin, auf denen die Ableitung der Mischungsentropie basiert. S comb = R x lnφ + x ln ) (5) N N gesamt ( φ N φ = und φ = (6) N gesamt In Gleichung (5) stehen x für den Stoffmengenanteil des Lösungsmittels und x für den Stoffmengenanteil der Polymerkettensegmente. Die Volumenbrüche (Ν) der Komponenten sind mit Gleichung (6) gegeben, wobei N und N der Zahl der Moleküle der jeweiligen Komponente entsprechen. Die Anzahl der Segmente in einem Molekül wird mit im Fall der Lösungsmittelmoleküle ( = ) und mit im Fall der Polymermoleküle bezeichnet. Der in Gleichung (5) dargestellte Zusammenhang gilt unter der Voraussetzung, dass keine Änderung der Enthalpie und keine Volumenänderung auftritt. Die Mischung eines amorphen Polymeren mit einem Lösungsmittel erfolgt somit unter isobaren und isothermen Bedingungen, und das Gesamtvolumen setzt sich additiv zusammen. Unter der Voraussetzung, dass der Platzbedarf eines Lösungsmittelmoleküls und eines Polymerkettensegmentes gleich ist, können anstelle der Molvolumina die Stoffmengenanteile des Lösungsmittels und der Polymerkettensegmente einbezogen werden. Die Mischungsenthalpie H ergibt sich aus der Differenz der Enthalpien der Lösung (H ) und H bzw. H der reinen Komponenten (Gleichung (7)). H = H ( H + ) (7) H Unter der Annahme, dass die Stoffmengenanteile und die Volumenanteile identisch sind und unter Berücksichtigung des mittleren Energiegewinns ( ε) bei Kontakt eines Lösungsmittelmoleküls mit einem Polymerkettensegment ergibt sich für die Mischungsenthalpie Gleichung (8): H = z N φ ε (8) N N = N + N N gesamt φ (Volumenbruch der Polymerkettensegmente) z = Zahl der Nachbarn N Bausteine aller Lösungsmittelmoleküle N Bausteine aller Polymerkettensegmente ε = Maß für die Gibbs-Energie Der Flory-Huggins-Wechselwirkungsparameter (χ) ist definitionsgemäß ein Maß für die Wechselwirkungsenergie (Gleichung 9). 5
6 z χ (9) k T Der χ -Parameter enthält einen Enthalpie- und einen Entropiebeitrag, wobei der Entropiebeitrag konzentrationsabhängig ist und in erster Näherung als lineare Funktion des Volumenbruches des Gelösten (Φ ) beschrieben werden kann (Gleichung ). χ = χ + σ () φ Durch Einsetzen der Gleichungen (9) und () in Gleichung (8) erhält man Gleichung (). H = k T N φ χ + σ ) () ( φ Durch Kombination der Gleichungen (), (5) und () ergibt sich für die Gibbs sche Mischungsenergie Gleichung (). G m R T = φ φ χ + φ φ σ + φ lnφ + φ lnφ () Durch Differentiation von Gleichung () ergeben sich unter Berücksichtigung der in den Gleichungen (3) und (4) dargestellten Zusammenhänge Gleichung (5) für das chemische Potential des Lösungsmittels (µ ) und Gleichung (6) für das chemische Potential des gelösten Polymeren (µ ). φ + φ (3) = G µ i n (4) i T, p, n j i ( + ) + ( ) + χ σ σ φ φ ln φ φ µ = RT (5) ( χ φ + σ φ φ ) φ + φ + φ µ = RT ln (6) Tritt bei einer Polymerlösung Phasentrennung auf, so müssen die chemischen Potentiale der einzelnen Komponenten in jeder Phase gleich sein (Gleichungen (7) und (8)). µ = und ' '' µ µ = (7) ' '' µ µ und ' ' '' '' µ µ µ (8) ' ' '' '' µ µ Durch Gleichsetzen der chemischen Potenziale lässt sich die Grenze zwischen der stabilen Polymerlösung und dem Bereich, in dem Phasentrennung erfolgt, beschreiben. Diese Grenze wird als Binodale bezeichnet. Die Berechnungen sind jedoch sehr kompliziert, da die Gleichungen (7) und (8) für jeden Polymerisationsgrad aufgestellt werden müssten. 6
7 Der nicht-stabile Bereich wird weiterhin in einen metastabilen und einen instabilen Bereich aufgeteilt. Die Grenze zwischen dem metastabilen und dem instabilen Bereich ist durch die Spinodale gegeben. Im metastabilen Bereich gilt die folgende Bedingung: G φ m > (9) Das System ist im metastabilen Bereich gegen Phasen mit verschwindend kleinen Unterschieden in der Zusammensetzung noch stabil, da hier die in der Ungleichung (9) beschriebene Bedingung gültig ist. Bei größeren Unterschieden in der Zusammensetzung erfolgt dagegen eine spontane Phasentrennung. Die Spinodale ist durch die Wendepunkte der Funktion G m = f φ ) charakterisiert (Gleichung ()). G φ m µ = φ = () Unter Berücksichtigung der in Gleichung () formulierten Bedingung ergibt sich aus Gleichung (5) für = und σ = für die Spinodale der in Gleichung () formulierte Zusammenhang. ( µ = RT χ φ + φ φ = Der kritische Punkt ist als derjenige Volumenbruch des Polymeren definiert, bei dem Maximum, Minimum und Wendepunkt der Funktion µ = f ) zusammenfallen. ( φ () µ = RT = χ () φ ( φ ) Auflösung der Gleichungen () und () nach χ ergibt unter Berücksichtigung von Gleichung (3) und einem negativen Vorzeichen der Wurzel Punkt den in Gleichung (4) formulierten Zusammenhang.,5,5 ( ) ( ) = ( ) ( ),5 für den kritischen + (3) φ (4) + ( ) = crit, 5 Wie aus Gleichung (4) erkennbar ist, nimmt der kritische Volumenbruch umso niedrigere Werte an, je höher der Polymerisationsgrad des Gelösten ist. 7
8 Das Mischungsverhalten eines Polymeren in einem Lösungsmittel ist von der Temperatur abhängig. Liegt oberhalb einer bestimmten Temperatur eine vollständige Lösung vor, so spricht man von einer UCST ( upper critical solution temperature ). Ist dagegen das Polymer-Lösungsmittel-Gemisch unterhalb einer bestimmten Temperatur einphasig und zeigt dieses Polymer-Lösungsmittel-Gemisch oberhalb dieser Temperatur eine Entmischung, spricht man von einer LCST ( lower critical solution temperature ). Die LCST entspricht einer entropisch induzierten Entmischung und die UCST einer enthalpisch induzierten Entmischung. Je nach Vorzeichen von Mischungsenthalpie und - entropie sollte man also völlige Mischbarkeit (H < und S > ), eine untere Mischungslücke (H > und S > ), eine Mischungslücke bei hohen Temperaturen (H < und S < ) oder völlige Unmischbarkeit (H > und S < ) erwarten. In Wahrheit sind die Verhältnise komplizierter, da sowohl H wie auch S selber Funktionen der Temperatur sind, und das in nicht monotoner Weise. Aus komplexeren theoretischen Behandlungen ergibt sich, dass prinzipiell jedes Polymer-Lösungsmittel-Gemisch sowohl eine UCST als auch eine LCST aufweisen sollte, obwohl nicht immer beide kritischen Entmischungstemperaturen experimentell bestimmbar sind. Je nach der Lage der beiden Entmischungstemperaturen wird entweder ein Stundenglas -Diagramm (Abb. a) oder eine geschlossene Mischungslücke beobachtet. Dabei wird das konkrete Mischungsverhalten der Polymere durch die Wahl des Lösungsmittels bestimmt. 8
9 a) b) Abb. : Entmischungstemperaturen (LCST und UCST) als Funktion der Zusammensetzung (φ PS = Volumenbruch an Polystyren, w PVA = Massenbruch an Polyvinylalkohol) für das Polymer-Lösungsmittel-System a) Polystyren/Aceton für folgende Molmassen: 48 (), 3 ( ) und 98 () b) Polyvinylalkohol (M n = 4g/mol - )/Wasser Aufgabenstellung Für das binäre System Poly(N-acryloyl-pyrrolidin)/Wasser sind die Entmischungstemperaturen in Abhängigkeit von der Konzentration des Gelösten mit der Ampullenmethode experimentell zu ermitteln. Die Trübungspunkte sind zu bestimmen und die Entmischungstemperatur als Funktion der Konzentration aufzutragen. Chemikalien: Wasser Poly(N-acryloyl-pyrrolidin) 9
10 Versuchsdurchführung Poly(N-acryloyl-pyrrolidin)-Wasser-Gemische unterschiedlicher Konzentrationen werden unter sehr sparsamer Verwendung des Polymeren hergestellt. Dabei ist eine Stammlösung herzustellen und weitere Konzentrationen durch Verdünnen dieser Stammlösung. Folgende Konzentrationen sind einzustellen: g/l; 5 g/l; g/l und g/l. Die Lösungen werden bei Raumtemperatur in Reagenzgläser (Ampullen) gefüllt und unter Rühren und unter Verwendung eines Wasserbades bis zu einer Temperatur von 7 C aufgeheizt. Dabei ist die Temperatur in den Reagenzgläsern zu kontrollieren und die Temperatur zu notieren, bei der eine Trübung auftritt. Anschließend sind die Proben auf Raumtemperatur abzukühlen und die Temperatur zu notieren, bei welcher die Polymerlösung wieder klar wird. Ein genaues Beobachten und ein schnelles Registrieren der Temperaturen ist notwendig. Die Entmischungstemperatur wird in Abhängigkeit von der Konzentration in einem Diagramm aufgetragen. Anschließend wird das Experiment mit denselben Proben mindestens noch einmal wiederholt und die erhaltenen Messwerte wiederum aufgetragen. Das Experiment sollte erst beendet werden, wenn sich die Entmischungstemperaturen reproduzieren lassen. Das Experiment wird mit einer der folgenden Poly(N-acryloyl-pyrrolidin)proben durchgeführt: M n : ca. 5g/mol; ca. 56g/mol; ca. 45g/mol Ergebnisdiskussion Die Abhängigkeit der Entmischungstemperatur für Poly(N-acryloyl-pyrrolidin)/Wasser Gemische von der Konzentration des Gelösten ist zu diskutieren. Weiterführende Fragen. Wie wird Polyvinylalkohol hergestellt?. Welche Größe kann als Maß für die Wechselwirkung zwischen einem Polymer und einem Lösungsmittel herangezogen werden? 3. Welche anderen Polymere zeigen auch in Wasser ein Entmischungsverhalten? Literatur. Hans-Georg Elias Makromoleküle Struktur-Eigenschaften-Synthesen Stoffe- Technologie, Hüthig & Wepf Verlag Basel Heidelberg. J. M. G. Cowie Polymers: Chemistry & Physics of Modern Materials, Blackie and Son Ltd. Glasgow London
1. Thermodynamik der Polymerlösungen
 . Thermodynamik der Polymerlösungen. Polydispersität der Polymeren Polymere sind gewöhnlich polydispers, das heißt, sie bestehen aus einer Vielzahl chemisch ähnlicher Spezies, die sich vor allem in der
. Thermodynamik der Polymerlösungen. Polydispersität der Polymeren Polymere sind gewöhnlich polydispers, das heißt, sie bestehen aus einer Vielzahl chemisch ähnlicher Spezies, die sich vor allem in der
Inhaltsverzeichnis. Symbolverzeichnis 3. Einführung 6
 Inhaltsverzeichnis 3 Einführung 6 1. Thermodynamik der Polymerlösungen 9 1.1 Polydispersität der Polymeren........................ 9 1.2 Entmischungsverhalten von echt binären und quasibinären Systemen...
Inhaltsverzeichnis 3 Einführung 6 1. Thermodynamik der Polymerlösungen 9 1.1 Polydispersität der Polymeren........................ 9 1.2 Entmischungsverhalten von echt binären und quasibinären Systemen...
Mischungslücke in der flüssigen Phase
 Übungen in physikalischer Chemie für B. Sc.-Studierende Versuch Nr.: S05 Version 2018 (260218) Kurzbezeichnung: Mischungslücke Mischungslücke in der flüssigen Phase Aufgabenstellung Die Entmischungskurven
Übungen in physikalischer Chemie für B. Sc.-Studierende Versuch Nr.: S05 Version 2018 (260218) Kurzbezeichnung: Mischungslücke Mischungslücke in der flüssigen Phase Aufgabenstellung Die Entmischungskurven
8. Mehrkomponentensysteme. 8.1 Partielle molare Größen. Experiment 1 unter Umgebungsdruck p:
 8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
8. Mehrkomponentensysteme 8.1 Partielle molare Größen Experiment 1 unter Umgebungsdruck p: Fügen wir einer Menge Wasser n mit Volumen V (molares Volumen v m =V/n) bei einer bestimmten Temperatur T eine
Abbildung 1: Dichtegradient im Gleichgewicht (rechte Achse) und Hierbei sind neben einer Dichteverteilung auch die ungefähren Molmas-
 UZ-Dichtegradient Ziel des Experiments Häufig ist die Dichte eines sedimentierenden Partikels nicht bekannt oder sogar Hauptgegenstand der Untersuchung. Zur ausschließlichen Bestimmung der Teilchendichte
UZ-Dichtegradient Ziel des Experiments Häufig ist die Dichte eines sedimentierenden Partikels nicht bekannt oder sogar Hauptgegenstand der Untersuchung. Zur ausschließlichen Bestimmung der Teilchendichte
Vorlesung Physikalische Chemie IV Statistische Thermodynamik realer chemischer Systeme"
 Vorlesung Physikalische Chemie IV Statistische hermodynamik realer chemischer Systeme" Dietmar Paschek SS 6 Flory-Huggins heorie (III) Polymer-Lösungen: Osmotischer Druck Statistische hermodynamik realer
Vorlesung Physikalische Chemie IV Statistische hermodynamik realer chemischer Systeme" Dietmar Paschek SS 6 Flory-Huggins heorie (III) Polymer-Lösungen: Osmotischer Druck Statistische hermodynamik realer
Einführung in die Polymer- und Kolloidwissenschaften. 4. Lösungsmitteleffekte
 Einführung in die Polymer- und Kolloidwissenschaften Warum sind Polymere schlecht löslich? 4. Lösungsmitteleffekte Fuhrmann, Kassel 2004 Polymere lassen sich in der Regel schlechter in Lösungsmitteln lösen
Einführung in die Polymer- und Kolloidwissenschaften Warum sind Polymere schlecht löslich? 4. Lösungsmitteleffekte Fuhrmann, Kassel 2004 Polymere lassen sich in der Regel schlechter in Lösungsmitteln lösen
S05-Mischungslücke_Bsc Erstelldatum :15:00
 S05-ischungslücke_Bsc Erstelldatum 21.03.2014 11:15:00 Übungen in physikalischer Chemie für Studierende der Biochemie Versuch Nr.: S05 Version 2014 Kurzbezeichnung: ischungslücke ischungslücke in der flüssigen
S05-ischungslücke_Bsc Erstelldatum 21.03.2014 11:15:00 Übungen in physikalischer Chemie für Studierende der Biochemie Versuch Nr.: S05 Version 2014 Kurzbezeichnung: ischungslücke ischungslücke in der flüssigen
Protokoll zum Versuch 4.2
 Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
Grundpraktikum Physikalische Chemie Studiengang: Chemie-Ingenieurwesen Technische Universität München SS 2003 Protokoll zum Versuch 4.2 Entmischungsgleichgewicht Gruppe 3 Kim Langbein Oliver Gobin 07 April
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen
 Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Polymere in Lösung DNA. i-pp. Helix 3 1. Knäuel: PE (Zick-Zack Struktur) a-pp, i-pp. l max. Macro Handout 8: Polymere in Lösung
 Konformation von Kohlenwasserstoffen Polymere in Lösung Reele Knäuel Dimensionen werden durch Rotationswinkel (gauche, eclipsed, anti) und den Torsionswinkel bestimmt. Die aktuelle Konformation eines Makromoleküls
Konformation von Kohlenwasserstoffen Polymere in Lösung Reele Knäuel Dimensionen werden durch Rotationswinkel (gauche, eclipsed, anti) und den Torsionswinkel bestimmt. Die aktuelle Konformation eines Makromoleküls
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
(4.41) (4.42) (4.43) = Gm (4.44) heißt Gibbssche-Mischungsenergie Gm. Für die ideale Lösung gilt: x i (4.45)
 78 4. Thermodynamik von Polymerlösungen 4. Thermodynamik von Polymerlösungen 4.. Ideale und reale Lösungen Eine makromolekulare Lösung besteht in der Regel aus einer bestimmten Sorte eines Polymers und
78 4. Thermodynamik von Polymerlösungen 4. Thermodynamik von Polymerlösungen 4.. Ideale und reale Lösungen Eine makromolekulare Lösung besteht in der Regel aus einer bestimmten Sorte eines Polymers und
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11
 23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
Gefrierpunktserniedrigung
 Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Knoch, Anastasiya Datum der Durchführung: Petri, Guido 05.01.2016 (Gruppe 11) Datum der Korrektur: 02.02.2016 Praktikum Physikalische Chemie I. Thermodynamik Gefrierpunktserniedrigung 1. Aufgabenstellung
Schmelzdiagramm eines binären Stoffgemisches
 Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Praktikum Physikalische Chemie I 30. Oktober 2015 Schmelzdiagramm eines binären Stoffgemisches Guido Petri Anastasiya Knoch PC111/112, Gruppe 11 1. Theorie hinter dem Versuch Ein Schmelzdiagramm zeigt
Lehrbuch der Thermodynamik
 Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Prof. Dr. U. Schollwöck Sommersemester 2013
 Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Klausur Prof. Dr. U. Schollwöck Sommersemester 2013 Matrikelnummer: Aufgabe 1 2 3 4 5 6 Summe Punkte Note: WICHTIG! Schreiben
Theoretische Physik 25. Juli 2013 Thermodynamik und statistische Physik (T4) Klausur Prof. Dr. U. Schollwöck Sommersemester 2013 Matrikelnummer: Aufgabe 1 2 3 4 5 6 Summe Punkte Note: WICHTIG! Schreiben
Die Innere Energie U
 Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen
 Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Inhalt Kapitel 3 3.0-1 3. Mehrkomponentensysteme 3.1 Partielle molare Zustandsgrößen 3.2 Thermodynamische Gleichgewichte in Mehrkomponentensystemen Das Chemische Potential reiner Stoffe und von Stoffen
Mischungslücke in der flüssigen Phase
 Übungen in physikalischer Chemie für B. Sc.-Studierende Versuch Nr.: S05 Version 2015 Kurzbezeichnung: Mischungslücke Mischungslücke in der flüssigen Phase Aufgabenstellung Die Entmischungskurven von Phenol/Wasser
Übungen in physikalischer Chemie für B. Sc.-Studierende Versuch Nr.: S05 Version 2015 Kurzbezeichnung: Mischungslücke Mischungslücke in der flüssigen Phase Aufgabenstellung Die Entmischungskurven von Phenol/Wasser
Thermo Dynamik. Mechanische Bewegung (= Arbeit) Wärme (aus Reaktion) maximale Umsetzung
 Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
9. Phasengleichgewichte und Zustandsänderungen 9.1 Einkompentige Systeme
 9. Phasengleichgewichte und Zustandsänderungen 9.1 Einkompentige Systeme Temperaturabhängigkeit der freien Enthalpie dg = d( H TS ) = dh T ds S dt = C P dt TC P T H Da S > 0, nimmt G mit zunehmender Temperatur
9. Phasengleichgewichte und Zustandsänderungen 9.1 Einkompentige Systeme Temperaturabhängigkeit der freien Enthalpie dg = d( H TS ) = dh T ds S dt = C P dt TC P T H Da S > 0, nimmt G mit zunehmender Temperatur
Physikalische Chemie Praktikum. Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung
 Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
Hochschule Emden / Leer Physikalische Chemie Praktikum Mischphasenthermodynamik: Gefrierpunktserniedrigung Molmassenbestimmung Vers.Nr. 17 Sept. 2015 Allgemeine Grundlagen a) Reine Stoffe Bei reinen Stoffen
Vorlesung Physikalische Chemie IV Statistische Thermodynamik realer chemischer Systeme"
 Vorlesung Physikalische Chemie IV Statistische Thermodynamik realer chemischer Systeme" Dietmar Paschek SS 016 Gittermodell für Mischungen Grenzen der Bragg-Williams Näherung Das Ising Modell Quasi-Chemische
Vorlesung Physikalische Chemie IV Statistische Thermodynamik realer chemischer Systeme" Dietmar Paschek SS 016 Gittermodell für Mischungen Grenzen der Bragg-Williams Näherung Das Ising Modell Quasi-Chemische
Inhalt 1 Grundlagen der Thermodynamik
 Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Aufgabe: Es sind die kryoskopischen Konstante von Wasser und die Molmassen von darin löslichen Substanzen zu bestimmen.
 Versuchsanleitungen zum Praktikum Physikalische Chemie für nfänger 1 4 Kryoskopie ufgabe: Es sind die kryoskopischen Konstante von Wasser und die Molmassen von darin löslichen Substanzen zu bestimmen.
Versuchsanleitungen zum Praktikum Physikalische Chemie für nfänger 1 4 Kryoskopie ufgabe: Es sind die kryoskopischen Konstante von Wasser und die Molmassen von darin löslichen Substanzen zu bestimmen.
Chemische Thermodynamik. Arbeitsbuch 4. 4., überarbeitete Auflage. Autoren. Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
 Arbeitsbuch 4 Chemische Thermodynamik Autoren Gert Wolf, Freiberg (federführender Autor) Wolfgang Schneider, Dresden 4., überarbeitete Auflage Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
Arbeitsbuch 4 Chemische Thermodynamik Autoren Gert Wolf, Freiberg (federführender Autor) Wolfgang Schneider, Dresden 4., überarbeitete Auflage Mit 53 Bildern sowie zahlreichen Tabellen im Text und im Anhang
Kolligative Eigenschaften
 Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
Praktikumsrelevante Themen
 Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Praktikumsrelevante Themen Lösungen Der Auflösungsprozess Beeinflussung der Löslichkeit durch Temperatur und Druck Konzentration von Lösungen Dampfdruck, Siede- und Gefrierpunkt von Lösungen Lösungen von
Die Zusammensetzung am Ausgang der 1. Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik
 Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
Bernhard Härder. Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik W/ WESTAR.P WISSENSCHAFTEN. Skripte, Lehrbücher Band 2
 Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
= n + + Thermodynamik von Elektrolytlösungen. Wdhlg: Chemisches Potential einer Teilchenart: Für Elektrolytlösungen gilt: wobei : und
 Elektrolyte Teil III Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Thermodynamik von Elektrolytlösungen
Elektrolyte Teil III Solvatation, elektrische Leitfähigkeit, starke und schwache Elektrolyte, Ionenstärke, Debye Hückeltheorie, Migration, Diffusion, Festelektrolyte Thermodynamik von Elektrolytlösungen
9. Festkörperreaktionen
 9. Festkörperreaktionen Wir hatten bereits bei der Diskussion von Diffusionsvorgängen gesehen, dass auch im festen Zustand Atome ständig ihre Plätze tauschen und so chemische Reaktionen in fester Materie
9. Festkörperreaktionen Wir hatten bereits bei der Diskussion von Diffusionsvorgängen gesehen, dass auch im festen Zustand Atome ständig ihre Plätze tauschen und so chemische Reaktionen in fester Materie
Gesetz von Boyle. Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V.
 Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Vorlesung Anorganische Chemie
 Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
Vorlesung Anorganische Chemie Prof. Ingo Krossing WS 2007/08 B.Sc. Chemie Lernziele Block 5 Verhalten von Lösungen Konzentrationen Solvatation und Solvatationsenthalpie Kolligative Eigenschaften Kryoskopie/Ebullioskopie
-aus theoretischen Ansätzen - Approximationen
 2.3 Bestimmung von Zustandsgrößen Zustand wird bestimmt durch zwei unabhängige, intensive Zustandsgrößen Bestimmung anderer Zustandsgrößen aus Stoffmodellen Zustandsgleichungen Stoffmodelle aus - Experimenten
2.3 Bestimmung von Zustandsgrößen Zustand wird bestimmt durch zwei unabhängige, intensive Zustandsgrößen Bestimmung anderer Zustandsgrößen aus Stoffmodellen Zustandsgleichungen Stoffmodelle aus - Experimenten
8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale
 8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper
8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper
Prof. Dr. Peter Vogl, Thomas Eissfeller, Peter Greck. Übung in Thermodynamik und Statistik 4B Blatt 8 (Abgabe Di 3. Juli 2012)
 U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
Moderne Theoretische Physik IIIa WS 18/19
 Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Moderne Theoretische Physik IIIa WS 8/9 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 7 Dr. Stefan Rex Besprechung: 9..9.
Karlsruher Institut für Technologie Institut für Theorie der Kondensierten Materie Moderne Theoretische Physik IIIa WS 8/9 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 7 Dr. Stefan Rex Besprechung: 9..9.
Physik III im Studiengang Elektrotechnik
 hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 2. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 2 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 2: Übersicht 2 Zustandsgrößen 2.3 Bestimmung von Zustandsgrößen 2.3.1 Bestimmung der Phase 2.3.2 Der Sättigungszustand
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 2 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 2: Übersicht 2 Zustandsgrößen 2.3 Bestimmung von Zustandsgrößen 2.3.1 Bestimmung der Phase 2.3.2 Der Sättigungszustand
Polymakromonomere als anisotropes Modellsystem zur Untersuchung kolloidaler Mehrkomponentensysteme
 Polymakromonomere als anisotropes Modellsystem zur Untersuchung kolloidaler Mehrkomponentensysteme Dissertation zur Erlangung des Grades Doktor der Naturwissenschaften am Fachbereich Chemie und Pharmazie
Polymakromonomere als anisotropes Modellsystem zur Untersuchung kolloidaler Mehrkomponentensysteme Dissertation zur Erlangung des Grades Doktor der Naturwissenschaften am Fachbereich Chemie und Pharmazie
Versuch 3: Partielles Molvolumen
 Versuchsprotokoll Grundpraktikum Physikalische Chemie WS 09/10 Versuch 3: Partielles Molvolumen Assistent: Dr. Ute Kolb Versuchsdurchführung: 18.11.2009 Protokollabgabe: 25.11.2009 Gruppe B2 Carmen Fischer
Versuchsprotokoll Grundpraktikum Physikalische Chemie WS 09/10 Versuch 3: Partielles Molvolumen Assistent: Dr. Ute Kolb Versuchsdurchführung: 18.11.2009 Protokollabgabe: 25.11.2009 Gruppe B2 Carmen Fischer
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan
 Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
212 - Siedepunktserhöhung
 1 - Siedeunktserhöhung 1. Aufgabe Es ist für verschiedene in Wasser lösliche Stoffe die Siedeunktserhöhung ihrer Lösung zu messen und daraus die molare Masse zu bestimmen.. Grundlagen Stichworte: Damfdruck,
1 - Siedeunktserhöhung 1. Aufgabe Es ist für verschiedene in Wasser lösliche Stoffe die Siedeunktserhöhung ihrer Lösung zu messen und daraus die molare Masse zu bestimmen.. Grundlagen Stichworte: Damfdruck,
Versuch zur Thermodynamik von Polymerlösungen
 Thermodynamik von Polymerlösungen, Seite Praktikumsskript Chemie, Physikalische Chemie und Physik der Makromoleküle Versuch zur Thermodynamik von Polymerlösungen Alle Praktikanten werden gebeten, sich
Thermodynamik von Polymerlösungen, Seite Praktikumsskript Chemie, Physikalische Chemie und Physik der Makromoleküle Versuch zur Thermodynamik von Polymerlösungen Alle Praktikanten werden gebeten, sich
E i n f ü h r u n g i n d i e P h y s i k a l i s c h e C h e m i e K13-1 Komplexe Systeme. 13. Komplexe Systeme
 13. Komplexe Systeme E i n f ü h r u n g i n d i e P h y s i k a l i s c h e C h e m i e K13-1 Komplexe Systeme - Ideale und reale Mischungen - Mischungsentropie - Partielle molare Grössen - Gibbs-Duhem-Beziehung
13. Komplexe Systeme E i n f ü h r u n g i n d i e P h y s i k a l i s c h e C h e m i e K13-1 Komplexe Systeme - Ideale und reale Mischungen - Mischungsentropie - Partielle molare Grössen - Gibbs-Duhem-Beziehung
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti Ulf Wiedwald 16. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 16. 07. 2007
Grundlagen der Physik II Othmar Marti Ulf Wiedwald 16. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 16. 07. 2007
W2 Gasthermometer. 1. Grundlagen: 1.1 Gasthermometer und Temperaturmessung
 W2 Gasthermometer Stoffgebiet: Versuchsziel: Literatur: Temperaturmessung, Gasthermometer, Gasgesetze Mit Hilfe eines Gasthermometers sind der Ausdehnungs- und Druckkoeffizient von Luft zu bestimmen. Beschäftigung
W2 Gasthermometer Stoffgebiet: Versuchsziel: Literatur: Temperaturmessung, Gasthermometer, Gasgesetze Mit Hilfe eines Gasthermometers sind der Ausdehnungs- und Druckkoeffizient von Luft zu bestimmen. Beschäftigung
Klausur Thermodynamik E2/E2p SoSe 2019 Braun. Formelsammlung Thermodynamik
 Klausur Thermodynamik E2/E2p SoSe 2019 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Klausur Thermodynamik E2/E2p SoSe 2019 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Ternäre polymerhaltige Lösungen Phasenverhalten und Grenzflächenspannung
 Ternäre polymerhaltige Lösungen Phasenverhalten und Grenzflächenspannung Dissertation Zur Erlangung des Grades Doktor der Naturwissenschaften im Fachbereich Chemie und Pharmazie der Johannes Gutenberg-Universität
Ternäre polymerhaltige Lösungen Phasenverhalten und Grenzflächenspannung Dissertation Zur Erlangung des Grades Doktor der Naturwissenschaften im Fachbereich Chemie und Pharmazie der Johannes Gutenberg-Universität
Die Eigenschaften einfacher
 Die Eigenschaften einfacher ischungen Lernziele: Thermodynamische eschreibung von ischungen Partielle molare Grössen, TD von Ischhasen Chemisches Potenzial flüssiger Phasen Eigenschaften von Lösungen,
Die Eigenschaften einfacher ischungen Lernziele: Thermodynamische eschreibung von ischungen Partielle molare Grössen, TD von Ischhasen Chemisches Potenzial flüssiger Phasen Eigenschaften von Lösungen,
Karl Stephan Franz Mayinger. Thermodynamik. Grundlagen und technische Anwendungen. Zwölfte, neubearbeitete und erweiterte Auflage
 Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Schmelzdiagramme Kornelia Schmid & Jelena Cikoja Gruppe 150. Schmelzdiagramme
 Schmelzdiagramme 1. Aufgabenstellung: Im Versuch sollen die Schmelzpunkte von 7 Gemischen unterschiedlicher Zusammensetzung aus den Komponenten Biphenyl (A) und Naphthalin (B) bestimmt werden. Anschließend
Schmelzdiagramme 1. Aufgabenstellung: Im Versuch sollen die Schmelzpunkte von 7 Gemischen unterschiedlicher Zusammensetzung aus den Komponenten Biphenyl (A) und Naphthalin (B) bestimmt werden. Anschließend
Bestimmung des Phasendiagramms eines binären Systems mit Mischungslücke
 Bestimmung des Phasendiagramms eines binären Systems mit Mischungslücke Themenbereiche Gibbssches Phasengesetz, Phasendiagramme, Mischbarkeit im flüssigen und festen Zustand, thermodynamische Stabilitätsbedingungen.
Bestimmung des Phasendiagramms eines binären Systems mit Mischungslücke Themenbereiche Gibbssches Phasengesetz, Phasendiagramme, Mischbarkeit im flüssigen und festen Zustand, thermodynamische Stabilitätsbedingungen.
Physikalisches Anfaengerpraktikum. Zustandsgleichung idealer Gase und kritischer Punkt
 Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 1. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 1 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 1: Übersicht 2 Zustandsgrößen 2.1 Thermische Zustandsgrößen 2.1.1 Masse und Molzahl 2.1.2 Spezifisches
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
PCI (Biol./Pharm.) Thermodyn. Musterlösung Übung 5 H.P. Lüthi / R. Riek HS Musterlösung Übung 5
 Musterlösung Übung 5 ufgabe 1: Enthalpieänderungen bei Phasenübergängen Es ist hilfreich, zuerst ein Diagramm wie das folgende zu konstruieren: (Die gesuchten Werte sind in den umrandeten oxen.) sub X
Musterlösung Übung 5 ufgabe 1: Enthalpieänderungen bei Phasenübergängen Es ist hilfreich, zuerst ein Diagramm wie das folgende zu konstruieren: (Die gesuchten Werte sind in den umrandeten oxen.) sub X
Kolligative Eigenschaften
 Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Kolligative Eigenschaften Kolligative (lat. colligare, sammeln) Eigenschaften (in verdünnter Lösung): f(nzahl der eilchen des gelösten Stoffs) f(rt der eilchen des gelösten Stoffs) eispiel: Gefrierpunkt,
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik. Thermodynamik Teil II. 12. September 2011 Michael Mittermair
 Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Werner Langbein. Thermodynamik. Gleichgewicht, Irreversible Prozesse, Schwankungen. Verlag Harri Deutsch
 Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
Klausur-Musterlösungen
 Klausur-Musterlösungen 9.7.4 Theoretische Physik IV: Statistische Physik Prof. Dr. G. Alber Dr. O. Zobay. Der in Abb. dargestellte Kreisprozess wird mit einem elektromagnetischen Feld ausgeführt. Abb..
Klausur-Musterlösungen 9.7.4 Theoretische Physik IV: Statistische Physik Prof. Dr. G. Alber Dr. O. Zobay. Der in Abb. dargestellte Kreisprozess wird mit einem elektromagnetischen Feld ausgeführt. Abb..
! #!! % & ( )! ! +, +,# # !.. +, ) + + /) # %
 ! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
Oberflächenspannung. Abstract. 1 Theoretische Grundlagen. Phasen und Grenzflächen
 Phasen und Grenzflächen Oberflächenspannung Abstract Die Oberflächenspannung verschiedener Flüssigkeit soll mit Hilfe der Kapillarmethode gemessen werden. Es sollen die mittlere Abstand der einzelnen Moleküle
Phasen und Grenzflächen Oberflächenspannung Abstract Die Oberflächenspannung verschiedener Flüssigkeit soll mit Hilfe der Kapillarmethode gemessen werden. Es sollen die mittlere Abstand der einzelnen Moleküle
Wie können Sie die Oberflächenspannung eines Feststoffes bestimmen.
 Beim Mischen von Substanzen ist in vilen Fällen die Mischungswärmeproportional dem quadrat der differenz charakteristischer Parameter der reinsubstanzen (Hildebrandt-Parameter) bzw. einer Summe von quadraten
Beim Mischen von Substanzen ist in vilen Fällen die Mischungswärmeproportional dem quadrat der differenz charakteristischer Parameter der reinsubstanzen (Hildebrandt-Parameter) bzw. einer Summe von quadraten
Versuch Beschreiben Sie die Vorgänge, die in der Nähe des kritischen Punktes zu beobachten sind.
 1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
Systemtheorie. Vorlesung 6: Lösung linearer Differentialgleichungen. Fakultät für Elektro- und Informationstechnik, Manfred Strohrmann
 Systemtheorie Vorlesung 6: Lösung linearer Differentialgleichungen Fakultät für Elektro- und Informationstechnik, Manfred Strohrmann Einführung Viele technischen Anwendungen lassen sich zumindest näherungsweise
Systemtheorie Vorlesung 6: Lösung linearer Differentialgleichungen Fakultät für Elektro- und Informationstechnik, Manfred Strohrmann Einführung Viele technischen Anwendungen lassen sich zumindest näherungsweise
Musterlösung Übung 10
 Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Musterlösung Übung 10 Aufgabe 1: Phasendiagramme Abbildung 1-1: Skizzen der Phasendiagramme von Wasser (links) und Ethanol (rechts). Die Steigung der Schmelzkurven sind zur besseren Anschaulichkeit überzogen
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
D r H Entropie-Änderungeng. D rs Arbeit, maximale (Nicht Volumen) D r G
 REP Was schon behandelt wurde: 1. Hauptsatz 2. Hauptsatz Enthalpie-Änderungen D r H Entropie-Änderungeng D rs Arbeit, maximale (Nicht Volumen) D r G REP D r G = D r H - TDD r S Gleichgewicht: D r G = 0
REP Was schon behandelt wurde: 1. Hauptsatz 2. Hauptsatz Enthalpie-Änderungen D r H Entropie-Änderungeng D rs Arbeit, maximale (Nicht Volumen) D r G REP D r G = D r H - TDD r S Gleichgewicht: D r G = 0
Amphiphile Moleküle vereinen zwei inkompatible Molekülteile mit unterschiedlicher Löslichkeit (meist: hydrophil + hydrophob)
 3. Amhihile 3.1. Allgemeines Amhihile Moleküle vereinen zwei inkomatible Molekülteile mit unterschiedlicher Löslichkeit (meist: hydrohil + hydrohob) Tenside, Detergentien, surfactant, Liide, Blockcoolymere,...
3. Amhihile 3.1. Allgemeines Amhihile Moleküle vereinen zwei inkomatible Molekülteile mit unterschiedlicher Löslichkeit (meist: hydrohil + hydrohob) Tenside, Detergentien, surfactant, Liide, Blockcoolymere,...
Physikalische Chemie Praktikum. Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln
 Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
Hochschule Emden/Leer Physikalische Chemie Praktikum Vers. Nr. 16 April 2017 Elektrolyte: Dissoziationskonstante von Essigsäure λ von NaCl ist zu ermitteln In diesem Versuch soll die Dissoziationskonstante
E Homogene / inhomogene Mischungen und Entmischungsdiagramme
 E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
3. Mikrostruktur und Phasenübergänge
 3. Mikrostruktur und Phasenübergänge Definition von Mikrostruktur und Gefüge Gefüge bezeichnet die Beschaffenheit der Gesamtheit jener Teilvolumina eines Werkstoffs, von denen jedes hinsichtlich seiner
3. Mikrostruktur und Phasenübergänge Definition von Mikrostruktur und Gefüge Gefüge bezeichnet die Beschaffenheit der Gesamtheit jener Teilvolumina eines Werkstoffs, von denen jedes hinsichtlich seiner
Mischphasenthermodynamik Prüfung
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Van der Waals-Theorie und Zustandsgleichung
 Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht
 8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
Kapitel 10 - Gase. Kapitel 10 - Gase. Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller Bewegung
 Kapitel 0 - Gase Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller ewegung Druck Kraft pro Fläche in Pa(scal) oder bar Normdruck = 760mm = 0,35 KPa =,035 bar = atm Messung
Kapitel 0 - Gase Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller ewegung Druck Kraft pro Fläche in Pa(scal) oder bar Normdruck = 760mm = 0,35 KPa =,035 bar = atm Messung
Statistische Mechanik
 David H. Trevena Statistische Mechanik Eine Einführung '«WO«.»vmo i; Übersetzt von Thomas Filk VCH Weinheim New York Basel Cambridge Tokyo Inhaltsverzeichnis Vorwort von H. N. V. Temperley Vorwort des
David H. Trevena Statistische Mechanik Eine Einführung '«WO«.»vmo i; Übersetzt von Thomas Filk VCH Weinheim New York Basel Cambridge Tokyo Inhaltsverzeichnis Vorwort von H. N. V. Temperley Vorwort des
Einführung in die Technische Thermodynamik
 Arnold Frohn Einführung in die Technische Thermodynamik 2., überarbeitete Auflage Mit 139 Abbildungen und Übungen AULA-Verlag Wiesbaden INHALT 1. Grundlagen 1 1.1 Aufgabe und Methoden der Thermodynamik
Arnold Frohn Einführung in die Technische Thermodynamik 2., überarbeitete Auflage Mit 139 Abbildungen und Übungen AULA-Verlag Wiesbaden INHALT 1. Grundlagen 1 1.1 Aufgabe und Methoden der Thermodynamik
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
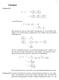 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Die Zusammensetzung am Ausgang der Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
8.3 Ausgleichsprozesse in abgeschlossenen Systemen, thermodynamisches Gleichgewicht und thermodynamische Potentiale
 8.3 Ausgleichsprozesse in abgeschlossenen Systemen, thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper ist im Gleichgewicht,
8.3 Ausgleichsprozesse in abgeschlossenen Systemen, thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper ist im Gleichgewicht,
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Thermodynamik. Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen.
 Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Spinodale Entmischung
 Benjamin Andrae Spinodale Entmischung Seminarvortrag im Hauptseminar zur statistischen Mechanik bei Prof. Dr. Erwin Frey Inhalt: Vorbemerkung zur Methode Qualitatives Quantitatives Weiterführendes: Van-der-Waals
Benjamin Andrae Spinodale Entmischung Seminarvortrag im Hauptseminar zur statistischen Mechanik bei Prof. Dr. Erwin Frey Inhalt: Vorbemerkung zur Methode Qualitatives Quantitatives Weiterführendes: Van-der-Waals
