Moderne Phasengleichgewichtsmodelle
|
|
|
- Helga Peters
- vor 7 Jahren
- Abrufe
Transkript
1 Moderne Phasengleichgewichtsmodelle NRTL-Unifac-PSRK-SRK Als der Doktorand und Physiker Johannes Diderik van der Waals ( ) 1873 seine Doktorarbeit an der holländischen Universität Leiden über Over de Continuiteit van den Gasen Vloeistoftoestand (Die Kontinuität des flüssigen und gasförmigen Zustands) verfasste, konnte er nicht ahnen, was er damit auslöste. Er erhielt 1910 den Nobelpreis für Physik. Abb. 1 Prof. Dr. van der Waals. Quelle: Wikipedia Mit seiner Zustandsgleichung legte van der Waals den Grundstein für nahezu alle Zustandsgleichungen, die wie heute kennen. Redlich-Kwong (RK, 1949), Soave-Redlich-Kwong (SRK, 1972), Peng-Robinson (PR, 1976), Grayson-Streed-Chao-Seader (GS, 1961), Benedikt-Weg-Rubin- Starling (BWRS), Reichsanstaltgleichung, Virialgleichung basieren auf seiner Gleichung. Alle Zustandsgleichung wurden allerdings erst Jahrzehnte nach van der Waals Zustandsgleichung entwickelt und veröffentlicht. Ein Schüler von van der Waals und Henricus van t Hoff an der Universität Amsterdam war der holländische Chemiker Johannes Jacobus van Laar ( ). Er wurde 1924 Ehrendoktor der Universität Groningen trug er sein Modell über die Berechnung der chemischen Aktivität γ vor. Nach ihm ist das van Laar Modell benannt. Auch er konnte nicht ahnen, das auf seiner Grundlage viele uns heute bekannte Modelle wie Porter, Margules, Wilson, Uniquac, und NRTL entwickelt wurden. 1
2 NRTL Das NRTL-Modell (Non-Random-Two-Liquid) gilt heute als das leistungsfähigste Modell der Gamma- Modell- Klasse zur Beschreibung von Phasengleichgewichten. Das soll die Leistung anderer Modelle wie z.b. Uniquac, welches in Unifac enthalten ist, nicht schmälern. Aber das NRTL-Modell hebt sich von allen anderen Modellen dadurch ab, daß es seit seiner ersten Veröffentlichung sehr viele Modifikationen erfahren hat. Dadurch wurde dieses Modell zunehmend leistungsfähiger. Ist es zunächst, wie alle anderen Modelle dieser Klasse, geschaffen worden, um VLE (Vapor-Liquid- Equilibrium) zu berechnen, wird es heute auch für LLE (Liquid-Liquid-Equilibrium) und SLE (Solid- Liquid-Equilibrium) und sogar für Elektrolyte verwendet. Es muss aber klargestellt werden, dass alle Gamma-Modelle zunächst nichts anderes tun, als binäre Messdaten von Phasengleichgewichten wiederzugeben und zu interpolieren. Der Unterschied der Modelle besteht aber darin, welche Art von Phasengleichgewicht und wie genau diese wiedergegeben werden. Genau darin liegt der Vorteil von NRTL wie am nachstehenden Beispiel gezeigt wird. Vor ca. 40 Jahren begann man am Lehrstuhl Prof. Dr. Onken, Uni Dortmund, viele binäre Messungen durchzuführen, die unter Dechema Data Collection veröffentlicht wurden. Die daran enthaltenen VLE und LLE Messdaten und Parameter sind in CHEMCAD für NRTL und andere Modelle enthalten. Leider ist dieses Werk nicht fortgesetzt worden. AMessungen, die später durchgeführt wurden, sind meist nicht öffentlich und daher nicht in CHEMCAD verfügbar. Sind die fehlenden binären Gleichgewichtsdaten nicht zu beschaffen, sollte man die entsprechenden NRTL Parameter in CHEMCAD dennoch auffüllen, andernfalls erfolgt eine ideale Berechnung mit Aktivitätskoeffizient= 1. Die schnellste Methode in CHEMCAD ist Unifac. Für Vorprojekte und Machbarkeitsstudien reicht das in den meisten Fällen. Genauer, aber aufwendiger ist es, Messungen oder Molekularsimulationen durchzuführen bzw. in Auftrag zu geben. Dass das Phasengleichgewicht von Mehrstoffgemischen auf der Basis binärer Daten berechnet werden kann, ist eine der wichtigsten Leistungen aller Gamma-Modelle. Ebenso gilt für alle Gamma- Modelle, dass sie grundsätzlich LLE berechnen können. Mit NRTL erhält man natürlich die genauesten Ergebnisse. Basieren die verwendeten Parameter jedoch auf VLE-Messungen, kann man damit nur bedingt LLE berechnen. Bei großer Mischungslücke, d.h. geringer gegenseitiger Löslichkeit (z.b. Benzol-Wasser) erhält man mit VLE Parametern noch gute LLE Ergebnisse. Ist die Mischungslücke jedoch klein und die gegenseitige Löslichkeit groß (z.b. Butanol-Wasser) erhält man mit VLE Parameter schlechte LLE Ergebnisse. Genauer wird die LLE Berechnung durch NRTL, wenn man LLE Parameter aus LLE Messdaten verwendet. Zu Beginn hatte das NRTL Modell lediglich 3 Parameter. Heute steht in CHEMCAD das NRTL Modell mit bis zu 9 Parametern zur Verfügung. Damit lassen sich auch außergewöhnliche Gleichgewichte berechnen. Hier ein Beispiel eines LLE. 2
3 Abb. 2 LLE Methylpiridin-Wasser nach NRTL in CHEMCAD Dieses Phasendiagramm stellt das LLE Methylpyridin-Wasser dar. Ungewöhnlich ist die Tatsache, dass oberhalb von 160 C und unterhalb von 50 C das LLE verschwunden ist. Für diese Berechnung wurde NRTL mit 7 Parameter verwendet. Das NRTL Modell lässt sich auch für SLE (Solid-Liquid-Equilibrium) und Elektrolyte sehr erfolgreich verwenden. Beispiel dafür lassen sich leicht in CHEMCAD erstellen. Unifac Das Thema fehlender NRTL Parameter wurde schon angesprochen. Wenn die Beschaffung von Messdaten nicht gelingt, kommen ersatzweise nur Schätzmethoden in Frage. Die bekannteste Methode ist Unifac. Das Prinzip ist einfach. Man ermittelt die Molekülgruppen (z.b. -CH3, -OH), aus denen sich das zu berechnende Molekül zusammensetzt und addiert die Daten, die diesen Molekülgruppen zugeordnet sind. Eine analoge Methode ist bekannt zur Berechnung von Stoffdaten nach Joback-Lydersen, s. VDI-Wärmeatlas Kapitel Berechnen von Stoffdaten. Beim Unifac Modell werden allerdings keine Stoffdaten berechnet, sondern die Aktivitätskoeffizienten Gamma auf der Basis des Uniquac (Universal quasichemical) Modells. In CHEMCAD dient das Unifac Modell auch dazu, fehlende NRTL Parameter zu ersetzen. Es ist nicht selten, daß bei einem Gemisch von z.b. 10 Stoffen etwa nur die Hälfte der erforderlichen binären NRTL Parameter vorhanden sind. In dem Fall würden diese ideal berechnet. Die fehlenden binären Parameter werden in CHEMCAD durch einen einzigen Knopfdruck mit NRTL Parameter aus Unifac aufgefüllt, und zwar entweder aus der VLE - Datenbank oder aus der LLE Datenbank. Dabei ist ebenfalls zu beachten, daß zu LLE (die zwei Stoffe 3
4 bilden zwei flüssige Phasen) auch Unifac LLE und zu VLE (die zwei Stoffe sind vollständig mischbar) Unifac- VLE gewählt werden sollte. Nun hört sich das etwa so an wie wenn man auf Messdaten ganz verzichten könnte, denn man wird ja wohl für die bekannten Stoffe die Daten der Molekülgruppen wissen. Letzteres ist auch in der Tat fast so, jedoch ist die Genauigkeit des Unifac Modells nicht so hoch wie die der Messdaten. Eine allgemein gültige Angabe über die Unifac Genauigkeit kann aber nicht gegeben werden, da sie von vielen Einflüssen abhängig ist. Der Vorteil des Unifac Modells besteht aber immerhin darin, dass sich damit auf Anhieb Phasengleichgewichte deutlich besser als auf idealer Basis berechnen lassen, ohne daß man binäre Parameter benötigt. Es ist das Verdienst von Prausnitz, Fredenslund und Gmehling, die Unifac Methode entwickelt zu haben. Im VDI Wärmeatlas ist das Unifac Modell ausführlich erläutert. Die dort angegebenen Daten für die einzelnen Molekülgruppen stammen jedoch von anderen Autoren als bei CHEMCAD. Das führt natürlich zu unterschiedlichen, aber geringfügigen Ergebnissen. Die Ermittlung der Unifac-Parameter ist mit einem sehr großen Aufwand verbunden. Man benötigt eine große Zahl an VLE und LLE Daten, um die Daten, die einer Molekülgruppe zugeordnet werden sollen, in genügt großer Zahl und damit mit ausreichender Genauigkeit zu erhalten. Es gibt ca. 50 Unifac-Gruppen. Rechnet man z.b. mit 100 Messdaten pro Molekülgruppe, um eine ausreichende Genauigkeit zu erzielen, so sind 50 * 50 * 100 = Gleichgewichtsmessdaten erforderlich. Allein diese Größenordnung macht es deutlich, dass man über eine sehr umfangreiche VLE und LLE Datenbank verfügen muss. Um damit umzugehen, wird eine entsprechend große Erfahrung benötigt. Für den Verfahrenstechniker ist es daher nicht ratsam, Unifac Parameter selbst zu ermitteln. Zurück zu van der Waals. Die van der Waals Gleichung beschreibt das grundsätzliche kontinuierliche Verhalten der Materie vom gasförmigen Zustand über die Kondensation bis zum flüssigen Zustand. Der Verlauf lässt sich anschaulich grafisch darstellen wie hier mit Hilfe des Grafikprogramms Techplot. 4
5 Abb. 3 Isothermen der van der Waals-Gleichung, Quelle: Techplot-Programm Es ist darin zu erkennen, dass die Isotherme am kritischen Punkt eine horizontale Wendetangente hat. Daraus resultiert die besondere Verfahrenstechnik der überkritischen Gase. Der Zweiphasenbereich ist dadurch gekennzeichnet, dass die beiden Flächen F1 und F2 vom Betrag her identisch sind und damit die Maxwell sche Gleichung erfüllt ist. Die van der Waals-Gleichung enthält einige Vereinfachungen, ohne die sie nicht hätte entstehen können. Daher ist sie generell für die Berechnung von Gasdaten geeignet, wird darin aber von a anderen Zustandsgleichungen an Genauigkeit übertroffen. Der Grund liegt in dem Term V 2. Dieser Term besagt, dass die potentielle Energie eines Gases lediglich von der Dichte, d.h. Konzentration abhängig ist. Für Stoffe mit kugelförmigem Potenzial wie z.b. Edelgase, führt diese Vereinfachung durchaus zu guten Ergebnissen. Für alle anderen Stoffe ist dies, je mehr sie polar oder unsymmetrisch sind, nicht der Fall. Daher wird in allen anderen Zustandsgleichungen dieser Term durch meist empirisch gefundene Modifikationen ersetzt. Diese sind an Messungen bestimmter Stoffgruppen angepasst. Während z.b. die SRK-Gleichung an mehrere Stoffgruppen angepasst wurde und daher weitgehend universell einsetzbar ist, wurden z.b. die Zustandsgleichungen PR und GS an petrochemische Stoffe angepasst. Für Edelgase und andere Stoffe mit nahezu kugelförmigem Potenzial gilt das Theorem der übereinstimmenden Zustände. D.h. ihre auf die kritischen Daten reduzierten Stoffeigenschaften sind untereinander identisch. Eine der bekanntesten Eigenschaften ist die Fugazität, wie sie u.a. im VDI- 5
6 Wärmeatlas grafisch wiedergegeben wird. In CHEMCAD werden die Fugazitätskoeffizienten entsprechend der Gleichung P ( Z 1) lnϕ = 0 berechnet. dp P Über die Lösung dieser Gleichung muss man für die bekannten Zustandsgleichungen nicht mehr nachdenken, man kann sie der Literatur entnehmen. Alle Zustandsgleichung haben gemeinsam, dass ihre Parameter aus kritischen Daten berechnet werden. Das liegt daran, dass die kritische Isotherme am kritischen Punkt (Pc, Tc, Vc) eine horizontale Wendetangente aufweist. Daher erhält man durch zweimaliges Ableiten dp dv ein einfaches Gleichungssystem, welches nach den Parametern aufgelöst werden kann. In der Literatur wird diese Berechnung häufig am Beispiel der van der Waals Gleichung demonstriert. In CHEMCAD werden alle stoffabhängigen Parameter der Zustandsgleichungen automatisch aus den kritischen Daten des jeweiligen Stoffes berechnet. Bei der BWRS Gleichung kann der Anwender allerdings eigene Parameter verwenden. Vergleicht man die kritischen Daten der Stoffe mit denen des Verfahrens, ergibt sich, dass die Zustandsgleichung umso genauer ist, je näher die Verfahrensdaten denen der kritischen Daten sind. Daraus lässt sich schließen, dass Zustandsgleichungen im Vakuum ungenau sein können. Andererseits lassen sich Prozesse in der Näher des kritischen Punktes zumindest thermodynamisch gut wiedergeben, was aber nicht bedeutet, daß die Löslichkeit von Feststoffen berechnet werden kann. Alle Zustandsgleichungen sind für die Gasphase entwickelt worden, sind aber auch in der Lage, Kondensation und Verdampfung und sogar die Verdampfungswärme zumindest qualitativ zu berechnen. Sie sind aber ausnahmslos nicht in der Lage, für die Flüssigphase auch nur annähernd gute Ergebnisse zu liefern. Trotz aller Grenzen der Genauigkeit sind Zustandsgleichung unverzichtbar und gerade die Soave- Redlich-Kwong Zustandsgleichung (SRK) hat sich als nahezu universell einsetzbar erwiesen, während andere wie die Peng-Robinson (PR) oder Grayson-Stread-Chao-Seader (GS) oder Benedikt-Web- Robin-Starling (BWRS) für Spezialanwendungen entwickelt wurden. Daher werden viele thermodynamische Daten wie z.b. die Gasdichte in CHEMCAD mit der SRK-Gleichung ermittelt. Bei der Simulation von Gasprozessen wie Kompression bzw. Expansion ist die Anwendung einer Zustandsgleichung unerlässlich. Gerade bei dieser Anwendung sind die Berechnungsgleichungen, die auf dem idealen Gasgesetz beruhen, zu ungenau. 6
7 Beim Phasengleichgewicht unter einem Druck von >1 bar sollte der Fugazitätskoeffizient in der Gasphase grundsätzlich berücksichtigt werden. Bereits bei 1 bar beträgt der Fugazitätskoeffizient 0,98 und ist damit um 2% niedriger als der des idealen Gases (φ=1,0). Leider ist dies bei vielen publizierten VLE Messungen nicht beachtet worden. Für die meisten Stoffe sind die kritischen Daten bekannt oder lassen sich mit der Lyderson-Joback- Methode zumindest für nicht zu große Moleküle (MG <200 g/mol) abschätzen. Diese Leichtigkeit der Handhabung sollte aber nicht dazu verführen, den Ergebnissen der SRK-Gleichung unendliches Vertrauen zu schenken nach dem Motto endlich gibt es eine universelle Zustandsgleichung. Das ist sie aber nicht wie man leicht nachprüfen kann. Schon der Versuch, brauchbare Ergebnisse im Flüssigbereich zu erhalten, scheitert. Auch kann man mit SRK nur ideale VLE (Vapor-Liquid- Equilibrium), d.h. Phasengleichgewichte berechnen. Auf SRK-Basis kann man keine Aktivitätskoeffizienten γ für das Raoult sche Gesetz berechnen, eben nur Fugazitätskoeffizienten φ für das Dalton sche Gesetz. Das gilt auch für jede andere Zustandsgleichung. Es ist ratsam, diese beiden wichtigen Koeffizienten nur der jeweiligen Phase zuzuordnen. Es hat aber dennoch nicht an Versuchen gefehlt, mit SRK Phasengleichgewichte zu berechnen. In der Mineralöltechnik ist dies gängige Praxis. In Ermangelung der Stoffdaten, insbesondere der Dampfdrücke kann man das bis zu einem gewissen Grad nachvollziehen. Dass man dann aber nicht zwischen Aliphaten, Aromaten, Naphthenen und Olefinen unterscheiden kann, muss man in Kauf nehmen. Für Mischungen existieren mehr oder weniger lineare Mischungsregeln, aus denen man die mittleren Parameter der Zustandsgleichung ermittelt. Auf dieser Basis lassen sich Zustandsgleichung auch auf Mischungen anwenden wie an einem Beispiel gezeigt werden soll. 7
8 Die nachstehende Grafik zeigt das Phase - Envelope (PT-Diagramm) einer Mischung aus leichten Kohlenwasserstoffen (C5-). Abb. 4 PT-Diagramm nach SRK eines aliphatischen Gemisches C5- in CHEMCAD Man erkennt einige Besonderheiten, nämlich, dass der kritische Punkt (blau) nicht mit dem Maximum der Kurve zusammenfällt, und dass die 90 bar Horizontale einerseits und die 95 C Vertikale andererseits die Kurve zweimal schneidet. Dies nennt man reziprokes Verhalten: der Ein- und Austritt durch das Zweiphasengebiet erfolgt ohne Phasenwechsel flüssig-gasförmig, sondern man kehrt zur ursprünglichen Phase zurück. Andere Zustandsgleichungen statt SRK liefern in diesem Fall ähnliche Ergebnisse. PSRK Dies ist eine an der Uni Oldenburg (Gmehling) entwickelte Methode zur besseren Gaslöslichkeitsberechnung (Fischer). PSRK bedeutet Prediktiv-SRK. Die bereits o.g. Schwachstelle des zweiten van der Waals Term wird durch Unifac ersetzt. Damit ergeben sich interessante Lösungen für die Gaslöslichkeit von z.b. C4- in Methanol oder der CO2 Löslichkeit in diversen Lösungsmitteln. Gaslöslichkeiten können mit SRK nur ideal (d.h. Wechselwirkungen werden nicht berücksichtigt)berechnet werden. Allerdings können nicht die für allgemein bekannten Unifac Parameter verwendet werden, sondern es müssen erneut Messungen gemacht werden, die für PSRK angepasst sind. Daher lagen in den Anfängen der PSRK Gleichung nur wenige Parameter vor. 8
9 Inzwischen können in CHEMCAD diese PSRK-Unifac Parameter durch Messdaten, meist Partialdruckmessungen durch Regression gewonnen werden. Das Verfahren kann bei großen Molekülen wie Selexol sehr aufwendig sein, wurde aber für das wichtige Anwendungsgebiete wie uchen Carbon Capture nahezu vollständig durchgeführt. Beispiele und Publikationen belegen die erfolgreiche Simulation. Das Verfahren ist in der Lage, die Löslichkeit von CO2 in Lösungsmitteln wie Selexol zu berechnen. Bekanntlich will man damit alles CO2 aus Großanlagen und einigen auf der Weide stehenden CO2 Lieferanten auffangen und in Hohlräume (unterirdisch) verbringen, wie man eben so manches in der Erde versteckt, was man nicht mehr braucht. Andere Verfahren entnehmen es dort wieder und gewinnen zusammen mit H2 und Strom wertvolle Produkte wie z.b. Synthesegas. Ein Ansatz für das Auflösen der CO2 ist im nachstehenden Flowsheet zu sehen. To Gas Turbines Treated Gas Pre-combustion Carbon Capture Selexol Absorber and Stripper Combined Flash & Thermal Regeneration Syngas without H2S and COS 4 Partial Condenser Compression Stage 3 Inlet 14 Lean Solvent Cooler Captured CO2 Absorber Flash Heater Rich Selexol Stripper From Integrated Shift and Cooling Syngas 1 3 Rich Flash Drum Compression Stage 3 Inlet Lean / Rich Heat Exchanger Lean Selexol Reboiler Intermediate Flash Turbo-generator Abb. 5 Verfahren zur CO 2 Absorption und Desorption mit Selexol in CHEMCAD Das Verfahren besteht im Wesentlichen aus zwei Kolonnen. In der ersten Kolonne wird CO2 aus einem Gasstrom mit Selexol ausgewaschen, d.h. absorbiert. Die Waschflüssigkeit Selexol wird expandiert und gibt dabei bereits beträchtliche Mengen CO2 ab. Schließlich erfolgt in der zweiten Kolonne die letzte Desorption, so dass am Kopf der Kolonne die Gesamtmenge CO2 anfällt. Das gereinigte Selexol aus der zweiten Kolonne wird der ersten Kolonne im Kreislauf wieder zugeführt. Auf diese Weise Damit lassen sich alle CO2 haltigen Gase wie u.a Rauchgase behandeln. Damit leistet die chemische Verfahrenstechnik mal wieder einen enormen Beitrag zur Lösung eines selbst gemachten Problems, nämlich der Rettung des Klimawandels, vielmehr des Klimas als solches oder was Nichtmeteorologen dafür halten: alles bleibt beim Alten. 9
10 Dieser Beitrag zum Thema Phasengleichgewichte hat nun 4 Modelle und deren Anwendung besprochen und eine Brücke schlagen von NRTL bis SRK. Nicht etwa, um zu zeigen, dass man mit einer Gleichung alles kann, sondern vielmehr, dass es eben nicht so ist und diese 4 Gleichungen ihre Berechtigung nebeneinander haben und sogar ineinander übergehen. Wenn dem so ist, dann ist doch die Frage erlaubt, warum gibt es nicht eine Gleichungen, die alle 4 vereint? Bemühungen dazu gibt es (Molekular Modelling), aber ohne erwähnenswerte bzw. brauchbare Ergebnisse für die ingenieurmäßige praktische Anwendung. Wir lassen diese Frage daher an dieser im Raum unbeantwortet stehen und begeben uns wieder an unsere täglichen verfahrenstechnischen Aufgabenstellungen und verwenden dazu diese 4 Modelle wo immer wir können, richtig an, am besten mit CHEMCAD. Kurzangaben der Quellen 1. Wikipedia Molwyn-Hughes: Physikalische Chemie 3. Lydecke-Lydecke: Thermodynamik 4. Prausnitz, Gmehling: Hochschulkurs III: Thermodynamik der Mischphasen 5. Gmehling, Kolbe:Thermodynamik 6. Pfennig: Thermodynamik 7. Nachdrucke der Veröffentlichung von Johannes Diderik Van Der Waals (ca. 1900) Wolfgang Schmidt November
Inhalt 1 Grundlagen der Thermodynamik
 Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Inhalt 1 Grundlagen der Thermodynamik..................... 1 1.1 Grundbegriffe.............................. 2 1.1.1 Das System........................... 2 1.1.2 Zustandsgrößen........................
Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik
 Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
Lüdecke Lüdecke Thermodynamik Physikalisch-chemische Grundlagen der thermischen Verfahrenstechnik Grundlagen der Thermodynamik Grundbegriffe Nullter und erster Hauptsatz der Thermodynamik Das ideale Gas
User NRTL BIPs. Für die BIP-Regression wählt man:
 User NRTL BIPs In CHEMCAD kann man seit 2009 eigene Datenbanken für binäre Daten erstellen. Die in CHEMCAD enthaltenen BIPs (Binary Interaction Parameter) stammen überwiegend aus Dechema Data Collection,
User NRTL BIPs In CHEMCAD kann man seit 2009 eigene Datenbanken für binäre Daten erstellen. Die in CHEMCAD enthaltenen BIPs (Binary Interaction Parameter) stammen überwiegend aus Dechema Data Collection,
Karl Stephan Franz Mayinger. Thermodynamik. Grundlagen und technische Anwendungen. Zwölfte, neubearbeitete und erweiterte Auflage
 Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Karl Stephan Franz Mayinger Thermodynamik Grundlagen und technische Anwendungen Zwölfte, neubearbeitete und erweiterte Auflage Band 2 Mehrstoffsysteme und chemische Reaktionen Mit 135 Abbildungen Springer-Verlag
Mischphasenthermodynamik Prüfung
 Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Institut für Energie- und Verfahrenstechnik Thermodynamik und Energietechnik Prof. Dr.-Ing. habil. Jadran Vrabec ThEt Mischphasenthermodynamik Prüfung 06. 03. 2017 Teil 1 : Fragenteil Gesamte Bearbeitungszeit
Die Zusammensetzung am Ausgang der 1. Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Thermodynamik I. Sommersemester 2012 Kapitel 2, Teil 2. Prof. Dr. Ing. Heinz Pitsch
 Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 2 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 2: Übersicht 2 Zustandsgrößen 2.3 Bestimmung von Zustandsgrößen 2.3.1 Bestimmung der Phase 2.3.2 Der Sättigungszustand
Thermodynamik I Sommersemester 2012 Kapitel 2, Teil 2 Prof. Dr. Ing. Heinz Pitsch Kapitel 2, Teil 2: Übersicht 2 Zustandsgrößen 2.3 Bestimmung von Zustandsgrößen 2.3.1 Bestimmung der Phase 2.3.2 Der Sättigungszustand
Entwicklung einer universellen Gruppenbeitragszustandsgleichung
 Entwicklung einer universellen Gruppenbeitragszustandsgleichung Vom Fachbereich Chemie der Carl von Ossietzky Universität Oldenburg zur Erlangung des Grades eines Doktors der Naturwissenschaften angenommene
Entwicklung einer universellen Gruppenbeitragszustandsgleichung Vom Fachbereich Chemie der Carl von Ossietzky Universität Oldenburg zur Erlangung des Grades eines Doktors der Naturwissenschaften angenommene
Die Simulation einer Abwasseranlage mit CHEMCAD
 Die Simulation einer Abwasseranlage mit CHEMCAD Author: Dipl..-Ing. Wolfgang Schmidt Chemstations Deutschland GmbH 46483 Wesel, Augustastr. 12 Die Prozeßsimulation CHEMCAD wurde als Computerprogramm entwickelt,
Die Simulation einer Abwasseranlage mit CHEMCAD Author: Dipl..-Ing. Wolfgang Schmidt Chemstations Deutschland GmbH 46483 Wesel, Augustastr. 12 Die Prozeßsimulation CHEMCAD wurde als Computerprogramm entwickelt,
Physikalisches Anfaengerpraktikum. Zustandsgleichung idealer Gase und kritischer Punkt
 Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Physikalisches Anfaengerpraktikum Zustandsgleichung idealer Gase und kritischer Punkt Ausarbeitung von Marcel Engelhardt & David Weisgerber (Gruppe 37) Freitag, 18. März 005 email: Marcel.Engelhardt@mytum.de
Simulation und Optimierung. 7. Vorlesung. Ergänzungen zur Parametrierung eines A+ Projektes. Grundlagen der Simulation von Destillationsprozessen
 Fakultät Maschinenwesen Institut für Verfahrenstechnik und Umwelttechnik Professur Verfahrensautomatisierung Simulation und Optimierung 7. Vorlesung Ergänzungen zur Parametrierung eines A+ Projektes Grundlagen
Fakultät Maschinenwesen Institut für Verfahrenstechnik und Umwelttechnik Professur Verfahrensautomatisierung Simulation und Optimierung 7. Vorlesung Ergänzungen zur Parametrierung eines A+ Projektes Grundlagen
-aus theoretischen Ansätzen - Approximationen
 2.3 Bestimmung von Zustandsgrößen Zustand wird bestimmt durch zwei unabhängige, intensive Zustandsgrößen Bestimmung anderer Zustandsgrößen aus Stoffmodellen Zustandsgleichungen Stoffmodelle aus - Experimenten
2.3 Bestimmung von Zustandsgrößen Zustand wird bestimmt durch zwei unabhängige, intensive Zustandsgrößen Bestimmung anderer Zustandsgrößen aus Stoffmodellen Zustandsgleichungen Stoffmodelle aus - Experimenten
Praktikum Physikalische Chemie I. Versuch 4. p, V, T - Verhalten realer Gase am Beispiel von SF 6
 Praktikum Physikalische Chemie I ersuch 4 p,, T - erhalten realer Gase am Beispiel von SF 6 1. Grundlagen Komprimiert man ein Gas isotherm, so steigt dessen Druck näherungsweise gemäß dem idealen Gasgesetz
Praktikum Physikalische Chemie I ersuch 4 p,, T - erhalten realer Gase am Beispiel von SF 6 1. Grundlagen Komprimiert man ein Gas isotherm, so steigt dessen Druck näherungsweise gemäß dem idealen Gasgesetz
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Phasendiagramme 1 Lernziele: Ø Phasen, Komponenten, Freiheitsgrade Ø Die Phasenregel Ø Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Ø Zweikomponentensysteme: Siedediagramme (die Destillation
Modul: Allgemeine Chemie
 Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
Modul: Allgemeine Chemie 5. Grundlagen der chemischen Bindung Ionenbindung Eigenschaften, Ionengitter, Kugelpackung Strukturtypen, Kreisprozesse Kovalente Bindung Lewis Formeln, Oktettregel, Formalladungen
2.1 Bestimmung einiger Isothermen von Schwefelhexafluorid SF 6
 Atom- und Kernphysi-Versuch 31 AKP-31-1 Zustandsgrößen realer Gase 1 Vorbereitung Koexistenz von Flüssigeiten und Dampf, Dampfdruc, Verdampfungswärme, Koexistenz von Festörper und Flüssigeit, Koexistenz
Atom- und Kernphysi-Versuch 31 AKP-31-1 Zustandsgrößen realer Gase 1 Vorbereitung Koexistenz von Flüssigeiten und Dampf, Dampfdruc, Verdampfungswärme, Koexistenz von Festörper und Flüssigeit, Koexistenz
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
Lernziele: Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme,
 Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Phasendiagramme Lernziele: ee Phasen, Komponenten, Freiheitsgrade Die Phasenregel Zweikomponentensysteme: Dampfdruckdiagramme, Hebelgesetz Zweikomponentensysteme: Siedediagramme (die Distillation von Mischungen,
Die Zusammensetzung am Ausgang der Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Fragenteil : Aufgabe Phasengleichgewichte P a Eine binäre Mischung wird in einer Verdampfereinheit kontinuierlich teilweise verdampft. Messtechnisch wurden für die Ausgangsströme der Temperatur, der Druck
Die kinetische Gastheorie beruht auf den folgenden drei Annahmen:
 Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
Band 2: Mehrstoffsysteme und chemische Reaktionen. Grundlagen und technische Anwendungen
 Karl Stephan Franz Mayinger n 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. or Band 2: Mehrstoffsysteme und chemische
Karl Stephan Franz Mayinger n 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. or Band 2: Mehrstoffsysteme und chemische
PC I Thermodynamik J. Stohner / M. Quack SoSe 2006
 PC I Thermodynamik J. Stohner / M. Quack SoSe 2006 Musterlösung zu Übung 9 9.1 Druckfehler: In der Spalte 2 der Tabelle 4.1 (Seite 73) muss es T K /K statt T K heissen. 9.2 Bild 4.3a stellt das Phasendiagramm
PC I Thermodynamik J. Stohner / M. Quack SoSe 2006 Musterlösung zu Übung 9 9.1 Druckfehler: In der Spalte 2 der Tabelle 4.1 (Seite 73) muss es T K /K statt T K heissen. 9.2 Bild 4.3a stellt das Phasendiagramm
Liste der Formelzeichen. A. Thermodynamik der Gemische 1
 Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Inhaltsverzeichnis Liste der Formelzeichen XV A. Thermodynamik der Gemische 1 1. Grundbegriffe 3 1.1 Anmerkungen zur Nomenklatur von Mischphasen.... 4 1.2 Maße für die Zusammensetzung von Mischphasen....
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan
 Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Physik 4 Praktikum Auswertung Zustandsdiagramm Ethan Von J.W., I.G. 2014 Seite 1. Kurzfassung......... 2 2. Theorie.......... 2 2.1. Zustandsgleichung....... 2 2.2. Koexistenzgebiet........ 3 2.3. Kritischer
Einführung in die Rektifikation mit CHEMCAD
 - - Einführung in die Rektifikation mit CHEMCAD Inhaltsverzeichnis. Dampfdruck, Zustandsgleichung, Fugazitätskoeffizient 2. Phasengleichgewicht nach Raoult, Dalton, Aktivitätskoeffizient 3. Rektifikation
- - Einführung in die Rektifikation mit CHEMCAD Inhaltsverzeichnis. Dampfdruck, Zustandsgleichung, Fugazitätskoeffizient 2. Phasengleichgewicht nach Raoult, Dalton, Aktivitätskoeffizient 3. Rektifikation
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Manfred Nitsche. Kolonnen-Fibel. Für die Praxis im chemischen Anlagenbau. Springer Vi eweg
 Manfred Nitsche KolonnenFibel Für die Praxis im chemischen Anlagenbau Springer Vi eweg 1 Planung von Destillations und Absorptionskolonnen 1 1.1 Planungshinweise 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung
Manfred Nitsche KolonnenFibel Für die Praxis im chemischen Anlagenbau Springer Vi eweg 1 Planung von Destillations und Absorptionskolonnen 1 1.1 Planungshinweise 1 1.2 Mengenbilanz für die gegebene Aufgabenstellung
Die 4 Phasen des Carnot-Prozesses
 Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse
 Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs der Technischen Chemie der Universität Oldenburg unter Leitung von Herrn Prof. Dr. J. Gmehling Ort: Universität
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs der Technischen Chemie der Universität Oldenburg unter Leitung von Herrn Prof. Dr. J. Gmehling Ort: Universität
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas. Thermodynamik
 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
2.3 Stoffmodelle für Reinstoffe Die Dampftabelle ... MPa C m 3 /kg m 3 /kg ... 0, ,23 0, ,
 2.3 Stoffmodelle für Reinstoffe 2. 3. 1 Die Dampftabelle Beispiel Wasser: 60 kg Nassdampf bei p = 2 bar = 0,2 MPa und V= 3 m 3, v = 0,05 m 3 /kg Drucktafel (Tab. A1.2)... MPa C m 3 /kg m 3 /kg...............
2.3 Stoffmodelle für Reinstoffe 2. 3. 1 Die Dampftabelle Beispiel Wasser: 60 kg Nassdampf bei p = 2 bar = 0,2 MPa und V= 3 m 3, v = 0,05 m 3 /kg Drucktafel (Tab. A1.2)... MPa C m 3 /kg m 3 /kg...............
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Vorlesung Statistische Mechanik: Ising-Modell
 Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Phasendiagramme Das Phasendiagramm zeigt die Existenzbereiche der Phasen eines Stoffes in Abhängigkeit von thermodynamischen Parametern. Das einfachste Phasendiagramm erhält man für eine symmetrische binäre
Kolligative Eigenschaften
 Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
Prof. Dr. Norbert Hampp 1/8 11. Kolligative Eigenschaften Kolligative Eigenschaften Unter kolligativen Eigenschaften versteht man die Eigenschaften eines Systems die auf der Mischung unterschiedlicher
Versuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten -
 1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
1 ersuch 14: Dampfdruckkurve - Messung der Dampfdruckkurven leicht verdampfbarer Flüssigkeiten - 1. Theorie Befindet sich eine Flüssigkeit in einem abgeschlossenen Gefäß, so stellt sich zwischen der Gasphase
PC-Übung Nr.1 vom
 PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
Grundlagen der Allgemeinen und Anorganischen Chemie. Atome
 Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Grundlagen der Allgemeinen und Anorganischen Chemie Atome Elemente Chemische Reaktionen Energie Verbindungen 361 4. Chemische Reaktionen 4.1. Allgemeine Grundlagen (Wiederholung) 4.2. Energieumsätze chemischer
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11
 Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
Übungen zur Vorlesung Physikalische Chemie 1 (B. Sc.) Lösungsvorschlag zu Blatt 11 Prof. Dr. Norbert Hampp Jens Träger Sommersemester 2007 02. 07. 2007 Aufgabe 1 a) Die Dampfdrücke nach dem Raoult schen
PC-Übung Nr.3 vom
 PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
Van der Waals-Theorie und Zustandsgleichung
 Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Van der Waals-Theorie und Zustandsgleichung Eine verbesserte Zustandsgleichung für klassische Gase bei höheren Dichten liefert die Van der Waals-Gleichung. Diese Gleichung beschreibt auch den Phasenübergang
Physikalische Chemie Praktikum. Reale Gase, Kritischer Punkt
 Hochschule Emden / Leer Physikalische Chemie Praktikum Reale Gase Kritischer Punkt Vers.Nr. 1 April 2017 Allgemeine Grundlagen Reale Gase Kompressionsfaktor (Realgasfaktor) Van der Waals Gleichung Kritischer
Hochschule Emden / Leer Physikalische Chemie Praktikum Reale Gase Kritischer Punkt Vers.Nr. 1 April 2017 Allgemeine Grundlagen Reale Gase Kompressionsfaktor (Realgasfaktor) Van der Waals Gleichung Kritischer
Probeklausur STATISTISCHE PHYSIK PLUS
 DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 2- Siedediagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Siedediagramm wird dieses Vorgespräch durch einen Multiple-Choice
Karlsruher Institut für Technologie Festkörperphysik. Übungen zur Theoretischen Physik F SS 10
 Karlsruher Institut für Technologie Institut für Theoretische Festkörperphysik Übungen zur Theoretischen Physik F SS 10 Prof. Dr. G. Schön Lösungsvorschlag zu Blatt 2 Dr. J. Cole 30.04.2010 1. Van-der-Waals
Karlsruher Institut für Technologie Institut für Theoretische Festkörperphysik Übungen zur Theoretischen Physik F SS 10 Prof. Dr. G. Schön Lösungsvorschlag zu Blatt 2 Dr. J. Cole 30.04.2010 1. Van-der-Waals
Van der Waalsgeleichung
 HTL Steyr Van der Waals Seite 1 von 11 Nietrost Bernhard, bernhard.nietrost@htl-steyr.ac.at Van der Waalsgeleichung Mathematische / Fachliche Inhalte in Stichworten: Van der Waalsgleichung, Hyperbel, Differenzieren
HTL Steyr Van der Waals Seite 1 von 11 Nietrost Bernhard, bernhard.nietrost@htl-steyr.ac.at Van der Waalsgeleichung Mathematische / Fachliche Inhalte in Stichworten: Van der Waalsgleichung, Hyperbel, Differenzieren
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
! #!! % & ( )! ! +, +,# # !.. +, ) + + /) # %
 ! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
! #! #!! % & ( )!! +, +,# #!.. +, ) + + /)!!.0. #+,)!## 2 +, ) + + 3 4 # )!#!! ), 5 # 6! # &!). ) # )!#! #, () # # ) #!# #. # ) 6 # ) )0 4 )) #, 7) 6!!. )0 +,!# +, 4 / 4, )!#!! ))# 0.(! & ( )!! 8 # ) #+,
P = P(T, v) = k BT v b a v 2 (37.1)
 37 Van der Waals-Gas Das van der Waals-Gas wird als ein Modell für den Phasenübergang gasförmig flüssig vorgestellt und untersucht Van der Waals hat dieses Modell 1873 in seiner Doktorarbeit eingeführt
37 Van der Waals-Gas Das van der Waals-Gas wird als ein Modell für den Phasenübergang gasförmig flüssig vorgestellt und untersucht Van der Waals hat dieses Modell 1873 in seiner Doktorarbeit eingeführt
Flüssigdichte eines Gemisches
 Flüssigdichte eines Gemisches am Beispiel Ethanol-Wasser Die Flüssigdichte von Gemischen wird in CHEMCAD nach einer idealen, linearen Mischungsregel berechnet, diese lautet: m n V Darin ist n die Molmenge
Flüssigdichte eines Gemisches am Beispiel Ethanol-Wasser Die Flüssigdichte von Gemischen wird in CHEMCAD nach einer idealen, linearen Mischungsregel berechnet, diese lautet: m n V Darin ist n die Molmenge
8.4.5 Wasser sieden bei Zimmertemperatur ******
 8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
8.4.5 ****** 1 Motivation Durch Verminderung des Luftdrucks siedet Wasser bei Zimmertemperatur. 2 Experiment Abbildung 1: Ein druckfester Glaskolben ist zur Hälfte mit Wasser gefüllt, so dass die Flüsigkeit
Das Mie Potenzial sowie die Form nach Lennard-Jones
 Das Mie Potenzial sowie die Form nach Lennard-Jones Das Mie Potenzial [Mie.] und das Lennard-Jones Potenzial sind neben allen anderen Molekül Potenzialen wie Buckingham und Morse die bekanntesten Molekül
Das Mie Potenzial sowie die Form nach Lennard-Jones Das Mie Potenzial [Mie.] und das Lennard-Jones Potenzial sind neben allen anderen Molekül Potenzialen wie Buckingham und Morse die bekanntesten Molekül
Lehrbuch Chemische Technologie
 C. Herbert Vogel Lehrbuch Chemische Technologie Grundlagen Verfahrenstechnischer Anlagen WILEY- VCH WILEY-VCH Verlag GmbH & Co. KGaA IX Inhaltsverzeichnis 1 Einführung 1 1.1 Das Ziel industrieller Forschung
C. Herbert Vogel Lehrbuch Chemische Technologie Grundlagen Verfahrenstechnischer Anlagen WILEY- VCH WILEY-VCH Verlag GmbH & Co. KGaA IX Inhaltsverzeichnis 1 Einführung 1 1.1 Das Ziel industrieller Forschung
Inhaltsverzeichnis Hinweise zur Benutzung Einführung in die Arbeits- und Denkweise Basis der Thermodynamik
 Inhaltsverzeichnis 1 Hinweise zur Benutzung... 1 1.1 Ausrichtung...... 1 1.2 Lernhilfen und -kontrollen...... 4 2 Einführung in die Arbeits- und Denkweise... 9 2.1 Zielsetzung...... 9 2.2 Wichtige physikalische
Inhaltsverzeichnis 1 Hinweise zur Benutzung... 1 1.1 Ausrichtung...... 1 1.2 Lernhilfen und -kontrollen...... 4 2 Einführung in die Arbeits- und Denkweise... 9 2.1 Zielsetzung...... 9 2.2 Wichtige physikalische
E Homogene / inhomogene Mischungen und Entmischungsdiagramme
 E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
E Homogene / inhomogene Mischungen und Entmischungsdiagramme 1 Homogene / inhomogene Mischungen Es gibt Flüssigkeiten, die bilden beim Mischen eine klare und einheitlich aussehende Lösung. Solche Mischungen,
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
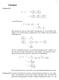 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6
 LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6 Aufgabe 1: Phasendiagramm reiner Stoffe. Die Abbildung zeigt das allgemeingültige Phasendiagramm reiner Stoffe. a) Beschriften Sie das Diagramm
LMPG1 ÜB1 Phasendiagramme & Dampfdruck Lösungen Seite 1 von 6 Aufgabe 1: Phasendiagramm reiner Stoffe. Die Abbildung zeigt das allgemeingültige Phasendiagramm reiner Stoffe. a) Beschriften Sie das Diagramm
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #12 am 26.01.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E143, Tel.
 Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Lösungen flüchtiger Stoffe - Stofftrennung http://ac16.uni-paderborn.de/lehrveranstaltungen/_aac/vorles/skript/kap_7/kap7_5/ Für Lösungen flüchtiger Stoffe ist der Dampfdruck des Gemischs ebenfalls von
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse
 Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg/DDBST (DDBST Dortmund Data Bank Software & Separation Technology
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg/DDBST (DDBST Dortmund Data Bank Software & Separation Technology
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse
 Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg (Universität Oldenburg, Standort Oldenburg-Wechloy (Naturwissenschaften),
Grundlagen zur Auswahl, Synthese und Auslegung thermischer Trennprozesse 3(4)-tägiger Kurs am Lehrstuhl Technische Chemie der Univ. Oldenburg (Universität Oldenburg, Standort Oldenburg-Wechloy (Naturwissenschaften),
PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test
 PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test 1. Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Lösungswärme wird dieses Vorgespräch durch einen Multiple Choice
PCG Grundpraktikum Versuch 5 Lösungswärme Multiple Choice Test 1. Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Lösungswärme wird dieses Vorgespräch durch einen Multiple Choice
Bernhard Härder. Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik W/ WESTAR.P WISSENSCHAFTEN. Skripte, Lehrbücher Band 2
 Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Thermodynamik der Gemische
 Thermodynamik der Gemische Bearbeitet von Andreas Pfennig 1. Auflage 2003. Buch. x, 394 S. Hardcover ISBN 978 3 540 02776 8 Format (B x L): 15,5 x 23,5 cm Gewicht: 771 g Weitere Fachgebiete > Chemie, Biowissenschaften,
Thermodynamik der Gemische Bearbeitet von Andreas Pfennig 1. Auflage 2003. Buch. x, 394 S. Hardcover ISBN 978 3 540 02776 8 Format (B x L): 15,5 x 23,5 cm Gewicht: 771 g Weitere Fachgebiete > Chemie, Biowissenschaften,
1. Ziel des Versuchs. 2. Theorie. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Don t gamble with physical properties Kein Glücksspiel mit Stoffdaten Lunch & Learn
 Don t gamble with physical properties Kein Glücksspiel mit Stoffdaten 08.06.2016 Lunch & Learn Siemens AG 2016 siemens.de/ec Agenda 1 2 3 4 5 Motivation Der seltsame Fall der Stoffdaten Wie läuft das bei
Don t gamble with physical properties Kein Glücksspiel mit Stoffdaten 08.06.2016 Lunch & Learn Siemens AG 2016 siemens.de/ec Agenda 1 2 3 4 5 Motivation Der seltsame Fall der Stoffdaten Wie läuft das bei
Phasen, Komponenten, Freiheitsgrade
 Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Phasendiagramme Lernziele: Phasen, Komonenten, Freiheitsgrade Die Phasenregel Zweikomonentensysteme: Damfdruckdiagramme, Hebelgesetz Zweikomonentensysteme: Siedediagramme (die Destillation von Mischungen,
Untersuchungen zum Einsatz alternativer
 Prozesswissenschaften Untersuchungen zum Einsatz alternativer Waschmedien für die Rückgewinnung aromatischer Kohlenwasserstoffe aus Kokereigasen vorgelegt von Diplom Ingenieur Diethmar Richter aus Bremen
Prozesswissenschaften Untersuchungen zum Einsatz alternativer Waschmedien für die Rückgewinnung aromatischer Kohlenwasserstoffe aus Kokereigasen vorgelegt von Diplom Ingenieur Diethmar Richter aus Bremen
Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung)
 Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Versuch Nr. 57 Dampfdruck von Flüssigkeiten (Clausius-Clapeyron' sche Gleichung) Stichworte: Dampf, Dampfdruck von Flüssigkeiten, dynamisches Gleichgewicht, gesättigter Dampf, Verdampfungsenthalpie, Dampfdruckkurve,
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
So genannte. Steckbriefaufgaben. für ganzrationale Funktionen. Teil 1: Ganzrationale Funktionen 2. Grades (Parabelfunktionen) Datei 42080
 Analysis So genannte Steckbriefaufgaben für ganzrationale Funktionen Funktionsgleichungen aufstellen Teil 1: Ganzrationale Funktionen. Grades (Parabelfunktionen) Datei 4080 Stand 8. März 010 INTERNETBIBLIOTHEK
Analysis So genannte Steckbriefaufgaben für ganzrationale Funktionen Funktionsgleichungen aufstellen Teil 1: Ganzrationale Funktionen. Grades (Parabelfunktionen) Datei 4080 Stand 8. März 010 INTERNETBIBLIOTHEK
Phasengleichgewicht. 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. A fl. A g
 Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Physikalisch-Chemische Praktika Phasengleichgewicht Versuch T-2 Aufgaben 1. Experimentelle Bestimmung des Dampfdrucks von Methanol als Funktion der Temperatur. 2. Ermittlung der Phasenumwandlungsenthalpie
Reale Gase - kritischer Pumkt
 1 Reale Gase - kritischer Pumkt In diesem Versuch werden Isothermen eines realen Gases (Ethan oder Schwefelhexafluorid) im Temperaturbereich zwischen 10 C und 50 C vermessen und mit den Isothermen des
1 Reale Gase - kritischer Pumkt In diesem Versuch werden Isothermen eines realen Gases (Ethan oder Schwefelhexafluorid) im Temperaturbereich zwischen 10 C und 50 C vermessen und mit den Isothermen des
Versuch Beschreiben Sie die Vorgänge, die in der Nähe des kritischen Punktes zu beobachten sind.
 1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
1 Versuch 220 Reale Gase 1. Aufgaben 1.1 Nehmen Sie ein Isothermennetz für Schwefelhexafluorid (SF 6 ) auf. Bestimmen Sie daraus die kritischen Daten, und berechnen Sie die Konstanten der Van-der-Waals-Gleichung.
Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H 2 O von
 Aufgabe 1: Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H O von 0 C bis zum Siedepunkt (100 C) zu erwärmen. Die spezifische Wärmekapazität von Wasser c = 4.18 J K - 1 g -1. Lösung
Aufgabe 1: Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H O von 0 C bis zum Siedepunkt (100 C) zu erwärmen. Die spezifische Wärmekapazität von Wasser c = 4.18 J K - 1 g -1. Lösung
Van der Waalsgleichung
 HTL Steyr Van der Waals Seite 1 von 11 Nietrost Bernhard, Van der Waalsgleichung bernhard.nietrost@htl-steyr.ac.at Mathematische / Fachliche Inhalte in Stichworten: Van der Waalsgleichung, Hyperbel, Differenzieren
HTL Steyr Van der Waals Seite 1 von 11 Nietrost Bernhard, Van der Waalsgleichung bernhard.nietrost@htl-steyr.ac.at Mathematische / Fachliche Inhalte in Stichworten: Van der Waalsgleichung, Hyperbel, Differenzieren
Reale Gase. Versuch: RG. Inhaltsverzeichnis. Fachrichtung Physik. Erstellt: E. Beyer Aktualisiert: am Physikalisches Grundpraktikum
 Versuch: RG Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: E. Beyer Aktualisiert: am 01. 10. 2010 Bearbeitet: J. Kelling F. Lemke S. Majewsky M. Justus Reale Gase Inhaltsverzeichnis 1 Aufgabenstellung
Versuch: RG Fachrichtung Physik Physikalisches Grundpraktikum Erstellt: E. Beyer Aktualisiert: am 01. 10. 2010 Bearbeitet: J. Kelling F. Lemke S. Majewsky M. Justus Reale Gase Inhaltsverzeichnis 1 Aufgabenstellung
4. Freie Energie/Enthalpie & Gibbs Gleichungen
 4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
Kompressor in CHEMCAD
 Komressor in CHEMCAD Berechnungsmethoden Die im Menü des Komressors zu wählenden Berechnungsmethoden sollen hier näher besrochen werden: Die Auswahl besteht aus. Adiabatic,. Polytroic und 3. Polytroic
Komressor in CHEMCAD Berechnungsmethoden Die im Menü des Komressors zu wählenden Berechnungsmethoden sollen hier näher besrochen werden: Die Auswahl besteht aus. Adiabatic,. Polytroic und 3. Polytroic
Untersuchung von Realgaseigenschaften in ANSYS CFX am Beispiel einer Lavaldüsenströmung
 Diplomarbeit Untersuchung von Realgaseigenschaften in ANSYS CFX am Beispiel einer Lavaldüsenströmung vorgelegt von cand. Ing. Nicole Nenn Matrikel-Nr.: 210658 betreut von Prof. Dr.-Ing Frank Thiele Dipl.
Diplomarbeit Untersuchung von Realgaseigenschaften in ANSYS CFX am Beispiel einer Lavaldüsenströmung vorgelegt von cand. Ing. Nicole Nenn Matrikel-Nr.: 210658 betreut von Prof. Dr.-Ing Frank Thiele Dipl.
Thermodynamik 1 Klausur 02. August 2010
 Thermodynamik 1 Klausur 02. August 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 6 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Thermodynamik 1 Klausur 02. August 2010 Bearbeitungszeit: 120 Minuten Umfang der Aufgabenstellung: 6 nummerierte Seiten Alle Unterlagen zu Vorlesung und Übung sowie Lehrbücher und Taschenrechner sind als
Gesetz von Boyle. Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V.
 Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11
 23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
23. Mai 2000 Physikalisch-Chemisches Praktikum Versuch Nr. 11 Thema: Nernst scher Verteilungssatz Aufgabenstellung: 1. Ermittlung des Molekülzustandes der Benzoesäure in der Wasser- und in der Toluolphase
Physik III im Studiengang Elektrotechnik
 hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
hysik III im Studiengang Elektrotechnik - reale Gase, hasenübergänge - rof. Dr. Ulrich Hahn WS 2008/09 reale Gase kleine Temperaturen, hohe Drücke: Moleküle weisen Eigenvolumen auf Moleküle ziehen sich
Klausur zur Vorlesung Thermodynamik
 Institut für Thermodynamik 23. August 2013 Technische Universität Braunschweig Prof. Dr. Jürgen Köhler Klausur zur Vorlesung Thermodynamik Für alle Aufgaben gilt: Der Rechen- bzw. Gedankengang muss stets
Institut für Thermodynamik 23. August 2013 Technische Universität Braunschweig Prof. Dr. Jürgen Köhler Klausur zur Vorlesung Thermodynamik Für alle Aufgaben gilt: Der Rechen- bzw. Gedankengang muss stets
Abschlussbericht zu Kennziffer 2472: Experimentelle Bestimmung von Grenzaktivitätskoeffizienten in ternären und höheren Elektrolytsystemen
 Abschlussbericht zu Kennziffer 2472: Experimentelle Bestimmung von Grenzaktivitätskoeffizienten in ternären und höheren Elektrolytsystemen Während es bei Nichtelektrolytsystemen möglich ist, mit Hilfe
Abschlussbericht zu Kennziffer 2472: Experimentelle Bestimmung von Grenzaktivitätskoeffizienten in ternären und höheren Elektrolytsystemen Während es bei Nichtelektrolytsystemen möglich ist, mit Hilfe
Werner Langbein. Thermodynamik. Gleichgewicht, Irreversible Prozesse, Schwankungen. Verlag Harri Deutsch
 Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
Einführung in die linearen Funktionen. Autor: Benedikt Menne
 Einführung in die linearen Funktionen Autor: Benedikt Menne Inhaltsverzeichnis Vorwort... 3 Allgemeine Definition... 3 3 Bestimmung der Steigung einer linearen Funktion... 4 3. Bestimmung der Steigung
Einführung in die linearen Funktionen Autor: Benedikt Menne Inhaltsverzeichnis Vorwort... 3 Allgemeine Definition... 3 3 Bestimmung der Steigung einer linearen Funktion... 4 3. Bestimmung der Steigung
Phasendiagramm. Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; Verfasser: Philippe Knüsel
 Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; 19.11.2008 Phasendiagramm Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch) Versuchsdurchführung: Claudio Zihlmann und Philippe Knüsel Assistenz:
Praktikum I, Teil Werkstoffe HS 2008/09 Versuch 6; 19.11.2008 Phasendiagramm Verfasser: Philippe Knüsel (pknuesel@student.ethz.ch) Versuchsdurchführung: Claudio Zihlmann und Philippe Knüsel Assistenz:
Phasengleichgewicht und Phasenübergänge. Gasförmig
 Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
Phasengleichgewicht und Phasenübergänge Siedetemperatur Flüssig Gasförmig Sublimationstemperatur Schmelztemperatur Fest Aus unserer Erfahrung mit Wasser wissen wir, dass Substanzen ihre Eigenschaften bei
PC I Thermodynamik und Transportprozesse
 20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
20.06.2006 15:19 1 PC I Thermodynamik und Transportprozesse Kapitel 5 20.06.2006 15:19 2 V. Lösungen und Mischungen Im Winter des Jahres 1729 setzte ich Bier, Wein, Essig und Salzwasser in großen offenen
