Bauprinzip, funktionelle Gruppen, polare und apolare Reste, Reaktionen der Amino und Carboxylgruppe
|
|
|
- Heiko Raske
- vor 7 Jahren
- Abrufe
Transkript
1 Kapitel 2 Aminosäuren Prüfungsstandard Bauprinzip, funktionelle Gruppen, polare und apolare Reste, Reaktionen der Amino und arboxylgruppe Elektrolyteigenschaften, Säure Basen Status, Ampholyte, isoelektrischer Punkt, Titrationskurven Puffereigenschaften: Definition Säure/Base, starke und schwache Säuren, ENDERSN ASSELBAL Gleichung, p, pk, Puffergleichung, physiologische Bedeutung eines konstanten p Wertes, Puffersysteme des rganismus 2.1 Struktur und Eigenschaften Bauprinzip Bauprinzip, funktionelle Gruppen, polare und apolare Reste, Reaktionen der Amino und arboxylgruppe α N Abbildung 2.1: Grundstruktur einer Aminosäure R Elektrolyteigenschaften Elektrolyteigenschaften, Säure Basen Status, Ampholyte, isoelektrischer Punkt, Titrationskurven Ampholyte amphoterische Elektrolyte [gr. αµφóτερoς beide], Substanzen, die sowohl als Base als auch als Säure reagieren können (VET und VET, 1995) isoelektrischer Punkt pi, p Wert, bei dem ein Molekül keine Nettoladung trägt (VET und VET, 1995) 5
2 6 KAPITEL 2. AMINSÄUREN Amino acids with nonpolar side chains Glycine Gly G Alanine Ala A Valine Val V Leucine Leu L Isoleucine Ile I Methionine Met M N N N N N N S Threonine Thr T Asparagine Asn N Glutamine Gln Q Tyrosine Tyr Y ysteine ys Lysine Lys K N N N N N N S N 2 Amino acids with charged polar side chains N 2 2 N Proline Pro P Phenylalanine Phe F N N Arginine Arg R istidine is N N N 2 N N N 2 N 2 Tryptophan Trp W Serine Ser S N N 2 Amino acids with uncharged polar side chains N Aspartic acid Asp D Glutamic acid Glu E 2 N 2 2 N Abbildung 2.2: Die 20 häufigsten Aminosäuren, nach (VET und VET, 1995)
3 Kapitel Proteine Prüfungsstandard Struktur: Peptidbindung, Strukturebenen, kovalente und nichtkovalente Bindungen, globuläre/fibrilläre Proteine, Löslichkeitsverhalten, Assoziations und Dissoziationsverhalten, Stabilität/Flexibilität, Konformationsänderungen, Faltung/Entfaltung, Denaturierung, Fällung, Einfluß von Ionen, p, Temperatur, Ligandenbindung, Elektrolyteigenschaften, Proteinevolution Proteinanalytik: qualitative Nachweisreaktionen, quantitative Bestimmungsmehoden (z. B. Biuret Methode, UV Messung u. a.), Salzfraktionierung, Gelfiltration, hromatographie, Elektrophorese, Isoelektrische Fokussierung, Sequenzanalyse, Raumstrukturaufklärung Proteinbiosynthese: genetischer ode, Wobble ypothese, Struktur des Ribosoms, Phasen des Synthesevorgangs, posttranslationale Proteinmodifikation, experimentelle und klinische Bedeutung von emmstoffen der Proteinbiosynthese.1 Strukturebenen.2 Struktur/Funktionsbeziehungen (ämoglobin). physikochemische Eigenschaften.4 Analysemethoden.4.1 Qualitative Proteinnachweise.4.2 Quantitative Proteinbestimmungsmethoden Funktionen von Proteinen Enzyme Biokatalysatoren hohe anzhal mit unterschiedlicher Substrat und Wirkungsspezifität Transportproteine Transport von Substraten/Produkten in Zellen, Geweben, rganen und rganismen Bsp.: ämoglobin Nährstoff und Speicherproteine Bsp.: 9
4 10 KAPITEL. PRTEINE asein (Milch) Ferritin (Eisenspeicherprotein) Kontraktile und motile Proteine Bsp.: Actin, Myosin, Tubulin (Mikrotubuli) Strukturproteine Bsp.: Kollagen (Sehnen, Knorpel) Keratin (aar) Abwehrproteine Bsp.: Immunglobuline (Antikörper) Ricin (giftiges Protein von Ricinus) Regulatorproteine Bsp.: manche ormone G Proteine Proteine mit speziellen Aufgaben Bsp.: Antifrost Proteine (Senkung des Gefrierpunktes) Entkoppler Protein (Wärmeerzeugung im braunen Fettgewebe) Molekulare Eigenschaften von Proteinen Monomere Proteine bestehen aus einem Polypeptid, oligomere Proteine aus mehreren Polypeptiden (Untereinheiten). Die Untereinheiten können ausschließlich nichtkovalent verbunden sein oder auch über Disulfidbrücken (yss Sys). Die Untereinheiten oligomerer Proteine können identisch (homooligomere Prteine) oder unterschiedlich (heterooligomere Proteine) sein. Manche Proteine tragen fest (kovalent oder nicht kovalent) gebundende prosthetische Gruppen, die für die biologische Aktivität des betreffenden Proteins notwendig sind. Beispiele für prosthetische Gruppen sind Ionen von Metallen wie Zn und u, die ämgruppe und Biotin. Nachweis und Reinigung von Proteinen Nachweise (Auswahl) UV Absorption maximale Absorption bei 280 nm (aromatische Aminosäuren) Vgl.: max. Absorption von DNA/RNA bei 260 nm Farbreaktionen Bsp.: Biuret Test Bindung von u 2 Ionen an die Peptidbindung
5 .4. ANALYSEMETDEN 11 quantifizierbar über photometrische Messung Polyacrylamid Gelelektrophorese, anschließende Färbung Reinigungsmethoden (Auswahl) Genutzt werden überwiegend chromatographische und elektrophoretische Methoden Salzfällung mit (N 4 ) 2 S 4 erster Standardschritt Ionenaustausch hromatographie Trägermaterialien v. a. Dextran Gelfiltration Affinitätschromatographie PolyacrylamidGelelektrophorese Strukturaufklärung von Proteinen Primärstruktur Peptidsequenzierung (Edman) und/oder Ableitung von der Nucleotidsequenz des kodierenden Gens Raumstruktur Röntgenstrukturanalyse von Proteinkristallen Kristallisation des gereinigten Proteins (sehr kleine Kristalle) Aufnahme von Röntgenbeugungsmustern der Kristalle Die Röntgenstrahlen werden an Elektronen der Atome des Proteins gebeug und verstärken bzw. löschen sich je nach Phasenverschiebung. Aus dem Diffraktionsmuster wird durch ein mathematisches Verfahren (Fourier Transformation) ein D Bild der Elektronendichteverteilung des kristallisierten Proteins ermittelt Auflösung: 0.2 nm NMR spektroskopische Ermittlung der Proteinstruktur in Lösung zur Zeit Proteine bis max kda Elektronenmikroskopie und Elektronenkristallographie
6 Kapitel 4 Enzyme Enzyme Enzyme sind weit überwiegend Proteine ohne oder mit prosthetischen Gruppen, in wenigen Fällen RNA Moleküle. (LKAU, 2000) Prüfungsstandard Prinzipien der Enzymnomenklatur, prosthetische Gruppen, oenzyme, ofaktoren, Isoenzyme, Multi Enzymkomplexe Wesen der Katalyse, Aktivierungsenergie, Katalysemechanismen, aktives Zentrum, p/temperaturabhängigkeit, Substrat und Reaktionsspezifität Reaktionskinetik: Reaktionen 0. und 1. rdnung, MIAELIS MENTEN Kinetik, Affinität, Maximalgeschwindigkeit, graphische Ermittlung von K m und V max, allosterisches Verhalten, Kooperativität, emmtypen Enzymanalytik und diagnostik: Prinzipien der Enzymaktivitätsbestimmung, Standard Enzymeinheit, spezifische Aktivität, Meßmethoden (optischer Test, gekoppelter optischer Test, Farbreaktionen, enzymatische Substratbestimmung), Enzymdiagnostik, biotechnologische Anwendung 4.1 Einführung Unterschiede zu chemischen Katalysatoren (VET und VET, 1995) 1. höhere Reaktionsgeschwindigkeit 2. mildere Reaktionsbedingungen. höhere Reaktionsspezifität 4. Möglichkeit der Regulation Substratspezifität The noncovalent forces through which substrates and other molecules bind to enzymes are identical in character to the forces that dictate the conformations of the proteins themselves: Both involve van der Waals, electrostatic, hydrogen bonding and hydrophobic interactions. X Ray studies indicate that the substrate bindung sites of most enzymes are largely performed but that most of them exhibit at least some degree of induced fit upon bindung substrate. 1
7 14 KAPITEL 4. ENZYME Stereospezifität stereospecifity Enzymes are highly specific both in binding chiral substrates and in catalyzing their reactions. (VET und VET, 1995) Enzymes are absolutely stereospecific in the reactions they catalyze. The stereospecificity is by no means uncommon. As we consider biochemical reactions we shall find that nearly all enzymes that participate in chiral reactions are absolutely stereospecific. Geometrische Spezifität geometric specifity In addition to their stereospecificity, however, most enzymes are quite selective about the identities of the chemical groups on their substrates. (VET und VET, 1995) Enzymes vary considerably in their degree of geometric specificity oenzyme ofaktor kleine Moleküle, die für die Katalyse essentiell sind (the enzymes chemical teeth ) (VET und VET, 1995) oenzym organische ofaktoren (VET und VET, 1995) osubstrat nur vorübergehend mit dem Enzym verbundene ofaktoren (Bsp.: NAD ) (VET und VET, 1995) prosthetische Gruppe essentiell permanent mit dem Enzym (oft kovalent) verbundene ofaktoren (VET und VET, 1995) oloenzym katalytisch aktiver Enzym ofaktor Komplex (VET und VET, 1995) Apoenzym enzymatisch inaktives Enzym; Ergebnis der Entfernung des ofaktors aus dem oloenzym (VET und VET, 1995) Tabelle 4.1: TE MMN ENZYMES (VET und VET, 1995) oenzyme Reaction Mediated Biotin arboxylation obalamin (B 12 ) coenzymes Alkylation oenzyme A Acyl transfer Flavin coenzymes xidation reduction Lipoic acid Acyl transfer Nicotinamide coenzymes xidation reduction Pyridoxal phosphate Amino group transfer Tetrahydrofolate ne carbon group transfer Thiamine pyrophosphate Aldehyde transfer 4.1. Regulation der Enzymaktivität 1. ontrol of enzyme availability The amount of a given enzyme in a cell depends on both its rate of synthesis and its rate of degradation.
8 4.1. EINFÜRUNG 15 Tabelle 4.2: VITAMINS TAT ARE ENZYME PREURSRS (VET und VET, 1995) Vitamine Biotin obalamin (B 12 ) Folic acid Nicotinamide (niacinamide) Pantothenate Pyridoxine (B 6 ) Riboflavin (B 2 ) Thiamine (B 1 ) oenzyme Biocytin obalamin (B 12 ) coenzymes Tetrahydrofolate Nicotinamide coenzymes oenzyme A Pyridoxal phosphate Flavin coenzymes Thiamine pyrophosphate 2. ontrol of enzyme activity An enzyme s catalytic activity may be directly regulated through conformational or structural alterations. An enzymes s substrate binding affinity may likewise vary with the binding of small molecule effectors, thereby changing the enzyme s catalytic activity. Regulation der Enzymaktivität Veränderung der Syntheserate und/oder Abbaurate eines Enzyms (besonders oft bei Prokaryoten und bei Differenzierungsvorgängen) durch regulatorische Moleküle/Ionen (Bsp.: camp; a 2 ) und/oder regulatorische Proteine 2 (Bsp.: a almodulin); i. d. R. allosterisch durch Produkthemmung: Das unmittelbare Produkt einer enzymatischen Reaktion wirkt hemmend (i. d. R. kompetitiv) durch Enzyminterkonversion (überwiegend reversible Phosphorylierung durch Proteinkinasen/ Proteinphosphatasen) E ATP E P 2 Proteinkinase E P ADP Proteinphosphatase E P i Durch die Phosphorylierung kann das Enzym entweder gehemmt oder aktiviert werden. Phosphoryliert werden überwiegend hydroxylierte Aminosäuren (Ser, Thr, Tyr; Phosphatester), die nur selten im aktiven Zentrum liegen. Die eigentliche Regulationsebene ist die Regulation der Aktivität der Proteinkinase, selten der Proteinphosphatase. Aktivierung inaktiver Enzym Vorstufen (Zymogenese) durch spezifische, limitierte Proteolyse. Beispiele sind die Verdauungsproteasen Trypsin und hymotrypsin Enzymnomenklatur Isoenzyme Produkte verschiedener Gene, die gleiche Substrat und Wirkungsspezifität haben, aber unterschiedlich reguliert und lokalisiert sein können (LKAU, 2000) Multi Enzymkomplex Komplex verschiedener Enzyme (von Abschnitten) von Stoffwechselwegen. Vorteile: Beschleunigung des Durchsatzes durch Weiterreichen von Intermediaten des Stoffwechselweges, Minimierung von Nebenreaktionen. Beispiele: Pyruvat Dehydrogenase Komplex; Fettsäure Synthase Komplex (LKAU, 2000)
9 16 KAPITEL 4. ENZYME Tabelle 4.: ENZYME LASSIFIATIN ARDING T REATIN TYPE (VET und VET, 1995) lassification Type of Reaction atalyzed 1. xidoreductases xidation reduction reactions 2. Transferases Transfer of functional groups. ydrolases ydrolysis reactions 4. Lyases Group elimination to form double bonds 5. Isomerases Isomerization 6. Ligases Bound formation coupled with ATP hydrolysis 4.2 Geschwindigkeit enzymatischer Reaktionen Practical Importance of Enzyme Kinetics in Biochemistry 1. The binding affinities of substrates and inhibitors to an enzyme can be determined The maximum catalytic rate of an enzyme can be established. 2. The enzyme s catalytic mechanism may be elucidated. By observing how the rate of an enzymatic reaction varies with the reaction conditions and combining this information with that obtained from chemical and structural studies of the enzyme. Most enzymes function as members of metabolic pathways. The study of the kinetics of an enzymatic reaction leads to an understanding of that enzyme s role in an overall metabolic process. 4. Most enzyme assays 1 are based on kinetic studies of the enzyme. Under the proper conditions, the rate of an enzymatically catalyzed reaction is proportional to the amount of the enzyme present. Measurements of enzymatically catalyzed reactions are therefore among the most commonly employed procedures in biochemical and clinical analyses hemische Kinetik Enzym Kinetik 4.2. Inhibition Einfluß des p Bisubstrate Reactions 4. Enzym Katalyse 4..1 katalytische Eigenschaften Übersicht Erhöhung der Reaktionsgeschwindigkeit Kein Einfluß auf die Gleichgewichtslage der Reaktion Substrat und Wirkungsspezifität Aktivität oft regulierbar Manche Enzyme/Enzymsysteme konvertieren Formen von Energie 1 measurements of the amount of enzyme present
10 4.. ENZYM KATALYSE 17 ohne Enzymkatalyse Übergangszustand Freie Energie der Systemzustände E a S E E a 1 o G < 0 mit Enzymkatalyse E a 2 ES EP E a P E P S E ES EP E P K 1 K K 2 K eq = K 1 K K 2 Abbildung 4.1: Energiediagramm einer enzymkatalysierten Reaktion. Die Reaktion wird in Einzelschritte mit kleiner Aktivierungsenergie zerlegt und kann daher bei gegebener Temperatur rascher als ohne Katalysator (Enzym) ablaufen. S bedeutet Substrat, P Produkt der Reaktion S P. K 2 ist die Gleichgewichtskonstante für den Umsatz der Enyzm gebundenen Reaktionspartner. Erhöhung der Reaktionsgeschwindigkeit Das Ausmaß der Erhöhung der Reaktionsgeschwindigkeit durch Enzyme gegenüber der unkatalysierten Reaktion ist in er Regel sehr hoch. So erhöht arboanhydrase (arboanhydratase) die Geschwindigkeit der Reaktion in beiden Richtungen um das 10 7 fache. Die Wechselzahl (turnover number; Enzymarbeit/s) eines arboanhydrase Moleküls beträgt 10 5 s 1. Kein Einfluß auf die Gleichgewichtslage Gleichgewicht wird druch die Differenz des Energiegehaltes der Edukte und der Produkte einer Reaktion und durch die Änderung der Entropie bestimmt. Dies beschreibt die sogenannte GIBBSsche freie Energie G: G T S G ist ein Maß für die Gleichgewichtskonstante einer Reaktion. A B G 0: Reaktion ist im Gleichgewicht; G 0: Reaktion läuft von links nach rechts bis zum Gleichgewicht ab; G 0: Reaktion läuft von rechts nach links bis zum Gleichgewicht ab.
11 18 KAPITEL 4. ENZYME Substrat und Wirkungsspezifität Enzyme sind spezifisch für das/die umzusetzende(n) Substrat(e) und die Art der Reaktion. Viele Enzyme können sogar zwischen enantiomeren Formen eines Moleküls unterscheiden. Thrombin, ein proteolytisches Enzym der Blutgerinnung, erkennt bestimmte Abfolgen von Aminosäuren eines Polypeptides und spaltet dann nur die Peptidbindung zwischen L Arg und Gly in dieser Abfolge unter Einsatz von 2, d. h. hydrolytisch. Aktivität oft regulierbar Die Aktivität biochemischer Umsetzungen muß zur Anpassung an die Bedürfnisse reguliert werden. Dies kann auf der Ebene der Transkription, der Translation oder am reifen Enzym (posttranslational) erfolgen. Manche Enzyme/Enzymsysteme konvertieren Formen von Energie So wird in der Photosynthese Lichtenergie in chemisch verwertbare Energie (ATP, NADP) umgewandelt, in der Zellatmung (Atmungskette) Reduktionskraft (Redoxenergie) zur Synthese von ATP genutzt, das ein hohes Gruppenübertragungspotential besitzt Mechanismen
12 Kapitel 6 Biologische Membranen Prüfungsstandard rganisation und Dynamik biologischer Membranen, Membranpermeabilität, Diffusion, aktiver Transport, Rezeptoren, Adenyl yclasesystem, Membranpotential 6.1 Struktur und Funktionen Glycolipid integrales Membranprotein peripheres Membranprotein holesterin Glycoprotein Abbildung 6.1: fluid mosaic model, nach (AMPBELL, 1997) u. a., verändert 6.2 Membrankomponenten 6. Membrantransport 21
13 Kapitel 8 Stoffwechsel der Kohlenhydrate Prüfungsstandard Mono, Di und Polysaccharide, Strukturmerkmale, Aldosen, Ketosen, exosen, Pentosen, Ring, Ketten, α, β Form, qualitative und quantitative Nachweisreaktionen (Benedict Probe, Glucoseoxidase), biologische Bedeutung von Kohlenhydraten Glykolyse: reversible, irreversible Reaktionen, ATP liefernde Reaktionen, Substratketten Phosphorylierung, Energiebilanz, zentrale Rolle des Glucose 6 Phosphates und der UDP Glucose, wechselseitige Umwandlung der Monosaccharide (Glucose, Galaktose, Fructose), Pentosephosphatweg, Transaldolasen, Transketolasen, biologische Bedeutung des oxidativen Pentosephosphatweges, Schlüsselenzyme der Glykolyse, aerober und anaerober Glukoseabbau, Pasteureffekt (molekulare Ursachen) Gluconeogenese: Substrate und ihre erkunft, ori Zyklus, Umgehungsschritte der irreversiblen Glykolysereaktionen, hormonelle Kontrolle, Beziehung zum itratcyclus und zur Glykolyse Glykogenstoffwechsel: Bauprinzip und Rolle des Glykogens, Glykogenabbau und synthese, Regulation, Rolle der Proteinkinasen 8.1 Kohlenhydrate Biologische Bedeutung von Kohlenhydraten Energielieferanten ( Brennstoffe ) Energiespeicher Glykogen Stärke, Fructane Bestandteil von oenzymen DNA und RNA Glykolipiden Glykoproteinen Strukturelemente ellulose hitin Murein in vielfältiger Form als Metabolite 27
14 28 KAPITEL 8. STFFWESEL DER KLENYDRATE Fettsäuren Aminosäuren Glucose e e e Pyruvat Glycolyse PyruvatD 1. Bildung von AcetyloA 2 AcetyloA e e e xalacetat e itratcyclus itrat e 2 2. xidation von AcetyloA 2 NAD FAD ADP P i ATP Atmungskette 2. Elektronenoxidative übertragung und Phosphorylierung Abbildung 8.1: Die Stufen des aeroben Katabolismus von Brennstoffen, nach (LKAU, 2000) 8.2 Glykolyse 8. Glukoneogenese 8.4 Pentosephosphatzyklus 8.5 Stoffwechsel weiterer Monosaccharide 8.6 Glykogenstoffwechsel
15 8.6. GLYKGENSTFFWESEL 29 ATP ADP Fructose6phosphate (F6P) ATP ADP Glucose Mg 2 hexokinase (K) Glucose6phosphate (G6P) Mg 2 phosphofructokinase (PFK) Fructose1,6bisphosphate (FBP) GAP P i 5 NAD NAD 1,Bisphosphoglycerate (1,BPG) Phosphoglycerate (PG) 2Phosphoglycerate (2PG) phosphoglycerate kinase (PGK) Mg 2 enolase Mg 2 Phosphoenolpyruvate (PEP) ATP Mg 2 K 10 pyruvate kinase (PK) ADP Pyruvate phosphoglucose isomerase (PGI) aldolase DAP triose phosphate isomerase (TIM) glyceraldehydephosphate dehydrogenase (GAPD) phosphoglycerate mutase (PGM) 2 P 2 P 2 P 2 P GAP 2 P 2 P 2 P (6) P P (1) 2 DAP 1() 1(4) 2(5) P 2 2 P Abbildung 8.2: The degradation of glucose via the glycolytic pathway, from (VET und VET, 1995) 2 1 P 2
16 Kapitel 9 itratzyklus Prüfungsstandard Rolle des itratzyklus im Stoffwechsel, Reaktionstypen (Dehydrierungen, Decarboxylierungen, ydratisierungen, Kondensation, Substratketten Phosphorylierung), Energiebildung in Verbindung mit der Atmungskette, Verbindung zu anderen Stoffwechselwegen, Regulation, zentrale Rolle der aktiven Essigsäure (Acetyl oa), Bildung und Bedeutung von oa Verbindungen von ans A. Krebs 197 als Zyklus formuliert ( Krebs Zyklus ) zwei Grundfunktionen 1. xidation von Acetat zu 2 2 zur Energiegewinnung (es entstehen NAD, FAD 2 und GTP) 2. Bereitstellung von Intermediaten für Biosynthesen Lokalisation Matrix der Mitochondrien ein Enzym an die innere Mitochondrienmembran gebunden! Komplex II der Atmungskette 9.1 Reaktionsmechanismen und Reaktionsfolge 9.2 Stellung im Stoffwechsel 9. Regulation 9..1 Regulation hohe Spiegel von ATP und NAD hemmen den Durchsatz an mehreren Stellen " Anzeichen für ausreichende Versorgung der Mitochondrien (und der Zelle) mit Energie 9..2 Anaplerotische (auffüllende) Reaktionen des itrat Zyklus Entnahme von Intermediaten des itrat Zyklus für Biosynthesen " Zyklus käme rasch zum Erliegen anaplerotische Reaktionen gehen vom Pyruvat oder Phosphoenolpyruvat aus arboxylierungsreaktionen 1
17 2 KAPITEL 9. ITRATZYKLUS Reaktionen Leber und Niere Pyruvat arboxylase ATP$ Pyruvat # xalacetat ADP P i weit verbreitet Malat Enzym Pyruvat # NAD(P)$ Malat NAD(P)% Muskeln PEP arboxy Kinase PEP 2 GDP $ xalacetat GTP Pflanzen, efen, Bakterien PEP arboxylase PEP # $ xalacetat P i
18 9.. REGULATIN Pyruvate oas NAD pyruvate dehydrogenase 2 NAD AcetyloA S oa FAD 2 FAD 2 Fumarate 2 2 Succinate 2 NAD Malate 7. fumarase 6. succinate dehydrogenase 8. malate dehydrogenase oas NAD 5. succinyloa synthetase 2 GTP 4. αketoglutarate 2 dehydrogenase GDP P 2 i 2 oas 2. 2 S oa SuccinyloA NAD NAD 2 α Ketoglutarate 2 xaloacetate citrate 1. synthase itric acid cycle oas 2 2 itrate 2. aconitase. isocitrate dehydrogenase 2 xalosuccinate aconitase cisaconitate 2 Isocitrate Abbildung 9.1: The reactions of the citric acid cycle, from (VET und VET, 1995) NAD 2 NAD
19 Kapitel 10 Biologische xidation Prüfungsstandard Redoxreaktionen: xidation, Reduktion, Dehydrierung primärer und sekundärer Gruppen, Aldehyde, gesättigte Verbindungen, Redoxpotential, freie Enthalpie, Gibbs elmholtz Gleichung, Beziehung zwischen Potentialdifferenz, Energietönung und chemischem Gleichgewicht, Reversibilität, Energie der Wasserbildung und ihre Verwertung Atmungskette und ihre Regulation: Elektronentransportsystem, strukturelle Anordnung (4 Komplexe), Aufbau und Funktion der ytochrome, Fe S Proteine, Ubichinon, Atmungskontrolle, Atmungsgifte, chemiosmotische Theorie der oxidativen Phosphorylierung, ATP Synthase, Protonengradient, Kopplung, Entkopplung, Wirkungsweise von Entkopplern, Transportprozesse, emmsstoffe Mechanismus der Übertragung durch NAD, Einschleusung von NAD ins Mitochondrium, Bildung und Verwertung von NADP, Reaktionsmöglichkeiten von Flavinenzymen, Struktur des äms, Beispiele für Flavin und ämenzyme, extramitochondrialer 2 Verbrauch, 2 2 Bildung, Katalase, Peroxidase, Superoxid Dismutase, Monooxygenasen, Dioxygenasen 10.1 Redoxreaktionen 10.2 Atmungskette 10. oxidative Phosphorylierung VET und VET (1995) Energy oupling ypotheses Proton Gradient Generation 10.. Mechanism of ATP Synthesis Binding hange Mechanism proton translocating ATP synthase is driven by conformational changes three (conceptual) phases 1. translocation of protons carried out by F 0 2. catalysis of formation of the phosphoanhydride bond of ATP carried out by F 1. coupling of the dissipation of the proton gradient with ATP synthesis requires interaction of F 1 and F 0 5
20 6 KAPITEL 10. BILGISE XIDATIN F 1 subunit proposed to have three interacting catalytic protomers! each in a different conformational state 1. L state & loose binding for ligands & catalytic inactive 2. T state & tight binding for ligands & catalytically active. state & open conformation & very low affinity for ligands & catalytically inactive interconversion of the three states! by free energy released on proton translocation synthesis of the phosphoanhydride bond of ATP only in the T state ATP release only in the state steps of the reaction 1. binding of ADP and P i to site L 2. energy dependent conformational change converting binding site L to T, T to, and to L. synthesis of ATP at site T and release of ATP from site Uncoupling of xidative Phosphorylation
21 10.. XIDATIVE PSPRYLIERUNG 7 Tabelle 10.1: Die ATP Ausbeute bei vollständiger Glucoseoxidation Reaktionsfolge ATP Ausbeute pro Glucose Glykolyse: Von der Glucose zum Pyruvat (im ytosol) Phosphorylierung der Glucose 1 Phosporylierung von Fructose 6 phosphat 1 Dephosphorylierung von 2 Molekülen 1, BPG 2 Dephosphorylierung von 2 Molekülen PEP 2 Bildung von 2 NAD bei der xidation von 2 GAP Umwandlung von Pyruvat in Acetyl oa (Mitochondrien) Bildung von 2 NAD itrat Zyklus (Mitochondrien) Bildung von 2 GTP aus 2 Succinyl oa 2 Bildung von 6 NAD aus je 2 Isocitrat, α Ketoglutarat, Malat Bildung von 2 FAD 2 bei xidation von 2 Succinat oxidative Phosphorylierung (Mitochondrien) 2 NAD aus der Glykolyse (je 2 ATP) 4 2 NAD aus der oxidativen Decarboxylierung (je ATP) 6 2 FAD 2 aus dem itrat Zyklus (je 2 ATP) 4 6 NAD aus dem itrat Zyklus (je ATP) 18 Nettoausbeute pro Glucose 6
22 Kapitel 11 Stoffwechsel der Lipide Prüfungsstandard Gesättigte und ungesättigte Fettsäuren, Strukturprinzip einfacher und komplexer Lipide, Lipide als Bausteine biologischer Membranen, Synthese und Abbau einfacher und komplexer Lipide, Verdauung und Resorption der Fette, fettspaltende Enzyme, Phospholipasen, Rolle von Gallensäuren, Lipid und Fettsäuretransport im Blut, Micellen, hylomikronen, rgane des Fettstoffwechsels, Aktivierung und intrazellulärer Transport von Fettsäuren, Synthese und Abbau von Fettsäuren, Energiebilanz, Synthese und Verwertung von Acetonkörpern, Ursache der Acetonkörperbildung bei Diabetes mellitus, Grundzüge der holesterolsynthese, Funktion und Umwandlung in andere Steroidverbindungen, Lipidstoffwechselprodukte als Regulatoren und ormone (Prostanoide) Lipoproteine: Klassen, Stoffwechsel, LDL Rezeptorweg 11.1 Lipidklassen 11.2 Stoffwechsel der Fettsäuren, Triglyceride, Phospholipide, des holesterols und der Ketonkörper 11. Lipidtransport 11.4 oxygenierte Fettsäuren 9
Bauprinzip, funktionelle Gruppen, polare und apolare Reste, Reaktionen der Amino und Carboxylgruppe
 Anhang B Prüfungsstandard Aminosäuren Bauprinzip, funktionelle Gruppen, polare und apolare Reste, Reaktionen der Amino und Carboxylgruppe Elektrolyteigenschaften, Säure Basen Status, Ampholyte, isoelektrischer
Anhang B Prüfungsstandard Aminosäuren Bauprinzip, funktionelle Gruppen, polare und apolare Reste, Reaktionen der Amino und Carboxylgruppe Elektrolyteigenschaften, Säure Basen Status, Ampholyte, isoelektrischer
Präsentation STOFFWECHSEL STOFFWECHSEL. Fettstoffwechsel im Sport. Biologische Oxidation Zitratzyklus und Atmungskette
 STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
STOFFWESEL GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention 6 Bedeutung der körperlichen Aktivität Präsentation Fettstoffwechsel im Sport Glukose exokinase 1ATP -> 1ADP Glukose-6-Phosphat Phosphohexoisomerase
Regulation der Glykolyse: Phosphofructokinase
 Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
Regulation der Glykolyse: Phosphofructokinase Abbauwege des Pyruvats Weitere Oxidation (zu CO 2 ) Alkoholische Gärung Pyruvat- Decarboxylase Alkohol- Dehydrogenase NAD + wird bei der Gärung regneriert,
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue Prüfungsordnung Dauer Std.), 2. 2. 203, 8:00-9:00 Uhr, Sporthalle, sowie Biochemische Teilklausur zum Grundmodul
Gluconeognese Neusynthese von Glucose aus Pyruvat
 Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Gluconeognese Neusynthese von Glucose aus Pyruvat Warum notwendig? Das Gehirn ist auf eine konstante Versorgung mit Glucose angewiesen. Eine Unterzuckerung (< 3 4 mmol/l) führt unweigerlich zur Bewußtlosigkeit
Wirkungsmechanismen regulatorischer Enzyme
 Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
Wirkungsmechanismen regulatorischer Enzyme Ein Multienzymsystem ist eine Aufeinanderfolge von Enzymen, bei der das Produkt eines vorstehenden Enzyms das Substrat des nächsten Enzyms wird. Ein regulatorisches
- der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen
 Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Die Aufgabe des Citratcyklus ist: - der oxidative Abbau von Acetyl-CoA (und die somit gebildeten Reduktionsäquivalente) - Lieferung von Substraten für verschiedene Synthesen Die Aufgabe des Citratcyklus
Mathematik und Naturwissenschaften, Biologie, Biochemie. Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 12.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 12.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Was bisher geschah 1
 Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Was bisher geschah 1 Zellatmung (Übersicht) Der Citratcyclus ist die erste Stufe der Zellatmung 2 Citratzyklus Synonyme: Tricarbonsäurezyklus (TCA-Zyklus) Krebszyklus, Zitronensäurezyklus Der Zyklus ist
Pentosephosphat-Weg: alternativer Abbau von Glucose. Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet.
 Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Pentosephosphat-Weg: alternativer Abbau von Glucose Wird auch als Hexosemonophosphatweg (HMW) oder Phosphogluconat-Cyclus bezeichnet. Er liefert NADPH und Ribose-5-phosphat. NADPH ist die 2. Währung der
Klausur zur Vorlesung Biochemie I im WS 2002/03 Lösungen
 Klausur zur Vorlesung Biochemie I im W 00/03 Lösungen am 17.0.003 von 14.15 15.45 Uhr Gebäude 4, aum 115 (insgesamt 100 Punkte, mindestens 40 erforderlich) Bitte amen (in Druckbuchstaben), Matrikelnummer
Klausur zur Vorlesung Biochemie I im W 00/03 Lösungen am 17.0.003 von 14.15 15.45 Uhr Gebäude 4, aum 115 (insgesamt 100 Punkte, mindestens 40 erforderlich) Bitte amen (in Druckbuchstaben), Matrikelnummer
Grundlagen der Biochemie. Prof. W. LOCKAU Humboldt-Universität zu Berlin WS 1999/2000 & SS 2000
 Grundlagen der Biochemie Prof. W. LOKAU umboldt-universität zu Berlin WS 1999/2000 & SS 2000 Vorlesungsmitschrift c Till Biskup 2000 Till Biskup Grundlagen der Biochemie Vorlesungsmitschrift Version 0.1.0c
Grundlagen der Biochemie Prof. W. LOKAU umboldt-universität zu Berlin WS 1999/2000 & SS 2000 Vorlesungsmitschrift c Till Biskup 2000 Till Biskup Grundlagen der Biochemie Vorlesungsmitschrift Version 0.1.0c
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler
 Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
Vorlesung Biophysik I - Molekulare Biophysik Kalbitzer/Kremer/Ziegler 23.10. Zelle 30.10. Biologische Makromoleküle I 06.11. Biologische Makromoleküle II 13.11. Nukleinsäuren-Origami (DNA, RNA) 20.11.
Klausur zur Vorlesung Biochemie I im WS 2004/05
 Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
Klausur zur Vorlesung Biochemie I im W 2004/05 am 9.03.2005 von 0.00 -.30 Uhr Gebäude 42, örsaal 5 Lösungen in rot Punkte in grün Aufgabe : Formulieren ie die repetitiven chritte in der -xidation von Fettsäuren
15. Aminosäuren, Peptide und Proteine
 15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
15. Aminosäuren, Peptide und Proteine 1 Proteine (Polypeptide) erfüllen in biologischen ystemen die unterschiedlichsten Funktionen. o wirken sie z.b. bei vielen chemischen eaktionen in der atur als Katalysatoren
KOHLENHYDRATE PYRUVAT-DEHYDROGENASE
 PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
PYRUVAT-DEHYDROGENASE PYRUVAT-DEHYDROGENASE: Um ein Optimum Beute garantieren zu können, Wird das entstandene Pyruvat (bei der aeroben) Glykolyse, durch die PDH in Acetyl-CoA umgewandelt, um dann, Teil
Peptide Proteine. 1. Aminosäuren. Alle optisch aktiven proteinogenen Aminosäuren gehören der L-Reihe an: 1.1 Struktur der Aminosäuren
 1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
1. Aminosäuren Aminosäuren Peptide Proteine Vortragender: Dr. W. Helliger 1.1 Struktur 1.2 Säure-Basen-Eigenschaften 1.2.1 Neutral- und Zwitterion-Form 1.2.2 Molekülform in Abhängigkeit vom ph-wert 1.3
Citratzyklus. Biochemie Maria Otto,Bo Mi Ok Kwon Park
 Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
Citratzyklus Biochemie 13.12.2004 Maria Otto,Bo Mi Ok Kwon Park O CH 3 C Acetyl-CoA + H 2 O HO C COO C NADH O C H Citrat Cis-Aconitat H C Malat Citratzyklus HO C H Isocitrat CH H 2 O Fumarat C = O FADH
ENZYME. Teil 1: Grundlagen und Substratbestimmungen
 ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
ENZYME Teil 1: Grundlagen und Substratbestimmungen Metastabiler Zustand Beispiel: Glucose-6-Phosphat + H 2 O [Glc6P] [H 2 0] K = = 1.135 x 10 [Glc] [Pi] -3 Gleichgewicht stark auf Seite von Glc + Pi Glucose
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 16.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Der Energiestoffwechsel eukaryotischer Zellen
 Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
Der Energiestoffwechsel eukaryotischer Zellen Der Abbau (Katabolismus/Veratmung/Verbrennung) reduzierter Kohlenstoffverbindungen (Glukose, Fettsäuren, Aminosäuren) bzw. deren makromolekularer Speicher
Anaerobe NADH-Regeneration: Gärung
 Anaerobe NADH-egeneration: Gärung Milchsäure-Gärung H 3 Lactat-DH H H H 3 Pyruvat Lactat Anaerobe NADH-egeneration: Gärung Milchsäure-Gärung H 3 Lactat-DH H H H 3 Pyruvat Lactat Alkoholische Gärung H 3
Anaerobe NADH-egeneration: Gärung Milchsäure-Gärung H 3 Lactat-DH H H H 3 Pyruvat Lactat Anaerobe NADH-egeneration: Gärung Milchsäure-Gärung H 3 Lactat-DH H H H 3 Pyruvat Lactat Alkoholische Gärung H 3
am von Uhr, Mensa 1 & 2 Insgesamt 50 Punkte, mindestens 20 erforderlich
 Biochemische Teilklausur zum Grundmodul 7--B im Bachelor-Studiengang Biologie sowie Allgemeine Klausur zur Vorlesung Biochemie I (Modul B-V1) im WS 2009/10 am 01.03.2010 von 17.15 18.45 Uhr, Mensa 1 &
Biochemische Teilklausur zum Grundmodul 7--B im Bachelor-Studiengang Biologie sowie Allgemeine Klausur zur Vorlesung Biochemie I (Modul B-V1) im WS 2009/10 am 01.03.2010 von 17.15 18.45 Uhr, Mensa 1 &
Der Citratzyklus (= Trikarbonsäurezyklus, Krebszyklus)
 Der Citratzyklus (= Trikarbonsäurezyklus, Krebszyklus) Biochemischer Kreisprozeß Ablauf in der mitochondrialen Matrix Glykolyse β-oxidation Atmungskette AS-Abbau Der Citratzyklus Der Citratzyklus: Übersicht
Der Citratzyklus (= Trikarbonsäurezyklus, Krebszyklus) Biochemischer Kreisprozeß Ablauf in der mitochondrialen Matrix Glykolyse β-oxidation Atmungskette AS-Abbau Der Citratzyklus Der Citratzyklus: Übersicht
Grundlagen der Physiologie
 Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Grundlagen der Physiologie Abbau eines Zuckermoleküls www.icbm.de/pmbio Lebensweise eines heterotrophen Aerobiers 1 Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien Anabolismus
Stoffwechsel. Metabolismus (3)
 Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Vorlesung Zell- und Molekularbiologie Stoffwechsel Metabolismus (3) Überblick Stoffwechsel Glykolyse Citratcyklus Chemiosmotische Prinzipien 1 Glykolyse 1 Glucose und in der Glykolyse daraus gebildete
Bioorganische Chemie Enzymatische Katalyse 2011
 Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Ringvorlesung Chemie B - Studiengang Molekulare Biotechnologie Bioorganische Chemie Enzymatische Katalyse 2011 Prof. Dr. A. Jäschke INF 364, Zi. 308, Tel. 54 48 51 jaeschke@uni-hd.de Lehrziele I Kenntnis
Atmung Übersicht. Atmung der Mitochondrien
 Atmung der Mitochondrien Atmung Übersicht e - Transportkette REAKTION: C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O + Energie (Glucose) (Sauerstoff) (Kohlendioxid) (Wasser) Nur ca. 40% der Energie wird zu ATP Der
Atmung der Mitochondrien Atmung Übersicht e - Transportkette REAKTION: C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O + Energie (Glucose) (Sauerstoff) (Kohlendioxid) (Wasser) Nur ca. 40% der Energie wird zu ATP Der
Grundzüge des Energiestoffwechsels I
 Grundzüge des Energiestoffwechsels I 4.5 Grundzüge des Energiestoffwechsels 4.5.2 Glykolyse 4.5.3 Pyruvatdecarboxylierung 4.5.4 Citratzyklus 4.5.5 Glyoxylatzyklus und Gluconeogenese 4.5.6 Atmung, Endoxidation
Grundzüge des Energiestoffwechsels I 4.5 Grundzüge des Energiestoffwechsels 4.5.2 Glykolyse 4.5.3 Pyruvatdecarboxylierung 4.5.4 Citratzyklus 4.5.5 Glyoxylatzyklus und Gluconeogenese 4.5.6 Atmung, Endoxidation
Inhaltsverzeichnis. a. Chemie der Aminosäuren und Peptide
 Inhaltsverzeichnis 1 Zelluläre Grundlagen der Biochemie Typen lebender Zellen 2 Typen biochemischer Präparationen 2 Subzelluläre Fraktionierung 3 Biochemische Funktionen der Zellorganellen 4 2 Proteine
Inhaltsverzeichnis 1 Zelluläre Grundlagen der Biochemie Typen lebender Zellen 2 Typen biochemischer Präparationen 2 Subzelluläre Fraktionierung 3 Biochemische Funktionen der Zellorganellen 4 2 Proteine
1. Biochemie-Klausur Zahnmediziner, WS 03/04
 1. Biochemie-Klausur Zahnmediziner, WS 03/04 1. Welche Aussage zur ß-Oxidation von Fettsäuren in Peroxisomen ist falsch? A) Die Aufnahme langkettiger Fettsäuren in die Peroxisomen erfolgt Carnitin-unabhängig!
1. Biochemie-Klausur Zahnmediziner, WS 03/04 1. Welche Aussage zur ß-Oxidation von Fettsäuren in Peroxisomen ist falsch? A) Die Aufnahme langkettiger Fettsäuren in die Peroxisomen erfolgt Carnitin-unabhängig!
ORGANISCHE CHEMIE. Aminosäuren und Proteine
 RGAISE EMIE Aminosäuren und Proteine Aminosäuren (AS) R 2 arbonsäuren mit einer Aminogruppe Die (etwa) 20 proteinogenen Aminosäuren sind alle α-aminosäuren (Aminogruppe an -2), unterscheiden sich durch
RGAISE EMIE Aminosäuren und Proteine Aminosäuren (AS) R 2 arbonsäuren mit einer Aminogruppe Die (etwa) 20 proteinogenen Aminosäuren sind alle α-aminosäuren (Aminogruppe an -2), unterscheiden sich durch
BIOCHEMIE DER ERNÄHRUNG II Oxidation von Lipiden. Gastrointestinaltrakt. Fettsäureoxidation zu Acetyl-CoA
 xidation von Lipiden ß-xidation: Fettsäureoxidation zu Acetyl-oA BIEMIE DER ERNÄRUNG II 07.05.2012 wichtigste Fettsäurequelle in Nahrung: Triacylglyceride Import freier Fettsäuren ins ytosol oder Erzeugung
xidation von Lipiden ß-xidation: Fettsäureoxidation zu Acetyl-oA BIEMIE DER ERNÄRUNG II 07.05.2012 wichtigste Fettsäurequelle in Nahrung: Triacylglyceride Import freier Fettsäuren ins ytosol oder Erzeugung
Mathematik und Naturwissenschaften, Biologie, Biochemie. Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 20.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 20.10.2016 Alexander Götze 3.Semester Molekulare Biotechnologie a.goetze2207@googlemail.com Mi. 2DS DRU. 68 H Michel
Die innere Mitochondrienmebran ist durchlässig für: 1. Pyruvat 2. Malat 3. Aspartat 4. Citrat
 Der Malat-Shuttle Die innere Mitochondrienmebran ist durchlässig für: 1. Pyruvat 2. Malat 3. Aspartat 4. Citrat Die innere Mitochondrienmembran ist undurchlässig für: 1. Wasserstoffatomen > 2. Acetyl-
Der Malat-Shuttle Die innere Mitochondrienmebran ist durchlässig für: 1. Pyruvat 2. Malat 3. Aspartat 4. Citrat Die innere Mitochondrienmembran ist undurchlässig für: 1. Wasserstoffatomen > 2. Acetyl-
Kataboler und Anaboler Stoffwechsel
 Vorlesung Vom Molekül zur Zelle Ao.Univ.Prof. Dr. Georg Weitzer Fortsetzung von Block 3 nach Prof. Müllner, ab 8.1. Kataboler und Anaboler Stoffwechsel Aktuelle Folien unter http://homepage.univie.ac.at/georg.weitzer/lectures.html
Vorlesung Vom Molekül zur Zelle Ao.Univ.Prof. Dr. Georg Weitzer Fortsetzung von Block 3 nach Prof. Müllner, ab 8.1. Kataboler und Anaboler Stoffwechsel Aktuelle Folien unter http://homepage.univie.ac.at/georg.weitzer/lectures.html
Kohlenhydrate. spielen in der Natur eine sehr wichtige Rolle. dienen als Energiespeicher: Stärke, Glykogen
 Kohlenhydrate spielen in der Natur eine sehr wichtige Rolle dienen als Energiespeicher: Stärke, Glykogen sind Bestandteile von DNA bzw. RNA, Zellwänden,... gebunden an Proteine und Lipide Einteilung der
Kohlenhydrate spielen in der Natur eine sehr wichtige Rolle dienen als Energiespeicher: Stärke, Glykogen sind Bestandteile von DNA bzw. RNA, Zellwänden,... gebunden an Proteine und Lipide Einteilung der
Aufgabe 2: (Aminosäuren)
 Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Aufgabe 2: (Aminosäuren) Aufgabenstellung Die 20 Aminosäuren (voller Name, 1- und 3-Buchstaben-Code) sollen identifiziert und mit RasMol grafisch dargestellt werden. Dann sollen die AS sinnvoll nach ihren
Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte)
 Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
Datum: 07.02.2011 Name: Matrikel-Nr.: Vorname: Studiengang: Bioinformatik Biochemie (für Bioinformatiker) WS 2010/2011, 2. Klausur (50 Punkte) Modulnr.: FMI-BI0027 Hiermit bestätige ich meine Prüfungstauglichkeit.
Asmaa Mebrad Caroline Mühlmann Gluconeogenese
 Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Gluconeogenese Asmaa Mebrad Caroline Mühlmann 06.12.2004 Definition: wichtiger Stoffwechselweg, bei dem Glucose aus Nicht-Kohlenhydrat-Vorstufen synthetisiert wird Ablauf bei längeren Hungerperioden dient
Inhaltsverzeichnis. Organische Chemie und Biochemie 1. Proteine und Peptide 23. Enzyme 47. Coenzyme 71
 Inhaltsverzeichnis Organische Chemie und Biochemie 1 1. Die chemische Bindung 1 2. Das Wasser 2 3. Der Kohlenwasserstoff als Grandkörper 4 4. Die funktionellen Gruppen 6 5. Biochemisch wichtige Reaktionen
Inhaltsverzeichnis Organische Chemie und Biochemie 1 1. Die chemische Bindung 1 2. Das Wasser 2 3. Der Kohlenwasserstoff als Grandkörper 4 4. Die funktionellen Gruppen 6 5. Biochemisch wichtige Reaktionen
Biochemie. Kurzes Lehrbuch der. für Mediziner und Naturwissenschaftler. Von Peter Karlson. 12., völlig neubearbeitete Auflage
 Kurzes Lehrbuch der Biochemie für Mediziner und Naturwissenschaftler Von Peter Karlson 12., völlig neubearbeitete Auflage 177 Abbildungen 323 Formelbilder und Schemata 37 Tabellen 2008 AGI-Information
Kurzes Lehrbuch der Biochemie für Mediziner und Naturwissenschaftler Von Peter Karlson 12., völlig neubearbeitete Auflage 177 Abbildungen 323 Formelbilder und Schemata 37 Tabellen 2008 AGI-Information
Inhaltsverzeichnis. I Stoffwechsel. 1 Vom Organismus zum Molekül Aminosäuren Peptide und Proteine Enzyme...
 XI I Stoffwechsel 1 Vom Organismus zum Molekül...................... 2 1.1 Aufbau des Organismus.............................. 2 1.2 Chemische Grundlagen des Stoffwechsels.................. 6 1.3 Informationsübertragung
XI I Stoffwechsel 1 Vom Organismus zum Molekül...................... 2 1.1 Aufbau des Organismus.............................. 2 1.2 Chemische Grundlagen des Stoffwechsels.................. 6 1.3 Informationsübertragung
Proteinogene Aminosäuren. Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren
 Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Proteinogene Aminosäuren Unpolare, aliphatische Seitenketten Monoaminomonocarbonsäuren Proteinogene Aminosäuren Unpolare, heterozyklische Seitenkette Monoaminomonocarbonsäuren Proteinogene Aminosäuren
Z11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung. Proteine aus der Nahrung werden
Klausur zur Vorlesung Biochemie I im WS 2001/02
 (insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
(insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 23.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 23.11.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die gentechnische Produktion von Insulin - Selbstlerneinheit zur kontextorientierten Wiederholung der molekularen Genetik Das komplette
Organische Chemie der biologischen Stoffwechselwege
 Organische Chemie der biologischen Stoffwechselwege John McMurry / Tadhg Begley aus dem Amerikanischen übersetzt von Karin Beifuss ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k_/l AKADEMISCHER VERLAG
Organische Chemie der biologischen Stoffwechselwege John McMurry / Tadhg Begley aus dem Amerikanischen übersetzt von Karin Beifuss ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k_/l AKADEMISCHER VERLAG
Autotrophe und heterotrophe Organismen
 Grundlagen der Umwelttechnik 5. Biomoleküle und Grundlagen des Stoffwechsels Vorlesung an der ochschule Augsburg Dr. Siegfried Kreibe 1 Autotrophe und heterotrophe rganismen Autotrophe rganismen: bauen
Grundlagen der Umwelttechnik 5. Biomoleküle und Grundlagen des Stoffwechsels Vorlesung an der ochschule Augsburg Dr. Siegfried Kreibe 1 Autotrophe und heterotrophe rganismen Autotrophe rganismen: bauen
Einführung in die Biochemie Wirkungsweise von Enzymen
 Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Wirkungsweise von en Am Aktiven Zentrum kann ein nur in einer ganz bestimmten Orientierung anlegen, wie ein Schlüssel zum Schloss. Dieses Prinzip ist die Ursache der spezifität von en. Dies resultiert
Z 11 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: 2) ÜBERSICHT ÜBER DEN ENERGIESTOFFWECHSEL
 GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
GRUNDLAGEN DER BIOCHEMIE STOFFWECHSELWEGE Zusammenfassung Zusammenfassung Kapitel 11 1) DIE WICHTIGSTEN STOFFWECHSELWEGE: Fette und Kohlenhydrate aus der Nahrung nutzt der Körper hauptsächlich zur Energiegewinnung.
Musterlösung. Frage Summe Note Punkte 1, ,5 1,0
 Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue rüfungsordnung Dauer Std.),. 4. 203, 8:30-9:30 Uhr, Mensa -3, sowie Biochemische Teilklausur zum Grundmodul 07
Biochemische Teilklausur zum Grundmodul 0 im Bachelor-Studiengang Biowissenschaften (neue rüfungsordnung Dauer Std.),. 4. 203, 8:30-9:30 Uhr, Mensa -3, sowie Biochemische Teilklausur zum Grundmodul 07
Reduction / Oxidation
 Reduction / Oxidation Pyruvat C6H12O 6 Glucose Glycogen Glucose-6-P Glycolyse 2 e - 2 Pyruvat 2 e - 2 Acetyl-CoA 2 CO 2 ATP ADP ATP ADP Citrat-Zyklus oder Tricarbonsäure 4 CO 2 8 e - Zyklus 6 O2 6 H 2
Reduction / Oxidation Pyruvat C6H12O 6 Glucose Glycogen Glucose-6-P Glycolyse 2 e - 2 Pyruvat 2 e - 2 Acetyl-CoA 2 CO 2 ATP ADP ATP ADP Citrat-Zyklus oder Tricarbonsäure 4 CO 2 8 e - Zyklus 6 O2 6 H 2
Hauptwege des Stoffwechsels
 Hauptwege des Stoffwechsels Auf- und Abbau der Stoffgruppen Kohlenhydrate 1 Enzyme Hauptklassen 1 2 3 4 5 6 Biochemie 08/2 Enzyme 1. Erhöhung der Reaktionsgeschwindigkeit ΔΔG kat = ΔG unkat - ΔG kat Erniedrigung
Hauptwege des Stoffwechsels Auf- und Abbau der Stoffgruppen Kohlenhydrate 1 Enzyme Hauptklassen 1 2 3 4 5 6 Biochemie 08/2 Enzyme 1. Erhöhung der Reaktionsgeschwindigkeit ΔΔG kat = ΔG unkat - ΔG kat Erniedrigung
Praktikum Biochemie B.Sc. Water Science WS Enzymregulation. Marinja Niggemann, Denise Schäfer
 Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Praktikum Biochemie B.Sc. Water Science WS 2011 Enzymregulation Marinja Niggemann, Denise Schäfer Regulatorische Strategien 1. Allosterische Wechselwirkung 2. Proteolytische Aktivierung 3. Kovalente Modifikation
Hemmung der Enzym-Aktivität
 Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Enzym - Inhibitoren Wie wirkt Penicillin? Wie wirkt Aspirin? Welche Rolle spielt Methotrexat in der Chemotherapie? Welche Wirkstoffe werden gegen HIV entwickelt? Hemmung der Enzym-Aktivität Substrat Kompetitiver
Pentosephosphatzyklus. Synonym: Hexosemonophosphatweg
 Pentosephosphatzyklus Synonym: Hexosemonophosphatweg Gliederung Funktion & Lokalisation Grundgerüst des Ablaufs Anpassung an Stoffwechselsituation Regelung Beispielreaktion Funktion & Lokalisation Gewinnung
Pentosephosphatzyklus Synonym: Hexosemonophosphatweg Gliederung Funktion & Lokalisation Grundgerüst des Ablaufs Anpassung an Stoffwechselsituation Regelung Beispielreaktion Funktion & Lokalisation Gewinnung
Beispiele für Prüfungsfragen zu den Einheiten. 2, 3, 5, 9-12, 15, 16, und 21 (Hartig)
 Beispiele für Prüfungsfragen zu den Einheiten 2, 3, 5, 9-12, 15, 16, und 21 (Hartig) Untenstehendes Molekül ist ein Peptidhormon. Wieviele Peptidbindungen besitzt dieses Molekül (zeichnen Sie diese ein)?
Beispiele für Prüfungsfragen zu den Einheiten 2, 3, 5, 9-12, 15, 16, und 21 (Hartig) Untenstehendes Molekül ist ein Peptidhormon. Wieviele Peptidbindungen besitzt dieses Molekül (zeichnen Sie diese ein)?
Kohlenhydrate C n. O) n (H 2. z.b. C 6 O 6 O) 6 H 12 : C 6. Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Monosaccharide
 Kohlenhydrate C n (H 2 O) n z.b. C 6 (H 2 O) 6 : C 6 H 12 O 6 Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Vortragender: Dr. W. Helliger Monosaccharide Reaktionen der Monosaccharide
Kohlenhydrate C n (H 2 O) n z.b. C 6 (H 2 O) 6 : C 6 H 12 O 6 Monosaccharide Di- und Oligosaccharide Polysaccharide (Glykane) Vortragender: Dr. W. Helliger Monosaccharide Reaktionen der Monosaccharide
KOHLENHYDRATE. Die Glykolyse
 Die Glykolyse Hexokinase Glucose Kostet 1ATP Mg 2+ Glucose-6-P Die Glucokinase kann durch Insulin induziert werden in : 1) Den Fettzellen 2) Den ß-Zellen des Pankreas 3) Der Nierenrinde 4) Der Leber Die
Die Glykolyse Hexokinase Glucose Kostet 1ATP Mg 2+ Glucose-6-P Die Glucokinase kann durch Insulin induziert werden in : 1) Den Fettzellen 2) Den ß-Zellen des Pankreas 3) Der Nierenrinde 4) Der Leber Die
1 Vom Organismus zum Molekül... 3
 I Stoffwechsel... 1 1 Vom Organismus zum Molekül... 3 1.1 Aufbau des Organismus... 4 1.2 Chemische Grundlagen des Stoffwechsels... 8 1.3 Informationsübertragung in lebenden Systemen... 17 1.4 Funktion
I Stoffwechsel... 1 1 Vom Organismus zum Molekül... 3 1.1 Aufbau des Organismus... 4 1.2 Chemische Grundlagen des Stoffwechsels... 8 1.3 Informationsübertragung in lebenden Systemen... 17 1.4 Funktion
Mechanismen der ATP Synthese in Mitochondrien
 Mechanismen der ATP Synthese in Mitochondrien Übersicht Die Bedeutung von ATP Aufbau eines Mitochondriums ATP Synthese: Citratzyklus Atmungskette ATP Synthase Regulation der ATP Synthese Die Bedeutung
Mechanismen der ATP Synthese in Mitochondrien Übersicht Die Bedeutung von ATP Aufbau eines Mitochondriums ATP Synthese: Citratzyklus Atmungskette ATP Synthase Regulation der ATP Synthese Die Bedeutung
Die hierarchische Organisation biologischer Strukturen
 Das Lehrbuch Die hierarchische Organisation biologischer Strukturen Die drei Etappen der Evolution von Leben Was ist Biochemie? Untersuchung des Lebens auf molekularer Ebene Leben, wie wir es kennen, ist
Das Lehrbuch Die hierarchische Organisation biologischer Strukturen Die drei Etappen der Evolution von Leben Was ist Biochemie? Untersuchung des Lebens auf molekularer Ebene Leben, wie wir es kennen, ist
schnell und portofrei erhältlich bei
 Kurzlehrbuch Biochemie Kurzlehrbuch Biochemie Bearbeitet von Melanie Königshoff, Timo Brandenburger 2. überarb. Aufl. 2007. Taschenbuch. 46 S. Paperback ISBN 978 3 13 136412 8 Format (B x L): 24 x 17 cm
Kurzlehrbuch Biochemie Kurzlehrbuch Biochemie Bearbeitet von Melanie Königshoff, Timo Brandenburger 2. überarb. Aufl. 2007. Taschenbuch. 46 S. Paperback ISBN 978 3 13 136412 8 Format (B x L): 24 x 17 cm
1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P)
 1. Klausur zum Modul 5.3 Biochemie WS 09/10 12.2.2010 1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P) 2) Welche Funktion
1. Klausur zum Modul 5.3 Biochemie WS 09/10 12.2.2010 1) Erklären sie die Begriffe Primär Sekundär und Tertiärstruktur von Proteinen. Nennen Sie drei typische Sekundärstrukturelemente (6P) 2) Welche Funktion
Enzyme. Fermente = chemische Substanzen En - zym = in Hefe/Sauerteig ; Trypsin Buchner (1897) zellfreier Hefeextrakt produziert Alkohol
 Enzyme Pasteur (1850) force vitale Liebig (1850) Fermente = chemische Substanzen Kühne (1878) En - zym = in efe/sauerteig ; Trypsin Buchner (1897) zellfreier efeextrakt produziert Alkohol Fischer (1894)
Enzyme Pasteur (1850) force vitale Liebig (1850) Fermente = chemische Substanzen Kühne (1878) En - zym = in efe/sauerteig ; Trypsin Buchner (1897) zellfreier efeextrakt produziert Alkohol Fischer (1894)
4.1. Eigenschaften von Enzymen
 4. Enzyme 106 107 4.1. Eigenschaften von Enzymen Enzyme sind Proteine, die chemische Reaktionen beschleunigen (Biokatalysatoren) Herausragende Merkmale verglichen mit anderen Katalysatoren: drastische
4. Enzyme 106 107 4.1. Eigenschaften von Enzymen Enzyme sind Proteine, die chemische Reaktionen beschleunigen (Biokatalysatoren) Herausragende Merkmale verglichen mit anderen Katalysatoren: drastische
Pentosephosphat. hosphatweg
 Pentosephosphat hosphatweg Wie aus dem Namen abzuleiten ist, werden C5-Zucker, einschließlich Ribose, aus Glucose synthetisiert. Das oxidierende Agens ist hierbei NADP + ; es wird zu NADP reduziert, das
Pentosephosphat hosphatweg Wie aus dem Namen abzuleiten ist, werden C5-Zucker, einschließlich Ribose, aus Glucose synthetisiert. Das oxidierende Agens ist hierbei NADP + ; es wird zu NADP reduziert, das
Vertiefendes Seminar zur Vorlesung Biochemie
 Vertiefendes Seminar zur Vorlesung Biochemie 24.10.2014 Vorbesprechung und Organisation Gerhild van Echten-Deckert Fon. +49-228-732703 Homepage: http://www.limes-institut-bonn.de/forschung/arbeitsgruppen/unit-3/abteilung-van-echten-deckert/abt-van-echten-deckert-startseite/
Vertiefendes Seminar zur Vorlesung Biochemie 24.10.2014 Vorbesprechung und Organisation Gerhild van Echten-Deckert Fon. +49-228-732703 Homepage: http://www.limes-institut-bonn.de/forschung/arbeitsgruppen/unit-3/abteilung-van-echten-deckert/abt-van-echten-deckert-startseite/
Stoffwechsel der essentiellen Aminosäuren
 Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Stoffwechsel der essentiellen Aminosäuren Andrea Schulte aus: Löffler/Petrides, Biochemie und Pathobiochemie, 7. Aufl., Kap. 15.3 Gliederung Einleitung: essentielle Aminosäuren, Biosynthese Abbau, Stoffwechselbedeutung
Aliphatische Aminosäuren. Aromatische Aminosäuren
 Prof. Dr..-U. eißig rganische Chemie I 17.1 Aliphatische Aminosäuren systematischer ame (Trivialname) truktur Vorkommen, Bedeutung 2-Aminoethansäure (α-aminoessigsäure, Glycin) 3 C 2 C 2 α Proteine, Peptide
Prof. Dr..-U. eißig rganische Chemie I 17.1 Aliphatische Aminosäuren systematischer ame (Trivialname) truktur Vorkommen, Bedeutung 2-Aminoethansäure (α-aminoessigsäure, Glycin) 3 C 2 C 2 α Proteine, Peptide
Kapitel 5: 1. Siderophore assistieren dem Transfer welcher der folgenden Makronährstoffe über Membranen? A. Stickstoff B. Phosphor C. Eisen D.
 Kapitel 5: 1 Siderophore assistieren dem Transfer welcher der folgenden Makronährstoffe über Membranen? A. Stickstoff B. Phosphor C. Eisen D. Kalium Kapitel 5: 2 Welcher der folgenden Makronährstoffe ist
Kapitel 5: 1 Siderophore assistieren dem Transfer welcher der folgenden Makronährstoffe über Membranen? A. Stickstoff B. Phosphor C. Eisen D. Kalium Kapitel 5: 2 Welcher der folgenden Makronährstoffe ist
Inhaltsverzeichnis - Kapitel
 Inhaltsverzeichnis - Kapitel 1. Einleitung: Die Chemie des Lebens 2. Kohlenhydrate 3. Lipide und Membranen 4. Nukleinsäuren 5. Aminosäuren und Proteine 6. Enzyme und Katalyse 7. Vitamine & Kofaktoren 8.
Inhaltsverzeichnis - Kapitel 1. Einleitung: Die Chemie des Lebens 2. Kohlenhydrate 3. Lipide und Membranen 4. Nukleinsäuren 5. Aminosäuren und Proteine 6. Enzyme und Katalyse 7. Vitamine & Kofaktoren 8.
Nach Terpenen und Kohlenhydraten nun eine weitere große Klasse an Naturstoffen
 260 17. Aminosäuren, Peptide ach Terpenen und Kohlenhydraten nun eine weitere große Klasse an aturstoffen 17.1 Übersicht Analog zu ydroxycarbonsäuren α-, β-, γ- Aminocarbonsäuren möglich: 2 3 2 2 α-amino-essigsäure
260 17. Aminosäuren, Peptide ach Terpenen und Kohlenhydraten nun eine weitere große Klasse an aturstoffen 17.1 Übersicht Analog zu ydroxycarbonsäuren α-, β-, γ- Aminocarbonsäuren möglich: 2 3 2 2 α-amino-essigsäure
Punkte 1. a) Erklären Sie wieso das Wassermolekül ein Dipol ist (gerne mit Zeichnung).
 -Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
-Klausur Biochemie - 20.07.6 Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Kraftwerk Körper Energiegewinnung in unseren Zellen
 Was passiert eigentlich, wenn wir etwas essen und dann loslaufen müssen? Wie können unsere Zellen die Stoffen aus der Nahrung zur Energiegewinnung nutzen? Die Antwort auf diese Fragen gibt s in diesem
Was passiert eigentlich, wenn wir etwas essen und dann loslaufen müssen? Wie können unsere Zellen die Stoffen aus der Nahrung zur Energiegewinnung nutzen? Die Antwort auf diese Fragen gibt s in diesem
Kohlenhydrate Aminosäuren Peptide
 Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Kohlenhydrate Aminosäuren Peptide Kohlenhydrate Kohlenhydrate = Saccharide Sie stellen zusammen mit Fetten und Proteinen den quantitativ größten verwertbaren (z.b. Stärke) und nicht-verwertbaren (Ballaststoffe)
Aminosäuren - Proteine
 Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Aminosäuren - Proteine ÜBERBLICK D.Pflumm KSR / MSE Aminosäuren Überblick Allgemeine Formel für das Grundgerüst einer Aminosäure Carboxylgruppe: R-COOH O Aminogruppe: R-NH 2 einzelnes C-Atom (α-c-atom)
Oxidative Phosphorylierung
 BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
BICEMIE DER ERÄRUG II Grundzüge des Metabolismus xidative Phosphorylierung 24.04.2012 xidative Phosphorylierung xidative Phosphorylierung -Die Elektronen in AD und in FAD 2 (hohes Übertragungspotential)
Weitere Übungsfragen
 1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail. Mag. Gerald Trutschl
 Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Enzyme (Teil 2) Enzymatische Reaktion, Thermodynamik & Enzyme im Detail Mag. Gerald Trutschl 1 Inhalt 1. Enzym Reaktion im Detail 2. Thermodynamische Reaktion 3. Katalysemechanismen 4. Michaelis-Menten-Konstante
Atmungskette ( Endoxidation) Reaktionen und ATP-Synthase
 Atmungskette ( Endoxidation) Reaktionen und ATP-Synthase Einleitung Aufrechterhaltung von Struktur und Funktion aller Lebensformen hängt von einer ständigen Energiezufuhr ab Höchste Energieausbeute liefert
Atmungskette ( Endoxidation) Reaktionen und ATP-Synthase Einleitung Aufrechterhaltung von Struktur und Funktion aller Lebensformen hängt von einer ständigen Energiezufuhr ab Höchste Energieausbeute liefert
Biochemische UE Alkaline Phosphatase.
 Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Biochemische UE Alkaline Phosphatase peter.hammerl@sbg.ac.at Alkaline Phosphatase: Katalysiert die Hydrolyse von Phosphorsäure-Estern: O - O - Ser-102 R O P==O O - H 2 O R OH + HO P==O O - ph-optimum im
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Grundlagen der Biochemie (BCh 5.3) Prof. Dr. Christoph Thiele WS 2014/15 1. Klausur ( )
 Grundlagen der Biochemie (BCh 5.3) Prof. Dr. Christoph Thiele WS 2014/15 1. Klausur (6.2.2015) Aufgabe 1: Erläutern Sie die Primär-, Sekundär- und die Tertiärstruktur von Proteinen. [3 P] Aufgabe 2: Erklären
Grundlagen der Biochemie (BCh 5.3) Prof. Dr. Christoph Thiele WS 2014/15 1. Klausur (6.2.2015) Aufgabe 1: Erläutern Sie die Primär-, Sekundär- und die Tertiärstruktur von Proteinen. [3 P] Aufgabe 2: Erklären
Funktion von Proteinen:
 Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
Funktion von Proteinen: Transport und Speicherung Beispiel Myoglobin / Hämoglobin Myoglobin Hämoglobin Globin-Faltung ist konserviert Häm-Gruppe Cofaktoren, Coenzyme & Prosthetische Gruppen Cofaktor wird
10.2 Der Citratzyklus 203
 10.2 Der Citratzyklus 203 Ketonkörper-Biosynthese. Bei den Ketonkörpern handelt es sich um die verschiffbare Form von Acetyl-CoA. Staut sich viel Acetyl-CoA in der Leber an im Hungerzustand, dann werden
10.2 Der Citratzyklus 203 Ketonkörper-Biosynthese. Bei den Ketonkörpern handelt es sich um die verschiffbare Form von Acetyl-CoA. Staut sich viel Acetyl-CoA in der Leber an im Hungerzustand, dann werden
Bachelorstudiengang Biologie. Vorlesung Biochemie I Klausur am 11. Oktober 2012, 9:00 11:00, H18
 Bachelorstudiengang Biologie Vorlesung Biochemie I Klausur am 11. Oktober 2012, 9:00 11:00, H18 1. (a) Welche Aminosäuren mit positiv geladenen Seitenketten kennen Sie? Bitte geben Sie die Strukturformel
Bachelorstudiengang Biologie Vorlesung Biochemie I Klausur am 11. Oktober 2012, 9:00 11:00, H18 1. (a) Welche Aminosäuren mit positiv geladenen Seitenketten kennen Sie? Bitte geben Sie die Strukturformel
12. Oxidative Phosphorylierung
 12. Oxidative Phosphorylierung 303 Zweck: Gewinnung von ATP Regeneration von NAD + und FAD Gesamtreaktionen: 3 ADP + 3 P i 3 ATP NADH + 0,5 O 2 + H + NAD + + H-O-H 2 ADP + 2 P i 2 ATP FADH 2 + 0,5 O 2
12. Oxidative Phosphorylierung 303 Zweck: Gewinnung von ATP Regeneration von NAD + und FAD Gesamtreaktionen: 3 ADP + 3 P i 3 ATP NADH + 0,5 O 2 + H + NAD + + H-O-H 2 ADP + 2 P i 2 ATP FADH 2 + 0,5 O 2
Biologie für Mediziner
 Biologie für Mediziner - Zellbiologie 1 - Prof. Dr. Reiner Peters Institut für Medizinische Physik und Biophysik/ CeNTech Robert-Koch-Strasse 31 Tel. 0251-835 6933, petersr@uni-muenster.de Dr. Martin Kahms
Biologie für Mediziner - Zellbiologie 1 - Prof. Dr. Reiner Peters Institut für Medizinische Physik und Biophysik/ CeNTech Robert-Koch-Strasse 31 Tel. 0251-835 6933, petersr@uni-muenster.de Dr. Martin Kahms
Enzyme SPF BCH am
 Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Enzyme Inhaltsverzeichnis Ihr kennt den Aufbau von Proteinen (mit vier Strukturelementen) und kennt die Kräfte, welche den Aufbau und die Funktion von Enzymen bestimmen... 3 Ihr versteht die Einteilung
Biochemie II - Tutorium
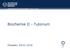 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Zellkern Lipidtröpfchen Nucleotidmetabolismus Glykogen- Stoffwechsel Pentosephosephatweg Glucose Glucose
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 04.01.2016 Zellkern Lipidtröpfchen Nucleotidmetabolismus Glykogen- Stoffwechsel Pentosephosephatweg Glucose Glucose
1.Frankfurter Consilium in 2015
 Regulationsmechanismen der Glykolyse und Tumorstoffwechsel Glykolyse leicht gemacht 1.Frankfurter Consilium in 2015 Alfons Meyer Facharzt f. Allgemeinmedizin Notfallmedizin, Naturheilverfahren, Akupunktur,
Regulationsmechanismen der Glykolyse und Tumorstoffwechsel Glykolyse leicht gemacht 1.Frankfurter Consilium in 2015 Alfons Meyer Facharzt f. Allgemeinmedizin Notfallmedizin, Naturheilverfahren, Akupunktur,
- Biochemieklausur Name: Matrikelnr.:
 08.07.20 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
08.07.20 Name: Matrikelnr.: Nur vollständige Reaktionsgleichungen, Berechnungen und Antworten werden als Lösung der Aufgaben gewertet, das Ergebnis alleine genügt nicht. Der Rechengang muß ersichtlich
Biochemie II - Tutorium
 Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 09.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Mathematik und Naturwissenschaften, Biologie, Biochemie Biochemie II - Tutorium Dresden, 09.01.2016 Ablauf des Tutoriums Einführung und Wiederholung Vorlesungszusammenfassung Übungsaufgaben Selbststudium
Scheinbedingungen für die Lehrveranstaltung Praktikum der Biochemie/ Molekularbiologie
 Scheinbedingungen für die Lehrveranstaltung Praktikum der Biochemie/ Molekularbiologie gültig ab: Wintersemester 2011/12 verantwortlicher Fachvertreter: Prof. K.-D. Fischer, Institut für Biochemie und
Scheinbedingungen für die Lehrveranstaltung Praktikum der Biochemie/ Molekularbiologie gültig ab: Wintersemester 2011/12 verantwortlicher Fachvertreter: Prof. K.-D. Fischer, Institut für Biochemie und
BIOPHYSIK DER ZELLE Energieumwandlung Mitochondrien, Atmungskette, Michell Hypothese, ATP Synthase. ATP Synthese
 BIOPHYSIK DER ZELLE 03.06. Energieumwandlung Mitochondrien, Atmungskette, Michell Hypothese, ATP Synthase ATP Synthese Important Concepts and Terms ATP- Hydrolysis Glykolysis Oxidative Phosphorylierung
BIOPHYSIK DER ZELLE 03.06. Energieumwandlung Mitochondrien, Atmungskette, Michell Hypothese, ATP Synthase ATP Synthese Important Concepts and Terms ATP- Hydrolysis Glykolysis Oxidative Phosphorylierung
7 Oxidativer Abbau von Pyruvat: Die Reaktionen der Pyruvat-Dehydrogenase und des Citratzyklus
 A 7.1 inführung 103 7 xidativer Abbau von Pyruvat: Die Reaktionen der Pyruvat-Dehydrogenase und des itratzyklus 7.1 inführung Die Abbauwege aller Kohlenhydrate vereinigen sich letztlich in der Glykolyse
A 7.1 inführung 103 7 xidativer Abbau von Pyruvat: Die Reaktionen der Pyruvat-Dehydrogenase und des itratzyklus 7.1 inführung Die Abbauwege aller Kohlenhydrate vereinigen sich letztlich in der Glykolyse
