Totalsynthese von Solandelactone E
|
|
|
- Tomas Salzmann
- vor 6 Jahren
- Abrufe
Transkript
1 Totalsynthese von Solandelactone E Jennifer A. Davoren, Christian Harcken and Stephen F. Martin Department of Chemistry and Biochemistry, The University of Texas, Austin, Texas J. rg. Chem., 2008, 73, Michael Ansorge, Jan Hasselmeyer, Annegret Jentsch, David Kunhardt, Christin Rengers, Linda Scharfenberg TU Dresden, Solandelactone E Folie 1
2 Gliederung 1. Einleitung 2. Retrosynthese 3. Totalsynthese 3.1 Darstellung des zentralen C(6)-C(15) Kerns 3.2 Konstruktion des C(12)-C(22) Segments 3.3 Konstruktion des C(1)-C(7) Lactons 3.4 Abschluss der Synthese 4. Strukturrevision und Zusammenfassung 5. Reaktionsübersicht 6. Abkürzungsverzeichnis TU Dresden, Solandelactone E Folie 2
3 1. Einleitung Solandelacton A Solandelacton C: 19,20 Solandelacton E: 4,5 Solandelacton G: 4,5, 19,20 Solandelacton B Solandelacton D: 19,20 Solandelacton F: 4,5 Solandelacton H: 4,5, 19,20 Halicholacton Neohalicholacton: 17,18 - xylipine: oxidierte Fettsäuren - 2 Subfamilien der Solandelactone Unterschied: Stereochemie am C(11) - verschiedene Anzahl Doppelbindungen im 8-gliedrigen Lactonring und in der Seitenkette - Gemeinsamkeit mit anderen marinen xylipinen: Lactonring und aliphatische Seitenkette über trans-disubstituierten Cyclopropanring verknüpft - Unterschied: Anzahl C-Atome, Größe des Lactonrings, verschiedene Stereochemie an den 5 Stereozentren Constanolacton A: R 1 = H, R 2 = H Constanolacton B: R 1 = H, R 2 = H Y. Seo, K. Cho, J.-R. Rho, J. Shin, B.-M. Kwon, Tetrahedron, 1996, 52, ; J. White, W.H.C. Martin, C. Lincoln, J. Yang, J. rg. Lett., 2007, 9, ; H. Niwa, K. Wakamatsu, K. Yamada, Tetrahedron Lett., 1989, 30, TU Dresden, Solandelactone E Folie 3
4 1. Einleitung 1996 erstmalige Isolierung aus Solanderia secunda Hydroid/Polyp vor der Küste Südkoreas Solandelactone C, D, G inhibieren Farnesylproteintransferase FPTase überträgt Farnesylrest auf Rasprotein wichtiges Protein im Signaltransduktionweg Ras wird an Zellmembran gebunden unkontrolliertes Zellwachstum & Tumorbildung etwa 30% aller Tumorzellen enthalten mutiertes Ras Kontrolle der Ras-vermittelten Signaltransduktion mit FPTase-Inhibitoren natürliche Quellen limitiert gesteigertes Interesse wegen anspruchsvoller Struktur und biologischer Aktivität 2007 erste Totalsynthese Solandelactone E & F durch White et. al. Y. Seo, K. Cho, J.-R. Rho, J. Shin, B.-M. Kwon, Tetrahedron, 1996, 52, ; J. White, W.H.C. Martin, C. Lincoln, J. Yang, J. rg. Lett., 2007, 9, ; S.-H. Lee, M.-J. Kim, S.H. Bok, H. Lee, B.-M. Kwon, J. Shin, Y. Seo, J. rg. Chem.,1998, 63, ; TU Dresden, Solandelactone E Folie 4
5 2. Retrosynthese Wichtig für Syntheseweg: maximale stereochemische Kontrolle bei guter Ausbeute TU Dresden, Solandelactone E Folie 5
6 3.1 Darstellung des zentralen C(6)-C(15) Kerns Horner-Wadsworth-Emmons-lefinierung Triethyl-4-phosphonocrotonat siehe Carbonylolefinierungsvortrag TU Dresden, Solandelactone E Folie 6
7 3.1 Darstellung des zentralen C(6)-C(15) Kerns Cyclopropanierung TU Dresden, Solandelactone E Folie 7
8 3.1 Darstellung des zentralen C(6)-C(15) Kerns Simmons-Smith-Reagenzien: klassisch Furukawa-Carbenoid Sawada-(Denmark-)Carbenoid R. Brückner, Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004, 117 TU Dresden, Solandelactone E Folie 8
9 3.1 Darstellung des zentralen C(6)-C(15) Kerns Mechanismus: Vermutlich Schlenk-Gleichgewicht Nachweis der Stereochemie mittels Röntgenanalyse am Einkristall des Carbamats: Autorenkollektiv, rganikum, 22. Auflage, Wiley-VCH, 2004, 327 ; T. Morikawa, H. Sasaki, R. Hanai, A. Shibuya, T. Taguchi, J. rg. Chem., 1994, 59, ; J. Nishimura, J. Furukawa, N. Kawabata, M. Kitayama, Tetrahedron, 1971, 27, ; T. K. Dargel, W. Koch, J. Chem. Soc., Perkin Trans. 2, 1996, TU Dresden, Solandelactone E Folie 9
10 3.1 Darstellung des zentralen C(6)-C(15) Kerns DIBAL-Reduktion TU Dresden, Solandelactone E Folie 10
11 3.1 Darstellung des zentralen C(6)-C(15) Kerns Mechanismus: R. Brückner, Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004, 788 TU Dresden, Solandelactone E Folie 11
12 3.1 Darstellung des zentralen C(6)-C(15) Kerns TPAP-NM-xidation TU Dresden, Solandelactone E Folie 12
13 3.1 Darstellung des zentralen C(6)-C(15) Kerns Mechanismus: Rückgewinnung des Katalysators: R. Brückner, Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004, 747 TU Dresden, Solandelactone E Folie 13
14 3.1 Darstellung des zentralen C(6)-C(15) Kerns Horner-Wadsworth-Emmons-lefinierung Ethoxycarbonylmethanphosphonsäurediethylester siehe Carbonylolefinierungsvortrag TU Dresden, Solandelactone E Folie 14
15 3.1 Darstellung des zentralen C(6)-C(15) Kerns Asymmetrische Dihydroxylierung H R 1 = R 2 = Et 2 C H TU Dresden, Solandelactone E Folie 15
16 3.1 Darstellung des zentralen C(6)-C(15) Kerns kommerziell erhältlicher AD-Mix: 0,2 mol-% K 2 s 2 (H) 4 (Kaliumosmat-(VI)-dihydrat), 1 mol-% (DHQ) 2 -PHAL (für AD-Mix α) bzw. (DHQD) 2 -PHAL (für AD-Mix β), 3 eq. K 3 Fe[CN] 6, 3 eq. K 2 C 3 geringer Umsatz selbst nach 48 h Reaktionszeit modifizierter AD-Mix mit 8 mol-% (DHQ) 2 -PHAL bzw. (DHQD) 2 -PHAL, 5 mol-% K 2 s 2 (H) 4, 3 eq. K 3 Fe[CN] 6 und 3 eq. K 2 C 3 erzielte höheren Umsatz (DHQ) 2 -PHAL (dihydroquinine phthalazine) (DHQD) 2 -PHAL (dihydroquinidine phthalazine) Kaliumosmat-(VI)-dihydrat K.B. Sharpless, W. Amberg, Y.L. Bennani, G.A. Crispino, J. Hartung, K.S. Jeong, H.L. Kwong, K. Morikawa, Z.M. Wang, J. rg. Chem., 1992, 57 (10), TU Dresden, Solandelactone E Folie 16
17 3.1 Darstellung des zentralen C(6)-C(15) Kerns Sharpless-Modell H.C. Kolb, M.S. VanNieuwenhze, K.B. Sharpless, Chem. Rev., 1994, 94, TU Dresden, Solandelactone E Folie 17
18 3.1 Darstellung des zentralen C(6)-C(15) Kerns Mechanismusvorschlag: R 2 s L L s R 1 L s R 2 L s R 2 R 2 R 1 R 1 R 2 R 1 R 1 s R 2 R 1 s L L s R 1 R 2 R 1 R 2 H H s H H 2- L s R 1 R 2 2 Fe(CN) H + 2 Fe(CN) 6 3- R 1 H H R 2 H H H H H R 2 R 1 H 2 H H 2 A.J. DelMonte, J. Haller, K.N. Houk, K.B. Sharpless, D.A. Singleton, T. Strassner, A.A. Thomas, J. Am. Chem. Soc., 1997, 119 (41), TU Dresden, Solandelactone E Folie 18
19 3.1 Darstellung des zentralen C(6)-C(15) Kerns Vorteile der asymmetrischen Dihydroxylierung: da keine dirigierenden funktionellen Gruppen benötigt werden, ist die Reaktion auf viele Substrate anwendbar die Verwendung von enantiomerenreinen Liganden beschleunigt zum einen die Reaktion und führt zum anderen zu einer hoch enantioselektiven Dihydroxylierung die Liganden (tertiäre Amine) bilden mit dem smiumtetroxid einen sehr reaktiven smiumtetroxid/additiv-komplex die Reaktion wird in einem 2-Phasensystem aus t-butanol:wasser = 1:1 durchgeführt, wodurch ein sekundärer Katalysecyclus, in dem Diole mit geringem Enantiomerenüberschuss entstehen, unterdrückt wird die Zugabe von Methansulfonamid beschleunigt die Hydrolyse des entstehenden smatesters und ermöglicht so hohe kat. Umsätze H.C. Kolb, M.S. VanNieuwenhze, K.B. Sharpless, Chem. Rev., 1994, 94, TU Dresden, Solandelactone E Folie 19
20 3.2 Konstruktion des C(12)-C(22) Segments Anbringen der TBS-Schutzgruppe siehe Schutzgruppenvortrag TU Dresden, Solandelactone E Folie 20
21 3.2 Konstruktion des C(12)-C(22) Segments DIBAL-Reduktion TU Dresden, Solandelactone E Folie 21
22 3.2 Konstruktion des C(12)-C(22) Segments Redoxkondensation nach Mukaiyama TU Dresden, Solandelactone E Folie 22
23 3.2 Konstruktion des C(12)-C(22) Segments Mechanismus: R. Brückner, Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004, 99 TU Dresden, Solandelactone E Folie 23
24 3.2 Konstruktion des C(12)-C(22) Segments S N 2-Reaktion TU Dresden, Solandelactone E Folie 24
25 3.2 Konstruktion des C(12)-C(22) Segments Reagenzdarstellung Mechanismus: Br H n-pent C C Li H TBS H TBS - LiBr TBS TBS H n-pent C C Li Br via H TBS TBS H K. Peter, C. Vollhardt, N.E. Schore, rganische Chemie, 4. Auflage, WILEY-VCH, 2005, 876 TU Dresden, Solandelactone E Folie 25
26 3.3 Konstruktion des C(1)-C(7) Lactons Hydrolyse siehe Schutzgruppenvortrag TU Dresden, Solandelactone E Folie 26
27 3.3 Konstruktion des C(1)-C(7) Lactons Epoxidbildung TU Dresden, Solandelactone E Folie 27
28 3.3 Konstruktion des C(1)-C(7) Lactons Mechanismus: laut Quelle alternativer Vorschlag A.B. Smith III., V.A. Doughty, C. Sfouggatakis, C.S. Bennett, J. Koyanagi, M. Takeuchi, rg Lett, 2002, 4, ; D.R. Ilicks, B. Fraser-Raid, Synthesis, 1974, 203 ; J. Meinwald, S.S. Labana, L.L. Labana, G.H. Wahl, Jr. Tetrahedron Lett., 1965,1789 TU Dresden, Solandelactone E Folie 28
29 3.3 Konstruktion des C(1)-C(7) Lactons Epoxidöffnung TU Dresden, Solandelactone E Folie 29
30 3.3 Konstruktion des C(1)-C(7) Lactons Mechanismusvorschlag: M. Yamaguchi, I. Hirao, Tetrahedron Lett., 1983, 24, 391 TU Dresden, Solandelactone E Folie 30
31 3.3 Konstruktion des C(1)-C(7) Lactons DMAP-katalysierte Veresterung siehe Schutzgruppenvortrag TU Dresden, Solandelactone E Folie 31
32 3.3 Konstruktion des C(1)-C(7) Lactons Saure Entschützung von THP siehe Schutzgruppenvortrag TU Dresden, Solandelactone E Folie 32
33 3.3 Konstruktion des C(1)-C(7) Lactons Heterogene Lindlar-Hydrierung TU Dresden, Solandelactone E Folie 33
34 3.3 Konstruktion des C(1)-C(7) Lactons Mechanismus: R. Brückner, Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004, 800ff. TU Dresden, Solandelactone E Folie 34
35 3.3 Konstruktion des C(1)-C(7) Lactons Parikh-Doering-xidation TU Dresden, Solandelactone E Folie 35
36 3.3 Konstruktion des C(1)-C(7) Lactons Mechanismus: H S S R C H H N + Et 3 N R H C + S + HS 4 Et 3 NH N R. Brückner, Reaktionsmechanismen, 3. Auflage, Spektrum Akademischer Verlag, 2004, 745 TU Dresden, Solandelactone E Folie 36
37 3.3 Konstruktion des C(1)-C(7) Lactons Pinnick-xidation TU Dresden, Solandelactone E Folie 37
38 3.3 Konstruktion des C(1)-C(7) Lactons Esterspaltung siehe Schutzgruppenvortrag TU Dresden, Solandelactone E Folie 38
39 3.3 Konstruktion des C(1)-C(7) Lactons Yamaguchi-Cyclisierung TU Dresden, Solandelactone E Folie 39
40 3.3 Konstruktion des C(1)-C(7) Lactons Mechanismus: R H Cl C Cl Cl + Et 3 NH Cl N N J. Inanaga, K. Hirata, H. Saeki, T. Katsuki, M. Yamaguchi, Bull. Cem. Soc. Jpn., 1979, 52, TU Dresden, Solandelactone E Folie 40
41 3.4 Abschluss der Synthese Abspaltung der TBS-Schutzgruppen siehe Schutzgruppenvortrag TU Dresden, Solandelactone E Folie 41
42 3.4 Abschluss der Synthese Bildung einer Selenspezies nach Grieco und [2,3]-sigmatrope Umlagerung TU Dresden, Solandelactone E Folie 42
43 3.4 Abschluss der Synthese Bildung einer Selenspezies nach Grieco P.A. Grieco et al, J. rg. Chem., 1976, 41, 8, TU Dresden, Solandelactone E Folie 43
44 3.4 Abschluss der Synthese Mechanismusvorschlag: P.A. Grieco et al, J. rg. Chem., 1976, 41, 8, TU Dresden, Solandelactone E Folie 44
45 3.4 Abschluss der Synthese [2,3]-sigmatrope Umlagerung P.A. Grieco et al, J. rg. Chem., 1976, 41, 8, TU Dresden, Solandelactone E Folie 45
46 3.4 Abschluss der Synthese Mechanismusvorschlag: P.A. Grieco et al, J. rg. Chem., 1976, 41, 8, TU Dresden, Solandelactone E Folie 46
47 4. Strukturrevision und Zusammenfassung Solandelacton E Solandelacton F TU Dresden, Solandelactone E Folie 47
48 4. Strukturrevision und Zusammenfassung Strukturrevision: - Vermutung: erste Totalsynthese des Solandelacton F - jedoch Unstimmigkeiten beim Vergleich der gemessenen 1 H-NMR und 13 C-NMR Spektren mit den Spektren des riginal Papers von Prof. Shin 1 - alternativer Bildungsmechanismus des selbst hergestellten Solandelacton (letzter Schritt 5-stufig) und damit Bestätigung der eigenen Messwerte - Rücksprache mit Prof. Shin 1 zwecks Strukturrevision, die später durch J. White 2 et.al. zusätzlich belegt werden konnte - damit: Inversion der Stereochemie des C(11)-Atoms bei allen gefundenen Solandelactonen ( R S ) [1] Y. Seo, K. Cho, J.-R. Rho, J. Shin, B.-M. Kwon, Tetrahedron, 1996, 52, [2] J. White, W.H.C. Martin, C. Lincoln, J. Yang, J. rg. Lett., 2007, 9, TU Dresden, Solandelactone E Folie 48
49 4. Strukturrevision und Zusammenfassung Zusammenfassung: - Totalsynthese in 23 Schritten - klares Öl - 0,6% Gesamtausbeute - Auswahl von Mechanismen mit hoher Ausbeute - Rückgewinnung von Edukten (aus Nebenprodukten) um Ausbeute zu steigern besonders erwähnenswert: - diastereoselektive und acetaldirigierte Cyclopropanierung eines Elektronenmangelolefins - diastereoselektive bzw. enantioselektive Dihydroxylierung - stereoselektiver 1,3-Chiralitätstransfer durch [2,3]-sigmatrope Umlagerung mit einem allylischen Selenoxid TU Dresden, Solandelactone E Folie 49
50 5. Reaktionsübersicht Seite Schutzgruppenchemie: Einführung der TBS-Gruppen 20 Saure Acetalhydrolyse 26 Veresterung (mit DMAP) 31 Saure THP-Spaltung 32 Esterspaltung 38 Abspaltung der TBS-Gruppen 41 xidation: mit TPAP (und NM) 12 Parikh-Doering 35 Pinnick 37 Reduktion: mit DIBAL 10/21 Lindlar-Hydrierung 33 Seite Nucleophile Substitution: Redoxkondensation nach Mukaiyama 22 S N 2 mit Acetylid 24 Epoxidbildung 27 Epoxidöffnung 29 Bildung der Selenspezies nach Grieco 43 Reaktion am Carboxylkohlenstoff: Yamaguchi-Cyclisierung 39 Reaktion am Carbonylkohlenstoff: HWE-lefinierung 6/14 Umlagerung: [2,3]-sigmatrope Umlagerung 45 Addition an Mehrfachbindung: Simmons-Smith-Reaktion 7 Asymmetrische Dihydroxylierung 15 TU Dresden, Solandelactone E Folie 50
51 6. Abkürzungsverzeichnis Ac AD aq. Bu i-bu n-bu t-bu DCM (DHQ) 2 -PHAL (DHQD) 2 -PHAL DIBAL DMAP DMF DMS Et eq ff Im kat. LDA Me NM n-pent Ph Pr i-pr RT TBAF TBS TFA THF THP TPAP p-ts Acetyl Asymmetrische Dihydroxylierung wässrig Butyl iso-butyl n-butyl tert-butyl Dichlormethan Dihydroquinine-phthalazine Dihydroquinidine-phthalazine Diisobutylaluminiumhydrid 4-(Dimethylamino)-pyridin Dimethylformamid Dimethylsulfoxid Ethyl Äquivalente folgende Imidazol katalytisch Lithiumdiisopropylamid Methyl N-Methylmorpholin-N-oxid n-pentan Phenyl Propyl iso-propyl Raumtemperatur Tetrabutylammoniumfluorid tert-butyldimethylsilyl Trifluoressigsäure Tetrahydrofuran Tetrahydropyryl Tetrapropylammoniumperruthenat para-tosyl TU Dresden, Solandelactone E Folie 51
9. Syntheseübung WS 2006/2007. Thapsigargine
 9. Syntheseübung WS 2006/2007 Thapsigargine isoliert aus der mediterranen Pflanze Thapsia garganica R 1 R 2 Thapsigargin Tribolid Nortribolid Thapsivillosin R 1 = ctanoyl, R 2 = Butanoat R 1 =, R 2 = (S)-2-thylbutanoat
9. Syntheseübung WS 2006/2007 Thapsigargine isoliert aus der mediterranen Pflanze Thapsia garganica R 1 R 2 Thapsigargin Tribolid Nortribolid Thapsivillosin R 1 = ctanoyl, R 2 = Butanoat R 1 =, R 2 = (S)-2-thylbutanoat
Technische Universität Dresden Institut für Organische Chemie Organisch-chemisches Grundpraktikum. Aufgabe Max. Punkte Punkte
 Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Name: Praktikum SS 003: Platz-Nr.: Assistent: Nachschreiber: Praktikum SS Platz-Nr.: Aufgabe 5 6-6 Max. Punkte 33 33 3 100 Punkte Zeichnen Sie sorgfältig und richtig! Die Fähigkeit richtig zeichnen zu
Julia-Colonna- Epoxidierung Nadzeya Sigle Johanna Lauer
 Julia-Colonna- Epoxidierung 04.06.2009 Nadzeya Sigle Johanna Lauer Überblick Epoxide und Varianten der erstellung Asymmetrische Variante: Julia-Colonna-Epoxidierung Allgemeine Darstellung als 3-asenreaktion
Julia-Colonna- Epoxidierung 04.06.2009 Nadzeya Sigle Johanna Lauer Überblick Epoxide und Varianten der erstellung Asymmetrische Variante: Julia-Colonna-Epoxidierung Allgemeine Darstellung als 3-asenreaktion
Klausur WS 03/04. 1 Schutzgruppen 10
 Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
Institut für rganische Chemie rganisch-chemisches Fortgeschrittenenpraktikum http://www.chm.tu-dresden.de/organik/hierse/c_fp.htm Name: Erfolgreiche Teilnahme am Praktikum: WS Erfolgreiche Teilnahme am
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung
 Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
Technische Universität Dresden Fachrichtung Chemie Organisch-chemisches Praktikum zum Modul OCII
 rganisch-chemisches Praktikum zum Modul CII http://www.chm.tu-dresden.de/oc2/modul_cii.shtml Name: Matrikelnummer: Fachsemester: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom Praktikumsteilnehmer
rganisch-chemisches Praktikum zum Modul CII http://www.chm.tu-dresden.de/oc2/modul_cii.shtml Name: Matrikelnummer: Fachsemester: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom Praktikumsteilnehmer
Name: Matrikelnummer: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom
 Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
Übung zur Vorlesung Organische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 O 2 N
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Aufg Σ Note max erz.
 1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, SS 08 Klausur 1, 9. Mai 2008 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift: Punkteverteilung
1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, SS 08 Klausur 1, 9. Mai 2008 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift: Punkteverteilung
Organokatalyse durch asymmetrische
 rganokatalyse durch asymmetrische Protonierung? R Nachrichten aus der Chemie 2008, 56, 73-76. P H R Vortragsseminar des FP WS 2008/2009 04.12.08 Themenübersicht Vortragsseminar des FP WS 2008/2009 04.12.08
rganokatalyse durch asymmetrische Protonierung? R Nachrichten aus der Chemie 2008, 56, 73-76. P H R Vortragsseminar des FP WS 2008/2009 04.12.08 Themenübersicht Vortragsseminar des FP WS 2008/2009 04.12.08
Organische Chemie III
 rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 13.06.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 13.06.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Entschlüsseln Sie die Bedeutung der folgenden Abkürzungen: PMB tbu TBS Ph Ts Bz TPS MOM Bn Ms TES
 rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
rganisch-chemisches Grundpraktikum Leseauftrag: rganikum (23. Auflage): Kapitel D3 Brückner (3. Auflage): Kapitel 4 Leseempfehlung: Carey, Sundberg (4. engl. Auflage): Band A, Kapitel 1(!) und 6 P. Y.
Totalsynthese von (+)-Neopeltolid nach Sasaki et al.
 Totalsynthese von ()-eopeltolid nach Sasaki et al. S. Freitag, A. Wolf, P. Strubel, K. Schnaars,. Zimmermann. Fuwa, A.Saito, M. Sasaki, Angew. Chemie 2010, 122, 3105-3108 1. Allgemeines Entdeckung 2007
Totalsynthese von ()-eopeltolid nach Sasaki et al. S. Freitag, A. Wolf, P. Strubel, K. Schnaars,. Zimmermann. Fuwa, A.Saito, M. Sasaki, Angew. Chemie 2010, 122, 3105-3108 1. Allgemeines Entdeckung 2007
Moderne Aldol-Reaktionen
 Moderne Aldol-Reaktionen Katrina Brendle Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktium KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum in der Helmholtz-Gemeinschaft
Moderne Aldol-Reaktionen Katrina Brendle Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktium KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum in der Helmholtz-Gemeinschaft
Suzuki-Reaktion. - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert
 Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
Shvo s Katalysator. Von Michaela Märken und Matthias Hussong
 Shvo s Katalysator Von Michaela Märken und Inhalt Allgemeines und Struktur Entdeckung Synthese Anwendung Mechanismen analoge Systeme Y.Shvo et al. J. Am. Chem. Soc. 1986, 108,7400 Allgemeine Daten kristalliner
Shvo s Katalysator Von Michaela Märken und Inhalt Allgemeines und Struktur Entdeckung Synthese Anwendung Mechanismen analoge Systeme Y.Shvo et al. J. Am. Chem. Soc. 1986, 108,7400 Allgemeine Daten kristalliner
Lithium. Seminarvortrag am von Josefine Martin und Bettina Nägele
 Lithium Seminarvortrag am 22.1.2009 von Josefine Martin und Bettina ägele 2 Gliederung 1. Einführung 2. organische Synthese 3. Verwendung von Lithiumorganylen in der organischen Synthese 4. Literatur 3
Lithium Seminarvortrag am 22.1.2009 von Josefine Martin und Bettina ägele 2 Gliederung 1. Einführung 2. organische Synthese 3. Verwendung von Lithiumorganylen in der organischen Synthese 4. Literatur 3
Organische Chemie III
 1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
7 Reaktionen von Carbonylverbindungen
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) 7 eaktionen von Carbonylverbindungen 7.1 Ketone/Aldehyde und eteroatomnucleophile 7.1-70 Vervollständigen Sie die folgenden
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) 7 eaktionen von Carbonylverbindungen 7.1 Ketone/Aldehyde und eteroatomnucleophile 7.1-70 Vervollständigen Sie die folgenden
Organische Synthese (OCIII)
 rganische Synthese (CIII) Sommersemester 2005 Technische Universität München Klausur am 14.10.2005 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
rganische Synthese (CIII) Sommersemester 2005 Technische Universität München Klausur am 14.10.2005 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
Künstliche Peptide aus b-aminosäuren
 Künstliche Peptide aus b-aminosäuren Seminar zum CF-Praktikum WS 03/04 Übersicht Struktur und omenklatur von ß-Aminosäuren Synthese von ß-Aminosäuren Methoden zur Peptidsynthese Schutzgruppen Aktivierung
Künstliche Peptide aus b-aminosäuren Seminar zum CF-Praktikum WS 03/04 Übersicht Struktur und omenklatur von ß-Aminosäuren Synthese von ß-Aminosäuren Methoden zur Peptidsynthese Schutzgruppen Aktivierung
Aufg Σ Note max erz.
 1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, WS 07/08 Klausur 1, 23. November 2007 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift:
1 Institut für rganische Chemie der TU Braunschweig Prof. Dr. Thomas Lindel Grundpraktikum rganische Chemie, WS 07/08 Klausur 1, 23. November 2007 Name: Vorname: Matrikel-Nr.: Studienfach: Unterschrift:
Organische Chemie III
 rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 09.08.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2006 Technische Universität München Klausur am 09.08.2006 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Träger für die Festphasensynthese
 - 1 - Träger für die Festphasensynthese Vortrag im ahmen des Seminars zum organisch-chemischen Fortgeschrittenenpraktikum 5.2.2007 Matthias Ernst - 2 - Gliederung 1. Festphasensynthese Konzepte, Schema,
- 1 - Träger für die Festphasensynthese Vortrag im ahmen des Seminars zum organisch-chemischen Fortgeschrittenenpraktikum 5.2.2007 Matthias Ernst - 2 - Gliederung 1. Festphasensynthese Konzepte, Schema,
Kapitel 5: Additionen an C-C- Mehrfachbindungen
 Kapitel 5: Additionen an C-C- hrfachbindungen» Theorie, Konzepte, chanismus - MO Theorie: elektrophile Addition (Brom/Olefin) und [2+4]- Cycloaddition (Diels-Alder-Reaktion) - Bromierung der Doppelbindung:
Kapitel 5: Additionen an C-C- hrfachbindungen» Theorie, Konzepte, chanismus - MO Theorie: elektrophile Addition (Brom/Olefin) und [2+4]- Cycloaddition (Diels-Alder-Reaktion) - Bromierung der Doppelbindung:
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Kapitel 4: Eliminierung - Übersicht
 » Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
» Reaktionstypen - 1,1-, 1,2-, 1,3-, 1,4-Eliminierung (α-, β-, γ-, δ- Eliminierung), thermische Fragmentierung, cis-eliminierung» Regel - Eliminierung wird begünstigt durch hohe Temperatur, starke Basen,
1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Palladiumkatalysierte Kreuzkupplungen in der Totalsynthese. Brigitte Czepukojc, Anton Bayer
 Kreuzkupplungen in der Totalsynthese Brigitte Czepukojc, Anton Bayer Kreuzkupplungnen in der Totalsynthese 2 Inhalt Einleitung chanismen, Syntheserouten und ausgewählte Beispiele eck-reaktionen Stille-Reaktionen
Kreuzkupplungen in der Totalsynthese Brigitte Czepukojc, Anton Bayer Kreuzkupplungnen in der Totalsynthese 2 Inhalt Einleitung chanismen, Syntheserouten und ausgewählte Beispiele eck-reaktionen Stille-Reaktionen
1.) Organometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte).
 Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
Lösung zur Übung 7 1.) rganometallverbindungen sind wichtige Reagenzien für C C-Bindungsbildungen. Der am Metall gebundene Kohlenstoff ist nukleophil (10 Punkte). a) para-bromtoluol A wird mit n-butyllithium
b) Zeichnen Sie die beiden möglichen Isomere der Aldol-Kondensation und bezeichnen Sie die Stereochemie der Produkte.
 1. Aufgabe a) Formulieren Sie den Mechanismus der durch ydroxid-ionen katalysierten Aldol- Addition und Aldol-Kondensation zwischen den beiden unten gezeigten Molekülen. + 2 2 b) Zeichnen Sie die beiden
1. Aufgabe a) Formulieren Sie den Mechanismus der durch ydroxid-ionen katalysierten Aldol- Addition und Aldol-Kondensation zwischen den beiden unten gezeigten Molekülen. + 2 2 b) Zeichnen Sie die beiden
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Schriftliche Sessionsprüfung Organische Chemie. Teilprüfung OC I F. Diederich, C. Schaack. Herbstsemester 2015
 Schriftliche Sessionsprüfung rganische Chemie Teilprüfung C I F. Diederich, C. Schaack erbstsemester 2015 Bitte überprüfen Sie: der Prüfungsbogen beinhaltet 5 Aufgaben auf 8 Seiten. Bitte beachten Sie:
Schriftliche Sessionsprüfung rganische Chemie Teilprüfung C I F. Diederich, C. Schaack erbstsemester 2015 Bitte überprüfen Sie: der Prüfungsbogen beinhaltet 5 Aufgaben auf 8 Seiten. Bitte beachten Sie:
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
3 Synthese. 3.1 Synthese: Bedeutung, Methodik und Planung
 3 Synthese 3.1 Synthese: Bedeutung, Methodik und Planung folie245 3.2 Retrosynthese: Zielmoleküle ( target molecules, TM Zielmoleküle, ) und Retrons: a. Erkennung und Klassifizierung von funktionellen
3 Synthese 3.1 Synthese: Bedeutung, Methodik und Planung folie245 3.2 Retrosynthese: Zielmoleküle ( target molecules, TM Zielmoleküle, ) und Retrons: a. Erkennung und Klassifizierung von funktionellen
a) Vervollständigen Sie das Freie-Enthalpie-Diagramm der Reaktion, indem Sie den zutreffenden Buchstaben A D in die leeren Kreise setzen:
 1. Aufgabe Für die Reaktion R-X + u R-u + X findet man folgendes Reaktionsdiagramm: a) Vervollständigen Sie das Freie-Enthalpie-Diagramm der Reaktion, indem Sie den zutreffenden Buchstaben A D in die leeren
1. Aufgabe Für die Reaktion R-X + u R-u + X findet man folgendes Reaktionsdiagramm: a) Vervollständigen Sie das Freie-Enthalpie-Diagramm der Reaktion, indem Sie den zutreffenden Buchstaben A D in die leeren
Nucleophile Katalyse am Beispiel von 4-(Dimethylamino)pyridin
 Nucleophile Katalyse am Beispiel von 4-(Dimethylamino)pyridin Matthias Kellermeier Einordnung der nucleophilen Katalyse und Beispiele nucleophiler Katalysatoren Nucleophile Katalyse bislang wenig erforscht;
Nucleophile Katalyse am Beispiel von 4-(Dimethylamino)pyridin Matthias Kellermeier Einordnung der nucleophilen Katalyse und Beispiele nucleophiler Katalysatoren Nucleophile Katalyse bislang wenig erforscht;
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann
 Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Synthesemethoden in der Organischen Chemie. Ulf Diederichsen
 Synthesemethoden in der Organischen Chemie Ulf Diederichsen Institut für Organische und Biomolekulare Chemie, Georg-August-Universität Göttingen, Tammannstr. 2, 37077 Göttingen, Email: udieder@gwdg.de
Synthesemethoden in der Organischen Chemie Ulf Diederichsen Institut für Organische und Biomolekulare Chemie, Georg-August-Universität Göttingen, Tammannstr. 2, 37077 Göttingen, Email: udieder@gwdg.de
As. Strecker ist weniger umständlich als fraktionierte Kristallisation
 As. Strecker ist weniger umständlich als fraktionierte Kristallisation A. Geyer C-4 2015 (S)-tert-Leucin hat zahlreiche Anwendungen xazolinliganden für die as. Synthese (S)-t-BuPHX Frage: Wie würden Sie
As. Strecker ist weniger umständlich als fraktionierte Kristallisation A. Geyer C-4 2015 (S)-tert-Leucin hat zahlreiche Anwendungen xazolinliganden für die as. Synthese (S)-t-BuPHX Frage: Wie würden Sie
Klausur zur Vorlesung OCII Reaktionsmechanismen WS 2008/2009
 liver Reiser, Institut für rganische Chemie der Universität Regensburg Klausur zur Vorlesung CII Reaktionsmechanismen WS 008/009 ame Matr.r. 3 4 5 6 a+b 6c 6d 7 8 Σ ote xxoooxxx 0 0 0 0 0 + 3 5 0 0 00+
liver Reiser, Institut für rganische Chemie der Universität Regensburg Klausur zur Vorlesung CII Reaktionsmechanismen WS 008/009 ame Matr.r. 3 4 5 6 a+b 6c 6d 7 8 Σ ote xxoooxxx 0 0 0 0 0 + 3 5 0 0 00+
+ MnO MnO 3. Oxidierbarkeit primärer, sekundärer und tertiärer Alkohole. Chemikalien. Materialien
 DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
DaChS xidierbarkeit primärer, sekundärer und tertiärer Alkohole 1 Versuch Nr. 005 xidierbarkeit primärer, sekundärer und tertiärer Alkohole C 3 Mn - 4 (violett) 3 C Mn 2 (braun) 3 C C 3 Mn - 4 (violett)
Festphasenpeptidsynthese und kombinatorische Bibliotheken
 Festphasenpeptidsynthese und kombinatorische Bibliotheken Christoph Dräger 20.06.2011 Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktikum KIT Universität des Landes Baden-Württemberg
Festphasenpeptidsynthese und kombinatorische Bibliotheken Christoph Dräger 20.06.2011 Institut für Organische Chemie Seminar zum Fortgeschrittenenpraktikum KIT Universität des Landes Baden-Württemberg
Organische Chemie II Reaktivität
 1. Klausur zur Vorlesung rganische Chemie Reaktivität Wintersemester 2008/09 Klausur am 12.12.2008 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer) 1. Teilnahme 1. Wiederholung
1. Klausur zur Vorlesung rganische Chemie Reaktivität Wintersemester 2008/09 Klausur am 12.12.2008 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer) 1. Teilnahme 1. Wiederholung
Chirale Phospholanefür die Synthese enantiomerenreiner Produkte
 Chirale Phospholanefür die Synthese enantiomerenreiner Produkte Dr. Jens Holz Themenleiter Leibniz-Institut für Katalyse e.v. (LIKAT Rostock) Inhalt Asymmetrische Hydrierungen in der Industrie Entwicklung
Chirale Phospholanefür die Synthese enantiomerenreiner Produkte Dr. Jens Holz Themenleiter Leibniz-Institut für Katalyse e.v. (LIKAT Rostock) Inhalt Asymmetrische Hydrierungen in der Industrie Entwicklung
Zweite Klausur zur Vorlesung Grundlagen der Organischen Chemie
 Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Prof. Dr. Jens Christoffers 28. Februar 2011 Universität ldenburg Zweite Klausur zur Vorlesung Grundlagen der rganischen Chemie für Studierende der Chemie (Fach-Bachelor und Zwei-Fächer-Bachelor, Wert:
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Organische Chemie III
 1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 15.10.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
1 rganische Chemie III Sommersemester 2003 Technische Universität München Klausur am 15.10.2003 ame; Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
Organische Chemie. Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter!
 Organische Chemie Name: Fachprüfung Vorname: 11. März 2002, 8 00-10 00 h Matr.-Nr.: Raum 204 + 206 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Organische Chemie Name: Fachprüfung Vorname: 11. März 2002, 8 00-10 00 h Matr.-Nr.: Raum 204 + 206 Schreiben Sie bitte Ihre Lösungen ausschließlich auf diese Aufgabenblätter! Jede Aufgabe wird mit 10 Punkten
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Technische Universität Dresden Fachrichtung Chemie Modul OC II
 Modul C II http://www.chm.tu-dresden.de/oc2/modul_cii.shtml ame: Matrikelnummer: achsemester Studienfach: LC Chemie-Bachelor Lehramt-Master Lehramt-Staatsex. Praktikumsteilnehmer und achschreiber Praktikumsteilnahme
Modul C II http://www.chm.tu-dresden.de/oc2/modul_cii.shtml ame: Matrikelnummer: achsemester Studienfach: LC Chemie-Bachelor Lehramt-Master Lehramt-Staatsex. Praktikumsteilnehmer und achschreiber Praktikumsteilnahme
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
I. Theoretischer Teil. 2. Synthese aryl-substituierter Cyclopentadiene Praktischer Nutzen von Pentaarylcyclopentadienderivaten 4
 Inhaltsverzeichnis I. Theoretischer Teil 1. Einleitung und Problemstellung 1 2. Synthese aryl-substituierter Cyclopentadiene 4 2.1. Praktischer Nutzen von Pentaarylcyclopentadienderivaten 4 2.2. Palladium-katalysierte
Inhaltsverzeichnis I. Theoretischer Teil 1. Einleitung und Problemstellung 1 2. Synthese aryl-substituierter Cyclopentadiene 4 2.1. Praktischer Nutzen von Pentaarylcyclopentadienderivaten 4 2.2. Palladium-katalysierte
Schutzgruppen in der organischen Synthesechemie
 Schutzgruppen in der organischen Synthesechemie Warum Schutzgruppen? Umgehen die Inkompatibilität funktioneller Gruppen bei der Synthese komplexer organischer Strukturen. Schutzgruppen sollen eine funktionelle
Schutzgruppen in der organischen Synthesechemie Warum Schutzgruppen? Umgehen die Inkompatibilität funktioneller Gruppen bei der Synthese komplexer organischer Strukturen. Schutzgruppen sollen eine funktionelle
Neuere organisch-chemische Synthesemethoden
 euere organisch-chemische Synthesemethoden orst Kunz Institut für rganische Chemie Universität Mainz aturstoffsynthese in den 60/70iger Jahren: Die technische Synthese von Vitamin A der BASF orst Pommer,
euere organisch-chemische Synthesemethoden orst Kunz Institut für rganische Chemie Universität Mainz aturstoffsynthese in den 60/70iger Jahren: Die technische Synthese von Vitamin A der BASF orst Pommer,
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
3 Eliminierungen. 3.1 Begriffe und mechanistische Einteilung. Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül
 3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie)
 Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie) Nachklausur 18.03.2016 Zeit: 120 min Seite 1 Seite 2 Seite 3 Seite 4 Seite 5 Seite 6 Seite 7 / 18 / 18 / 10 / 10 / 19 / 15 / 10 Gesamt: Note:
Modulabschlussprüfung Chemie für LA-Biologen (o. HF Chemie) Nachklausur 18.03.2016 Zeit: 120 min Seite 1 Seite 2 Seite 3 Seite 4 Seite 5 Seite 6 Seite 7 / 18 / 18 / 10 / 10 / 19 / 15 / 10 Gesamt: Note:
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1
 Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Prof. Dr. J. Gmehling Universität Oldenburg, Institut für Reine und Angewandte Chemie, Technische Chemie, D Oldenburg
 Abschlussbericht an die Max-Buchner-Forschungsstiftung (FKZ: 277) Messung der Gleichgewichtslage und der Kinetik ausgewählter Veretherungsreaktionen und Überprüfung der Vorhersagbarkeit der Lösungsmitteleffekte
Abschlussbericht an die Max-Buchner-Forschungsstiftung (FKZ: 277) Messung der Gleichgewichtslage und der Kinetik ausgewählter Veretherungsreaktionen und Überprüfung der Vorhersagbarkeit der Lösungsmitteleffekte
Titration von Metallorganylen und Darstellung der dazu benötigten
 Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Fluorierungsreaktionen. Seminarvortrag am 20.11.2008 im MCII-Seminar von Reida Rutte und Joachim Moser v. Filseck
 Fluorierungsreaktionen Seminarvortrag am 20.11.2008 im MCII-Seminar von Reida Rutte und Joachim Moser v. Filseck 1 Gliederung Einleitung Reaktionen Nucleophile Fluorierung Elektrophile Fluorierung Radikalische
Fluorierungsreaktionen Seminarvortrag am 20.11.2008 im MCII-Seminar von Reida Rutte und Joachim Moser v. Filseck 1 Gliederung Einleitung Reaktionen Nucleophile Fluorierung Elektrophile Fluorierung Radikalische
Metallorganik Teil 2. OFP-Seminar. Marburg, 31.01.06
 Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
Metallorganik Teil 2 FP-Seminar Marburg, 31.01.06 Einleitung Teil 2: Titan, smium, Zirkonium Bor Silizium Mangan, uthenium Palladium Zusammenfassung Wiederholung? 2 Stufen Et NC Wiederholung Cuprat Et
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Neue Systeme für die Ringschlussmetathese
 Neue Systeme für die Ringschlussmetathese Cezary Samojlowicz, Michal Bieniek, Karol Grela, Chem. Rev. 2009, 109, 3708-3742. Steven P. Nolan, Hervé avier, Chem. Soc. Rev. 2010, 39, 3305-3316. 12.01.2011
Neue Systeme für die Ringschlussmetathese Cezary Samojlowicz, Michal Bieniek, Karol Grela, Chem. Rev. 2009, 109, 3708-3742. Steven P. Nolan, Hervé avier, Chem. Soc. Rev. 2010, 39, 3305-3316. 12.01.2011
Name: 1 Reaktion von Carbonylverbindungen mit Kohlenstoffnukleophilen 71
 Institut für rganische Chemie rganisch-chemisches Grundpraktikum ame: Praktikum Platz-r.: Assistent: SS 2002: achschreiber Praktikum SS Bemerkungen: Achtung: 0 Zusatzpunkte können erreicht werden 1 2 3
Institut für rganische Chemie rganisch-chemisches Grundpraktikum ame: Praktikum Platz-r.: Assistent: SS 2002: achschreiber Praktikum SS Bemerkungen: Achtung: 0 Zusatzpunkte können erreicht werden 1 2 3
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2015
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2015 Nachtrag Aromatische Substitution Sicherheitsbelehrung: Regeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse September
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2015 Nachtrag Aromatische Substitution Sicherheitsbelehrung: Regeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse September
Weitere Übungsfragen
 1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
1 Strategie bei multiple choice Fragen Wie unterscheidet sich Glucose von Fructose? (2 Punkte) Glucose hat 6 C Atome, Fructose hat nur 5 C Atome. In der Ringform gibt es bei Glucose α und β Anomere, bei
Ausflüge zu regio- und stereoselektiven Reaktionen an Naturstoffen
 Ausflüge zu regio- und stereoselektiven Reaktionen an Naturstoffen 26.03.2013 René Csuk Einleitung Naturstoffe: hohe molekulare Komplexizität mehrere/viele stereogene Zentren Zentren ähnlicher Reaktivität
Ausflüge zu regio- und stereoselektiven Reaktionen an Naturstoffen 26.03.2013 René Csuk Einleitung Naturstoffe: hohe molekulare Komplexizität mehrere/viele stereogene Zentren Zentren ähnlicher Reaktivität
Organische Chemie. Einstieg. Chemie-Formeldarstellungen. Formeldarstellungen der Chemie: Bei Ionenverbindungen: Verhältnisformeln. , AlF 3. etc.
 Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Organische Chemie Einstieg Chemie-Formeldarstellungen Formeldarstellungen der Chemie: Textuelle Darstellungen: Bei Ionenverbindungen: Verhältnisformeln Bsp: NaCl; CaBr 2, AlF 3 etc. Bei Molekülverbindungen:
Prof. Dr. H. Hauptmann Übungen zur Vorlesung Organische Chemie II für Studierende des Lehramtes und der Biologie (3. Sem.)
 Prof. Dr.. auptmann Übungen zur Vorlesung rganische hemie II für Studierende des Lehramtes und der Biologie (3. Sem.) Lösungsbogen zu Übungsblatt 7, Diels-Alder-Reaktionen und Dihydroxylierung von Doppelbindungen
Prof. Dr.. auptmann Übungen zur Vorlesung rganische hemie II für Studierende des Lehramtes und der Biologie (3. Sem.) Lösungsbogen zu Übungsblatt 7, Diels-Alder-Reaktionen und Dihydroxylierung von Doppelbindungen
Organische Chemie II Reaktivität
 2. Klausur zur Vorlesung rganische Chemie II eaktivität Wintersemester 2008/09 Klausur am 11.02.2009 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme 1. Wiederholung
2. Klausur zur Vorlesung rganische Chemie II eaktivität Wintersemester 2008/09 Klausur am 11.02.2009 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme 1. Wiederholung
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt
 Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 1. Nachschreibklausur zum 2. Praktikumsteil (OC) vom 07.07.09
Chemisches Praktikum für Studierende der Humanmedizin, der Zahnheilkunde und Biologie/Lehramt Fachbereich Chemie der Philipps-Universität Marburg 1. Nachschreibklausur zum 2. Praktikumsteil (OC) vom 07.07.09
Grundlagen zum Verständnis chemischer Reaktionen = Handwerkszeug
 Grundlagen zum Verständnis chemischer Reaktionen = andwerkszeug chemische Bindung: ionische, kovalente, Dipolmomente, Bindungsstärke, Atom- und Molekülorbitale, ybridisierung Substanzklassen, funktionelle
Grundlagen zum Verständnis chemischer Reaktionen = andwerkszeug chemische Bindung: ionische, kovalente, Dipolmomente, Bindungsstärke, Atom- und Molekülorbitale, ybridisierung Substanzklassen, funktionelle
Übergangsmetall-Verbindungen in der Organischen Synthese Prof. Dr. Günter Helmchen
 Übergangsmetall-Verbindungen in der Organischen Synthese Prof. Dr. Günter Helmchen Teil I 1. Einleitung, Übersicht, Literatur 2. -Komplexe 2.1 Einleitung, Übersicht 2.2 -Eliminierung (Mechanismus) 2.3
Übergangsmetall-Verbindungen in der Organischen Synthese Prof. Dr. Günter Helmchen Teil I 1. Einleitung, Übersicht, Literatur 2. -Komplexe 2.1 Einleitung, Übersicht 2.2 -Eliminierung (Mechanismus) 2.3
OC-F-Seminar: Organische Synthesen mit Fluorphasen. Stefan Sticher 28.01.2004
 C-F-Seminar: rganische Synthesen mit Fluorphasen Stefan Sticher 28.01.2004 Gliederung: 1. rganofluorverbindungen 1.1 Was sind rganofluorverbindungen? 1.2 Physikalische Eigenschaften 1.3 Chemische Eigenschaften
C-F-Seminar: rganische Synthesen mit Fluorphasen Stefan Sticher 28.01.2004 Gliederung: 1. rganofluorverbindungen 1.1 Was sind rganofluorverbindungen? 1.2 Physikalische Eigenschaften 1.3 Chemische Eigenschaften
Die Grundlagen nachhaltiger Chemie. Moderne Synthesemethoden (OC07) Christina Kosch, Moritz Wolfer
 Die Grundlagen nachhaltiger Chemie Moderne Synthesemethoden (OC07) Christina Kosch, Moritz Wolfer Was bedeutet Nachhaltigkeit? Nachhaltigkeit ist ein Handlungsprinzip zur Ressourcen-Nutzung, bei dem die
Die Grundlagen nachhaltiger Chemie Moderne Synthesemethoden (OC07) Christina Kosch, Moritz Wolfer Was bedeutet Nachhaltigkeit? Nachhaltigkeit ist ein Handlungsprinzip zur Ressourcen-Nutzung, bei dem die
Übungsklausur mit Lösungen
 DECKBLATT PRÜFUGLEITUG PERÖLICE AGABE: mit Lösungen ame und Vorname:... Matrikelnummer:.. Diplom Chemie oder Wirtschaftschemie Diplom Biochemie/Molekularbiologie B.c. Chemie oder Wirtschaftschemie B.c.
DECKBLATT PRÜFUGLEITUG PERÖLICE AGABE: mit Lösungen ame und Vorname:... Matrikelnummer:.. Diplom Chemie oder Wirtschaftschemie Diplom Biochemie/Molekularbiologie B.c. Chemie oder Wirtschaftschemie B.c.
Hydroxylderivate. Alkohole und Phenole. Säure-BaseEigenschaften. Reaktionen mit. Bruch der C-H- und der C-OBindungen. Prof. Dr. Ivo C.
 Hydroxylderivate Alkohole und Phenole. Säure-BaseEigenschaften. Reaktionen mit Bruch der C-H- und der C-OBindungen. 1 Alkohole: Grundlagen, Nomenklatur Alkohole: R-OH; funktionelle Gruppe: Hydroxy-Gruppe
Hydroxylderivate Alkohole und Phenole. Säure-BaseEigenschaften. Reaktionen mit Bruch der C-H- und der C-OBindungen. 1 Alkohole: Grundlagen, Nomenklatur Alkohole: R-OH; funktionelle Gruppe: Hydroxy-Gruppe
Ketone gehären zu den Carbonylverbindungen. Sie tragen als funktionelle Gruppe eine nicht endståndige Carbonylgruppe. R 1 R 2
 rganische Chemie Ri 12 2.5. Ketone Ketone gehären zu den Carbonylverbindungen. Sie tragen als funktionelle Gruppe eine nicht endståndige Carbonylgruppe. R 1 C R 2 R 1 C R 2 R 1 C R 2 Strukturformel Elektronenstrichformel
rganische Chemie Ri 12 2.5. Ketone Ketone gehären zu den Carbonylverbindungen. Sie tragen als funktionelle Gruppe eine nicht endståndige Carbonylgruppe. R 1 C R 2 R 1 C R 2 R 1 C R 2 Strukturformel Elektronenstrichformel
Spezielle, einfache 1 H-NMR-Experimente
 Spezielle, einfache 1 -MR-Experimente Vereinfachung der Spektren (Zuordnung / Interpretation) Isotopen-Austausch Shift-Reagenzien Entkopplungsexperimente Zusatzinformation E: Effekt und E-Differenzspektroskopie
Spezielle, einfache 1 -MR-Experimente Vereinfachung der Spektren (Zuordnung / Interpretation) Isotopen-Austausch Shift-Reagenzien Entkopplungsexperimente Zusatzinformation E: Effekt und E-Differenzspektroskopie
Aufgabe Summe: max Punkte: Punkte:
 rganische Chemie Grundvorlesung Klausur (Teil 2) zur Lehrveranstaltung C I/1 ame: Matrikelnummer: Prüf ID: Studienfach: Fachsemester: Bei unvollständigen Angaben kann die Klausureinsicht nicht gewährleistet
rganische Chemie Grundvorlesung Klausur (Teil 2) zur Lehrveranstaltung C I/1 ame: Matrikelnummer: Prüf ID: Studienfach: Fachsemester: Bei unvollständigen Angaben kann die Klausureinsicht nicht gewährleistet
Der Natur auf der Spur Möglichkeiten und Grenzen der Organokatalyse Lutz Ackermann
 3 rganokatalyse Der atur auf der Spur Möglichkeiten und Grenzen der rganokatalyse Lutz Ackermann Asymmetrische Katalyse 3.1 Einleitung B A Y A B Y A B A Y B Beispiel: thylphenidat (Ritalin ) 3 C 2 C (R,R):
3 rganokatalyse Der atur auf der Spur Möglichkeiten und Grenzen der rganokatalyse Lutz Ackermann Asymmetrische Katalyse 3.1 Einleitung B A Y A B Y A B A Y B Beispiel: thylphenidat (Ritalin ) 3 C 2 C (R,R):
Anwendungen der Mikrowellentechnik in der Forschung und Lehre
 Anwendungen der ntechnik in der Forschung und Lehre Dr. Aleksandra Zivkovic Institute für Pharmazeutische Chemie Medizinische Chemie AK Stark 0 Pharmazie: Studienplan 1 Praktikum Pharmazeutische Chemie
Anwendungen der ntechnik in der Forschung und Lehre Dr. Aleksandra Zivkovic Institute für Pharmazeutische Chemie Medizinische Chemie AK Stark 0 Pharmazie: Studienplan 1 Praktikum Pharmazeutische Chemie
Übungsblatt 6 - Lösung
 Übungen rganische hemie für Studierende der Lehrämter und der Biologie (Diplom), WS 2003/04 Dr.. abrele Übungsblatt 6 - Lösung 1. n-butylbromid, sec-butylbromid und tert-butylbromid werden jeweils mit
Übungen rganische hemie für Studierende der Lehrämter und der Biologie (Diplom), WS 2003/04 Dr.. abrele Übungsblatt 6 - Lösung 1. n-butylbromid, sec-butylbromid und tert-butylbromid werden jeweils mit
Übungsaufgaben: Alkohole und Aldehyde/Ketone
 Übungsaufgaben: Alkohole und Aldehyde/Ketone 15.12.06 1. Alkohol und Schwefelsäure Propan-1-ol wird mit bzw. in Gegenwart von verdünnter Schwefelsäure zur Reaktion gebracht. Geben Sie die Reaktionen für
Übungsaufgaben: Alkohole und Aldehyde/Ketone 15.12.06 1. Alkohol und Schwefelsäure Propan-1-ol wird mit bzw. in Gegenwart von verdünnter Schwefelsäure zur Reaktion gebracht. Geben Sie die Reaktionen für
Klausur zur Vorlesung Biochemie I im WS 2001/02
 (insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
(insgesamt 100 Punkte, mindestens 40 erforderlich) Klausur zur Vorlesung Biochemie I im WS 2001/02 am 18.02.2002 von 08.15 09.45 Uhr Gebäude 52, Raum 207 Bitte Namen, Matrikelnummer und Studienfach unbedingt
Modul: BS Chemie II Organische Chemie Nachklausur zum Organisch-Chemischen Grundpraktikum für. Studierende der Biologie
 Chemisches Praktikum für Studierende der Biologie (Diplom und Bachelor) Universität zu Köln Institut für rganische Chemie Prof. Dr. A. G. Griesbeck Greinstr. 4 50939 Köln Modul: BS Chemie II rganische
Chemisches Praktikum für Studierende der Biologie (Diplom und Bachelor) Universität zu Köln Institut für rganische Chemie Prof. Dr. A. G. Griesbeck Greinstr. 4 50939 Köln Modul: BS Chemie II rganische
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Naturstoffsynthese: Morphin
 aturstoffsynthese: Morphin Dominik Schollenberger Institut für rganische Chemie Seminar zum Fortgeschrittenenpraktikum KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum
aturstoffsynthese: Morphin Dominik Schollenberger Institut für rganische Chemie Seminar zum Fortgeschrittenenpraktikum KIT Universität des Landes Baden-Württemberg und nationales Großforschungszentrum
Hoch effiziente asymmetrische Katalyse durch doppelte Aktivierung von Nucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem.
 och effiziente asymmetrische Katalyse durch doppelte Aktivierung von ucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem. 2004, 116, 4666-4683 1. Einleitung ymmetrische Katalysereaktionen
och effiziente asymmetrische Katalyse durch doppelte Aktivierung von ucleophil und Elektrophil Jun-An Ma und Dominique Cahard Angew. Chem. 2004, 116, 4666-4683 1. Einleitung ymmetrische Katalysereaktionen
OC07 Seminar WS15/16
 OC07 Seminar WS15/16 Chemie Frustrierter Lewis-Paare Bastian Oberhausen und Stephan Muth Betreuer: Lukas Junk D. W. Stephan und G. Erker, Angew. Chem. 2015, 127, 6498 6541. D. W. Stephan und G. Erker,
OC07 Seminar WS15/16 Chemie Frustrierter Lewis-Paare Bastian Oberhausen und Stephan Muth Betreuer: Lukas Junk D. W. Stephan und G. Erker, Angew. Chem. 2015, 127, 6498 6541. D. W. Stephan und G. Erker,
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Vorlesung Chemie für Biologen: Klausur 1 WS Sa
 1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Stoffklasse: LIPIDE Funktionen in der Zelle
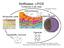 Stoffklasse: LIPIDE Funktionen in der Zelle Zellmembranen Industrielle Nutzung Strukturelle Lipide Speicherstoffe Signalstoffe, Hormone Pigmente 2 1 R 1 R 2 3 5 7 2 4 A 6 B 8 R 3 1 21 22 9 N N H 17 1 20
Stoffklasse: LIPIDE Funktionen in der Zelle Zellmembranen Industrielle Nutzung Strukturelle Lipide Speicherstoffe Signalstoffe, Hormone Pigmente 2 1 R 1 R 2 3 5 7 2 4 A 6 B 8 R 3 1 21 22 9 N N H 17 1 20
Neue Anwendungen von IBX
 Neue Anwendungen von IBX Iodoxybenzoesäure Dominik Brox, Skrollan Stockinger Assistentin: Filiz Ata Gliederung 1. Historischer Überblick 2. Darstellung von IBX und DMP 3. Ursprüngliche Anwendungsgebiete
Neue Anwendungen von IBX Iodoxybenzoesäure Dominik Brox, Skrollan Stockinger Assistentin: Filiz Ata Gliederung 1. Historischer Überblick 2. Darstellung von IBX und DMP 3. Ursprüngliche Anwendungsgebiete
Synthese von Essigsäureisopropylester (1) Präparat 1
 Synthese von Essigsäureisopropylester (1) Präparat 1 1. Reaktionstyp: Azeotrope Veresterung 2. Reaktionsgleichung: 3 3 3 3 2 3 3 Essigsäure Isopropanol Essigsäureisopropylester Wasser 60,05 g/mol 60,1
Synthese von Essigsäureisopropylester (1) Präparat 1 1. Reaktionstyp: Azeotrope Veresterung 2. Reaktionsgleichung: 3 3 3 3 2 3 3 Essigsäure Isopropanol Essigsäureisopropylester Wasser 60,05 g/mol 60,1
