Retrospektive cytogenetische und molekularcytogenetische Abklärung von ätiologisch ungeklärten Aborten mit morphologisch auffälligen Feten
|
|
|
- Paulina Kraus
- vor 6 Jahren
- Abrufe
Transkript
1 Aus dem Medizinischen Zentrum für Humangenetik Geschäftsführender Direktor: Prof. Dr. Karl-Heinz Grzeschik des Fachbereichs Medizin der Philipps-Universität Marburg Retrospektive cytogenetische und molekularcytogenetische Abklärung von ätiologisch ungeklärten Aborten mit morphologisch auffälligen Feten Inaugural-Dissertation zur Erlangung des Doktorgrades der Humanbiologie dem Fachbereich Medizin der Philipps-Universität Marburg vorgelegt von Ilona Dietze aus Karl-Marx-Stadt Marburg 2006
2 Angenommen vom Fachbereich Medizin der Philipps-Universität Marburg am: Gedruckt mit Genehmigung des Fachbereichs Dekan: Prof. Dr. Bernhard Maisch Referent: PD Dr. rer. nat. Barbara Fritz Korreferent: Prof. Dr. Roland Moll
3 Inhaltsverzeichnis 1 Einleitung Definition des Abortes Häufigkeit, Ätiologie und Wiederholungsrisiko von Spontanaborten Ursachen von Aborten Einfluss des mütterlichen Alters Genetische Faktoren von Spontanaborten Entstehungsmechanismen von Aneuploidien / Polyploidien Parentale Herkunft chromosomaler Aberrationen - möglicher phänotypischer Effekt Methoden zur Abklärung chromosomaler Ursachen in der Abortpathologie Fluoreszenz-in situ-hybridisierung (FISH) Comparative Genomhybridisierung (CGH) Methodischer Hintergrund der CGH Sensitivität und Validität der CGH Mikrodissektion Mikrosatellitenanalyse zur Abklärung der parentalen Herkunft von Chromosomenaberrationen Ziel der vorliegenden Dissertation 23 2 Material Chemikalien Lösungen, Puffer und Medien Medien, Puffer und Lösungen für die Zellkultur Puffer und Lösungen für die Chromosomen-Bänderung Puffer, Lösungen, Sonden und Antikörper für die In situ-hybridisierung PCR-Zusätze und Primer Lösungen und Reagenzien für die DNA-Isolierung Lösungen und Reagenzien für die DNA-Fällung Lösungen und Reagenzien für die Agarosegelektrophorese Lösungen und Reagenzien für die Polyacrylamidgelektrophorese Geräte und Zubehör Geräte und Zubehör für die Mikrodissektion Sonstige Geräte und Zubehör 31 3 Methoden Untersuchungsgut Cytogenetische Methoden Zellkultivierung 34 I
4 Langzeitkultur aus Amnionzellen und Abortgewebe Lymphocytenkultur Chromosomenpräparation Giemsa-Trypsin-Bänderung (GTG-Bänderung) Molekularcytogenetische Methoden Fluoreszenz- in situ- Hybridisierung (FISH) Vorbereitung der Sonden und Hybridisierung Fluoreszenz-Detektion und Waschung von indirekt markierten Sonden Multicolor-FISH (M-FISH) Comparative Genomhybridisierung (CGH) Markierung der genomischen DNA über Nicktranslation Markierung der genomischen DNA über DOP-PCR Herstellung der Hybridisierungsmischung und Hybridisierung Waschung der hybridisierten Objektträger Auswertung der CGH mit digitaler Bildanalyse Mikrodissektion Molekulargenetische Methoden DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe nach Proteinausfällung DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe mittels All-tissue DNA-Kit (Fa. GEN-IAL) DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe mittels Invisorb Spin Tissue Mini Kit (Fa. Invitek) DNA-Isolierung aus gefrorenem Gewebe DNA-Isolierung aus Blut DNA-Isolierung aus fixierter Chromosomensuspension DNA-Konzentrationsbestimmung DNA-Amplifikation Polymerase-Kettenreaktion (PCR) PCR mit spezifischen Primern mittels CombiPol DNA Polymerase Kit von Invitek Degenerate oligonukleotide primed-pcr (DOP-PCR) für die Mikrodissektion DNA-Amplifikation mittels GenomiPhi Amplification Kit Gelelektrophoretische Auftrennung von Nukleinsäuren Agarosegelelektrophorese Polyacrylamidgelelektrophorese (PAGE) 61 II
5 4 Ergebnisse DNA-Isolierung aus asserviertem Fetal- oder Abortgewebe DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Geweben DNA-Isolierung aus frischem und nativ eingefrorenem Gewebe DNA-Isolierung aus EDTA-Blut DNA-Isolierung aus fixierter Chromosomensuspension Vergleich der verschiedenen Methoden zur DNA-Isolierung DNA-Amplifikation Universelle DNA-Amplifikation mit DOP-PCR von ROCHE Universelle DNA-Amplifikation mit GenomiPhi DNA Amplifikation Kit Mikrosatellitentypisierung Korrelation zwischen Formalinfixierung und DNA-Qualität Comparative Genomhybridisierung (CGH) Fälle mit unauffälligem CGH-Ergebnis Bestätigung eines Normalbefundes (O-1980/02) Bestätigung eines Normalbefundes (O-2017/02) Falsch negativer Befund bei Vorliegen einer Triploidie (V-2317/01) Fälle mit pathologischem CGH-Profil Terminale Deletion 13q Präzisierung eines cytogenetischen Vorbefundes (O-515/88) Terminale Deletion 4q Präzisierung eines cytogenetischen Vorbefundes (O-643/88) Nachweis einer Trisomie 18 (S-41/02) Nachweis einer Trisomie 12 (V-1771/95) Nachweis einer interstitiellen Deletion 3p (O-212/86) Charakterisierung eines überzähligen Markerchromosoms (O-1919/01) Fälle ohne Ergebnis nach CGH Molekularcytogenetische und molekulargenetische Methoden zur umfassenden Charakterisierung chromosomaler Imbalancen bei Aborten Ausschluss einer Uniparentalen Disomie 2 (O-1893/01) Terminale Deletion 4p (Wolf-Hirschhorn-Syndrom) (O-1910/01) Inversionsduplikation 8p (118/02) Derivativchromosom 8 (V-2309/01) Diskussion Retrospektive Chromosomendiagnostik an Formalin fixiertem und in Paraffin eingebettetem Gewebe Methodische Aspekte DNA-Isolierung aus Formalin fixierten, paraffiniertem Gewebe CGH-Analysen mit DNA aus Paraffingewebe 118 III
6 5.2.3 CGH nach DOP-PCR Korrelation der CGH-Ergebnisse mit cytogenetischen Befunden CGH-Analyse mit unauffälligem CGH-Profil Feten mit Syndromverdacht Verdacht auf chromosomale Aberration CGH-Analyse mit auffälligem CGH-Profil Nachweis von autosomalen Trisomien Nachweis gonosomaler Chromosomenaberrationen Nachweis von Deletionen / Sonderform Ringchromosomen Nachweis von Duplikationen / Sonderform überzählige Markerchromosomen Nachweis unbalancierter Translokationen Parentale Herkunft von Chromosomenaberrationen Parentale Herkunft numerischer Chromosomenaberrationen Parentale Herkunft struktureller Chromosomenaberrationen Fallbeschreibungen Nachweis von chromosomalen Zugewinnen - Charakterisierung eines Markerchromosoms durch die Kombination von M-FISH, chromosomaler Mikrodissektion, CGH und molekulargenetischer Analyse (O-1919/01) Chromosomale Verluste Terminale Deletion 4q (O-643/88) Chromosomale Verluste Interstitielle Deletion 3p (O-212/86) Nachweis von Entstehungsmechanismen bei chromosomalen Aberrationen Zusammenfassung Zukünftige Entwicklungen Tabellenanhang 158 Tabelle A: Liste für Fälle mit unauffälligem CGH-Ergebnis 158 Tabelle B: Liste für Fälle mit auffälligem CGH-Ergebnis 160 Tabelle C: Auflistung aller bearbeiteten Fälle hinsichtlich stattgefundener Pränataldiagnostik, CGH-Ergebnisse und anderer Methoden 162 Tabelle D: Auflistung aller Fälle, deren Lagerzeit in Formalin, der Autolysegrad des Gewebes und DNA-Zustand Literaturverzeichnis Anhang Verzeichnis der akademischen Lehrer Danksagung 181 IV
7 1 Einleitung 1.1 Definition des Abortes Eine Fehlgeburt (Abort) bedeutet das Absterben eines Embryos oder die frühzeitige Geburt eines Kindes vor Erreichen der Überlebensfähigkeit und stellt die häufigste Schwangerschaftskomplikation dar. Wenn ein Kind ein Geburtsgewicht von > 500g erreicht, dann wird bereits von einer Frühgeburt gesprochen, da der heutige Stand der Kinderheilkunde theoretisch ein Überleben ermöglicht. Die Ursachen eines Abortes sind vielfältig und im Einzelfall oft nicht eruierbar. Sie umfassen sowohl chromosomale, als auch endokrinologische, anatomische, immunologische, hämostasiologische und exogene Ursachen. Im Hinblick auf den klinischen Verlauf und die Ätiologie erscheint eine Klassifizierung der Spontanaborte nach Gestationsalter sinnvoll (Martius et al. 1996): Spontanabort: Schwangerschaftsverlust vor Lebensfähigkeit des Kindes mit einem Geburtsgewicht unter 500g Frühestabort: innerhalb der ersten 5 Schwangerschaftswochen (SSW, p.m.) Frühabort: Verlust zwischen SSW (p.m.) Spätabort: Fruchtabgang nach 13. SSW (p.m.) Von habituellen Aborten spricht man definitionsgemäß nach drei erlittenen Fehlgeburten in ununterbrochener Reihenfolge (Definition der WHO = Weltgesundheitsorganisation). Habituelle Aborte kommen mit einer Häufigkeit von 0,4-1,8% aller Schwangerschaften vor und betreffen etwa 2% der Paare im reproduktionsfähigen Alter. Bei Paaren mit habitueller Abortneigung, für die keine gynäkologische oder exogene Ursache bekannt ist, findet man in 6-12% der Fälle bei einem Partner strukturelle Chromosomenveränderungen (vor allem Translokationen). Die Häufigkeit, mit der Chromosomenaberrationen bei solchen Paaren gefunden werden, ist 5-6-fach höher als in der Allgemeinbevölkerung und etwa 2-fach höher als bei Paaren mit einem sporadischen Abort (Heyat et al. 1991). Als missed abortions wird ein verhaltener Abort bis zur 9. Embryonalwoche bezeichnet, bei dem der Embryo keine Herzaktivität zeigt und die Fruchtausstoßung ausgeblieben ist (Philipp & Kalousek 2002b). Einigen Untersuchungen zufolge besteht eine direkte Korrelation zwischen Phänotyp und chromosomaler Auffälligkeit des Frühabortes (Kalousek 1987, Philipp et al. 2003). 1
8 1.2 Häufigkeit, Ätiologie und Wiederholungsrisiko von Spontanaborten Spontanaborte sind ein häufiges Ereignis in der menschlichen Fortpflanzung % aller Schwangerschaften enden vorzeitig, meist als Frühaborte vor Beendigung der 12. Schwangerschaftswoche (Boué et al. 1975). Je jünger die Schwangerschaft ist, desto höher ist die Rate des Embryonenverlustes. Eine hohe Abortrate von 15-18% ist in der 6.-8.SSW zu verzeichnen, während die Abortrate von der SSW unter 5% liegt (Shapiro et al. 1971, Koller 1983). Diese Zahl gilt nur für klinisch erkannte Schwangerschaften, die mittels Ultraschall oder hcg-bestimmung festgestellt werden konnten. Neuere Studien zeigen, dass bis zu 70% aller Konzeptionen schon vor dem Zeitpunkt der Regelblutung unerkannt absterben (Beck et al. 1998). Beobachtungen aus in vitro Fertilisations-Studien deuten sogar auf eine noch geringere Implantationsquote von unter 30% hin (Munné et al. 1995). Weitere 30% gehen in der frühen Post- Implantationsperiode verloren. Etwa 30-40% der frühen Fehlgeburten lassen sich nicht auf eine Chromosomenstörung oder eine exogene Ursache zurückführen und bleiben somit ätiologisch ungeklärt. In das 2. Schwangerschaftstrimenon fallen nur ca. 10% der Aborte, ca. 1/3 davon weisen einen auffälligen Karyotyp auf (Tab. 1). Relativ wenig Information liegt über die chromosomale Konstitution von Totgeburten vor. Der Anteil von Chromosomenaberrationen beträgt hier weniger als 6% und ist somit wesentlich geringer als bei Spontanaborten. Die Wahrscheinlichkeit eines Abortes steigt mit der Zahl der vorangegangenen Aborte. Frauen mit drei und mehr vorausgegangenen Fehlgeburten haben unabhängig vom Alter ein 3-fach erhöhtes Risiko für eine erneute Fehlgeburt in der folgenden Schwangerschaft im Vergleich zu Erstgebärenden. Auch wenn es sich möglicherweise um eine rein zufällige Aneinanderreihung von Aborten unterschiedlicher Genese handelt, kann dennoch ein gemeinsamer pathophysiologischer Faktor wirksam sein, welcher zu wiederholten Aborten führen kann. Erste prospektive Studien beschreiben ein Wiederholungsrisiko von rund 20% für Frauen nach Erstabort mit oder ohne Lebendgeburten in der Anamnese (Poland et al. 1977). Das entspricht dem allgemeinen Abortrisiko und ist somit nicht erhöht (siehe Kap ). Nach Auswertung von 10 Studien zur Abhängigkeit der Abortrate bezogen auf die Anzahl vorangegangener Aborte liegt die Wahrscheinlichkeit eines erfolgreichen Schwangerschaftsverlaufs noch über 65% (Stirrat 1990). Differenziert man zudem zwischen chromosomal aberranten Erstaborten und Erstaborten mit unauffälligem Karyotyp, so scheint das Risiko für einen Abort in einer 2
9 nachfolgenden Schwangerschaft erhöht, wenn ein normaler Karyotyp im Abortmaterial gefunden wurde (16-17% versus 23%) (Boué et al. 1975, Geisler & Kleinbrecht 1978, Morton et al. 1987, Ogasawara et al. 2000). Für die Trisomien 13, und 18 sowie Aneuploidien der Geschlechtschromosomen ist das Wiederholungsrisiko in der nachfolgenden Schwangerschaft nicht wesentlich erhöht. In der Literatur wird das Wiederholungsrisiko für ein Down-Syndrom mit rund 0,62% für eine 20 Jährige und mit 0,85% für eine Frau unter 30 Jahren angegeben, wenn bereits ein Kind mit einer Trisomie 21 geboren wurde. Somit ist das Risiko für Frauen unter 30 Jahren 6mal höher als bei anderen Frauen ohne vorangegangene Schwangerschaft mit einem Down- Syndrom. Für diese nichtaltersabhängigen Risiken werden versteckte Mosaike oder kleine strukturelle Defekte eines Elternteils diskutiert (Morris et al. 2005). Dem erhöhten Wiederholungsrisiko liegt zumindest für einen Teil der Familien ein Gonadenmosaik bei einem Elternteil zugrunde (Bruyère et al. 2000). 1.3 Ursachen von Aborten Einfluss des mütterlichen Alters Eine positive Korrelation zwischen Spontanabortrate und mütterlichem Alter ist schon seit mehreren Jahrzehnten bekannt. Das ermittelte durchschnittliche Abortrisiko liegt bei 13,5% (Kiely et al. 1986, Kline & Stein 1987, Fretts et al. 1992). Dies konnte durch eine neuere Studie, in der mehr als 1,2 Millionen Schwangerschaften in einem Untersuchungszeitraum von 14 Jahren erfasst wurden, bestätigt werden. Als einzig signifikanter Risikofaktor kristallisierte sich ein erhöhtes mütterliches Alter heraus (Nybo Andersen et al. 2000). Geringen Einfluss hatte dagegen die Anzahl vorausgegangener Aborte, Geburten bzw. der Konzeptionstermin. Danach haben Frauen unter 20 Jahren Abortraten um 10%, bei 40-jährigen steigt die Abortinzidenz auf über 35%, bei 45-jährigen beträgt die Rate sogar ca. 75% (vgl. Abb. 1). Zwei- und Dreifachtrisomien werden am häufigsten bei Schwangeren über 37 Jahre gefunden. Wird die Abortrate auch nach Gestationswochen analysiert, so liegt diese in der Altersgruppe der Jährigen in fast allen Schwangerschaftswochen am niedrigsten (Wulf & Schmidt-Matthiesen 1985). Das Risiko für Totgeburten und ektopische Schwangerschaften ist ebenfalls abhängig vom mütterlichen Alter. Bei der Besprechung von Abortursachen in einer genetischen Beratung sollte diese Altersabhängigkeit stets berücksichtigt werden. 3
10 Abbildung 1: Wahrscheinlichkeit eines Spontanabortes in Abhängigkeit vom mütterlichen Alter zum Zeitpunkt der Konzeption (nach Nybo Andersen et al. 2000) Genetische Faktoren von Spontanaborten Chromosomale Aberrationen sind eine wesentliche Ursache für die frühe Eliminierung einer Schwangerschaft. Die Rate der Chromosomenanomalien variiert in Abhängigkeit des Schwangerschaftsalters. Sie beträgt unter Frühaborten im Durchschnitt 50-60% (u. a. Boué et al. 1975, Eiben et al. 1990, Demjek et al. 1992, Gaillard et al. 1993). Der Anteil von Chromosomenaberrationen bei Aborten im 2. Trimenon beträgt 4-20%, wobei eine Abhängigkeit der Inzidenz chromosomaler Störungen von der Dauer der Fruchtretention nachzuweisen war. Mazerierte Feten wiesen in 17% einen pathologischen Karyotyp auf, gut erhaltene Feten hingegen nur in 4% (Gaillard et al. 1993). Gesammelte Daten von fast karyotypisierten Spontanaborten zeigen, dass autosomale Trisomien mit ca. 58% die häufigste Anomalie sind, gefolgt von Monosomie X und Triploidien mit jeweils 15%, Tetraploidien mit 4,8% und strukturellen Aberrationen mit insgesamt 5,1%. Autosomale Monosomien wurden bisher nur sehr selten beobachtet. Nach gegenwärtigem Kenntnisstand werden monosomale Konzeptionen nicht implantiert. Zum Zeitpunkt der Konzeption jedoch kommen ebenso viele Monosomien wie Trisomien vor, da es sich bei der Entstehung um einen reziproken Entstehungsmechanismus handelt. Die häufigste Trisomie der Autosomen ist die Trisomie 16 mit ca. 32%, gefolgt von der Trisomie 22 und 21 mit jeweils ca. 20% (Übersicht in Fritz 2002). Die cytogenetische Abklärung von Aborten ist damit aus klinischen, therapeutischen und prognostischen Gründen indiziert. Es ist anzunehmen, dass innerhalb dieses 4
11 Kollektivs die Frequenz von chromosomalen Aberrationen unterschätzt wird, da nur in maximal 70% der Fälle eine konventionelle Chromosomenanalyse erfolgreich durchgeführt werden kann (Tab. 1). Tabelle 1: Häufigkeit von Chromosomenaberrationen in Abhängigkeit des Gestationsalters. Auswertung von 631 Spontanaborten (Fritz 2002) Schwangerschaftswochen (p.m.) Anzahl karyotypisierter Aborte Anzahl chromosomal auffälliger Aborte cytogenetisch nicht analysierte Aborte < (71%) 12,5% (41,7%) 17,2% (24,1%) 31,8% > Lediglich die Trisomien 13, 18 und 21 sowie Aneuploidien der Geschlechtschromosomen sind mit einer Entwicklung bis zur Geburt vereinbar. Für alle anderen numerischen Anomalien ist eine nahezu vollständige intrauterine Selektion bis zur Geburt gegeben. Infolgedessen nimmt die Häufigkeit von chromosomalen Veränderungen in Aborten mit zunehmendem Gestationsalter ab (Tab. 2, Jacobs 1990): Als weiterer Faktor wird eine genetische Prädispostion für ein Non-disjunction diskutiert. Untersuchungen zum Replikationsverhalten der Chromosomen bei Müttern nach Geburt eines Kindes mit Trisomie 21 weisen auf eine solche Prädispostion hin. Es scheint demnach eine Relation zwischen Verlust der Replikationskontrolle, Dysfunktion des Centromers sowie eine Prädispostion zur Non-disjunction zu bestehen (Amiel et al. 2000). Tabelle 2: Häufigkeit der verschiedenen chromosomalen Veränderungen bei Spontanaborten, Totgeburten und Neugeborenen (Jacobs 1990) Anomalien (%) Population 45,X Trisomie Triploidie Tetraploidie Strukurelle Sonstiges Summe Anomalien abnormal Spontanaborte 8,6 26,8 7,3 2,5 2 0,7 47,9 Totgeburten 0,25 3,8 0,6-0,4 0,6 5,65 Neugeborene < 0,05 0, ,25 0,02 0,57 Klinisch erkannte SS 1,3 4,31 1,1 0,38 0,76 0,15 0,8 Überlebenswahrscheinlichkeit bis zur Geburt (%) 0,3 5, ,5 6 Im Vergleich zu Lebendgeburten sind Fehlgeburten mit einem hohen Anteil an Fehlbildungen belastet, insbesondere Neuralrohrdefekten, Lippen-Kiefer- Gaumenspalten, Polydaktylien und Zyklopien. Mehr als die Hälfte aller Aborte gehen 5
12 mit einem aberranten Karyotyp einher (Hassold et al. 1980), wobei diese ebenfalls eine hohe Rate an phänotypischen Anomalien aufweisen (Kalousek et al. 1987, 1993, Philipp et al. 2003). In mehreren Studien über missed abortions wurden insgesamt 262 Embryonen mittels Embryoskopie untersucht (Philipp & Kalousek 2002a, 2002b; Philipp et al. 2003). Die häufigsten beschriebenen Fehlbildungen sind Mikrocephalie, Extremitätenfehlbildungen, faciale Dysmorphien, Holoprosencephalie, Neuralrohrdefekte (insbesondere Anencephalie, Encephalocelen, Spina bifida), Gaumenspalten und allgemeine Wachstumsdisorganisation der Embryonen. Cytogenetische Untersuchungen ergaben am häufigsten Trisomien (59%), Monosomie X (23%), Polyploidien (13%) und in 5% Strukturanomalien. In Tabelle 3 wird der Zusammenhang zwischen morphologisch auffälligen Embryonen und aberranten cytogenetischen Ergebnissen dargestellt. Tabelle 3: Korrelation zwischen Morphologie und Karyotyp in missed abortions Philipp & Kalousek 2002a Philipp & Kalousek 2002b Philipp et al Embryonen gesamt * 233 Cytogenetik aberranter Karyotyp total 9 (60%) 8 (100%) 165 (75%) normaler Karyotyp total 6 (40%) 0 56 (25%) Chromosomenanomalie in morphologisch normalen 20% - 15/31 (48%) Embryos Chromosomenanomalie in Embryonen mit isolierten - - 6/10 (60%) Defekten Chromosomenanomalie in Embryonen mit kombinierten 70% 100% 98/114 (86%) Defekten Chromosomenanomalie in Embryonen mit Wachstumsdisorganisation /66 (70%) * ausschließlich Embryonen mit Neuralrohdefekten (Anencephalus, Encephalocele, Spina bifida) Entstehungsmechanismen von Aneuploidien / Polyploidien Fehlverteilungen homologer Chromosomen geschehen häufig während der Keimzellreifung in Meiose I bzw. II. Aufgrund der großen Zahl von Zygoten mit chromosomalen Imbalancen lässt sich schließen, dass die Meiose ein sehr fehleranfälliger Prozess ist. Mögliche exogene Ursachen für eine erhöhte Aneuploidierate können beispielsweise ionisierende Strahlen, Rauchen, Alkoholkonsum, virale Infektionen und auch saisonale endokrinologische Schwankungen sein (Sperling 1998). Es konnte gezeigt werden, dass die sensitivste 6
13 Phase der Oocyte gegenüber ionisierenden Strahlen der Zeitpunkt der Konzeption bzw. die Meiose II ist (Sperling et al. 1991, 1994, Mailhes & Marchetti 1994). Der offensichtlichste Faktor für ein gehäuftes Auftreten einer Non-disjunction sowohl in Meiose I und II ist ein erhöhtes mütterliches Alter. Insbesondere ab dem 35. Lebensjahr erhöht sich das Risiko für das Auftreten einer Trisomie. Hier zeigen die meisten cytogenetischen Studien eine klare Korrelation zwischen dem mütterlichen Alter und der Häufigkeit von Trisomien einschließlich der Trisomien für die Gonosomen. Im Gegensatz hierzu tritt die Monosomie X unabhängig vom mütterlichen Alter auf. Aufgrund der Tatsache, dass Aneuploidien maternaler Herkunft vorherrschen und dem Fehlen des Verständnisses der menschlichen Meiose, wurden menschliche, nicht befruchtete Eizellen verstärkt cytogenetisch untersucht. Dabei lagen in 22,1% der untersuchten Eizellen chromosomale Aberrationen vor, wobei 10,8% aneuploide, 5,4% diploide und 2,1% strukturelle Aberrationen vorkamen (Tab. 4). Als Pathomechanismen zur Entstehung von Aneuploidien gilt ein Non-disjunction sowohl ganzer Chromosomen als auch einzelner Chromatiden (Pellestor et al. 2002). analysierte Eizellen 1397 Eizellen gesamt (100%) normaler Karyotyp 23,X 1088 (77,9%) abnormaler Karyotyp 309 (22,1%) hypohaploid 75 hyperhaploid 57 komplex aneuploid 12 extrem aneuploid 7 aneuploid diploid tetraploid strukturell abnorm 151 (10,8%) 75 (5,4%) 1 (0,07%) 29 (2,1%) Tabelle 4: Häufigkeit chromosomaler Imbalancen in cytogenetisch untersuchten Eizellen (Pellestor et al. 2002) Eizellen-spezifische Gene spielen eine bedeutende Rolle bei der Regulierung der Eizellenentwicklung, und deren Wachstum, Fertilisation und frühe Embryonalentwicklung. Inzwischen sind eine Vielzahl von Genen identifiziert, die für eine korrekte Chromosomensegregation und für die Reparatur von DNA-Mismatches verantwortlich sind, u.a. Spo11, Msh5 und Mlh1 (Acevedo & Smith 2005). Ebenso spielen Centromerproteine bei der Segregation homologer Chromatiden in der Meiose eine wichtige Rolle. Mutationen in der Shugoshin-Proteinfamilie bewirken einen vorzeitigen Verlust der Bindung der Chromatiden am Centromer (Hamant et al. 2005). Die Entstehung einer Triploidie kann durch Diandrie oder Dispermie mit zwei Chromosomensätzen väterlicherseits und einem mütterlichen Chromosomensatz erklärt werden. Der sehr selten vorkommende 69,XYY-Karyotyp spricht für einen frühen 7
14 Entwicklungsstillstand, so dass der Abort eintritt, bevor die Schwangerschaft gesichert werden konnte. Gynoide Triploidien dagegen sind charakterisiert durch zwei mütterliche und einen väterlichen haploiden Chromosomensatz. Etwa 65% aller Tetraploidien weisen den Karyotyp 92,XXXX auf. Da die meisten Aborte mit einer Tetraploidie eine Gonosomenkonstellation XXXX oder XXXY zeigen, liegt ein Fehler während der ersten meiotischen Teilung der Eizelle vor (Wulf & Schmidt-Matthiesen 1985). 1.4 Parentale Herkunft chromosomaler Aberrationen - möglicher phänotypischer Effekt Analysen mittels hochpolymorpher, chromosomenspezifischer Mikrosatelliten ermöglichen die Bestimmung der parentalen Herkunft chromosomaler Aberrationen. Diese zeigen, dass autosomale Trisomien überwiegend mütterlichen Ursprungs sind, wobei es aber bezüglich der einzelnen Chromosomen große Unterschiede gibt. So sind 90-95% der Trisomie 18-Fälle und nahezu 100% der Trisomie 16 mütterlichen Ursprungs (Kupke und Muller 1989, Nicolaides & Petersen 1998). Lediglich 8,5% der Trisomie 21-, 11,9% der Trisomie 13- und 11,8% der Trisomie 15-Fälle sind väterlichen Ursprungs (Nicolaides & Petersen 1998). In 50% der Trisomie 2-Fälle und 33,3% der Fälle mit einer Trisomie 8 konnte ebenfalls ein väterlicher Ursprung ermittelt werden (Hassold et al. 1996, Nicolaides & Petersen 1998) (vgl. Tab. 5). Für die Inzidenz paternaler Trisomien scheint ein Zusammenhang zu der Größe der involvierten Chromosomen zu bestehen. Trisomie Ursprung Anzahl Fälle (%) maternal paternal 8 10 (66,7) 5 (33,3) (88,1) 5 (11,9) (88,2) 2 (11,8) (100) (91,5) 15 (8,5) (91,5) 75 (8,5) (96) 2 (4) Tabelle 5: Parentaler Ursprung der häufigsten Aneuploidien bei Lebendgeborenen und Spontanaborten (Hassold et al. 1996, Nicolaides & Petersen 1998) Dass väterliche und mütterliche Genome funktionell nicht identisch sind, dokumentieren fetale Triploidien. Bei Vorliegen zwei väterlicher und einem mütterlichen haploiden Chromosomensatz (Diandrie), ist die Plazenta groß und weist zystische Veränderungen auf (Partialmole). Der Fetus selbst ist macrocephal und zeigt eine schwere intrauterine Wachstumsretardierung. Gynoide Triploidien sind 8
15 charakterisiert durch eine kleine Plazenta ohne zystische Veränderungen und einem hypertrophen Fetus. Der pathogene Effekt beruht auf einer unterschiedlichen Aktivität paternaler und maternaler Gene, ein Mechanismus der als genomisches Imprinting (Prägung) bezeichnet wird. Die parentale Herkunft einer Genom- bzw. Chromosomenmutation kann daher Einfluss auf die Penetranz und Expression und damit auf die phänotypische Manifestation eines genetischen Krankheitsbildes nehmen. Die meisten Gene unterliegen nicht einer elterlichen Prägung. Dies ist nur bei einer begrenzten Zahl einzelner Gene in definierten chromosomalen Bereichen von Bedeutung. Zwei wichtige Cluster mit geprägten Genen sind: a) 11p15.5 mit einer Größe von 1Mb mit Umfassung der Region für das Beckwith-Wiedemann-Syndrom (Maher & Reik 2000) und b) 15q11-q13 über eine Länge von 2,2Mb mit den Bereichen für das Prader-Willi- und Angelman-Syndrom (Meguro et al. 2001). Mehrere Untersuchungen belegen, dass nach assistierter Reproduktion (ICSI=Intracytoplasmatische Spermainjektion) eine höhere Rate von maternalen Imprinting-Defekten auftreten. Dies gilt beispielsweise für das Angelman-Syndrom und das Beckwith-Wiedemann-Syndrom (Cox et al. 2002, Gicquel et al. 2003, Ludwig et al. 2005). Ebenso wird nach ICSI eine erhöhte Zahl chromosomaler de novo-aberrationen und größerer angeborener Fehlbildungen beschrieben (Devroey & Van Steirteghem 2004). In einer Studie über 1586 Feten nach ICSI fanden sich in 3% (47 Feten) abnorme Karyotypen, wobei 1,6% (25) der Aberrationen neu entstanden waren. Von 22 vererbten strukturellen Anomalien wurden 17 vom Vater vererbt. In einem Fall mit einem 47,XXY-Karyotyp stammte das zusätzliche X-Chromosom ebenfalls vom Vater (Bonduelle et al. 2002). 1.5 Methoden zur Abklärung chromosomaler Ursachen in der Abortpathologie Fluoreszenz-in situ-hybridisierung (FISH) Mit der molekularcytogenetischen Methode der Fluoreszenz-in situ-hybridisierung (FISH) ist die Detektion spezifischer DNA-Sequenzen mit Hilfe von markierten DNA- Sonden an Metaphasechromosomen oder Interphasekernen möglich. Die FISH hat die diagnostischen Möglichkeiten in der prä- und postnatalen Chromosomendiagnostik sowie auf dem Gebiet der Cytogenetik entscheidend verbessert. Dies gilt insbesondere für Chromosomenstörungen, die mit konventionellen cytogenetischen Methoden nicht oder nur schwer identifizierbar sind, wie z.b. die Identifizierung des genetischen 9
16 Ursprungs von Markerchromosomen und komplexen Translokationen. FISH ist grundsätzlich sensitiver als die konventionelle Cytogenetik beim Nachweis von Mikrodeletionssyndromen. Das sind klinische Syndrome, die auf submikroskopischen (< 3kb) Deletionen beruhen. Chemisch gesehen ist die DNA ein linearer Polyester aus Desoxyribose und Phosphorsäure mit heterozyklischen Stickstoffbasen in der Seitenkette. Zwei solche DNA-Einzelstränge können durch Wasserstoffbrückenbindungen eine DNA- Doppelhelix ausbilden. Verglichen mit einer kovalenten Elektronenpaarbindung sind diese Wasserstoffbrücken schwache Bindungen, so dass durch Erwärmung auf Temperaturen um 70 C oder durch Zugabe organischer Lösungsmittel wie Formamid die Doppelhelix in zwei Einzelstränge getrennt werden kann. Dieser Vorgang wird Denaturierung genannt. Die Temperatur, bei der diese Separation des Doppelstranges stattfindet, wird als Schmelztemperatur bezeichnet. Zwei DNA-Einzelstränge können nach einer Denaturierung wieder spezifisch zum Doppelstrang rekombinieren, wenn die Basensequenz der Einzelstränge zueinander komplementär ist. Diese spezifische Rekombination von DNA-Einzelsträngen verschiedener Herkunft zu einem Doppelstrang wird als Hybridisierung bezeichnet. Eine Hybridisierungsstelle kann dadurch nachgewiesen werden, dass man ein DNA- Molekül mit einem Fluoreszenzfarbstoff markiert (siehe Abb. 2) und diesen nach erfolgter Hybridisierung durch eine geeignete Lichtquelle zur Fluoreszenz anregt. Setzt man als Ziel-DNA ein biologisches Präparat ein, so kann man durch diese spezifische Rekombination eine ganz bestimmte DNA-Sequenz, z.b. ein Chromosom oder einen Zellkern, nachweisen. Diese spezielle Hybridisierungvariante wird Fluoreszenz-in situ- Hybridisierung genannt. Die FISH-Technik begründete Ende der 80iger Jahre die molekulare Cytogenetik. Durch neue Fluoreszenzfarbstoffe und sensitive Fluoreszenzmikroskopie konnten bald auch multiple Nukleinsequenzen direkt und präzise lokalisiert werden. 10
17 Abbildung 2: Schematische Darstellung einer Fluoreszenz-in situhybridisierung Eine Vielzahl kommerziell erhältlicher Sonden für die cytogenetische Diagnostik steht heutzutage zur Verfügung (Abb. 3). Im Wesentlichen unterscheidet man 3 Typen von DNA-Sonden: 1. Centromerspezifische Sonden (CEP): Centromerspezifische Sonden binden sich an chromosomenspezifische ermöglichen die hochrepetitive Identifizierung Satelliten-DNA. von CEP-Sonden Markerchromosomen in Metaphasechromosomen oder den Nachweis numerischer Aberrationen im Interphasekern. 2. Chromosome Painting Sonden: Die Hybridisierung komplexer DNA durch Suppression repetitiver Elemente erlaubt es, individuelle Chromosomen oder Chromosomenabschnitte selektiv mit chromosomenspezifischen DNA-Pools (DNABibliotheken) anzufärben. Chromosomenspezifische Sonden werden einzeln oder in 24-Farben-FISH-Experimenten (Multicolor-FISH) eingesetzt. Über M-FISH ist eine einfache und schnelle Identifizierung von chromosomalen Veränderungen insbesondere auch der Zuordnung des chromosomalen Ursprungs von Markerchromosomen in einem Versuchsansatz möglich. Noch spezifischere Aussagen über strukturelle Aberrationen einzelner Chromosomen erlaubt die mband-fish, eine Methode, bei der jedes Chromosom in einem eigenen Bandenmuster erscheint. Dabei werden regionenspezifische Bereiche eines Chromosoms auf dem Level der konventionellen Chromosomenbanden unterschieden. Diese Technik basiert auf dem Gebrauch unterschiedlicher 11
18 überlappender fluoreszenzmarkierter Mikrodissektiosbibliotheken, sogenannter region specific partial paints (rpcp). 3. Locus spezific identifier (LSI-Sonden): Mit Hilfe von locusspezifischen DNA- Sonden können subtile chromosomale Veränderungen durch Markierung einzelner Genorte aufgedeckt werden, die unterhalb des Auflösungsvermögens der konventionellen Cytogenetik liegen (< 5-10Mb). Die Sensitivität ist im Vergleich zur konventionellen Cytogenetik um das ca. 10fache erhöht. Locusspezifische Sonden werden gezielt für die genomische Lokalisation eines Gens, für die Detektion von Mikrodeletionen oder für den Nachweis chromosomaler Translokationen in Interphasezellkernen eingesetzt. Subtelomer-Sonden sind spezifisch für den terminalen Abschnitt eines bestimmten Chromosomenarms (p/q) und dienen dem Nachweis von kryptischen terminalen Deletionen (Subtelomer-FISH) (vgl. Abb. 3). Abbildung 3: Verschiedene DNA-Sonden zum Nachweis numerischer und struktureller Chromosomenveränderungen mittels FISH-Technik: Centromer-Sonden zur Bindung an repetitive Satelliten-DNA eines Chromosoms; Chromosomen- oder Chromosomenarm-spezifische Sonden (Chromosome Painting) zur Anfärbung eines bestimmten Chromosoms oder Chromosomenarms über die gesamte Länge; mband zur Darstellung regionenspezifischer Bereiche; locusspezifische Sonden zur Markierung einzelner Genorte; Subtelomer-Sonden für die distalen Abschnitte einzelner Chromosomenarme Chromosome Painting-Sonde Centromersonde Chromosomenarm spezifische Sonde mband (rcps) region specific partial paints Locusspezifische Sonde Subtelomersonde Die Fluoreszenz-in situ-hybridisierung ist eine spezifische und hoch sensitive Methode und bietet ein breites Spektrum an Einsatzmöglichkeiten für Diagnostik und Forschung. Der Nachweis kann sowohl an Metaphasechromosomen aus kultivierten Zellen als auch ohne Kultivierung direkt an Interphasezellkernen durchgeführt werden. Dabei kann die FISH-Methode auch solche Veränderungen aufdecken, die in der klassischen Cytogenetik nicht sichtbar sind. Da die LSI-Sonden in der Regel nur maximal wenige hundert Kilobasen und damit nur einen Bruchteil eines Chromosoms überspannen, ergeben sie vergleichsweise schwache Fluoreszenzsignale. Demzufolge werden hohe Anforderungen an die Sensitivität der FISH Mikroskopie gestellt (hohe Transmission, gutes Signal-Rausch-Verhältnis, hohe Auflösung und Farbtrennung). 12
19 1.5.2 Comparative Genomhybridisierung (CGH) Während die Anwendung der FISH sowohl an Metaphasechromosomen als auch an Interphasekernen Kenntnis über die zu untersuchende Region voraussetzt, ermöglicht die in jüngster Zeit entwickelte Technik der Comparativen Genomischen Hybridisierung (CGH) komplette Genome auf chromosomale Veränderungen zu untersuchen. Die CGH wurde unabhängig von zwei Arbeitsgruppen entwickelt (Kallioniemi et al. 1992, du Manoir et al. 1993) und verbindet die Vorteile des molekularen Ansatzes, d.h. die Unabhängigkeit von der mitotischen Aktivität des zu untersuchenden Gewebes, mit den Vorteilen der Cytogenetik, nämlich der Darstellung des gesamten Chromosomenkompartiments. Somit bietet die CGH als Screeningmethode einen generellen Überblick über alle unbalancierten genetischen Veränderungen der zu untersuchenden DNA und ermöglicht eine Beurteilung der genomischen Veränderungen auf chromosomaler Ebene. Von besonderem Interesse ist, dass eine CGH auch an langjährig archiviertem Material durchgeführt werden kann, wobei auch sehr kleine Gewebeproben ausreichend sind. Im Bedarfsfall kann die DNA über eine PCR mit degenerierten Primern (DOP-PCR) universell vermehrt werden (vgl. Kap ), so dass für eine Analyse die DNA einiger Zellen ausreichend ist, um chromosomale Imbalancen gesichert zu erfassen (Lichter et al. 1996). Anfänglich wurde die CGH ausschließlich als Screeningverfahren zur Aufdeckung von genetischen Imbalancen, bei der Suche nach involvierten Genen bei der Entstehung, Verständnis der Pathogenese und Progression von Tumoren und damit zur Klassifikation und Malignitätsbeurteilung in der Tumorcytogenetik eingesetzt (Bentz et al. 1995, Kallioniemi et al. 1995). Im Laufe der letzten Jahre erfuhr die CGH allerdings auch in anderen diagnostischen Zusammenhängen, wie z. B. der Präimplantationsdiagnostik, der forensischen Wissenschaft, der Pränataldiagnostik oder der Fetalpathologie bei Fragestellungen aus der Reproduktionsmedizin, zunehmend an Bedeutung (Bryndorf et al. 1995, Hummel et al. 1999, Bartsch et al. 2001, Fritz et al. 2001, Delhanty 2005). Ebenso findet die CGH Anwendung in der Diagnostik von Patienten mit mentaler Retardierung und Dysmorphiezeichen mit normalem Karyotyp zur Aufdeckung submikroskopischer chromosomaler Rearrangements (Joly et al. 2001). Im Rahmen der Fetalpathologie nimmt die Diagnostik und die ätiologische Zuordnung von Fehlbildungen eine zentrale Rolle ein, die bei nachfolgender genetischer Beratung Grundlage zur Abschätzung des Wiederholungsrisikos ist. Dem Verdacht auf eine chromosomale Aberration kann jedoch oftmals nicht nachgegangen werden, da eine 13
20 Autolyse oder eine vorangegangene Fixierung des fetalen Gewebes die Abklärung nicht zulässt (Dietze et al. 2004). Die Arbeitsgruppe von Bryndorf (1995) konnte erstmals nachweisen, dass mittels CGH numerische Chromosomenaberrationen in kultiviertem bzw. unfixiertem Placentagewebe sicher zu diagnostizieren sind. In der eigenen Arbeitsgruppe gelang retrospektiv der Nachweis einer Duplikation 2p bei zwei dystrophen Feten und einer Duplikation 1q bei einem makrocephalen Feten (Aviram- Goldring et al. 2000, Bartsch et al. 2001) Methodischer Hintergrund der CGH Die Methode der CGH basiert auf einer Markierung mit unterschiedlichen Fluorochromen von Test-DNA und Referenz-DNA. Definitionsgemäß wird die zu testende DNA mit einem grünen Fluoreszenzfarbstoff (FITC) und die Referenz-DNA mit einem roten Fluoreszenzfarbstoff (Texas Red) markiert. Bei den mit Fluorescein markierten Nukleotiden ist die emittierte Farbe abhängig von der genomischen Sequenz. G/C reiche Sequenzen erscheinen demnach mehr gelb als A/G reiche Sequenzen. Die Farbe der mit Texas-Red markierten Nukleotide wird jedoch gleichmäßig als blau/rot beschrieben. Jedes einzelne fluorochrommarkierte Nukleotid hat dabei sein eigenes Anregungsspektrum und seine spezifische Emission (Abb. 5). Zum Nachweis genetischer Imbalancen wird die zu testende DNA im Verhältnis 1:1 mit einer Referenz-DNA eines normalen männlichen Spenders gemischt. Diese DNA- Mischung wird an Metaphasechromosomen von gesunden männlichen Spendern hybridisiert. Das Vorgehen wird als reverse in situ-hybridisierung bezeichnet, da bei diesem Verfahren nicht direkt die Chromosomen des zu untersuchenden Materials analysiert werden. Bei der Anlagerung der DNA-Mischung an die korrespondierenden DNA-Abschnitte der Metaphasechromosomen kompetitieren die Anteile aus der Test- und Referenz- DNA um Bindung. Liegen alle Chromosomenabschnitte der Test- und Referenz-DNA im gleichen Verhältnis vor, so kommt es zu einer homogenen Mischanfärbung der Chromosomen. Sind jedoch in der Test-DNA im Vergleich zur Referenz-DNA einzelne Chromosomenabschnitte überrepräsentiert, so färbt sich der betreffende Abschnitt des Metaphasechromosoms vermehrt in der Farbe der Test-DNA an. Fehlen in der Test- DNA Segmente, so überwiegt an der betreffenden Stelle die Färbung der Referenz- DNA. Die Fluoreszenzverteilung und -intensität an den hybridisierten Metaphasechromosomen wird mittels eines Bildanalysesystems für jedes Fluorochrom separat erfasst und in einem Fluoreszenzratioprofil verrechnet (siehe Abb. 4). Die 14
21 Ausprägung der Fluoreszenzunterschiede hängt dabei von der Größe des veränderten Chromosomenabschnitts sowie dem Anteil der veränderten Zellen in der Probe ab, aus der die Test-DNA gewonnen wurde. Die detektierbaren Veränderungen werden entweder als DNA-Gewinn oder Verlust klassifiziert. Abbildung 4: Schematische Darstellung der vergleichenden Comparativen Genom-Hybridisierung (CGH): Testund Referenz-DNA werden in einem Mischungsverhältnis von 1:1 auf normale Metaphasechromosomen hybridisiert. Beide Proben konkurrieren um ihre spezifischen Bindungsstellen. Mittels digitaler Bildanalyse wird die Fluoreszenzverteilung und intensität für jedes Fluorochrom separat erfasst und zu einem Fluoreszenzratio-Profil verrechnet. Bei gleichen Verhältnissen ergibt sich ein Profilwert von 1. Im Falle einer Über- bzw. Unterrepräsentation kommt es zu einem Abweichen des Fluoreszenzratioprofils von der Mittellinie. Ein einfacher Zugewinn (Trisomie) entspricht der Fluoreszenzratio von 3:2 (entsprechend 1.5:1) und ein einfacher Verlust (Monosomie) der Fluoreszenzratio von 1:2 (0.5:1). Mehrfache Zugewinne und Verlust ergeben entsprechend höhere oder niedrigere Ratiowerte (Rieder 1998). Ausgeprägte genomische Imbalancen bewirken Veränderungen in den Fluoreszenzintensitäten, die am Mikroskop mit bloßem Auge erkennbar sind. Dagegen können kleinere Verschiebungen der Fluoreszenzfärbungen nur mit Hilfe einer rechnergestützten digitalen Bildanalyse der Farbzusammensetzung aufgedeckt werden (Forozan et al. 1997; Knuutila et al. 1998). 15
22 Abbildung 5: Emissions- und Exititionsmaxima der entsprechenden fluorochrommarkierten Nukleotide (Technical Data, Fa. NEN Life Science Products) FITC-dATP FITC-dCTP Wellenlänge: Exitition 496nm (Maxima) Emission 517nm Wellenlänge: Exitition 494nm (Maxima) Emission 517nm TR-dATP TR-dCTP Wellenlänge: Exitition 593nm (Maxima) Emission 612nm Wellenlänge: Exitition 593nm (Maxima) Emission 612nm Sensitivität und Validität der CGH Über CGH werden genetische Veränderungen auf chromosomaler Ebene lediglich als DNA-Zugewinne oder Verluste im unbalanciertem Zustand erfasst. Sie lässt keine Aussagen zu balancierten Chromosomenveränderungen zu, die jedoch im Abortgeschehen eher eine untergeordnete Rolle spielen. Repetetive Sequenzen sind in hoher Zahl in allen Centromeren, Telomeren und einigen chromosomspezifischen Regionen wie 1p, 16p sowie den Chromosomen 19 und 22 vorhanden. Da die Länge dieser Regionen zwischen verschiedenen Individuen hochvariabel ist, können Abweichungen in der DNA der Test- und Referenzperson die CGH-Analyse stören (Weiss et al. 1999). Demzufolge werden die centromerischen und pericentromerischen Regionen sowie die kurzen (p-) Arme der akrocentrischen Chromosomen von einer CGH-Analyse ausgegrenzt (Kirchhoff et al. 1999). Des Weiteren sind Abweichungen der Fluoreszenzintensität (FI) in den Telomerbereichen der Chromosomen mit Vorsicht zu werten, da die FI graduell zu den Telomeren hin abnimmt (Kallioniemi et al. 1994). Bei der Detektion von Ringchromosomen und der Abklärung der genauen Bruchpunkte kann es hierbei zu Fehlinterpretationen kommen. Häufig treten auch falsch positive DNA-Zugewinne an den Chromosomenregionen 16
23 1p32 pter und 12q, sowie der Chromosomen16, 19 und 22 auf. Da die Trisomie 16 eine der häufigsten Abortursachen ist, kann ein methodisch bedingter Zugewinn am Chromosom 16 ein falsch positives Ergebnis ergeben. Diese sind auf differente Hybridisierungseigenschaften der unterschiedlich markierten DNAs in GC-reichen Regionen zurückzuführen. Dieses methodische Problem, welches die CGH-Auswertung erschwert, kann durch eine reverse CGH, bei der die Test-DNA rot und die Referenz- DNA grün markiert ist, umgangen werden (Kallioniemi et al. 1994, Bryndorf et al. 1995, du Manoir et al. 1995). Da die CGH-Analyse nur Änderungen der Anzahl eines DNA-Abschnitts in Relation zur durchschnittlichen Kopienzahl der Test-DNA erfasst, können Ploidie-Änderungen (zahlenmäßige Veränderungen eines haploiden Chromosomensatzes) nicht nachgewiesen werden. Triploidien bzw. Tetraploidien erzeugen keine Verschiebung im Fluoreszenz-Ratioprofil der einzelnen Chromosomen. Hinweise auf eine Ploidie- Mutation können allenfalls aus der relativen Ratio von grüner und roter Fluoreszenz erhalten werden, die über nachfolgende Untersuchungen (FISH mit locusspezifischen Sonden, Mikrosatellitentypisierung) zu bestätigen wären Mikrodissektion Eine signifikante Limitierung der konventionellen cytogenetischen Bänderungstechniken ist, dass nicht alle cytogenetisch erkannten Aberrationen, wie z.b. Markerchromosomen oder unbalancierte Rekombinationen genau zu charakterisieren sind, insbesondere dann nicht, wenn das zu identifizierende Chromosomensegment keine charakteristischen Bänderungsstrukturen enthält. Im Rahmen der prä- und postnatalen cytogenetischen Diagnostik sowie in der Tumorcytogenetik nimmt die möglichst exakte Charakterisierung chromosomaler Aberrationen aber eine zentrale Rolle sowohl bei der ätiologischen Zuordnung von Fehlbildungen und Tumorentitäten als auch bei der genetischen Beratung als Grundlage zur Abschätzung eines Wiederholungsrisikos ein (z. B. Eggermann et al. 1996, Friedrich et al. 2001, Fritz et al. 2001). Die Chromosomenmikrodissektion ist eine Methode, die es ermöglicht, von definierten Chromosomenregionen DNA zu erhalten. Sie stellt somit einen speziellen Aspekt der Zellchirurgie dar (Hagag & Viola 1993). Das bei der Dissektion isolierte Material bildet die Grundlage für vielfältige weitere Analysen, wie z.b. die Generierung spezifischer DNA-Sonden für die Fluoreszenz-in situ-hybridisierung zur Abklärung chromosomaler Aberrationen. So befassen sich beispielsweise zahlreiche Publikationen mit der 17
24 erfolgreichen Charakterisierung von de novo Markerchromosomen in der pränatalen cytogenetischen Diagnostik (u.a. Meltzer et al. 1992; Müller-Navia et al. 1995, Hu et al. 2004). Die Isolierung spezifischer Zellpopulationen ermöglicht auch die retrospektive Analyse histologischer Präparationen, oder dient als Ausgangsmaterial für Genexpressionsstudien sowie gentechnologisch orientierte Forschungsvorhaben, beispielswiese für die Positionsklonierung zur Eingrenzung von Kandidatengenen (Lüdecke et al. 1989, Walch et al. 2000, Burgess & Hazelton 2000). Die ersten Mikromanipulationsinstrumente wie beispielsweise Mikronadeln wurden von DeFonbrune bereits 1949 entwickelt. Edström und Mitarbeiter (1964) nutzten diese Technik zur Isolierung subzellulärer Strukturen. Die Arbeitsgruppen von Scalenghe (1981) und Henning (1983) berichteten zu Beginn der 80er Jahre über die Anwendung der Methode der chromosomalen Mikrodissektion an Drosophila-Riesenchromosomen erfolgte erstmals die Mikrodissektion eines menschlichen Chromosoms (Bates et al. 1986). Eine Weiterentwicklung dieser mechanisch, manuell orientierten Mikrodissektion, die in hohem Maße von der Geschicklichkeit des Operators abhängig ist, ist die Laser Capture Microdissection (LCM). Bei dieser Methode werden die ausgewählten Zellen mit Hilfe eines Lasers an einen Polymerfilm gebunden. Ein großer Vorteil ist, dass bei diesem Prozess das Gewebe nicht zerstört wird und die Morphologie der selektionierten Zellen erhalten bleibt. Die Präzision dieses Vorganges der LCM ist abhängig von dem optischen Auflösungsvermögen zur Identifikation der Targets. Zellstrukturen mit einer Größe von 3-5µm können isoliert werden. Die Entwicklung der LCM ermöglicht beispielsweise Untersuchungen von spezifischen Genexpressionsmustern von unterschiedlichen Geweben eines Patienten (Simone et al. 1998). Methodische Voraussetzung und Ablauf einer Mikrodissektion Grundvoraussetzungen sind: ein Invertoskop mit hoher Auflösung zur genauen Identifizierung der Chromosomen bzw. der Chromosomenbande. ein (manueller oder elektronisch gesteuerter) Mikromanipulator Der Mikromanipulator steuert den Nadelhalter in der X-, Y- und Z-Achse. Die Dreiachsbewegung wird benötigt, um möglichst große Präzisionsbewegungen während des Dissektionsvorganges zu erreichen. Eine Hydraulikvorrichtung gestattet eine glatte und vibrationsfreie Bewegung. 18
25 eine Apparatur für das Ausziehen der Mikronadeln ( Pipettenpuller ) Die Dissektionsnadeln werden mit Hilfe eines Pullers gezogen. Die Spitze muss eine Dicke von weniger als 0,5µm aufweisen und dennoch flexibel genug sein, um Druck auszuüben ohne zu brechen. Erreicht wird die Qualität optimalerweise durch eine Doppel-Pull-Methode, bei der die Nadeln in zwei Heizschritten gezogen werden. Der methodische Ablauf lässt sich in die folgenden Schritte unterteilen (Abb. 6). A: Präparation und Färbung geeigneter Metaphasechromosomen Die Präparation, Färbung und Behandlung der Chromosomen für die Mikrodissektion hat Einfluss auf den gesamten Schneidevorgang. Harte Chromosomen lassen sich präziser mikrodissezieren als weiche Chromosomen. Dies ist besonders vorteilhaft, wenn definierte Banden isoliert werden sollen (Senger et al. 1990). Die Härte der Chromosomen nimmt mit der Alterung in Ethanol und dem Trocknungsvorgang vor der GTG-Bänderung zu. B: Dissektion der zu analysierenden Chromosomen/Chromosomensegmente mittels Mikronadeln über einen Mikromanipulator (B). C: Sammeln der isolierten Fragmente in einem Reaktionsgefäß (C) zur weiteren Verwendung wie z.b. für die Generierung von DNA-Sonden. Abbildung 6: Schematische Darstellung der chromosomalen Mikrodissektion. A: Identifizierung der gebänderten Chromosomen im Lichtmikroskop und Positionierung der Mikronadel; B: Herausschneiden der zu untersuchenden chromosomalen Region mit Hilfe der Mikronadel; C: Sammeln der chromosomalen Fragmente in einem Reaktionsgefäß für anschließende Untersuchungen Reverse Painting CGH- Analysen Positionsklonierung A B C Die Mikrodissektion der zu untersuchenden Chromosomenregionen ermöglicht eine äußerst präzise cytogenetische Analyse aller Rearrangements (Markerchromosomen, balancierte bzw. unbalancierte Translokationen, Duplikationen, Deletionen und Insertionen) (Fritz et al. 2001, Sanchez-Garcia et al. 2001, Dietze et al. 2003). 19
26 Die Identifizierung unbekannter chromosomaler Rearrangements erfolgt dabei über eine FISH an Metaphasechromosomen eines gesunden Spenders. Der Begriff des Reverse Chromosome Painting wurde zuerst von Carter et al. (1992) geprägt. Hierfür wird die durch Mikrodissektion gewonnene DNA zunächst universell amplifiziert, in einer 2. PCR mit einem Fluorochrom markiert, mittels eines Trägerreagenz gefällt und als Sonde auf normale männliche Metaphasechromosomen für eine Fluoreszenz-in situ- Hybridisierung (FISH) eingesetzt. Die zugehörigen detektierten Signalpositionen erlauben die exakte Identifizierung von Chromosomenregionen, die in die Strukturveränderung involviert sind (Müller-Navia et al. 1996) Mikrosatellitenanalyse zur Abklärung der parentalen Herkunft von Chromosomenaberrationen Menschliche Satelliten-DNA besteht aus sehr langen Folgen tandemförmiger Wiederholungen von DNA-Sequenzen. Sequenzen dieser Art liegen im Allgemeinen zwischen den Genen oder innerhalb von Introns, werden nicht transkribiert und sind für die meisten heterochromatischen Bereiche im Genom verantwortlich (Strachan & Read 2005). Es gibt mehrere Hauptklassen direkter repetitiver Sequenzen (Tab. 6). Unter Mikrosatelliten-DNA versteht man eine kurze Folge tandemartiger Wiederholungen sehr einfacher Sequenzen von 1-12bp, die insgesamt meist kürzer als 0,1kb sind. Bei repetetiven Einheiten bestehend aus 2 Nukleotiden findet man häufig Folgen von CA (bzw. TG auf dem komplementären Strang). Diese nehmen 0,5% des Genoms ein und sind hochpolymorph. CT/AG- Wiederholungen erscheinen alle 50kb und haben einen Anteil von 0,2% im Genom. Repetitive Einheiten aus Tri- und Tetranukleotiden sind dagegen relativ selten, oft aber sehr polymorph und eher selten in codierenden Gensequenzen zu finden. Kommt es zur pathologischen Ausdehnung solcher Trinukleotid-Einheiten in codierenden Bereichen, können diese für Krankheitsbilder verantwortlich sein (z.b. Chorea Huntington, fragiles X-Syndrom). Minisatelliten-DNA dagegen wird als mittellange Reihe (etwas 0,1-20kb) von kurzen sich direkt wiederholenden DNA-Sequenzen bezeichnet. Sie sind über größere Bereiche des Kerngenoms verteilt. Der größte Teil des Heterochromatins am Centromer besteht aus alphoider DNA mit einer Wiederholungseinheit von 171bp. 20
27 Tabelle 6: Hauptklassen direkter repetitiver DNA- Sequenzen in der menschlichen DNA (nach Strachan & Read 2005) Klasse Satelliten-DNA 100kb bis mehrere Megabasen lang Größe der Wiederholungseinheit (bp) Hauptsächliche Lokalisation auf den Chromosomen besonders an Centromeren Satelliten 2 und 3 5 die meisten, möglicherweise alle Chromosomen Satellit 1 (AT-reich) Centromeren-Heterochromatin der meisten Chromosomen und andere Heterochromatin- Bereiche (alphoide DNA) 171 Centromeren-Heterochromatin aller Chromosomen 68 Centromeren-Heterochromatin der Chromosomen 1, 9, 13, 14, 15, 21, 22, Y Minisatelliten (0,1-20kb) Hypervariable Familie Telomer- Familie alle Chromosomen, oft in Telomernähe alle Telomere Mikrosatelliten 12 verstreut auf allen Chromosomen, einige sehr kleine Bereiche mit sehr einfachen Sequenzen Die Variabilität im menschlichen Genom ist weiterhin durch polymorphe DNA-Marker wie Restriktions-Fragment-Längen-Polymorphismen (RFLPs), VNTR (variable number of tandem repeats)-polymorphismen (mittellange Minisatelliten-DNA von 5-64bp Länge), LINE (long intersperced nuclear element) und STR`s (short tandem repeats 8-25 Wiederholungen) charakterisiert. SNPs (single nucleotid polymorphisms) dagegen sind genetische Variationen in der Bevölkerung, die durch den Austausch einzelner Basen im Laufe der Evolution enstanden sind. Diese Marker finden hauptsächlich in der forensischen DNA-Analyse, bei der Kopplungsanalyse Abstammungsbegutachtung und Pharmakogenetik Anwendung. Bei der Pharmakogenetik werden zum einen neue Medikamente mit besserem Nutzen entwickelt und zum anderen geprüft, inwieweit die genetischen Anlagen den Erfolg einer Medikamententherapie beeinflussen. Anwendung der Mikrosatellitenanalyse zur Feststellung der parentalen Herkunft chromosomaler Aberrationen Die zunehmende Entdeckung von hochinformativen Tri- und Tetranukleotidmarkern führte zu einer genomdeckenden Verteilung amplifizierbarer Loci. Dieser Schritt eröffnete die Möglichkeit der Erforschung phänotypischer Effekte chromosomaler Aberrationen in Abhängigkeit der parentalen Herkunft. Aber auch bezüglich der Aufdeckung verschiedener Entstehungsmechanismen chromosomaler Aberrationen erweist sich die parentale Herkunftsbestimmung als hilfreich, da sich auf diese Weise der Elternteil festlegen lässt, bei dem die 21
28 Fehlverteilung stattgefunden haben muss. Davon ausgehend können ursächliche Faktoren wie z.b. im Falle der Trisomien ein erhöhtes mütterliches Alter untersucht werden. Die meisten Informationen über die elterliche Herkunft von Chromosomenstörungen hat man aus Familienuntersuchungen von lebendgeborenen Probanden mit den häufig auftretenden Trisomien 13, 18 und 21 gewonnen. Über den elterlichen Ursprung der verschiedenen Aneuploidien in Spontanaborten ist relativ wenig bekannt und die Fallzahlen sind vergleichsweise gering. Generell zeigte sich, dass autosomale Trisomien überwiegend auf einen Segregationsfehler in der mütterlichen Gametogenese beruhen (Tab. 7). Die Analyse von hochpolymorphen chromosomenspezifischen Mikrosatelliten erlaubte neben der Feststellung der parentalen Herkunft der Chromosomenaberration auch Aussagen über die Verteilung von crossing-over Ereignissen, die Rückschlüsse zulassen, in welchem Stadium sich das Non-disjunction ereignet haben muss. Tabelle 7: Parentaler Ursprung von einigen ausgewählten Aneuploidien in Spontanaborten (Lorda-Sanchez et al. 1992, Hassold et al. 1992, 1995, Fisher et al. 1993, 1995, Robinson et al. 1999). Trisomie n Ätiologie des überzähligen bzw. fehlenden Chromosoms maternal paternal (80%) 2 (20%) (86%) 8 (14%) (100%) (100%) (100%) (96%) 2 (4%) 45,X (83%) 9 (17%) Wegen der geringen Größenunterschiede ist zur Analyse der Mikrosatelliten eine gelelektrophoretische Auftrennung in einer hochauflösenden Polyacrylamidmatrix notwendig. Voraussetzung für parentale Zuordnung ist eine Heterozygotie der zu untersuchenden Loci. Bei einer Trisomie sind im fetalen Gewebe entsprechend den dreifach vorhandenen Chromosomen drei Allelbanden nachzuweisen. Bei Vorliegen von homozygoten Markern kann eine Auswertung auch anhand eines Dosis-Effekts erfolgen (vgl. auch Abb. 27). 22
29 1.6 Ziel der vorliegenden Dissertation Das Ziel dieser Dissertation ist die retrospektive, möglichst genaue molekularcytogenetische Charakterisierung von bisher nicht exakt zuzuordnenden Chromosomenstörungen von ätiologisch ungeklärten Aborten mit morphologisch auffälligen Feten. Mit diesem Projekt soll einerseits auf Phänotypebene, andererseits auf molekularcytogenetischer Ebene ein Beitrag zur Ursachenforschung von Entwicklungsstörungen während der Embryogenese geleistet werden. Denn erst die Kenntnis der genauen Herkunft überzähliger oder verloren gegangener Chromosomensegmente und die Bestimmung ihrer Bruchpunkte erlaubt eine Stellungnahme zur Frage der phänotypischen Manifestation und Prognose einer Chromosomenanomalie und ist im Rahmen einer Pränataldiagnostik häufig entscheidend für Fortführung oder Abbruch einer Schwangerschaft. Über die Korrelation mit den erhobenen klinischen Daten soll daher eine Aufstellung von prognostischen Kriterien angestrebt werden, die bei der genetischen Beratung Betroffener und ihrer Familien hilfreich sein können. Insgesamt sollen 55 Abortfälle bearbeitet werden, deren jeweilige fetale Fehlbildungen einen begründeten Verdacht auf eine chromosomale Störung geben. Die Untersuchungen sollen an verschiedenen asservierten fetalen oder placentaren Gewebeproben erfolgen. Ein wesentlicher Teil der Arbeit soll in der Evaluierung und Optimierung von Methoden zur DNA-Isolierung aus Formalin fixiertem und in Paraffin eingebettetem Gewebe als grundlegende Voraussetzung für die weiterführenden molekularcytogenetischen und molekulargenetischen Methoden liegen. Es sollen einflussnehmende Parameter auf die Qualität der DNA evaluiert werden. Des Weiteren soll insbesondere die komplexe Methode der CGH-Analyse mit DNA aus archiviertem Abortgewebe optimiert werden, um retrospektiv den Nachweis von Chromosomenaberrationen zu ermöglichen. Anhand der ausgewählten fetalpathologischen Fälle sollen die Möglichkeiten, Probleme und Grenzen bei der Evaluierung von chromosomalen Aberrationen an Formalin fixiertem und in Paraffin eingebettetem Material ermittelt werden. Die Ergebnisse sollen möglichst mit weiteren molekularcytogenetischen und molekulargenetischen Methoden überprüft werden. Wenn möglich, soll zudem die Abklärung der parentalen Herkunft der jeweiligen Chromosomenstörung erfolgen, um zu prüfen, ob die parentale Herkunft Einfluss auf den Manifestationszeitpunkt, Typ und Schweregrad sowie auf den Ausgang der Schwangerschaft nehmen kann. 23
30 2 Material 2.1 Chemikalien Alle Chemikalien für die Puffer und Lösungen wurden in p.a.-qualität bezogen. Alle nicht näher bezeichneten Chemikalien stammen ausschließlich von den folgenden Firmen: Gibco BRL (USA), Merck (Darmstadt), Riedel-de Häen (Seelze), Roth (Karlsruhe). Agarose Albumin Bovine (BSA) Ammoniumpersulfat Anti-Digoxigenin-Fluorescein Fab-Fragments Aqua ad iniectabilia Bariumhydroxid Biotin-11-dUTP Biotinylated Anti-Avidin D Borsäure (H 3 BO 3 ) Bromphenolblau DAPI (4,6-Diamidino-2-phenylindol) Dextransulfat DNA 100 base pair Ladder DNA Marker VIII EDTA-Dinatriumsalz Eisessig 100% Ethanol Ethidiumbromid (10mg/ml) Euparal Fluorescein Avidin DCS (Cell Sorter Grade) Formaldehyd Gelatine Gellösung A Gellösung B Giemsa-Lösung Glycerin Hering Sperm DNA (10mg/ml) Gibco BRL, USA Sigma, Deisenhofen Roth, Karlsruhe Boehringer, Mannheim Braun, Melsungen Merck, Darmstadt Sigma, Deisenhofen Vektor, USA Merck, Darmstadt Roth, Karlsruhe Sigma, Deisenhofen Pharmacia, Wien ROCHE, Mannheim ROCHE, Mannheim Roth, Karlsruhe Merck, Darmstadt Merck, Darmstadt Serva, Heidelberg Schmid, Köngen Vektor, USA Roth, Karlsruhe Merck, Darmstadt Roth, Karlsruhe Roth, Karlsruhe Merck, Darmstadt Roth, Karlsruhe Promega, USA 24
31 Human COT 1-DNA Kaliumchlorid Kalium-di-hydrogenphosphat Lithiumchlorid Marabu Fixogum Rubber Cement Natriumacetat Natriumcarbonat Natriumchlorid Natriumcitrat Natrium-di-hydrogenphosphat Natriumhydroxid NP-40 Nuclei Lysis Solution Polyoxyethylensorbitan Monolaurate (Tween20) Protein Precipitation Solution Salpetersäure 65% Salzsäure Silbernitrat Sodium Dodecyl Sulfate Stickstoff (flüssig) TEMED Texas Red Avidin DCS Tris-(hydroxymethyl)aminomethan Tris-HCl Trypsin Vectashield Mounting Medium Xylencyanol Xylol Invitrogen, Berlin Merck, Darmstadt Merck, Darmstadt Merck, Darmstadt Erich Feucht GmbH, Tamm Merck, Darmstadt Merck, Darmstadt Merck, Darmstadt Riedel-de Häen, Seelze Merck, Darmstadt Merck, Darmstadt Merck, Darmstadt Promega, USA Sigma, Deisenhofen Promega, USA Merck, Darmstadt Merck, Darmstadt Merck, Darmstadt BRL, USA Messer Griesheim, Darmstadt Roth, Karlsruhe Vektor, USA Roth, Karlsruhe Merck, Darmstadt DIFCO, USA Vektor, USA Roth, Karlsruhe Roth, Karlsruhe 25
32 2.2 Lösungen, Puffer und Medien Alle Lösungen, Puffer und Nährmedien werden, wenn nicht anders angegeben, mit entmineralisiertem Wasser angesetzt, autoklaviert oder sterilfiltriert. Der ph-wert wird mit Salzsäure oder Natronlauge eingestellt Medien, Puffer und Lösungen für die Zellkultur Antibiotikum / Antimycotikum-Lösung: Gibco BRL, USA Amphotericin (25µg/ml) Penicillin/Streptomycin (10.00 units/ml) Chang-Medium A, Supplement B Laboserv, Gießen Colcemid-Lösung (10µg/ml) Boehringer, Mannheim fetales Kälberserum Gibco BRL, USA L-Glutamin 200M (100x) Gibco BRL, USA Mc Coy s 5-Medium Gibco BRL, USA Natriumbicarbonat 7,5% Gibco BRL, USA Trypsin-EDTA-Lösung (1x): (Trypsin 0,5%; EDTA 0,2%) Biochrom, Berlin Hypotone Lösung adhaerente Zellen: 0,5% NaCitrat / 75mM KCl (1:1, vol: vol) Suspensionskulturen: 75mM KCl PBS-Puffer: 8g NaCl; 0,2g Na 2 HPO 4 ; 0,2g KCl; 1,15g KH 2 PO 4 ; ad 1000ml A. bidest; ph 7,2 Fixativ-Lösung: Ethanol/Eisessig (3:1, vol:vol) Puffer und Lösungen für die Chromosomen-Bänderung GTG-Bänderung für die cytogenetische Diagnostik Sörensen-Puffer: 38,8ml KH 2 PO 4 -Lösung; 61,2ml Na 2 HPO 4 -Lösung Natrium-di-hydrogenphosphat-Lösung: 11,8g Na 2 HPO 4 ad 1000ml A. bidest. Kalium-di-hydrogenphosphat-Lösung: 9,1g KH 2 PO 4 ad 1000ml A. bidest. Giemsa-Lösung: 8% in Sörensen-Puffer Trypsin: Lyophilisat resubstituieren mit 5ml A. dest., aliquotieren zu je 0,5ml und bei 20 C lagern Versen-Stammlösung: 0,2g EDTA ad 1000ml PBS-Puffer Versen-Trypsin-Gebrauchslösung: 30ml Versen-Stammlsg.; 0,5ml Trypsin 26
33 GTG-Bänderung für die Mikrodissektion Ethanol: 70% Giemsa-Lösung: 30,6ml Na 2 HPO ,4ml KH 2 PO 4 gut durchmischen und davon 4ml entnehmen + 4ml Giemsa zugeben PBS-Puffer Versen-Stammlösung Versen-Trypsin-Gebrauchslösung: 50ml Versen-Stammlsg µl Trypsin (aliquotiert und bei 20 C gelagert) Puffer, Lösungen, Sonden und Antikörper für die in situ-hybridisierung 20xSSC: 350,4g NaCl + 176,4g Na-Citrat ad 2l A. dest.; ph 7,4 4xSSC: 20ml 20xSSC + 80ml A. dest. 2xSSC: 100ml 20xSSC + 900ml A. dest. 1xSSC: 50ml 20xSSC + 950ml A. dest. 0,1xSSC: 5 ml 20xSSC + 995ml A. dest. Blockungslösung: 4xSSC/Tween/3%BSA: 20ml 4xSSC + 0,5ml Tween20 + 0,6g BSA, aliquotieren a 1ml und bei 20 C lagern 2xSSC/Tween: 10ml 20xSSC + 900ml A. dest. + 1,8ml Tween20 Natronlauge: 93ml A. dest. + 7ml NaOH 1 N Mastermix: 11ml Formamid deion. + 2g Dextransulfat + 1ml 20xSSC vortexen Anti-Avidin-FITC, Biotin konjugiert: Stocklsg. 1mg/ml A. bidest.; Gebrauchslsg. 1:200 verdünnt mit 4xSSC/Tween20/1% BSA (vol:vol:vol), Endkonz. 5µg/ml Anti-Digoxigenin-Rhodamin-Fab-Fragment: Stocklsg. 200µg Lyophilisat/ml A. bidest.; Gebrauchslsg. 1:10 verdünnt; 1ml 4xSSC/Tween20 + 1%BSA (vol:vol:vol) Endkonz. 20µg/ml Antikörper für Verstärkungsreaktion: Antidigoxigenin-FITC/-Rhodamin DAPI: 70ml 4xSSC/Tween µl DAPI-Stocklsg. (200µg/ml) für M-FISH 24 Xcyte: 24 color probe mix (2x60µl) Antikörper-Detektionsmix (B-tect): Blockungslösung (2x1000µl) Detektion 1+3 (2x10µl) Detektion 2 (2x5µl) 27
34 für CGH Nicktranslationskit (Abbott Laboratories): unmarkierte Nukleotide (datp; dgtp; dctp; dttp; 0,3mM) Nicktranslationspuffer (500 mm Tris-HCl, ph 7,2, 100 mm MgSO 4 ), 1 mm DDT Nicktranslationsenzym-Mix: DNA Pol 1, DNAse 1 in 50% Glycerol Markierte Nukleotide: FITC-dATP, FITC-dCTP, Texas Red-dATP, Texas Red-dCTP (1mM, Fa. NEN) Human COT 1-DNA (1µg/ml) Natriumacetat: 3M; ph 7,0 Formamid: 100% deionisiert mit Ionenaustauscher Dowex, ph 7,0, filtriert, aliquotiert und bei 4 C gelagert Mastermix I: 4xSSC (10ml) / 20% Dextransulfat (2g) Mastermix II: 11ml Formamid deion., 2g Dextransulfat, 1ml 20 x SSC; gevortext und gelöst bei 70 C; ph 7,0 männliche gesunde Referenz-DNA mit definierter Konzentration (1µg/ml) Test-DNA DNA-Sonden zur Verifizierung und weiteren Abklärung der Ergebnisse Tabelle 8: Sonden zur Abklärung und Verifizierung der ermittelten Karyotypen (bio = Biotin; dig = Digoxigenin; SG = Spektrum Green; SO = Spektrum Orange) Sonden-Typ Markierung Firma Fall- Nr. Whole Chromosome Painting- Sonden WCP X direkt markiert (SG) Vysis V-2351/02 WCP 6 direkt markiert (SO) Vysis V-2309/01 WCP 8 direkt markiert (SG) Vysis 118/02 Centromer spezifische Sonden D4Z1 direkt markiert (SG) Vysis O-1910/01 D8Z1 direkt markiert (SO) Vysis 118/02 D14Z1 / D22Z1 bio Oncor V-1771/95 D12Z1 direkt markiert (SG) Vysis V-1771/95 DXZ1 direkt markiert (SG) Vysis V-2351/02 Locus-spezifische Sonden WHSCR (4p16.3)) direkt markiert (SG) Vysis O-1910/01 D4S96 dig Oncor O-1910/01 D4S3359 (4ptel) direkt markiert (SG) Vysis O-1910/01 GLI (12q13) dig Oncor V-1771/95 D8S504 (8ptel) direkt markiert (SG) Vysis 118/02, V-2309/01 8qtel direkt markiert (SO) Vysis LSI21 direkt markiert (SO) Vysis O-2017/02 Telomer-spezifische Sonden All Human Telomeres dig Oncor O-1919/01 28
35 2.2.4 PCR-Zusätze und Primer Enzyme: AmpliTaq DNA-Polymerase GeneAmp + 10xPCR-Puffer + 50mM MgCl 2, Perkin Elmer AmpliTaq Gold DNA-Polymerase GeneAmp + 10xPuffer (enthält MgCl 2 ), Perkin Elmer dntp-stammlösung: DNA-Polymerisation-Mix (datp, dgtp, dctp, dttp), Perkin Elmer DOP- Primer: DopMueNa 5 -CCG-ACT-GCA-GNN-NNN-NAT-GTG-G- 3 Bio-11-dUTP: 50nmol, 1mM BSA acetyliert: 10mg / 2ml A. dest. gelöst Stammlösung, Endkonz. 5ng/µl Sammelpuffer: 1M MgCl 2 Stammlsg., Endkonz. 2,5mmol/l; 1M KCl Stammlsg., Endkonz. 50mmol/l; 1M Tris-HCl Stammlsg., 10mmol/l; Brj 0,1%; Gelatine 2%, Endkonz. 0,1 mg/ml Replithermpuffer: 1 M Tris-HCl Stammlsg., Endkonz. 200mM; 2M KCl Stammlsg., Endkonz. 1M; Tween Stammlsg., Endkonz. 0,1%; NP-40 Stammlsg., Endkonz. 1% DOP PCR Master (ROCHE): DOP PCR Primer; steriles A. bidest.; DOP PCR Mastermix: 20mM Tris-HCl; 100mM KCl; 3mM MgCl 2 ; 0,01% Brij 35; je 0,4mM datp+ dctp+ dttp+ dgtp und 25U Taq-Polymerase CombiPol DNA Polymerase (Invitek):10xOptiPerform-Puffer ohne Mg 2+ ; 50mM MgCl 2 ; 5xOptiZyme Enhancer; CombiPol Polymerase (4U/ l) Lösungen und Reagenzien für die DNA-Isolierung Kitsysteme: All tissue DNA Kit (Fa. GEN-IAL, Troisdorf): Xylol; 100% / 70% Ethanol Isopropanol Invisorb Spin Tissue Mini Kit (Fa. Invitek, Berlin): Xylol; RNAse (20mg/ml) nach Proteinausfällung: Xylol QIAamp DNA Blood Maxi Kit 100% / 70% Ethanol Nuclei Lysis Solution (Promega) Proteinase K (10mg/ml) RNAse (20mg/ml) Protein Precipitation Solution (Promega) 3M Natriumacetat Lineares Polyacrylamid (Sigma) 5mg/ml 29
36 Puffer und Lösungen für die DNA-Isolierung aus gefrorenem Gewebe SE-Puffer: 75mM NaCl + 1mM Na 2 -EDTA; ph 8,0 SDS: 10%iges Sodium Dodecyl Sulfate NaCl (5M): 146,1g ad 500ml A. dest. 100% / 70% Ethanol eiskalt Lösungen und Reagenzien für die DNA-Fällung Ethanol: 70% / 100% Mastermix: 50% Formamid/ 10% Dextransulfat/ 2xSSC flüssiger Stickstoff Natriumacetat: 3M; ph 7,0 Lineares Polyacrylamid (Sigma) 5mg/ml Lösungen und Reagenzien für die Agarosegelektrophorese 1%iges Agarosegel Agarose: 1g ad 100ml 1xTBE + 1µl Ethidiumbromid (1%) Gel-/Laufpuffer: 10xTBE: 1,34M Tris-Base + 750mM Borsäure + 25mM EDTA, 81,17g Tris + 23,19g Borsäure + 4,65g EDTA ad 1l; ph 8,8 Gelladepuffer 0,25% Xylencyanol 0,25% Bromphenolblau 30% Glycerin Molecular Weight Marker VIII 35 dest Lösungen und Reagenzien für die Polyacrylamidgelektrophorese Zusammensetzung eines 8%igen Polyacrylamidgels (Gesamtvolumen 75ml) Acrylamidlösung 30% (Gel A, Roth): 19,4ml Bisacrylamidlösung (Gel B, Roth): 9,9ml 1xTBE-Puffer: 45,7ml (55,02 g/l Borat (Borsäure), 107,8g/l Tris (-base), 7,44g/l EDTA ad 1000ml A. bidest, ph 8,0) 10% Ammoniumpersulfat: 750µl (0,45g APS + 4,5ml A. dest.) TEMED (Tetramethylendiamin): 50µl 30
37 Reagenzien zur Silberfärbung 10% Essigsäure Färbelösung: 0,2% Silbernitratlösung (800mg in 400ml A. dest.) Entwicklungslösung: 100ml 30%ige Natriumcarbonatlösung + 485µl Formaldehyd Gelfixierlösung: 20ml Glycerin (2%) + 280ml 96% Ethanol + 700ml A.dest. 100bp Ladder 5 l Marker 100bp (1 g) 25 l 10xPCR-Puffer 220 l A. dest l (Bromphenolblau/Xylencyanol 20mg/ml) 37%iges 2.3 Geräte und Zubehör Nicht aufgeführt sind Werkzeuge und Geräte der Laborgrundausstattung Geräte und Zubehör für die Mikrodissektion Axiovert S100 Deckgläser (26x76mm/Dicke 1mm) Glasstäbe (1mmx15cm) Mikromanipulator 5171 Monitor (Trinitron) Puller (Typ P10) Zeiss, Jena Menzel, Braunschweig Sarasota, England Eppendorf, Hamburg Sony, Japan Narishige Group Sonstige Geräte und Zubehör Autoklav Automated Gel Stainer CO 2 -Brutschrank Filtriereinheiten (steril) Sartolab V115 Sartolab V500 Fluorometer (TKO) Gelelektrophoresekammer horizontal Gelelektrophoresekammer vertikal Model SA Gelelektrophoreseschlitten Gelkämme für Agarosegele Large Cellophane Magnetrührer Ikamag RO Gössner, Hamburg Pharmacia Biotech Heraeus, Hanau Sartorius, Göttingen Sartorius, Göttingen Hoefer, USA Gibco BRL, USA Gibco BRL, USA AGS, Heidelberg AGS, Heidelberg Novex, USA Ika-Werk, Staufen 31
38 Mikroskope Fluoreszenzmikroskop Axiophot Axioskop MC 100, Axioplan 2 Phasenkontrastmikroskop Mikrowelle Typ MWD 2920 Omni Gene-Apparat ph-meter Photometer UV-160 Pipetten Pipettenspitzen Wertheim Power Supply High Voltage P30 E442 Reaktionsgefäße Falcontubes (50ml) Schüttelwasserbad Software Kryoröhrchen (1,5ml) Micro-Test-Tubes (1,5ml; 0,5ml) Ikarus Isis Spannungsgeber Steril-Werkbank Laminar Air (Typ HB 2448) Thermocycler Tischzentrifugen Mikrozentrifuge (Biofuge 13) Eppendorf-Zentrifuge Biofuge 28RS Vakuumzentrifuge Vakuumpumpe + Kühlaggregat Waagen Wärmeplatte Wärmeschrank Wasserbad Feinwaage Präzisionswaage Zellkultureinweg-Material (steril) Zeiss, Jena Zeiss, Jena Zeiss, Jena Bauknecht, Schorndorf HPW Diagnostics, Rabenau WTW, Weilheim Shimadzu, Japan Eppendorf, Hamburg Micro-Bio-Tec Brand, Biometra Biotechnologie-Systeme, Heidelberg Falcon, USA Nunc, Wiesbaden Eppendorf, Hamburg GFL, Münster Metasystems, Altlußheim Metasystems, Altlußheim Biometra, USA Heraeus, Hanau MWG, Ebersbach Heraeus, Hanau Eppendorf, Hamburg Heraeus, Hanau Bachhofer, Reutlingen Bachhofer, Reutlingen Sartorius, Göttingen Sartorius, Göttingen Heraeus, Hanau Heraeus, Hanau Kottermann Falcon, USA 32
39 3 Methoden 3.1 Untersuchungsgut Das Institut für Klinische Genetik verfügt über eine Sammlung von mehr als 2000 fetalpathologischen Fällen und mehr als 2700 Frühaborten. Unter diesen wurden 55 Fälle ausgewählt, bei denen das fetale Fehlbildungs- bzw. Dysmorphiemuster eine chromosomale Störung vermuten ließ, bei denen die konventionell durchgeführte Chromosomenanalyse jedoch unzureichende Befunde ergeben hatte. Bei dem Untersuchungsgut handelte es sich ausschließlich um zur Routinediagnostik eingesandtes Material. Bei der Bearbeitung patientenbezogener Daten wurde entsprechend den Richtlinien des Datenschutzes verfahren. Jede Probe wurde mit einer Kenn-Nummer versehen und nur unter dieser Etikettierung bearbeitet. Die Aborte wurden nach folgenden Kriterien ausgewählt: Aus der autoptischen Beurteilung des Fetus ergab sich ein Verdacht auf eine chromosomale Aberration. Konventionelle cytogenetische Diagnose hatte unzureichende Beurteilung hinsichtlich der diagnostizierten genetischen Imbalancen ergeben. Primär sollten zunächst Aborte mit unbalancierten Translokationen und nicht identifizierten Markerchromosomen analysiert werden. Es lag eine unbekannte Chromosomenstörung bei auffälliger Placentahistologie bzw. phänotypisch auffälliger Feten vor. Es konnte jedoch kein Zellwachstum des bei der Obduktion/Untersuchung des Abradats entnommenen Materials erzielt werden. In 6 Fällen handelte es sich um Frühaborte der SSW, in 39 Fällen um Spätaborte/intrauteriner Fruchttod zwischen der SSW. In 9 Fällen lagen keine Informationen bezüglich der Schwangerschaftswoche vor. In einem Fall handelte es sich um ein Neugeborenes. Die Untersuchung wurde an DNA aus Placentazotten, Amnion- oder fetalem Gewebe bzw. asservierten Chromosomensuspensionen und in einem Fall an EDTA-Blut durchgeführt. Der Einsatz der jeweiligen molekularcytogenetischen Techniken zur Abklärung der chromosomalen Störung war abhängig von der Art des asservierten Materials. Sie umfassten die Erhebung des chromosomalen Status mittels CGH (Kap ) einschließlich der Überprüfung der CGH-Ergebnisse mittels Mikrosatellitenanalyse (vgl. Kap ), bzw. die präzise Abklärung von 33
40 rearrangierten Chromosomen mittels Fluoreszenz-in situ-hybridisierung (Kapitel 3.3.1) und chromosomaler Mikrodissektion (vgl. Kapitel 3.3.3). Wenn möglich, sollte über eine molekulargenetische Markertypisierung die parentale Herkunft der Chromosomenstörung eruiert werden. 42 Fälle, von denen ausschließlich Formalin fixiertes und in Paraffin eingebettetes Gewebe zur Verfügung stand, wurden über eine CGH/Mikrosatelliten-Analyse bearbeitet. In 11 Fällen stand natives Gewebe zur Verfügung. 2 Fälle, von denen eine Fibroblastenkultur bzw. eine Chromosomensuspension asserviert wurde, sollen über Mikrodissektion analysiert werden. Genaue Angaben zu den Fällen, Indikationen, Fehlbildungen und Art der Untersuchungen sind aus den Tabellen A-C im Anhang zu entnehmen. 3.2 Cytogenetische Methoden Zellkultivierung Langzeitkultur aus Amnionzellen und Abortgewebe Zellen aus Fruchtwasser bzw. von Aborten wurden als Monolayer Kulturen in 50ml Gewebekulturflaschen (Fa. Falcon) in Chang Medium bei 37 C in einem 5% CO 2 Luftgemisch und bei annähernd 100% Luftfeuchtigkeit über Tage kultiviert. Abortgewebe wurde vor Ansatz der Kultur zweimal in Phosphatpuffer (PBS) gewaschen, anschließend mit einem Skalpell zerteilt und in eine Gewebekulturflasche überführt. Fruchtwasser wurde abzentrifugiert und die Zellen in Kulturflaschen überführt. Als Nährmedium wurden 5ml Chang Medium pro Ansatz verwendet. Routinemäßig wurde das Kulturmedium zweimal pro Woche durch frisches ersetzt, bis sich eine ausreichende Anzahl von Zellklonen gebildet hatte. Die Zellklone wurden dann durch Zugabe einer 0,05%igen Trypsinlösung vom Flaschenboden abgelöst, vorsichtig zur Separation der Zellen suspendiert und auf zwei Flaschen verteilt (Split 1:1). In der Regel lagen nach 1-2 Tagen weiterer Kultur genügend teilungsbereite Zellen vor, deren Zellzyklus durch Zugabe des Mitosegiftes Colcemid (0,1µg/ml Medium) in der Metaphase unterbrochen wurde. Colcemid (Desactethymethylcolchizin), ein Derivat des Colchizins, dem Gift der Herbstzeitlosen, hemmt in den sich teilenden Zellen die Ausbildung des Spindelapparates, so dass der Vorgang der Mitose blockiert wird. Die Chromosomen liegen in einer stark kontrahierten und spiralisierten Form vor, die bei der nachfolgenden Bänderung ihre Identifizierung ermöglicht. 34
41 Die adhärenten Zellen wurden anschließend durch Zugabe einer 0,05%igen Trypsinlösung vom Flaschenboden abgelöst. Der gesamte Inhalt wurde nach Zugabe von einigen Millilitern Kulturmedium in ein Zentrifugenröhrchen überführt und für 10min bei 1000rpm zentrifugiert. Der Überstand wurde dekantiert und das Sediment wurde in 5ml einer hypotonen Lösung (1% Na-Citrat-Lösung / 0.075M KCl-Lösung 1:1; v:v) resuspendiert und 20min bei 37 C inkubiert Lymphocytenkultur Für die Kultivierung von Lymphocyten wurde venöses Blut verwendet, das durch Zusatz von Heparin an der Gerinnung gehindert wurde. Die Kultivierung der Lymphocyten erfolgte in 10ml McCoy s 5A-Medium, supplementiert mit 10% fetalem Kälberserum. Zur Pufferung im physiologischen Bereich wurden 0,2ml einer 7,5% Bicarbonatlösung und zur Vermeidung bakterieller Kontaminationen des weiteren routinemäßig 0,1ml einer Antibiotika-Lösung (Penicillin/Streptomycin) dem Kulturmedium zugesetzt. Um eine ausreichende Anzahl von Metaphasen zu gewinnen, wurden die Lymphocyten mit PHA (Phytohämagglutinin) stimuliert, einem pflanzlichen Lektin, das aus Phaseolus vulgaris isoliert wird. Unter dieser Stimulation werden vorwiegend die T-Lymphocyten zum Wachstum angeregt. Die Kultivierung erfolgte für 3 Tage bei 37 C. Nach 72h wird der Zellzyklus durch Zugabe von 0,1µl Colcemid- Lösung (10µg/ml) in der Mitose unterbrochen und die Kultur für weitere 2h bei 37 C inkubiert. Die Behandlung der Zellen mit einer hypotonen Lösung dient der verbesserten Spreizung und somit der Darstellbarkeit der Chromosomen. Durch die osmotische Flüssigkeitsaufnahme werden eine Zellschwellung und eine Dehnung der Zellwand erreicht Chromosomenpräparation Im Anschluß an die hypotone Behandlung wurden die Zellsuspensionen abzentrifugiert (10min/800rpm) und durch Zugabe einer eisgekühlten Fixierlösung (Ethanol/Eisessig 1:3; v:v) fixiert und erneut für 10min bei 1000rpm abzentrifugiert. Dieser Fixiervorgang wurde dreimal wiederholt, wobei vor der letzten Zentrifugation die Zellen für 30min bei 20 C ruhten, um eine vollständige Fixierung zu gewährleisten. Die Zellsuspension wurde dann auf entfettete, kaltfeuchte Objektträger aufgetropft. Die Qualität der Präparate hinsichtlich der Zelldichte und Spreizung der Chromosomen wurde in einem Phasenkontrastmikroskop (Fa. Zeiss) überprüft. Die Objektträger wurden anschließend 35
42 24h bei 60 C inkubiert und konnten nach entsprechender Färbung für die cytogenetische Diagnostik verwendet werden Giemsa-Trypsin-Bänderung (GTG-Bänderung) Zu Beginn wurden die Präparate für wenige Sekunden in einer gepufferten Bactotrypsinlösung bei 37 C inkubiert, anschließend kurz in Ethanol und in eiskaltem PBS-Puffer gewaschen, um die Enzymreaktion zu stoppen. Die Färbung erfolgte für 15min in einer 8%igen Giemsa-Lösung bei Raumtemperatur. Nach der Färbung wurde überschüssige Giemsa-Lösung unter Leitungswasser abgespült und die Objektträger luftgetrocknet (Tab. 9). Für die mikroskopische Auswertung wurden die Präparate mit Euparal, einem Kunstharz, eingedeckt. Die bei der Erstellung der Chromosomenpräparate anfallenden Ethanol/Eisessig fixierten Zellsuspensionen wurden bei 20 C gelagert und standen für weitere cytogenetische oder molekulargenetische Untersuchungen zur Verfügung. Tabelle 9: Ablauf der Giemsa-Trypsin-Bänderung (GTG) Lösung Zeit Temperatur Funktion Trypsin-Versen-Lösung 4 6s 37 C Abbau von chromosomalen Proteinen 70 % Ethanol 10 20s RT Abstoppen der Trypsin-Reaktion PBS-Puffer ca. 30s 4 C Waschen Giemsa-Lösung (8%) 5min RT Färbung H 2 O ca. 10s RT Waschen --- über Nacht RT Trocknen Mittels hochauflösender Durchlicht-Mikroskope (Fa. Zeiss) wurden die gefärbten Präparate systematisch nach Metaphasen durchgemustert und ausgewählte Metaphasen bei einer 1000-fachen Vergrößerung analysiert. Um eine gesicherte Aussage über den Karyotyp machen zu können, wurden pro Gewebe mindestens 10 Giemsa-Trypsin (GTG) gebänderte Metaphasen gezählt und weitere 5 mit Hilfe eines Auswertcomputers karyotypisiert und dokumentiert. Die Formel für die schriftliche Niederlegung der Chromosomenbefunde richtet sich nach der internationalen Standardnomenklatur (ISCN 2005). Die Chromosomen-Präparationen, die Auswertung und Befundung wurden vom Labor für postnatale Cytogenetik des Institutes für klinische Genetik übernommen. 36
43 3.3 Molekularcytogenetische Methoden Fluoreszenz- in situ- Hybridisierung (FISH) Die FISH mit kommerziell erhältlichen Sonden wurde zur Nachuntersuchung von strukturellen Chromosomenanalysen eingesetzt. Untersucht wurden Metaphasechromosomen aus kultiviertem Abortgewebe und Amnionzellen. Die zur FISH vorgesehenen Chromosomenpräparate wurden wie unter Punkt (Tab. 19) beschrieben für die Hybridisierung vorbereitet Vorbereitung der Sonden und Hybridisierung Die Vorbereitung der DNA-Sonden richtete sich nach der Art der Sonde sowie dem Hersteller (Tab. 10). Alle Sonden (10µl pro Ansatz) wurden durch Hitze denaturiert und anschließend auf die zuvor denaturierten Chromosomen aufgetragen, mit einem 22x22 mm 2 Deckglas luftblasenfrei eingedeckt und mit Fixogum versiegelt. Die Hybridisierung erfolgte über Nacht in einer feuchten Kammer bei 37 C im Brutschrank. Tabelle 10: Vorbereitung der Sonden für die Fluoreszenz-in situ-hybridisierung Sondenart Firma Ansatz Vorbereiten Auftrag CEP centromerspezifische DNA- Sonden Oncor 8µl Mastermix 1µl Heringssperm-DNA 1µl DNA-Sonde Telomersonden Oncor 10µl aufgetaute Sonde entnehmen, Ansatz anzentrifugieren LSI locusspezifische DNA-Sonden Oncor 10µl aufgetaute Sonde entnehmen, Ansatz anzentrifugieren denaturieren für 5 min bei C, anzentrifugieren, auf Eis bis zum Auftrag inkubieren denaturieren für 10min bei 72 C, danach sofort auf Eis stellen vorwärmen bei 37 C für 5min, denaturieren für 10min bei 72 C, danach sofort auf Eis stellen bei 37 C auf Wärmeplatte bei 37 C auf Wärmeplatte bei 37 C auf Wärmeplatte WCP-, LSI-, CEP-, Subtelomer- Sonden Vysis 7µl Puffer + 1µl A. dest + 1µl Sonde denaturieren für 5min bei 73 C; auf Heizplatte bei 37 C bis zum Auftrag lagern bei 37 C auf Wärmeplatte 37
44 Fluoreszenz-Detektion und Waschung von indirekt markierten Sonden Die Biotin markierten Sonden mussten durch die Bindung von Fluorochrom markiertem Avidin (Avidin-FITC bzw. Texas-Red) nachgewiesen werden. Die Detektion der Digoxigenin markierten Sonden erfolgte über Fluorochrom gekoppelte monoklonale Antikörper. Die Waschung erfolgte wie unter beschrieben. Zur Vermeidung unspezifischer Proteinbindungen der Detektionsreagenzien wurden unspezifische Bindungsstellen mit Rinderserumalbumin (BSA, 3%) gesättigt; anschließend erfolgte die eigentliche Detektion durch Auftrag mit 50µl Antikörperlösung und Inkubation für 60min bei 37 C in einer feuchten Kammer. Ungebundene Antikörper wurden durch wiederholte Waschschritte mit 2xSSC- Puffer/Tween20 bei RT entfernt. Die Chromosomen wurden mittels 4,6-Diamidino-2- Phenylindol (DAPI-Lösung) für 5min bei RT gegengefärbt und mit Antifade (Vectashield) eingedeckt, um ein Ausbleichen der Fluoreszenzfarbstoffe zu vermeiden. Eine Übersicht über die einzelnen Arbeitsschritte bietet Tabelle 11. Die hybridisierten Meta- und Interphasen wurden an einem Zeiss-Epifluoreszenzmikroskop mit entsprechenden Filterkombinationen analysiert und ausgewertet. Tabelle 11: Detektion und Waschung nach Hybridisierung indirekt markierter Sonden Arbeitsschritte Lösung Zeit Temperatur Funktion 2 x SSC 2x5min RT Entfernung der Deckgläser 1 x SSC 5min C stringente Waschung zur Entfernung ungebundener Sonden-DNA 3% BSA-Lösung 5min RT Blockung unspezifischer Bindungsstellen Avidin-FITC Avidin-Texas-Red Anti-Digoxigenin-FITC Anti-Digoxigenin-Rhodamin 60min 37 C Fluorochrom markierter Primärantikörper für Biotin markierte DNA-Sonden 60min 37 C Fluorochrom markierter Primärantikörper für Digoxigenin markierte DNA-Sonden 2 x SSC / Tween 2x5min 37 C Waschen DAPI 5min RT Gegenfärbung der Chromosomen A. dest. ca. 1min RT Waschen 15min 37 C Lufttrocknen der Objektträger Vectashield RT Eindecken mit 24x60mm Deckgläschen In Fällen mit zu schwachem Fluoreszenzsignal, insbesondere nach Verwendung der All Human Telomeres-Sonde, konnte dies über einen Brückenantikörper verstärkt werden (Tab. 12). 38
45 Tabelle 12: FISH: Signalverstärkung mit Sekundärantikörpern - Arbeitsschritte Lösung Zeit Temperatur Funktion / Bemerkungen 4xSSC/Tween/3% BSA 5min RT Blockung Rabbit-Anti-Sheep (Kreuzreaktivität mit Antikörper der Ziege) 30min 37 C in feuchter Kammer 2xSSC/Tween 2x5min 37 C Waschen 4xSSC/Tween/ 3% BSA 5min RT Blockung Brückenantikörper für Digoxigenin markierte Sonden Goat-Anti-Rabbit-FITC 30min 37 C Fluorochrom markierter Antikörper für Digoxigenin markierte Sonden 2xSSC/Tween 2x5min 37 C Waschen DAPI 5min RT Gegenfärbung der Chromosomen A. dest. 1min RT Abspülen der Objektträger 15min 37 C Lufttrocknen der Objektträger Vectashield RT Eindecken mit 24x60mm Deckgläschen Multicolor-FISH (M-FISH) Die 24-Farben-FISH ermöglicht die simultane Darstellung der 22 Autosomen und der Geschlechtschromosomen des menschlichen Genoms in jeweils unterschiedlichen Farben. Diese 24 Farben-FISH-Paints erlauben die Untersuchung des gesamten Chromosomensatzes und sind insbesondere für Zellen mit komplexen Umbauten, die mit klassischen Bänderungsverfahren nicht vollständig aufgeschlüsselt werden können, geeignet. Um 24 unterschiedliche Farben zu erhalten, wurden die über Flow-sorting oder Mikrodissektion hergestellten chromosomenspezifischen Painting-Sonden über ein Set von 5 verschiedenen Fluorochromen (Alexa 228 Cy5 die einzigartige Fluorochromkombination ein hochcharakteristisches Emissionsspektrum auf, das eine genaue Zuordnung der Chromosomen ermöglicht. Für die Versuche wurde der M-FISH-Kit der Firma Metasystems verwendet. Die Vorbehandlung der Objektträger und deren Denaturierung erfolgten wie in Kapitel beschrieben. 12µl des Probengemisches pro Spot wurden für 5min bei 75 C denaturiert, 30min bei 37 C inkubiert und anschließend auf die denaturierten Metaphasechromosomen aufgetragen und für 2-4 Tage hybridisiert. Mit Ausnahme von Fluorochrom Cy5 waren alle Nukleotide direkt mit dem jeweiligen Fluorochrom gekoppelt. Cy5 wurde über Avidin-Cy5 mit Signalverstärkung visualisiert. 39
46 (Arbeitsschritte siehe Tab. 13). Die Chromosomen wurden mit DAPI gegengefärbt, luftgetrocknet und mit Vectashield eingedeckt. Die Präparate wurden am Computer über ein spezielles Programm (ISIS-MFISH der Firma Metasystems, Altlussheim) ausgewertet. Tabelle 13: M-FISH: Detektion der Biotin-markierten Sonden - Arbeitsschritte Lösungen / Menge Zeit Temperatur Funktion Blockungsreagenz 15min 37 C Blockung 4xSSC/Tween 1min RT Waschen Mix aus 50µl, Blockungsreagenz und 1µl Detektion min 37 C Detektion zur Signalverstärkung von Cy5 4xSSC/Tween 2x3min RT Waschen Mix aus 50µl, Blockungsreagenz und 1µl Detektion 2 30min 37 C Signalamplifikation 4xSSC/Tween 2x3min RT Waschen Mix aus 50µl, Blockungsreagenz und 1µl Detektion min 37 C Detektion 4xSSC/Tween 2x3min RT Waschen DAPI 5min RT Gegenfärbung Comparative Genomhybridisierung (CGH) Markierung der genomischen DNA über Nicktranslation Für eine CGH-Analyse wurde die genomische DNA mittels Nicktranslation markiert (Rigby et al. 1977). Hierzu wurde ein eigens für diese Anwendung optimierter vorgefertigter Reagentiensatz verwendet (Nicktranslation Kit, Fa. Vysis). In dem Reaktionsgemisch für die Nicktranslation befand sich zum einen die zu markierende Ausgangs-DNA und zum anderen das für die Reaktion notwendige Puffersystem, Wasser, Nukleotide und das Enzymgemisch. Die Fluorochrom markierten Nukleotide (Fa. NEN) wurden wie in Tabelle 14 beschrieben dem Reaktionsgemisch zugesetzt. Bei der Nicktranslation führt man in einen DNA-Strang Brüche (nicks) mit Hilfe einer geeigneten Endonuclease wie die Desoxyribonuclease I, isoliert aus dem Pankreas der Kuh, ein. Auf diese Weise entstehen freie 3 -Hydroxyl- und 5 -Phosphatenden. Dabei wird die DNA in Fragmente von bp geschnitten. Die exponierte Bruchstelle dient dann als Ausgangspunkt für eine weitere Reaktion, bei der über die DNA- Polymerase-Aktivität der DNA-Polymerase I von E. coli am 3 -Hydroxylende des Bruchs neue Nukleotide eingeführt werden. Hierzu werden fluoreszenzmarkierte Nukleotide im Reaktionsgemisch angeboten. Gleichzeitig baut die 5 a3 -Exonuclease- 40
47 Aktivität desselben Enzyms auf der anderen Seite des Bruchs weitere Nukleotide ab. Auf diese Weise wird die Bruchstelle langsam in 5 a3 -Richtung auf der DNA entlang verschoben ( transloziert ). Für eine effektive Markierung der DNA ist ein ausgewogenes Verhältnis der Reaktion von DNAse und Polymerase notwendig. Wird die Reaktion bei einer relativ niedrigen Temperatur von etwa 15 C durchgeführt, so schreitet die Reaktion nur soweit fort, bis die alte Nukleotidsequenz vollkommen erneuert ist. Obwohl also bei diesen Temperaturen keine Nettosynthese erfolgt, kann man so über die beschriebene Reaktion die unmarkierten Nukleotide durch markierte ersetzen. In der Tabelle 14 ist die Zusammensetzung der Nukleotid-Mixe der jeweiligen Markierungsart dargestellt. Pro zu markierende DNA wurden 10µl des dntp-mix in die Reaktion eingesetzt. Tabelle 14: Nicktranslation zur Markierung gesamtgenomischer DNA (Nicktranslation markierte Nukleotide Fa. NEN) Kit Fa. Vysis; FITC- dntp- Mix für Test- DNA TEXAS RED- dntp- Mix für Referenz- DNA datp 2,7µl 2,7µl FITC-dATP 0,4µl - TEXAS RED-dATP - 0,4µl dctp 2,7µl 2,7µl FITC-dCTP 0,4µl - TEXAS RED-dCTP - 0,4µl dttp 4µl 4µl dgtp 4µl 4µl Gesamt 14,2µ 14,2µl Einsatz in die Reaktion 10,0µl 10,0µl 1µg der jeweiligen DNA in einer Lösung wurden unter Zugabe der mitgelieferten Mischung aus DNAse und DNA-Polymerase I für 2 h bei 15 C inkubiert. Die Reaktion wurde durch Erhitzen auf 70 C für 10min gestoppt. Die Abbildung 7 zeigt die Moleküle der einzelnen Fluorochrom markierten Nukleotide und ihre chemische Formel. 41
48 Abbildung 7: Molekülstruktur der Fluorochrom markierten Nukleotide (aus Technisches Datenblatt, Fa. NEN ) a) FITC-dATP: C 41 H 41 N 6 O 19 P 3 b) FITC-dCTP: C 39 H 40 N 5 O 20 P 3 c) TR-dATP: C 46 H 51 N 7 O 18 P 3 S 2 d) TR-dCTP: C 44 H 50 N6O 19 P 3 S 2 42
49 Markierung der genomischen DNA über DOP-PCR Die DOP-PCR dient der universellen Amplifikation gesamtgenomischer DNA (siehe auch Kap ). Diese Art der Vor-Amplifikation ist Grundlage für die weiterführende Markierungsreaktion mit Fluoreszenzmarkern und nachfolgenden Hybridisierungsexperimenten. Der hierfür verwendete DOP PCR Master (Fa. ROCHE) enthält die Reagenzien für die Durchführung einer PCR in Form eines vorgemischten, doppelt-konzentrierten Mastermixes (siehe Kap ) und den degenerierten Oligonukleotid-Primern mit der Sequenz 5`-OH CCG ACT CGA GNN NNN NAT GTG G OH- 3`. Für eine vergleichende Genomhybridisierung waren 2 PCR-Reaktionen, zum einen die universelle Amplifikation und zum anderen die Markierungsreaktion der zu testenden DNA, notwendig. Für die erste Amplifizierungsreaktion gesamtgenomischer DNA wurden je nach Konzentration und Degradationsgrad der Ausgangs-DNA zwischen 1 und 10µl (50-15). Die Reaktionsbedingungen sind für die Verwendung mit genomischer DNA optimiert worden. Der PCR-Ansatz wurde auf Eis pipettiert, gut durchmischt und nach den Bedingungen in Tabelle 16 amplifiziert. DOP PCR Mastermix 25µl A. dest. 21,5µl Primer (4µmol/l) 2,5µl Template-DNA 1,0µl Tabelle 15: DOP-PCR: Reaktionsansatz für 1. PCR mit degenerierten Primern (Protokoll von ROCHE) Tabelle 16: Thermozyklus-Bedingungen für 1. DOP PCR unter wenig stringenten Bedingungen (nach Protokoll von ROCHE) Denaturierung Annealing Elongation Anzahl Temp. Zeit Temp. Zeit Temp. Zeit (n) Zyklus 1 95 C 5min 1 Zyklus 2 94 C 1min 30 C 1,5min 72 C 3min 5 Zyklus 3 94 C 1min 62 C 1min 72 C 2min 35 Zyklus 4 72 C 7min 1 Ein Aliquot des PCR generierten DNA-Pools wurde einer erneuten PCR unterworfen und mittels Fluoreszenz markierter Nukleotide (FdUTP-Spectrum Green, Fa. Vysis) markiert. Das Reaktionsgemisch entsprach Tabelle 17, die Zyklusbedingungen sind Tabelle 18 zu entnehmen. 43
50 DOP PCR Mastermix 25µl A. dest. 20,5µl DOP-Primer (4µmol/l) 2,5µl FdUTP 1mM 1,0 l Template-DNA 1,0µl Tabelle 17: DOP-PCR: Reaktionsansatz für Markierungs-PCR (2. PCR) mit Fluorescein markiertem Nukleotid (nach Protokoll von ROCHE) Tabelle 18: Zyklus-Bedingungen für die Markierungs-PCR nach dem Protokoll von ROCHE Denaturierung Annealing Elongation Anzahl Temp. Zeit Temp. Zeit Temp. Zeit (n) Zyklus 1 95 C 5min 1 Zyklus 2 94 C 30sec 62 C 30sec 72 C 1,5min 35 Zyklus 4 72 C 7min 1 Das Ergebnis der DOP-PCR wurde mittels Agarosegelelektrophorese überprüft (Kap ). Im Idealfall war ein homogener DNA-Schmier im Bereich von bp zu sehen (vgl. auch Abb. 14 Kap ) Herstellung der Hybridisierungsmischung und Hybridisierung Ca. 400ng über Nicktranslation bzw. DOP-PCR markierte Test- und Referenz-DNA wurden in gleichen Verhältnissen gemischt, mit 15µg COT 1-DNA (Fa. Invitrogen) versetzt und nach Zugabe von 1/10 Volumen 3M Natriumacetatlösung mit eisgekühltem 100% Ethanol präzipitiert. Nach Auswaschen des Natriumacetats mit eisgekühltem 70%igem Ethanol wurde das Pellet in 10µl 100% deionisierten Formamid bei 37 C über Nacht auf einem Schüttelblock gelöst und anschließend in 10µl Mastermix (4xSSC + 20% Dextransulfat) aufgenommen. Diese Hybridisierungsmischung wurde dann bei 75 C im Wasserbad für 10min denaturiert und zur Reduktion der Hybridisierung unspezifischer, repetitiver DNA-Sequenzen bei 37 C für 30min im Wasserbad inkubiert (Präannealing). Diese DNA-Mischung wurde dann auf Objektträger aufgetragen, auf denen sich denaturierte Metaphasechromosomen PHA-stimulierter Lymphocyten eines gesunden männlichen Spenders befanden. Die Denaturierung der Chromosomen erfolgte nach dem Protokoll von Fritz und Mitarbeitern (Fritz et al. 1998). Die einzelnen Schritte sind in Tabelle 19 zusammengefasst. Alle Inkubationen fanden in Küvetten statt. 44
51 Tabelle 19: Denaturierung der Chromosomenpräparate - Arbeitsschritte Lösung Zeit Temperatur Funktion Alkoholreihe (100%, 70%, 50%, 30%) je 2min RT Rehydrierung 0,1xSSC 2min RT Rehydrierung 2xSSC 2min RT Rehydrierung 2xSSC 30min C Verbesserung der Chromosomenstruktur 0,1xSSC 1min RT Äquilibrieren 0,07N NaOH 1min RT Denaturierung 0,1xSSC 1min 4 C Stoppen und Waschen 2xSSC 1 min 4 C Waschen Alkoholreihe (30%, 50%, 70%,100%) 2min RT Dehydrierung 10min RT Lufttrocknen Nach dem Abdecken mit einem Deckglas und luftdichter Versiegelung der Chromosomenpräparate mittels Gummilösung (Fixogum, Marabu) wurden die Objektträger bei 37 C für 3-5 Tage in einer feuchten Kammer inkubiert Waschung der hybridisierten Objektträger Nach Entfernen der Deckgläser in 2xSSC wurde die überschüssige Sonden-DNA durch stringente Waschungen (1xSSC-Puffer bei 75 C für 5min) entfernt. Die Chromosomen wurden anschließend mit DAPI (700ng/ml 4-6 -Diamino-2-Phenylindol) für 5min bei Raumtemperatur gegengefärbt. Abschließend wurden die Objektträger nach Trocknung mit Eindeckmedium (Vectashield, Fa. Vector-Laboratories) eingedeckt (siehe Tab. 20). Tabelle 20: Waschung der hybridisierten Objektträger - Arbeitsschritte Lösung Zeit Temperatur Funktion / Bemerkungen 2 x SSC 2 x 5min RT Entfernung der Deckgläser 1 x SSC 5min C stringente Waschung zur Entfernung ungebundener Sonden-DNA DAPI 5min RT Gegenfärbung der Chromosomen A. dest. ca. 1min RT Waschen 15min 37 C Trocknen der Objektträger Vectashield RT Eindecken mit 24x60mm Deckgläschen 45
52 Auswertung der CGH mit digitaler Bildanalyse Die Auswertung erfolgte an einem Epifluoreszenz-Mikroskop (Axiophot, Zeiss, Oberkochem) mit Hilfe eines computergestützten digitalen Bildanalysesystems (ISIS, Fa. MetaSystems). Das Mikroskop war mit einem 100W Quecksilberdampfbrenner und der Filterkombination Nr. 1 nach Prof. Dan Pinkel (AHF Analysentechnik, Tübingen, Germany) ausgestattet. Bei dieser Filterkombination waren die Anregungsfilter von Strahlenteiler und Sperrfilter unabhängig wählbar. Dadurch konnten die für die jeweiligen Fluorochrome benötigten Anregungswellenlängen gewechselt werden, während Strahlenteiler und Sperrfilter in Position blieben. Auf diese Weise kam es nicht zu dem Bildversatz, wie er bei dem Wechsel von kompletten Filtersets zu beobachten war. Die Filterkombination erlaubte die selektive Darstellung von DAPI-, FITC- und Texas Red-Fluoreszenzen sowie mittels eines Doppelbandfilters die zweifarbige Darstellung von FITC und Texas Red und mittels eines Triplebandpassfilters die dreifarbige Ansicht von DAPI, FITC und Texas Red. Die mittels DAPI in Q-Bandendarstellung gefärbten Metaphasechromosomen, sowie die Fluoreszenzen der mit Texas Red und FITC markierten Referenz- bzw. Test-DNA, wurden mit einer mit einem hochempfindlichen Photochip ausgestatteten elektronischen Kamera (charged-coupled device-, CCD-Kamera, Fa. IMAC) als Grauwerte separat aufgenommen. Von jeder Metaphase wurden 3 monochrome Bilder aufgenommen, ein Bild pro Fluoreszenzkanal. Jedes Bild hat einen spezifischen Informationsgehalt. Das DAPI-Bild dient der Chromosomenidentifizierung, das FITC-Bild repräsentiert die Test-DNA und das TRITC-Bild stellt die Referenz-DNA dar (Roth et al. 1996). Anhand der DAPI-gefärbten Metaphasechromosomen wurden die Chromosomengrenzen manuell festgelegt. Die Chromosomen einer Metaphase wurden anschließend in einem Karyogramm geordnet. Die Fluoreszenzintensitäten (FI) der Fluorochrome FITC und Texas Red wurden getrennt in kurzen (p-) und langen (q-) Arm über die Länge der einzelnen Chromosomen ermittelt. Die Fluoreszenzen Grün zu Rot wurden zueinander ins Verhältnis gesetzt. Daraus ergab sich über die Länge des jeweiligen Chromosoms ein Profil der Verhältnisse der Fluoreszenzintensitäten (VFI). Anschließend wurde für jede Metaphase ein Histogramm der Werte der Verhältnisse der Fluoreszenzintensitäten erstellt. Auf der Basis dieses Histogramms erfolgte für jeden Chromosomentyp einer Metaphase eine Normalisierung der Profile der VFI (NVFI). Anschließend wurde für jeden Chromosomentyp der Mittelwert der NVFI aus mehreren Metaphasen einschließlich der Standardabweichungen ermittelt und als Profil über die Länge des jeweiligen 46
53 Chromosoms dargestellt (vgl. Abb. 4 in Kap ). Zur Ermittlung von Über- und Unterrepräsentationen wurde der Schwellenwert auf die dreifache Standardabweichung festgesetzt. Dies entspricht einem Konfidenzintervall von etwa 99%. In einigen Fällen war es notwendig, mit definierten theoretischen Grenzwerten für eine Über- bzw. Unterrepräsentation auszuwerten. Unter der Annahme von einem 50%igen Normalanteil in der Testprobe wurde die Fluoreszenzratio von 0,75 als Monosomie und 1,25 als Trisomie definiert. Dementsprechend stellen sich Tetrasomien durch eine Ratio von 1,5 bzw. Pentasomien durch eine Ratio von 1,75 dar. Dies entspricht einem Konfidenzintervall von etwa 95%. Mindestens 10, in der Regel jedoch 20 Chromosomen eines Typs wurden für die CGH analysiert. Die Ergebnisse wurden für jedes Chromosom in Bezug auf das jeweilige Chromosomen-Ideogramm grafisch dargestellt. Die Regionen der chromosomalen Imbalancen in der Test-DNA wurden mittels Balken verdeutlicht. Dabei wurde gemäß internationaler Übereinkunft Rot für Unter- und Grün für Überrepräsentation gewählt. Alle Berechnungen und grafischen Aufbereitungen der Ergebnisse erfolgten computergestützt mit einem Software-Paket für Farbkaryotypisierung (ISIS-CGH, Fa. MetaSystems). Aberrante Befunde wurden nach dem internationalen System für die Nomenklatur cytogenetischer Befunde beschrieben (ISCN 2005) Mikrodissektion Die für die chromosomale Mikrodissektion notwendigen Arbeitsmittel wie Petrischale, Nadelhalter und Nadeln wurden vor Gebrauch unter UV-Licht sterilisiert. Soweit möglich erfolgten alle Arbeitschritte unter einer Sterilbank. Alle Lösungen wurden autoklaviert bzw. steril filtriert, um Kontamination mit Fremd-DNA zu vermeiden. Im Gegensatz zu herkömmlichen Chromosomenpräparaten wurde die Chromosomensuspension auf Deckgläschen aufgetropft. Die Deckgläschen wurden zuvor 24h zur Entfettung in 25%iger HCl aufbewahrt, mit A. dest. abgespült, in 100%igem Ethanol für 10min überführt, erneut mehrmals mit A. dest. gespült und bis zum Auftropfen der Chromosomensuspension bei 4 C gelagert. Je nach Menge der asservierten Chromosomensuspension wurden pro Fall 2-4 Deckgläser präpariert. Die Qualität der Metaphasechromosomen bezüglich der Größe, Spreitung der Chromosomen sowie Anzahl der Metaphaseplatten wurde unter einem Phasenkontrastmikroskop geprüft. Die GTG-Bänderung der Chromosomenpräparate erfolgte wie unter Kapitel beschrieben. 47
54 Die Dissektion wurde mit einem Inverse-Mikroskops (Axiovert S100) durchgeführt. Die umgekehrte Anordnung der Objektive und des Kondensors ermöglichten den größtmöglichen Arbeitsabstand, so dass die geschnittenen Fragmente von oben aufgenommen werden konnten. Die Hydraulikvorrichtung für die Steuerung der Nadel war rechtsseitig oberhalb des Drehtisches angebracht und mit einem Joystick verbunden, der die Nadelbewegung in allen drei Ebenen zuließ. Das Schneiden wurde bei 1000facher Vergrößerung mittels einer Vorwärtsbewegung der Nadel vollzogen. Die Fragmentaufnahme geschah über eine Rückwärts-Hochbewegung der Nadel, so dass das dissezierte Fragment an der Nadelspitze hängen blieb. Nun wurde die Nadel aus dem Nadelhalter ausgespannt und das Fragment in das Eppendorf- Tube, in dem sich 20µl Sammelpuffer befanden, überführt. Diese Prozedur wurde je nach Qualität und Quantität der vorhandenen Metaphasen mehrmals wiederholt. Die im Sammelpuffer gesammelte chromosomale DNA wurde einer universellen Amplifikation unterzogen (vgl. Kap ) und über eine 2. PCR-Reaktion mit Biotin- 11dUTP markiert, welches mit dttp um den Einbau in die DNA konkurriert. Um den Einbau von Biotin-markierten Nukleotiden zu erleichtern, wird dies im Überschuss zugegeben. Mit diesem Einbau wird eine spezifische Detektion der amplifizierten DNA bei der Fluoreszenz-in situ-hybridisierung (vgl. Kap ) ermöglicht. In der Regel wurden 6µl des über DOP-PCR generierten DNA-Pools in eine Markierungs-PCR zur weiteren Amplifizierung und Markierung eingesetzt (Tab. 21). Die Zyklusbedingungen sind Tabelle 22 zu entnehmen. Sämtliche Reaktionsansätze wurden auf Eis pipettiert, um einen vorzeitigen Start der PCR zu vermeiden. Der Nachweis der amplifizierten PCR-Produkte und ihre Quantifizierung erfolgten über eine Agarosegelelektrophorese. Replitherm-Puffer 0,75 µl datp, dgtp, dctp ( 200µmol/l) je 3µl dttp ( 100µmol/l) 0,15µl Primer DopMueNa* (2µmol/l) 0,3 Bio-11dUTP ( 100µmol/l) 1,5µl Taq-Polymerase 0,5µl DNA 6µl H 2 O 7,9µl MgCl 2 (2,5µmol) 1,5µl Tabelle 21: Reaktionsansatz für Markierungs-PCR (*DOP-Primer nach Müller- Navia et al. 1995) Tabelle 22: DOP-PCR: Zyklusbedingungen für Markierungs-PCR Denaturierung Annealing Elongation Anzahl (Temp.) (Zeit) (Temp.) (Zeit) (Temp.) (Zeit) (n) Zyklus 1 94 C 1min 56 C 1min 72 C 2min 20 48
55 Die amplifizierte DNA wurde durch Zugabe von 1µl einer Trägerreagenz (Lineares Polyacrylamid, GenElute LPA, Sigma) gefällt (siehe auch Kap ), in Mastermix aufgenommen und als DNA-Sonde für eine Fluoreszenz-in situ-hybridisierung eingesetzt. Die Vorgehensweise entspricht der wie in Kapitel beschrieben. Die Biotinmarkierte Sonden-DNA wurde mittels an einem Antikörper gebundenen grünen Fluoreszenzfarbstoff FITC detektiert (vgl. Kap ) Die Auswertung mit Hilfe eines Fluoreszenzmikroskop erlaubte eine entsprechende Zuordnung der chromosomalen Aberration und ermöglichte die Bestimmung unbekannter Strukturaberrationen oder die Herkunft von Markerchromosomen. 3.4 Molekulargenetische Methoden DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe Die Gewinnung möglichst hochmolekularer DNA aus Formalin fixierten, paraffiniertem Gewebe bildet den Grundstein und somit den kritischsten Parameter für alle sich anschließenden molekularcytogenetischen Untersuchungen. Zunächst wurden histologische Gewebeschnitte unterschiedlicher Gewebe eines Obduktionsfalles in der Standard-HE-Färbung unter einem Lichtmikroskop auf ihre Zelldichte sowie den Autolysegrad hin überprüft, um das am besten geeignete Gewebe für die folgende DNA-Extraktion auszuwählen. Von diesen wurden 5-10 Gewebeschnitte mit einer Schnittdicke von je 5µm mittels eines Schlittenmikrotoms von einem Paraffingewebeblock abgehobelt und in ein steriles Eppendorfcup (1,5ml) überführt. Bei diesem Arbeitsschritt musste sehr sorgfältig und sauber gearbeitet werden (Schutzkittel, Handschuhe), um eine Kontamination der DNA zu vermeiden. Für jeden neuen Fall wurde die Mikrotomklinge erneuert und der Arbeitsplatz mit Alkohol gereinigt. Die DNA wurde nach 3 unterschiedlichen Methoden extrahiert, um die Effizienz hinsichtlich DNA-Menge- und Qualität zu vergleichen DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe nach Proteinausfällung Die Paraffingewebeschnitte wurden unter Zugabe von 1ml Xylol zur Entparaffinierung für 30min bei Raumtemperatur stehengelassen und alle 5min für ca. 30s gevortext. 49
56 Nach Zentrifugation (5min/13000rpm/RT) wurde das Xylol vom Gewebe abpipettiert. Dieser Schritt wurde einmal wiederholt. Zum Auswaschen des Xylols wurde das Gewebepellet in 1ml 100% unvergällten Ethanol für 5min bei Raumtemperatur stehen gelassen und abzentrifugiert (5min/13000rpm/RT). Der Alkohol wurde entfernt und dieser Waschschritt wiederholt. Im Anschluss daran wurde das Pellet in 200µl Nuclei Lysis Solution (Fa. Promega) aufgenommen. Die noch vorhandenen Proteine wurden durch Zugabe von 50µl Proteinase K (10mg/ml) und 50µl RNAse (20mg/ml) in einer anschließenden 12-stündigen Inkubation auf einem Wärmeschüttelblock bei 65 C verdaut. Die Proteine wurden durch Zugabe von 70µl Protein Precipitation Solution (Fa. Promega), 20sec vortexen und 5min bei 4 C präzipitiert. Nach Zentrifugation (5min/13000rpm/RT) wurde die im Überstand befindliche DNA gefällt. Hierfür wurden 10µl Natriumacetat (3M; ph 7,0), 1ml 100% reinstes Ethanol, und 1µl LPA (Lineares Polyacrylamid, Konzentration 5 mg/ml, Fa. Sigma) dazugegeben und anschließend bei 80 C für 30-60min inkubiert. LPA, ein so genanntes Transportpolymer, wurde zur besseren Fällung von kleinen DNA-Mengen hinzugefügt. Nach Zentrifugation (30min/13000rpm/4 C) wurde das DNA-Pellet 2x mit 70% vergälltem Ethanol gewaschen und getrocknet. Abschließend wurde die gewonnene DNA in 50µl hochgereinigtem Wasser gelöst. Eine Zusammenstellung der einzelnen Arbeitsschritte bietet Tabelle 23. Tabelle 23: DNA-Isolierung aus Formalin fixiertem und paraffiniertem Gewebe nach Proteinausfällung Schritt / Funktion Lösungen / Menge Zeit Temperatur Anzahl der Schritte / Bemerkungen Entparaffinierung Xylol 1000µl 30min RT 2x Waschung 100% Ethanol 1000µl 5min RT 2x Proteinverdau Nuclei Lysis Solution 200µl Proteinase K 50µl Proteinpräzipitation Zentrifugation zur Proteinfällung DNA-Fällung Zentrifugation zur DNA-Fällung RNAse 50µl Protein Precipitation Solution 70µl Natriumacetat 1/10 Vol. 100% Ethanol 2,5 Vol. LPA 1µl DNA waschen 70% Ethanol 2min RT DNA lösen A. dest. 50µl ü.n. 4 C ü.n. 65 C 1x; Schüttelblock 5min 4 C 1x; auf Eis 5min RT DNA im Überstand 1h -80 C 1x 30min 4 C 1x; Kühlzentrifuge 50
57 DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe mittels All-tissue DNA-Kit (Fa. GEN-IAL) Das in Paraffin eingebettete Gewebe wurde zunächst mit 100%igem Ethanol entparaffiniert und dann in 2 Volumen Lyse 1-Lösung, 1/10 Volumen Lyse 2-Lösung und 2/100 Volumen Proteinase K (10mg/ml) bei 65 C lysiert. Das Lysat wurde mit 75% (v/v) Lyse 3-Lösung versetzt, gemischt und zur Unterstützung der Proteinpräzipitation kurz bei 20 C gekühlt. Bei der anschließenden Zentrifugation wurden Zellreste, Proteine, Kohlenhydrate u.ä. pelletiert. Der Überstand wurde in ein neues Reaktionsgefäß überführt und die darin befindliche DNA mit 0,8 Volumen Isopropanol bei Raumtemperatur gefällt. Nach der Zentrifugation (10min/13000rpm) wurde das DNA-Pellet mit 70%igem Ethanol von Salzen gereinigt. Das Ethanol wurde vollständig entfernt, die DNA getrocknet und in sterilem A. dest. gelöst (Tab. 24). Zur Entfernung von RNA konnte im Anschluss ein RNAse A-Verdau durchgeführt werden. Dazu wurde die DNA-Lösung mit 1/100Volumen RNAse A für 30min bei 37 C inkubiert und die enzymatische Reaktion durch Temperaturerhöhung (65 C/5min) gestoppt. Danach wurde die DNA erneut gefällt. Tabelle 24: DNA-Isolierung aus Formalin fixiertem und paraffiniertem Gewebe mittels All-tissue DNA-Kit (Fa. GEN-IAL) Schritt / Funktion Lösungen / Menge Zeit Temperatur Anzahl der Schritte / Bemerkungen Entparaffinierung 100% Ethanol 1000µl 10min 65 C 1x Waschung 100% Ethanol 1000µl 5min RT 2x Proteinverdau Lyse 1 500µl Lyse 2 50µl Proteinase K 20µl RNAse 50µl Proteinpräzipitation Lyse 3 375µl 20s Zentrifugation zur Proteinfällung ü.n. 37 C 1x 5min RT -20 C Vortexen Verbesserung der Proteinpräzipitation 20min RT 13000rpm; DNA im Überstand DNA-Fällung Isopropanol 0,8 Vol. 15min RT 13000rpm; Pelletierung der DNA DNA waschen 70% Ethanol 300µl 2min 4 C DNA lösen A. dest. 50µl ü.n. 4 C 51
58 DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe mittels Invisorb Spin Tissue Mini Kit (Fa. Invitek) Die in Paraffin eingebetteten Gewebeschnitte wurden zunächst mit Ethanol (100%) entparaffiniert und mittels Lysis-Puffer G lysiert und dem Enzym Proteinase K (10mg/ml) verdaut (3h bei 52 C). Anschließend wurden 200µl Binding-Puffer-T zugegeben und alles gevortext. Das Gemisch wurde auf eine Säule pipettiert und zentrifugiert, um die DNA an die Matrix zu binden. Proteine und RNA wurden durch die nachfolgenden Waschschritte mit dem Waschpuffer von der Säule gelöst. Die so gereinigte DNA wurde nun mit einem Puffer höherer Ionenstärke von der Säule eluiert (Überblick über die durchgeführten Schritte in Abb. 8 und Tab. 25). Abbildung 8: Darstellung der Arbeitsschritte der DNA-Extraktion aus Formalin fixierten und in Paraffin eingebetteten Gewebe mittels Invisorb Spin Tissue Mini Kit (nach Fa. Invitek) Lyse des Gewebes bei 52 C in einem Thermomixer Laden der Säule bei anschließender DNA-Bindung Realisierung optimaler Bindungsbedingungen Waschung der an der Säule gebundenen DNA Eluierung der gesamtgenomischen DNA von der Säule und Sammeln in einem Reaktionsgefäß Tabelle 25: DNA-Isolierung aus Formalin fixierten und paraffiniertem Gewebe mittels Invisorb Spin Tissue Mini Kit Schritt / Funktion Lösungen / Menge Zeit Temperatur Anzahl der Schritte / Bemerkungen Entparaffinierung Xylol 1000µl 30min RT 2x Waschung 100% Ethanol 1000µl 5min RT 2x Proteinverdau Lyse-Puffer G 400µl; 3h 52 C 1x; DNA im Überstand Proteinase K 40µl RNAse-Verdau RNAse A (20mg/ml) 20µl 5min RT DNA-Bindung Binde-Puffer T 200µl 10s RT Vortexen; Gemisch auf Säule übertragen Waschung Waschpuffer 400µl; 300µl; 200µl 1min RT 3x Eluierung der DNA Eluierungspuffer D 50µl 3min 52 C Zentrifugation; Sammeln der eluierten DNA 52
59 3.4.2 DNA-Isolierung aus gefrorenem Gewebe Der Zellaufschluss des nativen Gewebes erfolgte durch Zerkleinern mit dem Mörser unter flüssigem Stickstoff, bis eine pulverartige Konsistenz erreicht wurde. Das zerkleinerte Gewebe wurde in PBS-Puffer aufgenommen und in ein Zentrifugenröhrchen überführt. Nach dem Abzentrifugieren (5min/3000rpm/RT) wurde der Überstand dekantiert und das Gewebepellet in einem Gemisch aus 5ml SE-Puffer (zur Lyse der Zellkerne), 10µl des eiweißspaltenden Enzyms Proteinase K (10mg/ml) und 500µl SDS resuspendiert. Dieser Schritt diente dem Verdau der Zellmembranen und der Freisetzung der DNA aus dem Zellkern. Die Proteolyse erfolgte bei 37 C im Schüttelbad über Nacht. Hierbei wurden auch die Nukleasen irreversibel inaktiviert. Dies ist von essentieller Bedeutung, damit die aus dem Zellkern stammenden DNAsen nicht die freigesetzte DNA verdauen. Nach Inkubation über Nacht wurden die Proben mit weiteren 5ml SE-Puffer versetzt und für 10min bei 55 C im Wasserbad inkubiert. Dann wurden 2ml einer 5M NaCl- Lösung zugegeben und sofort die Lösungen durch Vortexen für 15sec vermischt. Die proteinogenen Zelltrümmer wurden durch Zugabe hoher Salzkonzentrationen ausgefällt und von der DNA durch Abzentrifugation getrennt (15min/3000rpm/RT). Der Überstand mit der darin enthaltenen DNA wurde in ein neues Zentrifugierröhrchen überführt. Die DNA wurde mit 30ml auf -20 C gekühltem 96% Ethanol gefällt. Durch vorsichtiges Schwenken des Zentrifugierröhrchens bildete sich im optimalen Fall eine genügend große Menge zusammenhängender DNA-Fäden, die mit Hilfe einer über einer Bunsenbrennerflamme gebogenen Pipettenspitze geangelt und in ein Eppendorfcup überführt wurde. Dort erfolgte ein zweimaliges Auswaschen mit 70%igem Ethanol. Anhand der ausgefällten DNA-Menge wurde die zuzugebende Menge an A. dest. (zwischen µl) abgeschätzt. Das vollständige Lösen der DNA erfolgte durch Inkubation über Nacht bei 4 C (Tab. 26). 53
60 Tabelle 26: DNA-Isolierung aus nativ eingefrorenem Gewebe über Aussalzmethode (laborinternes Protokoll) Schritt / Funktion Lösungen / Menge Zeit Temperatur Anzahl der Schritte / Bemerkungen Gewebezerkleinerung flüssiger Stickstoff 1min -198 C Waschung 1xPBS 50µl 2min RT 1x Zentrifugation 10min RT 1x; Überstand dekantieren Proteinverdau SE-Puffer 5ml 10% SDS 500µl Proteinase K 50µl Proteinpräzipitation SE-Puffer 5ml 10min 55 C Zentrifugation zur Proteinfällung ü.n. 37 C Schüttelwasserbad 5M NaCl 2,5ml 15sec RT 1x; vortexen DNA-Fällung 100% Ethanol 30ml 5 min 4 C DNA waschen 70% Ethanol 200µl 2min RT DNA lösen A. dest µl ü.n. 4 C 15min RT DNA im Überstand DNA-Isolierung aus Blut Genomische DNA lässt sich aus den kernhaltigen Leukocyten menschlichen Blutes extrahieren. Zur DNA-Präparation aus venösem Vollblut wurde der QIAamp DNA Blood Maxi Kit der Firma Qiagen verwendet. In ein 50ml Zentrifugationsröhrchen wurden 500µl Protease pipettiert und 10ml Vollblut dazugegeben. Danach erfolgte die Zugabe von 12ml AL-Puffer zur selektiven Lyse der Erythrocyten. Durch gutes Mischen wird eine homogene Lösung erzielt. Das Gemisch wurde anschließend für 10min bei 70 C zum Proteinverdau inkubiert. Durch Zugabe von 10ml 100%igem Ethanol und vortexen der Lösung wurde die Effektivität der späteren Bindung der DNA an die Säulenmatrix verbessert. Je eine Hälfte des Gesamtgemisches wurde nun nacheinander in ein Maxi Spin Column Röhrchen überführt und zentrifugiert (3min/3000rpm). Dabei bindet die DNA als negativ geladenes Molekül an der als Anionenaustauscher funktionierenden Säulenmatrix. Die weniger negativ geladenen Proteine und RNA dagegen wurden durch die nachfolgenden Waschschritte mit den Puffern AW1 und AW2 von der Säule gelöst. Die so gereinigte DNA wurde nun mit einem Puffer (AE) höherer Ionenstärke von der Säule eluiert. Die Tabelle 27 gibt einen Überblick über die durchgeführten Schritte. 54
61 Tabelle 27: DNA-Gewinnung aus Vollblut mit QIAamp Blood Maxi Kit (Fa. Qiagen) Schritt / Funktion Lösungen / Menge Zeit Temperatur / Drehzahl Zelllyse Protease 500µl 3x5sec RT AL-Puffer 12 ml Proteinverdau 10min 70 C Erhöhung der DNA- Bindungseffizienz Bindung der DNA an Anionenaustauscher durch Zentrifugation Waschung + Proteineluierung durch Zentrifugation 100% Ethanol 10ml RT AW1-Puffer 5ml AW2 Puffer 5ml 3min 1min 15min RT; 3000rpm RT; 5000rpm RT; 5000rpm DNA-Eluierung AE-Puffer 1ml 5min RT; 5000rpm DNA-Isolierung aus fixierter Chromosomensuspension DNA aus asservierten Chromosomensuspensionen wurde mit der Methode nach Li et al. (1995) gewonnen. Hierzu wurde das Zellpellet mit Carnoy s Fixativ im Verhältnis 1:1 bis 1:5 verdünnt. Cirka 100µl der verdünnten Zellsuspension wurde in ein Eppendorfgefäß überführt und anschließend abzentrifugiert (5min/13000rpm/4 C). Nach Verwerfen des Überstandes wurden die Zellen mit 200µl 70%igem Ethanol gewaschen und erneut zentrifugiert (5min/13000rpm/RT). Nach diesem Waschschritt wurde das Pellet luftgetrocknet, in 20µl hochgereinigtem A. dest. aufgenommen und für 30min bei Raumtemperatur gelöst. 2-3µl dieser Lösung wurden dann direkt als Template-DNA für PCR-Reaktionen eingesetzt DNA-Konzentrationsbestimmung Die Konzentration der extrahierten DNA wurde photometrisch bei dem Absorptionsmaximum der DNA von 260nm bestimmt. Bei dieser Wellenlänge und einer Schichtdicke einer Küvette von 1cm entspricht eine Absorption (OD) von 1,0 einer DNA-Doppelstrangkonzentration von 50µg/ml (Sambrook et al. 1989). Eine Probe der zu bestimmenden DNA-Lösung wurde im Verhältnis 1:50 mit A. dest. verdünnt. Nach Kalibrierung des Nullwertes mit H 2 O wurde die Differenzabsorption der Probe gegen H 2 O gemessen. Um Aufschluss über den Grad der Verunreinigung mit Proteinen oder RNA zu erhalten, wurde auch die OD bei 280nm bestimmt. Bei proteinfreien DNA-Proben liegt das Verhältnis von OD 260 zu OD 280 zwischen 1,8-2,0. Werte größer als 2,0 weisen auf RNA-Rückstände, Werte kleiner als 1,7 auf Proteinverunreinigung hin. 55
62 3.4.6 DNA-Amplifikation Polymerase-Kettenreaktion (PCR) Für die sequenzielle in vitro Amplifikation von DNA werden Reaktionszusätze in Form von Nukleotiden (datp, dctp, dgtp, dttp), zwei gegenläufige Primer bekannter Sequenz, ein Puffersystem, Wasser und eine DNA-Polymerase zum komplementären Strangaufbau benötigt. Die für eine PCR angepassten Reaktionsbedingungen, speziell die Annealingtemperatur der Primer (Tab. 28 und 29), sorgen für Qualität und Quantität der PCR-Ausbeute. Sämtliche Reaktionsansätze wurden auf Eis pipettiert. Insbesondere für die Amplifikation von Mikrosatelliten hat sich ein `touch-down` Protokoll als vorteilhaft erwiesen. Um eine möglichst spezifische Primeranlagerung zu erzielen, ist in den ersten Zyklen die Annealing-Temperatur für die Primer zu erhöhen. Die Annealing- Temperatur wurde in den nachfolgenden Zyklen schrittweise gesenkt, um eine möglichst hohe Ausbeute an Amplifikaten zu erhalten (Tab. 29). Der Nachweis der Amplifikate und ihre Quantifizierung erfolgte über eine Agarosegelelektrophorese (Kap ). Alle PCR-Produkte wurden für spätere Analysen bei -20 C aufbewahrt. 10x Puffer dntps (100µmol/l) Primer (100pmol/µl) vorwärts rückwärts Amplitaq Taq-Polymerase DNA (50ng/µl) H 2 O (variabel) Gesamt 2,5µl 0,25µl 0,5µl 0,5µl 0,5µl 1,0µl 19,75µl 25,0µl Tabelle 28: Reaktionsansatz für PCR mit spezifischen Primern Tabelle 29: Standard der Zyklus-Bedingungen für PCR mit spezifischen Primern (touch-down Protokoll) Denaturierung Annealing Elongation Anzahl Temp. Zeit Temp. Zeit Temp. Zeit (n) Zyklus 1 94 C 5min 1 Zyklus 2 96 C 15sec 61 C 40sec 72 C 40sec 3 Zyklus 3 96 C 15sec 59 C 40sec 72 C 40sec 3 Zyklus 4 96 C 15sec 57 C 40sec 72 C 40sec 3 Zyklus 5 96 C 15sec 55 C 40sec 72 C 40sec 30 Zyklus 6 72 C 2min 1 Zyklus 7 35 C 30min 1 56
63 Tabelle 30: Auflistung der Fälle mit durchgeführter Mikrosatellitenanalyse unter Angabe der Fragestellung, des verwendeten Gewebes und den jeweils untersuchten Chromosomen Fall Gewebe Chromosom(en) Fragestellung O-1893/01 O-1910/01 O-1919/01 O-2065/03 Chromosomensuspension/ Blut der Eltern Gefrorener Muskel/ Blut der Eltern Gefrorener Muskel/ Chromosomensuspension der Eltern Gefrorener Muskel Blut der Eltern 118/02 Chromosomensuspension Blut der Eltern S-41/02 V-2309/01 V-2317/01 V-2370/02 Formalin fixierte Lunge Blut der Eltern Gefrorene Abortzotten/ Blut der Eltern Formalin fixierte Abortzotten/ Blut der Eltern Gefrorene Abortzotten/ Blut der Eltern 2 Ausschluss einer Uniparentalen Disomie für Chromosom 2 4 Bruchpunktbestimmung; parentale Herkunft des deletierten Chromosoms 2 Bruchpunktbestimmung; Ausschluss einer Uniparentalen Disomie für die Chromosomen 2; parentale Herkunft des Markerchromosoms 1, 7, 11, 12, 13 Nachweis einer Triploidie; parentale Herkunft des überzähligen haploiden Chromosomensatzes 8 Bruchpunktbestimmung; parentale Herkunft des aberranten Chromosoms 18 parentale Herkunft der Trisomie 18 6, 8 Ausschluss einer Uniparentalen Disomie für die Chromosomen 6 und 8; parentale Herkunft der Translokation 1, 2, 5, 13, 16, 18 Nachweis einer Triploidie; parentale Herkunft des überzähligen haploiden Chromosomensatzes 8, 13 parentale Herkunft der Trisomie 13; Nachweis einer Chromosomenaberration am Chromosom PCR mit spezifischen Primern mittels CombiPol DNA Polymerase Kit von Invitek Zur Verbesserung der Amplifikationsergebnisse von DNA, die nach dem Protokoll für die Standard-PCR entweder eine nur geringe oder keine Amplifikation zeigte, wurde zusätzlich der CombiPol DNA Polymerase Kit (Fa. Invitek) angewandt. Das im Kit enthaltene Enzymgemisch beinhaltet einen Cocktail aus rekombinanter Taq DNA- Polymerase mit thermostabiler Korrekturlese-Eigenschaft und anorganischer Pyrophosphatase von Thermus thermophilus. Weiterhin sind in dem Kit optimierter Reaktionspuffer, MgCl 2 sowie ein PCR-Verstärkungszusatz (Enhancer) enthalten. Mit diesem so genannten Enhancer soll eine hohe Prozessivität, Geschwindigkeit und Extensionsstabilität der Enzyme während der PCR-Reaktion erreicht werden (Tab. 31). Die Zyklusbedingungen sind in Tabelle 29 aufgelistet. 57
64 10x Puffer dntps (100µmol/l) Primer (100pmol/µl) vorwärts rückwärts MgCl 2 Enhancer CombiPol DNA Polymerase DNA (50ng/µl) H 2 O (variabel) Gesamt 2,5µl 0,5µl 0,5µl 0,5µl 5,0 l 0,4µl 1,0µl 13,35µl 25,0µl Tabelle 31: Reaktionsansatz für PCR mit spezifischen Primern mittels CombiPol DNA Polymerase Kit Degenerate oligonukleotide primed-pcr (DOP-PCR) für die Mikrodissektion Eine Modifikation der ursprünglichen PCR-Amplifikation von singulären Sequenzen der Target-DNA stellt die DOP-PCR (,degenerate oligonucteotide primed PCR ) dar, bei der mit Hilfe von sogenannten degenerierten Primern eine statistische und repräsentative Amplifikation von unbekannten DNA-Templates erfolgt (Telenius et al. 1992, Tab. 32). Daher kann sie zur Amplifikation von mikrodissezierten Chromosomen oder zur vergleichenden Genomhybridisierung bei wenig Ausgangsmaterial verwendet werden. Für Hybridisierungsexperimente können DOP-PCR amplifizierte DNA- Fragmente nichtradioaktiv beispielsweise mit Fluoreszenzmarkern markiert werden. Die DOP-Primer besitzen definierte Enden am 5 und 3 Ende. In der Mitte liegt eine Random Hexamer-Sequenz, die alle möglichen Kombinationen der Nukleotide A, C, G und T abdeckt. Die Sequenz des Primers lautet: 5 -CCG-ACT-GCA-GNN-NNN-NAT-GTG-G- 3. Die 6 degenerierten Positionen ermöglichen einen Pool von 4 6 -Primer verschiedener Sequenz. Der Reaktionsansatz für eine DOP-PCR ist in Tabelle 32 zu finden. Als Template-DNA dienen die im Sammelpuffer befindlichen dissezierten DNA-Fragmente (vgl. Kap ). Im Gegensatz zur PCR zur Amplifikation spezifischer DNA-Sequenzen laufen die ersten Zyklen der DOP-PCR unter wenig stringenten Temperaturbedingungen ab. Nach initialer Denaturierung bei 93 C folgten 8 Zyklen bei 94 C für 1min, 30 C für 1,5min mit einer 4 minütigen Transition von 30 C 72 C und Elongation bei 72 C für 3min. Die folgenden 28 Zyklen liefen unter stringenten Bedingungen ab (Denaturierung bei 94 C 1min, Annealing bei 56 C 1min, Elongation bei 72 C 3min). Das Ergebnis der DOP-PCR wurde mit einer Agarosegelelektrophorese überprüft (vgl. Kapitel ). 58
65 Im Idealfall ist ein homogener Schmier im Bereich von 300bp bis 2000bp zu sehen. Die PCR-Produkte wurden bis zur späteren Verwendung bei 20 C aufbewahrt. Tabelle 33 gibt einen Überblick über die PCR-Bedingungen. 10x Puffer 3,0µl dntps (100µmol/l) 2,4µl Primer* (4µmol/l) 1,2µl BSA acetyliert (5ng) 1,0µl Taq-Polymerase 0,5µl DNA (gesamter Präamplifikations-Ansatz) 20µl H 2 O 18,9µl MgCl 2 (2,5mmol/l) 3,0µl Tabelle 32: Reaktionsansatz für PCR mit degenerierten Primern nach Mikrodissktion (*DOP-Primer nach Müller-Navia et al. 1995) Denaturierung Annealing Elongation Zyklen Temp. Zeit Temp. Zeit Temp. Zeit Anzahl (n) Zyklus 1 93 C 3min 1 Zyklus 2 94 C 1min 30 C 45 C 1min 1min 72 C 3min 8 Zyklus 3 94 C 1min 56 C 1min 72 C 3min 28 Zyklus 4 72 C 10min 1 Tabelle 33: Zyklusbedingungen für DOP-PCR nach Mikrodissektion DNA-Amplifikation mittels GenomiPhi Amplification Kit Mit dem GenomiPhi DNA Amplification Kit (Fa. Amersham Biosciences) können, ausgehend von kleinen bis kleinsten DNA-Mengen, gesamte Genome universell über einen `Rolling Circle`-Mechanismus amplifiziert werden. Die bei dieser Methode verwendete Phi29 DNA-Polymerase amplifiziert die Template-DNA exponentiell mittels Strangverschiebung. Dabei werden am 3` OH-Ende der Ausgangs-DNA Nukleotide ansynthetisiert. Der komplementäre Strang wird kontinuierlich verlängert und kann nun länger werden als der Ausgangs-Strang (Abb. 9). Die Korrekturlese- Eigenschaft dieser speziellen DNA-Polymerase bewahrt die originale genetische Sequenz. Als Template-DNA wurde GenomiPhi Sample Buffer gemischt. Das Gemisch wurde 3min bei 95 C denaturiert und danach sofort auf 4 C abgekühlt. Anschließend wurden 9 -Puffer und -Mix zugegeben. Das Reaktionsgemisch wurde nun 16-18h bei 30 C inkubiert. Die Amplifikation wurde bei 65 C für 10min gestoppt und die Proben auf Eis gestellt. 59
66 Zur Überprüfung des Amplifikationsergebnisses wurden 5µl auf ein 1%iges Agarosegel aufgetragen. In der Regel war ein DNA-Schmier >1100bp zu finden (vgl. auch Abb. 17 in Kap ). Abbildung 9: Amplifikation genomischer DNA mittels Phi29 Polymerase über `Rolling Circle`-Mechanismus (GenomiPhi, Amersham Biosciences) Verlängerung des 3`Endes der Ausgangs-DNA Synthese des komplementären Stranges Kontinuierliche Strangverlängerung. Amplifizierte DNA hat Größe bis ca. 10kb Gelelektrophoretische Auftrennung von Nukleinsäuren Agarosegelelektrophorese Agarose-Gelsysteme sind die Standardmethode für die Trennung und Identifizierung von linearen DNA-Fragmenten. Agarosegele werden verwendet, wenn man große Poren für die Analyse von Molekülen über 10nm Durchmesser benötigt. Gele mit Porengrößen von 150nm werden durch 1% und bis 500nm durch 0,16% Agarose erzielt. Tabelle 34 gibt eine Übersicht über die Trennbereiche und die entsprechenden Agarosekonzentrationen (Gassen & Schrimpf 1999). Agarose wurde durch Aufkochen in einer Pufferlösung gelöst und durch Abkühlung geliert. Dabei bilden sich aus dem Polysaccharid-Sol Doppelhelices aus, die sich in Gruppen seitlich zu relativ dicken Fäden zusammenlagern. Agarosekonzentration [%(w/v)] Kettenlänge [kb] 0, , ,9 0,5-7 1,2 0,4-6 1,5 0,2-3 2,0 0,1-2 Tabelle 34: Trennbereiche für lineare DNA- Fragmente in Agarosegelen (nach Gassen & Schrimpf 1999) Um den Zustand der DNA aus den verschiedenen asservierten Geweben, d.h. ihren Degradationsgrad beurteilen zu können, wurden 5µl DNA-Lösung auf ein 2%iges Agarosegel aufgetragen. Hierzu wurde Agarose (4g in 200ml 1xTBE-Puffer) durch Kochen gelöst und nach Abkühlung mit 2µl Ethidiumbromid (10µg/ml) versetzt. Durch 60
67 diesen in die DNA interkalierenden Farbstoff lässt sich doppelsträngige DNA bis etwa 20ng bei einem Auftrag von 4µl nachweisen (Datenblatt DNA-Längenstandard XIV, ROCHE 2001). Anschließend wurde das Gel in einen vorbereiteten waagerechten Gelschlitten gegossen. Ein in den Schlitten eingehängter Kamm (1mm) sparte dabei die Ladetaschen aus. Nach ca. 20min war das Gel vollständig auspolymerisiert und konnte in die mit Laufpuffer gefüllte Elektrophoresekammer eingesetzt werden. Nach Entfernung des Kammes wurden die mit Ladepuffer versehenen DNA-Proben und der Längenstandard (Marker VIII, Fa. Boehringer-Mannheim) in die Taschen pipettiert. Bei einer Spannung von 90V und einer Laufzeit von ca. 45min erfolgte die Auftrennung der negativ geladenen DNA von der Kathodenseite auf die Anodenseite bis zur gewünschten Laufstrecke. Nach der Elektrophorese wurde die aufgetrennte DNA auf einem UV-Transilluminator bei 312nm sichtbar gemacht und fotografisch dokumentiert. Neben der Größenidentifizierung der Produkte durch den Vergleich mit dem Längenstandard ermöglichte das Gelbild anhand der Bandenintensität eine Abschätzung der Produktmenge. Der Nachweis der DNA aus in Paraffin eingebettetem Gewebe, der Nicktranslationsprodukte sowie der amplifizierten PCR-Produkte und ihre Quantifizierung erfolgte über ein Agarosegel in verschiedenen Konzentrationen (1%; 1,2%; 2%) Polyacrylamidgelelektrophorese (PAGE) Die Polyacrylamidgelelektrophorese wird für die Auftrennung von DNA-Fragmenten <1000bp verwendet. Durch Variation der Acrylamidkonzentration kann der Trennbereich für unterschiedliche Fragmentlängen optimiert werden (Tab. 35). Zur Trennung doppelsträngiger DNA-Moleküle werden native Gelsysteme verwendet. Da sich die Größe zweier Allele um nur zwei Basenpaare unterscheiden kann, ist ihre Auftrennung in einer hochauflösenden Acryl-Matrix zur genauen Auswertung notwendig. Nach der PCR wurden die Produkte gelelektrophoretisch auf einem 8%igen, nicht denaturierenden Polyacrylamidgel getrennt. 61
68 Tabelle 35: Trennbereich für DNA-Fragmente in nativen Polyacrylamidgelen (nach Sambrook et al. 1989) 1 Die Zahlen geben in etwa die Größe (in bp) der Fragmente doppelsträngiger DNA an, deren Wanderungsverhalten dem des Farbstoffs entspricht. Acrylamidkonzentration [%] Kettenlänge [bp] Bromphenolblau 1 Xylencyanol 1 5, , , , Gießen der Gele und Probenauftrag Ein Gel setzt sich aus insgesamt 4 Komponenten zusammen: Gel-Lösungen A und B (Fa. Roth), 1xTBE-Puffer, 10%iges Ammoniumpersulfat und TEMED. Zur Vorbereitung gehörte die Reinigung der beiden Glasplatten und des 0,8mm dicken Spacers mit Wasser und anschließend 96%igem Ethanol. Die Glasplatten mit den am Rand aufgesetzten Spacern, welche die Geldicke vorgeben, wurden aufeinander gelegt und der untere Rand zum Auslaufschutz mit Klebeband abgeklebt. Die Längsseiten der Glasplatten wurden durch Klammern zusätzlich abgedichtet. Die Gel-Lösung wurde in den Spalt zwischen den schräg gehaltenen Glasplatten möglichst luftblasenfrei eingegossen. Am oberen Ende wurde ein 20 zähniger Plastikkamm zur Formung der Geltaschen eingelegt. Das Gel lagerte bis zur vollständigen Auspolymerisierung in der Horizontalen für mindestens 1-1½ Stunden. Nach Auspolymerisation wurden die seitlichen Klammern und das Klebeband entfernt. Das Gel wurden in die horizontale Gelkammer eingespannt. In die obere sowie untere Kammer kamen als Laufpuffer etwa 200ml 1xTBE. Der Kamm wurde nun entfernt und die Taschen sofort mit Hilfe einer Spitze durchgespült, um nichtpolymerisierte Acrylamidreste und Luftblasen, die den Lauf stören könnten, aus den Geltaschen zu entfernen. Um eine möglichst gleichmäßige Temperatur auf der Geloberfläche von ca. 50 C zu erhalten, erfolgte ein Vorlauf der Elektrophorese bei 35 Watt für ca. 20 Minuten. Zur Probenvorbereitung wurde die zuvor anhand des Agarosegelergebnisses bestimmte Menge des PCR-Produkts (in der Regel zwischen 0,5-5µl) entnommen und mit A. dest. auf 6µl aufgefüllt. Zu diesem Probenansatz wurden 2µl Ladepuffer, bestehend aus 0,25% Bromphenolblau, 0,25% Xylencyanol und 30% Glycerol pro Probenansatz hinzugegeben. Zur Abklärung der Produktgrößen wurde in den beiden äußersten Taschen ein 100bp DNA-Ladder aufgetragen. Zur besseren Auftrennung ließ man die Proben mit 10 Watt 62
69 aus den Taschen ins Gel hineinlaufen und steigerte nach 10 Minuten für die restliche Laufzeit die Leistung auf 35 Watt. Über die den Proben beigemischte Farbkomponente konnte die Auftrennung der Produkte verfolgt werden. Bromphenolblau wanderte in einem 8%igen PAGE eine Höhe von 45bp, während Xylencyanol als Farbmarker ungefähr die Laufstrecke der 160bp Fragmente anzeigte (siehe Tab. 35). Erfahrungswerte zeigten, dass für eine genaue Auftrennung der PCR-Produkte von einer Länge von bp eine Laufzeit von etwa 2 Stunden und bei Produkten mit bp ca. 3 Stunden erforderlich waren. Es war wichtig, für die einzelnen Produkte die optimale Laufzeit zu ermitteln, da bei zu langer Laufzeit unscharfe Banden resultierten und bei zu kurzer die Auftrennung der einzelnen Allele nicht ausreichend war. Silberfärbung Um die Nachteile einer radioaktiven Laborarbeit zu umgehen (Strukturbelastung, hohe Kosten für die Entsorgung der Abfälle), wurde zum sensiblen Nachweis der aufgetrennten Allele die Silberfärbung angewandt. Diese bietet gegenüber anderen Nachweismethoden die zusätzlichen Vorteile einer kostengünstigen und relativ einfachen Handhabung. Zudem entspricht die Sensitivität in etwa derjenigen einer radioaktiven Markierung (Bassam et al. 1991). Die Silberlösung musste immer frisch vor jedem Färbevorgang angesetzt werden, während die Ammoniumpersulfatlösung maximal eine Woche bei 4 C haltbar ist. Die Entwicklerlösung (30%iges Natriumcarbonat) wurde als Stammlösung angesetzt und auf eine 3%ige Lösung vor jedem Färbegang frisch verdünnt. Die Stopp- und Fixierlösungen konnten zur Vereinfachung der Methode in größeren Mengen angesetzt und bei Raumtemperatur aufbewahrt werden. Färbeschritte Das Gel wurde nach einer Laufzeit von 2-3 Stunden vorsichtig in die Färbewanne überführt. Mittels Tröpfchentest wurden die Färbelösungen auf ihre richtige Funktionsweise getestet. Dazu wurden auf einem Objektträger jeweils einen Tropfen Silbernitrat- und Natriumcarbonatlösung gemischt. Innerhalb weniger Sekunden zeigte sich eine Schwarzfärbung. Blieb diese aus oder benötigte mehr als 10 Sekunden, musste die Qualität der Chemikalien und des Aqua bidest sowie die Reinheit der Gefäße überprüft werden. Die weiteren Schritte wurden in einer vollautomatischen Färbeeinheit (Fa. Pharmacia Biotech) durchgeführt. Nach Entfernen des 10%igen Ethanols wurde das Gel zweimal 63
70 für 3min mit A. dest. gespült. Danach erfolgte die Zugabe der Silbernitratlösung. Nach 20min Färben wurde diese nach mehrmaligem Spülen mit A. dest. durch die Entwicklerlösung ersetzt. Dabei musste das Gel genau beobachtet werden, um den richtigen Farbton der Banden abzupassen. Danach wurden die Stopp-, Essig- und Fixierlösungen in beschriebener Reihenfolge und Zeitdauer ausgetauscht (Tab. 36) Die Gesamtdauer eines Färbevorgangs betrug ungefähr 90 Minuten. Lösung Zeit Schritt 10% Ethanol 1x5min Waschung 1% HNO 3 2x3min Vorbereitung für Färbung 0,2% AgNO 3 1x20min Aufnahme des Silbernitrats A. dest. 3x1min Auswaschung überschüssiges Silbernitrat 3% NaCO 3 + Formaldehyd 3x1min 10% CH 3 COOH 1x3min Waschung A. dest. 1x5min Färbung der Banden; 3. Schritt individuell nach Färbedauer Gel-Fix-Lösung 1x20min Stabilisierung und Fixierung des Gels Tabelle 36: Färbeprotokoll zur Silberfärbung von Polyacrylamidgelen Nach sichtbar werden der Banden wurde das Gel auf eine optimale Größe zugeschnitten. Dann wurden zwei Blätter Celophanfolie in der Fixierlösung eingeweicht, zwischen die das Gel möglichst ohne Luftblasen gelegt und zum Trocknen in einen Plastikrahmen für mindestens 24 Stunden bei Raumtemperatur eingespannt wurde. Danach war das Gel gut zu handhaben und konnte mit Edding-Stift beschriftet und ausgewertet werden. Auswertung eines Polyacrylamidgels Über den Vergleich mit dem Längenstandard wurde die Größe der Amplifikationsprodukte überprüft. Beim Vorliegen einer Heterozygotie (dialleles System) für den entsprechenden Lokus ergaben sich zwei unterschiedlich große Banden pro Elternteil, so dass sich die Allelverteilung im zu untersuchenden fetalen Gewebe exakt ermitteln ließ (siehe Fallbeschreibung Kap , Abb. 27). Im ungünstigsten Falle lagen beide elterlichen Banden auf einer Höhe. Aufgrund der Homozygotie war dann eine Auswertung bezüglich der parentalen Herkunft nicht möglich. 64
71 4 Ergebnisse In der vorliegenden Arbeit wurden 55 Fälle, die einer konventionellen cytogenetischen Analyse nicht bzw. nur unzureichend zugänglich waren, mit molekularcytogenetischen und molekulargenetischen Methoden untersucht. Einen Überblick über die Fälle bietet die Tabelle C im Anhang. Die Untersuchungen wurden an DNA aus Placentazotten, Amnion, verschiedenen fetalen Geweben, Blut oder asservierter Chromosomensuspension durchgeführt. Sie umfasste die Erhebung des chromosomalen Status mittels CGH in 51 Fällen, die präzise Abklärung von rearrangierten Chromosomen mittels Mikrodissektion in 2 Fällen sowie die Durchführung von FISHund Mikrosatelliten-Analysen in insgesamt 11 Fällen. Anhand der in 10 Fällen durchgeführten Markertypisierung konnte in allen Fällen die Chromosomenstörung und in 8 Fällen deren parentale Herkunft eruiert werden. In 51/55 Fällen wurde eine CGH-Analyse zur Abklärung der Abortursache bzw. Fehlbildungen von Feten durchgeführt. In 42/51 der Fälle (82,4%) konnte ein Ergebnis über CGH erzielt werden, während in 9 Fällen (17,6%) kein Ergebnis mittels CGH zu erreichen war. In 10/51 Fällen wurden zusätzlich zur CGH molekularcytogenetische und molekulargenetische Methoden angewendet, um das bereits vorhandene Ergebnis zu verifizieren und zu präzisieren. 4/55 Fälle wurden nicht mit der Comparativen Genomhybridisierung, sondern ausschließlich mittels FISH und/oder Mikrosatellitenanalyse bzw. Mikrodissektion auf ihre chromosomale Aberration hin untersucht. Im Allgemeinen war der Einsatz der jeweiligen molekularcytogenetischen Techniken zur Abklärung der Chromosomenstörung abhängig von der Art des asservierten Materials. Fälle, bei denen ausschließlich Formalin fixiertes und in Paraffin eingebettetes Gewebe zur Verfügung stand, wurden über CGH, wohingegen Fälle, in denen eine Fibroblastenkultur bzw. Chromosomensuspension asserviert wurde, über Mikrodissektion sowie FISH analysiert. 65
72 4.1 DNA-Isolierung aus asserviertem Fetal- oder Abortgewebe Die Grundvoraussetzung für das Gelingen molekularcytogenetischer Analyseverfahren ist eine gut erhaltene und in ausreichender Menge vorhandene genomische DNA. In Tabelle E im Anhang sind alle Fälle mit Lagerungszeit in Formalin, Autolysegrad des Gewebes und DNA-Fragmentlänge aufgelistet. Insgesamt wurden 6 verschiedene Methoden zur Isolierung von DNA aus asserviertem Abortgewebe angewendet (Tab. 37). Tabelle 37: Übersicht der verwendeten Methoden zur DNA-Isolierung an verschieden asservierten Geweben Gewebe Methode Anzahl bearbeiteter Fälle Formalin fixiertes und in Paraffin eingebettetes Gewebe - nach Proteinausfällung (vgl ) - All-tissue DNA-Kit (vgl ) - Invisorb Spin Tissue Mini Kit (vgl ) Gesamt: 51 nativ eingefrorenes Gewebe - Aussalzmethode (vgl ) 10 Blut - QIAamp DNA Blood Maxi Kit (vgl ) 1 fixierte Chromosomensuspension - nach Li et al (vgl ) DNA-Isolierung aus Formalin fixierten und in Paraffin eingebetteten Gewebe Als Untersuchungsgut dienten Formalin fixierte und in Paraffin eingebettete Gewebeblöckchen unterschiedlichen Alters. Für eine CGH-Analyse war es erforderlich, doppelsträngige DNA zu isolieren. Zum Vergleich der Effizienz wurde DNA nach 3 unterschiedlichen Methoden (Alltissue DNA-Kit, Invisorb Spin Tissue Mini Kit, Proteinausfällung) in 6 Fällen parallel isoliert. Hierbei wurden von den einzelnen Fällen vorrangig Gewebe mit hoher Zelldichte und minimaler Autolyse gewählt. Beim Vergleich der drei Methoden zeigte sich, dass über die Proteinausfällung die größte DNA-Menge mit gutem Reinheitsgrad gewonnen werden konnte. Die sowohl mit dem All-tissue DNA-Kit als auch Invisorb Spin Tissue Mini Kit behandelten Gewebe wiesen im Verhältnis zur Methode der Proteinausfällung eine insgesamt zu niedrigere DNA-Konzentration sowie Reinheit auf (Tab. 38). Nach Auftrennung der DNA-Isolate auf ein Agarosegel zeigte sich in allen Fällen ein Bandenschmier von maximal 100bp- 500bp. 66
73 Die Ratiowerte von 0,2-4,9 deuteten auf Verunreinigung mit Proteinen und RNA hin, welche auf den vorgegebenen, für Formalin fixierte Gewebe vermutlich zu kurzen Enzymverdau zurückgeführt werden dürfte. Die DNAs, die mittels All tissue Kit und Invisorb Spin Tissue Mini Kit isoliert wurden, eigneten sich daher nicht zum direkten Einsatz für die CGH über Nicktranslation, sondern mussten zuvor gereinigt und wegen der geringen Ausbeute universell amplifiziert werden (siehe Kap oder Kap ). Wie die späteren Ergebnisse zeigten, erschwerten die hohen Verunreinigungen mit Proteinen und RNA die für eine CGH notwendigen Markierungsverfahren. Daher wurde für die weiteren Untersuchungen DNA aus formalinfixiertem Gewebe vorrangig durch Proteinausfällung isoliert. Insgesamt wurde in 42 Fällen DNA über die Methode der Proteinausfällung gewonnen. Die Qualität und Quantität der DNA wurde anhand der photometrischen Konzentrationsbestimmung sowie der Fragmentgröße im Agarosegel ermittelt (Tab. 38, Abb. 10). Tabelle 38: Methodenvergleich zur DNA-Extraktion aus Formalin fixierten und in Paraffin eingebetteten Gewebeproben: Angaben zur DNA-Konzentration und Reinheit Fall Gewebe DNA-Konzentration (ng/ l) Ratio A260:A280 O- 535/88 O- 944/91 O- 1173/93 O- 1362/95 O- 1485/96 O- 1488/96 Lunge Leber Haut Gehirn Lunge Leber Lunge Niere nach Proteinausfällung 1203,2 3205,0 77,7 227,0 1120,1 2585,3 1521,3 131,3 All-tissue DNA-Kit 0 6,8 12,7 10,5 0 38,9 10,9 26,8 Invisorb Spin Tissue Mini Kit 32,5 42,2 27,4 16,4 52,2 63,9 30,5 75,2 nach Proteinausfällung 1,60 1,53 1,50 1,43 1,62 1,60 1,58 1,58 All-tissue DNA-Kit 1,06 0,45 0,68 0,50 0,72 1,921 4,24 2,01 Invisorb Spin Tissue Mini Kit 1,00 1,23 1,35 0,98 1,10 1,19 1,18 1,12 Lunge 1499,8 3,0 48,7 1,57 0,21 1,20 Lunge Haut 303,2 914,7 26,2 40,2 46,8 23,9 1,46 1,56 2,28 4,86 1,60 1,38 Anhand der Untersuchungsergebnisse konnte eine Klassifizierung der DNA bezüglich ihrer Fragmentgröße vorgenommen werden. Ausgehend von einer erfolgreichen CGH- Analyse kristallisierten sich 3 Stufen bezüglich der DNA-Qualität heraus (vgl. auch Tab. D im Anhang): DNA-Längen-Optimum: 200bp-1000bp und mehr DNA leicht degradiert: 200bp-700bp DNA stark degradiert: 100bp-500bp und weniger 67
74 In insgesamt 26/42 Fällen (61,9%) konnte aus Formalin fixierten und in Paraffin eingebetteten Geweben DNA gewonnen werden, die ein DNA-Optimum aufzeigten, während 10 Fälle (23,8%) leicht degradierte DNA aufwiesen. In 6 Fällen (14,3%) konnten keine für eine CGH-Analyse ausreichend großen DNA-Fragmente isoliert werden. Die fortgeschrittene Degradierung der DNA nach einer Fixierung von ca. 2 Jahren im Vergleich zur DNA mit einer Fixierungsdauer von ca. 1,5 Monaten ist Abbildung 10 zu entnehmen. Abbildung 10: DNA aus Formalin fixierten und in Paraffin eingebetteten Geweben Fall 114/85: Spätabort mit fortgeschrittener Mazeration der Haut sowie Autolyse der inneren Organe; 2 Jahre Lagerungszeit in Formalin; DNA in der Größenordnung von bp; O- 633/88: 3 Monate Lagerungszeit in Formalin; DNA in der Größenordnung bp; Lu=Lunge; Le=Leber; Nie=Niere) Marker VIII O-114/85 Lu Le O-633/88 Lu Nie 1114bp 501bp 320bp 190bp DNA leicht bis stark degradiert DNA-Isolierung aus frischem und nativ eingefrorenem Gewebe In insgesamt 10 Fällen wurde DNA aus nativ eingefrorenem Gewebe nach Gewebeaufschluss unter Stickstoff (vgl. Kapitel 3.4.2) isoliert. In allen 10 Fällen wurde DNA in ausreichender Menge mit sehr guter Qualität und einer DNA-Länge im Bereich von 300bp bis >1500bp gewonnen (Tab. 39, Abb. 11). 1114bp Marker VIII O-1910/01 Muskelgewebe I II Abbildung 11: O-1910/01: überwiegend hoch-molekulare DNA (>1100bp) mit Anzeichen von DNA- Degradierung aus nativ eingefrorenem Muskelgewebe in zwei verschiedenen Ansätzen (I+II) 501bp Anzeichen für DNA- Degradierung 68
75 Tabelle 39: DNA-Konzentration und Reinheit nach DNA-Extraktion aus verschiedenen nativ eingefrorenen Geweben (I+II entsprechen verschiedenen Extraktionsansätzen) Fall Gewebe DNA-Konzentration ng/ l Ratio A260:A280 O-1842/00 Zunge I 732,9 1,50 O-1896/01 Zotten I Muskel I 471,6 512,9 O-1910/01 Muskel II 524,2 1,76 O-1919/01 Zotten I 363,8 1,57 O-1946/02 Zunge II Zotten II 966,8 1440,6 1,59 1,56 1,53 1,54 O-2051/03 Muskel II 744,9 1,54 O-2065/03 Zunge 757,5 1,51 FBK137 Zotten I 1201,5 1,68 V-2309/02 Zotten I 398,7 1,69 V-2370/02 Zotten I 370,1 1, DNA-Isolierung aus EDTA-Blut In einem Fall wurde aus EDTA-Blut eines Neugeborenen DNA für eine CGH-Analyse isoliert. In 4 weiteren Fällen wurde DNA aus EDTA-Blut von Eltern für eine vergleichende Mikrosatellitentypisierung mittels QIAamp Maxi Kit gewonnen. In allen Fällen konnte hochmolekulare DNA mit einer Länge von 300bp bis ca. 2kb gewonnen und problemlos in PCR-Reaktionen eingesetzt werden werden. Die Ratiowerte lagen im Bereich von 1,5-1,8 (Abb. 12). Marker VIII V-2370/02 Vater Mutter Abbildung 12: V-2370/02: hochmolekulare DNA (>1kb) aus EDTA-Blut ohne Hinweis auf DNA- Degradierung 1114bp 501bp 69
76 4.1.4 DNA-Isolierung aus fixierter Chromosomensuspension In 3 Fällen wurde DNA aus asservierter Chromosomensuspension isoliert. In diesen Fällen sollte eine molekulargenetische Diagnostik Aufschluss über Entstehungsmechanismen, Herkunft von Markerchromosomen oder Präzisierung cytogenetischer Befunde erbringen. Die über diese Methode isolierte DNA war in Quantität gut geeignet für eine Mikrosatellitentypisierung Vergleich der verschiedenen Methoden zur DNA-Isolierung Grundsätzlich ließ sich mit allen angewandten Methoden DNA gewinnen. Im Gegensatz zu DNA aus Formalin fixierten und in Paraffin eingebetteten Geweben erzielte die DNA aus Blut oder frischem bzw. nativ gefrorenem Gewebe in den nachfolgenden molekularcytogenetischen Untersuchungen klare und reproduzierbare Ergebnisse. Im Falle Formalin fixierter Gewebe konnte gezeigt werden, dass ein direkter Zusammenhang zwischen Formalinfixierungsdauer und der DNA-Fragmentgröße besteht. Abbildung 13 zeigt gesamtgenomische DNA isoliert aus formalinfixiertem und in Paraffin eingebettetem Gewebe im Vergleich zu DNA, die aus nativem Gewebe gewonnen wurde. Die DNA aus frischem Zotten- und Muskelgewebe hat eine Länge von >1100bp. DNA nach dreiwöchiger Formalinfixierung ist bereits hochgradig degradiert (DNA- Schmier mit einer Gesamt-Fragmentlänge zwischen bp). Der größte Teil der DNA zeigt jedoch eine Länge zwischen bp. Abbildung 13: O-1896/01: 2%iges Agarosegel; Spur 1-4 höhermolekulare DNA aus nativem Gewebe mit Fragmentlängen von >1100bp (Zotten und Muskel in je 2 Ansätzen). Spur 6+7 degradierte DNA aus Formalin fixierten und in Paraffin eingebettetem Lungen- und Nieren Gewebe mit Fragmentlängen von bp Marker VIII frisches Gewebe Zotten Muskel Formalin fixiertes Gewebe Lunge Niere 1114bp 501bp 110bp 70
77 4.2 DNA-Amplifikation Universelle DNA-Amplifikation mit DOP-PCR von ROCHE Für die universelle Amplifikation gesamtgenomischer DNA wurde ein Kit-System der der Firma ROCHE (DOP Master) getestet. Zur Etablierung dieses Verfahrens wurde aus EDTA-Blut isolierte DNA in verschiedenen Konzentratio eingesetzt. Hierzu wurden 2 unterschiedliche methodische Vorgehensweisen durchgeführt, um die Effizienz der Schritte miteinander zu vergleichen und die Reproduzierbarkeit der Ergebnisse zu erhöhen. Im ersten Versuchsteil wurde die aus nativem Blut gewonnene Test-DNA entsprechend den Reaktions- und Zyklusbedingungen der Amplifikation nach Mikrodissektion universell amplifiziert (siehe Kapitel , Tab. 32). Anschließend wurden jeweils -Produkt in eine weitere DOP-PCR eingesetzt, welche nach den Reaktions- und Zyklusbedingungen des ROCHE-Protokolls durchgeführt wurde (siehe Kap , Tab. 15 -Produktes wurde nun in eine Markierungs-PCR eingesetzt (siehe Kap , Tab. 17). Alle drei PCR-Reaktionen wurden mittels Agarosegelelektrophorese überprüft (Abb. 14) -Produkt auf ein 1,2%iges Agarosegel aufgetragen und mittels Ethidiumbromidfärbung sichtbar gemacht. Abbildung 14: 1,2%iges Agarosegel mit PCR-Produkten einer Test-DNA in verschiedenen Konzentrationen (900ng/µl, 450ng/µl, 90ng/µl und 45ng/µl) nach 1. DOP-PCR (Spuren 1-4) und 2. DOP-PCR (Spuren 5-8) und anschließender Markierungs-PCR (Spuren 9-12) 1. DOP-PCR 2. DOP-PCR Markierungs-PCR Marker VIII ng/µl 1114bp 501bp 242bp nicht eingebautes FdUTP 71
78 Es konnte in allen Ansätzen eine Amplifikation nachgewiesen werden. Mit jeder weiteren PCR-Reaktion zeigte sich jedoch eine kontinuierliche Abnahme der Fragmentgröße. Nach der 1. DOP-PCR betrug die Fragmentgröße ca bp mit einem Hauptanteil zwischen 100bp und 400bp. Nach der 2. DOP-PCR nahm die Fragmentgröße deutlich ab ( bp) mit einem Hauptanteil bei bp. Nach der Markierung der DNA mit FdUTP in der 3. PCR lag die Größe der DNA-Fragmente überwiegend zwischen bp (Abb. 14). Im zweiten Versuchsteil wurde dieselbe genomische Test-DNA direkt in der 2. DOP- PCR amplifiziert und in einer Markierungs-PCR mit FdUTP markiert (Tab. 17; Kap ). Damit sollte eine Abnahme der Fragmentgröße verhindert werden. In allen Ansätzen ließ sich eine Amplifikation nachweisen, wobei die Fragmentgröße der amplifizierten DNA im Bereich von 300 bis >1500bp lag. Nach der Markierungs-PCR waren Fragmentgrößen im Bereich von bp zu verzeichnen (Abb. 15), so dass sich diese Vorgehensweise als günstiger erwies und daher für die Amplifikation von DNA aus Formalin fixiertem und in Paraffin eingebettetem Gewebe herangezogen wurde. Abbildung 15: 1,2%iges Agarosegel mit PCR-Produkten einer normal weiblichen Test-DNA in verschiedenen Konzentrationen (900ng/µl, 450ng/µl, 90ng/µl und 45ng/µl) nach 2. DOP-PCR (Spuren 1-4) und anschließender Markierungs-PCR (Spuren 5-8) Marker VIII 2. DOP-PCR Markierungs-PCR ng/µl 1114bp 501bp 110bp nicht eingebautes FdUTP 72
79 Im Fall V-2309/01 wurde dieses Verfahren an DNA aus Formalin fixiertem Gewebe mit drei verschiedenen DNA-Konzentrationen (50, 100 und 250ng/µl) angewendet. Um zu prüfen, welche DNA-Menge am geeignetsten zur Erhöhung der Amplifikationsrate war, wurden jeweils 10µl und 20µl aus der 2. DOP-PCR in die Markierungs-PCR eingesetzt. Unabhängig von der eingesetzten DNA-Menge war die Ausbeute insgesamt geringer als bei DNA aus nativem Blut. Die Größe der PCR-Produkte lag im Bereich von ca. 1000bp. Nach Markierungs-PCR trat eine deutliche Verkürzung der Fragmente auf (Bereich bp). Tendenziell war eine stärkere Amplifikation bei den Proben mit 20µl zu beobachten (Abb. 16). In 5 Fällen (O-101/85; O-574/88; O-955/91; O-1173/93; O-1485/96) war entweder die Ausbeute nach DNA-Isolierung gering oder die Markierung der DNA über Nicktranslation erbrachte ein negatives Ergebnis, so dass vor dem eigentlichen Markierungsverfahren eine Präamplifikation vorgeschaltet werden musste. Abbildung 16: V-2309/01: 1,2%iges Agarosegel mit PCR-Produkten verschiedener Konzentrationen (50ng/µl, 100ng/µl, 250ng/µl) nach 2. DOP-PCR (Spuren 1-3) und anschließender Markierungs-PCR mit je 10µl und 20µl eingesetztem Amplifikat aus der 2. DOP-PCR (Spuren 1a=10µl und 1b=20µl; Spuren 2a=10µl und 2b=20µl; 3a=10µl); Pfeile markieren Fragmentgröße der PCR-Produkte Marker VIII 2. DOP-PCR ng/µl Marker VIII Markierungs-PCR 1a 1b 2a 2b 3a 10µl 20µl 10µl 20µl 10µl 1114bp 1114bp 501bp 501bp Universelle DNA-Amplifikation mit GenomiPhi DNA Amplification Kit Die Polymerase des Bacteriophagen Phi29 leitet die Reproduktion der DNA gleichzeitig an mehreren Stellen auf der denaturierten linearen DNA ein. Während der Synthese wird durch eine Strangverlagerung neu synthetisierte einzelsträngige DNA erzeugt. Weitere Primer binden an den verlagerten DNA-Strängen und erzeugen Doppelstrang- DNA. Erzielt werden damit Fragmente mit großer Länge. Angewendet wurde dieses Verfahren an 7 Fällen, bei denen die Ausgangskonzentration zu niedrig für eine direkte 73
80 CGH-Analyse war. In allen Fällen konnte eine Amplifikation erreicht werden. Die Bestimmung der DNA-Konzentration und Reinheit erfolgte photometrisch. Die Beurteilung der DNA-Fragmentlänge wurde über ein 1%iges Agarosegel erreicht (Abb. 17). In allen Fällen konnte hochmolekulare DNA >1500bp nachgewiesen werden (Tab. 40). Tabelle 40: Universelle DNA-Amplifikation mit GenomiPhi: Vergleich der DNA-Ausgangskonzentration und Fragmentlänge mit der DNA-Konzentration, Reinheit und Fragmentlänge nach Amplifikation Fall Gewebe DNA- Ausgangskonzentration O-515/88 Niere Trachea 20,0 190, bp bp Fragmentlänge vor Amplifikation DNA- Konzentration nach Amplifikation 1144,2 1059,2 1,47 1,45 Ratio-Werte OD260: OD280 nach Amplifikation Fragmentlänge nach Amplifikation >1500bp >1500bp O-643/88 Niere 200, bp 895,2 1,58 >1500bp O-944/91 Lunge 320, bp 1170,9 1,40 >1500bp O- 1362/95 Niere 130, bp 1172,8 1,43 >1500bp 306/03 Blut 100,0 >1500bp 1062,4 1,45 >1500bp V- 1738/94 V- 2307/01 fetales Gewebe 6, bp 906,9 1,27 >1500bp Zotten III 762,0 >1500bp 987,6 1,33 >1500bp Marker VIII Spur 1 2 Abbildung 17: O-515/88: 2%iges Agarosegel mit DNA nach universeller Amplifikation mittels GenomiPhi DNA Amplification Kit von Amersham Biosciences. In die Amplifikationsreaktion wurden jeweils 10ng Template- DNA aus Formalin fixierten und in Paraffin eingebetteten Gewebeproben eingesetzt. Spur 1 Niere; Spur 2 Trachea. 1114bp 501bp Beim Vergleich der beiden Methoden zur universellen DNA-Vermehrung nach DOP- PCR (Fa. ROCHE) bzw. GenomiPhi (Fa. Amersham Biosciences) erwies sich die Amplifikation der DNA mittels GenomiPhi-Methode bezüglich Quantität und Qualität als effektiver. Bei der DOP-PCR wurde die DNA mit jeder weiteren PCR zunehmend fragmentiert und lag letztlich im Bereich von bp. Für eine homogene Hybridisierung bei einer CGH-Analyse sind jedoch Fragmentlängen ab 300bp bis 74
81 mindestens 800bp erforderlich. Die Fragmentlänge der DNA nach GenomiPhi betrug jedoch in allen Versuchen über 1500bp Mikrosatellitentypisierung An insgesamt 10 Fällen wurde eine Mikrosatellitentypisierung mit chromosomenspezifischen Primern durchgeführt (siehe Kapitel ). Die Amplifikation erfolgte mittels AmpliTaq Polymerase (Applied Biosystems). Die Erfolgsrate mit diesem System lag bei ca. 90%. Die PCR-Produkte wurden hinsichtlich ihrer Größen und Quantität über ein 2%iges Agarosegel überprüft. Sichtbar wurden hierbei Fragmente definierter Größe. In Abbildung 18 wird dies exemplarisch für den Fall 118/01 veranschaulicht. Abbildung 18: Fall 118/01: 2%iges Agarosegel mit PCR-Produkten von Chromosom 8-spezifischen Primern D8S1145 und D8S1110 (V=Vater; K=Kind; M=Mutter) Marker VIII D8S1145 D8S1110 V K M V K M 1114bp 501bp In 10% der Fälle konnte keine DNA mit der AmpliTaq Polymerase amplifiziert werden. Ursächlich hierfür dürfte degradierte und zum Teil hochvernetzte Template- DNA sein. Demzufolge wurde die DNA in ein optimiertes und mit einem Enhancer ausgestattetem PCR-System (CombiPol DNA-Polymerase, Fa. Invitek) eingesetzt. In Variation mit Veränderungen der eingesetzten DNA-Menge und längeren Annealingund Extensionszeiten (siehe Kapitel ) während der PCR-Zyklen konnten Verbesserungen erreicht werden. In Abbildung 19 ist die Amplifikation des Primers D8S1099 von Fall 118/02 mit den PCR-Systemen AmpliTaq und CombiPol DNA Polymerase gegenübergestellt. 75
82 Abbildung 19: Fall 118/02: 2%iges Agarosegel mit PCR-Produkten für den Locus D8S1099 a) AmpliTaq -Polymerase: spezifische Amplifikation bei Kind und Mutter; keine Amplifikation beim Vater. b) CombiPol DNA Polymerase: Amplifikation nach Wiederholung der PCR mit väterlicher DNA a) Marker D8S1099 b) VIII V K M Marker VIII V 331bp 242bp 331bp 242bp Der Vergleich der beiden Methoden zur spezifischen DNA-Vermehrung zeigte, dass aufgrund des im Kit enthaltenen Enhancers und verbesserter DNA-Polymerase- Aktivität Amplifikationen auch bei unzureichender DNA-Qualität zu verzeichnen waren. 4.3 Korrelation zwischen Formalinfixierung und DNA-Qualität Wie die Ergebnisse der CGH-Analysen zeigten, ist die Grundvoraussetzung für eine CGH-Analyse zur Abklärung chromosomaler Imbalancen eine DNA mit einer Mindestgröße von mindestens 200 bis >1200bp. Nach Markierung der DNA über Nicktranslation kann in diesen Fällen ein homogenes, nicht granuläres Hybridisierungsmuster erzielt werden (Abb. 20). In insgesamt 42 Fällen konnte ein Ergebnis über CGH erzielt werden. In 9/42 Fällen (21,4%) lag frisches bzw. nativ eingefrorenes Gewebe vor. In allen Fällen konnte DNA mit im Optimum liegender Qualität (300->1200bp) isoliert werden. In 33 der 42 Fälle (78,6%) lag DNA aus Formalin fixierten und in Paraffin eingebetteten Geweben vor. In 26/33 Fällen (78,8%) konnte DNA im Optimum (200->1200bp) isoliert werden. In 7/33 Fällen (21,2%) war die DNA mit Fragmentlängen von bp leicht degradiert. In 9/33 Fällen (17,6%) konnte kein aussagekräftiges Ergebnis über CGH erzielt werden. 3 der 9 Fälle (33,3%) wiesen leicht degradierte DNA ( bp) und 6 Fälle (66,7%) stark degradierte DNA ( bp) auf. Einen Überblick über die Korrelation zwischen DNA-Fragmentgröße und CGH-Erfolg aller analysierten Fälle gibt die Abbildung
83 Abbildung 20: O-684/89: Metaphase nach CGH; DNAFragmentlänge nach Nicktranslation betrug bp; Hybridisierung zeigt homogenes Muster; Kennzeichnung der Geschlechtschromosomen. Abbildung 21: Korrelation zwischen erfolgreicher CGH-Analyse und Größe der isolierten DNA-Fragmente 25 Anzahl der Fälle Fälle ohne erfolgreiche Cases with CGH-Analyse Fälle mit erfolgreicher CGHAnalyse DNA-Qualität: DNA of formalin fixed tissue formalinfixiertes Gewebe bp bp bp bp bp bp 77 frozen tissue nativ eingefrorenes Gewebe bp bp
84 Des Weiteren wurde der Zusammenhang zwischen Formalinfixierungsdauer und der DNA-Fragmentgröße in Kombination mit vorangegangener Mazeration / Autolyse des zu testenden Gewebes untersucht. Der Autolysegrad wurde in folgende 4 Klassen unterteilt: I: Mazeration der Haut Ia: beginnende Mazeration der Haut Ib: fortgeschrittene Mazeration der Haut II: Autolyse der inneren Organe IIa: beginnende Autolyse der inneren Organe IIb: fortgeschrittene Autolyse der inneren Organe Es konnte eine stark positive Korrelation zwischen Dauer der Formalinfixierung und der Degradierung der DNA nachgewiesen werden. Vorangegangene autolytische Prozesse der Feten bzw. des Abortmaterials zeigten jedoch keine direkte Korrelation zur Qualität einer CGH-Analyse (vgl. Abb. 22). So zeigten insgesamt 5 Fälle ohne beschriebene Autolyse und qualitativ guter Ausgangs-DNA diskrepante CGH-Ergebnisse zu den cytogenetischen Vorbefunden (O- 317/87, O-542/88, O-633/88, O-684/89, O-875/90). Andererseits konnte in 4 Fällen mit beschriebener beginnender und fortgeschrittener Autolyse der inneren Organe hochwertige DNA gewonnen werden, so dass ein eindeutiges CGH-Ergebnis erzielt werden konnte (O-1154/93, O-1949/02, O-2017/02, S-41/02). Eine eindeutige Korrelation zwischen Autolyse des Feten und DNA-Zustand lag nur in insgesamt 4 Fällen vor (O-114/85, O-1362/95, O-1475/96, O-1485/96). 78
85 Abbildung 22: Korrelation zwischen Formalinfixierungsdauer und DNA-Fragmentgröße und Mazeration / Autolyse fetalen Gewebes 2 Jahre Mazeration/ Autolyse 1 Jahr Formalinfixierungsdauer 6 Monate 3 Monate 2 Monate 1 Monat Fälle mit positivem CGH-Ergebnis Erfolg II b II a I b I a - Fälle mit negativem CGH-Ergebnis Keine Autolyse DNA-Qualität -Qualität des des Formalin fixiertengewebes bp bp bp 79
86 Dagegen schien die Lagerungsdauer der Gewebe in Paraffin ( Blöckchenalter ) keinen entscheidenden Einfluss auf die Struktur der DNA-Moleküle und somit auf die Qualität der nachfolgenden Untersuchungen zu haben (Abb. 23). Abbildung 23: Korrelation zwischen Lagerungsdauer des Gewebes in Paraffin (Paraffinblöckchen) und DNA- Qualität. Die Kreise geben die einzelnen Fälle entsprechend ihrer DNA-Fragmentgröße wieder. 20 Jahre Blöckchenalter 5 2 1,5 1 0, bp bp bp 4.4 Comparative Genomhybridisierung (CGH) An insgesamt 51 Fällen wurde eine CGH-Analyse nach Markierung über Nicktranslation durchgeführt (siehe Kapitel ). Die Qualität der Nicktranslations- Produkte wurde mittels Agarosegelelektrophorese bestimmt. Es konnte gezeigt werden, dass nach Nicktranslation eine Verkürzung der DNA-Fragmente um durchschnittlich 400bp stattfand. Zudem bestand eine Korrelation der Fragmentgrößen nach Nicktranslation mit der Degradierung der Ausgangs-DNA (Tab. 41). In Abbildung 24 ist DNA aus Formalin fixierten und in Paraffin eingebettetem Gewebe und DNA aus gefrorenem Gewebe nach Nicktranslation dargestellt. Die Spuren 1, 2 und 80
87 4 zeigen eine hochgradig degradierte DNA mit Fragmentlängen von bp, während die Spur 3 weniger stark degradierte Fragmentlängen im Bereich von bp aufwies. Die Spuren 5 und 6 aus nativ gefrorenem Gewebe hingegen zeigen eine homogenen DNA-Schmier von 50->1000bp. Ein vergleichbares Bild ergibt sich für die Texas-Red markierte Referenz-DNA, die aus Vollblut gewonnen wurde (Spuren 7-9). Die DNA-Fragmente lagen in einem Größenbereich von 200- >1100bp. Tabelle 41: Fragmentgröße der DNA nach Nicktranslation (DNA aus Formalin fixiertem Gewebe gefrorenem Gewebe ) Fall Gewebe Fragmentgröße der Ausgangs- DNA in bp ; DNA aus Fragmentgröße der DNA nach Nicktranslation in bp O-212/86 Niere O-236/86 Niere O-542/88 Lunge O-1154/93 Lunge O-1919/01 Muskel >1100 Zotten >1100 Abbildung 24: DNA-Fragmentgröße nach Nicktranslation: Spuren 1-4: DNA aus Formalin fixierten und in Paraffin eingebettetem Gewebe; Spuren 5 und 6: DNA aus gefrorenem Gewebe; Spuren 7-9: Referenz-DNA aus Vollblut. Formalin fix-iertes und in Paraffin einge-bettetes Gewebe (Lunge) Nativ eingefrorenes Gewebe (Muskel) EDTA-Blut 1114bp 501bp 190bp Texas Red-dNTPs FITC-dNTPs 81
88 In 33 der mit CGH analysierten 51 Fälle lag DNA aus Formalin fixiertem und in Paraffin eingebettetem Gewebe vor. In insgesamt 9 Fällen (17,6%) konnte kein Ergebnis über CGH erzielt werden. Der Prozess der Formalinfixierung konnte als Ursache für bereits degradierte DNA festgestellt werden. Zudem wurde die DNA aufgrund der methodisch in der Nicktranslation bedingten Strangbrüche weiter fragmentiert. In 42 Fällen (82,4%) konnte, sowohl an DNA aus Formalin fixiertem und in Paraffin eingebettetem Gewebe als auch an nativem/gefrorenem Gewebe, mittels CGH über Nicktranslation ein Ergebnis erzielt werden. In 29 dieser Fälle lagen cytogenetische Vorbefunde entweder nach Pränataldiagnostik vor oder an Abortmaterial erhoben. In 11/29 Fällen (38%) konnte der cytogenetische Vorbefund bestätigt und in 6/29 Fällen (20,7%) präzisiert werden. In 3 Fällen (10,3%) ergaben sich nach CGH abweichende Bruchpunkte. In 9 Fällen (31%) konnte der cytogenetische Vorbefund allerdings nicht bestätigt werden (vgl. Kap ). In 13 Fällen lag kein cytogenetischer Befund vor. In 5 Fällen (38,5%) konnte ein pathologisches Ergebnis und in 8 Fällen (61,5%) ein unauffälliger Befund ermittelt werden. In insgesamt 10 der mit CGH positiv getesteten Fälle wurden Zusatzuntersuchungen wie Mikrosatellitenanalyse und FISH mit diversen Sonden zur Befundbestätigung- und präzisierung durchgeführt. Dabei konnte in 2 Fällen nach pathologischem Histologiebefund des Abortmaterials und normalem CGH-Befund eine Triploidie als Abortursache gesichert werden. In insgesamt 5 Fällen wurde eine CGH-Analyse nach Amplifikation und Markierung der DNA über DOP-PCR durchgeführt. In 3/5 Fällen ergab die CGH-Analyse einen unauffälligen Befund (60%). In 2/5 Fällen (40%) erbrachte die CGH-Analyse kein auswertbares Ergebnis. In insgesamt 7 Fällen wurde die DNA mittels GenomiPhi-Vermehrung universell amplifiziert und anschließend über Nicktranslation markiert. In 4/7 Fällen (57,2%) konnte ein Ergebnis mittels CGH erzielt werden (43%). In 3/7 Fällen (42,8%) konnte die genomische DNA zwar amplifiziert werden, das Hybridisierungsmuster nach Nicktranslation zeigte jedoch inhomogene Signale, so dass eine Auswertung mittels digitaler Bildanalyse nicht möglich war. Tabelle 42 gibt die Zusammenstellung der einzelnen Ergebnisse wieder. 82
89 Tabelle 42: Auflistung aller Fälle mit CGH-Analyse nach Nicktranslation, DOP-PCR und GenomiPhi Amplifikation. CGH nach Nicktranslation Anzahl Fälle (n) CGH erfolgreich normaler Befund auffälliger Befund kein CGH- Ergebnis CGH nach DOP-PCR CGH nach GenomiPhi Fälle mit unauffälligem CGH-Ergebnis In 22 von 42 Fällen (52,4%) mit einem Ergebnis nach CGH ergab die Analyse einen unauffälligen Befund (Tab. 43, Tabelle A im Anhang). Alle 8 Fälle ohne cytogenetische Vorbefunde (34,8%) wiesen einen Phänotyp auf, der auf eine chromosomale Grunderkrankung schliessen ließ (siehe z.b. Fallbeschreibungen O-1980/02 Kap und O-2017/02 Kap ). In 2 weiteren Fällen konnte durch Mikrosatellitenanalyse eine Triploidie nachgewiesen werden, die durch eine CGH unerkannt blieb (Fall O-2065/03, Fall V-2317/01 in Kap ). In insgesamt 14 von 22 Fällen (63,6%) lag ein cytogenetischer Vorbefund vor. In 5 Fällen ergab die Chromosomenanalyse einen unauffälligen Karyotyp. Die fetalpathologische Untersuchung zeigte jedoch klinische Auffälligkeiten auf, die eine Chromosomenaberration als Ursache nahe legte. In diesen Fällen konnte jedoch über die retrospektive CGH-Analyse keine chromosomale Veränderung nachgewiesen werden, so dass der cytogenetische Vorbefund, der pränatal an Amnionzellen bzw. Chorionzotten erhoben wurde, bestätigt werden konnte. Weitere 3 Fälle wiesen einen Karyotyp mit einem zusätzlichen Markerchromosom auf, wobei in 2/3 Fällen das Markerchromosom in Mosaikform auftrat. Nähere Angaben über die Größe oder das Mosaiklevel der überzähligen Markerchromosomen lagen nicht vor. In 3 weiteren Fällen lag eine Chromosomenaberration in Form eines Ringchromosoms vor. In einem Fall wies das Ringchromosom einen Mosaikstatus auf. In 2 der 3 Fälle waren Bruchpunkte angegeben, wobei diese in einem Fall (O-633/88) terminal an den Chromosomenenden lagen. Im zweiten Fall (O-1485/96) lag dagegen der Bruchpunkt im p-arm in Centromernähe, während der Bruch distal im langen Arm des Chromosoms erfolgt war. In allen 6 Fällen ergab die CGH ein unauffälliges Ergebnis, so dass die vordiagnostizierten Chromosomenaberrationen nicht bestätigt werden konnten. 83
90 In 3 weiteren Fällen lagen unterschiedliche chromosomale Aberrationen vor. In zwei Fällen (O-665/89, V-1738/94) lag eine unbalancierte Translokation vor. Im Fall O- 1896/01 war in der Chorionzotten-Kurzzeitkultur ein zusätzliches Chromosom in der Größe eines D-Gruppenchromosoms in 36% der analysierten Mitosen gefunden worden, während der Karyotyp nach Langzeitkultur unauffällig war. In allen 3 Fällen ergab die CGH-Analyse ein unauffälliges Ergebnis (siehe auch Kap und Tab. B im Anhang). Die Rate für falsch negative Ergebnisse in 9 von 14 Fällen mit strukturellen Auffälligkeiten lag nach CGH bei 64,3%. Dies ließ sich durch die hohe Anzahl von Marker- und Ringchromosomen begründen (vgl. Kap. 5.3). Tabelle 43: Unauffälliges CGH-Ergebnis: Tabellarische Übersicht über die Fälle (AB=cytogenetischer Vorbefund an Abortmaterial erstellt; KZ=Kurzzeitkultur; LZ=Langzeitkultur) Anzahl (n) ohne Vordiagnostik Unauffälliger Vorbefund mit Vordiagnostik Markerchromosomen Ringchromosomen Strukturelle und andere Aberrationen O-518/88 O-574/88 O-1980/02 O-2022/03 O-2065/03 S-145/03 V-2317/01 V-2381/03 O-943/91: 46,XX O-1842/00: 46,XX O-1949/02: 46,XY O-2017/02: 46,XX (AB) V-2351/02: 46,XX (AB) O-101/85: 47,XX,+mar O-317/87: 46,XY/47,XY,+ mar O-875/90: 46,XX/47,XX,+ mar O-542/88: 46,XX/46,XX, r(19) O-633/88: 46,XY,r(14) (p12q32) O-1485/96: 46,XY,r(18) (p11q23)/ 45,XY,-18 O-665/89: 46,XX,- 21,+t(13;21)(pter ->q13::21.2->qter) O-1896/01: 46,XY[9]/47,XY,+ D(KZ); 46,XY (LZ) V-1738/94: 46,XX,der(7) t(7;?14) (AB) Um die hohe Quote der falsch negativen Ergebnisse zu erklären, sowie Möglichkeiten und Grenzen der CGH-Analyse darzustellen, werden in den folgenden Kapiteln einzelne Fallbeispiele dargestellt. In allen bearbeiteten Fällen wurde dieselbe männliche Referenz-DNA über Nicktranslation mit Texas-Red markiert nach Mischung (1:1) mit einer Fluorescein-markierten Test-DNA auf Metaphasen eines gesunden männlichen Spenders hybridisiert (3-5 Tage). 84
91 Bestätigung eines Normalbefundes (O-1980/02) Bei diesem Fet wurde ein intrauteriner Fruchttod in der rechnerisch 21.SSW festgestellt. Nach Aborteinleitung wurde der Fet fetalpathologisch untersucht. Der Fet wies bereits starke Mazerationserscheinungen auf. Bei der Obduktion wurden neben facialen Dysmorphien (tief sitzende Ohren, weit ausladender Hinterkopf), starke Wachstumsretardierung sowie zahlreiche Fehlbildungen wie Hydrocephalus, rechtsseitige Nierenagenesie und komplexe Herzgefäßfehlbildung festgestellt. Der Herzfehler konnte näher als Ebstein`sche Anomalie charakterisiert werden. Es lag kein cytogenetischer Vorbefund vor. CGH-Analyse Es wurde DNA mit Fragmentlängen von bp aus fetalem Lungengewebe isoliert. Die Auswertung der CGH-Analyse erfolgte an 10 Metaphasen. Die Ratioprofile aller Autosomen lagen innerhalb der Grenzwerte mit Ausnahme von Abweichungen der pericentrischen Regionen von Chromosom 9 und 16. Es ergab sich eine weibliche Gonosomenkonstellation. Es wurde jedoch ein Verlust von X-chromosomalen Material im Bereich q13-q22 detektiert (Abb. 25a). Dies könnte auf eine Deletion in diesem Bereich hindeuten. Wahrscheinlicher erschien jedoch ein Hybridisierungsartefakt bedingt durch inhomogene Hybridisierung. Eine Kontrollhybridisierung mit weiblicher Referenz-DNA ergab unauffällige Ratioprofile für die Gonosomen (Abb. 25b). Die Ratioprofile der Autosomen lagen innerhalb der Grenzwerte. Es ergab sich somit kein Hinweis für eine numerische oder strukturelle Chromosomenaberration als Ursache für die beschriebenen Fehlbildungen. Die abschließende Karyotypformel lautet: rev ish XX. Abbildung 25 Fall O-1980/02: Partielles CGH-Profil: Darstellung der Fluoreszenz-Ratioprofile der Gonosomen. a) weibliche Gonosomenkonstellation mit Unterrepräsentation fetaler DNA im Bereich der Chromosomenbande Xq13-q22. b) Kontrollhybridisierung: unauffällige weibliche Gonosomenkonstellation bei Hybridisierung weiblicher Referenz-DNA gegen weibliche Test-DNA. a) b) 85
92 Bestätigung eines Normalbefundes (O-2017/02) In diesem Fall handelte es sich um einen Abort aus der 15.SSW, bei dem eine fetalpathologische Untersuchung aufgrund des syndromalen Erscheinungsbildes des Feten veranlasst wurde. Der weibliche Fetus wies bereits beginnende Mazerationserscheinungen der Haut und beginnende Autolyse der inneren Organe insbesondere von Leber und Gehirn auf. Dies spricht für einen bereits intrauterin stattgefundenen Fruchttod. Neben facialen Dysmorphien (Brachycephalie, Protrusio bulbi beidseits, leichte Retrognathie, kleine tiefsitzende Ohrmuscheln) zeigte der Fet Vierfingerfurchen beider Hände, Sandalenfurchen beider Füße, Hypoplasie einer Nabelarterie sowie einen komplexen Herzfehler in Form eines persistierenden gemeinsamen AV-Kanals. Cytogenetischer Befund Zur Abklärung der Abortursache wurden zunächst fetale Zotten kultiviert. Die anschließende Chromosomenanalyse ergab einen unauffälligen weiblichen Karyotyp. Bei Kultivierung von Abortzotten kann jedoch bei einem weiblichen fetalen Karyotyp eine Kontamination mit mütterlichen Zellen nicht vollständig ausgeschlossen werden. Da sich aus dem Obduktionsbefund ein starker Verdacht auf ein fetales Down-Syndrom ergab, wurde zum Ausschluss eines kryptischen Rearrangements mit Beteiligung der Down critical region`, die auf dem langen Arm von Chromosom 21 in 21q22.13-q22.2 lokalisiert, eine FISH-Analyse durchgeführt. Als DNA-Sonden wurden die Loci D21S259, D21S341 und D21S342 (LSI 21-Sonde, Fa. Vysis) verwendet. In allen 20 analysierten Metaphasen und in 50 Interphasekernen ließen sich stets 2 regelrechte Signale nachweisen [46,XX. ish 21 (D21S259/D21S341/D21S342x2)], (Abb. 26a). CGH-Analyse Zur Erhärtung des unauffälligen cytogenetischen Befundes an fetalen Abortzotten wurde eine CGH mit DNA aus fetalem Lungen- und Nierengewebe durchgeführt. Die DNA wies eine Fragmentänge zwischen bp auf. Es wurden insgesamt 13 Metaphasen in die Analyse einbezogen. Im heterochromatischen Bereich von Chromosom 16 wurde ein leichter Zugewinn detektiert, welcher jedoch als methodisch bedingter Artefakt interpretiert wurde (vgl. Kap ). Die Ratioprofile aller anderen Autosomen lagen innerhalb der Grenzwerte. Die Gonosomenkonstellation war XX (Abb. 26b). Die Karyotypformel nach ISCN lautet demnach: rev ish XX. 86
93 Zusammenfassung Es konnte keine Chromosomenaberration mittels CGH des zu untersuchenden Gewebes nachgewiesen werden. Molekularcytogenetisch gab es keinen Hinweis für eine Trisomie 21. Somit konnte der post mortem an Abortzotten erhobene unauffällige weibliche Karyotyp bestätigt werden. Abbildung 26 Fall O-2017/02: a) FISH mit LSI-Sonde für die Down-kritische Region (Loci D21S259, D21S341 und D21S342; rote Markierung); 2 regelrechte Signale auf den beiden homologen Chromosomen 21. b) CGH-Profil mit weiblicher Gonosomenkonstellation ohne Hinweis auf eine Trisomie 21; Ratioprofile aller Autosomen innerhalb der Grenzwerte a) b) 87
94 Falsch negativer Befund bei Vorliegen einer Triploidie (V-2317/01) CGH-Analyse Es wurde DNA ( bp) in zwei Ansätzen aus Formalin fixierten, in Paraffin eingebetteten Abortzotten isoliert. Die CGH-Analyse ergab keinen Hinweis auf eine unbalancierte Chromosomenaberration. Für alle Autosomen lagen die Fluoreszenz- Ratioprofile innerhalb der Grenzwerte. Das Fluoreszenzmuster für die Geschlechtschromosomen war typisch für einen weiblichen Karyotyp (rev ish XX). Mikrosatellitenanalyse Da histologisch der Verdacht auf eine Triploidie bestand, wurde eine Mikrosatellitentypisierung mittels PCR an DNA des Abortes und der Eltern durchgeführt. Es wurden insgesamt 12 hochpolymorphe Marker der Chromosomen 1, 2, 5, 13, 16 sowie 18 untersucht. Von diesen waren 8 Loci informativ und belegten einen triploiden Chromosomensatz im Abort (Tab. 44, Abb. 27). Mit 3 der getesteten informativen Marker (D1S518, D2S436, D13S317) konnte eine mütterliche Herkunft des überzähligen Chromosomensatzes nachgewiesen werden. Diese Ergebnisse belegten eine Triploidie mütterlichen Ursprungs, die während der mütterlichen Keimzellreifung in Meiose I entstanden ist. Tabelle 44 Fall V-2317/01: Mikrosatellitenanalyse bestätigt Triploidie maternalen Ursprungs. Marker/Lokalisation Vater Abort Mutter Interpretation D1S534 / 1p13-12 a,c a,b,c b,c 3 Allele D1S518 / 1q24 a,b b,c,d c,d 3 Allele, maternal D1S1660 / 1q31 a,a a,a,b a,b Dosiseffekt D2S1360 / 2p24 a,c a,b,c b,c 3 Allele D2S436 / 2p b,b a,a,b a,a Dosiseffekt; maternal D5SNA / 5p15.3 a,c b,c,c b,c Dosiseffekt D13S317 / 13q21 b,c a,a,c a,a Dosiseffekt; maternal D16S539 / 16q24 a,a a,a,b a,b Dosiseffekt 88
95 Abbildung 27 Fall V-2317/01: Mikrosatellitenanalyse: Exemplarisch ist die Allelsegregation zweier Repeat-Polymorphismen dargestellt. D2S436 belegt mütterliche Herkunft des überzähligen Chromosomensatzes im Abort. D2S1360 zeigt 3 Allele und weist auf die Entstehung der Triploidie während der maternalen Meiose I hin (a,b,c stellen Arbeitseinheiten dar). Vater D2S436 Abort Mutter D2S1360 Vater Abort Mutter a b a b c Fälle mit pathologischem CGH-Profil In 20 von 42 Fällen (47,6%) konnte ein pathologisches CGH-Profil erstellt werden (Tab. 45). In insgesamt 5/20 Fällen (25,0%) lag kein cytogenetischer Befund vor. In einem Fall konnte eine Deletion detektiert werden [O-506/88 del(13)(q22->qter)]. In 4 Fällen wurden numerische Chromosomenaberrationen nachgewiesen. In einem Fall lag gonosomale Aberration mit einem fetalen Turner-Syndrom vor. In 3 Fällen wurden autosomale Trisomien nachgewiesen (jeweils eine Trisomie für die Chromosomen 3, 13 und 18). In insgesamt 15/20 Fällen (75,0%) mit einem auffälligen cytogenetischen Vorbefund konnte dieser mit einer CGH-Analyse charakterisiert werden. In 6/15 Fällen (40,0%) konnten die erstellten Vorbefunde bestätigt werden (1xTrisomie 3, 1xTrisomie 21, 2xKlinefelter-Syndrom, eine interstitielle Deletion 9p und eine Duplikation 2p). In 6/15 Fällen (40,0%) konnte der Vorbefund präzisiert werden. In zwei Fällen mit je einer terminalen und interstitiellen Deletion ergaben sich nach CGH andere Bruchpunkte, so dass die Deletion kleiner erschien als cytogenetisch vordiagnostiziert (siehe Beispiele O-643/88 Kap und sowie O-212/86 Kap und 5.5.3). Im Fall O-1919/01 konnten die Bruchpunkte eines zusätzlichen Markerchromosoms durch eine CGH-Analyse exakt charakterisiert werden (Kap ). In einem Fall konnte eine in Placentazotten gefundene partielle Deletion eines X-Chromosoms nicht, jedoch ein 45,X-Karyotyp in kultivierten Amnionzellen bestätigt werden (O-750/89). Im Fall V-1771/95 konnte anhand der CGH-Analyse der Entstehungsmechanismus der vorliegenden Chromosomenstörung näher bestimmt werden (Kap und 5.5.4). Aufgrund von divergierenden Bruchpunkten konnten in 3/15 Fällen (20,0%) die cytogenetischen Vorbefunde nicht näher charakterisiert werden. Im Falle eines 89
96 Ringchromosoms 18 (O-162/85) zeigte die CGH-Analyse lediglich eine Deletion im langen Arm. Zur Ringbildung musste jedoch auch ein Bruch im kurzen Arm erfolgt sein. Ein Verlust von Material des kurzen Arms war jedoch nicht nachzuweisen. Im Fall O-236/86 lag eine unbalancierte Translokation mit einer partiellen Trisomie 5p13->pter und partiellen Monosomie 22q vor, wobei nach CGH-Analyse nur ein Zugewinn von 5p15.1->pter detektiert werden konnte. Der Verlust von 22q13->qter konnte nicht nachgewiesen werden. Im Fall O-684/89 lag eine partielle Duplikation für 13q22->qter aufgrund einer maternalen paracentrischen Inversion vor. Die CGH-Analyse ergab jedoch einen Zugewinn im Bereich 13q32->qter. Tabelle 45: Tabellarische Übersicht über die Fälle mit auffälligem CGH-Ergebnis (PZ=Placentazotten; AZ=Amnionzellen; AB=cytogenetischer Befund an Abortmaterial erstellt) Anzahl (n) ohne Vordiagnostik bestätigt präzisiert divergente Bruchpunkte mit Vordiagnostik strukturell numerisch gonosomal autosomal O- 1154/93 O- 506/88 S-41/02 V- 2307/01 V- 2370/02 O-1035/92: 46,XY,del(9) (p22p23)[80%] /46,XY O-1946/02: 47,XXY (AB) O-2039/03: 47,XXY (AB) O-2051/03: 47,XX, /03: 46,XY,dup(2) (p13p22) FBK137: 47,XX,+3 (AB) O-212/86: 46,XY,del(3) (p11p14) O-515/88: 46,XX,r(13)(p12 q13/14 (AB) O-643/88: 46,XY,del(4) (q31.3->qter) O-750/89: 46,XX,del(Xq?) in PZ; 45,X in AZ O-1919/01: 46,XX/47,XX, +r(2) V-1771/95: 46,XY,add(22) (AB) O-162/85: 46,XX,r(18)/ 45,XX,-18 O-236/86: 46,XY,t(5;22) (p13;q13)pat O-684/89: 46,XY,dup(13) (q22->qter) 90
97 Terminale Deletion 13q Präzisierung eines cytogenetischen Vorbefundes (O-515/88) Bei diesem Fall wurde eine Interruptio in der 29.SSW durchgeführt. Zu allgemeiner Hypotrophie wies der Fet multiple Fehlbildungen auf. Neben facialen Dysmorphien (Mikro-Brachycephalie, Epikanthus beidseits, Protrusio bulbi, Makro-Retrogenie, ungewöhnlich große Ohrmuscheln) zeigte er Gelenkkontrakturen, Klumpfußstellung beidseits, lobäre Holoprosencephalie, Aplasie von Gallenblase und Pankreas, anorektale Atresie sowie hypoplastische und mikrozystische Nieren. Die cytogenetische Chromosomenanalyse aus einer Fibroblastenkultur aus kultiviertem Hautgewebe ergab einen weiblichen Karyotyp mit einem Ringchromosom 13 mit partieller Monosomie 13q13/14->qter, wobei der Bruchpunkt im langen Arm nicht vollständig geklärt wurde, so dass der Karyotyp mit [46,XX,r(13)(p12q13/14)] angegeben wurde. CGH-Analyse Es wurde DNA ( bp) aus fetalem Nierengewebe isoliert. Das Fluoreszenzmuster für die Geschlechtschromosomen ergab einen weiblichen Karyotyp. Die Auswertung der Fluoreszenz-Ratioprofile der Autosomen für das Chromosom 13 zeigte einen Verlust im Bereich q21->qter. Der Verlust am langen Arm von Chromosom 13 wurde bereits in den Metaphasen sichtbar (vgl. Abb. 28a, b). Für alle anderen Autosomen lagen die Fluoreszenz-Ratioprofile innerhalb der Grenzwerte. Die Karyotypformel nach ISCN lautet: rev ish XX, dim(13q21qter). Der Befund multipler schwerer Fehlbildungen des Feten entspricht dem Deletionssyndrom 13q. Die Detektion der Deletion des kurzen Arms bei einem Ringchromosom ist aufgrund der Methodik (Abblockung der repetitiven Sequenzen mit COT1-DNA) nicht möglich. Der an Fibroblasten erhobene Karyotyp konnte jedoch mittels CGH präzisiert und mit 46,XX, del(13)(q21->qter) beschrieben werden. 91
98 Abbildung 28 Fall O-515/88: a) Metaphase nach CGH: Es zeigt sich eine deutliche Unterrepräsentation (rot) des Chromosoms 13. Gekennzeichnet sind die Gonosomen X und Y sowie das auffällige Chromosom 13. b) partielles CGH-Profil: Verlust im Bereich 13q21->qter bei weiblicher Gonosomenkonstellation. a) b) Terminale Deletion 4q Präzisierung eines cytogenetischen Vorbefundes (O-643/88) Die Pränataldiagnostik erfolgte in der 18.SSW aus Altersindikation. Dabei fiel sonografisch eine ausgeprägte Retrognathie und eine mediane Gaumenspalte auf. Die Chromosomenanalyse kultivierter Amnionzellen zeigte eine terminale Deletion am langen Arm von Chromosom 4 [46,XY,del(4q). Die fetalpathologische Untersuchung ergab einen leicht hypotrophen, macrocephalen männlichen Fetus mit facialen Dysmorphien (Mikro-Retrogenie, langes prominentes Philtrum, sattelförmig eingesunkene breite Nasenwurzel, hintere Gaumenspalte mit gespaltener Uvula), Cutis laxa im Halsbereich, Gelenkkontrakturen, Wiegenkufenfüße beidseits, Makropenis sowie eine beidseitige inkomplette Lungenlappung. Die cytogenetische Chromosomenanalyse aus einer Fibroblastenkultur bestätigte den pränatal erhobenen Karyotyp mit einer Deletion am langen Arm von Chromosom 4 [46,XY,del(4)(q31.3->qter)]. 92
99 CGH-Analyse Es konnte qualitativ gute DNA mit Fragmentlängen im Bereich von bp aus Lungen- und Nierengewebe isoliert werden. In beiden untersuchten Geweben ergab das Fluoreszenzmuster für die Geschlechtschromosomen einen männlichen Karyotyp. Die Auswertung der Fluoreszenz-Ratioprofile der Autosomen für das Chromosom 4 zeigte einen Verlust im Bereich q32->qter. Die Fluoreszenz-Ratioprofile der anderen Autosomen lagen innerhalb der Grenzwerte (Abb. 29). Die Karyotypformel nach ISCN lautet: rev ish XY, dim(4)(q32qter). Abbildung 29 Fall 643/88: Partielles CGH-Profil der Chromosomen 4 und 5 bei weiblicher Gonosomenkonstellation. Pfeile markieren Ausmaß der terminalen Deletion 4q32->qter Die beschriebenen Dysmorphien sind mit einem chromosomalen Krankheitsbild vereinbar, wie es pränatal als Deletion 4q diagnostiziert worden war. Der an Fibroblasten erhobene Karyotyp konnte jedoch mittels CGH präzisiert und mit 46,XY, del(4)(q32->qter) beschrieben werden Nachweis einer Trisomie 18 (S-41/02) In dieser Schwangerschaft kam es in der rechnerisch 24.SSW zu einem Abort. Die fetalpathologische Untersuchung ergab einen stark hypotrophen (Körpermaße entsprechend der 18.SSW) männlichen Fetus mit deutlichen Mazerationserscheinungen der Haut und Autolyse der inneren Organe, insbesondere des Gehirns. An inneren Fehlbildungen war eine Ösophagusatresie mit ösophagotrachealer Fistel charakteristisch. Die Placenta wies eine ausgeprägte Zottenfibrose auf, was dem Bild einer abgelaufenen Placentitis entsprach. Diese Placentainsuffizienz schien ursächlich für den intrauterinen Fruchttod. Eine Chromosomenanalyse war nicht erfolgt. Aufgrund der beschriebenen Fehlbildungen wurde jedoch eine Chromosomenstörung vermutet. CGH-Analyse Es wurde qualitativ gute DNA mit einer Fragmentlänge im Bereich von bp aus fetalem Lungen- und Placentagewebe isoliert. Die CGH-Analyse ergab eine männliche 93
100 Gonosomenkonstellation. Für das Chromosom 18 konnte ein Zugewinn für das gesamte Chromosom nachgewiesen werden (Abb. 30a). Für alle anderen Autosomen lagen die Fluoreszenz-Ratioprofile innerhalb der Grenzwerte. Somit lag bei dem Feten eine Trisomie 18 vor, die phänotypisch dem Edwards-Syndrom entspricht. Die Trisomie 18 kann als Ursache für die in der fetalpathologischen Untersuchung erhobenen Befunde (Wachstumsretardierung, Ösophagusatresie, ösophagotracheale Fistel) angesehen werden. Diese Zuordnung wurde durch die CGH-Analyse ermöglicht. Die Karyotypformel nach CGH lautet: rev ish XY, enh(18). Mikrosatellitenanalyse Die Mikrosatellitentypisierung mittels PCR mit spezifischen Primern wurde an DNA des Feten und der Eltern durchgeführt. Es wurden insgesamt 12 hochpolymorphe Marker von Chromosom 18 getestet. Von diesen belegten 8 Loci eine Trisomie 18 über einen Dosiseffekt (Tab. 46). Mit einem der getesteten Marker (D18S862) konnte eine mütterliche Herkunft des überzähligen Chromosoms nachgewiesen werden (Abb. 30b). Das Vorhandensein von 3 Allelen spricht zudem für die Entstehung während der mütterlichen Meiose I. Abbildung 30 Fall S-41/03: a) Partielles CGH-Profil: Darstellung der Fluoreszenz-Ratioprofile der Chromosomen 3, 17 und 18 mit Zugewinn am Chromosom 18 bei männlicher Gonosomenkonstellation b) Mikrosatellitenanalyse zur Bestätigung einer Trisomie 18 mütterlicher Herkunft. Exemplarisch ist die Allelsegregation eines Repeatpolymorphismus (D18S862) dargestellt. In der fetalen DNA waren 3 Allele nachzuweisbar (a,b,c stellen Arbeitseinheiten dar). a) b) D18S862 Vater Fetus Mutter a b c 94
101 Tabelle 46 Fall S-41/02: Mikrosatellitenanalyse bestätigt Trisomie 18 maternalen Ursprungs. Marker/Lokalisation Vater Abort Mutter Interpretation D18S62 / 18p a,b a,a,c a,c Dosiseffekt D18S71 / 18p11.22 a,b a,b,b b,b Dosiseffekt D18S843 / 18p a,b a,a,b a,b Dosiseffekt D18S535 / 18q12 b,c a,b,b a,a Dosiseffekt D18S877 / 18q12.1 a,c a,a,b a,b Dosiseffekt D18S858 / 18q21.2 a,a a,a,b a,b Dosiseffekt D8S862 / 18q21.2 b,b a,b,c a,c 3 Allele, maternale Herkunft D18S878 / 18q21.3 b,c a,b,c a,b 3 Allele Nachweis einer Trisomie 12 (V-1771/95) Bei diesem Fall handelte es sich um einen Frühabort aus der rechnerisch 11+1 SSW. Die cytogenetische Analyse aus Abortzotten ergab eine unbalancierte Chromosomenstörung mit einem Derivativchromosom 22 bei männlichen Karyotyp. Die Herkunft des zusätzlichen Materials konnte nicht näher bestimmt werden. Chromosomenanalysen beider Eltern lagen nicht vor. CGH-Analyse Es wurde DNA aus Formalin fixiertem, in Paraffin eingebettetem Zottengewebe isoliert. Die CGH-Analyse ergab einen männlichen Karyotyp. Die Auswertung der Fluoreszenz- Ratioprofile für die Autosomen zeigte einen Zugewinn für Chromosom 12, der bereits in der Metaphase durch eine intensive Grünfluoreszenz der homologen Chromosomen 12 auffiel (Abb. 31a). Die statistische Auswertung der Fluoreszenzintensitäten sprach für einen Zugewinn für das gesamte Chromosom 12 (Abb. 31b). Für alle anderen Autosomen lagen die Fluoreszenz-Ratioprofile innerhalb der Grenzwerte. Karyotypformel nach CGH lautet: rev ish XY, enh(12). Die 95
102 a) Abbildung 31 Fall V-1771/95: a) Metaphase nach Hybridisierung auf Metaphasen eines männlichen Spenders. Es zeigt sich eine deutliche Überrepräsentation (grün) des Chromosoms 12. b) partielles CGH-Profil mit Darstellung der Fluoreszenz-Ratioprofile der Chromosomen 10, 11 und 12 sowie der Gonosomen mit Zugewinn von Chromosom 12 bei männlichem Karyotyp. b) Fluoreszenz-in situ-hybridisierung Zur Überprüfung und Präzisierung der CGH-Ergebnisse wurde eine FISH-Diagnostik an asservierter Chromosomensuspension angeschlossen. Allerdings waren nur wenige Metaphasechromosomen vorhanden, so dass zur Auswertung überwiegend Interphasenuclei herangezogen werden mussten. Zunächst wurde eine Centromersonde spezifisch für die -Satelliten DNA von Chromosom 12 (D12Z1) verwendet, um die Herkunft des zusätzlichen Materials auf dem Derivativchromosom 22 zu bestätigen. In 5 analysierten Metaphasen konnten 3 Signale nachgewiesen werden, jeweils ein regelrechtes Signal auf den beiden normalen homologen Chromosomen 12 und ein Signal auf dem Derivativchromosom 22 (Abb. 32a). Die Auswertung von 119 Interphasenkernen ergab in 84% drei Chromosom 12-spezifische Signale. Dies spricht für einen Mosaikstatus entsprechend der getesteten Region. Bei der Interphasediagnostik blieb es allerdings ungeklärt, ob es sich bei dem überzähligem Signal um das dicentrische Derivat, wie es in der cytogenetischen Analyse nachgewiesen wurde, oder um ein überzähliges Chromosom 12, das über CGH detektiert wurde, handelte. Daher wurde eine weitere FISH mit einer digoxigeninmarkierten DNA-Sonde, die auf dem langen Arm von Chromosom 12 lokalisiert ist (GLI-Gen in 12q13) durchgeführt (Abb. 32c). In 57% der analysierten Zellkerne waren zwei und in 43% drei spezifische Signale vorhanden. Dieser Befund 96
103 deutet darauf hin, dass zumindest in einem Teil der Zellen eine komplette Trisomie 12 vorlag. Des Weiteren wurde eine FISH-Analyse mit Centromersonden spezifisch für die Centromere der Chromosomen 14/22 durchführt. In 5 analysierten Metaphasen und 35 Interphasekernen konnten jeweils 4 Signale nachgewiesen werden (Abb. 32b). Unter Verwendung der cytogenetischen und molekularcytogenetischen Analysen lässt sich der Karyotyp wie folgt beschreiben: 46,XY,dic(12;22)(12pter->12q11::22p11.1->22qter). rev ish enh(12). ish der(22) (D14Z1/D22Z1+,D12Z1+).nuc ish D12Z1x2,GLI3x3,GLI3x2) Abbildung 32 Fall V-1771/95: Fluoreszenz-in situ-hybridisierung: a) Centromer-Sonde für das Chromosom 12 (D12Z1 grün). Sowohl beide normalen homologen Chromosomen 12 als auch das Derivativchromosom 22 (Pfeil) zeigten ein centromerspezifisches grünes Signal. b) Centromer-Sonden für die Chromosomen 14/22 (D14Z1/D22Z1 rot). der(22) zeigte eine deutliche Hybridisierung in der Centromerregion als Hinweis für ein dicentrisches Chromosom. c) LSI Sonde 12q13 (GLI 3 grün). Interphasekern mit drei spezifischen Signalen b) a) c) Mikrosatellitenanalyse Die Mikrosatellitentypisierung mittels PCR mit spezifischen Primern wurde an DNA des Abortes (Zotten) und der Mutter (Dezidua) durchgeführt. Dazu wurde das Schnittpräparat des Abortes zur Trennung der kindlichen und mütterlichen Areale histologisch bewertet. Anschließend wurden mittels einem Skalpell die entsprechenden 97
104 Gewebeproben separat voneinander aus dem Paraffinblöckchen herausgeschnitten und getrennt zur DNA-Isolierung überführt. Es wurden insgesamt 17 hochpolymorphe Marker von Chromosom 12 getestet. Von diesen waren 5 Loci semiinformativ mit Hinweis auf eine Trisomie 12 maternaler Herkunft (Tab. 47, Abb. 33). Tabelle 47 Fall V-1771/95: Mikrosatellitenanalyse bestätigt Trisomie für Chromosom 12. Marker/Lokalisation Distanz in cm von 12ptel Abort Mutter Interpretation D12S372/ 12p a,b,b a,b Dosiseffekt D12S374/ 12p13.31 keine Angaben a,b,b a,b Dosiseffekt D12S373/ 12p a,a,b a,b Dosiseffekt D12S1042/ 12p a,b,b a,b Dosiseffekt D12S375/ 12q a,a,b a,a Dosiseffekt a b Kind Mutter Abbildung 33 Fall V-1771/95: Mikrosatellitenanalyse deutet auf mütterliche Herkunft des überzähligen Chromosoms 12. Der hochpolymorphe Repeatmarker D12S372 zeigte Dosiseffekt für das maternale Allel b (a und b stellen Arbeitseinheiten dar) Nachweis einer interstitiellen Deletion 3p (O-212/86) Wegen fortgeschrittenen mütterlichen Alters erfolgte in der 16.SSW eine Pränataldiagnostik. Die Chromosomenanalyse kultivierter Amnionzellen zeigte eine interstitielle Deletion des kurzen Arms von Chromosom 3 [46,XY,del(3)(p11p14)]. Die fetalpathologische Untersuchung ergab einen leicht hypotrophen männlichen Fetus mit facialen Dysmorphien (hoher schmaler Schädel mit kleinem Gesicht, Hypertelorismus, Epikanthus beidseits, langes Philtrum), Balkenagenesie des Gehirns sowie leichte subvalvuläre hypertrophische Aortenstenose bei ansonsten regelhaften Skelettverhältnissen und ohne weiteren Fehlbildungen. CGH-Analyse Es wurde DNA mit einer Fragmentlänge im Bereich von bp aus fetalem Nierengewebe isoliert. Das Fluoreszenzmuster für die Geschlechtschromosomen entsprach einem männlichen Karyotyp. Die Auswertung der Fluoreszenz-Ratioprofile für die Autosomen zeigte für das Chromosom 3 einen Verlust im Bereich p12-p14 (Abb. 34). Die Fluoreszenz-Ratioprofile der anderen Autosomen lagen innerhalb der Grenzwerte. Die Karyotypformel nach ISCN lautet: rev ish XY, dim(3p12p14). 98
105 Abbildung 34 Fall O-212/86: Partielles CGH-Profil mit den Fluoreszenz-Ratioprofilen der Chromosomen 1, 2 und 3 bei männlicher Gonosomenkonstellation: Dargestellt ist die Unterrepräsentation fetaler DNA am Chromosom 3 im Bereich p12p14 (Pfeile). Der pränatal erhobene Karyotyp konnte mittels CGH präzisiert und mit 46,XY, del(3)(p12p14) beschrieben werden. Allerdings scheint nach CGH die Deletion etwas kleiner als cytogenetisch vordiagnostiziert Charakterisierung eines überzähligen Markerchromosoms (O-1919/01) Aus Altersindikation erfolgte in der 16.SSW eine Pränataldiagnostik. Der Ultraschall war unauffällig. Die cytogenetische Analyse kultivierter Amnionzellen ergab einen numerisch auffälligen Befund mit einem überzähligen Markerchromosom in 53% der untersuchten Zellen (47,XX,+mar/46,XX). Die zusätzlich durchgeführte NOR-Färbung zeigte keine spezifische Anfärbung des Markerchromosoms, während die C-Färbung positiv für den Marker war. Über eine M-FISH-Analyse konnte er als ein Derivat des Chromosoms 2 identifiziert werden (Abb. 35a). Aufgrund der infausten Prognose wurde eine Interruptio durchgeführt. Die anschließende fetalpathologische Untersuchung ergab einen weiblichen dystrophen Fetus mit craniofacialen Dysmorphien (ausgeprägter Hypertelorismus, breite Nase, prominentes Philtrum, Makrostomie, Mikro-Retrognathie und tiefsitzende Ohren) sowie ein verkürztes 4. Metacarpale und ohne weitere inneren Fehlbildungen. Die Chromosomenanalyse der Eltern ergab beim Vater einen unauffälligen Karyotyp (46,XY), während bei der Mutter ein Triple X- Karyotyp gefunden wurde (47,XXX). Die genaue Identifizierung der genetischen Zusammensetzung des Markerchromosoms sollte retrospektiv über eine CGH-Analyse erfolgen. CGH-Analyse Es wurde qualitativ gute DNA mit Fragmentlängen im Bereich von bp aus nativ gefrorenem Muskelgewebe isoliert. Das Fluoreszenzmuster für die Geschlechtschromosomen zeigte einen weiblichen Karyotyp. Die Auswertung der Fluoreszenz-Ratioprofile ergab einen pathologischen Befund für das Chromosom 2. Im 99
106 centromernahen Bereich des Chromosoms 2 fiel bereits eine intensive Grünfluoreszenz auf. Abbildung 35b zeigt das Ergebnis der CGH in Form eines Partialprofils für das Chromosom 2. Die statistische Auswertung der Fluoreszenzintensitäten sprach für einen Zugewinn der Chromosomenregion 2p13-q13. Die Karyotypformel nach ISCN lautet demnach: rev ish XX,enh(2)(p13q13). Somit dürfte das Markerchromosom beim Kind neu entstanden sein. Abbildung 35 Fall O-1919/01: a) M-FISH-Analyse: Identifizierung des chromosomalen Ursprungs des überzähligen Markerchromosoms als Derivat von Chromosom 2. b) partielles CGH-Profil mit Darstellung der Fluoreszenz-Ratioprofile der Chromosomen 2 und 3 mit Zugewinn am Chromosom 2 in p13-q13 bei weiblichem Karyotyp. a) b) Mikrodissektion Zur Überprüfung der mittels CGH identifizierten Bruchpunkte des überzähligen Markerchromosoms wurde der Marker mikrodisseziert. Aus Metaphasen der kultivierten Amnionzellen wurden 5 Markerchromosomen mit Hilfe der Mikrodissektion disseziert und die DNA mittels DOP-PCR amplifiziert (Kap ). In einer 2. PCR wurde die DNA mit Biotin markiert und als Sonde für eine FISH 100
107 verwendet (vgl. Kap ). Beim Reverse Painting (Abb. 36a) wurden die centromernahen Regionen der homologen Chromosomen 2 im Bereich p13-q13 vollständig markiert. Bei Hybridisierung auf Metaphasen des Feten (Forward Painting) zeigte sich eine vollständige Markierung des Markerchromosoms sowie ebenfalls der pericentromerischen Regionen der normalen Chromosomen 2 (Abb. 36b). Da der Verdacht auf Bildung eines Ringchromosoms vorlag, wurde zudem eine FISH- Analyse mit der All Human Telomeres -Sonde durchgeführt (Abb. 36c). Diese zeigte auf allen Chromosomen regelrechte Signale mit Ausnahme des Markers. Somit konnte ein Ringchromosom verifiziert werden. Abbildung 36 Fall O-1919/01: Mikro-FISH- und FISH-Analysen: a) FISH auf normale männliche Metaphasen (reverse chromosome painting): Markierung der centromernahen Region der homologen Chromosomen 2. b) Hybridisierung auf Metaphasen des Feten (forward painting): vollständige Markierung des Markerchromosoms sowie pericentromerischen Regionen der normalen Chromosomen 2. c) FISH mit der Sonde All Human Telomeres : kein spezifisches Signal am Markerchromosom (Pfeil). a) b) c) Mikrosatellitenanalyse Zur Bestimmung der parentalen Herkunft des Markers sowie zum Ausschluss einer uniparentalen Disomie der normalen homologen Chromosomen 2 wurde eine Mikrosatellitentypisierung mittels PCR an DNA des Feten und der Eltern durchgeführt. Es wurden insgesamt 9 hochpolymorphe Marker der pericentromerischen Region und 5 Marker des langen Arms von Chromosom 2 eingesetzt. Zwei der pericentromerischen Marker (D2S1790 in 2p und D2S1394 in 2p13) waren informativ und belegten 101
108 eine paternale Herkunft des Markers. Zwei der getesteten Marker außerhalb der pericentromerischen Region (D2S1326 in 2q22 und D2S427 in 2q37) ergaben eine biparentale Vererbung der beiden homologen Chromosomen 2 (Abb. 37). Somit konnte eine UPD für das Chromosom 2 ausgeschlossen werden. Abbildung 37: Polyacrylamidgelelektrophorese (PAGE) hochpolymorpher Mikrosatelliten. D2S1790 (a) und D2S1394 (b) zeigten Dosiseffet für paternale Herkunft des Markers. D2S427 (c) dagegen zeigt biparentale Vererbung der homologen Chromosomen 2. D2S1790 D2S1394 a) b) Vater Abort Mutter Vater Abort Mutter a a b b c c) D2S427 Vater Abort Mutter a b c Das pränatal diagnostizierte zusätzliche Markerchromosom konnte aufgrund des Einsatzes unterschiedlicher molekularcytogenetischer Methoden (FISH, Multicolor- FISH, Mikrodissektion) exakt charakterisiert und die Bruchpunkte nach CGH präzise bestimmt werden Fälle ohne Ergebnis nach CGH In 9/51 Fällen (17,6%) konnte kein Ergebnis über CGH erzielt werden (siehe Anhang Tab. A). In 6/9 Fällen (66,6%) wurde hochgradig degradierte DNA mit einer Länge von 150 bis maximal 500bp Länge isoliert. Die Fixierungsdauer der Gewebeproben in Formalin betrug mehrere Wochen bis zu 2 Jahre. In 3/9 Fällen (33,3%) konnte leicht degradierte DNA ( bp) gewonnen werden. Verantwortlich hierfür ist die vorangegangene, längere Formalienfixierungsdauer von mehreren Wochen (Tab. D im Tabellenanhang). 102
109 Trotz mehrerer Versuche unter Einbeziehung unterschiedlicher Methoden (vgl. Kap und ) gelang es nicht, die DNA in diesen Fällen für eine CGH ausreichend zu markieren. 4.5 Molekularcytogenetische und molekulargenetische Methoden zur umfassenden Charakterisierung chromosomaler Imbalancen bei Aborten In 3 Fällen konnte über Mikrosatellitentypisierung und in einem Fall über chromosomale Mikrodissektion die vordiagnostizierte Chromosomenstörung präzise abgeklärt werden. In allen vier Fällen hatte die cytogenetische Diagnostik einen auffälligen Karyotyp mit einem strukturell veränderten Chromosom ergeben Ausschluss einer Uniparentalen Disomie 2 (O-1893/01) In diesem Fall wurde in der 23.SSW eine Chorionzottenbiopsie aufgrund sonografischer Auffälligkeiten (cerebrale Ventrikulomegalie, Oligohydramnion) durchgeführt. Die cytogenetische Untersuchung der Chorionzotten nach Langzeitkultivierung erbrachte den pathologischen Befund einer Mosaik-Trisomie 2 level III mit folgendem Karyotyp: 47,XX,+2[38]/46,XX[6]. Zur weiteren Befundabklärung erfolgten eine Entnahme von Fetalblut und Fruchtwasser. Die cytogenetische Untersuchung der fetalen Lymphocyten und Amnionzellen ergaben in allen analysierten Metaphasen einen numerisch und strukturell unauffälligen weiblichen Karyotyp (46,XX). Die in den Chorionzotten gefundene Mosaik-Trisomie 2 ließ sich nicht mehr nachweisen. Der Spontanabort aus der 26.SSW wurde nicht fetalpathologisch untersucht. Molekulargenetische Methoden Zum Ausschluss einer uniparentalen Disomie für das Chromosom 2 infolge eines Trisomie Rescues wurde eine Mikrosatellitentypisierung über PCR durchgeführt. Es wurden insgesamt 17 hochpolymorphe für das Chromosom 2 spezifische Mikrosatellitenmarker eingesetzt, von denen 4 der getesteten Loci informativ waren und eine biparentale Vererbung belegten (Tab. 48, Abb. 38). Somit konnte eine UPD für das Chromosom 2 als Ursache der sonografisch ermittelten Auffälligkeiten ausgeschlossen werden. Es bestand daher entweder die Möglichkeit, dass die Mosaik-Trisomie 2 auf die Placenta beschränkt war, nicht den Feten betraf oder die Trisomie 2 betraf andere fetale Gewebe, die jedoch nicht untersucht werden konnten. 103
110 Tabelle 48 Fall O-1893/01: Mikrosatellitenanalyse belegt biparentalen Vererbungsmodus für die Chromosomen 2; Allele sind in Arbeitseinheiten angegeben. Marker/Lokalisation * Vater Abort Mutter Interpretation D2S2232 / 2p10-q11.2 a, a a, b b, b biparental D2S1897 / 2p10-q11.2 c, c a, c a, b biparental D2S1384 / 2q33 a, c a, b b, b biparental D2S1363 / 2q36 a, b a, c c, c biparental (* nach cedar.genetics.soton.ac.uk) a b c D2S1897 Vater Kind Mutter Abbildung 38 Fall O-1893/01: Mikrosatellitenanalyse. Ausschluss einer UPD 2 als Ursache des Spontanabortes und der beschriebenen Fehlbildungen Terminale Deletion 4p (Wolf-Hirschhorn-Syndrom) (O-1910/01) In der rechnerisch 27.SSW wurde aufgrund eines auffälligen Ultraschallbefundes (intrauterine Wachstumsretardierung, Klumpfüße beidseits, flaches Profil, Abb. 39a) eine Amniocentese durchgeführt. Die Chromosomenanalyse kultivierter Amnionzellen ergab eine Deletion des kurzen Armes an einem Chromosom 4 (Abb. 39c) mit dem Karyotyp 46,XX,del(4)(p16.1). Die Deletion wurde mittels FISH mit einer DNA-Sonde spezifisch für das Wolf-Hirschhorn-Syndrom bestätigt. Die Eltern entschieden sich aufgrund der infausten Prognose für einen Schwangerschaftsabbruch. Die fetalpathologische Untersuchung ergab einen stark hypotrophen weiblichen Feten mit Maßen, die der 23.SSW entsprachen. Die facialen Dysmorphien waren typisch für das Wolf-Hirschhorn-Syndrom (`Greek warrior helmet`-facies: Mikrocephalie, Hypertelorismus, breiter Nasenrücken, kurzes prominentes Philtrum, Karpfenmund, Mikro-Retrognathie, tiefsitzende Ohren, Abb. 39b). Weiterhin wies der Fet Klumpfüße, starke Lungen- und Nierenhypoplasie sowie einen Herzfehler in Form einer Fenestrierung des Foramen ovale auf. Die Chromosomenanalyse beider Eltern ergab einen normalen Befund. 104
111 Abbildung 39 Fall O-1910/01: a) Darstellung der Klumpfüße des Feten im Ultraschall der 27.SSW; b) Facialer Aspekt des Feten mit Wolf-Hirschhorn-Syndrom: `Greek warrior helmet-facies`mit Hypertelorismus, breitem Nasenrücken, Karpfenmund, Mikro-Retrognathie und tiefsitzenden Ohren; c) Partielles Karyogramm: links normales Chromosom 4, rechts deletiertes Chromosom 4. Im Ideogramm ist das Ausmaß der Deletion markiert. a) b) c) Fluoreszenz-in situ-hybridisierung Mittels FISH-Diagnostik unter Verwendung locusspezifischer Sonden (D4S96, Oncor, Gaithersburg, MD, USA; WHSCR-Sonde und die Subtelomer-Probe D4S3359, Vysis Inc, Downers Grove IL, USA) konnte die 4p-Deletion bestätigt werden. Die jeweiligen Loci ließen sich an dem deletierten Chromosom 4 nicht darstellen (Abb. 40). Abbildung 40 Fall O-1910/01: Zwei-Farben-FISH mit locusspezifischen Sonden. Die Pfeile markieren jeweils das deletierte Chromosom 4. a) LSI WHSCR in 4p16.1 (rot): D4Z1 (grün); WHSCR ist nicht darstellbar b) Subtelomer-Sonde in 4p16.3: (D4S3359 grün); Telomer 4q (rot) - Verlust der Subtelomerregion 4p. a) b) 105
112 Mikrosatellitenanalyse Um das Ausmaß der Deletion näher zu charakterisieren sowie die parentale Herkunft des deletierten Chromosoms abzuklären, wurde eine Mikrosatellitenanalyse durchgeführt. Dazu wurde fetale DNA aus gefrorenem Muskelgewebe isoliert. Die elterliche DNA konnte aus der asservierten Chromosomensuspension gewonnen werden. Insgesamt wurden 28 spezifische, hochpolymorphe Marker aus der kritischen Region 4p15.3->pter getestet. Von diesen waren 7 Marker informativ und belegten das Fehlen des väterlichen Allels (Marker D4S3023, D4S394 und D4S2366). Für weiter proximal gelegene Marker konnten beim Fet 2 Allele nachgwiesen werden (Abb. 41). Demnach muss der Bruch zwischen den Markern D4S394 und D4S2928 erfolgt sein (Tab. 49). Tabelle 49 Fall O-1910/01: Mikrosatellitenanalyse bestätigt Deletion des paternal vererbten Chromosoms; Allele sind in Arbeitseinheiten angegeben. Marker/ Lokalisation * Distanz in cm von 4ptel * Vater Abort Mutter Interpretation D4S3023/4p b,c a a,d paternales Allel fehlt D4S2366/4p b,c a a,c paternales Allel fehlt D4S394/4p b,b a a,c paternales Allel fehlt D4S2928/4p a,c a,b b,b 2 Allele; biparental (* nach cedar.genetics.soton.ac.uk) Abbildung 41 Fall O-1910/01: Mikrosatellitenanalyse: Die hochpolymorphen Repeatmarker D4S3023 und D4S2366 zeigten Deletion des paternal vererbten Chromosoms. D4S3023 D4S2366 Vater Fetus Mutter Vater Fetus Mutter a b c d a b c Die pränatal mittels konventioneller Chromosomenanalyse festgestellte Deletion des kurzen Armes eines Chromosoms 4 konnte somit durch FISH unter Verwendung spezifischer DNA-Sonden (D4S96 und LSI WHSCR) bestätigt werden. Durch die Mikrosatellitentypisierung konnte gezeigt werden, dass das deletierte Chromosom vom Vater stammt. und die Ergebnisse zeigten zudem, dass die Deletion größer als die für das Wolf-Hirschhorn-Syndrom kritische Region ist. 106
113 4.5.3 Inversionsduplikation 8p (118/02) Die vorgeburtliche Chromosomenanalyse aus Amnionzellen in der 15.SSW (Amniocentese erfolgte aus Altersindikation) ergab einen strukturell auffälligen weiblichen Karyotyp mit einer Verlängerung des kurzen Armes eines Chromosoms 8 (Abb. 42). Da eine Inversionsduplikation 8p vermutet wurde, wurde das veränderte Chromosom mit Hilfe der FISH-Technik näher untersucht. Das zusätzliche Material am Chromosom 8 wurde mit einer WCP 8-Sonde als Chromosom 8-Material identifiziert (Abb. 43a). Eine Beteiligung weiterer Chromosomen an dieser Strukturaberration konnte daher mit großer Wahrscheinlichkeit ausgeschlossen werden. Nach Hybridisierung mit einer Subtelomersonde für 8p ergab diese an dem aberranten Chromosom 8 kein Signal, so dass der Verlust der terminalen Region 8p23.1->pter nachgewiesen werden konnte (vgl. Abb. 43b). FISH mit den Sonden für die Centromer- und Subtelomerregion 8q ergaben jeweils regelrechte Signale. Die Inversionsduplikation einhergehend mit einer Deletion der Subtelomerregion wurde somit molekularcytogenetisch bestätigt. Im Zusammenhang mit dem G-Bandenmuster wurde die Verlängerung als Inversionsduplikation der Banden 8p11.2->p23 bei gleichzeitigem Verlust der terminalen Region 8p23.1->pter interpretiert. Die Karyotypformel lautet demnach: 46,XX,inv dup del(8)(qter->p23.1::p23.1->p11.2:). ish inv dup del(8)(wcp8+,d8s505-,8qtel+,d8z1+). Die Chromosomenanalyse beider Eltern ergab einen unauffälligen Befund. Aufgrund der infausten Prognose entschieden sich die Eltern zu einem Schwangerschaftsabbruch. Die fetalpathologische Untersuchung ergab einen normotrophen weiblichen Fetus mit Maßen entsprechend der 18.SSW. Auffällig waren diskrete faciale Dysmorphiezeichen (Hypertelorismus, Mikrognathie, hoher Gaumen, kleine Ohrmuscheln), Pes equinvarus beidseits, ein Herzfehler in Form eines Vorhofseptumdefekts vom Sekundum-Typ und Hirnfehlbildungen wie Hydrocephalus internus, fehlende Gyrierung der Großhirnhemisphären und Corpus callosum-agenesie. 107
114 Abbildung 42 Fall 118/02: Partielles Karyogramm nach GTG-Bänderung: links normales Chromosom 8, rechts strukturell verändertes Chromosom 8. Das Ideogramm zeigt das Ausmaß der Duplikation. Pfeile markieren involvierte Banden der Duplikation normales Chromosom 8 Inversionsduplikation 8p Abbildung 43 Fall 118/02: FISH mit Chromosom 8-spezifischen Sonden (Pfeil kennzeichnet das Derivativchromosom 8). a) FISH mit WCP 8 (grün, Vysis): durchgängige Markierung des strukturell veränderten Chromosoms 8; b) FISH mit Subtelomer-Sonden 8p (D8S505, grün) + Subtelomer 8q (rot) + Centromer-Sonde für das Chromosom 8 (D8Z1, rot): Deletion von 8p. a) b) Mikrosatellitenanalyse Zur näheren Charakterisierung des duplizierten bzw. deletierten Segmentes und zur Bestimmung der parentalen Herkunft des aberranten Chromosoms wurde eine Mikrosatellitenanalyse durchgeführt. Es wurde DNA aus asservierter Chromosomensuspension des Vaters und des Kindes sowie aus EDTA-Blut der Mutter isoliert. Insgesamt wurden 27 polymorphe Marker aus der chromosomalen Region 8p11->8ptel sowie 3 Marker aus dem langen Arm von Chromosom 8 getestet (Tab. 50). 5 polymorphe Marker für die Bereiche 8p23.2, 8p23.1, 8p21.2 und 8p11.1 bestätigten eine Duplikation (vgl. Abb. 44). Anhand der Befunde der Mikrosatellitentypisierung ist das duplizierte Segment größer, als cytogenetisch vermutet wurde. Die parentale Herkunft des aberranten Chromosoms konnte jedoch nicht bestimmt werden. 108
115 Der vollständige Karyotyp kann demnach folgendermaßen beschrieben werden: 46,XX,inv dup del(8)(qter->p23.3::p23.3->p11.1::p11.1:).ish inv dup del(8)(wcp8+, D8S504-, 8qtel+, D8Z1+). Tabelle 50 Fall 118/02: Mikrosatellitenanalyse bestätigt Duplikation 8p; Allele sind in Arbeitseinheiten angegeben. Marker/Lokalisation * Distanz in cm von 8ptel * Vater Abort Mutter Interpretation D8S1469 / 8p a,b a,b,c b,c 3 Allele D8S1109 / 8p23.1 k.a. a,b b,b,c b,c Dosiseffekt D8S1107 / 8p23.1 k.a. b,b a,b,b a,b Dosiseffekt D8S1989 / 8p a,b a,a,b a,b Dosiseffekt D8S1104 / 8p a,c a,b,c b,c 3 Allele D8S1110 / 8p a,b b,c a,c biparental D8S1132 / 8q23.1 k.a. b,c b,d a,d biparental D8S1128 / 8q a,a a,c b,c biparental (* Abbildung 44 Fall 118/02: Mikrosatellitenanalyse: die hochpolymorphen Marker D8S1104 in 8p11.1 und D8S1989 in 8p21.2 zeigten Duplikation für 8p Vater D8S1104 Kind Mutter D8S1989 Vater Kind Mutter a b c a b Derivativchromosom 8 (V-2309/01) Die Schwangerschaft kam nach einer IVF-Behandlung aufgrund eines OAT-Syndroms des Vaters zustande. Eine Chromosomenanalyse der Eltern war vorab nicht erfolgt. Nach eingetretener Schwangerschaft zeigte der hcg-verlauf einen inadäquaten Anstieg mit sonografischem Verdacht auf ein Windei. Es kam in der rechnerisch 8.SSW (sonografisch 5.SSW) zu einem Frühabort. Die cytogenetische Analyse an Metaphasen aus kultivierten Abortzotten ergab einen männlichen Karyotyp mit einem strukturell veränderten Chromosom 8. Das aberrante Chromosom 8 wies proximal am kurzen Arm zusätzliches Chromosomenmaterial unbekannter Herkunft auf (vgl. Abb. 45). Der Karyotyp konnte cytogenetisch wie folgt beschrieben werden: 46,XY,add(8)(p23). 109
116 der(8) Abbildung 45 Fall V-2309/01: Partielles Karyogramm nach GTG- Bänderung: links das normale Chromosom 8, rechts das strukturell veränderte Chromosom 8 mit zusätzlichem Material unbekannter Herkunft. Die FISH-Analyse mit Chromosom 8-spezifischen Sonden bestätigten die unbalancierte Translokation mit einer partiellen Monosomie 8p23->pter und einer partiellen Trisomie unbekannter Herkunft (siehe Abb. 46a). Zur Bestimmung der Herkunft des zusätzlichen Chromosomenmaterials wurde das gesamte Derivativchromosom mikrodisseziert. Aus Metaphasen der kultivierten Abortzotten wurden 3 Markerchromosomen mit Hilfe der Mikrodissektion disseziert und die DNA mittels DOP-PCR amplifiziert. In einer 2. PCR wurde die DNA mit Biotin markiert, gefällt und als Sonde für eine FISH verwendet (vgl. Kap ). Bei der Hybridisierung auf Metaphasen eines nomalen männlichen Spenders (Abb. 46b) wurden die homologen Chromosomen 8 vollständig sowie die Chromosomen 6 im Bereich 6q22->qter markiert. Bei der Hybridisierung von Chromosom 8- und Chromosom 6-spezifischen WCP-Sonden an Metaphasen des Patienten konnte bestätigt werden, dass das zusätzliche Chromosomenmaterial von Chromosom 6 stammt (Abb. 46c). Mikrosatellitenanalyse Zur näheren Charakterisierung der Bruchpunkte sowie zur Bestimmung der parentalen Herkunft des duplizierten Segmentes 6q wurde eine Mikrosatellitenanalyse durchgeführt. Es wurde qualitativ gute DNA (>1500bp) aus tiefgefrorenem Zotten- und Nabelschnurgewebe sowie DNA aus asservierter Chromosomensuspension der Eltern isoliert. Insgesamt wurden 9 polymorphe Mikrosatellitenmarker von Chromosom 6 getestet (Tab. 51). 4 der 5 informativen Marker zeigten einen biparentalen Vererbungsmodus. Der Marker D6S1003 in der chromosomalen Bande 6q23 dagegen belegte einen Dosiseffekt, eine Aussage zur parentalen Herkunft konnte jedoch nicht getroffen werden (Abb. 47). 110
117 Abbildung 46 Fall V-2309/01: Mikro-FISH- und FISH-Analysen: a) Zwei-Farben-FISH mit WCP 8 (rot) und Subtelomer 8p (D8S504, grün): Das normale Chromosom 8 zeigte durchgehende Markierung für WCP 8 und ein Signal für 8ptel. Das Derivativchromosom 8 dagegen zeigte keine durchgängige Markierung für WCP 8 sowie den Verlust von 8p. b) Reverse Chromosome Painting nach Mikrodissektion des Derivativchromosoms ergab durchgängige Markierung der homologen Chromosomen 8 sowie der distalen langen Arme von Chromosom 6q22->qter; c) FISH mit WCP 8 (grün) und WCP 6 (rot) bestätigt die unbalancierte Translokation 6;8 a) b) c) Tabelle 51 Fall V-2309/01: Mikrosatellitenanalyse belegte Dosiseffekt des trisomen Materials von Chromosom 6. Allele sind in Arbeitseinheiten angegeben. Marker/Lokalisation * Vater Abort Mutter Interpretation D6S477/6p25 b,c a,c a,a 2 Allele; biparental D6S1017/6p21 a,b a,b a,c 2 Allele D6S1056/6q16 a,b a,c b,c 2 Allele; biparental D6S474/6q21 b,c b,c a,b 2 Allele D6S1003/6q23 b,c a,c,c a,d Dosiseffekt * 111
118 a b c D6S1003 Vater Abort Mutter Abbildung 47 Fall V-2309/01: Polyacrylamidgelelektrophorese mit hochpolymorphen Markern: D6S1003 zeigt Dosiseffekt für 6q23. Eine Aussage zur parentalen Herkunft konnte nicht getroffen werden. In diesem Fall konnte eine unbalancierte Chromosomenstörung mit Hilfe der Mikrodissektion näher charakterisiert werden. Die Herkunft des zusätzlichen unbekannten Chromosomenmaterials am Chromosom 8 konnte als 6q-Material mit Bruchpunkt in der Bande q22 identifiziert werden. Die durch FISH belegte terminale Deletion von 8p23 konnte durch Mikrodissektion nicht bestätigt werden, da dieser deletierte Bereich unterhalb der Nachweisgrenze lag. Mikrosatellitenanalyse bestätigte die partielle Trisomie für 6q23. Anhand der informativen Marker für das Chromosom 6 konnte nachgewiesen werden, dass der Bruchpunkt proximal von 6q23 liegen muss. Der Karyotyp lässt sich abschließend wie folgt beschreiben: 46,XY,add(8)(p23).ish t(6;8) (wcp6+, wcp8+, D8S504-). rev ish der(8) t(6;8)(8qter->8p23::6q22->6qter). Die unbalancierte Translokation mit partieller Trisomie 6q und einhergehendem Verlust der Subtelomerregion 8p ist als Ursache für den erlittenen Frühabort anzusehen. 112
Qualität aus ärztlichen Händen. Nicht invasiver Pränataltest (NIPT) Information für werdende Mütter
 Qualität aus ärztlichen Händen Nicht invasiver Pränataltest (NIPT) Information für werdende Mütter Liebe Schwangere, als werdende Mutter befinden Sie sich wahrscheinlich in einer der emotionalsten Phasen
Qualität aus ärztlichen Händen Nicht invasiver Pränataltest (NIPT) Information für werdende Mütter Liebe Schwangere, als werdende Mutter befinden Sie sich wahrscheinlich in einer der emotionalsten Phasen
Methoden der invasiven Pränataldiagnostik. Methoden zur Beurteilung der fetalen Kondition
 Pränataldiagnostik Nicht-invasive invasive Methoden der Pränataldiagnostik Sonographie-Screening (10., 20., 30. SSW) und weiterführende Sonographie Ersttrimesterscreening Methoden der invasiven Pränataldiagnostik
Pränataldiagnostik Nicht-invasive invasive Methoden der Pränataldiagnostik Sonographie-Screening (10., 20., 30. SSW) und weiterführende Sonographie Ersttrimesterscreening Methoden der invasiven Pränataldiagnostik
SS07 Klausur Humangenetik
 Seite 1 von 8 SS07 Klausur Humangenetik 13.07.2007 1. Welche Aussage über strukturelle Chromosomenaberrationen trifft nicht zu? A) Ein Isochromosom ist in der Regel akrozentrisch. B) Unter einer Robertson'schen
Seite 1 von 8 SS07 Klausur Humangenetik 13.07.2007 1. Welche Aussage über strukturelle Chromosomenaberrationen trifft nicht zu? A) Ein Isochromosom ist in der Regel akrozentrisch. B) Unter einer Robertson'schen
PraenaTest. Nicht-invasive Untersuchung auf Trisomien beim ungeborenen Kind. Qualität aus Deutschland JETZT NEU
 JETZT NEU PraenaTest express Ihr Ergebnis in 1 Woche PraenaTest Qualität aus Deutschland Nicht-invasive Untersuchung auf Trisomien beim ungeborenen Kind Information und Aufklärung für Schwangere Liebe
JETZT NEU PraenaTest express Ihr Ergebnis in 1 Woche PraenaTest Qualität aus Deutschland Nicht-invasive Untersuchung auf Trisomien beim ungeborenen Kind Information und Aufklärung für Schwangere Liebe
Klinische Anwendung der Array-CGH (Microarrays, Genchips ) in der Pränataldiagnostik
 Klinische Anwendung der Array-CGH (Microarrays, Genchips ) in der Pränataldiagnostik Maximilian Schmid, Barbara Pertl, Christoph Duba, Michael Speicher Zusammenfassung: In den letzten Jahren haben sich
Klinische Anwendung der Array-CGH (Microarrays, Genchips ) in der Pränataldiagnostik Maximilian Schmid, Barbara Pertl, Christoph Duba, Michael Speicher Zusammenfassung: In den letzten Jahren haben sich
Nicht-invasive molekulargenetische Pränataldiagnostik
 Nicht-invasive molekulargenetische Pränataldiagnostik Dr. rer. medic. Wera Hofmann Medical Director LifeCodexx AG Dr. Wera Hofmann, Medical Director Porto, ECA 2011 July 2, 2011 page 1 2011 LifeCodexx
Nicht-invasive molekulargenetische Pränataldiagnostik Dr. rer. medic. Wera Hofmann Medical Director LifeCodexx AG Dr. Wera Hofmann, Medical Director Porto, ECA 2011 July 2, 2011 page 1 2011 LifeCodexx
Listen Sie auf, welche Verdachtsdiagnosen mit dem First-Trimester-Screening abgeklärt werden können!
 Ersttrimester-Screening Fallbeschreibung 37-jährige Patientin. Sie befindet sich in der 11. Schwangerschaftswoche (SSW) ihrer ersten Schwangerschaft und lässt in ein Ersttrimester-Screening (First-Trimester-Screening)
Ersttrimester-Screening Fallbeschreibung 37-jährige Patientin. Sie befindet sich in der 11. Schwangerschaftswoche (SSW) ihrer ersten Schwangerschaft und lässt in ein Ersttrimester-Screening (First-Trimester-Screening)
ACT/CVS neueste gendiagnostische Verfahren. 20. THÜRINGER ULTRASCHALLTAGUNG für Frauenärzte 09. Bis 10. November Erfurt K. R. Held
 ACT/CVS neueste gendiagnostische Verfahren 20. THÜRINGER ULTRASCHALLTAGUNG für Frauenärzte 09. Bis 10. November Erfurt K. R. Held DNA, Gene, Chromosomen DNA besteht aus den Basenpaaren Adenin - Thymin
ACT/CVS neueste gendiagnostische Verfahren 20. THÜRINGER ULTRASCHALLTAGUNG für Frauenärzte 09. Bis 10. November Erfurt K. R. Held DNA, Gene, Chromosomen DNA besteht aus den Basenpaaren Adenin - Thymin
numerischen Chromosomenstörungen bzw. von Fehlverteilungen der Chromosomen strukturelle Chromosomenstörungen Mosaike
 Sehr geehrte Ärztin, sehr geehrte Arzt, folgenden Text stellen wir Ihnen zur Verfügung, damit Sie ihn als Basisinformation für Ihr Aufklärungsgespräch zum PraenaTest verwenden können. Wir weisen Sie jedoch
Sehr geehrte Ärztin, sehr geehrte Arzt, folgenden Text stellen wir Ihnen zur Verfügung, damit Sie ihn als Basisinformation für Ihr Aufklärungsgespräch zum PraenaTest verwenden können. Wir weisen Sie jedoch
Pränatale Analytik Informationen für die Eltern
 Pränatale Analytik Informationen für die Eltern Liebe Eltern Sie entscheiden. Diese Broschüre vermittelt Ihnen wichtige Informationen zur pränatalen Diagnostik fetaler Trisomien. Die Entscheidung, einen
Pränatale Analytik Informationen für die Eltern Liebe Eltern Sie entscheiden. Diese Broschüre vermittelt Ihnen wichtige Informationen zur pränatalen Diagnostik fetaler Trisomien. Die Entscheidung, einen
Chromosomen & Populationsgenetik (1)
 Übungsblatt Molekularbiologie und Genetik für Studierende der Bioinformatik II 1 Name des Studierenden: Datum: 1 Karyogramme Chromosomen & Populationsgenetik (1) Bestimmen Sie den Karyotyp der folgenden
Übungsblatt Molekularbiologie und Genetik für Studierende der Bioinformatik II 1 Name des Studierenden: Datum: 1 Karyogramme Chromosomen & Populationsgenetik (1) Bestimmen Sie den Karyotyp der folgenden
GENTECHNIKBUCH: 7. KAPITEL GENETISCHE ANALYSEN IM RAHMEN EINER PRÄIMPLANTATIONSDIAGNOSTIK (PID)
 GENTECHNIKBUCH: 7. KAPITEL GENETISCHE ANALYSEN IM RAHMEN EINER PRÄIMPLANTATIONSDIAGNOSTIK (PID) (beschlossen von der Gentechnikkommission am 29. Jänner 2016) I. Einleitung Die Präimplantationsdiagnostik
GENTECHNIKBUCH: 7. KAPITEL GENETISCHE ANALYSEN IM RAHMEN EINER PRÄIMPLANTATIONSDIAGNOSTIK (PID) (beschlossen von der Gentechnikkommission am 29. Jänner 2016) I. Einleitung Die Präimplantationsdiagnostik
Eine menschliche Körperzelle: 46 Chromosomen; 22 Autosomenpaare, 1 Gonosomenpaar
 Eine menschliche Körperzelle: 46 Chromosomen; 22 Autosomenpaare, 1 Gonosomenpaar Chromosomenaberrationen 4Numerische Chromosomenanomalien Trisomie Monosomie Die Überzahl oder Unterzahl von Chromosomen
Eine menschliche Körperzelle: 46 Chromosomen; 22 Autosomenpaare, 1 Gonosomenpaar Chromosomenaberrationen 4Numerische Chromosomenanomalien Trisomie Monosomie Die Überzahl oder Unterzahl von Chromosomen
GRUPPENPUZZLE: Hochdurchsatztechnologien in der Genomanalyse. Erste Lernphase: Aneignungsphase
 Folie GRUPPENPUZZLE: Hochdurchsatztechnologien in der Genomanalyse Erste Lernphase: Aneignungsphase Erarbeiten Sie in Ihrer Expertengruppe die Inhalte eines der vier Textabschnitte (2.1, 2.2, 3.1, 3.2).
Folie GRUPPENPUZZLE: Hochdurchsatztechnologien in der Genomanalyse Erste Lernphase: Aneignungsphase Erarbeiten Sie in Ihrer Expertengruppe die Inhalte eines der vier Textabschnitte (2.1, 2.2, 3.1, 3.2).
Molekulare Grundlagen der Humangenetik
 Molekulare Grundlagen der Humangenetik Aufbau und Funktion des Genoms... Grundlagen... Eukaryontengenom... Variabilität des Genoms... Transkription und Translation der genetischen Information... DNAundRNA...
Molekulare Grundlagen der Humangenetik Aufbau und Funktion des Genoms... Grundlagen... Eukaryontengenom... Variabilität des Genoms... Transkription und Translation der genetischen Information... DNAundRNA...
Pränataldiagnostik Dr. med. Regina Rasenack Universitäts-Frauenklinik Freiburg
 Pränataldiagnostik Dr. med. Regina Rasenack Universitäts-Frauenklinik Freiburg Pränataldiagnostik Definition Untersuchungen zur Erkennung von angeborenen Fehlbildungen und Krankheiten Kleine Fehlbildungen:
Pränataldiagnostik Dr. med. Regina Rasenack Universitäts-Frauenklinik Freiburg Pränataldiagnostik Definition Untersuchungen zur Erkennung von angeborenen Fehlbildungen und Krankheiten Kleine Fehlbildungen:
5 ZUSAMMENFASSUNG Zusammenfassung
 5 ZUSAMMENFASSUNG 56 5 Zusammenfassung Schwangere mit Gestationdiabetes (GDM) haben ein erhöhtes Risiko für die Entwicklung einer fetalen Makrosomie. Die Geburt eines makrosomen Neugeborenen erhöht nicht
5 ZUSAMMENFASSUNG 56 5 Zusammenfassung Schwangere mit Gestationdiabetes (GDM) haben ein erhöhtes Risiko für die Entwicklung einer fetalen Makrosomie. Die Geburt eines makrosomen Neugeborenen erhöht nicht
Präimplantationsdiagnostik aus genetischer Sicht. P. Wieacker Institut für Humangenetik Münster
 Präimplantationsdiagnostik aus genetischer Sicht P. Wieacker Institut für Humangenetik Münster Häufigkeit genetisch bedingter Erkrankungen Geburt Leben Chromosomenstörungen ca. 0,6% ca. 0,6% Monogene Erkrankungen
Präimplantationsdiagnostik aus genetischer Sicht P. Wieacker Institut für Humangenetik Münster Häufigkeit genetisch bedingter Erkrankungen Geburt Leben Chromosomenstörungen ca. 0,6% ca. 0,6% Monogene Erkrankungen
Trisomie 21: Entstehung - Folgen - Lebenserwartung/-standard - Auftretenswahrscheinlichkeit
 Naturwissenschaft Lorenz Wächter Trisomie 21: Entstehung - Folgen - Lebenserwartung/-standard - Auftretenswahrscheinlichkeit Studienarbeit Inhaltsverzeichnis 1. Begriffsbestimmung 1 2. Entstehung...1
Naturwissenschaft Lorenz Wächter Trisomie 21: Entstehung - Folgen - Lebenserwartung/-standard - Auftretenswahrscheinlichkeit Studienarbeit Inhaltsverzeichnis 1. Begriffsbestimmung 1 2. Entstehung...1
Positionen. Fachthema: Reproduktionsmedizin Ethik, Beratung, Recht
 Fachthema: Reproduktionsmedizin Ethik, Beratung, Recht 21. Mai 2005 Grand Hotel am Dom in Erfurt Positionen Bundesregierung Nationaler Ethikrat Bundesärztekammer Bundesverband Reproduktionsmedizinischer
Fachthema: Reproduktionsmedizin Ethik, Beratung, Recht 21. Mai 2005 Grand Hotel am Dom in Erfurt Positionen Bundesregierung Nationaler Ethikrat Bundesärztekammer Bundesverband Reproduktionsmedizinischer
1.-Trimester-Test (1.-TT) Informationen für die Eltern
 1.-Trimester-Test (1.-TT) Informationen für die Eltern Liebe Eltern Sie entscheiden! Dieses Faltblatt wurde geschrieben, um Ihnen wichtige Informationen zum 1.-Trimester-Test (1.-TT) zu vermitteln. Die
1.-Trimester-Test (1.-TT) Informationen für die Eltern Liebe Eltern Sie entscheiden! Dieses Faltblatt wurde geschrieben, um Ihnen wichtige Informationen zum 1.-Trimester-Test (1.-TT) zu vermitteln. Die
2 Chromosomopathien. 2.1 Einleitung. Karl Sperling und Heidemarie Neitzel
 2 Chromosomopathien Karl Sperling und Heidemarie Neitzel Inhaltsverzeichnis 2.1 Einleitung... 43 2.2 Normaler menschlicher Karyotyp... 45 2.2.1 Morphologie der Chromosomen... 45 2.2.2 Differenzielle Darstellung
2 Chromosomopathien Karl Sperling und Heidemarie Neitzel Inhaltsverzeichnis 2.1 Einleitung... 43 2.2 Normaler menschlicher Karyotyp... 45 2.2.1 Morphologie der Chromosomen... 45 2.2.2 Differenzielle Darstellung
genomischen Mutation in bis zu 25 Kilobasen kodierender Sequenz 11445
 05315 Zuschlag zu den Gebührenordnungspositionen 31840, 31841, 36840 und 36841 11501 Zuschlag zu den Gebührenordnungspositionen 11502 und 11503 für die Anwendung eines Kulturverfahrens zur Anzucht von
05315 Zuschlag zu den Gebührenordnungspositionen 31840, 31841, 36840 und 36841 11501 Zuschlag zu den Gebührenordnungspositionen 11502 und 11503 für die Anwendung eines Kulturverfahrens zur Anzucht von
Bei Einbeziehung von neun Allelen in den Vergleich ergibt sich eine Mutation in 38 Generationen (350:9); das entspricht ca. 770 Jahren.
 336 DNA Genealogie Das Muster genetischer Variationen im Erbgut einer Person - zu gleichen Teilen von Mutter und Vater ererbt - definiert seine genetische Identität unveränderlich. Neben seiner Identität
336 DNA Genealogie Das Muster genetischer Variationen im Erbgut einer Person - zu gleichen Teilen von Mutter und Vater ererbt - definiert seine genetische Identität unveränderlich. Neben seiner Identität
Fäden des Lebens. Pränatal-Medizin München. Genetische Beratung. Pränatale Diagnostik Sonographie. Pränatale Diagnostik Invasive Methoden
 Fäden des Lebens 50 Jahre DNA - Doppelhelix Münchner Wissenschaftstage 16. - 20. Juli 2003 Pränatal-Medizin München Genetische Beratung Pränatale Diagnostik Sonographie Pränatale Diagnostik Invasive Methoden
Fäden des Lebens 50 Jahre DNA - Doppelhelix Münchner Wissenschaftstage 16. - 20. Juli 2003 Pränatal-Medizin München Genetische Beratung Pränatale Diagnostik Sonographie Pränatale Diagnostik Invasive Methoden
Labor information. Pränatale Array-CGH (Comparative Genomic Hybridization) Microarray-basierte vergleichende genomische Hybridisierung
 www.bioscientia-humangenetik.de Labor information Pränatale Array-CGH (Comparative Genomic Hybridization) Microarray-basierte vergleichende genomische Hybridisierung Die Array-CGH-Analyse (kurz: Array-CGH)
www.bioscientia-humangenetik.de Labor information Pränatale Array-CGH (Comparative Genomic Hybridization) Microarray-basierte vergleichende genomische Hybridisierung Die Array-CGH-Analyse (kurz: Array-CGH)
Wiederholte Fehlgeburt (WSA) Prof. Dr. med. Georg-Friedrich von Tempelhoff FCATH Frauenklinikum St. Vinzenz Krankenhaus Hanau
 Wiederholte Fehlgeburt (WSA) Prof. Dr. med. Georg-Friedrich von Tempelhoff FCATH Frauenklinikum St. Vinzenz Krankenhaus Hanau Definition der Fehlgeburt (Abort) nach WHO (Welt Gesundheits Organisation)!
Wiederholte Fehlgeburt (WSA) Prof. Dr. med. Georg-Friedrich von Tempelhoff FCATH Frauenklinikum St. Vinzenz Krankenhaus Hanau Definition der Fehlgeburt (Abort) nach WHO (Welt Gesundheits Organisation)!
Die Chromosomen sind im Zellkern immer paarweise vorhanden. In der menschlichen Zelle befinden sich 23 Chromosomenpaare. Diese bilden den diploiden
 Die Chromosomen Die Chromosomen sind Träger der Erbinformation. Unter dem Mikroskop erscheinen sie in verschiedenen Formen. Einmal als gekrümmte oder gedrungene Stäbchen, in deren Mitte sich eine Ein-schnürung
Die Chromosomen Die Chromosomen sind Träger der Erbinformation. Unter dem Mikroskop erscheinen sie in verschiedenen Formen. Einmal als gekrümmte oder gedrungene Stäbchen, in deren Mitte sich eine Ein-schnürung
Kapitel 19 Pränataldiagnostik bei Fanconi-Anämie
 183 Kapitel 19 Pränataldiagnostik bei Fanconi-Anämie Prof. Dr. rer. nat. Susan Olson Oregon Health Sciences University, Portland OR, USA Pränatale Diagnose Mit Hilfe der pränatalen Diagnose kann man feststellen,
183 Kapitel 19 Pränataldiagnostik bei Fanconi-Anämie Prof. Dr. rer. nat. Susan Olson Oregon Health Sciences University, Portland OR, USA Pränatale Diagnose Mit Hilfe der pränatalen Diagnose kann man feststellen,
Pränatale Diagnostik der Chromosomen
 Pränatale Diagnostik der Chromosomen Einleitung Die kontinuierliche Weiterentwicklung der vorgeburtlichen (pränatalen) Untersuchungsmethoden ermöglicht heute verschiedene Ansätze in der pränatalen Diagnostik.
Pränatale Diagnostik der Chromosomen Einleitung Die kontinuierliche Weiterentwicklung der vorgeburtlichen (pränatalen) Untersuchungsmethoden ermöglicht heute verschiedene Ansätze in der pränatalen Diagnostik.
ANDROLOGY LETTER. Empfehlungen zur genetischen Diagnostik beim Mann in Fällen von habituellen Aborten
 ANDROLOGY LETTER Empfehlungen zur genetischen Diagnostik beim Mann in Fällen von habituellen Aborten Wichtig zu wissen 1. Bestimmung des DNA Fragmentations Index von Einzelstrang wie Doppelstrangbrüchen
ANDROLOGY LETTER Empfehlungen zur genetischen Diagnostik beim Mann in Fällen von habituellen Aborten Wichtig zu wissen 1. Bestimmung des DNA Fragmentations Index von Einzelstrang wie Doppelstrangbrüchen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus:
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die klassische Genetik: T.H. Morgan und seine Experimente mit Drosophila melanogaster Das komplette Material finden Sie hier: Download
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Die klassische Genetik: T.H. Morgan und seine Experimente mit Drosophila melanogaster Das komplette Material finden Sie hier: Download
Gendiagnose. Als nächstes möchte ich einige Verfahren von Gentests nennen und erläutern.
 Gendiagnose Gentest Der Gentest ist ein molekularbiologisches Verfahren. Bei diesem wird die DNA untersucht, um Rückschlüsse auf genetische Aspekte zu erhalten. Gentests haben vielfältige Anwendungsmöglichkeiten,
Gendiagnose Gentest Der Gentest ist ein molekularbiologisches Verfahren. Bei diesem wird die DNA untersucht, um Rückschlüsse auf genetische Aspekte zu erhalten. Gentests haben vielfältige Anwendungsmöglichkeiten,
Kapitel 13 Bestimmung von klonalen Chromosomenveränderungen im Knochenmark von Fanconi-Anämie-Patienten
 131 Kapitel 13 Bestimmung von klonalen Chromosomenveränderungen im Knochenmark von Fanconi-Anämie-Patienten Prof. Dr. rer. nat. Heidemarie Neitzel Dr. rer. nat. Holger Tönnies Institut für Humangenetik,
131 Kapitel 13 Bestimmung von klonalen Chromosomenveränderungen im Knochenmark von Fanconi-Anämie-Patienten Prof. Dr. rer. nat. Heidemarie Neitzel Dr. rer. nat. Holger Tönnies Institut für Humangenetik,
Karyotypanalysen durch Chromosomen-Färbungen an HeLa-Zelllinien
 Karyotypanalysen durch Chromosomen-Färbungen an HeLa-Zelllinien Sonja Prohaska 9808503 A441 sonja@bioinf.uni-leipzig.de 1 Einleitung HeLa-Zellen sind Zervixkarzinom-Zellen, die ihre begrenzte Teilbarkeit,
Karyotypanalysen durch Chromosomen-Färbungen an HeLa-Zelllinien Sonja Prohaska 9808503 A441 sonja@bioinf.uni-leipzig.de 1 Einleitung HeLa-Zellen sind Zervixkarzinom-Zellen, die ihre begrenzte Teilbarkeit,
Genisolierung in 2 Stunden : Die Polymerase-Ketten-Reaktion (PCR)
 PCR Genisolierung in 2 Stunden : Die Polymerase-Ketten-Reaktion (PCR) von Kary B. Mullis entwickelt (1985) eigentlich im Mai 1983 bei einer nächtlichen Autofahrt erstes erfolgreiches Experiment am 16.12.1983
PCR Genisolierung in 2 Stunden : Die Polymerase-Ketten-Reaktion (PCR) von Kary B. Mullis entwickelt (1985) eigentlich im Mai 1983 bei einer nächtlichen Autofahrt erstes erfolgreiches Experiment am 16.12.1983
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main
 Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Blutspendedienst des Deutschen Roten Kreuzes Institut für Transfusionsmedizin und Immunhämatologie Direktor: Professor
Aus dem Fachbereich Medizin der Johann Wolfgang Goethe-Universität Frankfurt am Main Blutspendedienst des Deutschen Roten Kreuzes Institut für Transfusionsmedizin und Immunhämatologie Direktor: Professor
Zytogenetische Diagnostik. Chromosomenanalyse und Array-CGH
 Zytogenetische Diagnostik Chromosomenanalyse und Array-CGH Einleitung Chromosomen sind die Träger der Erbanlagen (Gene). Sie befinden sich im Kern einer jeden Körperzelle. Jeder Mensch hat 46 Chromosomen,
Zytogenetische Diagnostik Chromosomenanalyse und Array-CGH Einleitung Chromosomen sind die Träger der Erbanlagen (Gene). Sie befinden sich im Kern einer jeden Körperzelle. Jeder Mensch hat 46 Chromosomen,
Labortechniken (2) Amplifikationskurve (linear linear) Realtime-PCR
 Realtime PCR Quantitative PCR Prinzip: Nachweis der PCR-Produkte in Echtzeit und Quantifizierung anhand eines fluoreszenten Reporters R Q Taq-Polymerase Synthese- und Nuklease-Einheit R=Reporter, Q=Quencher
Realtime PCR Quantitative PCR Prinzip: Nachweis der PCR-Produkte in Echtzeit und Quantifizierung anhand eines fluoreszenten Reporters R Q Taq-Polymerase Synthese- und Nuklease-Einheit R=Reporter, Q=Quencher
UNSER RATGEBER FÜR DIE SCHWANGER- SCHAFT
 UNSER RATGEBER FÜR DIE SCHWANGER- SCHAFT INHALT SCHWANGERSCHAFTS-VORSORGE-UNTERSUCHUNGEN DER GESETZLICHEN KRANKENKASSE... 2 ULTRASCHALL-UNTERSUCHUNGEN IN DER SCHWANGERSCHAFT... 4 ÜBERSICHT ÜBER DIE ZUSÄTZLICHEN
UNSER RATGEBER FÜR DIE SCHWANGER- SCHAFT INHALT SCHWANGERSCHAFTS-VORSORGE-UNTERSUCHUNGEN DER GESETZLICHEN KRANKENKASSE... 2 ULTRASCHALL-UNTERSUCHUNGEN IN DER SCHWANGERSCHAFT... 4 ÜBERSICHT ÜBER DIE ZUSÄTZLICHEN
Doppelmarkierung im CISH Her2 und Topo2A
 Doppelmarkierung im CISH Her2 und Topo2A Sonja Urdl und Sigurd Lax Institut für Pathologie LKH Graz West sonja.urdl@lkh-grazwest.at; sigurd.lax@lkh-grazwest.at In Situ Hybridisierung (ISH) Molekularbiologische
Doppelmarkierung im CISH Her2 und Topo2A Sonja Urdl und Sigurd Lax Institut für Pathologie LKH Graz West sonja.urdl@lkh-grazwest.at; sigurd.lax@lkh-grazwest.at In Situ Hybridisierung (ISH) Molekularbiologische
Sehr geehrte Schwangere, sehr geehrte werdenden Eltern,
 Dr. med. Matthias ALBIG Dr. med. Ute KNOLL Prof. Dr. med. Rolf BECKER Fachärztin für Kinderheilkunde Medizinische Genetik PD Dr. med. Michael ENTEZAMI Dr. med Joachim Bürger PD. Dr. med. Ilka FUCHS Facharzt
Dr. med. Matthias ALBIG Dr. med. Ute KNOLL Prof. Dr. med. Rolf BECKER Fachärztin für Kinderheilkunde Medizinische Genetik PD Dr. med. Michael ENTEZAMI Dr. med Joachim Bürger PD. Dr. med. Ilka FUCHS Facharzt
prenatal Nicht invasiver pränataler Test
 prenatal Nicht invasiver pränataler Test 1 Sie sind schwanger. Herzlichen Glückwunsch! 2 Liebe zukünftige Eltern, wahrscheinlich ist alles gerade sehr aufregend für Sie, und es ist nur natürlich, dass
prenatal Nicht invasiver pränataler Test 1 Sie sind schwanger. Herzlichen Glückwunsch! 2 Liebe zukünftige Eltern, wahrscheinlich ist alles gerade sehr aufregend für Sie, und es ist nur natürlich, dass
Aufklärung. Ersttrimester-Ultraschall (Nackendickemessung)
 Gemeinschaftspraxis FERA Pränataldiagnostik Aufklärung Ersttrimester-Ultraschall (Nackendickemessung) Sehr geehrte Schwangere, Sie stellen sich heute in unserer Praxis vor, um eine Ultraschalluntersuchung
Gemeinschaftspraxis FERA Pränataldiagnostik Aufklärung Ersttrimester-Ultraschall (Nackendickemessung) Sehr geehrte Schwangere, Sie stellen sich heute in unserer Praxis vor, um eine Ultraschalluntersuchung
Zeitaufgelöste Fluoreszenzmessung zur Verwendung bei der Realtime-PCR
 Zeitaufgelöste Fluoreszenzmessung zur Verwendung bei der Realtime-PCR Nils Scharke, inano Abstract Die Verwendung neuartiger Seltenerd-Komplexe in Verbindung mit zeitaufgelöster Fluoreszenzmessung liefert
Zeitaufgelöste Fluoreszenzmessung zur Verwendung bei der Realtime-PCR Nils Scharke, inano Abstract Die Verwendung neuartiger Seltenerd-Komplexe in Verbindung mit zeitaufgelöster Fluoreszenzmessung liefert
Alcaiseda, 22.5.2015
 Alcaiseda, 22.5.2015 Nicht-invasive Diagnostik Ersttrimester Screening (Ultraschall + Biochemie) Cell-Free Fetal DNA im mütterlichen Blut (NIPT) PRC Risk Calculation-Programm der FMF Deutschland mit einem
Alcaiseda, 22.5.2015 Nicht-invasive Diagnostik Ersttrimester Screening (Ultraschall + Biochemie) Cell-Free Fetal DNA im mütterlichen Blut (NIPT) PRC Risk Calculation-Programm der FMF Deutschland mit einem
Fehlgeburten. Erkennen, was fehlt und was hilft. Wenn Ihre Schwangerschaften zu früh zu Ende gehen
 Fehlgeburten Erkennen, was fehlt und was hilft Wenn Ihre Schwangerschaften zu früh zu Ende gehen Die größte Sorge: Kann mir das noch einmal passieren? Fehlgeburt: Was bedeutet das für Sie? Fehlgeburt oder
Fehlgeburten Erkennen, was fehlt und was hilft Wenn Ihre Schwangerschaften zu früh zu Ende gehen Die größte Sorge: Kann mir das noch einmal passieren? Fehlgeburt: Was bedeutet das für Sie? Fehlgeburt oder
Entwicklungsstörung. Abklären, erkennen, vorsorgen. Informationen für Eltern mit einem Sorgenkind
 Entwicklungsstörung Abklären, erkennen, vorsorgen Informationen für Eltern mit einem Sorgenkind Entwicklungsstörungen haben oft genetische Ursachen Was sind genetisch bedingte Störungen und Erkrankungen?
Entwicklungsstörung Abklären, erkennen, vorsorgen Informationen für Eltern mit einem Sorgenkind Entwicklungsstörungen haben oft genetische Ursachen Was sind genetisch bedingte Störungen und Erkrankungen?
Medizinethische Fragen am Lebensanfang
 Medizinethische Fragen am Lebensanfang Dr. med. Gisbert Voigt Kinder- und Jugendarzt / Kinderpneumologe Stellv. Vorsitzender PID Kommission Nord Symposium zur Medizinethik 23.09.2015 23. September 2015
Medizinethische Fragen am Lebensanfang Dr. med. Gisbert Voigt Kinder- und Jugendarzt / Kinderpneumologe Stellv. Vorsitzender PID Kommission Nord Symposium zur Medizinethik 23.09.2015 23. September 2015
"Chromosomen Didac 2" Einzelsatz Best.- Nr / Paket von 6 Sätzen
 "Chromosomen Didac 2" Einzelsatz Best.- Nr. 2013336 / 2013337 Paket von 6 Sätzen Zusammensetzung Der Einzelsatz besteht aus: 2 blauen Sätzen mit 3 Chromosomen + 1 Geschlechtschromosom + 1 Stück von einem
"Chromosomen Didac 2" Einzelsatz Best.- Nr. 2013336 / 2013337 Paket von 6 Sätzen Zusammensetzung Der Einzelsatz besteht aus: 2 blauen Sätzen mit 3 Chromosomen + 1 Geschlechtschromosom + 1 Stück von einem
4. ERGEBNISSE. 4.2. Untersuchung des umgelagerten IgH Gens in Hodgkinzelllinien
 36 4. ERGEBNISSE 4.1. Immunglobulin Gentranskripte in Hodgkinzelllinien Mit Hilfe der RT PCR untersuchten wir die Expression umgelagerter Ig Gene in den Hodgkinzelllinien L1236, L428, L591 und KM-H2 sowie
36 4. ERGEBNISSE 4.1. Immunglobulin Gentranskripte in Hodgkinzelllinien Mit Hilfe der RT PCR untersuchten wir die Expression umgelagerter Ig Gene in den Hodgkinzelllinien L1236, L428, L591 und KM-H2 sowie
SCRIPTUM HIGH PRECISE
 Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
ERFOLGSRATE BEI DEN IVF- BEHANDLUNGEN IM JAHRE 2014
 Wir möchten Ihnen gern unsere Ergebnisse der IVF-Zyklen im Jahre 2014 vorlegen. - 1 - Da es immer Spekulationen auftauchen, wie die Ergebnisse gerechnet werden und ob sie objektiv und wahr sind, möchten
Wir möchten Ihnen gern unsere Ergebnisse der IVF-Zyklen im Jahre 2014 vorlegen. - 1 - Da es immer Spekulationen auftauchen, wie die Ergebnisse gerechnet werden und ob sie objektiv und wahr sind, möchten
In situ Hybridisierung
 In situ Hybridisierung eine Methode zum direkten und spezifischen Nachweis von Nukleinsäuren (DNA und RNA) in Gewebe, Zellen, Zellkompartimenten und Chromosomen Was kann damit erreicht werden? direkte
In situ Hybridisierung eine Methode zum direkten und spezifischen Nachweis von Nukleinsäuren (DNA und RNA) in Gewebe, Zellen, Zellkompartimenten und Chromosomen Was kann damit erreicht werden? direkte
?? Klausur Humangenetik, Gruppe B
 Seite 1 von 8?? Klausur Humangenetik, Gruppe B 1) Welche der folgenden Aussagen sind richtig? 1. An einer zentrischen Fusion sind zwei Chromosomen beteiligt 2. An einer reziproken Translokation sind zwei
Seite 1 von 8?? Klausur Humangenetik, Gruppe B 1) Welche der folgenden Aussagen sind richtig? 1. An einer zentrischen Fusion sind zwei Chromosomen beteiligt 2. An einer reziproken Translokation sind zwei
Leitlinien und Stellungnahmen
 Leitlinien und Stellungnahmen medgen 2010 22:20 25 DOI 10.1007/s11825-010-0210-7 Online publiziert: 5. Februar 2010 Springer Verlag 2010 Deutsche Gesellschaft für Humangenetik e.v. (GfH) Berufsverband
Leitlinien und Stellungnahmen medgen 2010 22:20 25 DOI 10.1007/s11825-010-0210-7 Online publiziert: 5. Februar 2010 Springer Verlag 2010 Deutsche Gesellschaft für Humangenetik e.v. (GfH) Berufsverband
5 Zusammenfassung und Schlussfolgerung
 5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
5 Zusammenfassung und Schlussfolgerung Einleitung In der Schwangerschaft vollziehen sich Veränderungen des Kohlenhydratstoffwechsels im Sinne einer Insulinresistenz sowie eines Anstieges der Blutfettwerte.
Nicht invasive Pränataldiagnostik. Alle Argumente sprechen für Prendia
 Nicht invasive Pränataldiagnostik Alle Argumente sprechen für Prendia Nicht invasive Pränataldiagnostik Grundwissen Pränataldiagnostik 4 Grafik Pränataldiagnostiken 6 Die Produktefamilie 9 Robustheit von
Nicht invasive Pränataldiagnostik Alle Argumente sprechen für Prendia Nicht invasive Pränataldiagnostik Grundwissen Pränataldiagnostik 4 Grafik Pränataldiagnostiken 6 Die Produktefamilie 9 Robustheit von
SYMPOSIUM INSTAND GENETIK 2013 Freitag 25. Oktober 2013. Zytogenetische Ringversuche entsprechend RiliBäk B-5-2
 Zytogenetische Ringversuche entsprechend RiliBäk B-5-2 Prof. Dr. Jürgen Kunz Berufsverband Deutscher Humangenetiker e.v. Linienstrasse 127 10115 Berlin Zytogenetische Diagnostik: Indikationen und Ausgangsmaterial
Zytogenetische Ringversuche entsprechend RiliBäk B-5-2 Prof. Dr. Jürgen Kunz Berufsverband Deutscher Humangenetiker e.v. Linienstrasse 127 10115 Berlin Zytogenetische Diagnostik: Indikationen und Ausgangsmaterial
DNA-Fingerprint. (Syn. DNA Profiling)
 DNA-Fingerprint (Syn. DNA Profiling) Dient dazu Individuen genetisch zu unterscheiden Dazu braucht man genetischen Polymorphismus (Bsp. Blutgruppen-Polymorphismus/Landsteiner). Als Polymorphismus ( Vielgestaltigkeit
DNA-Fingerprint (Syn. DNA Profiling) Dient dazu Individuen genetisch zu unterscheiden Dazu braucht man genetischen Polymorphismus (Bsp. Blutgruppen-Polymorphismus/Landsteiner). Als Polymorphismus ( Vielgestaltigkeit
HABITUELLER ABORT. Wie Abklären? Wie Therapieren? Bruno Imthurn. Klinik für Reproduktions-Endokrinologie UniversitätsSpital Zürich STS 560
 HABITUELLER ABORT Wie Abklären? Wie Therapieren? Bruno Imthurn Klinik für Reproduktions-Endokrinologie UniversitätsSpital Zürich STS 560 DEFINITION Habitueller Abort: 2 aufeinanderfolgende Aborte klinischer
HABITUELLER ABORT Wie Abklären? Wie Therapieren? Bruno Imthurn Klinik für Reproduktions-Endokrinologie UniversitätsSpital Zürich STS 560 DEFINITION Habitueller Abort: 2 aufeinanderfolgende Aborte klinischer
Etablierung, Validierung und praktische Anwendung einer multiplex real-time RT-PCR zum Nachweis des Rabbit Haemorrhagic Disease Virus
 Aus dem Institut für Virologie der Tierärztlichen Hochschule Hannover und dem Institut für Virusdiagnostik des Friedrich-Loeffler-Instituts, Insel Riems Etablierung, Validierung und praktische Anwendung
Aus dem Institut für Virologie der Tierärztlichen Hochschule Hannover und dem Institut für Virusdiagnostik des Friedrich-Loeffler-Instituts, Insel Riems Etablierung, Validierung und praktische Anwendung
Aneuploidiediagnostik an Polkörpern nach ICSI bei 460 Frauen mit multiplen Fehlgeburten, Implantationsversagen oder erhöhtem mütterlichem Alter
 Aneuploidiediagnostik an Polkörpern nach ICSI bei 460 Frauen mit multiplen Fehlgeburten, Implantationsversagen oder erhöhtem mütterlichem Alter Bärbel Grossmann 1, Eva Schwaab 2, Omar Khanaga 3, Thomas
Aneuploidiediagnostik an Polkörpern nach ICSI bei 460 Frauen mit multiplen Fehlgeburten, Implantationsversagen oder erhöhtem mütterlichem Alter Bärbel Grossmann 1, Eva Schwaab 2, Omar Khanaga 3, Thomas
Werte für Menschen, Tiere und Umwelt. Dermatophyten-PCR. synlab.vet Fachinformation
 Werte für Menschen, Tiere und Umwelt Dermatophyten-PCR synlab.vet Fachinformation Dermatophyten-PCR Ergebnisse einer vergleichenden Studie von kultureller mykologischer Untersuchung und PCR-Untersuchung.
Werte für Menschen, Tiere und Umwelt Dermatophyten-PCR synlab.vet Fachinformation Dermatophyten-PCR Ergebnisse einer vergleichenden Studie von kultureller mykologischer Untersuchung und PCR-Untersuchung.
Inhalt. 2 Chromosomen des Menschen 14. Vorwort. Mitarbeiterverzeichnis
 Inhalt Vorwort Mitarbeiterverzeichnis V VI 1 Biochemische Grundlagen der Humangenetik l 1.1 Molekularbiologie...? 1 1.2 Molekularbiologische Veränderungen als Grundlage menschlicher Erbleiden 4 1.3 Folgen
Inhalt Vorwort Mitarbeiterverzeichnis V VI 1 Biochemische Grundlagen der Humangenetik l 1.1 Molekularbiologie...? 1 1.2 Molekularbiologische Veränderungen als Grundlage menschlicher Erbleiden 4 1.3 Folgen
Zusätzliche Behandlungs möglichkeiten für Ihre Patienten
 Zusätzliche Behandlungs möglichkeiten für Ihre Patienten Über FoundationOne Bei dem validierten umfassenden Tumorprofil von FoundationOne wird die gesamte codierende Sequenz von 315 krebsassoziierten Genen
Zusätzliche Behandlungs möglichkeiten für Ihre Patienten Über FoundationOne Bei dem validierten umfassenden Tumorprofil von FoundationOne wird die gesamte codierende Sequenz von 315 krebsassoziierten Genen
Nicht invasive Pränataldiagnostik. Alle Argumente sprechen für Prendia
 Nicht invasive Pränataldiagnostik Alle Argumente sprechen für Prendia Nicht invasive Pränataldiagnostik Grundwissen Pränataldiagnostik 4 Grafik Pränataldiagnostiken 6 Die Produktefamilie 9 Robustheit von
Nicht invasive Pränataldiagnostik Alle Argumente sprechen für Prendia Nicht invasive Pränataldiagnostik Grundwissen Pränataldiagnostik 4 Grafik Pränataldiagnostiken 6 Die Produktefamilie 9 Robustheit von
1. Mendelsche Vererbung, Stammbäume:
 1. Mendelsche Vererbung, Stammbäume: typische Stammbäume atypische Stammbäume 2. Allelische und nicht-allelische Mutationen, Komplementationstests 3. Hardy-Weinberg Gleichgewicht 4. Mutation und Selektion,
1. Mendelsche Vererbung, Stammbäume: typische Stammbäume atypische Stammbäume 2. Allelische und nicht-allelische Mutationen, Komplementationstests 3. Hardy-Weinberg Gleichgewicht 4. Mutation und Selektion,
2. Übung: Chromosomentheorie
 Konzepte: 2. Übung: Chromosomentheorie Mitose/Meiose Geschlechtschromosomale Vererbung Chromosomentheorie Regeln zur Vererbung Autosomal rezessiv: - Merkmal tritt auf in Nachkommen nicht betroffener Eltern
Konzepte: 2. Übung: Chromosomentheorie Mitose/Meiose Geschlechtschromosomale Vererbung Chromosomentheorie Regeln zur Vererbung Autosomal rezessiv: - Merkmal tritt auf in Nachkommen nicht betroffener Eltern
Molekulargenetische und biochemische Untersuchungen zur Pathogenese der Spinalen Muskelatrophie mit Atemnot Typ 1 (SMARD1)
 Molekulargenetische und biochemische Untersuchungen zur Pathogenese der Spinalen Muskelatrophie mit Atemnot Typ 1 (SMARD1) Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften
Molekulargenetische und biochemische Untersuchungen zur Pathogenese der Spinalen Muskelatrophie mit Atemnot Typ 1 (SMARD1) Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften
Psychosoziale Beratung im Kontext von pränataler Diagnostik
 Geisteswissenschaft Sandra Mette Psychosoziale Beratung im Kontext von pränataler Diagnostik Rolle und Aufgabe der Sozialen Arbeit Bachelorarbeit Bibliografische Information der Deutschen Nationalbibliothek:
Geisteswissenschaft Sandra Mette Psychosoziale Beratung im Kontext von pränataler Diagnostik Rolle und Aufgabe der Sozialen Arbeit Bachelorarbeit Bibliografische Information der Deutschen Nationalbibliothek:
Projektskizze: Studie/ Auswertung/ Publikation
 Projektskizze: Studie/ Auswertung/ Publikation Name: PD Dr. Dr. Robert Bals, CAPNetz C11 Datum: 30. 8. 2007 Institution(en)/Autor(en): Klinikum der Universität Marburg Klinik für Innere Medizin mit Schwerpunkt
Projektskizze: Studie/ Auswertung/ Publikation Name: PD Dr. Dr. Robert Bals, CAPNetz C11 Datum: 30. 8. 2007 Institution(en)/Autor(en): Klinikum der Universität Marburg Klinik für Innere Medizin mit Schwerpunkt
Untersuchungen zur differenziellen Genexpression im ZNS von Noradrenalintransporter-Knockout- und Wildtyp-Mäusen
 Untersuchungen zur differenziellen Genexpression im ZNS von Noradrenalintransporter-Knockout- und Wildtyp-Mäusen Inaugural-Dissertation zur Erlangung des Doktorgrades (Dr. rer. nat.) der Mathematisch-Naturwissenschaftlichen
Untersuchungen zur differenziellen Genexpression im ZNS von Noradrenalintransporter-Knockout- und Wildtyp-Mäusen Inaugural-Dissertation zur Erlangung des Doktorgrades (Dr. rer. nat.) der Mathematisch-Naturwissenschaftlichen
Humangenetik 3. 1 Sexuelle Fortpflanzung
 Humangenetik 3. 1 Sexuelle Fortpflanzung Lehrplaneinheit Keimzellenbildung und Befruchtung 1 3. Genetik Hinweise Bedeutung der Meiose ohne Betrachtung der einzelnen Phasen Bedeutung der Meiose (Reduktion
Humangenetik 3. 1 Sexuelle Fortpflanzung Lehrplaneinheit Keimzellenbildung und Befruchtung 1 3. Genetik Hinweise Bedeutung der Meiose ohne Betrachtung der einzelnen Phasen Bedeutung der Meiose (Reduktion
Universitäts-Frauenklinik Essen. Chorionzottenbiopsie und Amniozentese
 Universitäts-Frauenklinik Essen Chorionzottenbiopsie und Amniozentese Chorionzottenbiospie (Untersuchung von Gewebe des Mutterkuchens) und Amniozentese (Fruchtwasseruntersuchung) Antworten auf Ihre Fragen
Universitäts-Frauenklinik Essen Chorionzottenbiopsie und Amniozentese Chorionzottenbiospie (Untersuchung von Gewebe des Mutterkuchens) und Amniozentese (Fruchtwasseruntersuchung) Antworten auf Ihre Fragen
Entwicklungsstörungen und Intelligenzdefekte im Licht neuer gendiagnostischer Verfahren
 Institut für Medizinische Genetik Entwicklungsstörungen und Intelligenzdefekte im Licht neuer gendiagnostischer Verfahren Prof. Dr. med. Anita Rauch Seite 1 Häufigkeit von Intelligenzminderung (ID) IQ
Institut für Medizinische Genetik Entwicklungsstörungen und Intelligenzdefekte im Licht neuer gendiagnostischer Verfahren Prof. Dr. med. Anita Rauch Seite 1 Häufigkeit von Intelligenzminderung (ID) IQ
In memoriam Lisa. und aller Kinder, die nur viel zu kurz das Licht dieser Welt erblicken durften. Matthias Bloechle
 In memoriam Lisa und aller Kinder, die nur viel zu kurz das Licht dieser Welt erblicken durften Matthias Bloechle 1 Mit Gentest zum Wunschkind? Prof. Dr. rer. nat. Wolfgang Schumann Institut für Genetik
In memoriam Lisa und aller Kinder, die nur viel zu kurz das Licht dieser Welt erblicken durften Matthias Bloechle 1 Mit Gentest zum Wunschkind? Prof. Dr. rer. nat. Wolfgang Schumann Institut für Genetik
Non-Invasive Prenatal Testing (NIPT)
 Non-Invasive Prenatal Testing (NIPT) Methode & klinische Anwendung Information für Fachkreise Qualität aus Deutschland Non-Invasive Prenatal Testing (NIPT) Die Untersuchungsmethode des PraenaTest basiert
Non-Invasive Prenatal Testing (NIPT) Methode & klinische Anwendung Information für Fachkreise Qualität aus Deutschland Non-Invasive Prenatal Testing (NIPT) Die Untersuchungsmethode des PraenaTest basiert
HUMANGENETIK. Herausgegeben von Jan Murken und Hartwig Cleve. 5., neu bearbeitete Auflage 206 Einzeldarstellungen, 56 Tabellen
 HUMANGENETIK Herausgegeben von Jan Murken und Hartwig Cleve 5., neu bearbeitete Auflage 206 Einzeldarstellungen, 56 Tabellen Ferdinand Enke Verlag Stuttgart 1994 Inhalt 1 Molekulare Grundlagen der Humangenetik
HUMANGENETIK Herausgegeben von Jan Murken und Hartwig Cleve 5., neu bearbeitete Auflage 206 Einzeldarstellungen, 56 Tabellen Ferdinand Enke Verlag Stuttgart 1994 Inhalt 1 Molekulare Grundlagen der Humangenetik
Klonierung von Säugern durch Zellkerntransfer
 Klonierung von Säugern durch Zellkerntransfer Gentechnik und Genomics WiSe 2007/2008 Kristian M. Müller Institut für Biologie III Albert-Ludwigs-Universität Freiburg Können differenzierte Zellen einen
Klonierung von Säugern durch Zellkerntransfer Gentechnik und Genomics WiSe 2007/2008 Kristian M. Müller Institut für Biologie III Albert-Ludwigs-Universität Freiburg Können differenzierte Zellen einen
Das Cri-du-Chat-Syndrom Medizinische, psycho-soziale und pädagogische Aspekte
 Das Cri-du-Chat-Syndrom Medizinische, psycho-soziale und pädagogische Aspekte Stephan Berger Nachdruck einer wissenschaftlichen Hausarbeit zur ersten Staatsprüfung für das Lehramt an Sonderschulen von
Das Cri-du-Chat-Syndrom Medizinische, psycho-soziale und pädagogische Aspekte Stephan Berger Nachdruck einer wissenschaftlichen Hausarbeit zur ersten Staatsprüfung für das Lehramt an Sonderschulen von
Mutationen. Chromosomenmutation. Deletion. Genommutation Trisomie 22. Punktmutation Genmutation
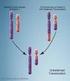 Mutationen Chromosomenmutation Deletion Genommutation Trisomie 22 5...G A T C T T G A T A...3 3...C T A A A A C T A T...5 Punktmutation Genmutation Lernziele Kernpunkte zur Prüfung Lernziele/Kernpunkte:
Mutationen Chromosomenmutation Deletion Genommutation Trisomie 22 5...G A T C T T G A T A...3 3...C T A A A A C T A T...5 Punktmutation Genmutation Lernziele Kernpunkte zur Prüfung Lernziele/Kernpunkte:
Begleittext zum Foliensatz Erbgänge beim Menschen
 Für ein besseres Verständnis der Folien werden vorab einige Begriffe definiert: Gen Genom Allel Ein Gen ist die physikalische und funktionelle Einheit der Vererbung. Biochemisch ist es eine geordnete Abfolge
Für ein besseres Verständnis der Folien werden vorab einige Begriffe definiert: Gen Genom Allel Ein Gen ist die physikalische und funktionelle Einheit der Vererbung. Biochemisch ist es eine geordnete Abfolge
Inhaltsverzeichnis. Abbildungsverzeichnis. Tabellenverzeichnis. Abkürzungsverzeichnis
 Inhaltsverzeichnis Abbildungsverzeichnis Tabellenverzeichnis Abkürzungsverzeichnis vi viii ix 1. Einleitung 3 1.1. Phage Display................................ 4 1.1.1. Phage-Display-Bibliothekenformate................
Inhaltsverzeichnis Abbildungsverzeichnis Tabellenverzeichnis Abkürzungsverzeichnis vi viii ix 1. Einleitung 3 1.1. Phage Display................................ 4 1.1.1. Phage-Display-Bibliothekenformate................
Seminar 2016. Schwere IUWR Sonographische Befunde Management Genetische Diagnostik. 11. Mai 2016. Seminarraum. Pränatal-Medizin München
 Seminar 2016 Schwere IUWR Sonographische Befunde Management Genetische Diagnostik 11. Mai 2016 Seminarraum Seminar 2016 Schwere IUWR Sonographische Befunde Management Genetische Diagnostik I am small,
Seminar 2016 Schwere IUWR Sonographische Befunde Management Genetische Diagnostik 11. Mai 2016 Seminarraum Seminar 2016 Schwere IUWR Sonographische Befunde Management Genetische Diagnostik I am small,
Die Messung der kindlichen Nackenfalte Der neue Standard in der vorgeburtlichen Risikoberechnung
 Die Messung der kindlichen Nackenfalte Der neue Standard in der vorgeburtlichen Risikoberechnung Einleitung Jede werdende Mutter hat ein gewisses Risiko, ein Kind mit einer Chromosomenstörung zu bekommen.
Die Messung der kindlichen Nackenfalte Der neue Standard in der vorgeburtlichen Risikoberechnung Einleitung Jede werdende Mutter hat ein gewisses Risiko, ein Kind mit einer Chromosomenstörung zu bekommen.
ethische Probleme im Kontext der Humangenetik
 ethische Probleme im Kontext der Humangenetik ethische Probleme im Kontext der Humangenetik / Lernziele molekulargenetische Diagnostik pränatale Diagnostik / Interruptio Elternalter Human-Genetik A C Genetik
ethische Probleme im Kontext der Humangenetik ethische Probleme im Kontext der Humangenetik / Lernziele molekulargenetische Diagnostik pränatale Diagnostik / Interruptio Elternalter Human-Genetik A C Genetik
Leukämien im Kindesalter Allgemeines
 5 2 Leukämien im Kindesalter Allgemeines Paul Imbach 2.1 Definition 6 2.2 Häufigkeit und Vorkommen 6 2.3 Ätiologie und prädisponierende Faktoren 6 2.3.1 Genetik 6 2.3.2 Ionisierende Strahlen 7 2.3.3 Chemische
5 2 Leukämien im Kindesalter Allgemeines Paul Imbach 2.1 Definition 6 2.2 Häufigkeit und Vorkommen 6 2.3 Ätiologie und prädisponierende Faktoren 6 2.3.1 Genetik 6 2.3.2 Ionisierende Strahlen 7 2.3.3 Chemische
Genetische pränatale Beratung Sicht des Genetikers
 Genetische pränatale Beratung Sicht des Genetikers Ersttrimester-Ultraschall-Kurs mit praktischen Übungen zum Erhalt des Fähigkeitsausweises Schwangerschafts-Ultraschall Neue Frauenklinik, Kantonsspital
Genetische pränatale Beratung Sicht des Genetikers Ersttrimester-Ultraschall-Kurs mit praktischen Übungen zum Erhalt des Fähigkeitsausweises Schwangerschafts-Ultraschall Neue Frauenklinik, Kantonsspital
Biologie und molekulare Medizin
 Biologie und molekulare Medizin für Mediziner und Naturwissenschaftler Bearbeitet von Monica Hirsch-Kauffmann, Manfred Schweiger, Michal-Ruth Schweiger 7. Auflage 2009. Buch. XIII, 416 S. Kartoniert ISBN
Biologie und molekulare Medizin für Mediziner und Naturwissenschaftler Bearbeitet von Monica Hirsch-Kauffmann, Manfred Schweiger, Michal-Ruth Schweiger 7. Auflage 2009. Buch. XIII, 416 S. Kartoniert ISBN
GENETIK und VERERBUNG
 GENETIK und VERERBUNG 1. Einleitung Epidermolysis bullosa (EB) ist eine Erkrankung, die genetisch bedingt ist, das heißt also, dass die Ursache dafür in den Erbanlagen eines Menschen zu finden ist. Die
GENETIK und VERERBUNG 1. Einleitung Epidermolysis bullosa (EB) ist eine Erkrankung, die genetisch bedingt ist, das heißt also, dass die Ursache dafür in den Erbanlagen eines Menschen zu finden ist. Die
'- Bestehensgrenze: Mindestens 18 der 30 Fragen innerhalb von 45 min sind richtig zu beantworten.
 I Klausur Humangenetik Köln WS '07/'08 28.01.2008; 16:00 s.t. -16:45 Uhr; großer Hörsaal I, LFI-Gebäude Bitte: - Kugelschreiber (blau oder schwarz) verwenden; Korrekturen nur mit TippEx (Computer liest
I Klausur Humangenetik Köln WS '07/'08 28.01.2008; 16:00 s.t. -16:45 Uhr; großer Hörsaal I, LFI-Gebäude Bitte: - Kugelschreiber (blau oder schwarz) verwenden; Korrekturen nur mit TippEx (Computer liest
Prognostische und prädiktive Marker beim Prostata Ca
 JOURNAL CLUB α Prognostische und prädiktive Marker beim Prostata Ca Dr. med. K.-E. Ambs Facharzt für Urologie - Urologische Privatpraxis und Praxisklinik im Medico Palais Parkstr. 6 65812 Bad Soden www.dr-ambs.com
JOURNAL CLUB α Prognostische und prädiktive Marker beim Prostata Ca Dr. med. K.-E. Ambs Facharzt für Urologie - Urologische Privatpraxis und Praxisklinik im Medico Palais Parkstr. 6 65812 Bad Soden www.dr-ambs.com
Informationen zur Ultraschalluntersuchung in der Schwangerschaft
 Ersttrimesterscreening Bitte ausfüllen Name, Vorname Geburtsdatum Informationen zur Ultraschalluntersuchung in der Schwangerschaft Ersttrimesterscreening (Diagnostik 12.-14. SSW): Messung der fetalen Nackenfalte
Ersttrimesterscreening Bitte ausfüllen Name, Vorname Geburtsdatum Informationen zur Ultraschalluntersuchung in der Schwangerschaft Ersttrimesterscreening (Diagnostik 12.-14. SSW): Messung der fetalen Nackenfalte
Mitteilung des Bundesamts für Sicherheit im Gesundheitswesen über Maßnahmen zur Gewährleistung der Arzneimittelsicherheit:
 Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
Landeshauptleute Landessanitätsdirektionen Österreichische Apothekerkammer Österreichische Ärztekammer Landesärztekammern Anstaltsapotheken d. Universitätskliniken Datum: 16.11.2015 Kontakt: Mag. Rudolf
ZytoLight porcine X/Y Dual Color Probe
 ZytoLight porcine X/Y Dual Color Probe Z-2094-200 20 (0,2 ml) Zum Nachweis porciner Chromosom-X- und Chromosom-Y-spezifischer Sequenzen durch Fluoreszenz in situ Hybridisierung (FISH) Nur für Forschungszwecke
ZytoLight porcine X/Y Dual Color Probe Z-2094-200 20 (0,2 ml) Zum Nachweis porciner Chromosom-X- und Chromosom-Y-spezifischer Sequenzen durch Fluoreszenz in situ Hybridisierung (FISH) Nur für Forschungszwecke
