Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil3. zumeist planar trigonal. planar bis pyramidal, starr oder flexibel (Zwischenstellung)
|
|
|
- Beate Franke
- vor 5 Jahren
- Abrufe
Transkript
1 adikale Prof Dr P ademacher rganische Chemie IV CIV-SS2005-Teil3 4 Struktur von adikalen C (+) Carbenium-Ion C C (-) adikal Carbanion zumeist planar trigonal planar bis pyramidal, starr oder flexibel (Zwischenstellung) zumeist pyramidal C C starre oder flexible Pyramide planar trigonal
2 2 Prof Dr P ademacher rganische Chemie IV adikal C 3 C 2 Cl CCl 3 CF 3 Struktur (thode) planar oder leicht pyramidal (ES) I (bei tiefer Temperatur in gefrorenem Inertgas, Matrix): max 5 Abweichung von der Planarität planar (ES, I) pyramidal (ES, I) pyramidal (ES, I) C(C 3 ) 3 C 2 pyramidal (ES), ϕ = 20, Beziehung zwischen Kopplung des ES-Signals mit 13 C und ybridisierung des zentralen C-Atoms Temperaturabhängigkeit des Spektrums: Inversionsbarriere 24 kj/mol pyramidal (ES) pyramidal (ES) Einfluss von Substituenten: Tendenz zur pyramidalen (nicht planaren) Struktur: CF 3 < C 3 < Cl < F <
3 Prof Dr P ademacher rganische Chemie IV 3 Stereochemie von adikal-eaktionen zb Chlorierung: ermöglicht ückschluss auf die Struktur der Zwischenstufe Cl Et Cl 2 hν Cl Cl Et + Cl (+) ein Enantiomer (+) acemat Verlust der optischen Aktivität, das adikal bildet keine "stabile" Pyramide Brückenkopf-adikale werden im Gegensatz zu Brückenkopf-Carbenium-Ionen relativ leicht gebildet Die Planarität bei C 3 (+) ist stärker ausgeprägt als bei C 3 Bei C 3 (+) ist die planare Form etwa 85 kj/mol stabiler als die pyramidale eaktionen über Brückenkopf- adikale Carbenium-Ionen (S N 1) relativ zu acyclische Verbindungen mal langsamer mal langsamer
4 4 Prof Dr P ademacher rganische Chemie IV Formyl-adikal, C, Struktur durch MW-Spektroskopie bestimmt (r 0 -Werte; Brown u amsay, 1975) pm 1175 pm Allyl-adikal, planar C 2 2 C Vinyl-adikal, Inversionsbarriere ca 8 kj/mol ' " ' "
5 Prof Dr P ademacher rganische Chemie IV 5 Pentaphenylcyclopentadienyl und Diphenylpicrylhydrazyl öntgenstrukturanalyse Ph Ph Torsionswinkel 49 2 N Ph Ph Ph N φ 22 N 33 Ph Ph 2 N N 2 φ ~ 60 Propellerartige Struktur
6 6 Prof Dr P ademacher rganische Chemie IV 5 Stabilität von adikalen 3 C > 2 C > C 2 > C 3 eaktivitätsfolge umgekehrt analog: Carbenium-Ionen +I-Effekt von und yperkonjugation (Carbanionen invers) Bindungsstärken von C -Bindungen [kj/mol] DE(C ) 435 C 3 C 2 2 C 3 C Et + Et C 2 C= + Et Et ist stabiler als Alkoxy-adikal Geschwindigkeit der -Abstraktion von Toluol: Ph C 3 + Ph C 2 + DE(C ) = 355 kj/mol primäres > sekundäres > tertiäres adikal
7 Prof Dr P ademacher rganische Chemie IV 7 Benzyl-adikal Konjugation mit π-systemen erhöht die Stabilität C 2 C 2 C 2 C 2 ES: adikaldichte im SM (einfach besetztes M) ~ LCA-Koeffizienten Ph 3 C : DE(C ) = 314 kj/mol Allyl-adikal "delokalisiertes" adikal, nicht linear, Aufenthaltswahrscheinlichkeit des ungepaarten Elektrons an den Enden ~ M C 2 =C C 3 DE(C ) = 370 kj/mol Propargyl-adikal C C C 3 DE(C ) = 393 kj/mol
8 8 Prof Dr P ademacher rganische Chemie IV Ar, 2 C=C, C C Aryl-, Vinyl-, Ethinyl-adikale sind sehr reaktiv, da das ungepaarte Elektron nicht delokalisiert werden kann Bindungsdissoziationsenergien DE und ybridisierung DE(C ) [kj/mol] C C sp 471 Ph sp C=C 2 sp C C 3 sp Auch die Konjugation mit n-elektronen erhöht die Stabilität: C 2 - ist stabiler als C 3
9 Prof Dr P ademacher rganische Chemie IV 9 Stabilität einiger adikale Struktur Eigenschaft/Stabilität Als Feststoff selbst an Luft unbegrenzt stabil Ph Ph Ph Im kristallinen Zustand wird die Verbindung nur langsam von Sauerstoff angegriffen, obwohl Lösungen gegen Luft empfindlich sind; in Abwesenheit von Sauerstoff ist sie auch bei höheren Temperaturen stabil Ph Ph C 6 Cl 5 C 6 Cl 5 C 6 Cl 5 In Lösung selbst an der Luft tagelang stabil Im festen Zustand unbegrenzt stabil Thermisch stabil bis 300 C Stabil gegenüber Sauerstoff; kann als Feststoff längere Zeit unzersetzt aufbewahrt werden Zersetzt sich langsam in Lösung = t-bu Galvinoxyl
10 10 Prof Dr P ademacher rganische Chemie IV 3 C 3 C (CF 3 ) 2 CF CF 2 CF 3 Stabil in verdünnten Lösungen (<10-5 M) unterhalb von -30 C in Abwesenheit von Sauerstoff: t 1/2 = 50 s bei 25 C Thermisch stabil bis 70 C Stabil gegenüber Sauerstoff (CF 3 ) 2 CF 3 C N 3 C <Carey-Sundberg, S 631> Selbst oberhalb 100 C stabil gegen Sauerstoff Persistente adikale bilden keine stabilen Dimere, sie reagieren also nicht diffusionskontrolliert mit sich selbst, aber mit anderen reaktiven adikalen wie C 3 und 2
11 Prof Dr P ademacher rganische Chemie IV 11 6 adikal-eaktionen 60 Übersicht 1) ekombination/dimerisierung von adikalen Azoverbindungen, Diacylperoxide 2) adikalische Substitution S alogenierung, Allylische alogenierung (mit NBS), Sulfochlorierung, xidation, ocksche Phenolsynthese 3) adikalische Addition an hrfachbindungen A Addition von alogen, alogenwasserstoff, alogenmethanen, Thiolen, Alkoholen radikal Polymerisation 4) -Abstraktion und andere S 2-eaktionen 5) Umlagerung (intramolekulare -Abstraktion) 6) Disproportionierung 7) edox-eaktionen mit radikalischen Zwischenstufen Acyloin-Synthese, Birch-eduktion, Sandmeyer-eaktion 8) Biochemisch wichtige Antioxidanzien
12 12 Prof Dr P ademacher rganische Chemie IV 61 adikal-ekombination 2 adikal-adikal-eaktionen sind sehr schnell, verlaufen in der egel diffusionskontrolliert Aktivierungsenergie E a 0 Geschwindigkeitskonstante k ist sehr groß, zb 2 C 3 3 C C 3 k = 10 9 s -1 adikale werden aus organischen Vorstufen stets als Paare gebildet Deshalb besteht immer die Gefahr einer ekombination, bevor sie zu freien adikalen werden Bei der adikalbildung in Lösung sind die beiden zunächst räumlich nahe bei einander, in derselben Solvathülle (Lösungsmittelkäfig) Bei Peroxiden ist die ekombination unproblematisch 2
13 Prof Dr P ademacher rganische Chemie IV 13 Bei Azoverbindungen und ähnlichen Vorstufen wird jedoch der adikalbildner nicht zurückgebildet N N [ + N 2 + ] - N 2 Solvens-Käfig 2 ekombination Diffusion freie adikale Bestimmung des Verhältnisses durch Abfangen der freien adikale Ph C N N C Ph Produkte 73 % 40 C Benzol 2 adikalfänger Diffusion k Diff Ph C Ph k Diff / k ekomb = 27 + N 2 + Ph C Ph ekombination k ekomb 27 % Ph Beispiel: Azocumol Das Verhältnis von k Diff /k ekomb ist abhängig von Temperatur und Lösungsmittel-Viskosität, jedoch auch von der Natur des adikalbildners
14 14 Prof Dr P ademacher rganische Chemie IV Bei Diacylperoxiden ist der Käfigeffekt kleiner als bei Azoverbindungen: größere Entfernung der beiden [ + C 2 + C 2 + ] Solvens-Käfig
15 Prof Dr P ademacher rganische Chemie IV adikalische Substitution S Kettenreaktion Beispiele: Photochlorierung - + Cl 2 -Cl + Cl hν [kj/mol] Start (Bildung des adikals) : Cl 2 hν 2 Cl +243 Fortpflanzung: Cl + - Cl Cl 2 Cl + Cl -96 Quantenausbeute: bis zu 10 6 ; dh für jedes absorbierte Photon werden bis zu 10 6 Produktmoleküle gebildet wird als Nebenprodukt gefunden (wenn es nicht selbst weiterreagiert): <01 % - Cl -Cl adikalinhibitoren stören!! z B 2 : ) -Cl Cl 2 Kettenabbruch: 2 Cl Cl Cl -Cl
16 16 Prof Dr P ademacher rganische Chemie IV adikalreaktionen sind sehr schnell und zumeist wenig spezifisch relative eaktivitäten von prim, sek und tert -Atomen: C 3 2 C C 3 2 C C C 3 2 C C 2 k rel : ( ) Einfluss der Temperatur k rel C 3 C 2 >C bei 100 C bei 200 C Bei höherer Temperatur nimmt die Selektivität ab (~ statistische Verteilung) Bei niedrigerer Temperatur entspricht k in etwa der Stabilität des jeweiligen adikals Ph C 2 C 2 C 2 C 3 k rel : Allgemein: benzylisch > nicht-benzylisch; tertiär >sekundär> primär
17 Prof Dr P ademacher rganische Chemie IV 17 Kinetik von adikalreaktionen istens komplizierte Geschwindigkeitsgesetze Typisch: Edukt-Konzentrationen mit gebrochenen Exponenten, z B Photochlorierung unter bestimmten Bedingungen: Geschw = k [] [Cl 2 ] 1/2 adikalische Polymerisation: kinetische Kettenlänge v = Polymerisationsgrad v = Gesamtgeschw/Geschw der Startreaktion niedrige adikal-konzentration (keine ekombination!) große Kettenlänge
18 18 Prof Dr P ademacher rganische Chemie IV Sulfochlorierung Chlorsulfonierung eed-eaktion (1933) Einführung der S 2 Cl-Gruppe in Paraffine und Cycloparaffine Verfahren zur erstellung von Aniontensiden, speziell Alkansulfonaten eagenzien: Chlor + Schwefeldioxid (1:1) Cl 2 hν 2 Cl + S 2 S S + Cl + Cl + Cl 2 S Cl + Cl
19 Prof Dr P ademacher rganische Chemie IV 19 alogenierung in Allyl- und Benzylposition Bromierung mit N-Bromsuccinimid (NBS) Br + N Br AIBN + N C 3 C 2 -Br + NBS AIBN Spezifische Substitution von allylischem bzw benzylischem Wasserstoff chanistische Untersuchungen zeigten, dass molekulares Brom das halogenierende Agens ist Br 2 -Konzentration muss sehr niedrig sein, sonst Br 2 -Addition!
20 20 Prof Dr P ademacher rganische Chemie IV Br + Br + Br + N Br schnell, N + Br 2 ionisch Br 2 + Br + Br Die eaktion wird am besten in CCl 4 durchgeführt, in dem NBS nahezu unlöslich ist Dies bedingt eine sehr niedrige NBS- und damit auch Br 2 -Konzentration <Im C-Grundpraktikum wird das weniger giftige Cyclohexan als LM verwendet>
21 Prof Dr P ademacher rganische Chemie IV 21 Autoxidation, Bildung von ydroperoxiden und Dialkylperoxiden + 2 ydroperoxid Praktische Bedeutung: Trocknen und ärten von Öl in Farben und Lacken Altern von Kunststoffen und Gummi Verderben von Lebensmitteln Die eaktion ist relativ selektiv, bevorzugt tertiären, allylischen oder benzylischen Wasserstoff Bildung von Diaklyperoxiden und Alkoholen Tetroxid Dialkylperoxid
22 22 Prof Dr P ademacher rganische Chemie IV Die ocksche Phenolsynthese verläuft über ein ydroperoxid 2 (+) + 2 C= Cumen Cumenhydroperoxid relativ stabil Besonders reaktiv sind Ether, die tertiäre -Atome besitzen, z B Diisopropylether: usw 2 2 Die ydroperoxide und Dialkylperoxide sind schwerer flüchtig als die Ether eftige Explosion bei der Destillation! Vernichten durch eduktion, z B mit FeS 4
23 Prof Dr P ademacher rganische Chemie IV Additionsreaktionen A Addition von alogen an Alkene und Aromaten + X 2 X X Zwei chanismen (Grundpraktikum): ionisch (A E ): polares Lösungsmittel, Lewis-Säure-Katalyse zb Br 2 -Addition, Zwischenstufe: Bromonium-Ion radikalisch (A ): unpolares Lösungsmittel, Gasphase, Licht, adikalbildner eaktivität bei A : F 2 > C1 2 > Br 2 > I 2 F 2 -Addition: sehr heftig, ohne photochemische oder andere Aktivierung, unkontrolliert, viele Nebenprodukte, praktisch unbrauchbar
24 24 Prof Dr P ademacher rganische Chemie IV Cl 2 - und Br 2 -Addition 1/2 X 2 hν oder T oder adikalbildner X = Cl oder Br X X 2 X C X X + X Chlorierung: lange eaktionsketten Quantenausbeute: Bromierung: kürzere eaktionsketten I 2 -Addition: schwer, Addukte spalten das Iod leicht wieder ab, ückreaktion ist begünstigt Addition von Chlor an Benzen Cl + Cl 2 Licht oder Peroxide Cl Cl Cl Cl exachlorcyclohexan (C) acht Stereosomere ua Gammexan (Insektizid) Cl
Prof. Dr. Paul Rademacher
 Prof. Dr. P. ademacher rganische hemie IV IV(VorlesungsskriptSS2005) ampus Essen Skript für die Vorlesung rganische hemie IV: eaktive Zwischenstufen (IV) im Sommersemester 2005 V2, Di 8-10, S05 03 20 Prof.
Prof. Dr. P. ademacher rganische hemie IV IV(VorlesungsskriptSS2005) ampus Essen Skript für die Vorlesung rganische hemie IV: eaktive Zwischenstufen (IV) im Sommersemester 2005 V2, Di 8-10, S05 03 20 Prof.
Radikale. Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil2
 Radikale Prof. Dr. P. Rademacher rganische Chemie IV CIV-SS2005-Teil2 1. Charakterisierung von Radikalen 2. Darstellung von Radikalen 2.1 Thermolyse 2.2 Photolyse 2.3 Redox-Reaktionen 3. achweis von Radikalen
Radikale Prof. Dr. P. Rademacher rganische Chemie IV CIV-SS2005-Teil2 1. Charakterisierung von Radikalen 2. Darstellung von Radikalen 2.1 Thermolyse 2.2 Photolyse 2.3 Redox-Reaktionen 3. achweis von Radikalen
II. Halogenalkane, radikalische und nukleophile Substitution
 II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
1. Gruppe: Nucleophile Substitution
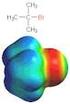 1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
Markownikow-Addition ionisch, zwei Stufen A E. + H-Br dunkel polares LM. anti-markownikow-addition radikalisch, Kettenreaktion A R.
 Prof Dr P ademacher rganische hemie IV Addition von -Br an Alkene IV-SS2005-Teil5 + -Br dunkel polares LM 3 Br A E Markownikow-Addition ionisch, zwei Stufen Licht oder --- Br 2 2 A anti-markownikow-addition
Prof Dr P ademacher rganische hemie IV Addition von -Br an Alkene IV-SS2005-Teil5 + -Br dunkel polares LM 3 Br A E Markownikow-Addition ionisch, zwei Stufen Licht oder --- Br 2 2 A anti-markownikow-addition
Reaktionen der Alkene
 Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 4
 Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Halogenierung von gesättigten Kohlenwaserstoffen
 Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Struktur von freien Radikalen
 Struktur von freien Radikalen pplung von Elektrospin mit dem 13 -Kern gibt einen Richtwert für den Grad der Pyramidalisierung a a 13 [G] 3 2 F F 2 F 3 2 a 13 [G] 38.5 54.8 148.8 272 47 99 Die Größe der
Struktur von freien Radikalen pplung von Elektrospin mit dem 13 -Kern gibt einen Richtwert für den Grad der Pyramidalisierung a a 13 [G] 3 2 F F 2 F 3 2 a 13 [G] 38.5 54.8 148.8 272 47 99 Die Größe der
Bildung und Reaktion von Radikalen bei der Plasmabehandlung von Polymeren. Andreas Holländer, Stefan Kröpke
 Bildung und eaktion von adikalen bei der Plasmabehandlung von Polymeren Andreas olländer, Stefan Kröpke adikale Energie ungepaartes Elektron Inhalt adikalbildung Analyse eaktionen adikale bei der Plasmabehandlung
Bildung und eaktion von adikalen bei der Plasmabehandlung von Polymeren Andreas olländer, Stefan Kröpke adikale Energie ungepaartes Elektron Inhalt adikalbildung Analyse eaktionen adikale bei der Plasmabehandlung
Übung: Alkene & Alkohole HS-07
 kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
Lösungen 2.Übungsblatt SS NBS, AIBN Br K +
 Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Organische Experimentalchemie
 PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
PD Dr. Alexander Breder (abreder@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der umanmedizin, Zahnmedizin und
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2017
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017 Die Übungsfragen
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017 Die Übungsfragen
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
5 Radikalreaktionen 79
 5 adikalreaktionen 79 5.1 rzeugung von adikalen 79 5.1.1 adikale durch homolytische Bindungsspaltung 79 5.1.2 adikale durch edoxprozesse 80 a) adikale durch eduktion 80 b) adikale durch xidation 80 5.1.3
5 adikalreaktionen 79 5.1 rzeugung von adikalen 79 5.1.1 adikale durch homolytische Bindungsspaltung 79 5.1.2 adikale durch edoxprozesse 80 a) adikale durch eduktion 80 b) adikale durch xidation 80 5.1.3
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2018
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
2 Radikalische Substitutionen
 2 Radikalische Substitutionen Wie in der Einleitung besprochen, ist für eine chemische Reaktion eines gesättigten Moleküls ein Bindungsbruch notwendig. Eine Einfachbindung kann homolytisch oder heterolytisch
2 Radikalische Substitutionen Wie in der Einleitung besprochen, ist für eine chemische Reaktion eines gesättigten Moleküls ein Bindungsbruch notwendig. Eine Einfachbindung kann homolytisch oder heterolytisch
Organische Chemie 1 Teil 2 3. Vorlesung Dienstag
 Inhalte der 3. Vorlesung: 2. Carbonylchemie 2.1.2 -Nukleophile 2.1.2.1 eaktivitäten unterschiedlicher Carbonylderivate 2.1.2.2 eduktionen mit NaB4 2.1.2.3 Lithiumaluminiumhydrid (LiAl4) als eduktionsmittel
Inhalte der 3. Vorlesung: 2. Carbonylchemie 2.1.2 -Nukleophile 2.1.2.1 eaktivitäten unterschiedlicher Carbonylderivate 2.1.2.2 eduktionen mit NaB4 2.1.2.3 Lithiumaluminiumhydrid (LiAl4) als eduktionsmittel
Organostickstoff- Verbindungen
 rganostickstoff- Verbindungen [1] Chiralität von Aminen [2] -Enantiomere Isomerisieren sehr schnell -E A 20-30 KJ/mol [2] Alkylierung von Ammoniak [2] [2] [2] -geringe Selektivität aufgrund von Mehrfachalkylierung
rganostickstoff- Verbindungen [1] Chiralität von Aminen [2] -Enantiomere Isomerisieren sehr schnell -E A 20-30 KJ/mol [2] Alkylierung von Ammoniak [2] [2] [2] -geringe Selektivität aufgrund von Mehrfachalkylierung
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Oxidation und Reduktion. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse März
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse März
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Aliphatische Substitutionen
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aliphatische Substitutionen Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aliphatische Substitutionen Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil7
 Prof. r. P. ademacher rganische Chemie IV CIV-SS2005-Teil7 Arine C. Grundmann, Arine, Methoden der rganischen Chemie (ouben-weyl), Bd. 5/2b, Georg Thieme Verlag, Stuttgart, 1981, S. 613-648... Wenk, M.
Prof. r. P. ademacher rganische Chemie IV CIV-SS2005-Teil7 Arine C. Grundmann, Arine, Methoden der rganischen Chemie (ouben-weyl), Bd. 5/2b, Georg Thieme Verlag, Stuttgart, 1981, S. 613-648... Wenk, M.
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
zur Vorlesung "Organische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2002/2003
 J. aub/febr. 200 Klausur zur Vorlesung "rganische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie. Semester" Lösungsbogen WS 2002/200 ) Radikalreaktionen (2 Punkte):
J. aub/febr. 200 Klausur zur Vorlesung "rganische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie. Semester" Lösungsbogen WS 2002/200 ) Radikalreaktionen (2 Punkte):
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
s- und p-orbitale MO-Schema des Wasserstoffmoleküls H 2 y z z x p x p y p z antibindendes MO bindendes MO
 s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
s- und p-rbitale y y z z x x s p x p y p z M-Schema des Wasserstoffmoleküls 2 antibindendes M 1s 1s bindendes M Merkmale wichtiger ybridorbitale sp 3 -ybridisierung: Tetraedrische Ausrichtung der ybridorbitale,
Prof. Dr. P. Rademacher Organische Chemie IV
 Prof Dr P ademacher rganische hemie IV arbene und itrene 1 Einleitung arbene sind Verbindungen mit zweibindigem Kohlenstoff, der ein Elektronensextett besitzt Einfachstes arben : 2 = thylen Substituierte
Prof Dr P ademacher rganische hemie IV arbene und itrene 1 Einleitung arbene sind Verbindungen mit zweibindigem Kohlenstoff, der ein Elektronensextett besitzt Einfachstes arben : 2 = thylen Substituierte
2 Nucleophile Substitutionen am gesättigten Kohlenstoff
 2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Cyclisierung von freien Radikalen (Baldwin-Regel) Konkurrenz der Bildung von Fünf- und Sechsringen
 yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015
 Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Organisch-Chemisches Institut Fakultät für Chemie und Geowissenschaften Universität Heidelberg 4. September 2015 Musterlösung Zwischennachklausur II zur Experimentalvorlesung Organische Chemie von Prof.
Spektroskopie-Seminar SS 18 8 Massenspektrometrie Massenspektrometrie
 SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
SS 18 Massenspektrometrie 1 8.1 Prinzip Methode zur Bestimmung der Masse von Molekülen Analyt wird in die Gasphase überführt Moleküle werden ionisiert und durch elektrisches Feld beschleunigt Auftrennung
Klausur - Lösungsbogen
 Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.1 Homologe Reihe, Nomenklatur, Konstitution, Konformation CH 2
 Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
Prof. hristoffers, Vorlesung rganische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler. Alkane.1 omologe Reihe, Nomenklatur, Konstitution, Konformation.1.1 omologe Reihe
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Aldehyde und Ketone Carbonylverbindungen
 Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
Aldehyde und Ketone Carbonylverbindungen Prof. Dr. Ivo C. Ivanov 1 Prof. Dr. Ivo C. Ivanov 2 Die Siedepunkte liegen höher als bei den jeweils zugrundeliegenden Alkanen, eine Folge des polaren Charakters
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Übung zur Vorlesung Organische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 O 2 N
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Aromatische Substitution. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
7. Oxidationsreaktionen
 7. xidationsreaktionen xidation Entzug von Elektronen durch ein geeignetes eagens, das xidationsmittel entweder wird Wasserstoff aus dem Molekül entfernt oder Sauerstoff eingefügt Industriell bzw. optimal:
7. xidationsreaktionen xidation Entzug von Elektronen durch ein geeignetes eagens, das xidationsmittel entweder wird Wasserstoff aus dem Molekül entfernt oder Sauerstoff eingefügt Industriell bzw. optimal:
Übergangsmetall-π-Komplexe
 Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
a81 a Carbonylverbindungen (I)
 Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
a81 a Carbonylverbindungen (I)
 Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Ω Amine können als formale -Substitutionsprodukte des Ammoniaks (Ersatz von -Atomen am Stickstoff durch Alkylgruppen) betrachtet werden.sie sind durch das freie Elektronenpaar am N-Atom, genauso wie Ammoniak,
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2016
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Organische Chemie 2. Skript. zur. Vorlesung. Wintersemester 2010/2011. Prof. H. Mayr
 Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Grundpraktikum für Biologen 2016
 Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
Grundpraktikum für Biologen 2016 31.03.2016 Übersicht # 2 Kovalente Bindung Freies Elektronenpaar Einzelnes Elektron Oktett erfüllt Einzelne Chloratome haben einen Elektronenmangel Reaktion zu Cl 2 erfüllt
M U S T E R L Ö S U N G
 Prof. r. O. Reiser Prof. r. A. Geyer Nachholklausur zur 1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2002 am Mittwoch, dem 31. Juli 2002 Name:...Vorname:...
Prof. r. O. Reiser Prof. r. A. Geyer Nachholklausur zur 1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2002 am Mittwoch, dem 31. Juli 2002 Name:...Vorname:...
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
Konzertierte Reaktionen
 Konzertierte Reaktionen. Elektrocyclische Reaktionen 2. Sigmatrope Umlagerungen 3. Cycloadditionen Definition: Konzertierte Reaktionen laufen in einem Schritt ab, so dass nur ein Übergangszustand und keine
Konzertierte Reaktionen. Elektrocyclische Reaktionen 2. Sigmatrope Umlagerungen 3. Cycloadditionen Definition: Konzertierte Reaktionen laufen in einem Schritt ab, so dass nur ein Übergangszustand und keine
Musterlösung zur. 1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2001
 Prof. Dr. B. König Prof. Dr. A. Geyer Musterlösung zur. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Montag, dem 8. Mai 00 Name: Mustermann...Vorname:
Prof. Dr. B. König Prof. Dr. A. Geyer Musterlösung zur. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Montag, dem 8. Mai 00 Name: Mustermann...Vorname:
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. O R 3
 Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. 1 2 [ ] 2 3 2 oder 3 [ 3 ] ' '' Amid, wenn '' =, Alkyl, Aryl 2 ydrazid ydroxamsäure (geringere eaktionsgeschwindigkeiten
Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. 1 2 [ ] 2 3 2 oder 3 [ 3 ] ' '' Amid, wenn '' =, Alkyl, Aryl 2 ydrazid ydroxamsäure (geringere eaktionsgeschwindigkeiten
Alkylwanderungen. Mechanismus: HCl. HCl. Cl β-pinen. Bornylchlorid. OC4_folie185
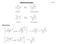 Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
3. Gruppe: Aromatische Substitution
 1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
O + + R' Die langsamere Weiterreaktion des Sulfoxids führt zum Sulfon:
 6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
Organische Chemie II Reaktivität
 Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2018
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Carbonsäuren und Derivate Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser/Dr. Martin Sumser September
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Carbonsäuren und Derivate Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser/Dr. Martin Sumser September
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Wiederholungsklausur zur Grundvorlesung Organische Chemie im SS 2002
 Prof. Dr. B. König Institut für rganische hemie Universität Regensburg Wiederholungsklausur zur Grundvorlesung rganische hemie im SS 2002 am Samstag, dem 28. September 2002 Name:...Vorname:... Geburtsdatum:...Unterschrift:...
Prof. Dr. B. König Institut für rganische hemie Universität Regensburg Wiederholungsklausur zur Grundvorlesung rganische hemie im SS 2002 am Samstag, dem 28. September 2002 Name:...Vorname:... Geburtsdatum:...Unterschrift:...
Vorlesung Organische Chemie II, Teil 2, SS Quickie Nr. 1: Radikalreaktionen und aromatische Substitution
 Vorlesung rganische Chemie II, Teil 2, SS 2009 Prof. Dr. C. Christoph Tzschucke Quickie Nr. 1: Radikalreaktionen und aromatische Substitution Aufgabe 1. Geben sie für die folgenden Bindungen jeweils Bindungsenergie
Vorlesung rganische Chemie II, Teil 2, SS 2009 Prof. Dr. C. Christoph Tzschucke Quickie Nr. 1: Radikalreaktionen und aromatische Substitution Aufgabe 1. Geben sie für die folgenden Bindungen jeweils Bindungsenergie
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
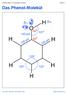 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
O H H 3 C. Methanol. Molekulargewicht Siedepunkt Löslichkeit in Wasser H 3 C-OH. unbegrenzt H 3 C-Cl. 7.4 g/l H 3 C-CH 3 -24/C -88/C
 Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
Struktur und Eigenschaften 3 C 3 C C 3 105 109 112 Wasser Methanol Dimethylether Vektoraddition der einzelnen Dipolmomente eines Moleküls zum Gesamtdipolmoment Anmerkung zu aktuellen Ereignissen: itrofen
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 E 102.1: Grundlagen der hemie - rganische hemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 4. Alkene: eaktionen und erstellung 4.1. Elektrophile Additionen an Alkene: egioselektivität Das Proton einer
E 102.1: Grundlagen der hemie - rganische hemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 4. Alkene: eaktionen und erstellung 4.1. Elektrophile Additionen an Alkene: egioselektivität Das Proton einer
D D. D endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% p = 6.8 kbar: 72.0 : 27.0 : <1.0 cis-stereoselectivity: >99%
 4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
Eliminierungsreaktionen: E1- und E2- Mechanismen; Olefine
 Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Synthesen von Carbonsäuren: industrielle Verfahren
 Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
Substituenten-Effekt auf die Orientierung der Zweitsubstituenten Orientierung bei der Toluolsubstitution
 Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
1. Übungsblatt Radikale
 Prof. Dr. liver Reiser Institut für rganische Chemie Universität Regensburg 1. Übungsblatt Radikale Aufgabe 1: Mittels radikalischer Chlorierung oder omierung können Alkylhalogenie aus Alkanen effektiv
Prof. Dr. liver Reiser Institut für rganische Chemie Universität Regensburg 1. Übungsblatt Radikale Aufgabe 1: Mittels radikalischer Chlorierung oder omierung können Alkylhalogenie aus Alkanen effektiv
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Die Herstellung von Alkenen aus Chloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen.
 Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
Organische Chemie 1 Teil 2
 Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
