Organische Chemie 2. Skript. zur. Vorlesung. Wintersemester 2010/2011. Prof. H. Mayr
|
|
|
- Hajo Becker
- vor 7 Jahren
- Abrufe
Transkript
1 Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1
2 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes Lehrbuch ersetzen. Betrachten Sie daher das nachfolgende Skript lediglich als ilfsmittel, der Vorlesung leichter folgen zu können. Bewusst wurden Lücken gelassen, um Sie während der Vorlesung schon zum Mitarbeiten zu animieren. Während das Skript für die erste Woche dem des letzten Semesters fast vollständig entspricht, habe ich in späteren Wochen einige Stoff-Verbindungen vorgenommen. Die aktuellen Seiten finden Sie rechtzeitig vor den entsprechenden Vorlesungen an dieser Stelle. Für inweise auf Fehler bedanke ich mich schon im Voraus. Ihr erbert Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 2
3 1 Radikale und Radikal-Reaktionen 1.1 Eigenschaften von Radikalen Radikale: Atome, Moleküle oder Ionen mit ungepaarten Elektronen Beispiele: Einfache, ungeladene Radikale: Diradikale und Triradikale (2 bzw. 3 ungepaarte Elektronen): Geladene Radikale (Radikal-Anionen und Radikal-Kationen): e 3 : e ( 3 SbF 6 ) Strukturen: arbokation (planar) arbanion (pyramidal) Radikale F F F Die Elektronen befinden sich in sp 2 -ybridorbitalen, p z -rbital ist leer. Das freie Elektronenpaar befindet sich in einem sp 3 -ybridorbital (Ausnahmen: Resonanzstabilisierte arbanionen). Im allgemeinen flache Energiehyperflächen, d. h. geringe Energieunterschiede zwischen planaren und pyramidalen Formen. Konsequenz für Stereochemie radikalischer Substitutionen: Me Et Pr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 3
4 Stabilitätsreihe aus Bindungsdissoziationsenthalpien (BDEs): < < < < = < 2 3 < Resonanzstabilisierung beim Allyl- und Benzyl-Radikal Keine Resonanzstabilisierung beim enyl-radikal. Manche Radikale sind wenig reaktiv (persistent) 1900 erhielt Gomberg beim Behandeln von 3 l mit metallischem Silber einen Kohlenwasserstoff 38 30, der nicht die Struktur von exaphenylethan besitzt. Die Substanz ist zu 2 % in die Triphenylmethyl (Trityl)-Radikale dissoziiert. 2 l 2 Ag 0 2 Agl 2 Teile in 0.1 % Benzol-Lösung 98 Teile kein! Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 4
5 weitere persistente Radikale: gelbgrüne, luftempfindliche Kristalle DPP (Diphenylpicrylhydrazyl) violette Kristalle TEMP (Tetramethylpiperidin- -oxid) dunkelblauer Feststoff 1.2 Bildung von organischen Radikalen Übersicht Bildung von Radikalen omolyse von A B Redox-Reaktionen aus anderen Radikalen A B A B thermisch photochemisch Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 5
6 1.2.2 omolytische Bindungsspaltungen A B A B Standardbindungsdissoziationsenthalpien (BDEs) (kj mol 1 ) 435 F F 155 F 565 l l 242 l I I 150 I F l I ( 3 ) ( 3 ) 3 ( 3 ) ( 3 ) ( 3 ) = = (aus Y.-R. Luo, andbook of Bond Dissociation Energies in rganic ompounds, R Press, Boca Raton, 2003) 3 3 Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 6
7 Thermolysen ( 3 ) 3 ( 3 ) 3 t 1/2 ca. 1 h Di-tert.butylperoxid Dibenzoylperoxid 95 t 1/2 ca. 1 h t 3 1/2 ca. 1 h 3 Azo-bis(isobutyronitril) = AIB otolyse: Die Bindungsdissoziationsenergie kann auch durch otonen aufgebracht werden. λ = 300 nm (UV) 400 nm (violett) 600 nm (orange) E = hν 400 kj mol kj mol kj mol 1 otwendigkeit der Absorption! hν Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 7
8 1.2.3 Redox-Reaktionen R--- Fe 2 a : a Reduktion fl. nach Birch; s. Aromaten-hemie 3 Kolbe Elektrolyse: R : e 1.3 Reaktionen der Radikale Übersicht Verlust der Radikaleigenschaften Bildung neuer Radikale Radikal-Kombinationen.. häufig diffusionskontrolliert (k 2 = 10 9 bis L mol 1 s 1 ) Disproportionierungen Zersetzung von Radikalen bzw. Umlagerungen Addition von Radikalen an Mehrfachbindungen Abspaltung von Atomen durch Radikale R l. Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 8
9 1.3.2 Radikalische alogenierung von Kohlenwasserstoffen In der Grundvorlesung wurde bereits die radikalische hlorierung des Methans besprochen. Kettenstart:.....l.. l... hν oder Δ 2 Δ = 242 kj mol 1 hlor-atom = hlor-radikal Durch ein Lichtquant oder durch Erhitzen auf über 300 wird die Energie aufgebracht, um einzelne hlor-moleküle (l 2 ) in hlor-radikale (l ) zu spalten. Kettenfortpflanzung:. l l.... Δ = 8 kj mol l l l... l Δ = 108 kj mol Methyl-Radikal Summe l l l l 100 kj mol 1 Kettenabbruch:... l l l.. l l... l.. Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 9
10 Warum sind nur hlorierung und omierung nicht aber Fluorierung und Iodierung von Methan durch radikalische Substitution durchführbar? Energien in kj mol 1 X = F l I X 4 X X 2 X 3 X X 2 3 X X ammond-postulat Schnelle exotherme Reaktionen haben einen frühen Übergangszustand (Eduktähnlich). Langsame endotherme Reaktionen haben späten Übergangszustand (Produkt-ähnlich) F. 125 kj mol kj mol 1 früher Übergangszustand später Übergangszustand Selektivität von alogenierungen (s. -1 Vorlesung) hlorierung von Propan Regioselektivität: Von zwei möglichen, ähnlichen Regionen wird eine bevorzugt angegriffen. l hν (25 ) 43% 1-hlorpropan 57% 2-hlorpropan Warum werden 1-hlorpropan und 2-hlorpropan nicht im statistischen Verhältnis der Wasserstoff-Atome gebildet (6 : 2 entspricht 75% : 25%)? Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
11 Δ /kj mol 1 l 10 l. 1-Propyl-Radikal l 20 2-Propyl-Radikal Weil das 2-Propyl-Radikal stabiler ist als das 1-Propyl-Radikal, wird mehr 2-hlorpropan gebildet als aus statistischen Gründen zu erwarten ist. Stabilisierung der Radikale: 3 < prim < sek < tert ach dem ammond-postulat wirkt sich die unterschiedliche Reaktionsenthalpie der exothermen Reaktionen geringfügig auf den Übergangszustand der Wasserstoff-Abspaltungen aus, sodass statt des statistischen Werts für 2-hlorpropan (25%) 57% gebildet werden. omierung von Propan % 91.3% Δ /kj mol Da die Reaktion des omradikals mit den primären und sekundären - Bindungen des Propans endotherm ist, wirkt sich die unterschiedliche Stabilisierung primärer und sekundärer Radikale im späten Übergangszustand der omierung stärker aus als im frühen Übergangszustand der hlorierung. Konsequenz: omierungen sind selektiver als hlorierungen, und es werden nun 91% des vom stabileren Isopropylradikal abgeleiteten 2-ompropans gebildet (statt der statistischen 25%). Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
12 Das Reaktivitäts-Selektivitäts-Prinzip Mit zunehmender Reaktivität von Reaktanten nimmt ihre Selektivität ab. Entgegen früheren Behauptungen, die in vielen Lehrbüchern immer noch vertreten werden, handelt es sich hierbei nicht um einen allgemein gültigen Zusammenhang! Details in Fortgeschrittenen-Vorlesungen! Wenn Sie sich früher schon damit befassen wollen, lesen Sie unseren Aufsatz: Das Reaktivitäts-Selektivitäts-Prinzip: ein unzerstörbarer Mythos der organischen hemie (Angewandte hemie 2006, 118, ). l 2 ΔT l l l 28 % 35 % 24 % 12 % l 2 ΔT 90.4 % 9.0 % 0.34 % 0.17 % hlorierung omierung. R R R 3. R 2 l l.. R 2 l 21 R 3. l 31. Produktverhältnisse bei der hlorierung und omierung von 2-Methylbutan und berechnete Reaktionsenthalpien (Δ r in [kjmol 1 ]), Abbildung aus Angewandte hemie 2006, 118, hemoselektivität: Bevorzugte Reaktion eines Reagenzes mit einer von zwei (oder mehreren) funktionellen Gruppen. hlorierungen haben eine geringe hemoselektivität. Das hlor-radikal differenziert wenig zwischen 4, 3 l und 2 l 2, sodass bei der radikalischen hlorierung von Methan stets ein Gemisch von einfach und mehrfach chlorierten Produkten entsteht. Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
13 Radikalische Substitution an Aromaten KKK = Kälte, Katalysator, Kern -> elektrophile aromatische Substitution SSS = Sonne, Siedehitze, Seitenkette -> radikalische Substitution Bei radikalischer hlorierung: oft mehrfache hlorierung: l l l l l KKK SSS 2,Al 3 2,hv (Elektrophile Aromatische Substitution) es entstehen keine Radikale Daneben spielen polare Effekte eine Rolle -Abstraktion aus Propionsäure l 3 50 : : l ist elektrophiles Radikal 3 ist nucleophiles Radikal Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
14 1.3.4 Synthesebeispiele für radikalische alogenierungen Da im Labor der Einsatz elementaren hlors problematisch ist, verwendet man zur radikalischen hlorierung meist andere hlorierungsmittel, die häufig auch selektiver sind als l 2. hlorierung mit Sulfurylchlorid hlorierung mit tert-butyl-hypochlorit Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
15 omierungen mit elementarem om wurden oben besprochen. Allylbromierung nach Wohl-Ziegler Radikal- Starter Δ BS (-omsuccinimid) Mechanismus: Start: Über verschiedene Wege kann es zur Bildung von om-radikalen kommen. Kette: Warum kommt es nicht zur radikalischen Addition von om an die Doppelbindung? 2 2 Wegen der geringen 2 -Konzentration ist die Reaktion des 2-omcyclohexyl- Radikals mit 2 langsam, sodass das 2-omcyclohexyl-Radikal wieder in die Reaktanten ( und yclohexen) zerfällt. Weitere Details finden Sie im ückner. Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
16 Sulfochlorierung hν 3 l 2 S 2 S l l Kette: 3 l S 2 S l 2 Sulfoxidation hν 2 R 2 S 2 R S R S 2 S 2 Peroxosulfonsäure komplizierter Mechanismus über elektronisch angeregtes S 2 2 S 4 xidation mit 2 R 2 Luft Licht R ydroperoxid Ein aus einer unbekannten Vorstufe entstehendes, strukturell nicht identifiziertes Radikal R greift eine -Bindung mit geringer Bindungsdissoziationsenergie an. Start: R Kette: = R ist wenig reaktiv, greift daher bevorzugt Wasserstoffe in Benzyl-, Allyl-, tert. und α-position zum Sauerstoff an. Bildung von Ether-ydroperoxiden bei Diethylether, Diisopropylether, TF u. ä. Ersatz: ( 3 ) 3 3 (bildet keine Peroxide) Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
17 Peroxid-achweis: mit essigsaurer KI-Lösung bzw. Peroxid-Teststäbchen Zerstörung mit Fe 2 -Salzen Peroxid-Bildung auch bei umol (= Isopropylbenzol), Dekalin, Tetralin. Technischer umol-prozess zur enol-erstellung (ock-umol-verfahren): Δ ydrolyse 3 3 umylhydroperoxid 3 3 Aceton enol albacetal xidation von Aldehyden zu arbonsäuren, z. B. oxidiert Benzaldehyd bereits an der Luft zu Benzoesäure. 2 Ranzigwerden von Fetten Radikal-Additionen an Mehrfachbindungen (s. eigenes Kapitel) Radikalfänger (Radikal-Inhibitoren) reagieren mit reaktiven Radikalen unter Bildung stabilisierter Radikale, die nicht in der Lage sind, Ketten fortzusetzen. R I 2 R Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
18 Wirkungsweise von Vitamin E: Vitamin E R R gefährliches, reaktives Radikal "Zähmung" des reaktiven Radikals als R- Das α-tocopheroxyradikal ist aufgrund von Delokalisierung des ungepaarten Elektrons und Abschirmung des Radikalzentrums durch die Methylgruppen reaktionsträge. Durch Reaktion mit Vitamin kann daraus Vitamin E (α-tocopherol) regeneriert werden Defunktionalisierung durch radikalische Substitutionsreaktionen Dehalogenierungen R al SnBu 3 [AIB] Δ R al SnBu 3 al =, I Start: 3. SnBu 3 3 Kette: R al SnBu 3 R SnBu 3 Die Sn-Bindung in Tributylzinnhydrid ist schwach und lässt sich leicht homolytisch spalten. Da Zinnverbindungen sehr toxisch sind, wird SnBu 3 gerne durch Si(SiMe 3 ) 3 ersetzt. Si(SiMe 3 ) 3 wird auch katalytisch in Gegenwart von ab 4 eingesetzt. Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
19 Deoxygenierung nach Barton-Mcombie R 1. a / S 2 2. MeI 3. Bu 3 Sn / AIB / Δ R Schritte 1 und 2: erstellung der Xanthogenate (Thiokohlensäure-ester) R a S==S S R S 3 I Mechanismus von Schritt 3: Erzeugung von Bu 3 Sn wie oben Kette: S R S 3 SnBu 3 R S S 3 SnBu 3 R SnBu 3 Bei Verwendung von D SnBu 3 kann auf diese Weise eine -Gruppe durch Deuterium ersetzt werden. Eine Variante der Barton-Mcombie-Deoxygenierung, die basische Bedingungen vermeidet (bei der Umsetzung mit S 2 ), verwendet Thiocarbonyl-diimidazol. S S R R Weitere Reaktionen mit SnBu 3 oder Si(SiMe 3 ) 3 wie bei den Xanthogenaten. Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
v = - = - = = k [R] [S]
![v = - = - = = k [R] [S] v = - = - = = k [R] [S]](/thumbs/81/82977406.jpg) Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 4
 Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
II. Halogenalkane, radikalische und nukleophile Substitution
 II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
2 Nucleophile Substitutionen am gesättigten Kohlenstoff
 2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
Struktur von freien Radikalen
 Struktur von freien Radikalen pplung von Elektrospin mit dem 13 -Kern gibt einen Richtwert für den Grad der Pyramidalisierung a a 13 [G] 3 2 F F 2 F 3 2 a 13 [G] 38.5 54.8 148.8 272 47 99 Die Größe der
Struktur von freien Radikalen pplung von Elektrospin mit dem 13 -Kern gibt einen Richtwert für den Grad der Pyramidalisierung a a 13 [G] 3 2 F F 2 F 3 2 a 13 [G] 38.5 54.8 148.8 272 47 99 Die Größe der
Radikale. Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil2
 Radikale Prof. Dr. P. Rademacher rganische Chemie IV CIV-SS2005-Teil2 1. Charakterisierung von Radikalen 2. Darstellung von Radikalen 2.1 Thermolyse 2.2 Photolyse 2.3 Redox-Reaktionen 3. achweis von Radikalen
Radikale Prof. Dr. P. Rademacher rganische Chemie IV CIV-SS2005-Teil2 1. Charakterisierung von Radikalen 2. Darstellung von Radikalen 2.1 Thermolyse 2.2 Photolyse 2.3 Redox-Reaktionen 3. achweis von Radikalen
Herstellung des Benzoldiazoniumchlorids aus Anilin, Natriumnitrit und Salzsäure. Benzoldiazonium-Ion
 Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Alkylwanderungen. Mechanismus: HCl. HCl. Cl β-pinen. Bornylchlorid. OC4_folie185
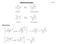 Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
zur Vorlesung "Organische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2002/2003
 J. aub/febr. 200 Klausur zur Vorlesung "rganische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie. Semester" Lösungsbogen WS 2002/200 ) Radikalreaktionen (2 Punkte):
J. aub/febr. 200 Klausur zur Vorlesung "rganische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie. Semester" Lösungsbogen WS 2002/200 ) Radikalreaktionen (2 Punkte):
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Halogenierung von gesättigten Kohlenwaserstoffen
 Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Substituenten-Effekt auf die Orientierung der Zweitsubstituenten Orientierung bei der Toluolsubstitution
 Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Substituenten-Effekt auf die rientierung der Zweitsubstituenten rientierung bei der Toluolsubstitution I_folie215 3 3 3 3 meta para 58 % Nitrierung 4 % 38 % = N 2 N 3 / 2 S 4 Sulfonierung 32 % 6 % 62 %
Bromierung von Cycloalkenen
 hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
+ HBr. Gruppe 2 Pflichtversuch. Fotochemische Halogenierung des Toluols. Reaktion: h ν. Zeitbedarf: Versuchsdurchführung: Nachbereitung
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann
 Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Vortag OC07 Moderne Synthesemethoden Jessica Hilschmann 26.10.2011 1. Definition 2. Was macht ein stabiles Radikal stabil? 3. Kohlenstoffradikale - Gomberg 3.1. Entdeckung 3.2. Stabilisierung 3.3. Verwendung
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
3 Eliminierungen. 3.1 Begriffe und mechanistische Einteilung. Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül
 3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil3. zumeist planar trigonal. planar bis pyramidal, starr oder flexibel (Zwischenstellung)
 adikale Prof Dr P ademacher rganische Chemie IV CIV-SS2005-Teil3 4 Struktur von adikalen C (+) Carbenium-Ion C C (-) adikal Carbanion zumeist planar trigonal planar bis pyramidal, starr oder flexibel (Zwischenstellung)
adikale Prof Dr P ademacher rganische Chemie IV CIV-SS2005-Teil3 4 Struktur von adikalen C (+) Carbenium-Ion C C (-) adikal Carbanion zumeist planar trigonal planar bis pyramidal, starr oder flexibel (Zwischenstellung)
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2018
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2018 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser und Dr. Martin Sumser September
Organische Chemie II Reaktivität
 Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
8 Carbonsäuren und Derivate
 8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
8 arbonsäuren und Derivate 8.1 Allgemeine Darstellungsverfahren xidation primärer Alkohole und Aldehyde (s. Kap. 6) 2 2 xidation durch r 3 /, KMn 4 /, N 3 aloform-eaktion (s. Kap. 9) 3 Br 2 xidation von
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 Carbonylgruppen und eine C=C Doppelbindung.
 rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
Aromatische Kohlenwasserstoffe
 Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
2 Radikalische Substitutionen
 2 Radikalische Substitutionen Wie in der Einleitung besprochen, ist für eine chemische Reaktion eines gesättigten Moleküls ein Bindungsbruch notwendig. Eine Einfachbindung kann homolytisch oder heterolytisch
2 Radikalische Substitutionen Wie in der Einleitung besprochen, ist für eine chemische Reaktion eines gesättigten Moleküls ein Bindungsbruch notwendig. Eine Einfachbindung kann homolytisch oder heterolytisch
Organische Chemie II Reaktivität
 Klausur zur Vorlesung rganische Chemie II Reaktivität Sommersemester 2009 Wiederholungsklausur WiSe 2008/09 Klausur am 3.4.2009 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer)
Klausur zur Vorlesung rganische Chemie II Reaktivität Sommersemester 2009 Wiederholungsklausur WiSe 2008/09 Klausur am 3.4.2009 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer)
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Organische Chemie, Reaktionsmechanismen
 , Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
, Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Aromatische Substitution. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse
Prof. Dr. P. Rademacher Organische Chemie IV
 Prof. Dr. P. Rademacher Organische hemie IV arbokationen 1. Nomenklatur arbokationen = alle kationischen -Verbindungen Beispiele:,, 2, 3, 4, 5. Im Massenspektrum von than bei hohem Druck findet man Peaks
Prof. Dr. P. Rademacher Organische hemie IV arbokationen 1. Nomenklatur arbokationen = alle kationischen -Verbindungen Beispiele:,, 2, 3, 4, 5. Im Massenspektrum von than bei hohem Druck findet man Peaks
Übung: Alkene & Alkohole HS-07
 kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
Organische Chemie für Biologen und Nebenfächler Übungsaufgaben für die Klausur
 rganische Chemie für Biologen und Nebenfächler Übungsaufgaben für die Klausur Aufgabe 1: Sie wollen Fettflecken von ihrem Kleidungsstück entfernen. Man gibt Ihnen als Fleckenentferner folgende Chemikalien
rganische Chemie für Biologen und Nebenfächler Übungsaufgaben für die Klausur Aufgabe 1: Sie wollen Fettflecken von ihrem Kleidungsstück entfernen. Man gibt Ihnen als Fleckenentferner folgende Chemikalien
Übungen Kapitel 1 Alkane- Radikalische Substitution
 Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Übungen Kapitel 1 Alkane- Radikalische Substitution 1. Ein Gemisch aus Halogen und Alkan reagiert bei Bestrahlung mit UV- Licht oder höheren Temperaturen (Bsp. die Gase Methan und Chlor erst bei 250-400
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
Gruppe 3 Pflichtversuch. Umsetzung von Cyclohexan und Cyclohexen mit Bromwasser. Menge R-Sätze S-Sätze Gefahrensymbole. 300 ml /38
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 3 Pflichtversuch Umsetzung von Cyclohexan
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 3 Pflichtversuch Umsetzung von Cyclohexan
Versuch: Reaktivität von primären, sekundären und tertiären Alkylbromiden gegenüber ethanolischer Silbernitratlösung. keine Reaktion.
 Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Philipps-Universität Marburg 15.01.2008 rganisches Grundpraktikum (LA) Katrin Hohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 5, Halogenalkane Versuch: Reaktivität von primären, sekundären
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Chemie Alkohole, Aldehyde & Ketone, Carbonsäuren
 Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Alkohole hemie Alkohole, Aldehyde & Ketone, arbonsäuren Alkohole erkennt man aufgrund ihrer funktionellen Gruppe, die ydroxy-gruppe. Diese ist Polar, der Rest ist unpolar. Benannt wird der Alkohol nach
Vorlesung 8. Andere radikalische Halogenierungen von Methan Aus den Bindungsdissoziationsenergien der Halogene
 Vorlesung 8 Andere radikalische alogenierungen von Methan Aus den Bindungsdissoziationsenergien der alogene F F 155 kj mol 1 Br Br 192 kj mol 1 Cl Cl 242 kj mol 1 I I 150 kj mol 1 und den in Vorlesung
Vorlesung 8 Andere radikalische alogenierungen von Methan Aus den Bindungsdissoziationsenergien der alogene F F 155 kj mol 1 Br Br 192 kj mol 1 Cl Cl 242 kj mol 1 I I 150 kj mol 1 und den in Vorlesung
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2016
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2016 Aromatische Substitution Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2016 Gruppe A
Anorganische Peroxide und Radikale. von Benjamin Scharbert
 Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
Anorganische Peroxide und Radikale von Benjamin Scharbert Inhalt: 1. Anorganische Peroxide: 2. Radikale: 1.1 Grundsätzliches 1.2 Na 2 O 2 1.3 BaO 2 1.4 H 2 O 2 2.1 Grundsätzliches 2.2 Sauerstoff 2.3 Stickstoffmonoxid
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Reaktionen der Alkene
 Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Organische Chemie II Reaktivität
 1. Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 14.12.2007 (ame, Vorname) im. Fachsemester (tudiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme 1. Wiederholung
1. Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 14.12.2007 (ame, Vorname) im. Fachsemester (tudiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme 1. Wiederholung
Aldehyde und Ketone. Aldehyde C 2 H 5 H 3 C. H Propanal Propionaldehyd. H Ethanal Acetaldehyd. H Methanal Formaldehyd. Benzaldehyd.
 Aldehyde und Ketone Aldehyde Methanal Formaldehyd 3 Ethanal Acetaldehyd 2 5 Propanal Propionaldehyd Benzaldehyd Ketone 3 3 2 5 Propanon Aceton 3 2 5 2-Butanon 2 5 3-Pentanon Acetophenon 3 Natürliche Aldehyde
Aldehyde und Ketone Aldehyde Methanal Formaldehyd 3 Ethanal Acetaldehyd 2 5 Propanal Propionaldehyd Benzaldehyd Ketone 3 3 2 5 Propanon Aceton 3 2 5 2-Butanon 2 5 3-Pentanon Acetophenon 3 Natürliche Aldehyde
H = kj/mol. DH = +435 kj/mol
 4. REAKTIONEN DER ALKANE Die in diesem Teil verwendeten Abbildungen stammen aus: K. P. C. Vollhardt, N. E. Schore, Organische Chemie, 4. Auflage, Wiley-VCH. Homolytischer und heterolytischer Bindungsbruch
4. REAKTIONEN DER ALKANE Die in diesem Teil verwendeten Abbildungen stammen aus: K. P. C. Vollhardt, N. E. Schore, Organische Chemie, 4. Auflage, Wiley-VCH. Homolytischer und heterolytischer Bindungsbruch
Grundwissen Chemie Mittelstufe (10 MNG)
 Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Grundwissen hemie Mittelstufe (10 MNG) Marie-Therese-Gymnasium Erlangen Einzeldateien: GW8 Grundwissen für die 8. Jahrgangsstufe GW9 Grundwissen für die 9. Jahrgangsstufe (MNG) GW9a Grundwissen für die
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2017 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität
 13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
Synthesen von Carbonsäuren: industrielle Verfahren
 Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Grundlagen der Organischen Chemie
 Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
Vergleichende Reaktionsmechanismen
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Vergleichende Reaktionsmechanismen 1. rdnen Sie die angegebenen Reaktionen einem Reaktionstyp zu und formulieren Sie den Reaktionsmechanismus. Radikalische
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Vergleichende Reaktionsmechanismen 1. rdnen Sie die angegebenen Reaktionen einem Reaktionstyp zu und formulieren Sie den Reaktionsmechanismus. Radikalische
Lösungen 2.Übungsblatt SS NBS, AIBN Br K +
 Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner Kap. 6 Nucleophile Substitutionsreaktionen (außer durch Enolate) am Carboxyl-Kohlenstoff Dr. Hermann A. Wegner hermann.wegner@unibas.ch
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner Kap. 6 Nucleophile Substitutionsreaktionen (außer durch Enolate) am Carboxyl-Kohlenstoff Dr. Hermann A. Wegner hermann.wegner@unibas.ch
Chemisches Praktikum für Biologen
 Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
Chemisches Praktikum für Biologen Klausur am 13.02.2017 Die Klausur besteht aus 10 Seiten. Bitte zu den folgenden Aufgaben die jeweils richtige Antwort (A, B, C, D) bzw. den berechneten Wert (ohne Maßeinheit)
Klausur zur Vorlesung Allgemeine Chemie II (Organische Chemie) für Studierende der Agrarwissenschaften und der Ökotrophologie. Wintersemester 2002/03
 Klausur zur Vorlesung Allgemeine hemie II (rganische hemie) für Studierende der Agrarwissenschaften und der Ökotrophologie Wintersemester 2002/03 Name: Studienfach: Korrekturbogen Matrikelnummer: Ich versichere,
Klausur zur Vorlesung Allgemeine hemie II (rganische hemie) für Studierende der Agrarwissenschaften und der Ökotrophologie Wintersemester 2002/03 Name: Studienfach: Korrekturbogen Matrikelnummer: Ich versichere,
Seminar zum Organisch-Chemischen Praktikum für Biologen Sommersemester 2017
 Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017 Die Übungsfragen
Seminar zum rganisch-chemischen Praktikum für Biologen Sommersemester 2017 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Prof. Dr. asmus Linser September 2017 Die Übungsfragen
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Chemie für Biologen WS 2005/6 Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen (Teil 5: )
 Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
Chemie für Biologen WS 2005/6 Arne Lützen Institut für rganische Chemie der Universität Duisburg-Essen (Teil 5: 23.11.2005) Kovalente Bindung Atome können sich Valenzelektronen unter Ausbildung von Bindungen
O + + R' Die langsamere Weiterreaktion des Sulfoxids führt zum Sulfon:
 6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
Organische Chemie 1 Teil 2
 Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Carbonsäuren (Vollhardt, 3. Aufl., S. 893 ff, 4. Aufl., S. 967 ff; Hart, S. 345 ff; Buddrus, S. 501 ff)
 Vorlesung 39 arbonsäuren (Vollhardt, 3 Aufl, S 893 ff, 4 Aufl, S 967 ff; art, S 345 ff; Buddrus, S 501 ff) Die funktionelle Gruppe der arbonsäuren (= Fettsäuren) ist die arboxyl- (bzw arboxy-) Gruppe In
Vorlesung 39 arbonsäuren (Vollhardt, 3 Aufl, S 893 ff, 4 Aufl, S 967 ff; art, S 345 ff; Buddrus, S 501 ff) Die funktionelle Gruppe der arbonsäuren (= Fettsäuren) ist die arboxyl- (bzw arboxy-) Gruppe In
Seminar zum Organisch-Chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016. Oxidation und Reduktion. Dr. Florian Achrainer AK Zipse
 Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse März
Seminar zum rganisch-chemischen Praktikum für Lehramtsstudierende Wintersemester 2015/2016 xidation und eduktion Sicherheitsbelehrung: egeln für das Arbeiten im Labor Dr. Florian Achrainer AK Zipse März
Organische Chemie III
 rganische Chemie III Wintersemester 2008/09 Technische Universität München Nachholklausur am 10.10.2008 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
rganische Chemie III Wintersemester 2008/09 Technische Universität München Nachholklausur am 10.10.2008 Name, Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl....
Chemie für Biologen WS 2005/6. Arne Lützen Institut für Organische Chemie der Universität Duisburg-Essen
 hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
hemie für Biologen WS 2005/6 Arne Lützen Institut für Organische hemie der Universität Duisburg-Essen (Teil 10: Organische hemie gesättigte Kohlenwasserstoffe) Sonderstellung des Elements Elektronegativität
Diene: C n H 2n-2 : 2 Doppelbindungen
 Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Homologe Reihe der unverzweigten Alkane C n H (2n+2)
 Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
Organische hemie I 3.01 Homologe Reihe der unverzweigten Alkane n H (2n+2) (Paraffine) (veraltet: normale Alkane = n-alkane) Name Konstitution Siedepunkt ausführliche Schreibweise Stenographie [ ] Methan
Versuchsprotokoll. Reaktivität von Alkylbromiden. Gruppe 5, Typ: Pflichtversuch. AgBr + HNO 3 + H 3 C C C C. AgBr + HNO 3 +
 Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktivität von Alkylbromiden Gruppe
Anna-Lena Eicke Philipps-Universität Marburg rganisch-hemisches Praktikum (LA) Leitung: Dr. Reiß WS 08/09 20.11.08 Schulversuche Assistentin: Beate Abé Versuchsprotokoll Reaktivität von Alkylbromiden Gruppe
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1
 Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
Organische Chemie 1 SS2011 Tutorium Übungsblatt 12 Seite 1 1) Ordnen Sie die folgenden aromatischen Verbindungen nach steigender Reaktivität in der elektrophilen aromatischen Substitution. Chlorbenzol,
1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Klausur - Lösungsbogen
 Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Prof. Dr. J. Daub Februar 2005 Klausur - Lösungsbogen zur Vorlesung "rganische Chemie II (Reaktionen, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2004/2005 14. Februar
Die Herstellung von Alkenen aus Chloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen.
 Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. O R 3
 Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. 1 2 [ ] 2 3 2 oder 3 [ 3 ] ' '' Amid, wenn '' =, Alkyl, Aryl 2 ydrazid ydroxamsäure (geringere eaktionsgeschwindigkeiten
Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. 1 2 [ ] 2 3 2 oder 3 [ 3 ] ' '' Amid, wenn '' =, Alkyl, Aryl 2 ydrazid ydroxamsäure (geringere eaktionsgeschwindigkeiten
1. Bei den folgenden Stoffumwandlungen handelt es sich um typische Reaktionen der organischen Chemie.
 rganische hemie E 102 Aufgaben 7 1. Bei den folgenden Stoffumwandlungen handelt es sich um typische Reaktionen der organischen hemie. 2 /Na Na + Et Et / KN N 2 Um welche Reaktionen handelt es sich? 1.
rganische hemie E 102 Aufgaben 7 1. Bei den folgenden Stoffumwandlungen handelt es sich um typische Reaktionen der organischen hemie. 2 /Na Na + Et Et / KN N 2 Um welche Reaktionen handelt es sich? 1.
Organische Chemie für Mediziner WS 2016/2017. Übungsblatt 3: Ausgewählte Substanzklassen
 1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
1 rganische hemie für Mediziner WS 2016/2017 Übungsblatt 3: Ausgewählte Substanzklassen 01 Die Siedetemperatur von Alkoholen unterscheidet sich deutlich von der ungefähr gleich schwerer Alkane (z.b. 3
