Struktur von freien Radikalen
|
|
|
- Christin Sachs
- vor 5 Jahren
- Abrufe
Transkript
1 Struktur von freien Radikalen pplung von Elektrospin mit dem 13 -Kern gibt einen Richtwert für den Grad der Pyramidalisierung a a 13 [G] 3 2 F F 2 F 3 2 a 13 [G] Die Größe der Kopplungskonstante hängt vom s-harakter des ybrid-rbitals ab. a 13 a 13 = 1110 G (Elektron in reinem s-rbital) sp 3 : ¼ s ¾ p: a 13 (ber.) = ¼ 1110 = 277.5
2 Substituenteneffekte Pyramidale Radikalzentren: F l 2 F 2 l 2 F F F l 2 F l F l auptprodukt F l F l Brückenkopf-Radikale yclopropylradikal Konformation recht stabil omoallyl-yclopropylmethyl-umlagerung 2 25 k 1 = s -1 k 2 omoallyl Allyl D 2 k 2 = s -1 D D 2 0 f: f = 7.9 kcal/mol D 2 D 2 G = -RT ln K = -RT ln k 1 k 2 = ln = 6.6 kcal/mol
3 Reaktionen mit freien Radikalen als Intermediaten (sp 3 -hybridisierte Systeme) (Verlust der Stereochemie am Radikalzentrum) 1) 3 l optisch aktiv hν l 2 l 2 3 l l 2 - l 3 l l Racemat (2) 3 ( 3 ) optisch aktiv t-bu - t-bu ( 3 ) ( 3 ) Decarbonylierung R - R ( 3 ) 2 2 Racemat ) optisch aktiv l T - l ( 3 ) 2 3 R l - R 3 l Racemat
4 Reaktionen mit freien Radikalen als Intermediale (sp 2 -hybridisierte Systeme) T - 2 tbu - tbu tbu ( 3 ) 2 - ( 3 ) 2 stereounspezifische Reaktion Jedoch: n-buli 2 Br Li Konfiguration stabil stereospezifische Reaktion
5 Kinetische Daten für Radikal-Rekombinationen 2 R k R R (in der Gasphase) Bimolekulare, stoßkontrollierte Reaktion in der Gasphase: k exp (0.0 kcal/mol/rt) (Erwartungswert) Reaktion k exp [M -1 s -1 ] log A E A [kcal/mol] (9.6±1.0) 8.4 0±0.2 2 ( 3 ) 2 ( 3 ) 2 ( 3 ) 2 10 (8.6±1.0) n.b. n.b. 2 ( 3 ) 3 ( 3 ) 3 ( 3 ) 3 10 (5.4±1.5) n.b. ca n.b. = nicht bekannt
6 Generierung von freien Radikalen omolytische Bindungsdissoziation: A B A B D A B kcal/mol Rekombination: k = M -1 s -1 (400, Gasphase) eterolytische Bindungsdissoziation: A B A B R = 314 kcal/mol (Gasphase) [A B] A B yperfläche der potentiellen Energie D (A B) A B Reaktionskoordinate Bindungsabstand: d
7 Mittlere Bindungsdissoziationsenergien D [kcal/mol] D [kcal/mol] ca ca. 39 ca. 90 l l 58 ca. 80 Br Br 46 l ca. 80 I I 36 Br I ca. 50
8 Berechnung von - und -Bindungsdissoziationsenergie [in kcal/mol] mit ilfe von Bildungsenthalpien der freien Radikale D (R ) = f (R ) f ( ) - f (R ) D (R R) = 2 f (R ) - f (R R) R f (R ) f (R ) f (R R) D (R ) D (R R) ( 3 ) ( 3 ) * ) * ) Minimalwert (ohne Berücksichtigung der zusätzlichen Aktivierungsbarrieren der Radikal-Rekombination (E A 9 kcal/mol)
9 Berechnung von - und -Bindungsdissoziationsenergie [in kcal/mol] für resonanzstabilisierte Radikale R f (R ) f (R ) f (R R) D (R ) D (R R) Allyl Benzyl Pentadienyl Allylstabilisierungsenergie: ASE = D 1 -D D 1 = D 2 = Benzylstabilisierungsenergie: BSE = D 1 -D 3 ASE = = 13.5 kcal/mol BSE = (D 3 ) = 10.1 kcal/mol Pentadienylstabilisierungsenergie: PSE = D 1 - D 4 bzw. D 1 - D 5 PSE 1 = (D 4 ) = 17.3 kcal/mol PSE 2 = (D 5 ) = 22.2 kcal/mol
10 adikalische Substitution: Beispiel: Alkan-hlorierung R l 2 R l l l 2 T 2 l 58 kcal/mol (D ) Für den Fall, dass D E A ; A s -1 (Dissoziation) ist k = Ae -E /RT A bei 25 = 298 K: k = e = s -1 bei 500 = 773 K: k = e = s -1 : τ ½ = 17s l 2 hν 2 l Start l R R l R l 2 R l l Kette 2 l l 2 2 R R R Termination R l R l Initiatoren zum Start von Kettenreaktionen T D 33 kcal/mol Benzoylperoxid enyl-radikal Azoisobutyronitril (AIB) T D = 31 kcal/mol
11 Präparative Methoden a) Silicium-Methode t-butylperoxid hν 2 (Initiator) Et 3 Si Et 3 Si Et 3 Si R Br Et 3 Si Br R R Et 3 Si langsam R Et 3 Si Mit dieser Methode lässt sich eine kleine stationäre Konzentration von R herstellen, z.b. für ESR-Messungen b) Zinn-Methode Bu 3 Sn hν oder AIB, T Bu 3 Sn Start Tri-n-butylzinnhydrid Bu 3 Sn R X Bu 3 Sn X R X = l, Br, I (1) R Bu 3 Sn Bu 3 Sn R Wasserstoff-Transfer R R Y Y (2) Y Bu 3 Sn R R Addition Y Bu 3 Sn Wenn Reaktion (2) schneller als (1) dann ist das Additionsprodukt auptprodukt.
12 c) Quecksilber-Methode R gx ab 4 R g bisher noch nicht isoliert R g Init R g Init Init =, g R g R g R R R g k 10 7 M -1 s -1 Da [R-g] sehr klein ist, kann die Addition mit dem Wasserstoff-Tranfer Y Y R konkurrieren, R Y Y R g R g R R Synthese von R-gX (X = l, Br, I, Ac) (1) R X Mg R MgX gx 2 R gx - MgX (Grignard-Reaktion) 2 (2) R 1 R 2 B 2 6 /TF oder 2 B R 1 R 2 B g(ac) 2 B Ac R 1 R 2 gac (3) R 1 R 2 g(ac) 2 R (R =, Alkyl) R 1 R 2 2 gac R (ydroxy- bzw. Alkoxy- Merkurierung) Beispiel: ( 6 11 ) 2 B B( 6 11 ) 2 1) gac 2) ab 4,
13 X Y Y 6 11 X Ausbeute Alken Quecksilber-Methode a) Zinn-Methode b) l l a) 6 11 gac / ab 4 ; b) 6 11 I / Bu 3 Sn
14 Diastereoselektive Synthese R 1 R 2 X R 1 R 2 n-bu 3 Sn Me 2 2 Me n-bu 3 Sn Me 2 2 Me -n-bu 3 Sn Lewis-Säure: MgBr 2 Et 2 Me 2 R 1 R 2 2 Me Me 2 R 1 R 2 2 Me anti syn R 1 =Me, R 2 = t-bu : 52 : 48 (ohne Zusatz von Lewissäure) 2 : 98 (mit Zusatz von Lewissäure) R 2 R 1 Me Mg Br Br syn n-busn Me J. Metzger et al. J. Am. hem. Soc. 2000, 122, Übersicht: achrichten aus der hemie 2002, 3, 294
15 Weitere Reaktionen über freie Radikale Sandmeyer-Reaktion: Ar X u X Ar - 2 Ar - u X Ar X Arendiazoniumsalz u 2 2 X u 2 2 X X = l, Br, Kolbe-Elektrolyse: 2 R Anodische xidation - 2 e 2 R ohe Ausbeute an Dimeren R R R gekreuzte Kolbe-Elektrolyse möglich (eine Komponente im Überschuß) R 1 R 2-2 e R 1 R 2 Beispiele: eromon-synthesen 3 ( 2 ) 7 ( 2 ) 7 ( 2 ) 5 3 Ölsäure eptansäure intramolekular: - 2 2
16 Abbau von Säurechlorid: R l R R R l - l S S Anion von -ydroxypyridin-2-thion Bu 3 Sn (aus Bu 3 Sn- Initiator) R S SnBu 3 - R - 2 R Bu 3 Sn R Bu 3 Sn S SnBu 3 Ar l Ar Br (Arylbromide) Ar S l 3 (aus Br-l 3 Initiator) (2) Ar (1) S - S l 3 Ar - 2 Brl 3 Ar Br l 3 l 3
17 Radikalische Substitution alogenierung: l l l 2, hν (l wenig selektiv) l S 2 l 2 () l S 2 l Br 2 hν Br (Br wesentlich selektiver) Br 2 Br 2 hν 2 Br (Benzyl-Bromierung) Br Br Br AIB oder () 2 Allylbromierung (BS) t-bul hν (-78 ) l l Allylchlorierung
18 Radikalische Substitution Autooxidation: In R In R R 3 2 R R R R 3 2 u.s.w. 3 2 (In.) umol umolhydroperoxid enol Aceton Tetralin 3 2 (In.)
19 Addition von X-l 3 (X = l, Br) X l 3 In -In X l 3 2 R 2 l 3 R X l 3 2 R - l 3 l 3 X regiospezifisch Stereochemie: Br l 3 hν Br l 3 trans 55 : 45 cis Br l 3 l 3 flexibel l 3 l 3 exo trans Br Br anti (axial) l 3 l 3 sterisch fixiert
20 Barton-Reaktion: Funktionalisierung von entfernten Alkylgruppen X X = l l hν R l - X - R X = xim xim 2 / - 2 ydroxyaldehyd
21 Funktionalisierung von Steroiden l 3 hν 3 Ac Ac Ac
22 Anwendung: Permethrin-Säure-Synthese 2 hrysanthemumsäure: Ester sind die Inhaltsstoffe einiger hrysanthemenarten mit stark insektizider Wirkung. l l 2 Permethrin hochwirksame Insektizide gehört zur Familie der Pyrethroide (ca 1/100 der Menge von normalen ophorsäureestern ist erforderlich) 2 Et l 4 (In ) l 3 l 2 Et Base - l l 3 2 Et l - l 2 Et l Permethrinsäure
23 Synthese der 3,3-Dimethyl-4-pentensäureester Prenol Et Et Et Et Et rthoessigsäure Et Et Et - Et - Et laisen- Umlagerung sigmatrope [3,3] - Verschiebung Et 2 Et
24 Spaltung von Peroxyverbindungen R 1 R 2 T Dialkylperoxid R 1 R 2 --Bindung ist schwach, d.h. die Bindungsspaltung erfolgt schon bei niedrigen Temperaturen (<100 ) R 1 R 2 Diacylperoxid T R 1 R schnell R 1 R 2 R 1 R 2 stufenweise R 1 R 2 Zwischenstufen - 2 R 1 R 2 konzertiert R 1 R 2 Übergangszustand stufenweise: = 37.4 kcal/mol, S = 17 cal/kmol konzertiert: = 28.1 kcal/mol, S = 3.9 cal/kmol
25 Spaltung von Azoverbindungen konzertiert R 2 R 1 R 1 R 2 R 1 R 2 stufenweise R 1 R 2 bzw. R 1 R 2 Übersicht: P. S. Engel, hem. Rev. 1980, 80, 90
26 Aktivierungsparameter für die 2 -Eliminierung von Azoverbindungen [kcal/mol] S [cal/mol K] ( 3 ) 2 ( 3 ) 2 ( 3 ) 3 ( 3 ) bis bis bis
27 Reaktionen im Lösungsmittelkäfig D 3 3 D 3 1 : 2 : 1 Gasphase 3 3 D 3 D 3 1:1-Mischung in Lösung Lösungsmittelkäfig D 3 D D 3 D D 3 D 3 D 3 bei Diffusion aus dem Lösungsmittelkäfig AIB in Lösung Käfig ca. 20% % 3 3 2S
28 Me Et anti-1 optisch aktiv achweis des stufenweisen Zerfalls bei unsymmetrisch substituierten Azoverbindungen hν Et Me hν hν Me Et syn-1 optisch aktiv hν Me Me Et Et anti-ent-1 syn-ent-1 Partielle Racemisierung der Ausgangsprodukte bei nicht vollständigem Umsatz. hν Turn-around -Produkt 600 keine Reaktion jedoch: Quelle für die erstellung von enylradikalen
29 Resonanzstabilisierung von Radikalen P n
30 yclisierung von freien Radikalen (Baldwin-Regel) Konkurrenz der Bildung von Fünf- und Sechsringen R R R R R R R = : 98 : 2 R = 3 : 99 : 1 33 : 66 Angriff des Radikals auf das disubstituierte sp 2 - Atom sterisch gehindert X X X =, Si( 3 ) 2 X Y X Y X Y kinetisch kontrolliert (wird schneller gebildet) thermodynamisch kontrolliert (ist stabiler), auptprodukt X, Y =, 2 Me
31 yclisierung von freien Radikalen: Konkurrenz der Bildung von Sechs- und Siebenringen bzw. Sieben- und Achtringen 90 : 10 <1 : 100 Erklärung der Baldwin-Regel SM R π* bzw. repulsive WW zwischen SM und LUM LUM exo-trig gut endo-trig schlecht jedoch: R LUM sym. π-komplex M endo bevorzugt
32 Vergleich der Ringbildung über Radikal- und arbokation-zwischenstufen I Bu 3 Sn Initiator Bu 3 Sn - Bu 3 Sn Ausbeute 60% - 2 F 3 F 3 R 1, R 2 = 3, F 3 R 1 R 2 3 3
Cyclisierung von freien Radikalen (Baldwin-Regel) Konkurrenz der Bildung von Fünf- und Sechsringen
 yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
yclisierung von freien adikalen (Baldwin-egel) Konkurrenz der Bildung von Fünf- und Sechsringen 4_folie048 + + = : 98 : 2 = 3 : 99 : 1 33 : 66 Angriff des adikals auf das disubstituierte sp 2 - Atom sterisch
Alkylwanderungen. Mechanismus: HCl. HCl. Cl β-pinen. Bornylchlorid. OC4_folie185
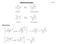 Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Alkylwanderungen 4_folie185 l l amphen Isobornylchlorid l l β-pinen Bornylchlorid Mechanismus: l l l l Pinakol-Umlagerung 4_folie186 2 + - 2 2-2 + 3 3 3 1,2-3 ~ 3 3 3 3 3 3 3 3 3-3 ( 3 ) 3 Dienon-Phenol-Umlagerung
Lösungen 2.Übungsblatt SS NBS, AIBN Br K +
 Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Lösungen 2.Übungsblatt 2002 1. Aufgabe: ubstitutionsreaktionen NB, AIBN racemisch Erklärung: Die radikalische ubstitution erfolgt wegen der hohen elektivität des omatoms am tertiären (und zugleich auch
Radikale. Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil2
 Radikale Prof. Dr. P. Rademacher rganische Chemie IV CIV-SS2005-Teil2 1. Charakterisierung von Radikalen 2. Darstellung von Radikalen 2.1 Thermolyse 2.2 Photolyse 2.3 Redox-Reaktionen 3. achweis von Radikalen
Radikale Prof. Dr. P. Rademacher rganische Chemie IV CIV-SS2005-Teil2 1. Charakterisierung von Radikalen 2. Darstellung von Radikalen 2.1 Thermolyse 2.2 Photolyse 2.3 Redox-Reaktionen 3. achweis von Radikalen
2 Nucleophile Substitutionen am gesättigten Kohlenstoff
 2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
2 ucleophile Substitutionen am gesättigten Kohlenstoff 21 Allgemeiner eaktionsablauf X Y: Y X: allgemeiner: Substrat ucleophil Produkt ucleofug Elektrophil ucleophil Elektrophil ucleophil ucleophile: Anionen
D D. D endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% p = 6.8 kbar: 72.0 : 27.0 : <1.0 cis-stereoselectivity: >99%
 4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
4_folie100 [4 + 2] endo-cis exo-cis trans p = 1 bar: 58.4 : 38.6 : 3.0 cis- stereoselectivity: 97% + 120 p = 6.8 kbar: 72.0 : 27.0 : 99% V (endo-exo) -2.5 cm 3 /mol [2 + 2]
Konzertierte Reaktionen
 Konzertierte Reaktionen. Elektrocyclische Reaktionen 2. Sigmatrope Umlagerungen 3. Cycloadditionen Definition: Konzertierte Reaktionen laufen in einem Schritt ab, so dass nur ein Übergangszustand und keine
Konzertierte Reaktionen. Elektrocyclische Reaktionen 2. Sigmatrope Umlagerungen 3. Cycloadditionen Definition: Konzertierte Reaktionen laufen in einem Schritt ab, so dass nur ein Übergangszustand und keine
Markownikow-Addition ionisch, zwei Stufen A E. + H-Br dunkel polares LM. anti-markownikow-addition radikalisch, Kettenreaktion A R.
 Prof Dr P ademacher rganische hemie IV Addition von -Br an Alkene IV-SS2005-Teil5 + -Br dunkel polares LM 3 Br A E Markownikow-Addition ionisch, zwei Stufen Licht oder --- Br 2 2 A anti-markownikow-addition
Prof Dr P ademacher rganische hemie IV Addition von -Br an Alkene IV-SS2005-Teil5 + -Br dunkel polares LM 3 Br A E Markownikow-Addition ionisch, zwei Stufen Licht oder --- Br 2 2 A anti-markownikow-addition
Prof. Dr. H. Hauptmann Übungen zur Vorlesung Organische Chemie II für Studierende des Lehramtes und der Biologie (3. Sem.)
 Prof. Dr.. auptmann Übungen zur Vorlesung rganische hemie II für Studierende des Lehramtes und der Biologie (3. Sem.) Lösungsbogen zu Übungsblatt 7, Diels-Alder-Reaktionen und Dihydroxylierung von Doppelbindungen
Prof. Dr.. auptmann Übungen zur Vorlesung rganische hemie II für Studierende des Lehramtes und der Biologie (3. Sem.) Lösungsbogen zu Übungsblatt 7, Diels-Alder-Reaktionen und Dihydroxylierung von Doppelbindungen
Organische Chemie 2. Skript. zur. Vorlesung. Wintersemester 2010/2011. Prof. H. Mayr
 Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
Skript zur Vorlesung rganische hemie 2 Wintersemester 2010/2011 Prof.. Mayr Prof.. Mayr, LMU München, -2 Vorlesung im WS 2010/2011 1 Liebe Studierende, ein Vorlesungsskript kann und soll nicht ein gutes
II. Halogenalkane, radikalische und nukleophile Substitution
 II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
II. alogenalkane, radikalische und nukleophile Substitution Experimentelle Beobachtung: 36 n-c 6 14 RT n-c 6 13 Br + Br Allgemein formuliert: R- Br 2 -Br R-Br Wie geht das? 37 Mechanismus am besten mit
Vorlesung Organische Chemie II, Teil 2, SS Quickie Nr. 1: Radikalreaktionen und aromatische Substitution
 Vorlesung rganische Chemie II, Teil 2, SS 2009 Prof. Dr. C. Christoph Tzschucke Quickie Nr. 1: Radikalreaktionen und aromatische Substitution Aufgabe 1. Geben sie für die folgenden Bindungen jeweils Bindungsenergie
Vorlesung rganische Chemie II, Teil 2, SS 2009 Prof. Dr. C. Christoph Tzschucke Quickie Nr. 1: Radikalreaktionen und aromatische Substitution Aufgabe 1. Geben sie für die folgenden Bindungen jeweils Bindungsenergie
Organische Chemie III
 1 rganische hemie III Sommersemester 2003 Technische Universität München Klausur am 16.07.2003 Name; Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
1 rganische hemie III Sommersemester 2003 Technische Universität München Klausur am 16.07.2003 Name; Vorname... Matrikel-Nr.... (Druckbuchstaben) geboren am... in... Studiengang (Diplom/ Bachelor)......
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
1. Gruppe: Nucleophile Substitution
 1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
1. Gruppe: ucleophile ubstitution 1 1. ubstitutionstypen: C Y C Y Klassifizierung der ubstitution je nach atur von Y: - Y kann ein ukleophil sein: (ersetzt das ukleophil => Lewis - Base): δ δ a, 3, BuMg
Reaktionen der Alkene
 Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Addition an die π-bindung eaktionen der Alkene CI_folie144 C C X Y C C X Y 1) Katalytische ydrierung von Alkenen Beispiele: Katalysator C C Pt C C C C C C C C C C C C, 5 C C -Methyl--hexen (Lösungsmittel)
Klausur-Wiederholung (Lösungsbogen)
 Prof. Dr. J. Daub 28. März 2003 KlausurWiederholung (Lösungsbogen) zur Vorlesung "rganische hemie II (Aliphaten, Reaktionsmechanismen) für tudierende der hemie und der Biochemie 3. emester" W 2002/2003
Prof. Dr. J. Daub 28. März 2003 KlausurWiederholung (Lösungsbogen) zur Vorlesung "rganische hemie II (Aliphaten, Reaktionsmechanismen) für tudierende der hemie und der Biochemie 3. emester" W 2002/2003
Halogenalkane. Radikalische Halogenierung von Alkanen. Addition von Halogenwasserstoffen an Alkene. H 3 C + HBr H C C C H.
 alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
alogenalkane erstellung: adikalische alogenierung von Alkanen + l + l + l l l + l Addition von alogenwasserstoffen an Alkene 3 Br + Br 3 Nucleophile Substitution an Alkylhalogeniden Nucleophil Elektrophil
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
Organische Chemie III
 1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
1 rganische Chemie III Sommersemester 2004 Technische Universität München Klausur am 28.07.2004 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Prof. Dr. P. Rademacher Organische Chemie IV OCIV-SS2005-Teil3. zumeist planar trigonal. planar bis pyramidal, starr oder flexibel (Zwischenstellung)
 adikale Prof Dr P ademacher rganische Chemie IV CIV-SS2005-Teil3 4 Struktur von adikalen C (+) Carbenium-Ion C C (-) adikal Carbanion zumeist planar trigonal planar bis pyramidal, starr oder flexibel (Zwischenstellung)
adikale Prof Dr P ademacher rganische Chemie IV CIV-SS2005-Teil3 4 Struktur von adikalen C (+) Carbenium-Ion C C (-) adikal Carbanion zumeist planar trigonal planar bis pyramidal, starr oder flexibel (Zwischenstellung)
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
Chemie für Biologen, 2017
 Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Chemie für Biologen, 2017 Übung 11 Organisch chemische Reaktionen (Thema 12.1 12.6) Aufgabe 1: a) Erklären Sie folgende Begriffe: i) Übergangszustand Zustand der höchsten Energie in einer Reaktion, kann
Synthesen von Carbonsäuren: industrielle Verfahren
 Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Synthesen von arbonsäuren: industrielle Verfahren I_folie267 a. Essigsäure: 2 2 Ethylen Acetylen 2 ( + 2 ) 2 Ethanol 2 (gs 4, + ) 2 2 2, 2 Kat. Vinylalkohol Enol 2 Enol Katalysator: Pdl 2 /ul 2 : Wacker-Prozess
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 4 -Eliminierungen Dr. ermann A. Wegner hermann.wegner@unibas.ch Begriffe -, "-, 1,3-, 1,4-Eliminierungen syn-, cis-eliminierung anti-,
eaktionsmechanismen nach dem gleichnahmigen Buch von. ückner Kap. 4 -Eliminierungen Dr. ermann A. Wegner hermann.wegner@unibas.ch Begriffe -, "-, 1,3-, 1,4-Eliminierungen syn-, cis-eliminierung anti-,
Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen:
 Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen: Palladium (Pd) hat die Elektronenkonfiguration [Kr] 4d 10 Gruppe VIIIc, spätes Übergangsmetall, xidationsstufen 0 und 2 typische Verwendung: wegen
Palladiumkatalysierte C-C-Bindungsknüpfungsreaktionen: Palladium (Pd) hat die Elektronenkonfiguration [Kr] 4d 10 Gruppe VIIIc, spätes Übergangsmetall, xidationsstufen 0 und 2 typische Verwendung: wegen
Prof. Dr. P. Rademacher Organische Chemie IV
 Prof. Dr. P. Rademacher Organische hemie IV arbokationen 1. Nomenklatur arbokationen = alle kationischen -Verbindungen Beispiele:,, 2, 3, 4, 5. Im Massenspektrum von than bei hohem Druck findet man Peaks
Prof. Dr. P. Rademacher Organische hemie IV arbokationen 1. Nomenklatur arbokationen = alle kationischen -Verbindungen Beispiele:,, 2, 3, 4, 5. Im Massenspektrum von than bei hohem Druck findet man Peaks
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung
 Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
Ausgewählte wichtige Reaktionen (Transformationen) für die Syntheseplanung folie267 TGT Structure Retron Transform Precursor(s) (1) C 2 t-bu C C C (E)-Enolate Aldol C + C 2 t-bu (2) C C C C C Michael +
1. Klausur zum Praktikum Organische Chemie I für Studierende der Chemie und der Biochemie im SS 2000
 Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Prof. Dr. B. König Prof. Dr. Th. Troll 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 2000 am Dienstag, dem 30. Mai 2000 Name: Mustermann...Vorname: Max...
Diene: C n H 2n-2 : 2 Doppelbindungen
 Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
3 Eliminierungen. 3.1 Begriffe und mechanistische Einteilung. Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül
 3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
3 Eliminierungen 3.1 Begriffe und mechanistische Einteilung Abspaltung zweier Atome bzw. Atomgruppen aus einem Molekül Einteilung nach den Positionen der abgespaltenen Gruppen 1,1-Eliminierung (α-eliminierung)
Claisen-Kondensation (Nucleophile Substitution am Acyl-C-Atom) Mechanismus der Claisen-Kondensation
 2 I_folie321 laisen-kondensation (ucleophile Substitution am Acyl--Atom) 3 2 5 1) a 2 3 2) 2 / γ β α 3 2 2 5 "Acetessigsäureethylester" ein β-ketoester 2 2 3 3 1) a 3 2) 2 / 5 4 3 2 1 3 2 3 3 2-Methyl-3-oxopentansäuremethylester
2 I_folie321 laisen-kondensation (ucleophile Substitution am Acyl--Atom) 3 2 5 1) a 2 3 2) 2 / γ β α 3 2 2 5 "Acetessigsäureethylester" ein β-ketoester 2 2 3 3 1) a 3 2) 2 / 5 4 3 2 1 3 2 3 3 2-Methyl-3-oxopentansäuremethylester
Elektrophile Additionen von HX an die CC-Doppelbindung (Vollhardt, 3. Aufl., S , 4. Aufl., S ; Hart, S ; Buddrus, S.
 Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Vorlesung 19 Elektrophile Additionen von X an die -Doppelbindung (Vollhardt, 3. Aufl., S. 504-514, 4. Aufl., S. 566-577; art, S. 96-105; Buddrus, S. 149-155) Die Elektronenwolke der π-bindung verleiht
Prof. Dr. Stephen Hashmi, Sommersemester Organische Chemie für Technische Biologen, Organische Chemie für Lehramtskandidaten, Teil 4
 Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Prof. Dr. ashmi, Sommersemester 2005 33 rganische hemie für Technische Biologen, rganische hemie für Lehramtskandidaten, Teil 4 Anders als das Methan weisen die meisten Kohlenwasserstoffe verschiedene
Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. O R 3
 Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. 1 2 [ ] 2 3 2 oder 3 [ 3 ] ' '' Amid, wenn '' =, Alkyl, Aryl 2 ydrazid ydroxamsäure (geringere eaktionsgeschwindigkeiten
Umsetzungen von Estern Umesterung in Gegenwart katalytischer Mengen Säure oder Base. 1 2 [ ] 2 3 2 oder 3 [ 3 ] ' '' Amid, wenn '' =, Alkyl, Aryl 2 ydrazid ydroxamsäure (geringere eaktionsgeschwindigkeiten
3. Gruppe: Aromatische Substitution
 1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
1 1) Zum chanismus der elektrophilen aromatischen Substitution Aromatischer Charakter Antiaromatischer Charakter (4 n 2)π-lektronen 4 nπ e 3 C C 3 2 C C 2 1.48Å 1.54Å 1.34Å 1.39Å ingstrom-ffekte δ = 5
Michaeladditionen an auxiliargeschützten cyclischen Enoaten
 Michaeladditionen an auxiliargeschützten cyclischen Enoaten auxiliargeschützte Cyclopentenoncarboxylate auxiliargeschützte Cyclohexenoncarboxylate N S2 Ph N S2 Ph N S2 Ph 1n 6n 16n N S2 Ph N S 2 Ph N S
Michaeladditionen an auxiliargeschützten cyclischen Enoaten auxiliargeschützte Cyclopentenoncarboxylate auxiliargeschützte Cyclohexenoncarboxylate N S2 Ph N S2 Ph N S2 Ph 1n 6n 16n N S2 Ph N S 2 Ph N S
Übung zur Vorlesung Organische Chemie II Reaktivität (Dr. St. Kirsch, Dr. A. Bauer) Wintersemester 2008/09 O 2 N
 Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
Übung zur Vorlesung rganische Chemie II eaktivität (Dr. St. Kirsch, Dr. A. Bauer) zu 7.1-70: C [pts] (PhMe) 110 C Entfernung mit ilfe eines Wasserabscheiders Zusatzfrage: i) Was bedeutet die Abkürzung
v = - = - = = k [R] [S]
![v = - = - = = k [R] [S] v = - = - = = k [R] [S]](/thumbs/81/82977406.jpg) Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
Vorlesung 7 Die hemische Kinetik (Vollhardt, 3 Aufl, S 70-72, 4 Aufl, S 54-58; art, S 107-110; Buddrus, S 26-29) befasst sich mit Geschwindigkeit, mit der eine Reaktion abläuft R S P Geschwindigkeit einer
Kapitel 3. Nucleophile Substitution
 Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Kapitel 3. Nucleophile Substitution Reaktionsmechanismen - S N 1-Reaktion: Reaktionskoordinate-Energie-Diagramm; Kinetik, Struktur-Reaktivitätsbeziehungen (stabiles Carbokation, schwaches Nucleophil, gute
Basisprüfung Allgemeine Chemie (Teil OC) Montag, 3. September 2007
 Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
Basisprüfung Allgemeine Chemie (Teil C) Montag, 3. September 2007 1. omenklatur (20 Pt) 1.1 (10Pt) Benennen Sie die Verbindungen A - D nach IUPAC inkl. stereochemischer Deskriptoren. A B (2E,5E)4-Prop-1-inylhepta-2,5-dien
4. Gruppe: Alkene und Alkine
 1 1) Alkene 1.1. Struktur und Isomerie der Alkene 117 : 350 kj/mol : 350 265 = 615 kj/mol Doppelbindungs-Anteil 1.34Å Isomerie # = 260 kj/mol # = 180 kj/mol Saytzeff-egel: Substituierte Doppelbindungen
1 1) Alkene 1.1. Struktur und Isomerie der Alkene 117 : 350 kj/mol : 350 265 = 615 kj/mol Doppelbindungs-Anteil 1.34Å Isomerie # = 260 kj/mol # = 180 kj/mol Saytzeff-egel: Substituierte Doppelbindungen
M U S T E R L Ö S U N G
 Universität egensburg Institut für rganische Chemie Prof. Dr.. eiser 3. Klausur zum rganisch-chemischen Praktikum I für Studierende der Chemie und der Biochemie im SS 999 am Freitag, dem 3. Juli 999 M
Universität egensburg Institut für rganische Chemie Prof. Dr.. eiser 3. Klausur zum rganisch-chemischen Praktikum I für Studierende der Chemie und der Biochemie im SS 999 am Freitag, dem 3. Juli 999 M
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Die Herstellung von Alkenen aus Chloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen.
 Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Vorlesung 18. Alkene ie erstellung von Alkenen aus hloralkanen bzw. aus anderen Estern oder Alkoholen durch E2- oder E1-Eliminierungen wurde bereits besprochen. Technische erstellung von Ethylen (= Ethen)
Übung: Alkene & Alkohole HS-07
 kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
kt. 007, r.marti / Synthese und eaktionsmechanismen Übung: Alkene & Alkohole S-07 = C 6 7 8 CMe 9 0 Fragen: - Wie können die Intermediate - hergestellt werden, auf was ist zu achten bzgl. eaktivitäten/eagenzien
Arzneistoff der Woche. Alkohole. Eliminierungen. Organische Chemie Agenda. Johann Wolfgang Goethe -Universität Frankfurt am Main
 Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
Agenda Arzneistoff der Woche Alkohole Eliminierungen 1 Prof. Dr. Manfred Schubert-Zsilavecz Dabigatran - Struktur 2 Prof. Dr. Manfred Schubert-Zsilavecz Lucas-Test 3 Prof. Dr. Manfred Schubert-Zsilavecz
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Graphisches Inhaltsverzeichnis
 Kapitel I Graphisches Inhaltsverzeichnis Einübung von ausgewählten Reinigungs- und Trennverfahren............ 65 R C 2 S Ph 2 R C 2 Ph 3 S R C 2 Ph R 3 R C 2 Ph R 2 R C 2 R C 2 Trennung dieser Diastereomere
Kapitel I Graphisches Inhaltsverzeichnis Einübung von ausgewählten Reinigungs- und Trennverfahren............ 65 R C 2 S Ph 2 R C 2 Ph 3 S R C 2 Ph R 3 R C 2 Ph R 2 R C 2 R C 2 Trennung dieser Diastereomere
Phenole (Nomenklatur)
 Phenole (omenklatur) I_folie377 Phenol: Schmp. 41 ; Sdp. 182 ; Lösl.: 9.3 g in 100 ml 2 Br 3 2 2 2 2 2 m-bromphenol p-kresol 2,4-Dinitrophenol Pikrinsäure (p-methylphenol) (2,4,6-Trinitrophenol) Salicylsäure
Phenole (omenklatur) I_folie377 Phenol: Schmp. 41 ; Sdp. 182 ; Lösl.: 9.3 g in 100 ml 2 Br 3 2 2 2 2 2 m-bromphenol p-kresol 2,4-Dinitrophenol Pikrinsäure (p-methylphenol) (2,4,6-Trinitrophenol) Salicylsäure
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
C-Radikale. BAND E19a MANFRED REGITZ BERND GIESE BASEL GEORG THIEME VERLAG STUTTGART NEW YORK A. GHOSEZ B. GIESE W. MEHL J. O. METZGER H.
 BAND E19a C-Radikale HERAUSGEGEBEN VON MANFRED REGITZ KAISERSLAUTERN und BERND GIESE BASEL BEARBEITET VON A. GHOSEZ B. GIESE W. MEHL BASEL BASEL DARMSTADT J. O. METZGER H. ZIPSE OLDENBURG DARMSTADT GEORG
BAND E19a C-Radikale HERAUSGEGEBEN VON MANFRED REGITZ KAISERSLAUTERN und BERND GIESE BASEL BEARBEITET VON A. GHOSEZ B. GIESE W. MEHL BASEL BASEL DARMSTADT J. O. METZGER H. ZIPSE OLDENBURG DARMSTADT GEORG
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 Reaktionsmechanismen nach dem gleichnahmigen Buch von R. ückner Kap. 5 Substitutionsreaktionen am Aromaten Dr. ermann A. Wegner hermann.wegner@unibas.ch lektrophile aromatische Substitution Wheland-Komplex
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. ückner Kap. 5 Substitutionsreaktionen am Aromaten Dr. ermann A. Wegner hermann.wegner@unibas.ch lektrophile aromatische Substitution Wheland-Komplex
Aromatische Kohlenwasserstoffe
 Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
M U S T E R L Ö S U N G
 Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
Prof. Dr.. Reiser Prof. Dr. A. Geyer 1. Klausur zum Praktikum rganische Chemie I für Studierende der Chemie und der Biochemie im SS 00 am Dienstag, dem 14. Mai 00 Name:...Vorname:... Matrikelnummer:...
Die Baldwin-Regeln. Ringschluss oder nicht?
 Die Baldwin-Regeln Ringschluss oder nicht? Inhalt Sir Jack E. Baldwin Die originalen Regeln Suche nach der 5-endo-trig-Reaktion Sauerstoff-Nukleophile Enolendo- & Enolexo-exo-Reaktionen Ausnahmen & Enzymkatalyse
Die Baldwin-Regeln Ringschluss oder nicht? Inhalt Sir Jack E. Baldwin Die originalen Regeln Suche nach der 5-endo-trig-Reaktion Sauerstoff-Nukleophile Enolendo- & Enolexo-exo-Reaktionen Ausnahmen & Enzymkatalyse
7. Syntheseübung WS 2008/09
 7. Syntheseübung WS 2008/09 4 9 11 1 1 1 1 16 16 ( )-kilactomycin 4 Se 14 9 11 ap A. B. Smith III, K Basu, T. Bosanac J. Am. Chem. Soc. 2007, 129, 14872-14874. Amos. B. Smith III University of Pennsylvania
7. Syntheseübung WS 2008/09 4 9 11 1 1 1 1 16 16 ( )-kilactomycin 4 Se 14 9 11 ap A. B. Smith III, K Basu, T. Bosanac J. Am. Chem. Soc. 2007, 129, 14872-14874. Amos. B. Smith III University of Pennsylvania
Eliminierungsreaktionen: E1- und E2- Mechanismen; Olefine
 Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Eliminierungsreaktionen: E1 und E2 chanismen; lefine Allgemeine Gleichung der Eliminierung: Base X X Die Bindung wird am Atom gebrochen. Für die Qualität der Abgangsgruppe X gelten die selben egeln wie
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Diels-Alder-Reaktionen in Theorie und Praxis
 Diels-Alder-Reaktionen in Theorie und Praxis 04.02.2015 Tobias Wiehn Seminar zur Vorlesung OC07 Gliederung Einführung Genauere mechanistische Betrachtungen Grenzorbitaltheorie Katalysierte Diels-Alder-Reaktionen
Diels-Alder-Reaktionen in Theorie und Praxis 04.02.2015 Tobias Wiehn Seminar zur Vorlesung OC07 Gliederung Einführung Genauere mechanistische Betrachtungen Grenzorbitaltheorie Katalysierte Diels-Alder-Reaktionen
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
1 Übung 13 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Ms: Mesyl-Gruppe (CH 3 SO 3 -), Tf: Triflyl-Gruppe (CF 3 SO 3 -), Ts:
zur Vorlesung "Organische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie 3. Semester" WS 2002/2003
 J. aub/febr. 200 Klausur zur Vorlesung "rganische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie. Semester" Lösungsbogen WS 2002/200 ) Radikalreaktionen (2 Punkte):
J. aub/febr. 200 Klausur zur Vorlesung "rganische Chemie II (Aliphaten, Reaktionsmechanismen) für Studierende der Chemie und der Biochemie. Semester" Lösungsbogen WS 2002/200 ) Radikalreaktionen (2 Punkte):
Organische Chemie III
 rganische Chemie III Sommersemester 2010 Technische Universität München Klausur am 03.08.2010 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
rganische Chemie III Sommersemester 2010 Technische Universität München Klausur am 03.08.2010 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie Bachelor
Organische Chemie II Reaktivität
 Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
Wiederholungs-Klausur zur Vorlesung rganische Chemie II Reaktivität Wintersemester 2007/08 Klausur am 28.03.2008 (ame, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-ummer) 1. Teilnahme
Grundlagen der Organischen Chemie
 Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Grundlagen der Organischen Chemie Vorlesung im WS 2010/2011 1. Einführung 1 1.1 Die wunderbare Welt der Organischen Chemie 1.2 Kohlenstoff ein ganz besonderes Element 4 2. Die kovalente Bindung 5 2.1 Atomorbitale
Übungen zur Vorlesung Organische Chemie (Teil 2)
 Übungen zur Vorlesung rganische Chemie (Teil 2) K. Hohmann/ J. Massoth/ F. Lehner/ H. Schwalbe Blatt 5 1) Enolat und Enamin Geben Sie das bevorzugte Deprotonierungsprodukt an a) Thermodynamisch kontrolliert
Übungen zur Vorlesung rganische Chemie (Teil 2) K. Hohmann/ J. Massoth/ F. Lehner/ H. Schwalbe Blatt 5 1) Enolat und Enamin Geben Sie das bevorzugte Deprotonierungsprodukt an a) Thermodynamisch kontrolliert
Organische Chemie 1 Teil 2
 Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
Inhalte der 7. Vorlesung: 2.4. Bildung & Reaktion von Enolen und Enolaten 2.5 Chemie des Enolatanions 2.6 Enolat-Analoga 2.8 1,3-Dicarbonylverbindungen/ß-Dicarbonylverbindungen 2.9 α,β-ungesättigte Carbonylverbindungen
3mol%Pd(OAc) 2 6 mol% R-BINAP
 eck-eaktion: Asymmetrische Induktion Tf 3mol%(Ac) 2 6 mol% -BIAP Protonenschwamm AB = 71% ee= 93% P 2 P 2 -BIA P Protonenschwamm Die chirale Information wird über die Liganden am Palladium eingebracht;
eck-eaktion: Asymmetrische Induktion Tf 3mol%(Ac) 2 6 mol% -BIAP Protonenschwamm AB = 71% ee= 93% P 2 P 2 -BIA P Protonenschwamm Die chirale Information wird über die Liganden am Palladium eingebracht;
1. Die folgenden Alkene liefern bei der elektrophilen Addition von Brom unterschiedliche kationische Zwischenstufen.
 Professor Lindhorst rganische Chemie 1: rganisch-chemische Reaktionsmechanismen chem303 WS 2008/09 ÜUNG 4 Addition an CC-hrfachbindungen - LÖSUNGEN - 1. Die folgenden Alkene liefern bei der elektrophilen
Professor Lindhorst rganische Chemie 1: rganisch-chemische Reaktionsmechanismen chem303 WS 2008/09 ÜUNG 4 Addition an CC-hrfachbindungen - LÖSUNGEN - 1. Die folgenden Alkene liefern bei der elektrophilen
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Organische Synthese. Sommersemester 2012 Technische Universität München. Nachholklausur am
 rganische Synthese Sommersemester 2012 Technische Universität München achholklausur am 04.10.2012 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
rganische Synthese Sommersemester 2012 Technische Universität München achholklausur am 04.10.2012 ame, Vorname... Matrikel-r.... (Druckbuchstaben) geboren am... in... Studiengang Chemie Dipl.... Chemie
O + + R' Die langsamere Weiterreaktion des Sulfoxids führt zum Sulfon:
 6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
6.7 xidation von eteroatomen Sulfide, Selenide, Amine und Phosphane haben freie Elektronenpaare und können daher leicht oxidiert werden. Verschiedene Peroxyverbindungen sind als xidationsmittel geeignet.
11. Syntheseübung WS 2006/2007
 11. Syntheseübung WS 2006/2007 isoliert aus Streptomyces sp.#9885 potente Antitumorverbindung, stabilisiert Microtubuli Totalsynthesen durch die Gruppen von - Erik Sorensen (Princeton University) JACS
11. Syntheseübung WS 2006/2007 isoliert aus Streptomyces sp.#9885 potente Antitumorverbindung, stabilisiert Microtubuli Totalsynthesen durch die Gruppen von - Erik Sorensen (Princeton University) JACS
5. Präparat: cis-9,10-dihydro-9,10-ethanoanthracen-11,12-dicarbonsäureanhydrid
 Marcus Wolf Seite 1 04.06.2003 5. Präparat: cis-9,10-dihydro-9,10-ethanoanthracen-11,12-dicarbonsäureanhydrid Literatur: Autorenkollektiv ; rganikum rganisch chemisches Grundpraktikum ; 20. Auflage ; Seite
Marcus Wolf Seite 1 04.06.2003 5. Präparat: cis-9,10-dihydro-9,10-ethanoanthracen-11,12-dicarbonsäureanhydrid Literatur: Autorenkollektiv ; rganikum rganisch chemisches Grundpraktikum ; 20. Auflage ; Seite
Sekundäre Orbital-Wechselwirkungen: Alder sche endo-regel
 Sekundäre rbital-wechselwirkungen: Alder sche endo-regel folie164 endo-addukt Hauptprodukt exo-addukt Nebenprodukt HM primäre rbital-ww sekundäre rbital-wechselwirkung bindend stabilisierend keine sekundäre
Sekundäre rbital-wechselwirkungen: Alder sche endo-regel folie164 endo-addukt Hauptprodukt exo-addukt Nebenprodukt HM primäre rbital-ww sekundäre rbital-wechselwirkung bindend stabilisierend keine sekundäre
Prof. Dr. H. Hauptmann Übungen zur Vorlesung Organische Chemie II für Studierende des Lehramtes und der Biologie (3. Sem.)
 Prof. Dr.. auptmann Übungen zur Vorlesung rganische hemie für Studierende des Lehramtes und der Biologie (3. Sem.) Lösungsbogen zu Übungsblatt 5, zu E2, E1cB und thermischen Eliminierungen, Regiochemie
Prof. Dr.. auptmann Übungen zur Vorlesung rganische hemie für Studierende des Lehramtes und der Biologie (3. Sem.) Lösungsbogen zu Übungsblatt 5, zu E2, E1cB und thermischen Eliminierungen, Regiochemie
Reaktionsmechanismen nach dem gleichnahmigen Buch von R. Brückner
 eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
eaktionsmechanismen nach dem gleichnahmigen Buch von. Brückner Kap. 2 cleophile Substitution Dr. ermann A. Wegner hermann.wegner@unibas.ch 1 Darauf wird aufgebaut... Atom-rbital & Molekül-rbital Theorie
Physikalische Eigenschaften der Alkohole
 Physikalische Eigenschaften der Alkohole Die Struktur von Alkoholen ist ähnlich der von Wasser 96pm 110pm 143pm 96pm Methanol 109 104.5 108.9 I_folie228 Wasserstoffbrückenbindungen: BDE = 21KJ/mol 207pm
Physikalische Eigenschaften der Alkohole Die Struktur von Alkoholen ist ähnlich der von Wasser 96pm 110pm 143pm 96pm Methanol 109 104.5 108.9 I_folie228 Wasserstoffbrückenbindungen: BDE = 21KJ/mol 207pm
Kapitel 5: Additionen an C-C- Mehrfachbindungen
 Kapitel 5: Additionen an C-C- hrfachbindungen» Theorie, Konzepte, chanismus - MO Theorie: elektrophile Addition (Brom/Olefin) und [2+4]- Cycloaddition (Diels-Alder-Reaktion) - Bromierung der Doppelbindung:
Kapitel 5: Additionen an C-C- hrfachbindungen» Theorie, Konzepte, chanismus - MO Theorie: elektrophile Addition (Brom/Olefin) und [2+4]- Cycloaddition (Diels-Alder-Reaktion) - Bromierung der Doppelbindung:
Chemie Punkte/Points:
 Institut für Chemie der Freien Universität Berlin Wiederholungsklausur zur Vorlesung C IIb Retake exam for lecture course C IIb Verfasser Author: Christoph Schalley öchstpunktzahl / Max. of points 160
Institut für Chemie der Freien Universität Berlin Wiederholungsklausur zur Vorlesung C IIb Retake exam for lecture course C IIb Verfasser Author: Christoph Schalley öchstpunktzahl / Max. of points 160
Organische Chemie II Reaktivität
 Klausur zur Vorlesung rganische Chemie II Reaktivität Sommersemester 2009 Wiederholungsklausur WiSe 2008/09 Klausur am 3.4.2009 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer)
Klausur zur Vorlesung rganische Chemie II Reaktivität Sommersemester 2009 Wiederholungsklausur WiSe 2008/09 Klausur am 3.4.2009 (Name, Vorname) im. Fachsemester (Studiengang) (Unterschrift) (Matrikel-Nummer)
2. Gruppe: Carbonsäuren und Derivate
 1 1) Eigenschaften der Carbonsäuren: Carbonsäuren gehen Wasserstoffbrückenbindungen ein. C 2 2 C 2 3 pk a = 5 vgl. pk a ( 2 ) = 16 K a = Bsp.: [C 2 ] [ ] [C 2 ] stabilisiert durch somerie Säure C 3 C 2
1 1) Eigenschaften der Carbonsäuren: Carbonsäuren gehen Wasserstoffbrückenbindungen ein. C 2 2 C 2 3 pk a = 5 vgl. pk a ( 2 ) = 16 K a = Bsp.: [C 2 ] [ ] [C 2 ] stabilisiert durch somerie Säure C 3 C 2
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
Ruthenium-katalysierte Reaktionen eine Schatzkiste der Atomökonomie. B.M. Trost, M.U. Frederiksen, M.T. Rudd, Angew. Chem. 2005, 117,
 uthenium-katalysierte eaktionen eine Schatzkiste der Atomökonomie B.M. Trost, M.U. Frederiksen, M.T. udd, Angew. Chem. 2005, 117, 6788-6825 1 Motivation steigender Bedarf an neuen Chemikalien steigender
uthenium-katalysierte eaktionen eine Schatzkiste der Atomökonomie B.M. Trost, M.U. Frederiksen, M.T. udd, Angew. Chem. 2005, 117, 6788-6825 1 Motivation steigender Bedarf an neuen Chemikalien steigender
Übergangsmetall-π-Komplexe
 Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Übergangsmetall-π-Komplexe ausschließlich π-wechselwirkungen von Liganden- mit etallorbitalen Alken od. Olefin Diolefin Alkenkomplexe Alkin od. Acetylen Allyl yclopentadienyl sehr häufig, Beispiele mit
Carbonyl- und Enolatchemie
 Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
Carbonyl- und Enolatchemie 1 Addition von rganometall-eagenzien an Carbonylverbindungen eformatzky-eaktion: Zn-eagenz weniger reaktiv als Grignard, greift keine Ester an! Br 2 Zn ZnBr 2 Br Zn 2 1 2 Barbier-eaktion:
Suzuki-Reaktion. - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert
 Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
Suzuki-Reaktion - Kupplung einer Aryl- oder Vinylboronsäure mit einem Aryloder Vinylhalogenid - verläuft Palladiumkatalysiert Allgemein: R-X + R -B-R R-R + X-B-R R-X + R -B-() 2 R-R + X-B-() 2 R, R = Aryl-
CHE 102.1: Grundlagen der Chemie - Organische Chemie
 E 102.1: Grundlagen der hemie - rganische hemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 4. Alkene: eaktionen und erstellung 4.1. Elektrophile Additionen an Alkene: egioselektivität Das Proton einer
E 102.1: Grundlagen der hemie - rganische hemie Prof Dr. E. Landau und Prof. Dr. J. A. obinson 4. Alkene: eaktionen und erstellung 4.1. Elektrophile Additionen an Alkene: egioselektivität Das Proton einer
Name: Matrikelnummer: Studienfach (bitte ankreuzen): LC Chemie-Bachelor Chemie-Diplom
 Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
Fachrichtung Chemie Professur für rganische Chemie II rganisch-chemisches Praktikum zum Modul C II http://www.chm.tu-dresden.de/oc2/modul_c_ii.shtml ame: Matrikelnummer: Studienfach (bitte ankreuzen):
Halogenierung von gesättigten Kohlenwaserstoffen
 Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
Halogenierung von gesättigten Kohlenwaserstoffen Reaktivität Halogene: F 2 > Cl 2 > Br 2 > J 2 Reaktivität CH-Gruppen: primäre CH < sekundäre CH < tertiäre CH Bei Temperatursteigerung verringern sich die
1. Übung zur Vorlesung OC III
 . Übung zur Vorlesung C III 8.04.05 Aufgabe Schlagen Sie vier verschiedene retrosynthetische Schnitte für die gezeigte Verbindung vor und beurteilt ihre Praktikabilität. F Aufgabe 2 a) Die Deprotonierung
. Übung zur Vorlesung C III 8.04.05 Aufgabe Schlagen Sie vier verschiedene retrosynthetische Schnitte für die gezeigte Verbindung vor und beurteilt ihre Praktikabilität. F Aufgabe 2 a) Die Deprotonierung
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Aldolreaktion und ihre Stereokontrolle. Stefan Benson und Tobias Brodmann
 Aldolreaktion und ihre Stereokontrolle Stefan Benson und Tobias Brodmann 13.12.2004 0 Gliederung Allgemeine Grundlagen zur Aldoladditions-Reaktion Stereokontrolle bei d. Bildung von Li-Enolaten Stereokontrolle
Aldolreaktion und ihre Stereokontrolle Stefan Benson und Tobias Brodmann 13.12.2004 0 Gliederung Allgemeine Grundlagen zur Aldoladditions-Reaktion Stereokontrolle bei d. Bildung von Li-Enolaten Stereokontrolle
1. Valenzisomerisierung
 . Valenzisomerisierung a) vollständiges Korrelationsdiagramm σ * (A) σ * (A) Ψ 4 (A) Ψ 4 (A) Ψ (S) π (S) Ψ (S) π (S) Ψ (A) π(a) Ψ (A) π(a) Ψ (S) Ψ (S) σ(s) σ(s) a) disrotatorischer Prozess b) konrotatorischer
. Valenzisomerisierung a) vollständiges Korrelationsdiagramm σ * (A) σ * (A) Ψ 4 (A) Ψ 4 (A) Ψ (S) π (S) Ψ (S) π (S) Ψ (A) π(a) Ψ (A) π(a) Ψ (S) Ψ (S) σ(s) σ(s) a) disrotatorischer Prozess b) konrotatorischer
S N 2, S N 1 E1, E2 S N 2, S N 1, E1, E2
 S N vs. E S N 2, S N 1 - B: E1, E2 H E1, E2 C C - : Nu L S N 2, S N 1, E1, E2 Die vier durch Pfeile angedeutenden Reaktionsmöglichkeiten laufen mit unterschiedlichen Geschwindigkeiten ab. Wichtigste Einflussfaktoren:
S N vs. E S N 2, S N 1 - B: E1, E2 H E1, E2 C C - : Nu L S N 2, S N 1, E1, E2 Die vier durch Pfeile angedeutenden Reaktionsmöglichkeiten laufen mit unterschiedlichen Geschwindigkeiten ab. Wichtigste Einflussfaktoren:
Ester aus Carbonsäure-Salzen und Alkylhalogeniden (vgl. Kap. 2) S N. Methylester aus Carbonsäuren und Diazomethan (vgl. Kap. 2) P + OH.
 Ester aus arbonsäure-salzen und Alkylhalogeniden (vgl. Kap. 2) : : a X 2 ' S 2 2 ' X = Br, I Stereochemie! Methylester aus arbonsäuren und Diazomethan (vgl. Kap. 2) 2.. : 3 Wegen der Toxizität und Explosivität
Ester aus arbonsäure-salzen und Alkylhalogeniden (vgl. Kap. 2) : : a X 2 ' S 2 2 ' X = Br, I Stereochemie! Methylester aus arbonsäuren und Diazomethan (vgl. Kap. 2) 2.. : 3 Wegen der Toxizität und Explosivität
