Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
|
|
|
- Walter Schmid
- vor 5 Jahren
- Abrufe
Transkript
1 Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg hysikalische Chemie für Studierende der ikrosystemtechnik Lösungen zum 7. Übungsblatt im WS 200/ rof. Dr. Gräber 7. (2 unkte) Zwischen 240 K und 0 K ist die molare Wärmekapazität von CHCl (l) konstant und ist gegeben durch C m 947 J K -. Wir erwärmen mol CHCl von 275 K auf 00 K indem wir es mit einem sehr großen von 00 K in thermischen Kontakt bringen. Wir setzen dabei voraus dass Flüssigkeit und von der Umgebung isoliert sind und dass die Wärmekapazität des s so groß ist dass bei der Wärmeübertragung auf CHCl seine emperatur praktisch konstant bleibt. a) Wie ändert sich die Entropie des CHCl? (5 unkte) b) Wie ändert sich die Entropie des s? (6 unkte) c) rüfen Sie an diesem rozess nach ob S ges > 0 gilt. ( unkt) a) Es ist d 0 woraus folgt: dh q d 0 Außerdem gilt: H C dq dq dh C d ncmd Integration: n C SE E m d SA A E S n C d n C ln CHCl m m A E A 00K SCHCl mol 9 47JK mol ln 796JK 275K b) Entropieänderung des s: q S om CHCl aufgenommene Wärmemenge: 00K 00K qchcl n C md n Cm d mol 9 47JK mol 00K 275K 2287J 275K 275K Diese Wärmemenge muss vom abgegeben worden sein: q q 2287J CHCl
2 q 2287J S 7 62JK 00K c) Gesamtentropieänderung: ges CHCl S S + S 796JK JK 04JK Die Entropieänderung ist größer als Null wie vom 2. Hauptsatz beschrieben. 7.2 L (8 unkte) Wie ändert sich die Entropie wenn 50 g Kupfer von 00 C zu 00 g Wasser von 0 C in einem isolierten Gefäß gegossen werden? Es gilt: C m (H 2 Ol) 755 J K - mol - C m (Kupfers) 244 J K - mol -. Hinweis: Berechnen Sie zunächst die emperatur die sich nach dem ischprozess einstellt. Es ist d 0 woraus folgt: dh q d 0 Wärmemengen: Wasser: qh O n H OCmH O ( H O ) Es gilt: q H2O Kupfer: q n C ( ) q m n C + n C ischungstemperatur: n C + n C H O mh O H O m H2O mh2o m mh2o 00g Stoffmengen: n H2O 555mol 802gmol m 50g n 0 79mol 655gmol H2O 555mol 755JK mol 285K + 079mol 24 4JK mol 75K 555mol 755JK mol mol 24 4JK mol K Entropieänderung: E S ncm ln A S n C ln + n C ln H2O mh2o m H 2O K K S 555mol 755JK mol ln mol 24 4JK mol ln 285K 75K S 076JK 7. L (7 unkte) Berechnen Sie die molare Wärmekapazität C m für Neon (einatomiges ideales Gas). Berechnen Sie aus der molaren Standardentropie des Neons bei 298 K die molare Entropie des Neons bei 500 K. Das olumen sowie C m werden als konstant vorausgesetzt ( S (Neon) 46JK mol ). 298m 2
3 Für ein ideales einatomiges Gas gilt: Cm R 8 4JK mol 2 47JK mol 2 2 Es gilt: du dq + dw dq d Bei konstantem olumen ist d 0 es folgt: dq du Außerdem gilt: U C dq dq du C d ncmd m Cmd Integration: S500m 500K d m Cm 500m 298m m S 298K 298m 500K S S C ln 298K 500K S S + C ln 298K 500m 298m m 500K S 46 JK mol JK mol ln 52 78JK mol 298K 500m 7.4 L (7 unkte) ragen Sie die molare Entropie gegen die emperatur von 0 bis 500 K für H 2 O auf. Zeichnen Sie die Bereiche der festen flüssigen und gasförmigen hase sowie den Schmelzpunkt und den Siedepunkt ein. olare Entropie gegen emperatur für H 2 O: gasförmig S Sdm S m flüssig fest S Smm [K] Sm Sd
4 7.5 L (0 unkte) a) (C 6 H 6 ) und oluol (C 7 H 8 ) werden bei 298 K miteinander gemischt und bilden eine ideale ischung. Skizzieren Sie in einem Diagramm die Abhängigkeit der molaren ischungsentropie vom olenbruch des s. Stellen Sie dazu eine Wertetabelle im Bereich von 0 bis auf in 0 Schritten auf. (6 unkte) b) Wie groß ist die ischungsentropie wenn 50 mol mit 250 mol oluol gemischt werden? (4 unkte) a) olenbrüche: x n + n n x x oluol oluol oluol + noluol ischungsentropie: Sixm R ( x ln x + xoluol ln xoluol ) S R x ln x + ( x ) ln ( x ) Wertetabelle: ixm x S ixm / J K - mol Auftragung S ixm gegen x : 6 5 S ix S ixm / J K - mol x 4
5 50mol b) olenbrüche: x 075 n + n 50mol mol oluol x x oluol ischungsentropie: Six R ( ln x + noluol ln xoluol ) S 84JK mol ( 50mol ln mol ln 0 625) ix S 220JK ix 7.6 L (6 unkte) Berechnen Sie die Standardreaktionsentropie für die folgenden Reaktionen bei 2985 K: a) 2 CH CHO(g) + O 2 (g) 2 CH COOH(l) ( unkte) b) 2 AgCl(s) + Br 2 (l) 2 AgBr(s) + Cl 2 (g) ( unkte) Hinweis: Schlagen Sie die Standardentropien der jeweiligen Substanzen in geeigneten abellenwerken nach. Achten Sie auf den Aggregatzustand der Substanzen. a) Reaktionsentropie: S ν S ( i) b) Reaktionsentropie: R m i m i S 2 S 2 S S R m mchcooh mchcho mo2 RSm JK mol 864JK mol S 2 S + S 2 S S R m magbr mcl2 magcl mbr2 RSm JK mol + S 92 64JK mol R m 5
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische heie lbert-ludwigs-universität Freiburg Lösungen zu 7. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 7. L Berechnen Sie aus der olaren Standardentropie des
Institut für hysikalische heie lbert-ludwigs-universität Freiburg Lösungen zu 7. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 7. L Berechnen Sie aus der olaren Standardentropie des
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Cheie Albert-Ludwigs-Universität Freiburg hysikalische Cheie für Studierende der Mikrosystetechnik Lösungen zu 10. Übungsblatt i WS 010/11 rof. Dr. Gräber 10.1 L (8 unkte) Skizzieren
Institut für hysikalische Cheie Albert-Ludwigs-Universität Freiburg hysikalische Cheie für Studierende der Mikrosystetechnik Lösungen zu 10. Übungsblatt i WS 010/11 rof. Dr. Gräber 10.1 L (8 unkte) Skizzieren
Physikalische Chemie I
 M.Bredol / M hysikalische Chemie I / 6.7.2017 1 hysikalische Chemie I Nachname orname Matrikel Aufgabe unkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Wasser besitzt die folgenden charakteristischen
M.Bredol / M hysikalische Chemie I / 6.7.2017 1 hysikalische Chemie I Nachname orname Matrikel Aufgabe unkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Wasser besitzt die folgenden charakteristischen
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum 0. Übungsblatt zur Vorlesung hysikalische Chemie I SS 04 rof. Dr. Bartsch 0. L Die freie Standardreaktionsenthalpie der
Institut für hysikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum 0. Übungsblatt zur Vorlesung hysikalische Chemie I SS 04 rof. Dr. Bartsch 0. L Die freie Standardreaktionsenthalpie der
Physikalische Chemie I
 M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
M.Bredol / MP Physikalische Chemie I / 10.3.16 1 Physikalische Chemie I Nachname orname Matrikel Aufgabe Punkte erreicht Note 1 20 2 20 3 20 4 22 5 18 Summe: 100 1. Gegeben seien 20 g Kohlendioxid, die
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
Institut für Physikalische Chemie Albert-Ludigs-Universität Freiburg Lösungen zum 4. Übungsblatt zur orlesung Physikalische Chemie I SS 00 Prof. Dr. Bartsch 4. (6 Punkte) In einem Behälter mit der Grundfläche
Musterlösung zur Abschlussklausur PC I Übungen (27. Juni 2018)
 1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
Die Innere Energie U
 Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Die Innere Energie U U ist die Summe aller einem System innewohnenden Energien. Es ist unmöglich, diese zu berechnen. U kann nicht absolut angegeben werden! Differenzen in U ( U) können gemessen werden.
Thermodynamik. Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen.
 Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Thermodynamik Was ist das? Thermodynamik ist die Lehre von den Energieänderungen im Verlauf von physikalischen und chemischen Vorgängen. Gesetze der Thermodynamik Erlauben die Voraussage, ob eine bestimmte
Lösung. Nachholklausur zur Vorlesung Physikalische Chemie I - Sommersemester 2002
 Lösung Nachholklausur zur orlesung Physikalische hemie I - Sommersemester 00 6. Oktober 00, 9 5-5 Uhr Hineise - Bitte Namen auf jedes Blatt schreiben. - Auch Blatt-Rückseiten beschreiben. - Ggf. eitere
Lösung Nachholklausur zur orlesung Physikalische hemie I - Sommersemester 00 6. Oktober 00, 9 5-5 Uhr Hineise - Bitte Namen auf jedes Blatt schreiben. - Auch Blatt-Rückseiten beschreiben. - Ggf. eitere
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 12.12.2014 Gase Flüssigkeiten Feststoffe Wiederholung Teil 2 (05.12.2014) Ideales Gasgesetz: pv Reale Gase: Zwischenmolekularen Wechselwirkungen
Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt
 1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
1 Aufgabe: Entropieänderung Ferienkurs Experimentalphysik 2 - Donnerstag-Übungsblatt 1 Aufgabe: Entropieänderung a) Ein Kilogramm Wasser bei = C wird in thermischen Kontakt mit einem Wärmereservoir bei
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C?
 A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
A 1.1 a Wie groß ist das Molvolumen von Helium, flüssigem Wasser, Kupfer, Stickstoff und Sauerstoff bei 1 bar und 25 C? (-> Tabelle p) A 1.1 b Wie groß ist der Auftrieb eines Helium (Wasserstoff) gefüllten
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Cheie lbert-ludwigs-universität Freiburg Lösungen zu 8. Übungsblatt zur Vorlesung hysikalische Cheie I SS 00 rof. Dr. Bartsch 8. (5 unkte) Benzol erstarrt unter at bei 5,5 C;
Institut für hysikalische Cheie lbert-ludwigs-universität Freiburg Lösungen zu 8. Übungsblatt zur Vorlesung hysikalische Cheie I SS 00 rof. Dr. Bartsch 8. (5 unkte) Benzol erstarrt unter at bei 5,5 C;
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14,
 ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
ÜBUNGEN ZUR VORLESUNG Physikalische Chemie I (PC I) (Prof. Meerholz, Hertel, Klemmer) Blatt 14, 12.02.2016 Aufgabe 1 Kreisprozesse Mit einem Mol eines idealen, monoatomaren Gases (cv = 3/2 R) wird, ausgehend
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Enthalpie H (Wärmeinhalt, Wärmefunktion)
 Enthalpie H (Wärmeinhalt, Wärmefunktion) U = Q + W Innere Energie: Bei konstantem Volumen ablaufende Zustandsänderung (isochorer Prozess, dv=) W=p V= U=Q v Bei Zustandsänderung unter konstantem Druck (isobarer
Enthalpie H (Wärmeinhalt, Wärmefunktion) U = Q + W Innere Energie: Bei konstantem Volumen ablaufende Zustandsänderung (isochorer Prozess, dv=) W=p V= U=Q v Bei Zustandsänderung unter konstantem Druck (isobarer
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009)
 Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Musterlösung Klausur Physikalische Chemie I: Thermodynamik (Januar 2009) Aufgabe 1: Reaktionsthermodynamik a) möglichst niedrige Temeratur (begünstigt exotherme Reaktionen) möglichst hoher Druck (begünstigt
Thermo Dynamik. Mechanische Bewegung (= Arbeit) Wärme (aus Reaktion) maximale Umsetzung
 Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
Thermo Dynamik Wärme (aus Reaktion) Mechanische Bewegung (= Arbeit) maximale Umsetzung Aussagen der Thermodynamik: Quantifizieren von: Enthalpie-Änderungen Entropie-Änderungen Arbeit, maximale (Gibbs Energie)
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases. f=5 Translation + Rotation. f=7 Translation + Rotation +Vibration. Wiederholung
 1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
Musterlösung Klausur Physikalische Chemie I: Thermodynamik
 Musterlösung Klausur Physikalische Chemie I: hermodynamik Aufgabe : Dimerisierung von Stickstoffdioxid a Nach dem Prinzip des kleinsten Zwanges von LeChatelier sollte der Druck p möglichst klein und die
Musterlösung Klausur Physikalische Chemie I: hermodynamik Aufgabe : Dimerisierung von Stickstoffdioxid a Nach dem Prinzip des kleinsten Zwanges von LeChatelier sollte der Druck p möglichst klein und die
Bekannter Stoff aus dem 1. Semester:
 Bekannter Stoff aus dem 1. Semester: Atombau! Arten der Teilchen! Elemente/Isotope! Kernchemie! Elektronenhülle/Quantenzahlen Chemische Bindung! Zustände der Materie! Ionenbindung! Atombindung! Metallbindung
Bekannter Stoff aus dem 1. Semester: Atombau! Arten der Teilchen! Elemente/Isotope! Kernchemie! Elektronenhülle/Quantenzahlen Chemische Bindung! Zustände der Materie! Ionenbindung! Atombindung! Metallbindung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Uniersität Freiburg Lösungen zum 11. Übungsblatt zur Vorlesung Physikalische Chemie I SS 214 Prof. Dr. Bartsch 11.1 L a) Die Bildungsgeschwindigkeit on
Institut für Physikalische Chemie Albert-Ludwigs-Uniersität Freiburg Lösungen zum 11. Übungsblatt zur Vorlesung Physikalische Chemie I SS 214 Prof. Dr. Bartsch 11.1 L a) Die Bildungsgeschwindigkeit on
Ferienkurs Experimentalphysik 2 - Mittwoch-Übungsblatt. 1 Aufgabe: Adiabatengleichung fürs Ideale Gas
 Aufgabe: Gasrozess Ferienkurs Exerimentalhysik - Mittwoch-Übungsblatt 1 Aufgabe: Adiabatengleichung fürs Ideale Gas Aus dem 1. HS und den Wärmekaazitäten c und c olgt zusammen mit dem Adiabatenkoeffizienten
Aufgabe: Gasrozess Ferienkurs Exerimentalhysik - Mittwoch-Übungsblatt 1 Aufgabe: Adiabatengleichung fürs Ideale Gas Aus dem 1. HS und den Wärmekaazitäten c und c olgt zusammen mit dem Adiabatenkoeffizienten
(b) Schritt I: freie adiabatische Expansion, also ist δw = 0, δq = 0 und damit T 2 = T 1. Folglich ist nach 1. Hauptsatz auch U = 0.
 3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
3 Lösungen Lösung zu 65. (a) Siehe Abbildung 1. (b) Schritt I: freie adiabatische Expansion, also ist δw 0, δq 0 und damit. Folglich ist nach 1. Hauptsatz auch U 0. Schritt II: isobare Kompression, also
1 Massenwirkungsgesetz
 1 Massenwirkungsgesetz Zeige: Bei konstantem Druck und konstanter emperatur gilt für chemische Reaktionen der Art a 1 A 1 + a A + : : : a L A L b 1 B 1 + b B + : : : b R B R : K c (A i ) ai c (B j ) bj
1 Massenwirkungsgesetz Zeige: Bei konstantem Druck und konstanter emperatur gilt für chemische Reaktionen der Art a 1 A 1 + a A + : : : a L A L b 1 B 1 + b B + : : : b R B R : K c (A i ) ai c (B j ) bj
Übung 2. Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen
 Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen Wärmekapazitäten isochore/isobare Zustandsänderungen Standardbildungsenthalpien Heizwert/Brennwert adiabatische Flammentemperatur WS 2013/14
Ziel: Bedeutung/Umgang innere Energie U und Enthalpie H verstehen Wärmekapazitäten isochore/isobare Zustandsänderungen Standardbildungsenthalpien Heizwert/Brennwert adiabatische Flammentemperatur WS 2013/14
Zweiter Hauptsatz der Thermodynamik
 Zweiter Hauptsatz der hermodynamik Spontan ablaufende Prozesse: Expansion von ideale Gasen Diffusion Wärmeaustausch Der 2. Hauptsatz der hermodynamik liefert Kriterien, mit deren Hilfe sich die Richtung
Zweiter Hauptsatz der hermodynamik Spontan ablaufende Prozesse: Expansion von ideale Gasen Diffusion Wärmeaustausch Der 2. Hauptsatz der hermodynamik liefert Kriterien, mit deren Hilfe sich die Richtung
1. Klausur zur Vorlesung Physikalische Chemie I
 1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
1. Klausur zur Vorlesung Physikalische Chemie I Sommersemester 2006 8. Juni 2006 Angaben zur Person (BITTE LESERLICH UND IN DRUCKBUCHSTABEN) Name, Vorname... Geburtsdatum und -ort... Matrikelnummer...
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg Lösungen zum Übungsblatt 4 zur Vorlesung Physikalische Chemie II WS 2008/09 Prof. E. Bartsch 4.1 Der Siedepunkt einer flüssigen Mischung
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Physik 2 (B.Sc. EIT) 2. Übungsblatt
 Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
Institut für Physik Werner-Heisenberg-Weg 9 Fakultät für Elektrotechnik 85577 München / Neubiberg Universität der Bundeswehr München / Neubiberg Prof Dr H Baumgärtner Übungen: Dr-Ing Tanja Stimpel-Lindner,
PC I Thermodynamik G. Jeschke FS Lösung zur Übung 12
 PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
PC I Thermodynamik G. Jeschke FS 2015 Lösung zur Übung 12 12.1 Die Hydrierung von Ethen zu Ethan a) Die Reaktionsenthalpie ist direkt aus den in der Aufgabenstellung tabellierten Standardbildungsenthalpien
Chemische Thermodynamik ENTROPIE LÖSUNGEN
 L-Üb29: Die Standardentropie der Edelgase steigt in regelmässiger Weise mit der molaren Masse. Diese schöne Regelmässigkeit kommt daher, dass die Edelgase nur Translationsenergie besitzen und keine Schwingungsenergie
L-Üb29: Die Standardentropie der Edelgase steigt in regelmässiger Weise mit der molaren Masse. Diese schöne Regelmässigkeit kommt daher, dass die Edelgase nur Translationsenergie besitzen und keine Schwingungsenergie
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
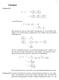 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
Chemie Klausur
 Chemie Klausur 12.1 1 21. Oktober 2002 Aufgaben Aufgabe 1 1.1. Definiere: Innere Energie, Enthalpieänderung, Volumenarbeit, Standard-Bildungsenthalpie, molare Standard- Bildungsenthalpie. 4 VP 1.2. Stelle
Chemie Klausur 12.1 1 21. Oktober 2002 Aufgaben Aufgabe 1 1.1. Definiere: Innere Energie, Enthalpieänderung, Volumenarbeit, Standard-Bildungsenthalpie, molare Standard- Bildungsenthalpie. 4 VP 1.2. Stelle
Der Zweite Hauptsatz der TD- Lernziele
 Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Der Zweite Hautsatz der D- Lernziele o Einleitung o Entroie (Definition, Entroie als Zustandsfunktion, die Clausius sche Ungleichung) o Der Zweite Hautzatz der D o Die Entroieänderungen bei seziellen Prozessen
Physik I TU Dortmund WS2017/18 Gudrun Hiller Shaukat Khan Kapitel 6
 Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
Physik I U Dortmund WS7/8 Gudrun Hiller Shaukat Khan Kapitel Carnotscher Kreisprozess Modell eines Kreisprozesses (Gedankenexperiment). Nicht nur von historischem Interesse (Carnot 84), sondern auch Prozess
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische Cheie lbert-ludwigs-universität Freiburg Lösungen zu 9. Übungsblatt zur Vorlesung hysikalische Cheie I SS 2014 rof. Dr. artsch 9.1 L/M Hean (C 6 H 14 ) und Heptan (C 7 H 16 )
Institut für hysikalische Cheie lbert-ludwigs-universität Freiburg Lösungen zu 9. Übungsblatt zur Vorlesung hysikalische Cheie I SS 2014 rof. Dr. artsch 9.1 L/M Hean (C 6 H 14 ) und Heptan (C 7 H 16 )
Probeklausur STATISTISCHE PHYSIK PLUS
 DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
Thermochemie. Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2
 Thermochemie Energie ist die Fähigkeit, Arbeit zu leisten. E pot = m g h E kin = ½ m v 2 Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2 Eine wirkende Kraft
Thermochemie Energie ist die Fähigkeit, Arbeit zu leisten. E pot = m g h E kin = ½ m v 2 Arbeit ist das Produkt aus wirkender Kraft F und Weglänge s. w = F s 1 J = 1 Nm = 1 kgm 2 /s 2 Eine wirkende Kraft
Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I
 Institut für Anorganische Chemie Prof. Dr. R. Streubel Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I Vorlesung für die Studiengänge Bachelor Chemie und Lebensmittelchemie Im WS 08/09 Die
Institut für Anorganische Chemie Prof. Dr. R. Streubel Modul BCh 1.2 Praktikum Anorganische und Analytische Chemie I Vorlesung für die Studiengänge Bachelor Chemie und Lebensmittelchemie Im WS 08/09 Die
11.2 Die absolute Temperatur und die Kelvin-Skala
 11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
11. Die absolute Temperatur und die Kelvin-Skala p p 0 Druck p = p(t ) bei konstantem olumen 1,0 0,5 100 50 0-50 -100-150 -00-73 T/ C Tripelpunkt des Wassers: T 3 = 73,16 K = 0,01 C T = 73,16 K p 3 p Windchill-Faktor
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Institut für hysikalische heie Albert-Ludwigs-Universität Freiburg Lösungen zu 5. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 5. M Leiten Sie einen allgeeinen Ausdruck für die Änderung
Institut für hysikalische heie Albert-Ludwigs-Universität Freiburg Lösungen zu 5. Übungsblatt zur orlesung hysikalische heie I SS 04 rof. Dr. Bartsch 5. M Leiten Sie einen allgeeinen Ausdruck für die Änderung
4. Freie Energie/Enthalpie & Gibbs Gleichungen
 4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
4. Freie Energie/Enthalpie & Gibbs Gleichungen 1. Eigenschaften der Materie in der Gasphase 2. Erster Hauptsatz: Arbeit und Wärme 3. Entropie und Zweiter Hauptsatz der hermodynamik 4. Freie Enthalpie G,
D r H Entropie-Änderungeng. D rs Arbeit, maximale (Nicht Volumen) D r G
 REP Was schon behandelt wurde: 1. Hauptsatz 2. Hauptsatz Enthalpie-Änderungen D r H Entropie-Änderungeng D rs Arbeit, maximale (Nicht Volumen) D r G REP D r G = D r H - TDD r S Gleichgewicht: D r G = 0
REP Was schon behandelt wurde: 1. Hauptsatz 2. Hauptsatz Enthalpie-Änderungen D r H Entropie-Änderungeng D rs Arbeit, maximale (Nicht Volumen) D r G REP D r G = D r H - TDD r S Gleichgewicht: D r G = 0
Abiturvorbereitung Energetik
 Abiturvorbereitung Energetik Folgende Fragen sind an Chemie-Abiturfragen aus Baden-Württemberg angelehnt, wurden jedoch aus didaktischen Gründen in der Aufgabenstellung ergänzt, modifiziert oder gekürzt.
Abiturvorbereitung Energetik Folgende Fragen sind an Chemie-Abiturfragen aus Baden-Württemberg angelehnt, wurden jedoch aus didaktischen Gründen in der Aufgabenstellung ergänzt, modifiziert oder gekürzt.
Übungsblatt MWG und Spontanität 2 Seite 1 von 6
 Übungsblatt MWG und Spontanität Seite 1 von 6 Aufgabe 1 Im Gleichgewicht H (g) + N (g) NH (g) mit 7.18. 10 - ka - betragen die Gleichgewichtsdrücke p(n ) 6.4 ka und p(nh ) 16.8 ka. Wie gross ist der Gleichgewichtsdruck
Übungsblatt MWG und Spontanität Seite 1 von 6 Aufgabe 1 Im Gleichgewicht H (g) + N (g) NH (g) mit 7.18. 10 - ka - betragen die Gleichgewichtsdrücke p(n ) 6.4 ka und p(nh ) 16.8 ka. Wie gross ist der Gleichgewichtsdruck
Thermodynamische Hauptsätze, Kreisprozesse Übung
 Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
Thermodynamische Hauptsätze, Kreisprozesse Übung Marcus Jung 14.09.2010 Inhaltsverzeichnis Inhaltsverzeichnis 1 Thermodynamische Hauptsätze 3 1.1 Aufgabe 1:.................................... 3 1.2 Aufgabe
PC I Thermodynamik J. Stohner/M. Quack Sommer Übung 12
 PC I Thermodynamik J. Stohner/M. Quack Sommer 2006 Übung 12 Ausgabe: Dienstag, 20. 6. 2006 Rückgabe: Dienstag, 27. 6. 2006 (vor Vorlesungsbeginn) Besprechung: Freitag, 30.6./Montag, 3.7.2006 (in der Übungsstunde)
PC I Thermodynamik J. Stohner/M. Quack Sommer 2006 Übung 12 Ausgabe: Dienstag, 20. 6. 2006 Rückgabe: Dienstag, 27. 6. 2006 (vor Vorlesungsbeginn) Besprechung: Freitag, 30.6./Montag, 3.7.2006 (in der Übungsstunde)
Lösungen zur Übungsklausur Thermodynamik WS 2003/04
 Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Lösungen zur Übungsklausur hermodynamik WS 003/04 Name: Vorname: Matrikelnummer: Aufgabe 3 4 5 Gesamt Note mögliche Punkte 9 0 8 9 4 40 erreichte Punkte Die Klausur wird bei Erreichen von insgesamt 0 Punkten
Erster und Zweiter Hauptsatz
 PN 1 Einführung in die alphysik für Chemiker und Biologen 26.1.2007 Paul Koza, Nadja Regner, Thorben Cordes, Peter Gilch Lehrstuhl für BioMolekulare Optik Department für Physik Ludwig-Maximilians-Universität
PN 1 Einführung in die alphysik für Chemiker und Biologen 26.1.2007 Paul Koza, Nadja Regner, Thorben Cordes, Peter Gilch Lehrstuhl für BioMolekulare Optik Department für Physik Ludwig-Maximilians-Universität
PN 1 Einführung in die Experimentalphysik für Chemiker und Biologen
 PN 1 Einführung in die Experimentalphysik für Chemiker und Biologen 26.1.2007 Paul Koza, Nadja Regner, Thorben Cordes, Peter Gilch Lehrstuhl für BioMolekulare Optik Department für Physik Ludwig-Maximilians-Universität
PN 1 Einführung in die Experimentalphysik für Chemiker und Biologen 26.1.2007 Paul Koza, Nadja Regner, Thorben Cordes, Peter Gilch Lehrstuhl für BioMolekulare Optik Department für Physik Ludwig-Maximilians-Universität
Aufgaben Kreisprozesse. 1. Ein ideales Gas durchläuft den im V(T)- Diagramm dargestellten Kreisprozess. Es ist bekannt:
 Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
Aufgaben Kreisrozesse. Ein ideales Gas durchläuft den im ()- Diagramm dargestellten Kreisrozess. Es ist bekannt: 8 cm 6 cm 00 K 8MPa MPa a) Geben Sie die fehlenden Zustandsgrößen, und für die Zustände
T4p: Thermodynamik und Statistische Physik Prof. Dr. H. Ruhl Übungsblatt 8 Lösungsvorschlag
 T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
T4p: Thermodynamik und Statistische Physik Pro Dr H Ruhl Übungsblatt 8 Lösungsvorschlag 1 Adiabatengleichung Als adiabatische Zustandssänderung bezeichnet man einen thermodynamischen organg, bei dem ein
TU-München, Musterlösung. Experimentalphysik II - Ferienkurs Andreas Schindewolf
 TU-München, 18.08.2009 Musterlösung Experimentalphysik II - Ferienkurs Andreas Schindewolf 1 Random Kreisprozess a Wärme wird nur im isochoren Prozess ab zugeführt. Hier ist W = 0 und Q ab = nc V t b T
TU-München, 18.08.2009 Musterlösung Experimentalphysik II - Ferienkurs Andreas Schindewolf 1 Random Kreisprozess a Wärme wird nur im isochoren Prozess ab zugeführt. Hier ist W = 0 und Q ab = nc V t b T
Klausur zu Grundlagen der Physikalischen Chemie (21371) - Teil 1
 Klausur zu Grundlagen der Physikalischen Chemie (21371) - Teil 1 Name: Mat.Nr.: Punkte: /50 Zur Bearbeitung der folgenden Aufgaben haben Sie 90 Minuten Zeit. Antworten dürfen in Form von Stichpunkten gegeben
Klausur zu Grundlagen der Physikalischen Chemie (21371) - Teil 1 Name: Mat.Nr.: Punkte: /50 Zur Bearbeitung der folgenden Aufgaben haben Sie 90 Minuten Zeit. Antworten dürfen in Form von Stichpunkten gegeben
Beispielaufgaben IChO 2. Runde 2019 Grundlagen der Thermodynamik, Lösungen. = -0,900 kj/k (21,84 22,15) K / 13,16 g = 0,279 kj / 13,16 g
 Lösung Beispiel 1 Erhaltung der Energie a) ZnSO 4(s) ZnSO 4(aq): Lösungsenthalpie Lsg (ZnSO 4) = -0,900 kj/k (23,52 22,55) K / 1,565 g = -0,873 kj / 1,565 g mit (ZnSO 4) = 161,48 g/mol: Lsg (ZnSO 4) =
Lösung Beispiel 1 Erhaltung der Energie a) ZnSO 4(s) ZnSO 4(aq): Lösungsenthalpie Lsg (ZnSO 4) = -0,900 kj/k (23,52 22,55) K / 1,565 g = -0,873 kj / 1,565 g mit (ZnSO 4) = 161,48 g/mol: Lsg (ZnSO 4) =
Musterlösung zu Übung 7
 PCI hermodynamik G. Jeschke FS 05 Musterlösung zu Übung 7 08.04.05 a Der Goldbarren wird beim Einbringen in das Reservoir sprunghaft erwärmt. Der Wärmeaustausch erfolgt daher auf irreversiblem Weg. Um
PCI hermodynamik G. Jeschke FS 05 Musterlösung zu Übung 7 08.04.05 a Der Goldbarren wird beim Einbringen in das Reservoir sprunghaft erwärmt. Der Wärmeaustausch erfolgt daher auf irreversiblem Weg. Um
Musterlösung Übung 3
 Musterlösung Übung 3 Aufgabe 1: Der 1. Hautsatz der Thermodynamik a) Für ein geschlossenes System folgt aus der Energieerhaltung (Gleichung (94) im Skrit) du = dw + dq, (1.1) da ausser Arbeit und Wärme
Musterlösung Übung 3 Aufgabe 1: Der 1. Hautsatz der Thermodynamik a) Für ein geschlossenes System folgt aus der Energieerhaltung (Gleichung (94) im Skrit) du = dw + dq, (1.1) da ausser Arbeit und Wärme
4.1.2 Quantitative Definition durch Wärmekapazitäten
 4 Energie Aus moderner (mikroskopischer Sicht ist klar, daß die Summe U der kinetischen Energien der Moleküle eines Gases (und ggf. ihrer Wechselwirkungsenergien eine thd. Zustandsgröße des Gases ist,
4 Energie Aus moderner (mikroskopischer Sicht ist klar, daß die Summe U der kinetischen Energien der Moleküle eines Gases (und ggf. ihrer Wechselwirkungsenergien eine thd. Zustandsgröße des Gases ist,
1 Thermodynamik allgemein
 Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Einführung in die Energietechnik Tutorium II: Thermodynamik Thermodynamik allgemein. offenes System: kann Materie und Energie mit der Umgebung austauschen. geschlossenes System: kann nur Energie mit der
Moderne Theoretische Physik IIIa WS 18/19
 Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik IIIa WS 18/19 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 2 Dr. Stefan Rex Besprechung: 06.11.2018
Karlsruher Institut für echnologie Institut für heorie der Kondensierten Materie Moderne heoretische Physik IIIa WS 18/19 Prof. Dr. Alexander Mirlin Lösungen zu Blatt 2 Dr. Stefan Rex Besprechung: 06.11.2018
Prof. Dr. Peter Vogl, Thomas Eissfeller, Peter Greck. Übung in Thermodynamik und Statistik 4B Blatt 8 (Abgabe Di 3. Juli 2012)
 U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
U München Physik Department, 33 http://www.wsi.tum.de/33 eaching) Prof. Dr. Peter Vogl, homas Eissfeller, Peter Greck Übung in hermodynamik und Statistik 4B Blatt 8 Abgabe Di 3. Juli 202). Extremalprinzip
Aufgaben zur Experimentalphysik II: Thermodynamik
 Aufgaben zur Experimentalphysik II: Thermodynamik Lösungen William Hefter - 5//8 1. 1. Durchmesser der Stahlstange nach T : D s D s (1 + α Stahl T) Durchmesser der Bohrung im Ring nach T : D m D m (1 +
Aufgaben zur Experimentalphysik II: Thermodynamik Lösungen William Hefter - 5//8 1. 1. Durchmesser der Stahlstange nach T : D s D s (1 + α Stahl T) Durchmesser der Bohrung im Ring nach T : D m D m (1 +
Physikalische Chemie 0 Klausur, 22. Oktober 2011
 Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
C Metallkristalle. Allgemeine Chemie 60. Fluorit CaF 2 KZ(Ca) = 8, KZ(F) = 4. Tabelle 7: weiter Strukturtypen. kubisch innenzentriert KZ = 8
 Allgemeine Chemie 60 Fluorit CaF 2 KZ(Ca) = 8, KZ(F) = 4 Tabelle 7: weiter Strukturtypen C Metallkristalle kubisch primitiv KZ = 6 kubisch innenzentriert KZ = 8 kubisch flächenzentriert, kubisch dichteste
Allgemeine Chemie 60 Fluorit CaF 2 KZ(Ca) = 8, KZ(F) = 4 Tabelle 7: weiter Strukturtypen C Metallkristalle kubisch primitiv KZ = 6 kubisch innenzentriert KZ = 8 kubisch flächenzentriert, kubisch dichteste
Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10
 Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10 1. Berechnen Sie die Viskosität von Benzoldampf bei 0 C, 0 C und 900 C, verwenden sie dabei einen mittleren Stoßquerschnitt von σ 0,88 nm.
Übung zur Vorlesung PC I Chemische Thermodynamik B.Sc. Blatt 10 1. Berechnen Sie die Viskosität von Benzoldampf bei 0 C, 0 C und 900 C, verwenden sie dabei einen mittleren Stoßquerschnitt von σ 0,88 nm.
Lösungen zum Übungsblatt 5 zur Vorlesung Physikalische Chemie WS 2009/2010 Prof. Dr. Bartsch
 1 Lösungen zum Übungsblatt 5 zu Volesung hysikalische Chemie WS 29/21 o. D. Batsch 5.1 L (5 unkte Geben Sie die Deinition de Enthalpie an und zeigen Sie, dass die bei konstantem Duck zwischen System und
1 Lösungen zum Übungsblatt 5 zu Volesung hysikalische Chemie WS 29/21 o. D. Batsch 5.1 L (5 unkte Geben Sie die Deinition de Enthalpie an und zeigen Sie, dass die bei konstantem Duck zwischen System und
Modul Chemische Thermodynamik: Verdampfungsgleichgewicht
 Modul Chemische hermodynamik: Verdampfungsgleichgewicht M. Broszio, F. Noll, Oktober 2007, Korrekturen September 2008 Lernziele Ziel dieses Versuches ist es einen Einblick in die Beschreibung von Phasengleichgewichten
Modul Chemische hermodynamik: Verdampfungsgleichgewicht M. Broszio, F. Noll, Oktober 2007, Korrekturen September 2008 Lernziele Ziel dieses Versuches ist es einen Einblick in die Beschreibung von Phasengleichgewichten
Musterlösung zu Übung 7
 PCI Thermodynamik G. eschke FS 011 Musterlösung zu Übung 7 (8. April 011) Aufgabe 1 (a) Die Shomate-Gleichung (Script (153)) lautet: C p (gas, T ) A + BT + CT + DT 3 + E T (1) Für das Kohlenstoffmonooxid
PCI Thermodynamik G. eschke FS 011 Musterlösung zu Übung 7 (8. April 011) Aufgabe 1 (a) Die Shomate-Gleichung (Script (153)) lautet: C p (gas, T ) A + BT + CT + DT 3 + E T (1) Für das Kohlenstoffmonooxid
Theoretische Physik IV
 Sommersemester 2011 heoretische hysik IV hermodynamik und statistische hysik I Skriptum zur Vorlesung von Helmuth Hüffel Umgesetzt in L A EX von Horak Johannes LYX-Version von Bernhard Reiter Kapitel 1
Sommersemester 2011 heoretische hysik IV hermodynamik und statistische hysik I Skriptum zur Vorlesung von Helmuth Hüffel Umgesetzt in L A EX von Horak Johannes LYX-Version von Bernhard Reiter Kapitel 1
Aufgabe 1: Theorie Punkte
 Aufgabe 1: Theorie.......................................... 30 Punkte (a) (2 Punkte) In einen Mischer treten drei Ströme ein. Diese haben die Massenströme ṁ 1 = 1 kg/s, ṁ 2 = 2 kg/s und ṁ 3 = 2 kg/s.
Aufgabe 1: Theorie.......................................... 30 Punkte (a) (2 Punkte) In einen Mischer treten drei Ströme ein. Diese haben die Massenströme ṁ 1 = 1 kg/s, ṁ 2 = 2 kg/s und ṁ 3 = 2 kg/s.
Institut für Physikalische Chemie Albert-Ludwigs-Universität Freiburg
 Isttut für Physkalsche heme lbert-ludwgs-uverstät Freburg Physkalsche heme für Studerede der Mkrosystemtechk Lösuge zum 6. Übugsblatt m WS 00/ Prof. Dr. Gräber 6. L (0 Pukte) a) rage Se de thalpe gege
Isttut für Physkalsche heme lbert-ludwgs-uverstät Freburg Physkalsche heme für Studerede der Mkrosystemtechk Lösuge zum 6. Übugsblatt m WS 00/ Prof. Dr. Gräber 6. L (0 Pukte) a) rage Se de thalpe gege
Tutorium Physik 1. Wärme.
 Tutorium Physik 1. Wärme. WS 18/19 1. Sem. B.Sc. Catering und Hospitality Services Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nicht-kommerziell Weitergabe unter gleichen
Tutorium Physik 1. Wärme. WS 18/19 1. Sem. B.Sc. Catering und Hospitality Services Diese Präsentation ist lizenziert unter einer Creative Commons Namensnennung Nicht-kommerziell Weitergabe unter gleichen
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
Kurze Einführung in die Thermodynamik mit Begriffsklärungen
 Kurze Einführung in die Thermodynamik mit Begriffsklärungen Gliederung 1. Begriffsklärungen 2. Energieumwandlungen 3. Molare Volumenarbeit 4. Hauptsätze der Thermodynamik 5. Quellen 1. Begriffsklärungen
Kurze Einführung in die Thermodynamik mit Begriffsklärungen Gliederung 1. Begriffsklärungen 2. Energieumwandlungen 3. Molare Volumenarbeit 4. Hauptsätze der Thermodynamik 5. Quellen 1. Begriffsklärungen
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
Hochschule Düsseldorf University of Applied Sciences. 20. April 2016 HSD. Energiespeicher Wärme
 Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Versuch 2. Physik für (Zahn-)Mediziner. c Claus Pegel 13. November 2007
 Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Versuch 2 Physik für (Zahn-)Mediziner c Claus Pegel 13. November 2007 1 Wärmemenge 1 Wärme oder Wärmemenge ist eine makroskopische Größe zur Beschreibung der ungeordneten Bewegung von Molekülen ( Schwingungen,
Name, Vorname (bitte leserlich) Studiengang Matr. Nr. oder Pseudonym Σ
 Name, Vorname (bitte leserlich) Studiengang Matr. Nr. oder Pseudonym... LA CHE DS BIO... 1 2 3 4 5 6 7 8 Σ bestanden (7) (4) (4) (3) (10) (6) (6) (4) Klausur zum Grundpraktikum Physikalische Chemie im
Name, Vorname (bitte leserlich) Studiengang Matr. Nr. oder Pseudonym... LA CHE DS BIO... 1 2 3 4 5 6 7 8 Σ bestanden (7) (4) (4) (3) (10) (6) (6) (4) Klausur zum Grundpraktikum Physikalische Chemie im
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Versuch: Sieden durch Abkühlen
 ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
ersuch: Sieden durch Abkühlen Ein Rundkolben wird zur Hälfte mit Wasser gefüllt und auf ein Dreibein mit Netz gestellt. Mit dem Bunsenbrenner bringt man das Wasser zum Sieden, nimmt dann die Flamme weg
9. Thermodynamik. 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala. 9.4 Wärmekapazität
 9. Thermodynamik 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala 93 9.3 Thermische h Ausdehnung 9.4 Wärmekapazität 9. Thermodynamik Aufgabe: - Temperaturverhalten von Gasen,
9. Thermodynamik 9.1 Temperatur und thermisches Gleichgewicht 9.2 Thermometer und Temperaturskala 93 9.3 Thermische h Ausdehnung 9.4 Wärmekapazität 9. Thermodynamik Aufgabe: - Temperaturverhalten von Gasen,
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 05. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 05. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 05. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 05. 07. 2007 Klausur Die Klausur
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Vorlesung T4p, WS08/09 Klausur am 11. Februar 2009 Name: Matrikelnummer: Erreichte Punktzahlen: 1.1 1.2 1.3 2.1 2.2 2.3 2.4 Hinweise Die Bearbeitungszeit
Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H 2 O von
 Aufgabe 1: Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H O von 0 C bis zum Siedepunkt (100 C) zu erwärmen. Die spezifische Wärmekapazität von Wasser c = 4.18 J K - 1 g -1. Lösung
Aufgabe 1: Berechnen Sie die Wärmemenge in kj, die erforderlich ist, um 750g H O von 0 C bis zum Siedepunkt (100 C) zu erwärmen. Die spezifische Wärmekapazität von Wasser c = 4.18 J K - 1 g -1. Lösung
4 Hauptsätze der Thermodynamik
 I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
I Wärmelehre -21-4 Hauptsätze der hermodynamik 4.1 Energieformen und Energieumwandlung Innere Energie U Die innere Energie U eines Körpers oder eines Systems ist die gesamte Energie die darin steckt. Es
Physik für Mediziner im 1. Fachsemester
 Physik für Mediziner im 1. Fachsemester #10 30/10/2008 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Thermisches Gleichgewicht Soll die Temperatur geändert werden, so muss dem System Wärme (kinetische
Physik für Mediziner im 1. Fachsemester #10 30/10/2008 Vladimir Dyakonov dyakonov@physik.uni-wuerzburg.de Thermisches Gleichgewicht Soll die Temperatur geändert werden, so muss dem System Wärme (kinetische
Hauptsatz der Thermodynamik
 0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
0.7. Hauptsatz der Thermodynamik Die einem System von außen zugeführte Wärmemenge Q führt zu Erhöhung U der inneren Energie U und damit Erhöhung T der Temperatur T Expansion des olumens gegen den äußeren
Tutorium Physik 1. Wärme
 1 Tutorium Physik 1. Wärme WS 15/16 1.Semester BSc. Oec. und BSc. CH 2 Themen 1. Einführung, Umrechnen von Einheiten / Umformen von Formeln 2. Kinematik, Dynamik 3. Arbeit, Energie, Leistung 4. Impuls
1 Tutorium Physik 1. Wärme WS 15/16 1.Semester BSc. Oec. und BSc. CH 2 Themen 1. Einführung, Umrechnen von Einheiten / Umformen von Formeln 2. Kinematik, Dynamik 3. Arbeit, Energie, Leistung 4. Impuls
Gefahrenstoffe. Styroporkalorimeter, Magnetrührer, digitales Thermometer, Stativ und Stativmaterial
 1.1 V 3 Lösungswärme von Salzen Dieser Versuch zeigt dass beim Lösen von Salzen Wärme freigesetzt wird. Es soll jeweils die emperaturdifferenz beim Lösen verschiedener Salze bestimmt werden und anschließend
1.1 V 3 Lösungswärme von Salzen Dieser Versuch zeigt dass beim Lösen von Salzen Wärme freigesetzt wird. Es soll jeweils die emperaturdifferenz beim Lösen verschiedener Salze bestimmt werden und anschließend
LN Vortermin SS 02. PC Teil
 LN Vortermin SS 02 PC Teil 1. 15g Magnesium werden mit Salzsäure im Überschuß versetzt. Folgende Standardbildungsenthalpien bei 198K sind dazu gegeben: Mg 2+ -466,85 kj/mol Cl - aq -167,16 kj/mol a) Berechnen
LN Vortermin SS 02 PC Teil 1. 15g Magnesium werden mit Salzsäure im Überschuß versetzt. Folgende Standardbildungsenthalpien bei 198K sind dazu gegeben: Mg 2+ -466,85 kj/mol Cl - aq -167,16 kj/mol a) Berechnen
Spontane und nicht spontane Vorgänge Freiwillig und nicht freiwillig ablaufende Vorgänge
 Prof. Dr. Norbert Hampp 1/7 6. Freie Energie und Freie Enthalphie / 2. Hauptsatz Spontane und nicht spontane Vorgänge Freiwillig und nicht freiwillig ablaufende Vorgänge 1. Empirischer Befund: Bei einer
Prof. Dr. Norbert Hampp 1/7 6. Freie Energie und Freie Enthalphie / 2. Hauptsatz Spontane und nicht spontane Vorgänge Freiwillig und nicht freiwillig ablaufende Vorgänge 1. Empirischer Befund: Bei einer
A 2.6 Wie ist die Zusammensetzung der Flüssigkeit und des Dampfes eines Stickstoff-Sauerstoff-Gemischs
 A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
A 2.1 Bei - 10 o C beträgt der Dampfdruck des Kohlendioxids 26,47 bar, die Dichte der Flüssigkeit 980,8 kg/m 3 und die Dichte des Dampfes 70,5 kg/m 3. Bei - 7,5 o C beträgt der Dampfdruck 28,44 bar. Man
Die Zusammensetzung am Ausgang der 1. Verdampfereinheit (0) kann aus dem beigefügten T, x-diagramm abgelesen werden zu
 Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
Fragenteil : Aufgabe 1 Phasengleichgewichte 15 P a Eine binäre Mischung wird in einer Verdamfereinheit kontinuierlich teilweise verdamft. Messtechnisch wurden für die Ausgangsströme der Temeratur, der
8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale
 8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper
8.3 Ausgleichsprozesse in abgeschlossenen und nichtabgeschlossenen Systemen - thermodynamisches Gleichgewicht und thermodynamische Potentiale Rückschau: Mechanisches Gleichgewicht und Stabilität Ein Körper
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung
 E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
E2: Wärmelehre und Elektromagnetismus 6. Vorlesung 26.04.2018 Heute: - Kondensationskerne - Van der Waals-Gas - 2. Hauptsatz https://xkcd.com/1166/ Prof. Dr. Jan Lipfert Jan.Lipfert@lmu.de 26.04.2018 Prof.
