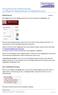
Skizze zur Veranschaulichung der Legendretransformation
|
|
|
- Benedikt Klein
- vor 8 Jahren
- Abrufe
Transkript
1 9 Die thermodynamischen Funktionen G und H Ehe das Schema des vorherigen Abschnittes zur Konstruktion weiterer thermodynamischer Potentiale zu Ende gebracht wird, kurz einige Erläuterungen zur Legendretransformation. Die Funktion y fx) soll weiter keinen Einschränkungen unterliegen, außer daß sie eine konvexe Funktion f x) > 0 ist. Die Legendretransformierte g) ist durch folgende geometrische Konstruktion gegeben: y fx) y x g Skizze zur Veranschaulichung der Legendretransformation Man gibt sich eine Steigung vor, die eine Gerade y x festlegt. Dann sucht man das Maximum des Abstandes zwischen Gerade und Kurve das dann die Legendretransformierte definiert d dx x fx)) f x) 0, g) f x) x fx) mit f x). Wegen der Konvexität ist die Konstruktion eindeutig. Für die thermodynamischen Potentiale ist die Voraussetzung für die Legendretransformation erfüllt. Geht man z.b. von der inneren Energie US) zur freien Energie F US) S mit du/ds über, dann ist die Konvexität der Kurve US) garantiert, weil d 2 U/dS 2 d/ds /C > 0 ist, denn die Wärmekaazität C ist immer ositiv. Man kann die Legendretransformation noch einmal ausführen, aber man kommt nur zum Ausgangsunkt zurück, dh. das Quadrat der Abbildung ist die Identität g) x fx), dg d x + df dx x ) dx d x g 2 dg d g) f. Soviel zur geometrischen Veranschaulichung der Legendretransformation! Betrachtet man das Differential der freien Energie, deren Namensgebung übrigens sofort aus diesem Differential ersichtlich ist df S d dv, denn bei konstanter emeratur ergibt die Änderung der freien Energie die nach außen abgegebene Arbeit, also die vom thermodynamischen System freigegebene Energie. Von der freien Energie gelangt man zum Gibbsschen Potential G, ) dg df + d V ) S d dv + dv + V d dg S d + V d. 16
2 Damit sind die natürlichen Variablen von G die emeratur und der Druck, beides Größen, die nicht von der Ausdehnung und Größe des thermodynamischen Systems abhängen, wie z.b. das Volumen V und die Entroie S. Aus der Energie US, V ) kann man die Enthalie, die mit HS, ) abgekürzt wird, gewinnen. Der Buchstabe H steht auch für Heat function, weil beim Durchlaufen eines heißen Gases durch eine Wärmekraftmaschine der entscheidende Parameter der Druck ist, wobei die Entroie wegen der geringen Wärmeleitung als konstant angesehen werden kann. H gibt also die zur Arbeitsleistung verfügbare Energie an. Das Differential dh gewinnt man wie vorher durch Legendretransformation dh du + d V ) ds dv + dv + V d dh ds + V d, so daß in der at die Entroie S und der Druck die Variablen der Enthalie sind. In der folgenden abelle sind alle Potentiale zusammengestellt. hermodynamische Potentiale Name Formel Differential Entroie SU, V ) ds 1 du + dv innere Energie US, V ) du ds dv freie Energie F, V ) U S df S d dv Gibbssches Potential G, ) F + V dg S d + V d Enthalie HS, ) U + V dh ds + V d Die zugehörigen Maxwellrelationen kann man unmittelbar an der abelle ablesen. Benutzt man z.b. die Enthalie HS, ) oder das Gibbssche Potential G, ), dann erhält man S S, S als Relationen. Soweit die rein formellen Überlegungen! Als Anwendung soll kurz der Joule-homson-Effekt studiert werden, wie man der Figur entnehmen kann, sind für die Entsannung eines realen Gases die Drucke 1 und 2 einstellbar. Wärmeleitvorgänge sollen keine Rolle sielen, so daß die Entroie S konstant ist. Es geht darum, unter welchen Bedingungen man eine emeraturerniedrigung erwarten kann, 1 P1 P 2 D 2 Gedrosselte Entsannung eines Gases, in der Drossel D muß ein oröses Material sein. 17
3 denn dieser Abkühlungseffekt wurde und wird benutzt, um tiefe emeraturen zu erreichen. Die Enthalhie H U + V ist das richtige Potential für die Analyse, weil sie von S und abhängt. Benutzt man als Modell für ein reales Gas die van der Waalssche Gleichung + a ) V 2 V b) R, dann muß man zuerst die innere Energie U bestimmen. Es geht zunächst um die Volumenabhängigkeit der inneren Energie, beim idealen Gas war bekanntlich die innere Energie volumenunabhängig. Für das van der Waals Gas ist eine Zerlegung von U, V ) in einen nur temeraturabhängigen Anteil und einen nur volumenabängigen Anteil U U 1 ) + U 2 V ) U 1 ) C v, U 2 V )? möglich. Benutzt man die thermodynamische Relation, die aus ds U/ ) U/ 2 ) d + / ) dv folgt, dann kann man U 2 finden U / ) 2. V Um sie zu benutzen, stellt man die van der Waalsgleichung um und erhält für U 2 durch Integration ) U und damit für die Enthalie R V b a V 2 a V 2 U 2 V ) a V H C v a V + V C v 2a V + R V V b C 2a V + R b V b, wobei C C v + R ist. Aus der Konstanz von H kann man nun die emeraturänderung bestimmen H 0 0 C + 2a R b V 2 V. Dabei ist eine Näherung gemacht worden V b V, die eigentlich nur für verdünnte Gase gerechtfertigt ist. Benutzt man diese Näherung durch die ideale Gasgleichung nocheinmal, um die Volumenänderung V durch die Druckänderung zu ersetzen, dh. V R /V 2, dann läßt sich die emeraturänderung in eine übersichtliche Form bringen ) 2 a R b. C Für tiefe emeraturen dominiert der erm mit a, so daß sich das Gas abkühlt, falls der Druck abnimmt. Das ist lausibel, denn a ist der erm, der die anziehende Wechselwirkung der Partikel untereinander beschreibt. Entsannt man das Gas, so muß man Arbeit gegen diese Anziehung leisten, so daß die emeratur abnimmt. Oberhalb der sogenannten Inversionstemeratur, kehrt sich der Effekt um. Das Gas erwärmt sich bei der Entsannung. Das kann man auch anschaulich interretieren. Der Koeffizient b gibt das Eigenvolumen der Partikel an, beschreibt also die Abstoßung zwischen ihnen, so daß ihre Bewegungsenergie wächst, wenn sie mehr Platz haben. Bei Zimmertemeratur kühlt sich Luft ab, Wasserstoff hingegen erwärmt sich, denn der Siedeunkt, der ein Maß für a ist, ist für H 2 erheblich niedriger als für Luft. 18
4 10 Das chemische Potential µ Die thermodynamischen Potentiale S, U, F, G und H von thermodynamischen Systemen, die aus gleichartigen eilchen bestehen, sind für große Systeme additiv, dh. wenn man zwei Systeme zusammenfügt, die im Gleichgewicht stehen ist z.b. S 1 + S 2 S, also die Gesamtentroie Summe der eilentroien. Führt man die Entroie ro eilchen, N ist deren Anzahl, s S/N und das Volumen ro eilchen v V/N ein, dann läßt sich die innere Energie US, V ) als S US, V ) N u N, V ) N us, v) N schreiben, wobei u U/N die innere Energie ro eilchen ist. Ebenso kann man mit den anderen Potentialen verfahren. Für das Gibbssche Potential hat man eine Besonderheit, denn G, ) N µ, ) ist direkt der eilchenzahl roortional, da die emeratur und der Druck nicht von der eilchenzahl abhängen können. µ nennt man das chemische Potential aus Gründen, die säter klarer werden. Bei chemischen Umsetzungen ändern sich z.b. bei emeraturänderungen die Konzentrationen oder die eilchenzahlen der Reaktionartner. Das thermodynamische Potential, das diese eilchenzahl kontrolliert, nennt man deshalb das chemische Potential. Bleibt festzuhalten, daß es zwei Sorten von thermodynmischen Größen gibt, solche die roortional zur eilchenzahl sind, man nennt sie extensive, und solche die unabhängig davon sind. Letztere heißen intensive Größen, Druck und emeratur sind intensive Größen. Die freie Energie und das Gibbssche Potential hängen über die Beziehung G F + V zusammen, so daß sich bei der Differentialbildung aus F N µ, ) V df S d dv + µ dn eine zusätzliche Abhängigkeit der freien Energie F, V, N) von der eilchenzahl N ergibt. Dabei ist das chemische Potential durch die Ableitung ) F µ,v definiert. Um zu sehen was dies bedeutet, schreibt man die exlizite N-Abhängigkeit der freien Energie auf und differenziert nach N: F, V, N) N f, V ) [ ) ] f N ) µ f N V F 1 v N 2 F V N G N. Man erhält also die Definition von µ G/N zurück. Möglicherweise ist das chemische Potential der Kontrollarameter und nicht die eilchenzahl. Mit anderen Worten, was assiert, wenn man eine Legendretransformation ausführt? Welches Potential erhält man mit ) F F N Ω V?,V Formelmässig ergibt sich aus F G V das merkwürdige Ergebnis Ω V. Die richtigen Variablen von Ω sind dieselben, wie die der freien Energie F, nur daß die eilchenzahl N durch das chemische Potential µ zu ersetzen ist, denn es gilt ) Ω dω S d dv N dµ Ω, V, µ), N. µ,v 19
5 Um eine Vorstellung vom chemischen Potential µ und dem Ω Potential zu gewinnen, sollen die Ausdrücke für das ideale Gas konstruiert werden. Ein Ausgangsunkt ist die in den vorherigen Abschnitten hergeleitet Formel für die Entroie des idealen Gases SU, V ) C v log U + R log V SU, V, N) Nc v log U N + Nk log V N, die bei der Berücksichtigung der eilchenzahl abgeändert werden muß. Man führt die Gaskonstante R ro eilchen ein, dh. R k N. Die Konstante k ist die Boltzmannkonstante. Analog ist C v c v N. Neben diesen Ersetzungen, muß man die Formel noch korrigieren, um eine korrekte eilchenzahlabhängigkeit zu bekommen. Da U N ist, bekäme man für die Entroie S N log N heraus. Das ist wegen der Definition der Entroie über die Wärmemenge nicht korrekt, deshalb muß man in den log Funktionen als Argument U/N oder V/N wählen. Die Entroie SU, V, N) hat also folgende Form SU, V, N) N s U N, V N ), woraus sich das chemische Potential durch Differentiation nach N ergibt ) S U,V Für das ideale Gas ergibt sich danach also S U V ) 1 N G N µ µ c v log U N k log V N + c, wobei der letzte erm nicht vollständig ist, wie man säter sehen wird, denn man braucht die Quantenstatistik für seine Festlegung. Setzt man die richtigen Variablen ein, indem man die für das ideale Gas gültigen Relationen U N c v und V Nk/, / benutzt, dann hat man schließlich µ, ) c v log c v k log k c. Um nachzurüfen, ob sich nicht irgendwelche Fehler eingeschlichen haben, benutzt man dµ s d + v d und schaut nach, ob diese Beziehung erfüllt ist: v ) µ k, s ) µ c v log c v k log k, wobei wie vorher c c v + k benutzt worden ist. Bliebe noch das Ω Potential zu bestimmen. Bei der statistischen Methodik ergibt sich dies eigentlich zwangsläufig, so daß man an dieser Stelle die Konstruktion von Ω für das ideale Gas einsaren kann. 20
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht
 8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
1 Mathematische Grundlagen
 Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Mathematische Grundlagen - 1-1 Mathematische Grundlagen Der Begriff der Menge ist einer der grundlegenden Begriffe in der Mathematik. Mengen dienen dazu, Dinge oder Objekte zu einer Einheit zusammenzufassen.
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren
 Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
Lineargleichungssysteme: Additions-/ Subtraktionsverfahren W. Kippels 22. Februar 2014 Inhaltsverzeichnis 1 Einleitung 2 2 Lineargleichungssysteme zweiten Grades 2 3 Lineargleichungssysteme höheren als
erster Hauptsatz der Thermodynamik,
 1.2 Erster Hautsatz der hermodynamik Wir betrachten ein thermodynamisches System, dem wir eine beliebige Wärmemenge δq zuführen, und an dem wir eine Arbeit da leisten wollen. Werden umgekehrt dem System
1.2 Erster Hautsatz der hermodynamik Wir betrachten ein thermodynamisches System, dem wir eine beliebige Wärmemenge δq zuführen, und an dem wir eine Arbeit da leisten wollen. Werden umgekehrt dem System
Ideale und Reale Gase. Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig)
 Ideale und Reale Gase Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig) Wann sind reale Gase ideal? Reale Gase verhalten sich wie ideale Gase
Ideale und Reale Gase Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig) Wann sind reale Gase ideal? Reale Gase verhalten sich wie ideale Gase
DIFFERENTIALGLEICHUNGEN
 DIFFERENTIALGLEICHUNGEN GRUNDBEGRIFFE Differentialgleichung Eine Gleichung, in der Ableitungen einer unbekannten Funktion y = y(x) bis zur n-ten Ordnung auftreten, heisst gewöhnliche Differentialgleichung
DIFFERENTIALGLEICHUNGEN GRUNDBEGRIFFE Differentialgleichung Eine Gleichung, in der Ableitungen einer unbekannten Funktion y = y(x) bis zur n-ten Ordnung auftreten, heisst gewöhnliche Differentialgleichung
Quadratische Gleichungen
 Quadratische Gleichungen Aufgabe: Versuche eine Lösung zu den folgenden Zahlenrätseln zu finden:.) Verdoppelt man das Quadrat einer Zahl und addiert, so erhält man 00..) Addiert man zum Quadrat einer Zahl
Quadratische Gleichungen Aufgabe: Versuche eine Lösung zu den folgenden Zahlenrätseln zu finden:.) Verdoppelt man das Quadrat einer Zahl und addiert, so erhält man 00..) Addiert man zum Quadrat einer Zahl
Primzahlen und RSA-Verschlüsselung
 Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
Primzahlen und RSA-Verschlüsselung Michael Fütterer und Jonathan Zachhuber 1 Einiges zu Primzahlen Ein paar Definitionen: Wir bezeichnen mit Z die Menge der positiven und negativen ganzen Zahlen, also
7 Rechnen mit Polynomen
 7 Rechnen mit Polynomen Zu Polynomfunktionen Satz. Zwei Polynomfunktionen und f : R R, x a n x n + a n 1 x n 1 + a 1 x + a 0 g : R R, x b n x n + b n 1 x n 1 + b 1 x + b 0 sind genau dann gleich, wenn
7 Rechnen mit Polynomen Zu Polynomfunktionen Satz. Zwei Polynomfunktionen und f : R R, x a n x n + a n 1 x n 1 + a 1 x + a 0 g : R R, x b n x n + b n 1 x n 1 + b 1 x + b 0 sind genau dann gleich, wenn
13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen.
 13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen. Sie heißt linear, wenn sie die Form y (n) + a n 1 y (n 1)
13. Lineare DGL höherer Ordnung. Eine DGL heißt von n-ter Ordnung, wenn Ableitungen y, y, y,... bis zur n-ten Ableitung y (n) darin vorkommen. Sie heißt linear, wenn sie die Form y (n) + a n 1 y (n 1)
Allgemeine Speicherberechnung
 doc 6. Seite von 5 Allgemeine Seicherberechnung echnische Daten Grundlage Die Berechnung eines Hydroseichers bezieht sich auf die Zustandsänderung des Gases im Hydroseicher. Die gleiche Veränderung erfolgt
doc 6. Seite von 5 Allgemeine Seicherberechnung echnische Daten Grundlage Die Berechnung eines Hydroseichers bezieht sich auf die Zustandsänderung des Gases im Hydroseicher. Die gleiche Veränderung erfolgt
OECD Programme for International Student Assessment PISA 2000. Lösungen der Beispielaufgaben aus dem Mathematiktest. Deutschland
 OECD Programme for International Student Assessment Deutschland PISA 2000 Lösungen der Beispielaufgaben aus dem Mathematiktest Beispielaufgaben PISA-Hauptstudie 2000 Seite 3 UNIT ÄPFEL Beispielaufgaben
OECD Programme for International Student Assessment Deutschland PISA 2000 Lösungen der Beispielaufgaben aus dem Mathematiktest Beispielaufgaben PISA-Hauptstudie 2000 Seite 3 UNIT ÄPFEL Beispielaufgaben
2.8 Grenzflächeneffekte
 - 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
- 86-2.8 Grenzflächeneffekte 2.8.1 Oberflächenspannung An Grenzflächen treten besondere Effekte auf, welche im Volumen nicht beobachtbar sind. Die molekulare Grundlage dafür sind Kohäsionskräfte, d.h.
Einführung in die Algebra
 Prof. Dr. H. Brenner Osnabrück SS 2009 Einführung in die Algebra Vorlesung 13 Einheiten Definition 13.1. Ein Element u in einem Ring R heißt Einheit, wenn es ein Element v R gibt mit uv = vu = 1. DasElementv
Prof. Dr. H. Brenner Osnabrück SS 2009 Einführung in die Algebra Vorlesung 13 Einheiten Definition 13.1. Ein Element u in einem Ring R heißt Einheit, wenn es ein Element v R gibt mit uv = vu = 1. DasElementv
Zeichen bei Zahlen entschlüsseln
 Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Zeichen bei Zahlen entschlüsseln In diesem Kapitel... Verwendung des Zahlenstrahls Absolut richtige Bestimmung von absoluten Werten Operationen bei Zahlen mit Vorzeichen: Addieren, Subtrahieren, Multiplizieren
Definition und Begriffe
 Merkblatt: Das Dreieck Definition und Begriffe Das Dreieck ist ein Vieleck. In der Ebene ist es die einfachste Figur, die von geraden Linien begrenzt wird. Ecken: Jedes Dreieck hat drei Ecken, die meist
Merkblatt: Das Dreieck Definition und Begriffe Das Dreieck ist ein Vieleck. In der Ebene ist es die einfachste Figur, die von geraden Linien begrenzt wird. Ecken: Jedes Dreieck hat drei Ecken, die meist
Lineare Gleichungssysteme
 Brückenkurs Mathematik TU Dresden 2015 Lineare Gleichungssysteme Schwerpunkte: Modellbildung geometrische Interpretation Lösungsmethoden Prof. Dr. F. Schuricht TU Dresden, Fachbereich Mathematik auf der
Brückenkurs Mathematik TU Dresden 2015 Lineare Gleichungssysteme Schwerpunkte: Modellbildung geometrische Interpretation Lösungsmethoden Prof. Dr. F. Schuricht TU Dresden, Fachbereich Mathematik auf der
Güte von Tests. die Wahrscheinlichkeit für den Fehler 2. Art bei der Testentscheidung, nämlich. falsch ist. Darauf haben wir bereits im Kapitel über
 Güte von s Grundlegendes zum Konzept der Güte Ableitung der Gütefunktion des Gauss im Einstichprobenproblem Grafische Darstellung der Gütefunktionen des Gauss im Einstichprobenproblem Ableitung der Gütefunktion
Güte von s Grundlegendes zum Konzept der Güte Ableitung der Gütefunktion des Gauss im Einstichprobenproblem Grafische Darstellung der Gütefunktionen des Gauss im Einstichprobenproblem Ableitung der Gütefunktion
Die Gleichung A x = a hat für A 0 die eindeutig bestimmte Lösung. Für A=0 und a 0 existiert keine Lösung.
 Lineare Gleichungen mit einer Unbekannten Die Grundform der linearen Gleichung mit einer Unbekannten x lautet A x = a Dabei sind A, a reelle Zahlen. Die Gleichung lösen heißt, alle reellen Zahlen anzugeben,
Lineare Gleichungen mit einer Unbekannten Die Grundform der linearen Gleichung mit einer Unbekannten x lautet A x = a Dabei sind A, a reelle Zahlen. Die Gleichung lösen heißt, alle reellen Zahlen anzugeben,
Die innere Energie eines geschlossenen Systems ist konstant
 Rückblick auf vorherige Vorlesung Grundsätzlich sind alle möglichen Formen von Arbeit denkbar hier diskutiert: Mechanische Arbeit: Arbeit, die nötig ist um einen Massepunkt von A nach B zu bewegen Konservative
Rückblick auf vorherige Vorlesung Grundsätzlich sind alle möglichen Formen von Arbeit denkbar hier diskutiert: Mechanische Arbeit: Arbeit, die nötig ist um einen Massepunkt von A nach B zu bewegen Konservative
Charakteristikum des Gutachtenstils: Es wird mit einer Frage begonnen, sodann werden die Voraussetzungen Schritt für Schritt aufgezeigt und erörtert.
 Der Gutachtenstil: Charakteristikum des Gutachtenstils: Es wird mit einer Frage begonnen, sodann werden die Voraussetzungen Schritt für Schritt aufgezeigt und erörtert. Das Ergebnis steht am Schluß. Charakteristikum
Der Gutachtenstil: Charakteristikum des Gutachtenstils: Es wird mit einer Frage begonnen, sodann werden die Voraussetzungen Schritt für Schritt aufgezeigt und erörtert. Das Ergebnis steht am Schluß. Charakteristikum
Lineare Funktionen. 1 Proportionale Funktionen 3 1.1 Definition... 3 1.2 Eigenschaften... 3. 2 Steigungsdreieck 3
 Lineare Funktionen Inhaltsverzeichnis 1 Proportionale Funktionen 3 1.1 Definition............................... 3 1.2 Eigenschaften............................. 3 2 Steigungsdreieck 3 3 Lineare Funktionen
Lineare Funktionen Inhaltsverzeichnis 1 Proportionale Funktionen 3 1.1 Definition............................... 3 1.2 Eigenschaften............................. 3 2 Steigungsdreieck 3 3 Lineare Funktionen
Würfelt man dabei je genau 10 - mal eine 1, 2, 3, 4, 5 und 6, so beträgt die Anzahl. der verschiedenen Reihenfolgen, in denen man dies tun kann, 60!.
 040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
040304 Übung 9a Analysis, Abschnitt 4, Folie 8 Die Wahrscheinlichkeit, dass bei n - maliger Durchführung eines Zufallexperiments ein Ereignis A ( mit Wahrscheinlichkeit p p ( A ) ) für eine beliebige Anzahl
Lineare Differentialgleichungen erster Ordnung erkennen
 Lineare Differentialgleichungen erster Ordnung In diesem Kapitel... Erkennen, wie Differentialgleichungen erster Ordnung aussehen en für Differentialgleichungen erster Ordnung und ohne -Terme finden Die
Lineare Differentialgleichungen erster Ordnung In diesem Kapitel... Erkennen, wie Differentialgleichungen erster Ordnung aussehen en für Differentialgleichungen erster Ordnung und ohne -Terme finden Die
Thermodynamik. Basics. Dietmar Pflumm: KSR/MSE. April 2008
 Thermodynamik Basics Dietmar Pflumm: KSR/MSE Thermodynamik Definition Die Thermodynamik... ist eine allgemeine Energielehre als Teilgebiet der Chemie befasst sie sich mit den Gesetzmässigkeiten der Umwandlungsvorgänge
Thermodynamik Basics Dietmar Pflumm: KSR/MSE Thermodynamik Definition Die Thermodynamik... ist eine allgemeine Energielehre als Teilgebiet der Chemie befasst sie sich mit den Gesetzmässigkeiten der Umwandlungsvorgänge
Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen?
 Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen können zwei Ebenen (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen? Wie heiÿt
Welche Lagen können zwei Geraden (im Raum) zueinander haben? Welche Lagen können zwei Ebenen (im Raum) zueinander haben? Welche Lagen kann eine Gerade bezüglich einer Ebene im Raum einnehmen? Wie heiÿt
50. Mathematik-Olympiade 2. Stufe (Regionalrunde) Klasse 11 13. 501322 Lösung 10 Punkte
 50. Mathematik-Olympiade. Stufe (Regionalrunde) Klasse 3 Lösungen c 00 Aufgabenausschuss des Mathematik-Olympiaden e.v. www.mathematik-olympiaden.de. Alle Rechte vorbehalten. 503 Lösung 0 Punkte Es seien
50. Mathematik-Olympiade. Stufe (Regionalrunde) Klasse 3 Lösungen c 00 Aufgabenausschuss des Mathematik-Olympiaden e.v. www.mathematik-olympiaden.de. Alle Rechte vorbehalten. 503 Lösung 0 Punkte Es seien
Repetitionsaufgaben Wurzelgleichungen
 Repetitionsaufgaben Wurzelgleichungen Inhaltsverzeichnis A) Vorbemerkungen B) Lernziele C) Theorie mit Aufgaben D) Aufgaben mit Musterlösungen 4 A) Vorbemerkungen Bitte beachten Sie: Bei Wurzelgleichungen
Repetitionsaufgaben Wurzelgleichungen Inhaltsverzeichnis A) Vorbemerkungen B) Lernziele C) Theorie mit Aufgaben D) Aufgaben mit Musterlösungen 4 A) Vorbemerkungen Bitte beachten Sie: Bei Wurzelgleichungen
Unterrichtsmaterialien in digitaler und in gedruckter Form. Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis
 Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
Unterrichtsmaterialien in digitaler und in gedruckter Form Auszug aus: Übungsbuch für den Grundkurs mit Tipps und Lösungen: Analysis Das komplette Material finden Sie hier: Download bei School-Scout.de
Chemie Zusammenfassung KA 2
 Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Chemie Zusammenfassung KA 2 Wärmemenge Q bei einer Reaktion Chemische Reaktionen haben eine Gemeinsamkeit: Bei der Reaktion wird entweder Energie/Wärme frei (exotherm). Oder es wird Wärme/Energie aufgenommen
Arbeitspunkt einer Diode
 Arbeitspunkt einer Diode Liegt eine Diode mit einem Widerstand R in Reihe an einer Spannung U 0, so müssen sich die beiden diese Spannung teilen. Vom Widerstand wissen wir, dass er bei einer Spannung von
Arbeitspunkt einer Diode Liegt eine Diode mit einem Widerstand R in Reihe an einer Spannung U 0, so müssen sich die beiden diese Spannung teilen. Vom Widerstand wissen wir, dass er bei einer Spannung von
Was ist das Budget für Arbeit?
 1 Was ist das Budget für Arbeit? Das Budget für Arbeit ist ein Persönliches Geld für Arbeit wenn Sie arbeiten möchten aber nicht mehr in einer Werkstatt. Das gibt es bisher nur in Nieder-Sachsen. Und in
1 Was ist das Budget für Arbeit? Das Budget für Arbeit ist ein Persönliches Geld für Arbeit wenn Sie arbeiten möchten aber nicht mehr in einer Werkstatt. Das gibt es bisher nur in Nieder-Sachsen. Und in
Professionelle Seminare im Bereich MS-Office
 Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Der Name BEREICH.VERSCHIEBEN() ist etwas unglücklich gewählt. Man kann mit der Funktion Bereiche zwar verschieben, man kann Bereiche aber auch verkleinern oder vergrößern. Besser wäre es, die Funktion
Lichtbrechung an Linsen
 Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Sammellinsen Lichtbrechung an Linsen Fällt ein paralleles Lichtbündel auf eine Sammellinse, so werden die Lichtstrahlen so gebrochen, dass sie durch einen Brennpunkt der Linse verlaufen. Der Abstand zwischen
Musterlösungen zur Linearen Algebra II Blatt 5
 Musterlösungen zur Linearen Algebra II Blatt 5 Aufgabe. Man betrachte die Matrix A := über dem Körper R und über dem Körper F und bestimme jeweils die Jordan- Normalform. Beweis. Das charakteristische
Musterlösungen zur Linearen Algebra II Blatt 5 Aufgabe. Man betrachte die Matrix A := über dem Körper R und über dem Körper F und bestimme jeweils die Jordan- Normalform. Beweis. Das charakteristische
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht
 8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
8.2 Thermodynamische Gleichgewichte, insbesondere Gleichgewichte in Mehrkomponentensystemen Mechanisches und thermisches Gleichgewicht 8.2-1 Stoffliches Gleichgewicht Beispiel Stickstoff Sauerstoff: Desweiteren
Lösungsmethoden gewöhnlicher Differentialgleichungen (Dgl.)
 Lösungsmethoden gewöhnlicher Dierentialgleichungen Dgl) Allgemeine und partikuläre Lösung einer gewöhnlichen Dierentialgleichung Eine Dierentialgleichung ist eine Gleichung! Zum Unterschied von den gewöhnlichen
Lösungsmethoden gewöhnlicher Dierentialgleichungen Dgl) Allgemeine und partikuläre Lösung einer gewöhnlichen Dierentialgleichung Eine Dierentialgleichung ist eine Gleichung! Zum Unterschied von den gewöhnlichen
Statuten in leichter Sprache
 Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
Statuten in leichter Sprache Zweck vom Verein Artikel 1: Zivil-Gesetz-Buch Es gibt einen Verein der selbstbestimmung.ch heisst. Der Verein ist so aufgebaut, wie es im Zivil-Gesetz-Buch steht. Im Zivil-Gesetz-Buch
Kulturelle Evolution 12
 3.3 Kulturelle Evolution Kulturelle Evolution Kulturelle Evolution 12 Seit die Menschen Erfindungen machen wie z.b. das Rad oder den Pflug, haben sie sich im Körperbau kaum mehr verändert. Dafür war einfach
3.3 Kulturelle Evolution Kulturelle Evolution Kulturelle Evolution 12 Seit die Menschen Erfindungen machen wie z.b. das Rad oder den Pflug, haben sie sich im Körperbau kaum mehr verändert. Dafür war einfach
Mit dem Tool Stundenverwaltung von Hanno Kniebel erhalten Sie die Möglichkeit zur effizienten Verwaltung von Montagezeiten Ihrer Mitarbeiter.
 Stundenverwaltung Mit dem Tool Stundenverwaltung von Hanno Kniebel erhalten Sie die Möglichkeit zur effizienten Verwaltung von Montagezeiten Ihrer Mitarbeiter. Dieses Programm zeichnet sich aus durch einfachste
Stundenverwaltung Mit dem Tool Stundenverwaltung von Hanno Kniebel erhalten Sie die Möglichkeit zur effizienten Verwaltung von Montagezeiten Ihrer Mitarbeiter. Dieses Programm zeichnet sich aus durch einfachste
Info zum Zusammenhang von Auflösung und Genauigkeit
 Da es oft Nachfragen und Verständnisprobleme mit den oben genannten Begriffen gibt, möchten wir hier versuchen etwas Licht ins Dunkel zu bringen. Nehmen wir mal an, Sie haben ein Stück Wasserrohr mit der
Da es oft Nachfragen und Verständnisprobleme mit den oben genannten Begriffen gibt, möchten wir hier versuchen etwas Licht ins Dunkel zu bringen. Nehmen wir mal an, Sie haben ein Stück Wasserrohr mit der
Plotten von Linien ( nach Jack Bresenham, 1962 )
 Plotten von Linien ( nach Jack Bresenham, 1962 ) Ac Eine auf dem Bildschirm darzustellende Linie sieht treppenförmig aus, weil der Computer Linien aus einzelnen (meist quadratischen) Bildpunkten, Pixels
Plotten von Linien ( nach Jack Bresenham, 1962 ) Ac Eine auf dem Bildschirm darzustellende Linie sieht treppenförmig aus, weil der Computer Linien aus einzelnen (meist quadratischen) Bildpunkten, Pixels
Zahlenwinkel: Forscherkarte 1. alleine. Zahlenwinkel: Forschertipp 1
 Zahlenwinkel: Forscherkarte 1 alleine Tipp 1 Lege die Ziffern von 1 bis 9 so in den Zahlenwinkel, dass jeder Arm des Zahlenwinkels zusammengezählt das gleiche Ergebnis ergibt! Finde möglichst viele verschiedene
Zahlenwinkel: Forscherkarte 1 alleine Tipp 1 Lege die Ziffern von 1 bis 9 so in den Zahlenwinkel, dass jeder Arm des Zahlenwinkels zusammengezählt das gleiche Ergebnis ergibt! Finde möglichst viele verschiedene
Was meinen die Leute eigentlich mit: Grexit?
 Was meinen die Leute eigentlich mit: Grexit? Grexit sind eigentlich 2 Wörter. 1. Griechenland 2. Exit Exit ist ein englisches Wort. Es bedeutet: Ausgang. Aber was haben diese 2 Sachen mit-einander zu tun?
Was meinen die Leute eigentlich mit: Grexit? Grexit sind eigentlich 2 Wörter. 1. Griechenland 2. Exit Exit ist ein englisches Wort. Es bedeutet: Ausgang. Aber was haben diese 2 Sachen mit-einander zu tun?
Skript und Aufgabensammlung Terme und Gleichungen Mathefritz Verlag Jörg Christmann Nur zum Privaten Gebrauch! Alle Rechte vorbehalten!
 Mathefritz 5 Terme und Gleichungen Meine Mathe-Seite im Internet kostenlose Matheaufgaben, Skripte, Mathebücher Lernspiele, Lerntipps, Quiz und noch viel mehr http:// www.mathefritz.de Seite 1 Copyright
Mathefritz 5 Terme und Gleichungen Meine Mathe-Seite im Internet kostenlose Matheaufgaben, Skripte, Mathebücher Lernspiele, Lerntipps, Quiz und noch viel mehr http:// www.mathefritz.de Seite 1 Copyright
Sichere E-Mail Anleitung Zertifikate / Schlüssel für Kunden der Sparkasse Germersheim-Kandel. Sichere E-Mail. der
 Sichere E-Mail der Nutzung von Zertifikaten / Schlüsseln zur sicheren Kommunikation per E-Mail mit der Sparkasse Germersheim-Kandel Inhalt: 1. Voraussetzungen... 2 2. Registrierungsprozess... 2 3. Empfang
Sichere E-Mail der Nutzung von Zertifikaten / Schlüsseln zur sicheren Kommunikation per E-Mail mit der Sparkasse Germersheim-Kandel Inhalt: 1. Voraussetzungen... 2 2. Registrierungsprozess... 2 3. Empfang
Prozentrechnung. Wir können nun eine Formel für die Berechnung des Prozentwertes aufstellen:
 Prozentrechnung Wir beginnen mit einem Beisiel: Nehmen wir mal an, ein Handy kostet 200 und es gibt 5% Rabatt (Preisnachlass), wie groß ist dann der Rabatt in Euro und wie viel kostet dann das Handy? Wenn
Prozentrechnung Wir beginnen mit einem Beisiel: Nehmen wir mal an, ein Handy kostet 200 und es gibt 5% Rabatt (Preisnachlass), wie groß ist dann der Rabatt in Euro und wie viel kostet dann das Handy? Wenn
Gleichungen Lösen. Ein graphischer Blick auf Gleichungen
 Gleichungen Lösen Was bedeutet es, eine Gleichung zu lösen? Was ist überhaupt eine Gleichung? Eine Gleichung ist, grundsätzlich eine Aussage über zwei mathematische Terme, dass sie gleich sind. Ein Term
Gleichungen Lösen Was bedeutet es, eine Gleichung zu lösen? Was ist überhaupt eine Gleichung? Eine Gleichung ist, grundsätzlich eine Aussage über zwei mathematische Terme, dass sie gleich sind. Ein Term
Abschlussprüfung Realschule Bayern II / III: 2009 Haupttermin B 1.0 B 1.1
 B 1.0 B 1.1 L: Wir wissen von, dass sie den Scheitel hat und durch den Punkt läuft. Was nichts bringt, ist beide Punkte in die allgemeine Parabelgleichung einzusetzen und das Gleichungssystem zu lösen,
B 1.0 B 1.1 L: Wir wissen von, dass sie den Scheitel hat und durch den Punkt läuft. Was nichts bringt, ist beide Punkte in die allgemeine Parabelgleichung einzusetzen und das Gleichungssystem zu lösen,
6.2 Scan-Konvertierung (Scan Conversion)
 6.2 Scan-Konvertierung (Scan Conversion) Scan-Konvertierung ist die Rasterung von einfachen Objekten (Geraden, Kreisen, Kurven). Als Ausgabemedium dient meist der Bildschirm, der aus einem Pixelraster
6.2 Scan-Konvertierung (Scan Conversion) Scan-Konvertierung ist die Rasterung von einfachen Objekten (Geraden, Kreisen, Kurven). Als Ausgabemedium dient meist der Bildschirm, der aus einem Pixelraster
Anleitung über den Umgang mit Schildern
 Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
Anleitung über den Umgang mit Schildern -Vorwort -Wo bekommt man Schilder? -Wo und wie speichert man die Schilder? -Wie füge ich die Schilder in meinen Track ein? -Welche Bauteile kann man noch für Schilder
1. Kennlinien. 2. Stabilisierung der Emitterschaltung. Schaltungstechnik 2 Übung 4
 1. Kennlinien Der Transistor BC550C soll auf den Arbeitspunkt U CE = 4 V und I C = 15 ma eingestellt werden. a) Bestimmen Sie aus den Kennlinien (S. 2) die Werte für I B, B, U BE. b) Woher kommt die Neigung
1. Kennlinien Der Transistor BC550C soll auf den Arbeitspunkt U CE = 4 V und I C = 15 ma eingestellt werden. a) Bestimmen Sie aus den Kennlinien (S. 2) die Werte für I B, B, U BE. b) Woher kommt die Neigung
Die Größe von Flächen vergleichen
 Vertiefen 1 Die Größe von Flächen vergleichen zu Aufgabe 1 Schulbuch, Seite 182 1 Wer hat am meisten Platz? Ordne die Figuren nach ihrem Flächeninhalt. Begründe deine Reihenfolge. 1 2 3 4 zu Aufgabe 2
Vertiefen 1 Die Größe von Flächen vergleichen zu Aufgabe 1 Schulbuch, Seite 182 1 Wer hat am meisten Platz? Ordne die Figuren nach ihrem Flächeninhalt. Begründe deine Reihenfolge. 1 2 3 4 zu Aufgabe 2
Informationen zum Ambulant Betreuten Wohnen in leichter Sprache
 Informationen zum Ambulant Betreuten Wohnen in leichter Sprache Arbeiterwohlfahrt Kreisverband Siegen - Wittgenstein/ Olpe 1 Diese Information hat geschrieben: Arbeiterwohlfahrt Stephanie Schür Koblenzer
Informationen zum Ambulant Betreuten Wohnen in leichter Sprache Arbeiterwohlfahrt Kreisverband Siegen - Wittgenstein/ Olpe 1 Diese Information hat geschrieben: Arbeiterwohlfahrt Stephanie Schür Koblenzer
ONLINE-AKADEMIE. "Diplomierter NLP Anwender für Schule und Unterricht" Ziele
 ONLINE-AKADEMIE Ziele Wenn man von Menschen hört, die etwas Großartiges in ihrem Leben geleistet haben, erfahren wir oft, dass diese ihr Ziel über Jahre verfolgt haben oder diesen Wunsch schon bereits
ONLINE-AKADEMIE Ziele Wenn man von Menschen hört, die etwas Großartiges in ihrem Leben geleistet haben, erfahren wir oft, dass diese ihr Ziel über Jahre verfolgt haben oder diesen Wunsch schon bereits
15.3 Bedingte Wahrscheinlichkeit und Unabhängigkeit
 5.3 Bedingte Wahrscheinlichkeit und Unabhängigkeit Einführendes Beispiel ( Erhöhung der Sicherheit bei Flugreisen ) Die statistische Wahrscheinlichkeit, dass während eines Fluges ein Sprengsatz an Bord
5.3 Bedingte Wahrscheinlichkeit und Unabhängigkeit Einführendes Beispiel ( Erhöhung der Sicherheit bei Flugreisen ) Die statistische Wahrscheinlichkeit, dass während eines Fluges ein Sprengsatz an Bord
Wachstum 2. Michael Dröttboom 1 LernWerkstatt-Selm.de
 1. Herr Meier bekommt nach 3 Jahren Geldanlage 25.000. Er hatte 22.500 angelegt. Wie hoch war der Zinssatz? 2. Herr Meiers Vorfahren haben bei der Gründung Roms (753. V. Chr.) 1 Sesterze auf die Bank gebracht
1. Herr Meier bekommt nach 3 Jahren Geldanlage 25.000. Er hatte 22.500 angelegt. Wie hoch war der Zinssatz? 2. Herr Meiers Vorfahren haben bei der Gründung Roms (753. V. Chr.) 1 Sesterze auf die Bank gebracht
ratgeber Urlaub - Dein gutes Recht
 Viele Arbeitgeber wollen jetzt die Urlaubsplanung für 2011 vorgelegt bekommen. Dabei kommt es immer wieder zu Streitereien unter den Kollegen. Aber auch zwischen Arbeitnehmern und Arbeitgebern kann es
Viele Arbeitgeber wollen jetzt die Urlaubsplanung für 2011 vorgelegt bekommen. Dabei kommt es immer wieder zu Streitereien unter den Kollegen. Aber auch zwischen Arbeitnehmern und Arbeitgebern kann es
AGROPLUS Buchhaltung. Daten-Server und Sicherheitskopie. Version vom 21.10.2013b
 AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
AGROPLUS Buchhaltung Daten-Server und Sicherheitskopie Version vom 21.10.2013b 3a) Der Daten-Server Modus und der Tresor Der Daten-Server ist eine Betriebsart welche dem Nutzer eine grosse Flexibilität
Tag der Mathematik 2012
 Gruppenwettbewerb Einzelwettbewerb Mathematische Hürden Aufgaben mit en und Bepunktung Allgemeine Hinweise: Als Hilfsmittel dürfen nur Schreibzeug, Geodreieck und Zirkel benutzt werden. Taschenrechner
Gruppenwettbewerb Einzelwettbewerb Mathematische Hürden Aufgaben mit en und Bepunktung Allgemeine Hinweise: Als Hilfsmittel dürfen nur Schreibzeug, Geodreieck und Zirkel benutzt werden. Taschenrechner
Tangentengleichung. Wie lautet die Geradengleichung für die Tangente, y T =? Antwort:
 Tangentengleichung Wie Sie wissen, gibt die erste Ableitung einer Funktion deren Steigung an. Betrachtet man eine fest vorgegebene Stelle, gibt f ( ) also die Steigung der Kurve und somit auch die Steigung
Tangentengleichung Wie Sie wissen, gibt die erste Ableitung einer Funktion deren Steigung an. Betrachtet man eine fest vorgegebene Stelle, gibt f ( ) also die Steigung der Kurve und somit auch die Steigung
Grundlagen der höheren Mathematik Einige Hinweise zum Lösen von Gleichungen
 Grundlagen der höheren Mathematik Einige Hinweise zum Lösen von Gleichungen 1. Quadratische Gleichungen Quadratische Gleichungen lassen sich immer auf die sog. normierte Form x 2 + px + = 0 bringen, in
Grundlagen der höheren Mathematik Einige Hinweise zum Lösen von Gleichungen 1. Quadratische Gleichungen Quadratische Gleichungen lassen sich immer auf die sog. normierte Form x 2 + px + = 0 bringen, in
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6
 Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
Übungen zur VL Chemie für Biologen und Humanbiologen 05.12.2011 Lösung Übung 6 Thermodynamik und Gleichgewichte 1. a) Was sagt die Enthalpie aus? Die Enthalpie H beschreibt den Energiegehalt von Materie
Lösung. Prüfungsteil 1: Aufgabe 1
 Zentrale Prüfung 01 Lösung Diese Lösung wurde erstellt von Cornelia Sanzenbacher. Sie ist keine offizielle Lösung des Ministeriums für Schule und Weiterbildung des Landes. Prüfungsteil 1: Aufgabe 1 a)
Zentrale Prüfung 01 Lösung Diese Lösung wurde erstellt von Cornelia Sanzenbacher. Sie ist keine offizielle Lösung des Ministeriums für Schule und Weiterbildung des Landes. Prüfungsteil 1: Aufgabe 1 a)
SEK II. Auf den Punkt gebracht!
 SEK II Profil- und Kurswahl Einbringungspflicht Abitur-Bestimmungen Gesamtqualifikation Auf den Punkt gebracht! 1 Inhaltsverzeichnis Sinn und Zweck dieses Dokuments...3 Profil- und Kurswahl für den 11.
SEK II Profil- und Kurswahl Einbringungspflicht Abitur-Bestimmungen Gesamtqualifikation Auf den Punkt gebracht! 1 Inhaltsverzeichnis Sinn und Zweck dieses Dokuments...3 Profil- und Kurswahl für den 11.
Studienplatzbeschaffung
 Studienplatzbeschaffung - Einklagen www.asta.haw-hamburg.de Hintergrund Alle Unis und Hochschulen unterliegen dem Kapazitätsausschöpfungsgebot Sie müssen alle ihnen zur Verfügung stehenden Plätze vergeben!
Studienplatzbeschaffung - Einklagen www.asta.haw-hamburg.de Hintergrund Alle Unis und Hochschulen unterliegen dem Kapazitätsausschöpfungsgebot Sie müssen alle ihnen zur Verfügung stehenden Plätze vergeben!
Daten sammeln, darstellen, auswerten
 Vertiefen 1 Daten sammeln, darstellen, auswerten zu Aufgabe 1 Schulbuch, Seite 22 1 Haustiere zählen In der Tabelle rechts stehen die Haustiere der Kinder aus der Klasse 5b. a) Wie oft wurden die Haustiere
Vertiefen 1 Daten sammeln, darstellen, auswerten zu Aufgabe 1 Schulbuch, Seite 22 1 Haustiere zählen In der Tabelle rechts stehen die Haustiere der Kinder aus der Klasse 5b. a) Wie oft wurden die Haustiere
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Gehen wir einmal davon aus, dass die von uns angenommenen
 geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
geben. Die Wahrscheinlichkeit von 100% ist hier demnach nur der Vollständigkeit halber aufgeführt. Gehen wir einmal davon aus, dass die von uns angenommenen 70% im Beispiel exakt berechnet sind. Was würde
14 Schmiegeparabel und Freunde, Taylor-Reihe
 14 Schmiegeparabel und Freunde, Taylor-Reihe Jörn Loviscach Versionsstand: 20. März 2012, 16:01 Die nummerierten Felder sind absichtlich leer, zum Ausfüllen in der Vorlesung. Videos dazu: http://www.j3l7h.de/videos.html
14 Schmiegeparabel und Freunde, Taylor-Reihe Jörn Loviscach Versionsstand: 20. März 2012, 16:01 Die nummerierten Felder sind absichtlich leer, zum Ausfüllen in der Vorlesung. Videos dazu: http://www.j3l7h.de/videos.html
Geld Verdienen im Internet leicht gemacht
 Geld Verdienen im Internet leicht gemacht Hallo, Sie haben sich dieses E-book wahrscheinlich herunter geladen, weil Sie gerne lernen würden wie sie im Internet Geld verdienen können, oder? Denn genau das
Geld Verdienen im Internet leicht gemacht Hallo, Sie haben sich dieses E-book wahrscheinlich herunter geladen, weil Sie gerne lernen würden wie sie im Internet Geld verdienen können, oder? Denn genau das
Statistische Auswertung:
 Statistische Auswertung: Die erhobenen Daten mittels der selbst erstellten Tests (Surfaufgaben) Statistics Punkte aus dem Punkte aus Surftheorietest Punkte aus dem dem und dem Surftheorietest max.14p.
Statistische Auswertung: Die erhobenen Daten mittels der selbst erstellten Tests (Surfaufgaben) Statistics Punkte aus dem Punkte aus Surftheorietest Punkte aus dem dem und dem Surftheorietest max.14p.
Theoretische Grundlagen der Informatik WS 09/10
 Theoretische Grundlagen der Informatik WS 09/10 - Tutorium 6 - Michael Kirsten und Kai Wallisch Sitzung 13 02.02.2010 Inhaltsverzeichnis 1 Formeln zur Berechnung Aufgabe 1 2 Hamming-Distanz Aufgabe 2 3
Theoretische Grundlagen der Informatik WS 09/10 - Tutorium 6 - Michael Kirsten und Kai Wallisch Sitzung 13 02.02.2010 Inhaltsverzeichnis 1 Formeln zur Berechnung Aufgabe 1 2 Hamming-Distanz Aufgabe 2 3
PTV VISWALK TIPPS UND TRICKS PTV VISWALK TIPPS UND TRICKS: VERWENDUNG DICHTEBASIERTER TEILROUTEN
 PTV VISWALK TIPPS UND TRICKS PTV VISWALK TIPPS UND TRICKS: VERWENDUNG DICHTEBASIERTER TEILROUTEN Karlsruhe, April 2015 Verwendung dichte-basierter Teilrouten Stellen Sie sich vor, in einem belebten Gebäude,
PTV VISWALK TIPPS UND TRICKS PTV VISWALK TIPPS UND TRICKS: VERWENDUNG DICHTEBASIERTER TEILROUTEN Karlsruhe, April 2015 Verwendung dichte-basierter Teilrouten Stellen Sie sich vor, in einem belebten Gebäude,
QM: Prüfen -1- KN16.08.2010
 QM: Prüfen -1- KN16.08.2010 2.4 Prüfen 2.4.1 Begriffe, Definitionen Ein wesentlicher Bestandteil der Qualitätssicherung ist das Prüfen. Sie wird aber nicht wie früher nach der Fertigung durch einen Prüfer,
QM: Prüfen -1- KN16.08.2010 2.4 Prüfen 2.4.1 Begriffe, Definitionen Ein wesentlicher Bestandteil der Qualitätssicherung ist das Prüfen. Sie wird aber nicht wie früher nach der Fertigung durch einen Prüfer,
1. Weniger Steuern zahlen
 1. Weniger Steuern zahlen Wenn man arbeitet, zahlt man Geld an den Staat. Dieses Geld heißt Steuern. Viele Menschen zahlen zu viel Steuern. Sie haben daher wenig Geld für Wohnung, Gewand oder Essen. Wenn
1. Weniger Steuern zahlen Wenn man arbeitet, zahlt man Geld an den Staat. Dieses Geld heißt Steuern. Viele Menschen zahlen zu viel Steuern. Sie haben daher wenig Geld für Wohnung, Gewand oder Essen. Wenn
FAQ Spielvorbereitung Startspieler: Wer ist Startspieler?
 FAQ Spielvorbereitung Startspieler: Wer ist Startspieler? In der gedruckten Version der Spielregeln steht: der Startspieler ist der Spieler, dessen Arena unmittelbar links neben dem Kaiser steht [im Uhrzeigersinn].
FAQ Spielvorbereitung Startspieler: Wer ist Startspieler? In der gedruckten Version der Spielregeln steht: der Startspieler ist der Spieler, dessen Arena unmittelbar links neben dem Kaiser steht [im Uhrzeigersinn].
Im Jahr t = 0 hat eine Stadt 10.000 Einwohner. Nach 15 Jahren hat sich die Einwohnerzahl verdoppelt. z(t) = at + b
 Aufgabe 1: Im Jahr t = 0 hat eine Stadt 10.000 Einwohner. Nach 15 Jahren hat sich die Einwohnerzahl verdoppelt. (a) Nehmen Sie lineares Wachstum gemäß z(t) = at + b an, wobei z die Einwohnerzahl ist und
Aufgabe 1: Im Jahr t = 0 hat eine Stadt 10.000 Einwohner. Nach 15 Jahren hat sich die Einwohnerzahl verdoppelt. (a) Nehmen Sie lineares Wachstum gemäß z(t) = at + b an, wobei z die Einwohnerzahl ist und
Der Zwei-Quadrate-Satz von Fermat
 Der Zwei-Quadrate-Satz von Fermat Proseminar: Das BUCH der Beweise Fridtjof Schulte Steinberg Institut für Informatik Humboldt-Universität zu Berlin 29.November 2012 1 / 20 Allgemeines Pierre de Fermat
Der Zwei-Quadrate-Satz von Fermat Proseminar: Das BUCH der Beweise Fridtjof Schulte Steinberg Institut für Informatik Humboldt-Universität zu Berlin 29.November 2012 1 / 20 Allgemeines Pierre de Fermat
Korrigenda Handbuch der Bewertung
 Korrigenda Handbuch der Bewertung Kapitel 3 Abschnitt 3.5 Seite(n) 104-109 Titel Der Terminvertrag: Ein Beispiel für den Einsatz von Future Values Änderungen In den Beispielen 21 und 22 ist der Halbjahressatz
Korrigenda Handbuch der Bewertung Kapitel 3 Abschnitt 3.5 Seite(n) 104-109 Titel Der Terminvertrag: Ein Beispiel für den Einsatz von Future Values Änderungen In den Beispielen 21 und 22 ist der Halbjahressatz
Kurzanleitung fu r Clubbeauftragte zur Pflege der Mitgliederdaten im Mitgliederbereich
 Kurzanleitung fu r Clubbeauftragte zur Pflege der Mitgliederdaten im Mitgliederbereich Mitgliederbereich (Version 1.0) Bitte loggen Sie sich in den Mitgliederbereich mit den Ihnen bekannten Zugangsdaten
Kurzanleitung fu r Clubbeauftragte zur Pflege der Mitgliederdaten im Mitgliederbereich Mitgliederbereich (Version 1.0) Bitte loggen Sie sich in den Mitgliederbereich mit den Ihnen bekannten Zugangsdaten
Was bedeutet Inklusion für Geschwisterkinder? Ein Meinungsbild. Irene von Drigalski Geschäftsführerin Novartis Stiftung FamilienBande.
 Was bedeutet Inklusion für Geschwisterkinder? unterstützt von Ein Meinungsbild - Irene von Drigalski Geschäftsführerin Novartis Stiftung FamilienBande Haben Sie Kontakt zu Geschwistern schwer chronisch
Was bedeutet Inklusion für Geschwisterkinder? unterstützt von Ein Meinungsbild - Irene von Drigalski Geschäftsführerin Novartis Stiftung FamilienBande Haben Sie Kontakt zu Geschwistern schwer chronisch
1 topologisches Sortieren
 Wolfgang Hönig / Andreas Ecke WS 09/0 topologisches Sortieren. Überblick. Solange noch Knoten vorhanden: a) Suche Knoten v, zu dem keine Kante führt (Falls nicht vorhanden keine topologische Sortierung
Wolfgang Hönig / Andreas Ecke WS 09/0 topologisches Sortieren. Überblick. Solange noch Knoten vorhanden: a) Suche Knoten v, zu dem keine Kante führt (Falls nicht vorhanden keine topologische Sortierung
Erstellen von x-y-diagrammen in OpenOffice.calc
 Erstellen von x-y-diagrammen in OpenOffice.calc In dieser kleinen Anleitung geht es nur darum, aus einer bestehenden Tabelle ein x-y-diagramm zu erzeugen. D.h. es müssen in der Tabelle mindestens zwei
Erstellen von x-y-diagrammen in OpenOffice.calc In dieser kleinen Anleitung geht es nur darum, aus einer bestehenden Tabelle ein x-y-diagramm zu erzeugen. D.h. es müssen in der Tabelle mindestens zwei
DOWNLOAD. Kniffliges für gute Mathe-Schüler 2. Klasse 4. Anspruchsvolle Aufgaben durch Skizzen und Gleichungen lösen. in der 2.
 DOWNLOAD Ralph Birkholz Kniffliges für gute Mathe-Schüler 2. Klasse 4 Anspruchsvolle Aufgaben durch Skizzen und Gleichungen lösen Ralph Birkholz in der 2. Klasse Bergedorfer Unterrichtsideen Downloadauszug
DOWNLOAD Ralph Birkholz Kniffliges für gute Mathe-Schüler 2. Klasse 4 Anspruchsvolle Aufgaben durch Skizzen und Gleichungen lösen Ralph Birkholz in der 2. Klasse Bergedorfer Unterrichtsideen Downloadauszug
Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken?
 UErörterung zu dem Thema Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken? 2000 by christoph hoffmann Seite I Gliederung 1. In zu großen Mengen ist alles schädlich. 2.
UErörterung zu dem Thema Ist Fernsehen schädlich für die eigene Meinung oder fördert es unabhängig zu denken? 2000 by christoph hoffmann Seite I Gliederung 1. In zu großen Mengen ist alles schädlich. 2.
Sonderrundschreiben. Arbeitshilfe zu den Pflichtangaben in Immobilienanzeigen bei alten Energieausweisen
 Sonderrundschreiben Arbeitshilfe zu den Pflichtangaben in Immobilienanzeigen bei alten Energieausweisen Sonnenstraße 11-80331 München Telefon 089 / 5404133-0 - Fax 089 / 5404133-55 info@haus-und-grund-bayern.de
Sonderrundschreiben Arbeitshilfe zu den Pflichtangaben in Immobilienanzeigen bei alten Energieausweisen Sonnenstraße 11-80331 München Telefon 089 / 5404133-0 - Fax 089 / 5404133-55 info@haus-und-grund-bayern.de
Formelsammlung zur Kreisgleichung
 zur Kreisgleichung Julia Wolters 6. Oktober 2008 Inhaltsverzeichnis 1 Allgemeine Kreisgleichung 2 1.1 Berechnung des Mittelpunktes und Radius am Beispiel..... 3 2 Kreis und Gerade 4 2.1 Sekanten, Tangenten,
zur Kreisgleichung Julia Wolters 6. Oktober 2008 Inhaltsverzeichnis 1 Allgemeine Kreisgleichung 2 1.1 Berechnung des Mittelpunktes und Radius am Beispiel..... 3 2 Kreis und Gerade 4 2.1 Sekanten, Tangenten,
4.4 AnonymeMärkteunddasGleichgewichtder"vollständigen Konkurrenz"
 4.4 AnonymeMärkteunddasGleichgewichtder"vollständigen Konkurrenz" Wir haben bisher nachvollziehen können, wie zwei Personen für sich den Anreiz zum TauschentdeckenundwiemitwachsenderBevölkerungdieMengederAllokationensinkt,
4.4 AnonymeMärkteunddasGleichgewichtder"vollständigen Konkurrenz" Wir haben bisher nachvollziehen können, wie zwei Personen für sich den Anreiz zum TauschentdeckenundwiemitwachsenderBevölkerungdieMengederAllokationensinkt,
Grundlagen der Theoretischen Informatik, SoSe 2008
 1. Aufgabenblatt zur Vorlesung Grundlagen der Theoretischen Informatik, SoSe 2008 (Dr. Frank Hoffmann) Lösung von Manuel Jain und Benjamin Bortfeldt Aufgabe 2 Zustandsdiagramme (6 Punkte, wird korrigiert)
1. Aufgabenblatt zur Vorlesung Grundlagen der Theoretischen Informatik, SoSe 2008 (Dr. Frank Hoffmann) Lösung von Manuel Jain und Benjamin Bortfeldt Aufgabe 2 Zustandsdiagramme (6 Punkte, wird korrigiert)
Erstellen einer Collage. Zuerst ein leeres Dokument erzeugen, auf dem alle anderen Bilder zusammengefügt werden sollen (über [Datei] > [Neu])
![Erstellen einer Collage. Zuerst ein leeres Dokument erzeugen, auf dem alle anderen Bilder zusammengefügt werden sollen (über [Datei] > [Neu]) Erstellen einer Collage. Zuerst ein leeres Dokument erzeugen, auf dem alle anderen Bilder zusammengefügt werden sollen (über [Datei] > [Neu])](/thumbs/29/13170670.jpg) 3.7 Erstellen einer Collage Zuerst ein leeres Dokument erzeugen, auf dem alle anderen Bilder zusammengefügt werden sollen (über [Datei] > [Neu]) Dann Größe des Dokuments festlegen beispielsweise A4 (weitere
3.7 Erstellen einer Collage Zuerst ein leeres Dokument erzeugen, auf dem alle anderen Bilder zusammengefügt werden sollen (über [Datei] > [Neu]) Dann Größe des Dokuments festlegen beispielsweise A4 (weitere
Aufgaben zur Flächenberechnung mit der Integralrechung
 ufgaben zur Flächenberechnung mit der Integralrechung ) Geben ist die Funktion f(x) = -x + x. a) Wie groß ist die Fläche, die die Kurve von f mit der x-chse einschließt? b) Welche Fläche schließt der Graph
ufgaben zur Flächenberechnung mit der Integralrechung ) Geben ist die Funktion f(x) = -x + x. a) Wie groß ist die Fläche, die die Kurve von f mit der x-chse einschließt? b) Welche Fläche schließt der Graph
Das Mathematik-Abitur im Saarland
 Informationen zum Abitur Das Mathematik-Abitur im Saarland Sie können Mathematik im Abitur entweder als grundlegenden Kurs (G-Kurs) oder als erhöhten Kurs (E-Kurs) wählen. Die Bearbeitungszeit für die
Informationen zum Abitur Das Mathematik-Abitur im Saarland Sie können Mathematik im Abitur entweder als grundlegenden Kurs (G-Kurs) oder als erhöhten Kurs (E-Kurs) wählen. Die Bearbeitungszeit für die
Entladen und Aufladen eines Kondensators über einen ohmschen Widerstand
 Entladen und Aufladen eines Kondensators über einen ohmschen Widerstand Vorüberlegung In einem seriellen Stromkreis addieren sich die Teilspannungen zur Gesamtspannung Bei einer Gesamtspannung U ges, der
Entladen und Aufladen eines Kondensators über einen ohmschen Widerstand Vorüberlegung In einem seriellen Stromkreis addieren sich die Teilspannungen zur Gesamtspannung Bei einer Gesamtspannung U ges, der
Betragsgleichungen und die Methode der Fallunterscheidungen
 mathe online Skripten http://www.mathe-online.at/skripten/ Betragsgleichungen und die Methode der Fallunterscheidungen Franz Embacher Fakultät für Mathematik der Universität Wien E-mail: franz.embacher@univie.ac.at
mathe online Skripten http://www.mathe-online.at/skripten/ Betragsgleichungen und die Methode der Fallunterscheidungen Franz Embacher Fakultät für Mathematik der Universität Wien E-mail: franz.embacher@univie.ac.at
Korrelation (II) Korrelation und Kausalität
 Korrelation (II) Korrelation und Kausalität Situation: Seien X, Y zwei metrisch skalierte Merkmale mit Ausprägungen (x 1, x 2,..., x n ) bzw. (y 1, y 2,..., y n ). D.h. für jede i = 1, 2,..., n bezeichnen
Korrelation (II) Korrelation und Kausalität Situation: Seien X, Y zwei metrisch skalierte Merkmale mit Ausprägungen (x 1, x 2,..., x n ) bzw. (y 1, y 2,..., y n ). D.h. für jede i = 1, 2,..., n bezeichnen
Vorkurs Mathematik Übungen zu Differentialgleichungen
 Vorkurs Mathematik Übungen zu Differentialgleichungen Als bekannt setzen wir die folgenden Umformungen voraus: e ln(f(x)) = f(x) e f(x)+c = e f(x) e c e ln(f(x)) +c = f(x) e c = f(x) c f ( g(x) ) g (x)
Vorkurs Mathematik Übungen zu Differentialgleichungen Als bekannt setzen wir die folgenden Umformungen voraus: e ln(f(x)) = f(x) e f(x)+c = e f(x) e c e ln(f(x)) +c = f(x) e c = f(x) c f ( g(x) ) g (x)
Herzlich Willkommen beim Webinar: Was verkaufen wir eigentlich?
 Herzlich Willkommen beim Webinar: Was verkaufen wir eigentlich? Was verkaufen wir eigentlich? Provokativ gefragt! Ein Hotel Marketing Konzept Was ist das? Keine Webseite, kein SEO, kein Paket,. Was verkaufen
Herzlich Willkommen beim Webinar: Was verkaufen wir eigentlich? Was verkaufen wir eigentlich? Provokativ gefragt! Ein Hotel Marketing Konzept Was ist das? Keine Webseite, kein SEO, kein Paket,. Was verkaufen
Bruchrechnung Wir teilen gerecht auf
 Bruchrechnung Wir teilen gerecht auf Minipizzen auf Personen. Bruchrechnung Wir teilen gerecht auf Minipizzen auf Personen. : (+) : + Wir teilen einen Teil Eine halbe Minipizza auf Personen. :? Wir teilen
Bruchrechnung Wir teilen gerecht auf Minipizzen auf Personen. Bruchrechnung Wir teilen gerecht auf Minipizzen auf Personen. : (+) : + Wir teilen einen Teil Eine halbe Minipizza auf Personen. :? Wir teilen
3. LINEARE GLEICHUNGSSYSTEME
 176 3. LINEARE GLEICHUNGSSYSTEME 90 Vitamin-C-Gehalt verschiedener Säfte 18,0 mg 35,0 mg 12,5 mg 1. a) 100 ml + 50 ml + 50 ml = 41,75 mg 100 ml 100 ml 100 ml b) : Menge an Kirschsaft in ml y: Menge an
176 3. LINEARE GLEICHUNGSSYSTEME 90 Vitamin-C-Gehalt verschiedener Säfte 18,0 mg 35,0 mg 12,5 mg 1. a) 100 ml + 50 ml + 50 ml = 41,75 mg 100 ml 100 ml 100 ml b) : Menge an Kirschsaft in ml y: Menge an
Wir machen neue Politik für Baden-Württemberg
 Wir machen neue Politik für Baden-Württemberg Am 27. März 2011 haben die Menschen in Baden-Württemberg gewählt. Sie wollten eine andere Politik als vorher. Die Menschen haben die GRÜNEN und die SPD in
Wir machen neue Politik für Baden-Württemberg Am 27. März 2011 haben die Menschen in Baden-Württemberg gewählt. Sie wollten eine andere Politik als vorher. Die Menschen haben die GRÜNEN und die SPD in
