AG 8: Qualifizierung und Validierung. Reduzierung des Qualifizierungsaufwandes über eine risikobasierte Gerätekategorisierung?
|
|
|
- Albert Knopp
- vor 7 Jahren
- Abrufe
Transkript
1 AG 8: Qualifizierung und Validierung Reduzierung des Qualifizierungsaufwandes über eine risikobasierte Gerätekategorisierung? Sprecher: Dr. Nils Hamann, Vibalogics GmbH 5. GMP-Gesprächskreis Niedersachsen Braunschweig, 20. Februar
2 Themen der AG 8 Qualifizierung von Geräten und Anlagen - Life-Cycle-Management - Einbindung von ICH Q9 und ICH Q10 Qualifizierung von Laborgeräten ( AG 3 Labor) Validierung computergestützter Systeme Reinigungsvalidierung Neue Technologien / Anforderungen Mitarbeitervalidierung Mängelstatistik der Behörden Qualifizierung externer Dienstleister (Wartung/Qualifizierung/Validierung) 02
3 Themen der AG 8 Qualifizierung von Geräten und Anlagen - Life-Cycle-Management - Einbindung von ICH Q9 und ICH Q10 Qualifizierung von Laborgeräten ( AG 3 Labor) Validierung computergestützter Systeme Reinigungsvalidierung Neue Technologien / Anforderungen Mitarbeitervalidierung Mängelstatistik der Behörden Qualifizierung externer Dienstleister (Wartung/Qualifizierung/Validierung) 02
4 Treffen seit dem letzten Gesprächskreis Med-X-Press GmbH & Co. KG, Goslar Sanum-Kehlbeck GmbH, Hoya Vibalogics GmbH, Cuxhaven Med-X-Press GmbH & Co. KG, Goslar Med-X-Press GmbH & Co. KG, Goslar Vielen Dank an die Organisatoren und Gastgeber! 03
5 Life-Cycle-Management Life-Cycle Grundkonzept Mögliche Qualifizierungsschritte/abläufe Bedarf (Neuanschaffung, Ersatz, geänderte regulatorische Anforderungen) Change Control Risikoanalyse URS Pflichtenheft Lieferantenauswahl (Qualifizierungsplan) Kategorisierung RA Review / Durchführung Anschaffung Kaufmännische Klärung Verträge Lieferantenbewertung FAT Umgebungsbedingungen (z.b Räume) CC Korrekturmaßnahmen Installation / Inbetriebnahme (SAT) IQ /OQ (SOP) (Schulung) Bewertung PQ Abweichung Routinebetrieb Wartung Kalibrierung Instandhaltung Logbuch Reparaturen Re-Qualifizierung Prozessvalidierung Periodic Review Methodenvalidierung Änderungsbedarf endgültige Ausserbetriebnahme Abschlusskalibration Funktionsprüfung Change Control 04
6 Minimierung des Qualifizierungsaufwandes? Qualifizierung / Re-qualifizierung: Hoher Aufwand für kritische Anlagen, geringerer Aufwand für weniger kritische Anlagen Kategorisierung Kategorien in Anlehnung an die USP <1058> AIQ (Analytical Instrument Qualification): A = niedriges Risiko B = mittleres Risiko C = hohes Risiko Risikobasierte Kategorisierung (ICH Q9, ICH Q10) 05
7 Life-Cycle-Management Life-Cycle Grundkonzept Mögliche Qualifizierungsschritte/abläufe Bedarf (Neuanschaffung, Ersatz, geänderte regulatorische Anforderungen) Change Control Risikoanalyse URS Pflichtenheft Lieferantenauswahl (Qualifizierungsplan) Kategorisierung RA Review / Durchführung Anschaffung Kaufmännische Klärung Verträge Lieferantenbewertung FAT Umgebungsbedingungen (z.b Räume) CC Korrekturmaßnahmen Installation / Inbetriebnahme (SAT) IQ /OQ (SOP) (Schulung) Bewertung PQ Abweichung Routinebetrieb Wartung Kalibrierung Instandhaltung Logbuch Reparaturen Re-Qualifizierung Prozessvalidierung Periodic Review Methodenvalidierung Änderungsbedarf endgültige Ausserbetriebnahme Abschlusskalibration Funktionsprüfung Change Control 06
8 Risikobasierte Qualifizierungsmatrix Matrix für Qualifizierungsaktivitäten (Stand ) # Aktivität Dokumentation Gerätekategorisierung 1 Bedarfsfeststellung Change Control (CC) Für alle Anlagen durchzuführen 2 Risikoanalyse (RA) -> URS 3 DQ User Requirement Specification (URS) 4 Planung/Anschaffung Lasten-/Pflichtenheft 5 Kaufmännische Klärung Notwendigkeit definiert in CC oder RA 6 Verträge (Wartungsverträge?) 7 Umgebungsbedingungen (z.b. Räume) 8 Lieferantenauswahl 9 Qualifizierung erforderlich? Risikoanalyse (RA) -> JA NEIN 10 Kategorisierung Risikoanalyse (RA) -> Qualifizierungsplan Kategorie A: Kategorie B: Kategorie C: Verantwortlichkeiten Risiko Risiko Risiko niedrig mittel hoch 11 Bestellung/Beauftragung FAT - - (x) - 12 IQ/OQ/PQ SAT - - (x) - 13 Installation/ IQ (Plan, Protokoll, Bericht) x x x - 14 Inbetriebnahme/ OQ (Plan, Protokoll, Bericht) x* x x - 15 Qualifizierung/ SOP (Betrieb, Reinigung, Wartung) - x x x 16 Validierung Logbuch erstellen - x x x 17 Schulung x x x x 18 PQ (Plan, Protokoll, Bericht) - - x - 19 Qualifzierungsbericht (Freigabe) x x x - 20 Routinebetrieb Kalibrierung - x x - 21 (über Risikoanalyse/QMP definiert) Wartung/Instandhaltung - x x x 22 Reinigung/Desinfektion x x x x 23 Periodic Review x x Re-Qualifizierung - - x - 25 Re-Validierung Reinigung (PV) - - x x 26 Prozessvalidierung (PV) - - x - 27 Änderungen/Reparatur CC: Re-Qualifizierung nach Änderungen - x x - 28 Dev: Re-Qualifizierung nach Reparatur - x x - 29 Ausserbetriebnahme Abschlusskalibrierung nach CC - x x - 30 Funktionsprüfung nach CC - - x x *einfacher Funktionstest (Funktion wird aus Betrieb ersichtlich) nicht qualitätsrelevant 07
9 Risikobasierte Qualifizierungsmatrix Matrix für Qualifizierungsaktivitäten (Stand ) # Aktivität Dokumentation Gerätekategorisierung 1 Bedarfsfeststellung Change Control (CC) Für alle Anlagen durchzuführen 2 Risikoanalyse (RA) -> URS 3 DQ User Requirement Specification (URS) 4 Planung/Anschaffung Lasten-/Pflichtenheft 5 Kaufmännische Klärung Notwendigkeit definiert in CC oder RA 6 Verträge (Wartungsverträge?) 7 Umgebungsbedingungen (z.b. Räume) 8 Lieferantenauswahl 9 Qualifizierung erforderlich? Risikoanalyse (RA) -> JA NEIN Kategorisierung Risikoanalyse (RA) -> Qualifizierungsplan Kategorie A: Kategorie B: Kategorie C: nicht 10 Verantwortlichkeiten Risiko Risiko Risiko qualitätsrelevant niedrig mittel hoch 11 Bestellung/Beauftragung FAT - - (x) - 08
10 Risikobasierte Qualifizierungsmatrix 9 Qualifizierung erforderlich? Risikoanalyse (RA) -> JA NEIN Kategorisierung Risikoanalyse (RA) -> Qualifizierungsplan Kategorie A: Kategorie B: Kategorie C: nicht 10 Verantwortlichkeiten Risiko Risiko Risiko qualitätsrelevant niedrig mittel hoch 11 Bestellung/Beauftragung FAT - - (x) - 12 IQ/OQ/PQ SAT - - (x) - 13 Installation/ IQ (Plan, Protokoll, Bericht) x x x - 14 Inbetriebnahme/ OQ (Plan, Protokoll, Bericht) x* x x - 15 Qualifizierung/ SOP (Betrieb, Reinigung, Wartung) - x x x 16 Validierung Logbuch erstellen - x x x 17 Schulung x x x x 18 PQ (Plan, Protokoll, Bericht) - - x - 19 Qualifzierungsbericht (Freigabe) x x x - 20 Routinebetrieb Kalibrierung - x x - 21 (über Risikoanalyse/QMP definiert) Wartung/Instandhaltung - x x x 22 Reinigung/Desinfektion x x x x 23 Periodic Review x x Re-Qualifizierung - - x - 25 Re-Validierung Reinigung (PV) - - x x 26 Prozessvalidierung (PV) - - x - 27 Änderungen/Reparatur CC: Re-Qualifizierung nach Änderungen - x x - 28 Dev: Re-Qualifizierung nach Reparatur - x x - 29 Ausserbetriebnahme Abschlusskalibrierung nach CC - x x - 30 Funktionsprüfung nach CC - - x x *einfacher Funktionstest (Funktion wird aus Betrieb ersichtlich) 09
11 Beispiele für Geräte/Anlagen Kategorie Firma A B C Fassisi Kolbenhubpipetten Trockenschrank Bio-Dot-Sprayer SANUM-Kehlbeck Transportbehälter Mörsermühle Autoklav Vibalogics Vortexer Schlauchpumpe Abfüllanlage 10
12 Minimierung des Qualifizierungsaufwandes Pauschalisierung und feste Gruppierung = hoher Aufwand Kategorien in Anlehnung an die USP <1058> AIQ (Analytical Instrument Qualification): A = niedriges Risiko B = mittleres Risiko C = hohes Risiko Risikobasierte Kategorisierung (ICH Q9, ICH Q10) Firmen- und ggf. Bereichs-abhängige Kategorien Qualifizierung / Re-qualifizierung: Hoher Aufwand für kritische Anlagen, geringerer Aufwand für weniger kritische Anlagen Grundlage für Intervalle und Aufwand zum Erhalt des qualifizierten Zustandes ( Periodic Review oder Re-Qualifizierung) Eine risikobasierte Qualifizierungsmatrix kann den Qualifizierungsaufwand reduzieren. 11
13 Themen der AG 8 Qualifizierung von Geräten und Anlagen - Life-Cycle-Management - Einbindung von ICH Q9 und ICH Q10 Qualifizierung von Laborgeräten ( AG 3 Labor) Validierung computergestützter Systeme Reinigungsvalidierung Neue Technologien / Anforderungen Mitarbeitervalidierung Mängelstatistik der Behörden Qualifizierung externer Dienstleister (Wartung/Qualifizierung/Validierung) 12
14 Themen der AG 8 Qualifizierung von Geräten und Anlagen - Life-Cycle-Management - Einbindung von ICH Q9 und ICH Q10 Qualifizierung von Laborgeräten ( AG 3 Labor) Validierung computergestützter Systeme Reinigungsvalidierung Neue Technologien / Anforderungen Mitarbeitervalidierung Mängelstatistik der Behörden Qualifizierung externer Dienstleister (Wartung/Qualifizierung/Validierung) 12
15 Themen der AG 8 Qualifizierung von Geräten und Anlagen - Life-Cycle-Management - Einbindung von ICH Q9 und ICH Q10 Qualifizierung von Laborgeräten ( AG 3 Labor) Validierung computergestützter Systeme Reinigungsvalidierung Neue Technologien / Anforderungen Mitarbeitervalidierung Mängelstatistik der Behörden Qualifizierung externer Dienstleister (Wartung/Qualifizierung/Validierung) 12
16 Mitglieder der AG 8 Frau Dr. Astner, Isabel Staatl. Gewerbeaufsichtsamt Braunschweig Herr Bödecker, Bernd Staatl. Gewerbeaufsichtsamt Hannover Herr Dr. Brill, Holger Dr. Brill + Partner GmbH Hamburg Frau Butler, Sabrina Paul Lohmann GmbH & Co. KG Emmerthal Herr Christ, Jens Barentz GmbH Oberhausen Frau Derksen, Anja Vibalogics GmbH Cuxhaven Herr Dr. Hamann, Nils Vibalogics GmbH Cuxhaven Frau Jones, Gabriele YES Pharma Services GmbH Hamburg Frau Knipper, Kristina Fassisi GmbH Göttingen Frau Dr. Pfitzner, Anne Med-X-Press GmbH Goslar Herr Dr. Steinbach, Rolf Hanosan GmbH Garbsen Herr Thiering, Alexander bela-pharm GmbH & Co. KG Vechta Frau Willenkamp, Sabine Sanum-Kehlbeck GmbH & Co. KG Hoya Die AG 8 freut sich über weitere Mitglieder! nils.hamann@vibalogics.com 15
17 AG 8: Qualifizierung und Validierung Vielen Dank für Ihre Aufmerksamkeit! 16
18
Praxisbuch GMP- Anlagenqualifizierung in der Pharmaindustrie Planung, Durchführung, Beispieldokumente
 Thomas Peither, Dr. Petra Rempe, Winfried Büßing Praxisbuch GMP- Anlagenqualifizierung in der Pharmaindustrie Planung, Durchführung, Beispieldokumente Inhaltsverzeichnis INHALTSVERZEICHNIS I i Vorwort
Thomas Peither, Dr. Petra Rempe, Winfried Büßing Praxisbuch GMP- Anlagenqualifizierung in der Pharmaindustrie Planung, Durchführung, Beispieldokumente Inhaltsverzeichnis INHALTSVERZEICHNIS I i Vorwort
Die Firma laminar gmbh begrüsst Sie!
 Die Firma laminar gmbh begrüsst Sie! Die Firma laminar gmbh ist ein bestehendes Unternehmen seit 2007 aus der Schweiz. Ab 01.Juni 2012 werden wir unsere Dienstleistungen ausbauen und uns personell vergrössern.
Die Firma laminar gmbh begrüsst Sie! Die Firma laminar gmbh ist ein bestehendes Unternehmen seit 2007 aus der Schweiz. Ab 01.Juni 2012 werden wir unsere Dienstleistungen ausbauen und uns personell vergrössern.
Qualifizierung im Überblick
 Qualifizierung im Überblick Ein Auszug aus Praxisbuch GMP-Anlagenqualifizierung in der Pharmaindustrie von Thomas Peither, Dr. Petra Rempe, Winfried Büßing Grundlegende GMP-Anforderung Die Qualifizierung
Qualifizierung im Überblick Ein Auszug aus Praxisbuch GMP-Anlagenqualifizierung in der Pharmaindustrie von Thomas Peither, Dr. Petra Rempe, Winfried Büßing Grundlegende GMP-Anforderung Die Qualifizierung
AG 8: Qualifizierung und Validierung. Bericht der Arbeitsgruppe / Einführung in die Computervalidierung
 AG 8: Qualifizierung und Validierung Bericht der Arbeitsgruppe / Einführung in die Computervalidierung Dr. Nils Hamann (Vibalogics GmbH, Cuxhaven) 6. GMP-Gesprächskreis Niedersachsen Braunschweig, 20.
AG 8: Qualifizierung und Validierung Bericht der Arbeitsgruppe / Einführung in die Computervalidierung Dr. Nils Hamann (Vibalogics GmbH, Cuxhaven) 6. GMP-Gesprächskreis Niedersachsen Braunschweig, 20.
Prospektive und Retrospektive Maschinenqualifizierung
 Prospektive und Retrospektive Maschinenqualifizierung vom Praktiker für Praktiker von Norbert Waldy 1. Auflage Prospektive und Retrospektive Maschinenqualifizierung Waldy schnell und portofrei erhältlich
Prospektive und Retrospektive Maschinenqualifizierung vom Praktiker für Praktiker von Norbert Waldy 1. Auflage Prospektive und Retrospektive Maschinenqualifizierung Waldy schnell und portofrei erhältlich
Validierung in der Praxis
 Validierung in der Praxis Strategie und Taktik bei der Validierung von medizinischen Produkten SAQ Fachgruppe Medizinprodukte Aarau, 16. Feb. 2006 Dr. Peter Forrer Roche Instrument Center Forrenstrasse
Validierung in der Praxis Strategie und Taktik bei der Validierung von medizinischen Produkten SAQ Fachgruppe Medizinprodukte Aarau, 16. Feb. 2006 Dr. Peter Forrer Roche Instrument Center Forrenstrasse
Dipl.-Phys. Dr. Horst Weißsieker
 1 ULG Reinraumtechnik Modul «Reinraumbetrieb» Block 16: Reinraumbetrieb - Grundlagen Eine Übersicht und Einordnung VDI 2083 Reinraumtechnik Status heute Laufende Projekte VDI 2083/9.2 Verbrauchsmaterialien
1 ULG Reinraumtechnik Modul «Reinraumbetrieb» Block 16: Reinraumbetrieb - Grundlagen Eine Übersicht und Einordnung VDI 2083 Reinraumtechnik Status heute Laufende Projekte VDI 2083/9.2 Verbrauchsmaterialien
Einführung Systemvalidierung Schulung (Modul 0) Version: V03
 Einführung Systemvalidierung Schulung (Modul 0) Version: V03 Ronald Speer LIFE Leipzig Systemvalidierung - Schulung Modul 0 - Einführung Ronald Speer Seite 1 Einleitung Studiensoftware muss GCP-konform
Einführung Systemvalidierung Schulung (Modul 0) Version: V03 Ronald Speer LIFE Leipzig Systemvalidierung - Schulung Modul 0 - Einführung Ronald Speer Seite 1 Einleitung Studiensoftware muss GCP-konform
GM P-Qualifizierung und Validierung von Wirkstoffanlagen
 Ralf Gengenbach Mit Beiträgen von Dr. Hans-Georg Eckert und Wolfgang Hähnel GM P-Qualifizierung und Validierung von Wirkstoffanlagen Ein Leitfaden für die Praxis 6B WILEY YCH WI LEY-VCH Verlag GmbH & Co.
Ralf Gengenbach Mit Beiträgen von Dr. Hans-Georg Eckert und Wolfgang Hähnel GM P-Qualifizierung und Validierung von Wirkstoffanlagen Ein Leitfaden für die Praxis 6B WILEY YCH WI LEY-VCH Verlag GmbH & Co.
Regio Event. 21. November 2013, Blaubeuren Qualifizierung von Reinräumen Rita Welser
 Regio Event 21. November 2013, Blaubeuren Qualifizierung von Reinräumen Rita Welser Übersicht Qualifizierungskonzept: Lüftungs- und Raumqualifizierung Prüfpunkte aus IQ/OQ/PQ Durchführung von Smoke Studies
Regio Event 21. November 2013, Blaubeuren Qualifizierung von Reinräumen Rita Welser Übersicht Qualifizierungskonzept: Lüftungs- und Raumqualifizierung Prüfpunkte aus IQ/OQ/PQ Durchführung von Smoke Studies
Qualifizierungsphasen bei einem Monitoring System
 Qualifizierungsphasen bei einem Monitoring System SCC Seminar GAMP 5 für Praktiker, Rheinfelden 26.Mar.2014 we prove it. www.elpro.com Qualifizierungsphasen bei einem CMS 26.Mar.2014 Seite 1 Agenda 1.
Qualifizierungsphasen bei einem Monitoring System SCC Seminar GAMP 5 für Praktiker, Rheinfelden 26.Mar.2014 we prove it. www.elpro.com Qualifizierungsphasen bei einem CMS 26.Mar.2014 Seite 1 Agenda 1.
Modernes Risikomanagement Anforderungen und Herausforderungen
 Modernes Risikomanagement Anforderungen und Herausforderungen TestXpo2015 TestXpo2015 VTU VTU Engineering Engineering GmbH GmbH Brigitte Brigitte Gübitz Gübitz www.vtu.com Inhalt Anforderungen und Status
Modernes Risikomanagement Anforderungen und Herausforderungen TestXpo2015 TestXpo2015 VTU VTU Engineering Engineering GmbH GmbH Brigitte Brigitte Gübitz Gübitz www.vtu.com Inhalt Anforderungen und Status
Inhaltsverzeichnis. Celeitwort Storhas V. Celeitwort Behrendt. Abkiirzungsverzeichnis. 1 Einfuhrung 1
 Inhaltsverzeichnis Celeitwort Storhas V Celeitwort Behrendt VII Vorwort XVII Abkiirzungsverzeichnis XXIII 1 Einfuhrung 1 2 GMP-Grundlagen 7 2.1 Der BegriffGMP 7 2.2 Geltungsbereich von GMP 10 2.2.1 GMP
Inhaltsverzeichnis Celeitwort Storhas V Celeitwort Behrendt VII Vorwort XVII Abkiirzungsverzeichnis XXIII 1 Einfuhrung 1 2 GMP-Grundlagen 7 2.1 Der BegriffGMP 7 2.2 Geltungsbereich von GMP 10 2.2.1 GMP
Was ist ein Lastenheft?
 Lastenheft Was ist ein Lastenheft? Wann wird ein Lastenheft erstellt? Wozu wird ein Lastenheft erstellt? Was beinhaltet ein Lastenheft? Wer erstellt ein Lastenheft? Wie wird ein Lastenheft erstellt? Was
Lastenheft Was ist ein Lastenheft? Wann wird ein Lastenheft erstellt? Wozu wird ein Lastenheft erstellt? Was beinhaltet ein Lastenheft? Wer erstellt ein Lastenheft? Wie wird ein Lastenheft erstellt? Was
Inhaltsverzeichnis IVZ. Vorwort der Herausgeber zur 5. Auflage 5. Die Autoren 7. 1 Anlagen A Einleitung 25
 Vorwort der Herausgeber zur 5. Auflage 5 Die Autoren 7 1 Anlagen 23 1.A Einleitung 25 1.B Mechanische Komponenten 27 1.B.1 Konstruktions- und Montagematerialien 27 1.B.2 GMP-konforme Konstruktionsmerkmale
Vorwort der Herausgeber zur 5. Auflage 5 Die Autoren 7 1 Anlagen 23 1.A Einleitung 25 1.B Mechanische Komponenten 27 1.B.1 Konstruktions- und Montagematerialien 27 1.B.2 GMP-konforme Konstruktionsmerkmale
Validierung nach GMP Standard
 Validierung nach GMP Standard Dr. Hans Peter Schröder 29.07.2007 aleph-consulting GmbH 1 Einführung Bei der Herstellung von pharmazeutischen Produkten sind besondere Anforderungen an die Qualität der Produktion
Validierung nach GMP Standard Dr. Hans Peter Schröder 29.07.2007 aleph-consulting GmbH 1 Einführung Bei der Herstellung von pharmazeutischen Produkten sind besondere Anforderungen an die Qualität der Produktion
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE. Praxisleitfaden für Hersteller und Zulieferer. 2., überarbeitete Auflage HANSER
 Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
APP. APP betriebsengineering gmbh betriebsengineering gmbh
 APP betriebsengineering gmbh Inhaber Willy Schneeberger Memo Guten Tag! Vor gut einem Jahr am 17. Juli 2002 haben wir die APP betriebsengineering gmbh neu ins Leben gerufen. APP steht für applied. Wir
APP betriebsengineering gmbh Inhaber Willy Schneeberger Memo Guten Tag! Vor gut einem Jahr am 17. Juli 2002 haben wir die APP betriebsengineering gmbh neu ins Leben gerufen. APP steht für applied. Wir
DEUTSCH. Go for the world s leading filling and sealing solution.
 DEUTSCH www.rychiger.com Healthcare Go for the world s leading filling and sealing solution. MIT FUNKTIONALEN SIEGEL- LÖSUNGEN ZUM ERFOLG Rychiger AG in der Schweiz profiliert sich als internationale,
DEUTSCH www.rychiger.com Healthcare Go for the world s leading filling and sealing solution. MIT FUNKTIONALEN SIEGEL- LÖSUNGEN ZUM ERFOLG Rychiger AG in der Schweiz profiliert sich als internationale,
Validierung / Qualifizierung in der AApot. Besuch SAQ Sektion Bern
 Validierung / Qualifizierung in der AApot Besuch Sektion Bern 05.11.2013 Reto Spinnler (Validierungsbeauftragter) Dr. Jean-Paul Buchs (Chef Bereich QS) Agenda 1. Theoretischer Teil: Übersicht Validierung
Validierung / Qualifizierung in der AApot Besuch Sektion Bern 05.11.2013 Reto Spinnler (Validierungsbeauftragter) Dr. Jean-Paul Buchs (Chef Bereich QS) Agenda 1. Theoretischer Teil: Übersicht Validierung
Intensivseminar. Der GMP-Spezialist - für QS, QK, Produktion und Technik -
 Intensivseminar Der GMP-Spezialist - für QS, QK, Produktion und Technik - DER GMP-SPEZIALIST Zielsetzung: Die Anforderungen der Good Manufacturing Practices stellen ein komplexes und stark interpretierbares
Intensivseminar Der GMP-Spezialist - für QS, QK, Produktion und Technik - DER GMP-SPEZIALIST Zielsetzung: Die Anforderungen der Good Manufacturing Practices stellen ein komplexes und stark interpretierbares
Qualifizierungsbedarfsermittlung (QBE) bei der Sartorius AG
 Qualifizierungsbedarfsermittlung (QBE) bei der Sartorius AG - Warum QBE? - Welches Konzept zur QBE? - Wie wurde die QBE durchgeführt? Bereiche, in denen QBE durchgeführt wurde Qualifikationsstruktur in
Qualifizierungsbedarfsermittlung (QBE) bei der Sartorius AG - Warum QBE? - Welches Konzept zur QBE? - Wie wurde die QBE durchgeführt? Bereiche, in denen QBE durchgeführt wurde Qualifikationsstruktur in
REINIGEN IN DER MEDIZINTECHNIK
 CLEANING AND SURFACE PROCESSING REINIGEN IN DER MEDIZINTECHNIK Hannes Köble, Vertrieb parts2clean Fachforum 2016 www.durr.com ÜBERSICHT 1. Teile / Anforderungen 2. Validierung und Qualifizierung Anlagenausstattung
CLEANING AND SURFACE PROCESSING REINIGEN IN DER MEDIZINTECHNIK Hannes Köble, Vertrieb parts2clean Fachforum 2016 www.durr.com ÜBERSICHT 1. Teile / Anforderungen 2. Validierung und Qualifizierung Anlagenausstattung
INHALTSVERZEICHNIS. Kapitel 1 Einführung...15. Kapitel 2 Projektmanagement...27. Vorwort...11. Autoren...12
 Inhaltsverzeichnis INHALTSVERZEICHNIS Vorwort...11 Autoren...12 Kapitel 1 Einführung...15 1.1 GMP für die Arzneimittelsicherheit...16 1.1.1 Hintergrund...16 1.1.2 Zulassung von Arzneimitteln...17 1.1.3
Inhaltsverzeichnis INHALTSVERZEICHNIS Vorwort...11 Autoren...12 Kapitel 1 Einführung...15 1.1 GMP für die Arzneimittelsicherheit...16 1.1.1 Hintergrund...16 1.1.2 Zulassung von Arzneimitteln...17 1.1.3
TÜV SÜD Industrie Service GmbH. Dipl.-Ing.(FH) Walter Ritz / Senior Consultant, 11.10.2012 / 1
 Dipl.-Ing.(FH) Walter Ritz / Senior Consultant, 11.10.2012 / 1 Projektablauf Konzept Studie Basic & Detail Engineering Bestellung Ausführungsplanung Technische Gebäude -ausrüstung Installation Prozess-
Dipl.-Ing.(FH) Walter Ritz / Senior Consultant, 11.10.2012 / 1 Projektablauf Konzept Studie Basic & Detail Engineering Bestellung Ausführungsplanung Technische Gebäude -ausrüstung Installation Prozess-
Inhaltsverzeichnis. Geleitwort Storhas V. Geleitwort Behrendt VII. Vorwort XVII. Abkürzungsverzeichnis XXIII. 1 Einführung 1
 Inhaltsverzeichnis Geleitwort Storhas V Geleitwort Behrendt VII Vorwort XVII Abkürzungsverzeichnis XXIII 1 Einführung 1 2 GMP-Grundlagen 7 2.1 Der Begriff GMP 7 2.2 Geltungsbereich von GMP 10 2.2.1 GMP
Inhaltsverzeichnis Geleitwort Storhas V Geleitwort Behrendt VII Vorwort XVII Abkürzungsverzeichnis XXIII 1 Einführung 1 2 GMP-Grundlagen 7 2.1 Der Begriff GMP 7 2.2 Geltungsbereich von GMP 10 2.2.1 GMP
Pharmazie & Life-Science
 Pharmazie & Life-Science Engineering im regulierten Umfeld für Ihre GMP-gerechte Anlage. Qualität, Erfahrung und Branchenexpertise für Ihr Projekt. Basierend auf 30 Jahren Erfahrung planen und optimieren
Pharmazie & Life-Science Engineering im regulierten Umfeld für Ihre GMP-gerechte Anlage. Qualität, Erfahrung und Branchenexpertise für Ihr Projekt. Basierend auf 30 Jahren Erfahrung planen und optimieren
Das 4 Phasen Modell der TIS CH
 GAP Analysen der strukturierte Weg zum GMP upgrade Das 4 Phasen Modell der TIS CH Vortrag am 06.11.2017 im Rahmen des 13. SCC Event in Pratteln Wolfgang Hähnel Geschäftsführer testo industrial services
GAP Analysen der strukturierte Weg zum GMP upgrade Das 4 Phasen Modell der TIS CH Vortrag am 06.11.2017 im Rahmen des 13. SCC Event in Pratteln Wolfgang Hähnel Geschäftsführer testo industrial services
Datenlogger. Dok.-Nr.: Seite 1 von 6
 Seite 1 von 6 Nummer Verfaßt durch Freigabe durch Apothekenleitung Seite 2 von 6 Inhaltsverzeichnis 1. Gegenstand... 3 2. Begriffe... 3 3. Geltungsbereich... 3 4. Zuständigkeiten... 3 5. Durchführung...
Seite 1 von 6 Nummer Verfaßt durch Freigabe durch Apothekenleitung Seite 2 von 6 Inhaltsverzeichnis 1. Gegenstand... 3 2. Begriffe... 3 3. Geltungsbereich... 3 4. Zuständigkeiten... 3 5. Durchführung...
Systemvalidierung der Studiensoftware eresearch Network am Koordinierungszentrum für f r Klinische Studien DüsseldorfD. Dimitrios Venizeleas
 Systemvalidierung der Studiensoftware eresearch Network am Koordinierungszentrum für f r Klinische Studien DüsseldorfD Dimitrios Venizeleas AG Datenmanagement Koordinierungszentrum für Klinische Studien
Systemvalidierung der Studiensoftware eresearch Network am Koordinierungszentrum für f r Klinische Studien DüsseldorfD Dimitrios Venizeleas AG Datenmanagement Koordinierungszentrum für Klinische Studien
Seminar Qualifizierung und Validierung im GMP und Reinraum-Bereich
 Seminar Qualifizierung und Validierung Mittwoch, 23. November 2016 in Rheinfelden Themen Ziel der Qualifizierungsaktivitäten / Neuerungen im EU-GMP-Annex 15 Planung und Durchführung / Risikobetrachtung
Seminar Qualifizierung und Validierung Mittwoch, 23. November 2016 in Rheinfelden Themen Ziel der Qualifizierungsaktivitäten / Neuerungen im EU-GMP-Annex 15 Planung und Durchführung / Risikobetrachtung
Automatisierte Fertigungsprozesse. Umbruch in der Medizintechnik. Medizintechnisches Kolloquium 06.11.2012
 Automatisierte Fertigungsprozesse Umbruch in der Medizintechnik Medizintechnisches Kolloquium 06.11.2012 Rolf Andrasi Unit Manager Plates Stryker Leibinger GmbH & Co.KG Agenda Unternehmensvorstellung Stryker
Automatisierte Fertigungsprozesse Umbruch in der Medizintechnik Medizintechnisches Kolloquium 06.11.2012 Rolf Andrasi Unit Manager Plates Stryker Leibinger GmbH & Co.KG Agenda Unternehmensvorstellung Stryker
Abweichungen. AG 7 Abweichungsmanagement 16. August 2010, Dr. Andrea Behrenswerth
 2010 Abweichungen DIN ISO 15378 Primärpackmittel für Arzneimittel Besondere Anforderungen für die Anwendung von ISO 9001:2000 entsprechend der Guten Herstellungspraxis (GMP) AG 7 Abweichungsmanagement
2010 Abweichungen DIN ISO 15378 Primärpackmittel für Arzneimittel Besondere Anforderungen für die Anwendung von ISO 9001:2000 entsprechend der Guten Herstellungspraxis (GMP) AG 7 Abweichungsmanagement
TECHNISCHER SERVICE MAXIMALE LEBENSDAUER UND LEISTUNG IHRES MESSINSTRUMENTS
 TECHNISCHER SERVICE MAXIMALE LEBENSDAUER UND LEISTUNG IHRES MESSINSTRUMENTS Wenn Mensch und Technik Hand in Hand arbeiten, entstehen die besten Ergebnisse. Thomas Zschockelt, Technical Support Engineer
TECHNISCHER SERVICE MAXIMALE LEBENSDAUER UND LEISTUNG IHRES MESSINSTRUMENTS Wenn Mensch und Technik Hand in Hand arbeiten, entstehen die besten Ergebnisse. Thomas Zschockelt, Technical Support Engineer
Das "Competence Center Pharma" stellt sich vor
 Das "Competence Center Pharma" stellt sich vor Unsere Leistungen Computervalidierung Prozeßvalidierung Anlagenvalidierung Compliance Inspektionen Qualitätsmanagement (ISO 9000, 13485, KAIZEN) Instandhaltungsmanagement
Das "Competence Center Pharma" stellt sich vor Unsere Leistungen Computervalidierung Prozeßvalidierung Anlagenvalidierung Compliance Inspektionen Qualitätsmanagement (ISO 9000, 13485, KAIZEN) Instandhaltungsmanagement
1 Angaben zum Betrieb (Ref: KlGAP i Vorwort S.5)
 Checkliste zur Inspektion der Aufbereitung von Medizinprodukten (MEP) in Zahnarztpraxen, die Kleinsterilisatoren und Thermodesinfektionsgeräte gemäss Medizinprodukteverordnung (MepV) einsetzen. 1 Angaben
Checkliste zur Inspektion der Aufbereitung von Medizinprodukten (MEP) in Zahnarztpraxen, die Kleinsterilisatoren und Thermodesinfektionsgeräte gemäss Medizinprodukteverordnung (MepV) einsetzen. 1 Angaben
Praxis:... Strasse Nr... PLZ / Ort... Tel. Nr
 Praxis:...... Strasse Nr.... PLZ / Ort...... Tel. Nr.... EMail... Zahl der Units... Zahl der Mitarbeiter... in Stellenprozenten...% Total davon... in Stellenprozenten...% davon MPA ii... in Stellenprozenten...%
Praxis:...... Strasse Nr.... PLZ / Ort...... Tel. Nr.... EMail... Zahl der Units... Zahl der Mitarbeiter... in Stellenprozenten...% Total davon... in Stellenprozenten...% davon MPA ii... in Stellenprozenten...%
GDP-gerechte Qualifizierung eines Logistikzentrums
 Testo industrial services GmbH & Grieshaber Logistics Group AG GDP-gerechte Qualifizierung eines Logistikzentrums Simone Dietz & Markus Salemink www.testotis.de 1/18 Vorschau Arzneimittellagerung nach
Testo industrial services GmbH & Grieshaber Logistics Group AG GDP-gerechte Qualifizierung eines Logistikzentrums Simone Dietz & Markus Salemink www.testotis.de 1/18 Vorschau Arzneimittellagerung nach
Prozessvalidierung: Status Quo vs. Neuer Life-Cycle-Approach
 Testo Industrial Services Mehr Service Mehr Sicherheit R e g i o e v e n t B l a u b e u r e n Prozessvalidierung: Status Quo vs. Neuer Life-Cycle-Approach Testo Industrial Services GmbH, Prozessvalidierung,
Testo Industrial Services Mehr Service Mehr Sicherheit R e g i o e v e n t B l a u b e u r e n Prozessvalidierung: Status Quo vs. Neuer Life-Cycle-Approach Testo Industrial Services GmbH, Prozessvalidierung,
Gerätequalifizierung eines KF-Titrators SCHOTT Instruments
 Gerätequalifizierung eines KF-Titrators SCHOTT Instruments Dr. Jürgen Peters 10.03.2007 Gliederung QS-Merkmale Ein Titrator wird richtig aufgebaut IQ Normative Rückführung Methodenvalidierung versus Gerätevalidieren
Gerätequalifizierung eines KF-Titrators SCHOTT Instruments Dr. Jürgen Peters 10.03.2007 Gliederung QS-Merkmale Ein Titrator wird richtig aufgebaut IQ Normative Rückführung Methodenvalidierung versus Gerätevalidieren
Compliance-Lösungen für sterile Bereiche
 Compliance-Lösungen für sterile Bereiche Testo Industrial Services Mehr Service, mehr Sicherheit. www.testotis.de Compliance-Lösungen für sterile Bereiche Reinheit hat höchste Priorität Die Herstellung
Compliance-Lösungen für sterile Bereiche Testo Industrial Services Mehr Service, mehr Sicherheit. www.testotis.de Compliance-Lösungen für sterile Bereiche Reinheit hat höchste Priorität Die Herstellung
Prozessvalidierung und Qualifizierung von Lasersystemlösungen MEDICAL. Prozessvalidierung und Gerätequalifizierung
 Prozessvalidierung und Qualifizierung von Lasersystemlösungen 1 7 Process monitoring (Prozessmonitoring) Design Qualification (Design-Qualifi zierung) 2 DQ 6 Process validation (Prozessvalidierung) Maintenance
Prozessvalidierung und Qualifizierung von Lasersystemlösungen 1 7 Process monitoring (Prozessmonitoring) Design Qualification (Design-Qualifi zierung) 2 DQ 6 Process validation (Prozessvalidierung) Maintenance
Inspektionen Qualifizierung von Tiefkühlzellen und Validierung des Einfrierens von Plasma
 www.pei.de Inspektionen Qualifizierung von Tiefkühlzellen und Validierung des Einfrierens von Plasma Dr. Sonja Otten ARGE Plasmapherese 22./23.11.2013 Qualifizierung von Tiefkühlzellen und Validierung
www.pei.de Inspektionen Qualifizierung von Tiefkühlzellen und Validierung des Einfrierens von Plasma Dr. Sonja Otten ARGE Plasmapherese 22./23.11.2013 Qualifizierung von Tiefkühlzellen und Validierung
Pharmazie & Life-Science Engineering im regulierten Umfeld für Ihre GMP-gerechte Anlage.
 planting your vision. our know-how. Pharmazie & Life-Science Engineering im regulierten Umfeld für Ihre GMP-gerechte Anlage. Unsere Kompetenzen und Tools In jeder Projektphase verfügen wir über die notwendigen
planting your vision. our know-how. Pharmazie & Life-Science Engineering im regulierten Umfeld für Ihre GMP-gerechte Anlage. Unsere Kompetenzen und Tools In jeder Projektphase verfügen wir über die notwendigen
Mit unserem Team bieten wir ein umfassendes Angebot in. Anlagen-Qualifizierung Prozess-Validierung. für die
 GTW & Partner GmbH Hofackerstrasse 71 Postfach 317 CH 4132 Muttenz 1 Tel. (+41) 061 461 8102 Fax: (+41) 061 461 8104 e-mail: info@gtw-partner.com web: www.gtw-partner.com Mit unserem Team bieten wir ein
GTW & Partner GmbH Hofackerstrasse 71 Postfach 317 CH 4132 Muttenz 1 Tel. (+41) 061 461 8102 Fax: (+41) 061 461 8104 e-mail: info@gtw-partner.com web: www.gtw-partner.com Mit unserem Team bieten wir ein
1 Angaben zum Betrieb (Ref: KlGAP i Vorwort S.5)
 Checkliste zur Inspektion der Aufbereitung von Medizinprodukten (MEP) in Arztpraxen, die Kleinsterilisatoren und Reinigungs und Desinfektionsgeräte (RDG) gemäss Medizinprodukteverordnung (MepV) einsetzen.
Checkliste zur Inspektion der Aufbereitung von Medizinprodukten (MEP) in Arztpraxen, die Kleinsterilisatoren und Reinigungs und Desinfektionsgeräte (RDG) gemäss Medizinprodukteverordnung (MepV) einsetzen.
Einsparpotenziale bei der Validierung computergestützter Systeme
 Einsparpotenziale bei der Validierung computergestützter Systeme Die Stellschrauben zur Optimierung Kostenpotenziale GAMP 5 Risikobasiertes Vorgehen Lieferanten einbinden Standardisierung nutzen SOPs optimieren
Einsparpotenziale bei der Validierung computergestützter Systeme Die Stellschrauben zur Optimierung Kostenpotenziale GAMP 5 Risikobasiertes Vorgehen Lieferanten einbinden Standardisierung nutzen SOPs optimieren
Anforderungen an die Dampfsterilisation
 Leicht verständlicher Überblick Praxisnahe Darstellung Was müssen Sie bei der Qualifizierung von Autoklaven beachten? Audits sicher bestehen! Di. 05. Februar 2019, Rheinfelden Themen Behördliche Inspektion
Leicht verständlicher Überblick Praxisnahe Darstellung Was müssen Sie bei der Qualifizierung von Autoklaven beachten? Audits sicher bestehen! Di. 05. Februar 2019, Rheinfelden Themen Behördliche Inspektion
Experience responsibility. Dienstleistungen für die. Medizintechnik. Pharma & Biotechnologie
 Experience responsibility Dienstleistungen für die Pharma & Biotechnologie Medizintechnik QM/GMP Compliance für Ihre Medizinprodukte Für Inverkehrbringer, Hersteller und technische Aufbereiter von Medizinprodukten
Experience responsibility Dienstleistungen für die Pharma & Biotechnologie Medizintechnik QM/GMP Compliance für Ihre Medizinprodukte Für Inverkehrbringer, Hersteller und technische Aufbereiter von Medizinprodukten
Der GMP-Spezialist - für QS, QK, Produktion und Technik -
 Intensivseminar Der GMP-Spezialist - für QS, QK, Produktion und Technik - 7. bis 9. Juni 2016 Karlsruhe (D) Von der Bundesapothekerkammer anerkanntes Weiterbildungsseminar für die Fachrichtungen Pharmazeutische
Intensivseminar Der GMP-Spezialist - für QS, QK, Produktion und Technik - 7. bis 9. Juni 2016 Karlsruhe (D) Von der Bundesapothekerkammer anerkanntes Weiterbildungsseminar für die Fachrichtungen Pharmazeutische
Services PAS X SERVICES. Das komplette Dienstleistungspaket
 Services PAS X SERVICES Das komplette Dienstleistungspaket Consulting Werum verfügt über mehr als 15 Jahre Erfahrung in der Definition und Optimierung von Geschäftsprozessen. Zum Beratungsangebot von Werum
Services PAS X SERVICES Das komplette Dienstleistungspaket Consulting Werum verfügt über mehr als 15 Jahre Erfahrung in der Definition und Optimierung von Geschäftsprozessen. Zum Beratungsangebot von Werum
Vorwort Autoren Danke Einleitung...18
 Praxisbuch Reinstwasser INHALTSVERZEICHNIS Vorwort...14 Autoren...16 Danke...17 Einleitung...18 Kapitel 1 Wasser und seine Inhaltsstoffe...21 1.1 Wasserherkunft...22 1.1.1 Grundwasser...23 1.1.2 Oberflächenwasser...24
Praxisbuch Reinstwasser INHALTSVERZEICHNIS Vorwort...14 Autoren...16 Danke...17 Einleitung...18 Kapitel 1 Wasser und seine Inhaltsstoffe...21 1.1 Wasserherkunft...22 1.1.1 Grundwasser...23 1.1.2 Oberflächenwasser...24
Modernes LifeCycle- Risikomanagement. Anforderungen und Herausforderungen
 Modernes LifeCycle- Risikomanagement Anforderungen und Herausforderungen ÖRRG ÖRRG 2015 2015 VTU VTU Engineering Engineering GmbH GmbH Brigitte Brigitte Gübitz Gübitz www.vtu.com Inhalt Anforderungen und
Modernes LifeCycle- Risikomanagement Anforderungen und Herausforderungen ÖRRG ÖRRG 2015 2015 VTU VTU Engineering Engineering GmbH GmbH Brigitte Brigitte Gübitz Gübitz www.vtu.com Inhalt Anforderungen und
Qualifizierungs-/ Validierungs- Monitoring. >>QVMon<<
 Qualifizierungs-/ Validierungs- Monitoring >>QVMon
Qualifizierungs-/ Validierungs- Monitoring >>QVMon
Zusammenfassung MAB Review Meeting mit Roche Basel. P. Bürgin, Geschäftleiter CTE
 Zusammenfassung MAB Review Meeting mit Roche Basel P. Bürgin, Geschäftleiter CTE 2008 Übersicht der Themen Die folgenden Themen wurden am Review Meeting besprochen Strukturierung der Anlage Grösse Batchdatenbank
Zusammenfassung MAB Review Meeting mit Roche Basel P. Bürgin, Geschäftleiter CTE 2008 Übersicht der Themen Die folgenden Themen wurden am Review Meeting besprochen Strukturierung der Anlage Grösse Batchdatenbank
Inhaltsverzeichnis IVZ. Vorwort der Herausgeber zur 1. Auflage 5. Die Autoren 7. 1 Audits und Inspektionen 17
 Vorwort der Herausgeber zur 1. Auflage 5 Die Autoren 7 1 Audits und Inspektionen 17 1.A Grundsätze 21 1.A.1 Begriffe 21 1.A.2 Rechtliche Aspekte 23 1.A.3 Anlässe für Audits 23 1.A.4 Kernforderungen an
Vorwort der Herausgeber zur 1. Auflage 5 Die Autoren 7 1 Audits und Inspektionen 17 1.A Grundsätze 21 1.A.1 Begriffe 21 1.A.2 Rechtliche Aspekte 23 1.A.3 Anlässe für Audits 23 1.A.4 Kernforderungen an
Werdegang - Vita Gordon Chalas
 Werdegang - Vita Gordon Chalas Seite 2 von 5 Angaben zur Person Name: Chalas Vorname: Gordon Geburtsdatum: 26. Juni 1975 Familienstand: Ledig Staatsangehörigkeit: Deutsch Berufsbezeichnung: Dipl.-Ing.
Werdegang - Vita Gordon Chalas Seite 2 von 5 Angaben zur Person Name: Chalas Vorname: Gordon Geburtsdatum: 26. Juni 1975 Familienstand: Ledig Staatsangehörigkeit: Deutsch Berufsbezeichnung: Dipl.-Ing.
Kalibrierung. Dok.-Nr.: Seite 1 von 6
 Seite 1 von 6 Nummer Verfaßt von: Genehmigung durch Apothekenleitung: Seite 2 von 6 Inhaltsverzeichnis 1. Gegenstand... 3 2. Geltungsbereich... 3 3. Zuständigkeiten... 3 4. Durchführung... 3 4.1 Allgemeines...
Seite 1 von 6 Nummer Verfaßt von: Genehmigung durch Apothekenleitung: Seite 2 von 6 Inhaltsverzeichnis 1. Gegenstand... 3 2. Geltungsbereich... 3 3. Zuständigkeiten... 3 4. Durchführung... 3 4.1 Allgemeines...
GMP-Risikoanalysen. Standardvorlagen. Leseprobe. Ralf Gengenbach u.a. für Räume und Ausrüstung im pharmazeutischen Umfeld
 GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld Leseprobe Ralf Gengenbach u.a. GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld
GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld Leseprobe Ralf Gengenbach u.a. GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld
Annex 15 Lebenszyklus neue Philosophie und Aufwand sparen?
 Vortrag Qualifizierung & Validierung im Wandel Annex 15 Lebenszyklus neue Philosophie und Aufwand sparen? Vortrag am 14.04.2016 im Rahmen des 10. SCC Event in Pratteln Wolfgang Hähnel Geschäftsführer Testo
Vortrag Qualifizierung & Validierung im Wandel Annex 15 Lebenszyklus neue Philosophie und Aufwand sparen? Vortrag am 14.04.2016 im Rahmen des 10. SCC Event in Pratteln Wolfgang Hähnel Geschäftsführer Testo
GMP Basis und AufbauSeminar inkl. Fallstudien und. Praxisübungen. Praxisworkshop/Seminar. Testo Industrial Services Mehr Service, mehr Sicherheit.
 25.02.-28.02.2019, A-Wien 11.03.-14.03.2019, Kirchzarten bei Freiburg 23.09.-26.09.2019, Mörfelden-Walldorf Praxisworkshop/Seminar GMP Basis und AufbauSeminar inkl. Fallstudien und Praxisübungen Testo
25.02.-28.02.2019, A-Wien 11.03.-14.03.2019, Kirchzarten bei Freiburg 23.09.-26.09.2019, Mörfelden-Walldorf Praxisworkshop/Seminar GMP Basis und AufbauSeminar inkl. Fallstudien und Praxisübungen Testo
Risikomanagement im Auftragslabor Ein Erfahrungsbericht
 Risikomanagement im Auftragslabor Ein Erfahrungsbericht Dr. Frank Böttcher, Labor L+S AG Bad Bocklet Akkreditierungskonferenz am 6. und 7. Juni 2016 in Berlin 13.05.2016 1 Die Labor L+S AG Mittelständisches
Risikomanagement im Auftragslabor Ein Erfahrungsbericht Dr. Frank Böttcher, Labor L+S AG Bad Bocklet Akkreditierungskonferenz am 6. und 7. Juni 2016 in Berlin 13.05.2016 1 Die Labor L+S AG Mittelständisches
Anforderungen an das Reinraumpersonal: Verhalten, Mitarbeiterqualifikation und Dokumentation
 Anforderungen an das Reinraumpersonal: Verhalten, Mitarbeiterqualifikation und Dokumentation Claudia Pachl, AVANTALION Consulting Group Cleanzone Stand A 24 Frankfurt, 27.10.2015 Agenda Regulatorische
Anforderungen an das Reinraumpersonal: Verhalten, Mitarbeiterqualifikation und Dokumentation Claudia Pachl, AVANTALION Consulting Group Cleanzone Stand A 24 Frankfurt, 27.10.2015 Agenda Regulatorische
7.5.1 Dokumentierte Informationen. Dokumentenübersicht Revision vom Ersteller/ in Verteiler Grund der letzten Änderung
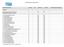 Handbuch Handbuch gesamt mit Kapitel 1 bis 10 0 QM QM Prozessbeschreibungen / Verfahren 6 1 0 Ermittlung Risiken Chancen 0 QM QM 6 2 0 Qualitätsziele 0 QM QM 6 3 0 Planung Änderungen 0 QM QM 7 1 3 Externe
Handbuch Handbuch gesamt mit Kapitel 1 bis 10 0 QM QM Prozessbeschreibungen / Verfahren 6 1 0 Ermittlung Risiken Chancen 0 QM QM 6 2 0 Qualitätsziele 0 QM QM 6 3 0 Planung Änderungen 0 QM QM 7 1 3 Externe
Validierung von Verpackungsprozessen nach aktualisierter Leitlinie
 Validierung von Verpackungsprozessen nach aktualisierter Leitlinie Rolf Seipelt Vortrag auf der 42. Veranstaltung des Arbeitskreises Infektionsprophylaxe am 15.03.2016 in Potsdam und 16.03.2015 in Leipzig
Validierung von Verpackungsprozessen nach aktualisierter Leitlinie Rolf Seipelt Vortrag auf der 42. Veranstaltung des Arbeitskreises Infektionsprophylaxe am 15.03.2016 in Potsdam und 16.03.2015 in Leipzig
AG 3 - Labor 20. Feb. 2013. Laborspezifische Fragestellungen
 AG 3 - Labor 20. Feb. 2013 * Laborspezifische Fragestellungen Einwandfrei arbeitende Analysengeräte Vertrauen in die Analysenergebnisse Nachvollziehbare und dokumentierte Nachweise Ausschluss von Störeinwirkungen
AG 3 - Labor 20. Feb. 2013 * Laborspezifische Fragestellungen Einwandfrei arbeitende Analysengeräte Vertrauen in die Analysenergebnisse Nachvollziehbare und dokumentierte Nachweise Ausschluss von Störeinwirkungen
Food & Pharma. Lösungen in bester Qualität für einheitliche Waschresultate und hohe Hygieneanforderungen
 Food & Pharma Lösungen in bester Qualität für einheitliche Waschresultate und hohe Hygieneanforderungen Über KEN A/S KEN ist eine innovative Firma, die 1941 gegründet wurde. Heute bietet KEN effiziente
Food & Pharma Lösungen in bester Qualität für einheitliche Waschresultate und hohe Hygieneanforderungen Über KEN A/S KEN ist eine innovative Firma, die 1941 gegründet wurde. Heute bietet KEN effiziente
Ergebnis: Workshop A Computer Validierung
 Behörde für betrieblichen Arbeits-, Umwelt- und Verbraucherschutz - Dez. 24 AMG Ergebnis: Workshop A Computer Validierung 5. am Vorstellung durch: Herzdame Matthias Franke und Kreuzbube Susanne Strempel
Behörde für betrieblichen Arbeits-, Umwelt- und Verbraucherschutz - Dez. 24 AMG Ergebnis: Workshop A Computer Validierung 5. am Vorstellung durch: Herzdame Matthias Franke und Kreuzbube Susanne Strempel
gempex GmbH Zweigniederlassung Schweiz Unterdorfstrasse Sisseln
 gempex GmbH Technisches Büro Deutschland Besselstraße 6 68219 Mannheim +49 621 819119-0 www.gempex.de Zweigniederlassung Schweiz Unterdorfstrasse 1 4334 Sisseln +41 62 86990-20 www.gempex.ch gempex = gemp
gempex GmbH Technisches Büro Deutschland Besselstraße 6 68219 Mannheim +49 621 819119-0 www.gempex.de Zweigniederlassung Schweiz Unterdorfstrasse 1 4334 Sisseln +41 62 86990-20 www.gempex.ch gempex = gemp
Gerätequalifizierung IQ/OQ/PQ
 Gerätequalifizierung IQ/OQ/PQ Gerätequalifizierung im Rahmen von Qualitätsmanagement oder Validierung ist bei einer Vielzahl von Unternehmen unabdingbare Voraussetzung für eine Lieferantenentscheidung.
Gerätequalifizierung IQ/OQ/PQ Gerätequalifizierung im Rahmen von Qualitätsmanagement oder Validierung ist bei einer Vielzahl von Unternehmen unabdingbare Voraussetzung für eine Lieferantenentscheidung.
Effiziente Qualifizierung analytischer Systeme Ein praxisnahes, GxP-konformes, integriertes und risikobasiertes Umsetzungskonzept
 Effiziente Qualifizierung analytischer Systeme Ein praxisnahes, GxP-konformes, integriertes und risikobasiertes Umsetzungskonzept Dr. Hiltrud Lenke 1 und Jens Bourquain 2 Chemgineering Business Design
Effiziente Qualifizierung analytischer Systeme Ein praxisnahes, GxP-konformes, integriertes und risikobasiertes Umsetzungskonzept Dr. Hiltrud Lenke 1 und Jens Bourquain 2 Chemgineering Business Design
GMP-Basislehrgang Schwerpunkt Biotechnologie bis Campus Berlin-Buch. Weiterbildungsprogramm
 Weiterbildungsprogramm GMP-Basislehrgang Schwerpunkt Biotechnologie Berufsbegleitender Grundlagenkurs (Wochenendkurs) 04.11.2016 bis 04.12.2016 Campus Berlin-Buch Dauer 04.11.2016 04.12.2016, Klausur:
Weiterbildungsprogramm GMP-Basislehrgang Schwerpunkt Biotechnologie Berufsbegleitender Grundlagenkurs (Wochenendkurs) 04.11.2016 bis 04.12.2016 Campus Berlin-Buch Dauer 04.11.2016 04.12.2016, Klausur:
Installations-, Funktions- und Leistungsqualifizierung einer Thermoguard Installation
 Installations-, Funktions- und Leistungsqualifizierung einer Thermoguard Installation Thermoguard Qualifizierungen gemäss GMP Für den Betrieb von Thermoguard Hard- und Software in einer gesetzlich geregelten
Installations-, Funktions- und Leistungsqualifizierung einer Thermoguard Installation Thermoguard Qualifizierungen gemäss GMP Für den Betrieb von Thermoguard Hard- und Software in einer gesetzlich geregelten
Prozess-Systeme für die Pharmazie, Biotechnologie & Kosmetikindustrie. Pharmatec GmbH
 Prozess-Systeme für die Pharmazie, Biotechnologie & Kosmetikindustrie Pharmatec GmbH KIESELMANN Pharmatec GmbH Hauptsitz der KIESELMANN Gruppe am Standort Knittlingen Engineering und Projektmanagement
Prozess-Systeme für die Pharmazie, Biotechnologie & Kosmetikindustrie Pharmatec GmbH KIESELMANN Pharmatec GmbH Hauptsitz der KIESELMANN Gruppe am Standort Knittlingen Engineering und Projektmanagement
Projektplanung Reinraumtechnik
 Lothar Gail / Udo Gommel / Horst Weißsieker (Hrsg.) Projektplanung Reinraumtechnik Hüthig Verlag Heidelberg Inhaltsverzeichnis Vorwort " V Die Autoren VI Einführung: Leitfaden für Reinraumprojekte 1 1
Lothar Gail / Udo Gommel / Horst Weißsieker (Hrsg.) Projektplanung Reinraumtechnik Hüthig Verlag Heidelberg Inhaltsverzeichnis Vorwort " V Die Autoren VI Einführung: Leitfaden für Reinraumprojekte 1 1
Validierung. - Organisationsstruktur im Lebenszyklus - Dr. Rainer Gnibl. DIALOG 5 Prozessvalidierung
 Validierung - Organisationsstruktur im Lebenszyklus - Dr. Rainer Gnibl 1 1 Dr. Rainer Gnibl Regierung von Oberfranken Ludwigstr. 20 95444 Bayreuth Phone +49 981 53-1262 Fax +49 921 604-4950 Mail rainer.gnibl@reg-ofr.bayern.de
Validierung - Organisationsstruktur im Lebenszyklus - Dr. Rainer Gnibl 1 1 Dr. Rainer Gnibl Regierung von Oberfranken Ludwigstr. 20 95444 Bayreuth Phone +49 981 53-1262 Fax +49 921 604-4950 Mail rainer.gnibl@reg-ofr.bayern.de
Working for You. Anton Paar Certified Service
 Working for You. Anton Paar Certified Service Anton Paar Certified Service Erweiterter Geräteschutz Garantieverlängerung auf bis zu 3 Jahre, inklusive aller Reparaturen* ab Lieferdatum Bei Kombination
Working for You. Anton Paar Certified Service Anton Paar Certified Service Erweiterter Geräteschutz Garantieverlängerung auf bis zu 3 Jahre, inklusive aller Reparaturen* ab Lieferdatum Bei Kombination
GMP-Risikoanalysen. Standardvorlagen. Leseprobe. Ralf Gengenbach u.a. für Räume und Ausrüstung im pharmazeutischen Umfeld
 GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld Leseprobe Ralf Gengenbach u.a. GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld
GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld Leseprobe Ralf Gengenbach u.a. GMP-Risikoanalysen Standardvorlagen für Räume und Ausrüstung im pharmazeutischen Umfeld
Aufbereitung von Instrumenten und Medizinprodukten
 Dritter Hygienetag der Kassenärztlichen Vereinigung Bayerns Nürnberg, 10.Mai 2014 Aufbereitung von Instrumenten und Medizinprodukten Vortrag: Validierung der Instrumentenaufbereitung in der Arztpraxis;
Dritter Hygienetag der Kassenärztlichen Vereinigung Bayerns Nürnberg, 10.Mai 2014 Aufbereitung von Instrumenten und Medizinprodukten Vortrag: Validierung der Instrumentenaufbereitung in der Arztpraxis;
Stellenbeschreibung Fachtechnisch verantwortliche Person (FvP) Pharmalogistik
 Stellenbeschreibung Fachtechnisch verantwortliche Person (FvP) Pharmalogistik Funktionsbezeichnung: Stellvertreter: Fachtechnisch verantwortliche Person Herr Markus Muster Anforderungen an die Schweizer
Stellenbeschreibung Fachtechnisch verantwortliche Person (FvP) Pharmalogistik Funktionsbezeichnung: Stellvertreter: Fachtechnisch verantwortliche Person Herr Markus Muster Anforderungen an die Schweizer
GMP-Gesprächskreis Niedersachsen. Bericht der AG 2 Ongoing Stability Programme / PQR
 GMP-Gesprächskreis Niedersachsen Bericht der AG 2 Ongoing Stability Programme / PQR Braunschweig, 29. Oktober 2009 Konsolidierende Sitzung und Ziele der Arbeitsgruppe Konsolidierende Sitzung Die Arbeitsgruppe
GMP-Gesprächskreis Niedersachsen Bericht der AG 2 Ongoing Stability Programme / PQR Braunschweig, 29. Oktober 2009 Konsolidierende Sitzung und Ziele der Arbeitsgruppe Konsolidierende Sitzung Die Arbeitsgruppe
Stufen der Reinraumqualifizierung. Dr. R. Laub (profi con GmbH)
 Stufen der Reinraumqualifizierung Dr. R. Laub (profi con GmbH) 1 Einführung Vor Projektbeginn sollte man wissen was man wirklich will Was alles schiefgehen kann wer wovon Ahnung hat Wer was macht wann
Stufen der Reinraumqualifizierung Dr. R. Laub (profi con GmbH) 1 Einführung Vor Projektbeginn sollte man wissen was man wirklich will Was alles schiefgehen kann wer wovon Ahnung hat Wer was macht wann
AG 3 Labor Stand 28.01.2013 Seite: 1 von 5 Gerätequalifizierung. Leitfaden zur Gerätequalifizierung
 AG 3 Labor Stand 28.01.2013 Seite: 1 von 5 Leitfaden zur Vorbemerkung Der Leitfaden soll einen schnellen Überblick für den ergebnissicheren Einsatz von analytischen Hilfsmitteln, Messgeräten und Messsystemen
AG 3 Labor Stand 28.01.2013 Seite: 1 von 5 Leitfaden zur Vorbemerkung Der Leitfaden soll einen schnellen Überblick für den ergebnissicheren Einsatz von analytischen Hilfsmitteln, Messgeräten und Messsystemen
Lebenszyklus-Risikoanalyse in der Qualifizierung
 Maschinen- und Anlagenbau Lebenszyklus-Risikoanalyse in der Qualifizierung Implementierung eines software-unterstützten Life-Cycle-Risikomanagement-Prozesses Teil 2* ) Dipl.-Ing. Brigitte Gübitz VTU Engineering
Maschinen- und Anlagenbau Lebenszyklus-Risikoanalyse in der Qualifizierung Implementierung eines software-unterstützten Life-Cycle-Risikomanagement-Prozesses Teil 2* ) Dipl.-Ing. Brigitte Gübitz VTU Engineering
Good Weighing Practice
 Good Weighing Practice The Global Weighing Guideline Martin Huber Greifensee 5.Mai 2011 Garantierte Qualität Kostenreduktion Sichere Audits Wir wollen qualitativ hochwertige Produkte herstellen. Wir wollen
Good Weighing Practice The Global Weighing Guideline Martin Huber Greifensee 5.Mai 2011 Garantierte Qualität Kostenreduktion Sichere Audits Wir wollen qualitativ hochwertige Produkte herstellen. Wir wollen
Standard Monitoringsystem
 Standard Monitoringsystem Reinraum-Anforderungen nach Annex 1, EU-GMP-Leitfaden Strikte Anforderungen an die Einhaltung der Umgebungsbedingungen in den entsprechenden Reinraum-Klassen Kontinuierliche Datenaufzeichnung
Standard Monitoringsystem Reinraum-Anforderungen nach Annex 1, EU-GMP-Leitfaden Strikte Anforderungen an die Einhaltung der Umgebungsbedingungen in den entsprechenden Reinraum-Klassen Kontinuierliche Datenaufzeichnung
Kalibrierung, Qualifizierung, Validierung, GxP-Beratung und -Umsetzung
 Kalibrierung, Qualifizierung, Validierung, GxP-Beratung und -Umsetzung Testo Industrial Services Mehr Service, mehr Sicherheit. www.testotis.ch GxP-Services Testo Industrial Services Ihr Beratungs- und
Kalibrierung, Qualifizierung, Validierung, GxP-Beratung und -Umsetzung Testo Industrial Services Mehr Service, mehr Sicherheit. www.testotis.ch GxP-Services Testo Industrial Services Ihr Beratungs- und
Gerätequalifizierung und -überwachung im Analytik-Labor
 A 3 ANALYTIK Gerätequalifizierung und -überwachung im Analytik-Labor Fortbildung zum Prüfmittelbeauftragten 16. 18. Oktober 2013, Mannheim Umsetzung europäischer und US-amerikanischer Anforderungen Mit
A 3 ANALYTIK Gerätequalifizierung und -überwachung im Analytik-Labor Fortbildung zum Prüfmittelbeauftragten 16. 18. Oktober 2013, Mannheim Umsetzung europäischer und US-amerikanischer Anforderungen Mit
GMP-Vorqualifizierung für Separatoren ab Werk. Flexibel und sicher am GEA Pharmaprüfstand
 GMP-Vorqualifizierung für Separatoren ab Werk Flexibel und sicher am GEA Pharmaprüfstand 2 GMP-VORQUALIFIZIERUNG FÜR SEPARATOREN AB WERK Kundenspezifisch, wirtschaftlich und sicher Für Hersteller von Pharmaprodukten
GMP-Vorqualifizierung für Separatoren ab Werk Flexibel und sicher am GEA Pharmaprüfstand 2 GMP-VORQUALIFIZIERUNG FÜR SEPARATOREN AB WERK Kundenspezifisch, wirtschaftlich und sicher Für Hersteller von Pharmaprodukten
Management von Software Projekten
 Management von Software Projekten INSO Forschungsgruppe Industrielle Software Leitung Prof. Grechenig VU 183.166 2h Sommer 09 www.inso.tuwien.ac.at Agenda Quality Management Risk Management Quality Management
Management von Software Projekten INSO Forschungsgruppe Industrielle Software Leitung Prof. Grechenig VU 183.166 2h Sommer 09 www.inso.tuwien.ac.at Agenda Quality Management Risk Management Quality Management
Qualifizierung von Analysengeräten. Garantierte Sicherheit durch IQ/OQ
 Qualifizierung von Analysengeräten Garantierte Sicherheit durch IQ/OQ Metrohm steht für Qualität 02 Professionelle, zertifizierte IQ/OQ Korrekte und präzise Ergebnisse Erfüllung behördlicher Vorschriften
Qualifizierung von Analysengeräten Garantierte Sicherheit durch IQ/OQ Metrohm steht für Qualität 02 Professionelle, zertifizierte IQ/OQ Korrekte und präzise Ergebnisse Erfüllung behördlicher Vorschriften
GTP Gute TitrierPraxis
 GTP Gute TitrierPraxis GTP Sicheres Titrieren Gleichbleibende Qualität Minimiertes Risiko Reduzierter Aufwand Schutz Ihrer Investition Verlässliche Resultate Sicheres Titrieren in der Praxis GTP Gute TitrierPraxis
GTP Gute TitrierPraxis GTP Sicheres Titrieren Gleichbleibende Qualität Minimiertes Risiko Reduzierter Aufwand Schutz Ihrer Investition Verlässliche Resultate Sicheres Titrieren in der Praxis GTP Gute TitrierPraxis
IT-Anforderungen an Biobanken. Ronald Speer Koordinierungszentrum für Klinische Studien Leipzig. TMF-Symposium Biomaterialbanken Berlin, 27.04.
 IT-Anforderungen an Biobanken Ronald Speer Koordinierungszentrum für Klinische Studien Leipzig TMF-Symposium Biomaterialbanken Berlin, 27.04.2006 TMF-Symposium Biomaterialbanken. 27.04.2006 Gliederung
IT-Anforderungen an Biobanken Ronald Speer Koordinierungszentrum für Klinische Studien Leipzig TMF-Symposium Biomaterialbanken Berlin, 27.04.2006 TMF-Symposium Biomaterialbanken. 27.04.2006 Gliederung
