8 Aromaten. vorläufige Fassung. 8.1 Erforschung des Benzols
|
|
|
- David Lang
- vor 7 Jahren
- Abrufe
Transkript
1 8.1 Erforschung des Benzols vorläufige Fassung A1 Im Vergleich mit einem Alkan der Summenformel 6 14 fehlen im Molekül der Verbindung mit der Summenformel 6 6 acht -Atome, d. h., ein offenkettiges Molekül müsste entweder zwei Dreifachbindungen, eine Dreifachbindung und zwei Doppelbindungen oder vier Doppelbindungen enthalten. Beispiele: A2 Die Strukturformel von Dewar steht nicht mit dem experimentellen Befund in Einklang, dass bei der omierung von Benzol nur ein ombenzol-isomer entsteht. Die beiden anderen Strukturformeln stehen mit dem Befund in Einklang. Monosubstitutionsprodukte der beiden ersten Beispiele aus A1: (E)-1-om-hexa-1,5-dien-3-in (Z)-1-om-hexa-1,5-dien-3-in 2-om-hexa-1,5-dien-3-in 1-om-hexa-1,5-diin 3-om-hexa-1,5-diin A3 Das Ladenburg-Benzol steht mit dem experimentellen Befund in Einklang, dass bei der omierung von Benzol nur ein ombenzol-isomer entsteht, da alle -Atome gleichwertig sind. Es steht auch auf den ersten Blick damit in Einklang, dass es drei Dibrombenzol-Isomere gibt: Bei genauerer Betrachtung erkennt man allerdings, dass das rechts dargestellte Molekül chiral ist, d. h., es gibt vier Ladenburg-Dibrombenzol -Isomere, von denen zwei zueinander spiegelbildisomer sind. Elemente hemie 2 1
2 8 Aromaten 8.2 Bindungsverhältnisse im Benzolmolekül A1 109,5 109, Ethan Ethen Ethin Benzol inweis: Die genaueren Winkel im Ethen sind 117,4 ( ) und 121,3 ( ). A2 Die besondere Stabilität des Benzolmoleküls ist auf den Bau des Benzolmoleküls und die Mesomeriestabilisierung zurückzuführen: regelmäßiges, ebenes Sechseck, alle --Bindungslängen gleich, Delokalisierung der sechs Ringelektronen. A3 Prismanmoleküle sind nicht durch Mesomerie stabilisiert. Außerdem stehen sie unter hoher Ringspannung, was energetisch ungünstig ist. Das isomere Benzol ist dagegen durch Mesomerie stabilisiert. Außerdem stehen seine planaren Moleküle nicht unter Ringspannung. Bei ca. 90 haben die Prismanmoleküle ausreichend Aktivierungsenergie, um zum engergieärmeren Benzol zu isomerisieren. 8.3 Mesomerie und Aromatizität A1 Betrachtet man zunächst das Ethenmolekül, so ist jedes der beiden Kohlenstoffatome über eine Doppelbindung mit dem anderen Kohlenstoffatom verbunden sowie über Einfachbindungen mit zwei Wasserstoffatomen. Nach dem Elektronenpaar- Abstoßungs- Modell (EPA-Modell) wird die Doppelbindung wie eine Einfachbindung behandelt und somit die Abstoßung von nur drei Elektronenwolken betrachtet. Diese haben den größtmöglichen Abstand bei einer trigonalplanaren Anordnung mit einem Bindungswinkel von ca Beim Buta-1,3-dien-Molekül erwartet man analog, dass die beiden Molekülhälften für sich genommen eben sind. Das EPA-Modell würde aber freie Drehbarkeit um die Einfachbindung in der Mitte erlauben, sodass das Molekül als Ganzes nicht eben wäre. Die mesomeren Grenzstrukturen zeigen aber, dass auch die mittlere --Bindung Doppelbindungscharakter hat: Die Delokalisierung ist energetisch günstiger als die Lokalisierung der Elektronen in den endständigen Doppelbindungen. Wendet man das EPA-Modell auf die polaren Grenzstrukturen und den Mittelteil des Moleküls an, ergibt sich auch dort eine planare Anordnung. Folglich erwartet man, dass das ganze Molekül planar ist. inweis: Messungen haben ergeben, dass im Buta-1,3-dien die beiden äußeren --Bindungen etwas länger sind, als bei einer normalen Doppelbindung zu erwarten wäre, während die mittlere --Bindung etwas kürzer ist, als bei einer normalen Einfachbindung zu erwarten wäre. 2 Elemente hemie 2
3 A2 Anwendung der ückel-regel ergibt: Verbindung Zahl der delokalisierten Elektronen Aromat yclobuta-1,3-dien 4 n mit n = 1 nein Pyrimdin 4 n + 2 mit n = 1 ja ycloocta-1,3,5,7-tetraen 4 n mit n = 2 nein Borazol 4 n + 2 mit n = 1 ja Eine Recherche kann z. B. ergeben: yclobuta-1,3-dien wird auch als Antiaromat bezeichnet. ycloocta-1,3,5,7-tetraen ist kein Antiaromat, da das Molekül nicht eben, sondern wannenförmig ist; es ist eher als cyclisches Polyen zu betrachten, das unter Ringspannung steht. Pyrimdin wird als eteroaromat bezeichnet. Borazol wird oft als anorganischer Aromat bezeichnet; andere Quellen sind der Meinung, dass es eine formale Ähnlichkeit zu Benzol hat, aber kein Aromat ist. 8.5 alogenierung von Benzol Zur Aufgabe A1 Im zweiten Reaktionsschritt findet eine Säure-Base-Reaktion statt. Das im ersten Reaktionsschritt gebildete arbokation (arbeniumion) ist die ønsted-säure, die ein Proton abspaltet (Protonendonator). Das Fe 4 -Ion wirkt als Base, die das Proton aufnimmt (Protonen akzeptor). 8.6 Exkurs Reaktionsmechanismen im Vergleich Zur Aufgabe A1 Die elektrophile Substitution an Aromaten und die radikalische Substitution haben gemeinsam, dass es sich jeweils um eine Substitution handelt, d. h., Atome oder Atomgruppen werden ersetzt. Unterschiede: Bei der radikalischen Substitution sind die reaktionsfähigen Teilchen, die das Substrat angreifen, Radikale. Bei der elektrophilen Substitution sind die reaktionsfähigen Teilchen, die das Substrat angreifen, Kationen oder Bereiche von Teilchen mit positiver Partialladung. Bei der radikalischen Substitution erfolgen homolytische Spaltungen, bei der elektrophilen Substitution heterolytische Spaltungen. Die radikalische Substitution wird durch Licht oder Radikalbildner gestartet und ist danach eine Kettenreaktion. Die elektrophile Substitution erfolgt häufig in Gegenwart eines Katalysators. Die elektrophile Substitution an Aromaten und die elektrophile Addition haben gemeinsam, dass jeweils ein elektrophiler Angriff auf den Reaktionspartner erfolgt. Unterschiede: Bei der elektrophilen Addition werden Doppelbindungen (oder Dreifachbindungen) aufgehoben, bei der elektrophilen Substitution bleibt das aromatische System erhalten. Bei der elektrophilen Substitution sind die auptschritte ein Additions- und ein Eliminierungsschritt. Bei der elektrophilen Addition folgt auf den ersten Additionsschritt ein zweiter. Die radikalische Substitution und die elektrophile Addition sind so unterschiedlich, dass sie sich kaum vergleichen lassen. Zu den Versuchen V1 B1 im Schülerbuch zeigt die Reaktionsgleichungen. a) Im Dunkeln erfolgt katalytisch die Substitution. Es entstehen bevorzugt 2-omtoluol und 4-omtoluol und wenig 3-omtoluol. b) Im Licht z. B. eines Diaprojektors oder auf einem verhead-projektor erfolgt in einer Radikalreak tion bevorzugt die omierung des Methylrestes; es entsteht Benzylbromid. Elemente hemie 2 3
4 c) Nach beiden Reaktionen kann im Kolben omwasserstoff nachgewiesen werden, z. B. mit feuchtem Universalindikatorpapier (wird rot) oder mit einem Glasstab, an dem ein Tropfen Ammoniak hängt (Ammoniumbromid-Rauch). V2 Es bilden sich zwei flüssige Phasen (Schichten), die untere Phase (omwasser) ist zunächst gelb. Beim Schütteln tritt sofort Entfärbung ein. Es bildet sich 1,2-Dibromcyclohexan. 8.7 Wichtige Benzolderivate A1 Das DDT-Molekül (Dichlordiphenyltrichlorethan) ist ein unpolares Teilchen, das zwei Benzolringe und fünf hloratome enthält. DDT weist eine hohe Toxizität für Insekten auf, aber nur eine geringe für Säugetiere. Daher wurde es lange Zeit groß flächig als Insektizid angewandt. Die Entwicklung von Resistenzen und das Erkennen der negativen Auswirkungen von DDT für die Umwelt führten dazu, dass DDT heute nur noch zur Bekämpfung der Malariamücke (Anopheles) eingesetzt wird. DDT ist lipophil und chemisch sehr stabil. Die Stabilität bedingt, dass DDT biologisch schwer abbaubar ist. Gelangt DDT in die Nahrungskette, so kann es sich aufgrund seiner Fettlöslichkeit im Gewebe von Tieren und Menschen anreichern. DDT und seine Abbauprodukte besitzen eine endokrine Wirkung, d. h., sie können wie ormone wirken oder körpereigene ormone hemmen. Dies kann fatale Auswirkungen für rganismen mit hoher DDT-Konzentration haben, z. B. zu dünne Eierschalen bei Vögeln. l l l l l Dichlor-Diphenyl- Trichlorethan (DDT) A2 Toluol reagiert mit hlor in Gegenwart eines geeigneten Katalysators zu einem hlortoluol (KKK-Regel: Kälte, Katalysator, Kern). Unter dem Einfluss von Licht oder bei höherer Temperatur werden ein oder mehrere Wasserstoffatome der Methylgruppe durch hloratome ersetzt (SSS-Regel: Sonne, Siedehitze, Seitenkette). l l l 2-hlortoluol (o-hlortoluol) 4-hlortoluol (p-hlortolul) hlorphenylmethan A3 N Phthalsäure Phenylalanin 4 Elemente hemie 2
5 Zu den Versuchen V1 Mit Eisen(III)-chlorid zeigt Phenol eine rotviolette Farbe, die durch einen Eisen(III)-phenolat- Komplex hervorgerufen wird. V2 Bei der xidation tritt bald der charakteristische Geruch des Benzaldehyds ( Bittermandelaroma ) auf. 8.8 Acidität von Phenol und Basizität von Anilin Zur Aufgabe A1 Diethylamin < Anilin < Ethanol < Wasser < Phenol < Essigsäure Begründung: Essigsäure (pk S = 4,75) hat von den genannten Verbindungen die höchste Acidität. Das positiv polarisierte Kohlenstoffatom der arboxyl gruppe übt einen elektronen anziehenden Effekt aus; dieses erleichtert die Abgabe eines Protons im Vergleich zur ydroxylgruppe eines Alkohols. Noch wichtiger ist, dass das arboxylation, die korrespondierende Base des Essigsäuremoleküls, mesomeriestabilsiert ist. Phenol (pk S = 9,95) hat keine arboxyl gruppe, ist aber trotzdem eine schwache Säure. Der Phenylring übt einen elektronenanziehenden Effekt aus. Wichtiger ist aber auch hier, dass das Phenolation, die korrespondierende Base des Phenolmoleküls, mesomeriestabilisiert ist. Wasser (pk S = pk B = 15,74) ist ein Ampholyt. Die Wassermoleküle können sowohl Protonen abgeben als auch aufnehmen. Ethanol (pk S = 15,9), ebenfalls ein Ampholyt, ist eine noch schwächere Säure als Wasser. Die Ethylgruppe übt einen elektronenschiebenden Effekt aus. Im Ethanolat ion, der korrespondierenden Base des Ethanolmoleküls, konzentriert sich die gesamte Ladung auf das Sauerstoffatom. Ethanolationen werden von Wassermolekülen vollständig protoniert. Umgekehrt geben Ethanolmoleküle praktisch keine Protonen an Wassermoleküle ab. Anilin (pk B = 9,4) ist eine schwache Base. Ein Anilinmolekül hat am Stickstoffatom ein freies Elektronenpaar und kann damit ein Proton binden. Anilin ist eine wesentlich schwächere Base als andere Amine, da das Anilinmolekül mesomeriestabilisiert ist. Das freie Elektronenpaar am Stickstoffatom ist in die Mesomerie des Phenylringes einbezogen und somit für die Bindung eines Protons schlecht verfügbar. Diethylamin (pk B = 3,0) ist eine wesentlich stärkere Base als Anilin, da es nicht an einen Phenylring gebunden ist, und folglich das freie Elektronenpaar am Stickstoffatom für die Bindung eines Protons zur Verfügung steht. Die beiden Ethylgruppen üben außerdem einen elektronenschiebenden Effekt aus, dadurch ist die Elektronendichte am Stickstoffatom erhöht. Zu den Versuchen V1 Die Löslichkeit von Phenol in Wasser bei 20 ist 84 g/l. Die Konzentration im ersten Reagenzglas beträgt ca. 2 g/(5 + 2) ml 300 g/l. Durch Verdünnen auf knapp das vierfache Volumen entsteht also eine klare Lösung. Ihr p-wert ist ca. 4,5. Durch Zugabe von Natronlauge bilden sich Phenolationen, die in Wasser gut löslich sind. Durch Zugabe von Essigsäure bilden sich aus den Phenolationen wieder schlechter lösliche Phenolmoleküle. V2 Diethylamin ist eine starke Base (pk B = 3,0). Die wässrige Lösung reagiert deutlich alkalisch; sie färbt Lackmuspapier blau. V3 Der Versuch zeigt, dass Anilin eine wesentlich schwächere Base als Diethylamin ist (vgl. V2). Anilin ist eine schwache Base (pk B = 9,4), die sich in Wasser schlecht löst (36 g/l bei 20 ). Anilin sollte folglich mit Wasser eine schwach alkalische Lösung bilden (berechnet: p = 9,1). Trotzdem färbt eine gesättigte Lösung von Anilin in deionisiertem Wasser rotes Lackmuspapier i. d. R. nicht Elemente hemie 2 5
6 blau; teilweise ist ein leicht violetter Schimmer erkennbar. Universal indikator papier zeigt p-werte zwischen ca. 7 und 8 an. Gründe für die Abweichung sind vermutlich die Sättigung des Wassers mit Kohlenstoffdioxid und eine teilweise xidation des Anilins durch Luftsauerstoff. V4 Bei Zugabe von Salzsäure bilden sich Aniliniumionen, die in Wasser gut löslich sind. Gibt man Natronlauge dazu, bildet sich wieder schlecht lösliches Anilin. 8.9 Exkurs ASS ein Jahrhundertarzneimittel A1 Durch Spaltung der glykosidischen Bindung von Salicin und xidation erhält man: Salicylaldehyd 2 b-d-glucose A2 Bekannte Nebenwirkungen von Acetylsalicylsäure sind z. B.: Sodbrennen, Übelkeit und Erbrechen, Durchfall, Blutungen, Eisenmangel, Magen-Darm-Geschwüre, allergische Reaktionen, Gichtanfälle (bei Gichtpatienten). Internet-Quelle (Stand Juli 2011): A3 Salicylsäure reagiert mit Methanol in Anwesenheit von Schwefelsäure zu Salicylsäuremethylester und Wasser. Man versetzt Methanol mit wenig konz. Schwefelsäure und gibt dazu Salicylsäure. Das Gemisch wird dann erwärmt. Reaktionsgleichung: 2 S Salicylsäure Methanol Salicylsäuremethylester Zu den Versuchen V1 B3 im Schülerbuch zeigt die Reaktionsgleichung. Acetylsalicylsäure ist in kaltem Wasser sehr schlecht löslich, sodass sie mit guter Ausbeute abfiltriert werden kann. V2 a) Gemessen wird mit einem p-meter. Mit Universalindikatorpapier können kaum unterschiedliche p-werte festgestellt werden. In jedem Fall liegt der p-wert des Produktes zwischen den Werten von Salicylsäure und ASS. Ermittelte Werte: p(ass) 3,1 p(salicylsäure) 2,4 p(produkt) 2,6 b) Die Farbreaktion der phenolischen -Gruppe mit Eisen(III)-chlorid-Lösung (siehe Kap. 8.7, V1) zeigt ebenfalls deutliche Unterschiede: Bei Salicylsäure färbt sich die Lösung dunkel violett, bei reiner Acetylsalicylsäure schwach bräunlich rot, bei dem hergestellten Produkt bräunlich violett. 6 Elemente hemie 2
7 V3 Die Untersuchung mit Iod-Kaliumiodid-Lösung zeigt, dass das Bindemittel Stärke ist (Blaufärbung). V4 Bei der ydrolyse von Acetylsalicylsäure entstehen Salicylsäure und Essigsäure. Salicylsäure gibt mit Eisen(III)-chlorid-Lösung (w = 0,1 %) eine charakteristische Farbreaktion: Eine intensive, blau- bis schwarzviolette Färbung tritt auf. Frisch bereitete ASS-Lösung gibt diese Farbreaktion nicht. Die Lösung wird lediglich hell bräunlichrot gefärbt. Das Entstehen freier Salicylsäure beim Erhitzen einer wässrigen ASS-Lösung kann durch kontinuierliche Probenentnahme verfolgt werden. Die Färbung der Proben bei Zugabe von jeweils wenigen Tropfen der Eisen(III)-chlorid- Lösung geht in Abstufungen von äunlichrot über aunlila bis Violett. Nach etwa vier Minuten intensiven Siedens wird fast der gleiche Farbton erreicht wie bei reiner Salicylsäure Impulse Aromaten im Alltag A1 a) Motive, die Jugendliche zu Rauchern machen: Gruppenzwang Einfluss gleichaltriger Jugendlicher: Ein Jugendlicher möchte dazugehören ; Rauchen fördert (in den Augen der Raucher) die Geselligkeit und die Kommunikation. Nachahmung: Die Eltern oder Erwachsenen der näheren Umgebung rauchen. Der Jugendliche nimmt das Angebot der Erwachsenen an und fühlt sich in den Kreis der Erwachsenen aufgenommen. Neugier: Einfach mal ausprobieren! Als Begründungen für das Rauchen geben viele Jugendliche an: Rauchen steckt an, Rauchen beruhigt, Zigarettenpausen schaffen Wohlbefinden, Rauchen schmeckt. b) Mögliche Maßnahmen: Rauchverbot zum Schutz Jugendlicher vor der Verführung zum Rauchen Rauchverbote in Schulen, Diskotheken und Gaststätten Verkaufseinschränkungen Ächten des Rauchens durch Gleichaltrige Belohnung des Entwöhnens, Perspektivwechsel (inwendung zu intensiven sportlichen Betätigungen oder neuen beruflichen Anforderungen) A2 Energy-Drinks enthalten wie auch andere Limonaden Wasser, Zucker oder Süßstoffe, Farbstoffe und Aromastoffe. Besondere Zusatzstoffe der Energy-Drinks sind offein, Taurin, Inosit und Glucuronolacton. offein hat eine anregende Wirkung. Eine Überdosis kann Nervosität, Schwindel, Kopfschmerzen, Schlaflosigkeit, Magen-Darm-Beschwerden, Schweiß ausbrüche und erzrasen verursachen. Außerdem kann eine regelmäßige Zufuhr von offein zu offeinismus ( Kaffee-Sucht ) führen. Bei Taurin, Inosit und Glucuronolacton sind zurzeit weder positive noch schädliche Wirkungen erwiesen. Zucker in zu großer Menge kann Übergewicht, Karies und Diabetes verursachen. Internet-Quellen (Stand Juli 2011): von_energy_shots.pdf Elemente hemie 2 7
8 8.11 Durchblick Zusammenfassung und Übung A1 a) Die erste Grenzformel des Pyrrols weist keine Ladungstrennung auf, sie ist daher energetisch günstiger als die anderen Grenzformeln und trägt mehr zur Mesomeriestabilisierung bei. b) Pyrrol weist nur eine sehr geringe Basizität auf (K B 2, ), da das freie Elektronenpaar am Stickstoffatom delakolisiert ist. Es ist mit in die Konjugation eingebunden, wodurch das Elektronenpaar kaum für die Bindung eines Protons zur Verfügung steht, das Stickstoffatom bzw. Pyrrolmolekül ist nur schwer zu protonieren. A2 1. erstellung von Toluol: + l Katalysator + l 2. xidation von Toluol: Mn 4 / 2 S 4 inweise: Der erste Reaktionsschritt ist eine elektrophile Substitution. Man bezeichnet ihn als Friedel-rafts-Alkylierung; als Katalysator ist z. B. Aluminiumchlorid geeignet. Der zweite Reaktionsschritt ist in Kap. 8.7 beschrieben (Lesetext und V2). Er kann in folgende kleinere Schritte unterteilt werden: +[] +[] 2 +[] A3 In alkalischer Lösung reagiert Phenol zum Phenolat: Das negativ geladene Sauerstoffatom übt einen +M-Effekt aus. Ein freies Elektronenpaar des Sauerstoffatoms tritt in Wechselwirkung mit dem delokalisierten Ringelektronensystem des Benzolrings, wodurch die Elektronendichte im Ring erhöht wird. Dies erleichtert einen elektrophilen Angriff, sodass die elektrophile Substitution auch ohne Katalysator ablaufen kann. Vergleicht man die Grenzformeln des Phenolations, so fällt auf, dass in den Ringpositionen 2, 6 (ortho-stellungen) und 4 (para-stellung) eine negative Ladung auftritt. Ein elektrophiles Teilchen wird bevorzugt an diesen Postionen angreifen: 8 Elemente hemie 2
9 Aromaten. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
Lösungen zu den Durchblick-Seiten 9.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 1. Aromaten sind ebene, cyclische Moleküle. 2. Das Ringmolekül weist ein durchgehendes System konjugierter
1.4 Die elektrophile aromatische Substitution
 1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
1.4 Die elektrophile aromatische Substitution Versuch: Bromierung von Toluol mit Eisen V In einem RG werden 2ml Toluol mit 0,5 g Eisenspänen gemischt. Hierzu werden 5 Tropfen Brom gegeben B Es bildet sich
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang
 Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Lösung :Aromatische Kohlenwasserstoffe Kursleiter Klaus Bentz/ Kollegiat Andreas Maier Abiturjahrgang 2004 1985/IV/1 Zunächst wird Methan bei Licht bromiert: 4 2 3 Gemäß der FriedelraftSynthese unter Verwendung
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Darstellung von Phenolphthalein und Fluorescein
 Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Philipps-Universität Marburg 04. Juli 2007 Fachbereich 15: Chemie rganisch-chemisches Grundpraktikum für Lehramtskandidaten Praktikumsleiter: Dr. Philipp Reiß SS 2007 Mario Gerwig Versuch: Darstellung
Energie. 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital
 sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
sp 2 -ybridisierung sp 2 -ybridisierung sp 2 -ybridisierung 1 x 2p Orbital Energie 3 x sp Orbitale 3 x sp-orbital 1 x 2p-Orbital z y x planare Anordnung in sp 2 -hybridisierten -Atomen: Alle 4 (3 s- und
6. Rechenübung Organik (27.01./ )
 1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
1 6. Rechenübung Organik (27.01./03.02.2009) Literatur: 2.) Mortimer : hemie Basiswissen hemie ISBN 3 13 484308 0 Paula Y. Bruice : Organische hemie ISBN 978 3 8273 7190 4 Gesättigtes Atom Atom, nur mit
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Chemie Stufe 13 / Aromaten / Phenol Folie 01. Das Phenol-Molekül. δ δ+ sp 3. sp 2
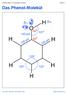 Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
Chemie Stufe 13 / Aromaten / Phenol Folie 01 Das Phenol-Molekül δ δ+ sp 3 sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 02 Das Phenolat-Ion sp 3 H + sp 2 Chemie Stufe 13 / Aromaten / Phenol Folie 03 Grenzstrukturen
 hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
hemie-protokoll 11.11.02, Seite 1 von 5 Lukman Iwan, 12.11.02 Stundenprotokoll vom Montag, 11. ovember 2002 Es fehlen: Janine und Jeannette Zettel 1&2: Aromatische eterocyclen http://www.oci.unizh.ch/edu/lectures/material/a_bii/kap6/kap6.html
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) OH H + - H 2 O. (aus H 3 PO 4 H 2 SO 4 ) - H + Stichpunkte zum E1-Mechanismus:
 Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Eliminierung nach E1 (Konkurrenzreaktion zu S N 1) + (aus 3 P 4 2 S 4 ) - 2 - + Stichpunkte zum E1-Mechanismus: 2-Schritt-eaktion über ein Carbenium-Ion (1. Schritt ist Abspaltung der Abgangsgruppe (im
Chemie für Biologen, a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride?
 Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
Chemie für Biologen, 2017 Übung 9 Organische Verbindungen (Thema 10.1 10.3) Aufgabe 1: a) Was ist Hybridisierung? Und aus welchen Orbitalen bestehen jeweils sp-, sp 2 - und sp 3 - Hybride? Hybridisierung,
2. Elektroneneffekte in den organischen Molekülen
 2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
2. Elektroneneffekte in den organischen Molekülen Induktive und mesomere Effekte Die Ladungsverteilung in einer Kohlenwasserstoffkette wird durch Substituenten (Halogen, OH, NH 2 usw.) beeinflusst. Man
Bromierung von Cycloalkenen
 hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
hemie Q1 / 4. Reaktionswege der organischen hemie / 4.2 Alkene und elektrophile Addition 1/ omierung von ycloalkenen Zufällig kommt ein 2-Molekül in die Nähe der elektronenreichen Doppelbindung. Ulrich
Übungen zur VL Chemie für Biologen und Humanbiologen
 Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Übungen zur VL Chemie für Biologen und Humanbiologen 28.01.2011 1. Zeichnen Sie die Valenzstrichformeln folgender Verbindungen und benutzen Sie im Falle unbestimmter Alkylreste ein R: a) ein tertiärer
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte
 Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
Elektrophile Reaktionsmechanismen Erkennungsmerkmale und Reaktionsschritte H. Wünsch 2012 Signale für elektrophile Reak;onen Signale am organischen Molekül: π- Elektronen (Mehrfachbindungen), π- Elektronensysteme
im Molekül eine Dreifachbindung (eine σ-bindung,
 1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
1 14.03.2006 0.1 Grundwissen Alkane Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen, sondern nur Einfachbindungen (σ-bindungen) zwischen den Kohlenstoffatomen im Molekül aufweisen. Die allgemeine
Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )
![Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 ) Beobachtung [Jeweils] exotherme Reaktion unter Gasentwicklung (H 2 )](/thumbs/74/69784240.jpg) 1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
1 25.01.2006 0.1 Alkohole Alkohole enthalten neben den Elementen C und H auch O. Sie leiten sich aber dennoch von den Kohlenwasserstoffen ab. Beispiel: C 2 H 6 O als Summenformel Strukturformel: C C O
Herstellung und Oxidation von 2,4,6-Tri-tert-butylphenol
 2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
2.9B erstellung und xidation von 2,4,6-Tri-tert-butylphenol Chemikalien 4,7 g (50 mmol) Phenol R: 24, 25, 45 S: 28.2, 45 17,6 g (200 mmol) tertylmethylether R: 11, 36, 37, 38 Kp = 55 C S: 9, 16, 26, 29,
Alkohole Brüder des Wassers
 6. Alkohole Brüder des Wassers 6.1 Alkohole Brüder des Wassers entsteht aus Zucker durch die alkoholische Gärung. Dabei werden Glucosemoleküle mit ilfe von efezellen in und Kohlendioxid umgewandelt. NS29
6. Alkohole Brüder des Wassers 6.1 Alkohole Brüder des Wassers entsteht aus Zucker durch die alkoholische Gärung. Dabei werden Glucosemoleküle mit ilfe von efezellen in und Kohlendioxid umgewandelt. NS29
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Bundesrealgymnasium Imst. Chemie Klasse 8. Aromaten und deren Reaktionen
 Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
Bundesrealgymnasium Imst Chemie 2010-11 und deren Reaktionen Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter
(Anmerkung: Es sind weitere möglich. Spektren zeigen Diradikal.)
 eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
eispielaufgaben IChO 2. Runde 2017 Aromaten, Lösungen Aromaten eispiel 1: a) b) (Zeichnungen hier und unten teilweise ohne Wasserstoff-Atome) c) Das Anion ist planar und hat ein cyclisch konjugiertes π-elektronensystem
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Vorlesung "Organische Chemie 1" Übungsblatt 4
 Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Vorlesung "Organische hemie 1" Übungsblatt 4 Ü1: Beim Steamcracken wird eine komplexe Mischung von Kohlenwasserstoffen durch kurzzeitiges Erhitzen in Gegenwart von Wasserdampf in eine Mischung von leichter
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1. Grundwissen 10.Klasse NTG 2 Grundwissen 10.Klasse NTG 2
 Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Grundwissen 10.Klasse NTG 1 Grundwissen 10.Klasse NTG 1 Homologe Reihe: Reihe von Kohlenwasserstoffen, bei der jedes Molekül eine CH 2 -Gruppe mehr enthält als das vorhergehende. Gesättigte Kohlenwasserstoffe
Organische Experimentalchemie
 Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Dr. Franziska Thomas (fthomas@gwdg.de) Georg-August-Universität Göttingen SoSe 2018 Veranstaltungsnummer: 15 133 30200 Organische Experimentalchemie Für Studierende der Humanmedizin, Zahnmedizin und Biologie
Schulversuchspraktikum. Nadja Felker. Sommersemester Klassenstufen 11 & 12. Aromaten (SSS, KKK)
 Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 11 & 12 Aromaten (SSS, KKK) Auf einen Blick: Das Protokoll enthält für die Klassen 11 und 12 einen Lehrerversuch und einen Schülerversuch
Schulversuchspraktikum Nadja Felker Sommersemester 2015 Klassenstufen 11 & 12 Aromaten (SSS, KKK) Auf einen Blick: Das Protokoll enthält für die Klassen 11 und 12 einen Lehrerversuch und einen Schülerversuch
Ionisierungsenergie und Elektronenaffinität. Bindigkeit Valenzstrichformel Molekülgeometrie
 Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Tendenzen im Periodensystem Ionisierungsenergie und Elektronenaffinität Atombindung (Elektronenpaarbindung) Bindigkeit Valenzstrichformel Molekülgeometrie Räumlicher Bau einfacher Moleküle Polare Atombindung
Übungen zur VL Chemie für Biologen und Humanbiologen Lösung Übung 9
 Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Übungen zur VL Chemie für Biologen und Humanbiologen 13.01.2012 Lösung Übung 9 1. Geben Sie jeweils zwei Beispiele für Konformations- und Konstitutionsisomere, d.h. insgesamt vier Paare von Molekülen.
Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen.
 1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
1 Lösung 5 AC/OC I, HS 2017 Name Assistent/in Verwenden Sie keinen Bleistift für die Abgabe und heften Sie einzelne Blätter zusammen. Falls Sie Fragen zur Vorlesung/Übung/generellen Konzepten haben schreiben
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09
 Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 12.11.2008 Gruppe 4: Aromaten Versuch: omierung von Toluol
Organisch-chemisches Praktikum für Studierende des Lehramts WS 08/09 Praktikumsleitung: Dr. Reiß Assistent: Beate Abé Name: Sarah enkel Datum: 12.11.2008 Gruppe 4: Aromaten Versuch: omierung von Toluol
H δ+ H H H H. Addition von HBr an Ethen. Zufällig kommt ein HBr-Molekül in die Nähe der elektronenreichen Doppelbindung. Schritt 1
 hemie Q1 / 4. Reaktionswege der Organik / 4.2 Alkene und elektrophile Addition Addition von an Ethen Schritt 1 1/ Zufällig kommt ein -Molekül in die Nähe der elektronenreichen δ- δ+ Ulrich elmich 2015
hemie Q1 / 4. Reaktionswege der Organik / 4.2 Alkene und elektrophile Addition Addition von an Ethen Schritt 1 1/ Zufällig kommt ein -Molekül in die Nähe der elektronenreichen δ- δ+ Ulrich elmich 2015
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
8 Organische Verbindungen und ihre Reaktionswege
 Lösungen zu den Durchblick-Seiten 8 rganische Verbindungen und ihre Reaktionswege 8.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 a) 2 b) Es handelt sich um eine ydrierung. Die ydrierung gehört
Lösungen zu den Durchblick-Seiten 8 rganische Verbindungen und ihre Reaktionswege 8.15 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 a) 2 b) Es handelt sich um eine ydrierung. Die ydrierung gehört
Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 Carbonylgruppen und eine C=C Doppelbindung.
 rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
rganische hemie I Lösungen zur Übung 23 Aufgabe 1 Funktionelle Gruppen: Progesteron hat 2 arbonylgruppen und eine = Doppelbindung. 3 () 3 3 Progesteron Das Molekül hat 6 hiralitätszentren (mit * bezeichnet).
Endersch, Jonas 26./ Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Endersch, Jonas 26./27.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.4a: Herstellung von 2,5 Dibrombenzochinon Reaktionsgleichung: Einleitung und Theorie: In diesem
Herstellung des Benzoldiazoniumchlorids aus Anilin, Natriumnitrit und Salzsäure. Benzoldiazonium-Ion
 Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Vorlesung 34 Arendiazoniumsalze (Vollhardt, 3. Aufl., S. 1113-1117, 4. Aufl. 1191-1195; art, S. 412-418; Buddrus, S. 621-627) werden in gleicher Weise hergestellt wie die aliphatischen Diazonium-Salze.
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Versuch: Bromierung von Phenol
 Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
Philipps-Universität Marburg 01.12.2007 Organisches Grundpraktikum (LA) Katrin ohmann Assistent: Beate Abé Leitung: Dr. Ph. Reiß WS 2007/08 Gruppe 4, Aromaten Versuch: omierung von Phenol Zeitbedarf: Vorbereitung:
σ-bindung beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
 VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
VIII. Alkine Die C/C-Dreifachbindung als funktionelle Gruppe erste π-bindung σ-bindung zweite π-bindung orthogonal zur ersten beide Kohlenstoffatome sp-hybridisiert => Bindungswinkel 180 eine lineare Struktur
12 Naturstoffe. 1 Elemente Chemie Oberstufe NRW Ernst Klett Verlag GmbH, Stuttgart Lösungen zu den Durchblick-Seiten
 Lösungen zu den Durchblick-Seiten 12.27 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 a) Fette dienen im Körper als Speicherstoff ( Brennstoff ), Wärmeisolator, Stoßdämpfer, Baustoff und Stoffwechselbaustein.
Lösungen zu den Durchblick-Seiten 12.27 Durchblick Zusammenfassung und Übung Zu den Aufgaben A1 a) Fette dienen im Körper als Speicherstoff ( Brennstoff ), Wärmeisolator, Stoßdämpfer, Baustoff und Stoffwechselbaustein.
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Aspirin und Paracetamol im chemischen Vergleich
 Aspirin und Paracetamol im chemischen Vergleich Achtung Aspirin und Paracetamol sind geschützte Namen und dürfen nicht ohne weiteres verwendet werden. Strukturformeln Aus den Strukturformeln leiten wir
Aspirin und Paracetamol im chemischen Vergleich Achtung Aspirin und Paracetamol sind geschützte Namen und dürfen nicht ohne weiteres verwendet werden. Strukturformeln Aus den Strukturformeln leiten wir
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Wiederholung der letzten Vorlesungsstunde: Chemische Bindungen, starke, schwache Bindungen, Elektronenpaarbindung, bindende und freie Elektronenpaare, Oktettregel, Edelgaskonfiguration, Lewis-Formeln,
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
KW Alkene. Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1
 KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
KW Alkene Nomenklatur. Darstellung. Reaktionen. Elektrophile Additionen. Prof. Ivo C. Ivanov 1 Alkene Alkene sind Kohlenwasserstoffe mit einer C=C-Bindung. Sie enthalten zwei -Atome weniger als die entsprechenden
82/III/1 1.1.) 0,147 nm. 0,132 nm C N H H C C N N. Peptidbindung
 Lösungen zum Thema Aminosäuren und Proteine der LK-hemie-Abiturjahrgängen von 1982 1998 Kursleiter Klaus Bentz/ Kollegiatin Maria Dickert Abiturjahrgang 2005 82/III/1 1.1.) 0,132 nm 0,147 nm R3 * n * Peptidbindung
Lösungen zum Thema Aminosäuren und Proteine der LK-hemie-Abiturjahrgängen von 1982 1998 Kursleiter Klaus Bentz/ Kollegiatin Maria Dickert Abiturjahrgang 2005 82/III/1 1.1.) 0,132 nm 0,147 nm R3 * n * Peptidbindung
SCHRIFTLICHE ABITURPRÜFUNG 2006 CHEMIE (Grundkursniveau)
 CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
CHEMIE (Grundkursniveau) Einlesezeit: Bearbeitungszeit: 30 Minuten 210 Minuten Der Prüfling wählt je ein Thema aus den Gebieten G (Grundlagen) und V (Vertiefung) zur Bearbeitung aus. Die zwei zur Bewertung
+ HBr. Gruppe 2 Pflichtversuch. Fotochemische Halogenierung des Toluols. Reaktion: h ν. Zeitbedarf: Versuchsdurchführung: Nachbereitung
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: Herr Dr. Reiß Datum: 0.05.09 SS 09 Gruppe Pflichtversuch Fotochemische Halogenierung
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
Inhaltsverzeichnis VII. Vorwort... V
 VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
VII Vorwort... V 1 Einleitung... 1 1.1 Der Begriff der Organischen Chemie... 1 1.2 Vielfalt organischer Verbindungen... 1 1.3 Ordnung in der Vielfalt... 2 2 Grundlegendes... 3 2.1 Kohlenstoff hat vier
Beispiel für eine Anionenaustausch-Matrix. Als funktionelle Gruppe dient hier eine Diethylaminoethylgruppe.
 Aufgabe 1 Essigsäure exansäure Der Laugenverbrauch ist im Falle der Essigsäure höher. Essigsäure verteilt sich besser in die Wasserphase, exansäure aufgrund der höheren Anzahl unpolarer Alkylreste besser
Aufgabe 1 Essigsäure exansäure Der Laugenverbrauch ist im Falle der Essigsäure höher. Essigsäure verteilt sich besser in die Wasserphase, exansäure aufgrund der höheren Anzahl unpolarer Alkylreste besser
Homoaromatizität. Charlotte Over Lara Schultes
 Homoaromatizität Charlotte Over Lara Schultes 02.12.2010 Übersicht 1. Einführung 2. Aromatizität 3. Homoaromatizität 4. Beispiele 4.1 Kationische Homoaromaten 4.2 Neutrale Homoaromaten 4.3 Anionische Homoaromaten
Homoaromatizität Charlotte Over Lara Schultes 02.12.2010 Übersicht 1. Einführung 2. Aromatizität 3. Homoaromatizität 4. Beispiele 4.1 Kationische Homoaromaten 4.2 Neutrale Homoaromaten 4.3 Anionische Homoaromaten
Doppelbindung. einfach besetztes Orbital. Resonanzstruktur II so auch nicht! (Seitensprungsituation) C C C
 RGANISE EMIE 1 Teil 2 Einfache Symbolik zur Beschreibung solcher ybridbindungen: Verwendung der schon bekannten Lewis-Punkt/Strich-Symbolik Einfachbindung l Doppelbindung n-elektronen (nicht bindendes
RGANISE EMIE 1 Teil 2 Einfache Symbolik zur Beschreibung solcher ybridbindungen: Verwendung der schon bekannten Lewis-Punkt/Strich-Symbolik Einfachbindung l Doppelbindung n-elektronen (nicht bindendes
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
Vorgehen bei der qualitativen Analyse. Nachweisreaktion. Nachweisreaktionen. molekular gebauter Stoffe
 Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
Vorgehen bei der qualitativen Analyse 1. Vorprobe liefert Hinweise auf die mögliche Zusammensetzung der Probe ; Bsp. Flammenfärbung 2. Blindprobe zeigt aus Aussehen der Nachweisreagenzien; Vergleichsprobe
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 11: Alkine / Polyene / Aromaten)
 hemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische hemie Universität Duisburg Essen (Teil 11: Alkine / Polyene / Aromaten) Bindungen mit sp ybridobitalen Bindungen mit sp ybridorbitalen
hemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische hemie Universität Duisburg Essen (Teil 11: Alkine / Polyene / Aromaten) Bindungen mit sp ybridobitalen Bindungen mit sp ybridorbitalen
Aufgabe S. 2/a (2 Punkte) Wodurch können Sie Cyclohexan von Cyclohexen unterscheiden?
 16-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
16-1 2 Zur Punktevergabe bei multiple choice-aufgaben: Es gibt meist 5 Antwortmöglichkeiten, und 2 Punkte können pro Aufgabe erreicht werden. Pro falscher Antwort (Kreuz zu viel, aber auch fehlend) wird
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser
 Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Phillipps- Universität Marburg Isabelle Kuhn Organisch Chemisches Grundpraktikum Lehramt WS 2006/07 Praktikumsleiter: Herr Reiß Gruppe 03: Umsetzung von Hexan und Hexen mit Bromwasser Reaktion: Chemikalien:
Grundwissen Chemie 10. Klasse NTG
 Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
Grundwissen Chemie 10. Klasse NTG Homologe Reihe der Alkane Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan 10.1 C NTG Allg. Summenformel Alkane C n H 2n+2 (gesättigte Kohlenwasserstoffe,
2. Übungsblatt. Organische Chemie für Studierende mit Nebenfach Chemie
 Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Allgemeine und Anorganische Chemie 2. Übungsblatt Organische Chemie für Studierende mit Nebenfach Chemie 1. Aufgabe: Ordnen Sie folgende Radikale nach steigender Stabilität: A B C D E F Lösung: A < C
Organische Chemie 10C1. Funktionelle Gruppen 10C2. Homologe Reihe der Alkane 10C3. Nomenklatur der Alkane (gesättigte Kohlenwasserstoffe) 10C4
 Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
Organische Chemie 10C1 Chemie der Kohlenstoffverbindungen (C und v.a. H, N, O, S) C-Atome immer vierbindig Funktionelle Gruppen 10C2 Alkan: nur Einfachbindungen Alken: mindestens eine Doppelbindung Alkin:
7. Studieneinheit. Siebte Studieneinheit
 86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
Grundwissenkarten Hans-Carossa- Gymnasium
 Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
Grundwissenkarten Hans-Carossa- Gymnasium 10. Klasse Chemie SG Es sind insgesamt 20 Karten für die 10. Klasse erarbeitet. Karten ausschneiden : Es ist auf der linken Blattseite die Vorderseite mit Frage/Aufgabe,
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Molekülstruktur und Stoffeigenschaften
 10.Klasse Chemie Grundwissen OlympiaMorataGymnasium Schweinfurt Molekülstruktur und Stoffeigenschaften Räumlicher Bau von Molekülen Möglicher Molekülbau: tetraedrisch; trigonalpyrimidal; gewinkelt; linear;
10.Klasse Chemie Grundwissen OlympiaMorataGymnasium Schweinfurt Molekülstruktur und Stoffeigenschaften Räumlicher Bau von Molekülen Möglicher Molekülbau: tetraedrisch; trigonalpyrimidal; gewinkelt; linear;
Carbonsäuren (Vollhardt, 3. Aufl., S. 893 ff, 4. Aufl., S. 967 ff; Hart, S. 345 ff; Buddrus, S. 501 ff)
 Vorlesung 39 arbonsäuren (Vollhardt, 3 Aufl, S 893 ff, 4 Aufl, S 967 ff; art, S 345 ff; Buddrus, S 501 ff) Die funktionelle Gruppe der arbonsäuren (= Fettsäuren) ist die arboxyl- (bzw arboxy-) Gruppe In
Vorlesung 39 arbonsäuren (Vollhardt, 3 Aufl, S 893 ff, 4 Aufl, S 967 ff; art, S 345 ff; Buddrus, S 501 ff) Die funktionelle Gruppe der arbonsäuren (= Fettsäuren) ist die arboxyl- (bzw arboxy-) Gruppe In
Organik-Beispiel. Inhaltsverzeichnis
 Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Inhaltsverzeichnis I. Säure-Basen-Gleichungen... 2 a) Nach Arrhenius:... 2 b) Nach Broensted:... 2 c) Nach Lewis:... 2 II. H 2 O + HCl?... 4 a) Was ist in der Reaktion passiert? Welche Produkte entstehen?...
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon
 Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Lösungen 3. Übungsblatt SS 2002
 Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Lösungen 3. Übungsblatt SS 2002 1. Aufgabe: omenklatur und Stereochemie a) (E)-7-(S)-om-4-nonen-2-on b) H 3- Methoxy-4-methyl-benzaldehyd 2. Aufgabe: Alkene a) A B C D E Stabilitätsbeeinflussende Faktoren
Seminarplan zum. Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie. (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE
 Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Seminarplan zum Chemischen Praktikum für Biologen ohne Prüfungsfach Chemie (Lehramt) TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE TEIL II: ORGANISCHE CHEMIE 1 TEIL I: ALLGEMEINE UND ANORGANISCHE CHEMIE Einführung
Organische Chemie I. OC I Lehramt F. H. Schacher 1
 Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß)
 Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß) Vorbereitung: Für die folgenden Versuche wird eine Eiweißlösung aus dem Eiklar eines ühnereis hergestellt, indem man dieses in 60 ml dest.
Auswertung der Versuche mit Aminosäuren und Proteinen (Eiweiß) Vorbereitung: Für die folgenden Versuche wird eine Eiweißlösung aus dem Eiklar eines ühnereis hergestellt, indem man dieses in 60 ml dest.
π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!)
 . Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
. Alkene (lefine) Funktionelle Gruppe: C=C-Doppelbindung π-bindung: 264 kj/mol (s c hw äc he r als die σ-bindung!) => C=C-Doppelbindung: 612 kj/mol sp 2 -hybridisierung σ-bindung: 348 kj/mol Wieder eine
Orbital. Atombindung, Bindung. Elektronegativität. Dipol
 GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
GW Chemie 10. SG GA rbital aum, in dem sich Elektronen mit 99%iger Wahrscheinlichkeit aufhalten; in einem rbital halten sich maximal 2 Elektronen auf; man unterscheidet Atom- und Molekülorbitale Atombindung,
Schulversuchspraktikum. Name Nicolai ter Horst. Semester SS Klassenstufen 11 & 12. Aromaten
 Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 11 & 12 Aromaten 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll geht es um das Thema
Schulversuchspraktikum Name Nicolai ter Horst Semester SS 2013 Klassenstufen 11 & 12 Aromaten 1 Beschreibung des Themas und zugehörige Lernziele 1 Auf einen Blick: In diesem Protokoll geht es um das Thema
Gruppe 3 Pflichtversuch. Umsetzung von Cyclohexan und Cyclohexen mit Bromwasser. Menge R-Sätze S-Sätze Gefahrensymbole. 300 ml /38
 Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 3 Pflichtversuch Umsetzung von Cyclohexan
Philipps- Universität Marburg FB 15 Chemie Organisch-Chemisches Grundpraktikum für das Lehramt Christian Lego Leitung: err Dr. Reiß Datum: 0.05.09 SS 09 Gruppe 3 Pflichtversuch Umsetzung von Cyclohexan
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Grundwissen Chemie Jahrgangsstufe 9, naturwissenschaftlicher Zweig
 Grundwissen Chemie Jahrgangsstufe 9, Qualitative Analysemethoden nachzuweisendes Molekül / Ion Nachweisverfahren Beobachtung Halogenide Fällung mit Silbernitrat weißer bis gelber Niederschlag Metallkationen
Grundwissen Chemie Jahrgangsstufe 9, Qualitative Analysemethoden nachzuweisendes Molekül / Ion Nachweisverfahren Beobachtung Halogenide Fällung mit Silbernitrat weißer bis gelber Niederschlag Metallkationen
3-01. Triphenylmethan
 Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Triphenylmethan 3-01 Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden. Die H-Atome
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redoxreaktionen Oxidation/Reduktion
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Aromatische Kohlenwasserstoffe
 Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Organische Chemie, Reaktionsmechanismen
 , Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
, Reaktionen, Teil 3-1 - hemieskript Dr. R. Steiger rganische hemie, Reaktionsmechanismen Das Lernziel dieser Unterrichtseinheit beinhaltet folgende Punkte: Wie können funktionelle Gruppen ineinander überführt
ORGANISCHE CHEMIE. Katherina Standhartinger. für Ahnungslose Eine Einstiegshilfe für Studierende. von Katherina Standhartinger, Memmingen
 Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
Katherina Standhartinger ORGANISCHE CHEMIE für Ahnungslose Eine Einstiegshilfe für Studierende von Katherina Standhartinger, Memmingen Mit 150 Abbildungen und 35 Tabellen S. Hirzel Verlag Stuttgart r VII
ALDEHYDE & KETONE. Referat über die Carbonylverbindungen: Aldehyde und Ketone Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium
 ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
ALDEHYDE & KETONE Referat über die Carbonylverbindungen: und Patrick König und Robert Bozsak LK C2 Sigmund-Schuckert-Gymnasium 1 1 GLIEDERUNG 1. Allgemeiner Vergleich der & Struktur Nomenklatur / Beispiele
