Vancomycin-resistente Enterokokken
|
|
|
- Jan Lenz
- vor 7 Jahren
- Abrufe
Transkript
1 Vancomycin-resistente Enterokokken Guido Werner, Ingo Klare, Wernigerode, Johannes Hübner, Winfried V. Kern, Freiburg, und Wolfgang Witte, Wernigerode Enterococcus faecalis und E. faecium sind wichtige Erreger von Krankenhaus-assoziierten Infektionen. Isolate beider Spezies zusammen repräsentieren weltweit den dritt- bis vierthäufigsten nosokomialen Erreger. Erworbene Antibiotika-Resistenzen, beispielsweise gegen Penicillin/Ampicillin, Aminoglykoside (Hochresistenz) und Glykopeptide, schränken das therapeutische Spektrum erheblich ein und treten zunehmend häufiger auf. Vor allem bei E. faecium wird auch Multiresistenz beobachtet. Erworbene Resistenz gegen Glykopeptide wird durch verschiedene Mechanismen vermittelt, vor allem der VanAaber auch der VanB-Resistenztyp sind in Mitteleuropa und Deutschland nahezu ausschließlich zu finden. Das Reservoir der übertragbaren vana-vermittelten Resistenz inner- und außerhalb der Humanmedizin liegt in E. faecium. Die Zunahme Vancomycin-resistenter Enterokokken (VRE) in vielen europäischen Ländern inklusive Deutschland ist somit einzig auf ein gehäuftes Auftreten von Vancomycin-resistenten E. faecium (VREF) zurückzuführen. Vancomycin- und/oder Ampicillin-resistente E. faecalis sind nach wie vor selten. E. faecium, die sich basierend auf DNS-Sequenz-basierter Typisierung (MLST) zu dem klonalen Komplex CC17 zuordnen lassen, zeigen eine erhöhte Ausbreitungsfähigkeit im nosokomialen Bereich. Diese Isolate sind meist auch Ampicillin-resistent, zum Teil Fluorchinolon-hochresistent und besitzen häufig spezifische Virulenzmarker wie die Gene für das Oberflächenprotein Esp und/oder eine vermeintliche Hyaluronidase. Im Gegensatz dazu ist der Besitz der Determinanten für Vancomycin-Resistenz keine Voraussetzung für eine erfolgreiche Ausbreitung dieser Isolate im Krankenhausmilieu. Anders als zu Beginn der 1990er Jahre sind epidemische, (noch) Vancomycin-sensible Stämme des CC17 mittlerweile in vielen deutschen und europäischen Kliniken verbreitet. Über horizontalen Gentransfer können sie die Determinanten für Glykopeptid-Resistenz erwerben und werden dann im klinischen Alltag erst auffällig. Die Ursachen eines vermehrten Auftretens von VREF in deutschen Kliniken seit 2003 sind multifaktoriell, im Detail aber nicht bekannt. Ergebnisse von Untersuchungen an einer repräsentativen Sammlung an VREF von 2004 bis 2006 ergaben, dass zwei Szenarien für eine erhöhte Ausbreitung von VREF in deutschen Krankenhäusern verantwortlich sind: (a) klonale Ausbreitung Hospital-adaptierter und bereits Vancomycin-resistenter Stämme in verschiedenen Krankenhäusern unterschiedlicher Bundesländer und (b) horizontaler Gentransfer der vana-gencluster in verschiedenen klonalen Typen in oligo- und polyklonalen Ausbrüchen. VRE-Infektionen gehen oft aus einer Besiedlung des Intestinaltrakts mit diesen Erregern (Hospital-adaptierte VREF) während eines Krankenhausaufenthalts hervor. Insofern ist ein VRE-Screening ein effizientes Mittel zur Infektionsprävention allgemein und Infektionskontrolle in speziellen Ausbruchsituationen. Neue sensitive, genotypische Testverfahren scheinen hierbei klassischen phänotypischen Tests überlegen zu sein, sind aber auch mit Nachteilen behaftet. Therapeutische Alternativen zur Behandlung von VRE-Infektionen sind beschränkt und beinhalten meist die Gabe von Reserveantibiotika (Quinupristin/Dalfopristin, Linezolid, Tigecyclin, Daptomycin); Resistenzen gegen diese Antibiotika in Enterokokken sind aber bereits beschrieben. Schlüsselwörter: Enterococcus faecium/faecalis, vana, vanb, CC17 Chemother J 2008;17: Die Gattung Enterococcus Enterokokken sind grampositive, fakultativ anaerobe Kokkenbakterien, die den Intestinaltrakt des Menschen, verschiedener Säugetiere, Vögel, Reptilien, Fische und Insekten besiedeln (Übersicht in [1]). Sie wurden nahezu 100 Jahre lang phylogenetisch zum Genus Streptococcus gezählt, da unter anderem alle Isolate ein Lancefield-Gruppe-D-Streptokokken-spezifisches Antigen auf ihrer Oberfläche ausprägen (Lipoteichonsäure; [2]). Der Terminus enterococcal group wurde für die Enterokokken Ende der 1930er Jahre anhand von Charakteristika definiert, die auch heute noch Priv.-Doz. Dr. Guido Werner, FG 13 Nosokomiale Infektionen, Abt. 1, Robert Koch-Institut, Bereich Wernigerode, Burgstr. 37, Wernigerode, wernerg@rki.de Dr. Ingo Klare, Prof. Dr. Wolfgang Witte, Robert Koch-Institut Wernigerode, Burgstr. 37, Wernigerode Prof. Dr. Johannes Hübner, Prof. Dr. Winfried V. Kern, Medizinische Universitätsklinik, Hugstetter Straße 55, Freiburg Eingang des Manuskripts: 21. Dezember 2007 Eingang des überarbeiteten Manuskripts: 13. März 2008 Chemotherapie Journal 17. Jahrgang Heft
2 ihre Gültigkeit zur Charakterisierung von Enterokokken beibehalten haben [3]: Wachstum bei 10 und 45 C Wachstum bei hohem ph-wert (hier: ph-wert = 9,6) Wachstum in 6,5%iger NaCl-Lösung Überleben einer thermischen Behandlung von 30 Minuten bei 60 C Erst die Anwendung von molekularen Methoden der Taxonomie Mitte der 1980er Jahre führte zu einer Abgrenzung der Enterokokken von den Streptokokken und einer Zusammenfassung in einer eigenständigen Gattung [4, 5]. Derzeit sind über 35 verschiedene Enterokokken-Spezies bekannt, wobei in den letzten Jahren einige neue hinzugefügt wurden [6 9]. Diese neueren Spezies besitzen allerdings keine humanmedizinische Bedeutung. Einige Jahrzehnte lang existierende Spezieszuweisungen erwiesen sich mit moderneren Methoden der Charakterisierung als nicht mehr haltbar und führten, beispielsweise für die beiden natürlich Low-Level-Vancomycin-resistenten Spezies E. casseliflavus und E. flavescens zur Zusammenführung in einer Spezies E. casseliflavus [10, 11]. Von den derzeit bekannten Enterokokken-Spezies haben lediglich E. faecalis und E. faecium größere, medizinische Bedeutung erlangt, auf die im Folgenden nahezu ausschließlich fokussiert wird [2, 12, 13]. Medizinische Bedeutung von Enterokokken Enterokokken gehören heute weltweit zu den wichtigsten Erregern von nosokomialen Infektionen [12]. In älteren Übersichtsartikeln wird eine Verteilung von etwa 90 % Infektionen mit E. faecalis und weniger als 10 % mit E. faecium beschrieben [2]. Während der Anteil an Infektionen mit Enterokokken in den letzten Jahren ungefähr gleich blieb, kann die Verteilung heute regional und zwischen einzelnen Krankenhäusern deutlich zugunsten von E. faecium verschoben sein (bis zu 35 % E. faecium; [14 16]). E. faecium zeigt ein deutlich größeres Reservoir an erworbenen Antibiotika-Resistenzen als E. faecalis, was unter anderem eine Verbreitung unter hohem Antibiotika-Selektionsdruck begünstigt [12, 13, 17]. Der steigende Anteil an E. faecium wird zudem ursächlich in einen direkten Zusammenhang mit dem Auftreten und der zunehmenden Verbreitung Hospital-adaptierter Klone von E. faecium im Krankenhausmilieu gebracht. Berichte über Infektionen mit anderen Enterokokken sind äußerst selten und beschränken sich auf mit E. faecium eng verwandte Spezies, wie E. durans und E. hirae, und die natürlich Vancomycin-resistenten Vertreter E. gallinarum und E. casseliflavus/flavescens [18 21]. Eine Infektion mit Enterokokken geht häufig aus der intestinalen Besiedlung mit diesen Erregern hervor (endogene Infektion). Typische Enterokokken-Infektionen sind demzufolge komplizierte oder nosokomiale Harnwegsinfektionen (überwiegend E. faecalis), postoperative Infektionen, die besiedelnden Bereiche betreffend (perianale und perineale Wundinfektionen, Peritonitis), und Katheter-assoziierte Infektionen (Harnwegskatheter, Venenkatheter). Über diese Eintrittspforten können sich sekundäre Infektionen (Cholezystitis, Pyelonephritis) bis hin zu lebensbedrohlichen Bakteriämien/Septikämien und daraus resultierenden Endokarditiden (Letzteres häufig E. faecalis) entwickeln. Welchen Anteil die Enterokokken bei einzelnen Infektionen als primärer Infektionserreger oder doch eher als begleitende Flora spielen, beispielsweise bei polymikrobiellen Wundinfektionen im Abdominalbereich oder bei Peritonitiden, ist derzeit noch unklar [22]. E. faecium besitzt ein geringeres Virulenzpotenzial als E. faecalis; die meisten durch E. faecium verursachten Infektionen betreffen Patienten mit schweren Grundleiden sowie Immunsuppression und lassen sich somit auf bestimmte klinische Bereiche einschränken (Hämatologie/Onkologie, Organtransplantation, Intensivstation). Aber nicht nur die patienteneigenen Charakteristika haben einen Einfluss auf eine Besiedlung und Infektion mit Enterokokken. In umfangreichen Studien zur Transmission von Pathogenen zwischen Patienten im nosokomialen Milieu zeigten Enterokokken das höchste Verbreitungspotenzial und lagen somit noch vor Staphylococcus aureus oder gramnegativen Pathogenen (exogene Infektion; [23, 24]). Das Überleben auf abiotischen Oberflächen scheint hierbei ein wichtiger Faktor zu sein [25]. Die Ursachen für die Zunahme von VRE-Infektionen sind multifaktoriell. Eine Reihe von Übersichtsartikeln und Metaanalysen erschien kürzlich zu dieser Problematik [12, 13, 22, 26, 27]. Der vermehrte Einsatz von modernen Antibiotika mit geringer oder fehlender Wirksamkeit gegen Enterokokken, wie neueren Fluorchinolonen und Cephalosporinen, scheint in einem direkten Zusammenhang zu stehen [28, 29]. Weitere Aspekte sind eine zunehmende Zahl älterer und/oder immunsupprimierter Patienten mit schweren Grunderkrankungen, speziell im intensiv-medizinischen Bereich. Personen mit einem hohen Risiko, an einer VRE- Infektion zu erkranken, sind Patienten mit Neutropenie, Krebserkrankungen, Niereninsuffizienz oder Leberzirrhose und Patienten nach Lebertransplantation [2, 13, 30]. Neben den für VRE-Infektionen aufgeführten Punkten spielt der Kolonisierungsdruck eine wichtige Rolle [26, 31, 32]. Natürliche Antibiotika-Resistenzen Eine zunehmende Bedeutung von Enterokokken als nosokomiale Infektionserreger resultiert, neben anderen Faktoren, aus ihrem breiten Spektrum an natürlichen Resistenzen gegen Antibiotika (Tab. 1). Cephalosporine zeigen keine Wirksamkeit gegen Enterokokken [2]. Penicilline sind generell gegen Enterokokken weniger aktiv als gegen die eng verwandten Streptokokken, E. faecium wiederum ist unempfindlicher als E. faecalis [2]. Semisynthetische Beta-Lactame, wie Isoxazolylpenicilline, mit sehr guter Wirksamkeit gegen empfindliche Staphylokokken und Monobactame sind gegen Enterokokken unwirksam. Gegen Aminoglykoside (z. B. Gentamicin, Kanamycin, Streptomycin) sind Enterokokken intrinsisch auf niedrigem Niveau resistent (low level). Dies wird durch ein Aminoglykosid-modifizierendes Enzym, eine Acetyltransferase vom AAC(6 )-I-Typ in einzelnen Spezies [33] und eine verminderte Antibiotika-Aufnahme durch die Bakterienzelle vermittelt. 184 Chemotherapie Journal 17. Jahrgang Heft
3 Vancomycin-resistente Enterokokken Tab. 1. Natürliche und erworbene Resistenzen bei Enterokokken Natürliche (intrinsische) Resistenzen Erworbene Resistenzen Cephalosporine Monobactame Isoxazolylpenicilline Aminoglykoside (low level) Lincosamide (E. faecalis) Streptogramine (E. faecalis) Mupirocin (E. faecalis) Vancomycin (low level; E. gallinarum, E. casseliflavus) Tetracycline Makrolide Aminoglykoside (high level) Chloramphenicol Trimethoprim/Sulfamethoxazol Fluorchinolone Glykopeptide (vor allem E. faecium) Ampicillin (vor allem E. faecium) Streptogramine (E. faecium) Oxazolidinone (Linezolid) Glycylcycline (Tigecyclin) Lipopeptide (Daptomycin) E. faecalis ist zusätzlich gegen Lincosamide und Streptogramine durch die natürliche Expression des ABC-Transporters LSA unempfindlich [34]. Trimethoprim/Sulfamethoxazol zeigte in vivo gegen Enterokokken eine deutlich geringere Aktivität als in vitro (keine bakterizide Wirkung in vivo; [2]). Fluorchinolone, auch die moderneren Vertreter der Gruppen 3 und 4, zeigen gegen Enterokokken nur eine eingeschränkte Wirksamkeit [35]. Die Ursache liegt möglicherweise in der natürlichen Ausstattung mit qnr-verwandten Resistenzgenen, die für Proteine kodieren, die die DNS- Gyrase vor einer inhibierenden Wirkung durch Chinolone schützen können (bisher nur für E. faecalis untersucht; [36]). Die Spezies E. gallinarum und E. casseliflavus besitzen eine natürliche Resistenz gegen Vancomycin (minimale Hemmkonzentration [MHK] von 2 bis 32 µg/ml). Sie wird als VanC- Phänotyp bezeichnet (VanC-1 E. gallinarum, VanC-2 E. casseliflavus; [37]) und ist chromosomal kodiert. Erworbene Antibiotika-Resistenzen in E. faecium und E. faecalis Enterokokken können neben ihren bereits vorhandenen, natürlichen Resistenzen gegen Antibiotika zusätzlich noch ein breites Spektrum an Resistenzen erwerben (Tab. 1). Gegen alle Chemotherapeutika, die gegen Enterokokken eingesetzt wurden, haben diese Bakterien Resistenzen entwickelt (Übersicht in [17, 38]). Ein entscheidendes Charakteristikum von Hospital-adaptierten Stämmen von E. faecium ist deren Resistenz gegen Ampicillin, resultierend aus Mutationen oder Rekombinationen im Penicillin-Bindeprotein 5 (PBP5 Efm ) [39]. Ampicillin-Resistenz in E. faecalis hat in Mitteleuropa keine medizinische Bedeutung, entsprechende Stämme mit verändertem PBP5 sind nicht beschrieben und Isolate mit einer Beta-Lactamase sind nur aus den USA bekannt, wo sie einen eigenen klonalen Komplex bilden [40]. Hochresistenz gegen Fluorchinolone resultiert aus Mutationen in den Genen der DNS-Gyrase und DNS-Topoisomerase IV und scheint ebenfalls mit Hospital-adaptierten E.-faecium-Stämmen assoziiert zu sein ([41] und eigene, unveröffentlichte Daten). Im Folgenden wird detaillierter nur auf die erworbene Glykopeptid-Resistenz bei Enterokokken Abb. 1. Biosynthese von Peptidoglykan und Mechanismus der Glykopeptid- Wirkung in Enterokokken [mod. nach 42] Eine Bindung der Glykopeptide an den C-Terminus d-ala-d-ala des extrazytoplasmatischen Zellwand-Grundbausteins verhindert eine effektive Zellwand-Biosynthese durch Transglycosylasen, Transpeptidasen und d,d- Carboxypeptidasen. Vancomycin agiert als Dimer und bindet immer an zwei entgegengesetzte Aminosäureseitenketten (nicht dargestellt; [45]). MurF/MurG = Synthasen; UDP = Uracildiphosphat eingegangen, für andere erworbene Resistenzen sei auf alternative Übersichtsartikel verwiesen [17, 38]. Resistenz gegen Glykopeptide Glykopeptid-Antibiotika interagieren als Zellwand-aktive Antibiotika im Gegensatz zu Beta-Lactamen nicht mit einem Zellwandbiosynthese-Enzym, sondern mit dem Substrat (Abb. 1). Sie bilden eine nicht-kovalente Bindung mit den beiden endständigen d-alanyl-d-alanin-resten der Aminosäureseitenkette (Pentapeptid) der Zellwand-Grundbausteine (N-Acetyl-Glucosamin-N-Acetyl-N-Muraminsäure- Pentapeptid) aus. Aufgrund der Größe der gebundenen Glykopeptid-Moleküle können die Zellwand-aufbauenden Enzyme (Transpeptidase, Transglycosidase) durch sterische Behinderung ihre Zielsequenzen nicht erreichen und die Zellwand-Biosynthese stoppt. Die Glykopeptide können aufgrund ihrer voluminösen Struktur die äußere Zellmembran gramnegativer Bakterien nicht durchdringen, weswegen sie gegen diese Bakterien unwirksam sind. Genetisch wird die Glykopeptid-Resistenz bei Enterokokken in zwei Gruppen eingeteilt: intrinsische (natürliche) und erworbene [17, 37, 42, 43]. Die Resistenz wird in beiden Fällen über eine Modifikation des Angriffsorts der Glykopeptide erreicht. Bei der erworbenen Resistenz wird endständiges d-alanin über eine modifizierte Biosynthese durch d-lactat oder d-serin ersetzt. Im Vergleich zum d-alanin fehlt im d-lactat ein Wasserstoffatom zur Ausbildung einer nichtkovalenten Brückenverbindung mit dem Glykopeptid [44], wodurch das Bindungsvermögen von Vancomycin an diese veränderte Zielstruktur um den Faktor sinkt. Dies resultiert phänotypisch in einer Resistenz gegen diese Antibiotika (MHK 16 µg/ml). Chemotherapie Journal 17. Jahrgang Heft
4 Tab. 2. Typen der erworbenen und natürlichen Glykopeptid-Resistenz in Enterokokken Erworbene Resistenzen Natürliche Resistenz Phänotyp VanA VanB 2) VanD 3) VanE VanG VanC MHK Vancomycin [µg/ml] ( 1 000) MHK Teicoplanin [µg/ml] ,5 1 0, ,5 0,5 0,5 1 Expression Induzierbar Induzierbar Konstitutiv Induzierbar Induzierbar Konstitutiv/induzierbar Lokalisation Plasmid/Chromosom Chromosom/Plasmid Chromosom Chromosom Chromosom Chromosom Mobiles Element Tn1546 Tn1547/Tn1549/Tn5382 (?) (?) (?) (?) Konjugative Übertragung +/ +/ + Ligase-Gen vana vanb vand vane vang vanc Ligase-Produkt 1) d-ala-d-lac d-ala-d-lac d-ala-d-lac d-ala-d-ser d-ala-d-ser d-ala-d-ser Enterokokken-Spezies E. faecium E. faecalis E. durans E. hirae E. gallinarum* E. casseliflavus* E. raffinosus E. avium E. mundtii E. faecium E. faecalis E. durans E. gallinarum* E. faecium E. faecalis E. raffinosus E. faecalis E. faecalis E. gallinarum: VanC1 E. casseliflavus: VanC2/3 Referenzen [42, 46, 75 78] [47, 52, 72, 73] [48, 50, 79] [80, 81] [49, 51, 82] [83 88] * Erwerb der Gene vana bzw. vanb zusätzlich zu natürlich vorhandenen vanc1- bzw. vanc2-genen selten 1) Bildung des alternativen Di- bzw. Didepsipeptids, die eine verminderte Bindungsaffinität zu Glykopeptiden zeigen 2) Subtypen VanB-1 bis VanB-3 sind bekannt 3) Subtypen VanD-1 bis VanD-5 sind beschrieben MHK: minimale Hemmkonzentration Erworbene Resistenz gegen Glykopeptide lässt sich genotypisch und phänotypisch in verschiedene Arten untergliedern, derzeit sind VanA, VanB sowie VanD, VanE und VanG in Enterokokken bekannt (Tab. 2) [46 53]. Namensgebend für den Resistenztyp ist die entsprechende Ligase mit erweiterter Substratspezifität (z. B. VanA-Ligase), die beispielsweise im Fall von VanA d-2-hydroxysäuren (z. B. d-lactat) mit d-alanin verbindet. Medizinisch relevant sind zurzeit nur VanA und in geringerem Umfang VanB. Beide Resistenzen sind in der Regel induzierbar, wobei als entscheidender Unterschied die VanB-vermittelte Resistenz nur durch Vancomycin, nicht aber durch Teicoplanin, induziert wird. Daher ist eine Infektion mit VRE vom VanB-Typ durchaus mit Teicoplanin (in Kombination) therapierbar [54]. Es kommt allerdings nicht selten unter längerer Therapie zu einer Selektion Teicoplanin-resistenter Mutanten durch konstitutive Expression des Resistenzmechanismus [55]. Die mittels In-vitro-Tests messbaren minimalen Hemmkonzentrationen (MKH) von Vancomycin können vor allem beim VanA-Typ sehr hoch sein, bei VanB liegen die MHK- Werte meist einige Stufen unter denen für VanA (Tab. 2). Die unterschiedlich stark ausgeprägte Vancomycin-Resistenz in VanB-Stämmen verursacht Schwierigkeiten bei der Erfassung der Resistenz im mikrobiologischen Labor, da MHK-Werte im Bereich von 2 bis 8 µg/ml als sensibel oder intermediär gelten. Darüber hinaus sind auch Enterokokkenstämme mit vana-gencluster beschrieben, die in vitro einen VanB-Phänotyp anzeigen, das heißt als Teicoplaninempfindlich erscheinen [56 59]. Per Definition Teicoplaninempfindliche oder -intermediäre (d. h. mit MHK 8 µg/ml) Stämme mit vana-gencluster sind keine Seltenheit, Stämme mit einer MHK von Teicoplanin wie bei VanB-Stämmen üblich, das heißt 1 µg/ml, sind dagegen die Ausnahme [59]. Über eine Bestimmung der Resistenzen mittels MHK lässt sich der zugrunde liegende Resistenztyp mitunter noch abschätzen, bei der Empfindlichkeitstestung mittels Agardiffusion, die speziell für Glykopeptide kein optimaler Test ist, ist dies kaum möglich. Entsprechend ist für eine Abklärung der zugrunde liegenden Resistenzmechanismen eine molekulare Diagnostik über Polymeraseketten-Reaktion (PCR) [60], real-time PCR [61, 62] oder Hybridisierungs-basierter Testsysteme zu empfehlen [63]. Es ist nicht bekannt, ob in vitro bestimmte MHK auch in vivo relevant sind, das heißt, ob beispielsweise VanB-Isolate mit sehr niedrigen MHK- Werten von Vancomycin in vivo mit hohen Vancomycin- Konzentrationen therapeutisch behandelt werden können. In den meisten untersuchten Isolaten ist das vana-gencluster Plasmid-kodiert und lässt sich konjugativ übertragen [64 67], während das vanb-gencluster oft chromosomal lokalisiert und nur teilweise übertragbar ist [52, 68 70]. Die genetischen Elemente, die induzierbare Glykopeptid-Resistenz vermitteln, sind in beiden Fällen charakterisiert worden. Es handelt sich um Transposonelemente, von denen Tn1546 für VanA bzw. Tn1547, Tn1549 und Tn5382 für VanB gut charakterisiert sind [46, 47, 52, 70, 71]. In späteren Studien wurde eine Differenzierung von verschiedenen vanb- Elementen anhand ihrer DNS-Sequenz in Subtypen vanb-1, vanb-2 und vanb-3 gezeigt [47, 70 73] sowie ein Einbau der vanb-cluster in große, zum Teil konjugative chromosomale Elemente [68 70, 74]. Drei induzierbare Proteine sind für den VanA-Resistenzmechanismus essenziell [75]: 186 Chemotherapie Journal 17. Jahrgang Heft
5 Vancomycin-resistente Enterokokken VanH-d-2-Hydroxysäure-Dehydrogenase VanA-Ligase VanX-d,d-Dipeptidase Zusammen mit einem vierten Enzym, einer VanY-d,d-Carboxypeptidase realisieren diese Proteine einen Stoffwechselweg zur Bildung eines alternativen Zellwand-Grundbausteins, der in der Peptidseitenkette in d-ala-d-lac anstelle von d-ala-d-ala endet (Abb. 2). Der induzierbare Charakter der VanA-Resistenz wird über ein Zwei-Komponentensystem vermittelt. VanS stellt einen membranständigen Sensor (N-Terminus) dar, der nach einem noch nicht völlig verstandenen Mechanismus die Glykopeptid-Wirkung auf die Zellwand-Biosynthese misst und über eine Autophosphorylierung die eigene Histidinkinasefunktion (C-Terminus) aktiviert. Der Phosphatrest wird auf einen zytoplasmatischen Regulator (VanR) übertragen, der dadurch aktiviert wird [77]. P-VanR wirkt als Transkriptionsfaktor und aktiviert durch Bindung an zwei Promotoren in Tn1546 die Expression von vanr/s und van- HAXYZ [89]. Bei nicht vorhandenem Selektionsdruck durch Glykopeptide übernimmt ebenfalls VanS die Dephosphorylierung von P-VanR und somit dessen Deaktivierung. Ein Ausfall von VanS führt interessanterweise in in vitro konstruierten Testbakterien zu konstitutiv exprimierter Vancomycin-Resistenz [89], während Mutationen in VanS das Niveau der Teicoplanin-Empfindlichkeit beeinflussen können [90]. Die anderen Glykopeptid-Resistenzcluster ähneln in ihrem Aufbau und ihrer Funktion dem vana-cluster soweit bekannt. Aufgrund ihrer untergeordneten medizinischen Bedeutung bei deutschen Krankenhauspatienten werden sie hier nicht ausführlicher behandelt und es sei auf alternative Übersichtsartikel verwiesen [37, 42, 43]. Diagnostik von Vancomycin-resistenten Enterokokken Heutzutage existieren eine Reihe kommerziell erhältlicher Testmedien und -systeme, die durch eine Einführung von zusätzlichen Modulen in den letzten Jahren für eine effizientere und für die meisten Fragestellungen ausreichend valide Enterokokken- und VRE-Diagnostik gerüstet sind [91 97]. Probleme bei der Detektion von vanb- oder vanc- Stämmen mit niedrigen MHK von Vancomycin sind bereits angemerkt worden. Solche Probleme ergeben sich bei der Detektion von VRE über kommerzielle Automatensysteme oder Screening-Agarmedien [90, 94]. Eine Abgrenzung der VanB-Isolate mit niedrigen MHK von Vancomycin von VanC- Enterokokken (MHK von Vancomycin meist 4 16 µg/ml) lässt sich über bestimmte, phänotypische Zusatztests bei fraglichem Ergebnis der biochemischen Charakterisierungen realisieren. Sie sind teilweise bereits fester Bestandteil der kommerziellen Testsysteme oder ausgewiesener Zusatzuntersuchungen bei Automatensystemen. So sind beispielsweise die Enterokokken-Spezies vom VanC-Typ (E. gallinarum/e. casseliflavus) im halbfesten Beweglichkeits-Agar mobil, während E. casseliflavus darüber hinaus noch ein Pigment besitzt, das sonst nur noch E. mundtii aufweist (Letzterer wiederum ist unbeweglich). Abb. 2. Glykopeptid-Resistenz vom VanA-Typ [mod. aus 42] Oben: Synthese der Peptidoglykan-Precursoren in einem Stamm mit VanA- Typ-Resistenz. Ddl: d-ala-d-ala-ligase; Penta: l-ala-γ-d-glu-l-lys-d-ala-d-ala; Pentadepsi: l-ala-γ-d-glu-l-lys-d-ala-d-lac; Tetra: l-ala-γ-d-glu-l-lys-d-ala; Tri: l-ala-γ-d-glul-lys. Unten: Struktur des vana-operons. Pfeile signalisieren kodierende Sequenzen und die Richtung der Transkription. Die regulativen und Resistenz-vermittelnden Gene werden von den Promotoren P R und P H abgelesen. Wesentlich sicherer ist die molekulare Diagnostik durch den Nachweis der entsprechenden Markergene. Verschiedene Zielgene sind als geeignetes Mittel zur Speziesidentifizierung bei Enterokokken ermittelt worden [98 101]. Eine Ermittlung des Besitzes der van-gene lässt sich über PCR, real-time PCR, kommerzielle Hybridisierungssysteme oder DNS-Mikroarrays erzielen. Aus der Vielzahl der PCR-basierten Tests sei hier nur auf eine kürzlich erschienene Arbeit verwiesen, in der alle zurzeit bekannten van-gene in einem Multiplex-Ansatz inklusive einer Speziesdiagnostik für E. faecium und E. faecalis über eine Amplifikation eines Spezies-spezifischen Fragments der d-ala-d-ala-ligase ermittelt werden [60]. Für die meisten Fragestellungen ausreichend dürfte jedoch eine Detektion des vana- oder vanb-gens sein, beispielsweise in einer Multiplex-PCR (Abb. 3). Für eine praktische Anwendung ist in erster Linie natürlich ein effizienter Nachweis aus Originalmaterialien wichtig. Dies kann heute über real-time PCR-Anwendungen realisiert werden. Eine valide Diagnositik ist unter anderem dokumentiert für einen VRE-Nachweis aus Analtupfern [62], Blut [102] oder verschiedenen klinischen Proben [103]. Dabei kann die molekulare Diagnostik der klassischen Diagnostik sowohl zeitlich als auch qualitativ überlegen sein [104]. Ein alternatives Testsystem läuft über eine Multiplex-PCR und eine anschließende Hybridisierung und Detektion der markierten Fragmente auf einem Teststreifen mit immobilisierten Sonden (Makroarray, DNA-Strip -Technologie; Hain Life Science, Nehren, Deutschland; de). Für Enterokokken werden zwei Kits, der GenoType Enterococcus und der GenoType blood culture Kit angeboten [63, 105]. Der GenoType Enterococcus differenziert E. faecium, E. faecalis und E. gallinarum und E. casse- Chemotherapie Journal 17. Jahrgang Heft
6 Primer Sequenz Größe des Produkts hyl-f 5 -AGGCTCCAATTCTGT 662 1) hyl-r liflavus sowie darüber hinaus die Resistenzgene vana, vanb und vanc1 (E. gallinarum) und vanc2 (E. casseliflavus). Der Test ist zu 100 % spezifisch und sensitiv und somit phänotypischen Detektionsverfahren überlegen [63]. Verwiesen sei an dieser Stelle noch auf ein mögliches Reservoir von vanb in anaeroben Darmkommensalen, was bei PCR-Screenings zu falsch positiven Ergebnissen führen kann [61, ]. Anscheinend existiert aber auch ein Reservoir für vana außerhalb von Enterokokken [ ]. Die Gencluster in den natürlichen Glykopeptid-Produzenten (Aktinomyzeten) sind zwar mit vana oder vanb verwandt, aber letztlich phylogenetisch deutlich abzugrenzen und führen nicht zu Kreuzreaktionen [ ]. VRE-Screening 5 -GAGTAGAGGAATATCTTAGC esp-tim-f 5 -TCCAACTACCACGGTTTGTTTATC 475 1) esp-tim-r 5 -CTTTGATTCTTGGTTGTCGGATAC vana-f 5 -GGAGTAGCTATCCCAGCATT 377 vana-r 5 -TCTGCAATAGAGATAGCCGC vanb-f 5 -GATGCGGAAGATACCGTGGCT 298 vanb-r 5 -CATCGCCGTCCCCGAATTTCAAA 1) nur für E. faecium sinnvoll, da andere Sequenz (hyl) bzw. ubiquitär (esp) in E. faecalis Abb. 3. In-house -Multiplex-PCR zum simultanen Nachweis der Gene vana/ vanb sowie esp und hyl Ausgangsmaterial ist isolierte genomische DNS Oben: verwendete Primer und Größe der PCR-Produkte; unten: Multiplex-PCR aufgetragen in 1%igem Agarosegel. M = Molekularmassenstandard; R = Referenz für Multiplex (alle 4 Gene positiv); 1 9: E.-faecium-Teststämme Die technische Realisierung einer effizienten und validen Detektion von VRE ist natürlich nur die eine Seite. Die Fragen, beispielsweise wer, wann und wie oft auf VRE gescreent werden sollte, sind ein eigenes, umfangreiches Themengebiet und Gegenstand kontroverser Diskussionen. Diese Fragestellungen (z. B. generelles Screening vs. Screening im Ausbruchsfall, wiederholtes Screening vs. einmaliges Screening bei Aufnahme) sind von einer Vielzahl von Faktoren abhängig. Bestimmte Vorgehensweisen sollten sich den jeweiligen epidemiologischen, räumlichen, personellen und organisatorischen und nicht zuletzt finanziellen Situationen und Ressourcen vor Ort anpassen (Isolierung bis zum Ergebnis des Screenings ja/nein? Kohortenisolierung? Zu untersuchender Personenkreis?). Alle diese Fragen sind Gegenstand einer Vielzahl von Übersichtsartikeln [13, 26, 27, 116] und Empfehlungen [ ] und sollen hier nicht im Detail diskutiert werden. Einigkeit herrscht in folgenden Punkten: Risikopatienten und Risikobereiche innerhalb eines Krankenhauses zeigen erhöhte Anfälligkeit für Besiedlungen und Infektionen mit VRE [27, ] Kohortenisolierung sollte nie zusammen mit MRSA-Patienten erfolgen, um eine Übertragung der van-vermittelten Glykopeptid-Resistenz auf MRSA zu verhindern [ ] Versuch einer selektiven Dekontamination von intestinal mit VRE besiedelten Patienten zeigt zum einen nur kurzfristige Erfolge und kann zum anderen zu alternativen Problemen führen [ ] als eine mögliche Alternative ist Ramoplanin noch in der Testung [125, 126] Ausbrüche mit VRE sind nicht selbstlimitierend ohne ein striktes Regime (z. B. Veränderungen im Antibiotika- Einsatz, verbesserte Hygiene und Compliance, umfangreicheres Screening) lassen sich Ausbrüche mit VRE nicht eindämmen [26, 27, 117, ]. Eine Bestimmung des Anteils einzelner Maßnahmen am Erfolg der Eindämmung des Ausbruchs ist häufig schwierig und lässt sich meist nicht einzeln belegen [27, 116, 123, ]. So ist es möglich, dass in Hochendemiegebieten oder -situationen der Anteil einzelner Maßnahmen, wie eine alleinige Reduktion des Vancomycin-Einsatzes, keinen nachweislichen Effekt auf eine Reduktion der VRE-Last haben kann [32]. Molekulare Typisierung und Populationsstruktur von E. faecium und E. faecalis Verschiedene Fragestellungen bedürfen des Einsatzes molekularer Typisierungsverfahren mit unterschiedlicher Diskriminierungsfähigkeit. Eine Aufklärung von lokal begrenzten Ausbrüchen erfordert Methoden mit einer sehr hohen und genauen Diskriminierungsfähigkeit, während Untersuchungen zur überregionalen Verbreitung von Epidemieklonen molekulare Methoden mit geringerer Diskriminierungsfähigkeit bedürfen. Bei Enterokokken sind verschiedene Methoden für eine molekulare Typisierung etabliert. Sie besitzen Unterschiede in technischen Anforderungen an das Labor und Personal, Diskriminierungsfähigkeit, Reproduzierbarkeit und Interlabor-Austauschbarkeit der Daten. Diese sind einerseits abhängig vom Erreger selbst, andererseits aber auch auf die Methoden an sich zurückzuführen (Tab. 3). Aus heutiger Sicht bereits veraltet erscheinen klassische Methoden der molekularen Typisierung wie MLEE (Multi-Locus-Enzymelektrophorese) und verschiedene PCR-Typisierungsmethoden, die unabhängig von der jeweiligen Fragestellung von moderneren oder Methoden mit verbessertem Auflösungsvermögen und der Möglichkeit eines besseren Interlabor-Datenaustauschs abgelöst wurden. Für einzelne In-house -Fragestellungen mögen sie noch genügen [134]. Ribotypisierung hat trotz kommerziell erhältlicher Vollautomaten nie eine breitere 188 Chemotherapie Journal 17. Jahrgang Heft
7 Vancomycin-resistente Enterokokken Tab. 3. Vergleich der Typisiermethoden für Enterokokken/VRE Methode Prinzip Diskriminierung Reproduzierbarkeit Datenaustausch Anwendung / Referenzen MLEE Unterschiedliches Laufverhalten im Gel durch Aminosäureaustausche in Haushaltsproteinen Variabel Gut Schwierig Veraltet, abgelöst durch MLST Plasmid-Profiling Muster von Plasmiden (Unbekannt) Sehr gut Schwierig Plasmide sehr heterogen, Stabilität von Plasmidmustern unbekannt daher generell nicht geeignet; zur Feintypisierung von eng verwandten Enterokokken verwendbar [17, 152]; Nachweis von Plasmid-Hospitalismus [144] Ribotypisierung RAPID/repPCR PFGE AFLP MLST MLVA Hybridisierung von markierter rdns mit geschnittener Gesamt-DNS PCR mit Random-Primern oder Primern, die in repetitiven Sequenzen binden Makrorestriktionsanalyse des Gesamtgenoms Längenpolymorphismen von genomischen PCR-Produkten Unterschiede in der DNS-Sequenz von Haushaltsgenen Unterschiedliche Fragmentlängen in genomischen Repeat-Regionen Mittel Gut Möglich 2 Zu schlechte Diskriminierung für Ausbruchsaufklärung [135, 136] Mittel Schlecht gut 1 Schwierig möglich 2 Nur für In-house -Ausbruchsaufklärung geeignet, z. T. als kommerzielle Kits [134, 153] Exzellent Gut sehr gut 1 Möglich 2 Gold-Standard für Ausbruchsaufklärung; für Populationsanalysen überdiskriminierend Sehr gut Gut sehr gut 1 Möglich Abgelöst durch MLST wegen der Möglichkeit des besseren Datentransfers/ -vergleichs [137, 152, 154] Sehr gut Exzellent Exzellent Gold-Standard für Populationsanalyse; vergleichbar aufwendig und teuer [40, 155] Gut sehr gut Exzellent Exzellent Für Ausbruchsaufklärung ungeeignet, da nicht genügend diskriminierend (E. faecium); geeignet für Populationsanalyse [143, 156, 157]; (s. auch Abb. 5); Ungenauigkeiten durch nichtvollständige Repeatlängen möglich AFLP = Amplified-fragment length polymorphism; MLEE = Multi-Locus-Enzymelektrophorese; MLST = Multi-Locus-Sequenztypisierung; MLVA = Multiple locus variable number of tandem repeat analysis; PFGE = Makrorestriktionsanalyse des Gesamtgenoms in der Pulsfeld-Gelelektrophorese. 1 Erste Angabe bei Interlabor-, zweite Angabe bei Intralabor-Reproduzierbarkeit 2 In Abhängigkeit eines einheitlichen Protokolls/Kits/Geräts Anwendung erfahren, da die zugrunde liegenden Prinzipien bei Enterokokken keine sinnvolle Diskriminierung zulassen [135, 136]. Dagegen erfährt die Anfang der 1990er Jahre eingeführte Makrorestriktionsanalyse des Gesamtgenoms und Auftrennung der Fragmente in der Pulsfeld-Gelelektrophorese (PFGE) trotz ihres hohen apparativen und zeitlichen Aufwands bei Enterokokken immer noch eine breite Anwendung zur Aufklärung von Ausbruchsgeschehen [116, ] oder für eine Untersuchung einer überregionalen Ausbreitung bestimmter Klone [17, ]. Eine Ablösung durch neuere Methoden wie MLST (Multi-Locus-Sequenztypisierung) oder MLVA (Multiple locus variable number of tandem repeat analysis) erweist sich, zumindest für E. faecium, nicht als sinnvoll, da erstere teilweise zu wenig diskriminierend und zudem teuer und aufwendig ist, letztere teilweise zu wenig diskriminierend ist und unzureichende Kongruenz mit Typen zeigt, die mittels PFGE oder MLST bestimmt wurden [143, 144] (Abb. 5). Das heutige Verständnis der Populationsstruktur insbesondere von E. faecium basiert auf den angesprochenen AFLP- (Amplified-fragment length polymorphism), MLST- sowie MLVA-Analysen und wurde kürzlich durch vergleichende genomische Hybridisierungen bestätigt [145]. Die Einführung moderner Software-Programme ermöglichte die Aufstellung und Verfolgung von phylogenetischen Verwandtschaften zwischen den einzelnen klonalen Typen und eine Definition von klonalen Komplexen [146]. Logarithmische Regressionsmodelle einer Analyse der Verteilung bestimmter Marker in verschiedenen klonalen Gruppen ergaben definierte Assoziationen [ ]. Demnach stellen unter anderem Hospital-adaptierte, epidemische E. faecium eine separate klonale Linie dar. Isolate dieser klonalen Gruppe sind durch ein charakteristisches MLST-Profil (oder MLVA-Profil) sowie durch das statistisch gehäufte Auftreten von (a) Ampicillin-Resistenz, (b) Fluorchinolon-Hochresistenz [41] sowie (c) bestimmten Virulenzmarkern wie esp und hyl Efm gekennzeichnet [140, 147, 148, 150, 151]. Eine Assoziation mit einer Resistenz gegen Vancomycin dagegen erwies sich als nicht signifikant [147, 148]. Somit ist der Erwerb der Vancomycin-Resistenz keine essenzielle Voraussetzung für eine erfolgreiche Ausbreitung dieser Klone im Krankenhausmilieu. Chemotherapie Journal 17. Jahrgang Heft
8 werden hier in den nächsten Jahren tiefere Einblicke in die Populationsstruktur von E. faecalis ermöglichen. Epidemiologie von VRE Abb. 4. Phylogenetische Analyse der Verwandtschaften derzeit bekannter MLST-Typen mittels eburst v3 [146] Sequenztyp ST17 ist der primäre Gründer (primary founder) des klonalen Komplexes CC17 (Kreis) und vereint Hospital-assoziierte Klone. Weitere, kleinere Cluster werden durch so genannte sekundäre Gründer (secondary founder) bestimmt (im CC17, z. B. ST16, ST17, ST18, ST78, ST117, ST132). Durch einen Strich verbundene Typen unterscheiden sich nur an einem Locus/in einem Haushaltsgen und werden als Single-Locus-Varianten (SLV) bezeichnet (entsprechend: DLV, Doppel-Locus-Varianten, etc.). In deutschen Krankenhäusern durch VRE-Ausbrüche vermehrt aufgetreten: ST17, ST18, ST78, ST117, ST192, ST202, ST203, ST233 [140, 143, 144] Nahezu alle Isolate aus Clustern von Infektionen und Besiedlungen im Krankenhaus besitzen MLST-Typen, die sie zum so genannten klonalen Komplex 17 zuordnen (clonal complex CC17 entspricht MLVA: CC1). Eine phylogenetische Analyse der derzeit bekannten MLST-Typen mittels eburst zeigt Abbildung 4. Über eine Zuordnung der Isolate in bestimmte klonale Linien (MLST CC17 oder MLVA CC1) mittels ihres MLST- oder MLVA-Profils sowie einen Nachweis der entsprechenden Marker (z. B. Ampicillin-Resistenz, Gene esp und hyl) lässt sich das epidemische Potenzial von Isolaten im Voraus abschätzen. Leider gibt es derzeit keinen Einzel-Marker, der sich als ein sicheres diagnostisches Mittel für ein erhöhtes Ausbreitungs- oder Pathogenitätspotenzial erweisen könnte. Die Ursachen, warum gerade Klone des MLST CC17 ein erhöhtes Ausbreitungspotenzial im Krankenhaus und eine vermehrte Assoziation mit Clustern von Infektionen und Besiedlungen bei hospitalisierten Personen zeigen, sind noch nicht verstanden und Bestandteil von aktuellen Forschungsprojekten ( Erst wenige Arbeiten sind zur Populationsstruktur von E. faecalis veröffentlicht worden und dann auch noch basierend auf verschiedenen MLST-Schemata [40, ]. Diese vorläufigen Ergebnisse wurden an einer limitierten Anzahl an Stämmen vorgenommen und deuten an, dass im Gegensatz zu E. faecium klonale Typen und Gruppen von E.-faecalis-Isolaten anscheinend keine ausgeprägten Wirtsspezifitäten zeigen. Somit ist ein Austausch von Isolaten zwischen Mensch und Tier denkbar. Allerdings zeigen wenigstens einzelne klonale Typen eine Assoziation mit dem Krankenhausmilieu und wurden gehäuft aus Infektionen und Besiedlungen bei Krankenhauspatienten isoliert (E.-faecalis-Isolate des CC2 und CC9; [40]). Erst eine breite Anwendung dieser Methode und umfangreichere Untersuchungen Das Reservoir der übertragbaren vana- und vanb-vermittelten Resistenz bei Enterokken liegt eindeutig in E. faecium. Auch außerhalb der Humanmedizin sind in Studien zu VRE kaum Vancomycin-resistente E. faecalis nachgewiesen worden [ ]. Verschiedene Surveillance-Studien (z. B. multizentrische Studie der Paul-Ehrlich-Gesellschaft; European Antimicrobial Resistance Surveillance System EARSS, bei EARSS ausschließlich invasive Isolate), in denen unter anderem Daten zur Antibiotika-Resistenz in Enterokokken von Krankenhauspatienten erhoben werden, zeigen einen Anstieg der Vancomycin-Resistenz bei Enterokokken für Deutschland seit Dabei ist der Anstieg in Deutschland einzig und allein auf eine Zunahme Vancomycin-resistenter E. faecium bei gleich bleibenden Raten von < 1 % Vancomycin-resistenter E. faecalis zurückzuführen ([168]; Ähnliches trifft für die Situation in anderen europäischen Ländern zu nahezu alle VRE sind E. faecium. Somit ist das VRE-Problem aus ökologischer und nosokomialer Sicht an sich ein VR-E.-faecium(VREF)-Problem. Die Häufigkeiten von VREF variieren dabei stark zwischen europäischen Ländern mit < 1 % in Skandinavien und Teilen Osteuropas und > 40 % in Griechenland, Portugal und Israel [168]. In verschiedenen Ländern zeigt sich ein unterschiedlicher Trend: Während in Portugal und Österreich die Raten an VREF signifikant abnehmen, zeigen die Ergebnisse für Deutschland, Griechenland, Irland und Israel einen statistisch signifikanten Anstieg auf unterschiedlichem Niveau in den letzten Jahren [168]. Daten aus klinischen Studien weisen darauf hin, dass Infektionen mit VRE häufig eine Besiedlung des Intestinaltrakts vorausgeht, die durch antibiotische Behandlung deutlich begünstigt wird [169, 170]. Bei den Risiko -Antibiotika handelt es sich um Cephalosporine der Gruppe 3, Fluorchinolone, Substanzen mit Wirksamkeit gegen Anaerobier sowie Vancomycin [31, 121, 122, ]. Die vana-vermittelte Vancomycin-Resistenz ist in Deutschland [17, , 174] und Europa [162, ], Asien [57, 179, 180) und den USA [ ] und Lateinamerika [185, 186] wesentlich häufiger verbreitet als die vanb-vermittelte. Lediglich Australien/Neuseeland scheinen eine spezielle, epidemiologische Situation darzustellen; in Australien ist die vanb-vermittelte Vancomycin-Resistenz häufiger [128, 129] und in Neuseeland findet man den vana-typ häufiger in E. faecalis als in E. faecium [ ]. Warum die mobilen vana- und vanb-elemente bevorzugt in E. faecium zu finden sind, ist unklar. E. faecalis verfügt über ein höchst effizientes System des konjugativen Gentransfers über Pheromonplasmide [Übersicht in 190]. Offenbar scheinen aber nur selten van-transposons dort zu integrieren, insgesamt sind auch andere Determinanten für Antibiotika-Resistenz sehr selten dort lokalisiert, obwohl viele von ihnen in mobilen Strukturen angeordnet 190 Chemotherapie Journal 17. Jahrgang Heft
9 Vancomycin-resistente Enterokokken sind (fehlende attachment sites?) [64, 66]. Ein Großteil der vana-determinanten wird über mobile und konjugative Plasmide übertragen [187, ]. Somit kann über eine Limitierung des Wirtsbereichs dieser Plasmide E. faecium, aber eben nicht E. faecalis ein bevorzugter Wirt sein [74, 176, 191, 192]. Eine Charakterisierung von vana-plasmiden in Enterokokken und eine Ermittlung ihres Wirtsbereichs und ihrer Übertragbarkeit ist unter anderem das Anliegen eines derzeit geförderten EU-Projekts über Enterokokken ( Basierend auf der im vorangegangenen Kapitel beschriebenen Populationsstruktur von E. faecium und obigen Ausführungen ergibt sich derzeit folgendes Modell der Entstehung und Ausbreitung von VREF im nosokomialen Milieu: Bestimmte Isolate von an das Krankenhaus angepassten klonalen Linien des CC17, die überwiegend Ampicillin-resistent sind und bestimmte Virulenzmarker wie esp und hyl besitzen, erwerben zu einem späteren Zeitpunkt die Determinanten der Glykopeptid-Resistenz und werden somit als VREF auffällig. Es stellte sich nun die Frage, ob bei einem überregionalen Auftreten von VREF sich die bereits resistenten Erreger ausgebreitet haben oder ob die bereits ausgebreiteten, Glykopeptid-empfindlichen Vorläufer aus unterschiedlichen Quellen die vana-gencluster erwerben und zu VREF werden. Um dies zu untersuchen, haben wir aus unserer Stammsammlung drei zeitlich verschiedene Kollektionen an Hospital-VREF des vana-typs molekular untersucht: Gruppe I: Isolate aus sporadischen Infektionen zwischen 1991 bis 1997 Gruppe II: Isolate aus Ausbrüchen oder gehäuftem Auftreten zwischen 1995 bis 1999 Gruppe III: Isolate aus Ausbrüchen oder gehäuftem Auftreten aus 2004 bis 2006 [143, 144] Die Isolate wurden mittels PFGE, MLST und MLVA typisiert, der Besitz von Virulenzmarkern mittels PCR geprüft und ihre vana-gencluster mittels PCR, Long-PCR, Hybridisierung und DNS-Sequenzierung verglichen. Isolate aus allen drei Klassen zeigten dabei eine deutlich verschiedene Epidemiologie. Isolate der Gruppe I aus sporadischen Besiedlungen und Infektionen sind wie erwartet auch klonal verschieden, besitzen MLST-Profile, die sie nur teilweise zum MLST CC17 gruppieren und haben aber bis auf eine Ausnahme ein identisches vana-cluster (Typ A1; Abb. 5). Ein identisches vana-cluster wurde auch in VREF außerhalb und unabhängig von Krankenhäusern zum damaligen Zeitpunkt identifiziert, beispielsweise isoliert aus humanen Stuhlproben und von Masttieren [65]. Gruppe-II-VREF sind klonal eng verwandt, besitzen ein nahezu identisches PFGE- Muster [17, 194, 195], einen identischen MLVA- (MT12) und MLST-Typ (ST117) sowie verwandte vana-gencluster vom Typ A1 und C1 (Abb. 5; Einbau eines mobilen IS-Elements ISEf1 zwischen vanx und vany). Zudem besitzen die Isolate ein eng verwandtes vana-plasmid, was den Hinweis auf eine klonale, überregionale Ausbreitung eines bereits Vancomycin-resistenten E. faecium untermauert [17, 194]. Isolate der Gruppe III zeigen ein heterogenes Bild. Allerdings weisen 50 der 51 Isolate aus 19 Krankenhäusern MLST-Typen aus, die sie zum CC17 zuordnen. Bis auf einen sind alle Ampicillin-resistent und besitzen bis auf fünf VREF entweder esp oder hyl oder beide Gene. Es ließen sich verschiedene vana-gencluster nachweisen, die Typen A1 und C waren dabei häufiger. Einzelne MLST-Typen zeigen unabhängig von ihrer Herkunft eine Assoziation mit bestimmten vana- Clustertypen und Virulenzgenmustern (Abb. 5): Alle zehn VREF des ST203 aus sechs Krankenhäusern fallen basierend auf ihrem PFGE-Muster in eine Gruppe, besaßen den vana-clustertyp A1 sowie das esp- nicht aber das hyl-gen 13 von 14 VREF des ST18 (7 Krankenhäuser) waren ebenfalls eng verwandt anhand ihres PFGE-Musters, besaßen ein gleiches vana-cluster vom Typ C und acht verfügten über das hyl-, nicht aber das esp-gen. Diese Assoziationen deuten auf eine klonale Ausbreitung bereits Vancomycin-resistenter E. faecium zwischen verschiedenen Krankenhäusern und Bundesländern hin [144] Häufungen von Infektionen und Besiedlungen mit VREF innerhalb eines Krankenhauses sind meist oligo- oder sogar polyklonal. Wir haben verschiedene Klone einzelner Einsender untersucht und festgestellt, dass die VREF alle ein identisches vana-gencluster besitzen [144]. Noch unveröffentlichte Daten aus unserem Labor zeigen zudem, dass die vana-vermittelte Resistenz auf Plasmiden lokalisiert ist, die in den verschiedenen VREF-Klonen identisch sind. Anhand dieser Daten und kürzlich veröffentlichter Studien [147, 148] ist also das vermehrte Auftreten von VREF in Deutschland und Mitteleuropa auf verschiedene Entwicklungen zurückzuführen: Cluster von Infektionen und Besiedlungen mit VREF sind häufig oligo-/polyklonal [138, 139, 144, 196] Innerhalb eines lokal begrenzten, oligo- bzw. polyklonalen Ausbruchs können die VREF ein identisches vana- Cluster über horizontalen Gentransfer/Plasmidtransfer erworben haben [144] Bereits Vancomycin-resistente E. faecium können sich zwischen Krankenhäusern verschiedener Bundesländer verbreiten (klonale Verbreitung) [143, 144], ähnlich wie man dies seit langem von Methicillin-resistenten Staphylococcus aureus (MRSA) kennt Ein Austausch von Determinanten der Glykopeptid-Resistenz unter In-vivo-Bedingungen ist bekannt [78, ]. Therapieoptionen und -limitationen bei Infektionen mit VRE Ampicillin ist das Standardtherapeutikum bei leichten Infektionen (Harnwegsinfekte) mit Enterokokken oder schwereren, invasiven Infektionen mit E. faecalis. Aminoglykoside sind klassische Kombinationspartner von Penicillinen bei der Enterokokken-Endokarditis, wobei die Mindestdauer einer Kombinationstherapie 2 bis 3 Wochen zu sein scheint, um die Rezidivrate klein zu halten [200, 201]. Probleme bereitet heutzutage die nahezu ubiquitäre Verbreitung der erworbenen Ampicillin-Resistenz in Hospitaladaptierten E. faecium, bei denen die Hochresistenz gegen Aminoglykoside ebenfalls deutlich gehäuft anzutreffen ist (Hochresistenz gegen Gentamicin bei E. faecium aus Blutkulturen: > 40 %; [168]). Unter diesen Bedingungen ist eine bakterizide Therapie nahezu unmöglich [13]. Chemotherapie Journal 17. Jahrgang Heft
10 Abb. 5. Epidemiologie von vana-positiven Vancomycin-resistenten E. faecium (VREF) aus deutschen Krankenhäusern (Erläuterungen zur Abbildung siehe Seite 193 oben links) Aufgrund des zusätzlich äußerst limitierten Spektrums an noch wirksamen Antibiotika sind Infektionen mit VRE, allen voran Vancomycin-resistente E. faecium, sehr schwer zu therapieren. In Fallberichten erwiesen sich Kombinationen aus zwei oder drei Antibiotika verschiedener Klassen (z. T. mit ungewöhnlichen Partnern wie Chloramphenicol) 192 Chemotherapie Journal 17. Jahrgang Heft
11 Vancomycin-resistente Enterokokken Abb. 5. Epidemiologie von vana-positiven VREF aus deutschen Krankenhäusern Oben: Clusteranalyse anhand des SmaI-Makrorestriktionsmusters in der PFGE, Ergebnissen der MLST- und MLVA-Typisierung sowie dem Besitz von esp, hyl und verschiedenen vana-clustertypen. Isolate sind auf der Basis ihrer SmaI-Makrorestriktionsmuster gruppiert (Dice-Koeffizient und UPMGA- Clustering mit BioNumercis Software). Es ist erkennbar, dass MLVA nicht ausreichend diskriminiert, da die häufigsten MLVA-Typen (MT1, MT159) über fast alle PFGE-Cluster verteilt sind und verschiedene nicht-verwandte MLST-Typen besitzen (weitere Erläuterungen s. Text). Unten: vana-clustertypen in Krankenhaus-VREF von Typ A ist der Referenztyp Tn1546 (10,851 bp). Deletionen bezeichnen einen neuen Subtyp (z. B. A1, A2) eines Ursprungstyps (A); Insertionen von DNS begründen einen neuen Typ (z. B. B, C). Unabhängig davon kann z. B. Typ A der Vorläufer für die Typen B und C als auch für A1 A5 sein, aber Typ A1 kann aufgrund der Deletion von orf1 nicht der Vorläufer vom Typ C sein. vany (Typ A5) bezeichnet eine Insertion von IS1216V an das 3 -Ende der kodierenden Region von vany (237). Die Sequenztypen in den Kästchen rechts neben der Abbildung zeigen das Auftreten der vana-clustertypen in den jeweiligen STs. Die Gencluster sind nicht maßstabsgerecht dargestellt. Legende Jahr: Jahr der Isolation; Herkunft: Code für Verschlüsselung des Krankenhauses/der Stadt; esp and hyl: PCR-Ergebnisse für die esp- und hyl-gene; Gruppe: Gruppeneinteilung I bis III, s. Text. als erfolgreiche Therapievarianten, bleiben aber jeweils nur für den Einzelfall dokumentiert [202, 203]. Meist stellen moderne Reserveantibiotika die einzige Alternative dar. Hierzu gehören derzeit in erster Linie Quinupristin/Dalfopristin, Linezolid, Tigecyclin und Daptomycin. Die Erfahrungen mit diesen Substanzen sind unterschiedlich, ihre Dokumentation zu unsystematisch, um klare Schlüsse zu ziehen. Quinupristin/Dalfopristin hatte bis zur Einführung neuerer Antibiotika wie Linezolid und Tigecyclin, einen hohen Stellenwert [13, 30, 203, 204]. Zu beachten ist die natürliche Resistenz von E. faecalis gegen die Streptogramin-Kombination. Eine sichere Speziesdiagnose ist daher notwendig. Erworbene Resistenzen bei E. faecium waren bereits vor Einführung von Quinupristin/Dalfopristin bekannt [205, 206], nosokomiale Ausbreitung von Quinupristin/Dalfopristin-resistenten Stämmen ist ebenso beschrieben [152, 207], eine Bestätigung der Erregerempfindlichkeit ist daher in jedem Fall notwendig. Zunehmende Bedeutung hat Linezolid erlangt, ein vollsynthetisches Antibiotikum einer neuen Antibiotika-Klasse, der Oxazolidinone. Leider mussten auch hier bereits kurz nach Einführung Resistenzen dokumentiert werden [ ], deren Prävalenz ist jedoch vielerorts noch niedrig. Linezolid-Resistenz resultiert aus Mutationen im Loop V der 23S rrns und wird meist unter Linezolid-Therapie selektiert [ ]. Es wurden nosokomiale Ausbrüche mit Linezolid-resistenten Enterokokken beschrieben [216]. Eine schnelle Resistenzentwicklung scheint in Einzelfällen möglich [217], da Resistenzmutationen spontan entstehen und ohne Selektionsdruck verbleiben können [218, 219]. Erst kurze Zeit steht Tigecyclin, ein Glycylcyclin, als therapeutische Alternative zur Verfügung [220]. Als Derivat des Tetracyclins ist es trotzdem aktiv gegen Tetracyclin-resistente Isolate [221], mit der Ausnahme spezifischer Effluxpumpen in Acinetobacter und einer tet(x)-kodierten Monooxygenase, die Resistenz gegen Tetracycline und Tigecyclin vermitteln können [222, 223]. Dies beeinflusst aber nicht die Empfindlichkeit bei Enterokokken [221]. Kürzlich wurde das erste Tigecyclin-resistente Enterococcus-Isolat von einer intensiv-medizinisch gepflegten Patientin aus Deutschland isoliert [224]. Als weiteres, neues Antibiotikum steht Daptomycin zur Verfügung. Seine Invitro-Wirksamkeit gegen Enterokokken ist dokumentiert [225, 226]. Zur Wirksamkeit in vivo sind die wenigen Daten kontrovers [227, 228]. Unempfindlichkeit gegen Daptomycin bei Enterokokken ist in Einzelfällen nachgewiesen worden [229, 230]. In unterschiedlichen Phasen klinischer Prüfungen befinden sich derzeit weitere Substanzen, darunter Glykolipopeptide mit unterschiedlicher Aktivität gegen VRE je nach Resistenzmechanismus (Oritavancin, Telavancin, Dalbavancin; [231, 232]), Cephalosporine mit Aktivität gegen Enterokokken (E. faecalis) einschließlich VRE (Ceftobiprol; [233]), neuere Oxazolidinone [234] und weitere Substanzen [235, 236]. Sie mögen in Zukunft durchaus Bedeutung bei der Behandlung von Infektionen mit VRE erlangen. Vancomycin-resistant enterococci Enterococcus faecalis and E. faecium are important hospital-acquired pathogens representing the third- to fourth-most prevalent nosocomial pathogen worldwide. Acquired antibiotic resistances, for instance, against penicillin/ampicillin, aminoglycosides (high-level) and glycopeptides are reported in increasing numbers and limit the therapeutic spectrum significantly. Especially E. faecium shows a tendency to multiple resistances. Acquired resistance to glycopeptides is mediated via different mechanisms, the so-called VanA but also the VanB resistance phenotypes are the most prevalent in Central Europe including Germany. The reservoir of the transferable vana-type resistance in- and outside human medicine is in E. faecium. Increasing rates of VRE in many European countries including Germany are almost exclusively associated with increasing rates of VR- E. faecium (VREF). Vancomycin- and/or ampicillin-resistant E. faecalis are still rare. E. faecium isolates clustered to a distinct clonal complex called CC17 based on MLST typing show an enhanced capacity to disseminate among the nosocomial setting. Those epidemic, hospital-adapted strains are mostly ampicillin-resistant, partly high-level fluoroquinolone-resistant and often possess specific virulence traits such as a gene for an enterococcal surface protein, esp, and/or a putative hyaluronidase gene, hyl Efm. The acquisition of vancomycin resistance, however, is not a prerequisite for a successful spread among the hospital setting. Different from the situation in the beginning of the 1990ies, epidemic, (still) vancomycin-susceptible strains of the clonal complex CC17 disseminated among many hospitals and European countries. They appear already hospital-adapted and are capable of acquiring determinants for vancomycin resistance via horizontal gene transfer and only then become a clinical problem. The reasons for an increased prevalence of VRE among German hospitals since 2003 are not known in detail and might be rather complex. Investigating a representative strain collection of German hospital VREF from 2004 to 2006 showed results describing two scenarios that could have caused increasing rates of VREF among German hospital patients since 2003: (a) clonal spread of VREF among different hospitals of various federal states and (b) horizontal gene transfer of vana gene clusters among different clonal types in oligo- or polyclonal outbreaks. Colonization of the human intestinal tract with (hospital-adapted) VRE during a hospital stay often precedes a subsequent VRE infection. Therefore VRE screening appears as an appropriate tool of both infection prevention and infection control in case of outbreaks. New genotypic tests seem to be more sensitive than classical phenotypic assays but have some limitations. Therapeutic alternatives to treat VRE infections are mostly limited to antibiotics of last resort (quinupristin/dalfopristin, linezolid, tigecycline, daptomycin); however, resistances to these drugs have already been reported in enterococci. Keywords: Enterococcus faecium/faecalis, vana, vanb, CC17 Literatur Im Internet unter > Inhalt > Heft Chemotherapie Journal 17. Jahrgang Heft
Vancomycin-resistente Enterokokken ein Problem in Deutschland? Guido Werner, Robert Koch Institut Wernigerode PEG Tagung 2008, Bonn,
 Vancomycinresistente Enterokokken ein Problem in Deutschland? Guido Werner, Robert Koch Institut Wernigerode PEG Tagung 2008, Bonn, 9. 11.10.08 Enterokokken / VRE Intestinale Besiedler in Mensch und Tier
Vancomycinresistente Enterokokken ein Problem in Deutschland? Guido Werner, Robert Koch Institut Wernigerode PEG Tagung 2008, Bonn, 9. 11.10.08 Enterokokken / VRE Intestinale Besiedler in Mensch und Tier
Einleitung 1.1 Geschichte, Namensgebung und Taxonomie der Enterokokken
 Einleitung 1.1 Geschichte, Namensgebung und Taxonomie der Enterokokken Die Einführung des Genus Enterococcus erfolgte 1984 durch Schleifer und Kilpper-Balz 1. Der Name setzt sich aus den griechischen Wörtern
Einleitung 1.1 Geschichte, Namensgebung und Taxonomie der Enterokokken Die Einführung des Genus Enterococcus erfolgte 1984 durch Schleifer und Kilpper-Balz 1. Der Name setzt sich aus den griechischen Wörtern
Zur MRSA-Situation in Deutschland im Jahr 2004: Bericht aus dem Nationalen Referenzzentrum für Staphylokokken
 376 Robert Koch-Institut Epidemiologisches Bulletin Nr. 41 14. Oktober 2005 Zur MRSA-Situation in Deutschland im Jahr 2004: Bericht aus dem Nationalen Referenzzentrum für Staphylokokken Die nachstehend
376 Robert Koch-Institut Epidemiologisches Bulletin Nr. 41 14. Oktober 2005 Zur MRSA-Situation in Deutschland im Jahr 2004: Bericht aus dem Nationalen Referenzzentrum für Staphylokokken Die nachstehend
Umgang mit multiresistenten Erregern (MRE) aus der Sicht des Mikrobiologischen Labor. Dr. med. Arno Köster
 Umgang mit multiresistenten Erregern (MRE) aus der Sicht des Mikrobiologischen Labor Dr. med. Arno Köster Definition Multiresistenz (MRE) ICD-10-GM Version 2010 U81! Bakterien mit Multiresistenz gegen
Umgang mit multiresistenten Erregern (MRE) aus der Sicht des Mikrobiologischen Labor Dr. med. Arno Köster Definition Multiresistenz (MRE) ICD-10-GM Version 2010 U81! Bakterien mit Multiresistenz gegen
ESBL und VRE berühmt und berüchtigt. Carola Schönborn Fachkrankenschwester für f r Hygiene, Charité
 ESBL und VRE berühmt und berüchtigt Carola Schönborn Fachkrankenschwester für f r Hygiene, Charité Walk of Fame der MRE ESBL VRE Was ist ESBL? Extended Spectrum ß-Lactamasen Betrifft nur gramnegative Bakterien,
ESBL und VRE berühmt und berüchtigt Carola Schönborn Fachkrankenschwester für f r Hygiene, Charité Walk of Fame der MRE ESBL VRE Was ist ESBL? Extended Spectrum ß-Lactamasen Betrifft nur gramnegative Bakterien,
Grundkurs Hygienebeauftragte Ärzte - VRE -
 Grundkurs Hygienebeauftragte Ärzte - VRE - 27.07.2016 INFEKTIONSPRÄVENTION UND KRANKENHAUSHYGIENE Zentrale Einrichtung des Universitätsklinikums Freiburg PROGNOSE MRE-ENTWICKLUNG Courtesy of: Prof. Dr.
Grundkurs Hygienebeauftragte Ärzte - VRE - 27.07.2016 INFEKTIONSPRÄVENTION UND KRANKENHAUSHYGIENE Zentrale Einrichtung des Universitätsklinikums Freiburg PROGNOSE MRE-ENTWICKLUNG Courtesy of: Prof. Dr.
Resistenzen bei gram-positiven Bakterien gegen Linezolid, Tigecyclin und Daptomycin
 Resistenzen bei gram-positiven Bakterien gegen Linezolid, Tigecyclin und Daptomycin G. Werner, F. Layer, B. Strommenger, C. Cuny, S. Fiedler, J. Bender, I. Klare Nationales Referenzzentrum für Staphylokokken
Resistenzen bei gram-positiven Bakterien gegen Linezolid, Tigecyclin und Daptomycin G. Werner, F. Layer, B. Strommenger, C. Cuny, S. Fiedler, J. Bender, I. Klare Nationales Referenzzentrum für Staphylokokken
Aktuelles zu Vancomycin-resistenten Enterokokken (VRE)
 Aktuelles zu Vancomycin-resistenten Enterokokken (VRE) Dr. Ingo Klare FG Nosokomiale Infektionserreger und Antibiotikaresistenzen Abt. Infektionskrankheiten Robert Koch-Institut, Bereich Wernigerode 30.
Aktuelles zu Vancomycin-resistenten Enterokokken (VRE) Dr. Ingo Klare FG Nosokomiale Infektionserreger und Antibiotikaresistenzen Abt. Infektionskrankheiten Robert Koch-Institut, Bereich Wernigerode 30.
49. Fortbildungsveranstaltung für Hals-Nasen- Ohrenärzte
 Multiresistente Keime: Mikrobiologie, Hygiene Autor: Prof. Dr. med. Wolfgang Pfister, Universitätsklinikum Jena, Institut für Medizinische Mikrobiologie, Erlanger Allee 101, 07747 Jena, E-Mail: Wolfgang.Pfister@med.uni-jena.de
Multiresistente Keime: Mikrobiologie, Hygiene Autor: Prof. Dr. med. Wolfgang Pfister, Universitätsklinikum Jena, Institut für Medizinische Mikrobiologie, Erlanger Allee 101, 07747 Jena, E-Mail: Wolfgang.Pfister@med.uni-jena.de
Multiresistente Gram-negative Bakterien (MRGN) Problemkeime des 21. Jahrhunderts
 Multiresistente Gram-negative Bakterien (MRGN) Problemkeime des 21. Jahrhunderts Prävention der Ausbreitung Präzise und rasche Diagnostik Konsequente Infektionskontrolle Rationaler Antibiotika- Einsatz
Multiresistente Gram-negative Bakterien (MRGN) Problemkeime des 21. Jahrhunderts Prävention der Ausbreitung Präzise und rasche Diagnostik Konsequente Infektionskontrolle Rationaler Antibiotika- Einsatz
Therapeutische Optionen bei Multiresistenten Erregern. OA Dr. Michael Siemann Zentrallabor Städtisches Krankenhaus Kiel
 Therapeutische Optionen bei Multiresistenten Erregern OA Dr. Michael Siemann Zentrallabor Städtisches Krankenhaus Kiel Themen Multiresistente Erreger MRSA MRGN VRE Therapeutische Optionen MRE-Netzwerk
Therapeutische Optionen bei Multiresistenten Erregern OA Dr. Michael Siemann Zentrallabor Städtisches Krankenhaus Kiel Themen Multiresistente Erreger MRSA MRGN VRE Therapeutische Optionen MRE-Netzwerk
Winterschool Obergurgl. Molekulare Typisierung CF-relevanter Erreger
 Winterschool Obergurgl Molekulare Typisierung CF-relevanter Erreger Barbara C. Kahl Institut für Medizinische Mikrobiologie Universitätsklinikum Münster Warum Typisierung? Individueller Patient Persistierende
Winterschool Obergurgl Molekulare Typisierung CF-relevanter Erreger Barbara C. Kahl Institut für Medizinische Mikrobiologie Universitätsklinikum Münster Warum Typisierung? Individueller Patient Persistierende
Neue Wege zur Reduktion der Antibiotikaverordnung bei Atemwegsinfektionen.
 Neue Wege zur Reduktion der Antibiotikaverordnung bei Atemwegsinfektionen. Epidemiologie der antimikrobiellen Resistenzen in Deutschland und Europa Miriam Wiese-Posselt Institut für Hygiene und Umweltmedizin
Neue Wege zur Reduktion der Antibiotikaverordnung bei Atemwegsinfektionen. Epidemiologie der antimikrobiellen Resistenzen in Deutschland und Europa Miriam Wiese-Posselt Institut für Hygiene und Umweltmedizin
Epidemiologische Analyse von S. Infantis-Isolaten aus Mensch, Tier sowie Lebensmitteln
 Epidemiologische Analyse von S Infantis-Isolaten aus Mensch, Tier sowie Lebensmitteln 50 Arbeitstagung des Arbeitsgebietes Lebensmittelhygiene der DVG 300909, Garmisch-Partenkirchen Tatjana Miller Salmonella
Epidemiologische Analyse von S Infantis-Isolaten aus Mensch, Tier sowie Lebensmitteln 50 Arbeitstagung des Arbeitsgebietes Lebensmittelhygiene der DVG 300909, Garmisch-Partenkirchen Tatjana Miller Salmonella
Antibiotikaresistenz und multiresistente Erreger
 Institut für medizinische Mikrobiologie Antibiotikaresistenz und multiresistente Erreger Seminar für Studierende der Humanmedizin SS2017 Steffen Höring Themenübersicht Seminar 1. Molekulare Resistenzmechanismen
Institut für medizinische Mikrobiologie Antibiotikaresistenz und multiresistente Erreger Seminar für Studierende der Humanmedizin SS2017 Steffen Höring Themenübersicht Seminar 1. Molekulare Resistenzmechanismen
Krankenkassen und Hygiene
 Krankenkassen und Hygiene Symposium Get your disinfection Auftakt-Veranstaltung zur Kampagne Händedesinfektion 2008 20. Februar 2008 in Essen Herausforderungen bei der Hygiene These 1 Problemfelder und/oder
Krankenkassen und Hygiene Symposium Get your disinfection Auftakt-Veranstaltung zur Kampagne Händedesinfektion 2008 20. Februar 2008 in Essen Herausforderungen bei der Hygiene These 1 Problemfelder und/oder
MRE AK Krankenhäuser Punktprävalenz-Untersuchung MRE Netzwerk Metropolregion Rhein-Neckar
 MRE AK Krankenhäuser Punktprävalenz-Untersuchung MRE Netzwerk Metropolregion Rhein-Neckar Warum sind wir hier? Wir möchten Ihnen eine Untersuchung vorstellen, die zeigt dass die Zahl der von multiresistenten
MRE AK Krankenhäuser Punktprävalenz-Untersuchung MRE Netzwerk Metropolregion Rhein-Neckar Warum sind wir hier? Wir möchten Ihnen eine Untersuchung vorstellen, die zeigt dass die Zahl der von multiresistenten
Multiresistente Erreger und Antibiotikaresistenzen
 Rationaler Antibiotikaeinsatz durch Information und Kommunikation Multiresistente Erreger und Antibiotikaresistenzen Professor Petra Gastmeier Dr. med. Tobias Kramer Dr. med. Florian Salm Institut für
Rationaler Antibiotikaeinsatz durch Information und Kommunikation Multiresistente Erreger und Antibiotikaresistenzen Professor Petra Gastmeier Dr. med. Tobias Kramer Dr. med. Florian Salm Institut für
Bedeutung von Kreuzresistenz und Mehrfachresistenz bei bakteriellen Erregern für die Initialtherapie Michael Kresken. 21./22. März 2016, Königswinter
 Bad Honnef-Symposium 2016 Paul-Ehrlich-Gesellschaft für Chemotherapie e. V. Empfehlungen zur kalkulierten Initialtherapie bakterieller Erkrankungen bei Erwachsenen 21./22. März 2016, Königswinter Bedeutung
Bad Honnef-Symposium 2016 Paul-Ehrlich-Gesellschaft für Chemotherapie e. V. Empfehlungen zur kalkulierten Initialtherapie bakterieller Erkrankungen bei Erwachsenen 21./22. März 2016, Königswinter Bedeutung
Multiresistenz sind wir noch zu retten?
 Multiresistenz sind wir noch zu retten? Dr. med. Béatrice Grabein Max von Pettenkofer-Institut für Hygiene und Medizinische Mikrobiologie Außenstelle Großhadern Béatrice Grabein Aktuelle Situation Resistenz-Entwicklung
Multiresistenz sind wir noch zu retten? Dr. med. Béatrice Grabein Max von Pettenkofer-Institut für Hygiene und Medizinische Mikrobiologie Außenstelle Großhadern Béatrice Grabein Aktuelle Situation Resistenz-Entwicklung
ESBL, AmpC & Co. Beta-Lactamasen in Enterobacteriaceae
 Antibiotikaresistenz Gram-negativer nosokomialer Infektionserreger ESBL, AmpC & Co. Beta-Lactamasen in Enterobacteriaceae Yvonne Pfeifer Bad Honnef Symposium 2008 Enterobakterien (Enterobacteriaceae) als
Antibiotikaresistenz Gram-negativer nosokomialer Infektionserreger ESBL, AmpC & Co. Beta-Lactamasen in Enterobacteriaceae Yvonne Pfeifer Bad Honnef Symposium 2008 Enterobakterien (Enterobacteriaceae) als
Fallbeispiele aus dem Alltag zur MRE Prävention. Dr. Giuseppe Valenza
 Fallbeispiele aus dem Alltag zur MRE Prävention Dr. Giuseppe Valenza Fallbeispiel 1: Management eines 4MRGN-Ausbruchsgeschehens Fallbeispiel 2: MRE, Screening und Sanierung www.lgl.bayern.de Deggendorfer
Fallbeispiele aus dem Alltag zur MRE Prävention Dr. Giuseppe Valenza Fallbeispiel 1: Management eines 4MRGN-Ausbruchsgeschehens Fallbeispiel 2: MRE, Screening und Sanierung www.lgl.bayern.de Deggendorfer
Vom multisensiblen Keim zur Resistenz
 Vom multisensiblen Keim zur Resistenz Dr. med. Béatrice Grabein Klinische Mikrobiologie und Krankenhaushygiene Klinikum der Universität München Die Erdgeschichte als ein Tag betrachtet 5:00Uhr Geburtsstunde
Vom multisensiblen Keim zur Resistenz Dr. med. Béatrice Grabein Klinische Mikrobiologie und Krankenhaushygiene Klinikum der Universität München Die Erdgeschichte als ein Tag betrachtet 5:00Uhr Geburtsstunde
ANTIBIOTIKATHERAPIE BEI IMPLANTATERHALTUNGSVERSUCH
 CAMPUS GROSSHADERN CAMPUS INNENSTADT ANTIBIOTIKATHERAPIE BEI IMPLANTATERHALTUNGSVERSUCH Dr. Béatrice Grabein Stabsstelle Klinische Mikrobiologie und Krankenhaushygiene WANN KOMMT EIN IMPLANTATERHALTUNGSVERSUCH
CAMPUS GROSSHADERN CAMPUS INNENSTADT ANTIBIOTIKATHERAPIE BEI IMPLANTATERHALTUNGSVERSUCH Dr. Béatrice Grabein Stabsstelle Klinische Mikrobiologie und Krankenhaushygiene WANN KOMMT EIN IMPLANTATERHALTUNGSVERSUCH
VanABC plus. GENSPEED VanABC plus. Molekularbiologischer Multiplex- Assay für maximale Information.
 VanABC plus GENSPEED VanABC plus Molekularbiologischer Multiplex- Assay für maximale Information www.genspeed-biotech.com Vancomycin Resistenz? VanABC plus für alle relevanten Parameter GENSPEED VanABC
VanABC plus GENSPEED VanABC plus Molekularbiologischer Multiplex- Assay für maximale Information www.genspeed-biotech.com Vancomycin Resistenz? VanABC plus für alle relevanten Parameter GENSPEED VanABC
Nosokomiale Infektionen
 Definitionen Nosokomiale Infektion Infektion, die bei Aufnahme ins Krankenhaus weder vorhanden noch in Inkubation war Healthcare-associated Infektionen werden nicht nur im Krankenhaus, sondern auch außerhalb
Definitionen Nosokomiale Infektion Infektion, die bei Aufnahme ins Krankenhaus weder vorhanden noch in Inkubation war Healthcare-associated Infektionen werden nicht nur im Krankenhaus, sondern auch außerhalb
Die Bedeutung der Pneumokokken-Resistenz bei ambulant erworbenen Pneumonie
 Die Bedeutung der Pneumokokken-Resistenz bei ambulant erworbenen Pneumonie Ralf René Reinert, ark van der Linden Nationales Referenzzentrum für Streptokokken (NRZS) www.pneumococcus.de Anzahl der Einsendungen
Die Bedeutung der Pneumokokken-Resistenz bei ambulant erworbenen Pneumonie Ralf René Reinert, ark van der Linden Nationales Referenzzentrum für Streptokokken (NRZS) www.pneumococcus.de Anzahl der Einsendungen
Vancomycin-resistente Enterokokken (VRE) und Clostridium difficile assoziierte Diarrhoe (CDAD)
 Vancomycin-resistente Enterokokken (VRE) und Clostridium difficile assoziierte Diarrhoe (CDAD) 12.02.2014 Dr. med. Nina Wantia Nina.Wantia@tum.de Noch mehr Multi-resistente Keime?? Wie relevant sind eigentlich
Vancomycin-resistente Enterokokken (VRE) und Clostridium difficile assoziierte Diarrhoe (CDAD) 12.02.2014 Dr. med. Nina Wantia Nina.Wantia@tum.de Noch mehr Multi-resistente Keime?? Wie relevant sind eigentlich
Antibiotikaresistenz und Surveillance
 Antibiotikaresistenz und Surveillance Ingo Klare, Wolfgang Witte Robert Koch-Institut, Bereich Wernigerode Klare, I., RKI, Bereich Wernigerode 1 Einführung von Antibiotika und Resistenzentwicklung: Gegenüber
Antibiotikaresistenz und Surveillance Ingo Klare, Wolfgang Witte Robert Koch-Institut, Bereich Wernigerode Klare, I., RKI, Bereich Wernigerode 1 Einführung von Antibiotika und Resistenzentwicklung: Gegenüber
und Linezolid sind mit hohen Tagestherapiekosten verbunden und auch resistente MRSA-Stämme gegen diese Substanzen sind bereits aufgetreten [28,29].
![und Linezolid sind mit hohen Tagestherapiekosten verbunden und auch resistente MRSA-Stämme gegen diese Substanzen sind bereits aufgetreten [28,29]. und Linezolid sind mit hohen Tagestherapiekosten verbunden und auch resistente MRSA-Stämme gegen diese Substanzen sind bereits aufgetreten [28,29].](/thumbs/54/33822289.jpg) 1. EINLEITUNG Methicillin-resistente Stämme der Spezies Staphylococcus aureus (MRSA) wurden erstmals 1961 in Großbritannien beschrieben [1,2]. Das semisynthetische Penicillin Methicillin wurde erst zwei
1. EINLEITUNG Methicillin-resistente Stämme der Spezies Staphylococcus aureus (MRSA) wurden erstmals 1961 in Großbritannien beschrieben [1,2]. Das semisynthetische Penicillin Methicillin wurde erst zwei
Keime sind klein - aber g e m e i n!
 Keime sind klein - aber g e m e i n! 1 A n t i b i o t i k a Wirksamkeit und Spektrum gegen Raffinesse und Resistenz der Keime Laborärztliche Gemeinschaftspraxis LÜBECK Dr. Stengel 2 P e n i c i l l i
Keime sind klein - aber g e m e i n! 1 A n t i b i o t i k a Wirksamkeit und Spektrum gegen Raffinesse und Resistenz der Keime Laborärztliche Gemeinschaftspraxis LÜBECK Dr. Stengel 2 P e n i c i l l i
Multiresistente Erreger
 Multiresistente Erreger MRSA, VRE, ESBL Sept. 2009 1 zeitliches Auftreten der Resistenzen 1960 HA-MRSA Methicillinresistenter Staphylococcus aureus 1993 CA-MRSA 1986 VRE Vancomycinresistanter Enterococcus
Multiresistente Erreger MRSA, VRE, ESBL Sept. 2009 1 zeitliches Auftreten der Resistenzen 1960 HA-MRSA Methicillinresistenter Staphylococcus aureus 1993 CA-MRSA 1986 VRE Vancomycinresistanter Enterococcus
Epidemiologisches Bulletin
 Epidemiologisches Bulletin 8. November 2010 / Nr. 44 aktuelle daten und informationen zu infektionskrankheiten und public health Enterokokken mit Vancomycin-Resistenz in deutschen Kranken häusern 2008/2009
Epidemiologisches Bulletin 8. November 2010 / Nr. 44 aktuelle daten und informationen zu infektionskrankheiten und public health Enterokokken mit Vancomycin-Resistenz in deutschen Kranken häusern 2008/2009
Multiresistente Erreger. Welche sollen es denn diesmal sein? Stäbchen? Kokken? Spiralen?
 Hygiene in der Arztpraxis 3MRGN/4MRGN was ist das nun wieder?? 17.04.2013 Multiresistente Erreger Welche sollen es denn diesmal sein? Stäbchen? Kokken? Spiralen? Multiresistente Erreger Welche sollen
Hygiene in der Arztpraxis 3MRGN/4MRGN was ist das nun wieder?? 17.04.2013 Multiresistente Erreger Welche sollen es denn diesmal sein? Stäbchen? Kokken? Spiralen? Multiresistente Erreger Welche sollen
Medizinisches Versorgungszentrum Dr. Löer Dr. Treder und Kollegen
 Medizinisches Versorgungszentrum Dr. Löer Dr. Treder und Kollegen Dr. med. Uwe Lang Facharzt für f r Medizinische Mikrobiologie, Infektionsepidemiologie und Virologie 1 Umsetzung von EUCAST Grenzwerten
Medizinisches Versorgungszentrum Dr. Löer Dr. Treder und Kollegen Dr. med. Uwe Lang Facharzt für f r Medizinische Mikrobiologie, Infektionsepidemiologie und Virologie 1 Umsetzung von EUCAST Grenzwerten
Multiresistente Keime - Therapie
 Multiresistente Keime - Therapie Dr. med. Christian Lanckohr, EDIC ABS-Experte (DGI) Klinik für Anästhesiologie, operative Intensivmedizin und Schmerztherapie Ted-Frage 1 Welche Erreger sind Ihrer Ansicht
Multiresistente Keime - Therapie Dr. med. Christian Lanckohr, EDIC ABS-Experte (DGI) Klinik für Anästhesiologie, operative Intensivmedizin und Schmerztherapie Ted-Frage 1 Welche Erreger sind Ihrer Ansicht
ESBL in Altenheimen: Ergebnisse einer LGL-Studie. Dr. Giuseppe Valenza
 ESBL in Altenheimen: Ergebnisse einer LGL-Studie Dr. Giuseppe Valenza MRE-Prävalenz Deutschland MRSA ESBL Prävalenz in der Allgemeinbevölkerung 1,6-3,1% 1 6,3% (E. coli) 2 Prävalenz in Pflegeheim-Bewohnern
ESBL in Altenheimen: Ergebnisse einer LGL-Studie Dr. Giuseppe Valenza MRE-Prävalenz Deutschland MRSA ESBL Prävalenz in der Allgemeinbevölkerung 1,6-3,1% 1 6,3% (E. coli) 2 Prävalenz in Pflegeheim-Bewohnern
Resistenzsituation im Krankenhausbereich -
 2. estagung der PEG Antibiotikaverbrauch und Resistenz Wo steht Deutschland Resistenzsituation im Krankenhausbereich - Datenquellen, Entwicklung und aktuelle Situation Michael Kresken Antiinfectives Intelligence
2. estagung der PEG Antibiotikaverbrauch und Resistenz Wo steht Deutschland Resistenzsituation im Krankenhausbereich - Datenquellen, Entwicklung und aktuelle Situation Michael Kresken Antiinfectives Intelligence
Fachinformation synlab.vet. Multiresistente Erreger. MRS(A), ESBL & Co
 Fachinformation synlab.vet Multiresistente Erreger MRS(A), ESBL & Co Multiresistente Erreger, MRS(A), ESBL & Co Einleitung Ein gravierendes und hochaktuelles Problem ist die Entstehung und Ausbreitung
Fachinformation synlab.vet Multiresistente Erreger MRS(A), ESBL & Co Multiresistente Erreger, MRS(A), ESBL & Co Einleitung Ein gravierendes und hochaktuelles Problem ist die Entstehung und Ausbreitung
AntibiotikaResistenzmechanismen
 AntibiotikaResistenzmechanismen 20. Oktober 2011 Patricia Kahl Charlotte Schäfer Definition: Antimikrobielle Medikamentenresistenz Erworbene Fähigkeit eines Mikroorganismus, der Wirkung einer chemotherapeutisch
AntibiotikaResistenzmechanismen 20. Oktober 2011 Patricia Kahl Charlotte Schäfer Definition: Antimikrobielle Medikamentenresistenz Erworbene Fähigkeit eines Mikroorganismus, der Wirkung einer chemotherapeutisch
Klassifizierung multiresistenter Keime. Dr. Ingrid Heller Sektion für Hygiene und Medizinische Mikrobiologie Hygieneteam LKI
 Klassifizierung multiresistenter Keime Dr. Ingrid Heller Sektion für Hygiene und Medizinische Mikrobiologie Hygieneteam LKI Definition Multiresistenz Mycobacteriumtuberculosis: MDR: Resistenz gegen INH
Klassifizierung multiresistenter Keime Dr. Ingrid Heller Sektion für Hygiene und Medizinische Mikrobiologie Hygieneteam LKI Definition Multiresistenz Mycobacteriumtuberculosis: MDR: Resistenz gegen INH
Multiresistente Erreger, insbesondere ESBL. J. Steinmann Institut für Medizinische Mikrobiologie
 Multiresistente Erreger, insbesondere ESBL J. Steinmann Institut für Medizinische Mikrobiologie Aktuelle Situation Folie 2 Resistenzmechanismen Impermeabilität der äußeren Zellmembran Geringe epidemiolog.
Multiresistente Erreger, insbesondere ESBL J. Steinmann Institut für Medizinische Mikrobiologie Aktuelle Situation Folie 2 Resistenzmechanismen Impermeabilität der äußeren Zellmembran Geringe epidemiolog.
Surveillanceergebnisse von Carbapenemase-bildenden Enterobacteriaceae
 Surveillanceergebnisse von Carbapenemase-bildenden Enterobacteriaceae 4. Kölner Hygienetag 20.01.2014 Christina Weßels Folie 1 20.01.2014 Christina Weßels Folie 2 CRE = Carbapenem-resistente Enterobakteriaceae
Surveillanceergebnisse von Carbapenemase-bildenden Enterobacteriaceae 4. Kölner Hygienetag 20.01.2014 Christina Weßels Folie 1 20.01.2014 Christina Weßels Folie 2 CRE = Carbapenem-resistente Enterobakteriaceae
KLINISCHE MIKROBIOLOGIE UND KRANKENHAUSHYGIENE ANTIBIOTIKATHERAPIE BEI VRE ISOLIERUNG PRO UND CONTRA
 CAMPUS GROSSHADERN CAMPUS INNENSTADT ANTIBIOTIKATHERAPIE BEI VRE ISOLIERUNG PRO UND CONTRA Dr. Béatrice Grabein Stabsstelle Klinische Mikrobiologie und Krankenhaushygiene ENTEROKOKKEN Medizinisch wichtig:
CAMPUS GROSSHADERN CAMPUS INNENSTADT ANTIBIOTIKATHERAPIE BEI VRE ISOLIERUNG PRO UND CONTRA Dr. Béatrice Grabein Stabsstelle Klinische Mikrobiologie und Krankenhaushygiene ENTEROKOKKEN Medizinisch wichtig:
Umgang mit multiresistenten Erregern in heilpädagogischen Einrichtungen. Lebenshilfe Euskirchen,
 Umgang mit multiresistenten Erregern in heilpädagogischen Einrichtungen Lebenshilfe Euskirchen, 18.04.2012 Bakterien im menschlichen Körper Human Microbiome Project In und auf dem menschlichen Körper ca.
Umgang mit multiresistenten Erregern in heilpädagogischen Einrichtungen Lebenshilfe Euskirchen, 18.04.2012 Bakterien im menschlichen Körper Human Microbiome Project In und auf dem menschlichen Körper ca.
Zwischenbericht zur ESPED Studie. Invasive Infektionen durch multiresistente Erreger (MRE) bei Kindern
 Zwischenbericht zur ESPED Studie Invasive Infektionen durch multiresistente Erreger (MRE) bei Kindern Einleitung: Bei Routineabstrichen werden gelegentlich multiresistente bakterielle Infektionserreger
Zwischenbericht zur ESPED Studie Invasive Infektionen durch multiresistente Erreger (MRE) bei Kindern Einleitung: Bei Routineabstrichen werden gelegentlich multiresistente bakterielle Infektionserreger
50. Fortbildungsveranstaltung für Hals-Nasen- Ohrenärzte
 Expertenrunde: Informationen zu aktuellen medizinischen Themen: Evidente Therapie bei Infektionen Antibiotikaeinsatz, Indikationen für antivirale Therapie in der HNO Autor: Prof. Dr. med. Wolfgang Pfister,
Expertenrunde: Informationen zu aktuellen medizinischen Themen: Evidente Therapie bei Infektionen Antibiotikaeinsatz, Indikationen für antivirale Therapie in der HNO Autor: Prof. Dr. med. Wolfgang Pfister,
von Elke Halle Institut für Mikrobiologie und Hygiene, Charité, Berlin
 Brauchen wir ein Referenzlabor für die Resistenztestung? Besser Antiinfektiva-Resistenz von Elke Halle Institut für Mikrobiologie und Hygiene, Charité, Berlin Aufgaben eines Referenzlabors für Antiinfektiva-Resistenz
Brauchen wir ein Referenzlabor für die Resistenztestung? Besser Antiinfektiva-Resistenz von Elke Halle Institut für Mikrobiologie und Hygiene, Charité, Berlin Aufgaben eines Referenzlabors für Antiinfektiva-Resistenz
MRE außerhalb des Krankenhauses: wer übernimmt die Verantwortung. Constanze Wendt Hygiene-Institut Heidelberg
 MRE außerhalb des Krankenhauses: wer übernimmt die Verantwortung Constanze Wendt Hygiene-Institut Heidelberg Ärztliche Versorgung Die ärztliche Grundversorgung im ambulanten Bereich wird durch den Hausarzt
MRE außerhalb des Krankenhauses: wer übernimmt die Verantwortung Constanze Wendt Hygiene-Institut Heidelberg Ärztliche Versorgung Die ärztliche Grundversorgung im ambulanten Bereich wird durch den Hausarzt
Vancomycin-resistente Enterokokken (VRE)
 Bundesgesundheitsbl 2012 55:1387 1400 DOI 10.1007/s00103-012-1564-6 Online publiziert: 21. Oktober 2012 Springer-Verlag 2012 I. Klare 1 W. Witte 1 C. Wendt 2 G. Werner 1 1 Nationales Referenzzentrum für
Bundesgesundheitsbl 2012 55:1387 1400 DOI 10.1007/s00103-012-1564-6 Online publiziert: 21. Oktober 2012 Springer-Verlag 2012 I. Klare 1 W. Witte 1 C. Wendt 2 G. Werner 1 1 Nationales Referenzzentrum für
Novellierung IFSG 2011
 Novellierung IFSG 2011 23 (1) Beim Robert Koch-Institut wird eine Kommission für Krankenhaushygiene und Infektionsprävention eingerichtet. Die Kommission erstellt Empfehlungen zur Prävention nosokomialer
Novellierung IFSG 2011 23 (1) Beim Robert Koch-Institut wird eine Kommission für Krankenhaushygiene und Infektionsprävention eingerichtet. Die Kommission erstellt Empfehlungen zur Prävention nosokomialer
GENSPEED HAI Portfolio
 HAI Portfolio GENSPEED HAI Portfolio Testpanel zum molekularen Nachweis von Krankenhauskeimen www.genspeed-biotech.com MRSA? ü Ein Test ü 2 Gene GENSPEED MRSA Testsystem Detektion der Varianten meca und
HAI Portfolio GENSPEED HAI Portfolio Testpanel zum molekularen Nachweis von Krankenhauskeimen www.genspeed-biotech.com MRSA? ü Ein Test ü 2 Gene GENSPEED MRSA Testsystem Detektion der Varianten meca und
Monitoring von Resistenzen in der Humanmedizin. Tim Eckmanns Robert Koch-Institut
 Monitoring von Resistenzen in der Humanmedizin Tim Eckmanns Robert Koch-Institut Unterschied Monitoring und Surveillance von Antibiotikaresistenzdaten Another task of epidemiology is monitoring or surveillance
Monitoring von Resistenzen in der Humanmedizin Tim Eckmanns Robert Koch-Institut Unterschied Monitoring und Surveillance von Antibiotikaresistenzdaten Another task of epidemiology is monitoring or surveillance
RESET-Verbund epidemiologische und bakteriologische Kooperation zur Bewertung ESBL-resistenter Bakterien in Deutschland
 gefördert durch RESET-Verbund epidemiologische und bakteriologische Kooperation zur Bewertung ESBL-resistenter Bakterien in Deutschland Aufbau und Ziele von RESET, Tierärztliche Hochschule Hannover Hypothesen
gefördert durch RESET-Verbund epidemiologische und bakteriologische Kooperation zur Bewertung ESBL-resistenter Bakterien in Deutschland Aufbau und Ziele von RESET, Tierärztliche Hochschule Hannover Hypothesen
MRSA Schluss mit Mythen
 Stefan Borgmann MRSA Schluss mit Mythen Klinikum Ingolstadt Neue MRSA Antibiotika Name Wirkort Indikation Keine Indikation Nebenwirkungen Kontraindikation Dosierung Kosten / Tag Ceftarolin (Zinforo) (Teflaro)
Stefan Borgmann MRSA Schluss mit Mythen Klinikum Ingolstadt Neue MRSA Antibiotika Name Wirkort Indikation Keine Indikation Nebenwirkungen Kontraindikation Dosierung Kosten / Tag Ceftarolin (Zinforo) (Teflaro)
Hygienemaßnahmen bei multiresistenten Erregern
 Hygienemaßnahmen bei multiresistenten Erregern Elisabeth Meyer Institut für Hygiene und Umweltmedizin Charité - Universitätsmedizin Berlin Überblick Definition & Epidemiologie Entstehung Übertragung Änderungen
Hygienemaßnahmen bei multiresistenten Erregern Elisabeth Meyer Institut für Hygiene und Umweltmedizin Charité - Universitätsmedizin Berlin Überblick Definition & Epidemiologie Entstehung Übertragung Änderungen
MRSA. (Methicillin-resistenter Staphylococcus aureus)
 MRSA (Methicillin-resistenter Staphylococcus aureus) Gemeinsam auf Nummer sicher Liebe Patientin, lieber Patient, herzlich willkommen in der Fachklinik 360 Die Klinik für Orthopädie und Rheumatologie der
MRSA (Methicillin-resistenter Staphylococcus aureus) Gemeinsam auf Nummer sicher Liebe Patientin, lieber Patient, herzlich willkommen in der Fachklinik 360 Die Klinik für Orthopädie und Rheumatologie der
Situation im Antibiotikaverbrauch und Erregerresistenz in der Humanmedizin
 Interdisziplinäres Symposium Antibiotikaresistenz Vom Wissen zum Handeln 19. / 20. September 2012 - Erlangen Situation im Antibiotikaverbrauch und Erregerresistenz in der Humanmedizin Michael Kresken Paul-Ehrlich-Gesellschaft
Interdisziplinäres Symposium Antibiotikaresistenz Vom Wissen zum Handeln 19. / 20. September 2012 - Erlangen Situation im Antibiotikaverbrauch und Erregerresistenz in der Humanmedizin Michael Kresken Paul-Ehrlich-Gesellschaft
Update multiresistente Erreger Konsequenzen für Mitarbeiter im Krankenhaus und in der Altenpflege
 Update multiresistente Erreger Konsequenzen für Mitarbeiter im Krankenhaus und in der Altenpflege Dr. med. Stefanie Kampmeier Institut für Hygiene Universitätsklinikum Münster Definition MRE = multiresistente
Update multiresistente Erreger Konsequenzen für Mitarbeiter im Krankenhaus und in der Altenpflege Dr. med. Stefanie Kampmeier Institut für Hygiene Universitätsklinikum Münster Definition MRE = multiresistente
MRSA in der Arztpraxis
 Eine neue Herausforderung MRSA in der Arztpraxis Übertragung mit den richtigen Massnahmen verhindern Barbara Schöbi Spitalhygiene Spitalregion St.Gallen Rorschach barbara.schoebi@kssg.ch MRSA M R S A ethicillin
Eine neue Herausforderung MRSA in der Arztpraxis Übertragung mit den richtigen Massnahmen verhindern Barbara Schöbi Spitalhygiene Spitalregion St.Gallen Rorschach barbara.schoebi@kssg.ch MRSA M R S A ethicillin
Empirische antibiotische Therapie bei schwerer Sepsis
 MEDIZINISCHE KLINIK TÜBINGEN Empirische antibiotische Therapie bei schwerer Sepsis Infektionsmedizin 2011 Reimer Riessen Internistische Intensivstation Bedeutung einer raschen Antibiotikatherapie Jede
MEDIZINISCHE KLINIK TÜBINGEN Empirische antibiotische Therapie bei schwerer Sepsis Infektionsmedizin 2011 Reimer Riessen Internistische Intensivstation Bedeutung einer raschen Antibiotikatherapie Jede
Antibiotikaresistenz: Carbapenemase-bildende Keime in Nutztierbeständen
 Antibiotikaresistenz: Carbapenemase-bildende Keime in Nutztierbeständen Aktualisierte Mitteilung Nr. 036/2016 des BfR vom 23.12.2016* Carbapeneme sind Antibiotika, die für die Behandlung von Menschen zugelassen
Antibiotikaresistenz: Carbapenemase-bildende Keime in Nutztierbeständen Aktualisierte Mitteilung Nr. 036/2016 des BfR vom 23.12.2016* Carbapeneme sind Antibiotika, die für die Behandlung von Menschen zugelassen
Krankenhaus-Hygiene Aktuell
 Krankenhaus-Hygiene Aktuell Juni 2015 Gundi Heuschen Weltweite Situation Globaler Reiseverkehr: Schnelle Verbreitung weltweit innerhalb weniger Stunden Steigende Infektionsraten Zunehmende Antibiotikaresistenzen
Krankenhaus-Hygiene Aktuell Juni 2015 Gundi Heuschen Weltweite Situation Globaler Reiseverkehr: Schnelle Verbreitung weltweit innerhalb weniger Stunden Steigende Infektionsraten Zunehmende Antibiotikaresistenzen
MRSA (Methicillin-Resistenter- Staphylococcus-Aureus)
 MRSA (Methicillin-Resistenter- Staphylococcus-Aureus) Dr. Bettina Tiemer Staphylococcus aureus grampositive Haufenkokken (Staphylos gr.= Traube) wachsen auf Blutagar gold-gelb gelb (lat. aureum=gold gold)
MRSA (Methicillin-Resistenter- Staphylococcus-Aureus) Dr. Bettina Tiemer Staphylococcus aureus grampositive Haufenkokken (Staphylos gr.= Traube) wachsen auf Blutagar gold-gelb gelb (lat. aureum=gold gold)
Stand der molekularen Resistenzbestimmung - sind die Methoden schon routinetauglich?
 Stand der molekularen Resistenzbestimmung - sind die Methoden schon routinetauglich? Peter Heisig Pharmazeutische Biologie und Mikrobiologie Universität Hamburg PH2008, UniHH 1 Vor- und Nachteile genetischer
Stand der molekularen Resistenzbestimmung - sind die Methoden schon routinetauglich? Peter Heisig Pharmazeutische Biologie und Mikrobiologie Universität Hamburg PH2008, UniHH 1 Vor- und Nachteile genetischer
Bedeutung, Behandlung, Prophylaxe
 ESBL und andere mulitresistente gramnegative Keime Bedeutung, Behandlung, Prophylaxe Dr. Martin Kaase NRZ für gramnegative Krankenhauserreger Ruhr-Universität Bochum martin.kaase@rub.de E. coli Wildtyp
ESBL und andere mulitresistente gramnegative Keime Bedeutung, Behandlung, Prophylaxe Dr. Martin Kaase NRZ für gramnegative Krankenhauserreger Ruhr-Universität Bochum martin.kaase@rub.de E. coli Wildtyp
Hygiene in der Arztpraxis
 Hygiene in der Arztpraxis 3MRGN/4MRGN Gefahr durch multiresistente Erreger? 22.04.2015 Multiresistente Erreger Welche sollen es denn diesmal sein? MRGN = Multiresistente Gramnegative Stäbchen Stäbchen?
Hygiene in der Arztpraxis 3MRGN/4MRGN Gefahr durch multiresistente Erreger? 22.04.2015 Multiresistente Erreger Welche sollen es denn diesmal sein? MRGN = Multiresistente Gramnegative Stäbchen Stäbchen?
Hypothetische Modelle
 Hypothetische Modelle Heutiges Paper Vorgehensweise: Screening nach neuen Mutanten mit neuen Phänotyp Neuer Phänotyp: CPD, NPA- Resistenz (CPD, NPA: Wachstumshemmung durch Inhibierung des Auxin- Transport
Hypothetische Modelle Heutiges Paper Vorgehensweise: Screening nach neuen Mutanten mit neuen Phänotyp Neuer Phänotyp: CPD, NPA- Resistenz (CPD, NPA: Wachstumshemmung durch Inhibierung des Auxin- Transport
Bei Einbeziehung von neun Allelen in den Vergleich ergibt sich eine Mutation in 38 Generationen (350:9); das entspricht ca. 770 Jahren.
 336 DNA Genealogie Das Muster genetischer Variationen im Erbgut einer Person - zu gleichen Teilen von Mutter und Vater ererbt - definiert seine genetische Identität unveränderlich. Neben seiner Identität
336 DNA Genealogie Das Muster genetischer Variationen im Erbgut einer Person - zu gleichen Teilen von Mutter und Vater ererbt - definiert seine genetische Identität unveränderlich. Neben seiner Identität
MRE / Diagnostik. Was wird im Labor gemacht? Heidrun Kerschner
 MRE / Diagnostik Was wird im Labor gemacht? Heidrun Kerschner Nationales Referenzzentrum für nosokomiale Infektionen und Antibiotikaresistenz Institut für Hygiene, Mikrobiologie und Tropenmedizin Krankenhauses
MRE / Diagnostik Was wird im Labor gemacht? Heidrun Kerschner Nationales Referenzzentrum für nosokomiale Infektionen und Antibiotikaresistenz Institut für Hygiene, Mikrobiologie und Tropenmedizin Krankenhauses
Antibiotikaverbrauch und Resistenzentwicklung auf Intensivstationen in Deutschland und in Europa (SARI, IPSE)
 Antibiotikaverbrauch und Resistenzentwicklung auf Intensivstationen in Deutschland und in Europa (SARI, IPSE) Dr. Elisabeth Meyer Institut für Umweltmedizin und Krankenhaushygiene Universitätsklinikum
Antibiotikaverbrauch und Resistenzentwicklung auf Intensivstationen in Deutschland und in Europa (SARI, IPSE) Dr. Elisabeth Meyer Institut für Umweltmedizin und Krankenhaushygiene Universitätsklinikum
BactiGuard Infektionsschutz Katheter. ein gewaltiger Schritt in Richtung Infektionskontrolle
 BactiGuard Infektionsschutz Katheter ein gewaltiger Schritt in Richtung Infektionskontrolle Innovationen Exklusivvertrieb bei Menke-Med DIE HERAUSFORDERUNG Infektionen im Krankenhausbereich die vierthäufigste
BactiGuard Infektionsschutz Katheter ein gewaltiger Schritt in Richtung Infektionskontrolle Innovationen Exklusivvertrieb bei Menke-Med DIE HERAUSFORDERUNG Infektionen im Krankenhausbereich die vierthäufigste
UNIVERSITÄTSKLINIKUM HAMBURG-EPPENDORF
 UNIVERSITÄTSKLINIKUM HAMBURG-EPPENDORF Zentrums für Diagnostische Medizin, Institut für Medizinische Mikrobiologie, Virologie und Hygiene Direktor Prof. Dr. M. Aepfelbacher Untersuchung zur Daptomycinresistenz
UNIVERSITÄTSKLINIKUM HAMBURG-EPPENDORF Zentrums für Diagnostische Medizin, Institut für Medizinische Mikrobiologie, Virologie und Hygiene Direktor Prof. Dr. M. Aepfelbacher Untersuchung zur Daptomycinresistenz
Multiresistenz Erfahrungen aus der PEG-Studie
 Multiresistenz Erfahrungen aus der PEG-Studie Bad Honnef- Symposium 2001 Michael Kresken Antiinfectives Intelligence Gesellschaft für klinisch-mikrobiologische Forschung und Kommunikation, Bonn Bad Honnef
Multiresistenz Erfahrungen aus der PEG-Studie Bad Honnef- Symposium 2001 Michael Kresken Antiinfectives Intelligence Gesellschaft für klinisch-mikrobiologische Forschung und Kommunikation, Bonn Bad Honnef
VRE. - Fragen und Antworten - LandesArbeitsgemeinschaft Resistente Erreger LARE BAYERN. Inhaltsverzeichnis
 LandesArbeitsgemeinschaft Resistente Erreger LARE BAYERN VRE - Fragen und Antworten - Inhaltsverzeichnis 1. Allgemeine Einführung/allgemeine Fragen... 2 1.1. Was ist VRE...2 1.2. Wie lange kann man VRE-Träger
LandesArbeitsgemeinschaft Resistente Erreger LARE BAYERN VRE - Fragen und Antworten - Inhaltsverzeichnis 1. Allgemeine Einführung/allgemeine Fragen... 2 1.1. Was ist VRE...2 1.2. Wie lange kann man VRE-Träger
Dosierung parenteraler ß-Laktame: Welche klinischen Vorteile bieten höhere Dosen und die kontinuierliche Infusion?
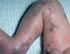 Dosierung parenteraler ß-Laktame: Welche klinischen Vorteile bieten höhere Dosen und die kontinuierliche Infusion? Katja de With Medizinische Universitätsklinik Freiburg Entwicklung antibiotikaresistenter
Dosierung parenteraler ß-Laktame: Welche klinischen Vorteile bieten höhere Dosen und die kontinuierliche Infusion? Katja de With Medizinische Universitätsklinik Freiburg Entwicklung antibiotikaresistenter
48. Fortbildungsveranstaltung für Hals-Nasen- Ohrenärzte
 Multiresistente Keime in der Praxis von Dr. Ute Helke Dobermann Autorin: Dr. Ute Helke Dobermann, Universitätsklinikum Jena, Erlanger Allee 101, 07740 Jena, Helke.Dobermann@med.uni-jena.de Einleitung:
Multiresistente Keime in der Praxis von Dr. Ute Helke Dobermann Autorin: Dr. Ute Helke Dobermann, Universitätsklinikum Jena, Erlanger Allee 101, 07740 Jena, Helke.Dobermann@med.uni-jena.de Einleitung:
Epidemiologie multiresistenter Erreger
 Epidemiologie multiresistenter Erreger Axel Kola Institut für Hygiene und Umweltmedizin Charité Universitätsmedizin Berlin Workshop Infektionsdiagnostik 25. Januar 2012 Immanuel Klinik Rüdersdorf Einfuhr
Epidemiologie multiresistenter Erreger Axel Kola Institut für Hygiene und Umweltmedizin Charité Universitätsmedizin Berlin Workshop Infektionsdiagnostik 25. Januar 2012 Immanuel Klinik Rüdersdorf Einfuhr
Krankenhaushygiene und Infektionsschutz: Gefahren erkennen: Neue Erreger auf dem Vormarsch
 Krankenhaushygiene und Infektionsschutz: Gefahren erkennen: Neue Erreger auf dem Vormarsch Petra Gastmeier Institut für Hygiene und Umweltmedizin, Charité Universitätsmedizin Berlin Die wichtigsten Erreger
Krankenhaushygiene und Infektionsschutz: Gefahren erkennen: Neue Erreger auf dem Vormarsch Petra Gastmeier Institut für Hygiene und Umweltmedizin, Charité Universitätsmedizin Berlin Die wichtigsten Erreger
Klinik und Poliklinik für Mund, Kiefer, Plastische Gesichtschirurgie Direktor: Prof. Dr. Dr. A. Kübler
 Antibiotika in der zahnärztlichen Praxis Urs Müller Richter Wirkgruppen β Lactame (Penicilline, Aminopenicilline, Cephalosporine) β Lactamaseinhibitoren (Clavulansäure Clavulansäure, Sulbactam) Lincosamide
Antibiotika in der zahnärztlichen Praxis Urs Müller Richter Wirkgruppen β Lactame (Penicilline, Aminopenicilline, Cephalosporine) β Lactamaseinhibitoren (Clavulansäure Clavulansäure, Sulbactam) Lincosamide
Gramnegative multiresistente Erreger eine unterschätzte Gefahr
 Gramnegative multiresistente Erreger eine unterschätzte Gefahr Dr. Martin Kaase NRZ für gramnegative Krankenhauserreger Ruhr-Universität Bochum martin.kaase@rub.de E. coli Wildtyp Ampicillin Piperacillin
Gramnegative multiresistente Erreger eine unterschätzte Gefahr Dr. Martin Kaase NRZ für gramnegative Krankenhauserreger Ruhr-Universität Bochum martin.kaase@rub.de E. coli Wildtyp Ampicillin Piperacillin
AGES-Webribo. Systematik in Clostridium difficile PCR-Ribotyping. Alexander Indra
 AGES-Webribo Systematik in Clostridium difficile PCR-Ribotyping Alexander Indra AGES-Institut für medizinische Mikrobiologie und Hygiene Wien Nationale Referenzzentrale für Clostridium difficile Clostridium
AGES-Webribo Systematik in Clostridium difficile PCR-Ribotyping Alexander Indra AGES-Institut für medizinische Mikrobiologie und Hygiene Wien Nationale Referenzzentrale für Clostridium difficile Clostridium
ESBL ESBL. Dies bedeutet eine Resistenz gegenüber Antibiotika! Übersicht. Übersicht. Was genau? Besiedlung / Infektion. Ursachen. Infektion.
 Besiedlung / Extended Spectrum Beta Lactamasen Zu deutsch: Diese Darmbakterien bilden von sich aus ein: extended spectrum = ein erweitertes Spektrum, einen erweiterten Bereich von Beta Lactamasen aus.
Besiedlung / Extended Spectrum Beta Lactamasen Zu deutsch: Diese Darmbakterien bilden von sich aus ein: extended spectrum = ein erweitertes Spektrum, einen erweiterten Bereich von Beta Lactamasen aus.
Zunehmende Gefahren durch resistente Bakterien in Deutschland: 7 Schritte zur Vermeidung unnötiger Antibiotikatherapie
 Zunehmende Gefahren durch resistente Bakterien in Deutschland: 7 Schritte zur Vermeidung unnötiger Antibiotikatherapie Prof. Mathias Herrmann Universitätskliniken des Saarlandes Homburg/Saar Mikrobielle
Zunehmende Gefahren durch resistente Bakterien in Deutschland: 7 Schritte zur Vermeidung unnötiger Antibiotikatherapie Prof. Mathias Herrmann Universitätskliniken des Saarlandes Homburg/Saar Mikrobielle
Kommentar zum Ringversuch B9 Mikrobiologie
 Verein für medizinische Qualitätskontrolle Association pour le contrôle de Qualité medical Associazione per il controllo di qualità medico Kommentar zum Ringversuch B9 Mikrobiologie 2012-3 Probe A: Mittelstrahlurin
Verein für medizinische Qualitätskontrolle Association pour le contrôle de Qualité medical Associazione per il controllo di qualità medico Kommentar zum Ringversuch B9 Mikrobiologie 2012-3 Probe A: Mittelstrahlurin
185. Anpassung der Meldepflichten nach dem Infektionsschutzgesetz (IfSG) durch eine Rechtsverordnung (Aktenzeichen: /05)
 DGGG e.v. Hausvogteiplatz 12 10117 Berlin Referat 323 Gesundheitssicherstellung, Infektionsschutzrecht Bundesministerium für Gesundheit Friedrichstr. 108 10117 Berlin Präsident Prof. Dr. med. Thomas Dimpfl
DGGG e.v. Hausvogteiplatz 12 10117 Berlin Referat 323 Gesundheitssicherstellung, Infektionsschutzrecht Bundesministerium für Gesundheit Friedrichstr. 108 10117 Berlin Präsident Prof. Dr. med. Thomas Dimpfl
MULTIRESISTENTE GRAMPOSITIVE UND GRAMNEGATIVE ERREGER. Dr. O. Janata FA für Infektionskrankheiten Hygieneteam des DSP Wien
 MULTIRESISTENTE GRAMPOSITIVE UND GRAMNEGATIVE ERREGER Dr. O. Janata FA für Infektionskrankheiten Hygieneteam des DSP Wien WARUM SIND ERREGER GEGEN ANTIBIOTIKA RESISTENT? Meropenem as predictive risk
MULTIRESISTENTE GRAMPOSITIVE UND GRAMNEGATIVE ERREGER Dr. O. Janata FA für Infektionskrankheiten Hygieneteam des DSP Wien WARUM SIND ERREGER GEGEN ANTIBIOTIKA RESISTENT? Meropenem as predictive risk
Problemkeime in der niedergelassenen Praxis
 Problemkeime in der niedergelassenen Praxis Prof. Dr. med. Ines Kappstein Krankenhaushygiene Kliniken Südostbayern AG Klinikum Traunstein Cuno-Niggl-Str. 3 83278 Traunstein E-Mail: ines.kappstein@kliniken-sob.de
Problemkeime in der niedergelassenen Praxis Prof. Dr. med. Ines Kappstein Krankenhaushygiene Kliniken Südostbayern AG Klinikum Traunstein Cuno-Niggl-Str. 3 83278 Traunstein E-Mail: ines.kappstein@kliniken-sob.de
Antibiotikatherapie - Grundlagen
 KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Antibiotikatherapie - Grundlagen B. Salzberger Hemmung der Zellwandsynthese: Penicilline, Cephalosporine, Glykopeptid-AB, Fosfomycin Proteinsynthese (Translation)
KLINIK UND POLIKLINIK FÜR INNERE MEDIZIN I Antibiotikatherapie - Grundlagen B. Salzberger Hemmung der Zellwandsynthese: Penicilline, Cephalosporine, Glykopeptid-AB, Fosfomycin Proteinsynthese (Translation)
ESBL PEG Rheinland 2014
 ESBL PEG Rheinland 2014 ESBL = Extended-Spectrum Beta- Laktamase Keime aus der Familie der Enterobakterien (z.b. E. coli, Salmonella, Klebsiella, Enterobacter, Proteus, Shigella, Yersinia u.a.) erzeugen
ESBL PEG Rheinland 2014 ESBL = Extended-Spectrum Beta- Laktamase Keime aus der Familie der Enterobakterien (z.b. E. coli, Salmonella, Klebsiella, Enterobacter, Proteus, Shigella, Yersinia u.a.) erzeugen
Lokalisation bzw. Ort der Probenentnahme Angaben zum Patienten
 ARS - Variablenplan tabellarische Übersicht Merkmalsbereich / Variable Angaben zum Labor Identifier des einsendenden Labors Angaben zum Einsender der Probe Identifier der einsendenden Institution Name
ARS - Variablenplan tabellarische Übersicht Merkmalsbereich / Variable Angaben zum Labor Identifier des einsendenden Labors Angaben zum Einsender der Probe Identifier der einsendenden Institution Name
Antibiotikaresistenz: Interventionen (preharvest- level) Gertraud Schüpbach
 Antibiotikaresistenz: Interventionen (preharvest- level) Gertraud Schüpbach Inhalt des Vortrags Hintergrund Antibiotikaresistenz Mögliche Interventionen Landwirtschaftsbetrieb Tierarztpraxis Lebensmittel
Antibiotikaresistenz: Interventionen (preharvest- level) Gertraud Schüpbach Inhalt des Vortrags Hintergrund Antibiotikaresistenz Mögliche Interventionen Landwirtschaftsbetrieb Tierarztpraxis Lebensmittel
ANTIBIOGRAMME - Interpretationshilfe -
 Institut für Medizinische Mikrobiologie und Hygiene Abteilung: Klinische Diagnostik ANTIBIOGRAMME - Interpretationshilfe - Institut für Medizinische Mikrobiologie und Hygiene Abteilung: Klinische Diagnostik
Institut für Medizinische Mikrobiologie und Hygiene Abteilung: Klinische Diagnostik ANTIBIOGRAMME - Interpretationshilfe - Institut für Medizinische Mikrobiologie und Hygiene Abteilung: Klinische Diagnostik
Vancomycin-resistente Enterokokken (VRE) bei Patienten und in der aquatischen Umwelt
 Vancomycin-resistente Enterokokken (VRE) bei Patienten und in der aquatischen Umwelt D I S S E R T A T I O N zur Erlangung des Grades Doktor der Naturwissenschaften Am Fachbereich Biologie der Johannes
Vancomycin-resistente Enterokokken (VRE) bei Patienten und in der aquatischen Umwelt D I S S E R T A T I O N zur Erlangung des Grades Doktor der Naturwissenschaften Am Fachbereich Biologie der Johannes
HYGIENE. Wo liegt die Grenze zwischen Krankenhaushygiene und Sauberkeit?
 Wo liegt die Grenze zwischen Krankenhaushygiene und Sauberkeit? Tagung des Bundesverbandes Beschwerdemanagement, 07.10.2016 PD Dr. med. Dr. PH Frank Kipp Institut für Hygiene HYGIENE Hygiene ist nach einer
Wo liegt die Grenze zwischen Krankenhaushygiene und Sauberkeit? Tagung des Bundesverbandes Beschwerdemanagement, 07.10.2016 PD Dr. med. Dr. PH Frank Kipp Institut für Hygiene HYGIENE Hygiene ist nach einer
Next Generation Sequencing (NGS): Eine neue Ära in der klinischen Mikrobiologie
 Next Generation Sequencing (NGS): Eine neue Ära in der klinischen Mikrobiologie Trinad Chakraborty Institut für Medizinische Mikrobiologie Deutsches Zentrum für Infektionsforschung Justus-Liebig-Universität
Next Generation Sequencing (NGS): Eine neue Ära in der klinischen Mikrobiologie Trinad Chakraborty Institut für Medizinische Mikrobiologie Deutsches Zentrum für Infektionsforschung Justus-Liebig-Universität
Qualitätssicherung MRSA in Baden- Württemberg: schlank und effizient? Prof. Dr. Constanze Wendt
 Qualitätssicherung MRSA in Baden- Württemberg: schlank und effizient? Prof. Dr. Constanze Wendt Verordnung des Sozialministeriums über die Krankenhaushygiene in Baden-Württemberg (Krankenhaushygieneverordnung
Qualitätssicherung MRSA in Baden- Württemberg: schlank und effizient? Prof. Dr. Constanze Wendt Verordnung des Sozialministeriums über die Krankenhaushygiene in Baden-Württemberg (Krankenhaushygieneverordnung
HELIOS Kliniken. Hygiene bei HELIOS. Information für Patienten, Besucher und Angehörige
 HELIOS Kliniken Hygiene bei HELIOS Information für Patienten, Besucher und Angehörige Liebe Patienten, Angehörige und Besucher, etwa 600.000 Patienten infizieren sich jedes Jahr in deutschen Krankenhäusern
HELIOS Kliniken Hygiene bei HELIOS Information für Patienten, Besucher und Angehörige Liebe Patienten, Angehörige und Besucher, etwa 600.000 Patienten infizieren sich jedes Jahr in deutschen Krankenhäusern
Umgang mit MRSA in der Arztpraxis
 Infomarkt der Kassenärztlichen Vereinigung Berlin 06.04.2011 Umgang mit MRSA in der Arztpraxis Dr. Levke Quabeck Ärztliche Referentin im Ref. Infektionsschutz Senatsverwaltung für Gesundheit, Umwelt und
Infomarkt der Kassenärztlichen Vereinigung Berlin 06.04.2011 Umgang mit MRSA in der Arztpraxis Dr. Levke Quabeck Ärztliche Referentin im Ref. Infektionsschutz Senatsverwaltung für Gesundheit, Umwelt und
