UNGESÄTTIGTE KOHLENWASSERSTOFFE OHLENWASSERSTOFFE Alkene und Alkine 86
|
|
|
- Manuela Meissner
- vor 6 Jahren
- Abrufe
Transkript
1 UNGESÄTTIGTE KOLENWASSERSTOFFE OLENWASSERSTOFFE Alkene und Alkine Modell der Aufenthaltswahrscheinlichkeiten der e - Das Orbitalmodell Unschärferelation Orbitale Vier Regeln zum Orbitalmodell 90 Regel 1: Orbitalformen 90 Regel 2: Pauli-Prinzip 90 Regel 3: und'sche Regel 91 Kästchenschema 91 Regel 4: Energieprinzip Orbitalbesetzungsschema Kovalente Bindung Moleküle ybridisierung: Eine energetische Gleichmacherei sp 3 -ybridisierung sp 2 -ybridisierung sp-ybridisierung Reaktionen der Alkene mit Elektrophilen Kumulierte, konjugierte und isolierte Doppelbindungen Drill&Practice: Alkene Reaktion von Alkenen mit alogenen Elektrophile Additionsreaktion: Reaktionsmechanismus Asymmetrische Elektrophile Addition Drill&Practice: Alkene (E)-(Z)-Isomere Drill&Practice: Alkene Arene (Aromaten) Benzen (Benzol) 104 Derivate 104 Die Bindung im Benzen 105 Strukturansichten von Benzen 106 Beispiele für aromatische Verbindungen TNT 108 Schwarzpulver 108 Nitroglycerin Drill&Practice: Arene Reaktionen der Arene: Elektr. aromat. Subst. (S E ) 110 Energetik: Additionsreaktion oder Substitutionsreaktion? Phenol 113 Saurer harakter von Ethanol und Phenol 113 Elektrophile aromatische Substitution mit Phenol Anilin und Azofarbstoffe Drill&Practice: Arene
2 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Ungesättigte Kohlenwasserstoffe Alkene und Alkine Alkene und Alkine sind ungesättigte Kohlenwasserstoffe mit Doppel- bzw. Dreifachbindungen. Ungesättigt bedeutet, dass Alkene und Alkine gegenüber den Alkanen weniger Wasserstoffatome besitzen. Selbstverständlich haben die Alkene und Alkine ihre eigene Nomenklatur. Von der Systematik ist sie der Nomenklatur der Alkane ähnlich. Die wichtigsten Punkte sind: Der Name erhält bei Alkenen die Endung -en und bei Alkinen die Endung -in. Die Doppel- oder Dreifachbindung muss sich in der längsten Kette befinden. Die Positionszahl wird mitten im Namen verwendetz.b. Pent-2-en. Die Doppelbindung befindet sich hier zwischen 2 und 3. Die Positionszahl der Doppel- oder Dreifachbindung muss möglichst klein sein. andelt es sich um ein Polyen oder ein Polyin (mehrfache Doppel- oder Dreifachbindungen) wird das Zahlwort -a-di, a-tri-, a-tetra-... vor den Ausdruck - en z.b. als -a-trien gesetzt: z.b. Penta-1,3-dien, falsch ist Pent-1,3-dien. Kommen in einer Kette sowohl Doppel- als auch Dreifachbindungen vor, so gilt -en vor -in bzw. alphabetische Ordnung z.b. Pent-3-en-1-in. Alkene Anzahl -Atome Name Molekülformel Strukturformel Anmerkung 2 Ethen (Ethylen) Gasförmiges Ethen wird von vielen Früchten abgegeben und fördert den Reifungsprozess. Propen 3 -= 2 -- But-1-en -- 2 =( 3 )- 3 Edukt für erstellung von Butanol und vielen Kunststoffen Buta-1,3-dien Edukt für Kunststoffe und Kautschuk Isopren = Ausgangsstoff für Kautschuk -- uttoformel Alkene: Bei cyclischen, ungesättigten Kohlenwasserstoffen beginnt die Nummerierung des Rings bei den Kohlenstoffatomen mit Mehrfachbindungen Methyl-cyclooct-1-en
3 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 87 Alkine -Atome Name Molekülformel Strukturformel Anmerkung Ethin (Acetylen) Schweissgas und Grubenlampengas Propin Buta-1,3-diin uttoformel Alkine: Experimentelle Darstellung von Ethen aus Ethanol und Schwefelsäure Eliminierungsreaktion Experimentelle Darstellung von Ethin aus alciumcarbid und Wasser
4 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 88 Aufgabe Zeichnen Sie geometrisch korrekt und zeichnen Sie alle Winkel (109.5, 120, 180 ) ein: a) als σ-bindung und π-bindung, b) als 3D Keilstrichformel, c) als Strichformel Welche Art von ybridisierungen liegt an den -Atomen vor: sp 3, sp 2, sp? Ethan 2 6 Ethen 2 4 Ethin 2 2 Zur Bearbeitung der Aufgabe ist die Kenntnis des Orbitalmodells unerlässlich. Für eine seriöse Behandlung des Themas ist es wichtig, sich (noch einmal?) mit der Theorie der chemischen Bindung nach dem Orbitalmodell auseinanderzusetzen: Was sind σ-bindungen, was π-bindungen? Warum werden π-elektronen bei der Reaktion der Alkene zuerst angegriffen? Wieso sind die Winkel bei Alkinen 180 und bei Alkenen 120? Was ist das Besondere an konjugierten Doppelbindungen? Also hier (noch einmal) die Orbitalmodelltheorie in relativ kurzer Fassung
5 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Modell der Aufenthaltswahrscheinlichkeiten der e - Das Orbitalmodell Welle-Teilchen Dualismus Mit ilfe des Bohr schen Atommodells lassen sich experimentelle Beobachtungen wie Linienspektren gut erklären, nicht aber andere Phänomene wie z.b. die Bildung des 2 Moleküls, an der massgeblich die Elektronen der ülle beteiligt sind. Dazu braucht es ein anderes Modell. Unangenehmerweise ist das Orbitalmodell sehr viel abstrakter als das Bohrmodell, denn wie links dargestellt, wird das Modell aus der Lösung mathematischer Gleichungen (Wellenfunktionen) erzeugt, die ansich relativ komplex sind. Im Bohr schen Atommodell wurde das Elektron als klassisches Teilchen mit Masse ( u = kg) und Ladung behandelt, das auf einer bestimmten Schale eine bestimmte Energie besitzt. Elektronen haben aber auch Eigenschaften einer Welle, wie man das von Wasserwellen her kennt. Treffen Wasserwellen auf einen engen Spalt, so werden dahinter halbkreisförmige Wellen ausgesandt. Die Wellen können sich überlagern und bilden ein Interferenzmuster. Auch Elektronen verhalten sich wie Wellen (Wellennatur des Elektrons, Dualismus von Teilchen und Welle). Wellenverhalten am Spalt Interferenz von Wellen Elektronen, die sich um den Atomkern bewegen, haben den harakter von dreidimensionalen, stehenden Wellen. Diese stehenden Wellen konnten 1926 vom Physiker Erwin Schrödinger mathematisch beschrieben werden. Mit ilfe der sog. Schrödingergleichung wird aus der Wellenfunktion a) die Energie des Elektrons berechnet und b) die Raumkoordinaten bestimmt. Die stehenden Wellen sind die mathematische Beschreibungsgrundlage. Sie sind später nicht als solche im Atom wiederzuerkennen Unschärferelation Von Werner eisenberg wurde 1927 die Unschärferelation formuliert. Von einem Elektron als Teilchen kann prinzipiell nie gleichzeitig der Ort und die Geschwindigkeit exakt bestimmt werden. Will man ein Elektron messen, muss man physikalisch mit ihm interagieren. Das geht nicht ohne Beeinflussung des Elektrons. Das erzeugt die berühmte Unschärfe.
6 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Orbitale Durch die prinzipielle Unexaktheit der Bestimmung von Aufenthaltsort und Geschwindigkeit des Elektrons kann man für den Aufenthaltsort nur eine gewisse Wahrscheinlichkeit angeben (z.b. 90 %), mit der es sich in einem gewissen Raum aufhält. (Aufenthaltswahrscheinlichkeit wird häufig erklärt mit einer Katze, die jede Minute fotografiert wird, ohne den Film weiterzuspulen. Die Katze kann sich im aus frei bewegen. Die höchste Aufenthaltswahrscheinlichkeit der Katze ist am Fressnapf (da sie verfressen ist) und auf ihrem Lieblingskissen (da sie ziemlich faul ist). Man könnte den Fressnapf als positiv geladenen Kern ansehen und die Katze als negativ geladenes Elektron, so dass die Aufenthaltswahrscheinlichkeit eines Elektrons in der Nähe des Kerns am grössten ist.) Das Orbital (Elektronenwolke) beschreibt den Raum, in dem sich ein Elektron mit einer bestimmten Wahrscheinlichkeit aufhält. Das die Bewegung des e - im Vergleich zum Kern äusserst gross ist, kann eine quasi gleichzeitige Anwesenheit des e - im ganzen Orbital angenommen werden. Mathematisch lässt sich die Aufenthaltswahrscheinlichkeit aus der Lösung der Schrödingergleichung (sehr grosser Aufwand) entnehmen. Die Lösung gelingt jedoch nur für die Annahme ganz bestimmter Energiewerte des Elektrons/der Elektronenwelle. Diese Energiewerte sind mit denen des Bohr schen Schalenmodells identisch, d.h. die Schalen des Bohrmodells entsprechen den Aufenthaltswahrscheinlichkeiten im Wellenmodell, nur die Starrheit von Bohrs Modell fehlt Vier Regeln zum Orbitalmodell Regel 1: Orbitalformen Bisher ist wohl der Eindruck entstanden, dass es nur kugelförmige Orbitale gibt. Das ist nicht richtig. Es gibt neben den Kugeln auch keulenförmige, kleeblattförmige und kompliziertere Formen. (Achtung: Ein d-orbital (s.u.) hat 4 Teilräume. Dies wird als ein Orbital gezählt, nicht als vier Orbitale.) Regel 2: Pauli-Prinzip Wie viele Elektronen passen in ein Orbital? In einem Orbital (Energie identisch, Ort identisch) lassen sich höchstens 2 Elektronen unterbringen, die einen unterschiedlichen Spin (Eigendrehimpuls) besitzen müssen. Sie werden mit bezeichnet. (Eigendrehimplus lässt sich folgendermassen bildhaft darstellen: das Elektron dreht sich recht- oder linksrum. Ein Drehwechsel ist problemlos machbar.)
7 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 91 Daraus folgt zwingend, die maximale Anzahl Elektronen pro Orbitaltyp. auptquantenzahl Anzahl Elektronen pro Schale nach Bohr Maximale Elektronenzahl pro Typ s p d f Art der Orbitale pro auptquantenzahl nur s-orbitale s und p Orbitale s, p, d Orbitale spdf Orbitale Das Ganze wird auch gern in Quantenzahlen ausgedrückt. (Zahlen nach Berke) auptquantenzahlen n : 1, 2, 3, Nebenquantenzahlen l : 0 = s-orbital, 1 = p-orbital, 2 = d-orbital, 3 = f-orbital, 4 = g-orbital Magnetische Quantenzahlen: m : 0 = ein s-orbital; -1/0/1 = drei p-orbitale p x /p y /p z, -2/-1/0/1/2 = fünf d-orbit. Spinquantenzahl: s : ½ und -½ Regel 3: und'sche Regel In welcher Reihenfolge werden energetisch gleichwertige Orbitale besetzt? und sche Regel (aufgestellt von Friedrich und) Energetisch gleichwertige Orbitale (z.b. die p-orbitale der auptquantenzahl 2) werden zunächst jeweils mit einem Elektron gleichen Spins besetzt. Kästchenschema Px Py Pz Regel 4: Energieprinzip Px Py Pz falsch Px Py Pz korrekt In welcher Reihenfolge werden energetisch unterschiedliche Orbitale besetzt? Energieprinzip: Die Besetzung der Orbitale erfolgt nach dem Prinzip, dass die energieärmsten Orbitale zuerst besetzt werden Orbitalbesetzungsschema Die Energiestufen der einzelnen Orbitaltypen sehen folgendermassen aus: Die Besetzung der Orbitale erfolgt nach dem Energieprinzip. Das Orbitalbesetzungsschema ist ein kleines ilfsmittel, zur Konstruktion der Besetzung. Sie finden die auptquantenzahlen in Zeilen mit den relevanten Orbitalen. Die 45 Grad Pfeile ergeben die Leserichtung. 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 6f 7s 7p 7d 7f
8 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Kovalente Bindung Moleküle Das Wasserstoffatom besitzt ein Elektron, das gleichzeitig auch das Valenzelektron ist. Durch Überlappung der beteiligten s-orbitale entsteht ein in sich abgeschlossenes Molekül. Die gemeinsame Nutzung der Elektronen führt zu einer Bindung zwischen den Atomen. Bei dieser kovalenten Bindung entsteht aus zwei halb besetzten Valenzorbitalen, die hier mit einem Punkt symbolisiert sind ein gemeinsames Elektronenpaar. Man spricht auch von einem bindenden Elektronenpaar und somit von einer Elektronenpaarbindung bzw. von einer Atombindung. Energie Bei der Entstehung dieser Bindung wird Energie, die sog. Bindungsenergie frei. Da das Prinzip vom Energieminimum gilt, ist der Vorgang des Erreichens des Energieminimums der Grund, warum sich die beiden Atome überhaupt zu einem Molekül verbinden. Reaktion ybridisierung: Eine energetische Gleichmacherei Eine nicht unbedeutende Schwierigkeit ergab sich, als die Kombination von Kohlenstoff und Wasserstoff untersucht wurde. Für die 6 Elektronen des Kohlenstoff gilt die rechts abgebildete Verteilung. Es sind 2 halb besetzte Valenzorbitale zu erkennen: könnte mit 2 Wasserstoffatomen reagieren, was das Molekül 2 ergibt. Energie 2p 2s 1s Ein 2 Molekül lässt sich in der Natur aber nicht finden! ingegen lässt sich im Erdgas das Molekül Methan 4 nachweisen (Erdgas besteht hauptsächlich aus Methan.). Ein weiteres Problem tauchte auf, als die Winkel zwischen den -Atomen physikalisch gemessen wurden. Da die p-orbitale senkrecht aufeinander stehen, müssen auch die -Atome und das einen Winkel von 90 aufweisen. Dieser Winkel wurde jedoch zu bestimmt Diese Schwierigkeiten liessen sich nur mit einer Erweiterung des Orbitalmodells, der ybridisierung lösen. Es gibt keinen Beweis, dass eine ybridisierung tatsächlich stattfindet. Eine ybridisierung wird immer dann angewendet, wenn sie zur Erläuterung eines gewissen Moleküls nötig erscheint: wie hier im Methanbeispiel findet sich anstatt 2 das 4. Ausserdem ist die Geometrie des Moleküls nicht so wie erwartet und wird mit ilfe der ybridisierung erklärt.
9 Ungesättigte Kohlenwasserstoffe SPF SB_A KME sp 3 -ybridisierung Eine ybridisierung ist die Verschmelzung von energetisch unterschiedlichen Orbitalen der Valenzschale. ybridisiert werden können nur energetisch ähnliche Orbitale, also nicht das 1s- mit dem 4p-Orbital. Ob die Orbitale mit Elektronen besetzt sind oder nicht ist völlig unerheblich. Rein formell wird das s-orbital energetisch angehoben und die drei p-orbitale energetisch abgesenkt. Das bedeutet: Ein s- und drei p-orbitale können zu vier sp 3 -ybridorbitalen hybridisieren, die energetisch identisch sind. Energie 1 x s 3 x p 4 x sp 3 ybridorbitale Anmerkung: Bei der Elektronenkonfigurationsschreibweise bedeuteten die hochgestellten Zahlen die Anzahl der Elektronen. Bei dieser Schreibweise hier handelt es sich aber um die Anzahl der Orbitale, die zur ybridisierung verwendet werden: ein s-orbital und drei p-orbitale. Für das Beispiel Kohlenstoff gilt: Auch hier werden ein s-orbital und drei p-orbitale hybridisiert. Die Orbitale gehören zur Valenzschale des Kohlenstoffs. Es handelt sich dabei um die Elektronen der zweiten auptquantenzahl. Das s-orbital der ersten auptquantenzahl bleibt unverändert. Energie 2p 2s 1s 1s 4 Stück sp 3 ybridorbitale ohne ybridisierung mit sp 3 ybridisierung Die Elektronenverteilung hat sich dramatisch verändert: sind es ohne ybridisierung zwei halb besetzte Orbitale, die bei der Reaktion mit Wasserstoff ein 2 ergeben würden, so sind es jetzt 4 halbbesetzte Orbitale. Damit ist das Molekül 4 sehr gut zu erklären. Wie lässt sich der Winkel von erwarteten 90 und gemessenen erklären? Die ybridisierung hat Auswirkungen auf die Geometrie der Orbitale. Aus einem kugelförmigen s- und drei keulenförmigen p-orbitalen entstehen vier gleich grosse Orbitale. Die Form von sp 3 -ybridorbitalen ist luftballonartig. Die Kombination von 4 Luftballons erzeugt keinen Winkel von 90, da die Abstossung relativ gross ist. Abstossung gross
10 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 94 Vielmehr ordnen sich die Orbitale wie 4 Luftballons in einer Form möglichst geringer Abstossung an. Das ist ein Tetraeder, ein Vierfächner, aufgebaut aus vier Dreiecken. Der Winkel zwischen den sp 3 -ybridorbitalen beträgt in der Papierebene Keil-Strich-Formel Die Keil-Strich Schreibweise macht diese Tetraeder-Geometrie sehr schön deutlich. nach hinten hinter die Papierebene nach vorn vor die Papierebene Welche Bedeutung hat das für das Methan? Nach Bindung von 4 Wasserstoffatomen ergibt sich folgendes Bild: 4 Wasserstoffatome können de facto binden. Der -- Winkel ist Damit ist es mit dem Konzept der ybridisierung möglich, die Geometrie und Bindung im Methan, wie aber auch sehr vieler anderer Moleküle, eindeutig und korrekt zu erklären. Bei dieser Bindung handelt es sich um eine σ-bindung, da die Überlappung des s-orbitals eines Wasserstoffs und des sp 3 -ybridorbitals des Kohlenstoffs auf der Kernverbindungslinie Kern Kern liegt. Mit σ-bindungen werden Einfachbindungen erzeugt. Gibt es auch Bindungen, die nicht auf der Kernverbindungslinie liegen? Gibt es auch andere Bindungen ausser der Einfachbindung? Gibt neben der σ-bindung noch andere Bindungen? Ja, denn neben der sp 3 -ybridisierung gibt es noch weitere Möglichkeiten, Orbitale energetisch zu mischen. Immer handelt es sich dabei aber um energetisch nahe beieinander liegende Orbitale.
11 Ungesättigte Kohlenwasserstoffe SPF SB_A KME sp 2 -ybridisierung Bei einer sp 2 -ybridisierung werden ein s- und zwei p-orbitale zu drei sp 2 - ybridorbitalen energetisch angeglichen. Ein p-orbital bleibt unangetastet. Für den Kohlenstoff gilt: Energie 2p 2s 1s 1s p 3 Stück sp 2 ybridorbitale ohne ybridisierung mit sp 2 ybridisierung Die Form der sp 2 -ybridorbitale ist den sp 3 -ybridorbitalen ähnlich. Die geometrische Anordnung ist aber sehr unterschiedlich. Aufgrund der Abstossung zwischen den sp 2 -ybridorbitalen (grau) entsteht ein Bindungswinkel von 120. Das p- Orbital bleibt von Form und Lage unbeeinflusst (weiss). P SP 2 SP 2 SP 2 Das Ethen Molekül Werden 2 Atome und 4 -Atome miteinander gebunden, so geschieht die - Bindung über eine σ-bindung der sp 2 -ybridorbitale (grau, Kernverbindungslinie, s.u.). Aufgrund der Abstossung zwischen den restlichen sp 2 -ybridorbitalen (grau) entsteht ein Bindungswinkel von 120 zu 2 Wasserstoffatomen in einer s-sp 2 σ- Bindung. Da das senkrecht stehende p-orbital auch halb besetzt ist, wird eine sogenannte π-bindungen ausgebildet. Die p-orbitale überlappen sich nicht direkt sondern biegen sich zu einander hin und wenden sich einander zu. π-bindungen liegen somit nicht auf der Kernverbindungslinie, sondern werden durch parallel stehende p-orbitale erzeugt. Es entsteht eine Doppelbindung. π σ π σ Der Aufenthaltsraum der π-elektronen der beiden Kohlenstoffatome liegt sowohl oberhalb als auch unterhalb der Achsenebene der σ-bindung. Es handelt sich hier nicht um zwei π-bindungen sondern um eine π-bindung, die auf 2 Räume veteilt ist. Die Strichformel ist rechts abgedruckt. Man erkennt deutlich die Bindungswinkel.
12 Ungesättigte Kohlenwasserstoffe SPF SB_A KME sp-ybridisierung Bei einer sp-ybridisierung werden ein s- und ein p-orbital zu zwei sp- ybridorbitalen energetisch angeglichen. Die Form ist den sp 3 -ybridorbitale ähnlich. Die geometrische Anordnung ist aber sehr unterschiedlich. Für den Kohlenstoff gilt: Energie 2p 2s 1s 1s 2p 2 Stück sp ybidorbitale ohne ybridisierung mit sp ybridisierung Die geometrische Anordnung der beiden sp-ybridorbitale geschieht wie immer nach dem Prinzip der minimalen Abstossung. Sie stehen in einem Winkel von 180 zueinander. Die p-orbitale bleiben von Form und Lage unbeeinflusst (weiss). SP P P SP Das Ethin Molekül Werden 2 Atome und 2 -Atome miteinander gebunden, so geschieht die - Bindung über eine σ-bindung der sp-ybridorbitale (grau, Kernverbindungslinie, s.u.). Aufgrund der Abstossung zwischen den sp-ybridorbitalen (grau) entsteht ein Bindungswinkel von 180. Da die beiden p-orbitale auch halb besetzt sind, werden hier zwei π-bindungen ausgebildet. Die p-orbitale überlappen sich nicht direkt sondern biegen sich zu einander hin und wenden sich einander zu. π- Bindungen liegen somit nicht auf der Kernverbindungslinie, sondern werden durch parallel stehende p-orbitale erzeugt. Es entsteht eine Dreifachbindung. π π σ π π σ Der Aufenthaltsraum der π-elektronen der beiden Kohlenstoffatome liegt oben/ unten und vorn/hinten zur Achsenebene der σ-bindung. Es handelt sich hier nicht um vier π-bindungen sondern um zwei π-bindungen. Die Strichformel ist rechts abgedruckt. Man erkennt deutlich die Bindungswinkel. Und jetzt zurück zur Zeichnungsaufgabe auf Seite 88.
13 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Reaktionen der Alkene mit Elektrophilen Kumulierte, konjugierte und isolierte Doppelbindungen isolierte Doppelbindungen konjugierte Doppelbindungen kumulierte Doppelbindungen Isolierte Mehrfachbindungen haben nichts Besonderes. Konjugierte Mehrfachbindungen können eine Mesomerie ausbilden. Die Doppelbindungen können sich über das ganze Molekül verteilen (siehe weiter hinten). Kumulierte Doppelbindungen sind direkt benachbart. Obwohl es Doppelbindungen sind, handelt es sich hier um einen Bindungswinkel von 180, da am mittleren eine sp ybridisierung auftritt Drill&Practice: Alkene 1 1. Orbitalzeichnungen sind sehr aufwändig. Zeichnen Sie in die folgenden Strukturen mit rot die π -Bindungen und mit grün die σ -Bindungen ein. Notieren Sie auch die Bindungswinkel und die Art der ybridisierung (sp 3, sp 2, sp). Es handelt sich dann um eine Mischzeichnungsform. Alle Strukturzeichnungen sind etwas in die Ebene gedreht, damit sich die p-orbitale besser einzeichnen lassen. Lässt sich erkennen, warum konjugierte Doppelbindungen über das Molekül verschiebbar sind? 2. Geben Sie die IUPA-Namen der 4 Strukturzeichnungen an. 3. Geben Sie die IUPA-Namen folgender ungesättigter Kohlenwasserstoffe an. A B D E F Lösungen unter weiter zu Drill&Practice Reaktion von Alkenen mit alogenen Reaktion von yclohexen (yclohex-1-en) und yclohexan mit om Vergleichen Sie: Wer ist reaktiver, Alkane oder Alkene? Notieren Sie die Reaktionsgleichung und einen Produktvorschlag.
14 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Elektrophile Additionsreaktion: Reaktionsmechanismus links: Strichformel von yclohexen rechts: yclohexen als 3D Zeichnung mit π-elektronen Die beiden -Atome der Doppelbindung sind sp 2 hybridisiert, alle anderen sp 3. Die Doppelbindung entsteht mit ilfe der freien p-orbitale oberhalb und unterhalb der Ringebene. Ein ommolekül nähert sich dem yclohexen. Die freien Elektronenpaare des oms werden von der Doppelbindung abgestossen. Es entsteht ein partiell positives omatom. δ δ Das partiell positive omatom bindet an die π-elektronen des yclohexens. Das omatom ist in diesem Fall das elektronenanziehende Teilchen. Es wird als Elektrophil (elektronenliebend) bezeichnet, der Gesamtmechanismus ist eine Elektrophile Addition. Es bildet sich der sog. π-komplex. Es kommt zu einer heterolytischen Spaltung der - Bindung: - Dabei entstehen 2 Ionen: ein omoniumion und ein omidion -. - oder oder gleich gleich Die π-elektronen der Doppelbindung binden an das omoniumion. Dabei entsteht ein arbokation (arbeniumion, ) neben dem -Atom, an dem das Elektrophil gebunden ist. Das jetzt gebundene omatom kann mit einem freien Elektronenpaar an das arbokation binden. Es wird ein cyclisches Kation gebildet, das nicht in der Ringebene liegt. Es bildet sich der sog. σ-komplex Alle Zustände sind nicht direkt unterscheidbar (Übergangszustände). Auch kann man ein solches Teilchen nicht isolieren, da es instabil ist. An diesem Übergangszustand greift das omidion als Nukleophil (liebt positive Ladungen) an. Es stellt für die Bindung ein freies e - -Paar zur Verfügung. Es greift von der Rückseite her an, da dort der Zugang zum arbokation nicht behindert wird. Was sind die 2 möglichen Endprodukte? Sind beide Produkte identisch? Können beide -Atome an das selbe -Atom binden? Kann es sein, dass die -Atome auf der gleichen Seite des Rings angeordnet sind (cis-position) und nicht gegenüber (trans-position)? Warum ist der Ausdruck Elektrophile Addition eigentlich irreführend? Aufgabe Notieren Sie in einer übersichtlichen Ein-Zeilen-Darstellung die gesamte Reaktion. Symbolisieren Sie das cyclische arbokation als Übergangszustand. Nutzen sie Strukturzeichnungen.
15 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 99 Aufgabe Die Elektrophile Addition von l an Alkene funktioniert nach dem gleichen Prinzip. Formulieren sei den Reaktionsmechanismus von Ethen mit l. Gibt es hier auch 2 verschiedene Produkte? Schreiben Sie auch eine Reaktionsgleichung mit Strukturzeichnungen ohne Reaktionsmechanismus in eine Zeile. Können Sie das Produkt hlorethan auch auf einem anderen Wege herstellen? Aufgabe Die Elektrophile Addition von Wasser an Alkene funktioniert nach dem gleichen Prinzip. Stellen Sie Ethanol her. Welche Edukte sind zu verwenden? Formulieren Sie die Reaktionsgleichung und den Reaktionsmechanismus. Schreiben Sie auch eine Reaktionsgleichung mit Strukturzeichnungen ohne Reaktionsmechanismus in eine Zeile. Aufgabe Vinylchlorid ist ein Ausgangsstoff für Polyvinylchlorid (PV). Allg. werden Strukturen von =-R als Vinyl bezeichnet. Alkine eignen sich auch für Elektrophile Additionen. Stellen Sie Vinylchlorid her. Welches Edukt ist einzusetzen? Schreiben Sie auch eine Reaktionsgleichung mit Strukturzeichnungen ohne Reaktionsmechanismus in eine Zeile.
16 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Asymmetrische Elektrophile Addition Bisher wurden völlig symmetrische Alkene betrachtet. Sind unsymmetrische Alkene genauso zu behandeln wie symmetrische? Folgende Reaktion zeigt, dass dem nicht so ist wenig viel Interessanterweise wird vom zweiten Produkt viel mehr produziert als vom ersten. Man sagt auch, die Ausbeute des 2. Prod. ist höher. Wie ist das zu erklären? Es sieht ja fast so aus, als ob sich an das -Atome, wo sich schon viele -Atome befinden, noch ein weiteres -Atom zugesellt. Markownikoff-Regel Bei der elektrophilen Addition von unsymmetrischen elektrophilen Reagenzien (alogenwasserstoffe, Wasser, Alkohole und andere) an unsymmetrische Alkene wird der elektrophilere Teil des Additionsreagenzes (meist das Proton) an das Kohlenstoff-Atom der Doppelbindung mit den meisten Wasserstoff- Atomen addiert. Aufgabe Lassen Sie Propen mit Iodwasserstoff reagieren. Welches Produkt entsteht? Zeichnen Sie den genauen Mechanismus. Schreiben Sie auch eine Reaktionsgleichung mit Strukturzeichnungen ohne Reaktionsmechanismus in eine Zeile Drill&Practice: Alkene 2 4. Lassen Sie 1 mol Iodwasserstoff mit 1 mol Buta-1,3-dien reagieren. Notieren Sie das Produkt, das in hoher Ausbeute (hauptsächlich) gebildet wird. Formulieren Sie den IUPA-Namen. Es wird auch noch ein weiteres Produkt gebildet, ein 1-Iodbut-2-en. Wie kommt das zustande? inweis: Buta-1,3-dien hat eine ganz besondere Lage der Doppelbindungen (vgl. S. 97). Was kann mit der im Verlauf des elektrophilen Angriffs gebildeten positiven Ladung am geschehen, wenn man die Möglichkeit =- -= bedenkt? 1,2- und 1,4-Addition Lösungen unter weiter zu Drill&Practice.
17 Ungesättigte Kohlenwasserstoffe SPF SB_A KME (E)-(Z)-Isomere Eine Doppelbindung ist nicht frei drehbar wie eine Einfachbindung. Um die σ- Bindung zu drehen, müsste die π-bindung gelöst werden, was eine hohe Aktivierungsenergie erfordert. Die (E)-(Z) Isomerie auch cis-trans-isomerie genannt, beschreibt die beiden Möglichkeiten der Anordnung von Substituenten an Doppelbindungen. π σ Anzahl -Atome Name Molekülformel Strukturformel Anmerkung (E)-But-2-en (Z)-But-2-en (E) = trans = entgegengesetzt: die Substituenten befinden sich auf der entgegengesetzten Seite der Doppelbindung (Z) = cis = zusammen die Substituenten befinden sich auf der gleichen Seite der Doppelbindung Reaktion von Lycopin ( Farbstoff von roten Tomaten, E160d) mit om Reaktion von β-arotin ( Farbstoff der Karotte, E160a) mit om Nach welchem Mechanismus verläuft die Reaktion der Farbstoffe mit om? all-(e)-lycopin all-(e)-β-arotin Lycopin und arotin werden auch als hromophore = Farbträger bezeichnet. Warum sind die Stoffe farbig? Welche Voraussetzungen muss für Farbe gegeben sein?
18 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 102 Der Sehfarbstoff Rhodopsin in den Photorezeptoren der Netzhaut ist eine Verbindung aus dem Protein Opsin und dem 11-(Z)-Retinal, das aus dem Vitamin A 1 synthetisiert wird. Vitamin A 1 wiederum wird aus dem Farbstoff der Rüebli, dem β-arotin gewonnen all-(e)-β-arotin Oxidative Spaltung in der Leber O O Vitamin A O O all-(e)-retinal 3 In der Netzhaut findet durch eine Aktivierungenergie (in Form von Licht) die Umwandlung vom 11-(Z)-Retinal zum (ganz wenig) stabileren und somit energetisch günstigeren 11-(E)-Retinal statt. Dadurch wird das Protein Opsin in seiner Struktur verändert. Die Strukturänderung stellt den Startpunkt einer Nervenerregung dar. Dies ist ein klassisches Beispiel für eine Umwandlung von Signalen: Licht - Struktur Retinal - Struktur Opsin - elektrisches Signal Die (Z)-(E)-Isomerisierung ist aufgrund der Tatsache möglich, dass sich zwar Einfachbindungen leicht um ihre eigene Achse drehen lassen, Doppelbindungen aber nicht. Dazu muss die Bindung gelockert werden (Licht = Aktivierungsenergie), was dann zu einer (Z)-(E)-Isomerisierung führt. In einem nachgeschalteten Prozess wird das 11-(E)-Retinal wieder in das 11-(Z)-Retinal überführt O Licht O 3 Das junge Feld der Bioelektronik versucht sich dieses Effekts zu bedienen. Das bekannte 0-I oder auch an/aus der Mikroelektronik könnte durch das Z-E des Rhodopsins ersetzt werden, ein äusserst schneller Vorgang zwischen 300 und 500 fs (Femtosekunden). Als Prototyp existiert bereits ein optisches Speichermedium, ein lichtsensitiver Film zur Speicherung von Informationen in der Sprache E-Z.
19 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Drill&Practice: Alkene 3 5. Sie sehen hier Strukturzeichnungen und die dazugehörigen Molekülformeln. Versuchen Sie aus der Molekülformel die funktionelle Gruppe und damit auch die Struktur zu erkennen. Die Anzahl der -Atome an den Kohlenstoffatomen geben Auskunft darüber, ob es sich um Alkane, Alkene oder Alkine handelt oder ob Amine, Ketone oder arbonsäuren beteiligt sind. Sehen Sie zur Sicherheit noch mal in die Tabelle der funktionellen Gruppen. Notieren Sie die Art der ybridisierung der einzelnen Atome. (Anmerkung: Bei den Strukturen sind die freien Elektronenpaare nicht gezeichnet. Die exakte Geometrie ist einer guten Lesbarkeit geopfert worden.) O N 2 O O 3 2 ( 3 )O 3 ( 3 ) 3 N OO 6. Notieren Sie die Strukturformeln und die IUPA-Namen aller Konstitutionsisomeren von inweis: Die uttoformel n 2n weist auf ycloalkane oder Alkene hin. Bei den Konstitutionsisomeren gibt es 1 Struktur mit einem yclopentan, 1 Struktur mit einem yclobutan, 3 Strukturen mit einem yclopropan und 5 offenkettige (verzweigt und unverzweigt) Alkenstrukturen. 7. Beschreiben Sie den Sehprozess unter besonderer Berücksichtigung der energetischen Aspekte z.b. Warum ist das 11-(E)-Retinal energetisch günstiger als das 11-(Z)-Retinal? Ausserdem: Welches generelle Prinzip wird hier deutlich? 8. Geben Sie die IUPA-Namen folgender ungesättigter Kohlenwasserstoffe an, die sie teilweise schon einmal bearbeitet haben. Erweitern Sie die erarbeiteten Namen mit der E-Z Nomenklatur. A B D E F 9. Je 1 mol (Z)-Oct-3-en und (E)-Oct-3-en werden mit Sauerstoff verbrannt. Welcher Stoff liefert die grössere Verbrennungswärme? Fertigen Sie eine Zeichnung an, die den Unterschied zeigt. 10. Welches Produkt wird bei der Reaktion von 1 mol But-1-in mit 1 mol om gebildet und welches Produkt mit 1 mol But-1-in und 2 mol om? 11. Lebensmittelzusatzstoffe wie Lycopin und β-arotin besitzen sog. E- Nummern. Auch der Tagi hat sich dem Thema gewidmet, wobei sich die Autoren bei der Auswahl der E-Nummern etwas gedacht haben. Der artoon ist mal wieder völlig klischeehaft (E = giftig, ist natürlich Unsinn), aber was haben sich die Autoren nur bei der Auswahl gedacht? Prüfen Sie unter Lösungen unter weiter zu Drill&Practice.
20 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Arene (Aromaten) O "Aromaten" klingt ganz nach aromatisch duftenden Substanzen. Tatsächlich hatte man angenommen, dass das Abbauprodukt Benzen aus den duftenden Stoffen Vanillin (Vanille-Aroma) und Eugenol (Gewürznelke) dem Duftstoff seinen harakter verleiht, was aber nicht den Tatsachen entspricht. eute wird der Begriff Aromaten als "aromatische Kohlenwasserstoffe" für Moleküle verwendet, die einen ganz bestimmten strukturellen Aufbau besitzen. O- 3 O Vanillin O- 3 O Eugenol Benzen (Benzol) Benzen ( 6 6 ) ist der typischste Vertreter der Aromaten. Es ist eine wasserklare Flüssigkeit, die an der Luft mit stark russender Flamme verbrennt, was auf ihren hohen Kohlenstoffgehalt schliessen lässt. Der Begriff Benzol deutet auf einen Alkohol hin. Das ist falsch. Daher wird hier der Name Benzen, der auf Doppelbindungen hindeutet, verwendet. Benzen ennbarkeit von Toluen im Vergleich zu Pentan [Toluen (Toluol) ist Methylbenzen und harmloser als Benzen. Verhalten der Stoffe Benzen und Toluen ist für diesen Versuch identisch.] Benzen wurde früher als Lösungs- und Reinigungsmittel für Gummi und Fette verwendet. In Gummiwarenfabriken traten daraufhin Massenvergiftungen auf. hronische Benzenvergiftungen führen zu Knochenmark-, Leber- und Nierenschäden und zusätzlich ist Benzen krebserregend (cancerogen = carcinogen). Benzen wird heute als Ersatzstoff für das Bleitetraethyl zur Erhöhung der Klopffestigkeit der Motorkraftstoffe verwendet (1-5% Benzen im Benzin). Unvollständige Verbrennung und das Verdampfen und Verschütten beim Tanken führt zu einer relativ starken Benzenemission. Mit ilfe von Gasabsaugsystemen an Zapfpistolen versucht man, die Emissionen so weit wie möglich zurückzudrängen. Die Eidgenössische Kommission für Lufthygiene schätzt aber, dass pro Jahr ca Tonnen Benzen durch den motorisierten Strassenverkehr freigesetzt werden. Derivate Benzen wird aus Erdöl gewonnen und ist ein wichtiger Baustein für die Synthese von Kunststoffen, Farbstoffen, waschaktiven Substanzen etc. Derivate, also Abkömmlinge vom Benzen wie Vanillin oder Eugenol sind von ihrer Toxizität nicht mit Benzen vergleichbar. Ein hoher Verwandtschaftgrad von Molekülen bedeutet in keinem Fall gleiches Verhalten der Stoffe. Anderer Stoff, anderes Verhalten.
21 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 105 Die Bindung im Benzen Es dauerte Jahre bis aus der uttoformel 6 6 die korrekte Strukturformel aus 217 Konstitutionsisomeren abgeleitet werden konnte. Die Summenformel deutet auf eine stark ungesättigte Verbindung hin. Bei genauerer Betrachtung kommen aber auch gesättigte Strukturen in Frage. A. Ladenburg (1869) J. Dewar (1867). laus (1867) Kekulé (1865) Reaktion von Benzen, yclohexen und Pentan mit omwasser (Benzoesäure wird als Ersatz für Benzen genommen, da weniger gefährlich. Sie ist in Wasser gelöst.) Welche der 6 Strukturen sind aufgrund der Experimente auszuschliessen? Erst 1872 postulierte August Kekulé, Professor in Gent und Bonn, folgende gleichwertige Strukturen, die sich nur in der Lage der Doppelbindungen unterscheiden. Aufgabe Zeichnen Sie p-orbitale und π-elektronen ein. August Kekulé von Stradonitz ( ) Grenzstrukturen Aromat Beide Strukturen sind gleichwertig, die Doppelbindungen befinden sich in Bewegung und gehen ineinander über. Es handelt sich hier, wie z.b. bei dem Nitrat-Ion oder beim Graphit um einen mesomeren Zustand. Die Struktur ist völlig planar.
22 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 106 Kekulé führte die Entstehung der Sechseckformel auf einen Traum zurück:...da saß ich und schrieb an meinem Lehrbuch; aber es ging nicht recht; mein Geist war bei anderen Dingen. Ich drehte den Stuhl nach dem Kamin und versank im albschlaf. Wieder gaukelten die Atome vor meinen Augen. Kleinere Gruppen hielten sich diesmal bescheiden im intergrund. Mein geistiges Auge, durch wiederholte Gesichte ähnlicher Art geschärft, unterschied jetzt größere Gebilde von mannigfacher Gestaltung. Lange Reihen, vielfach dichter zusammengefügt. Alles in Bewegung, schlangenartig sich windend und drehend. Und siehe, was war das? Eine der Schlagen erfasste den eigenen Schwanz und höhnisch wirbelte das Gebilde vor meinen Augen. Wie durch einen Blitzstrahl erwachte ich; auch diesmal verbrachte ich den Rest der Nacht, um die Konsequenzen der ypothese auszuarbeiten. Lernen wir träumen, meine erren, dann finden wir vielleicht die Wahrheit, aber hüten wir uns, unsere Träume zu veröffentlichen, ehe sie durch den wachenden Verstand geprüft worden sind. Strukturansichten von Benzen Struktur Oberfläche Oberfläche mit π-elektronen π-elektronen Arene (Aromaten) werden nach der ückel-regel (1931, erweitert 1970) folgendermassen definiert: Arene sind planare, ringförmige Moleküle, die 4n2 konjugierte Doppelbindungselektronen (n = 0, 1, 2, 3 ) in einem delokalisierten π-elektronensystem besitzen. Sie sind stark mesomeriestabilisiert. Aufgabe Bezeichnen Sie folgende Strukturen mit aromatisch (a) oder nicht aromatisch (na). Begründen Sie. Anmerkung: Bei polycyclischen Verbindungen werden die gleichzeitig delokalisierbaren e - auf der Peripherie des Moleküls kalkuliert. N N Aufgabe Zeichnen Sie die delokal. Doppelbindungen ein und zeigen Sie, dass nur eine der beiden Strukturen ein aromatisches System über die gesamte Struktur besitzt.
23 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 107 Beispiele für aromatische Verbindungen (Nur die fettgedruckten Strukturen sind zu lernen und prüfungsrelevant.) Naphthalin (Naphthalen) charakteristischer Geruch nach Mottenpulver Biphenyl (Diphenyl) Pilztötend. Konservierungsmittel für itrusfrüchten, leicht reizend für die aut beim Schälen von Orangen und Zitronen (2 Benzenringe = 2 aromatische Systeme) Anthracen intensive violette Fluoreszenz im UV Licht Phenanthren blaue Fluoreszenz Benzpyren (Benzo[a]pyren) Sehr cancerogen. Autoabgase. Erhöht in Zigarettenrauch massgeblich das Lungenkrebsrisiko, entsteht neben Nitrosaminen auch beim Grillieren von Fleisch über offenem Feuer. (Gestrichelte Doppelbindung ist vorhanden, zählt aber nicht zur Peripherie, daher mit 18 e - ein ückel-aromat.) l 3 l l l N N ( 3 ) 2 N N DDT Dichlor-diphenyl-trichlorethan, sehr wirksames Kontaktgift zur Bekämpfung der Malaria [Anopheles (Malariamücke), Überträger des Erregers Plasmodium], 1948 Nobelpreis in Medizin an den Basler hemiker Paul Müller, Resistenzprobleme, reichert sich in der Nahrungskette an. (2 isolierte Benzenringe) Atrazin erbizid (Unkrautvertilger) beim Maisbau und an Geleisen verwendet, kann durch Regenwasser ausgewaschen werden und ins Grundwasser gelangen. N Toluen Ausgangsstoff für Aromastoffe und Sprengstoff (Trinitrotoluen, TNT) O Phenol Ausgangsstoff für Kunststoffe (Phenolharze), Sprengstoffe und Aspirin (aromatischer Alkohol) N 2 Anilin Ausgangsstoff für Farbstoffe (Anilinfarbstoffe) (aromatisches Amin) O O 3 Acetylsalicylsäure (Aspirin) OO u.a. Schmerzmittel aber eigentlich ein Wundermittel O O 2 N 3 Adrenalin wird bei hemieprüfungen manchmal ausgeschüttet O
24 Ungesättigte Kohlenwasserstoffe SPF SB_A KME TNT Trinitrotoluen (TNT) ist ein Sprengstoff der zu den Arenen gehört. Eine Nitro- Gruppe wird mit -NO 2 symbolisiert. Durch Reaktion von Toluen mit Salpetersäure (NO 3 ) wird TNT gewonnen. Nach Zündung reagiert es detonationsartig zu Stoffe, die für Wirkung und einer grossen Anzahl gasförmiger Knall verantwortlich sind. Aufgabe Formulieren Sie zeichnerisch die Reaktionsgleichung der Reaktion von Toluen mit Salpetersäure zu 2,4,6-Trinitrotoluen (TNT). Toluen Salpetersäure TNT O 2 O N 2 2 O Verhalten von Schiessbaumwolle = Nitrocellulose ennbarkeit Schwarzpulver Schon die alten hinesen kannten Schwarzpulver, eine Mischung aus Kaliumnitrat, Kohlenstoff und Schwefel. Kaliumnitrat KNO 3 ist der Sauerstofflieferant für die Verbrennung. Dass der Freiburger Mönch Berthold Schwarz um 1300 bei alchemistischen Versuchen in einem Mörser als Erster das gefährliche Pulver zufällig zur Explosion brachte, wird heute bezweifelt. Nitroglycerin Nitroglycerin, das eigentlich Glycerintrinitrat heisst und eine farblose Flüssigkeit ist, wird aus Glycerin (Glycerol) und Salpetersäure hergestellt. Auch hier wird der benötigte Sauerstoff in Form von Nitraten im Molekül selbst transportiert. Nitroglycerin ist äusserst empfindlich gegen Stoss und Schlag. In kleinen Dosen wirkt Glycerintrinitrat physiologisch gefässerweiternd, so dass man es bei Asthmaanfällen oder erzinfarkt verabreichen kann. Erfunden und reich geworden mit Dynamit ist Alfred Nobel ( ), dem es gelungen war, das wenig handhabbare und unsichere Nitroglycerin in das sichere Dynamit umzuwandeln. Nitroglycerin ist äusserst empfindlich gegen Stoss und Schlag. Nobel kaufte von Ascanio Sobrero, Prof. für hemie in Turin, das Patent für die erstellung von Glycerintrinitrat gelang es ihm, die Flüssigkeit mit ilfe von festem Kieselgur (eine aus Kieselalgen entstandene Ablagerung) zu stabilisieren starb er ohne Nachkommen und Erben und stiftete sein grosses Vermögen von damals 31 Mio SKR für die Auszeichnung der bedeutendsten Entdeckungen auf dem Gebiet der hemie, Physik, Medizin, Literatur und für die Erhaltung des Weltfriedens. Ein Preis für Wirtschaftswissenschaften kam später hinzu wurde der sog. Nobelpreis 1 zum ersten Mal vergeben: Physik onrad Röntgen, hemie Jacobus van't off, Medizin Emil von Behring. Bei der erstellung von Sprengstoffen kam Alfreds jüngster uder um. Viele verheerende Explosionen zwangen die Produktion des Dynamits aus Sicherheitsgründen teilweise auf Flösse. Selbst Fachleute hatten und haben Schwierigkeiten bei der erstellung von Sprengstoffen. Daher: 2 2 O O Glycerin O ONO Glycerintrinitrat Nitroglycerin Alfred Nobel ONO 2 ONO 2 Stellen Sie selbst keine Sprengstoffe her! Es ist schlicht zu gefährlich! 1 Nobelpreise bei hemiepreise Vollständige Liste aller Preisträger
25 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Drill&Practice: Arene 1 1. Sind folgende Strukturpaare zueinander identisch? Die Frage ist möglicherweise nicht so simpel, wie sie sich anhört. Gemeint ist aber schon, dass man die beiden aromatischen Strukturen miteinander vergleicht und die beiden nichtaromatischen. 2. Welche Strukturen besitzen aromatische Systeme? inweis: Zeichnen Sie für Pyrrol, Furan und Thiophen die freien Elektronenpaare ein und versuchen Sie dann ein konjugiertes Elektronensystem zu konstruieren. N N Pyridin N O S Pyrrol Furan Thiophen 3. Geben Sie die Namen an. l 4. Zeichnen Sie 3 veschiedene Grenzstrukturen von Naphthalin. 5. Zeichnen Sie alle konstitutionsisomeren Tribrombenzene und geben Sie die Namen an. 6. Im Benzin finden sich bis zu 5% Benzen, da Benzen sehr klopffest ist. Würde man mit reinem Benzen fahren, müsste das Benzen/Luftgemisch für eine vollständige Verbrennung eine anderes Mischungsverhältnis haben, da Benzen sehr kohlenstoffreich ist. Nehmen Sie an, Benzen und Luft seien ideale Gase. Welches Verhältnis Benzen/Luft muss für eine vollständige Verbrennung vorliegen? Stellen Sie die Reaktionsgleichung der Verbrennung auf und kalkulieren Sie. Lösungen unter weiter zu Drill&Practice.
26 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Reaktionen der Arene: Elektr. aromat. Subst. (S E ) Die Reaktion von Elektrophilen mit Arenen funktioniert ganz ähnlich zum Reaktionsmechanismus von Elektrophilen mit Alkenen, nur handelt es sich hier nicht um eine Additionsreaktion sondern um eine Substitutionsreaktion (Austausch). Mechanismus Die höchste Elektronendichte befindet sich oberhalb und unterhalb des aromatischen Rings (π-elektronen). Angriff eines Elektrophils (ommolekül) mit ilfe eines Katalysators (partiell positiv geladen) von oben oder von unten. Partiell positiv geladener Katalysator erzeugt einen Elektronenzug über das ganze Elektrophil (ommolekül). π-komplex K(δ) eterolytische Spaltung des Elektrophils ( 2 Bindung). Für dieses Beispiel gilt: Ein omoniumion und ein omidion - entstehen. Das omoniumion bindet an das Aren, das omidion an den Katalysator. σ-komplex K(δ) - K(δ) = Stabilisierung des σ-komplexes durch Delokalisierung der positiven Ladung aufgrund der Verlagerung von konjugierten Doppelbindungen. Grenzstrukturen des σ-komplexes und mesomere Delokalisierung ist gezeigt. - K(δ) K(δ) Kat - Wiederherstellung des aromatischen Systems durch Abspaltung eines -Ions. Freigabe eines Elektronenpaars. Freigabe des Katalysators durch Abgabe des omidions (für dieses Beispiel) und Bildung eines Moleküls (für dieses Beispiel). Aufgabe Notieren Sie in einer übersichtlichen Ein-Zeilen-Darstellung die gesamte Reaktion. Machen Sie die mesomere Delokalisierung des σ-komplexes deutlich. Nutzen sie Strukturzeichnungen.
27 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 111 Reaktion von Benzen mit om (siehe S. 105) Reaktion von Benzen mit om plus Katalysator (Eisenwolle) Aufgabe Formulieren Sie die Friedel-rafts-Alkylierung. Die Reaktion wurde 1877 vom Franzosen harles Friedel und dem Amerikaner James Mason rafts entdeckt. In dieser Reaktion wird eine Alkylgruppe z.b. - 3 mit ilfe des Katalysator All 3 an den Aromaten gebunden. Lassen Sie Benzen mit hlormethan nach Friedel-rafts reagieren. Warum ist diese Reaktion so bedeutend? Was kann man mit dem Prinzip sonst noch alles anfangen? Aufgabe Formulieren Sie die Nitrierung von Benzen zu Nitrobenzen. Nehmen Sie als Elektrophil NO 2 (Info: Da sich die positive Ladung am N befindet besser NO 2 ). Vernachlässigen Sie den Katalysator. Welche Teilchen sind folgend dargestellt?
28 Ungesättigte Kohlenwasserstoffe SPF SB_A KME 112 Energetik: Additionsreaktion oder Substitutionsreaktion? Aufgabe Arene reagieren in einer Elektrophilen Substitutionsreaktion (nachfolgende Graphik obere Zeile) und nicht in einer Elektrophilen Additionsreaktion, wie es bei Alkenen beobachtet wird (nachfolgende Graphik untere Zeile).? K(δ) Elektrophile Aromatische Substitution ( gegen ) Kat -? Kat - K(δ) Elektrophile Addition ( 2 an Doppelbindung) Enthalpie Was ist der Grund für die unterschiedliche Reaktionsweise? Analysieren sie das Enthalpiediagramm und beantworten sie folgende 3 Fragen. 1. Welcher Reaktionsweg ist aus Gründen der Aktivierungsenergie vorzuziehen? Begründung! 2. Welcher Reaktionsweg ist aus Gründen der Reaktionsenthalpie vorzuziehen? Begründung! 3. Welcher Reaktionsweg ist aus Gründen der Reaktionsentropie vorzuziehen? Begründung!
29 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Phenol O Acidität: Säuren geben -Ionen ab. Der saure harakter eines Stoffes hängt u.a. von der -Abgabebereitschaft des Teilchens ab. Oder: ein Teilchen gilt dann als sauer, wenn es gern ein -Ion abgibt. Verhalten von Phenol in Wasser Vergleich der Acidität von Phenol (in Wasser) und Ethanol Saurer harakter von Ethanol und Phenol O O O O O O 2 O Phenolat = Anion des Phenols O 2 O Elektrophile aromatische Substitution mit Phenol Im Unterschied zu den bisher behandelten elektrophilen aromatischen Substitutionsreaktionen (S E ) wird beim Phenol von einer Zweitsubstitution gesprochen, da neben der -O Gruppe ein zweiter Substituent eingeführt wird. Es soll sich auch hier wieder um einen elektrophilen Angriff handeln. Die Positionbesetzung ortho, meta, para der Zweitsubstitution ist nicht zufällig. ortho meta R ortho meta Reaktionsschema der Reaktion eines Elektrophils mit Phenol (Zweitsubstitution) para O O Elektrophil (3 X 2 ) 3 X Reaktion von Phenol mit om Vergleich zur Reaktion von Benzen mit om (siehe S. 105) Vergleich zur Reaktion von Benzen mit om plus Kat. (siehe S. 111)
30 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Anilin und Azofarbstoffe Anilin ist unentbehrlich in der Farbstoffchemie der sog. Azofarbstoffe (franz. azote = Stickstoff). Der Azofarbstoff Lederschwarz ist sehr beliebt, da er eine hohe Farb- und Lichtechtheit besitzt. Das schwarze Ledersofa wird nicht plötzlich an manchen Stellen braun und es verschiesst nicht unter Sonnenlichteinfall zu einem ellgrau. N 2 Anilin zeigt ein zum Phenol ähnliches Verhalten, was die Zweitsubstitution betrifft: N 2 N N N Welche Position ist bei einer Zweitsubstitution bevorzugt? Auch viele Säure-Base Indikatoren, die eine saure Lösung und eine basische Lösung durch einen Farbstoffwechsel anzeigen, sind Azofarbstoffe. Die Synthese von Azofarbstoffen läuft nach folgendem, allgemeinen Reaktionsschema ab (kein Reaktionsmechanismus!) N 2 Azogruppe N=N NaNO 2 in l-lsg in l-lsg N 2 N N Diazotierung Azokupplung Elektrophil N N N 2 Synthese und Verhalten des Säure-Base Indikators Methylorange (Azofarbstoff) Formulieren Sie die Reaktion. N 2 Sulfanilsäure SO 3 3 N 3 N,N-Dimethylanilin
31 Ungesättigte Kohlenwasserstoffe SPF SB_A KME Drill&Practice: Arene 2 1. In der Mineralölsteuerverordnung (MinöStV) vom 20. November 1996 (Stand am 16. November 2004) steht in Artikel 89 und 90: Die zugelassenen Lagerinhaber müssen eizöl extraleicht vor Entstehung der Steuerforderung nach Artikel 90 färben und kennzeichnen. eizöl extraleicht muss je 1000 Liter bei 15, gleichmässig verteilt, mindestens enthalten: 4,2 g N-Ethyl-1-4(4-phenylazophenylazo)naphtyl-2-amin, oder 5,5 g N-(2-Ethylhexyl)-1-[[2-methyl-4-[(2- methylphenyl)azo]phenyl]azo]naphthyl-2-amin, oder 6,3 gn-(tridecyl)-1-[[2-methyl-4-[(2-methylphenyl)azo]phenyl]azo]naphthyl-2-amin, oder ein in der Farbwirkung äquivalentes Gemisch aus diesen Farbstoffen; und 6,0 g N-Ethyl-N-[2-(1-isobutoxyethoxy)ethyl]-4-(phenylazo)anilin. Steuerlich wenig belastetes eizöl wird also durch Anfärbung mit Azofarbstoffen von steuerlich hoch belastetem aber chemisch identischem Dieselkraftstoff unterschieden. Der erste aufgelistete Stoff ist Sudanrot (die Nomenklatur lassen wir weg) N 2 5 N N N N Zeichnen Sie die 3 verwendeten Ausgangsstoffe. Notieren Sie die Diazotierung und die Azokupplung. 2. Beurteilen Sie, warum sich die Farbe der Stoffe verändert. Nutzen Sie die Informationen in der Antwort. (Freie Elektronenpaare nicht eingezeichnet.) N 2 N 2 N N 2 N 2 2 N O - N O O - N O SO 3 - Na N N N N SO 3 - Na Benzen Anilin Kongorot farblos gelb gelborange orangerot rot O 3. Stellen Sie Thymol her, den typischenthymianduft. Was sind die Ausgangsstoffe? Die Reaktion soll einstufig sein, d.h. folgende Reaktion soll ablaufen: A B Thymol (nicht mehrere Schritte). 4. Formulieren Sie 2 Möglichkeiten für die Darstellung von Ethylbenzen. Nutzen Sie a) ein alogenalkan und b) Ethen. Für b) orientieren Sie sich am Kapitel der Alkene. Was muss passieren, damit aus einem Alken ein Elektrophil wird? 5. Für die erstellung von Aspirin (s. Tab. S. 107) wird ein Phenolatanion mit O 2 umgesetzt. Ist O 2 zu einem elektrophilen Angriff überhaupt in der Lage? 6. Eine Gruppe von Antibiotika stellen die sog. Sulfonamide dar. Eines der ersten war das Sulfanilamid. a) Eine Vorstufe ist die Sulfonierung von Anilin mit SO 3. Zeichnen Sie SO 3 und beurteilen Sie, ob das SO 3, (wie das O 2 ) in der Lage ist, an das Anilin zu binden. Gehen Sie ganz logisch vor. b) Wenn ein -Ion vorhanden ist, könnte dann Sulfanilsäure (aus dem Farbstoffexperiment) aus Anilin hergestellt werden? (Aus der Sulfanilsäure könnte dann das Sulfanilamid hergestellt werden.) c) In der technischen erstellung wird nicht SO 3 verwendet, sondern hlorsulfonsäure lso 3. Zeichnen Sie die hlorsulfonsäure. Finden Sie da Reagenz brauchbar? Argumentieren Sie mit der S E. Lösungen unter weiter zu Drill&Practice. 3 Thymol N SO 2 N 2 Sulfanilamid
Übungen zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe. 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit
 O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
O II zu den Kapiteln Ungesättigte und aromatische Kohlenwasserstoffe 1. Wie lauten die allgemeinen Formeln für ungesättigte Kohlenwasserstoffe mit a) 2 Dreifachbindungen n 2n-6 b) 3 Dreifachbindungen n
Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag)
 Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
Pharmazeutische Chemie Seite 1 Die Bearbeitung erfolgt mit Textausschnitten des Buches Chemie Teil 2 (Diesterweg Verlag) Fragen zu der sp³ Hybridisierung (S. 124-128): 1.) Notieren Sie die Elektronenverteilung
3. Aromatische Verbindungen Benzol(en)
 3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
3. Aromatische Verbindungen Benzol(en) Benzol erweist sich merkwürdigerweise als ungewöhnlich stabil gegen viele angreifende Reagenzien. So finden die typischen Additionen an die Doppelbindungen nicht
n Pentan 2- Methylbutan 2,2, dimethylpropan ( Wasserstoffatome sind nicht berücksichtigt )
 Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Grundwissen : 10 Klasse G8 Kohlenwasserstoffe Alkane Einfachbindung (σ -Bindung, kovalente Bindung ) : Zwischen Kohlenstoffatomen überlappen halbbesetzte p- Orbitale oder zwischen Kohlenstoff- und Wasserstoffatomen
Chemie für Biologen SS Georg Jansen AG Theoretische Organische Chemie Universität Duisburg Essen. (Teil 11: Alkine / Polyene / Aromaten)
 hemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische hemie Universität Duisburg Essen (Teil 11: Alkine / Polyene / Aromaten) Bindungen mit sp ybridobitalen Bindungen mit sp ybridorbitalen
hemie für Biologen SS 2007 Georg Jansen AG Theoretische rganische hemie Universität Duisburg Essen (Teil 11: Alkine / Polyene / Aromaten) Bindungen mit sp ybridobitalen Bindungen mit sp ybridorbitalen
Aromatische Kohlenwasserstoffe.
 Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Aromatische Kohlenwasserstoffe. Benzol und dessen Homologe. Mechanismus der S E 2-Ar-Reaktion. Orientierung in aromatischem Kern, abhängig vom ersten Substituent. Elektrophiler Mechanismus der Substitutionsreaktionen.
Die elektrophile Addition
 Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Die elektrophile Addition Roland Heynkes 3.10.2005, Aachen Die elektrophile Addition als typische Reaktion der Doppelbindung in Alkenen bietet einen Einstieg in die Welt der organisch-chemischen Reaktionsmechanismen.
Einführung in die Organische Chemie. Benjamin Grimm
 Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Einführung in die Organische Chemie Benjamin Grimm Gliederung Einführung: Begriff der organischen Chemie Synthese organischer Stoffe: Cracken von Erdöl Organische Stoffklassen Isomerie Orbitalmodell: Hybridisierung
Organik KOMPAKT Organik Blatt 1/5
 rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
rganik KMPAKT rganik Blatt 1/5 1 Elemente in organischen Verbindungen Kohlenstoff () Sauerstoff () Wasserstoff () Stickstoff (N) Phosphor (P) Schwefel (S) Kohlenstoff kommt immer in organischen Verbindungen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 4, 09./10.05.11 Nucleophile Substitution 1. Beschreiben Sie den Reaktionsmechanismus von a) S N 1 X = beliebige Abgangsgruppe
Reaktionstypen der Aromate
 Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Radikalische Reaktionspartner sind Atome bzw. Atomgruppen mit einem ungepaarten Elektron, wie z. B. das Chlorradikal Cl oder das Ethylradikal C 3 C 2. Radikale sind in der Regel sehr unbeständig, kurzlebig
Basiswissen Chemie. Vorkurs des MINTroduce-Projekts
 Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Basiswissen Chemie Vorkurs des MINTroduce-Projekts Christoph Wölper christoph.woelper@uni-due.de Sprechzeiten (Raum: S07 S00 C24 oder S07 S00 D27) Was bisher geschah Redox-Reaktion Oxidation Reduktion
Alkane. homologe Reihe. homologe Reihe der Alkane Nomenklatur. Isomerie. Gesättigte, kettenförmige Kohlenwasserstoffe
 Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Gesättigte, kettenförmige Kohlenwasserstoffe Alkane gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane : n 2n+2 (n N) Alle Alkane erhalten
Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie,
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische h Bindungen Bindungen: Kräfte, die Atome zusammenhalten, Bindungsenergie, unterschiedliche Arten chemischer Bindungen, Atombindung, kovalente
2 Die Atombindung im Wasserstoff-Molekül
 2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
2.1 Lernziele 1. Sie wissen, wie eine chemische Bindung zwischen zwei Wasserstoff-Atomen zustande kommt. 2. Sie können den bindenden vom antibindenden Zustand unterscheiden. 3. Sie wissen, weshalb das
6. Carbonyl-Verbindungen
 6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Carbonyl-Verbindungen Hierher gehören vor allem die Aldehyde und Ketone. (später: Die Carbonyl-Gruppe weisen auch die Carbonsäuren und ihre Derivate auf). Carbonylgruppe. Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und Herstellung
 6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
6. Kohlenwasserstoffe Alkane, Alkene, Alkine, Arene Molekülbau, Reaktionen und erstellung Moleküle, die nur Kohlenstoff und Wasserstoff enthalten, werden Kohlenwasserstoffe genannt Prof. Dr. Ivo C. Ivanov
CHE 172.1: Organische Chemie für die Life Sciences
 1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
1 E 172.1: Organische hemie für die Life Sciences Prof Dr. J. A. Robinson 4. Alkene und Alkine : Reaktionen und erstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken
Fragen zum Thema funktionelle Gruppen Alkohol und Phenol
 1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
1. Was sind Derivate? 2. Was sind Substituenten? 3. Wann werden neu angehängte Atome oder Gruppen als Substituent bezeichnet? 4. Warum sind Substituenten so wichtig für organische Verbindungen? Alkohol
Chemische Bindungen Atombindung
 Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Atombindung Das Lewis Modell der kovalenten Bindung Die Entstehung von Molekülen beruht auf der Bildung von gemeinsamen, bindenden Elektronenpaaren in dem Bestreben der Atome, eine energetisch stabile
Lösungen zum Übungsblatt zur Schulaufgabe. 0. Aufgaben aus dem Buch, S. 34
 Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Lösungen zum Übungsblatt zur Schulaufgabe 0. Aufgaben aus dem Buch, S. 34 A1 a) c) Br 5-Brom-2-methyl-hexa-2,3-dien 5-Brom-2-methyl-2,3-hexadien b) 3-Ethyl-3,4-dimethyldecan 3-Methylhexan A2 Butanmoleküle
Aromatische Kohlenwasserstoffe
 Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Benzol: 6 6 (Faraday 1825) Aromatische Kohlenwasserstoffe OI_folie201 Vorgeschlagene Konstitutionen von Benzol 1,3,5-yclohexatrien-Struktur 1858 Kekulé Erklärt nicht, warum es nur drei regioisomere disubstituierte
Z 8 EINFÜHRUNG IN DIE ORGANISCHE CHEMIE 1) DEFINITIONEN 2) ELEMENTE UND BINDUNGEN. Organische Chemie. Kunstoffe. Farbstoffe
 EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
EINFÜRUNG IN DIE RGANISCE CEMIE 1) DEFINITINEN Die C beschäftigt sich mit Molekülen, die ein Kohlenstoffgerüst haben. Die Fähigkeit des Kohlenstoffs Einfach-, Zweifach- und Dreifachbindungen (mit seinen
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe. Beschreiben Sie die Alkane allgemein.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
4-Butyl-2,5-dimethylheptan 5-Ethyl-4,8-dimethylundecan
 Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006 Themenbereich rganische Chemie 1. Warum ist der Kohlenstoff mehr als jedes andere Element dafür prädestiniert, komplexe Molekülverbindungen
4. Alkene und Alkine : Reaktionen und Darstellung
 Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Inhalt Index 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine
Valenz-Bindungstheorie H 2 : s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie
 Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
Valenz-Bindungstheorie Beschreibung von Molekülen mit Hilfe von Orbitalen H H H 2 : H 2 s Ueberlappung von Atomorbitalen s-bindung: 2 Elektronen in einem Orbital zylindrischer Symmetrie um die interatomare
4. Alkene und Alkine : Reaktionen und Darstellung
 Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Dienstag, 22. Oktober 2002 Allgemeine Chemie B II Page: 1 4. Alkene und Alkine : Reaktionen und Darstellung 4.1. Elektrophile Additionen an Alkene ; Regioselektivität Das Proton einer starken Säure kann
Chemie II. Vorlesung: Mo Uhr, HPT C103 Übungen: Mo Uhr, HCI H2.1, HCI J4
 hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
hemie II Vorlesung: Mo 11-13 Uhr, PT 103 Übungen: Mo 14-16 Uhr, I 2.1, I J4 Literatur:.E. Mortimer, U. Müller: hemie, 11. Auflage Thieme-Verlag Stuttgart 2014 Dr. Wolfram Uhlig Laboratorium für Anorganische
3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen.
 Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Inhalt Index 3. Organische Reaktionen - Einordung nach Mechanismen. Alkene : Kohlenwasserstoffe mit Doppelbindungen. 3.1 Die Nomenklatur der Alkene Eine C=C Doppelbindung ist die funktionelle Gruppe, die
Reaktionstypen der Aliphate
 Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
Einleitung Klasse 8 Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt.
1.2 Vergleichen Sie die Reaktionsbedingungen für die Bromierung von A und B und begründen Sie unter Mitverwendung von Grenzformeln den Unterschied!
 Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Aufgabe II Die aromatischen Ringsysteme folgender Verbindungen sollen zu Monobromderivaten umgesetzt werden: Benzol (A), Anilin (B) und Aniliniumchlorid (C). 1.1 Erläutern Sie unter Mitverwendung von Strukturformeln
Organische Chemie für MST 5. Lienkamp/ Prucker/ Rühe
 Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Organische Chemie für MST 5 Lienkamp/ Prucker/ Rühe Inhalt 5 Aromaten Struktur und Bindung im Benzol, Hückel-Regel, mesomeregrenzstrukturen, ortho-, meta-, para-substitution, elektrophile Substitution
Atommodell. Atommodell nach Bohr und Sommerfeld Für sein neues Atommodell stellte Bohr folgende Postulate auf:
 Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Für sein neues Atommodell stellte Bohr folgende Postulate auf: Elektronen umkreisen den Kern auf bestimmten Bahnen, wobei keine Energieabgabe erfolgt. Jede Elektronenbahn entspricht einem bestimmten Energieniveau
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II
 Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Wiederholung der letzten Vorlesungsstunde: Thema: Chemische Bindungen II Elektronenpaarbindung, Elektronegativität, polare Atombindung, Dipolmoment, Hybridisierung von Atomorbitalen, sp 3 -, sp 2 -, sp-hybridorbitale,
Kohlenwasserstoffe. Alkane. Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind.
 2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
2 2 Kohlenwasserstoffe Kohlenwasserstoffe sind brennbare und unpolare Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen aufgebaut sind. 4 4 Alkane Alkane sind gesättigte Kohlenwasserstoffverbindungen
Alkene / Additions-, Eliminierungsreaktionen
 2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
2.2.2. Alkene / Additions-, Eliminierungsreaktionen 64 65 Struktur und Bindung in Ethen Ethen ist planar 2 trigonale C-Atome Bindungswinkel annähernd 120 o C ist sp2-hybridisiert Einfachbindung durch Überlapp
Chemie der Kohlenwasserstoffe
 hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
hemie der Kohlenwasserstoffe Alkane Gesättigte, kettenförmige Kohlenwasserstoffe gesättigt = nur Einfachbindungen kettenförmig = keine inge Kohlenwasserstoff = nur - und -Atome Summenformel der Alkane
2-01. Das Ethen-Molekül. Perspektivische Darstellung des Ethen-Moleküls.
 Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Das Ethen-Molekül 2-01 Perspektivische Darstellung des Ethen-Moleküls. Rot: Sigma-Bindungen σ mit je zwei Bindungselektronen Blau: pz-orbitale mit je einem Elektron Die C-Atome sind sp 2 -hybridisiert,
Wiederholung der letzten Vorlesungsstunde:
 Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
Wiederholung der letzten Vorlesungsstunde: Das (wellen-) quantenchemische Atommodell Orbitalmodell Beschreibung atomarer Teilchen (Elektronen) durch Wellenfunktionen, Wellen, Wellenlänge, Frequenz, Amplitude,
Das quantenmechanische Atommodell
 Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
Ende 93 konzipierte de Broglie seine grundlegenden Ideen über die Dualität von Welle und Korpuskel. Albert Einstein hatte schon 905 von den korpuskularen Eigenschaften des Lichtes gesprochen; de Broglie
Skript zur Vorlesung Organische Chemie (Prof. M. Albrecht) an der RWTH Aachen
 Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Skript zur Vorlesung rganische hemie (Prof. M. Albrecht) an der WT Aachen Erstellt von: Michael Müller Erstellungsdatum: 23.01.2004 e-mail: michael.mueller@rwth-aachen.de Nomenklatur und Isomerie organischer
Atombau, Elektronenkonfiguration und das Orbitalmodell:
 Bohrsches Atommodell: Atombau, Elektronenkonfiguration und das Orbitalmodell: Nachdem Rutherford mit seinem Streuversuch bewiesen hatte, dass sich im Kern die gesamte Masse befindet und der Kern zudem
Bohrsches Atommodell: Atombau, Elektronenkonfiguration und das Orbitalmodell: Nachdem Rutherford mit seinem Streuversuch bewiesen hatte, dass sich im Kern die gesamte Masse befindet und der Kern zudem
Diene: C n H 2n-2 : 2 Doppelbindungen
 Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Diene: n 2n-2 : 2 Doppelbindungen I_folie63 ) Isolierte Diene: Die beiden Doppelbindungen sind durch ein oder mehrere sp 3 -hybridisierte - Atome getrennt. 2 2 3 2 4 5 2,4-Pentadien sp 3 2) Kumulierte
Lernmaterial Lernfeld 1 Grundlagen Physik und Chemie. Chemische Grundlagen, Bindungsarten. Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms
 Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Chemische Grundlagen, Bindungsarten Zu Erinnerung : Schematischer Aufbau eines Wasserstoffatoms Hier ist ein Lithiumatom schematisch dargestellt. Elektronen umkreisen den Kern in diskreten Bahnen IQ Technikum
Beschreiben Sie den Aufbau und die Eigenschaften der Kohlenwasserstoffe.
 den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
den Aufbau und die Eigenschaften der Kohlenwasserstoffe. nur Kohlenstoff- und Wasserstoffatome mit einander verbunden Kohlenstoffatom ist vierbindig Wasserstoffatom ist einbindig Skelett aller KW wird
Grundwissen Chemie Jahrgangsstufe 10, naturwissenschaftlicher Zweig. Methan Ethan Propan Butan Pentan Hexan Heptan Octan Nonan Decan
 Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Grundwissen hemie Jahrgangsstufe 10, homologe Reihe der Alkane Summenformel 4 2 6 3 8 4 10 5 12 6 14 7 16 8 18 9 20 10 22 Allgemeine Summenformel: n 2n+2 Name Methan Ethan Propan Butan Pentan exan eptan
Inhaltsverzeichnis. 3 Gesättigte Kohlenwasserstoffe (Alkane) 3.1 Offenkettige Alkane 3.2 Cyclische Alkane
 Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Inhaltsverzeichnis 1 Chemische Bindung in organischen Verbindungen 1.1 Einleitung 1.2 Grundlagen der chemischen Bindung 1.3 Die Atombindung (kovalente oder homöopolare Bindung) 1.4 Bindungslängen und Bindungsenergien
Das Tetraeder-Bällchen/Oktaeder-Bällchen
 H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
H-Atome: klein, weiß Edelgas-Atome: He, Ne, Ar, Kr, Xe, Rn: verschiedene Lila-Töne Metalle: Natrium, Calcium: eher Dunkelblau-Töne Nichtmetalle: C N O F P S Cl grau (kopiert) hellblau rot hellgelb orange
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3
 Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Übungen zur VL Chemie für Biologen und Humanbiologen 18.11.2011 Lösung Übung 3 Teil 1: Die Geometrie organischer Verbindungen 1. Welche Form hat ein s-orbital? Welche Form haben p-orbitale? Skizzieren
Vergleichende Reaktionsmechanismen
 Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Vergleichende Reaktionsmechanismen 1. rdnen Sie die angegebenen Reaktionen einem Reaktionstyp zu und formulieren Sie den Reaktionsmechanismus. Radikalische
Drill&Practice: Aufgaben und Lösungen, A. Dinter, KME 1 Vergleichende Reaktionsmechanismen 1. rdnen Sie die angegebenen Reaktionen einem Reaktionstyp zu und formulieren Sie den Reaktionsmechanismus. Radikalische
Prof. Christoffers, Vorlesung Organische Chemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler
 Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
Prof. hristoffers, Vorlesung Organische hemie für Verfahrensingenieure, Umweltschutztechniker und Werkstoffwissenschaftler 1. inführung 1.1 Atomorbitale Die Atome im Molekülverband werden durch lektronen
mentor Abiturhilfe: Chemie Oberstufe
 mentor Abiturhilfen mentor Abiturhilfe: Chemie Oberstufe Organische Chemie. Aufbauwissen von eribert Rampf, Sandra Schaumann-Eckel 1. Auflage mentor Abiturhilfe: Chemie Oberstufe Rampf / Schaumann-Eckel
mentor Abiturhilfen mentor Abiturhilfe: Chemie Oberstufe Organische Chemie. Aufbauwissen von eribert Rampf, Sandra Schaumann-Eckel 1. Auflage mentor Abiturhilfe: Chemie Oberstufe Rampf / Schaumann-Eckel
Hybridorbitale und ihre Bedeutung
 Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
Hybridorbitale und ihre Bedeutung Roland Heynkes 27.4.2005, Aachen Die Chemie wird kaum von den Atomkernen und den inneren Elektronenschalen, sondern hauptsächlich von der jeweils äußersten Elektronenschale
Organische Chemie I Chemie am 16.11.2012. Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2
 Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
Organische Chemie I Inhaltsverzeichnis Lewisformeln von Kohlenstoffverbindungen korrekt zeichnen!... 2 Verstehen was Organische Chemie heisst und die Entstehung von Kohlenstoffverbindungen kennen!... 2
08.12.2013. Wichtige Stoffgruppen. Stoffgruppe. Atomverband. Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Metall Metall:
 1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
1 Wichtige Stoffgruppen Atomverband Metall Metall: Metall Nichtmetall: Stoffgruppe Metallische Stoffe (Gitter) - Metalle - Legierungen (- Cluster) Salzartige Stoffe (Gitter) - Salze Nichtmetall Nichtmetall:
Summenformel Elektronenstrichformel Name Siedepunkt
 Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
Die homologe Reihe der Alkene Summenformel Elektronenstrichformel Name Siedepunkt C 2 H 4 Ethen -104 C C 3 H 6 Propen -47 C C 4 H 8 1-Buten -6 C C 5 H 10 (...) 1-Penten 30 C C 6 H 12 (...) 1-Hexen 63 C
3. AUFBAU ORGANISCHER VERBINDUNGEN - ISOMERIEN
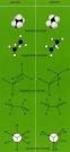 3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
3 AUFBAU ORGANISER VERBINDUNGEN - ISOMERIEN Die Bindungsverhältnisse und die Geometrien von Kohlenwasserstoffen lassen sich mit ilfe des ybrdisierungskonzepts verstehen und anschaulich darstellen (siehe
Radikalische Substitution von Alkanen
 adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
adikalische Substitution von Alkanen KW mit sp³-hybridisierten C-Atomen (z.b. in Alkanen) und alogene Gemisch aus alogenalkanen und alogenwasserstoff Licht C n n à C n n1 eaktionsmechanismus z.b. Chlorierung
1.4. Die Darstellung von Strukturen
 1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
1 Elektronenstruktur und Bindung Säuren und Basen 3D-Moleküle: Li, 2, F zieht positive Ladungen an rot orange gelb grün blau zieht negative Ladungen an stärkstes negatives elektrostatisches Potenzial stärkstes
Organische Chemie. Kapitel 1. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Organische Verbindungen enthalten Kohlenstoff
 rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
rganic Chemistry 4 th Edition Paula Yurkanis Bruice Kapitel 1 Elektronische Struktur und Bindung Säuren und Basen rganische Chemie rganische Verbindungen enthalten Kohlenstoff Kohlenstoff ist weder ein
Grundlagen der Chemie Die Atombindung Kovalente Bindungen
 Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
Die Atombindung Kovalente Bindungen Prof. Annie Powell KIT Universität des Landes Baden-Württemberg und nationales Forschungszentrum in der Helmholtz-Gemeinschaft www.kit.edu Kovalente Bindungen In einem
2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten
 Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Inhalt: 1. Regeln und Normen Modul: Allgemeine Chemie 2. Elementare Stöchiometrie I Definition und Gesetze, Molbegriff, Konzentrationseinheiten 3.Bausteine der Materie Atomkern: Elementarteilchen, Kernkräfte,
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./
 Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
Übung zum chemischen Praktikum für Studierende mit Chemie als Nebenfach Übung Nr. 5, 17./18.05.11 Wiederholung: Säurestärke organischer Verbindungen 1. a) Wovon hängt die Säurestärke einer organischen
 INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 Säuren und Basen der organischen Chemie 5 3.2 Chemische Reaktionstypen 15 3.3 Stereochemie 39 3.4 Alkane, Cycloalkane
Übungsbeispiele Kapitel Organische Verbindungen
 Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Übungsbeispiele 26. 1. 2016 Kapitel rganische Verbindungen 10) (9 Punkte) Schreiben Sie Valenzstrichformeln für folgende Substanzen: 3-Methyl-1-hepten, 2E-Nonen-4,5-diol-6-on, 2,3-Dihydroxybutandisäure,
Grundwissen C8 NTG. 1. Stoffe und Reaktionen. Reinstoff
 Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Grundwissen C8 NTG 1. Stoffe und Reaktionen Reinstoff Stoffgemisch - besitzt unter bestimmten Bedingungen (z.b. Temperatur, Druck ) kennzeichnende Eigenschaften, z.b. Farbe, Geruch, Geschmack, Dichte,
Übungsaufgaben zur Vorlesung Chemie für Biologen, WS 2005/2006
 Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Übungsaufgaben zur Vorlesung hemie für Biologen, WS 2005/2006 Themenbereiche Atombau, chemische Bindung, Stöchiometrie, Aggregatzustände 1. Ergänzen Sie folgende Tabelle: Symbol Z M Protonen eutronen Elektronen
Station 1: Nomenklatur von Alkanen
 Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
Station 1: Nomenklatur von Alkanen Station 1: Nomenklatur von Alkanen 1. a) 3-Ethyl-2-methylpentan e) 2,2-Dimethylpropan b) 3-Ethyl-2-methylpentan f) 2,3,5-Trimethylhexan c) 2,3,5-Trimethylhexan g) 2,3-Dimethylbutan
CHEMIE 7. Klasse - (Kernstoff) ORG. Bausteine der Stoffe: Aufbau der Atome Aufbau der Elektronenhülle Atommodelle: Dalton, Bohr Orbitalmodell
 7. Klasse - (Kernstoff) ORG Bausteine der Stoffe: Aufbau der Atome Aufbau der Elektronenhülle Atommodelle: Dalton, Bohr Orbitalmodell Ordnung der Elemente: Aufstellung des Periodensystems Eigenschaften
7. Klasse - (Kernstoff) ORG Bausteine der Stoffe: Aufbau der Atome Aufbau der Elektronenhülle Atommodelle: Dalton, Bohr Orbitalmodell Ordnung der Elemente: Aufstellung des Periodensystems Eigenschaften
13.1. Struktur der Carbonyl-Gruppe, Prinzipielle Reaktivität
 13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
13. arbonyl -Verbindungen 13.1. Struktur der arbonyl-gruppe, Prinzipielle Reaktivität 13.2. Aldehyde & Ketone 13.2.1 Nomenklatur 13.2.2 Darstellungen xidationen 13.2.3 Reaktionen Additionen an der = Acetale
IUPAC muss das denn sein?
 IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
IUPAC muss das denn sein? Die Begriffe Methan, Aceton, Formaldehyd, Ameisensäure oder Zitronensäure haben alle schon einmal gehört. Diese Namen verraten nichts über den Aufbau der benannten Moleküle und
VII INHALTSVERZEICHNIS
 VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
VII INHALTSVERZEICHNIS MC-FRAGEN 3. ORGANISCHE CHEMIE 1 3.1 Grundzüge der chemischen Bindung 1 3.2 Chemische Reaktionstypen 12 3.3 Stereochemie 30 3.4 Alkane, Cycloalkane 46 3.5 Alkene, Alkine 47 3.6 Aromatische
Elektronenkonfiguration
 Um die chemischen Eigenschaften von Elementen zu verstehen, muss man deren Elektronenkonfiguration kennen. Als Elektronenkonfiguration bezeichnet man die Verteilung der Elektronen auf Schalen um den Kern
Um die chemischen Eigenschaften von Elementen zu verstehen, muss man deren Elektronenkonfiguration kennen. Als Elektronenkonfiguration bezeichnet man die Verteilung der Elektronen auf Schalen um den Kern
Oktett-Theorie von Lewis
 Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Oktett-Theorie von Lewis Oktettregel Atome versuchen durch die Nutzung gemeinsamer Elektronenpaare möglichst ein Elektronenoktett zu erlangen. allgemeiner: Edelgasregel Atome streben durch Vereinigung
Organische Chemie. Kohlenwasserstoffe. Alkane. Alkane
 1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
1 1 Organische Chemie beschäftigt sich mit Verbindungen, die C- Atome enthalten 2 2 Kohlenwasserstoffe bestehen ausschließlich aus C- und H- Atomen 3 3 es existieren nur C-H Einfachbindungen C-C Einfachbindung
Chemie-Tutorien zur Vorbereitung auf das Praktikum
 Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Seite 1 von 7 LMU Co.Med (Curriculumsoptimierung Medizin) Chemie-Tutorien zur Vorbereitung auf das Praktikum 07.03.-18.03.2017 Dienstag, 07.03.2017 18.00-20.00 Uhr Grundlagen der Chemie I Donnerstag, 09.03.2017
Organische Chemie I. OC I Lehramt F. H. Schacher 1
 Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Organische Chemie I OC I Lehramt F. H. Schacher 1 Organisatorisches Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni jena.de Termine: Vorlesung: Freitag 12 14 Uhr Hörsaal,
Arene (Benzolderivate)
 Arene (Benzolderivate) Im Verlauf der Vorlesung haben wir bereits einige kennengelernt: DDT, DIXI, Cumol... hier nun weitere wichtige Vertreter: Acetylsalicylsäure (Aspirin) Synthese über die Kolbe-Schmitt-Synthese
Arene (Benzolderivate) Im Verlauf der Vorlesung haben wir bereits einige kennengelernt: DDT, DIXI, Cumol... hier nun weitere wichtige Vertreter: Acetylsalicylsäure (Aspirin) Synthese über die Kolbe-Schmitt-Synthese
Grundwissenskatalog Chemie G8 8. Klasse nt
 Grundwissenskatalog Chemie G8 8. Klasse nt 1. Wissenschaft Chemie: Chemie ist die Lehre von den Stoffen. Chemischer Vorgang: Stoffänderung Physikalischer Vorgang: Zustandsänderung 2. Unterteilung Stoffe:
Grundwissenskatalog Chemie G8 8. Klasse nt 1. Wissenschaft Chemie: Chemie ist die Lehre von den Stoffen. Chemischer Vorgang: Stoffänderung Physikalischer Vorgang: Zustandsänderung 2. Unterteilung Stoffe:
Grundwissen Chemie 9. Jahrgangsstufe Sprachlicher Zweig
 Grundwissen Chemie 9. Jahrgangsstufe Sprachlicher Zweig 1. Stoffeigenschaften und modell a) modell Alle Stoffe bestehen aus kleinsten Die eines Stoffes sind untereinander gleich. Die verschiedener Stoffe
Grundwissen Chemie 9. Jahrgangsstufe Sprachlicher Zweig 1. Stoffeigenschaften und modell a) modell Alle Stoffe bestehen aus kleinsten Die eines Stoffes sind untereinander gleich. Die verschiedener Stoffe
Kennsilbe. -an. -en -in. -yl. -ol. -al (VI) -on. (VII) -säure (VIII)
 Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Hinweise und Übungen zur Nomenklatur (Benennung) organischer Verbindungen Die Vielfalt organischer Verbindungen ist im Gegensatz zur anorganischen hemie durch wenige Elemente aber zahlreiche Strukturmöglichkeiten
Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe
 1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
1 Übungssblatt 3: Alkene und weitere cyclische Kohlenwasserstoffe Warm Up 1) Erweitern Sie die Ihnen bekannten Regeln der Nomenklatur für Alkene und benennen danach folgende Verbindungen. Die Regel zur
Ein Alkan, dem ein H-Atom fehlt, wird Alkyl-Rest genannt. Der Name ergibt sich aus dem Alkan, jedoch mit der Endung yl:
 Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Organische Chemie Unter organischer Chemie versteht man die Chemie der Kohlenwasserstoffe und ihre Derivate. Die C- Atome verbinden sich durch Kovalentebindung (Einfach-, Doppel- und Dreifachbindungen)
Vorlesung Chemie für Biologen: Klausur 1 WS Sa
 1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
1 Vorlesung Chemie für Biologen: Klausur 1 WS 02-03 Sa 07.12.02 Name:... Ihre Unterschrift:... Vorname:... Matrikel-Nr.:... Studienbeginn: SS: WS:...... Tutor der Übungen: (Dort Klausureinsicht.) Punkteschlüssel
Organische Chemie I Molekül der Woche - Azulen
 I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
I Molekül der Woche - Azulen 1 I Alkine C n H 2n-2 Bindungslängen Der C-H-Abstand verringert sich in dem Maße, wie der s-anteil an der Hybridisierung des C-Atoms wächst Schwermetallacetylide Ag 2 C 2 und
(2.65 ev), da sich die beiden Elektronen gegenseitig abstossen.
 phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
phys4.026 Page 1 13.8 Das Wasserstoff-Molekül Wie im Fall des H2 + Moleküls führen im H2 Molekül symmetrische Wellenfunktionen zu bindenden Zuständen, wohingegen anti-symmetrische Wellenfunktionen zu anti-bindenden
Inhalt. 1 Atombau Die chemische Bindung Energetik chemischer Reaktionen 50. Vorwort 9
 Vorwort 9 1 Atombau 10 1.1 Dalton-Modell 10 1.2 Thomson-Modell 12 1.3 Kern-Hülle-Modell (Rutherford-Modell) 12 1.4 Bohrsches Atommodell 14 1.5 Schalenmodell Bau der Atomhülle 18 1.6 Orbitalmodell 20 Kennzeichen
Vorwort 9 1 Atombau 10 1.1 Dalton-Modell 10 1.2 Thomson-Modell 12 1.3 Kern-Hülle-Modell (Rutherford-Modell) 12 1.4 Bohrsches Atommodell 14 1.5 Schalenmodell Bau der Atomhülle 18 1.6 Orbitalmodell 20 Kennzeichen
Klausur zur Vorlesung "Grundzüge der Chemie" für Studierende des Maschinenbaus BITTE AUSFÜLLEN BITTE HALTEN SIE IHREN STUDENTAUSWEIS BEREIT
 1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
1 PUNKTZAL NTE Klausur zur Vorlesung "Grundzüge der hemie" für Studierende des Maschinenbaus Termin: 17. Juni 2003 rt: Z 10 Zeit: 9.30-11.30 Uhr Dauer: 120 Minuten BITTE AUSFÜLLEN BITTE ALTEN SIE IREN
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Blatt 1 Brownsche Bewegung Beobachte die Bewegung von Rauchteilchen unter dem Miskroskop. Wie kann man die vom schottischen Botaniker
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)
 Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
Kohlenstoffverbindungen und Gleichgewichtsreaktionen (EF)... interpretieren den zeitlichen Ablauf chemischer Reaktionen in Abhängigkeit von verschiedenen Parametern (u.a. Oberfläche, Konzentration, Temperatur)
CHE 172.1: Organische Chemie für die Life Sciences
 1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
1 CHE 172.1: Organische Chemie für die Life Sciences Prof Dr. J. A. Robinson 1. Struktur und Bindung organischer Moleküle 1.1 Atomstruktur : Die Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number)
Selbsteinschätzungstest zum Vorkurs Organische Chemie
 WS 15/16 1/16 Selbsteinschätzungstest zum Vorkurs rganische hemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NIT die späteren Studieninhalte. Die Inhalte des Vorkurses
WS 15/16 1/16 Selbsteinschätzungstest zum Vorkurs rganische hemie Liebe Studierende! Der Vorkurs frischt Ihr Schulwissen auf, vermittelt aber NIT die späteren Studieninhalte. Die Inhalte des Vorkurses
Erläutere den CO 2 -Nachweis. Definiere den Begriff exotherme Reaktion und zeichne ein passendes Energiediagramm. Grundwissenskatalog Chemie 8 NTG
 Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
Erläutere den CO 2 -Nachweis. Wird das Gas in Kalkwasser (Ca(OH) 2 ) eingeleitet bildet sich ein schwerlöslicher Niederschlag von Calciumcarbonat (CaCO 3 ). Abgabe von innerer Energie (Wärme, Knall,...)
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen
 KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
KATA LOGO Organische Chemie - Zusammenhänge wichtiger funktioneller Gruppen Ketone werden nicht weiter oxidiert Ether R1 - O - R2 R-O- ersetzt H bei einem Alkan Ether: MTBE (Antiklopfmittel) Tertiäre Alkohole
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie
 Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Physik-Übung * Jahrgangsstufe 8 * Modellvorstellung vom Aufbau der Materie Aufgabe 1 * Mischung von Flüssigkeiten 3 Gruppen mischen Spiritus mit Wasser. 3 Gruppen mischen jeweils Erbsen mit Grieß. Füllt
Definiere den Begriff Chemischer Vorgang! Definiere den Begriff Physikalischer Vorgang!
 Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Chemischer Vorgang! Stoffänderung, keine Zustandsänderung, mit Energiebeteiligung Physikalischer Vorgang! Zustandsänderung, keine Stoffänderung (z.b. Lösen, Aggregatzustände,...) Erkläre die Begriffe heterogenes
Orbitalmodell SPF BCH am
 Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
Orbitalmodell Inhaltsverzeichnis Sie können sich unter einer elektromagnetischen Welle etwas vorstellen. Sie kennen typische Eigenschaften von Wellen im Vergleich zu Teilchen-Strahlen...2 Sie können die
a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten!
 Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
Übung Nr. 9 Mi. 02.05.2012 bzw. Fr. 04.05.2012 1. Aromatensynthese a) Schlagen Sie eine Synthese für den folgenden Aromaten vor, ausgehend von den gezeigten Edukten! b) Was passiert bei der Umsetzung von
INHALTSVERZEICHNIS. 1. Allgemeine Grundlagen 2. Grundbegriffe organisch-chemischer Reaktionen 3. Stereochemie 4. Stoffgruppen
 IALTSVERZEIIS 1. Allgemeine Grundlagen 2. Grundbegriffe organisch-chemischer Reaktionen 3. Stereochemie 4. Stoffgruppen 4.1. Alkane 4.2. Alkene, Alkine 4.3. Aromatische Systeme 4.4. alogenkohlenwasserstoffe
IALTSVERZEIIS 1. Allgemeine Grundlagen 2. Grundbegriffe organisch-chemischer Reaktionen 3. Stereochemie 4. Stoffgruppen 4.1. Alkane 4.2. Alkene, Alkine 4.3. Aromatische Systeme 4.4. alogenkohlenwasserstoffe
