> Grundpraktikum Organische Chemie im Wintersemester 2013 / 2014 Prof. Dr. B. J. Ravoo, Prof. Dr. F. Glorius, Dr. Simon Janich
|
|
|
- Wilhelm Jaeger
- vor 7 Jahren
- Abrufe
Transkript
1 > Grundpraktikum rganische Chemie im Wintersemester 2013 / 2014 Prof. Dr. B. J. Ravoo, Prof. Dr. F. Glorius, Dr. Simon Janich > Praktikumsskript rganisch-chemisches Institut der Westfälischen Wilhelms-Universität
2 INHALT I. TERMINE 3 II. RGANISATRISCHE HINWEISE ZUM PRAKTIKUM 4 Rundschreiben 4 Vor dem Praktikum 5 Während des Praktikums 5 Nach dem Praktikum 7 Fristen 7 III. PRÄPARATIVER TEIL DES PRAKTIKUMS 8 Versuchseinteilung 8 Arbeitsmethoden 9 1. Präparat: Radikalische Substitution Präparat: Nucleophile Substitution Präparat: Addition an C C-Mehrfachbindungen Präparat: Aromatische Substitution Präparat: Friedel-Crafts Reaktionen Präparat: Carbonylreaktionen I Addition von Enolaten an Carbonylverbindungen Präparat: Carbonylreaktionen II Nukleophile Substitutionen an Carbonylverbindungen Präparat: Carbonylreaktionen III Nukleophile Substitution des Carbonylsauerstoffs Präparat: Carbonylreaktionen IV Enolate als Nukleophile Präparat: Grignard-Reaktionen Präparat: Reduktionen Präparat: Umlagerungen 34 IV. KURZE RICHTLINIEN ZUR PRTKLLFÜHRUNG 36 V. SAALDIENSTE 38 Einteilung der Saaldienste 39 VI. SICHERHEITSHINWEISE ZUM PRAKTIKUM 40 Betriebsanweisung für das Grundpraktikum rganische Chemie nach 20 GefStoffV 40 Besondere Sicherheitsbestimmungen 45 Entsorgung 46 Hinweise auf besondere Gefahren und Sicherheitsratschläge (H- und P-Sätze nach GHS) 48 VII. TESTATE 55 VIII. ERKLÄRUNG 57 IX. PLATZAUSRÜSTUNG 59
3 Grundpraktikum rganische Chemie I. TERMINE Vorlesung Beginn: , semesterbegleitend, Mo. Mi., Fr. Sicherheitsunterweisung und allg. Informationen zum Praktikum 9.00 s.t Uhr C1 Prof. Glorius Mo., Uhr s.t. C1 Prof. Ravoo, Prof. Glorius, Dr. Kehr, Dr. Seppi, Dr. Janich Platzübernahme und Feuerlöschübung : Kurs 1: Mo., im Anschluss an die Sicherheitsunterweisung Kurs 2: Mo., Uhr Praktikumssäle 3.38, 4.33, 4.38 Praktikumszeiten: Kurs 1: Di.: Uhr Mi.: Uhr Kurs 2: Do.: Uhr Fr.: Uhr Dr. Seppi, wiss. Mitarbeiter Praktikumssäle 3.38, 4.33, 4.38 Platzabgabe: Kurs 1: Kurs 2: Fr., Fr., jeweils ab Uhr Praktikumssäle 3.38, 4.33, 4.38 Prof. Ravoo, Prof. Glorius, Dr. Kehr, Dr. Janich, wiss. Mitarbeiter wiss. Mitarbeiter 1. Klausur Mi., Uhr C1 Prof. Glorius 2. Klausur Fr., Uhr C1 Prof. Glorius Nachklausur Fr., Uhr C1 Prof. Glorius Weitere Informationen sowie Änderungen und sonstige Ankündigungen im WWW unter: 3
4 Grundpraktikum rganische Chemie II. RGANISATRISCHE HINWEISE ZUM PRAKTIKUM Rundschreiben an die Teilnehmer des Grundpraktikums rganische Chemie im Wintersemester 2013/2014 Das rganisch-chemische Grundpraktikum wird an der Universität Münster, wie an fast allen bundesdeutschen Universitäten, als Kurspraktikum durchgeführt. Es hat sich gezeigt, dass diese Praktikumsform dem Chemiestudierenden die beste Möglichkeit bietet, sich durch enge Verbindung von Experiment und Theorie die grundlegenden Kenntnisse über Synthese, Reaktivität und Analytik organischer Verbindungen rationell und rasch anzueignen. Hierzu ist eine enge Zusammenarbeit mit den Assistenten erforderlich, die Sie intensiv anleiten werden und Ihnen während des Praktikums mit Rat und Hilfe zur Verfügung stehen. Scheuen Sie sich bitte nicht, sich in allen anstehenden Fragen an die Assistenten oder die Praktikumsleiter zu wenden! Trotz des hohen organisatorischen Aufwands kann ein als Kurs durchgeführtes Praktikum nur bei intensiver Zeitausnutzung erfolgreich sein. Die Laborzeiten in der Woche (Di Uhr, Mi Uhr, Do Uhr, Fr Uhr) sind zur Durchführung sämtlicher Experimente ausreichend. Die verbleibende Zeit benötigen Sie aber dringend zur Erarbeitung der theoretischen Grundlagen und zur Vorbereitung auf die experimentellen Arbeiten. Um eine erfolgreiche Durchführung des Praktikums zu gewährleisten, gelten folgende Richtlinien: Standardwerk für die Experimente im Praktikum ist das Buch Praktikum Präparative rganische Chemie rganisch-chemisches Grundpraktikum (R. Brückner, S. Braukmüller, H.-D. Beckhaus, J. Dirksen, D. Goeppel, M. estreich, Spektrum Akademischer Verlag Heidelberg, 1. Aufl., 2008). Es ist unbedingt erforderlich, dass Sie vor Beginn der experimentellen Arbeiten gründlich das Kapitel IV Ausgewählte Arbeitstechniken durcharbeiten.! Erforderliche Änderungen werden am Schwarzen Brett des Praktikums bekannt gegeben! rganisation: Raum Telefonnummer Prof. B. J. Ravoo III Prof. F. Glorius Dr. G. Kehr Dr. S. Janich II
5 Grundpraktikum rganische Chemie Vor dem Praktikum > Die Teilnahme an der Sicherheitsunterweisung und der Vorbesprechung (Unterschrift) sind Voraussetzung für die Teilnahme am Praktikum! > Nach der Vorbesprechung erhalten Sie einen Laufzettel, auf dem Sie Ihre persönlichen Daten bitte kontrollieren. Der Laufzettel verbleibt bis zum Ende des Praktikums bei Ihnen. Bei Verlust des Laufzettels kann das Praktikum nicht mehr angerechnet werden. > Sie erhalten des weiteren einen Spindschlüssel und einen Laborplatzschlüssel. > Sie übernehmen diesen Laborplatz anhand der Liste auf der entsprechenden Erklärung am Ende dieses Skripts (S. 59) und bestätigen den Erhalt. Fehlende oder schadhafte Geräte reklamieren Sie bitte sofort, damit sie ersetzt werden können (im Laufe der ersten Kurswoche). Spätere Reklamationen werden nicht mehr berücksichtigt! Verschmutzte Glasgeräte sind zwar ärgerlich, können in der Regel aber noch gereinigt werden (den Assistenten nach Tipps fragen). Die ausgefüllte Erklärung zur Platzübernahme bekommt Ihr Gruppenassistent. > Füllen Sie die zweite Erklärung (S. 57), dass Sie die Laboratoriumsordnung sowie die Betriebsanweisungen zum Praktikum zur Kenntnis nehmen, vollständig aus und geben sie Ihrem Gruppenassistenten. Sicherheitsbestimmungen: Während des Praktikums > Das ständige Tragen einer Schutzbrille und eines Kittels in den Praktikumssälen ist Pflicht. Im gesamten Gebäude ist das Rauchen streng verboten! > Es empfiehlt sich, sich über den letzten Termin der eigenen Tetanus-Schutzimpfung zu informieren! > Auf weitere Sicherheitsvorkehrungen werden Sie bei der Sicherheitsunterweisung von Herrn Dr. Seppi, die ebenso wie die Feuerlöschübung eine Pflichtveranstaltung ist, hingewiesen. > Den Anweisungen der Assistenten ist strikt Folge zu leisten! Platzausrüstung: > Sichern Sie Ihren Arbeitsplatz sofort mit dem Schlüssel, den Sie von Ihrem Assistenten erhalten. > Wir bitten um schonende Behandlung der Geräte sowie der übrigen Leihapparaturen. Beschädigte oder abhanden gekommene Teile müssen vom Praktikumsteilnehmer ersetzt werden. Beschädigte Glasgeräte können bei den Glasbläsern des Instituts in Raum 139 zur Reparatur gegeben werden (Mo. Do., 8 11 und Uhr). Vor der Laborarbeit: Bevor Sie mit der praktischen Arbeit an den Präparaten beginnen, bereiten Sie sich vorher gut darauf vor! > Machen Sie sich mit den Arbeitsschritten vertraut! Die allermeisten der folgenden Präparate werden nach Vorschriften aus dem Buch Praktikum Präparative rganische Chemie rganisch-chemisches Grundpraktikum (R. Brückner, S. Braukmüller, H.-D. Beckhaus, J. Dirksen, D. Goeppel, M. estreich, Spektrum Akademischer Verlag Heidelberg, 1. Aufl., 2008) im Folgenden nur kurz als Brückner in den Literaturverweisen bezeichnet dargestellt. 5
6 Grundpraktikum rganische Chemie Zum Teil sind den Kapiteln in diesem Praktikumsbuch noch allgemeine Arbeitsvorschriften vorangestellt, die ebenfalls wichtige Details zum Aufbau der Apparatur und der Durchführung enthalten. Lesen Sie diese Vorschriften gründlich durch und beachten Sie dabei auch die Anmerkungen in den Fußnoten. > Erarbeiten Sie den theoretischen Hintergrund der Synthesen! Die Kenntnis der Theorie ist untrennbar mit der praktischen Arbeit verbunden. Sie ist nicht nur für Klausuren und Prüfungen wichtig, sondern auch dafür, dass Sie verstehen können, was Sie tun. So können Sie die Arbeitsschritte der Vorschriften gedanklich nachvollziehen und auch sicherheitsrelevante Aspekte der Synthesen erkennen, zum Beispiel wenn während der Reaktion ein potentiell schädliches oder gefährliches Nebenprodukt entsteht. Zur Vertiefung der theoretischen Kenntnisse empfehlen wir folgende Lehrbücher: Peter Vollhardt, Neil E. Schore : rganische Chemie, 3. Aufl. VCH Weinheim, 2000 Reinhard Brückner: Reaktionsmechanismen, Spektrum-Verlag, 2004 Clayden, Greeves, Warren, Wothers, rganic Chemistry, 2nd Ed., xford University Press, 2012 Maitland Jones, Jr.: rganic Chemistry, W. W. Norton & Company, New York / London, 2004 Eberhart Breitmaier, Günther Jung: rganische Chemie, 4. Aufl. Thieme Stuttgart, 2001 Bernd Goldfuß: Mechanismus & Synthese in der rganischen Chemie, 2. Aufl. USB Publishing Köln, 2005 > Machen Sie sich über die Sicherheit Gedanken! Die Vorschriften im Brückner enthalten häufig wertvolle Hinweise, wie Sie die Reaktionen sicher durchführen können. Darüber hinaus müssen Sie eine Betriebsanweisung für Ihr Präparat erstellen außer für die Versuche A.1 bis A.8, die alle sicherheitsrelevanten Informationen über die durchzuführende Reaktion enthält, beispielsweise auch Hinweise zur Ersten Hilfe und zur Entsorgung (Vordruck im Internet). Diese Betriebsanweisung muss vollständig ausgefüllt und von Ihrem Saalassistenten abgezeichnet sein, bevor Sie mit der Arbeit an dem Präparat beginnen. Das ist auch in Ihrem Interesse: bei Ihrer Arbeit im Praktikum werden Sie es öfters mit Substanzen zu tun haben, die schädlich oder gefährlich sein können. Wenn Sie sich jedoch vorher über den korrekten Umgang damit Gedanken machen und die entsprechenden Sicherheitshinweise einhalten, werden Sie sicher mit diesen Substanzen arbeiten können. Bitte beachten Sie diese Punkte: Sie werden von Ihrem Saalassistenten darauf hin in Einzel- oder Gruppenkolloquien befragt. Bei Erfolg, wird Ihnen das entsprechende Antestat abzeichnet (Vordruck s. S. 55). Sie dürfen mit der praktischen Arbeit nur mit gültigem Antestat beginnen! Präparate: > Die Präparate sollen in der Regel zum Ende der jeweils zugehörigen Praktikumswoche in Schraubdeckelgläschen abgegeben werden. Ausnahmen sind in Absprache mit dem Gruppenassistenten möglich. Das fertige Präparat wird auf dem entsprechenden Vordruck (S. 55) abtestiert. > Nicht abgegebene sowie nicht anerkannte Präparate müssen wiederholt werden. 6
7 Grundpraktikum rganische Chemie Protokolle: > Die Protokolle zu den Versuchen müssen spätestens eine Woche nach der Versuchsdurchführung vollständig abgegeben werden (in Rücksprache mit dem betreuenden Assistenten kann dieser Zeitraum verlängert werden). > Unvollständige Protokolle oder ohne Rücksprache zu spät abgegebene Protokolle führen zur Wiederholung, bzw. Nichtanerkennung des Versuchs. > Das fertige (ggf. korrigierte) Protokoll wird auf dem entsprechenden Vordruck (S. 55) abtestiert. > Beachten Sie die Richtlinien zur Protokollführung (S. 36) Scheuen Sie sich bitte nicht, sich mit anstehenden Fragen an die Gruppen-, bzw. Saalassistenten oder die Praktikumsleiter zu wenden! Nach dem Praktikum > Die Platzabgabe erfolgt anhand der Liste auf der Rückseite des Laufzettels. Eventuell fehlende, beschädigte oder stark verschmutzte Geräte werden nicht akzeptiert und müssen bis dahin sorgfältig gesäubert, repariert oder ersetzt worden sein. Am Schluss des Kurses werden Ihre Apparaturen vom Assistenten überprüft. > Reparaturen von Glasgeräten müssen rechtzeitig vor Praktikumsende (14 Tage) zum Glasbläser gebracht werden. Gutscheine werden nicht mehr anerkannt. > Bitte übergeben Sie Ihren Arbeitsplatz am Praktikumsende frisch mit Papier ausgelegt. > Mit dem vollständig ausgefüllten Testatvordruck bekommen Sie beim rganisationsassistenten (Dr. S. Janich) die entsprechende Unterschrift auf dem Laufzettel. > Die Kosten für selbstverschuldete Reparaturen oder Ersatz von Glasgeräten und sonstiger Ausrüstung und eine anteilige Umlage für Verbrauchsmaterialien und Chemikalien müssen Sie nach Abschluss des Praktikums selbst begleichen (im Geschäftszimmer der C). > Das Praktikum gilt erst nach Erfüllung aller Verpflichtungen als erfolgreich beendet. Fristen Erledigen Sie die obengenannten Verpflichtungen bis zu den folgenden Terminen. Bei unentschuldigter Versäumnis der Fristen wird Ihnen das Praktikum nicht mehr anerkannt. > Protokolle (inkl. aller Korrekturen): (1. Kurs) (2. Kurs) > Vorlage der vollständigen Testate: > Vorlage des vollständigen Laufzettels:
8 Grundpraktikum rganische Chemie III. PRÄPARATIVER TEIL DES PRAKTIKUMS Versuchseinteilung Der folgenden Tabelle können Sie anhand Ihrer Labor-Platznummer entnehmen, welche der verschiedenen Versuche Sie im Praktikum bearbeiten sollen. Die Versuche A.1, A.2 und P.1 bis P.3 sind Gruppenversuche, die Sie in Vierergruppen bearbeiten. Bei den Versuchen A.4 und A.7 gibt es je zwei unterschiedliche Gemische (A und B), von denen Sie eines untersuchen sollen. Bei den Versuchen A.3, A.5, A.6 und A.8 gibt es nur eine Variante, die Sie jeweils alleine bearbeiten. Bei den Präparaten 1 bis 12 bearbeiten Sie immer die gleiche Unternummer (also z.b. 1.1, 2.1, 3.1, usw.). Beachten Sie bei den Präparaten 1 und 2 die geänderte Reihenfolge! Der Grund dafür liegt darin, dass Sie für Präparat 1 zwei Gaswaschflaschen brauchen, aber nur eine in der Platzausrüstung haben. Sie müssen sich daher mit Ihrem Platznachbarn austauschen und können daher das Präparat nicht gleichzeitig bearbeiten. Saal Präparat Nummer A.1 A.2 A.4 A.7 P.1/ P.2 P Gruppenvers. Gruppenvers. A A Gruppenvers. Gruppenvers jeweils Versuch-Nr. 1 (3.1, 4.1, 5.1, usw.) B B jeweils Versuch-Nr. 2 (3.2, 4.2, 5.2, usw.) A A jeweils Versuch-Nr. 3 (3.3, 4.3, 5.3, usw.) B B jeweils Versuch-Nr. 4 (3.4, 4.4, 5.4, usw.) Gruppenvers. Gruppenvers. A A Gruppenvers. Gruppenvers jeweils Versuch-Nr. 1 (3.1, 4.1, 5.1, usw.) B B jeweils Versuch-Nr. 2 (3.2, 4.2, 5.2, usw.) A A jeweils Versuch-Nr. 3 (3.3, 4.3, 5.3, usw.) B B jeweils Versuch-Nr. 4 (3.4, 4.4, 5.4, usw.) Gruppenvers. Gruppenvers. A A Gruppenvers. Gruppenvers jeweils Versuch-Nr. 1 (3.1, 4.1, 5.1, usw.) B B jeweils Versuch-Nr. 2 (3.2, 4.2, 5.2, usw.) A A jeweils Versuch-Nr. 3 (3.3, 4.3, 5.3, usw.) B B jeweils Versuch-Nr. 4 (3.4, 4.4, 5.4, usw.) Gruppenvers. Gruppenvers. A A Gruppenvers. Gruppenvers jeweils Versuch-Nr. 1 (3.1, 4.1, 5.1, usw.) B B jeweils Versuch-Nr. 2 (3.2, 4.2, 5.2, usw.) A A jeweils Versuch-Nr. 3 (3.3, 4.3, 5.3, usw.) B B jeweils Versuch-Nr. 4 (3.4, 4.4, 5.4, usw.) Gruppenvers. Gruppenvers. A A Gruppenvers. Gruppenvers jeweils Versuch-Nr. 1 (3.1, 4.1, 5.1, usw.) B B jeweils Versuch-Nr. 2 (3.2, 4.2, 5.2, usw.) A A jeweils Versuch-Nr. 3 (3.3, 4.3, 5.3, usw.) B B jeweils Versuch-Nr. 4 (3.4, 4.4, 5.4, usw.) Gruppenvers. Gruppenvers. A A Gruppenvers. Gruppenvers jeweils Versuch-Nr. 1 (3.1, 4.1, 5.1, usw.) B B jeweils Versuch-Nr. 2 (3.2, 4.2, 5.2, usw.) A A jeweils Versuch-Nr. 3 (3.3, 4.3, 5.3, usw.) B B jeweils Versuch-Nr. 4 (3.4, 4.4, 5.4, usw.) 8
9 Grundpraktikum rganische Chemie Arbeitsmethoden A.1 Löslichkeit unterschiedlich polarer Verbindungen (Gruppenversuch) Versuchsvorschrift: In jeweils sieben Reagenzgläser werden je 2 3 ml Wasser bzw. Cyclohexan gefüllt. Etwa 1 ml der folgenden Verbindungen wird einerseits zum Wasser, andererseits zum Cyclohexan gegeben: Ethanol, 1-Pentanol, Ethylenglycol (1,2-Ethandiol), konzentrierte Essigsäure, Essigsäureethylester, Aceton und Dichlormethan. Jede Probe wird kurz durchgeschüttelt und festgestellt, ob eine homogene Lösung vorliegt oder ob sich zwei Phasen gebildet haben (Ergebnis mit Erklärung in einer Tabelle im Protokoll festhalten). Protokollaufgaben: Stellen Sie die Ergebnisse in einer Tabelle dar und erklären Sie sie. A.2 Polarität von Lösungsmitteln (Gruppenversuch) Literatur: C. Reichardt, Solvents and Solvent Effects in rganic Chemistry, Wiley-VCH, Weinheim, 3rd Ed., 2003; T. W. Bentley, I. S. Koo, rg. Biomol. Chem., 2004, 2, N Betain-30 Die Polarität von Lösungsmitteln spielt für viele Anwendungen in der rganischen Chemie eine wichtige Rolle, da die Wahl des Lösungsmittels nicht nur bei der effektiven Aufreinigung entscheidend sein kann, sondern auch starken Einfluss auf die Reaktionsraten haben kann. Sie ist aber relativ schwierig experimentell zu quantifizieren. Daher wurde von Reichardt und Dimroth die E T (30)-Skala entwickelt, die auf einfach zu ermittelnden empirischen spektroskopischen Daten basiert 1, und die von von E T (30)=30.7 für Tetramethylsilan als unpolarstes Lösungsmittel bis E T (30)=63.1 für Wasser reicht. 2 Im Kern basiert die Skala darauf, dass der Farbstoff 2,6- Diphenyl-4-(2,4,6-triphenyl-pyridinio)phenolat ( Betain-30 ) in Abhängigkeit von der Polarität des Lösungsmittels unterschiedlich Farben zeigt. 3 Versuchsvorschrift: In neun Reagenzgläsern werden wenige(!) Körnchen des Betain-30 gegeben und mit je 4 5 ml der in der Tabelle angegebenen Lösungsmitteln versetzt. In neun weiteren Reagenzgläsern werden ebenfalls wenige Körnchen des Farbstoffs mit 4 5 ml der folgenden Lösungsmitteln versetzt: Aceton, tert-butanol, Chloroform, Diethylether 4, Dimethylsulfoxid (DMS), Ethylenglycol (1,2- Ethandiol), Isobutanol (2-Methyl-1-propanol), 1-Pentanol und Tetrahydrofuran (THF). Schätzen Sie anhand der Farbe die E T (30)-Werte dieser Lösungsmittel ab. Lösungsmittel E T (30) Toluol Ethylacetat 38.1 Dichlormethan 40.7 Dimethylformamid (DMF) 43.2 Acetonitril (AcCN) 45.6 Isopropanol (2-Propanol) 48.4 Ethanol 51.9 Methanol 55.4 Protokollaufgaben: Stellen Sie die Ergebnisse in einer Tabelle dar und erläutern Sie die Resultate anhand der Eigenschaften der Lösungsmittel. 1 Der Wert ist definiert als die Übergangsenergie in kcal/mol für die langwelligste Absorptionsbande mit der Wellenlänge λ max im UV/Vis-Spektrum, und errechnet sich aus E T (30)=(h c N A )/λ max. 2 Eine Variation ist die normalisierte E N T -Skala, mit E N T =0.0 für Tetramethylsilan und E N T =1.0 für Wasser. 3 Streng genommen wurden die E T (30)-Werte von sehr unpolaren Lösungsmitteln mit einem anderen Derivat ermittelt und dann umgerechnet, da das Betain-30 in diesen Lösungsmitteln unlöslich ist. 4 Reagenzglas bei Bedarf kurz erwärmen oder im Ultraschallbad behandeln. 9
10 Grundpraktikum rganische Chemie A.3 Nachweis und Zerstörung von Etherperoxiden Literatur: rganikum (23. Aufl.), S. 209f u. 756f Versuchsvorschrift: In einem Reagenzglas eine frische Eisen(II)sulfat-Lösung zubereitet, indem eine kleine Spatelspitze Eisenfeilspäne mit 5 ml 2 N Schwefelsäure versetzt wird. Nach einiger Zeit werden etwa 2 ml der entstandenen Lösung in ein zweites Reagenzglas gegossen, mit 5 ml peroxidhaltigem Diethylether und einigen Tropfen einer Kaliumthiocyanat-Lösung versetzt und vorsichtig geschüttelt. In einem dritten Reagenzglas werden 2 ml Eisen(II)sulfat-Lösung mit 5 ml Diethylether aus einer braunen Flasche sowie ebenfalls etwas Kaliumthiocyanat-Lösung versetzt. Sowohl der peroxidhaltige als auch den peroxidfreie Ether werden auch mit Kaliumiodid-Stärke- Papier getestet. Protokollaufgaben: Stellen Sie die Entstehung von Etherperoxiden am Beispiel von Diethylether dar. Erläutern Sie die Nachweisreaktionen mit Eisen(II)sulfat/Kaliumthiocyanat und Kaliumiodid. A.4 Reinigung eines Substanzgemisches durch Extraktion und Umkristallisation Literatur: Brückner, S. 56ff, 62f; rganikum (23. Aufl.), S. 36f, 58ff und 77ff Versuchsvorschrift: Etwa 3 g eines 50:50 Gemisches (Gew.- %), das Benzoesäure, Borneol oder Campher enthält, werden in 25 ml TBME gelöst und mit 50 ml 5%-iger NaH-Lösung extrahiert (Vorsicht, hier kann ein Überdruck im Scheidetrichter entstehen Belüften!). Nach Phasentrennung wird die organische Phase über MgS 4 getrocknet, das Lösungsmittel am Rotationsverdampfer entfernt und der Rückstand durch tropfenweise Zugabe von möglichst wenig TBME in der Hitze gelöst (Apparatur s. Abb.). Es wird tropfenweise mit Pentan bis zur beginnenden Trübung versetzt, die Trübung mit wenigen Tropfen Ether (wie viele?) wieder aufgelöst und die Lösung langsam abkühlen gelassen (bis zum Beginn der Kristallisation kann es einige Minuten dauern). Das kristalline Produkt wird abfiltriert und nach kurzem Trocknen (ca. 15 min) an der Luft sein Schmelzpunkt bestimmt. Die wässrige Phase wird mit halbkonz. Salzsäure auf etwa ph 1 eingestellt (ph-papier) und mit Ether extrahiert. Nach dem Trocknen und Entfernen des Lösungsmittels wird wie oben umkristallisiert und der Schmelzpunkt bestimmt. Anhand der ermittelten Schmelzpunkte (s. unten) werden die Substanzen identifiziert. Schmelzpunkte: ( )-Borneol C; Benzoesäure C; D,L-Campher C. Protokollaufgaben: Geben Sie die ermittelten Schmelzpunkte und die Zusammensetzung des untersuchten Stoffgemisches an. 10
11 Grundpraktikum rganische Chemie A.5 Extraktion von Iod Literatur: Brückner, S. 56f; rganikum (23. Aufl.), S. 58ff Versuchsvorschrift: Aus 2 ml einer 2.55%-igen Iodlösung wird eine Stammlösung hergestellt, indem das Aliquot 10fach mit Wasser verdünnt wird (auf 20 ml Gesamtvolumen auffüllen). a) Herstellen einer Konzentrationsreihe: Mit 2 ml dieser Stammlösung wird eine Verdünnungsreihe (nur ein Mal pro Praktikumsgruppe ansetzen) zum Konzentrationsvergleich angefertigt: 1. Reagenzglas: 1 ml riginalstammlösung 2. Reagenzglas: 1 ml riginalstammlösung + 1 ml Wasser 3. Reagenzglas: 1 ml des 2. RG + 1 ml Wasser 4. Reagenzglas: 1 ml des 3. RG + 1 ml Wasser 5. Reagenzglas: 1 ml des 4. RG + 1 ml Wasser 6. Reagenzglas: 1 ml des 5. RG + 1 ml Wasser b) Wirksamkeit vielfacher bzw. einmaliger Extraktion In einen kleinen Scheidetrichter werden 9 ml der Stammlösung gefüllt. Es wird einmal mit 15 ml Dichlormethan extrahiert. Die beiden Phasen werden getrennt, 1 ml der wässrigen Phase wird in ein Reagenzglas gegeben und die Färbung mit der Konzentrationsreihe verglichen. Der Scheidetrichter wird mit Wasser gespült und die verbliebenen 9 ml der Stammlösung hineingefüllt. Nun wird nacheinander 3 mal mit je 5 ml Dichlormethan extrahiert. Die jeweils abgetrennten organischen Phasen werden gesammelt und von den wässrigen Phasen jeweils 1 ml zum Konzentrationsvergleich in ein Reagenzglas gegeben. Nach Bestimmung der Konzentration wird die Probe zurück in den Scheidetrichter gefüllt und erneut extrahiert. Von den gesammelten organischen Phasen wird 1 ml in ein Reagenzglas gegeben und mit 1 ml dest. Wasser versetzt. Dann wird eine Spatelspitze Kaliumiodid hinzugegeben. Zum Ende des Versuches werden alle I 2 -haltigen Phasen mit Na 2 S 2 3 versetzt, geschüttelt und danach in die entsprechenden Abfallbehälter entsorgt. Protokollaufgaben: Berechnen Sie die I 2 -Konzentrationen in den Reagenzgläsern 2 6. Welche Konzentrationen hatten die wässrigen Phasen nach den jeweiligen Extraktionsvorgängen? Welcher der beiden Extraktionsvorgänge (1 x 15 ml bzw. 3 x 5 ml) war effektiver? Erklären Sie Ihr Ergebnis anhand des Nernst schen Verteilungssatzes. Berechnen Sie den Nernst schen Verteilungskoeffizienten K für Dichlormethan und Wasser. Erklären Sie Ihre Beobachtungen nach der Zugabe von Kaliumiodid. Formulieren Sie die Reaktionsgleichung der Reaktion von I 2 mit Na 2 S
12 Grundpraktikum rganische Chemie A.6 Säulenchromatographische Trennung der Farbstoffe von Gras Literatur: Brückner, S. 51f; rganikum (23. Aufl.), S. 67ff und 70ff Versuchsvorschrift: a) Vorbereitung der Probe: Gras (5 g) wird möglichst klein geschnitten und in einer Porzellanschale mit 4 g Seesand und 4 g Magnesiumsulfat ca. 5 min verrieben. Anschließend werden 30 ml Aceton hinzugefügt und die Farbstoffe durch weiteres Reiben in dem Lösungsmittel aufgenommen. Das Gemisch wird filtriert und der Rückstand weitere fünfmal mit je 10 ml Aceton extrahiert und jeweils filtriert. Von dieser Lösung werden ca. 2 ml als Probe für die folgenden Dünnschichtchromatogramme entnommen. Das oben erhaltene Filtrat wird am Rotationsverdampfer eingeengt, bis kein Aceton mehr abdestilliert. Der Rückstand wird dann in 1 ml des mittels der DCs bestimmten Laufmittels (s.u.) aufgenommen. b) Dünnschichtchromatogramme (DCs): Von der zuvor entnommenen Probe werden zwei Dünnschichtchromatogramme mit verschiedenen Laufmittelgemischen angefertigt: 12 Cyclohexan/Essigsäureethylester: 80:1 Cyclohexan/Aceton: 70:30 Dazu wird auf zwei Dünnschichtplatten zunächst mit einem weichen Bleistift in ca. 1,5 cm Abstand vom unteren Rand eine feine Linie gezogen, ohne die berfläche des Kieselgels zu verletzen. Nun werden mittels einer Pasteurpipette oder eines Schmelzpunktröhrchens auf der Linie in ca. 1 cm Abstand durch ein-, drei- bzw. fünfmal Tüpfeln (nach jedem Tüpfeln das Lösungsmittel verdampfen lassen) drei verschiedene Konzentrationen der Lösung aufgetragen, wobei die Startflecken 2 3 mm Durchmesser haben sollten. Die Entwicklungskammer wird ca. 1 cm hoch mit dem Laufmittel gefüllt. Die Dünnschichtplatten werden in die jeweilige Entwicklungskammer gestellt und diese sofort wieder verschlossen. Die Startlinie darf nicht ins Laufmittel eintauchen! Wenn die Laufmittelfront ca. 1 cm von der oberen Kante der Dünnschichtplatte angekommen ist, wird die Platte entnommen, die Front mit einem Bleistift markiert und im Abzug trocknen gelassen. Anhand der Abstände der Farbstoffflecke ( spots ) wird (nach Rücksprache mit dem Assistenten) entschieden, welches Laufmittel für die säulenchromatographische Trennung genutzt wird. c) Säulenchromatographie: In eine Trennsäule wird trockenes Kieselgel gefüllt, bis die Säule etwa zu 2/3 gefüllt ist (abhängig vom Durchmesser, Rücksprache mit dem Assistenten). Das Kieselgel wird aus der Säule in einen 250 ml Erlenmeyerkolben überführt und mit etwa dem doppelten Volumen Laufmittel aufgeschlämmt. Die Säule wird zu circa einem Drittel mit dem Laufmittelgemisch befüllt, der Hahn geöffnet und das aufgeschlämmte Kieselgel in die Säule gegossen. Das überschüssige Laufmittel wird abgelassen (kann wieder verwendet werden) und dabei gleichzeitig durch Klopfen mit einem Korkring an die Säule eine gleichmäßige Sedimentation des Kieselgels erreicht. Die Säule darf keinesfalls trockenlaufen, um Riss- und Blasenbildung zu vermeiden! Wenn sich das Kieselgel gesetzt hat, wird so viel Laufmittel abgelassen, dass das Kieselgel gerade noch bedeckt ist. Nun wird der oben erhaltene Extrakt vorsichtig und gleichmäßig mit einer Pasteurpipette auf die berfläche gegeben, ohne diese aufzuwirbeln. Das Laufmittel wird wieder abgelassen, so dass die berfläche des Kieselgels gerade noch bedeckt bleibt. Der Kolben mit dem Extrakt wird mit etwa
13 Grundpraktikum rganische Chemie 0.5 ml Laufmittel nachgespült, diese Lösung ebenfalls auf die Säule aufgegeben und wiederum so viel Laufmittel abgelassen, bis der Rand des Kieselgels erreicht ist. Nun werden Seesand (ca. 1 cm Schicht) und dann ca. 200 ml Laufmittel auf die Säule gegeben und mit der Chromatographie begonnen. Die verschiedenfarbigen Fraktionen werden in Reagenzgläsern aufgefangen und dünnschichtchromatographisch untersucht. R f = Laufstrecke der Verbindung Laufstrecke der Lösungsmittelfront R f -Werte: β-carotin 0.98; Chlorophyll a 0.54; Chlorophyll b 0.32; Xanthophyll Das Trocknen und Entwickeln der Dünnschichtchromatogramme muss im Abzug durchgeführt werden! Die DCs müssen anschließend abgezeichnet werden. Die verwendeten DC-Platten dürfen nicht mit nach Hause genommen oder ins Protokoll geklebt werden, sondern werden als Feststoffabfälle entsorgt. Protokollaufgaben: Berechnen Sie die R f -Werte der Substanzen in beiden Laufmittelgemischen. Welchen Einfluss hat die Polarität des Gemisches auf die R f -Werte? Identifizieren Sie die Bestandteile anhand der oben für das verwendete Laufmittel angegebenen Vergleichswerte. A.7 Säulenchromatographische Trennung und Identifizierung eines farblosen Stoffgemisches Versuchsvorschrift: Zunächst muss analog zu Versuch 2.1 ein geeignetes Laufmittel gefunden werden. Dazu wird der vom Assistenten erhaltenen Lösung (4 ml, 20 %ig, 1:1 Gemisch zweier Substanzen) ein Tropfen entnommen und mit 9 Tropfen des Laufmittels verdünnt. Diese Referenzprobe ( R ) wird auf drei Dünnschichtplatten in drei unterschiedlichen Konzentrationen aufgetragen (ein-, zwei-, bzw. dreimal tüpfeln). Die Platten werden in drei Laufmitteln entwickelt: Cyclohexan/Essigsäureethylester: 70:30 Cyclohexan/Essigsäureethylester: 85:15 Cyclohexan/Essigsäureethylester: 95:5 Nach dem Trocknen der Platten im Abzug werden diese mit Hilfe einer UV-Lampe kontrolliert (bei 254 nm) und anschließend in eine Kaliumpermanganatlösung getaucht. Nach dem Trockenen mit dem Heißluftfön werden gelbe Substanzflecke ( spots ) sichtbar. Notieren Sie gegebenenfalls die Unterschiede zwischen der Detektion mit UV-Licht und der Färbelösung. In Absprache mit dem Assistenten wird das Laufmittel für die Säulenchromatographie gewählt. Entsprechend der Anleitung in Versuch 2.1 wird mit dem ausgewählten Laufmittel eine Chromatographiesäule eingeschlämmt. Es werden 4 ml der erhaltenen Lösung vorsichtig auf das Kieselgel gegeben und weiter wie in Versuch 2.1 angegeben verfahren. Das Eluat wird in Reagenzgläsern aufgefangen, die zu etwa drei Vierteln gefüllt werden. Es wird eine DC vom Inhalt jedes 3. Reagenzglases angefertigt. Die Fraktionen, die nur eine Verbindung enthalten, werden vereinigt und das Lösungsmittel am Rotationsverdampfer entfernt. Die erhaltenen Feststoffe werden über Nacht getrocknet und dann anhand ihres Schmelzpunktes identifiziert. R Schmelzpunkte: D,L-Menthol C; Benzophenon C; Diphenylmethanol C; D,L-Campher C. Protokollaufgaben: Berechnen Sie die R f -Werte in allen Laufmittelgemischen und identifizieren Sie die Bestandteile des Gemisches anhand der Schmelzpunkte. 13
14 Grundpraktikum rganische Chemie A.8 Fraktionierte Destillation eines Substanzgemisches Literatur: Brückner, S. 55f; rganikum (23. Aufl.), S. 36f, S. 80ff und S. 696ff Versuchsvorschrift: In einer Vakuumdestillationsapparatur mit Vigreux-Kolonne (s. Abb.) werden 30 ml eines Gemisches aus Pentan, Heptan und Decan in einem 50 ml Einhalsrundkolben mit Rührfisch vorgelegt. Die Vorlagen sind vor der Destillation zu wiegen. Das Gemisch wird unter Rühren langsam aufgeheizt, bis die erste Substanz in der Vigreux-Kolonne aufsteigt. Die Badtemperatur wird konstant gehalten, alle zwei Minuten die Kopftemperatur registriert und das Destillat in der ersten Vorlage aufgefangen. Wenn die Kopftemperatur sinkt, wird weiter aufgeheizt und die Vorlage gewechselt, sobald die höher siedende Komponente destilliert. Die zweite Komponente wird vollständig abdestilliert (dazu die Badtemperatur ggf. nochmals geringfügig erhöhen, nicht über 140 C). Nach dem Abkühlen der Ölbads auf Raumtemperatur (am Besten über Mittag) wird unter Vakuum weiter destilliert, wobei zunächst die Vorlagen gewechselt werden müssen. Wenn der Destillationskolben Raumtemperatur erreicht hat, wird Vakuum angelegt (die Abzugpumpen erreichen ca. 10 mbar) und langsam aufgeheizt. (Die Pfeile markieren die Wenn die Kopftemperatur wieder steigt, wird die Vorlage erneut Positionen der Klammern.) gewechselt und die dritte Komponente destilliert, wobei die Kopftemperatur registriert werden. Bestimmen Sie die Brechungsindizes ( n 20 D ) aller Fraktionen. Protokollaufgaben: Tragen Sie in einem Diagramm die Kopftemperatur gegen die Zeit auf. Bestimmen Sie die Ausbeuten aller Fraktionen und geben Sie entsprechenden Brechungsindizes an. Substanz Sdp. (1013 mbar) [ C] n D 20 Pentan Heptan Decan
15 Grundpraktikum rganische Chemie 1. Präparat: Radikalische Substitution Allgemeine Anmerkungen: Azobisisobutyronitril (AIBN) wird vom Saalassistenten ausgegeben. Die Benzylchloride 1.4 und 1.5 sind haut- und tränenreizend, daher immer im Abzug arbeiten und Schutzhandschuhe benutzen, auch bei der Bestimmung des Brechungsindexes! Auch kleine Reste an Benzylchloriden müssen stets und sofort durch Eintragen in Ethanol/NH 3(aq) vernichtet werden. Überschüssiges Sulfurylchlorid wird portionsweise in viel Wasser eingegossen und dieses sofort mit NaH neutralisiert. Dabei jeweils warten, bis die vorherige Menge zersetzt ist. 1.1 Chlorcyclohexan S 2 Cl 2, kat. AIBN Cl Literatur: rganikum (23. Aufl.), S. 203; Brückner, S. 79 (Apparatur & Allg. Durchführung) Ansatzgröße: 0.1 mol Cyclohexan Analytik: Brechungsindex Anmerkungen: Die Reaktionszeit wird auf zwei Stunden verkürzt Phenylethylchlorid S 2 Cl 2, kat. AIBN Cl Literatur: rganikum (23. Aufl.), S. 203; Brückner, S. 79 (Apparatur & Allg. Durchführung) Ansatzgröße: 0.1 mol Ethylbenzol Analytik: Brechungsindex Anmerkungen: Die Reaktionszeit wird auf zwei Stunden verkürzt Chlorbenzylchlorid Cl S 2 Cl 2, kat. AIBN Cl Cl Literatur: Brückner, Präp. 1-1, S. 81 Analytik: Brechungsindex, Schmelzpunkt Anmerkungen: Die Reaktionszeit wird auf zwei Stunden verkürzt Chlor-4-(dichlormethyl)benzol Cl Literatur: Brückner, Präp. 1-2, S. 82 Cl S 2 Cl 2, kat. AIBN Anmerkungen: Die Reaktionszeit wird auf zwei Stunden verkürzt. Cl Cl Ansatzgröße: 0.06 mol (halber Literaturansatz) Analytik: Brechungsindex 15
16 Grundpraktikum rganische Chemie Halogenierung von Alkoholen 2. Präparat: Nucleophile Substitution Chlor-2-methylpropan (tert-butylchlorid) H HCl Cl Analytik: Siedepunkt (s.u.) Versuchsvorschrift: 25 ml konzentrierte Salzsäure werden in einem Eisbad auf etwa 0 C gekühlt und in einen 100 ml Scheidetrichter gegeben. Es werden 9.5 ml (7.4 g, 0.1 mol) tert-butanol und 11.1 g (0.1 mol) wasserfreies CaCl 2 hinzugegeben. Über einen Zeitraum von 30 min wird die Mischung von Zeit zu Zeit geschüttelt, wobei der entstehende Überdruck abgelassen werden muss. Nach Trennung der Phasen wird die organische Phase vorsichtig mit 10 ml eiskalter 5 %-iger NaHC 3 -Lösung (C 2 -Entwicklung!) und 3x10 ml eiskaltem Wasser gewaschen. Die organische Phase wird über Natriumsulfat getrocknet und bei Normaldruck fraktioniert destilliert (Sdp. 760 Torr C) Brom-3-methylbut-2-en Literatur: Brückner, Präp. 2-3, S. 91 H wässr. HBr Br Ansatzgröße: mol (halber Literaturansatz) Analytik: Brechungsindex Anmerkungen: Anstelle von Petrolether wird Cyclohexan zum Extrahieren verwendet. Halogenierung von Aminosäuren 2.3 S-( )-2-Chlorpropionsäure NH 3 + NaN 2, wässr. HCl Cl H Literatur: Brückner, Präp. 2-17, S. 106 Ansatzgröße: 0.05 mol (halber Literaturansatz) Analytik: 1 H-NMR 2.4 S-( )-2-Brom-3-hydroxypropionsäure H NaN 2, wässr. HBr H H Literatur: Brückner, Präp. 2-18, S. 107 Ansatzgröße: 0.05 mol NH 3 + Br Analytik: DC (R f -Wert) 16
17 3. Präparat: Addition an C C-Mehrfachbindungen Grundpraktikum rganische Chemie 3.1 Cyclohexanol aus Cyclohexen NaBH 4, BF 3 Et 2 THF H Ausbeute: 81 % Analytik: Siedepunkt (70 C/15 Torr), 20 Brechungsindex ( =1.4652) n D Versuchsvorschrift: 5 In einem trockenen 500 ml-dreihalskolben mit Rührer, Rückflusskühler, Thermometer und Tropftrichter werde 3.3 ml (4.11 g, 50 mmol) Cyclohexen und 1.14 g (30 mmol) fein gepulvertes NaBH 4 in 30 ml abs. Tetrahydrofuran vorgelegt und gerührt, bis eine feine Suspension entstanden ist. Innerhalb von 30 min wird ein Gemisch von 5.1 ml (42 mmol) Bortrifluorid- Etherat in 5 ml Tetrahydrofuran dazu getropft, wobei die Temperatur bei C verbleiben soll. Nach 2 h Rühren bei Raumtemperatur wird auf 5 C (Innentemperatur) abgekühlt und bei dieser Temperatur 5 ml H 2 vorsichtig zu der Lösung getropft. Nach Erwärmen auf C und Zugabe von 10 ml 2 N NaH wird das rganoboran durch Zutropfen von 8 ml 30-%iger H 2 2 -Lösung oxidiert, wobei die Temperatur nicht über 40 C ansteigen soll. Es wird noch 20 min gerührt, die auf Raumtemperatur gekühlte Lösung sorgfältig mit festem NaCl gesättigt und 3x kräftig mit je 15 ml TBME ausgeschüttelt. Die vereinigten Etherphasen werden 2 3 mal mit je 15 ml gesättigter FeS 4 -Lösung gewaschen, bis sich die Farbe der FeS 4 -Lösung nicht mehr ändert und ein Test mit KI-Stärke-Papier negativ ausfällt. Die organische Phase wird über Natriumsulfat getrocknet und das Lösungsmittel im Vakuum entfernt. 6 Zur Destillation werden die Rohprodukte in möglichst kleine Kolben überführt und es wird eine Vigreuxkolonne benutzt. 3.2 trans-1,2-dibromcyclohexan Br 2 Br Br Literatur: Brückner, Präp. 3-8, S. 128 Ansatzgröße: 0.1 mol Cyclohexen Analytik: Brechungsindex 5 ACHTUNG Diboran ist giftig! Im Abzug arbeiten und Schutzhandschuhe tragen. 6 Vor der Destillation ist mit Hilfe der Peroxid-Teststäbchen der Ether auf Peroxide zu testen! 17
18 Grundpraktikum rganische Chemie 3.3 cis-cyclohexan-1,2-diol KMn 4 H H Ausbeute: etwa 0.8 g (ca. 25 %) Analytik: Schmelzpunkt (94 96 C) Versuchsvorschrift: Zu einer gerührten Lösung von 1.7 ml (2.1 g, 25.0 mmol) Cyclohexen in 100 ml Ethanol wird über einen Tropftrichter eine Lösung von 4.0 g (25.0 mmol) KMn 4 und 6.2 g (25.0 mmol) Magnesiumsulfat in 60 ml Wasser bei 15 C bis 20 C (Eis-Kochsalz-Kältebad) innerhalb von 60 min. zugetropft. Es wird weitere 2 Stunden bei RT gerührt, der abgeschiedene Niederschlag aus Braunstein über einen großen Büchnertrichter abgesaugt und der Rückstand dreimal mit je 10 ml Aceton gewaschen. Ist das Filtrat nicht klar, so wird nochmals abgesaugt. Das Filtrat wird auf ca. 30 ml eingedampft, mit Natriumchlorid gesättigt und vier- bis fünfmal mit je 15 ml Dichlormethan extrahiert. Die vereinigten organischen Phasen werden mit Magnesiumsulfat getrocknet, das Lösungsmittel am Rotationsverdampfer entfernt und der so erhaltene Rückstand aus Toluen in der Hitze umkristallisiert. 3.4 trans-cyclohexan-1,2-diol H 2 2, HC 2 H, NaH H H Literatur: Brückner, Präp. 3-4, S. 123 Analytik: Schmelzpunkt 18
19 Grundpraktikum rganische Chemie Polymerisationsreaktionen (Gruppenversuche) Ph n P.1 Kationische Polymerisation von Styrol Versuchsvorschrift: In einem Reagenzglas wird zu 3 ml frisch destilliertem Styrol 7 nur (!) 1 Tropfen konz. Schwefelsäure gegeben und vorsichtig durchgeschüttelt. Nach Abklingen der Wärmeentwicklung werden nochmals 1 2 Tropfen konz. Schwefelsäure zugesetzt und die Lösung nach einiger Zeit im Eisbad abgekühlt. Protokollieren und deuten Sie Ihre Beobachtungen. P.2 Radikal-initiierte Polymerisation und deren Inhibierung von Styrol Versuchsvorschrift: In saubere Reagenzgläser werden folgende Proben gegeben und die Substanzen durch Schütteln völlig aufgelöst: 1) 2 ml Styrol + eine kleine Spatelspitze Dibenzoylperoxid 2) 2 ml Styrol + eine kleine Spatelspitze Hydrochinon 3) 2 ml Styrol Die mit Aluminiumfolie abgedeckten Reagenzgläser werden im Ölbad 3 h auf 80 C erwärmt. Was beobachten Sie nach Abkühlen der Proben? 7 Das für die Versuche benötigte Styrol ist durch Destillation weitgehend vom Stabilisator befreit und wird im Kühlschrank aufbewahrt. 19
20 Grundpraktikum rganische Chemie Bromierung von Aromaten 4.1 2,4,6-Tribromanilin 4. Präparat: Aromatische Substitution NH 2 Br 2, HAc NH 2 Br Br Literatur: Brückner, Präp. 5-2, S. 154 Ansatzgröße: 30.0 mmol Anilin (halber Literaturansatz) Analytik: Schmelzpunkt Anmerkungen: Eisessig gefriert bei 17 C. Falls notwendig, die Reaktionslösung kurz auftauen lassen. Br 4.2 2,6-Dibrom-4-nitroanilin 2 N Br NH 2 Br 2, HAc NH 2 2 N Br Literatur: Brückner, Präp. 5-3, S. 155 Ansatzgröße: 25.0 mmol Nitroanilin Analytik: Schmelzpunkt Anmerkungen: Die Zeit für das Zutropfen der Bromlösung kann verkürzt werden. 4.3 Brommesitylen Br 2, Fe Br Literatur: rganikum (23. Aufl.), S. 372f, Variante B (ohne Fußnote 3) Ansatzgröße: 50.0 mmol Analytik: Siedepunkt, Brechungsindex Anmerkungen: Zum Trocknen MgS 4 statt CaCl 2 verwenden. 20
21 Grundpraktikum rganische Chemie Farbstoffe 4.4 Natrium-4-[2-(4-hydroxy-1-naphthalenyl)diazenyl]-benzolsulfonat (β-naphtholorange) 3 S NH H NaN 2, HCl Na + 3 S N H N Ausbeute: etwa 2.8 g (ca. 80 %) Analytik: Schmelzpunkt (260 C, Zersetzung) Versuchsvorschrift: In einem Erlenmeyerkolben wird 4-Aminobenzolsulfonsäure (1.7 g, 10 mmol, 1.0 Äquiv.) in 10 ml 2N NaH-Lösung gelöst und mit 10 ml 10%-iger NaN 2 -Lösung versetzt. Diese Lösung wird unter Rühren zu 10 ml eisgekühlter 4N HCl gegeben, wobei die Temperatur nicht über 5 C steigen sollte. Die entstandene Suspension wird zu einer gerührten Lösung von 2-Naphthol (1.4 g, 10 mmol, 1.0 Äquiv.) in 20 ml 2 N NaH vermischt und 30 Minuten bei Raumtemperatur ohne Rühren stehen gelassen. Nach Ablauf der 30 Minuten werden 40 ml gesättigte NaCl-Lösung zur Vervollständigung der Kristallisation zugegeben. Die entstandenen Plättchen werden abgesaugt, mit kaltem Wasser gewaschen und an der Luft getrocknet. 21
22 Grundpraktikum rganische Chemie Friedel-Crafts Acylierungen Chlorbenzophenon 5. Präparat: Friedel-Crafts Reaktionen Cl Cl AlCl 3 Cl Literatur: Brückner, Präp. 5-26, S. 179 Analytik: Schmelzpunkt 5.2 Benzoylferrocen Cl Literatur: Brückner, Präp. 5-27, S. 180 Fe Fe Analytik: Schmelzpunkt AlCl 3 22
23 Grundpraktikum rganische Chemie Friedel-Crafts Alkylierungen tert-Butyltoluol Ausbeute: ca. 75 % Analytik: Siedepunkt (s.u.), 20 Brechungsindex ( =1.492) n D Versuchsvorschrift: In einem 100 ml Dreihalskolben mit Rührmagneten, Rückflusskühler mit Gasableitungsrohr, Tropftrichter und Innenthermometer werden 1.0 g (7.5 mmol) Aluminiumchlorid in 40.0 ml (34.8 g, mmol) Toluol suspendiert. Zu dieser Reaktionsmischung werden unter heftigem Rühren 8.5 ml (6.9 g, 75.0 mmol) tert-butylchlorid zugegeben. Dabei werden zunächst einige Milliliter tert-butylchlorid ohne Kühlung zugegeben und gewartet, bis die Reaktion anspringt (erkennbar durch eine Farbänderung und HCl-Entwicklung). Dann wird der Rest tert-butylchlorid so zugegeben, dass die Innentemperatur 20 C nicht übersteigt. Nach Beendigung der HCl- Entwicklung wird die Reaktionsmischung auf 100 ml Eiswasser gegossen. Die organische Phase wird abgetrennt, mit 50 ml Wasser, 50 ml gesättigter NaHC 3 -Lösung, wiederum mit Wasser bis zur Neutralität gewaschen, und anschließend über MgS 4 getrocknet. Das Produkt wird nach fraktionierter Destillation als farblose Flüssigkeit erhalten (Sdp. 10 mbar 56 C) ,4'-Di-tert-butylbiphenyl Cl FeCl 3 Literatur: Brückner, Präp. 5-17, S. 170 Analytik: Schmelzpunkt 23
24 6. Präparat: Carbonylreaktionen I Addition von Enolaten an Carbonylverbindungen Aldoladditionen 6.1 1,2,4,5-Tetraphenylpentan-1,5-dion Grundpraktikum rganische Chemie Ph Ph H H wässr. KH Ph Ph Ph Ph Literatur: Brückner, Präp , S. 354 Ansatzgröße: 12.5 mmol Formaldehyd (halber Literaturansatz) Analytik: Schmelzpunkt, 1 H-NMR Hydroxy-2-methylpentanal kat. KH in MeH Literatur: Brückner, Präp. 13-9, S. 336 Ansatzgröße: 0.1 mol des Aldehyd H Analytik: Brechungsindex Aldolkondensationen 6.3 trans-1-phenylpent-1-en-3-on + kat. KH in MeH Literatur: Brückner, Präp , S. 338 Ansatzgröße: 0.1 mol Aldehyd Analytik: Schmelzpunkt Anmerkungen: Die Aufreinigung wird mit der Mikrodestillationsapparatur durchgeführt. Gegebenenfalls vorzeitig erstarrtes Produkt kann mit der Heizpistole wieder verflüssigt werden. Statt Petrolether wird Cyclohexan zum Umkristallisieren verwendet. 6.4 Zimtsäure + H H Pyridin, H Literatur: rganikum (23. Aufl.), S. 534f (Variante B) Ansatzgröße: 0.1 mol Aldehyd Analytik: Schmelzpunkt 24
25 Grundpraktikum rganische Chemie 7. Präparat: Carbonylreaktionen II Nukleophile Substitutionen an Carbonylverbindungen Carbonsäureamide 7.1 N-Phenylbenzamid Cl + H 2 N Pyridin, N H Ausbeute: 69 % Analytik: Schmelzpunkt (163 C) Versuchsvorschrift: In einem 100 ml-rundkolben werden 2.4 ml (2.3 g, 25 mmol) Anilin in 50 ml Pyridin gelöst. Unter Eiskühlung werden 4.8 ml (3.9 g, 28 mmol, 1.2 Äq.) Benzoylchlorid vorsichtig zu getropft und die Lösung wird anschließend drei Stunden unter Rückfluss erhitzt. Das Lösungsmittel wird über eine Claisenbrücke abdestilliert. Der Rückstand wird in 50 ml Dichlormethan aufgenommen und zwei mal mit 50 ml Wasser gewaschen. Die organische Phase wird über Magnesiumsulfat getrocknet und das Lösungsmittel anschließend im Vakuum entfernt. Das erhaltene Rohprodukt wird aus Toluol umkristallisiert und das N-Phenylbenzamid in Form farbloser Kristalle erhalten. 7.2 N,N-Diisopropylbenzamid Cl + HN NaH, N Ausbeute: ca. 70 % Analytik: Schmelzpunkt (69 C), 1 H-NMR Versuchsvorschrift: In einem 100 ml Rundkolben werden 3.5 ml (2.5 g, 25 mmol) Diisopropylamin in 25 ml 2 N Natronlauge vorgelegt. Unter Eiskühlung werden 4.8 ml (3.9 g, 28 mmol, 1.2 Äq.) Benzoylchlorid, gelöst in 20 ml Aceton, zugetropft. Nach einer Stunde Rühren bei 0 C wird der entstandene Niederschlag abgesaugt, mit Cyclohexan gewaschen und im Ölpumpenvakuum getrocknet. 25
26 Grundpraktikum rganische Chemie P.3 Herstellung eines synthetischen Polyamids (Nylon 6.10) (Gruppenversuch) Cl Cl + H3 N NH 2 Versuchsvorschrift: Ein Reagenzglas wird an der Innenwand mit Paraffinöl eingerieben und mit 2 ml einer Lösung von Sebacinsäuredichlorid in Dichlormethan (12.7 ml Sebacinsäuredichlorid in 1 l Dichlormethan) befüllt. Anschließend wird die organische Phase vorsichtig mit 3 ml einer wässrigen Hexamethylendiamin-Lösung (4.5 g Hexamethylendiamin und 3 g NaH in 380 ml Wasser) überschichtet. An der Phasengrenze entsteht eine Haut, die nach etwa einer Minute mit einer Pasteurpipette hochgezogen wird. Es bildet sich ein Faden, der sich auf die Pipette wickeln lässt. H N N H n Veresterungen Acetoxybenzoesäure (Acetylsalicylsäure) H Ac 2, H 2 S 4 Ac Literatur: Brückner, Präp. 6-10, S. 213 CH CH Analytik: Schmelzpunkt 7.4 Bernsteinsäuremonomethylester Literatur: Brückner, Präp. 6-11, S. 214 MeH Me H Ansatzgröße: 125 mmol (halber Literaturansatz) Analytik: Schmelzpunkt 26
27 Grundpraktikum rganische Chemie 8. Präparat: Carbonylreaktionen III Nukleophile Substitution des Enamine Alternative Apparatur: Carbonylsauerstoffs Rückflusskühler (Achtung: das untere Ende des Kühlers darf nicht in das Lösungsmittel im Tropftrichter eintauchen! Evtl. den Kühler tauschen.) Tropftrichter (randvoll mit dem benötigten Lösungsmittel), Hahn geschlossen Reaktionskolben (mit minimaler Lösungsmittelmenge, ca. 20 ml) Morpholinocyclohexen TsH, + HN N Literatur: Brückner, Präp. 9-12, S. 268 Analytik: Brechungsindex Morpholinocyclopenten + HN N Literatur: Brückner, Präp. 9-11, S. 267 Analytik: Brechungsindex (Pyrrolidin-1-yl)cyclohexen + HN TsH, N Literatur: Brückner, Präp. 9-13, S. 269 Analytik: Brechungsindex 20 ( =1.5234) n D Pyrrolidinocyclopent-1-en Literatur: rganikum (23. Aufl.), S HN TsH, N Ansatzgröße: 0.2 mol (fünftel Literaturansatz) Analytik: Brechungsindex 27
28 9. Präparat: Carbonylreaktionen IV Enolate als Nukleophile Grundpraktikum rganische Chemie 9.1 Acetylmalonsäurediethylester Et Et Cl Mg(Et) 2 Et Literatur: rganikum (23. Aufl.), S. 558f Ansatzgröße: 0.1 mol (zehntel Literaturansatz) Analytik: Siedepunkt, Brechungsindex Anmerkungen: Das Magnesium wird zuvor mit der Apparatur ausgeheizt. Um die Reaktion zum Anspringen zu bringen, kann etwas Natrium oder Iod zugegeben werden (kein CCl 4 ). Eventuell vorhandene Iodreste werden durch Waschen mit gesättigter NaHS 3 -Lösung entfernt. Et Acetyl-3-oxohexansäureethylester Et Cl Mg(Et) 2 Et Literatur: rganikum (23. Aufl.), S. 558f Ansatzgröße: 0.1 mol (zehntel Literaturansatz) Analytik: Siedepunkt, Brechungsindex Anmerkungen: Das Magnesium wird zuvor mit der Apparatur ausgeheizt. Um die Reaktion zum Anspringen zu bringen, kann etwas Natrium oder Iod zugegeben werden (kein CCl 4 ). Eventuell vorhandene Iodreste werden durch Waschen mit gesättigter NaHS 3 -Lösung entfernt. 9.3 Isobutylmalonsäurediethylester NaEt Literatur: rganikum (23. Aufl.), S. 614f Et Et Br Et Et Ansatzgröße: 0.1 mol (zehntel Literaturansatz) Analytik: Siedepunkt, Brechungsindex Anmerkungen: Bei Reaktionen mit elementaren Natrium unbedingt prüfen, ob der Rückflusskühler unbeschädigt und dicht ist! 28
29 Grundpraktikum rganische Chemie 9.4 5,5-Dimethyl-1,3-cyclohexadion (Dimedon) + Et Na + Et KH Literatur: Brückner, Präp , S. 353 Ansatzgröße: 0.05 mmol Natrium (halber Literaturansatz) Analytik: Schmelzpunkt Anmerkungen: Bei Reaktionen mit elementaren Natrium unbedingt prüfen, ob der Rückflusskühler unbeschädigt und dicht ist! Die Reaktionszeit kann verkürzt werden. 29
30 Grundpraktikum rganische Chemie 10. Präparat: Grignard-Reaktionen Phenylpentan-3-ol EtMgBr Et H Literatur: Brückner, Präp , S. 289f Ansatzgröße: 25 mmol (viertel Literaturansatz) Analytik: Brechungsindex Anmerkungen: Das Magnesium wird zuvor mit der Apparatur ausgeheizt. Um die Reaktion zum Anspringen zu bringen, kann etwas Natrium oder Iod zugegeben werden. Eventuell vorhandene Iodreste werden durch Waschen mit gesättigter NaHS 3 -Lösung entfernt ,2-Dimethyl-4-phenylpentan-3-ol tbumgbr tbu H Literatur: Brückner, Präp , S. 291f Ansatzgröße: 25 mmol (halber Literaturansatz) Analytik: Brechungsindex Anmerkungen: Das Magnesium wird zuvor mit der Apparatur ausgeheizt. Um die Reaktion zum Anspringen zu bringen, kann etwas Natrium oder Iod zugegeben werden. Eventuell vorhandene Iodreste werden durch Waschen mit gesättigter NaHS 3 -Lösung entfernt R,2R,4R-2-Ethyl-1,7,7-trimethylbicyclo[2.2.1]heptan-2-ol EtMgBr H Literatur: Brückner, Präp , S. 288 Ansatzgröße: 20 mmol (viertel Literaturansatz) Analytik: Schmelzpunkt Anmerkungen: Das Magnesium wird zuvor mit der Apparatur ausgeheizt. Um die Reaktion zum Anspringen zu bringen, kann etwas Natrium oder Iod zugegeben werden. Eventuell vorhandene Iodreste werden durch Waschen mit gesättigter NaHS 3 -Lösung entfernt. 30
> Grundpraktikum Organische Chemie im Wintersemester 2016 / 2017 Prof. Dr. B. J. Ravoo, Prof. Dr. A. Studer, Dr. Simon Janich, Dr. W.
 > Grundpraktikum Organische Chemie im Wintersemester 2016 / 2017 Prof. Dr. B. J. Ravoo, Prof. Dr. A. Studer, Dr. Simon Janich, Dr. W. Szymanski > Praktikumsskript Organisch-Chemisches Institut der Westfälischen
> Grundpraktikum Organische Chemie im Wintersemester 2016 / 2017 Prof. Dr. B. J. Ravoo, Prof. Dr. A. Studer, Dr. Simon Janich, Dr. W. Szymanski > Praktikumsskript Organisch-Chemisches Institut der Westfälischen
Betreuer: Tobias Olbrich Literatur: Nach Organic Syntheses Coll. Vol. 10 (2004), 96.
 rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
rganisches Praktikum CP II Wintersemester 2009/10 Versuch 28 Salen-Ligand Betreuer: Tobias lbrich Literatur: ach rganic Syntheses Coll. Vol. 10 (2004), 96. Chemikalien: L-()-Weinsäure 1,2-Diaminocyclohexan
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol
 7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
7.2.1 Nitrierung von Toluol zu 2-Nitrotoluol (1a), 4-Nitrotoluol (1b) und 2,4-Dinitrotoluol (1c) HNO 3, H 2 SO 4 + + C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1) 1a 1b 1c C 7 H 7 (137.1) C 7 H 6 N 2 O 4
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol
 4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4028 Synthese von 1-Bromdodecan aus 1-Dodecanol C 12 H 26 O (186.3) OH H 2 SO 4 konz. (98.1) + HBr (80.9) C 12 H 25 Br (249.2) Br + H 2 O (18.0) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
NO 2 Rühren mit Magnetrührer, Extrahieren, Ausschütteln, Abrotieren, Umkristallisieren, Abfiltrieren,
 1003 Nitrierung von Benzaldehyd zu 3-Nitrobenzaldehyd H O H O HNO 3 /H 2 SO 4 + Nebenprodukte NO 2 7 H 6 O HNO 3 (63.0) 7 H 5 NO 3 (106.1) H 2 SO 4 (98.1) (151.1) Klassifizierung Reaktionstypen und Stoffklassen
1003 Nitrierung von Benzaldehyd zu 3-Nitrobenzaldehyd H O H O HNO 3 /H 2 SO 4 + Nebenprodukte NO 2 7 H 6 O HNO 3 (63.0) 7 H 5 NO 3 (106.1) H 2 SO 4 (98.1) (151.1) Klassifizierung Reaktionstypen und Stoffklassen
4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester
 NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
NP 4019 Synthese von Acetamidostearinsäuremethylester aus Ölsäuremethylester C 19 H 36 2 (296.5) 10 9 SnCl 4 H 2 Me (260.5) + H 3 C C N C 2 H 3 N (41.1) NH + 10 10 9 9 Me Me C 21 H 41 N 3 (355.6) NH Klassifizierung
4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus
 NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
NP 4023 Synthese von Cyclopentanon-2-carbonsäureethylester aus Adipinsäurediethylester NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202.2) (23.0) (46.1) (156.2) Klassifizierung Reaktionstypen und Stoffklassen
Synthese von Acetophenon
 Illumina-Chemie.de - Artikel Synthesen Synthese von Geräte: 250 ml Zweihalskolben, Claisenaufsatz, 50 ml Tropftrichter mit Druckausgleich, Rückflusskühler, Eisbad, Trockenrohr, Thermometer, Magnetrührer,
Illumina-Chemie.de - Artikel Synthesen Synthese von Geräte: 250 ml Zweihalskolben, Claisenaufsatz, 50 ml Tropftrichter mit Druckausgleich, Rückflusskühler, Eisbad, Trockenrohr, Thermometer, Magnetrührer,
3016 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure
 6 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Klassifizierung Reaktionstypen
6 Oxidation von Ricinolsäure (aus Rizinusöl) mit KMnO 4 zu Azelainsäure CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Klassifizierung Reaktionstypen
6011 Hippursäure aus Glycin und Benzoylchlorid
 P 6011 Hippursäure aus Glycin und Benzoylchlorid Cl + H 2 H H H C 7 H 5 Cl C 2 H 5 2 C 9 H 9 3 (140.6) (75.1) (179.2) Klassifizierung Reaktionstypen und Stoffklassen Benzoylierung, Reaktion der Carbonylgruppe
P 6011 Hippursäure aus Glycin und Benzoylchlorid Cl + H 2 H H H C 7 H 5 Cl C 2 H 5 2 C 9 H 9 3 (140.6) (75.1) (179.2) Klassifizierung Reaktionstypen und Stoffklassen Benzoylierung, Reaktion der Carbonylgruppe
Organisches Praktikum OCP II Wintersemester 2009/10. Versuch 30. 1,4-Diphenyl-6,7-dihydro-5H-cyclopenta[d]pyridazin. Betreuer:
![Organisches Praktikum OCP II Wintersemester 2009/10. Versuch 30. 1,4-Diphenyl-6,7-dihydro-5H-cyclopenta[d]pyridazin. Betreuer: Organisches Praktikum OCP II Wintersemester 2009/10. Versuch 30. 1,4-Diphenyl-6,7-dihydro-5H-cyclopenta[d]pyridazin. Betreuer:](/thumbs/55/37246535.jpg) Organisches Praktikum OCP II Wintersemester 2009/10 Versuch 30 1,4-Diphenyl-6,7-dihydro-5-cyclopenta[d]pyridazin Betreuer: Chemikalien: Benzonitril Tomahogh ydrazinhydrat achtraum (Kühlschrank) Schwefel
Organisches Praktikum OCP II Wintersemester 2009/10 Versuch 30 1,4-Diphenyl-6,7-dihydro-5-cyclopenta[d]pyridazin Betreuer: Chemikalien: Benzonitril Tomahogh ydrazinhydrat achtraum (Kühlschrank) Schwefel
Disproportionierung von Furan-2-carbaldehyd (Furfural) mit Natronlauge zu Furan-2-carbonsäure und 2-Furylmethanol (Cannizzaro-Reaktion)
 4.3.1.8 Disproportionierung von Furan-2-carbaldehyd (Furfural) mit Natronlauge zu Furan-2-carbonsäure und 2-Furylmethanol (Cannizzaro-Reaktion) H NaH konz. 8a H + 8b H H 4 2 (96.1) H 4 3 (112.1) H 6 2
4.3.1.8 Disproportionierung von Furan-2-carbaldehyd (Furfural) mit Natronlauge zu Furan-2-carbonsäure und 2-Furylmethanol (Cannizzaro-Reaktion) H NaH konz. 8a H + 8b H H 4 2 (96.1) H 4 3 (112.1) H 6 2
2017 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid
 217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
217 Umsetzung von Zimtsäurechlorid mit Ammoniak zu Zimtsäureamid O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
170 C C 2 H C C 11 H 10 (174.2) Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien
 3.4.2 Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien. [4+2]-Cycloaddition von Cyclopentadien mit p-benzochinon zum 1:1- Addukt (2a) und zum 2:1-Addukt (2b) 170 C 2 C 10 12
3.4.2 Darstellung von Cyclopentadien durch thermische Spaltung von Dicyclopentadien. [4+2]-Cycloaddition von Cyclopentadien mit p-benzochinon zum 1:1- Addukt (2a) und zum 2:1-Addukt (2b) 170 C 2 C 10 12
4002 Synthese von Benzil aus Benzoin
 4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
4002 Synthese von Benzil aus Benzoin H VCl 3 + 1 / 2 2 + 1 / 2 H 2 C 14 H 12 2 C 14 H 10 2 (212.3) 173.3 (210.2) Klassifizierung Reaktionstypen und Stoffklassen xidation Alkohol, Keton, Schwermetallkatalysator
1017 Azokupplung von Benzoldiazoniumchlorid mit 2-Naphthol zu 1-Phenylazo-2-naphthol
 OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
OP 1017 Azokupplung von Benzoldiazoniumchlorid mit 2-aphthol zu 1-Phenylazo-2-naphthol H 3 Cl Cl ao 2 C 6 H 8 Cl (129.6) (69.0) C 6 H 5 Cl 2 (140.6) OH + Cl OH C 10 H 8 O (144.2) C 6 H 5 Cl 2 (140.6) C
1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid
 1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95.1) (63.0) (98.1) C 5 H 4 N 2 O 3 (140.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
1004 Nitrierung von Pyridin-N-oxid zu 4-Nitropyridin-N-oxid O N HNO 3 /H 2 SO 4 O N NO 2 C 5 H 5 NO (95.1) (63.0) (98.1) C 5 H 4 N 2 O 3 (140.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
5007 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin
 57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
57 Synthese von Fluorescein aus Phthalsäureanhydrid und Resorcin CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der
1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon)
 1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon) H Polyphosphorsäure C 10 H 12 2 (164.2) C 10 H 10 (146.2) Klassifizierung Reaktionstypen und Stoffklassen
1009 Intramolekulare Acylierung von 4-Phenylbuttersäure zu 1,2,3,4-Tetrahydronaphthalin-1-on (α-tetralon) H Polyphosphorsäure C 10 H 12 2 (164.2) C 10 H 10 (146.2) Klassifizierung Reaktionstypen und Stoffklassen
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol OH
 4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
4029 Synthese von Dodecylphenylether aus Bromdodecan und Phenol H C 12 H 25 Br (249.2) Br + + NaH (40.0) + Adogen 464 C 25 H 54 ClN (404.2) C 6 H 6 (94.1) C 18 H 30 (262.4) + NaBr (102.9) Klassifizierung
6012 Aldol-Kondensation von Aceton und Benzaldehyd zu Dibenzalaceton (1,5-Diphenyl-1,4-pentadien-3-on)
 6012 Aldol-Kondensation von Aceton und Benzaldehyd zu Dibenzalaceton (1,5-Diphenyl-1,4-pentadien-3-on) H 2 + KH H 2 /EtH/THF C 7 H 6 C 3 H 6 KH (56.1) C 17 H 14 (106.1) (58.1) (234.3) Klassifizierung Reaktionstypen
6012 Aldol-Kondensation von Aceton und Benzaldehyd zu Dibenzalaceton (1,5-Diphenyl-1,4-pentadien-3-on) H 2 + KH H 2 /EtH/THF C 7 H 6 C 3 H 6 KH (56.1) C 17 H 14 (106.1) (58.1) (234.3) Klassifizierung Reaktionstypen
Protokoll zum Gruppenpra parat
 Protokoll zum Gruppenpra parat Versuche 5.4.1.2 und 4.4.4: Darstellung von 1 Naphthol 1. Darstellung von Anthranilsäure aus Phthalsäureimid 1.1. Literatur [1] www.merckmillipore.de/chemicals [2] sdbs.riodb.aist.go.jp/
Protokoll zum Gruppenpra parat Versuche 5.4.1.2 und 4.4.4: Darstellung von 1 Naphthol 1. Darstellung von Anthranilsäure aus Phthalsäureimid 1.1. Literatur [1] www.merckmillipore.de/chemicals [2] sdbs.riodb.aist.go.jp/
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol
 4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4026 Synthese von 2-Chlor-2-methylpropan (tert-butylchlorid) aus tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74.1) (36.5) (92.6) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan
 Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
Endersch, Jonas 16.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.6/1: Benutzung des Wasserabscheiders zur Synthese von 2 (m Nitrophenyl) 1,3 dioxalan Reaktionsgleichung:
3003 Synthese von trans-2-chlorcyclohexanol aus Cyclohexen
 3003 Synthese von trans-2-chlorcyclohexanol aus Cyclohexen _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7 H
3003 Synthese von trans-2-chlorcyclohexanol aus Cyclohexen _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7 H
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon
 Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Präparat Nr. 2: Darstellung von Methyl-1-naphtylketon 3 3 l 1,2-Dichlorethan Naphthalin Acetylchlorid Methyl-1-naphtylketon ( 10 8 ) ( 2 3 l) ( 12 10 ) M=128.18 M=78.50 M=133.34 M=170.21 1. Ansatz: Es
Oxidation von p-xylol mit Kaliumpermanganat zu Terephthalsäure (2a) und Veresterung zu Terephthalsäurediethylester (2b) CO 2
 6. xidations-, Reduktions-Reaktionen www.ioc-praktikum.de 6.1.4.2 xidation von p-xylol mit Kaliumpermanganat zu Terephthalsäure (2a) und Veresterung zu Terephthalsäurediethylester (2b) C 3 C 2 C 2 C 2
6. xidations-, Reduktions-Reaktionen www.ioc-praktikum.de 6.1.4.2 xidation von p-xylol mit Kaliumpermanganat zu Terephthalsäure (2a) und Veresterung zu Terephthalsäurediethylester (2b) C 3 C 2 C 2 C 2
> Grundpraktikum Organische Chemie im Wintersemester 2012 / 2013 Prof. Dr. Gilmour, Prof. Dr. Studer
 > Grundpraktikum rganische Chemie im Wintersemester 2012 / 2013 Prof. Dr. Gilmour, Prof. Dr. Studer > Praktikumsskript rganisch-chemisches Institut der Westfälischen Wilhelms-Universität http://www.uni-muenster.de/chemie.oc/studies/oc_1.html
> Grundpraktikum rganische Chemie im Wintersemester 2012 / 2013 Prof. Dr. Gilmour, Prof. Dr. Studer > Praktikumsskript rganisch-chemisches Institut der Westfälischen Wilhelms-Universität http://www.uni-muenster.de/chemie.oc/studies/oc_1.html
1007 Synthese von 2,4,6-Tribromanilin aus 4-Bromacetanilid
 1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
1007 Synthese von 2,4,6-Tribromanilin aus 4-omacetanilid O HN CH 3 NH 2 NH 2 KOH 2 C 8 H 8 NO C 6 H 6 N C 6 H 4 3 N (214.1) (56.1) (172.0) (159.8) (329.8) Klassifizierung Reaktionstypen und Stoffklassen
Synthese: Triphenylcarbinol
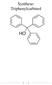 Synthese: Triphenylcarbinol 1 Inhaltsverzeichnis Synthese von Triphenylcarbinol 1.1 Allgemeine Angaben..... 3 1.2 Strukturformel...3 1.3 Reaktionsgleichung.......3 1.4 Ansatz........4 1.5 Ausbeuteberechnung.4
Synthese: Triphenylcarbinol 1 Inhaltsverzeichnis Synthese von Triphenylcarbinol 1.1 Allgemeine Angaben..... 3 1.2 Strukturformel...3 1.3 Reaktionsgleichung.......3 1.4 Ansatz........4 1.5 Ausbeuteberechnung.4
4006 Synthese von 2-(3-Oxobutyl)cyclopentanon-2- carbonsäureethylester
 4006 Synthese von 2-(3-xobutyl)cyclopentanon-2- carbonsäureethylester CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156.2) (70.2) (270.3) (226.3) Klassifizierung Reaktionstypen und Stoffklassen
4006 Synthese von 2-(3-xobutyl)cyclopentanon-2- carbonsäureethylester CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156.2) (70.2) (270.3) (226.3) Klassifizierung Reaktionstypen und Stoffklassen
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol
 4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
4027 Synthese von 11-Chlorundec-1-en aus 10-Undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Klassifizierung Reaktionstypen und Stoffklassen Nukleophile
Präparat 5: Darstellung von Triphenylmethanol -Reaktion der Carbonylfunktion mit Kohlenstoff-Nukleophilen (Grignard-Verbindungen)-
 Christina Sauermann 1 Präparat 5: Darstellung von Triphenylmethanol -Reaktion der Carbonylfunktion mit Kohlenstoff-Nukleophilen (Grignard-Verbindungen)- C + Et 2 C H C 13 H 10 (M=182,22 g/mol) C 6 H 5
Christina Sauermann 1 Präparat 5: Darstellung von Triphenylmethanol -Reaktion der Carbonylfunktion mit Kohlenstoff-Nukleophilen (Grignard-Verbindungen)- C + Et 2 C H C 13 H 10 (M=182,22 g/mol) C 6 H 5
3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b
 3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b 1 : 1 6a + AlCl 3 C 2 Cl 2 2 : 1 6b C 14 10 (178.2) C 6 4 2 (108.1) AlCl 3
3.4.6 Cycloaddition von Anthracen und 1,4-Benzochinon unter Aluminiumchlorid- Katalyse zum 1:1-Addukt 6a und zum 2:1-Addukt 6b 1 : 1 6a + AlCl 3 C 2 Cl 2 2 : 1 6b C 14 10 (178.2) C 6 4 2 (108.1) AlCl 3
1. Darstellung von 2-Chlor-2-methylpropan Trivialname: tert. Butylchlorid
 1. Darstellung von 2-Chlor-2-methylpropan Trivialname: tert. Butylchlorid Theorie Nucleophile Substitution 1. Ordnung am gesättigten Kohlenstoffatom. Darstellung tertiärer Alkylhalogenide durch Umsetzung
1. Darstellung von 2-Chlor-2-methylpropan Trivialname: tert. Butylchlorid Theorie Nucleophile Substitution 1. Ordnung am gesättigten Kohlenstoffatom. Darstellung tertiärer Alkylhalogenide durch Umsetzung
Ein Gemisch aus 13,2 g (0,1mol) 2,5-Dimethoxyterahydrofuran und 80ml 0,6 N Salzsäure werden erhitzt bis vollständige Lösung eintritt.
 1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
1.Acetondicarbonsäureanhydrid 40g (0,27mol)Acetondicarbonsäure werden in einer Lösung aus 100ml Eisessig und 43ml (0,45mol) Essigsäureanhydrid gelöst. Die Temperatur sollte 20 C nicht überschreiten und
1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid
 1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Klassifizierung Reaktionstypen und Stoffklassen
1011 Synthese von 1,4-Di-tert-butylbenzol aus tert-butylbenzol und tert-butylchlorid + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Klassifizierung Reaktionstypen und Stoffklassen
2-Methylcyclohexanon
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von 2-Methylcyclohexanon Zürich, Balzers & Eschen, Juni 2006 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Das Ausgangsprodukt dieser
1001 Nitrierung von Toluol zu 4-Nitrotoluol, 2-Nitrotoluol und 2,4-Dinitrotoluol
 1001 Nitrierung von Toluol zu 4-Nitrotoluol, 2-Nitrotoluol und 2,4-Dinitrotoluol CH 3 CH 3 CH 3 NO 2 CH 3 NO 2 HNO 3 /H 2 SO 4 + + + Nebenprodukte NO 2 NO 2 C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1)
1001 Nitrierung von Toluol zu 4-Nitrotoluol, 2-Nitrotoluol und 2,4-Dinitrotoluol CH 3 CH 3 CH 3 NO 2 CH 3 NO 2 HNO 3 /H 2 SO 4 + + + Nebenprodukte NO 2 NO 2 C 7 H 8 (92.1) HNO 3 (63.0) H 2 SO 4 (98.1)
3001 Hydroborierung/Oxidation von 1-Octen zu 1-Octanol
 3001 Hydroborierung/Oxidation von 1-Octen zu 1-Octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Literatur A.S. Bhanu Prasad, J.V.
3001 Hydroborierung/Oxidation von 1-Octen zu 1-Octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Literatur A.S. Bhanu Prasad, J.V.
Synthese von tert-butylchlorid (2-Chloro-2-methylpropan)
 Praktikum Organische Chemie I Zürich, 03.12.2005 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke Höhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von tert-butylchlorid
Praktikum Organische Chemie I Zürich, 03.12.2005 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke Höhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von tert-butylchlorid
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
Endersch, Jonas 30.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.5a: Herstellung von Cholesterylbenzoat Reaktionsgleichung: Einleitung und Theorie: In diesem Versuch
3012 Synthese von Adamantylidenadamantan aus Adamantanon
 Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
Synthese von Adamantylidenadamantan aus Adamantanon O TiCl /Zn/THF C H O (.) TiCl Zn (9.) (.) C H (.) Literatur D. Lenoir, Synthesis, 99, -9 Klassifizierung Reaktionstypen und Stoffklassen McMurry-Reaktion,
3011 Synthese von erythro-9,10-dihydroxystearinsäure aus Ölsäure
 311 Synthese von erythro-9,1-dihydroxystearinsäure aus Ölsäure COOH KMnO 4 /NaOH HO HO COOH C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Literatur A. Lapworth und E. N. Mottram,
311 Synthese von erythro-9,1-dihydroxystearinsäure aus Ölsäure COOH KMnO 4 /NaOH HO HO COOH C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Literatur A. Lapworth und E. N. Mottram,
Organisch chemisches Praktikum II
 18.04.2010 rganisch chemisches Praktikum II WS 2009 / 2010 Gruppenpräparat 7.3.4: 1,3-Dibenzoylbenzimidazolon Heuler Dominik Sedlag Florian Inhaltsverzeichnis: 1 Einleitung 2 Literaturrecherche 3 Reaktionsgleichung
18.04.2010 rganisch chemisches Praktikum II WS 2009 / 2010 Gruppenpräparat 7.3.4: 1,3-Dibenzoylbenzimidazolon Heuler Dominik Sedlag Florian Inhaltsverzeichnis: 1 Einleitung 2 Literaturrecherche 3 Reaktionsgleichung
7. Studieneinheit. Siebte Studieneinheit
 86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
86 Siebte Studieneinheit 7. Studieneinheit Lernziele Löslichkeit organisch-chemischer Substanzen unter verschiedenen Bedingungen Charakteristische Reaktionen ausgewählter organisch-chemischer Stoffklassen
Herstellung von Triphenylphosphin
 Aqua labor Herstellung von Triphenylphosphin Eigenschaften des Produktes: Triphenylphosphin, kurz TPP, ist eine farblose (oder in einem weniger reinem Zustand leicht gelbliche), aus monoklinen Kristallen
Aqua labor Herstellung von Triphenylphosphin Eigenschaften des Produktes: Triphenylphosphin, kurz TPP, ist eine farblose (oder in einem weniger reinem Zustand leicht gelbliche), aus monoklinen Kristallen
3002 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure
 32 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure OOC COO Br 2 OOC Br Br COO C 4 4 O 4 (6.) (59.8) C 4 4 Br 2 O 4 (275.9) Literatur A. M. McKenzie, J. Chem. Soc., 92,, 96 M. Eissen, D. Lenoir,
32 Addition von Brom an Fumarsäure zu meso-dibrombernsteinsäure OOC COO Br 2 OOC Br Br COO C 4 4 O 4 (6.) (59.8) C 4 4 Br 2 O 4 (275.9) Literatur A. M. McKenzie, J. Chem. Soc., 92,, 96 M. Eissen, D. Lenoir,
Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether)
 Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
Endersch, Jonas 17./19.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 2.1: Herstellung von Propoxybenzol (Phenylpropylether) Reaktionsgleichung: Einleitung und Theorie
4009 Synthese von Adipinsäure aus Cyclohexen
 4009 Synthese von Adipinsäure aus Cyclohexen C 6 H 10 (82.2) + Natriumwolframat-Dihydrat + 4 H 2 H 2 H + 4 H 2 (34.0) + Aliquat 336. Na 2 W 4 2 H 2 (329.9) C 25 H 54 ClN (404.2) C 6 H 10 4 (146.1) Klassifizierung
4009 Synthese von Adipinsäure aus Cyclohexen C 6 H 10 (82.2) + Natriumwolframat-Dihydrat + 4 H 2 H 2 H + 4 H 2 (34.0) + Aliquat 336. Na 2 W 4 2 H 2 (329.9) C 25 H 54 ClN (404.2) C 6 H 10 4 (146.1) Klassifizierung
4022 Synthese von (S)-(+)-3-Hydroxybuttersäureethylester
 NP 4022 Synthese von (S)-(+)-3-Hydroxybuttersäureethylester Fermentierende Hefe, Saccharose H C 6 H 10 3 C 12 H 22 11 C 6 H 12 3 (130.1) (342.3) (132.2) Klassifizierung Reaktionstypen und Stoffklassen
NP 4022 Synthese von (S)-(+)-3-Hydroxybuttersäureethylester Fermentierende Hefe, Saccharose H C 6 H 10 3 C 12 H 22 11 C 6 H 12 3 (130.1) (342.3) (132.2) Klassifizierung Reaktionstypen und Stoffklassen
Organisch-chemisches Praktikum Wintersemester 2005/06. 1-Phenyl-propan-1-ol. Stephan Steinmann
 Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
Organisch-chemisches Praktikum Wintersemester 005/06 -Phenyl-propan--ol 08.. 005 Stephan Steinmann . Methode [] Benzaldehyd () wird über eine Grignard-Reaktion mit Ethylmagnesiumbromid (5) zum -Phenylpropan--ol
5009 Synthese von Kupferphthalocyanin
 P 59 Synthese von Kupferphthalocyanin (H H ) 6 Mo 7 2 2. H2 + 8 + CuCl H 2-8 H 3-8 C 2 - H 2 - HCl Cu C 8 H 3 CH 2 CuCl H 2 Mo 7 6 2. H 2 C 32 H 16 8 Cu (18.1) (6.1) (99.) (1235.9) (576.1) Literatur Klassiche
P 59 Synthese von Kupferphthalocyanin (H H ) 6 Mo 7 2 2. H2 + 8 + CuCl H 2-8 H 3-8 C 2 - H 2 - HCl Cu C 8 H 3 CH 2 CuCl H 2 Mo 7 6 2. H 2 C 32 H 16 8 Cu (18.1) (6.1) (99.) (1235.9) (576.1) Literatur Klassiche
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Platz 53
 Endersch, Jonas 03.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 1.1: Einführung in die Laboratoriumstechnik Einleitung Um die in diesem Praktikum verwendeten Glasgeräte
Endersch, Jonas 03.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Platz 53 Versuchsprotokoll Versuch 1.1: Einführung in die Laboratoriumstechnik Einleitung Um die in diesem Praktikum verwendeten Glasgeräte
1.2.2 Williamson sche Ethersynthese: Isomere Butyl-phenylether (2a c) aus Natriumphenolat und den isomeren Brombutanen
 1.2.2 Williamson sche Ethersynthese: Isomere Butyl-phenylether (2a c) aus Natriumphenolat und den isomeren ombutanen Na R R + Adogen 464 + Na 4 9 (137.) 6 5 Na (116.1) 2a-c 1 14 (15.2) a: 2 1-ombutan b:
1.2.2 Williamson sche Ethersynthese: Isomere Butyl-phenylether (2a c) aus Natriumphenolat und den isomeren ombutanen Na R R + Adogen 464 + Na 4 9 (137.) 6 5 Na (116.1) 2a-c 1 14 (15.2) a: 2 1-ombutan b:
Versuchsprotokoll. Versuch 2.5 B: Brom-Addition an Cholesterol und Brom-Eliminierung N - NaI
 Matrikelnr.: 242232 Organischchemisches Grundpraktikum Versuchsprotokoll Versuch 2.5 B: omaddition an Cholesterol und omeliminierung Reaktionsgleichung: 2 3 3 O ai O 386,7 g/mol 606,6 g/mol C 3 COO Literatur:
Matrikelnr.: 242232 Organischchemisches Grundpraktikum Versuchsprotokoll Versuch 2.5 B: omaddition an Cholesterol und omeliminierung Reaktionsgleichung: 2 3 3 O ai O 386,7 g/mol 606,6 g/mol C 3 COO Literatur:
Einführungspraktikum zu den Arbeitsmethoden in der Organischen Chemie
 Einführungspraktikum zu den Arbeitsmethoden in der rganischen Chemie Versuche und Übungen Kapitel 8: Extraktion Extraktion von Crotonsäure oder Malonsäure aus wässrigen Lösungen mit tert-butylmethylether,
Einführungspraktikum zu den Arbeitsmethoden in der rganischen Chemie Versuche und Übungen Kapitel 8: Extraktion Extraktion von Crotonsäure oder Malonsäure aus wässrigen Lösungen mit tert-butylmethylether,
Indan-1,3-dion. Reaktionsgleichung. H- und P-Sätze. Für alle Reagenzien und Produkte. Ausformulierte H- und P-Sätze. Vor(Abschluss)protokoll
 Indan-1,3-dion Reaktionsgleichung H- und P-Sätze Substanz Gefahrensymbol Smp. ( C) Sdp. ( C) Phtalsäurediethylester Essigsäureethylester Flammpkt. ( C) H-Sätze P-Sätze - -40 302 150 - - Gefahr -83 77-4
Indan-1,3-dion Reaktionsgleichung H- und P-Sätze Substanz Gefahrensymbol Smp. ( C) Sdp. ( C) Phtalsäurediethylester Essigsäureethylester Flammpkt. ( C) H-Sätze P-Sätze - -40 302 150 - - Gefahr -83 77-4
1035 Synthese von p-methoxyacetophenon aus Anisol
 NP 05 Synthese von p-methoxyacetophenon aus Anisol CH + CH CH Sc(Tf) + CH CH CH CH C 7 H 8 (08.) C 4 H 6 (02.) (CF S ) Sc (492.2) C 9 H 0 2 (50.2) C 2 H 4 2 (60.) Klassifizierung Reaktionstypen und Stoffklassen
NP 05 Synthese von p-methoxyacetophenon aus Anisol CH + CH CH Sc(Tf) + CH CH CH CH C 7 H 8 (08.) C 4 H 6 (02.) (CF S ) Sc (492.2) C 9 H 0 2 (50.2) C 2 H 4 2 (60.) Klassifizierung Reaktionstypen und Stoffklassen
3021 Oxidation von Anthracen zu Anthrachinon
 xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
xidation von Anthracen zu Anthrachinon Ce(IV)(NH ) (N ) 6 C H CeH 8 N 8 8 C H 8 (78.) (58.) (8.) Literatur Tse-Lok Ho et al., Synthesis 97, 6. Klassifizierung Reaktionstypen und Stoffklassen xidation Aromat,
5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid
 NP 5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1) Klassifizierung
NP 5012 Synthese von Acetylsalicylsäure (Aspirin) aus Salicylsäure und Acetanhydrid CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1) Klassifizierung
Endersch, Jonas Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53
 Endersch, Jonas 13.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.5: Dünnschicht und Säulenchromatographie Einleitung und Theorie In diesem Versuch wurden
Endersch, Jonas 13.06.2008 Praktikum Allgemeine Chemie 2, Saal G1, Gruppe 3, Platz 53 Versuchsprotokoll Versuch 1.5: Dünnschicht und Säulenchromatographie Einleitung und Theorie In diesem Versuch wurden
5001 Nitrierung von Phenol zu 2-Nitrophenol und 4-Nitrophenol
 00 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol KNO, H SO NO + NO C H O (9.) KNO (0.) H SO (98.) C H NO (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution an Aromaten,
00 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol KNO, H SO NO + NO C H O (9.) KNO (0.) H SO (98.) C H NO (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution an Aromaten,
2. Herstellung der α,β-ungesättigten Kupplungskomponenten C H 3 H 33. Br 22 25
 2. Herstellung der α,β-ungesättigten Kupplungskomponenten 2.1. E-3-(2-omphenyl)-propenal (25) C H 3 H 1 H H 33 1' 3 22 25 2' Eine Emulsion aus 1.85 g (10.0 mmol) 2-ombenzaldehyd (22), 616 mg (14.0 mmol)
2. Herstellung der α,β-ungesättigten Kupplungskomponenten 2.1. E-3-(2-omphenyl)-propenal (25) C H 3 H 1 H H 33 1' 3 22 25 2' Eine Emulsion aus 1.85 g (10.0 mmol) 2-ombenzaldehyd (22), 616 mg (14.0 mmol)
Für das Praktikum muss ein Laborjournal (Kladde) geführt werden, und zwar handschriftlich. Kladde bitte mit Namen beschriften.
 Für das Praktikum muss ein Laborjournal (Kladde) geführt werden, und zwar handschriftlich. Kladde bitte mit Namen beschriften. Bitte über jeden Versuch dann ein Datum schreiben. Das zu führende Laborjournal
Für das Praktikum muss ein Laborjournal (Kladde) geführt werden, und zwar handschriftlich. Kladde bitte mit Namen beschriften. Bitte über jeden Versuch dann ein Datum schreiben. Das zu führende Laborjournal
6016 Oxidation von 2,2-Dimethyl-1,3-propandiol zu 2,2- Dimethylmalonsäure
 6016 Oxidation von 2,2-Dimethyl-1,3-propandiol zu 2,2- Dimethylmalonsäure HNO 3 O O C 5 H 12 O 2 HNO 3 C 5 H 8 O 4 (104.2) (63.0) (132.1) Klassifizierung Reaktionstypen und Stoffklassen Oxidation Alkohol,
6016 Oxidation von 2,2-Dimethyl-1,3-propandiol zu 2,2- Dimethylmalonsäure HNO 3 O O C 5 H 12 O 2 HNO 3 C 5 H 8 O 4 (104.2) (63.0) (132.1) Klassifizierung Reaktionstypen und Stoffklassen Oxidation Alkohol,
Mustervorschrift 2.3.1
 Christoph Böhm, Lisa Gutjahr, Philipp Hennig, Thorsten Scherpf, Junwen Shan, Verena Thyen Mustervorschrift 2.3.1 Darstellung von 1,2-Bis(trimethylsilyloxy)cyclohex-1-en: In einem trockenen und unter Schutzgas
Christoph Böhm, Lisa Gutjahr, Philipp Hennig, Thorsten Scherpf, Junwen Shan, Verena Thyen Mustervorschrift 2.3.1 Darstellung von 1,2-Bis(trimethylsilyloxy)cyclohex-1-en: In einem trockenen und unter Schutzgas
1005 Bromierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol
 1005 omierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol H 3 H 3 K 3, H Essigsäure H 3 H 3 + Nebenprodukt 8 H 10 2 K 3 (167.0) 8 H 8 2 2 (138.2) H (80.9) (296.0) Klassifizierung Reaktionstypen
1005 omierung von 1,2-Dimethoxybenzol zu 4,5-Dibrom-1,2- dimethoxybenzol H 3 H 3 K 3, H Essigsäure H 3 H 3 + Nebenprodukt 8 H 10 2 K 3 (167.0) 8 H 8 2 2 (138.2) H (80.9) (296.0) Klassifizierung Reaktionstypen
Organisch-Chemisches Grundpraktikum. trans-1,2-cyclohexandiol
 rganischhemisches Grundpraktikum Präparat 06: trans1,2yclohexandiol Gliederung: I. Literatur... 1 II. Präparateigenschaften... 1 III. Stöchiometrische Reaktionsgleichung... 1 IV. Reaktionsmechanismus...
rganischhemisches Grundpraktikum Präparat 06: trans1,2yclohexandiol Gliederung: I. Literatur... 1 II. Präparateigenschaften... 1 III. Stöchiometrische Reaktionsgleichung... 1 IV. Reaktionsmechanismus...
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid
 2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
2013 Umsetzung von Zimtsäure mit Thionylchlorid zu Zimtsäurechlorid H + SCl 2 Cl + HCl + S 2 C 9 H 8 2 (148.2) (119.0) C 9 H 7 Cl (166.6) Klassifizierung Reaktionstypen und Stoffklassen Reaktion der Carbonylgruppe
Chromatographie von Acetylsalicylsäure. Gefährdungsbeurteilung. Schülerexperiment. Lehrerexperiment
 Chromatographie von Acetylsalicylsäure Brandgefahr! Cyclohexan R-Sätze: 11-38-65-67-50/53 S-Sätze: 9-16-25-33-60-61-62 Acetylsalicylsäure R-Sätze: 22 S-Sätze: 26-37/39-45 Aceton R-Sätze: 11-36-66-67 S-Sätze:
Chromatographie von Acetylsalicylsäure Brandgefahr! Cyclohexan R-Sätze: 11-38-65-67-50/53 S-Sätze: 9-16-25-33-60-61-62 Acetylsalicylsäure R-Sätze: 22 S-Sätze: 26-37/39-45 Aceton R-Sätze: 11-36-66-67 S-Sätze:
Organisches Praktikum I - SS 2006 Assistentin: Gabi Marti. Synthese von. Isobutylacetat. Zürich, Balzers & Eschen, Mai 2005
 rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
rganisches Praktikum I - SS 2006 Assistentin: Gabi Marti Synthese von Isobutylacetat Zürich, Balzers & Eschen, Mai 2005 Daniel Frick frickd@student.ethz.ch 1. Einleitung 1 Carbonsäure bilden mit Alkoholen
1006 Bromierung von 4-Ethoxyacetanilid (Phenacetin) zu 3-Brom-4-ethoxyacetanilid
 NP 1006 Bromierung von 4-Ethoxyacetanilid (Phenacetin) zu 3-Brom-4-ethoxyacetanilid KBr 3, HBr Essigsäure Br C 10 H 13 N 2 C 10 H 12 BrN 2 (179.2) (167.0) (80.9) (258.1) Literatur P.F. Schatz, J. chem.
NP 1006 Bromierung von 4-Ethoxyacetanilid (Phenacetin) zu 3-Brom-4-ethoxyacetanilid KBr 3, HBr Essigsäure Br C 10 H 13 N 2 C 10 H 12 BrN 2 (179.2) (167.0) (80.9) (258.1) Literatur P.F. Schatz, J. chem.
3009 Synthese von trans-5-norbornen-2,3-dicarbonsäure aus Fumarsäure und Cyclopentadien
 3009 Synthese von trans-5-norbornen-2,3-dicarbonsäure aus Fumarsäure und Cyclopentadien 170 C 2 C 10 H 12 C 5 H 6 (132.2) (66.1) + COOH COOH HOOC COOH C 5 H 6 (66.1) C 4 H 4 O 4 (116.1) C 9 H 10 O 4 (182.2)
3009 Synthese von trans-5-norbornen-2,3-dicarbonsäure aus Fumarsäure und Cyclopentadien 170 C 2 C 10 H 12 C 5 H 6 (132.2) (66.1) + COOH COOH HOOC COOH C 5 H 6 (66.1) C 4 H 4 O 4 (116.1) C 9 H 10 O 4 (182.2)
3 Darstellung von n-butyllithium
 3 Darstellung von n-butyllithium 3.1 Haltbarkeit von Butyllithium in Heptan und in Diethylether 1 n-butyllithium kann man in verschiedenen Solventien darstellen, z.b. in Diethylether und in n-heptan. Dabei
3 Darstellung von n-butyllithium 3.1 Haltbarkeit von Butyllithium in Heptan und in Diethylether 1 n-butyllithium kann man in verschiedenen Solventien darstellen, z.b. in Diethylether und in n-heptan. Dabei
Synthese von Triphenylmethanol
 Synthese von Triphenylmethanol Name des/der Assistenten/in: Geyer Karolin Datum der Versuchsdurchführung: 9.1.2006 Rémy Denzler, D-Biol 1 1. Methode C-C Bindungsknüpfung von ombenzol und Benzophenon durch
Synthese von Triphenylmethanol Name des/der Assistenten/in: Geyer Karolin Datum der Versuchsdurchführung: 9.1.2006 Rémy Denzler, D-Biol 1 1. Methode C-C Bindungsknüpfung von ombenzol und Benzophenon durch
Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, Natriumsalz) - Azofarbstoff -
 Christina Sauermann 1 C- A- Praktikum Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, atriumsalz) - Azofarbstoff - Die Darstellung von Methylorange erfolgt in zwei Teilschritten:
Christina Sauermann 1 C- A- Praktikum Präparat 6: Darstellung von Methylorange (4 Dimethylaminoazobenzol-4 -sulfonsäure, atriumsalz) - Azofarbstoff - Die Darstellung von Methylorange erfolgt in zwei Teilschritten:
(±)-4-Methyl-3- heptanon
 Synthese von (±)-4-Methyl-3- heptanon rganische Chemie Praktikum 1 Zürich, 14.12.2006 WS 2006 / 07 Maresa Afthinos Assistenz: Michael Schär Versuchsdurchführung: 12. Dezember 2006-1 - CP1 Synthese 5 Maresa
Synthese von (±)-4-Methyl-3- heptanon rganische Chemie Praktikum 1 Zürich, 14.12.2006 WS 2006 / 07 Maresa Afthinos Assistenz: Michael Schär Versuchsdurchführung: 12. Dezember 2006-1 - CP1 Synthese 5 Maresa
Synthese von Acetessigsäureethylester
 Illumina-Chemie.de - Artikel Synthesen Synthese von Acetessigsäureethylester Acetessigsäureethylester ist der wohl bekannteste β-ketoester und durch seine CH-acide Methylengruppe (pk a = 11) leicht elektrophil
Illumina-Chemie.de - Artikel Synthesen Synthese von Acetessigsäureethylester Acetessigsäureethylester ist der wohl bekannteste β-ketoester und durch seine CH-acide Methylengruppe (pk a = 11) leicht elektrophil
Synthese von 1-(p-Tolyl)butan-1,4-diol
 Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1-(p-Tolyl)butan-1,4-diol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich, 07. April
Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1-(p-Tolyl)butan-1,4-diol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich, 07. April
Gruppenpräparat: Versuch Darstellung von 1,2-Diphenyl-2,2-(4-methylphenyl)- ethanon
 P II Praktikum im WS 2008/2009 Gruppenpräparat: Versuch 7.4.1.1 Darstellung von 1,2-Diphenyl-2,2-(4-methylphenyl)- ethanon 1.Gruppe: Christoph Mann Marco Schott 2.Gruppe: Tim Walter Holger Hartleb Stefan
P II Praktikum im WS 2008/2009 Gruppenpräparat: Versuch 7.4.1.1 Darstellung von 1,2-Diphenyl-2,2-(4-methylphenyl)- ethanon 1.Gruppe: Christoph Mann Marco Schott 2.Gruppe: Tim Walter Holger Hartleb Stefan
6018 Nitrierung von Phenol zu 2-Nitrophenol und 4-Nitrophenol
 08 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol HNO + + Nebenprodukte C H O C H NO C H NO (9.) (.0) (9.) (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution am Aromaten,
08 Nitrierung von Phenol zu -Nitrophenol und -Nitrophenol HNO + + Nebenprodukte C H O C H NO C H NO (9.) (.0) (9.) (9.) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile Substitution am Aromaten,
4010 Synthese von p-methoxyacetophenon aus Anisol
 4010 Synthese von p-methoxyacetophenon aus Anisol C 3 + 3 C C 3 Zeolith C 3 + C 3 C C 3 C 7 8 (108.1) C 4 6 3 (102.1) C 9 10 2 (150.2) C 2 4 2 (60.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
4010 Synthese von p-methoxyacetophenon aus Anisol C 3 + 3 C C 3 Zeolith C 3 + C 3 C C 3 C 7 8 (108.1) C 4 6 3 (102.1) C 9 10 2 (150.2) C 2 4 2 (60.1) Klassifizierung Reaktionstypen und Stoffklassen Elektrophile
Synthese von Glutarsäure (1,5-Pentandicarbonsäure)
 Praktikum rganische Chemie I Chemnitz, 07.01.2006 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Glutarsäure (1,5-Pentandicarbonsäure)
Praktikum rganische Chemie I Chemnitz, 07.01.2006 529-0229-00L (für Biol./Pharm.Wiss) Wintersemester 05/06 Sylke öhnel 04-921-664 3. Semester Assistent: Pascal Bindschädler Synthese von Glutarsäure (1,5-Pentandicarbonsäure)
V 1 Herstellung von Natriumchlorid
 1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
1 V 1 Herstellung von Natriumchlorid In diesem Versuch wird Natriumchlorid, im Alltag als Kochsalz bekannt, aus den Edukten Natrium und Chlorgas hergestellt. Dieser Versuch ist eine Reaktion zwischen einem
Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol
 Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich,
Praktikum in Organischer Chemie (OCP 1) Frühjahrssemester 2008 529-0230-00L Peifer Manuel Synthese von 1,4-Di-t-butyl-2,5-dimethoxybenzol Janosch Ehrenmann BSc Biotechnologie D CHAB, ETH Zürich Zürich,
Praktikum Advanced Inorganic Chemistry. Praktikumsanleitung Version 10/2012. Graetzel Zelle
 Praktikum Advanced Inorganic Chemistry Praktikumsanleitung Version 10/2012 Graetzel Zelle Synthese von cis-ru II (dcbpy) 2 (CS) 2 Chemikalien: RuCl 3 x H 2 5,5 -Dicarboxyl-2,2`-bipyridin (Herstellung s.
Praktikum Advanced Inorganic Chemistry Praktikumsanleitung Version 10/2012 Graetzel Zelle Synthese von cis-ru II (dcbpy) 2 (CS) 2 Chemikalien: RuCl 3 x H 2 5,5 -Dicarboxyl-2,2`-bipyridin (Herstellung s.
1024 Eliminierung von Wasser aus 4-Hydroxy-4-methyl-2- pentanon
 0 Eliminierung von Wasser aus -Hydroxy--methyl-- pentanon H I H H H H - H H + H H H H H I H 0 (.) (.8) (98.) Klassifizierung Reaktionstypen und Stoffklassen Eliminierung Alkohol, Alken, Keton, Säurekatalysator
0 Eliminierung von Wasser aus -Hydroxy--methyl-- pentanon H I H H H H - H H + H H H H H I H 0 (.) (.8) (98.) Klassifizierung Reaktionstypen und Stoffklassen Eliminierung Alkohol, Alken, Keton, Säurekatalysator
Synthesevorschriften. Acetanilid t-butylchlorid Zimtsäure p-chlor-acetophenon. Laborübungen aus Organischer Chemie (LA) W.
 Laborübungen aus Organischer hemie (LA) Institut für hemie, Karl-Franzens-Universität Graz Synthesevorschriften Acetanilid t-butylchlorid Zimtsäure p-hlor-acetophenon W. Stadlbauer 1. Acetanilid Reaktionstyp:
Laborübungen aus Organischer hemie (LA) Institut für hemie, Karl-Franzens-Universität Graz Synthesevorschriften Acetanilid t-butylchlorid Zimtsäure p-hlor-acetophenon W. Stadlbauer 1. Acetanilid Reaktionstyp:
SKRIPT ZUM INTEGRIERTEN SYNTHESEPRAKTIKUM
 Integriertes Synthesepraktikum 2016 rganische Chemie SKRIPT ZUM ITEGRIERTE SYTHESEPRAKTIKUM Woche 1 und 2 (rganische Chemie) 1. Herstellung eines Alkens über die lefinierung eines Aldehyds nach Wittig
Integriertes Synthesepraktikum 2016 rganische Chemie SKRIPT ZUM ITEGRIERTE SYTHESEPRAKTIKUM Woche 1 und 2 (rganische Chemie) 1. Herstellung eines Alkens über die lefinierung eines Aldehyds nach Wittig
4008 Synthese von 2-Dimethylaminomethyl-cyclohexanonhydrochlorid
 4008 Synthese von 2-Dimethylaminomethyl-cyclohexanonhydrochlorid + + H 2 N(CH 3 H H EtH, H NH(CH 3 C 6 H 10 CH 2 C 2 H 8 N C 9 H 18 N (98.2) (30.0) (81.6) (191.7) Klassifizierung Reaktionstypen und Stoffklassen
4008 Synthese von 2-Dimethylaminomethyl-cyclohexanonhydrochlorid + + H 2 N(CH 3 H H EtH, H NH(CH 3 C 6 H 10 CH 2 C 2 H 8 N C 9 H 18 N (98.2) (30.0) (81.6) (191.7) Klassifizierung Reaktionstypen und Stoffklassen
Trennung von Stoffgemischen durch fraktionierte Destillation
 Präparat 1 (B5): Trennung von Stoffgemischen durch fraktionierte Destillation Literatur: Organikum, 23. Auflage, Wiley-VCH, Abschnitt 2.3 Anlagentyp: fraktionierte Destillation mit Vigreux-Kolonne unter
Präparat 1 (B5): Trennung von Stoffgemischen durch fraktionierte Destillation Literatur: Organikum, 23. Auflage, Wiley-VCH, Abschnitt 2.3 Anlagentyp: fraktionierte Destillation mit Vigreux-Kolonne unter
Synthese 1 Herstellung von. Cyclohex-3-en-1,1-diyldimethanol
 Organisch-Chemisches Praktikum 1 (OCP 1) HS 10/11 Assistenten: Daniel Fankhauser, Lorenz Urner Synthese 1 Herstellung von Cyclohex-3-en-1,1-diyldimethanol Bastian Vögeli Versuch: 21./22. Oktober 2010 1
Organisch-Chemisches Praktikum 1 (OCP 1) HS 10/11 Assistenten: Daniel Fankhauser, Lorenz Urner Synthese 1 Herstellung von Cyclohex-3-en-1,1-diyldimethanol Bastian Vögeli Versuch: 21./22. Oktober 2010 1
Titration von Metallorganylen und Darstellung der dazu benötigten
 Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Kapitel 1 Titration von tallorganylen und Darstellung der dazu benötigten Indikatoren -(2-Tolyl)pivalinsäureamid, ein Indikator zur Konzentrationsbestimmung von -rganylen [1] Reaktionstyp: Syntheseleistung:
Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on
 Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on Dietikon, 24. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Praktikum Anorganische und rganische Chemie I Assistent: Matthias berli Synthese von eritreo- und reo-8,9,epoxy-p-menth-2-enl-on Dietikon, 24. April 2008 Jorge Ferreiro fjorge@student.ethz.ch 1 Zusammenfassung
Präperat Nr. 6: Synthese von 3,3,5,5-Tetramethylcyclohexanon
 Präperat Nr. 6: Synthese von 3,3,5,5-Tetramethylcyclohexanon C 3 MgI CuCl C 3 3 C C 3 3 C C 3 Isophoron (C 9 14 ) 138,21 g/mol 3,3,5,5-Tetramethylcyclohexanon (C 10 18 ) 154,25 g/mol 1. Ansatz Es sollen
Präperat Nr. 6: Synthese von 3,3,5,5-Tetramethylcyclohexanon C 3 MgI CuCl C 3 3 C C 3 3 C C 3 Isophoron (C 9 14 ) 138,21 g/mol 3,3,5,5-Tetramethylcyclohexanon (C 10 18 ) 154,25 g/mol 1. Ansatz Es sollen
Synthese von 3-Aminophthalsäurehydrazid
 Illumina-Chemie.de - Artikel Synthesen Synthese von 3-Aminophthalsäurehydrazid Hier wird eine zweistufige Synthese von Luminol beschrieben. Luminol findet insbesondere für Chemilumineszenz Verwendung,
Illumina-Chemie.de - Artikel Synthesen Synthese von 3-Aminophthalsäurehydrazid Hier wird eine zweistufige Synthese von Luminol beschrieben. Luminol findet insbesondere für Chemilumineszenz Verwendung,
5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester
 NP 5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester NH 4 HC 3 + + 2 C 2 C 2 C 2 H CH 3 H 3 C N CH 3 H + 4 H 2 + C N 3 C 7 H 6 C 6 H 10 3 C 19 H 23 4 N C 2 (79.1)
NP 5013 Synthese von 2,6-Dimethyl-4-phenyl-1,4-dihydropyridin- 3,5-dicarbonsäure-diethylester NH 4 HC 3 + + 2 C 2 C 2 C 2 H CH 3 H 3 C N CH 3 H + 4 H 2 + C N 3 C 7 H 6 C 6 H 10 3 C 19 H 23 4 N C 2 (79.1)
Dibenzoylmethan
 9.1.2. Dibenzoylmethan Dibenzoylmethan ist eine Stufe eines Zweistufenprärates: Benzoylchlorid (8.1.11) Benzoesäureethylester (8.1.3) Dibenzoylmethan Reaktion: Ansatz: 1,75 g Natrium, 16,0 g Acetophenon,
9.1.2. Dibenzoylmethan Dibenzoylmethan ist eine Stufe eines Zweistufenprärates: Benzoylchlorid (8.1.11) Benzoesäureethylester (8.1.3) Dibenzoylmethan Reaktion: Ansatz: 1,75 g Natrium, 16,0 g Acetophenon,
Gruppenpräparat im Organisch-Chemischen Praktikum II
 Gruppenpräparat im rganisch-chemischen Praktikum II WS 2007/2008 Versuch 6.2.3 Philipp Bissinger Alexander Damme Yvonne Göbel Inhaltsverzeichnis 1. Einleitung 2. Darstellungsmethoden 2.1 Darstellung von
Gruppenpräparat im rganisch-chemischen Praktikum II WS 2007/2008 Versuch 6.2.3 Philipp Bissinger Alexander Damme Yvonne Göbel Inhaltsverzeichnis 1. Einleitung 2. Darstellungsmethoden 2.1 Darstellung von
