Ergebnisse Nachweis der erfolgreichen Expression der intrazellulären Domäne
|
|
|
- Christa Böhmer
- vor 7 Jahren
- Abrufe
Transkript
1 Ergebnisse 16 2 Ergebnisse 2.1 Nachweis der erfolgreichen Expression der intrazellulären Domäne Da die intrazelluläre Domäne des nachr keine enzymatische Aktivität und keine andere bekannte biologische Funktion besitzt, ist kein Aktivitäts-Test zum Nachweis des Proteins vorhanden. Daher ist es schwierig, die Expression des gewünschten Proteins nachzuweisen. Eine Detektion kann nur durch Auftrennung der erhaltenen Proteinfraktionen über SDS-Gelelektrophorese (SDS-PAGE) und anschließenden Western-Blot erfolgen, bei dem das gesuchte Protein mit Antikörpern gegen einen vorhanden Tag oder die intrazelluläre Schleife selbst nachgewiesen wird. Dabei wird allerdings keine Aussage darüber getroffen, ob das Protein im Expressionssystem im nativen Zustand vorlag. 2.2 Expression in Insektenzellen Baculovirus-Expression (pfastbac-vektor) In Sf9-Insektenzellen kann fremde DNA mit Hilfe von Baculovirus-Partikeln eingeführt werden. Baculoviren sind Retroviren, die bestimmte Insektenarten befallen können. Durch genetische Veränderung dieser Viren kann DNA in das Virusgenom eingebracht werden, die nach Infektion der Zellen verstärkt abgelesen und in Proteine übersetzt wird. In Abb. 16 ist die Vorgehensweise zur Herstellung der rekombinanten Baculoviren dargestellt. Zunächst wird in das sog. Donor-Plasmid die gewünschte DNA-Sequenz insertiert. Dieses Plasmid wird in kompetente E. coli eingebracht, die die Bacmid- DNA und notwendige Helferplasmide bereits enthalten. In diesen Bakterien erfolgt die Rekombination der DNA-Sequenzen und mit Hilfe von Antibiotika können Bakterien selektiert werden, die intakte Bacmid-DNA enthalten. Sobald einzelne Klone mit rekombinanter Baculovirus-DNA identifiziert werden können, werden diese Bakterien amplifiziert und die Virus-DNA aus ihnen isoliert. Mit der Bacmid-DNA werden anschließend die Sf9-Zellen transfiziert, die dann den Virus exprimieren. Der Virus muss über mehrere Stufen amplifiziert werden, auf jeder Stufe wird die Konzentration der Viruspartikel bestimmt. Bei einem genügend hohen Virustiter können die Insektenzellen zur Expression des gesuchten Proteins mit dem rekombinanten Virus infiziert werden.
2 Ergebnisse 17 Abbildung 16: Schematische Darstellung der Vorgehensweise zur Herstellung rekombinanter Baculoviren mit Hilfe des Bac-To-Bac-Systems. Das Schema wurde dem Handbuch der Firma Invitrogen entnommen. Aus vorangegangenen Arbeiten in der Arbeitsgruppe waren Baculoviren für die Expression der intrazellulären Domäne der - und der -Untereinheit des Torpedo californica-nachr als Fusionsprotein mit Glutathion-S-Transferase (GST) bereits vorhanden. [54] Diese Virenstämme mussten weiter amplifiziert werden, bevor eine erfolgreiche Infektion der Insektenzellen zur Expression der gewünschten Proteine erfolgen konnte. Durch die Fusion mit einem anderen Protein sollten die Detektion und vor allem die Reinigung des exprimierten Konstruktes erleichtert werden. Das Enzym GST bindet an sein natürliches Substrat Glutathion, wodurch man eine Reinigung mit einer Affinitätschromatographie über an einer Matrix gebundenes Glutathion durchführen kann. In zahlreichen Expressionsversuchen wurden teilweise bis zu 50 Dg/ml (Abschätzung nach Coomassie-Färbungen von SDS-Gelen) des gesuchten Proteins gefunden. Das Protein war allerdings in Reinigungspuffer ohne Detergenz unlöslich und blieb nach der Zentrifugation im unlöslichen Teil des Zellhomogenats. Bei Verwendung von 1 % SDS im Homogenisierungspuffer wurde das Protein nicht an die Affinitätsmatrix gebunden. Ein Beispiel für dieses Ergebnis zeigt Abb. 17. Eine Reinigung über die Glutathion-Säule war aus diesen Gründen nicht möglich.
3 Ergebnisse 18 Abbildung 17: SDS-PAGE (links) und Western-Blot (rechts) eines Aufarbeitungs-Versuches des Fusionsproteins aus GST und der intrazellulären Schleife der -Untereinheit (Torpedo californica) aus Baculovirus-infizierten Sf9-Zellen. In Spur 1 ist jeweils das komplette Zellhomogenat aufgetragen, in Spur 2 die Waschlösung nach Durchlauf durch die Glutathion-Säulenmatrix. Das SDS-Gel ist mit Silber gefärbt worden, auf dem Western-Blot wurde mit Hilfe der Alkalischen-Phosphatase- Reaktion spezifisch die -Schleife mit einem monoklonalen Antikörper (von S. Tzartos, Athen, Griechenland) angefärbt. M: Molekulargewichts-Standard Das Protein aggregierte anscheinend in den Zellen, eventuell indem es an intrazellulären Membranen, z. B. im ER, hängen blieb oder aber von den Zellen in Kompartimente eingepackt wurde. Diese Membranen sollten aus den Zellen isoliert und damit das gesuchte Protein auf einfachere Weise erhalten werden. Daher wurden Membranpräparationen mit verschiedenen Homogenisationspuffern durchgeführt (Details siehe Kapitel 5.9), um mit dieser Methode bestimmte Membranbereiche der Insektenzellen zu isolieren und dabei das Fusionsprotein in einer oder mehreren Fraktionen anzureichern. Das Protein wurde jedoch immer über alle Fraktionen verteilt gefunden (siehe Abb. 18). Da keine Anreicherung im Sucrosegradienten in einer Fraktion gezeigt werden konnte, wurde dieser Ansatz nicht weiter verfolgt. In der Immunfluoreszenz von infizierten Zellen zeigte sich nach drei Tagen das exprimierte Protein innerhalb der Zellen mit deutlicher Fluoreszenz-Intensität, wahrscheinlich an intrazellulären Membranen aggregiert (siehe Abb. 19).
4 Ergebnisse 19 Abbildung 18: SDS-PAGE einer Membranpräparation von Sf9-Zellen nach Expression der intrazellulären Schleife der -Untereinheit als Fusionsprotein mit GST. Das Gel wurde mit Coomassie gefärbt. Spur 1: komplettes Zellhomogenat, Spur 2: Pellet der Präparation, Spuren 3-18: Fraktionen des Sucrosegradienten, M: Molekulargewichts-Standard. Die Proteinbande, die in allen Fraktionen höchstwahrscheinlich das Fusionsprotein enthält, ist markiert. Abbildung 19: Indirekte Immunfluoreszenz von Baculovirus-infizierten Sf9-Zellen. Gezeigt sind Aufnahmen mit einem konfokalen Mikroskop. Die Fluoreszenz zeigt die intrazelluläre Schleife der - Untereinheit. Für die Expression der intrazellulären Schleifen der anderen beiden Untereinheiten musste die DNA erst in den Baculovirus eingebracht (-Untereinheit) bzw. der Vektor kloniert und die DNA dann in den Virus überführt werden (-Untereinheit). Um die DNA für die Schleife der -Untereinheit in den Vektor zu bringen, wurde sowohl der Vektor als auch die gewünschte DNA-Sequenz mit den Restriktionsenzymen EcoR V und Hind III geschnitten. Diese Sequenz wurde vorher mit entsprechenden Primern mit Hilfe der PCR amplifiziert. Die Herstellung des richtigen Vektorkonstruktes wurde mittels Verdau in charakteristische Bruchstücke (siehe Abb. 20) und außerdem durch Sequenzierung überprüft.
5 Ergebnisse 20 Abbildung 20: Agarosegele des Kontrollverdaus der neu hergestellten pfastbacgst-plasmide mit der intrazellulären Schleife der -Untereinheit. Zu sehen ist ein 1 %iges Agarosegel zu zwei verschiedenen Zeitpunkten der Elektrophorese. Drei Klone des pfastbacgst-plasmides mit der DNA für die intrazelluläre Schleife der -Untereinheit wurden parallel mit den Enzymen EcoR V und Hind III verdaut (Spuren 1-3). Zu sehen ist das herausgeschnittene Fragment bei knapp unter 500 bp und der linearisierte Vektor bei etwa 5,5 kb. M: Molekulargewichts-Standard. Die Viruspartikel wurden über mehrere Stufen amplifiziert und der Virustiter mit Hilfe eines Tests der Firma Life Technologies zur einfacheren Bestimmung der Viruskonzentration auf jeder Stufe ermittelt. Dazu wurden in einer Mikrotiterplatte gesunde Insektenzellen ausgesät und mit Verdünnungen der Viruslösung inkubiert. Nach 45 h wurden die Zellen fixiert und die infizierten Zellen mit Hilfe eines Antikörpers gegen ein Virusprotein sichtbar gemacht. Anschließend erfolgte eine Auszählung der gefärbten Zellansammlungen unter dem Mikroskop. Dieser Vorgang wurde nach jedem Amplifikationsschritt wiederholt. Nach Erreichen einer ausreichenden Viruskonzentration wurden einige Expressionen durchgeführt. Dabei lag der Fokus auf der -Untereinheit, da dort insgesamt vier Phosphorylierungsstellen liegen. Nach diesem Verfahren konnte auch mit genügend großer Virusmenge keine Expression des gewünschten -Loop-Proteins erreicht werden. Die Insektenzellen starben ab, bevor eine Expression des gesuchten Proteins nachweisbar war. Eventuell war das zu exprimierende Fusionsprotein unter den Bedingungen der Baculovirus-Infektion toxisch für die Zellen. Deshalb wurde ein neuer Ansatz verfolgt. Die Proteine sollten mit einem Signalpeptid versehen exprimiert werden. Dieses Signal sollte dafür sorgen, dass das Protein nach der erfolgreichen Expression aus der Zelle transportiert wird. Damit wäre eine Reinigung des Proteins aus der Lösung im Zellkulturmedium sehr viel einfacher, da außerdem ein Tag zur Bindung des Proteins an eine Affinitätschromatographie-Säule eingebaut wird.
6 Ergebnisse Baculovirus-Expression (pbsv-8his-vektor) Der hier verwendete Vektor enthält ein Sekretionssignal, welches den Export des exprimierten Proteins aus der Zelle veranlassen soll. [55] Außerdem wird der His 8 -Tag an das Protein synthetisiert, der am N-Terminus des Proteins eine Folge von acht Histidinresten beinhaltet, die einen stabilen Chelatkomplex mit zweiwertigen Metallionen bilden. Mit Hilfe einer Ni 2+ -Affinitäts-Säule können diese Proteine aus einer Lösung isoliert und anschließend mit Imidazol-enthaltendem Puffer von der Säule eluiert werden. Als erstes Konstrukt wurde hier der Vektor mit der Sequenz für die intrazelluläre Schleife der -Untereinheit hergestellt. Dabei wurden die Restriktions-Schnittstellen der Enzyme Xma I und Pst I verwendet, um die gewünschte DNA-Sequenz an definierter Stelle in den Vektor einzusetzen. Das DNA-Stück wurde wiederum mit Hilfe der PCR hergestellt und die Richtigkeit des Konstruktes durch Kontrollverdau (siehe Abb. 21) und durch Sequenzierung nachgewiesen. Abbildung 21: Herstellung des pbsv-8his-plasmides mit der DNA für die intrazelluläre Schleife der -Untereinheit. Gezeigt werden die Ergebnisse der PCR zur Herstellung des DNA-Fragmentes für die intrazelluläre -Schleife (Spuren 1 und 2). M: Molekulargewichts-Standard. Anschließend wurde die Baculovirus-DNA in linearisierter Form mit dem Vektor in Sf9-Insektenzellen co-transfiziert und durch mehrere Selektionsschritte der entsprechende Virus hergestellt und über mehrere Amplifikationen vermehrt. Es zeigte sich jedoch bei den Expressionsversuchen keinerlei Expression des gewünschten Proteins. Der rekombinante Virus war von Anfang an mit Wildtyp-Virus verunreinigt, der sich über die Amplifikationen deutlich besser vermehrt hatte und schließlich den rekombinanten Stamm völlig verdrängt hatte. Dadurch war in der verwendeten Baculovirus-Lösung keine DNA zur Expression des gesuchten Proteins vorhanden. Eine derartige Verunreinigung entsteht häufig durch Schwierigkeiten bei der ersten Selektionsstufe der Herstellung des rekombinanten Virus. Bei diesem Schritt werden einzelne Ansammlungen von Zellen aus der Monolayer entnommen und auf die Expression des gesuchten Proteins getestet. Dabei kann es leicht vorkommen, dass
7 Ergebnisse 22 man Zellen untersucht, von denen einige mit dem rekombinanten, andere mit dem Wildtyp-Virus infiziert sind Transfektion von Sf9-Zellen Da das Baculovirus-System nach der Infektion zum schnellen Tod der Insektenzellen führte, wurde ein anderer Vektor getestet, der eine direkte Transfektion der Zellen ermöglicht. Die DNA sollte mit Hilfe des Vektors pmib/v5-his unmittelbar in die Zellen gebracht werden, nicht über die Infektion mit einem Virus. Der Vektor erzeugt ein Fusionsprotein aus der eingesetzten DNA mit einem His 6 -Tag und einem V5-Tag. Die Sequenz des V5-Tags dient dem besseren Nachweis des Proteins. Hier wurde erneut die kodierende DNA für die intrazelluläre Schleife der -Untereinheit in den neuen Vektor eingebracht. Dazu wurden die im Vektor vorhandenen Schnittstellen der Restriktionsenzyme Sph I und Xba I verwendet. Das DNA-Stück wurde mit Hilfe der PCR mit Primern, die ebenfalls die Sequenzen für diese Schnittstellen enthielten, synthetisiert. Die erfolgreiche Klonierung wurde über Restriktionsverdau zu charakteristischen Bruchstücken (siehe Abb. 22) und durch Sequenzierung nachgewiesen. Abbildung 22: Herstellung der DNA-Fragmente für die intrazelluläre -Schleife. Gezeigt sind die durch PCR hergestellten DNA-Stücke mit knapp 500 bp (Spur 1 und 2). M: Molekulargewichts-Standard. Zunächst wurden geringe Mengen von Insektenzellen in kleinen Petrischalen ausgesät und mit Hilfe des Lipid-Reagenzes SuperFect mit der DNA transfiziert. Drei Tage lang wurden diese Zellen mit dem normalen Medium gefüttert, bevor das selektierende Antibiotikum Blasticidin zugegeben wurde. Jetzt konnten nur Zellen, die das Vektorkonstrukt enthielten, weiter wachsen. Zunächst gediehen die Zellen in großer Zahl sehr gut, bis nach zwei Wochen plötzlich fast alle abstarben. Erst nach vier bis fünf Wochen hatten sich die wenigen überlebenden Zellen soweit erholt, dass sie sich entsprechend vermehrt hatten, um sie in größere Kulturflaschen subkultivieren zu können. Schließlich wurden von den Zellen sowohl Monolayer- als auch Schüttelkulturen angesetzt, die auf der Suche nach dem gewünschten Protein aufgearbeitet wurden. Auch das Zellkulturmedium wurde auf das Fusionsprotein hin ge-
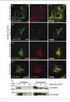
8 Ergebnisse 23 testet. Hier wurde allerdings kein exprimiertes Schleifen-Protein gefunden. Aus den Zellen wurde Homogenat in einem Phosphatpuffer hergestellt, das über eine Ni 2+ - Affinitäts-Säule gegeben wurde. In der Elutionsfraktion konnte das gesuchte Protein nachgewiesen werden, allerdings nicht in reiner Form. Da Insektenzellen viele endogene Histidin-reiche Proteine besitzen, wurden diese auch an die Säule gebunden und anschließend ebenfalls eluiert. Ein Beispiel für die Ergebnisse der Reinigungsversuche des rekombinanten Proteins über eine Ni 2+ -Affinitäts-Säule aus den stabil transfizierten Zellen zeigt Abb. 23. Abbildung 23: Versuch der Reinigung des exprimierten Proteins über Ni 2+ -Affinitätschromatographie. Links: Coomassie-gefärbtes SDS-PAGE der Elutionsfraktionen 1 bis 4 der Ni 2+ -Affinitätssäule (Spuren 1 bis 4). Rechts: ECL-Färbung des Western-Blots dieser Proteine. Verwendet wurde ein Antikörper gegen den V5-Tag des Fusionsproteins. M: Molekulargewichts-Standard. Über Immunfluoreszenz-Aufnahmen der transfizierten Zellen konnte gezeigt werden, dass das Protein in den Zellen hergestellt wurde, aber in bestimmten Bereichen stark aufkonzentriert ist. In Abb. 24 sind Beispiele für die dicht zusammengelagerten und eventuell in Membranen gehüllten Proteine in den Sf9-Zellen zu sehen. Abbildung 24: Indirekte Immunfluoreszenz von stabil transfizierten Sf9-Zellen. Die Abbildung zeigt Aufnahmen mit einem Fluoreszenzmikroskop. Die Zellen wurden mit einem Antikörper gegen den V5-Tag des Fusionsproteins behandelt.
9 Ergebnisse Expression in Escherichia coli Da die Expression in Insektenzellen nicht die gewünschte Ausbeute des Proteins erbrachte, wurde die Herstellung des gesuchten Proteins in Bakterien begonnen. Es wurden Vektoren zur Expression mit den Sequenzen für die intrazelluläre Schleife der -Untereinheit und der 7-Untereinheit verwendet. Die Konstrukte für die - Schleife wurden freundlicherweise von der Arbeitsgruppe von Prof. V. Tsetlin (Shemyakin-Ovchinnikov-Institut für Bioorganische Chemie, Moskau, Russland) bereitgestellt, die Konstrukte für 7 wurden selbst hergestellt. Basierend auf der Überlegung, dass eventuell an den kompletten Schleifen-Sequenzen die Enden Bereiche sind, die nicht mehr zu der autonom faltenden Domäne gehören oder aber normalerweise durch Membrannähe beeinflusst werden und ohne Membran zum Aggregieren neigen könnten, wurden neue DNA-Konstrukte hergestellt. Wenn man diese Stücke aus dem Expressionsprodukt entfernt, sollte das Protein eventuell besser löslich sein und weniger aggregieren. Da Bakterien eine bessere Expressionsausbeute bei löslichen - und damit den Stoffwechsel nicht so sehr störenden - Proteinen zeigen, sollte sich auch die Menge des exprimierten Proteins vergrößern. Daher wurden verkürzte Versionen der beiden Schleifen hergestellt, die bessere Ergebnisse zeigen könnten als die Konstrukte mit voller Länge. So wurden am C- und N- Terminus von 7- und -Schleife zehn bzw. sieben Aminosäuren weggelassen. Bei der Sequenz der 7-Untereinheit wurden am C-Terminus weitere Verkürzungen um 19 bzw. 29 Aminosäuren vorgenommen (siehe Abb. 25). 318 HHH VVDR 152 AS 312 HFR IDR 142 AS - 7AS GKM......VVDR - 7AS HVL AS - 10 AS...CSE - 10 AS...VGN - 7AS - 7AS HHH AS...RCQ - 29 AS...EVR - 10 AS...CSE - 19 AS...RCQ Abbildung 25: Schema der hergestellten Konstrukte der 7-Schleifen (links) und - Schleifen (rechts). Oben sind jeweils die kompletten Längen gezeichnet, darunter die jeweiligen verkürzten Sequenzen AS...EVR
10 Ergebnisse Expression der -Schleife In zwei verschiedenen Vektoren der pet-reihe (Firma Novagen) wurden die komplette intrazelluläre Schleife und zwei verkürzte Versionen eingesetzt. Das vollständige Konstrukt lag in pet-15b vor, wodurch ein Fusionsprotein mit einem His 6 -Tag entstehen sollte. Die beiden um sieben (N-Terminus) und zehn Aminosäuren (C-Terminus) verkürzten Versionen lagen in pet-28a vor, ebenfalls mit einem N-terminalen His 6 -Tag. Die Plasmide wurden von der Arbeitsgruppe von Prof. V. Tsetlin (Shemyakin-Ovchinnikov-Institut für Bioorganische Chemie, Moskau, Russland) zur Verfügung gestellt und sequenziert. Abbildung 26: Agarose-Gelelektrophorese der gereinigten Plasmide pet-28a/-7n (Spur 1) und pet-28a/-10c (Spur 2). Die Plasmide wurden mit dem Enzym Xho I verdaut, um die Größe der Konstrukte beurteilen zu können. M: Molekulargewichts-Standard. Ausreichende Mengen der Plasmide wurden aus Bakterien isoliert, bevor die Expression gestartet wurde. Erste Expressionsversuche im kleinen Maßstab waren aber nicht erfolgreich. Ein möglicher Grund hierfür ist, dass das Plasmid vor Beginn der Expression wieder aus den Bakterien ausgestoßen wurde. Wenn die eingebrachte DNA den Stoffwechsel der Bakterien irgendwie behindert, versuchen sie das Plasmid möglichst schnell wieder auszuschleusen Expression der 7-Schleife Die verschiedenen Konstrukte wurden in den Vektor pgex-4t-1 (Firma Amersham Pharmacia Biotech) eingesetzt. Der Vektor enthält die DNA-Sequenz des Enzyms Glutathion-S-Transferase (GST), das als Fusionsprotein mit den entsprechenden insertierten Sequenzen exprimiert wird. Über dieses Protein kann sowohl der Nachweis mit Hilfe eines spezifischen Antikörpers gegen GST, als auch die Reinigung des Fusionsproteins erfolgen. Die Sequenzen mit kompletter Länge und insgesamt sieben gekürzte Versionen wurden durch die entsprechenden Primer mit Hilfe der PCR produziert. Zum Einsetzen der Sequenzen in den Vektor wurden die Restriktionsenzyme EcoR I und Xho I verwendet, mit denen sowohl die PCR-Produkte als auch der Vektor geschnitten wurde. Nach der Ligation, Transformation in die Bakterien und
11 Ergebnisse 26 Selektion der Kolonien mit der entsprechenden Antibiotikum-Resistenz wurde die aus den Bakterien isolierte DNA auf ihre Richtigkeit untersucht (siehe Abb. 27). Abbildung 27: Herstellung der verschiedenen Konstrukte mit DNA der intrazellulären Schleife der 7-Untereinheit. Gezeigt sind einige zur Kontrolle verdaute Plasmide für vier verschiedene Konstrukte auf einem 1 %igen Agarosegel (Spuren 1-8). M: Molekulargewichts- Standard. Anschließend wurden Plasmide sequenziert. Die Sequenzen aller acht Plasmide waren korrekt. Es wurde mit kleinen Probeexpressionen begonnen. Die DNA wurde in den entsprechenden Bakterienstamm (BL21 (DE3)) zur Expression eingebracht. In Volumina von je 4 ml Medium wurde eine Expression der Konstrukte für 3,5 h durch Induktion mit IPTG gestartet. Über SDS-PAGE und Western-Blot wurde nach Aufschluss der Bakterien nach den gewünschten Expressionsprodukten gesucht. Durch Anfärben der Blotmembran mit Hilfe eines Antikörpers gegen die Glutathion-S- Transferase konnte gezeigt werden, dass die gesuchten Proteine tatsächlich synthetisiert worden waren (siehe Abb. 28). Unter denselben Bedingungen ohne Induktion der Expression mit IPTG wurde keine Expression des Fusionsproteins detektiert. Abbildung 28: Probeexpression in E. coli. SDS-PAGE (links) und Western-Blot (rechts) von Bakterienhomogenaten. Spur 1: ohne Induktion mit IPTG, Spur 2: Expression der 7-Schleife (komplett), Spur 3: 7-Schleife -10 AS am C-Terminus, Spur 4: 7-Schleife -19 AS, Spur 5: 7-Schleife -29 AS, M: Molekulargewichts-Standard. Die Expression in einem größeren Volumen Medium und auch in anderen Medien erwies sich in mehreren Versuchen als nicht erfolgreich. Bei einigen Expressionen wurde zumindest eine kleine Menge des gesuchten Proteins gefunden. Es wurden dann verschiedene Methoden zur Aufreinigung der Proteine getestet, die aber auch keine akzeptable Ausbeute an Protein erbrachten. Ein Beispiel eines Reinigungsver-
12 Ergebnisse 27 suches über Glutathion-Sepharose zeigt Abb. 29. Die exprimierten Proteine wurden wahrscheinlich durch Proteasen verdaut. Abbildung 29: Versuch der Reinigung des GST-Fusionsproteins über eine Glutathion-Sepharose-Säule. SDS-PAGE (links) und Western-Blot (rechts) von Bakterienhomogenat (Spur 1) und Elutionsfraktionen 1 bis 5 von der Glutathion-Sepharose-Säule (Spuren 2-6). Das Gel wurde mit Coomassie gefärbt, der Blot mit Hilfe eines anti-gst-antikörpers und der Alkalischen-Phosphatase- Reaktion. In Elutionsfraktion 2 und 3 (Spuren 4 und 5) wurden kleine Fragmente des gesuchten Proteins gefunden. Das komplette Fusionsprotein hat eine Größe von knapp 40 kda. M: Molekulargewichts-Standard. Als weitere Variante wurde ein von den bisher verwendeten stark abweichendes Expressionsprotokoll getestet. Die Bakterien (BL21 (DE3)) wurden frisch mit den Plasmiden für das komplette Konstrukt und die am stärksten verkürzte Version transformiert. Anschließend erfolgte eine sehr kurze Expressionszeit von nur 1,5 h bei sehr niedriger Temperatur (25 C) und die Aufarbeitung der Bakterien mit einem Puffer, der einen hohen Anteil an Sucrose enthielt. Der Zuckergehalt des Puffers sollte die Proteine besser stabilisieren und vor dem Aggregieren bewahren. Nach Aufschluss der Bakterien entstand ein klares Homogenat, das über eine Glutathion- Sepharose-Säule gegeben wurde. An diese Säulenmatrix sollte nur das exprimierte Fusionsprotein binden. Nach der Elution und Analyse der Eluatfraktionen über ein SDS-PAGE-Gel und Western-Blot konnte die Expression der gewünschten Proteine nachgewiesen werden (siehe Abb. 30).
13 Ergebnisse 28 Abbildung 30:Expression in BL21 (DE3). SDS-Page (oben) und Western-Blot (unten) von Bakterienhomogenat (Spuren 2(Gel) bzw. 1(Blot) und 9(Gel) bzw. 6(Blot)), Durchlauf der Säule (Spuren 3 bzw. 2 und 10 bzw. 7), Elutionsfraktionen 1 bis 3 (Spuren 4-6 bzw. 3-5 und bzw. 8-10). Links ist jeweils das komplette 7-Konstrukt zu sehen, rechts das um 7 AS am N-Terminus und 29 AS am C-Terminus verkürzte Konstrukt. Das Gel wurde mit Coomassie gefärbt, vom Blot ist die ECL-Färbung mit einem anti-gst-antikörper abgebildet. M: Molekulargewichts-Standards. Hier sind die Protein-Banden der Fusionsproteine gut in den Elutionsfraktionen (Spuren 4-6 und 11-13) im Gel und in allen Fraktionen im entsprechend Antikörper-gefärbten Western-Blot zu erkennen. Der Proteingehalt der Fraktion von Spur 5 betrug 30 Dg. Allerdings ist auch zu sehen, dass eine größere Menge GST ohne das N-terminal angehängte Protein von der Säule eluiert wurde. In den Bakterien scheint durch Proteasen das frisch hergestellte Protein gespalten oder nicht vollständig exprimiert worden zu sein. Während der Reinigung waren ständig große Konzentrationen Protease-Inhibitoren vorhanden. Die Proteinbande mit dem höchsten Proteingehalt an Fusionsprotein (Spur 5 des in Abb. 30 gezeigten Gels) wurde aus dem Gel geschnitten. Das Protein wurde tryptisch verdaut und die entstandenen Peptide mit Hilfe der MALDI-Massenspektrometrie analysiert (siehe Abb. 31). Durch Massen- Fingerprint und teilweise Sequenzierung eines C-terminalen Peptids konnte das Fusionsprotein eindeutig identifiziert werden.
14 Ergebnisse 29 Abbildung 31: MALDI-TOF-Spektrum des gereinigten Fusionsproteins aus E. coli. Gezeigt ist ein Ausschnitt aus dem Gesamtspektrum, in dem die eindeutig identifizierten Peaks der Peptide mit ihren m/z-verhältnissen markiert sind. Es wurden Peptide aus dem gesamten Bereich des Fusionsproteins gefunden. Das Peptid mit m/z = 758,44 wurde mittels Peptid-Mass-Fingerprint sequenziert. Es handelt sich hierbei um den C-Terminus des Proteins mit der Sequenz ILEEVR. Auch die Experimente mit einem anderen Bakterienstamm (NM522) zeigten die Expression der Proteine, allerdings in viel kleinerer Menge als bei BL21 (DE3) (siehe Abb. 32). Dafür wurde aber das jeweilige Fusionsprotein in größerem Anteil als Ganzes von der Säule eluiert, es ist kaum GST allein nachzuweisen. Eine mögliche Begründung dafür ist, dass in diesem Bakterienstamm die Proteasen nicht so aktiv wie in BL21 (DE3)-Zellen sind.
15 Ergebnisse 30 Abbildung 32: Expression in NM522. SDS-Page (oben) und Western-Blot (unten) von Bakterienhomogenat (Spuren 2 und 7(Gel) bzw. 1 und 7(Blot)), Durchlauf der Säule (Spuren 3 bzw. 2 und 8), Elutionsfraktionen 1 bis 3 (Spuren 4-6 bzw. 3-5 und 9-11). Links ist jeweils das komplette 7-Konstrukt zu sehen, rechts das um 7 AS am N-Terminus und 29 AS am C-Terminus verkürzte Konstrukt. Das Gel wurde mit Coomassie gefärbt, vom Blot ist die ECL-Färbung mit einem anti-gst-antikörper abgebildet. M: Molekulargewichts- Standards. Bei dem Versuch, die Expression nach derselben Vorschrift exakt zu wiederholen, zeigten sich die folgenden Probleme. Das Lysat der Bakterien wurde nicht als klare Lösung erhalten, wodurch sich die Reinigung über die Glutathion-Sepharose sehr schwierig gestaltete (siehe Abb. 33). Im Lysat waren noch viele Proteine aggregiert, weswegen keine Bindung an die Säulenmatrix stattfinden und damit auch keine Reinigung des gesuchten Proteins erfolgen konnte.
16 Ergebnisse 31 Abbildung 33: SDS-PAGE einer Aufarbeitung von Bakterien entsprechend dem vorher erfolgreichen Protokoll. Zu sehen sind die aufgetragenen Proteine des Überstands und des Pellets des Bakterienlysats (Spur 1 und 2), der Durchlauf und die Waschlösung der Glutathion-Sepharose-Säule (Spur 3 und 4) und die vier Elutionsfraktionen (Spuren 5-8). Es wurde kaum exprimiertes Fusions-protein in den Elutionsfraktionen gefunden. M: Molekulargewichts-Standard. Diese Ergebnisse zeigen, dass die Bedingungen für die Bakterienexpression weiter zu optimieren sind, bevor eine größere Menge des gesuchten Proteins auf einmal hergestellt werden kann. Schließlich wurde die Expression der GST-Fusionsproteine eingestellt, es sollen in Zukunft Fusionsproteine mit dem Maltose-Binding-Protein (MBP) hergestellt werden. Diese Konstrukte sollen bessere Löslichkeit und Renaturierung der Proteine zeigen.
17 Ergebnisse Expression in zellfreien Systemen Für problematisch zu exprimierende Proteine, die eventuell sogar toxisch auf die Wirtszelle wirken können, gibt es die Möglichkeit, die Expression im kleineren Maßstab im zellfreien System durchzuführen. Dabei wird ein Lysat von E. coli verwendet, das von den natürlichen Nuklein- und Aminosäuren befreit worden ist. Dieses Lysat enthält aber alle zur Transkription und Translation notwendigen Enzyme. Die benötigten Amino- und Nukleinsäuren sowie energieliefernde Substanzen werden vor Reaktionsbeginn zugegeben. Dieses System ermöglicht eine große Variabilität der Expressionsbedingungen und damit auch die Herstellung auf anderem Weg nur mit hohem Aufwand herzustellender Proteine. Allerdings schwankt die zu exprimierende Proteinmenge je nach verwendetem System zwischen wenigen Dg/ml und bis zu 5mg/ml Rapid Translation System (Roche) Die Firma Roche vertreibt ein System, mit dessen Hilfe man in einfachen Schritten Proteine herstellen können sollte. Dabei wird ein optimiertes E. coli-lysat eingesetzt, zu dem die verschiedenen Pufferlösungen mit den notwendigen Substanzen und die gewünschte DNA gegeben werden. Das zu exprimierende Gen sollte in einem Vektor unter Einfluss eines T7-Promotors und -Terminators stehen. Außerdem muss die Ribosomen-Bindungsstelle in der mrna vorhanden sein. In einer gekoppelten In vitro-reaktion wird zunächst das Gen von der T7-Polymerase in mrna umgeschrieben, anschließend wird das Protein mit Hilfe der Ribosomen des Lysates nach der Sequenz der RNA synthetisiert. Das Protein sollte nach einigen Stunden Reaktion aus dem Lysat isoliert werden können. Abbildung 34: Schema der In vitro-transkription und -Translation. Darstellung der Firma Roche zur Erläuterung des Systems der zellfreien Expression von Proteinen.
18 Ergebnisse 33 Laut Herstellerangaben können in diesem System auch herkömmliche Vektoren von der Expression in E. coli verwendet werden. Es ist jedoch vorteilhaft, das gewünschte Gen in die für die in vitro-reaktion optimierten Vektoren umzuklonieren. Für die ersten Versuche wurden die bereits vorhandenen Plasmide mit den Genen für die intrazellulären Schleifen der - und der 7-Untereinheit benutzt. Dazu wurden 50 Dl-Ansätze nach der Vorschrift der Firma Roche vorbereitet. Beim ersten Versuch wurden insgesamt acht Reaktionen gestartet: o eine Positivkontrolle mit einem mitgelieferten GFP-Plasmid (zur Überprüfung der korrekten Vorbereitungen) o drei Reaktionen mit den -Schleifen-Konstrukten und o vier verschieden lange Konstrukte für die 7-Schleife. Es hat sich gezeigt, dass bei der Vorbereitung der Reaktionen besonders sauberes Arbeiten notwendig ist, da sonst RNAsen in die Lösungen gelangen können und dann während der Reaktion die gerade entstehende mrna zerstören. Die Reaktionsgefäße wurden nach 6 h bei 30 C im Thermocycler bei -20 C eingefroren und am nächsten Tag auf Eis aufgetaut. Zunächst wurde die erfolgreiche Expression des GFP durch Bestrahlung der Gefäße mit UV-Licht nachgewiesen (siehe Abb. 35). Abbildung 35: Versuchsansätze der zellfreien Expression. Abgebildet sind die Reaktionsgefäße der Positivkontrolle mit GFP (rechts) und drei der Reaktion mit eigenen Plasmiden (links). Die Lösungen wurden mit UV-Licht bestrahlt und damit das GFP zur Fluoreszenz angeregt. Da die Kontrollreaktion erfolgreich abgelaufen war, wurden die Proteine der acht Ansätze mit Aceton gefällt und mit SDS-Probenpuffer zur Denaturierung versetzt. Über eine SDS-PAGE und anschließenden Western-Blot wurden die Reaktionsansätze auf erfolgreiche Expression der gesuchten Proteine getestet (siehe Abb. 36).
19 Ergebnisse 34 Abbildung 36: Expressionsversuche mit verschiedenen Konstrukten im RTS-System der Firma Roche. SDS-PAGE (oben) und Western-Blot (unten) der kompletten Versuchsansätze. Die Proteine wurden nach der Reaktion gefällt und auf das Gel aufgetragen. Die Spuren 1-7 zeigen Reaktionen mit DNA-Konstrukten für die - und die 7-Schleifen. In Spur 8 ist die Positivkontrolle aufgetragen. Deutlich ist das exprimierte GFP sowohl im Gel als auch im Western-Blot erkennbar. Das Gel wurde mit Coomassie gefärbt, vom Blot ist die ECL-Färbung mit einem anti-his 6 -Tag-Antikörper zu sehen. M: Molekulargewichts-Standard. Außer dem Kontrollprotein GFP wurde keines der gesuchten Proteine nachgewiesen. Deshalb wurde ein weiterer Versuch mit denselben Plasmiden für die -Schleife und den noch nicht getesteten Konstrukten für 7 unternommen. Auch hier wurde wieder die Positivkontrolle über GFP eingesetzt. Die Reaktion wurde erneut bei 30 C für 6 h durchgeführt, allerdings unter leichtem Schütteln im Wasserbad. Nach Überprüfung der erfolgreichen Expression der Kontrolle (s. o.), wurden die Proteine über eine SDS-PAGE und Western-Blot untersucht (siehe Abb. 37). Auch hier zeigte sich keine Expression der gesuchten Proteine.
20 Ergebnisse 35 Abbildung 37: Expressionsversuch mit den 7-Konstrukten unter veränderten Bedingungen. SDS-PAGE und ein Teil des Western-Blots der Proteine aus den Expressionsversuchen. In Spur 1-7 sind die Proteine der Ansätze mit 7-Konstrukten aufgetragen, in Spur 8 ist als Positivkontrolle GFP zu erkennen. Das Gel wurde mit Coomassie gefärbt, vom Western-Blot ist die ECL-Färbung mit einem anti-his 6 -Tag-Antikörper gezeigt. Da die bisher beschriebenen Versuche mit den nicht dafür optimierten Plasmiden unternommen wurden, sollten jetzt die entsprechenden DNA-Sequenzen in die vom Hersteller für das System mitgelieferten Vektoren eingebaut werden. Dazu wurde aus dem Plasmid mit der kompletten -Schleife mit Hilfe der Restriktionsenzyme Nde I und Xho I die betreffende Sequenz herausgeschnitten. Der ausgewählte Vektor pivex2.3 MCS der Firma Roche enthält dieselben Schnittstellen in der Multiple Cloning Site, so dass der Vektor mit denselben Enzymen aufgeschnitten werden konnte. Nach der Ligation der DNA-Stücke wurden Bakterien mit dem Plasmid transformiert und über die Selektion mit dem Antibiotikum Ampicillin einige Klone mit dem richtigen Konstrukt ausgewählt. Eine ausreichende Menge der DNA wurde präpariert und durch Kontrollverdau auf die Richtigkeit der Plasmide überprüft (siehe Abb. 38). Abbildung 38: Kontrollverdau der neu hergestellten DNA-Konstrukte zur zellfreien Expression. Gezeigt sind vier der neu hergestellten Plasmide, die mit einem Restriktionsenzym zur Kontrolle verdaut wurden. M: Molekulargewichts-Standard. Mit dem so hergestellten Plasmid wurde ein neuer Expressionsversuch unternommen. Um das gesuchte Protein besser herstellen zu können, wurden die Reaktionsbe-
21 Ergebnisse 36 dingungen etwas variiert. Zunächst wurde eine Reaktion bei 30 C über 4 h durchgeführt, anschließend wurden wie vorher die Proteine analysiert (siehe Abb. 39). Abbildung 39: Expressionsversuch mit optimierten Plasmiden für zellfreie Expression. SDS-PAGE und Western-Blot der gefällten Proteine der Reaktionen. In Spur 1 ist die Reaktion mit dem DNA-Konstrukt für die -Schleife zu sehen, in Spur 2 die Positivkontrolle mit GFP. Das Gel wurde mit Coomassie gefärbt, vom Blot ist die ECL-Färbung mit einem anti-his 6 -Tag-Antikörper zu sehen. M: Molekulargewichts-Standards. Da auch auf diesem Weg das Protein nicht erfolgreich exprimiert wurde, wurden weitere Temperaturen getestet. Es wurden Reaktionen bei 28 C und 25 C mit zwei verschiedenen DNA-Präparationen des -Konstruktes durchgeführt, die aber auch keine Expression des gewünschten Proteins zeigten Cell-Free Protein Biosynthesis (RiNA GmbH) Bei dem In vitro-system der RiNA GmbH wird dasselbe Prinzip wie bei der Firma Roche angewandt. In einem E. coli-lysat werden die gewünschte DNA und die Ausgangssubstanzen für die Reaktion gemischt, danach lässt man mehrere Stunden bei einer für jedes Protein optimierten Temperatur die Reaktion ablaufen. Anschließend werden die Proteine analysiert oder können gereinigt werden. Mit Hilfe von Herrn Thorsten Lamla (Arbeitsgruppe Prof. V. Erdmann, Institut für Chemie - Biochemie, FU Berlin), konnte das System mit dem -Schleifen-Konstrukt (im Vektor pet-15b) getestet werden. Zum Nachweis der Expression eines Proteins wurde mit C 14 radioaktiv markiertes Leucin verwendet, das in einem bestimmten Verhältnis zu den anderen Aminosäuren (inklusive Leucin) gemischt wurde. Nach der Reaktion über 90 min bei 37 C wurden die Proteine mit Trichloressigsäure (TCA) gefällt, um die nicht eingebauten Aminosäuren und alle Nukleotide zu entfernen. Die gefällten Proteine wurden auf ihre Radioaktivität untersucht, um festzustellen, wie viele markierte Aminosäuren eingebaut wurden. Auf diese Weise konnte nachgewiesen werden, ob überhaupt Expression stattgefunden hatte. Nach dieser Radioaktivitätsmessung wurden in diesem ersten Versuch etwa 13 Dg/ml des gewünschten Proteins in einem An-
22 Ergebnisse 37 satz von 50 Dl hergestellt. Anschließend wurde der Reaktionsansatz über SDS-PAGE analysiert und von diesem Gel eine Autoradiographie angefertigt (siehe Abb. 40). Abbildung 40: Expression von - und 7-Schleife im zellfreien Expressionssystem der RiNA AG. SDS-PAGE und Autoradiographie der Proteine der Reaktionsansätze von FABP (Fatty Acid Binding Protein, Positivkontrolle, Spur 1), -Schleife (Spur 2) und 7-Schleife (Spur 3). Eine geringe Expression der -Schleife ist zu erkennen, die Reaktion für die 7-Schleife war nicht erfolgreich. M: Molekulargewichts-Standard. Da in diesem kleinen Ansatz nur eine sehr kleine Menge Protein hergestellt wurde, wurde die Reaktion noch einmal mit einem Volumen von 250 Dl wiederholt. Aus dieser Reaktionslösung wurde über eine kleine Ni 2+ -Affinitätssäule eine Reinigung des exprimierten Proteins durchgeführt (vgl. Abb. 41).
23 Ergebnisse 38 Abbildung 41: Expression und Reinigung der -Schleife über Ni + -Affinitätschromatographie. SDS-PAGE (oben) und Western-Blot (unten) der gefällten Proteine aus den verschiedenen Arbeitsschritten. Spur 1: Gesamtprotein des Reaktionsansatzes, Spur 2: Durchlauf durch die Chromatographiesäule, Spuren 3 und 4: Waschfraktionen, Spuren 5 8: Elutionsfraktionen von der Säule. Das Gel wurde mit Coomassie gefärbt, vom Western-Blot ist die ECL-Färbung mit einem anti-his 6 -Tag-Antikörper gezeigt. In den Elutionsfraktionen konnte das -Schleifen-Protein nachgewiesen werden, obwohl es nicht sauber von der Säule eluiert wurde. Es ist auch zu sehen, dass das Protein nicht in dem zu erwartenden Größenbereich von 18 kda auf dem Gel erscheint, sondern bei etwa 40 kda und eine Bande sogar beim vierfachen Molekulargewicht erscheint. Das Protein wurde also in kleinerer Menge exprimiert (ungefähr 6 Dg/ml entsprechend der Radioaktivitätsbestimmung). Außerdem scheint es auch in diesem System zur Aggregation zu neigen, und diese Aggregate werden im SDS-PAGE ebenfalls nicht getrennt.
Heterologe Expression einer funktionellen Domäne des nikotinischen Acetylcholinrezeptors
 Heterologe Expression einer funktionellen Domäne des nikotinischen Acetylcholinrezeptors Inauguraldissertation zur Erlangung der Doktorwürde am Fachbereich Biologie/Chemie/Pharmazie der Freien Universität
Heterologe Expression einer funktionellen Domäne des nikotinischen Acetylcholinrezeptors Inauguraldissertation zur Erlangung der Doktorwürde am Fachbereich Biologie/Chemie/Pharmazie der Freien Universität
AUFGABENSAMMLUNG. Restriktionsenzyme. Füllen Sie den Lückentext aus. Gentechnik Schroedel, Braunschweig
 Restriktionsenzyme Füllen Sie den Lückentext aus. PCR 1a Mit dem folgenden Quiz können Sie Ihr Wissen zum Thema PCR überprüfen. Klicken Sie jeweils die richtige Antwort an. PCR 1b Mit dem folgenden Quiz
Restriktionsenzyme Füllen Sie den Lückentext aus. PCR 1a Mit dem folgenden Quiz können Sie Ihr Wissen zum Thema PCR überprüfen. Klicken Sie jeweils die richtige Antwort an. PCR 1b Mit dem folgenden Quiz
Abbildung 1: Schematische Darstellung der Domänenorganisation von Survivin
 Abbildung 1: Schematische Darstellung der Domänenorganisation von Survivin Survivin weist eine N-terminale BIR-Domäne (grün) und eine C-terminale α-helix (blau) auf. Das intrinsische nuclear export signal
Abbildung 1: Schematische Darstellung der Domänenorganisation von Survivin Survivin weist eine N-terminale BIR-Domäne (grün) und eine C-terminale α-helix (blau) auf. Das intrinsische nuclear export signal
Antibiotika sind oft Inhibitoren der Genexpression
 Antibiotika sind oft Inhibitoren der Genexpression Inhibitoren der Transkription: Rifampicin, Actinomycin α-amanitin Inhibitoren der Translation: Puromycin, Streptomycin, Tetracycline, Chloramphenicol
Antibiotika sind oft Inhibitoren der Genexpression Inhibitoren der Transkription: Rifampicin, Actinomycin α-amanitin Inhibitoren der Translation: Puromycin, Streptomycin, Tetracycline, Chloramphenicol
MODULE für den SCHULKOFFER GENTECHNIK
 MODULE für den SCHULKOFFER GENTECHNIK Modul 1 - DNA-Bastel-Set Zusammenbau eines Papiermodells in Form einer Doppelhelix sehr einfach, Unterstufe, ohne Koffer möglich Modul 2 - DNA-Isolierung aus Gemüse
MODULE für den SCHULKOFFER GENTECHNIK Modul 1 - DNA-Bastel-Set Zusammenbau eines Papiermodells in Form einer Doppelhelix sehr einfach, Unterstufe, ohne Koffer möglich Modul 2 - DNA-Isolierung aus Gemüse
3.2. Untersuchungen zu Protein-Protein-Interaktionen der GNE
 3.2. Untersuchungen zu Protein-Protein-Interaktionen der GNE 3.2.1. Valosin-Containing-Protein (VCP, p97) Das bei der erblichen Einschlußkörperchenmyositis (h-ibm) krankheitsverursachende Gen ist das der
3.2. Untersuchungen zu Protein-Protein-Interaktionen der GNE 3.2.1. Valosin-Containing-Protein (VCP, p97) Das bei der erblichen Einschlußkörperchenmyositis (h-ibm) krankheitsverursachende Gen ist das der
Rekombinante Antikorperfragmente fur die. Zoonosediagnostik
 Rekombinante Antikorperfragmente fur die Zoonosediagnostik Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des Grades eines Doktors
Rekombinante Antikorperfragmente fur die Zoonosediagnostik Von der Fakultat fur Lebenswissenschaften der Technischen Universitat Carolo-Wilhelmina zu Braunschweig zur Erlangung des Grades eines Doktors
4.1. Herstellung des CH2/CH3-trunkierten dimerisierten anti-cd30-igg1-tnf- Fusionsproteins
 ERGEBNISSE 29 4. Ergebnisse 4.1. Herstellung des CH2/CH3-trunkierten dimerisierten anti-cd3-igg1-tnf- Fusionsproteins Im vorliegenden Immunzytokin wurden die Domänen CH2/CH3 des humanen Fc-Fragmentes durch
ERGEBNISSE 29 4. Ergebnisse 4.1. Herstellung des CH2/CH3-trunkierten dimerisierten anti-cd3-igg1-tnf- Fusionsproteins Im vorliegenden Immunzytokin wurden die Domänen CH2/CH3 des humanen Fc-Fragmentes durch
3 Ergebnisse. 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren
 3 Ergebnisse 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren 76-120 Die Existenz verschiedener Isoformen von WT1 ist unter anderem auf die Verwendung einer für die Aminosäuren KTS kodierenden alternativen
3 Ergebnisse 3.1 Die Speckling-Domäne von Wt1 umfaßt die Aminosäuren 76-120 Die Existenz verschiedener Isoformen von WT1 ist unter anderem auf die Verwendung einer für die Aminosäuren KTS kodierenden alternativen
Herstellung und Charakterisierung von zellpermeablem Interferon-α des Waldmurmeltieres (Marmota monax)
 Aus der Abteilung Innere Medizin II der Medizinischen Universitätsklinik der Albert-Ludwigs-Universität Freiburg im Breisgau Herstellung und Charakterisierung von zellpermeablem Interferon-α des Waldmurmeltieres
Aus der Abteilung Innere Medizin II der Medizinischen Universitätsklinik der Albert-Ludwigs-Universität Freiburg im Breisgau Herstellung und Charakterisierung von zellpermeablem Interferon-α des Waldmurmeltieres
2. Konstruktion und Charakterisierung einer stx 2 -Mutante im E. coli-stamm O157:H7 86-24
 IV. Ergebnisse 90 2. Konstruktion und Charakterisierung einer stx 2 -Mutante im E. coli-stamm O157:H7 86-24 Die Konstruktion einer isogenen Toxinmutante des Stx2-produzierenden EHEC- Stamm O157:H7 86-24
IV. Ergebnisse 90 2. Konstruktion und Charakterisierung einer stx 2 -Mutante im E. coli-stamm O157:H7 86-24 Die Konstruktion einer isogenen Toxinmutante des Stx2-produzierenden EHEC- Stamm O157:H7 86-24
Hochdurchsatz Generierung und Analyse von Arabidopsis thaliana-proteinen
 MAX-PLANCK-INSTITUT FÜR MOLEKULARE GENETIK Hochdurchsatz Generierung und Analyse von Arabidopsis thaliana-proteinen Dissertation zur Erlangung der Doktorwürde des Fachbereichs Biologie, Chemie, Pharmazie
MAX-PLANCK-INSTITUT FÜR MOLEKULARE GENETIK Hochdurchsatz Generierung und Analyse von Arabidopsis thaliana-proteinen Dissertation zur Erlangung der Doktorwürde des Fachbereichs Biologie, Chemie, Pharmazie
Restriktion und Gentechnik
 Restriktion und Gentechnik Einteilung 1.) Restriktion - Restriktionsenzyme - Southern Blotting 2.)Gentechnik - sticky ends - blunt ends Restriktion Grundwerkzeuge der Gentechnik - Restriktionsenzymanalyse
Restriktion und Gentechnik Einteilung 1.) Restriktion - Restriktionsenzyme - Southern Blotting 2.)Gentechnik - sticky ends - blunt ends Restriktion Grundwerkzeuge der Gentechnik - Restriktionsenzymanalyse
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016
 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 7 (11.07-15.07.) Methoden und Techniken II 1. Sie bekommen
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 7 (11.07-15.07.) Methoden und Techniken II 1. Sie bekommen
Molekulare Klonierung Praktikum
 Molekulare Klonierung Praktikum 2013 Praktikumsaufgabe Ligation 1. Zusammensetzung des Ligationsreaktions-ansatzes : 1 l Vektor DNA 1 l Insert DNA 2 l 10X Ligase Puffer 15 l destillertes Wasser 1 l Ligase
Molekulare Klonierung Praktikum 2013 Praktikumsaufgabe Ligation 1. Zusammensetzung des Ligationsreaktions-ansatzes : 1 l Vektor DNA 1 l Insert DNA 2 l 10X Ligase Puffer 15 l destillertes Wasser 1 l Ligase
Aufbau eines Assays zur Optimierung einer Polymerase für die Generierung hochgradig fluoreszenz-markierter DNA
 Aufbau eines Assays zur Optimierung einer Polymerase für die Generierung hochgradig fluoreszenz-markierter DNA Von der Naturwissenschaftlichen Fakultät der Technischen Universität Carolo-Wilhelmina zu
Aufbau eines Assays zur Optimierung einer Polymerase für die Generierung hochgradig fluoreszenz-markierter DNA Von der Naturwissenschaftlichen Fakultät der Technischen Universität Carolo-Wilhelmina zu
5 Diskussion und Ausblick
 5 Diskussion und Ausblick Für biochemischen Untersuchungen wie das Testen potentieller inhibitorischer Substanzen oder Strukturuntersuchungen durch Proteinkristallisation oder NMR-Spektroskopie, aber auch
5 Diskussion und Ausblick Für biochemischen Untersuchungen wie das Testen potentieller inhibitorischer Substanzen oder Strukturuntersuchungen durch Proteinkristallisation oder NMR-Spektroskopie, aber auch
Transgene Organismen
 Transgene Organismen Themenübersicht 1) Einführung 2) Komplementäre DNA (cdna) 3) Vektoren 4) Einschleusung von Genen in Eukaryontenzellen 5) Ausmaß der Genexpression 6) Genausschaltung (Gen-Knockout)
Transgene Organismen Themenübersicht 1) Einführung 2) Komplementäre DNA (cdna) 3) Vektoren 4) Einschleusung von Genen in Eukaryontenzellen 5) Ausmaß der Genexpression 6) Genausschaltung (Gen-Knockout)
4.1. Herstellung, Aufreinigung und Nachweis eines CD33-spezifischen IgM-Antikörpers
 ERGEBNISSE 30 4. Ergebnisse 4.1. Herstellung, Aufreinigung und Nachweis eines CD33-spezifischen IgM-Antikörpers 4.1.1. Herstellung und Aufreinigung des Antikörpers CD33-spezifische IgM-Antikörper wurden
ERGEBNISSE 30 4. Ergebnisse 4.1. Herstellung, Aufreinigung und Nachweis eines CD33-spezifischen IgM-Antikörpers 4.1.1. Herstellung und Aufreinigung des Antikörpers CD33-spezifische IgM-Antikörper wurden
Grundideen der Gentechnik
 Grundideen der Gentechnik Die Gentechnik kombiniert Biotechnik und Züchtung. Wie in der Züchtung wird die Erbinformation eines Lebewesen verändert. Dabei nutzte man in den Anfängen der Gentechnik vor allem
Grundideen der Gentechnik Die Gentechnik kombiniert Biotechnik und Züchtung. Wie in der Züchtung wird die Erbinformation eines Lebewesen verändert. Dabei nutzte man in den Anfängen der Gentechnik vor allem
3 GFP green fluorescent protein
 SCHNUPPERKURS GENTECHNIK 1 ExploHeidelberg 2 Klonierung des Phagen Lambda 3 GFP green fluorescent protein 4 Gens in a bottle Vanessa Hecht 1 ExploHeidelberg Stiftung Jugend und Wissenschaft GmbH Technologiepark
SCHNUPPERKURS GENTECHNIK 1 ExploHeidelberg 2 Klonierung des Phagen Lambda 3 GFP green fluorescent protein 4 Gens in a bottle Vanessa Hecht 1 ExploHeidelberg Stiftung Jugend und Wissenschaft GmbH Technologiepark
Vorlesung LV-Nr Molekularbiologie für Agrarwissenschaften. J. Glößl, SS 2007
 Vorlesung LV-Nr. 954.104 Molekularbiologie für Agrarwissenschaften J. Glößl, SS 2007 Thematik: Molekularbiologische Methoden Teil 2 Die ppt Folien wurden freundlicherweise von Prof. Florian Rüker aus der
Vorlesung LV-Nr. 954.104 Molekularbiologie für Agrarwissenschaften J. Glößl, SS 2007 Thematik: Molekularbiologische Methoden Teil 2 Die ppt Folien wurden freundlicherweise von Prof. Florian Rüker aus der
Abkürzungsverzeichnis... 7. Inhaltsverzeichnis... 11. Abbildungsverzeichnis... 17. 1 Einleitung... 21 1.1 Proteomik... 21 1.1.1 Proteom...
 Inhaltsverzeichnis Abkürzungsverzeichnis... 7 Inhaltsverzeichnis... 11 Abbildungsverzeichnis... 17 1 Einleitung... 21 1.1 Proteomik... 21 1.1.1 Proteom... 21 1.1.2 Protein-Protein Interaktionen allgemein...
Inhaltsverzeichnis Abkürzungsverzeichnis... 7 Inhaltsverzeichnis... 11 Abbildungsverzeichnis... 17 1 Einleitung... 21 1.1 Proteomik... 21 1.1.1 Proteom... 21 1.1.2 Protein-Protein Interaktionen allgemein...
Laborkurs des Heidelberger Life-Science Lab und des igem-teams Heidelberg 2014 2. Woche/14. 16.07.2014
 Laborkurs des Heidelberger Life-Science Lab und des igem-teams Heidelberg 2014 2. Woche/14. 16.07.2014 Tag 1 PCR Die Polymerase-Kettenreaktion (engl. polymerase chain reaction) ermöglicht die selektive
Laborkurs des Heidelberger Life-Science Lab und des igem-teams Heidelberg 2014 2. Woche/14. 16.07.2014 Tag 1 PCR Die Polymerase-Kettenreaktion (engl. polymerase chain reaction) ermöglicht die selektive
Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005
 Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005 F1 Molekulare Zoologie Teil II: Expressionsanalyse Proteinexpressionsanalyse
Johannes Gutenberg-Universität Mainz Fachbereich Biologie, Institut für Zoologie Leitung: Prof. Dr. Wolfrum Datum: 15. April 2005 F1 Molekulare Zoologie Teil II: Expressionsanalyse Proteinexpressionsanalyse
Gentechnologie: Isolierung und Charakterisierung von DNA
 Genetisches Grundpraktikum 9. Kurstag 23.06.2005 Gentechnologie: Isolierung und Charakterisierung von DNA Lerninhalte: Klonierung, Plasmid, Polylinker ( multiple cloning site ), Restriktionsendonuklease,
Genetisches Grundpraktikum 9. Kurstag 23.06.2005 Gentechnologie: Isolierung und Charakterisierung von DNA Lerninhalte: Klonierung, Plasmid, Polylinker ( multiple cloning site ), Restriktionsendonuklease,
1 µl BamHI H 2 O 21 µl H 2 O 30 µl Volumen 18 µl H 2 O 30 µl Inkubation 2h @ 37 C 2h @ 37 C
 F1-Praktikum Genetik Protokoll Versuch 2: Nachweis der Funktion von Promotor- und Enhancer-Sequenzen mittels Reportergen-Assay Gruppe 8, Manfred Depner & Susanne Duncker Einführung Um die Funktion von
F1-Praktikum Genetik Protokoll Versuch 2: Nachweis der Funktion von Promotor- und Enhancer-Sequenzen mittels Reportergen-Assay Gruppe 8, Manfred Depner & Susanne Duncker Einführung Um die Funktion von
Klonierung von S2P Rolle der M19-Zellen. POL-Seminar der Biochemie II 13.02.2007 Sebastian Gabriel
 Klonierung von S2P Rolle der M19-Zellen POL-Seminar der Biochemie II 13.02.2007 Sebastian Gabriel Inhalt 1. Was ist eine humane genomische DNA-Bank? 2. Unterschied zwischen cdna-bank und genomischer DNA-Bank?
Klonierung von S2P Rolle der M19-Zellen POL-Seminar der Biochemie II 13.02.2007 Sebastian Gabriel Inhalt 1. Was ist eine humane genomische DNA-Bank? 2. Unterschied zwischen cdna-bank und genomischer DNA-Bank?
3 Generierung von Domänenkonstrukten für die NMR-Strukturbestimmung
 3 Generierung von Domänenkonstrukten für die NMR-Strukturbestimmung 3.1 Herstellung von Expressionskonstrukten am Beispiel der RUN-Domäne Aufgrund der unterschiedlichen Vorhersage der SMART- und Pfam-Datenbank
3 Generierung von Domänenkonstrukten für die NMR-Strukturbestimmung 3.1 Herstellung von Expressionskonstrukten am Beispiel der RUN-Domäne Aufgrund der unterschiedlichen Vorhersage der SMART- und Pfam-Datenbank
A. Rolfs, Zwischenbericht für die Tom-Wahlig-Stiftung 15.06.2004
 Zwischenbericht 1. Material und Methoden 1.1. Organismen und Vektoren 1.1.1. Bakterienstämme 1.1.2. Vektoren 1.2. Mikrobiologische Methoden 1.2.1. Zellkultivierung 1.2.2. Transfer von DNA in E.coli und
Zwischenbericht 1. Material und Methoden 1.1. Organismen und Vektoren 1.1.1. Bakterienstämme 1.1.2. Vektoren 1.2. Mikrobiologische Methoden 1.2.1. Zellkultivierung 1.2.2. Transfer von DNA in E.coli und
Gentechnische Methoden
 Desmond S. T. Nicholl Gentechnische Methoden 2. Auflage Aus dem Englischen übersetzt von Renate FitzRoy und Kurt Beginnen Spektrum Akademischer Verlag Heidelberg Berlin Inhalt Vorwort XI 1. 1.1 1.2 1.3
Desmond S. T. Nicholl Gentechnische Methoden 2. Auflage Aus dem Englischen übersetzt von Renate FitzRoy und Kurt Beginnen Spektrum Akademischer Verlag Heidelberg Berlin Inhalt Vorwort XI 1. 1.1 1.2 1.3
Zeitaufgelöste Fluoreszenzmessung zur Verwendung bei der Realtime-PCR
 Zeitaufgelöste Fluoreszenzmessung zur Verwendung bei der Realtime-PCR Nils Scharke, inano Abstract Die Verwendung neuartiger Seltenerd-Komplexe in Verbindung mit zeitaufgelöster Fluoreszenzmessung liefert
Zeitaufgelöste Fluoreszenzmessung zur Verwendung bei der Realtime-PCR Nils Scharke, inano Abstract Die Verwendung neuartiger Seltenerd-Komplexe in Verbindung mit zeitaufgelöster Fluoreszenzmessung liefert
Schlussbericht zur Studienwoche Biologie und Medizin vom 17. 23. März 2013
 Schlussbericht zur Studienwoche Biologie und Medizin vom 17. 23. März 2013 Projekt: Zellbiologie: Expression und Reinigung der onkogenen Kinase Abl an der Ecole Polytechnique Fédérale de Lausanne, EPFL
Schlussbericht zur Studienwoche Biologie und Medizin vom 17. 23. März 2013 Projekt: Zellbiologie: Expression und Reinigung der onkogenen Kinase Abl an der Ecole Polytechnique Fédérale de Lausanne, EPFL
Ergebnisse. I. Identifizierung intrazellulärer Interaktionspartner. Ergebnisse I. Identifizierung intrazellulärer Interaktionspartner
 Ergebnisse I. Identifizierung intrazellulärer Interaktionspartner Es sollten mithilfe des Yeast-Two-Hybrid-Systems Proteine identifiziert werden, die mit der zytoplasmatischen Domäne von CEACAM1-4L aus
Ergebnisse I. Identifizierung intrazellulärer Interaktionspartner Es sollten mithilfe des Yeast-Two-Hybrid-Systems Proteine identifiziert werden, die mit der zytoplasmatischen Domäne von CEACAM1-4L aus
Plasmidpräparation aus Bakterien Inhalt
 Inhalt Einleitung... 2 Materialien... 4 Gewinnung der Bakterien... 6 Zerstörung der Bakterien... 7 Trennung von Plasmid-DNA und genomischer DNA... 8 Reinigung der Plasmid-DNA... 10 Elution der gereinigten
Inhalt Einleitung... 2 Materialien... 4 Gewinnung der Bakterien... 6 Zerstörung der Bakterien... 7 Trennung von Plasmid-DNA und genomischer DNA... 8 Reinigung der Plasmid-DNA... 10 Elution der gereinigten
3 Ergebnisse. 3.1 Isolierung von leukozytärer Gesamt-RNA
 3 Ergebnisse 3.1 Isolierung von leukozytärer Gesamt-RNA Um Ausgangsmaterial zur Isolierung von CD44-RNA zu erhalten, wurde aus einem Buffy coat (siehe Abschnitt Materialen und Methoden ) der Leukozytenanteil
3 Ergebnisse 3.1 Isolierung von leukozytärer Gesamt-RNA Um Ausgangsmaterial zur Isolierung von CD44-RNA zu erhalten, wurde aus einem Buffy coat (siehe Abschnitt Materialen und Methoden ) der Leukozytenanteil
1. Einleitung S. 1 1.1. Zelladhäsionsmoleküle S. 1 1.2. Die Immunglobulin-Superfamilie S. 2. 1.2.1. Das neurale Zelladhäsionsmolekül NCAM S.
 Inhaltsverzeichnis 1. Einleitung S. 1 1.1. Zelladhäsionsmoleküle S. 1 1.2. Die Immunglobulin-Superfamilie S. 2 1.2.1. Das neurale Zelladhäsionsmolekül NCAM S. 4 1.2.1.1. Molekulare Struktur von NCAM S.
Inhaltsverzeichnis 1. Einleitung S. 1 1.1. Zelladhäsionsmoleküle S. 1 1.2. Die Immunglobulin-Superfamilie S. 2 1.2.1. Das neurale Zelladhäsionsmolekül NCAM S. 4 1.2.1.1. Molekulare Struktur von NCAM S.
Stand von letzter Woche
 RUB ECR1 AXR1 Stand von letzter Woche E2 U? E1-like AXR1 Repressor ARF1 Proteasom AuxRE Repressor wird sehr schnell abgebaut notwendig für Auxinantwort evtl. Substrat für SCF Identifikation des SCF-Ubiquitin
RUB ECR1 AXR1 Stand von letzter Woche E2 U? E1-like AXR1 Repressor ARF1 Proteasom AuxRE Repressor wird sehr schnell abgebaut notwendig für Auxinantwort evtl. Substrat für SCF Identifikation des SCF-Ubiquitin
Protokoll Versuch A1 Klonierung des Tyro3-D1D2-Fragments mittels PCR
 Protokoll Versuch A1 Klonierung des Tyro3-D1D2-Fragments mittels PCR Gruppe 8 Susanne Duncker und Friedrich Hahn Einleitung und Aufgabenstellung Ziel dieses Versuchs ist es, das Gen für ein bestimmtes
Protokoll Versuch A1 Klonierung des Tyro3-D1D2-Fragments mittels PCR Gruppe 8 Susanne Duncker und Friedrich Hahn Einleitung und Aufgabenstellung Ziel dieses Versuchs ist es, das Gen für ein bestimmtes
SCRIPTUM HIGH PRECISE
 Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
Nur für Forschungszwecke Datenblatt Artikel BS.50.020 = 20 Reaktionen x 50 µl Artikel BS.50.100 = 100 Reaktionen x 50 µl Artikel BS.50. 500 = 500 Reaktionen x 50 µl Haltbarkeit: 12 Monate Lagerung bei
Gentechnologie für Einsteiger
 T. A. Brown Gentechnologie für Einsteiger 3. Auflage Aus dem Englischen übersetzt von Sebastian Vogel Spektrum Akademischer Verlag Heidelberg Berlin Vorwort Vorwort zur dritten englischen Auflage Vorwort
T. A. Brown Gentechnologie für Einsteiger 3. Auflage Aus dem Englischen übersetzt von Sebastian Vogel Spektrum Akademischer Verlag Heidelberg Berlin Vorwort Vorwort zur dritten englischen Auflage Vorwort
Reagenzien Isolierung von Nukleinsäuren
 Aufbewahrung bei Raumtemperatur Anwendung Isolierung ultrareiner Plasmid-DNA aus Bakterienkulturen von 1 ml bis 800 ml. Die Plasmid-DNA eignet sich für Manuelle und automatisierte Sequenzierung mit Fluoreszenzfarbstoffen
Aufbewahrung bei Raumtemperatur Anwendung Isolierung ultrareiner Plasmid-DNA aus Bakterienkulturen von 1 ml bis 800 ml. Die Plasmid-DNA eignet sich für Manuelle und automatisierte Sequenzierung mit Fluoreszenzfarbstoffen
Drexler G.A. 1, Derer A 1, Dirks W.G. 2, Hable V. 3, Greubel C. 3, Burgdorfer C. 3, Dollinger G. 3, Du G. 4, Friedl A.A. 1
 Nutzung von bi-cistronischen Vektoren für die Beobachtung der Rekrutierung von Signal- und Reparaturproteinen an DNA-Schäden nach Ionen- Mikrobestrahlung durch Live-Cell Imaging Drexler G.A. 1, Derer A
Nutzung von bi-cistronischen Vektoren für die Beobachtung der Rekrutierung von Signal- und Reparaturproteinen an DNA-Schäden nach Ionen- Mikrobestrahlung durch Live-Cell Imaging Drexler G.A. 1, Derer A
Cornel Mülhardt. Genomics. 6. Auflaqe. Spektrum k - / l AKADEMISCHER VERLAG
 I Cornel Mülhardt Genomics 6. Auflaqe Spektrum k - / l AKADEMISCHER VERLAG Inhalt 1 Was ist denn "Molekularbiologie", bitteschön? 1 1.1 Das Substrat der Molekularbiologie, oder: Molli-World für Anfänger...
I Cornel Mülhardt Genomics 6. Auflaqe Spektrum k - / l AKADEMISCHER VERLAG Inhalt 1 Was ist denn "Molekularbiologie", bitteschön? 1 1.1 Das Substrat der Molekularbiologie, oder: Molli-World für Anfänger...
Nachweis von DNA im Wein
 Abschlussbericht über den Forschungsauftrag Nachweis von DNA im Wein Projektlaufzeit: 01.01.2001 bis 31.03.2003 Prof. Dr. Ralf Kaldenhoff Universität Würzburg Julius-von-Sachs-Institut für Biowissenschaften
Abschlussbericht über den Forschungsauftrag Nachweis von DNA im Wein Projektlaufzeit: 01.01.2001 bis 31.03.2003 Prof. Dr. Ralf Kaldenhoff Universität Würzburg Julius-von-Sachs-Institut für Biowissenschaften
Restriktion zweier Plasmide zur Erstellung einer physikalischen Karte, Grundlagen der DNA- Trennung und Analyse über Agarosegele
 Versuch 1: Restriktionsenzyme als molekulare Werkzeuge Versuchsinhalt Restriktion zweier Plasmide zur Erstellung einer physikalischen Karte, Grundlagen der DNA- Trennung und Analyse über Agarosegele Zwei
Versuch 1: Restriktionsenzyme als molekulare Werkzeuge Versuchsinhalt Restriktion zweier Plasmide zur Erstellung einer physikalischen Karte, Grundlagen der DNA- Trennung und Analyse über Agarosegele Zwei
Molekularbiologie/ Genomics
 Cornel Mülhardt Molekularbiologie/ Genomics 5. Auflage ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k-zlakademischer VERLAG Inhalt 1 Was ist denn "Molekularbiologie", bitteschön? 1 1.1 Das Substrat der
Cornel Mülhardt Molekularbiologie/ Genomics 5. Auflage ELSEVIER SPEKTRUM AKADEMISCHER VERLAG Spektrum k-zlakademischer VERLAG Inhalt 1 Was ist denn "Molekularbiologie", bitteschön? 1 1.1 Das Substrat der
Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Monokotylen
 Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Monokotylen Vorbereitung auf diesen Praktikumsteil: Organisation - Für den Bioinformatik-Teil benötigen Sie pro Gruppe einen Laptop -
Praktikumsteil: 3 - RACE-PCR und Klonierung von MADS-Box- Genen aus Monokotylen Vorbereitung auf diesen Praktikumsteil: Organisation - Für den Bioinformatik-Teil benötigen Sie pro Gruppe einen Laptop -
2) Veröffentlichungsnummer: PATENTANMELDUNG
 Europäisches Patentamt European Patent Office Dffice europeen des brevets 2) Veröffentlichungsnummer: 0 368 342 A2 EUROPAISCHE PATENTANMELDUNG 2) Anmeldenummer: 89120894.4 ) Anmeldetag: 10.11.89 it) Int.
Europäisches Patentamt European Patent Office Dffice europeen des brevets 2) Veröffentlichungsnummer: 0 368 342 A2 EUROPAISCHE PATENTANMELDUNG 2) Anmeldenummer: 89120894.4 ) Anmeldetag: 10.11.89 it) Int.
Inhalt. 3 Das Werkzeug... 47 3.1 Restriktionsenzyme... 47 3.2 Gele... 58 3.2.1 Agarosegele... 58
 Inhalt 1 Was ist denn Molekularbiologie, bitteschön?...................... 1 1.1 Das Substrat der Molekularbiologie, oder: Molli-World für Anfänger.... 2 1.2 Was brauche ich zum Arbeiten?..................................
Inhalt 1 Was ist denn Molekularbiologie, bitteschön?...................... 1 1.1 Das Substrat der Molekularbiologie, oder: Molli-World für Anfänger.... 2 1.2 Was brauche ich zum Arbeiten?..................................
Dissertation zur Erlangung des akademischen Grades des Doktors der Naturwissenschaften (Dr. rer. nat.)
 Identifizierung, funktionelle Expression und biochemische Charakterisierung von Isoformen der UDP-N-Acetylglucosamin-2-Epimerase/ N-Acetylmannosaminkinase Dissertation zur Erlangung des akademischen Grades
Identifizierung, funktionelle Expression und biochemische Charakterisierung von Isoformen der UDP-N-Acetylglucosamin-2-Epimerase/ N-Acetylmannosaminkinase Dissertation zur Erlangung des akademischen Grades
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers
 Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein (1) Plasmidpräparation
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein (1) Plasmidpräparation
Fachverlag Köhler Giessen VETERINÄRMEDIZIN
 VETERINÄRMEDIZIN Kälteanpassung \bi\ Listeria monocytogenes: Klonierung, D^Ä-Sequenzanalyse und Funktionsstudien der Gene CS/JL, CS/JLB und flar aus dem Wildtypstamm Listeria monocytogenes EGD Eva-Maria
VETERINÄRMEDIZIN Kälteanpassung \bi\ Listeria monocytogenes: Klonierung, D^Ä-Sequenzanalyse und Funktionsstudien der Gene CS/JL, CS/JLB und flar aus dem Wildtypstamm Listeria monocytogenes EGD Eva-Maria
Praktikum Biochemie Einführung in die Molekularbiologie. Bettina Siebers
 Praktikum Biochemie Einführung in die Molekularbiologie Bettina Siebers Rekombinante Expression einer Esterase aus Pseudomonas aeruginosa in E. coli Polyacrylamide Gelelektrophorese (PAGE) Denaturierende
Praktikum Biochemie Einführung in die Molekularbiologie Bettina Siebers Rekombinante Expression einer Esterase aus Pseudomonas aeruginosa in E. coli Polyacrylamide Gelelektrophorese (PAGE) Denaturierende
Inhaltsverzeichnis. 1 Einleitung... 1
 Inhaltsverzeichnis 1 Einleitung... 1 1.1 G-Protein-gekoppelte Rezeptoren... 3 1.1.1 Klassifizierung und Struktur von G-Protein-gekoppelten Rezeptoren... 6 1.1.2 Purinerge Rezeptoren... 12 1.1.3 Pharmazeutische
Inhaltsverzeichnis 1 Einleitung... 1 1.1 G-Protein-gekoppelte Rezeptoren... 3 1.1.1 Klassifizierung und Struktur von G-Protein-gekoppelten Rezeptoren... 6 1.1.2 Purinerge Rezeptoren... 12 1.1.3 Pharmazeutische
Western Blot. Zuerst wird ein Proteingemisch mit Hilfe einer Gel-Elektrophorese aufgetrennt.
 Western Blot Der Western Blot ist eine analytische Methode zum Nachweis bestimmter Proteine in einer Probe. Der Nachweis erfolgt mit spezifischen Antikörpern, die das gesuchte Protein erkennen und daran
Western Blot Der Western Blot ist eine analytische Methode zum Nachweis bestimmter Proteine in einer Probe. Der Nachweis erfolgt mit spezifischen Antikörpern, die das gesuchte Protein erkennen und daran
Mach-mit-Labor. Biochemie Prof. Rita Bernhardt
 Mach-mit-Labor Biochemie Prof. Rita Bernhardt Das Mach-mit-Labor Das Mach-mit-Labor (Betreiberin Prof. Dr. R. Bernhardt) bietet seit 2002 naturwissenschaftlich interessierten SchülerInnen die Möglichkeit,
Mach-mit-Labor Biochemie Prof. Rita Bernhardt Das Mach-mit-Labor Das Mach-mit-Labor (Betreiberin Prof. Dr. R. Bernhardt) bietet seit 2002 naturwissenschaftlich interessierten SchülerInnen die Möglichkeit,
Alternative Methoden der RNA-Analyse
 Alternative Methoden der RNA-Analyse In diesem Versuch wurde die Northern Blot Hybridisierung zur Analyse isolierter mrna eingesetzt. Mit dieser Technik können Größe und Menge einer spezifischen RNA bestimmt
Alternative Methoden der RNA-Analyse In diesem Versuch wurde die Northern Blot Hybridisierung zur Analyse isolierter mrna eingesetzt. Mit dieser Technik können Größe und Menge einer spezifischen RNA bestimmt
Überproduktion der Taq DNA Polymerase mit rekombinanten E. coli Zellen
 Überproduktion der Taq DNA Polymerase mit rekombinanten E. coli Zellen Versuchsleiter: Bernhard Eikmanns Protokollführung: Karl Varadi Gruppe: 11 Durchführung: 11.11 15.11.2002 Protokoll testiert: WS02
Überproduktion der Taq DNA Polymerase mit rekombinanten E. coli Zellen Versuchsleiter: Bernhard Eikmanns Protokollführung: Karl Varadi Gruppe: 11 Durchführung: 11.11 15.11.2002 Protokoll testiert: WS02
Phage-Display. Übersicht. Allgemeine Einführung Phage M13 Vektoren Bibliotheken Selektionsablauf Anwendungsmöglichkeiten.
 Phage-Display Thomas Haarmann AG Dietrich Methodenseminar Biochemie II 20.01. und 10.02.2009 Übersicht Allgemeine Einführung Phage M13 Vektoren Bibliotheken Selektionsablauf Anwendungsmöglichkeiten Phage-Display
Phage-Display Thomas Haarmann AG Dietrich Methodenseminar Biochemie II 20.01. und 10.02.2009 Übersicht Allgemeine Einführung Phage M13 Vektoren Bibliotheken Selektionsablauf Anwendungsmöglichkeiten Phage-Display
Modifizierte Gene Editor Mutagenese
 Modifizierte Gene Editor Mutagenese zur gleichzeitigen Einführung mehrerer Punktmutationen DNA Template Präparation: 2 µg Plasmid DNA (bei 6 kb, sonst entsprechend mehr oder weniger) + 2 µl 2M NaOH, 2
Modifizierte Gene Editor Mutagenese zur gleichzeitigen Einführung mehrerer Punktmutationen DNA Template Präparation: 2 µg Plasmid DNA (bei 6 kb, sonst entsprechend mehr oder weniger) + 2 µl 2M NaOH, 2
Molekulargenetische Experimente IV: Plasmidpräparation
 Molekulargenetische Experimente IV: Plasmidpräparation Plasmide sind kleine, ringförmige DNA-Moleküle in Bakterien, die in der Lage sind, sich selbst mit Hilfe von Enzymen zu replizieren. Gene, die auf
Molekulargenetische Experimente IV: Plasmidpräparation Plasmide sind kleine, ringförmige DNA-Moleküle in Bakterien, die in der Lage sind, sich selbst mit Hilfe von Enzymen zu replizieren. Gene, die auf
Kursinhalte der Weiterbildung Molekulare Biotechnologie (MNr.: 237 / 0411 / 2010)
 Kursinhalte der Weiterbildung Molekulare Biotechnologie (MNr.: 237 / 0411 / 2010) Schwerpunkte im Bereich BIOANALYTIK Polyacrylamidelektrophorese von Nukleinsäuren im Vertikalsystem Agarosegelelektrophorese
Kursinhalte der Weiterbildung Molekulare Biotechnologie (MNr.: 237 / 0411 / 2010) Schwerpunkte im Bereich BIOANALYTIK Polyacrylamidelektrophorese von Nukleinsäuren im Vertikalsystem Agarosegelelektrophorese
Gentechnologie: Klonierung und Transformation von DNA
 Grundpraktikum Genetik 8. Kurstag 16.06.2005 Gentechnologie: Klonierung und Transformation von DNA Lerninhalte: Transformation, natürliche Kompetenz, Transformationseffizienz, Vektor, Plasmid, Resistenzgen,
Grundpraktikum Genetik 8. Kurstag 16.06.2005 Gentechnologie: Klonierung und Transformation von DNA Lerninhalte: Transformation, natürliche Kompetenz, Transformationseffizienz, Vektor, Plasmid, Resistenzgen,
Zweigbibliothek Medizin
 Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Sächsische Landesbibliothek - Staats- und Universitätsbibliothek Dresden (SLUB) Zweigbibliothek Medizin Diese Hochschulschrift finden Sie original in Printform zur Ausleihe in der Zweigbibliothek Medizin
Probe und Probenmenge Wassermenge Auftragspuffermenge 5 µl Kaninchenmuskelextrakt 50 µl 100 µl
 Arbeitsgruppe D 6 Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Kurs 3: Proteinanalysen Im heutigen Kurs extrahierten wir zum einen Proteine aus verschiedenen Geweben eines Kaninchens und führten
Arbeitsgruppe D 6 Clara Dees Susanne Duncker Anja Hartmann Kristin Hofmann Kurs 3: Proteinanalysen Im heutigen Kurs extrahierten wir zum einen Proteine aus verschiedenen Geweben eines Kaninchens und führten
Das Prinzip der DNA-Sequenzierung Best.- Nr. 201.3055
 Das Prinzip der DNA-Sequenzierung Best.- Nr. 201.3055 Allgemeine Informationen Prinzip der DNA-Sequenzierung Ziel dieses Versuchs ist einen genauen Überblick über die Verfahrensweise der DNA- Sequenzierung
Das Prinzip der DNA-Sequenzierung Best.- Nr. 201.3055 Allgemeine Informationen Prinzip der DNA-Sequenzierung Ziel dieses Versuchs ist einen genauen Überblick über die Verfahrensweise der DNA- Sequenzierung
Ergebnisse 32. Peptid 1- Peptid 2- Peptid 1- Peptid 2- Sepharose Sepharose Sepharose Sepharose 1/I 1/II 2/I 2/II
 Ergebnisse 32 4 Ergebnisse 4.1 Nachweis des ORF1-Proteins p40 Das erste offene Leseraster (ORF1) eines L1-Retrotransposons kodiert für ein 40 kd Protein (p40-protein). Dieses Protein hat eine Chaperone-Funktion
Ergebnisse 32 4 Ergebnisse 4.1 Nachweis des ORF1-Proteins p40 Das erste offene Leseraster (ORF1) eines L1-Retrotransposons kodiert für ein 40 kd Protein (p40-protein). Dieses Protein hat eine Chaperone-Funktion
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016
 Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 2 (06.06. 10.06.) DNA-Schäden, Mutationen und Reparatur 1.
Biologie I/B: Klassische und molekulare Genetik, molekulare Grundlagen der Entwicklung Theoretische Übungen SS 2016 Fragen für die Übungsstunde 2 (06.06. 10.06.) DNA-Schäden, Mutationen und Reparatur 1.
Zusammenfassung Einleitung 3
 Inhaltsverzeichnis Zusammenfassung 1 1. Einleitung 3 1.1. Vorkommen und Bedeutung nichtsegmentierter Negativstrang Viren 3 1.2. Persistierende Infektionen 4 1.2.1. Humanmedizinische Bedeutung 4 1.2.2.
Inhaltsverzeichnis Zusammenfassung 1 1. Einleitung 3 1.1. Vorkommen und Bedeutung nichtsegmentierter Negativstrang Viren 3 1.2. Persistierende Infektionen 4 1.2.1. Humanmedizinische Bedeutung 4 1.2.2.
Zellbiologie: BSc Arbeiten 15/16
 Zellbiologie: BSc Arbeiten 15/16 Lehrstuhl Zellbiologie: Arbeitsgruppen Prof. Benedikt Kost Prof. Georg Kreimer PD Michael Lebert Slot Zeitraum Anzahl Plätze Semester 1 24.08.15 09.10.15 4 Ferien 2 09.11.15
Zellbiologie: BSc Arbeiten 15/16 Lehrstuhl Zellbiologie: Arbeitsgruppen Prof. Benedikt Kost Prof. Georg Kreimer PD Michael Lebert Slot Zeitraum Anzahl Plätze Semester 1 24.08.15 09.10.15 4 Ferien 2 09.11.15
Jens Tilsner (Autor) Aminosäuretransport in Raps unter besonderer Berücksichtigung des Entwicklungsstadiums der Pflanze und der Stickstoffdüngung
 Jens Tilsner (Autor) Aminosäuretransport in Raps unter besonderer Berücksichtigung des Entwicklungsstadiums der Pflanze und der Stickstoffdüngung https://cuvillier.de/de/shop/publications/3133 Copyright:
Jens Tilsner (Autor) Aminosäuretransport in Raps unter besonderer Berücksichtigung des Entwicklungsstadiums der Pflanze und der Stickstoffdüngung https://cuvillier.de/de/shop/publications/3133 Copyright:
APP-GFP/Fluoreszenzmikroskop. Aufnahmen neuronaler Zellen, mit freund. Genehmigung von Prof. Stefan Kins, TU Kaiserslautern
 Über die Herkunft von Aβ42 und Amyloid-Plaques Heute ist sicher belegt, dass sich die amyloiden Plaques aus einer Vielzahl an Abbaufragmenten des Amyloid-Vorläufer-Proteins (amyloid-precursor-protein,
Über die Herkunft von Aβ42 und Amyloid-Plaques Heute ist sicher belegt, dass sich die amyloiden Plaques aus einer Vielzahl an Abbaufragmenten des Amyloid-Vorläufer-Proteins (amyloid-precursor-protein,
Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS
 Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS Von: Andreas Tschammer, Fachhochschule Aalen-Hochschule f. Technik und Wirtschaft, Fachbereich Chemie, Schwerpunkt Molekulare Biotechnologie Material
Anwendungsbericht zur Herstellung des Proteins GST-GFP-NLS Von: Andreas Tschammer, Fachhochschule Aalen-Hochschule f. Technik und Wirtschaft, Fachbereich Chemie, Schwerpunkt Molekulare Biotechnologie Material
Integron und Integrase
 Integron und Integrase Ein Versuch zum Nachweis von Antibiotikaresistenzen. Ein NUGI-Projekt am Albert-Einstein-Gymnasium, Wiblingen These Der Einsatz von Antibiotika führt zu einer erhöhten Resistenzbildung
Integron und Integrase Ein Versuch zum Nachweis von Antibiotikaresistenzen. Ein NUGI-Projekt am Albert-Einstein-Gymnasium, Wiblingen These Der Einsatz von Antibiotika führt zu einer erhöhten Resistenzbildung
Genetik Praktikumsklausur SS2005
 Genetik Praktikumsklausur SS2005 1. Aufgabe: Der Genotyp AbaB wird geselbstet, dabei werden 256 Nachkommen gebildet. Davon erhalten 16 Pflanzen den Genotyp ABAB a) gekoppelt b) nicht gekoppelt c) teilweise
Genetik Praktikumsklausur SS2005 1. Aufgabe: Der Genotyp AbaB wird geselbstet, dabei werden 256 Nachkommen gebildet. Davon erhalten 16 Pflanzen den Genotyp ABAB a) gekoppelt b) nicht gekoppelt c) teilweise
Trennungsverfahren Techniken (in der Biologie)
 Trennungsverfahren Techniken (in der Biologie)? Biomoleküle können getrennt werden aufgrund ihrer - chemischen Eigenschaften: Ladung, Löslichkeit, Wechselwirkung mit spezifischen Reagenzen, Molmasse -
Trennungsverfahren Techniken (in der Biologie)? Biomoleküle können getrennt werden aufgrund ihrer - chemischen Eigenschaften: Ladung, Löslichkeit, Wechselwirkung mit spezifischen Reagenzen, Molmasse -
Sequenzierung und Charakterisierung der Triosephosphat-Isomerase aus Tenebrio molitor (Mehlwurm)
 Naturwissenschaft Daniel Knobeloch Sequenzierung und Charakterisierung der Triosephosphat-Isomerase aus Tenebrio molitor (Mehlwurm) Diplomarbeit Bibliografische Information der Deutschen Nationalbibliothek:
Naturwissenschaft Daniel Knobeloch Sequenzierung und Charakterisierung der Triosephosphat-Isomerase aus Tenebrio molitor (Mehlwurm) Diplomarbeit Bibliografische Information der Deutschen Nationalbibliothek:
Musterlösung - Übung 5 Vorlesung Bio-Engineering Sommersemester 2008
 Aufgabe 1: Prinzipieller Ablauf der Proteinbiosynthese a) Erklären Sie folgende Begriffe möglichst in Ihren eigenen Worten (1 kurzer Satz): Gen Nukleotid RNA-Polymerase Promotor Codon Anti-Codon Stop-Codon
Aufgabe 1: Prinzipieller Ablauf der Proteinbiosynthese a) Erklären Sie folgende Begriffe möglichst in Ihren eigenen Worten (1 kurzer Satz): Gen Nukleotid RNA-Polymerase Promotor Codon Anti-Codon Stop-Codon
Dr. Jens Kurreck. Otto-Hahn-Bau, Thielallee 63, Raum 029 Tel.: 83 85 69 69 Email: jkurreck@chemie.fu-berlin.de
 Dr. Jens Kurreck Otto-Hahn-Bau, Thielallee 63, Raum 029 Tel.: 83 85 69 69 Email: jkurreck@chemie.fu-berlin.de Prinzipien genetischer Informationsübertragung Berg, Tymoczko, Stryer: Biochemie 5. Auflage,
Dr. Jens Kurreck Otto-Hahn-Bau, Thielallee 63, Raum 029 Tel.: 83 85 69 69 Email: jkurreck@chemie.fu-berlin.de Prinzipien genetischer Informationsübertragung Berg, Tymoczko, Stryer: Biochemie 5. Auflage,
S-Dis Hotstart Polymerase
 Datenblatt Artikel-Nr. BS91.219.0200 Artikel-Nr. BS91.219.1000 200 Units 1000 Units (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen: Farbe: 1 Beschreibung Die
Datenblatt Artikel-Nr. BS91.219.0200 Artikel-Nr. BS91.219.1000 200 Units 1000 Units (Nur für Forschung und in vitro-anwendungen) Chargen-Nr.: Mindestens haltbar bis: Aussehen: Farbe: 1 Beschreibung Die
Molekularbiologische / gentechnische Methoden
 Molekularbiologische / gentechnische Methoden MPM 1 Wie lässt sich ein spezifisches Gen/Genprodukt molekular analysieren? Fundamentales Problem: Komplexität biologischer Systeme MPM 2 Ein Ausschnitt aus
Molekularbiologische / gentechnische Methoden MPM 1 Wie lässt sich ein spezifisches Gen/Genprodukt molekular analysieren? Fundamentales Problem: Komplexität biologischer Systeme MPM 2 Ein Ausschnitt aus
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers
 Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein (1) Kolonie-PCR Polymerase
Praktikum Biochemie Biotechnologie (Molekularbiologie & Biochemie) Bettina Siebers Protein Expression Genomische DNA PCR Vektormolekül (Plasmid) Escherichia coli Reinigung Protein (1) Kolonie-PCR Polymerase
4.1. Ergebnisse der Gesamt-RNA Isolierung aus Eimeria tenella Oozysten
 4. Ergebnisse 4.1. Ergebnisse der Gesamt-RNA Isolierung aus Eimeria tenella Oozysten Die widerstandsfähige Schale der Eimeria tenella Oozysten musste vor Beginnn des Kits zur Isolierung der Gesamt RNA
4. Ergebnisse 4.1. Ergebnisse der Gesamt-RNA Isolierung aus Eimeria tenella Oozysten Die widerstandsfähige Schale der Eimeria tenella Oozysten musste vor Beginnn des Kits zur Isolierung der Gesamt RNA
Aufgabe 1. Bakterien als Untersuchungsgegenstand!
 Genetik I Aufgabe 1. Bakterien als Untersuchungsgegenstand 1. Beschriften Sie die Abbildung zu den Bakterien. 2. Nennen Sie Vorteile, die Bakterien wie Escherichia coli so wertvoll für die genetische Forschung
Genetik I Aufgabe 1. Bakterien als Untersuchungsgegenstand 1. Beschriften Sie die Abbildung zu den Bakterien. 2. Nennen Sie Vorteile, die Bakterien wie Escherichia coli so wertvoll für die genetische Forschung
4.1 Interaktion von Envelope Proteinen mit dem spannungsabhängigen Kalium Kanal BEC-1
 4. Ergebnisse 60 4 ERGEBNISSE 4.1 Interaktion von Envelope Proteinen mit dem spannungsabhängigen Kalium Kanal BEC-1 Retrovirale Envelope Proteine spielen eine entscheidende Rolle beim Eindringen des Virus
4. Ergebnisse 60 4 ERGEBNISSE 4.1 Interaktion von Envelope Proteinen mit dem spannungsabhängigen Kalium Kanal BEC-1 Retrovirale Envelope Proteine spielen eine entscheidende Rolle beim Eindringen des Virus
Analyse des Genoms des Pseudomonas-Phagen 0CTX, insbesondere der Steuerung der späten Gene
 Analyse des Genoms des Pseudomonas-Phagen 0CTX, insbesondere der Steuerung der späten Gene Frank Wilhelm Langewische Inhaltsverzeichnis Verzeichnis der Abbildungen Verzeichnis der Tabellen Verzeichnis
Analyse des Genoms des Pseudomonas-Phagen 0CTX, insbesondere der Steuerung der späten Gene Frank Wilhelm Langewische Inhaltsverzeichnis Verzeichnis der Abbildungen Verzeichnis der Tabellen Verzeichnis
1971: Manipulation eines Viren-Genoms mit Restriktionsenzymen. 1973: Erstes gentechnisch verändertes Bakterium - Geburt der "Gentechnik"
 Geschichte der Gentechnik Ein kleiner Überblick: 1970-1983 1/28 1966: Entschlüsselung des genetischen Codes 1970: Entdeckung der Restriktionsenzyme in Bakterien. 1971: Manipulation eines Viren-Genoms mit
Geschichte der Gentechnik Ein kleiner Überblick: 1970-1983 1/28 1966: Entschlüsselung des genetischen Codes 1970: Entdeckung der Restriktionsenzyme in Bakterien. 1971: Manipulation eines Viren-Genoms mit
Rekombinante Antikörper
 Frank Breitling und Stefan Dübel 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. Rekombinante Antikörper Technische
Frank Breitling und Stefan Dübel 2008 AGI-Information Management Consultants May be used for personal purporses only or by libraries associated to dandelon.com network. Rekombinante Antikörper Technische
1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen:
 Übung 10 1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen: a. Eine Mutation, die zur Expression eines Repressors führt, der nicht mehr an den Operator binden kann.
Übung 10 1. Welche Auswirkungen auf die Expression des lac-operons haben die folgenden Mutationen: a. Eine Mutation, die zur Expression eines Repressors führt, der nicht mehr an den Operator binden kann.
Die antivirale Therapie der chronischen Hepatitis B: Identifikation neuer Resistenzmutationen und Optimierung der Verlaufskontrolle
 Angefertigt am Fachbereich 08 - Biologie und Chemie in Zusammenarbeit mit dem Institut für Medizinische Virologie am Fachbereich 11- Medizin der Justus-Liebig-Universität Gießen Die antivirale Therapie
Angefertigt am Fachbereich 08 - Biologie und Chemie in Zusammenarbeit mit dem Institut für Medizinische Virologie am Fachbereich 11- Medizin der Justus-Liebig-Universität Gießen Die antivirale Therapie
Abschlussbericht Max-Buchner-Forschungsprojekt 3357
 Dr. usanne Zehner Technische Universität Dresden Institut für Genetik Helmholtzstr. 10 01062 Dresden Abschlussbericht Max-Buchner-Forschungsprojekt 3357 Entwicklung einer Reinigungsstrategie für rekombinante
Dr. usanne Zehner Technische Universität Dresden Institut für Genetik Helmholtzstr. 10 01062 Dresden Abschlussbericht Max-Buchner-Forschungsprojekt 3357 Entwicklung einer Reinigungsstrategie für rekombinante
Inhaltsverzeichnis. 1. Einleitung... 9. 2. Material und Methoden... 32
 Inhaltsverzeichnis 1. Einleitung... 9 1.1 Posttranslationale Modifikationen... 10 1.2 N-Glykosylierung... 11 1.3 O-Glykosylierung... 12 1.4 Veränderungen der Glykosylierung bei der Tumorentstehung... 13
Inhaltsverzeichnis 1. Einleitung... 9 1.1 Posttranslationale Modifikationen... 10 1.2 N-Glykosylierung... 11 1.3 O-Glykosylierung... 12 1.4 Veränderungen der Glykosylierung bei der Tumorentstehung... 13
Inhalt. Entdeckung und allgemeine Informationen. Klassifizierung. Genom Viren untypische Gene Tyrosyl-tRNA Synthetase. Ursprung von grossen DNA Viren
 Mimivirus Inhalt Entdeckung und allgemeine Informationen Klassifizierung Genom Viren untypische Gene Tyrosyl-tRNA Synthetase Ursprung von grossen DNA Viren Entstehung von Eukaryoten Entdeckung 1992 in
Mimivirus Inhalt Entdeckung und allgemeine Informationen Klassifizierung Genom Viren untypische Gene Tyrosyl-tRNA Synthetase Ursprung von grossen DNA Viren Entstehung von Eukaryoten Entdeckung 1992 in
Warum will man Gene in Zellen einbringen? Gentransfer in eukaryotische Zellen
 Warum will man Gene in Zellen einbringen? Gentransfer in eukaryotische Zellen die Zelle soll Eigenschaften bekommen, die sie normalerweise nicht hat die Zelle soll Eigenschaften bekommen, die sie normalerweise
Warum will man Gene in Zellen einbringen? Gentransfer in eukaryotische Zellen die Zelle soll Eigenschaften bekommen, die sie normalerweise nicht hat die Zelle soll Eigenschaften bekommen, die sie normalerweise
Modul biol113 Zellbiologie - Nachweis von mitochondrialem Import
 Modul biol113 Zellbiologie - Nachweis von mitochondrialem Import Einführung Ein grundlegendes Problem der Zellbiologie ist es, die korrekte zelluläre Lokalisation eines Peptides zu bestimmen. Durch den
Modul biol113 Zellbiologie - Nachweis von mitochondrialem Import Einführung Ein grundlegendes Problem der Zellbiologie ist es, die korrekte zelluläre Lokalisation eines Peptides zu bestimmen. Durch den
Genisolierung in 2 Stunden : Die Polymerase-Ketten-Reaktion (PCR)
 PCR Genisolierung in 2 Stunden : Die Polymerase-Ketten-Reaktion (PCR) von Kary B. Mullis entwickelt (1985) eigentlich im Mai 1983 bei einer nächtlichen Autofahrt erstes erfolgreiches Experiment am 16.12.1983
PCR Genisolierung in 2 Stunden : Die Polymerase-Ketten-Reaktion (PCR) von Kary B. Mullis entwickelt (1985) eigentlich im Mai 1983 bei einer nächtlichen Autofahrt erstes erfolgreiches Experiment am 16.12.1983
Grundlagen der Klonierung. Analytische Methoden der Biologie SS09 7 Klonierung und Gentechnik. Modul
 Restriktion und Ligation: Restriktion und Ligation: Grundlagen der Klonierung Modul 2303-021 1 Restriktion und Ligation Verknüpfung von Fragmenten unterschiedlicher DNA Herkunft Restriktion und Ligation
Restriktion und Ligation: Restriktion und Ligation: Grundlagen der Klonierung Modul 2303-021 1 Restriktion und Ligation Verknüpfung von Fragmenten unterschiedlicher DNA Herkunft Restriktion und Ligation
4.1 Restriktionsenzymverdau von PCR-Produkten des β-catenin-gens
 4 Ergebnisse 4.1 Restriktionsenzymverdau von PR-Produkten des β-atenin-ens Für die Mutationsanalyse im Exon 3 des β-atenin-ens wurde in 19 Fällen die genomische DN aus umorgewebe untersucht, indem wie
4 Ergebnisse 4.1 Restriktionsenzymverdau von PR-Produkten des β-atenin-ens Für die Mutationsanalyse im Exon 3 des β-atenin-ens wurde in 19 Fällen die genomische DN aus umorgewebe untersucht, indem wie
