Know-How für Medizinprodukte
|
|
|
- Bernhard Braun
- vor 6 Jahren
- Abrufe
Transkript
1 Know-How für Medizinprodukte ISO 13485:2016: Auswirkungen & Empfehlungen für die Umstellung LISAvienna Business Treff: Die neuen Herausforderungen für Medizinprodukte & IVD am in Wien DI Martin Schmid, Geschäftsführer en.co.tec 1
2 en.co.tec Vorstellung Regulatory Compliance Solutions Medical Devices durch Beratung und Seminare Zulassung für CE, FDA & Support Technische Dokumentation Risikomanagement (ISO 14971), Software (EN 62304), Usability (EN 62366) Qualitätsmanagement (ISO 13485, cgmp) 2
3 Einführung ISO 13485:2016 Inhalt Wie kam es zur neuen ISO 13485:2016 Auswirkung der Änderungen der ISO 13485:2016 Empfehlungen zur Umstellung 3
4 Wie kam es zur ISO 13485:
5 ISO 13485:2012 Entstehungsgeschichte EN 46001/2 bis EN bis ISO 13485/8 bis EN ISO 13485/8 bis EN ISO 13485:2003 AC AC EN ISO 13485:2012 AC ISO 9001:1994 bis ISO 9001:2000 ISO 9001:2008 bis ISO 13485:2016 ISO 9001:2015 bis
6 Auslöser der Revision Die Norm war für die Revision auf der Grundlage des regulären 5 - Jahres-Zyklus (zweite Ausgabe 2003 veröffentlicht) an der Reihe. Erste Überprüfung (2008) ergab, dass keine Änderung erforderlich ist. Diese Bewertung (2012/13) ergab, dass es einige Treiber gibt. Anfragen von GHTF und AHWP Benutzer-Umfrage wies darauf hin, dass Bedarf an Klärungen (implizite Anforderungen) besteht. Europäische Union verlor das Vertrauen, dass die ISO als harmonisierte Norm taugt. 6
7 ISO Welche? ISO 13485:2016 (en) (publiziert ) EN ISO (en) (publiziert 1.Q.16) ÖNORM EN ISO 13485* (de) (publiziert 2.Q.16) * ÖNORM EN ISO Ausgabe: Konsolidierte nationale Neuausgabe der EN ISO 13485: , in die die Berichtigung EN ISO 13485:2016/AC: eingearbeitet ist. EN ISO 13485:2012 ist weiterhin in Europa harmonisiert. 7
8 Übergangsfristen ISO 13485:2012 hat eine Übergangsfrist von 3 Jahren und gilt bis keine Neuzertifizierungen ab mehr möglich! (Wichtig für jene, die aktuell gerade die ISO nach der alten Norm einführen!) ISO 13485:2016 Zertifizierung möglich, sofern die Benannte Stelle nach der neuen Ausgabe akkreditiert ist. (Alle wesentlichen Benannten Stellen sind dies seit spät ) EN ISO 13485:201x noch nicht harmonisiert. (Letztstand 13/05/ EN ISO 13485:2012) 8
9 Wie geht es weiter mit ISO ISO 9001? ab 09/2018 Beide Normen ergänzen sich nicht. Sie decken sich nicht 100%-ig ab.. Die Erfüllung von ISO 13485:2016 bedeutet keineswegs die Erfüllung von ISO 9001:2015. ISO 13485:2016 ISO 9001:2015 Mapping Kundenzufriedenheit, ständige Verbesserung Reg. Anforderung außerhalb von ISO 9001:
10 Wie geht es weiter mit ISO ISO 9001? Unterschied: Hersteller / Zulieferer von Medizinprodukten Hersteller Geben die ISO 9001 auf, da Aufwand zu hoch. Zulieferer Brauchen ISO 9001:2015, aber oft auf Kundenwunsch auch die branchenspezifischen Normen wie die ISO 13485:2016 ISO/TS 16949:2009. Daher lässt es sich vermutlich nicht vermeiden, beide Nomen parallel zu fahren. Zusatzaufwand 10
11 ÄNDERUNGEN der ISO 13485:
12 Allgemeines Scope: Expliziter Einschluss von Tätigkeiten wie Lagerung und Vertrieb Außerbetriebnahme und Entsorgung Erbringung dazugehöriger Leistungen insbesondere auch Zulieferer (freiwillig oder durch vertragliche Vereinbarungen) Viele Klarstellungen u.a. für verwendete Phrasen: Wenn zutreffend, Risiko, Produkt, dokumentiert & regulatorische Anforderung und Verben: muss, sollte, darf & kann Prozessmanagementzugang Zusammenhänge mit anderen Managementnormen ISO 9001:2008 Keine High Level Structure Klarstellung, dass keine spezifischen Anforderungen des Umwelt-, Arbeitssicherheits-, oder des Finanzmanagements abgedeckt werden. 12
13 Geltungsbereich Rolle der Organisation (im Produktlebenszyklus der Medizinprodukte) ist explizit festzulegen. Design und Entwicklung Herstellung Lagerung und Vertrieb Installation Service Dazugehörige Dienstleistungen (z.b. Technischer Support) Anmerkung: Ausgelagerte Prozesse liegen in der Verantwortung des Herstellers --> schriftliche Qualitätssicherungsvereinbarung obligatorisch bei Audits ist die ganze Lieferkette (insb. für kritische Lieferanten) ausschlaggebend. Nichtanwendungen (im Gegensatz zu Ausschlüssen --> die regeln die RL / Regulations) Erweiterung auf Kapitel 6: Ressourcen und 8 Messung, Analyse und Verbesserung Regulatorische Anforderungen Gesetze, Vorschriften, Bestimmungen, Verordnungen, beschränkt auf das Qualitätsmanagementsystem und die Sicherheit und Leistungsfähigkeit des Medizinproduktes 13
14 Begriffe Die Begriffsdefinitionen der ISO 9001:2015 gelten Deutliche Änderungen bei Begriffsdefinitionen (ggü. ISO 13485:2012) Neu Hersteller, Importeur, Vertrieb, authorized Representative (Quelle GHTF/SG1/N055:2009) Life Cycle (Quelle: ISO 14971:2007) Klinische Bewertung, Leistungsbewertung (Quelle GHTF/SG5/N4:2010) Marktbeobachtung Produkt, beschafftes Produkt, Medizinproduktefamilie Risiko, Risikomanagement Geändert: Labelling, Reklamation, Implantierbares Medizinprodukt, Medizinprodukt, steriles Medizinprodukt Gelöscht: Supply Chain, Aktives Medizinprodukt, Aktives implantierbares Medizinprodukt 14
15 Überblick Neuerungen Dokumentations- & Aufzeichnungsanforderungen Regulatorische Anforderungen Risikomanagement Neue Abschnitte Design-Transfer Design- und Entwicklungsakten Reklamationen 15
16 Dokumentierte Verfahren Dokumentierte Verfahren und Aufzeichnungen zur Validierung von QMS - Software (z.b.: Dokumentenmanagementsysteme, Ticketsysteme usw ) Dokumentiertes Verfahren für die Managementbewertung Dokumentierte Verifikations- und Validierungspläne Dokumentierte Prozeduren für Design- und Entwicklungsänderungen usw Neu: Unique Device Identifier (UDI): Wenn regulatorisch gefordert, muss ein dokumentiertes System zur Zuweisung der Unique Device Identification (UDI) etabliert werden. UDI von M/IVDR und FDA gefordert. 16
17 Regulatorische Anforderungen im Vergleich Regulatory Requirements Bsp. EUR: Meldepflichten an Behörden (schwerwiegende unerwünschte Ereignisse oder Produktmängel, Sicherheitsbericht", Trendmeldungen,... Herausgabe von Maßnahmenempfehlungen Medizinprodukteakte usw ISO 13485:2012 ISO 13485:
18 Risikomanagement im Vergleich Risiko Überwachung spezifizierter Prozesse (z.b. Lieferantenbewertung, Wareneingangsprüfungen, Prozessvalidierung, usw...) Überwachung QM - Prozesse Ausgelagerte Prozesse Validierung QM-Software 3 Methodik der Überprüfung der Effektivität von Schulungen 3 9 Geforderter Input ins Risikomanagement nach ISO ISO 13485:2012 ISO 13485:
19 Empfehlungen für die Umstellung 19
20 Umstellungsempfehlungen Es ist Halbzeit, beginnen Sie jetzt mit der Umstellung! Führen Sie eine Gap-Analyse zwischen ihrem QM-System und der ISO 13485:2016 durch: Erstellen Sie einen Projektplan für die Anpassung ihrer Prozesse & Dokumentation. Kontaktieren Sie ihre Benannte Stelle und legen Sie den Zeitplan für die Umstellung fest. Kostengünstiger ist die Umstellung im Rahmen der (alle 3 Jahre) stattfindenden Rezertifizierungsaudits. Nutzen Sie die Chance der Umstellung und machen Sie ihr QM-System effizienter und eliminieren Sie überflüssige Dokumente. Zeitgemäße Dokumentenmanagementsysteme erleichtern die Arbeit ungemein. 20
21 Danke für Ihre Aufmerksamkeit! DI Martin Schmid en.co.tec Schmid KG Breitenfurterstraße /25/R1 A 1230 Wien martin.schmid@encotec.at
Know-How für die Medizintechnik
 Know-How für die Medizintechnik ISO 13485:2016 - Neue Anforderungen Qualitätsmanagement für Medizinprodukte LISAvienna Business Treff Medizintechnik Regulatory Update 2016 am 07.06.2016 in Wien DI Martin
Know-How für die Medizintechnik ISO 13485:2016 - Neue Anforderungen Qualitätsmanagement für Medizinprodukte LISAvienna Business Treff Medizintechnik Regulatory Update 2016 am 07.06.2016 in Wien DI Martin
Know-How für die Medizintechnik
 Know-How für die Medizintechnik ISO 9001 - Qualitätsmanagement im Umbruch Neufassung mit Mut zur Veränderung ISO 9001 Neu: Welche Veränderungen haben Unternehmen zu erwarten? am 17.4.2014 in Innsbruck
Know-How für die Medizintechnik ISO 9001 - Qualitätsmanagement im Umbruch Neufassung mit Mut zur Veränderung ISO 9001 Neu: Welche Veränderungen haben Unternehmen zu erwarten? am 17.4.2014 in Innsbruck
Dokumentenübersicht Revision vom Ersteller/-in Verteiler Grund der letzten Änderung
 Handbuch Kapitel 1 und 2 Anwendungsbereich & Normative Verweise 0 BdoL BdoL Kapitel 3 Begriffe Abkürzungen 0 BdoL BdoL Kapitel 4 Qualitätsmanagementsystem 0 BdoL BdoL Kapitel 5 Verantwortung der Leitung
Handbuch Kapitel 1 und 2 Anwendungsbereich & Normative Verweise 0 BdoL BdoL Kapitel 3 Begriffe Abkürzungen 0 BdoL BdoL Kapitel 4 Qualitätsmanagementsystem 0 BdoL BdoL Kapitel 5 Verantwortung der Leitung
ISO 9001: Einleitung. 1 Anwendungsbereich. 2 Normative Verweisungen. 4 Qualitätsmanagementsystem. 4.1 Allgemeine Anforderungen
 DIN EN ISO 9001 Vergleich ISO 9001:2015 und ISO 9001:2015 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe 4 Kontext der Organisation 4.1 Verstehen der Organisation und ihres Kontextes
DIN EN ISO 9001 Vergleich ISO 9001:2015 und ISO 9001:2015 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe 4 Kontext der Organisation 4.1 Verstehen der Organisation und ihres Kontextes
Vorschau. QM-Dokumentation Verzeichnis der Aufzeichnungen
 Vorschau Bitte beachten Sie, dieses Dokument ist nur eine Vorschau. Hier werden nur Auszüge dargestellt. Nach dem Erwerb steht Ihnen selbstverständlich die vollständige Version im offenen Dateiformat zur
Vorschau Bitte beachten Sie, dieses Dokument ist nur eine Vorschau. Hier werden nur Auszüge dargestellt. Nach dem Erwerb steht Ihnen selbstverständlich die vollständige Version im offenen Dateiformat zur
Know-How für die Medizintechnik
 Know-How für die Medizintechnik 9. Linzer Forum Medizintechnik Einbindung von Medizinprodukten in IT-Netzwerke Risikomanagement konkret Erste Projekterfahrungen nach IEC 80001 1 aus dem AKh Linz Regulatory
Know-How für die Medizintechnik 9. Linzer Forum Medizintechnik Einbindung von Medizinprodukten in IT-Netzwerke Risikomanagement konkret Erste Projekterfahrungen nach IEC 80001 1 aus dem AKh Linz Regulatory
Übersicht über ISO 9001:2000
 Übersicht über die ISO 9001:2000 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe Übersicht über die ISO 9001:2000 4 Qualitätsmanagementsystem 5 Verantwortung der Leitung 6 Management
Übersicht über die ISO 9001:2000 0 Einleitung 1 Anwendungsbereich 2 Normative Verweisungen 3 Begriffe Übersicht über die ISO 9001:2000 4 Qualitätsmanagementsystem 5 Verantwortung der Leitung 6 Management
Qualitätsmanagement nach DIN EN ISO 9000ff
 Qualitätsmanagement nach DIN EN ISO 9000ff Die Qualität von Produkten und Dienstleistungen ist ein wesentlicher Wettbewerbsfaktor. Soll dauerhaft Qualität geliefert werden, ist die Organisation von Arbeitsabläufen
Qualitätsmanagement nach DIN EN ISO 9000ff Die Qualität von Produkten und Dienstleistungen ist ein wesentlicher Wettbewerbsfaktor. Soll dauerhaft Qualität geliefert werden, ist die Organisation von Arbeitsabläufen
11. Westsächsisches Umweltforum 12. November 2015, Meerane. Informationen zur Revision der DIN EN ISO 14001:2015
 11. Westsächsisches Umweltforum 12. November 2015, Meerane Informationen zur Revision der DIN EN ISO 14001:2015 Dipl. Kfm., Dipl. Ing. (FH) Jens Hengst qualinova Beratung für Integrierte Managementsysteme
11. Westsächsisches Umweltforum 12. November 2015, Meerane Informationen zur Revision der DIN EN ISO 14001:2015 Dipl. Kfm., Dipl. Ing. (FH) Jens Hengst qualinova Beratung für Integrierte Managementsysteme
Release: 001 Stand 02.Juni 2003 Stand:
 Seite: 1/10 Inhaltsverzeichnis 1 Gliederung der Projektstruktur...1 1.1 Kapitel der Norm 9001:2000 (1) Aufbau und Struktur des QMH...2 1.2 Kapitel der Norm 9001:2000 (2) Vorstellen des Unternehmens...3
Seite: 1/10 Inhaltsverzeichnis 1 Gliederung der Projektstruktur...1 1.1 Kapitel der Norm 9001:2000 (1) Aufbau und Struktur des QMH...2 1.2 Kapitel der Norm 9001:2000 (2) Vorstellen des Unternehmens...3
Erfahrungen der. DQS GmbH. bei der Zertifizierung von Medizinprodukteherstellern
 Erfahrungen der DQS GmbH bei der Zertifizierung von Medizinprodukteherstellern 2004-11-24, Seite 1 Normensituation Medizinprodukte DIN EN ISO 9001:94 DIN EN ISO 9001:2000 DIN EN 46001/2:1996 DIN EN ISO
Erfahrungen der DQS GmbH bei der Zertifizierung von Medizinprodukteherstellern 2004-11-24, Seite 1 Normensituation Medizinprodukte DIN EN ISO 9001:94 DIN EN ISO 9001:2000 DIN EN 46001/2:1996 DIN EN ISO
ÄNDERUNGEN UND SCHWERPUNKTE
 REVISION ISO 9001:2015 ÄNDERUNGEN UND SCHWERPUNKTE FRANKFURT, 25. JULI 2014 Folie Agenda 1. High Level Structure nach Annex SL 2. QMS Structure 3. Schwerpunkte der Änderungen Revision Iso 9001:2015 06/14
REVISION ISO 9001:2015 ÄNDERUNGEN UND SCHWERPUNKTE FRANKFURT, 25. JULI 2014 Folie Agenda 1. High Level Structure nach Annex SL 2. QMS Structure 3. Schwerpunkte der Änderungen Revision Iso 9001:2015 06/14
QM nach DIN EN ISO 9001:2015. copyright managementsysteme Seiler Tel:
 QM nach DIN EN ISO 9001:2015 1 copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 2 Prozessplanung copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 3 Kennzahlen im Unternehmen 48 Lieferzeit
QM nach DIN EN ISO 9001:2015 1 copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 2 Prozessplanung copyright managementsysteme Seiler www.erfolgsdorf.de Tel: 3 Kennzahlen im Unternehmen 48 Lieferzeit
Vorstellung der Norm DIN EN ISO 9001:2008
 QM nach DIN EN ISO 9001 Vorstellung der Norm DIN EN ISO 9001:2008 Referent: Klaus Seiler, MSc managementsysteme Seiler Zum Salm 27 D-88662 Überlingen / See 1 Sinn und Zweck der Norm die ständige Verbesserung
QM nach DIN EN ISO 9001 Vorstellung der Norm DIN EN ISO 9001:2008 Referent: Klaus Seiler, MSc managementsysteme Seiler Zum Salm 27 D-88662 Überlingen / See 1 Sinn und Zweck der Norm die ständige Verbesserung
Vergleich der Anforderungen der RiliBÄK K 2008 mit denen der DIN EN ISO 15189
 Vergleich der der K 2008 mit denen der Petra Möller und Gerd Hafner Zentrum für Labormedizin und Mikrobiologie, Essen 5.1 Das Labor muss unter fachlich qualifizierter Leitung stehen???????? Es besteht
Vergleich der der K 2008 mit denen der Petra Möller und Gerd Hafner Zentrum für Labormedizin und Mikrobiologie, Essen 5.1 Das Labor muss unter fachlich qualifizierter Leitung stehen???????? Es besteht
Kundencheckliste zur DIN EN ISO 9001
 Kundencheckliste zur Forderung der QM-System 4.1 Sind in Ihrem Unternehmen ausgegliederte Prozesse vorhanden, die sie für Ihr QM- System (die Produkt- /Dienstleistungsqualität benötigen? Wie stellen Sie
Kundencheckliste zur Forderung der QM-System 4.1 Sind in Ihrem Unternehmen ausgegliederte Prozesse vorhanden, die sie für Ihr QM- System (die Produkt- /Dienstleistungsqualität benötigen? Wie stellen Sie
HERZLICH WILLKOMMEN. Revision der 9001:2015
 HERZLICH WILLKOMMEN Revision der 9001:2015 Volker Landscheidt Qualitätsmanagementbeauftragter DOYMA GmbH & Co 28876 Oyten Regionalkreisleiter DQG Elbe-Weser Die Struktur der ISO 9001:2015 Einleitung Kapitel
HERZLICH WILLKOMMEN Revision der 9001:2015 Volker Landscheidt Qualitätsmanagementbeauftragter DOYMA GmbH & Co 28876 Oyten Regionalkreisleiter DQG Elbe-Weser Die Struktur der ISO 9001:2015 Einleitung Kapitel
Antrag auf Zertifizierung eines Informationssicherheitsmanagementsystems (ISMS) gem. ISO/IEC 27001:2013 und Fragebogen
 , Hofäckerstr. 32, 74374 Zaberfeld Antrag auf Zertifizierung eines Informationssicherheitsmanagementsystems (ISMS) gem. ISO/IEC 27001:2013 und Fragebogen Das nachfolgend aufgeführte Unternehmen (im Folgenden
, Hofäckerstr. 32, 74374 Zaberfeld Antrag auf Zertifizierung eines Informationssicherheitsmanagementsystems (ISMS) gem. ISO/IEC 27001:2013 und Fragebogen Das nachfolgend aufgeführte Unternehmen (im Folgenden
Experience responsibility. Dienstleistungen für die. Medizintechnik. Pharma & Biotechnologie
 Experience responsibility Dienstleistungen für die Pharma & Biotechnologie Medizintechnik QM/GMP Compliance für Ihre Medizinprodukte Für Inverkehrbringer, Hersteller und technische Aufbereiter von Medizinprodukten
Experience responsibility Dienstleistungen für die Pharma & Biotechnologie Medizintechnik QM/GMP Compliance für Ihre Medizinprodukte Für Inverkehrbringer, Hersteller und technische Aufbereiter von Medizinprodukten
Know-How für die Medizintechnik
 CMI-WORKSHOP Know-How für die Medizintechnik Medizinprodukte Klasse I Vademecum für den Marktzugang Grundlegende Anforderungen Harmonisierte Normen Technische Dokumentation Regulatory Compliance Solutions
CMI-WORKSHOP Know-How für die Medizintechnik Medizinprodukte Klasse I Vademecum für den Marktzugang Grundlegende Anforderungen Harmonisierte Normen Technische Dokumentation Regulatory Compliance Solutions
Der neue IFS Logistik, Version 2 Erfahrungen aus der Praxis
 Der neue IFS Logistik, Version 2 Erfahrungen aus der Praxis September 2011 Inhalte Grundsätzliche Veränderungen Schwerpunkte Entwicklung Der IFS-Logistik wurde 2006 entwickelt, um die Lieferkette des Handels
Der neue IFS Logistik, Version 2 Erfahrungen aus der Praxis September 2011 Inhalte Grundsätzliche Veränderungen Schwerpunkte Entwicklung Der IFS-Logistik wurde 2006 entwickelt, um die Lieferkette des Handels
Control 2010 Qualitätssicherung in der Medizintechnik
 Control 2010 Qualitätssicherung in der Geschäftsbereiche Consulting The Business Designers Investitionsunabhängige Beratung Management Consulting Compliance Consulting IS/CSV Consulting Engineering The
Control 2010 Qualitätssicherung in der Geschäftsbereiche Consulting The Business Designers Investitionsunabhängige Beratung Management Consulting Compliance Consulting IS/CSV Consulting Engineering The
Die Neue Revision der ISO 9001:2015
 Die Neue Revision der ISO 9001:2015 Qualitätsmanagementsystem - Anforderungen Akkreditiert durch Akkreditierung Austria Parkstraße 11 A-8700 Leoben Tel.: +43 (3842) 48476 Fax: DW 4 e-mail: office@systemcert.at
Die Neue Revision der ISO 9001:2015 Qualitätsmanagementsystem - Anforderungen Akkreditiert durch Akkreditierung Austria Parkstraße 11 A-8700 Leoben Tel.: +43 (3842) 48476 Fax: DW 4 e-mail: office@systemcert.at
DGQ Karlsruhe 07.März 2016
 Rechtsfragen des Qualitätsmanagementsystems DGQ Karlsruhe 07.März 2016 1 EH * Dr. Ekkehard Helmig 65189 Wiesbaden, Welfenstrasse 2 Zur Zur Person: Person: - Rechtsanwalt - Bis 2003 European Counsel von
Rechtsfragen des Qualitätsmanagementsystems DGQ Karlsruhe 07.März 2016 1 EH * Dr. Ekkehard Helmig 65189 Wiesbaden, Welfenstrasse 2 Zur Zur Person: Person: - Rechtsanwalt - Bis 2003 European Counsel von
Brancheninfotag 20.08.15 Revision der ISO 9001 Änderungen und Auswirkungen
 Brancheninfotag 20.08.15 Revision der ISO 9001 Änderungen und Auswirkungen 1 Inhalt Die neue ISO 9001:2015 Gründe der Anpassung Änderungen Die neue High Level Struktur Änderungen der Anforderungen an Managementsysteme
Brancheninfotag 20.08.15 Revision der ISO 9001 Änderungen und Auswirkungen 1 Inhalt Die neue ISO 9001:2015 Gründe der Anpassung Änderungen Die neue High Level Struktur Änderungen der Anforderungen an Managementsysteme
Zuordnung der Anforderungen der DIN EN ISO 9001:2015 im QMS-Reha
 4. Kontext der Organisation Zuordnung der Anforderungen der DIN EN ISO 9001:2015 im QMS-Reha 4.1 Verstehen der Organisation und ihres Kontextes 4.2 Verstehen der Erfordernisse und Erwartungen interessierter
4. Kontext der Organisation Zuordnung der Anforderungen der DIN EN ISO 9001:2015 im QMS-Reha 4.1 Verstehen der Organisation und ihres Kontextes 4.2 Verstehen der Erfordernisse und Erwartungen interessierter
WER ist er? Was macht er? Was will er?
 WER ist er? Was macht er? Was will er? DI Thomas A. Reautschnigg Consulting und Projektmanagement A-1180 Wien, Gentzg. 26/12-13 T: +43-650-2817233 E: thomas@reautschnigg.com Leitender Gutachter für die
WER ist er? Was macht er? Was will er? DI Thomas A. Reautschnigg Consulting und Projektmanagement A-1180 Wien, Gentzg. 26/12-13 T: +43-650-2817233 E: thomas@reautschnigg.com Leitender Gutachter für die
Die Rolle des QM-Systems - Forderung und Praxis
 Die Rolle des QM-Systems - Forderung und Praxis Inhalt Warum ist ein QM-System für Hersteller von Medizinprodukten so wichtig? Was kann die Basis eines solchen Systems sein? Zusammenfassung FAQs Inhalt
Die Rolle des QM-Systems - Forderung und Praxis Inhalt Warum ist ein QM-System für Hersteller von Medizinprodukten so wichtig? Was kann die Basis eines solchen Systems sein? Zusammenfassung FAQs Inhalt
Regionalkreise DGQ OWL & AK OWL Mitarbeiterideen
 Regionalkreise DGQ OWL & AK OWL Mitarbeiterideen Neue Releases der Qualitäts- und Umweltnormen Impulse und Handlungsfelder für das Ideenmanagement?! Thomas Bernhardt Paderborn, 23.08.2016 0 2016 FUJITSU
Regionalkreise DGQ OWL & AK OWL Mitarbeiterideen Neue Releases der Qualitäts- und Umweltnormen Impulse und Handlungsfelder für das Ideenmanagement?! Thomas Bernhardt Paderborn, 23.08.2016 0 2016 FUJITSU
Checkliste Technische Dokumentation Produktname
 Teil 1: Allgemeines Qualitätsmanagement Nr. Vorgelegte Dokumentation Anmerkung 1 Managementhandbuch 2 Spezielle Prozessanweisungen, Verfahrensanweisungen und Arbeitsanweisungen 3 Mitgeltende Formblätter
Teil 1: Allgemeines Qualitätsmanagement Nr. Vorgelegte Dokumentation Anmerkung 1 Managementhandbuch 2 Spezielle Prozessanweisungen, Verfahrensanweisungen und Arbeitsanweisungen 3 Mitgeltende Formblätter
Medizintechnologie.de. Entwicklungsplan. Entwicklungsplan. Einteilung in Entwicklungsphasen
 Medizintechnologie.de Entwicklungsplan Entwicklungsplan Medizinprodukte werden immer komplexer. Um alle gesetzlichen und normativen Vorgaben einhalten und die Entwicklung eines Medizinproduktes kontrollieren
Medizintechnologie.de Entwicklungsplan Entwicklungsplan Medizinprodukte werden immer komplexer. Um alle gesetzlichen und normativen Vorgaben einhalten und die Entwicklung eines Medizinproduktes kontrollieren
Neue Norm Was nun? 3-teilige Veranstaltungsreihe zur Revision der DIN EN ISO 9001:2015
 Informationsveranstaltung Neue Norm Was nun? 3-teilige Veranstaltungsreihe zur Revision der DIN EN ISO 9001:2015 Hans-Jürgen Wagener, 08.03.2016, InnovaKom GmbH Rückblick Erster Termin am 02.02.2016 in
Informationsveranstaltung Neue Norm Was nun? 3-teilige Veranstaltungsreihe zur Revision der DIN EN ISO 9001:2015 Hans-Jürgen Wagener, 08.03.2016, InnovaKom GmbH Rückblick Erster Termin am 02.02.2016 in
ISO 9001:2015 - Erfahrungsbericht ARBEITSKREIS QM DGQ/VDI Am TÜV 1, 66280 Sulzbach/Saar 14.06.2016 17:00
 ISO 9001:2015 - Erfahrungsbericht ARBEITSKREIS QM DGQ/VDI Am TÜV 1, 66280 Sulzbach/Saar 14.06.2016 17:00 AGENDA 2 STRUKTUR ISO 9001:2015 IM PDCA-ZYKLUS 1 3 WESENTLICHE ENTWICKLUNGEN ISO 9001:2015 1 4 ANNEX
ISO 9001:2015 - Erfahrungsbericht ARBEITSKREIS QM DGQ/VDI Am TÜV 1, 66280 Sulzbach/Saar 14.06.2016 17:00 AGENDA 2 STRUKTUR ISO 9001:2015 IM PDCA-ZYKLUS 1 3 WESENTLICHE ENTWICKLUNGEN ISO 9001:2015 1 4 ANNEX
Prozessorientierte Zertifizierung - Nachhaltigkeitsorientierte Zertifizierung Unterschied aus Sicht der Hersteller
 Prozessorientierte Zertifizierung - Nachhaltigkeitsorientierte Zertifizierung Unterschied aus Sicht der Hersteller 1 Die Normen Welche Normen und Verordnungen werden betrachtet? o DIN EN ISO 9001:2008
Prozessorientierte Zertifizierung - Nachhaltigkeitsorientierte Zertifizierung Unterschied aus Sicht der Hersteller 1 Die Normen Welche Normen und Verordnungen werden betrachtet? o DIN EN ISO 9001:2008
Was geht Qualitätsmanagement/ Qualitätsicherung die Physiotherapeutenan? Beispiel einer zertifizierten Abteilung
 Was geht Qualitätsmanagement/ Qualitätsicherung die Physiotherapeutenan? Beispiel einer zertifizierten Abteilung Angestellten Forum des ZVK Stuttgart 04.03.2016 Birgit Reinecke ZentraleEinrichtungPhysiotherapieund
Was geht Qualitätsmanagement/ Qualitätsicherung die Physiotherapeutenan? Beispiel einer zertifizierten Abteilung Angestellten Forum des ZVK Stuttgart 04.03.2016 Birgit Reinecke ZentraleEinrichtungPhysiotherapieund
ISO 9001:2015 Designen und Umsetzen
 Herzlich Willkommen zur Veranstaltung DGQ Regionalkreis Darmstadt ISO 9001:2015 Designen und Umsetzen Darmstadt, den 19.01.2016 Christian Ziebe Christian Ziebe ich freue mich auf Sie Beratung Audit & Assessment
Herzlich Willkommen zur Veranstaltung DGQ Regionalkreis Darmstadt ISO 9001:2015 Designen und Umsetzen Darmstadt, den 19.01.2016 Christian Ziebe Christian Ziebe ich freue mich auf Sie Beratung Audit & Assessment
Richtiges Brillen-Management nach dem Medizinprodukte-Gesetz. SPECTARIS-Infoveranstaltung
 Richtiges Brillen-Management nach dem Medizinprodukte-Gesetz SPECTARIS-Infoveranstaltung München, 10. Januar 2014 Was ist zu tun? - Warum ist meine Brille ein Medizinprodukt? - Welche Maßnahmen muss ich
Richtiges Brillen-Management nach dem Medizinprodukte-Gesetz SPECTARIS-Infoveranstaltung München, 10. Januar 2014 Was ist zu tun? - Warum ist meine Brille ein Medizinprodukt? - Welche Maßnahmen muss ich
Qualität auf einen Blick. Zertifi zierung nach DIN EN ISO 9001:2015. TÜV SÜD Management Service GmbH
 Qualität auf einen Blick Zertifi zierung nach DIN EN ISO 9001:2015 TÜV SÜD Management Service GmbH Einleitung Die jetzige Zeit stellt Unternehmen vor große Herausforderungen. Die Anforderungen werden zunehmend
Qualität auf einen Blick Zertifi zierung nach DIN EN ISO 9001:2015 TÜV SÜD Management Service GmbH Einleitung Die jetzige Zeit stellt Unternehmen vor große Herausforderungen. Die Anforderungen werden zunehmend
FAQ zur Normrevision ISO 9001:2015 mit Beispielen und Methodenempfehlungen
 FAQ zur Normrevision ISO 9001:2015 mit Beispielen und Methodenempfehlungen Seit September 2015 ist die ISO 9001:2015 in Kraft. Besonderer Schwerpunkt liegt u.a. auf risikobasierten Denken und der Prozess-/bzw.
FAQ zur Normrevision ISO 9001:2015 mit Beispielen und Methodenempfehlungen Seit September 2015 ist die ISO 9001:2015 in Kraft. Besonderer Schwerpunkt liegt u.a. auf risikobasierten Denken und der Prozess-/bzw.
Übungsbeispiele für die mündliche Prüfung
 Übungsbeispiele für die mündliche Prüfung Nr. Frage: 71-02m Welche Verantwortung und Befugnis hat der Beauftragte der Leitung? 5.5.2 Leitungsmitglied; sicherstellen, dass die für das Qualitätsmanagementsystem
Übungsbeispiele für die mündliche Prüfung Nr. Frage: 71-02m Welche Verantwortung und Befugnis hat der Beauftragte der Leitung? 5.5.2 Leitungsmitglied; sicherstellen, dass die für das Qualitätsmanagementsystem
Aktuelles zur Entwicklung der regulativen Anforderungen an die Medizinprodukteaufbereitung aus Sicht der Überwachung
 Aktuelles zur Entwicklung der regulativen Anforderungen an die Medizinprodukteaufbereitung aus Sicht der Überwachung Dr. Andrea Johmann Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln
Aktuelles zur Entwicklung der regulativen Anforderungen an die Medizinprodukteaufbereitung aus Sicht der Überwachung Dr. Andrea Johmann Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln
7.5.1 Dokumentierte Informationen. Dokumentenübersicht Revision vom Ersteller/ in Verteiler Grund der letzten Änderung
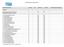 Handbuch Handbuch gesamt mit Kapitel 1 bis 10 0 QM QM Prozessbeschreibungen / Verfahren 6 1 0 Ermittlung Risiken Chancen 0 QM QM 6 2 0 Qualitätsziele 0 QM QM 6 3 0 Planung Änderungen 0 QM QM 7 1 3 Externe
Handbuch Handbuch gesamt mit Kapitel 1 bis 10 0 QM QM Prozessbeschreibungen / Verfahren 6 1 0 Ermittlung Risiken Chancen 0 QM QM 6 2 0 Qualitätsziele 0 QM QM 6 3 0 Planung Änderungen 0 QM QM 7 1 3 Externe
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE. Praxisleitfaden für Hersteller und Zulieferer. 2., überarbeitete Auflage HANSER
 Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
Johann Harer ANFORDERUNGEN AN MEDIZINPRODUKTE Praxisleitfaden für Hersteller und Zulieferer 2., überarbeitete Auflage HANSER Inhalt 1 QM-Systeme 1 1.1 Einleitung 1 1.2 Die wesentlichen Anforderungen der
AuS VErAnTworTung für SichErhEiT und QuAliTäT. www.mdc-ce.de
 Aus Verantwortung für Sicherheit und Qualität. www.mdc-ce.de Unser Unternehmen. Der Name mdc medical device certification steht für Qualität und Sicherheit im sensiblen Gebiet der Medizinprodukte und des
Aus Verantwortung für Sicherheit und Qualität. www.mdc-ce.de Unser Unternehmen. Der Name mdc medical device certification steht für Qualität und Sicherheit im sensiblen Gebiet der Medizinprodukte und des
Medizinproduktegesetz (MPG)
 Einführung ins Medizinproduktegesetz (MPG) Prof. Dr. Christian Fegeler Zielsetzung und Rechtlicher Rahmen Medical Device Direktive (MDD) Richtlinie i 93/42/EWG sowie Richtlinien 90/385/EWG aktive implantierbare
Einführung ins Medizinproduktegesetz (MPG) Prof. Dr. Christian Fegeler Zielsetzung und Rechtlicher Rahmen Medical Device Direktive (MDD) Richtlinie i 93/42/EWG sowie Richtlinien 90/385/EWG aktive implantierbare
Informationsveranstaltung von InnovaKom. Revision der ISO 9001 aus Zertifizierersicht. 27. August 2015, Paderborn
 Informationsveranstaltung von InnovaKom 27. August 2015, Paderborn Revision der ISO 9001 aus Zertifizierersicht Barbara Wicker Regionalvertrieb TÜV NORD CERT GmbH Michael Ostermeier Manager Partnernetzwerk
Informationsveranstaltung von InnovaKom 27. August 2015, Paderborn Revision der ISO 9001 aus Zertifizierersicht Barbara Wicker Regionalvertrieb TÜV NORD CERT GmbH Michael Ostermeier Manager Partnernetzwerk
2 QM-Handbuch. Zertifiziert nach DIN EN ISO 9001:2008
 Qualitätsmanagement Handbuch Handbuch nach ISO 9001:2008 Zertifiziert nach DIN EN ISO 9001:2008 Semmelroth Anlagentechnik GmbH & Co. KG Johann-Höllfritsch-Str. 19 90530 Wendelstein, Germany Fon.: +49 (0)
Qualitätsmanagement Handbuch Handbuch nach ISO 9001:2008 Zertifiziert nach DIN EN ISO 9001:2008 Semmelroth Anlagentechnik GmbH & Co. KG Johann-Höllfritsch-Str. 19 90530 Wendelstein, Germany Fon.: +49 (0)
Aktuelles zur Revision der ISO 9001:2015
 Aktuelles zur Revision der ISO 9001:2015 Frank Graichen frank.graichen@dqs-med.de Informationsstand 09-2014 1 DQS-UL Management Systems Solutions Planung: ISO 9001:2015 2013 2014 2015 Juni 2013: CD (Committee
Aktuelles zur Revision der ISO 9001:2015 Frank Graichen frank.graichen@dqs-med.de Informationsstand 09-2014 1 DQS-UL Management Systems Solutions Planung: ISO 9001:2015 2013 2014 2015 Juni 2013: CD (Committee
Leitfaden für einen erfolgreichen Übergang von ISO 9001:2008 zu ISO 9001:2015
 ISO 9001:2015 Leitfaden für den Übergang ISO Revisionen Leitfaden für einen erfolgreichen Übergang von ISO 9001:2008 zu ISO 9001:2015 Die neue internationale Norm für Qualitätsmanagementsysteme Erfolgreiche
ISO 9001:2015 Leitfaden für den Übergang ISO Revisionen Leitfaden für einen erfolgreichen Übergang von ISO 9001:2008 zu ISO 9001:2015 Die neue internationale Norm für Qualitätsmanagementsysteme Erfolgreiche
Matrixzertifizierung von Unternehmen mit mehreren Standorten/ Niederlassungen.
 Matrixzertifizierung von Unternehmen mit mehreren Standorten/ Niederlassungen Inhalt Vorgabedokumente Matrix- oder Gruppenzertifizierung Anwendungsbereich Zertifizierungsprozess Planung, Berechnung Audit
Matrixzertifizierung von Unternehmen mit mehreren Standorten/ Niederlassungen Inhalt Vorgabedokumente Matrix- oder Gruppenzertifizierung Anwendungsbereich Zertifizierungsprozess Planung, Berechnung Audit
Sicherheit Medizinischer elektrischer Geräte. Erich Forster
 (MEET THE EXPERT) 27. März 2008 Sicherheit Medizinischer elektrischer Geräte präsentiert von Erich Forster Inhalt 1. Vorstellung INTRATest GmbH 2. Konformitätsbewertungs-Verfahren 3. Anforderungen für
(MEET THE EXPERT) 27. März 2008 Sicherheit Medizinischer elektrischer Geräte präsentiert von Erich Forster Inhalt 1. Vorstellung INTRATest GmbH 2. Konformitätsbewertungs-Verfahren 3. Anforderungen für
Softwareentwicklung nach der ISO9001?
 Agenda Softwareentwicklung nach der ISO9001? von Robert Woll Motivation Einige aktuelle Herausforderungen für Unternehmen heutzutage: zunehmende Konkurrenz höhere Kundenanforderungen stärkere Integration
Agenda Softwareentwicklung nach der ISO9001? von Robert Woll Motivation Einige aktuelle Herausforderungen für Unternehmen heutzutage: zunehmende Konkurrenz höhere Kundenanforderungen stärkere Integration
Auditprogramm für die Zertifizierung. von Qualitätsmanagementsystemen. in Apotheken
 Auditprogramm für die Zertifizierung von Qualitätsmanagementsystemen in Apotheken der Apothekerkammer Berlin 1 Allgemeines 2 Ziele 3 Umfang 4 Kriterien 5 Verantwortlichkeiten 6 Ressourcen 7 Auditverfahren
Auditprogramm für die Zertifizierung von Qualitätsmanagementsystemen in Apotheken der Apothekerkammer Berlin 1 Allgemeines 2 Ziele 3 Umfang 4 Kriterien 5 Verantwortlichkeiten 6 Ressourcen 7 Auditverfahren
EN ISO Qualitätsmanagementsysteme Anforderungen. Quality management systems Requirements (ISO 9001:2008)
 ÖNORM EN ISO 9001 Ausgabe: 2008-12-01 Qualitätsmanagementsysteme Anforderungen (ISO 9001:2008) Quality management systems Requirements (ISO 9001:2008) Systèmes de management de la qualité Exigences (ISO
ÖNORM EN ISO 9001 Ausgabe: 2008-12-01 Qualitätsmanagementsysteme Anforderungen (ISO 9001:2008) Quality management systems Requirements (ISO 9001:2008) Systèmes de management de la qualité Exigences (ISO
TÜV NORD CERT GmbH DIN EN ISO 9001:2015 und Risikomanagement Anforderungen und Umsetzung
 TÜV NORD CERT GmbH Einfach ausgezeichnet. TÜV NORD CERT GmbH Einfach ausgezeichnet. Risikomanagement Aktueller Stand 2016 DIN EN ISO 9001:2015 und Risikomanagement Anforderungen und Umsetzung DIN EN ISO
TÜV NORD CERT GmbH Einfach ausgezeichnet. TÜV NORD CERT GmbH Einfach ausgezeichnet. Risikomanagement Aktueller Stand 2016 DIN EN ISO 9001:2015 und Risikomanagement Anforderungen und Umsetzung DIN EN ISO
Die neue ISO 9001:2015 Neue Struktur
 Integrierte Managementsysteme Die neue ISO 9001:2015 Neue Struktur Inhalt Neue Struktur... 1 Die neue ISO 9001:2015... 1 Aktuelle Status der ISO 9001... 3 Änderungen zu erwarten... 3 Ziele der neuen ISO
Integrierte Managementsysteme Die neue ISO 9001:2015 Neue Struktur Inhalt Neue Struktur... 1 Die neue ISO 9001:2015... 1 Aktuelle Status der ISO 9001... 3 Änderungen zu erwarten... 3 Ziele der neuen ISO
ISO Revisions. ISO Revisions. ISO 9001 Whitepaper. Die Änderungen verstehen. Annäherung an die Änderungen
 ISO 9001 Whitepaper Die Änderungen verstehen Annäherung an die Änderungen ISO 9001 Auf einen Blick Wie funktioniert ISO 9001? ISO 9001 kann auf alle Arten und Größen von Unternehmen angewendet werden.
ISO 9001 Whitepaper Die Änderungen verstehen Annäherung an die Änderungen ISO 9001 Auf einen Blick Wie funktioniert ISO 9001? ISO 9001 kann auf alle Arten und Größen von Unternehmen angewendet werden.
DGQ Regionalkreis Hannover
 Stefan Heinloth DGQ Regionalkreis Hannover Lebendiges Management mit System. Teil 1: Management mit System Top Management Themen Geld verdienen. Finanzen / Gewinn Bedürfnisse des Marktes erfüllen. Kunden
Stefan Heinloth DGQ Regionalkreis Hannover Lebendiges Management mit System. Teil 1: Management mit System Top Management Themen Geld verdienen. Finanzen / Gewinn Bedürfnisse des Marktes erfüllen. Kunden
Integrierte und digitale Managementsysteme
 MEET SWISS INFOSEC! 23. Juni 2016 Integrierte und digitale Managementsysteme Besfort Kuqi, Senior Consultant, Swiss Infosec AG Managementsysteme im Trendwechsel Integration Digitalisierung [Wieder]herstellung
MEET SWISS INFOSEC! 23. Juni 2016 Integrierte und digitale Managementsysteme Besfort Kuqi, Senior Consultant, Swiss Infosec AG Managementsysteme im Trendwechsel Integration Digitalisierung [Wieder]herstellung
ZSVA: Zertifizierung + Barcode Klinikum Heidenheim
 ZSVA: Zertifizierung + Barcode Klinikum Heidenheim Jürgen Bierlein Ltg. ZSVA Wir stellen uns Vor 11.1 VZ-Stellen auf 12 Mitarbeiter Ca. 45.000 StE im Jahr Betriebszeit von 6.00-21.00h Rufbereitschaft am
ZSVA: Zertifizierung + Barcode Klinikum Heidenheim Jürgen Bierlein Ltg. ZSVA Wir stellen uns Vor 11.1 VZ-Stellen auf 12 Mitarbeiter Ca. 45.000 StE im Jahr Betriebszeit von 6.00-21.00h Rufbereitschaft am
Zertifizierung einer Zentralen Sterilgutversorgungsabteilung (FAQ)
 Zertifizierung einer Zentralen Sterilgutversorgungsabteilung (FAQ) Marion Härtel Beraterin Zertifizierung ZSVA Expertin Medizinprodukte E-Mail: mp@herrderlage.com Tel: 030-53 000 466 Resultierend aus der
Zertifizierung einer Zentralen Sterilgutversorgungsabteilung (FAQ) Marion Härtel Beraterin Zertifizierung ZSVA Expertin Medizinprodukte E-Mail: mp@herrderlage.com Tel: 030-53 000 466 Resultierend aus der
DQS-weltweit. 61 Niederlassungen in 44 Ländern. 1.850 Auditoren und 528 Mitarbeiter. 43.000 zertifizierte Standorte in mehr als 100 Ländern
 Qualitätsmanagement und gesetzliche Anforderungen für Hersteller von Medizinprodukten und andere Organisationen die Medizinprodukte zur Verfügung stellen Themen: Wir über uns Übersicht über die Gesetze,
Qualitätsmanagement und gesetzliche Anforderungen für Hersteller von Medizinprodukten und andere Organisationen die Medizinprodukte zur Verfügung stellen Themen: Wir über uns Übersicht über die Gesetze,
Das "Competence Center Pharma" stellt sich vor
 Das "Competence Center Pharma" stellt sich vor Unsere Leistungen Computervalidierung Prozeßvalidierung Anlagenvalidierung Compliance Inspektionen Qualitätsmanagement (ISO 9000, 13485, KAIZEN) Instandhaltungsmanagement
Das "Competence Center Pharma" stellt sich vor Unsere Leistungen Computervalidierung Prozeßvalidierung Anlagenvalidierung Compliance Inspektionen Qualitätsmanagement (ISO 9000, 13485, KAIZEN) Instandhaltungsmanagement
Alle Neuerungen auf einen Blick
 News zur ISO 9001:2015 Alle Neuerungen auf einen Blick Der Weg zur Zertifizierung nach der überarbeiteten Norm ISO 9001:2015 Nach langen Diskussionen und Beratungen hat die International Organization for
News zur ISO 9001:2015 Alle Neuerungen auf einen Blick Der Weg zur Zertifizierung nach der überarbeiteten Norm ISO 9001:2015 Nach langen Diskussionen und Beratungen hat die International Organization for
Tobias Lauströer, InnovaKom GmbH Büren, 27.08.2015. Qualität Umwelt & Energie Arbeitssicherheit
 ??? Tobias Lauströer, InnovaKom GmbH Büren, 27.08.2015 High Level Structure ISO 14001:2004 1. Anwendungsbereich 2. Normative Verweise 3. Begriffe 4. Anforderungen an ein UMS 4.1 Allgemeine Anforderungen
??? Tobias Lauströer, InnovaKom GmbH Büren, 27.08.2015 High Level Structure ISO 14001:2004 1. Anwendungsbereich 2. Normative Verweise 3. Begriffe 4. Anforderungen an ein UMS 4.1 Allgemeine Anforderungen
Informationen zum QM-System
 Informationen zum QM-System EGH Hartha GmbH Leipziger Straße 10 * 04746 Hartha Tel. 034328 /734-0 Fax 034328 / 734-20 www.egh-gmbh.com info@egh-gmbh.com 1 Inhalt Präambel... 3 Unternehmensprofil... 4 Qualitätspolitik...
Informationen zum QM-System EGH Hartha GmbH Leipziger Straße 10 * 04746 Hartha Tel. 034328 /734-0 Fax 034328 / 734-20 www.egh-gmbh.com info@egh-gmbh.com 1 Inhalt Präambel... 3 Unternehmensprofil... 4 Qualitätspolitik...
How to Survive an Audit with Real-Time Traceability and Gap Analysis. Martin Kochloefl, Software Solutions Consultant Seapine Software
 How to Survive an Audit with Real-Time Traceability and Gap Analysis Martin Kochloefl, Software Solutions Consultant Seapine Software Agenda Was ist Traceability? Wo wird Traceability verwendet? Warum
How to Survive an Audit with Real-Time Traceability and Gap Analysis Martin Kochloefl, Software Solutions Consultant Seapine Software Agenda Was ist Traceability? Wo wird Traceability verwendet? Warum
Qualitätsmanagement nach DIN EN ISO 9000ff
 Qualitätsmanagement nach DIN EN ISO 9000ff Die Qualität von Produkten und Dienstleistungen ist ein wesentlicher Wettbewerbsfaktor. Soll dauerhaft Qualität geliefert werden, ist die Organisation von Arbeitsabläufen
Qualitätsmanagement nach DIN EN ISO 9000ff Die Qualität von Produkten und Dienstleistungen ist ein wesentlicher Wettbewerbsfaktor. Soll dauerhaft Qualität geliefert werden, ist die Organisation von Arbeitsabläufen
3. Kongress der Umweltbeauftragten. Umweltmanagement. Wesentliche Änderungen durch die Revision ISO
 3. Kongress der Umweltbeauftragten Umweltmanagement Wesentliche Änderungen durch die Revision ISO 14 001 Christine Jansen Erstellt durch 1 ISO 14001 DIN EN ISO 14001:2009 (ISO 14001:2004 + Cor.) Umweltmanagementsysteme
3. Kongress der Umweltbeauftragten Umweltmanagement Wesentliche Änderungen durch die Revision ISO 14 001 Christine Jansen Erstellt durch 1 ISO 14001 DIN EN ISO 14001:2009 (ISO 14001:2004 + Cor.) Umweltmanagementsysteme
Qualitätssicherung aus Sicht der Industrie
 Qualitätssicherung aus Sicht der Industrie Essen, 01. Dezember 2005 präsentiert von Jürgen Kief PPBCE / Abteilung Technik Qualität (lat.: qualitas = Beschaffenheit, Eigenschaft) Qualität Ist ein Terminus
Qualitätssicherung aus Sicht der Industrie Essen, 01. Dezember 2005 präsentiert von Jürgen Kief PPBCE / Abteilung Technik Qualität (lat.: qualitas = Beschaffenheit, Eigenschaft) Qualität Ist ein Terminus
Die vorliegende Arbeitshilfe V befasst sich mit dem Thema Risikobasiertes Denken.
 ISO 9001:2105-11 Die vorliegende Arbeitshilfe V befasst sich mit dem Thema. Die ISO 9001 wurde grundlegend überarbeitet und modernisiert. Die neue Fassung ist seit dem 23. September 2015 gültig (DIN ISO
ISO 9001:2105-11 Die vorliegende Arbeitshilfe V befasst sich mit dem Thema. Die ISO 9001 wurde grundlegend überarbeitet und modernisiert. Die neue Fassung ist seit dem 23. September 2015 gültig (DIN ISO
5 JAHRE EN ISO 13485 bereits Routine?
 5 JAHRE EN ISO 13485 bereits Routine? Erfahrungsbericht aus einer zertifizierten AEMP Brigitte Keplinger Krankenhaus Barmherzige Schwestern Linz Akutkrankenhaus mit Schwerpunkt Onkologie Kardiologie Orthopädie
5 JAHRE EN ISO 13485 bereits Routine? Erfahrungsbericht aus einer zertifizierten AEMP Brigitte Keplinger Krankenhaus Barmherzige Schwestern Linz Akutkrankenhaus mit Schwerpunkt Onkologie Kardiologie Orthopädie
6 Teilnehmerunterlage (nur auf CD-ROM)
 Modul 1: Einführung in die DIN EN ISO 9000er Reihe 1. So wenden Sie diese Praxislösung an.................... 7 1 DIN EN ISO 9000 ff. Warum? 1/01 Gründe für ein zertifiziertes Qualitätsmanagementsystem.......................
Modul 1: Einführung in die DIN EN ISO 9000er Reihe 1. So wenden Sie diese Praxislösung an.................... 7 1 DIN EN ISO 9000 ff. Warum? 1/01 Gründe für ein zertifiziertes Qualitätsmanagementsystem.......................
Die Neuerungen bei den Anforderungen nach dem DStV-Qualitätssiegel. Anforderungen nach dem DStV-Qualitätssiegel
 Die Neuerungen bei den Anforderungen nach dem DStV-Qualitätssiegel Anforderungen nach dem DStV-Qualitätssiegel Neuerungen bei den Anforderungen des DStV-Qualitätssiegels aufgrund der neuen DIN EN ISO 9001:2015
Die Neuerungen bei den Anforderungen nach dem DStV-Qualitätssiegel Anforderungen nach dem DStV-Qualitätssiegel Neuerungen bei den Anforderungen des DStV-Qualitätssiegels aufgrund der neuen DIN EN ISO 9001:2015
Regulierungsanforderungen an Medizinprodukte Apps
 Swissmedic Regulatory News aus dem Bereich Zulassung 2016 1. Dezember 2016, Stade de Suisse, Bern Regulierungsanforderungen an Medizinprodukte Apps Bernhard Bichsel, Leiter Abteilung Medizinprodukte Swissmedic
Swissmedic Regulatory News aus dem Bereich Zulassung 2016 1. Dezember 2016, Stade de Suisse, Bern Regulierungsanforderungen an Medizinprodukte Apps Bernhard Bichsel, Leiter Abteilung Medizinprodukte Swissmedic
Arbeitsschutz als ein Teil von integrierten Managementsystemen
 initiative umwelt unternehmen c/o RKW Bremen GmbH Arbeitsschutz als ein Teil von integrierten Managementsystemen Martin Schulze Sie möchten sich selbstständig machen? Wir helfen Ihnen dabei mit kompetenter
initiative umwelt unternehmen c/o RKW Bremen GmbH Arbeitsschutz als ein Teil von integrierten Managementsystemen Martin Schulze Sie möchten sich selbstständig machen? Wir helfen Ihnen dabei mit kompetenter
Revision der ISO 9001:2015 und ISO 14001:2015
 TÜV NORD CERT FAQ Revision der ISO 9001:2015 und ISO 14001:2015 TÜV NORD CERT GmbH Tel: 0800-245-7457 (kostenlose Service-Hotline) Fax: 0511-986-2899-1900 info.tncert@tuev-nord.de Das sollten Sie bei der
TÜV NORD CERT FAQ Revision der ISO 9001:2015 und ISO 14001:2015 TÜV NORD CERT GmbH Tel: 0800-245-7457 (kostenlose Service-Hotline) Fax: 0511-986-2899-1900 info.tncert@tuev-nord.de Das sollten Sie bei der
Die neue DIN EN ISO 9001:2015 - Ziele und wichtige Änderungen
 Die neue DIN EN ISO 9001:2015 - Ziele und wichtige Änderungen Im September 2015 wurde die überarbeitete ISO 9001:2015 veröffentlicht. Die wesentlichen Änderungen bzw. Neuerungen sind Themen wie Kontext/Ausrichtung
Die neue DIN EN ISO 9001:2015 - Ziele und wichtige Änderungen Im September 2015 wurde die überarbeitete ISO 9001:2015 veröffentlicht. Die wesentlichen Änderungen bzw. Neuerungen sind Themen wie Kontext/Ausrichtung
Rückverfolgbarkeit ISO 13485
 ISO 13485 Normforderung Rückverfolgbarkeit Stolpersteine aus Sicht einer Zertifizierungsstelle ISO 13485 Die Norm ISO 13485: Zweck: Zur Unterstützung der Erfüllung der grundlegenden Anforderungen der europäischen
ISO 13485 Normforderung Rückverfolgbarkeit Stolpersteine aus Sicht einer Zertifizierungsstelle ISO 13485 Die Norm ISO 13485: Zweck: Zur Unterstützung der Erfüllung der grundlegenden Anforderungen der europäischen
REACH in der Praxis UBA Fachworkshop
 1 REACH in der Praxis UBA Fachworkshop Kommunikationsformate und Anfragen-Management 26. April 2016 Eva Hink, Senior Consultant 1cc GmbH 2 März 2015 WER WIR SIND Beratungs- und Dienstleistungsunternehmen
1 REACH in der Praxis UBA Fachworkshop Kommunikationsformate und Anfragen-Management 26. April 2016 Eva Hink, Senior Consultant 1cc GmbH 2 März 2015 WER WIR SIND Beratungs- und Dienstleistungsunternehmen
I SO ISO DQS DQS
 Forderungen der ISO 14001 Gründe für die Implementierung eines Umweltmanagementsystems t t Kosteneinsparung durch systematisches und vorsorgendes Denken und Handeln 12% Mitarbeitermotivation 11% Verbesserung
Forderungen der ISO 14001 Gründe für die Implementierung eines Umweltmanagementsystems t t Kosteneinsparung durch systematisches und vorsorgendes Denken und Handeln 12% Mitarbeitermotivation 11% Verbesserung
Aktuelle Informationen zur Revision der ISO 14001:2015 Umwelt Forum Saar Franz-Josef-Röder-Straße 9, 66119 Saarbrücken 18.06.
 Aktuelle Informationen zur Revision der ISO 14001:2015 Umwelt Forum Saar Franz-Josef-Röder-Straße 9, 66119 Saarbrücken 18.06.2015 16:10 AGENDA Harald Wunsch: REVISION ISO 14001 KONTEXT ANNEX SL PROZESSMODELL
Aktuelle Informationen zur Revision der ISO 14001:2015 Umwelt Forum Saar Franz-Josef-Röder-Straße 9, 66119 Saarbrücken 18.06.2015 16:10 AGENDA Harald Wunsch: REVISION ISO 14001 KONTEXT ANNEX SL PROZESSMODELL
Revision der ISO 9001:2015 und ISO 14001:2015
 TÜV NORD CERT FAQ Revision der ISO 9001:2015 und ISO 14001:2015 TÜV NORD CERT GmbH Tel: 0800-245-7457 (kostenlose Service-Hotline) Fax: 0511-986-2899-1900 info.tncert@tuev-nord.de Das sollten Sie bei der
TÜV NORD CERT FAQ Revision der ISO 9001:2015 und ISO 14001:2015 TÜV NORD CERT GmbH Tel: 0800-245-7457 (kostenlose Service-Hotline) Fax: 0511-986-2899-1900 info.tncert@tuev-nord.de Das sollten Sie bei der
freiermuth consulting ISO 9001:2015 Leitfaden für den Übergang freiermuth consulting ist Mitglied von Region Aargau - Solothurn
 freiermuth consulting ISO 9001:2015 Leitfaden für den Übergang freiermuth consulting ist Mitglied von 09.09.2015 Region Aargau - Solothurn Inhaltsverzeichnis: 1. Warum ändert sich die ISO 9001? 3 2. Warum
freiermuth consulting ISO 9001:2015 Leitfaden für den Übergang freiermuth consulting ist Mitglied von 09.09.2015 Region Aargau - Solothurn Inhaltsverzeichnis: 1. Warum ändert sich die ISO 9001? 3 2. Warum
Managementhandbuch der Tintschl Communications AG
 Managementhandbuch der Tintschl Communications AG Version 3.1 13.02.2013 Verbindlichkeit Dieses Managementhandbuch beschreibt das Qualitätsmanagementsystem der Tintschl Communications AG. Zusammen mit
Managementhandbuch der Tintschl Communications AG Version 3.1 13.02.2013 Verbindlichkeit Dieses Managementhandbuch beschreibt das Qualitätsmanagementsystem der Tintschl Communications AG. Zusammen mit
Spezielle Regeln für die Akkreditierung im Bereich Medizinprodukte Aufbereitung von Medizinprodukten
 Spezielle Regeln für die Akkreditierung im Bereich Medizinprodukte Aufbereitung von Medizinprodukten Geltungsbereich: Die vorliegenden Speziellen Regeln legen Anforderungen fest an Zertifizierungsstellen
Spezielle Regeln für die Akkreditierung im Bereich Medizinprodukte Aufbereitung von Medizinprodukten Geltungsbereich: Die vorliegenden Speziellen Regeln legen Anforderungen fest an Zertifizierungsstellen
Qualitätsmanagement. Denny Bayer
 Qualitätsmanagement Denny Bayer 2 Inhalt Was ist QM Motivation Entstehung ISO 9000 ff. Zertifizierung Methoden des QM 3 Motivation Qualität wird vom Nutzer wahrgenommen Kundenorientierung Zuverlässige
Qualitätsmanagement Denny Bayer 2 Inhalt Was ist QM Motivation Entstehung ISO 9000 ff. Zertifizierung Methoden des QM 3 Motivation Qualität wird vom Nutzer wahrgenommen Kundenorientierung Zuverlässige
Technische Dokumentation in der Medizintechnik. Hans-Jörg Elsen Varian Medical System Particle Therapy
 Technische Dokumentation in der Medizintechnik Hans-Jörg Elsen Varian Medical System Particle Therapy Inhalte Person Varian Medical Systems Particle Therapy Technische Dokumentation bei VMS-PT Anforderungen
Technische Dokumentation in der Medizintechnik Hans-Jörg Elsen Varian Medical System Particle Therapy Inhalte Person Varian Medical Systems Particle Therapy Technische Dokumentation bei VMS-PT Anforderungen
Lieferant und Hersteller
 Lieferant und Hersteller 8.medical.device.forum device 04./05. März 2015 Dr. Volker Lücker (Rechtsanwalt / Fachanwalt für Medizinrecht) Essen Fragen zum Vortrag: Wer ist überhaupt Lieferant? Welche Rechtsvorgaben
Lieferant und Hersteller 8.medical.device.forum device 04./05. März 2015 Dr. Volker Lücker (Rechtsanwalt / Fachanwalt für Medizinrecht) Essen Fragen zum Vortrag: Wer ist überhaupt Lieferant? Welche Rechtsvorgaben
Die Bedeutung der Qualitätssicherung in der klinischen Forschung
 Die Bedeutung der Qualitätssicherung in der klinischen Forschung Am Beispiel eines externen Qualitätsaudits Nadja Schachteli 1 Qualitätskontrolle und Qualitätssicherung, GCP 5.1.1 Der Sponsor ist für die
Die Bedeutung der Qualitätssicherung in der klinischen Forschung Am Beispiel eines externen Qualitätsaudits Nadja Schachteli 1 Qualitätskontrolle und Qualitätssicherung, GCP 5.1.1 Der Sponsor ist für die
Konformitätsbewertung 3.9 A 3
 Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9 A 3 Reihenfolge bei der Durchführung von Konformitätsbewertungsverfahren Artikel 11 der Richtlinie 93/42/EWG legt fest, welche Konformitätsbewertungsverfahren
Antworten und Beschlüsse des EK-Med Konformitätsbewertung 3.9 A 3 Reihenfolge bei der Durchführung von Konformitätsbewertungsverfahren Artikel 11 der Richtlinie 93/42/EWG legt fest, welche Konformitätsbewertungsverfahren
- Leseprobe - Auditfeststellungen und deren Bewertungen. Auditfeststellungen und deren Bewertungen. von Ralph Meß
 Auditfeststellungen und deren Bewertungen von Ralph Meß Der folgende Artikel beschreibt mögliche Feststellungen und Ergebnisse, die üblicherweise bei internen oder externen Audits dokumentiert werden können.
Auditfeststellungen und deren Bewertungen von Ralph Meß Der folgende Artikel beschreibt mögliche Feststellungen und Ergebnisse, die üblicherweise bei internen oder externen Audits dokumentiert werden können.
Musterhandbuch AZAV & ISO 9001
 Musterhandbuch AZAV & ISO 9001 DIN EN ISO 9001:2008 Prozessorientiert ISBN 978-3-942882-28-6 Auflage 2 Qualitätsmanagement Verlag Seiler Dokumentationen Kapitel 4 Qualitätsmanagementsystem Inhaltsverzeichnis
Musterhandbuch AZAV & ISO 9001 DIN EN ISO 9001:2008 Prozessorientiert ISBN 978-3-942882-28-6 Auflage 2 Qualitätsmanagement Verlag Seiler Dokumentationen Kapitel 4 Qualitätsmanagementsystem Inhaltsverzeichnis
Risikomanagement bei Medizinprodukten
 Risikomanagement bei Medizinprodukten 10. Jahrestagung der AAL 24./25. September 2010 Stuttgart 2010 mdc medical device certification GmbH Risikomanagement 1 Regulatorische Grundlagen Richtlinie 93/42/EWG
Risikomanagement bei Medizinprodukten 10. Jahrestagung der AAL 24./25. September 2010 Stuttgart 2010 mdc medical device certification GmbH Risikomanagement 1 Regulatorische Grundlagen Richtlinie 93/42/EWG
Umsetzung der MAAS-BGW für IQMP-Reha als Vorbereitung für die erfolgreiche Zertifizierung
 Zentraler Dienst Qualitätsmanagement Umsetzung der MAAS-BGW für IQMP-Reha als Vorbereitung für die erfolgreiche Zertifizierung Workshop Arbeitsschutzanforderungen BGW 29. Oktober 2010 Agenda (1) Meilensteine
Zentraler Dienst Qualitätsmanagement Umsetzung der MAAS-BGW für IQMP-Reha als Vorbereitung für die erfolgreiche Zertifizierung Workshop Arbeitsschutzanforderungen BGW 29. Oktober 2010 Agenda (1) Meilensteine
Safety Integrated. Einführung und Begriffe zur funktionalen Sicherheit von Maschinen und Anlagen. Nachschlagewerk Januar Answers for industry.
 Siemens AG 2013 Einführung und Begriffe zur funktionalen Sicherheit von Maschinen und Anlagen Nachschlagewerk Januar 2013 Safety Integrated Answers for industry. Einführung und Begriffe zur funktionalen
Siemens AG 2013 Einführung und Begriffe zur funktionalen Sicherheit von Maschinen und Anlagen Nachschlagewerk Januar 2013 Safety Integrated Answers for industry. Einführung und Begriffe zur funktionalen
Neue Verpackungsstandards. IFS PACsecure und FSSC 22000 Verpackungen 30.7.2015
 Neue Verpackungsstandards IFS PACsecure und FSSC 22000 Verpackungen 30.7.2015 Hygienemanagementsysteme für Verpackungen Die wichtigsten Verpackungsstandards.. BRC Global Standard for Packaging and Packaging
Neue Verpackungsstandards IFS PACsecure und FSSC 22000 Verpackungen 30.7.2015 Hygienemanagementsysteme für Verpackungen Die wichtigsten Verpackungsstandards.. BRC Global Standard for Packaging and Packaging
Regulatorische Anforderungen an die Entwicklung von Medizinprodukten
 Regulatorische Anforderungen an die Entwicklung von Medizinprodukten Alexander Fink, Metecon GmbH Institut für Medizintechnik Reutlingen University Alteburgstraße 150 D-72762 Reutlingen Reutlingen, 04.03.2015
Regulatorische Anforderungen an die Entwicklung von Medizinprodukten Alexander Fink, Metecon GmbH Institut für Medizintechnik Reutlingen University Alteburgstraße 150 D-72762 Reutlingen Reutlingen, 04.03.2015
Korrektur- und Vorbeugungsmaßnahmen
 Dokument: 06-VA-AG-01 Datum des LAV-Beschlusses: 06.11.2006 Seite 1 von 5 Inhalt 1 Zweck, Ziel... 1 2 Geltungsbereich... 1 3 Begriffe... 2 4 Verfahren... 3 4.1 Erkennung und Bewertung von Fehlern... 4
Dokument: 06-VA-AG-01 Datum des LAV-Beschlusses: 06.11.2006 Seite 1 von 5 Inhalt 1 Zweck, Ziel... 1 2 Geltungsbereich... 1 3 Begriffe... 2 4 Verfahren... 3 4.1 Erkennung und Bewertung von Fehlern... 4
