Physikalische Chemie 92/93. c by Gerrit Jahn
|
|
|
- Katrin Schneider
- vor 8 Jahren
- Abrufe
Transkript
1 Physikalische Chemie 92/93 c by Gerrit Jahn
2 Konstanten c m sec 1 Vakuumlichtgeschwindigkeit e C Elementarladung ε C 2 J 1 m 1 Dielektrizitätskonstante F = N L e C mol 1 Faradaykonstante g m sec 1 Erdbeschleunigung h J sec Planck sche Konstante h = h J sec Drehimpulsquantum 2π k J K 1 Boltzmannkonstante m e kg Ruhemasse des Elektrons m P kg Ruhemasse des Protons µ B = e 0 h 2m e J T 1 Bohr sches Magneton N A mol 1 Avogadro-Konstante N L = N A mol 1 Loschmidtzahl R = N L k J mol 1 K 1 Gaskonstante R = m ee 4 0 8h 3 cε cm 1 Rydberg-Konstante Umrechnungen 1 atm = 760 torr = 760 mmhg = bar = Pa 1 cal = J 1 cm 1 = J 1 latm = J 1 ev = J 1 kwh = J 1Å = m Vorsätze a f p n µ m atto femto pico nano mikro milli c d k M G T centi dezi kilo Mega Giga Tera
3 INHALTSVERZEICHNIS 3 Inhaltsverzeichnis Vorwort 13 1 Wissenswertes Gleichgewichte (allgemein Physikalisches Gleichgewicht Thermisches Gleichgewicht Physikalisch Thermodynamisches Gleichgewicht Chemisches Gleichgew., Echtes Thermodyn. Gleichgew Gasgesetze Ideales Gas Partialdruck, Konzentration, Dichte Zustandsfunktion Partielle Differentialquotienten Thermischer Ausdehnungskoeffizient Kompressibilitätskoeffizient Partielle Volumenänderung Totales Differential des Volumens Reale Zustandsgleichung von Gasen Van der Waals Gleichung Virialgleichung, Abweichung vom idealen Verhalten Realfaktor Verhalten des Van-der-Waals Gases Verteilung der Moleküle auf versch. Energiezustände Barometrische Höheformel (Bsp Halbwertsdruck Zentrifuge (Bsp Boltzmann-Verteilung Bolzmann-Verteilung I Wahrscheinlichste Verteilung Stirling sche Formel (Einschub Boltzmann-Verteilung II Boltzmannsatz/Boltzmann sche e-funktion (III Kinetische Gastheorie Lennard-Jones-Potential (Einschub Druck des idealen Gases Graham sches Gesetz Urantrennung Trenndüsenverfahren Zentrifugentrennung Molare Wärmekapazität
4 4 INHALTSVERZEICHNIS Molare Wärmekapazität bei konstanten Volumen Freiheitsgrade Anwendung Freiheitsgrade Molekül-Stoßzahl eines Moleküls Freie Weglänge Gesamtzahl aller Stöße Maxwell-Boltzmann-Geschwindigk.-Verteilung Eindimensionale Verteilungsfunktion Zweidimensionale Verteilungsfunktion Dreidimensionale Verteilungsfunktion Stern-Lammert-Experiment Transportgesetze Viskosität, Impulstransport Wärmetransport Teilchentransport, Diffusion Expansion ins Vakuum, Fick sche Gesetze Wechselwirkungspotentiale Thermodynamik Erster Hauptsatz der Thermodynamik Zustandsfunktionen Enthalpie Reaktionsenthalpien bei Zimmertemperatur Reaktionsenthalpien bei beliebiger Temperatur Kirchhoff sches Gesetz Zusammenhang zw. Reaktionsenthalpie und -Energie Caloriemetr. Bestimmung der Reaktionsenthalpien und - Energien Verbrennungsenthalpie Innerer Druck, innere-, äußere Arbeit Expansion eines idealen Gases ins Vakuum Adiabatische Expansion ins Vakuum Arbeitsleistung des Idealen Gases Expansion ins Vakuum reversible, isotherme Expansion reversible, adiabatische Expansion Isenthalpe adiabatische, reversible Expansion Linde-Verflüssigung von Luft, Linde-Kälte-Maschine Umwandlung von Wärme in mechanische Energie Wärmekraftmaschine nach Carnot Thermodynamischer Wirkungsgrad Zweiter Hauptsatz der Thermodynamik Wärmepumpe Gegeneinanderschalten zweier Carnot-Maschinen
5 INHALTSVERZEICHNIS Entropie Clausius sche Ungleichung Totales Differential der Entropie Poisson sche Gleichung freie Energie freie Enthalpie chemisches Potential Aggregatzustände Phasenübergänge Phasengrenzlinie Flüssigkeit Gas (Verdampfung Phasengrenzlinie Festkörper Dampf (Sublimation Phasengrenzlinie Festkörper Flüssigkeit (Schmelzvorgang Druckabhängigkeit des chem. Potentials (id. Gas Trennfaktor der Destillation: Kolligative Eigenschaften Siedepunktserhöhung Gefrierpunktserniedrigung Osmotischer Druck Löslichkeit Löslichkeit, Temperaturabhängigkeit Löslichkeit, Druckabhängigkeit Chemische Gleichgewichte Gleichgewichtskonstante Zusammenfassung: Dampfdruck Gleichgewichtskonstante und freie Enthalpie Umrechnung der Gleichgewichtskonstante Das Prinzip des kleinsten Zwanges Dissoziationsgrad Gekoppelte Reaktion Kohlenmonoxid Konversion Eigendissoziation von Wasser Ionenprodukt des Wassers Hydrolysegleichgewicht Aktivität und Fugazitätskoeffizient Gibbs-Duhem Gleichung Formeln?! Chemische Kinetik Reaktionsgeschwindigkeit, Reaktionsordnung Partialbruchzerlegung Gleichgewichtsreaktion Parallelreaktion Folgereaktion Prinzip des Quasistatischen Zustandes
6 6 INHALTSVERZEICHNIS Folgereaktion mit vorgelagertem Gleichgewicht Kettenreaktionen Knallgasreaktion Reaktion mit Hilfe des Stoßansatzes Aktivierungsenergie Monomolekularer Zerfall, Peroxid Isomerisierung Experimentelle Methoden für schnelle Reaktionen Mischtechnik Flash-Methoden Sprung-, Relaxationsmethoden Ultraschallabsorption Katalyse Theorie des Übergangszustands Druckabhängigkeit der Reaktionsgeschwindigkeit Elektrochemie Elektrolyt-Leitfähigkeit Beweglichkeit Dissoziationsgrad Realitätseffekte Messung der Gleichgewichtskonstante unter Fremdstoffzugabe Elektrochemie Elektrochemische Zellen Daniell-Element Chlor-Wasserstoff-Zelle Knallgaszelle Gegeneinandergeschaltete Zellen Helmholtz sche Doppelkette, Konzentrationskette Standardelektrodenpotential Wertigkeitswechsel Reduktionskraft Löslichkeit, Löslichkeitsprodukt (Einschub, Nachtrag Elektroden zweiter Art Kalomel-Elektrode Weston-Standard-Zelle Glas-Elektrode Silber, Chlorid, Bromid, Iodid,...-Elektrode Statistische Thermodynamik Boltzmannverteilung Zustandssumme Einteilchenzustandssumme Systemzustandssumme
7 INHALTSVERZEICHNIS Thermodynamische Zustandsfunktionen (statistisch Innere Energie (statistisch Wärmekapazität (statistisch Entropie (statistisch Energiezustände (Translation, Rotation, Schwingung Schrödinger-Gleichung, zeitunabhängig Translationszustandssumme Thermodynamische Zustandsfunktionen (der Translation Deutung der Zustandssumme Heisenberg sche Unschärferelation Rotationszustandssumme Innere Energie der Rotation Schwingungszustandssumme Gesamtzustandssumme ZUSAMMENFASSUNG Zustandssumme, allg TD-Zustandsfunktionen Energiezustände Hochtemperaturzustandssummen Beispiel: Kohlenmonoxid Deutung der Entropie (Boltzmann Modifikationen des Wasserstoffs Drehimpuls eins linearen Moleküls Spin Zustandssumme Gleichgewichtskonstante (statistisch Wärmekapazität von Festkörpern Regel von Dulong und Petit Einstein-Formel der Wärmekapazität Debye-Formel der Wärmekapazität, T 3 -Gesetz Spektroskopie Licht- und Absorptionsspektroskopie Lambert-Beer sches Gesetz Starrer Rotator, Rotationsübergang Harmonischer Oszillator, Schwingungsübergang Morse-Potential Rotations-Schwingungsspektrum Fortrat-Diagramm Raman-Spektroskopie Lichtabsorption im VIS, Elektronenübergänge Bohr sches Atommodell Stern-Gerlach Versuch Elektronenspinresonanz-Spektroskopie, ESR
8 8 INHALTSVERZEICHNIS 8.9 makroskopische magnetische Eigenschaften Kernspinresonanzspektroskopie, NMR A Übungsaufgaben Gastheorie 182 A.1 Wechselwirkung, Gleichgewichtsabstand A.2 Anziehungskraftgesetz zwischen Ion und Dipol A.3 Thermische Ausdehnung und Kompressibilität A.4 Kompressibilität eines idealen/van-der-waals-gases A.5 Boltzmann-verteilte Rotationsenergie B Übungsaufgaben Kinetische Gastheorie 188 B.1 Trennverfahren B.2 Berechnung diverser Größen des Wasserstoffgases B.3 Geschwindigkeitsverteilung B.3.1 Die häufigste Geschwindigkeit û x bzw. û B.3.2 Die mittlere Geschwindigkeit ū x bzw. ū B.3.3 Die mittlere Geschwindigkeit u 2 x bzw. u B.4 Geschwindigkeitsverteilung im Verhältnis zu û B.5 Stoßzahlen bei H 2 und I B.5.1 H 2 und H B.5.2 I 2 und I B.5.3 H 2 und I B.6 Viskosität der Luft B.7 Wärmediffusion B.8 Diffusion eines Teilchens in eine Richtung B.9 Isotherme für ideales Gas, van-der-waals-gas B.10 Kritischer Punkt von Stickstoff B.11 Realfaktor in Abhängigkeit vom Druck B.12 (Reduzierter Kompressibilitäts-, Ausdehnungskoeffizient C Übungsaufgaben Thermodynamik 201 C.1 Diff. der molaren Wärmekapazität C P C V bei konst. Temperatur201 C.2 Standardbildungsenthalpie, H, U der Verbrennung von Glukose 201 C.3 Innerer Druck, isothermer Drosseleffekt bei van-der-waals-gasen 203 C.4 Kritische, Boyle-, Siede-, Inversionstemperatur C.5 Innerer Druck Π und Druck für reale Gase C.6 V und T bzw. p bei adiabatischer Volumenänderung C.7 Volumenabhängigkeit von C V C.8 Carnot scher Kreisprozeß mit van-der-waals-gas C.9 Molare Wärmekapazität C P eines van der Waals Gases C.10 Wärmepumpe, Carnotmaschine im Einsatz C.11 Entropieänderung bei Temperaturerhöhung C.12 Entropieänderung bei Druckerhöhung C.13 Schmelzpunkt berechnen
9 INHALTSVERZEICHNIS 9 C.14 Druck-, Volumenabhängigkeit der Entropie C.15 Entropieänderung bei Gasmischung C.16 Fraktionierte Destillation einer idealen Mischung C.17 Gefrierpunktserniedrigung C.18 Reaktionsgrößen und Gleichgewichtskonstanten C.19 Dimerisation von NO C.20 Exzeßgrößen C.21 Ideale Mischung aus idealen Gasen D Übungsaufgaben Reaktionskinetik 224 D.1 Zeitgesetz einer Reaktion A + B C 2. Ordnung D.2 Zeitgesetze integrieren, Reaktionshalbwertzeit D.3 Folgereaktion, Reaktion Pseudo-1.Ordnung D.4 Umsatzvariable D.5 Geschwindigkeitskonst. bei Gleichgewichtsreaktion 1. Ordnung. 227 D.6 Reaktionsgeschwindigkeit mal ganz einfach D.7 Bestimmung der Reaktionsordnung D.8 E a bei Reaktion mit dop. vorgelagertem Gleichgewicht D.9 Temperatursprungmethode D.10 Drucksprungversuch bei flüssiger Phase D.11 Reaktionskinetik von zwei Molekülen in Gasphase D.12 Druckabhängigkeit der Geschwindigkeitskonstante E Übungsaufgaben Elektrochemie 235 E.1 Ionenäquivalentleitfähigkeiten; Ionenbeweglichkeit E.2 Äquivalentleitfähigkeit konzentrationsabhängig E.3 Dissoziationskonstante berechnen E.4 Ionenäquivalentleitfähigkeit eines einzelnen Ions E.5 Dissoziationsgrad und Ionenprodukt berechnen E.6 EMK mit und ohne Aktivitätskoeffizienten F Übungsaufgaben Statistische Thermodynamik 240 F.1 Unschärfe der Geschwindigkeit errechnen F.2 Energie der Rotations-/Schwingungszustände F.3 Zustandssummen berechnen F.4 Entropie aus Zustandssummen F.5 Zustandssumme und Wellenlänge F.6 Heisenberg sche Unschärferelation (Umrechnung F.7 Translationsquantenzahl des Wasserstoffs F.8 Rotationsquantenzahl des Wasserstoffs F.9 Schwingungsquantenzahl des Wasserstoffs F.10 Besetzungsverhältnis der Rotation und Schwingung (H F.11 Schwingungszustandssumme aufsummieren F.12 Rotationszustandssumme aufsummieren
10 10 INHALTSVERZEICHNIS F.13 Gleichgewichtskonstante aus Symmetriezahlen F.14 Schwingungsfrequenzen berechnen F.15 Transition-State Zustand und Arrheniusfaktor F.16 Zustandssummen und sterischer Faktor F.17 Aktivierungsvolumen berechnen G Übungsaufgaben Spektroskopie 252 G.1 Rotationskonstante von HCl- Isotopen berechnen G.2 Morse-Potential H Praktikumsklausuraufgaben ( H.1 reversible adiabatische Expansion H.2 Verdampsfungsenthalpie H.3 Kühlpumpe, Wirkungsgrad H.4 EMK-Bestimmung aus Gleichgewichtskram H.5 Temperaturkoeffizient aus Verdampfungsenthalpie I Praktikumsklausuraufgaben ( I.1 Gibbs-Duhem Gleichung mit chem. Potential I.2 Aktivitätskoeffizienten der HCl-Zelle I.3 Äquivalentleitfähigkeit berechnen I.4 Aktivitätskoeffizienten mit Virialkoeffizient B I.5 Adiabatische Expansion I.6 mittlere Geschwindigkeit, - freie Weglänge, Stoßzahl I.7 Rezept der T-Abhängigkeit?! übliches I.8 Gleichgewichtskonstante aus Reaktionsenthalpie und -Entropie. 263 I.9 Geschwindigkeitsgesetz mit Umsatzvariablen I.10 Umformen von cm 3 /sec in l/(mol h J Praktikumsnachkachklausuraufgaben ( J.1 ph-wert und pk S -Wert J.2 Innere Energie, Enthalpie, Entropie, freie Energie und Enthalpie 267 J.3 Entropieänderung von Helium J.4 Volumenarbeit bei isothermer reversibler Expansion J.5 Beweglichkeit, Überführungszahlen J.6 Löslichkeit aus EMK J.7 Viskosität eines Gases J.8 MBV mit häufigster Geschwindigkeit J.9 Gleichgewichtskonstante aus Anfangsgeschwindigkeiten J.10 Arrheniusfaktor, Aktivierungsenergie
11 INHALTSVERZEICHNIS 11 K Praktikumsklausur ( K.1 Ideales Gasgesetz K.2 Eigenvolumen bei van der Waals-Gas K.3 Viskosität, freie Weglänge und Moleküldurchmesser K.4 Oberflächenspannung K.5 Ein reversibler Kreisprozeß beim idealen Gas K.6 Reaktionsenthalpie und Gleichgewichtskonstante K.7 Gleichgewichtskonstante und Dissoziationsgrad K.8 Osmotischer Druck und Gefrierpunktserniedrigung L Nachklausur Praktikum ( L.1 Stoßzahlen L.2 Maxwell-Boltzmann Geschwindigkeitsverteilung L.3 Translationsenergie L.4 Einstein-Formel der Wärmekapazität L.5 Adiabatische Volumenänderung L.6 Wirkungsgrad L.7 Bildungsenthalpie L.8 Siedepunktserhöhung L.9 Dampfdruck einer realen Mischung M Vordiplomsklausur M.1 Druck des Van der Waals Gases M.2 Druck in einer Wasserflasche M.3 Expansion und thermodynamische Größen M.4 Molenbruch und freie Enthalpie M.5 Überführungszahlen und Äquivalentleitfähigkeit M.6 Zinn-Kupfer-Zelle mit HCl-Brücke M.7 Wärmediffusion, Isolierfenster M.8 Reaktionsgeschwindigkeiten N Vordiplomsklausur N.1 Kompressibilität eines Van-der Waals Gases N.2 allgemeine Geschwindigkeitsverteilung N.3 Molmassenbestimmung N.4 EMK und freie Enthalpie N.5 freie Entahlpie und Gleichgewicht N.6 Entropie der Translation, Sackur und Tetrode N.7 Stromfluß in einer Zelle N.8 Wellenzahlen und Intensitäten N.9 Reaktionsgeschwindigkeit, Arrhenius und Stoßtheorie N.10 Geschwindigkeitsgesetz herleiten
12 12 INHALTSVERZEICHNIS O Sommersemesterklausur 91 (f. Chemiker 303 O.1 Bergsteiger O.2 Barometrische Höhenformel O.3 Zerfall von Radium O.4 Wärmepumpe O.5 adiabatische Expansion O.6 ph-bestimmung O.7 Aktivierungsenergie und Arrheniusfaktor O.8 Stoßzahl und freie Weglänge O.9 Bildungsenthalpie von Ethanol O.10 Kompressibilität am kritischen Punkt P Mathematischer Anhang 308 P.1 Euler sche Beziehungen P.2 Integrale P.3 Partialbruchzerlegung Schlußwort 310 Index 311
13 Vorwort Sehr geehrte Leserin, sehr geehrter Leser, Sie haben die neueste Auflage (236. der erweiterten Vorlesungsmitschrift der Vorlesung Physikalische Chemie I/II geschenkt bekommen, kopiert, ausgedruckt, geklaut,...und halten sie nun sicherlich in den Händen und wollen mehr wissen. Die Vorlesung wurde von Herrn Prof. Dr. Ulrich Schindewolf im Wintersemester 92/93 und der Hälfte des Sommersemesters 93 an der Uni Karlsruhe gehalten. Teils schlecht gelaunt ( Ruhe jetzt!, verdammt noch mal, ich kann mich nicht konzentrieren bei Ihrem Gemurmel, oder Sch...tafel, meist jedoch sogar in den Übungen gut gelaunt ( so, jetzt rechnen Sie mal vor, ich möchte auch mal la- chen zog dieser stets korrekt gekleidete wort- und stimmgewaltige fahrradfahrende Mann vor unseren Köpfen seine Runden und versuchte uns unten Beschriebenes mit Händen Ulrich Schindewolf und Füßen zu vermitteln,... Diese Mitschrift war eigentlich eher als Formelsammlung geplant, so daß man sich an einigen Stellen nicht wundern darf, wenn der zu vermittelnde Lehrinhalt aus lieblos aneinandergereihten Formeln besteht. An dieser Stelle will ich ein paar Worte über evtl. Fehler in der Mitschrift, bzw. in den Aufgaben am Ende dieses Werkes verlieren. Eigentlich mache ich zwar nie Fehler, sollte dies jedoch wider erwarten geschehen sein, so war selbstverständlich nicht ich daran schuld (sondern der Professor, der Computer,... und demnach ist wohl verständlich, daß niemand für evtl. auftretende negative Folgen der auftretenden Fehler zur Rechenschaft gezogen werden kann. Es wird keine Verantwortung für die Folgen evtl. vorhandener Fehler übernommen! Ich wäre aber sehr erfreut, z.b. via über evtl. doch vorhandene richtige Fehler aufheklärt zu werden... Nun zu den behandelten Themengebieten. Anfangs wurde etwas Gastheorie (ideales Gas, reales Gas, kinetische Gastheorie Transportphänomene, etc. behandelt. Dicht gefolgt wird die Gastheorie von einem großen Block Thermodynamik, der sich über unzählige Seiten mit noch viel mehr unzähligen Formeln erstreckt und letztlich mit der sog. Mischphasenthermodynamik vorerst endet. Daraufhin wurde ein wenig Reaktionskinetik behandelt (Reaktionsgeschwindigkeit, versch. Reaktionsmechanismen,... Der nächste Teil nennt sich Elektrochemie und beschreibt (hier im wesentlichen das Verhalten von elektrochemischen Zellen (Batterien. Im zweiten Semester wurde dann die Statistische Thermodynamik, welche versucht, Thermodynamik mathematisch zu machen und die Spektroskopie behandelt. Hinter der Vorlesung befinden sich über 100 Aufgaben (mit hoffentlich richtigen Lösungen zu den verschiedenen Themengebieten, u.a. auch einige Klau-
14 suraufgaben. Den krönenden Abschluß bildet der Index, der einigen anderen und mir selbst bei den Klausuren wertvolle Hilfe leistete um die 50%-Hürde zu überwinden. Eine kleine Bemerkung am Rande. Ich bin der Ansicht, daß sich die Leute, die sich für dieses kleine Heftchen abgerackert haben, nicht unwerwähnt bleiben sollten. Aus diesem Grund denke ich, daß dieses Werk nur vollständig!!! weitergegeben werden darf. Am Schluß dieser Einleitung möchte ich den Personen danken, die etwas positives zu diesem Werk beigetragen haben. Da wäre der Herr Achim Dicker Stremplat, der mehr als die Hälfte der Aufgaben gerechnet und kommentiert hat und dabei auch über einige Fehler(? in der Mitschrift stolperte, der Herr Frank Düse, is mir g rad egal Schmithüsen, der allüberall jede Menge Fehler gefunden hat und zu deren Verbesserung beigetragen hat und Herr Boris Bobo, Peace Postler trug stets spielerisch zur Gestaltung dieses Werkes bei. Nicht zu vergessen, der große Meister selbst (damit meine ich nicht mich, sondern unseren Professor Ulrich Schindewolf, der ja auch einen nicht ganz unerheblichen Teil zur Vorlesung beigetragen hat. Auch die IBM-3090 und der Xerox-4050 Laserdrucker des Uni-Rechenzentrums dürfen natürlich nicht unerwähnt bleiben, denn mit ihnen wurden in den Katakomben des RZ so einige Schlachten geschlagen, bevor nach zähem Ringen das heißbegehrte Endprodukt an den Verbraucher übergeben wurde. Bleibt mir nur noch übrig, viel Spaß oder besser viel Glück mit diesem Lehrbuch der Physikalischen Chemie zu wünschen, welches auf über 300 Seiten über 100 Bildchen, 150 Aufgaben und um die 1500 Formeln bzw. Herleitungen oder Rechnungen beinhaltet. Karlsruhe, den , Gerrit Jahn Ab sofort ist dieses Skript auf folgender WWW-Seite erhältlich: Meine -Adresse findet sich ebenfalls auf der Seite
15 Copyright-Geschichten: Da das Skript ja komischerweise ;- doch einige Fehler zu enthalten scheint, mußte ich mir bzgl. der Veröffentlichung der TEX-Files bzw. der kompletten Sourcefiles des Skriptes was einfallen lassen... Da das Skript meinem Copyright unterliegen dürfte, darf von anderen Leuten eigentlich an den TEX-, Pic-, Plt- und PS-Files nichts verändert werden. Um aber trotzdem anderen Leuten die Möglichkeit zu geben, Fehler zu verbessern und den Inhalt evtl. zu erweitern, versuche ich im folgenden eine sinnvolle Regelung zu finden. Die nachstehenden Bedingungen sollten meines Erachtens erfüllt sein, wenn mit den Skriptsourcen gearbeitet wird: Der Autor des Skripts muß nach wie vor auf dem Deckblatt stehen ;- Alle Leute, die maßgebliche Verbesserungen zu dem Skript beitragen, sollten mindestens im Vorwort bzw. dessen Erweiterung(en aufgeführt werden. Es ist dem Autor vorbehalten diese Änderungen in angemessener Weise vorzunehmen. Er verpflichtet sich hiermit zwanglos, dies zu tun. Das Skript sollte möglichst nur vollständig weitergegeben werden. Das heißt nicht, dass der Sourcecode implementiert sein muss, wie das z.b. bei den GNU-lizenzierten Programmen der Fall ist. Das scheint mir im vorliegenden Fall unpraktikabel zu sein. Der Hinweis auf den Autor und die Original-WWW-Site, von der das Skript zu beziehen ist, darf sinngemäß nicht verändert werden. Um Konsistenz zu gewährleisten, sollte das Skript nur von der Original- Site zu beziehen sein. Die Original-Site ist oben angegeben. Die Source-Files dürfen nur komplett weitergegeben werden und nicht in anderen Dokumenten ohne Zustimmung des Autors verwendet werden. Die Source-Files sind auf Nachfrage via beim Autor erhältlich. Die inhaltliche Reihenfolge sollte ohne Einwilligung des Autors nicht verändert werden. Insbesondere dürfen keine Dateien weggelassen werden. Das Skript darf in gar keinem Fall ohne Einwilligung des Autors verkauft werden. Auch in Auszügen nicht. Diese Regelungen finden sich u.a. nochmals in der Datei README, die den Sourcen beiliegt. Diese Datei darf nicht verändert werden und sollte von allen, die das Skript verändern wollen, gelesen werden. Karlsruhe, den , Gerrit Jahn
16 16 1 WISSENSWERTES 1 Wissenswertes 1.1 Gleichgewichte (allgemein Im ersten Abschnitt dieses Skripts wird kurz beschrieben, unter welchen Voraussetzungen sich ein System im Gleichgewicht befinden kann. (Unter einem System versteht man einen Ort, an dem z. B. chemische Reaktionen ablaufen oder Gase komprimiert werden,.... Die Beobachtungen finden aus der Umgebung des Systems statt, da sie, sofern sie aus dem System selbst gemacht würden, die Ergebnisse vermutlich verändern würde. U U labil stabil U invariant U metastabil Echte Gleichgewicht stellen sich immer dann ein, wenn sich ein System niedrigsten Energiezustand befindet, also keine Arbeit mehr verrichten kann. Der zugehörige Energiegraph dieses Systems oder der Reaktion hat am Punkt des echten Gleichgewichts ein globales Minimum. Echte Gleichgewichte heißen stabil Unechte Gleichgewichte heißen metastabil, dort weist der Graph nur ein lokales Minimum auf. Die anderen beiden Fälle entnehme man der Graphik. 1.2 Physikalisches Gleichgewicht stabiles, metastabiles Gleichgewicht folgt aus: de dr = 0 und d 2 E dr 2 > 0 r z.b. Abstand zweier Atome, E potentielle Energie 1.3 Thermisches Gleichgewicht zwei Behälter nur über Wärmebrücke verbunden: I Stoff ; II Stoff 2 T I = T II aber p I p II
17 1.4 Physikalisch Thermodynamisches Gleichgewicht Physikalisch Thermodynamisches Gleichgewicht wie oben, aber Behälter zueinander offen T I = T II und p I = p II = Energie bleibt konstant, Entropie steigt. 1.5 Chemisches Gleichgew., Echtes Thermodyn. Gleichgew. z.b. 3H 2 + N 2 2NH 3 H < 0 = Gleichgewicht: Energieabnahme, Entropiezunahme Weiteres siehe S. 2 und dem mathematischen Anhang.
18 18 2 GASGESETZE 2 Gasgesetze 2.1 Ideales Gas Im folgenden wird das ideale Gas behandelt. Es handelt sich hierbei um eine vereinfachte Theorie, die auf den Theorien von Boyle, Gay-Lussac und Avogadro aufbaut. Die einzelnen Gasteilchen werden als Punkte angesehen und stehen in keinerlei Wechselwirkung zueinander. Es ergibt sich das ideale Gasgesetz: Verhalten des idealen Gases p V = n R T p = nrt V p wobei p der Druck des idealen Gase ist und V das Volumen, welches n Mole des idealen Gases bei der Temperatur T einnehmen. R heißt universelle Gaskonstante, welche in verschiedenen Einheiten folgenden Wert annimmt. V T J R = MolK = latm MolK = 1.99 cal MolK Umrechnungen der verschiedenen, mehr oder weniger gebräuchlichen Einheiten, in denen der Druck noch angegeben wird. 1bar = 10 5 Nm 2 = 10 5 Pa 1atm = 760torr = 760mmHg = Partialdruck, Konzentration, Dichte Der Partialdruck p i einer Komponente i eines Gasgemisches ist nach Dalton der Druck, den die Teilchen dieser Komponente unter Abwesenheit anderer Teilchen bei gleichem Volumen ausüben würden. p i = n i RT V Der Gesamtdruck ergibt sich als Summe der Partialdrücke: RT p = p 1 + p 2 + p = n 1 V + n RT 2 V +... = (n 1 + n RT V = nrt V
19 2.2 Zustandsfunktion 19 Die Molzahl des Systems ergibt sich aus der Summe der Molzahlen der einzelnen Komponenten. (Die Molzahl gibt an, wieviel Mol Teilchen im System vorhanden sind. n = n 1 + n = i n i [n] = [m] [M] = kg kg/mol = Mol Der Molenbruch der Komponente i (x i ist das Verhältnis der Molzahl von i zur Gesamtmolzahl oder das Verhältnis des Partialdruckes zum Gesamtdruck. x i = n i = p i ni pi Die Konzentration ist das Verhältnis von Partialdruck oder Molzahl der Komponente i und dem Gesamtvolumen m = Masse; M =Molmasse n i V = p i RT = C i [C] = Mol l = p = m M RT V = ϱ M RT 2.2 Zustandsfunktion Eine Zustandsfunktion beschreibt einen Zustand eines Systems in Abhängigkeit von den Zustandsvariablen und ist unabhängig vom Weg, auf dem der Zustand erreicht werden kann. V = f(t, p, n 1, n 2,... = nrt p p = n V RT = C R T = ϱ M RT C molekulare Konzentration (Mol/V olumen 2.3 Partielle Differentialquotienten Unter einem partiellen Differentialquotienten versteht man die Ableitung einer Zustandsfunktion nach einer bestimmten Größe unter Konstanthaltung der übrigen Größen, die in der jeweiligen Funktion vorkommen. Z. B.: ( V = nr T p,n i P
20 20 2 GASGESETZE Thermischer Ausdehnungskoeffizient α 1 V ( V = 1 T p T Kompressibilitätskoeffizient ( V p = nrt p T,n 2 β 1 V Partielle Volumenänderung ( V = 1 p T,n p ( V dv = dt = αv dt T p,n ( V dv = dp = βv dp p T,n ( V dv = dn = V mol dn n T,p 2.4 Totales Differential des Volumens =Gesamtänderung des Volumens bei Änderung der Einzelkomponenten folgt aus partiellen Volumenänderungen ( ( ( V V V dv = dt + dp + dn T p,n p T,n n T,p = dv = V αdt + V βdp( 1 + V mol dn 2.5 Reale Zustandsgleichung von Gasen Van der Waals Gleichung Das ideale Gas wurde eingeführt, indem man annahm, daß die Gasteilchen ein verschwindendes Volumen besitzen und daß keine anziehenden Wechselwirkungen zwischen den Teilchen wirken. Dies wird nun durch Einführen des Anziehungsparameters a und des Eigenvolumens b der Teilchen behoben. ( p + a Vm 2 (V m b = RT ( p + n2 a V 2 (V n b = n R T
21 2.5 Reale Zustandsgleichung von Gasen 21 gesucht sind folgende partielle Ableitungen: ( V 1 = p und T ( p V T ( V 1 = ( T T p V p Die partiellen Ableitungen vor dem Gleicheitszeichen sind i. a. nicht lösbar, da Gleichungen 3. Grades auftreten. Wendet man nun die 2. Eulersche Beziehung (Inverter, siehe P.1 an, so kann man sie recht einfach bestimmen. ( ( ( p V V dt + dp = 0 T V,n T p,n p T,n = ( p T V,n = ( V/ T p ( V/ p T = α β Virialgleichung, Abweichung vom idealen Verhalten Das ideale Gas ist, wie wir gesehen haben, nur eine Näherung, die im wesentlichen bei kleinen Drücken und Temperaturen ihre Berechtigung hat. Will man ein Gas besser beschreiben, so entstehen in der Gasgleichung Korrekturglieder für die Wechselwirkungen der Teilchen untereinander: p V = RT 1 + B(Tp + C(Tp 2 +D(Tp 3 + } {{ } } {{ } 2er Stöße 3er Stöße Das ist die Virialgleichung oder Virialentwicklung des realen Gases. Die Koeffizienten B, C,... heißen Virialkoeffizienten. Möchte man nun ideale Gase betrachten, so läßt man die Koeffizienten einfach unberücksichtigt Realfaktor Der Realfaktor eines Gases gibt seine Abweichung vom idealen Verhalten an. Z = pv RT = 1 (für ideale Gase Z = pv RT = 1 + B(T RT p + C(T RT p2 + Bei einer ausgesuchten Temperatur verhält sich das entsprechende Gas bei kleinen Drucken wie ein ideales Gas. Diese Temperatur wird als Boyle-Temperatur T B bezeichnet. T B ergibt sich aus: lim p 0 ( Z p = 0
22 22 2 GASGESETZE Beim Van der Waals Gas (s haben wir die Parameter a und b kennengelernt: a beschreibt die anziehende Wechselwirkung (Kohäsionskräfte, die die Teilchen untereinander ausüben. Diese werden z. B. durch Dipol-, bzw. Coulomb- Kräfte bewirkt. b beschreibt die abstoßenden Wechselwirkungen, welche durch das Eigenvolumen der Teilchen hervorgerufen werden. Das Stoßvolumen, daß sich ergibt, wenn zwei Teilchen miteinander stoßen, beschreibt folgende Formel: V Stoß = 4 3 πd3 = 4 3 π 8r3 mit d =Moleküldurchmesser bzw. r =Radius des Moleküls. Das Eigenvolumen eines Teilchen ergibt sich, wenn man um die beiden stoßenden Teilchen ein Art Kugelschale mit dem Radius d legt (siehe Moore- Hummel S Die Kugelschale hat gerade die vierfache Größe des einzelnen Moleküls. Danach kann man dann, wie weiter unten beschrieben, das Eigenvolumen eines Mols Teilchen (= b ausrechnen. V eigen = 1 2 V Stoß = πr3 Das Volumen, welches ein Mol Teilchen tatsächlich einnimmt ergibt sich zu: V 0 = 4 3 πr3 N L Nach irgendeiner anderen Definition ist b = 4 V 0, demnach ist b also: b = 4 V 0 = N Lπr 3 (= V eigen N L Die Größe b wird in der Literatur auch als molares Covolumen bezeichnet. Sie gibt also an, wieviel Platz die Teilchen benötigen, wenn sie im Gas freudug hin- und herwackeln. Dieser Platz wird dann bei Betrachtung eines realen Gases vom restlichen freien Volumen abgezogen, um zu einer etwas besseren Beschreibung eines Gases zu kommen (also durch Beachtung des 2 Virialkoeffizienten (B. Z T > T B T B 1 id. Gas T < T B
23 2.6 Verhalten des Van-der-Waals Gases Verhalten des Van-der-Waals Gases V 3 m V 2 m (b + RT p + V m a p ab p = 0 Das ist die Van-der-Waals Gleichung nach dem Volumen aufgelöst. Sie hat drei Lösungen, aber es gibt nur eine sinnvolle Lösung: 3 reelle Lösungen bei tiefen Temperaturen T < T K 3 identische reelle Lösungen bei T = T K 1 reelle, 2 imaginäre Lösungen bei hohen T > T K p Reales Gas nach Van-der-Waals V K = 3b T 1 T 2 T 3 T KT4 T 5 T 6 p K V K T 1 > T 2 > T 3 > T K > T 4 > T 5 > T 6 V p K = a 3V 2 K T K = 8p KV K 3R = a 27b 2 Z K = p KV K RT K = 3 8 = 8a R27b p Van-der-Waals Gas mit Maxwell-Korrektur Maxwell-Geraden T 1 T k T 2 T 3 T 4 Wenn man sich das obere Bildchen einmal anschaut, so stellt man fest, daß Bereiche existieren, bei denen eine Vergrößerung des Druckes zu einer Vergrößerung des Volumens führen würde. (Dies geschieht gerade im Zweiphasengebiet. Da das aber unsinnig ist, hat Maxwell die Kurven in diesem Bereich durch Geraden ersetzt (s. links, Zweiphasengebiet ist gepunktet, T 1 > T k > T 2 > T 3 > T 4 V T K ist die Kritische Temperatur, dort befindet sich in dem p-v Diagramm des Van-der-Waals Gase eine waagerechte Wendetangente, also ein Sattelpunkt, welcher den obersten Punkt des Zweiphasengebietes markiert, in welchem gleichzeitig überhitzte Flüssigkeit und unterkühlter Dampf vorliegt (bei Temperaturen T < T K Eine andere Definition für T K wäre: T K ist die höchste Temperatur, bei der ein Gas noch verflüssigt werden kann. ( V p < 0 (f. T > T K ( dv > 0 (f. T < T K dp
24 24 2 GASGESETZE Wenn T K, P K, V K bekannt sind kann man die Anziehungs- und Abstoßungsparameter des Realen Gase a und b bestimmen: p = RT V b a V ( ( 2 = dp dv = 0 und d 2 p dv = 0 K K 2 = b = 1 3 V K a = 3p K VK 2 = 9 8 RT KV K p K V K T K = 3 8 R In dem metastabilen Zweiphasengebiet liegen gleichzeitig flüssige- und Gasphase vor, welche dort nicht mehr unterscheidbar sind. Durch Einsetzen von den Anziehungsparameter a und dem Abstoßungsparameter b in die Zustandsfunktion erhält man das Theorem der übereinstimmenden Zustände (bzw. die reduzierte Zustandsgleichung : ( p + 3pK V K (V V 1 2 ( p p K + 3V K 2 = 3 V K = 8 3 p K V K TK ( V 3 V 2 V K 1 (Π + 3ϕ (3ϕ 1 = 8ϑ 2 = 8 T T K (reduzierte Zustandsvariablen : Π = p p K, ϕ = V V K, ϑ = T T K Siedepunkt T S = (0.64 ± 0.03 T K, Boyletemperatur T B = 27 8 T K p = 1 V = 1 V ( RT a 1 b/v V 2 T nach Druck aufgelöste V-d-W Gleichung RT + brt V 2 a V 2 (bei V b RT = pv pv = RT + brt V a V ap ( RT + bp RT = RT + b a RT (Näherungsverhalten p Dabei entspricht der Zusatzterm dem zweiten Virialkoeffizienten, der die Wechselwirkung zwischen zwei Teilchen relativ großen Volumens repräsentiert (s B(T = b a RT B = 0 für ideale Gase Man kann diesen Virialkoeffizienten aber auch berechnen: B(T = 2πN L 1 exp rdr 0 ( U(r RT
25 2.7 Verteilung der Moleküle auf versch. Energiezustände Verteilung der Moleküle auf versch. Energiezustände Es folgt ein kurzer Einschub, der eigentlich eher zur statistischen Thermodynamik (vor allem die Boltzmannverteilung gehört. Allerdings kommt die BV auch schon in den folgenden Kapiteln zum Tragen Barometrische Höheformel (Bsp. 1 Aus p p 0 dp p = h 0 Mg RT dh = ln( p p0 = Mgh RT ( p = p 0 exp Mgh RT Halbwertsdruck ( p0 /2 ln p 0 = Mg RT h 1/2 Beispiel: M = x N2 M N2 + x O2 M O2 = 28, 8 g T = 273K Mol = h 1/2 = 5568m ( N = exp E pot N 0 RT RT = thermische Energie Zentrifuge (Bsp. 2 ( ( n mω N 0(r=0 = exp 2 r 2 M 2RT = exp 2 N N 0 = exp (( E RT v 2 RT exp ( E kin RT 2.8 Boltzmann-Verteilung Bolzmann-Verteilung I Wie verteilen sich im therm. Gleichgewicht N Teilchen auf n versch. Energiezustände 1, 2,...,n der rel. Größe g } {{ } i mit den Besetzungszahlen N 1, N 2,..., N n i
26 26 2 GASGESETZE (N 1 + N N n = n i=1 N i = N W = gn 1 1 N 1! g N 2 2 N i = f(ε i, g i N 2! gnn n N n! N! (N = n W Wahrscheinlichkeit, N! Gesamtpermutationen, N i! Perm. in Kasten i Wahrscheinlichste Verteilung dw dn 2 = 0 Zusammenhang: s ln W d lnw dn Stirling sche Formel (Einschub N! = N(N 1(N N N exp( N 2πN Boltzmann-Verteilung II Nebenbedingung: N i = konst. = N (konstante Teilchenzahl Ni ε i = konst = E (konst. Energie des Gesamtsystems = N i = exp(lng i α βε i = g i exp( α exp( βε i Ni = N = g i exp( α exp( βε i = e α N = gi e βε i = N i N = g ie βε i gi e βε i einfacher, wenn g i = 1 (kommt oft in der Natur vor = N ε i N εi =0 = e βε i e β0 = e βε i N εi N εj = e (ε i ε j β durch Vergleich zur Barometrischen Höhenformel und der Zentrifuge β = 1 RT (Energie pro Mol oder β = 1 kt N ε i N εj = e (ε i ε j /RT (Energie pro Molekül
27 2.8 Boltzmann-Verteilung Boltzmannsatz/Boltzmann sche e-funktion (III Allgemeine Lösung der Boltzmanngleichung N εi N = g ie εi/rt gi e ε i/rt T = 0 N Boltzmann sche e-funktion 0 < T < Gleichverteilung (T = N =Gesamtzahl aller Teilchen ε i
28 28 3 KINETISCHE GASTHEORIE 3 Kinetische Gastheorie In diesem Kapitel wird das Verhalten von Gasen und Dingen, die man übertragen kann (z. B. Wärme, Strom mathematisch ein wenig beschrieben. Voraussetzungen für die Kinetische Gastheorie idealer Gase ohne Wechselwirkungen: große Anzahl von Molekülen (Atomen regellose Translationsbewegung (Brown sche Bewegung Teilchenradius r mittlerer Abstand der Teilchen untereinander in der Gasphase (=mittlere frei Weglänge (λ Gefäßdimension d Stoßgesetze sind voll gültig (Energie- und Impulserhaltung beim Stoß Lennard-Jones-Potential (Einschub Dieses WW-Potential gilt für Van-der Waals Wechselwirkungen. ( U = 4ε( δ 12 ( r δ 6 r f. ideale Gase: LJP = 0 U 0 ε Lennard-Jones-Potential δ ε 6 2δ r 3.1 Druck des idealen Gases Der Druck des idealen Gases in einem Würfel mit der Kantenlänge l, bedingt durch Stöße auf die Wand berechnet sich wie folgt: Volumen V = l 3, Fläche A = l 2, u Geschwindigkeit Impulsänderung je Stoß = 2mu; Wegstrecke je Zeiteinheit = u Wegstrecke je Stoß (zwischen zwei Stößen = 2l kg m2 sec 2 Impulsänderung / Zeit = 2muu 2l = mu2 l [dimp/t] = m = N Wir berechnen nun den Druck eines Teilchens auf eine Wand: p = F A = mu2 l l 2 = mu2 V
29 3.2 Graham sches Gesetz 29 Berechnung des Druckes eines Mols Teilchen auf eine Wand: p = 1 mn L u 2 3 V (1/3 wegen Aufteilung in x-,y-,z-richtung = pv mol = 1 3 N Lu 2 m 2 2 = 1 3 N L2E kin = 2 3 N Lε kin = 2 3 E kin = 1 Mu pv mol = RT = 2 3 N Lε kin = 2 3 E kin E kin = N L m 2 u2 = 3 2 RT = 3 2 N LkT = M 2 u2 u 2 1 u 2 2 m 1 u 2 1 = m 2u 2 2 = m 2 m 1 = u2 1 = u 2 2 u 2 1 u 2 2 = m2 m 1 (je schwerer ein Teilchen, desto kleiner die Geschwindigkeit / T=konst. 3.2 Graham sches Gesetz Wir betrachten ein Rohr, welches ein sehr kleines Loch hat, durch das Teilchen nach außen diffundieren können. Es stellt sich die Frage nach der Anzahl der diffundierenden Teilchen. Wenn es also Teilchen der Sorte 1 und 2 gibt, so ist: ( N1 N 2 V ak ( N1 N 2 Rohr = m2 m 1 = u 1 u 2 Pro Zeiteinheit diffundieren demnach genauso viele Teilchen wie auf die Fläche des Loches auftreffen. 3.3 Urantrennung Um U 235 von U 238 zu trennen sind folgende Verfahren wichtig: Trenndüsenverfahren Uran besteht zu 0.7% aus U 235 und zu 93.3% aus U 238 Bei diesem Kreisprozeß wird der Feedstrom an der Trenndüse, an der der Produktstrom entnommen wird, vorbeigeführt, der Rest heißt dann Wastestrom und wird wieder als Feedstrom benutzt.... Als Trennmittel wird meist UF 6 verwendet α = ( U 235 U ( P 238 rodukt. U 235 U F 238 eed. = m238 m 235 = α = 1.004
30 30 3 KINETISCHE GASTHEORIE Zentrifugentrennung Zentrifuge mit Radius r, Umdrehungsgeschwindigkeit v = ωr hier: v = 400 m sec, T = 300K, (ω = Winkelgeschwindigkeit N r N r=0 = e Mv2 2RT = α = e (M 235 M 238 v2 2RT = 1.1 Beispiel für die mittlere Molekülgeschwindigkeit von Stickstoff N 2 : Nach RT ergibt sich ū = πm : kg MN2 = 28g = Mol, T = 300K = u 2 = 3.4 Molare Wärmekapazität kg m2 sec 2 MolK 300K kg Mol 500 m sec Wenn einem System Wärme zugeführt wird, ändert sich der Zustand des Systems, es könnte z. B. eine Temperaturerhöhung auftreten. Sofern nur fast undendlich kleine (infinitesimale Wärmeübergange stattfinden, ist die zugeführte Wärmemenge proportional der Temperatur des Systems. D. h. dq = C dt und C ist die spezifische Wärme oder Wärmekapazität. Bildet man nun das Verhältnis C m = C n (n=molzahl, so erhält man die molare Wärmekapazität Molare Wärmekapazität bei konstanten Volumen Innere Energie der Translation U = E kin = 3 2RT, V = konst. Q = C V T = U = E kin = 3 2 R T Q T = C V = U T = E α T C V ( U T = ( du dt = 3 V 2 R V = de kin dt = 3 2 R 3.5 Freiheitsgrade Die Freiheitsgrade eines Moleküls geben die Bewegungsmöglichkeit bezüglich der jeweiligen Bewegung an. Freiheitsgrade bezüglich Translation: Translationsbewegung ist in die drei Raumrichtungen möglich 3 FG Translationsenergie je FG = 1 2 RT C V je FG = 1 2 R
31 3.6 Molekül-Stoßzahl eines Moleküls 31 Freiheitsgrade bezüglich Rotation: Rotationsbewegung ist bei gewinkelten Molekülen um 3 Achsen möglich, bei linearen nur um 2 gewinkeltes Molekül: 3 FG, lineares Molekül: 2 FG Rotationsenergie je FG = 1 2 RT C V je FG = 1 2 R Freiheitsgrade bezüglich Schwingung: Die Anzahl der Freiheitsgrade der Schwingung sind aus der Formel im unteren Beispiel zu entnehmen Schwingungsenergie je F G = RT C V je FG = R Anwendung Freiheitsgrade Die Gesamtzahl der Freiheitsgrade ändert sich z. B. beim Übergang von Atomen zu Molekülen nicht! Molekül aus N Atomen: N Atome haben 3N Freiheitsgrade der Translation Molekül aus N Atomen: 3 FG der Translation 3 FG der Rotation (gewinkelt 2 FG der Rotation (linear x FG der Schwingung Da Gesamtzahl (3N konstant Beispiel: = x FG Schwing. = 3N 3FG Trans. [3FG oder 2FG] Rot. O C O : FG Schwing. = = 4 H 2 O : FG Schwing = = Molekül-Stoßzahl eines Moleküls Die Stoßzahl gibt an, wieviele Stöße ein Atom oder Molekül mit anderen Teilchen in einem festgelegten Zeitintervall ausführt [Z 1 ] = 1 sec, Z 1= Zahl der Stöße eines Moleküls Mittlere Freie Weglänge λ zwischen 2 Stößen ([λ] = m] Gesamtzahl aller Stöße Z 1,1 ([Z 1,1 ] = 1 m 3 sec Zur Vereinfachung der Rechnung wird folgendes vorausgesetzt: δ = 2r, mittlere Geschwindigkeit = u Im Stoßzylinder werden die gestoßenen Teilchen als Punkte angenommen, dafür wird das stoßende Teilchen mit dem Radius δ (statt r angenommen (also δ = 2r. A Stoßzylinder = πδ 2 u = l t V Stoßzylinder t = πδ 2 u
32 32 3 KINETISCHE GASTHEORIE Teilchendichte = N V Z 1 = V St. N V = πδ2 u N V Vereinfachung der Rechnung: Alle Teilchen sind gleich und treffen senkrecht aufeinander, es ergibt sich nach 3.7.3: u rel = ( u u 2 8RT 2 u i = πm i = 8RT π 1 M 1 M 2 M 1 +M 2 = 8RT πµ µ = M 1M 2 M 1 +M 2 reduzierte Masse Freie Weglänge = Z 1 = πδ 2 u rel N V = πδ2 2u N V Weg zwischen zwei Stößen (frei Weglänge λ λ = Weg Stoeße = Weg/Zeit Stoeße/Zeit = Gesamtzahl aller Stöße u V πδ 2 2uN = V πδ 2 2N Beispiel N 2 : N 1 Z 1,1 = Z 1 V 2 1/2 wegen Doppelzählung = πδ2 2 u ( N 2 [sec 1 m 3 ] V p i = 1atm; T = 25 C; δ = cm; M = 28g Mol 8RT = u = πm = 475 m sec = λ = = Z 1 = sec 1 = Z 1,1 = ( 1 Mol l = Z 1,1 = 5 10 cm 3 sec 10 Mol lsec 3.7 Maxwell-Boltzmann-Geschwindigk.-Verteilung Eindimensionale Verteilungsfunktion gesucht ist die Wahrscheinlichkeit einer best. Geschwindigk. eines Teilchens. Ansatz: A N ε i N = g ie ε i kt dn u x N A Normierungsfaktor = Ae mu2 x 2kT dux
33 3.7 Maxwell-Boltzmann-Geschwindigk.-Verteilung 33 (dn ux ist die Teilchenzahl mit Geschwindigkeiten zwischen u x und du x + u x wegen Normierung gilt: = 1 A = 1 = e m u 2 x 2 kt dux = dnu x N = A e m u 2 x 2 kt dux e z2 dz a = π a = A = a π = m 2πkT (z 2 = m 2kT u2 x = au 2 x f nx = dnu ( x m 1 2 = e m u 2 x 2 kt Ndu x 2πkT Zweidimensionale Verteilungsfunktion Bei dieser und der 3D-Herleitung hatte ich keine Lust, Bildchen zu malen, es werden hier kleine Ausschnitte eines Kreises betrachtet, in welchen die Teilchen die Geschwindigkeiten u + du haben. dnu N = dnu x dnu ( y m 2 2 N 2 = e m u 2 x +u2 y 2 kt 2πkT du x du y W = dnu N = m 2πkT e m u 2 2 kt (2πudu u 2 = u 2 x + u 2 y Dabei ist 2πu der Umfang des Kreisrings = f(u = m 2πkT e m u 2 2 kt 2πu Dreidimensionale Verteilungsfunktion Vollständige Geschwindigkeitsverteilungsfunktion nach Maxwell und Boltzmann Betrachtet werden Teilchen, die eine Geschwindigkeit haben, die dem Volumen eines Stückchens aus der Kugelschale entsprechen, die von den Werten u + du gebildet wird. W = dnu N = m 2πkT e m u 2 2 kt (4πu 2 du mit u 2 = u 2 x + u 2 y + u 2 z dabei ist 4πu 2 die Fläche der Kugelschale = f(u = ( 3 m 2 2πkT e m u 2 2 kt 4πu 2
34 34 3 KINETISCHE GASTHEORIE f(u Maxwell-Boltzmann-Geschwindigkeitsverteilung T 2 > T 1 T 1 T 3 < T 1 0 ûu u 2 u Fläche unter der Kurve = konst. (bei T = konst oder M = konst Häufigste Geschwindigkeit Die häufigste Geschwindigkeit erhält man, indem man nach Nullstellen der Ableitung der Verteilungsfunktion sucht. Die häufigste Geschwindigkeit wird oft auch als wahrscheinlichste Geschwindigkeit bezeichnet, da es sich bei der Funktion ja eigentlich um eine Wahrscheinlichkeitsverteilung handelt. û df(u du = 0 = û = 2kT m = 2RT M Mittlere Geschwindigkeit Die mittlere Geschwindigkeit erhält man, indem man die Summe der Geschwindigkeiten multipliziert mit der Anzahl der zugehörigen Teilchen durch die Gesamtzahl der Teilchen teilt. Die Gesamtzahl der Teilchen ist hier wegen der oben vorgenommenen Normierung =1. u = N 1u 1 +N 2 u 2 Ni u i N 1 +N 2 + = f(ui n i Ni = f(ui = 0 uf(udu = ( 3 m 2 2πkT 4π 0 8kT = u = πm = 8RT πm u 2 u e m 2 0 uf(udu f(udu 0 } {{ } =1 u 2 kt du Will man die mittlere Geschwindigkeit eines Gases mit unterschiedlichen Teilchen untersuchen, so hat man statt der Molmasse die reduzierte Masse einzusetzen: = ū = 8RT πµ µ = M 1 M 2 M 1 + M 2
Physikalische Chemie Physikalische Chemie I SoSe 2009 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas. Thermodynamik
 Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
Prof. Dr. Norbert Hampp 1/9 1. Das Ideale Gas Thermodynamik Teilgebiet der klassischen Physik. Wir betrachten statistisch viele Teilchen. Informationen über einzelne Teilchen werden nicht gewonnen bzw.
Inhalt der Vorlesung. 1. Eigenschaften der Gase. 0. Einführung
 Inhalt der Vorlesung 0. Einführung 0.1 Themen der Physikal. Chemie 0.2 Grundbegriffe/ Zentrale Größe: Energie 0.3 Molekulare Deutung der inneren Energie U Molekülstruktur, Energieniveaus und elektromagn.
Inhalt der Vorlesung 0. Einführung 0.1 Themen der Physikal. Chemie 0.2 Grundbegriffe/ Zentrale Größe: Energie 0.3 Molekulare Deutung der inneren Energie U Molekülstruktur, Energieniveaus und elektromagn.
Bernhard Härder. Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik W/ WESTAR.P WISSENSCHAFTEN. Skripte, Lehrbücher Band 2
 Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Bernhard Härder Einführung in die PHYSIKALISCHE CHEMIE ein Lehrbuch Chemische Thermodynamik Skripte, Lehrbücher Band 2 W/ WESTAR.P WISSENSCHAFTEN Inhaltsverzeichnis Vorwort zur ersten Auflage Vorwort zur
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal
 Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
Die freie Energie wird also bei konstantem Volumen und konstanter Temperatur minimal 7.2 Die Enthalpie Die Enthalpie H ist definiert als H = U + pv, womit wir für die Änderung erhalten dh = pdv + TdS +
Einführung in die Physikalische Chemie Teil 1: Mikrostruktur der Materie
 Einführung in die Physikalische Chemie Teil 1: Mikrostruktur der Materie Kapitel 1: Quantenmechanik Kapitel 2: Atome Kapitel 3: Moleküle Mathematische Grundlagen Schrödingergleichung Einfache Beispiele
Einführung in die Physikalische Chemie Teil 1: Mikrostruktur der Materie Kapitel 1: Quantenmechanik Kapitel 2: Atome Kapitel 3: Moleküle Mathematische Grundlagen Schrödingergleichung Einfache Beispiele
4 Thermodynamik mikroskopisch: kinetische Gastheorie makroskopisch: System:
 Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Theorie der Wärme kann auf zwei verschiedene Arten behandelt werden. mikroskopisch: Bewegung von Gasatomen oder -molekülen. Vielzahl von Teilchen ( 10 23 ) im Allgemeinen nicht vollständig beschreibbar
Inhaltsverzeichnis Hinweise zur Benutzung Einführung in die Arbeits- und Denkweise Basis der Thermodynamik
 Inhaltsverzeichnis 1 Hinweise zur Benutzung... 1 1.1 Ausrichtung...... 1 1.2 Lernhilfen und -kontrollen...... 4 2 Einführung in die Arbeits- und Denkweise... 9 2.1 Zielsetzung...... 9 2.2 Wichtige physikalische
Inhaltsverzeichnis 1 Hinweise zur Benutzung... 1 1.1 Ausrichtung...... 1 1.2 Lernhilfen und -kontrollen...... 4 2 Einführung in die Arbeits- und Denkweise... 9 2.1 Zielsetzung...... 9 2.2 Wichtige physikalische
Allgemeines Gasgesetz. PV = K o T
 Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Allgemeines Gasgesetz Die Kombination der beiden Gesetze von Gay-Lussac mit dem Gesetz von Boyle-Mariotte gibt den Zusammenhang der drei Zustandsgrößen Druck, Volumen, und Temperatur eines idealen Gases,
Gesetz von Boyle. Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V.
 Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Gesetz von Boyle Empirisch wurde beobachtet, dass bei konstanter Temperatur gilt: p.v = Konstant bzw V 1 / p bzw p 1 / V Isothermen Gesetz von Gay-Lussac Jacques Charles und Joseph-Louis Gay-Lussac fanden
Physikalische Chemie 0 Klausur, 22. Oktober 2011
 Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
Physikalische Chemie 0 Klausur, 22. Oktober 2011 Bitte beantworten Sie die Fragen direkt auf dem Blatt. Auf jedem Blatt bitte Name, Matrikelnummer und Platznummer angeben. Zu jeder der 25 Fragen werden
1. Wärmelehre 1.1. Temperatur. Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités)
 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für die Temperatur Prinzip
Wärmelehre/Thermodynamik. Wintersemester 2007
 Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov # am 25.0.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 ladimir Dyakonov # am 25.0.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/ep6/teaching.html Raum E43, Tel. 888-5875,
Skript zur Vorlesung
 Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
Skript zur Vorlesung 1. Wärmelehre 1.1. Temperatur Physikalische Grundeinheiten : Die Internationalen Basiseinheiten SI (frz. Système international d unités) 1. Wärmelehre 1.1. Temperatur Ein Maß für
PC-Übung Nr.1 vom
 PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
PC-Übung Nr.1 vom 17.10.08 Sebastian Meiss 25. November 2008 1. Allgemeine Vorbereitung a) Geben Sie die Standardbedingungen in verschiedenen Einheiten an: Druck p in Pa, bar, Torr, atm Temperatur T in
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene)
 Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Das Ideale Gas Kinetische Gastheorie (auf atomarer Ebene) Wir haben gesehen, dass ein sogenanntes 'ideales Gas' durch die Zustandsgleichung pv = νr T [1] beschrieben wird; wir wollen nun verstehen, welchen
Modelle zur Beschreibung von Gasen und deren Eigenschaften
 Prof. Dr. Norbert Hampp 1/7 1. Das Ideale Gas Modelle zur Beschreibung von Gasen und deren Eigenschaften Modelle = vereinfachende mathematische Darstellungen der Realität Für Gase wollen wir drei Modelle
Prof. Dr. Norbert Hampp 1/7 1. Das Ideale Gas Modelle zur Beschreibung von Gasen und deren Eigenschaften Modelle = vereinfachende mathematische Darstellungen der Realität Für Gase wollen wir drei Modelle
Zustandsbeschreibungen
 Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Aggregatzustände fest Kristall, geordnet Modifikationen Fernordnung flüssig teilgeordnet Fluktuationen Nahordnung gasförmig regellose Bewegung Unabhängigkeit ngigkeit (ideales Gas) Zustandsbeschreibung
Hochschule Düsseldorf University of Applied Sciences. 20. April 2016 HSD. Energiespeicher Wärme
 Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
 1 Physikalische Chemie 92/93 cby Gerrit Jahn 2 Konstanten c 2:997925 10 8 m sec ;1 Vakuumlichtgeschwindigkeit e 0 1:60219 10 ;19 C Elementarladung " 0 8:85419 10 ;12 C 2 J ;1 m ;1 Dielektrizitatskonstante
1 Physikalische Chemie 92/93 cby Gerrit Jahn 2 Konstanten c 2:997925 10 8 m sec ;1 Vakuumlichtgeschwindigkeit e 0 1:60219 10 ;19 C Elementarladung " 0 8:85419 10 ;12 C 2 J ;1 m ;1 Dielektrizitatskonstante
Grundlagen der Physik 2 Schwingungen und Wärmelehre
 Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 25. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 25. 06.
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik 25. 06. 2007 Othmar Marti (Universität Ulm) Schwingungen und Wärmelehre 25. 06.
Lehrbuch der Thermodynamik
 Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
Ulrich Nickel Lehrbuch der Thermodynamik Eine verständliche Einführung Ж HANSER Carl Hanser Verlag München Wien VII Inhaltsverzeichnis 1 GRUNDBEGRIFFE DER THERMODYNAMIK 1 Einführung 1 Systeme 3 offene
1 I. Thermodynamik. 1.1 Ideales Gasgesetz. 1.2 Vereinfachte kinetische Gastheorie. 1.3 Erster Hauptsatz der Thermodynamik.
 1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
1 I. hermodynamik 1.1 Ideales Gasgesetz eilchenzahl N Stoffmenge: n [mol], N A = 6.022 10 23 mol 1 ; N = nn A molare Größen: X m = X/n ideales Gasgesetz: V = nr, R = 8.314JK 1 mol 1 Zustandsgrößen:, V,,
Physik für Mediziner und Zahnmediziner
 Physik für Mediziner und Zahnmediziner Vorlesung 21 Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 1 Gase (insbesondere: im Körper) aus: Klinke/Silbernagel: Lehrbuch der Physiologie
Physik für Mediziner und Zahnmediziner Vorlesung 21 Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 1 Gase (insbesondere: im Körper) aus: Klinke/Silbernagel: Lehrbuch der Physiologie
Thermodynamik (Wärmelehre) III kinetische Gastheorie
 Physik A VL6 (07.1.01) Thermodynamik (Wärmelehre) III kinetische Gastheorie Thermische Bewegung Die kinetische Gastheorie Mikroskopische Betrachtung des Druckes Mawell sche Geschwindigkeitserteilung gdes
Physik A VL6 (07.1.01) Thermodynamik (Wärmelehre) III kinetische Gastheorie Thermische Bewegung Die kinetische Gastheorie Mikroskopische Betrachtung des Druckes Mawell sche Geschwindigkeitserteilung gdes
Basiswissen Physikalische Chemie
 Claus Czeslik Heiko Seemann Roland.Winter Basiswissen Physikalische Chemie 4., aktualisierte Auflage STUDIUM VIEWEG+ TEUBNER Inhaltsverzeichnis Vorwort Liste der wichtigsten Symbole V XI 1 Aggregatzustände.
Claus Czeslik Heiko Seemann Roland.Winter Basiswissen Physikalische Chemie 4., aktualisierte Auflage STUDIUM VIEWEG+ TEUBNER Inhaltsverzeichnis Vorwort Liste der wichtigsten Symbole V XI 1 Aggregatzustände.
Physikalische Chemie 1
 Physikalische Chemie 1 Christian Lehmann 31. Januar 2004 Inhaltsverzeichnis 1 Einführung 2 1.1 Teilgebiete der Physikalischen Chemie............... 2 1.1.1 Thermodynamik (Wärmelehre)............... 2 1.1.2
Physikalische Chemie 1 Christian Lehmann 31. Januar 2004 Inhaltsverzeichnis 1 Einführung 2 1.1 Teilgebiete der Physikalischen Chemie............... 2 1.1.1 Thermodynamik (Wärmelehre)............... 2 1.1.2
a) Welche der folgenden Aussagen treffen nicht zu? (Dies bezieht sind nur auf Aufgabenteil a)
 Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Aufgabe 1: Multiple Choice (10P) Geben Sie an, welche der Aussagen richtig sind. Unabhängig von der Form der Fragestellung (Singular oder Plural) können eine oder mehrere Antworten richtig sein. a) Welche
Grundlagen der Physik 2 Schwingungen und Wärmelehre Othmar Marti.
 (c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 14. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
(c) Ulm University p. 1/1 Grundlagen der Physik 2 Schwingungen und Wärmelehre 14. 05. 2007 Othmar Marti othmar.marti@uni-ulm.de Institut für Experimentelle Physik Universität Ulm (c) Ulm University p.
Lösungsvorschlag Übung 2
 Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
Lösungsvorschlag Übung Aufgabe : Dichte von Gasen a) Die Dichte ρ eines Gases ist definiert als der Quotient aus Masse m und Volumen V ρ = m V..) Die Masse eines Gases erhält man aus dem Produkt seiner
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13. Klausur PC 1. Sommersemester :15 bis 11:45.
 Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Physikalische Chemie 1 (Thermodyn. u. Elektrochemie) SS09 - Blatt 1 von 13 Klausur PC 1 Sommersemester 2009 03.08.2007 10:15 bis 11:45 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 12. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 12. 07. 2007 Klausur Die Klausur
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I Dr. Helge Klemmer
 Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
Mathematisch-Naturwissenschaftliche Grundlegung WS 2014/15 Chemie I 05.12.2014 Wiederholung Teil 1 (28.11.2014) Fragenstellungen: Druckanstieg im Reaktor bei Temeraturerhöhung und Produktbildung? Wie groß
2 Grundbegriffe der Thermodynamik
 2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
2 Grundbegriffe der Thermodynamik 2.1 Thermodynamische Systeme (TDS) Aufteilung zwischen System und Umgebung (= Rest der Welt) führt zu einer Klassifikation der Systeme nach Art der Aufteilung: Dazu: adiabatisch
Grundlagen der statistischen Physik und Thermodynamik
 Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Grundlagen der statistischen Physik und Thermodynamik "Feuer und Eis" von Guy Respaud 6/14/2013 S.Alexandrova FDIBA 1 Grundlagen der statistischen Physik und Thermodynamik Die statistische Physik und die
Übung 4. SS 2013 Übung - Einführung in die Verbrennung - Methling, Özuylasi 1
 Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Ziel: Grundlagen der chemischen Reaktionskinetik verstehen Verstehen qualitativer Reaktionsverläufe Aufstellung des Zeitgesetzes Umgang mit nicht reagierenden Stoßpartner (M) Berechnung Geschwindigkeitskoeffizient
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo
 Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Allgemeine Chemie für Studierende mit Nebenfach Chemie Andreas Rammo Allgemeine und Anorganische Chemie Universität des Saarlandes E-Mail: a.rammo@mx.uni-saarland.de innere Energie U Energieumsatz bei
Thermodynamik I Formeln
 Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
Thermodynamik I Formeln Tobi 4. September 2006 Inhaltsverzeichnis Thermodynamische Systeme 3. Auftriebskraft........................................ 3 2 Erster Hauptsatz der Thermodynamik 3 2. Systemenergie........................................
Auswahl von Prüfungsfragen für die Prüfungen im September 2011
 Auswahl von Prüfungsfragen für die Prüfungen im September 2011 Was ist / sind / bedeutet / verstehen Sie unter... Wie nennt man / lautet / Wann spricht man von / Definieren Sie... Die anschließenden Fragen
Auswahl von Prüfungsfragen für die Prüfungen im September 2011 Was ist / sind / bedeutet / verstehen Sie unter... Wie nennt man / lautet / Wann spricht man von / Definieren Sie... Die anschließenden Fragen
Inhaltsverzeichnis Teil I Grundlagen der Thermodynamik Grundlagen Temperatur und Zustandsgleichungen
 Inhaltsverzeichnis Teil I Grundlagen der Thermodynamik 1 Grundlagen... 3 1.1 Druck und mechanisches Gleichgewicht... 4 1.2 Thermodynamische Systeme... 5 1.3 Arbeit... 8 1.3.1 Arbeit in der Mechanik...
Inhaltsverzeichnis Teil I Grundlagen der Thermodynamik 1 Grundlagen... 3 1.1 Druck und mechanisches Gleichgewicht... 4 1.2 Thermodynamische Systeme... 5 1.3 Arbeit... 8 1.3.1 Arbeit in der Mechanik...
Die 4 Phasen des Carnot-Prozesses
 Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Die 4 Phasen des Carnot-Prozesses isotherme Expansion: A B V V T k N Q ln 1 1 isotherme Kompression: adiabatische Kompression: adiabatische Expansion: 0 Q Q 0 C D V V T k N Q ln 2 2 S Q 1 1 /T1 T 1 T 2
Der Zustand eines Systems ist durch Zustandsgrößen charakterisiert.
 Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
Grundbegriffe der Thermodynamik Die Thermodynamik beschäftigt sich mit der Interpretation gegenseitiger Abhängigkeit von stofflichen und energetischen Phänomenen in der Natur. Die Thermodynamik kann voraussagen,
1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus.
 1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung Entropie
1) Ein offenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung Entropie
9.4 Der 2. Hautsatz: spontane Prozesse und Entropie
 9.4 Der 2. Hautsatz: spontane Prozesse und Entropie Beispiele für spontane Prozesse: Ein heisser Körper kühlt sich auf Umgebungstemperatur ab. Ein kalter Köper erwärmt sich auf Umgebungstemperatur. Die
9.4 Der 2. Hautsatz: spontane Prozesse und Entropie Beispiele für spontane Prozesse: Ein heisser Körper kühlt sich auf Umgebungstemperatur ab. Ein kalter Köper erwärmt sich auf Umgebungstemperatur. Die
Lösungen 10 (Kinetik)
 Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
Chemie I WS 2003/2004 Lösungen 10 (Kinetik) Aufgabe 1 Verschiedenes 1.1 Als Reaktionsgeschwindigkeit v c wird die Ableitung der Konzentration eines Reaktanden A nach der Zeit t, dividiert durch dessen
7. Chemische Reaktionen
 7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen Welche Reaktion läuft spontan freiwillig ab? H 2 + I 2 2HI H 2 + I 2 2HI H 2 + I 2 2HI Wie ist der Energieumsatz einer Reaktion? Welche Wärme
7. Chemische Reaktionen 7.1 Thermodynamik chemischer Reaktionen Welche Reaktion läuft spontan freiwillig ab? H 2 + I 2 2HI H 2 + I 2 2HI H 2 + I 2 2HI Wie ist der Energieumsatz einer Reaktion? Welche Wärme
O. Sternal, V. Hankele. 5. Thermodynamik
 5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
5. Thermodynamik 5. Thermodynamik 5.1 Temperatur und Wärme Systeme aus vielen Teilchen Quelle: Wikimedia Commons Datei: Translational_motion.gif Versuch: Beschreibe 1 m 3 Luft mit Newton-Mechanik Beschreibe
f) Ideales Gas - mikroskopisch
 f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
f) Ideales Gas - mikroskopisch i) Annahmen Schon gehabt: Massenpunkte ohne Eigenvolumen Nur elastische Stöße, keine Wechselwirkungen Jetzt dazu: Wände vollkommen elastisch, perfekte Reflektoren Zeitliches
Die innere Energie and die Entropie
 Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Die innere Energie and die Entropie Aber fangen wir mit der Entropie an... Stellen Sie sich ein System vor, das durch die Entropie S, das Volumen V und die Stoffmenge n beschrieben wird. U ' U(S,V,n) Wir
Vorlesung Physikalische Chemie II WS 2017/18
 Vorlesung Physikalische Chemie II WS 2017/18 Vorlesung für BA Life Science und Lehramt Chemie Prof. Dr. K. Hauser Fachbereich Chemie Karin.Hauser@uni-konstanz.de Termine Vorlesung (4 std.) Beginn 25.10.2017
Vorlesung Physikalische Chemie II WS 2017/18 Vorlesung für BA Life Science und Lehramt Chemie Prof. Dr. K. Hauser Fachbereich Chemie Karin.Hauser@uni-konstanz.de Termine Vorlesung (4 std.) Beginn 25.10.2017
Inhaltsverzeichnis Thermodynamik
 Inhaltsverzeichnis 1 Thermodynamik 1 1.1 Temperatur und Wärme, Arbeit............................. 1 1.1.1 Grundbegriffe.................................. 1 1.1. Erster Hauptsatz der Thermodynamik.....................
Inhaltsverzeichnis 1 Thermodynamik 1 1.1 Temperatur und Wärme, Arbeit............................. 1 1.1.1 Grundbegriffe.................................. 1 1.1. Erster Hauptsatz der Thermodynamik.....................
Vorbemerkung. [disclaimer]
![Vorbemerkung. [disclaimer] Vorbemerkung. [disclaimer]](/thumbs/97/130802699.jpg) orbemerkung Dies ist ein abgegebener Übungszettel aus dem Modul physik2. Dieser Übungszettel wurde nicht korrigiert. Es handelt sich lediglich um meine Abgabe und keine Musterlösung. Alle Übungszettel
orbemerkung Dies ist ein abgegebener Übungszettel aus dem Modul physik2. Dieser Übungszettel wurde nicht korrigiert. Es handelt sich lediglich um meine Abgabe und keine Musterlösung. Alle Übungszettel
6.2 Temperatur und Boltzmann Verteilung
 222 KAPITEL 6. THERMODYNAMIK UND WÄRMELEHRE 6.2 Temperatur und Boltzmann Verteilung Im letzten Abschnitt haben wir gesehen, dass eine statistische Verteilung von Atomen eines idealen Gases in einem Volumen
222 KAPITEL 6. THERMODYNAMIK UND WÄRMELEHRE 6.2 Temperatur und Boltzmann Verteilung Im letzten Abschnitt haben wir gesehen, dass eine statistische Verteilung von Atomen eines idealen Gases in einem Volumen
PC-Übung Nr.3 vom
 PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
PC-Übung Nr.3 vom 31.10.08 Sebastian Meiss 25. November 2008 1. Die Säulen der Thermodynamik Beantworten Sie folgende Fragen a) Welche Größen legen den Zustand eines Gases eindeutig fest? b) Welche physikalischen
Grundlagen der Physik 3 Lösung zu Übungsblatt 1
 Grundlagen der Physik 3 Lösung zu Übungsblatt Daniel Weiss 0. Oktober 200 Inhaltsverzeichnis Aufgabe - Anzahl von Atomen und Molekülen a) ohlensto..................................... 2 b) Helium.......................................
Grundlagen der Physik 3 Lösung zu Übungsblatt Daniel Weiss 0. Oktober 200 Inhaltsverzeichnis Aufgabe - Anzahl von Atomen und Molekülen a) ohlensto..................................... 2 b) Helium.......................................
Ideale und Reale Gase. Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig)
 Ideale und Reale Gase Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig) Wann sind reale Gase ideal? Reale Gase verhalten sich wie ideale Gase
Ideale und Reale Gase Was ist ein ideales Gas? einatomige Moleküle mit keinerlei gegenseitiger WW keinem Eigenvolumen (punktförmig) Wann sind reale Gase ideal? Reale Gase verhalten sich wie ideale Gase
Hochschule Düsseldorf University of Applied Sciences. 26. April 2017 HSD. Energiespeicher Wärme
 Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Energiespeicher 02 - Wärme Wiederholung Energiearten Primärenergie Physikalische Energie Kernenergie Chemische Energie Potentielle Energie Kinetische Energie Innere Energie Quelle: Innere Energie Innere
Hochschule Düsseldorf University of Applied Sciences. 13. April 2016 HSD. Energiespeicher. Thermodynamik
 13. April 2016 Energiespeicher Thermodynamik Prof. Dr. Alexander Braun // Energiespeicher // SS 2016 26. April 2017 Thermodynamik Grundbegriffe Prof. Dr. Alexander Braun // Energiespeicher // SS 2017 26.
13. April 2016 Energiespeicher Thermodynamik Prof. Dr. Alexander Braun // Energiespeicher // SS 2016 26. April 2017 Thermodynamik Grundbegriffe Prof. Dr. Alexander Braun // Energiespeicher // SS 2017 26.
1. Wärmelehre 1.1. Temperatur Wiederholung
 1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
1. Wärmelehre 1.1. Temperatur Wiederholung a) Zur Messung der Temperatur verwendet man physikalische Effekte, die von der Temperatur abhängen. Beispiele: Volumen einer Flüssigkeit (Hg-Thermometer), aber
1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen
 IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
IV. Wärmelehre 1. Wärme und der 1. Hauptsatz der Thermodynamik 1.1. Grundlagen Historisch: Wärme als Stoff, der übertragen und in beliebiger Menge erzeugt werden kann. Übertragung: Wärmezufuhr Joulesche
Statistische Mechanik
 David H. Trevena Statistische Mechanik Eine Einführung '«WO«.»vmo i; Übersetzt von Thomas Filk VCH Weinheim New York Basel Cambridge Tokyo Inhaltsverzeichnis Vorwort von H. N. V. Temperley Vorwort des
David H. Trevena Statistische Mechanik Eine Einführung '«WO«.»vmo i; Übersetzt von Thomas Filk VCH Weinheim New York Basel Cambridge Tokyo Inhaltsverzeichnis Vorwort von H. N. V. Temperley Vorwort des
k B T de + p k B T dv µ k B T dn oder de = T ds pdv + µdn (1) Enthalpie I = E + pv zu betrachten und es gilt di = T ds + V dp + µdn (3)
 III. hermodynamik 14. Wärme und Arbeit 14.1 Wiederholung Ziffer 4: Reversible Zustandsänderungen (a) Zustandsgrößen im thermodynamischen Gleichgewicht: Extensive Zustandsgrößen: E, V, N; ln Φ(E, V, N)
III. hermodynamik 14. Wärme und Arbeit 14.1 Wiederholung Ziffer 4: Reversible Zustandsänderungen (a) Zustandsgrößen im thermodynamischen Gleichgewicht: Extensive Zustandsgrößen: E, V, N; ln Φ(E, V, N)
Die kinetische Gastheorie beruht auf den folgenden drei Annahmen:
 Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
Physikalische Chemie Modul II Versuch: Reales Gas 20. Juli 2010 1 Einleitung Die kinetische Gastheorie beruht auf den folgenden drei Annahmen: 1. Das Gas besteht aus Molekülen der Masse m und dem Durchmesser
6.7 Die Entropie und der Zweite Hauptsatz
 6.7. DIE ENROPIE UND DER ZWEIE HAUPSAZ 261 6.7 Die Entropie und der Zweite Hauptsatz 6.7.1 Definition der Entropie Im vorhergehenden Abschnitt haben wir im ersten Hauptsatz der hermodynamik die Änderung
6.7. DIE ENROPIE UND DER ZWEIE HAUPSAZ 261 6.7 Die Entropie und der Zweite Hauptsatz 6.7.1 Definition der Entropie Im vorhergehenden Abschnitt haben wir im ersten Hauptsatz der hermodynamik die Änderung
Übungsblatt 2 ( )
 Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Experimentalphysik für Naturwissenschaftler Universität Erlangen Nürnberg SS 01 Übungsblatt (11.05.01) 1) Geschwindigkeitsverteilung eines idealen Gases (a) Durch welche Verteilung lässt sich die Geschwindigkeitsverteilung
Probeklausur STATISTISCHE PHYSIK PLUS
 DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
DEPARTMENT FÜR PHYSIK, LMU Statistische Physik für Bachelor Plus WS 2011/12 Probeklausur STATISTISCHE PHYSIK PLUS NAME:... MATRIKEL NR.:... Bitte beachten: Schreiben Sie Ihren Namen auf jedes Blatt; Schreiben
Klausur Wärmelehre E2/E2p SoSe 2016 Braun. Formelsammlung Thermodynamik
 Klausur Wärmelehre E2/E2p SoSe 2016 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Klausur Wärmelehre E2/E2p SoSe 2016 Braun Name: Matrikelnummer: O E2 O E2p (bitte ankreuzen) Die mit Stern (*) gekennzeichneten Aufgaben sind für E2-Kandidaten vorgesehen - E2p-Kandidaten dürfen diese
Vorlesung Statistische Mechanik: N-Teilchensystem
 Virialentwicklung Die Berechnung der Zustandssumme bei realen Gasen ist nicht mehr exakt durchführbar. Eine Möglichkeit, die Wechselwirkung in realen Gasen systematisch mitzunehmen ist, eine Entwicklung
Virialentwicklung Die Berechnung der Zustandssumme bei realen Gasen ist nicht mehr exakt durchführbar. Eine Möglichkeit, die Wechselwirkung in realen Gasen systematisch mitzunehmen ist, eine Entwicklung
Roland Reich. Thermodynamik. Grundlagen und Anwendungen in der allgemeinen Chemie. Zweite, verbesserte Auflage VCH. Weinheim New York Basel Cambridge
 Roland Reich Thermodynamik Grundlagen und Anwendungen in der allgemeinen Chemie Zweite, verbesserte Auflage VCH Weinheim New York Basel Cambridge Inhaltsverzeichnis Formelzeichen Maßeinheiten XV XX 1.
Roland Reich Thermodynamik Grundlagen und Anwendungen in der allgemeinen Chemie Zweite, verbesserte Auflage VCH Weinheim New York Basel Cambridge Inhaltsverzeichnis Formelzeichen Maßeinheiten XV XX 1.
Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik
 Einführung in die Phsikalische Chemie Teil 2: Makroskopische Phänomene und Thermodnamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodnamik:
Einführung in die Phsikalische Chemie Teil 2: Makroskopische Phänomene und Thermodnamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodnamik:
Vorlesung Physik für Pharmazeuten PPh Wärmelehre
 Vorlesung Physik für Pharmazeuten PPh - 07 Wärmelehre Aggregatzustände der Materie im atomistischen Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistischen Bild
Vorlesung Physik für Pharmazeuten PPh - 07 Wärmelehre Aggregatzustände der Materie im atomistischen Bild Beispiel Wasser Eis Wasser Wasserdampf Dynamik an der Wasser-Luft Grenzfläche im atomistischen Bild
Werner Langbein. Thermodynamik. Gleichgewicht, Irreversible Prozesse, Schwankungen. Verlag Harri Deutsch
 Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
Werner Langbein Thermodynamik Gleichgewicht, Irreversible Prozesse, Schwankungen Verlag Harri Deutsch Einleitung 1 1 Gleichgewichtsthermodynaimiik 3 1 Thermodynamische Systeme 5 1.1 Geometrie und Inventar
1. Ziel des Versuchs. 2. Theorie. Dennis Fischer Gruppe 9 Magdalena Boeddinghaus
 Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
Versuch Nr. 1: Joule - Thomson - Effekt 1. Ziel des Versuchs In diesem Versuch soll der Joule - Thomson - oeffizient für CO und N bestimmt werden.. Theorie Einfache Zustandsgleichungen gegeben das reale
Schriftliche Leistungsüberprüfung PC/CBI
 Abschlusstest - Physikalische Chemie für CBI - SS07 - Blatt 1 von 12 Schriftliche Leistungsüberprüfung PC/CBI SS07-17.10.2007 Hörsaal H2 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Abschlusstest - Physikalische Chemie für CBI - SS07 - Blatt 1 von 12 Schriftliche Leistungsüberprüfung PC/CBI SS07-17.10.2007 Hörsaal H2 Name: Vorname: geb. am: in: Matrikelnummer: Unterschrift: Für die
Erreichte Punktzahlen: Die Bearbeitungszeit beträgt 3 Stunden.
 Fakultät für Physik der LMU München Prof. Ilka Brunner Michael Kay Vorlesung T4, WS11/12 Klausur am 18. Februar 2012 Name: Matrikelnummer: Erreichte Punktzahlen: 1 2 3 4 5 6 Hinweise Die Bearbeitungszeit
Fakultät für Physik der LMU München Prof. Ilka Brunner Michael Kay Vorlesung T4, WS11/12 Klausur am 18. Februar 2012 Name: Matrikelnummer: Erreichte Punktzahlen: 1 2 3 4 5 6 Hinweise Die Bearbeitungszeit
15. April Energiespeicher Wärme
 Energiespeicher 02 - Wärme 1 Wiederholung 2 Eigenschaften von Speichern Eigenschaft Kurzbeschreibung Kapazität Speicherdichte Leistung Zeitskala Wirkungsgrad Temperaturbereich Anzahl Ladezyklen Verluste
Energiespeicher 02 - Wärme 1 Wiederholung 2 Eigenschaften von Speichern Eigenschaft Kurzbeschreibung Kapazität Speicherdichte Leistung Zeitskala Wirkungsgrad Temperaturbereich Anzahl Ladezyklen Verluste
6.2 Zweiter HS der Thermodynamik
 Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Die Änderung des Energieinhaltes eines Systems ohne Stoffaustausch kann durch Zu-/Abfuhr von Wärme Q bzw. mechanischer Arbeit W erfolgen Wird die Arbeit reversibel geleistet (Volumenarbeit), so gilt W
Musterlösung zur Abschlussklausur PC I Übungen (27. Juni 2018)
 1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
1. Abkühlung (100 Punkte) Ein ideales Gas (genau 3 mol) durchläuft hintereinander zwei (reversible) Zustandsänderungen: Zuerst expandiert es isobar, wobei die Temperatur von 50 K auf 500 K steigt und sich
Musterlösung Übungsklausur zur Vorlesung PC I Chemische Thermodynamik B.Sc.
 Musterlösung Übungsklausur zur Vorlesung PC I Chemische Thermodynamik B.Sc. Angaben zur Person: (bitte leserlich und in Druckbuchstaben) Name, Vorname: Geburtsdatum und ort: Matrikelnummer: Studienfach,
Musterlösung Übungsklausur zur Vorlesung PC I Chemische Thermodynamik B.Sc. Angaben zur Person: (bitte leserlich und in Druckbuchstaben) Name, Vorname: Geburtsdatum und ort: Matrikelnummer: Studienfach,
Verflüssigung von Gasen / Joule-Thomson-Effekt
 Sieden und Kondensation: T p T p S S 0 1 RTSp0 1 ln p p0 Dampfdrucktopf, Autoklave zur Sterilisation absolute Luftfeuchtigkeit relative Luftfeuchtigkeit a ( g/m 3 ) a pw rel S ps rel 1 Taupunkt erflüssigung
Sieden und Kondensation: T p T p S S 0 1 RTSp0 1 ln p p0 Dampfdrucktopf, Autoklave zur Sterilisation absolute Luftfeuchtigkeit relative Luftfeuchtigkeit a ( g/m 3 ) a pw rel S ps rel 1 Taupunkt erflüssigung
Grundlagen der Physik II
 Grundlagen der Physik II Othmar Marti 09. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 09. 07. 2007 Klausur Die Klausur
Grundlagen der Physik II Othmar Marti 09. 07. 2007 Institut für Experimentelle Physik Physik, Wirtschaftsphysik und Lehramt Physik Seite 2 Wärmelehre Grundlagen der Physik II 09. 07. 2007 Klausur Die Klausur
b) Hydrostatik, Aerostatik (Fortsetzung) Schweredruck:
 b) Hydrostatik, Aerostatik (Fortsetzung) Schweredruck: = Druck einer senkrecht über einer Fläche A Stehenden Substanz (auch Flächen innerhalb der Flüssigkeit, nicht nur am Boden) Schweredruck steigt linear
b) Hydrostatik, Aerostatik (Fortsetzung) Schweredruck: = Druck einer senkrecht über einer Fläche A Stehenden Substanz (auch Flächen innerhalb der Flüssigkeit, nicht nur am Boden) Schweredruck steigt linear
Aufgaben zur Experimentalphysik II: Thermodynamik
 Aufgaben zur Experimentalphysik II: Thermodynamik Lösungen William Hefter - 5//8 1. 1. Durchmesser der Stahlstange nach T : D s D s (1 + α Stahl T) Durchmesser der Bohrung im Ring nach T : D m D m (1 +
Aufgaben zur Experimentalphysik II: Thermodynamik Lösungen William Hefter - 5//8 1. 1. Durchmesser der Stahlstange nach T : D s D s (1 + α Stahl T) Durchmesser der Bohrung im Ring nach T : D m D m (1 +
3 Der 1. Hauptsatz der Thermodynamik
 3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
3 Der 1. Hauptsatz der Thermodynamik 3.1 Der Begriff der inneren Energie Wir betrachten zunächst ein isoliertes System, d. h. es können weder Teilchen noch Energie mit der Umgebung ausgetauscht werden.
Benutzen Sie, falls erforderlich, die folgenden Werte für die Naturkonstanten. Naturkonstante Zahlenwert Einheit
 Benutzen Sie, falls erforderlich, die folgenden Werte für die Naturkonstanten. Naturkonstante Zahlenwert Einheit Allgemeine Gaskonstante R 8,3145 J mol -1 K -1 Elementarladung e 1,6022 10-19 C Faradaykonstante
Benutzen Sie, falls erforderlich, die folgenden Werte für die Naturkonstanten. Naturkonstante Zahlenwert Einheit Allgemeine Gaskonstante R 8,3145 J mol -1 K -1 Elementarladung e 1,6022 10-19 C Faradaykonstante
Ferienkurs Experimentalphysik 2
 Ferienkurs Experimentalphysik 2 Vorlesung 1 Thermodynamik Andreas Brenneis, Marcus Jung, Ann-Kathrin Straub 13.09.2010 1 Allgemeines und Grundbegriffe Grundlegend für das nun folgende Kapitel Thermodynamik
Ferienkurs Experimentalphysik 2 Vorlesung 1 Thermodynamik Andreas Brenneis, Marcus Jung, Ann-Kathrin Straub 13.09.2010 1 Allgemeines und Grundbegriffe Grundlegend für das nun folgende Kapitel Thermodynamik
Kapitel 10 - Gase. Kapitel 10 - Gase. Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller Bewegung
 Kapitel 0 - Gase Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller ewegung Druck Kraft pro Fläche in Pa(scal) oder bar Normdruck = 760mm = 0,35 KPa =,035 bar = atm Messung
Kapitel 0 - Gase Gase bestehen aus räumlich weit voneinander getrennten Atome/Moleküle in schneller ewegung Druck Kraft pro Fläche in Pa(scal) oder bar Normdruck = 760mm = 0,35 KPa =,035 bar = atm Messung
Brahe Kepler. Bacon Descartes
 Newton s Mechanics Stellar Orbits! Brahe Kepler Gravity! Actio = Reactio F = d dt p Gallilei Galilei! Bacon Descartes Leibnitz Leibniz! 1 Statistical Mechanics Steam Engine! Energy Conservation Kinematic
Newton s Mechanics Stellar Orbits! Brahe Kepler Gravity! Actio = Reactio F = d dt p Gallilei Galilei! Bacon Descartes Leibnitz Leibniz! 1 Statistical Mechanics Steam Engine! Energy Conservation Kinematic
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik. Thermodynamik Teil II. 12. September 2011 Michael Mittermair
 Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Ferienkurs Experimentalphysik II Elektro- und Thermodynamik Thermodynamik Teil II 12. September 2011 Michael Mittermair Inhaltsverzeichnis 1 Allgemeines 3 1.1 Kategorisierung von Systemen..................
Thermodynamik. Kapitel 4. Nicolas Thomas
 Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
Thermodynamik Kapitel 4 Arbeit und Wärme Länge, x F Kolben Länge, x F Der Kolben wird sehr langsam um die Distanz -dx verschoben. dx Kolben Wieviel Arbeit mussten wir leisten, um den Kolben zu bewegen?
Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik
 Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodynamik:
Einführung in die Physikalische Chemie Teil 2: Makroskopische Phänomene und Thermodynamik Kapitel 7: Boltzmann-Verteilung Kapitel 8: Statistische Beschreibung makroskopischer Grössen Kapitel 9: Thermodynamik:
0.1 Barometrische Höhenformel
 0. Barometrische Höhenformel Da, wie aus den bisherigen Überlegungen hervorgegeangen ist, Gase komressibel sind, kann deren Dichte nicht als konstant angesehen werden. Dies hat Konsequenzen auf den Schweredruck
0. Barometrische Höhenformel Da, wie aus den bisherigen Überlegungen hervorgegeangen ist, Gase komressibel sind, kann deren Dichte nicht als konstant angesehen werden. Dies hat Konsequenzen auf den Schweredruck
d) Das ideale Gas makroskopisch
 d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
d) Das ideale Gas makroskopisch Beschreibung mit Zustandsgrößen p, V, T Brauchen trotzdem n, R dazu Immer auch Mikroskopische Argumente dazunehmen Annahmen aus mikroskopischer Betrachtung: Moleküle sind
Teil A: Thermodynamik
 Teil A: Thermodynamik Teil B: Kinetik Manfred Kappes, Bastian Kern, Marc Oliver Winghart http://www.ipc.kit.edu/mik/ manfred.kappes@kit.edu; bastian.kern@kit.edu; marc oliver.winghart@kit.edu Bastian Kern,
Teil A: Thermodynamik Teil B: Kinetik Manfred Kappes, Bastian Kern, Marc Oliver Winghart http://www.ipc.kit.edu/mik/ manfred.kappes@kit.edu; bastian.kern@kit.edu; marc oliver.winghart@kit.edu Bastian Kern,
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases. f=5 Translation + Rotation. f=7 Translation + Rotation +Vibration. Wiederholung
 1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1. Wärmelehre 2.4. Die Freiheitsgrade eines Gases Wiederholung Speziische molare Wärmekapazität c m,v = 2 R R = N A k B = 8.315 J mol K =5 Translation + Rotation =7 Translation + Rotation +ibration 1.
1) Ein geschlossenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus.
 1) Ein geschlossenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung
1) Ein geschlossenes System zeichnet sich immer durch eine konstante Temperatur aus. zeichnet sich immer durch eine konstante Masse aus. kann mit der Umgebung Energie austauschen. kann mit der Umgebung
Statistische Thermodynamik I Lösungen zur Serie 11
 Statistische Thermodynamik I Lösungen zur Serie Verschiedenes 20 Mai 206 Barometrische Höhenformel: Betrachte die rdatmosphäre im homogenen Gravitationspotential M gz der rde Unter der Annahme, dass sich
Statistische Thermodynamik I Lösungen zur Serie Verschiedenes 20 Mai 206 Barometrische Höhenformel: Betrachte die rdatmosphäre im homogenen Gravitationspotential M gz der rde Unter der Annahme, dass sich
Multiple-Choice Test. Alle Fragen können mit Hilfe der Versuchsanleitung richtig gelöst werden.
 PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
PCG-Grundpraktikum Versuch 1- Dampfdruckdiagramm Multiple-Choice Test Zu jedem Versuch im PCG wird ein Vorgespräch durchgeführt. Für den Versuch Dampfdruckdiagramm wird dieses Vorgespräch durch einen Multiple-Choice
T p = T = RT. V b. ( ) 2 V p. V b. 2a(V b)2 V 3 RT. 2a(V b) V 3 (p+ a V 2 )
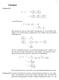 3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
3 Lösung zu 83. Lösungen ( C C = T ( = T ( ( ( 2 van-der-waals Gas: ( ( b + a 2 = T = T b a 2 Man beachte das dies nur eine andere Formulierung der van-der-waals Gleichung ist als auf dem letzten Aufgabenzettel.
